Урок №51. Генетическая связь между основными классами неорганических соединений
Генетические
связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов
и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→
→основный оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в
качестве звена ряда выступает растворимая кислота. Цепочку превращений можно
представить в следующем виде:
Генетический ряд неметаллов, где в
качестве звена ряда выступает растворимая кислота. Цепочку превращений можно
представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→
→кислотный оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
Закрепление:
Осуществите превращения по схеме, укажите типы реакций, назовите вещества
1.Al→Al2O3→AlCl3→Al(OH)3
→Al2O32. P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
3. Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
4.Cu →CuO→CuCl2→Cu(OH)2→CuO→Cu
5.N2O5→HNO3→Fe(NO3)2→Fe(OH)2→FeS→FeSO4
Тренажёры:
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Генетическая связь между классами неорганических веществ»
Составьте генетический ряд лития, используя схему. Генетические ряды металлов и их соединений Составить генетический ряд для лития
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Целосность и разнообразие химических веществ наиболее выражено изображены в генетической связи веществ, которая раскрывается в генетических рядах. Рассмотрим самые важные признаки генетических рядов:
Генетические ряды – это группа органических соединений, у которых равное число атомов углерода в молекуле, различающихся функциональными группами.
Генетическая связь – более общее понятие, в отличие от генетического ряда, который пусть и является достаточно ярким, но в тоже время частным проявлением данной связи, которая может происходить при любых двусторонних превращениях веществ.
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
ПОМОГИТЕ ЗАВТРА НАДО) 8 КЛАСС ХИМИЯ, 1) Составьте генетический ряд серы, используя схему: неметалл—-> кислотный оксид-> кислота →соль.2) . Составьте молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:Na2O->NaOH->NaCl
Na2O->NaOH->Na2SO4
Укажите тип каждой реакции.
3) Закончите фразу: «Водные растворы диссоциируют на…
помогите плиз хоть с чем-тоВариант № 1
Часть А. Тестовые задания с выбором одного правильного ответа
1. (2балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. CuO, CO2, h3SO4, FeS Б. HNO3, h3S, Al2O3, CuCl2 В. P2O5, NaOH, HCl, Na2CO3
2. (2балла). В генетическом ряду CuSO4→X→CuO
Веществом Х является вещество с формулой: А.CuOH Б. Cu(OH)2 В. CuCl2
3. (2балла). Формула гидроксида, соответствующего оксиду серы(VI):
А. h3S Б. h3SO3 В. h3SO4
h3S Б. h3SO3 В. h3SO4
А. Cu(OH)2→CuO→ Cu Б. FeSO4→Fe(OH)2→ h3O В. SO3→h3SO4→h3
5. (2балла). Гидроксид меди(II) можно получить при взаимодействии веществ, формулы которых: А. Cu и h3O Б. CuO и h3O В. CuCl2 и NaOH
6. (2балла). Пара формул веществ, взаимодействующих друг с другом:
А. Ca(OH)2 и CuO Б. HCl и Hg В. h3SO4 и MgO
7. (2балла). Гидроксид калия вступает в реакцию:
А. с гидроксидом меди(II) Б. с оксидом углерода(IV) В. с оксидом кальция
8. (2балла). В схеме превращений CaO→X Ca(OH)2 →Y CaCl2
вещества Х и Y имеют формулы:
А. X – h3O, Y – HCl Б. X – h3, Y – HNO3 В.X – O2, Y — HCl
9. (2балла). В генетическом ряду Э→Э2О→ЭОН→Э2SО4 Элемент Э – это:
А. Литий Б. Кальций В. Сера
10. (2балла). Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
А. CO2, SO2, SiO2 Б. BaO, P2O5, Li2O В. K2O, CaO, CuO
Часть Б. Задания со свободным ответом
11. (8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ba(OH)2, h3SO4, CO2, Ba, MgO, BaSO4, BaO
(8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ba(OH)2, h3SO4, CO2, Ba, MgO, BaSO4, BaO
12. (8 баллов). Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме: P→P2O5→h4PO4→Na3PO4
13. (6 баллов) Допишите уравнения реакции:
? + 2HCl→? + ? +СО2
14. (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду: CuSO4→А→В→Cu
1/ (2 балла) Ряд, в котором представлены формулы веществ каждого из четырёх классов неорганических соединений:
P2O5, h3SO4, h3SO3, NaOH
SO2, h3SiO3, MgSO4, CuO
CO2, h3S, K2SO3, KOH
2/ (2 балла) В генетическом ряду
Li Li2O X LiCl
веществом Х является вещество с формулой
A) Li B)LiOH C) HCl
3) (2 балла) Формула гидроксида, соответствующего оксиду фосфора (V):
4) (2 балла) Генетическим рядом является ряд, схема которого
A) SO3 h3SO4 CaSO4
B) ZnCl2 Zn(OH)2 h3O
C) Al AlCl3 AgCl
5) (2 балла) Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых:
A) Cu + HCl B) CuO + HCl C) CuOH + HCl
6) (2 балла) Пара формул веществ, взаимодействующих друг с другом:
A) Ag + HCl B) SO2 + NaOH C) CuO + NaOH
7) Cоляная кислота вступает в реакцию:
А) с магнием В) с оксидом серы (IV) С) с серебром
8) (2 балла) В схеме превращений:
P P2O5 h4PO4
вещества Х и У имеют формулы:
А) Х – h3O, Y – HCl B) X – O2, Y – h3 C) X – O2, Y – h3O
(2 балла) В генетическом ряду
Э Э2О5 Н3ЭО4 Na3ЭО4
элемент Э – это:
А) калий В) сера С) фосфор
10) (2 балла) Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
A) CO2, Li2O, SO3 B) CuO, P2O5, CaO C) BaO, FeO, ZnO
Часть Б.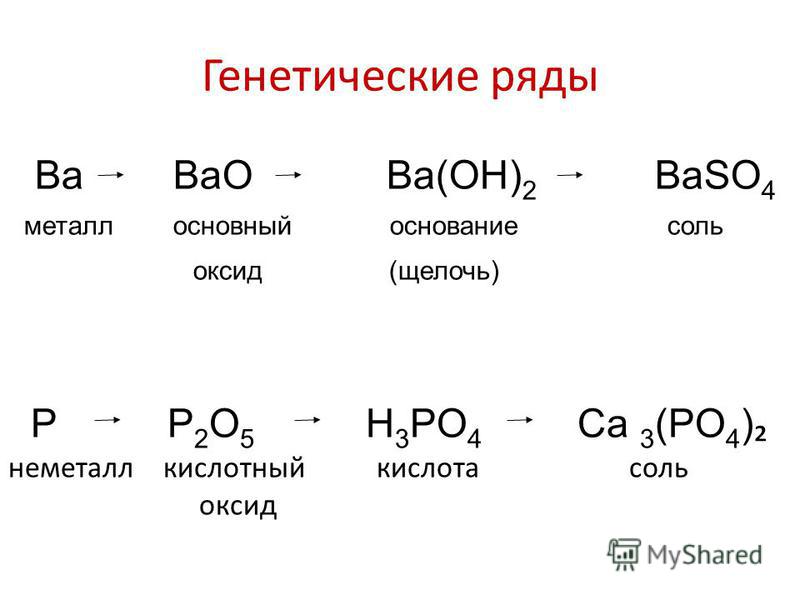
(8 баллов) Составьте генетический ряд бария, используя необходимые для этого формулы веществ: h3O, SO2, Fe2O3, S, CaCO3, h3SO3, K2SO3
(8 баллов) Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:
Ba BaO Ba(OH)2 BaSO4
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
(6 баллов) Допишите уравнения реакций:
Fe(OH)3 + NaOH = ? +
(4 балла) Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Li A B Li3PO4
(4 балла) Допишите уравнение реакций
N2 + ?= N2O3
Повторение. Генетическая связь классов неорганических соединений
Введение
Тема этого урока — «Повторение. Генетическая связь классов неорганических соединений». Вы повторите, как делятся все неорганические вещества, сделаете вывод, как из одного класса неорганических соединений можно получить другой. На основании полученных сведений узнаете, что такое генетическая связь таких классов, два основных пути таких связей.
Тема: Введение
Урок: Повторение. Генетическая связь классов неорганических соединений
Химия — это наука о веществах, их свойствах и превращениях друг в друга.
Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
Простые вещества
Сложные вещества.
Простые вещества делятся на:
Металлы
Неметаллы
Сложные вещества можно разделить на:
Основания
Кислоты
Соли. См. Рис.1.
Это бинарные соединения, состоящее из двух элементов, одним их которых является кислород в степени окисления -2. Рис.2.
Например, оксид кальция: Сa +2 О -2 ,оксид фосфора (V) P 2 O 5., оксид азота (IV) -« лисий хвост»
Рис. 2. Оксиды
Делятся на:
Основные
Кислотные
Основным оксидам соответствуют основания .
Кислотным оксидам соответствуют кислоты .
Соли состоят из катионов металла и анионов кислотного остатка .
Рис. 3. Пути генетических связей между веществами
Таким образом: из одного класса неорганических соединений можно получить другой класс.
Следовательно, все классы неорганических веществ взаимосвязаны .
Связь классов неорганических соединений часто называют генетической. Рис.3.
Генезис по — гречески означает «происхождение». Т.е. генетическая связь показывает взаимосвязь превращения веществ и их происхождение от единого вещества.
Существует два основных пути генетических связей между веществами. Один из них начинается металлом, другой — неметаллом.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль →Основание → Новая соль.
Генетический ряд неметалла отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота →Соль.
Для любого генетического ряда можно написать уравнения реакций, которые показывают превращения одних веществ в другие .
Для начала, нужно определить к какому классу неорганических соединений относится каждое вещество генетического ряда.
Подумать, как из вещества, стоящего до стрелочки, получить вещество стоящие после неё.
Пример №1. Генетический ряд металла.
Ряд начинается простым веществом металлом медью. Чтобы осуществить первый переход, нужно сжечь медь в атмосфере кислорода.
2Cu +O 2 →2CuO
Второй переход: нужно получить соль CuCl 2. Она образована соляной кислотой HCl, потому что соли соляной кислоты называются хлориды.
CuO +2 HCl → CuCl 2 + H 2 O
Третий шаг: чтобы получить нерастворимое основание, нужно к растворимой соли прибавить щелочь.
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Чтобы гидроксид меди(II) перевести в сульфат меди(II) прибавим к ней серную кислоту H 2 SO 4 .
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Пример №2. Генетический ряд неметалла.
Ряд начинается простым веществом неметаллом углеродом. Чтобы осуществить первый переход, нужно сжечь углерод в атмосфере кислорода.
Чтобы осуществить первый переход, нужно сжечь углерод в атмосфере кислорода.
C + O 2 → CO 2
Если к кислотному оксиду прибавить воду, получится кислота, которая называется угольной.
СO 2 + H 2 O → H 2 СO 3
Чтобы получить соль угольной кислоты — карбонат кальция, нужно к кислоте добавить соединение кальция, например гидроксид кальция Ca(OH) 2 .
H 2 СO 3 + Ca (OH) 2 → CaCO 3 + 2H 2 O
В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Но в эти вещества обязательно входит один и тот же элемент. Зная, химические свойства классов соединений, можно подбирать уравнения реакций, при помощи которых можно осуществить данные превращения. Эти превращения используются и на производстве, для подбора наиболее рациональных методов получения тех или иных веществ.
Вы повторили, как делятся все неорганические вещества, сделали вывод, как из одного класса неорганических соединений можно получить другой. На основании полученных сведений узнали, что такое генетическая связь таких классов, два основных пути таких связей.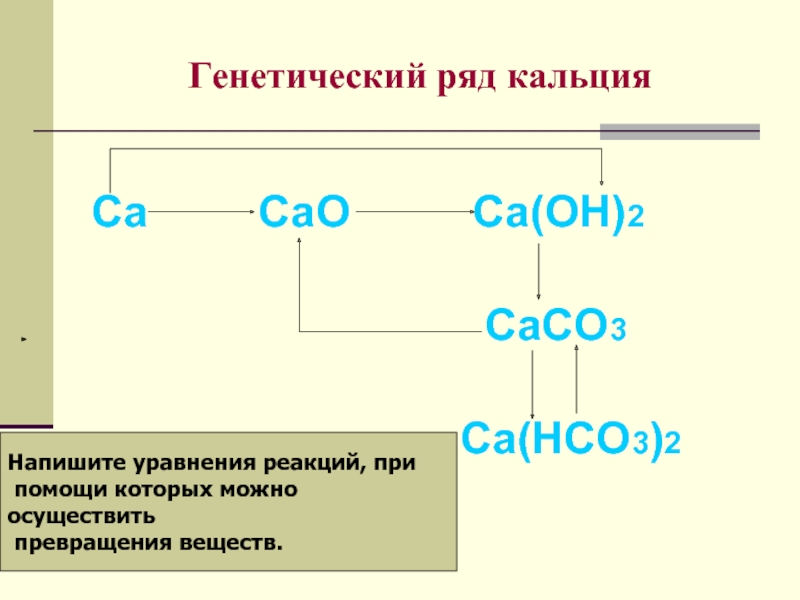
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с.
1. №№ 10-а,10з (с.112) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.: ил.
2. Как двумя способами из оксида кальция получить сульфат кальция?
3. Составьте генетический ряд получения из серы сульфата бария. Напишите уравнения реакций.
Каждый такой ряд состоит состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Сa + O 2 = 2СaO; 2Mg + O 2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путём известной вам реакции гидратации, например:
СaO + H 2 O = Сa(OH) 2 .
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их – в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH) 2 используют последовательные реакции:
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg(OH) 2 ↓ + Na 2 SO 4 .
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Генетические ряды неметаллов и их соединений .
Каждый такой ряд состоит состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
4P + 5O 2 = 2 P 2 O 5 ; Si + O 2 = SiO 2 ;
Переход от кислотных оксидов к кислотам в первых трёх рядах осуществляется путём известной вам реакции гидратации, например:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4 .
Однако, вы знаете, что содержащийся в последнем ряду оксид SiO 2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Следует запомнить:
· Вещества одного и того же генетического ряда друг с другом не реагируют.
· Вещества генетических рядов разных типов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема взаимосвязи веществ разных генетических рядов.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними.
Задание по теме:
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4 ;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3 ;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2 ;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3 ;
7. Al → Al 2 (SO 4) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 ;
8. Fe → FeCl 2 →FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2 ;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 ;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3 ;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3 ;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3 ;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3 ;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 ;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2 ;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3 ;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3 ;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3 ;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3 ;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3 ;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3 ;
Готовые работы
ДИПЛОМНЫЕ РАБОТЫ
Многое уже позади и теперь ты — выпускник, если, конечно, вовремя напишешь дипломную работу. Но жизнь — такая штука, что только сейчас тебе становится понятно, что, перестав быть студентом, ты потеряешь все студенческие радости, многие из которых, ты так и не попробовал, всё откладывая и откладывая на потом. И теперь, вместо того, чтобы навёрстывать упущенное, ты корпишь над дипломной работой? Есть отличный выход: скачать нужную тебе дипломную работу с нашего сайта — и у тебя мигом появится масса свободного времени!
Но жизнь — такая штука, что только сейчас тебе становится понятно, что, перестав быть студентом, ты потеряешь все студенческие радости, многие из которых, ты так и не попробовал, всё откладывая и откладывая на потом. И теперь, вместо того, чтобы навёрстывать упущенное, ты корпишь над дипломной работой? Есть отличный выход: скачать нужную тебе дипломную работу с нашего сайта — и у тебя мигом появится масса свободного времени!
Дипломные работы успешно защищены в ведущих Университетах РК.
Стоимость работы от 20 000 тенге
КУРСОВЫЕ РАБОТЫ
Курсовой проект — это первая серьезная практическая работа. Именно с написания курсовой начинается подготовка к разработке дипломных проектов. Если студент научиться правильно излагать содержание темы в курсовом проекте и грамотно его оформлять, то в последующем у него не возникнет проблем ни с написанием отчетов, ни с составлением дипломных работ, ни с выполнением других практических заданий. Чтобы оказать помощь студентам в написании этого типа студенческой работы и разъяснить возникающие по ходу ее составления вопросы, собственно говоря, и был создан данный информационный раздел.
Стоимость работы от 2 500 тенге
МАГИСТЕРСКИЕ ДИССЕРТАЦИИ
В настоящее время в высших учебных заведениях Казахстана и стран СНГ очень распространена ступень высшего профессионального образования, которая следует после бакалавриата — магистратура. В магистратуре обучаются с целью получения диплома магистра, признаваемого в большинстве стран мира больше, чем диплом бакалавра, а также признаётся зарубежными работодателями. Итогом обучения в магистратуре является защита магистерской диссертации.
Мы предоставим Вам актуальный аналитический и текстовый материал, в стоимость включены 2 научные статьи и автореферат.
Стоимость работы от 35 000 тенге
ОТЧЕТЫ ПО ПРАКТИКЕ
После прохождения любого типа студенческой практики (учебной, производственной, преддипломной) требуется составить отчёт. Этот документ будет подтверждением практической работы студента и основой формирования оценки за практику. Обычно, чтобы составить отчёт по практике, требуется собрать и проанализировать информацию о предприятии, рассмотреть структуру и распорядок работы организации, в которой проходится практика, составить календарный план и описать свою практическую деятельность.
Мы поможет написать отчёт о прохождении практики с учетом специфики деятельности конкретного предприятия.
Презентация по теме «Генетическая связь неорганических веществ»
Генетическая связь между классами неорганических веществ. ХИМИЯ – 8 Автор: Кунова Г.В. – учитель химии ЦДО, г. Липецк.
Цель урока Повторить и обобщить изученный материал: о классификации неорганических веществ; свойствах кислот, оснований, оксидов и солей в свете ТЭД. Сформировать понятие «генетический ряд», познакомить с генетическими рядами металлов и неметаллов и их видами. Формировать умение составлять генетические ряды металлов и неметаллов и записывать соответствующие им уравнения химических реакций.
Задание 1
Заполните схему «Классификация неорганических веществ», выбрав из перечня необходимые слова.
ПРОСТЫЕ
СЛОЖНЫЕ
Металлы
Неметаллы
ОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
ВЕЩЕСТВА
Приведите примеры для каждой группы веществ.
Задание 2 Посмотрим видео-опыты: Горение фосфора в кислороде 2. Растворение оксида фосфора (V) в воде Запишите уравнения химических реакций, показанных в опытах. 4Р + 5О2 = 2Р2О5 Р2О5 + 3Н2О = 2Н3РО4
Последовательность превращений в этих опытах можно выразить схемой: Последовательность превращений в этих опытах можно выразить схемой: Р → Р2О5 → Н3РО4 Что общего между веществами в этом ряду? В состав всех веществ в этом ряду входит элемент фосфор.
Задание 3 Посмотрим видео-опыты: Горение кальция Взаимодействие оксида кальция с водой Запишите уравнения химических реакций, показанных в опытах. 2Са + О2 = 2СаО СаО + Н2О = Са(ОН)2
Последовательность превращений в этих опытах можно выразить схемой:
Последовательность превращений в этих опытах можно выразить схемой:
Са → СаО → Са(ОН)2
Что общего между веществами в этом ряду?
В состав всех веществ в этом ряду входит элемент кальций.
Таким образом мы получили две цепочки превращений: Таким образом мы получили две цепочки превращений: Р → Р2О5 → Н3РО4 Са → СаО → Са(ОН)2 — А возможна ли реакция между Н3РО4 и Са(ОН)2? Запишем уравнение реакции: 2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2↓ + 6Н2О Са3(РО4)2
Выделим общие признаки в записанных нами рядах: Выделим общие признаки в записанных нами рядах: Все вещества одного ряда образованы одним химическим элементом. Вещества, образованные одним и тем же элементом, принадлежат к различным классам неорганических веществ. Вещества, образующие ряд одного элемента, связаны взаимопревращениями. Такие ряды получили название «генетические».
Генетические ряды Генетический ряд — это ряд веществ представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ. Генетические ряды металлов неметаллов
Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом. Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом.
Генетические ряды металлов
1 вид – металлу соответствует щелочь
2 вид – металлу соответствует нерастворимое основание
Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом.
Генетические ряды металлов
1 вид – металлу соответствует щелочь
2 вид – металлу соответствует нерастворимое основание
Генетические ряды металлов 1 вид – генетический ряд металлов, которым соответствует щелочь: металл → основный оксид → щелочь → соль Пример: Ba → BaO → Ba(OH)2 → BaCl2 2Ba + O2 = 2BaO BaO + h3O = Ba(OH)2 Ba(OH)2 + 2HCl = BaCl2 + 2h3O
Генетические ряды металлов 2 вид — генетический ряд металлов, которым соответствует нерастворимое основание: металл → основной оксид → соль → основание (Н) → основной оксид → металл Пример: генетический ряд цинка Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnO → Zn Задание: напишите соответствующие уравнения реакций.
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом. Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом.
Генетические ряды неметаллов
1 вид – неметаллу соответствует растворимая кислота
2 вид – неметаллу соответствует нерастворимая кислота
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом.
Генетические ряды неметаллов
1 вид – неметаллу соответствует растворимая кислота
2 вид – неметаллу соответствует нерастворимая кислота
Генетические ряды неметаллов 1 вид – генетический ряд неметаллов, которым соответствует растворимая кислота: неметалл → кислотный оксид → кислота → соль. Пример: S → SO2 → h3SO3 → Na2SO3 S + O2 = SO2 SO2 + h3O = h3SO3 h3SO3 + 2NaOH = Na2SO3 + 2h3O
Генетические ряды неметаллов
2 вид — генетический ряд металлов, которым соответствует нерастворимая кислота:
неметалл → кислотный оксид → соль → кислота (Н) → кислотный оксид
Из изученных нами кислот нерастворимой является только кремниевая кислота, поэтому рассмотрим в качестве примера генетический ряд кремния:
Si → SiO2 → Na2SiO3 → h3SiO3 → SiO2
Задание: напишите соответствующие уравнения реакций.
Генетическая взаимосвязь веществ Металл Неметалл Основный оксид Основание Кислотный оксид Кислота СОЛЬ СОЛЬ СОЛЬ СОЛЬ
— Где можно применить?
Более сложные вещества могут быть получены из простых, минуя одну или две стадии в приведенных схемах, например, металл, взаимодействуя с кислотой, дает соль.
Возможно образование не только более сложных веществ из менее сложных, но и наоборот.
Различные способы получения оксидов, оснований, солей, кислот широко используют как в химических лабораториях, так и в химической промышленности.
Производство кислот (серной, соляной, азотной, фосфорной), солей (минеральных удобрений — аммиачной и калийной селитры, суперфосфата, аммофоса), оксидов (например, негашеной извести СаО) и многих других неорганических соединений имеет важное значение для деятельности человека.
Выбирая наиболее рациональные способы получения какого-либо вещества, обычно используют сырье, встречающееся в природе в достаточно большом количестве, или выпускаемое промышленностью. Известняк
Известняк
Экспериментальная задача Прокалить медную проволоку, удерживая ее тигельными щипцами, в верхней части пламени спиртовки (1–2мин). Удалить черный налет с проволоки и поместить его в пробирку. Прилить в пробирку 1-2 мл раствора соляной кислоты. Для ускорения реакции можно слегка нагреть ее содержимое. Что будет наблюдаться? Осторожно погрузить в пробирку с раствором железный гвоздь. Через 2–3 мин извлечь гвоздь из раствора. Что будет наблюдаться? Составьте генетический ряд по предложенному эксперименту и напишите соответствующие химические уравнения.
Домашнее задание: §42.
Тест. Генетический ряд металлов и неметаллов
© 2020, ООО КОМПЭДУ, http://compedu.ru При поддержке проекта http://videouroki.net
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!Список вопросов теста
Вопрос 1
Установите соответствие между формулами исходных веществ и продуктов реакции:
Варианты ответов
FeCl3 + H2O
FeCl2
FeCl3 + H2
FeCl3
FeCl2 + H2O
FeCl2 + H2
Вопрос 2
Определите вещество «Х» из схемы превращений C → X → CaCO3:
Варианты ответов
Вопрос 3
Определите вещество «Y» из схемы превращения Na → Y → NaOH:
Варианты ответов
Вопрос 4
Генетический ряд металла — это:
Варианты ответов
- вещества, образующие ряд на основе металла и неметалла
- вещества, образующие ряд на основе одного неметалла
- вещества из различных классов веществ, связанных превращениями
- вещества, образующие ряд на основе одного металла
Вопрос 5
Элементом «Э», участвующим в цепочке превращений Э → Э2О5 → Н3ЭО4 → Na3ЭО4 является:
Варианты ответов
Вопрос 6
В схеме превращения CuCl2 → A → B → Cu формулами промежуточных продуктов А и В являются:
Варианты ответов
Вопрос 7
Элементом «Э» в цепочке превращения Э → ЭО2 → ЭО3 → Н2ЭО4 → Na2ЭО4 является:
Варианты ответов
Вопрос 8
Установите соответствие между формулами исходных веществ и продуктов реакции:
Варианты ответов
Na + H2O
Na2O + CO2
NaOH + CO2
NaOH + HCl
Вопрос 9
Соляная кислота не взаимодействует с:
Варианты ответов
- оксидом кальция
- хлоридом натрия
- кислородом
- раствором гидроксида натрия
Вопрос 10
Раствор сульфата меди (II) реагирует с :
Варианты ответов
- раствором гидроксида натрия
- железом
- оксидом углерода (II)
- оксидом алюминия
Взаимосвязь неорганических веществ | ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}↙{\text»металл»}→{FeCl_2}↙{\text»соль — хлорид железа(II)»}$ $→{Fe(OH)_2}↙{\text»основание — гидроксид железа(II)»}$ $→{FeO}↙{\text»основный оксид — оксид железа(II)»}$ $→{Fe}↙{\text»металл»}$ $→{FeCl_3}↙{\text»соль — хлорид железа(III)»}$ $→{Fe(OH)_3}↙{\text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}$ $→{Fe_2O_3}↙{\text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}$ $→{Fe}↙{\text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}↙{\text»неметалл»} → {SO_2}↙{\text»кислотный оксид — оксид серы (IV)»}$ $ → {H_SO_3}↙{\text»сернистая кислота»}$ $ → {Na_SO_3}↙{\text»соль — сульфит натрия»}$ $ → {SO_2}↙{\text»кислотный оксид — оксид серы (IV)»}$ $ → {SO_3}↙{\text»кислотный оксид — оксид серы (VI)»} $ $ → {H_SO_4}↙{\text»серная кислота»}$ $ → {SO_2}↙{\text»кислотный оксид — оксид серы (IV)»} $ $→ {S}↙{\text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}↖{+4}+2H_2{S}↖{-2}=2H_2O+S↖{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
$K{Cl}↖{+5}O_3+6H{Cl}↖{-1}=K{Cl}↖{-1}+3{Cl_2}↖{0}↑+H_2O.$
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
Составить генетический ряд лития и осуществить превращения. Генетическая связь между классами веществ. Тема: Обобщение пройденного материала
ПОМОГИТЕ ЗАВТРА НАДО) 8 КЛАСС ХИМИЯ, 1) Составьте генетический ряд серы, используя схему: неметалл—-> кислотныйоксид-> кислота →соль.
2) . Составьте молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:Na2O->NaOH->NaCl
Na2O->NaOH->Na2SO4
Укажите тип каждой реакции.
3) Закончите фразу: «Водные растворы диссоциируют на…
помогите плиз хоть с чем-тоВариант № 1
Часть А. Тестовые задания с выбором одного правильного ответа
1. (2балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. CuO, CO2, h3SO4, FeS Б. HNO3, h3S, Al2O3, CuCl2 В. P2O5, NaOH, HCl, Na2CO3
2. (2балла). В генетическом ряду CuSO4→X→CuO
Веществом Х является вещество с формулой: А.CuOH Б. Cu(OH)2 В. CuCl2
3. (2балла). Формула гидроксида, соответствующего оксиду серы(VI):
А. h3S Б. h3SO3 В. h3SO4
4. (2балла). Генетическим рядом является ряд, схема которого:
А. Cu(OH)2→CuO→ Cu Б. FeSO4→Fe(OH)2→ h3O В. SO3→h3SO4→h3
5. (2балла). Гидроксид меди(II) можно получить при взаимодействии веществ, формулы которых: А. Cu и h3O Б. CuO и h3O В. CuCl2 и NaOH
6. (2балла). Пара формул веществ, взаимодействующих друг с другом:
А. Ca(OH)2 и CuO Б. HCl и Hg В. h3SO4 и MgO
7. (2балла). Гидроксид калия вступает в реакцию:
А. с гидроксидом меди(II) Б. с оксидом углерода(IV) В. с оксидом кальция
8. (2балла). В схеме превращений CaO→X Ca(OH)2 →Y CaCl2
вещества Х и Y имеют формулы:
А. X – h3O, Y – HCl Б. X – h3, Y – HNO3 В.X – O2, Y — HCl
9. (2балла). В генетическом ряду Э→Э2О→ЭОН→Э2SО4 Элемент Э – это:
А. Литий Б. Кальций В. Сера
10. (2балла). Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
А. CO2, SO2, SiO2 Б. BaO, P2O5, Li2O В. K2O, CaO, CuO
Часть Б. Задания со свободным ответом
11. (8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ba(OH)2, h3SO4, CO2, Ba, MgO, BaSO4, BaO
12. (8 баллов). Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме: P→P2O5→h4PO4→Na3PO4
13. (6 баллов) Допишите уравнения реакции:
? + 2HCl→? + ? +СО2
14. (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду: CuSO4→А→В→Cu
1/ (2 балла) Ряд, в котором представлены формулы веществ каждого из четырёх классов неорганических соединений:
P2O5, h3SO4, h3SO3, NaOH
SO2, h3SiO3, MgSO4, CuO
CO2, h3S, K2SO3, KOH
2/ (2 балла) В генетическом ряду
Li Li2O X LiCl
веществом Х является вещество с формулой
A) Li B)LiOH C) HCl
3) (2 балла) Формула гидроксида, соответствующего оксиду фосфора (V):
A) HPO2 B) h4PO3 C) h4PO4
4) (2 балла) Генетическим рядом является ряд, схема которого
A) SO3 h3SO4 CaSO4
B) ZnCl2 Zn(OH)2 h3O
C) Al AlCl3 AgCl
5) (2 балла) Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых:
A) Cu + HCl B) CuO + HCl C) CuOH + HCl
6) (2 балла) Пара формул веществ, взаимодействующих друг с другом:
A) Ag + HCl B) SO2 + NaOH C) CuO + NaOH
7) Cоляная кислота вступает в реакцию:
А) с магнием В) с оксидом серы (IV) С) с серебром
8) (2 балла) В схеме превращений:
P P2O5 h4PO4
вещества Х и У имеют формулы:
А) Х – h3O, Y – HCl B) X – O2, Y – h3 C) X – O2, Y – h3O
(2 балла) В генетическом ряду
Э Э2О5 Н3ЭО4 Na3ЭО4
элемент Э – это:
А) калий В) сера С) фосфор
10) (2 балла) Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
A) CO2, Li2O, SO3 B) CuO, P2O5, CaO C) BaO, FeO, ZnO
Часть Б. задание со свободным ответом
(8 баллов) Составьте генетический ряд бария, используя необходимые для этого формулы веществ: h3O, SO2, Fe2O3, S, CaCO3, h3SO3, K2SO3
(8 баллов) Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:
Ba BaO Ba(OH)2 BaSO4
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
(6 баллов) Допишите уравнения реакций:
Fe(OH)3 + NaOH = ? +
(4 балла) Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Li A B Li3PO4
(4 балла) Допишите уравнение реакций
N2 + ?= N2O3
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Целосность и разнообразие химических веществ наиболее выражено изображены в генетической связи веществ, которая раскрывается в генетических рядах. Рассмотрим самые важные признаки генетических рядов:
Генетические ряды – это группа органических соединений, у которых равное число атомов углерода в молекуле, различающихся функциональными группами.
Генетическая связь – более общее понятие, в отличие от генетического ряда, который пусть и является достаточно ярким, но в тоже время частным проявлением данной связи, которая может происходить при любых двусторонних превращениях веществ.
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Каждый такой ряд состоит состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Сa + O 2 = 2СaO; 2Mg + O 2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путём известной вам реакции гидратации, например:
СaO + H 2 O = Сa(OH) 2 .
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их – в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH) 2 используют последовательные реакции:
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg(OH) 2 ↓ + Na 2 SO 4 .
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Генетические ряды неметаллов и их соединений .
Каждый такой ряд состоит состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
4P + 5O 2 = 2 P 2 O 5 ; Si + O 2 = SiO 2 ;
Переход от кислотных оксидов к кислотам в первых трёх рядах осуществляется путём известной вам реакции гидратации, например:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4 .
Однако, вы знаете, что содержащийся в последнем ряду оксид SiO 2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Следует запомнить:
· Вещества одного и того же генетического ряда друг с другом не реагируют.
· Вещества генетических рядов разных типов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема взаимосвязи веществ разных генетических рядов.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними.
Задание по теме:
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4 ;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3 ;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2 ;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3 ;
7. Al → Al 2 (SO 4) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 ;
8. Fe → FeCl 2 →FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2 ;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 ;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3 ;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3 ;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3 ;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3 ;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 ;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2 ;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3 ;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3 ;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3 ;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3 ;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3 ;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3 ;
Данный урок посвящен обобщению и систематизации знаний по теме «Классы неорганических веществ». Учитель расскажет, как из веществ одного класса можно получить вещество другого класса. Полученные знания и умения пригодятся для составления уравнений реакций по цепочкам превращений.
В ходе химических реакций химический элемент не исчезает, атомы переходят из одного вещества в другое. Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом — металлом или неметаллом — и заканчивающиеся солью.
Напомню вам, что в состав солей входят металлы и кислотные остатки. Итак, генетический ряд металла может выглядеть таким образом:
Из металла в результате реакции соединения с кислородом можно получить основный оксид, основный оксид при взаимодействии с водой дает основание (только, если это основание — щелочь), из основания в результате реакции обмена с кислотой, солью или кислотным оксидом можно получить соль.
Обратите внимание, такой генетический ряд подходит только для металлов, гидроксиды которых являются щелочами.
Запишем уравнения реакций, соответствующих превращениям лития в его генетическом ряду:
Li → Li 2 O → LiOH→ Li 2 SO 4
Как вы знаете, металлы при взаимодействии с кислородом, как правило, образуют оксиды. При окислении кислородом воздуха литий образует оксид лития:
4Li + O 2 = 2Li 2 O
Оксид лития, взаимодействуя с водой, образует гидроксид лития — растворимое в воде основание (щелочь):
Li 2 O + H 2 O = 2LiOH
Сульфат лития можно получить из лития несколькими способами, например, в результате реакции нейтрализации с серной кислотой:
2. Химическая информационная сеть ().
Домашнее задание
1. с. 130-131 №№ 2,4 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.204 №№ 2, 4 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
Задачи: формировать понятия «генетический ряд неметаллов» на примере соединений фосфора
Оксид фосфора(V). Фосфорная кислота
Цель урока: ознакомление учащихся с генетическим рядом фосфора, многообразием и практическим значением соединений фосфора на основе изучения химических свойств
Задачи:
формировать понятия «генетический ряд неметаллов» на примере соединений фосфора
раскрыть особенности химических свойств оксида фосфора (V), ортофосфорной кислоты и фосфатов;
познакомить с качественной реакцией на фосфат-ион;
развивать умение работать с учебником;
работать над развитием интереса к предмету.
Оборудование:
Тип урока: комбинированный
Ход урока
1.Организационный момент
-Здравствуйте. Садитесь.
2. Основная часть
А) проверка домашнего задания. Тест (Взаимопроверка. 1ошибка-«4», 2-3 ошибки- «3»)
1. Фосфор расположен…(5гр. гл подгр.)
2. на последнем энергетическом уровне … электронов(5)
3. проявляет степени окисления… (-3,0,+5)
4. у фосфора в группе неМЕ-ие свойства выражены сильнее, чем у …(мышьяка)
5.количество протонов …(16)
6. количество нейтронов …(15)
7.радиус атома фосфора по сравнению с азотом…(больше)
8.особое свойство белого фосфора …(светится в темноте)
9. красный фосфор при нагревании превращается … (в белый )
10. появление болотных блуждающих огней объясняется …(Ph5-легко воспламеняющийся на воздухе ядовитый газ)
Б) Новая тема
— Что такое генетический ряд?
— Чем отличается генетический ряд МЕ и неМЕ? (МЕ образуют основания, неМЕ кислоты. неМЕ- оксид- кислота- соль. Схему учитель пишет на доске.)
— Попробуйте составить генетический ряд для фосфора. (P-P2O5-h5PO4- Na3PO4)
— Как вы думаете, для чего мы составили генетический ряд фосфора? (формулировка целей и задач урока)
— Что сегодня мы будем изучать на уроке? (особенности физических, химических свойств оксида фосфора (V), ортофосфорной кислоты и фосфатов)
— Тема урока «Оксид фосфора (V). Фосфорная кислота».
-Пользуясь учебником дать характеристику P2O5 (стр.160, абзац 4 снизу.)
— Оксид фосфора это кислотный оксид, поэтому будет взаимодействовать с водой, оксидами металлов и основаниями. Пользуясь схемой, приведите самостоятельно примеры уравнений реакций. Не забудьте уравнять.
P205 +h40= h5PO4
P205+MEO=MEPO4
P205+MEOH=MEPO4+h4O
(2 ученика пишут свои примеры на доске, остальные проверяют)
— Дайте характеристику фосфорной кислоте, пользуясь учебником. Стр.160, абзац 3 снизу.
— Трёхосновная, кислородсодержащая кислота.
— Как диссоциируют трёхосновные кислоты? (ступенчато)
— Попробуйте написать диссоциацию фосфорной кислоты. (презентация)
H3PO4 ↔ H+ + H2PO4— (дигидрофосфат ион)
H2PO4— ↔ H+ + HPO42- гидрофосфат ион
HPO42- ↔ H+ + PO43- фосфат ион
— Соответственно образует три ряда солей:
Средние- фосфаты Кислые -дигидрофосфаты и гидрофосфаты
-Напишите формулы гидрофосфата магния, дигидрофосфата калия, фосфата алюминия.
Химические свойства фосфорной кислоты
— Как все кислоты взаимодействует с оксидами МЕ, МЕОН, МЕ(стоящие до водорода в электрохимическом ряду напряжения МЕ) , МЕКО.
— Используя схему, написать свои уравнения реакций. Для 2 и 4 примеров написать полное и сокращённое ионные уравнения. Для 3-ОВР. (1 ученик работает у доски)
(схема написана на доске)
MEO+ h5PO4=MEPO4+h4O
MEOH+ h5PO4=MEPO4+h4O
ME+h5PO4=MEPO4+h4
MEKO+ h5PO4=MEPO4+h4O
3. Закрепление
-Какие соединения образует фосфор?
-Почему фосфорная кислота может образовать три ряда солей?
— Что нового вы сегодня узнали на уроке?
— Сделайте вывод.
(При горении фосфор образует кислотный оксид, который обладает всеми свойствами кислотных оксидов. Фосфорная кислота , соответствующая оксиду фосфора (V), образует три ряда солей, так как трёхосновная. Взаимодействует с оксидами металлов, с основаниями, с солями. Реактивом на фосфат ионы является ион серебра Ag3PO4 жёлтый осадок)
4. Домашнее задание.
Параграф 28, упр.2, приготовить рассказ «Применение фосфора и его соединений».
Выставление оценок за урок.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
P3: Активность металлов
Группа реактивности представляет собой серию металлов в порядке их реактивности от наибольшей к наименьшей. Он используется для определения продуктов однократных реакций замещения, при которых металл A заменяет другой металл B в растворе, если A в ряду выше. Серии активности некоторых наиболее распространенных металлов, перечисленные в порядке убывания реакционной способности.
| Металлы | Металл-ион | Реакционная способность |
|---|---|---|
| К | К + | реагирует с водой |
| Na | Na + | реагирует с водой |
| Li | Li + | реагирует с водой |
| Ba | Ba 2 + | реагирует с водой |
| Sr | Sr 2 + | реагирует с водой |
| Ca | Ca 2 + | реагирует с водой |
| мг | мг 2 + | реагирует с кислотами |
| Al | Al 3 + | реагирует с кислотами |
| Мн | Mn 2 + | реагирует с кислотами |
| Zn | Zn 2 + | реагирует с кислотами |
| Cr | Cr 2 + | реагирует с кислотами |
| Fe | Fe 2 + | реагирует с кислотами |
| КД | Кд 2 + | реагирует с кислотами |
| Co | Co 2 + | реагирует с кислотами |
| Ni | Ni 2 + | реагирует с кислотами |
| Sn | Sn 2 + | реагирует с кислотами |
| Pb | Пб 2 + | реагирует с кислотами |
| H 2 | H + | включены для сравнения |
| Сб | Сб 2 + | крайне инертный |
| Bi | Bi 2 + | крайне инертный |
| Cu | Cu 2 + | крайне инертный |
| Hg | Hg 2 + | крайне инертный |
| Ag | Ag + | крайне инертный |
| Au | Au 3 + | крайне инертный |
| Pt | Pt + | крайне инертный |
Когда металл в элементарной форме помещается в раствор другой соли металла, для этого «элементарного металла» может быть более энергетически целесообразно существовать в виде иона, а «ионный металл» — в виде элемента.{2 +} (водн.) + Cu (s) \]
Однако серебро не может вытеснить ионы меди из раствора. Важно различать вытеснение водорода из кислоты и водорода из воды. Натрий очень активен и способен вытеснять водород из воды:
\ [2 Na (тв.) + 2 H_2O (l) \ rightarrow 2 NaOH (водн.) + H_2 (г) \]
Менее активные металлы, такие как железо или цинк, не могут вытеснить водород из воды, но легко реагируют с кислотами:
\ [Zn (s) + H_2SO_4 (вод.) \ Стрелка вправо ZnSO_4 (вод.) + H_2 (g) \]
Металлы, которые могут вытеснять ионы H + из кислот, легко распознать по их положению над H в ряду активности.Границу между металлами, которые вступают в реакцию с водой, и теми, которые не реагируют, труднее обнаружить. Например, кальций довольно реактивен с водой, тогда как магний не реагирует с холодной водой, но вытесняет водород из пара. Для точных прогнозов в этой области требуется более сложный расчет, включающий электродные потенциалы.
Происхождение
Реакционная способность металлов обусловлена разной стабильностью их электронных конфигураций как атомов и как ионов.Поскольку все они являются металлами, при реакции они образуют положительные ионы.
Калий имеет единственный электрон на внешней оболочке, который нужно потерять, чтобы получить стабильную электронную конфигурацию «благородный газ»; драгоценные металлы, которые существуют в d-блоке, не могут образовывать структуры, которые намного более стабильны, чем их элементарное состояние, с потерей всего нескольких электронов. Металлы, которым требуется потеря только одного электрона для образования стабильных ионов, более реактивны, чем аналогичные металлы, для которых требуется потеря более одного электрона.По этой причине металлы группы 1А являются наиболее реактивными.
Металлы с большим общим числом электронов имеют тенденцию быть более реактивными, поскольку их самые внешние электроны (те, которые будут потеряны) существуют дальше от положительного ядра, и поэтому они удерживаются менее прочно.
Токсичность и биологическая очистка экосистемы, загрязненной тяжелыми металлами, из сточных вод кожевенных заводов: обзор
Сброс неочищенных сточных вод кожевенных заводов, содержащих биотоксичные вещества тяжелых металлов, в экосистему является одной из наиболее важных проблем для окружающей среды и здоровья в нашем обществе.Следовательно, существует растущая потребность в разработке нового, эффективного, экологически чистого и экономичного подхода к восстановлению неорганических металлов (Cr, Hg, Cd и Pb), выбрасываемых в окружающую среду, и для защиты экосистемы. В этом отношении недавние достижения в области тяжелых металлов на основе микробов сделали биоремедиацию перспективной альтернативой традиционным методам. Тяжелые металлы не поддаются биологическому разложению и могут быть токсичными для микробов. Несколько микроорганизмов эволюционировали, чтобы разработать механизмы детоксикации, чтобы противостоять токсическим эффектам этих неорганических металлов.В настоящем обзоре предлагается критическая оценка способности микроорганизмов к биоремедиации, особенно в контексте защиты окружающей среды. Кроме того, в этой статье обсуждалась биосорбционная способность в отношении использования бактерий, грибов, биопленки, водорослей, генно-инженерных микробов и иммобилизованных микробных клеток для удаления тяжелых металлов. Использование биопленки показало синергетический эффект с многократным увеличением удаления тяжелых металлов как экологически безопасной технологии в ближайшем будущем.
1. Введение
Сточные воды промышленных кожевенных заводов являются основным источником загрязнения окружающей среды тяжелыми металлами. Тяжелые металлы имеют экономическое значение при промышленном использовании и являются наиболее важными загрязнителями окружающей среды. Загрязнение окружающей среды тяжелыми металлами стало серьезной угрозой для живых организмов в экосистеме [1–5]. Токсичность металлов вызывает серьезную озабоченность с точки зрения окружающей среды из-за их биоаккумуляции и отсутствия биоразлагаемости в природе [6, 7]. Несколько неорганических металлов, таких как магний (Mg), никель (Ni), хром (Cr 3+ ), медь (Cu), кальций (Ca), марганец (Mn) и натрий (Na), а также цинк (Zn). являются жизненно важными элементами, необходимыми в небольшом количестве для метаболических и окислительно-восстановительных функций.Тяжелые металлы, такие как алюминий (Al), свинец (Pb), кадмий (Cd), золото (Au), ртуть (Hg) и серебро (Ag), не имеют биологической роли и токсичны для живых организмов [1, 8 , 9].
Биоремедиация используется для перевода токсичных тяжелых металлов в менее вредное состояние с помощью микробов [10–12] или их ферментов для очистки загрязненной окружающей среды [13]. Методика экологически безопасна и экономична при оздоровлении окружающей среды [3, 9, 14]. Биоремедиация тяжелых металлов имеет ограничения.Среди них — производство токсичных метаболитов микробами и невозможность биоразложения тяжелых металлов.
Прямое использование микроорганизмов с отличительными характеристиками катаболического потенциала и / или их продуктов, таких как ферменты и био-поверхностно-активные вещества, является новым подходом к усилению и повышению их эффективности восстановления [15, 16]. Также ожидались различные альтернативы для расширения применения микробиологических методов для восстановления тяжелых металлов. Например, было исследовано использование микробных топливных элементов (MFC) для разложения устойчивых тяжелых металлов.Биопленочная биоремедиация может применяться для очистки окружающей среды, загрязненной тяжелыми металлами.
Микробные технологии активно развиваются [17]. Существует долгая история того, как микробы и металлы взаимодействуют как в естественной, так и в антропогенной среде. Взаимодействие микробов с металлами в первую очередь сосредоточено на удалении металлов, то есть на восстановлении и удалении загрязнений. Недавнее возрождение использования твердотельных электродов в качестве доноров или акцепторов электронов для роста микробов открыло новые перспективы, в результате чего появились микробно-электрохимические технологии (МЭТ) [18].Сообщалось о применении микроорганизмов в качестве зеленого подхода к синтезу металлических наночастиц (НЧ) [19]. Генетически модифицированные микроорганизмы также использовались в качестве средства восстановления [20, 21]. Генная инженерия и химическая модификация могут изменить компоненты поверхности клеток и могут эффективно улучшить адсорбционную способность и селективность по отношению к видам металлов-мишеней.
Несколько факторов, которые влияют на эффективность биоремедиации и ограничивают ее, включают температуру, pH, окислительно-восстановительный потенциал, статус питания, влажность и химический состав тяжелых металлов [22].Использование только микробов показало ограниченную эффективность из-за различных факторов, включая низкую конкурентоспособность, а также чрезмерные концентрации тяжелых металлов. Эффективность можно повысить за счет нескольких добавок с неорганическими питательными веществами, биосурфактантами, наполнителями и компостом, а также биочагом [23]. Эти корректировки были всесторонне рассмотрены в недавних исследованиях [24–26].
Существует несколько механизмов защиты микробных клеток от устойчивости к тяжелым металлам. Этими механизмами являются внеклеточный барьер, внеклеточная секвестрация и активный транспорт ионов металлов (отток), внутриклеточная секвестрация и восстановление ионов металлов [27, 28].
Таким образом, это исследование направлено на обзор отчетов предыдущих исследователей о токсическом действии и использовании микробных клеток и их продуктов, а именно биосурфактантов, для улучшения восстановления тяжелых металлов. В нем также обсуждаются факторы, влияющие на биоремедиацию тяжелых металлов, и их основные механизмы. Результаты и анализ представлены в следующих разделах. Текущие исследования в области микробной биосорбции и детоксикации не только обобщены, но и предложены направления на будущее.
2. Методология исследования
2.1. Стратегия поиска
В соответствующей научной литературе из основных баз данных был проведен поиск оригинальных научных статей о токсическом воздействии тяжелых металлов и использовании микробных клеток для восстановления тяжелых металлов. Был проведен поиск в следующих базах данных: PubMed, ScienceDirect и Google Scholar. Комбинации ключевых слов для поиска включали токсичность тяжелых металлов, сточные воды кожевенных заводов и биопленки, факторы, влияющие на микробную реабилитацию, биоремедиацию и механизмы микробной реабилитации.
2.2. Критерии включения
Были включены оригинальные научные исследования, в которых сообщалось о токсическом воздействии тяжелых металлов и использовании микроорганизмов для очистки экосистемы от тяжелых металлов.
2.3. Критерии исключения
Статьи, посвященные биоремедиации органических соединений, фиторемедиации тяжелых металлов и другим биологическим методам, были исключены.
3. Токсичность тяжелых металлов для микроорганизмов
Токсичность тяжелых металлов — это способность металла оказывать вредное воздействие на микроорганизмы, и она зависит от биодоступности тяжелого металла и поглощенной дозы [29].Токсичность тяжелых металлов включает несколько механизмов, то есть нарушение фатальных ферментативных функций, реагирование в качестве окислительно-восстановительных катализаторов при производстве активных форм кислорода (АФК), нарушение ионной регуляции и прямое влияние на образование ДНК, а также белка [30, 31] . Физиологические и биохимические свойства микроорганизмов могут изменяться из-за присутствия тяжелых металлов. Хром (Cr) и кадмий (Cd) способны вызывать окислительное повреждение и денатурацию микроорганизмов, а также ослаблять способность микробов к биоремедиации.
Хром Cr (III) может изменять структуру и активность ферментов, вступая в реакцию с их карбоксильными и тиольными группами [32]. Внутриклеточные катионные комплексы Cr (III) электростатически взаимодействуют с отрицательно заряженными фосфатными группами ДНК, что может влиять на транскрипцию, репликацию и вызывать мутагенез [32].
Тяжелые металлы, такие как медь (Cu (I) и Cu (II)), могут катализировать образование ROS посредством реакций Фентона и Габера-Вейса, которые будут действовать как растворимые переносчики электронов.Это может вызвать серьезные повреждения цитоплазматических молекул, ДНК, липидов и других белков [33, 34]. Алюминий (Al) может стабилизировать супероксидные радикалы, ответственные за повреждение ДНК [35]. Тяжелые металлы могут останавливать жизненно важные ферментативные функции за счет конкурентных или неконкурентных взаимодействий с субстратами, которые вызывают изменения конфигурации ферментов [30]. Кроме того, он также может вызывать дисбаланс ионов, прилипая к поверхности клетки и проникая через ионные каналы или трансмембранные переносчики [36].
Кадмий (Cd) и свинец (Pb) оказывают вредное воздействие на микробы, повреждают клеточные мембраны и разрушают структуру ДНК. Этот вред вызван вытеснением металлов с их естественных участков связывания или взаимодействием лигандов [37]. На морфологию, метаболизм и рост микробов влияет изменение структуры нуклеиновых кислот, вызывающее функциональные нарушения, разрушение клеточных мембран, ингибирование активности ферментов и окислительное фосфорилирование [38, 39] (Таблица 1).
| |||||||||||||||||||||||||||||||||||||||
4.Факторы, влияющие на микробное восстановление тяжелых металлов
Склонность тяжелых металлов к стимуляции или подавлению микроорганизмов определяется общей концентрацией ионов металлов, химическими формами металлов и связанными с ними факторами, такими как окислительно-восстановительный потенциал. Факторы окружающей среды, такие как температура, pH, низкомолекулярные органические кислоты и гуминовые кислоты, могут изменять трансформацию, транспортировку, состояние тяжелых металлов и биодоступность тяжелых металлов для микроорганизмов.Тяжелые металлы имеют тенденцию к образованию свободных ионных частиц при кислых уровнях pH, с большим количеством протонов, доступных для насыщения участков связывания металлов. При более высоких концентрациях ионов водорода поверхность адсорбента заряжается более положительно, что снижает притяжение между адсорбентом и катионами металлов, тем самым увеличивая его токсичность.
Температура играет важную роль в адсорбции тяжелых металлов. Повышение температуры увеличивает скорость диффузии адсорбата через внешний пограничный слой.Растворимость тяжелых металлов увеличивается с повышением температуры, что улучшает биодоступность тяжелых металлов [44]. Однако действие микроорганизмов усиливается с повышением температуры в подходящем диапазоне, и это усиливает микробный метаболизм и активность ферментов, что ускоряет биоремедиацию. Стабильность комплекса микробы-металл зависит от участков сорбции, конфигурации микробной клеточной стенки и ионизации химических фрагментов на клеточной стенке. Результат процесса разложения зависит от субстрата и ряда факторов окружающей среды (Таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||
5.Механизм микробной детоксикации тяжелых металлов
Микроорганизмы используют различные механизмы для взаимодействия и выживания в присутствии неорганических металлов. Различные механизмы, используемые микробами для выживания при токсичности металлов, включают биотрансформацию, экструзию, использование ферментов, производство экзополисахаридов (EPS) [41, 46] и синтез металлотионеинов. В ответ на присутствие металлов в окружающей среде у микроорганизмов выработались гениальные механизмы устойчивости к металлам и детоксикации. Механизм включает несколько процедур, включая электростатическое взаимодействие, ионный обмен, осаждение, окислительно-восстановительный процесс и поверхностное комплексообразование [47].Основными механическими средствами противодействия тяжелым металлам со стороны микроорганизмов являются окисление металлов, метилирование, ферментативное снижение, металлоорганический комплекс, уменьшение количества металлов, деградация металлических лигандов, насосы оттока металлов, деметилирование, внутриклеточная и внеклеточная секвестрация металлов, исключение через барьер проницаемости и продукция хелаторов металлов, таких как металлотионеины и био-поверхностно-активные вещества [48].
Микроорганизмы могут обеззараживать металлы путем преобразования валентности, улетучивания или внеклеточного химического осаждения [48].Микроорганизмы имеют отрицательный заряд на своей клеточной поверхности из-за наличия анионных структур, которые позволяют микробам связываться с катионами металлов [49]. Отрицательно заряженными участками микробов, участвующих в адсорбции металла, являются гидроксильная, спиртовая, фосфорильная, аминная, карбоксильная, сложноэфирная, сульфгидрильная, сульфонатная, тиоэфирная и тиоловая группы [49].
5.1. Механизм биосорбции
Поглощение тяжелых металлов микробными клетками с помощью механизмов биосорбции можно разделить на независимую от метаболизма биосорбцию, которая в основном происходит на внешней поверхности клеток, и биоаккумуляцию, зависящую от метаболизма, которая включает методы секвестрации, окислительно-восстановительной реакции и видовой трансформации. [50, 51].Биосорбция может осуществляться мертвой биомассой или живыми клетками как пассивное поглощение посредством поверхностного комплексообразования клеточной стенкой и поверхностными слоями [52]. Биоаккумуляция зависит от множества химических, физических и биологических механизмов (рис. 1), и эти факторы являются внутриклеточными и внеклеточными процессами, в которых биосорбция играет ограниченную и плохо определенную роль [52].
5.2. Внутриклеточная секвестрация
Внутриклеточная секвестрация — это комплексообразование ионов металлов с помощью различных соединений в цитоплазме клетки.Концентрация металлов в микробных клетках может быть результатом взаимодействия с поверхностными лигандами с последующим медленным переносом в клетку. Способность бактериальных клеток накапливать внутриклеточные металлы использовалась на практике, преимущественно при очистке сточных вод. Толерантный к кадмию штамм P. putida обладал способностью внутриклеточной секвестрации ионов меди, кадмия и цинка с помощью низкомолекулярных белков, богатых цистеином [54]. Также внутриклеточная секвестрация ионов кадмия глутатионом была обнаружена в клетках Rhizobium leguminosarum [55].
Жесткая клеточная стенка грибов состоит из хитина, минеральных ионов, липидов, азотсодержащих полисахаридов, полифосфатов и белков. Они могут обеззараживать ионы металлов за счет поглощения энергии, внеклеточного и внутриклеточного осаждения и преобразования валентности, при этом некоторые грибы накапливают металлы в своем мицелии и спорах. Внешняя часть клеточной стенки грибов ведет себя как лиганд, используемый для мечения ионов металлов, и вызывает удаление неорганических металлов [56-59]. Пептидогликан, полисахарид и липид являются компонентами клеточной стенки, которые богаты металлсвязывающими лигандами (например,g., -OH, -COOH, -HPO42-, SO42- -RCOO-, R2OSO3-, -Nh3 и -SH). Амин может быть более активным в захвате металла среди этих функциональных групп, так как он связывается с анионными частицами металлов посредством электростатического взаимодействия и с катионными частицами металлов через поверхностное комплексообразование.
5.3. Внеклеточная секвестрация
Внеклеточная секвестрация — это накопление ионов металлов клеточными компонентами в периплазме или комплексообразование ионов металлов в виде нерастворимых соединений. Резистентные к меди штаммы Pseudomonas syringae продуцировали индуцируемые медью белки CopA, CopB (периплазматические белки) и CopC (белок внешней мембраны), которые связывают ионы меди и микробные колонии [60].Бактерии могут выбрасывать ионы металлов из цитоплазмы, чтобы изолировать металл внутри периплазмы. Ионы цинка могут проникать из цитоплазмы по системе оттока, где они накапливаются в периплазме штамма Synechocystis PCC 6803 [61].
Осаждение металлов — это внеклеточная секвестрация. Бактерия-восстановитель железа, такая как Geobacter spp. и бактерии, восстанавливающие серу, такие как Desulfuromonas spp. способны восстанавливать вредные металлы до менее токсичных или нетоксичных металлов. г.Metallireducens , строгий анаэроб, способен восстанавливать марганец (Mn) от летального Mn (IV) до Mn (II) и уран (U) от ядовитого U (VI) до U (IV) [49]. G. Surreducens и G. Metallireducens обладают способностью снижать содержание хрома (Cr) от очень летального Cr (VI) до менее токсичного Cr (III) [62]. Сульфатредуцирующие бактерии выделяют большое количество сероводорода, что вызывает осаждение катионов металлов [63, 64].
Штамм Klebsiella planticola генерирует сероводород из тиосульфата в анаэробных условиях и осаждает ионы кадмия в виде нерастворимых сульфидов [65].Также кадмий осаждали штаммом P. aeruginosa в аэробных условиях [66]. Штамм Vibrio harveyi осаждал растворимый двухвалентный свинец в виде комплексной фосфатной соли свинца [67].
5.4. Внеклеточный барьер, предотвращающий проникновение металлов в микробную клетку
Микробная плазматическая мембрана, клеточная стенка или капсула могут препятствовать проникновению ионов металлов в клетку. Бактерии могут адсорбировать ионы металлов ионизируемыми группами клеточной стенки (амино, карбоксильными, фосфатными и гидроксильными группами) [68, 69].Pardo et al. [70], Taniguchi et al. [69] и Грин-Руис [71] наблюдали высокий уровень пассивной биосорбции ионов тяжелых металлов для нежизнеспособных клеток Pseudomonas putida, Brevibacterium sp. И Bacillus sp.
Клетки биопленки Pseudomonas aeruginosa проявляют более высокую устойчивость к ионам меди, свинца и цинка, чем планктонные клетки, в то время как клетки, расположенные на периферии биопленки, были убиты. Внеклеточные полимеры биопленки аккумулируют ионы металлов, а затем защищают бактериальные клетки внутри биопленки [72].
5.5. Метилирование металлов
Метилирование увеличивает токсичность металлов в результате повышенной липофильности и, следовательно, увеличения проникновения через клеточные мембраны. Метилирование микробов играет важную роль в восстановлении металлов. Метилированные соединения обычно взрывоопасны; например, Hg (II) может быть биометилирован некоторыми бактериями, такими как Bacillus spp ., Escherichia spp. , Clostridium spp . , и Pseudomonas spp . до газообразной метилртути. Биометилирование селена (Se) до летучего диметилселенида и мышьяка (As) до газообразных арсинов, а также свинца (Pb) до диметилсвинца наблюдалось в загрязненных верхних слоях почвы [48].
5.6. Восстановление ионов тяжелых металлов микробной клеткой
Микробные клетки могут переводить ионы металлов из одного состояния окисления в другое, тем самым снижая их вред [73]. Бактерии используют металлы и металлоиды в качестве доноров или акцепторов электронов для производства энергии. Металлы в окисленной форме могут служить конечными акцепторами электронов при анаэробном дыхании бактерий.Восстановление ионов металлов за счет ферментативной активности может привести к образованию менее токсичных форм ртути и хрома [74, 75].
6. Способность микроорганизмов к биоремедиации тяжелых металлов
Поглощение тяжелых металлов микроорганизмами происходит посредством биоаккумуляции, которая является активным процессом, и / или посредством адсорбции, которая является пассивным процессом. Некоторые микроорганизмы, такие как бактерии, грибы и водоросли, использовались для очистки окружающей среды, загрязненной тяжелыми металлами (таблица 3) [76, 77].Применение устойчивых к металлам штаммов в одиночной, консорциумной и иммобилизованной форме для восстановления тяжелых металлов дало эффективные результаты, в то время как иммобилизованная форма могла иметь больше участков хемосорбции для биосорбции тяжелых металлов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6.1. Способность бактерий к восстановлению тяжелых металлов
Микробная биомасса обладает различными биосорбционными способностями, которые также значительно различаются среди микробов.Однако биосорбционная способность каждой микробной клетки зависит от ее предварительной обработки и условий эксперимента. Микробная клетка должна адаптироваться к изменению физической, химической конфигурации и конфигурации биореактора для усиления биосорбции [52]. Бактерии являются важными биосорбентами из-за их повсеместности, размера и способности расти в контролируемых условиях, а также устойчивости к условиям окружающей среды [78, 79].
Де Джайсанкар и его соавторы [99] используют устойчивые к ртути бактерии, такие как Alcaligenes faecalis, Bacillus pumilus, Pseudomonas aeruginosa, и Brevibacterium iodinium для удаления кадмия (Cd) и свинца (Pb).В этом исследовании P. aeruginosa и A. faecalis удалили 70% и 75% кадмия (Cd) с уменьшением на 1000 мг / л до 17,4 мг / л кадмия (Cd) P. aeruginosa и 19,2 мг / л A. faecalis примерно за 72 часа. Brevibacterium iodinium и Bacillus pumilus удаляют более 87% и 88% свинца (Pb) со снижением на 1000 мг / л до 1,8 мг / л за 96 часов (таблица 3). В другом исследовании [118] используется местный факультативный анаэробный препарат Bacillus cereus для детоксикации шестивалентного хрома. Bacillus cereus обладает превосходной способностью удалять 72% Cr (VI) при концентрации хромата 1000 мкг / мл г / мл. Бактерии были способны восстанавливать Cr (VI) в широком диапазоне температур (от 25 до 40 ° C) и pH (от 6 до 10) с оптимумом при 37 ° C и начальным pH 8,0.
Несколько тяжелых металлов были протестированы с использованием таких видов бактерий, как Flavobacterium , Pseudomonas , Enterobacter, Bacillus, и Micrococcus sp. (Таблица 3).Их высокая биосорбционная способность обусловлена высоким отношением поверхности к объему и потенциально активными центрами хемосорбции (тейхоевая кислота) на клеточной стенке [119]. Бактерии более стабильны и лучше выживают, когда они находятся в смешанной культуре [120]. Следовательно, консорциумы культур метаболически превосходят по биосорбции металлов и более подходят для применения в полевых условиях [121]. De Jaysankar et al. [99] сообщил о 78% снижении хрома (Cr) с использованием консорциума бактерий Acinetobacter sp.и Arthrobacter sp. концентрации ионов металлов 16 мг / л. Micrococcus luteus был использован для удаления большого количества Pb из синтетической среды. В идеальных условиях элиминационная способность составляла 1965 мг / г [122].
Abioye и его сотрудники [123] исследовали биосорбцию свинца (Pb), хрома (Cr) и кадмия (Cd) в сточных водах кожевенных заводов, используя Bacillus subtilis, B. megaterium, Aspergillus niger и Penicillium sp. B. megaterium зафиксировал самое высокое восстановление свинца (Pb) (2.13 до 0,03 мг / л), за которым следует B . subtilis (2,13-0,04 мг / л). A. niger демонстрирует самую высокую способность снижать концентрацию хрома (Cr) (1,38-0,08 мг / л), за ним следует Penicillium sp. (1,38-0,13 мг / л), в то время как B. subtilis продемонстрировал самую высокую способность снижать концентрацию кадмия (Cd) (0,4-0,03 мг / л), за которым следует B. megaterium (0,04-0,06 мг / л) через 20 дней. Ким и его соавторы [76] разработали периодическую систему с использованием иммобилизованного цеолитом Desulfovibrio desulfuricans для удаления хрома (Cr 6+ ), меди (Cu) и никеля (Ni) с эффективностью удаления 99.8%, 98,2% и 90,1% соответственно (таблица 3). Ашрута и его коллеги [124] сообщили об эффективном удалении хрома, цинка, кадмия, свинца, меди и кобальта консорциумами бактерий примерно на 75-85% менее чем за два часа после контакта.
6.2. Способность грибов к восстановлению тяжелых металлов
Грибы широко используются в качестве биосорбентов для удаления токсичных металлов с отличной способностью поглощать и восстанавливать металлы [125–127]. Большинство исследований показало, что активные и безжизненные клетки грибов играют важную роль в адгезии неорганических химикатов [111, 128–130].Шривастава и Тхакур [131] также сообщили об эффективности Aspergillus sp. используется для удаления хрома из сточных вод кожевенных заводов. 85% хрома было удалено при pH 6 в системе биореактора из синтетической среды по сравнению с 65% удалением из сточных вод кожевенного завода. Это может быть связано с наличием органических загрязнителей, препятствующих росту организма.
Coprinopsis atramentaria изучается на предмет его способности к биоаккумуляции 76% Cd 2+ в концентрации 1 мг / л Cd 2+ и 94.7% Pb 2+ при концентрации 800 мг / л Pb 2+ . Следовательно, он был задокументирован как эффективный аккумулятор ионов тяжелых металлов для микромедиации [132]. Парк и его соавторы [133] сообщили, что биомасса мертвых грибов Aspergillus niger, Rhizopus oryzae, Saccharomyces cerevisiae и Penicillium chrysogenum может быть использована для преобразования токсичного Cr (VI) в менее токсичный или нетоксичный Cr (III). Luna et al. [134] также заметил, что Candida sphaerica производит биосурфактанты с эффективностью удаления 95%, 90% и 79% для Fe (железа), цинка (Zn) и свинца (Pb) соответственно.Эти поверхностно-активные вещества могут образовывать комплексы с ионами металлов и непосредственно взаимодействовать с тяжелыми металлами до отделения от почвы. Candida spp. накапливают значительное количество никеля Ni (57–71%) и меди Cu (52–68%), но на процесс влияют исходная концентрация ионов металла и pH (оптимум 3–5) [135].
Биосурфактанты вызывают интерес в последние годы из-за их низкой токсичности, биоразлагаемой природы и разнообразия. Маллиган и др. . [136] оценили эффективность использования сурфактина, рамнолипида и софоролипида для удаления тяжелых металлов (Cu и Zn).Однократная промывка 0,5% рамнолипида удалила 65% меди (Cu) и 18% цинка (Zn), тогда как 4% софоролипида удалили 25% меди (Cu) и 60% цинка (Zn). Несколько штаммов дрожжей, таких как Hansenula polymorpha , S. cerevisiae, Yarrowia lipolytica, Rhodotorula pilimanae, Pichia guilliermondii и Rhodotorula mucilage , были использованы для биопревращения Cr (VI) в Cr (III) [137–13]. 139].
6.3. Удаление тяжелых металлов с помощью биопленки
Имеется несколько отчетов о применении биопленок для удаления тяжелых металлов.Биопленка действует как эффективный инструмент биоремедиации, а также как средство биологической стабилизации. Биопленки обладают очень высокой толерантностью к токсичным неорганическим элементам даже в смертельной концентрации. В исследовании, проведенном на Rhodotorula mucilaginosa , было выявлено, что эффективность удаления металлов составляла от 4,79 до 10,25% для планктонных клеток и от 91,71 до 95,39% для клеток биопленки [140]. Механизмы биоремедиации биопленок могут осуществляться через биосорбент или экзополимерные вещества, присутствующие в биопленках, которые содержат молекулы с поверхностно-активными или эмульгаторными свойствами [141].
6.4. Способность тяжелых металлов к восстановлению водорослей
Водоросли являются автотрофными и, следовательно, требуют мало питательных веществ и производят огромную биомассу по сравнению с другими микробными биосорбентами. Эти биосорбенты также использовались для удаления тяжелых металлов с высокой сорбционной способностью [12]. Биомасса водорослей используется для биоремедиации сточных вод, загрязненных тяжелыми металлами, путем адсорбции или интеграции в клетки. Phycoremediation — это использование различных типов водорослей и цианобактерий для восстановления тяжелых металлов путем удаления или разложения токсиканта [142].Водоросли имеют на своей поверхности различные химические фрагменты, такие как гидроксил, карбоксил, фосфат и амид, которые действуют как участки связывания металлов [12, 143].
Goher и его соавторы [113] использовали мертвые клетки Chlorella vulgaris для удаления ионов кадмия (Cd 2+ ), меди (Cu 2+ ) и свинца (Pb 2+ ) из водного раствора. при различных условиях pH, дозировке биосорбента и времени контакта. Результаты показали, что биомасса C. vulgaris является чрезвычайно эффективным биосорбентом для удаления кадмия (Cd 2+ ) , меди (Cu 2+ ) и свинца (Pb 2+ ) при 95.5%, 97,7% и 99,4% соответственно из смешанного раствора 50 мг дм -3 каждого иона металла (таблица 3).
6.5. Иммобилизованная биосорбция тяжелых металлов
Использование инкапсулированной биомассы улучшает характеристики биосорбции и увеличивает ее физическую и химическую стабильность. Иммобилизация микробной биомассы в полимерных матрицах придает жесткость и термостойкость с оптимальной пористостью для практического применения. Биомасса Agrobacterium была инкапсулирована в альгинат с наночастицами оксида железа и показала адсорбционную способность 197.02 мг / г для Pb и был эффективным в течение пяти последовательных циклов [144].
6.6. Микробная генная инженерия
Благодаря передовым достижениям в области генной инженерии микробы конструируются с желаемыми характеристиками, такими как способность выдерживать металлический стресс, сверхэкспрессия металл-хелатирующих белков и пептидов и способность накапливать металлы. Frederick et al. [145] сконструировал микроорганизмы для производства трегалозы и установил, что она восстанавливает 1 мМ Cr (VI) до Cr (III). Сконструированный Chlamydomonas reinhardtii вызвал значительное повышение толерантности к токсичности кадмия и его накоплению [146].Генно-инженерные микробы для восстановления тяжелых металлов включают использование Escherichia coli ( E. coli ArsR (ELP153AR)) для нацеливания на As (III) [147] и Saccharomyces cerevisiae (CP2 HP3) для нацеливания на Cd 2+. и Zn 2+ [148]. Corynebacterium glutamicum была генетически модифицирована с использованием сверхэкспрессии оперонов ars ( ars 1 и ars 2) для дезактивации сайтов, загрязненных As [149].
Биоремедиация тяжелых металлов была тщательно изучена, и эффективность нескольких биоремедиаторов была рассмотрена и обобщена.Биоремедиация — это экологически чистая и экономичная технология очистки сложных промышленных сточных вод кожевенных заводов, содержащих тяжелые металлы. Многие природные биосорбенты микробного происхождения обладают эффективными биосорбционными характеристиками. Недавние модификации поверхности этих биоремедиаторов помогли улучшить их свойства связывания металлов и повысить общую стоимость процесса. Несмотря на такие недостатки, как нативные, так и модифицированные биосорбенты продемонстрировали свою совместимость при тестировании со сточными водами кожевенных заводов.Эти биосорбенты показали эффективное удаление металлов в широком диапазоне температуры, pH и условий раствора.
7. Перспективы на будущее
Определенные факторы, препятствующие широкому применению этой технологии, по мнению различных исследователей, включают трудность получения надежной и недорогой биомассы и негативное влияние сосуществующих ионов металлов на биосорбционную способность. Перед применением необходимо оценить характеристики сточных вод кожевенного завода и биосорбента.Сохраняя в центре внимания запреты технологии биоремедиации, будущее выглядит многообещающим для микробных генетических технологий и развития повышенной специфичности с использованием биопленок, что может быть достигнуто с помощью процесса оптимизации и методов иммобилизации. Следовательно, следует прилагать больше усилий к биоремедиации, опосредованной биопленками, генетически модифицированным микробам и микробным топливным элементам (MFC) для биоремедиации тяжелых металлов в экосистеме.
8. Заключение
Текущее состояние биоремедиации тяжелых металлов, рассмотренное в этом исследовании, показывает многообещающие перспективы биосорбции и детоксикации металлов, особенно от биопленок и генетически модифицированных микробов.Методы, опосредованные биопленкой, перенос микробных генов и методы, основанные на микробных топливных элементах, в последние годы стали серьезными соперниками. Пептидогликан и полисахаридный компонент клеточной стенки биосорбентов является активным участком связывания для более высокого поглощения металлов. Этот метод является рентабельным и экологически чистым, который имеет такие преимущества, как более быстрая кинетика, высокое связывание металлов в широком диапазоне pH и температуры. Этот обзор дает возможность выявить роль микробных клеток, биопленок и их метаболитов в восстановлении тяжелых металлов и исследованиях окружающей среды.Необходимо расширить область дальнейших исследований, чтобы сфокусировать внимание на переносе генов в биопленках для восстановления тяжелых металлов. Это будет способствовать разработке улучшенных методов биоремедиации тяжелых металлов в экосистеме.
Конфликт интересов
Авторы заявили об отсутствии конфликта интересов в отношении публикации этой статьи.
Вклад авторов
Это исследование было проведено в сотрудничестве со всеми авторами.Бернар Э. Игири получил концепцию исследования, написал черновик рукописи и участвовал в доработке. Стэнли И. Р. Окодува разработал исследование и критически отредактировал рукопись на предмет важного интеллектуального содержания. Грейс О. Идоко, Абрахам О. Адейи, Эбере П. Акабуогу и Ибе К. Эджиогу участвовали в приобретении и управлении соответствующей литературой для черновика рукописи и последующего редактирования. Окончательная версия была написана Бернардом Э. Игири и Стэнли И. Р. Окодува. Все авторы окончательно одобрили публикацию исправленной версии.
Благодарности
Авторы благодарны членам и исследователям из Директората исследований и разработок Нигерийского института кожевенных и научных технологий, Зария, Нигерия, за их моральную поддержку в ходе этого проекта.
Как взаимодействуют ваши гены и окружающая среда?
Самые распространенные болезни являются результатом как ваших генов, так и окружающей среды. Ваше окружение может включать в себя личный выбор, например, какие продукты вы едите и сколько вы тренируетесь, а также внешние факторы, такие как стресс, чистая вода и качество воздуха.Лишь небольшое количество заболеваний возникает в результате единственной мутации в гене. Примерами этих заболеваний, связанных с одним геном, являются болезнь Хантингтона и болезнь Тея Сакса. Большинство болезней, особенно распространенных, представляют собой сочетание вашего генетического риска и вашего окружения. Становится трудным сгруппировать болезни как чисто «генетические», так и «экологические», потому что большинство болезней — это то и другое одновременно. Например, эмфизема может быть результатом как курения, так и расстройства, называемого дефицитом альфа-1-АТ.Область исследований взаимодействия генов с окружающей средой (GxE) расширяется.
Как взаимодействуют ваши гены и окружающая среда?
Важно понимать, что в большинстве случаев ваши гены не определяют ваше здоровье. Небольшие различия в вашем генетическом составе означают, что два человека могут по-разному реагировать на одно и то же воздействие окружающей среды. Вот несколько способов взаимодействия ваших генов и окружающей среды:
- Мутагены — Мутагены — это загрязняющие вещества в окружающей среде, которые попадают в организм и напрямую изменяют последовательность вашей ДНК.Пример: химические вещества в сигаретном дыме могут вызывать рак.
- Взаимодействие ген-ген — Взаимодействие ген-ген происходит, когда загрязнители в окружающей среде не изменяют последовательность вашей ДНК, а вызывают цепную реакцию, которая влияет на функционирование одного гена, а затем влияет на функционирование другого гена. Пример: регулярное употребление слишком большого количества алкоголя может привести к тому, что определенный ген, ТАСЕ, не будет производить достаточное количество своего белка. Предполагается, что белок TACE помогает гену MTHFR производить достаточное количество его белка.Слишком мало белка MTHFR изменяет уровень фолиевой кислоты (другого белка) в нашей крови, а низкий уровень фолиевой кислоты может вызвать депрессию.
- Факторы транскрипции — Загрязняющие вещества в окружающей среде могут косвенно влиять на последовательность ДНК, изменяя факторы транскрипции, которые отвечают за запуск процесса использования генов для производства белков, необходимых для различных функций организма. Пример: стресс может изменить количество белков, вырабатываемых генами, задействованными в вашей иммунной системе, и поэтому вы можете легче заболеть, когда находитесь в состоянии стресса.
- Epigenetics — Окружающая среда может изменить ваше здоровье, воздействуя на белки, которые включают или выключают гены. Продолжайте читать, чтобы узнать больше об эпигенетике. Пример: половина генов, вызывающих семейный или наследственный рак, отключается, когда загрязнители окружающей среды влияют на эти белки. Поскольку они выключены, эти гены не могут подавлять образование опухолей или восстанавливать ДНК.
Эпигенетика
Эпигеном является первичным местом взаимодействия генов с окружающей средой и может изменяться окружающей средой как прямо, так и косвенно.Буквально это означает «помимо генетики или в дополнение к ней» или, по сути, факторы, не входящие в генетическую последовательность. Эпигенетические факторы (наиболее известные из них — модификация гистонов и метилирование ДНК) могут включать или выключать гены и определять, какие белки транскрибируются. Они участвуют во многих нормальных клеточных процессах, и эпигенетические изменения являются естественной частью человеческого развития. Однако некоторые изменения могут привести к заболеванию. Некоторые из этих аномальных изменений могут привести к таким заболеваниям, как:
- Рак
- Умственная отсталость
- Нарушения нервного развития
- Сердечно-сосудистые заболевания
- Сахарный диабет 2 типа
- Ожирение
- Бесплодие
Эпигенетика и окружающая среда
Некоторые воздействия окружающей среды и диетические факторы могут привести к аномальным изменениям эпигенетических путей.Поскольку эпигенетические изменения тонкие и кумулятивные, трудно понять истинную причинную связь между эпигенетикой и окружающей средой. Некоторые факторы, которые могут привести к эпигенетическим изменениям, включают —
- Тяжелые металлы, такие как кадмий
- Винклозолин, широко используемый пестицид
- Дефицит фолиевой кислоты и метионина ,00
- Сигаретный дым
Геномы полиэкстремофильных цианидиев содержат 1% горизонтально переносимых генов с разнообразными адаптивными функциями
Благодарим вас за отправку вашей статьи «Геномы полиэкстремофильных цианидиев содержат 1% горизонтально переносимых генов с различными адаптивными функциями» на рассмотрение eLife .Ваша статья была рассмотрена тремя рецензентами, а оценка проводилась под наблюдением редактора-рецензента и Дитхарда Тауца в качестве старшего редактора. Следующее лицо, участвовавшее в рассмотрении вашей заявки, согласилось раскрыть свою личность: Грегори Фурнье (Рецензент №2).
Рецензенты обсудили рецензии друг с другом, и редактор-рецензент подготовил это решение, чтобы помочь вам подготовить исправленную заявку.
Вы переоцениваете утверждения о широко распространенном HGT в линиях красных водорослей, в частности, в экстремофильных средах, Cyanidiales.Эта работа в значительной степени является ответом как на ранее опубликованные заявления об обширном HGT в геномах эукариот, так и на альтернативные утверждения о том, что прокоариот-эукариотный HGT чрезвычайно редок, причем в большинстве случаев это связано с загрязнением или другими систематическими ошибками в обнаружении. Вы решаете эти проблемы, расширяя выборку генома красных видов водорослей, а также применяя строгие филогенетические и статистические тесты для обнаружения событий HGT. Вы также делаете вывод, что этот ограниченный, но четкий сигнал HGT в клонах красных водорослей свидетельствует против существования эукариального «пангенома» точно так же, как пангеномы, вероятно, существуют внутри прокариот.Работа имеет отношение к этим дебатам, и тщательная оценка и изучение результатов, в том числе смещение содержания G + C, смещение интрон-экзон, транскриптомный анализ, эволюционная дистанция и ручная проверка предполагаемой филогении генного дерева, — все это говорит о том, что эта работа является ценное дополнение к полю. Особенно интересно тестирование интронной предвзятости и убедительное наблюдение, которое соответствует предсказанию. Вы ловко указываете на нетривиальность этих типов анализа, например, на сложность присвоения HGT группе получателей, когда потеря могла произойти в других кладах после более наследственной передачи.Использование PID для различения сценариев HGT и DL также убедительно и интуитивно понятно.
Необходимо внести ряд важных исправлений, как описано ниже:
1) Дерево на рисунке 2 имеет неверный корень. Корень должен находиться между кладой зеленых водорослей и кладой красных водорослей, а не внутри зеленых водорослей. Кроме того, аннотированные даты для разбиений в этом дереве потенциально вводят в заблуждение; Возраст этих групп остается весьма неопределенным, и его не следует сообщать без включенных возрастных диапазонов неопределенности, как указано в цитируемых источниках.
2) «Основная предпосылка теории HGT (и кумулятивных эффектов) состоит в том, что горизонтально приобретенные гены имеют другие структурные характеристики по сравнению с нативными генами». Хотя это правильное наблюдение, оно не является «основным предварительным условием», поскольку HGT между линиями с аналогичным содержанием G + C и использованием кодонов все равно будет происходить и обнаруживаться с помощью филогенетического анализа. Просто перенесенные гены какое-то время сохраняют состав своей донорской линии.
3) Спецификация HGT и схемы приобретения HGT.Как проиллюстрировано на рисунке 5, авторы описывают, как HGT-события и предполагаемые доноры HGT наблюдаются в генных деревьях. Эти генные деревья являются важным результатом, и, помимо скомпилированной таблицы, представленной в основном тексте, расширенная версия рисунка 5 должна быть включена в дополнительную информацию, которая включает все предполагаемые HGT. Общее количество HGT, выявленных в ходе исследования, достаточно мало, чтобы это было осуществимо.
4) Потенциальные доноры HGT живут в тех же средах обитания, что и Cyanidiales.«Чтобы определить потенциальные источники HGT, мы подсчитали частоту, с которой любые неэукариотические виды разделяли монофилию с Cyanidiales». Характеристика «донора» в этом разделе и на соответствующем рисунке 2 неверна. Сестринские группы для групп реципиентов HGT действительно составляют монофилетическую кладу в гене, указывающем на HGT, но они сами по себе не идентифицируют донорскую линию, группу доноров или вероятную среду донора. Как бактериальные, так и эукариальные сестринские группы могли быть реципиентами HGT от дополнительной незапечатанной или вымершей донорской линии, или ген мог быть распределен посредством пошагового HGT между сестринскими кладами после последующего приобретения.Единственный способ четко идентифицировать донорскую группу для HGT — это если генное дерево «гнездится» реципиентной группы HGT в парафилетической донорской кладе. Это не совсем ясно ни в одном из примеров деревьев генов HGT, показанных на фиг. 5. Например, на фиг. 5B, Galdieria является сестрой Actinobacteria, с представителями Firmicutes в качестве внешней группы. Поскольку у нас нет установленной взаимосвязи между видами и деревом, объединяющими актинобактерии и эти фирмикуты, мы не можем определить, передала ли линия актинобактерий ген предку Galdieria , или оба получили ген от более древнего родственника фирмикутов, или другая линия не представлена.Напротив, на Фигуре 5E, Galdieria гнездится внутри клады таксонов протеобактерий. Если вместе они представляют кладу видов Proteobacteria, то можно сделать вывод, что Galdieria была перенесена из этой группы, и экология этой клады-донора будет ограничивать экологию события переноса.
Это также усложняет вывод об общей экологии между группами «доноров» и получателей. Если существует сильная корреляция с бактериальными группами, близкими к реципиентам HGT, следует сделать правильный вывод, что HGT произошел ПОСЛЕ того, как в этой среде установилась линия реципиента.Однако этого не должно быть. HGT может происходить от донорской линии, которая не разделяет экологию с Cyanidiales сегодня, если HGT был достаточно древним, чтобы предок группы-реципиента (Cyanidiales) еще не эволюционировал, чтобы стать экстремофилом. В любом случае, эти выводы действительны независимо от способности идентифицировать конкретную донорскую линию HGT в дереве видов бактерий. Поэтому авторы должны внести некоторые дополнительные нюансы в обсуждение этих результатов и представить данные в таблице 2, чтобы не отражать «потенциальных доноров HGT» в отсутствие поляризации HGT от клады донора к кладе реципиента.Более агностический термин «естественная среда обитания прокариот с близкородственными ортологами» был бы наиболее точным.
5) В отсутствие обнаруживаемых кумулятивных эффектов — которые определенно должны существовать, учитывая, что HGT кажется реальным — динамику прироста и убытка следует изучить более подробно, прежде всего путем создания тепловых карт, аналогичных рисунку 2, но вместо этого показывая ( a) совместное использование предполагаемых OG HGT и (b) идентичность последовательности среди предположительно общих OG HGT. Одна из гипотез, объясняющих, почему обнаруживается мало близких совпадений, заключается в том, что последовательности претерпевают ускоренную эволюцию по прибытии, и поэтому должно быть интересно сравнить скорость эволюции последовательностей между основным геномом и этими элементами.
6) Было бы интересно расширить анализ отдельно на синглтоны, учитывая, что многие из них можно предположительно подтвердить как настоящие на основе всех других критериев, которые используют авторы, и это должно позволить идентифицировать недавно приобретенные гены, некоторые из которых могут проявляют более высокую гомологию с прокариотическими гомологами. Если бы можно было разработать набор высококачественных синглтонов, это позволило бы гораздо больше сказать об общих динамических принципах, связанных с приростом и потерей генов.
7) Файлы выравнивания последовательностей и дерева должны быть включены в рукопись для анализа всех видов и генов, а также быть общедоступными в качестве онлайн-ресурса в дополнение к тем файлам генома и аннотаций, которые уже определены как депонированные.
Следует обратить внимание на следующие моменты
Ускоренная эволюция может быть изучена более подробно, изучая модели гомологии внутри генов, чтобы увидеть, можно ли найти определенные тенденции, например с точки зрения конкретных предубеждений, отражающих адаптацию к эукариотическому контексту.
Дифференциальная транскрипция. Вы демонстрируете статистически значимую дифференциальную экспрессию генов HGT при изменении температуры. Однако тест на дифференциальную экспрессию, который они проводят для всех анализов, сравнивает гены HGT в массе с общей экспрессией полного транскриптома (то есть генов, отличных от HGT).Если мы правильно понимаем этот метод, есть небольшой недостаток, заключающийся в том, что гены HGT, как правило, являются рабочими генами, которые с большей вероятностью будут по-разному экспрессироваться в разных условиях. Однако многие гены в транскриптоме являются генами домашнего хозяйства, которые, как ожидается, не будут столь же чувствительны к дифференциальной экспрессии. Чтобы учесть эту систематическую ошибку, дифференциальную экспрессию генов HGT следует сравнивать с другими генами только по основным функциональным категориям, чтобы показать, что HGT имеет более высокую или более низкую экспрессию, чем ожидалось, относительно ожидаемой дифференциальной экспрессии, наблюдаемой по функциональным категориям генов.Это позволит более четко выделить HGT-зависимый сигнал в данных.
https://doi.org/10.7554/eLife.45017.151Болезнь Вильсона — NORD (Национальная организация по редким заболеваниям)
УЧЕБНИКИ
Brewer GJ. Болезнь Вильсона. В: Справочник НОРД по редким заболеваниям. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2003: 506.
Брюэр Г.Дж. Болезнь Вильсона: Руководство клинициста по распознаванию, диагностике и лечению. Kluwer Academic Publishing; Бостон, 2001 г.
Брюэр Г.Дж. Болезнь Вильсона для пациента и семьи: Руководство пациента по болезни Вильсона и часто задаваемые вопросы о меди. Кслибрис, Филадельфия; 2001.
Щильский М.Л. Болезнь Вильсона. В кн .: Болезни печени. Филадельфия, Пенсильвания: Липпинкотт-Рэйвен; 1999: 1091-1106.
Beers MH, Berkow R., eds. Руководство Merck, 17-е изд. Станция Уайтхаус, Нью-Джерси: Исследовательские лаборатории Мерк; 1999: 56-8.
Кански JJ., Изд. Клиническая офтальмология, 4-е изд. Воберн, Массачусетс: Баттерворт-Хайнеманн; 1999: 142.
Fauci AS, et al., Eds. Принципы внутренней медицины Харрисона, 14-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Inc; 1998: 2166-69.
Adams, RD, et al., Eds. Принципы неврологии. 6-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Companies; 1997: 969-71.
Bennett JC, Plum F., eds. Сесил Учебник медицины. 20-е изд. Филадельфия, Пенсильвания: W.B. Saunders Co; 1996: 1131-2.
Щильский М.Л. Болезнь Вильсона — генетическая основа токсичности меди и естественная история. В кн .: Семинары по болезням печени.Нью-Йорк, штат Нью-Йорк: Thieme Medical Publishers, Inc .: 1996: 83-95.
Behrman RE, изд. Учебник педиатрии Нельсона, 15-е изд. Филадельфия, Пенсильвания: W.B. Компания Сондерс; 1996: 1139-40.
Scriver CR, et al., Eds. Метаболические и молекулярные основы наследственных заболеваний. 7-е изд. Нью-Йорк, штат Нью-Йорк; McGraw-Hill Companies, Inc; 1995: 2217-23.
Menkes JH., Au., Pine JW, et al., Eds. Учебник детской неврологии, 5-е изд. Балтимор, Мэриленд: Уильямс и Уилкинс; 1995: 118-25.
Leevy CM, et al., ред. Заболевания печени и желчевыводящих путей: стандартизация номенклатуры, диагностических критериев и прогноза. Нью-Йорк, Нью-Йорк: Raven Press; 1994: 112-3.
СТАТЬИ В ЖУРНАЛЕ
Abuduxikuer K, Wang JS. Монотерапия цинком у китайских детей с предсимптоматической болезнью Вильсона: единый центр, ретроспективное исследование. PLoS ONE 9 (1): 2014. e86168. https://doi.org/10.1371/journal.pone.0086168
Брюэр, Дж. Дж. Лечение болезни Вильсона: наши пациенты заслуживают лучшего. Мнение эксперта по орфанным препаратам 2014; 2: 12.
Эль-Юссеф М., болезнь Вильсона. Mayo Clin Proc. 2003; 78: 1126-36.
Ferenci P, et al., Диагностика и фенотипическая классификация болезни Вильсона. Liver Int. 2003; 23: 139-42.
Pellecchia MT, et al., Клиническая картина и лечение болезни Вильсона: опыт одного центра. Eur Neurol. 2003; 50: 48-52.
Брюэр Г.Дж. и др., Лечение болезни Вильсона тетратиомолибдатом аммония: III. Первоначальная терапия в общей сложности 55 пациентов с неврологическими нарушениями и последующее лечение цинком.Arch Neurol. 2003; 60: 379-85.
Бэкон Б.Р. и др., Новые знания о генетическом патогенезе гемохроматоза и болезни Вильсона. Adv Intern Med. 1999; 44: 91-116.
Sturniolo GC, et al., Цинковая терапия увеличивает концентрацию металлотионеина и железа в двенадцатиперстной кишке у пациентов с болезнью Вильсона. Am J Gastroenterol. 1999; 94: 334-38.
Шефер М. и др., Гепатоцит-специфическая локализация и медьзависимый транспорт белка болезни Вильсона в печени. 1999; 276: 639-46.
Брюэр Г.Дж. и др., Лечение болезни Вильсона цинком: XV. Долгосрочные контрольные исследования. J Lab Clin Med. 1998; 132: 264-78.
Брюэр Дж. Дж. И др., Лечение болезни Вильсона тетратиомолибдатом аммония. Arch Neurol. 1996; 53: 1017-25.
Демиркиран М. и др., Неврологическая картина болезни Вильсона без колец Кайзера-Флейшера. Неврология. 1996; 46: 1040-3.
Scheinberg IH, et al., Лечение неврологических проявлений болезни Вильсона. Arch Neurol.1995; 52: 339-40.
Шильский М.Л. и др., Трансплантация печени при болезни Вильсона: показания и исход. Гепатология. 1994; 19: 583-7.
Yarse JC и др., Болезнь Вильсона: текущее состояние. Am J Med. 1992; 92: 643-54.
Брюэр Г.Дж. и др., Начальная терапия пациентов с болезнью Вильсона тетратиомолибдатом. Arch Neurol. 1991; 48: 42-7.
Танканов Р.М., Патофизиология и лечение болезни Вильсона. Clin Pharm. 1991; 10: 839-49.
Шильский М.Л., и др., Прогноз хронического активного гепатита Вильсона. Гастроэнтерология. 1991; 100: 762-7.
Woods SE, болезнь Вильсона. Семейный врач. 1989; 40: 171-8.
ИНТЕРНЕТ
Интернет Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Болезнь Вильсона. Запись №: 277900. Последнее изменение 09.07.2016. Доступно по адресу: http://omim.org/entry/277900. По состоянию на 7 марта 2018 г.
Типы, причины, симптомы и методы лечения
Унаследованные метаболические нарушения — это генетические состояния, которые приводят к проблемам метаболизма.У большинства людей с наследственными метаболическими нарушениями дефектный ген приводит к дефициту ферментов. Существуют сотни различных генетических нарушений обмена веществ, симптомы, методы лечения и прогнозы которых сильно различаются.
Что такое метаболизм?
Метаболизм — это все химические реакции, происходящие в организме для преобразования или использования энергии. Вот несколько основных примеров метаболизма:
- Расщепление углеводов, белков и жиров в пище для высвобождения энергии.
- Преобразование избыточного азота в продукты жизнедеятельности, выделяемые с мочой.
- Разрушение или преобразование химических веществ в другие вещества и транспортировка их внутрь клеток.
Метаболизм — это организованная, но хаотическая линия сборки химических веществ. Сырье, полуфабрикаты и отходы постоянно используются, производятся, транспортируются и выбрасываются. «Рабочие» на конвейере — это ферменты и другие белки, которые вызывают химические реакции.
Причины наследственных нарушений обмена веществ
При большинстве наследственных метаболических нарушений один фермент либо вообще не вырабатывается организмом, либо вырабатывается в неработающей форме.Недостающий фермент подобен отсутствующему работнику на конвейере. В зависимости от функции этого фермента его отсутствие означает, что могут накапливаться токсичные химические вещества или может не производиться необходимый продукт.
Продолжение
Код или план производства фермента обычно содержится в паре генов. Большинство людей с наследственными нарушениями обмена веществ наследуют две дефектные копии гена — по одной от каждого родителя. Оба родителя являются «носителями» плохого гена, что означает, что они несут одну дефектную копию и одну нормальную копию.
У родителей нормальная копия гена компенсирует плохую копию. Уровень их ферментов обычно адекватен, поэтому у них может не быть симптомов генетического нарушения обмена веществ. Однако ребенок, унаследовавший две дефектные копии гена, не может производить достаточно эффективных ферментов, и у него развивается генетическое нарушение обмена веществ. Эта форма генетической передачи называется аутосомно-рецессивным наследованием.
Первопричиной большинства генетических нарушений обмена веществ является мутация гена, произошедшая много-много поколений назад.Мутация гена передается из поколения в поколение, обеспечивая ее сохранение.
Каждое наследственное нарушение обмена веществ довольно редко встречается в общей популяции. В совокупности наследственные нарушения обмена веществ могут поражать примерно 1 из 1000–2 500 новорожденных. У некоторых этнических групп населения, таких как евреи-ашкенази (евреи центрально-восточноевропейского происхождения), частота наследственных нарушений обмена веществ выше.
Типы наследственных нарушений обмена веществ
Выявлены сотни наследственных нарушений обмена веществ, и продолжают обнаруживаться новые.Некоторые из наиболее распространенных и важных генетических нарушений метаболизма включают:
Лизосомные нарушения накопления : Лизосомы — это пространства внутри клеток, которые расщепляют отходы метаболизма. Дефицит различных ферментов внутри лизосом может привести к накоплению токсичных веществ, вызывая нарушения обмена веществ, в том числе:
- Синдром Гурлера (аномальная структура костей и задержка развития)
- Болезнь Ниманна-Пика (у детей развивается увеличение печени, затруднения при кормлении и повреждение нервов)
- Болезнь Тея-Сакса (прогрессирующая слабость у месячного ребенка, прогрессирующая до тяжелого повреждения нервов; ребенок обычно доживает до 4 или 5 лет)
- Болезнь Гоше (боль в костях, увеличение печени и низкое количество тромбоцитов, часто легкая форма, у детей или взрослых)
- Болезнь Фабри (боль в конечностях в детстве, при заболеваниях почек и сердца и инсультах во взрослом возрасте; поражаются только мужчины)
- Болезнь Краббе (прогрессирующее поражение нервов, задержка развития у маленьких детей; иногда взрослые)
Галактоземия: Нарушение расщепления сахарной галактозы приводит к желтухе, рвоте и поражению печени увеличение новорожденного после грудного или искусственного вскармливания.
Продолжение
Болезнь мочи кленовым сиропом: Дефицит фермента BCKD вызывает накопление аминокислот в организме. В результате повреждаются нервы, и моча пахнет сиропом.
Фенилкетонурия (PKU): Дефицит фермента PAH приводит к высокому уровню фенилаланина в крови. Если заболевание не распознается, наступает умственная отсталость.
Болезни накопления гликогена: Проблемы с накоплением сахара приводят к низкому уровню сахара в крови, мышечным болям и слабости.
Митохондриальные нарушения: Проблемы внутри митохондрий, электростанции клеток, приводят к повреждению мышц.
Атаксия Фридрейха: Проблемы, связанные с белком под названием фратаксин, вызывают повреждение нервов и часто проблемы с сердцем. Неспособность ходить обычно наступает в молодом возрасте.
Пероксисомные расстройства: Подобно лизосомам, пероксисомы представляют собой крошечные пространства, заполненные ферментами внутри клеток. Плохая функция ферментов внутри пероксисом может привести к накоплению токсичных продуктов метаболизма.К пероксисомальным расстройствам относятся:
- Синдром Зеллвегера (аномальные черты лица, увеличенная печень и повреждение нервов у младенцев)
- Адренолейкодистрофия (симптомы повреждения нервов могут развиться в детстве или в раннем взрослом возрасте в зависимости от формы.)
Продолжение
Нарушения метаболизма металлов: Уровень микроэлементов в крови контролируется специальными белками. Унаследованные метаболические нарушения могут привести к нарушению функции белков и токсическому накоплению металлов в организме:
Органические ацидемии: метилмалоновая ацидемия и пропионовая ацидемия.
Нарушения цикла мочевины: Дефицит орнитин-транскарбамилазы и цитруллинемия
Симптомы наследственных нарушений обмена веществ
Симптомы генетических нарушений обмена веществ широко варьируются в зависимости от имеющихся проблем метаболизма. Некоторые симптомы наследственных нарушений обмена веществ включают:
Симптомы могут возникать внезапно или медленно прогрессировать. Симптомы могут быть вызваны продуктами питания, лекарствами, обезвоживанием, незначительными заболеваниями или другими факторами. Симптомы появляются в течение нескольких недель после рождения при многих заболеваниях.Симптомы других наследственных метаболических нарушений могут развиться через годы.
Диагностика наследственных нарушений обмена веществ
Наследственные нарушения обмена веществ присутствуют при рождении, а некоторые выявляются при плановом обследовании. Все 50 штатов проводят скрининг новорожденных на фенилкетонурию (ФКУ). Большинство штатов также проверяют новорожденных на галактоземию. Однако никаких государственных тестов на выявление всех известных наследственных нарушений обмена веществ у младенцев не проводилось.
Усовершенствованная технология тестирования побуждает многие штаты расширять скрининг новорожденных на генетические нарушения обмена веществ.Национальный центр скрининга новорожденных и генетических ресурсов предоставляет информацию о методах скрининга в каждом штате.
Если наследственное нарушение обмена веществ не обнаруживается при рождении, его часто не диагностируют до появления симптомов. При появлении симптомов доступны специальные анализы крови или ДНК для диагностики большинства генетических нарушений обмена веществ. Направление в специализированный центр (обычно при университете) увеличивает шансы на постановку правильного диагноза.
Лечение наследственных нарушений обмена веществ
Доступны ограниченные методы лечения наследственных нарушений обмена веществ.Существенный генетический дефект, вызывающий это состояние, не может быть исправлен с помощью современных технологий. Вместо этого лечение пытается обойти проблему с метаболизмом.
Лечение генетических нарушений метаболизма основывается на нескольких общих принципах:
- Уменьшите или исключите потребление любых продуктов питания или лекарств, которые не могут метаболизироваться должным образом.
- Замените фермент или другое химическое вещество, которое отсутствует или неактивно, чтобы восстановить метаболизм до максимально близкого к норме.
- Удаляет токсичные продукты метаболизма, которые накапливаются из-за нарушения обмена веществ.
Лечение может включать такие меры, как:
- Специальные диеты, исключающие определенные питательные вещества
- Прием заменителей ферментов или других добавок, поддерживающих метаболизм
- Обработка крови химическими веществами для детоксикации опасных побочных продуктов метаболизма
Продолжение
По возможности человек с наследственным нарушением обмена веществ должен получать помощь в медицинском центре, имеющем опыт лечения этих редких состояний.
Дети и взрослые с наследственными нарушениями обмена веществ могут серьезно заболеть, требуя госпитализации, а иногда и жизнеобеспечения.Лечение во время этих эпизодов направлено на оказание неотложной помощи и улучшение функции органов.