Урок 25. Соли – HIMI4KA
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.


Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).


Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.


Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
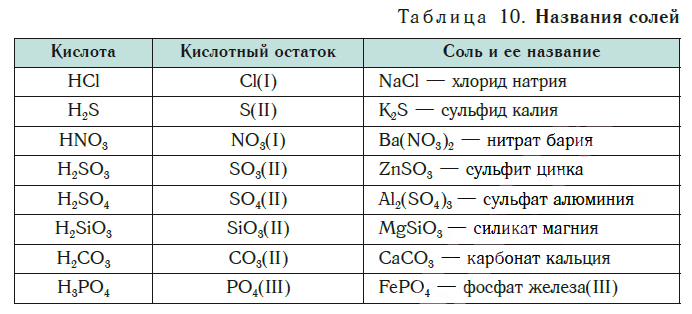

В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
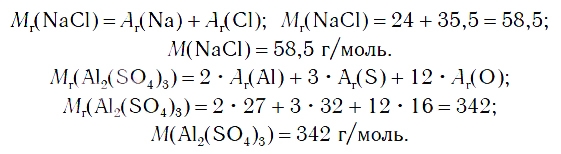
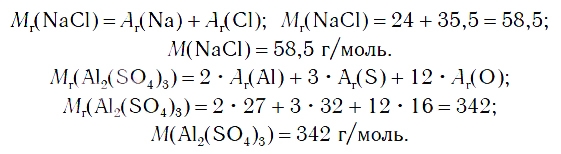
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
что такое кислоты ,соли,оксиды,основание? химия.
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония Nh5+ ; известны соли фосфония Ph5+ или гидроксония h4O+) и анионов кислотного остатка. Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония Nh5+ ; известны соли фосфония Ph5+ или гидроксония h4O+) и анионов кислотного остатка. Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Спасибо большое
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония Nh5+ ; известны соли фосфония Ph5+ или гидроксония h4O+) и анионов кислотного остатка. Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония Nh5+ ; известны соли фосфония Ph5+ или гидроксония h4O+) и анионов кислотного остатка. Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
touch.otvet.mail.ru
Физические свойства солей — урок. Химия, 8–9 класс.
При нормальных условиях соли — твёрдые кристаллические вещества. У солей типичных металлов — ионная кристаллическая решётка, поэтому они имеют сравнительно высокую температуру плавления и нелетучи.
Окраска солей чрезвычайно разнообразна. Отдельные кристаллы некоторых солей бесцветны, однако в массе множество таких мелких кристалликов приобретает белый цвет. Прозрачны и бесцветны отдельные кристаллы галогенидов щелочных металлов, например, хлорида натрия.
Многие соли имеют характерную окраску.
Цвет соли | Примеры |
| Чёрный | Сульфид свинца(\(II\)), железа(\(II\)), серебра |
| Кроваво-красный | Роданид железа(\(III\)) |
| Красный | Гексацианоферрат(\(III\)) калия, сульфид ртути(\(II\)) (киноварь) |
| Розовый | Кристаллогидраты солей марганца(\(II\)), разбавленный раствор перманганата калия |
| Оранжевый | Дихроматы |
| Бурый | Соли железа(\(III\)), концентрированные растворы этих солей |
Светло- коричневый | Сульфид марганца(\(II\)) |
| Жёлтый | Иодид свинца(\(II\)), фосфат серебра, хроматы, гексацианоферрат(\(II\)) калия, разбавленные растворы солей железа(\(III\)) |
| Бледно-жёлтый | Бромид и иодид серебра |
| Зелёный | Соли никеля(\(II\)) |
| Тёмно-зелёный | Манганат калия |
| Светло-зелёный | Гептагидрат сульфата железа(\(II\)) |
| Тёмно-синий | Гексацианоферрат(\(II\)) железа(\(III\)), гексацианоферрат(\(III\)) железа(\(II\)) |
| Синий | Пентагидрат сульфата меди(\(II\)), растворы солей меди(\(II\)) |
| Фиолетовый | Перманганат калия |
| Белый | Сульфаты, карбонаты и фосфаты щелочноземельных металлов, карбонат и фосфат магния; хлорид, сульфат, карбонат серебра; сульфид цинка; кристаллический сульфат меди(\(II\)) |
Что касается растворимости солей в воде, здесь описание ситуации несколько затруднено тем обстоятельством, что не имеется чётко установленной границы между малорастворимыми и практически нерастворимыми веществами. Поэтому данные в различных таблицах растворимости могут несколько (не очень существенно) отличаться.
Приведём обобщённые сведения о растворимости солей, которыми можно пользоваться, чтобы делать выводы о возможности протекания тех или иных химических реакций.
Соли | Растворимость |
| Нитраты, ацетаты | Практически все хорошо растворимы |
Соли щелочных металлов (натрия, калия) и аммония | Практически все хорошо растворимы |
Хлориды (это же относится к бромидам и иодидам) | Большей частью хорошо растворимы. Практически нерастворимы \(AgCl\) и \(PbCl_2\). Растворимость галогенидов свинца(\(II\)) с повышением температуры резко возрастает |
| Сульфаты | Большей частью хорошо растворимы. Малорастворимы \(Ag_2SO_4\) и \(CaSO_4\). Практически нерастворимы \(PbSO_4\), \(SrSO_4\), \(BaSO_4\) |
| Фосфаты, карбонаты, сульфиты, силикаты | Практически все нерастворимы, за исключением солей щелочных металлов (натрия, калия) и аммония |
| Сульфиды | Практически все нерастворимы, за исключением солей щелочных, щелочноземельных металлов и аммония |
| Кислые соли | Растворимы намного лучше, чем средние |
Растворы солей хорошо проводят электрический ток.
www.yaklass.ru
| 1. |
Химические формулы солей
Сложность: лёгкое |
1 |
| 2. |
Номенклатура средних солей
Сложность: среднее |
2 |
| 3. |
Составление названий средних солей
Сложность: среднее |
3 |
| 4. |
Классификация солей
Сложность: лёгкое |
1 |
| 5. |
Составление химических формул средних солей
Сложность: сложное |
4 |
| 6. |
Составление названий кислых, основных и комплексных солей
Сложность: среднее |
2 |
| 7. |
Составление названия кристаллогидрата соли
Сложность: сложное |
1 |
| 8. |
Составление химических формул кислых, основных и комплексных солей
Сложность: среднее |
3 |
| 9. |
Распознавание соли по её внешнему виду
Сложность: среднее |
3 |
| 10. |
Растворимость солей
Сложность: лёгкое |
1 |
| 11. |
Составление уравнений реакций по химическим свойствам солей
Сложность: среднее |
4 |
| 12. |
Уравнения реакций по химическим свойствам солей
Сложность: среднее |
4 |
| 13. |
С чем может реагировать соль?
Сложность: среднее |
4 |
| 14. |
Применение солей
Сложность: лёгкое |
1 |
| 15. |
Способы получения средних солей
Сложность: среднее |
2 |
| 16. |
Образование солей в реакциях обмена
Сложность: среднее |
5 |
| 17. |
Способы получения кислых, основных и комплексных солей
Сложность: сложное |
5 |
| 18. |
Расчёт по уравнению реакции, если исходное вещество содержит примеси
Сложность: среднее |
5 |
| 19. |
Расчёт формулы кристаллогидрата и составление его названия
Сложность: сложное |
5 |
| 20. |
Соли в природе. Названия минералов и горных пород
Сложность: среднее |
2 |
| 21. |
Названия солей, встречающихся в природе
Сложность: среднее |
2 |
| 22. |
Распространение солей в природе
Сложность: лёгкое |
3 |
www.yaklass.ru