Гомология в химии — это… Что такое Гомология в химии?
Гомология органических соединений, или закон гомологов, состоит в том, что вещества одной химической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишь на nCH2, оказываются сводными и во всем своем остальном хим. характере, а различие их физических свойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе, определяемой числом n групп СН2. Такие хим. сходственные соединения образуют так наз. гомологический ряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от состава первого члена ряда и числа атомов углерода; напр. ряд предельных углеводородов выражается формулою СnH2n+2, ряд олефинов СnH2n, ряд ацетилена СnH2n-2, ряд бензола СnH2n-1, ряд предельных одноатомных спиртов СnH2n+2O, аминов СnH2n+3N, нитрилов Cn
 п. Для примера приведем несколько членов ряда предельных углеводородов: метан СН4, этан C2H6, пропан С3Н8, бутан С4Н10, пентан С5H12, гексан C6H14 и т. д. Сходство между членами (гомологами) каждого ряда таково, что, зная свойства и превращения одного, можно наперед знать свойства и превращения и всех прочих членов этого ряда. С другой стороны, если имеем гомологический ряд, в котором недостает некоторых промежуточных членов, то на основании правильности изменения физических свойств при последовательном переходе от низших членов ряда к высшим является возможность с точностью предсказать все свойства этих недостающих и еще неизвестных членов. Отсюда — важность закона гомологов, ибо он не только обобщает состав соединений, позволяя изображать ряды их общими формулами, но и их свойства и приводит их в закономерную зависимость от состава. Все члены гомологических рядов производятся от простейшего по составу через последовательное замещение водорода в нем группою СН 3 (метил) и не только численно, но и фактически, на опыте, могут быть получены из него таким путем, чем устанавливается генетическая связь между всеми членами одного Г.
п. Для примера приведем несколько членов ряда предельных углеводородов: метан СН4, этан C2H6, пропан С3Н8, бутан С4Н10, пентан С5H12, гексан C6H14 и т. д. Сходство между членами (гомологами) каждого ряда таково, что, зная свойства и превращения одного, можно наперед знать свойства и превращения и всех прочих членов этого ряда. С другой стороны, если имеем гомологический ряд, в котором недостает некоторых промежуточных членов, то на основании правильности изменения физических свойств при последовательном переходе от низших членов ряда к высшим является возможность с точностью предсказать все свойства этих недостающих и еще неизвестных членов. Отсюда — важность закона гомологов, ибо он не только обобщает состав соединений, позволяя изображать ряды их общими формулами, но и их свойства и приводит их в закономерную зависимость от состава. Все члены гомологических рядов производятся от простейшего по составу через последовательное замещение водорода в нем группою СН 3 (метил) и не только численно, но и фактически, на опыте, могут быть получены из него таким путем, чем устанавливается генетическая связь между всеми членами одного Г. ряда. Физические свойства в рядах гомологов изменяются таким образом, что большею частью удельные веса и объемы, температуры кипения и плавления, теплоты горения и образования, эквиваленты лучепреломления и пр. возрастают постепенно от члена к члену, по мере увеличения числа атомов углерода; иногда происходит и обратное, примеры чему представляются в уменьшении удельных весов бензольных углеводородов, предельных одноосновных кислот и др. с увеличением числа атомов С; иногда, наконец, свойство изменяется так, что для первых членов ряда величина его падает, а затем вновь возрастает, как это наблюдается для удельного веса предельных одноатомных спиртов или для температуры плавления нормальных предельных одноосновных кислот, где влияние состава представляется еще более сложным. Часто первый член ряда представляет отступление от общей правильности. Так, гомологическая разность температуры кипения предельных спиртов вообще близка к 19°, очень медленно уменьшаясь с увеличением С, а разность между температурой кипения СН
ряда. Физические свойства в рядах гомологов изменяются таким образом, что большею частью удельные веса и объемы, температуры кипения и плавления, теплоты горения и образования, эквиваленты лучепреломления и пр. возрастают постепенно от члена к члену, по мере увеличения числа атомов углерода; иногда происходит и обратное, примеры чему представляются в уменьшении удельных весов бензольных углеводородов, предельных одноосновных кислот и др. с увеличением числа атомов С; иногда, наконец, свойство изменяется так, что для первых членов ряда величина его падает, а затем вновь возрастает, как это наблюдается для удельного веса предельных одноатомных спиртов или для температуры плавления нормальных предельных одноосновных кислот, где влияние состава представляется еще более сложным. Часто первый член ряда представляет отступление от общей правильности. Так, гомологическая разность температуры кипения предельных спиртов вообще близка к 19°, очень медленно уменьшаясь с увеличением С, а разность между температурой кипения СН Так как по мере усложнения частиц вследствие введения метильных групп на место водорода гомологическая разность состава СН 2, оставаясь постоянною, все менее и менее отражается на процентном составе, то и величина изменения физических свойств между двумя соседними членами (гомологическая разность их свойств) становится все меньшею и меньшею при переходе от низших гомологов к высшим; оттого при графическом изображении изменения физических свойств в зависимости от состава с помощью прямоугольной системы координат, нанося состав по оси абсцисс, а свойства по оси ординат, получаются большею частью кривые, стремящиеся стать параллельными оси абсцисс. Г. органических соединений была выяснена в 50 годах Жераром (см.). Им были впервые установлены гомологические ряды, которые и легли в основу его системы классификации органических соединений. Впоследствии Г. усложнилась вследствие открытия многочисленных случаев изомерии. Гомологические ряды Жерара расчленились в гомологические порядки.
Так как по мере усложнения частиц вследствие введения метильных групп на место водорода гомологическая разность состава СН 2, оставаясь постоянною, все менее и менее отражается на процентном составе, то и величина изменения физических свойств между двумя соседними членами (гомологическая разность их свойств) становится все меньшею и меньшею при переходе от низших гомологов к высшим; оттого при графическом изображении изменения физических свойств в зависимости от состава с помощью прямоугольной системы координат, нанося состав по оси абсцисс, а свойства по оси ординат, получаются большею частью кривые, стремящиеся стать параллельными оси абсцисс. Г. органических соединений была выяснена в 50 годах Жераром (см.). Им были впервые установлены гомологические ряды, которые и легли в основу его системы классификации органических соединений. Впоследствии Г. усложнилась вследствие открытия многочисленных случаев изомерии. Гомологические ряды Жерара расчленились в гомологические порядки.
П. П. Рубцов. Δ.
Гомологи. Гомологический ряд
Гомологи – это вещества близкие по строению и свойствам, которые отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для
каждого класса органических соединений можно составить их гомологический ряд.
Например, алканы имеют общую формулу CnH2n+2, где n – число атомов углерода, причём каждый член гомологического ряда будет отличаться от предыдущего на группу – СН2. Такая последовательность соединений называется гомологическим рядом (от греческого homolog – «сходный»), отдельные члены этого ряда называются гомологами, а группа атомов, на которую отличаются соседние гомологи (группа – СН2) – гомологической разностью.
Гомологический ряд легко построить, для этого нужно к каждому последующему
представителю добавить один атом углерода и 2 атома водорода, то есть группу –
СН2. Так, первым представителем алканов
является метан – СН Третий член гомологического – С3Н8, у него 3 атома углерода и он отличается
от предыдущего на группу – СН2 (Н – СН2 – СН2
– СН2 – Н). Четвёртый представитель гомологического ряда алканов также отличается от предыдущего на группу – СН2,
у него уже четыре атома углерода (Н – СН2 – СН2 – СН2
– СН2 – Н).
Третий член гомологического – С3Н8, у него 3 атома углерода и он отличается
от предыдущего на группу – СН2 (Н – СН2 – СН2
– СН2 – Н). Четвёртый представитель гомологического ряда алканов также отличается от предыдущего на группу – СН2,
у него уже четыре атома углерода (Н – СН2 – СН2 – СН2
– СН2 – Н).
Понятно, что гомологи отличаются молярной массой, а значит физическими свойствами. Как правило, с увеличение числа атомов углерода в молекуле увеличиваются температуры кипения и плавления, увеличивается плотность.
Для алкенов
характерна общая формула СnH2n. Первый член гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов – пропен – С3Н6, третий – бутен-1,четвёртый – пентен-1. И так далее, то есть в
данном гомологическом ряду также каждый последующий член гомологического ряда
отличается от предыдущего на группу – СН2.
И так далее, то есть в
данном гомологическом ряду также каждый последующий член гомологического ряда
отличается от предыдущего на группу – СН2.Для алкинов также можно составить
гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым
представителем этого ряда будет этин, али ацетилен –
С2Н2, вторым членом ряда является пропин
– С3Н4, третим – бутин-1 – С4Н6,
четвёртым – пентин-1 – С
Общая формула спиртов – СnH2n+1OH. Первым членом
гомологического ряда спиртов является метанол – СН3ОН, или метиловый
спирт, затем С2Н5ОН – этанол, или этиловый спирт, третьим
представителем ряда спиртов является пропанол-1, или пропиловый
спирт – С3Н7ОН, четвёртым – бутанол-1, или бутиловый
спирт – С4Н9ОН, пятым – пентанол-1, или амиловый спирт –
С5Н11ОН. Таким образом, в этом гомологическом ряду каждый
последующий представитель отличается от предыдущего на группу -СН2.
Таким образом, в этом гомологическом ряду каждый
последующий представитель отличается от предыдущего на группу -СН2.
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов СnH2
n+1CHO, то первым представителем данного гомологического ряда будет метаналь, или муравьиный альдегид – НСОН, вторым членом ряда – этаналь, или уксусный альдегид – СН3СНО, третьим – пропаналь, или пропионовый альдегид – СН3СН2СНО, четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО и так далее.Аналогично и для карбоновых кислот. Так, общая формула насыщенных
одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым
представителем данного гомологического ряда является метановая кислота, или
муравьиная – НСООН, вторым – этановая кислота, или
уксусная – СН3СООН, третьим – пропановая,
или пропионовая кислота – СН3СН2СООН,
четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН,
пятым – пентановая, или валериановая кислота – СН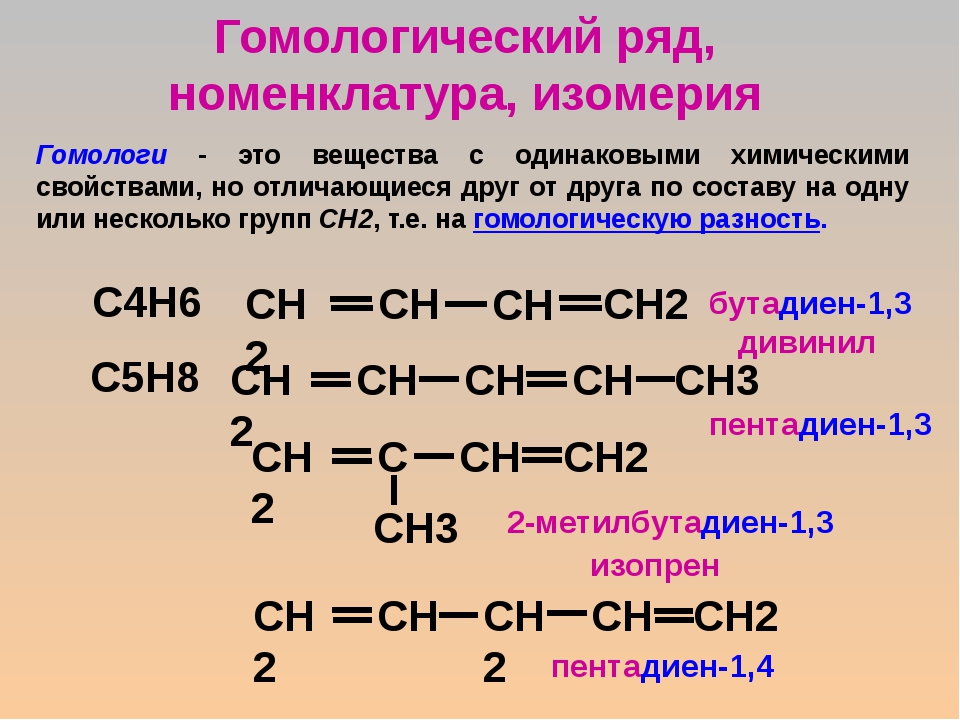
Таким образом, для каждого класса органических соединений можно составить гомологический ряд, учитывая общую формулу данного класса. Каждый последующий член гомологического ряда отличается от предыдущего на группу – СН2, которую называют гомологической разность. А сами вещества этого ряда называются гомологами. Как правило, с увеличением числа атомов углерода в гомологическом ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
Гомологи гомология — Справочник химика 21
Соединения, сходные по химическим свойствам, состав которых отличается друг от друга иа группу СН , называются гомологами. Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. Группа СНг называется гомологической разностью. [c.276] Соединения, имеющие одинаковые функциональные группы, но отличающиеся числом атомов углерода, обладают весьма похожими физическими и химическими свойствами. Такие соединения называют гомологами. Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СНз. Совокупность всех гомологов образует гомологический ряд. [c.268]
Такие соединения называют гомологами. Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СНз. Совокупность всех гомологов образует гомологический ряд. [c.268]
Ряд соединений, обладающих сходным химическим строением, сходными свойствами и отличающихся друг от друга на одну или несколько групп СНа, называется гомологическим рядом, члены этого ряда носят название гомологов (гомология — подобие), разница в составе двух соседних членов ряда — группа СНг — называется гомологической разностью состава. [c.34]
К н альдегиды Н и альдегиды гомологи гомологи [c.105]
Р Я кетоны R кетоны гомологи гомологи [c.105]
Между сходственными соединениями самый замечательный отдел составляют гомологи, — это ряд соединений, имеюш,их обыкновенно огромный ряд одинаковых реакций, продукты которых суть также гомологи гомологи, кроме сходства реакций, имеют еш,е тот признак, что по составу отличаются на С Н . Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит и приводить их. Ряд гомологов можно всегда обозначить обш,ею формулою. Например, ряд гомологов бензойной кислоты С Н >0 можно обозначить обш,ей формулой С Н » 80 . [c.43]
Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит и приводить их. Ряд гомологов можно всегда обозначить обш,ею формулою. Например, ряд гомологов бензойной кислоты С Н >0 можно обозначить обш,ей формулой С Н » 80 . [c.43]
Между сходственными соединениями самый замечательный отдел составляют гомологи, — это ряд соединений, имеющих, обыкновенно, огромный ряд одинаковых реакций, продукты которых суть также гомологи гомологи кроме сходства реакций имеют еще тот признак, что по составу отличаются на С»Н . Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит [c.112]
Исходя из этих соображений, Менделеев следующим образом сформулировал определение гомологии Гомологи имеют одинаковое химическое отправление, дают одинаковые типические реакции, и продукты этих реакций суть тоже гомологи. При этом сходстве в свойствах гомологи имеют различие в составе на СН или на пС Р. .. [c.19]
.. [c.19]
Чарлет, Ланио и Джонс нашли среди конденсированных ароматических углеводородов, кроме нафталина и его гомологов, гомологи фенантрена, хризена, бензфенантрена, бензантрацена и пирена. Все эти углеводороды относятся к классу конденсированных через 2 общих углеродных атома, и хотя в нефти были найдены дифенил и 3-метилдифенил, связанные через 1 углеродный атом в каждом кольце, однако углеводороды этого типа не играют в нефти большой роли. [c.122]
Соединения, образующие го.мологпческий ряд, называются гомологами. Гомологи обладают сходным строением, общими химическими свойствами. Их физические свойства закономерно меняются с увеличением молекулярного веса (стр. 43). [c.34]
Понятие гомологии является очень широким и включает в себя строгую гомологию, гомологию с заменами, гомологию с делениями и вставками и т.п.. Кроме того, различают глобальную и локальную постановки задач поиска гомологии. Для решения задач поиска строгой гомологии наиболее эффективными являются методы, связанные с 1-граммным разложением и с построением позиционных деревьев решение задач выравнивания обеспечи- [c. 34]
34]
Гомологи и гомологические ряды. Гомологические ряды
Спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность . Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула С n H 2n+2): метан CH 4 , этан C 2 H 6 , пропан С 3 H 8 и т. д.; гомологической разностью этого ряда является метиленовое звено -СН 2 -.
Энциклопедичный YouTube
1 / 3
1.1. Алканы: Строение, номенклатура, изомерия. Подготовка к ЕГЭ по химии
Химия. Органическая химия: Гомологический ряд алкенов. Центр онлайн-обучения «Фоксфорд»
№ 9. Органическая химия. Тема 6. Алканы. Часть 1. Гомологический ряд алканов
Субтитры
Гомология и структура соединений
В основе понятия гомологии в органической химии лежит фундаментальное положение о том, что химические и физические свойства вещества определяются структурой его молекул: эти свойства определяются как функциональными группами соединения (гидроксил спиртов , карбоксильная группа карбоновых кислот , арильная группа ароматических соединений и т. п.), так и его углеродным скелетом.
п.), так и его углеродным скелетом.
Сам комплекс химических свойств и, соответственно, принадлежность соединения к определённому классу, определяется именно функциональными группами (так, наличие карбоксильной группы определяет проявление соединением кислотных свойств и его принадлежность к классу карбоновых кислот), но на степень проявления химических свойств (например, реакционная способность и константа диссоциации) или физические свойства (температуры кипения и плавления , показатель преломления и т. п.) влияет и углеродный скелет молекулы (см. Рис. 1).
В случае подобия углеродных скелетов соединений, то есть отсутствия изомерии , формулу гомологичных соединений можно записать как X-(СН 2) n -Y , соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений (например, H-(СН 2) n -COOH — алифатические карбоновые кислоты). Таким образом, соединения-гомологи принадлежат к одному классу соединений, и свойства ближайших гомологов наиболее близки.
В гомологических рядах наблюдается закономерное изменение свойств от младших членов ряда к старшим, однако такая закономерность может нарушаться, в первую очередь, в начале ряда, из-за образования водородных связей при наличии функциональных групп, способных к их образованию (см. Рис. 2, температуры плавления).
АЛКАНЫ
Предельными углеводородами (алканами ) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только σ-связями, и не содержащие циклов. В алканах атомы углерода находятся в степени гибридизации sp 3 .
Простейшим
соединением этого класса является метан
— углеводород, содержащий один атом
углерода и четыре атома водорода.
Рассматривая формулу этана — предельного
углеводорода с двумя атомами углерода,
мы видим, что с формальных позиций он
как бы образован из метана: разорвана
одна из эквивалентных связей С-Н и
вместо разрыва вставлена группа -СН 2 -.
Точно так же из этана может быть образован
предельный углеводород с тремя
атомами углерода — пропан и т. д.:
д.:
Такой ряд сходных по строению соединений, обладающих близкими химическими свойствами, в котором отдельные члены ряда отличаются друг от друга лишь числом групп -СН 2 -, называется гомологическим рядом . В данном случае речь идет о гомологическом ряде алканов.
У членов любого гомологического ряда (например, ряда спиртов, альдегидов или кислот) подавляющее большинство реакций протекает одинаково (исключение составляют иногда только первые члены рядов). Следовательно, зная химические реакции лишь одного члена гомологического ряда, можно с большой степенью вероятности утверждать, что такого же типа превращения протекают и с остальными членами данного ряда.
Это
еще раз подчеркивает, что свойства
органического соединения определяются
в основном функциональной группой, что
дает возможность систематизировать
реакции по гомологическим рядам,
или, как часто говорят, по классам
органических соединений. Функциональной
группой обычно считают наиболее легко
изменяющуюся в реакциях часть молекулы
органического соединения, как правило,
содержащую атомы и группы, отличные от
С и Н, или кратные связи.
Для любого гомологического ряда может быть выведена общая формула, отражающая соотношение между атомами углерода и водорода у членов этого ряда; такая формула называется общей формулой гомологического ряда . Рассмотрев структурную формулу любого члена гомологического ряда предельных углеводородов с неразветвленной углеродной цепью, мы видим, что его молекула состоит из п групп -СН 2 — и еще двух атомов водорода у концевых групп. Таким образом, на п атомов углерода в ней приходится (2п + 2) атомов водорода, следовательно, и общая формула гомологического ряда имеет вид С n Н 2 n +2 .
В таблице 19 приведены члены гомологического ряда предельных углеводородов и их физические константы.
2. Изомерия
Если
два или больше индивидуальных веществ
имеют одинаковый количественный
состав, т. е. одинаковую молекулярную
формулу, но отличаются друг от друга
какими-то химическими или физическими
свойствами, то в общем случае они
называются изомерами .
Одним из типов изомерии является структурная изомерия , когда изомеры отличаются друг от друга порядком связей между отдельными атомами в молекуле.
В метане, этане и пропане существует только один-единственный порядок связей между атомами. Но уже четыре атома углерода могут быть соединены двумя различными способами:
В обоих случаях углеводороды имеют одну и ту же молекулярную формулу С 4 Н 10 . Однако в первом случае все четыре атома углерода образуют неразветвленную, или нормальную, цепь, а во втором — разветвленную на конце, или цепь изостроения. Это разные вещества: бутан и изобутан, которые имеют различные физические константы (см. табл. 19).
Для углеводорода С 5 Н 12 существуют уже три изомера
С увеличением числа углеродных атомов в молекуле углеводорода число
изомеров
быстро растет: для С 6
оно равно 5; для С 7
— 9; для С 8
— 18; для С 20
— 366 319; для С 40
— 62 491 178 805 831 изомер. Иногда такого типа
изомерию называют изомерией
углеродного скелета.
Рассмотрим разветвленный углеводород такого строения:
В этом углеводороде имеются атомы углерода четырех различных типов. Атомы, обозначенные значком С а, соединены с одним углеродным атомом, они называются первичными, соответственно называются первичными и три атома водорода у первичного углеродного атома. Атом углерода, обозначенный значком С б, соединен с двумя атомами углерода, он называется вторичным, а два атома водорода у него называются вторичными атомами водорода. Атом С в называется третичным, как и единственный атом водорода при нем; а атом углерода С г — четвертичным.
Алканы — класс углеводородов с общей формулой C n H 2n+2 . Родственные соединения, отличающиеся на одну метиленовую группу -CH 2 -, образуют гомологический ряд алканов. Самым простым веществом ряда является метан с одним атомом углерода (CH 4).
Гомологи
Родственные соединения — гомологи — схожи химическими, но различны физическими свойствам. В зависимости от количества атомов углерода выделяют газообразные, жидкие, твёрдые алканы. Первые четыре представителя — газы, гомологи с 5-15 атомами углерода — горючие жидкости. Высшими алканами называют воски и твёрдые вещества с 16-390 атомами углерода.
В зависимости от количества атомов углерода выделяют газообразные, жидкие, твёрдые алканы. Первые четыре представителя — газы, гомологи с 5-15 атомами углерода — горючие жидкости. Высшими алканами называют воски и твёрдые вещества с 16-390 атомами углерода.
Рис. 1. Горение метана.
Названия алканов отличаются суффиксом -ан после греческого обозначения числительного:
- ун- или ген- — один;
- до- — два;
- три- — три;
- тетра- — четыре;
- пент- — пять;
- гекс- — шесть;
- гепт- — семь;
- окт- — восемь;
- нон- — девять;
- дек- — десять.
Названия первых четырёх гомологов закрепились исторически. Каждое десятое название «переходит» к следующим девяти веществам, сохраняя числительные приставки и классовый суффикс. В таблице гомологического ряда алканов описаны первые 20 гомологов.
Название | Формула | Физические свойства |
Газы. | ||
Горючие маслянистые жидкости. Содержатся в нефти. Используются для получения жидкого топлива — бензина, керосина, мазута | ||
Тридекан | ||
Тетрадекан | ||
Пентадекан | ||
Гексадекан | Воски и твёрдые вещества. Используются для изготовления вазелина, парафина | |
Гептадекан | ||
Октадекан | ||
Нанадекан | ||
Температуры плавления и кипения алканов повышаются с увеличением количества атомов углерода и, соответственно, молекулярной массы. При этом всем алканам свойственна плотность меньше единицы. Алканы плавают на поверхности воды и растворяются только в органических растворителях.
При этом всем алканам свойственна плотность меньше единицы. Алканы плавают на поверхности воды и растворяются только в органических растворителях.
Изомеры
Алканы — нециклические насыщенные углеводороды. Молекулы представляют собой длинные или разветвлённые углеродные цепи. Гомологичные алканы могут образовывать изомеры. Чем больше атомов углерода, тем больше вариантов изомеров. Первые три алкана (метан, этан, пропан) изомеров не образуют. Бутан, пентан, гексан имеют только структурные изомеры. У бутана их два: н-бутан и изобутан. Пентан образует н-пентан, изопентан, неопентан. Гексан имеет пять изомеров: н-гексан, изогексан, 3-метилпентан, диизопропил, неогексан.
Гомологи от гептана и выше помимо структурных изомеров образуют стереоизомеры или пространственные изомеры, отличающиеся положением атомов в пространстве. Две молекулы идентичны по строению и структуре, но выглядят как предмет и его зеркальное отражение.
Рис. 2. Стереоизомеры.
Длинные названия изомеров составляются по международной номенклатуре ИЮПАК. Словесное обозначение состоит из трёх частей:
Словесное обозначение состоит из трёх частей:
- цифр и приставки, обозначающих количество присоединённых групп;
- названия групп;
- названия главной (самой длинной) цепи.
Например, название изомера гептана 2,3-диметилпентан, указывает, что молекула состоит из пяти атомов углерода (пентана) и двух метильных групп, присоединённых ко второму и третьему атомам углерода.
Для отображения строения изомеров используются структурные формулы. Метильная группа -CH 3 записывается либо через черту вверх или вниз от атома углерода, либо в скобочках после группы -CH 2 в углеродной цепи. Например, H 3 C-CH 2 -CH(CH 2 CH 3)-CH 2 -CH 3 .
Рис. 3. Структурная формула.
Количество изомеров для каждого алкана можно рассчитать математически. Поэтому многие изомеры существуют только в теории. Предполагается, что гектан (C 100 H 202) может иметь 592 107 ∙ 10 34 изомеров, а это далеко не последний алкан в гомологическом ряду.
Что мы узнали?
Алканы образованы гомологическим рядом метана с общей формулой C n H 2n+2 .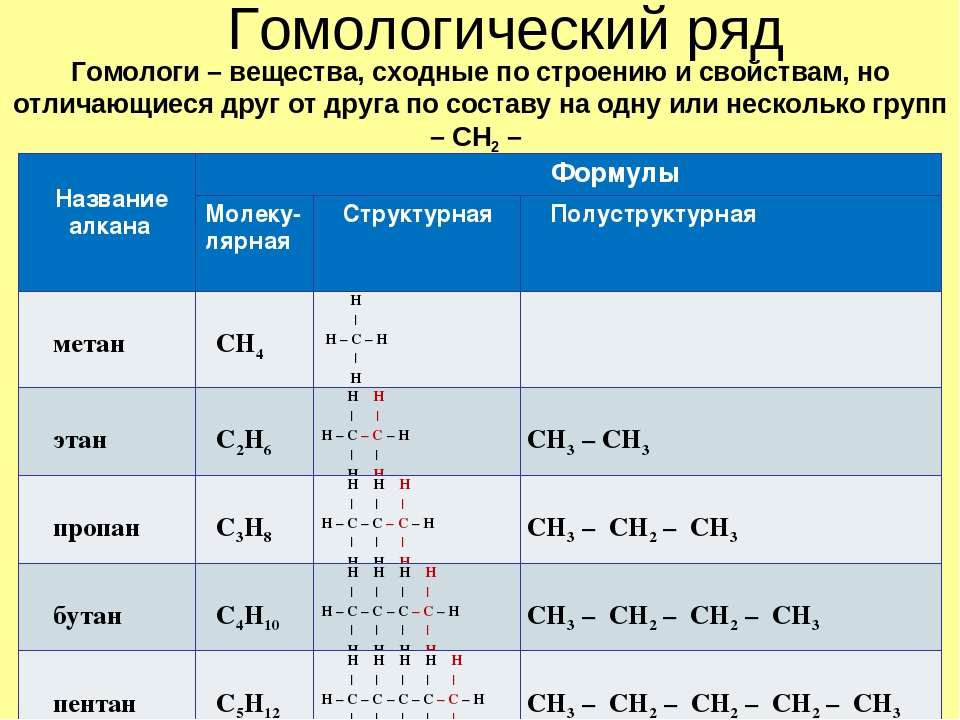 Каждый последующий гомолог отличается от предыдущего на одну группу CH 2 . С возрастанием атомов углерода в гомологическом ряду меняется физическое состояние веществ. Высшими алканами считаются соединения, содержащие более 15 атомов углерода. Это твёрдые вещества. Жидкости содержат 5-15 атомов углерода, газы — 1-4. Начиная с четвёртого гомолога, все алканы образуют структурные изомеры. Помимо этого алканы от гептана и выше могут образовывать стереоизомеры.
Каждый последующий гомолог отличается от предыдущего на одну группу CH 2 . С возрастанием атомов углерода в гомологическом ряду меняется физическое состояние веществ. Высшими алканами считаются соединения, содержащие более 15 атомов углерода. Это твёрдые вещества. Жидкости содержат 5-15 атомов углерода, газы — 1-4. Начиная с четвёртого гомолога, все алканы образуют структурные изомеры. Помимо этого алканы от гептана и выше могут образовывать стереоизомеры.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 121.
В данной статье читатель найдет информацию о гомологичных соединениях, узнает, что они собой представляют. Будут рассмотрены общие свойства, формула веществ и их наименования, характеристика. К тому же затронуто будет не только химическое понимание гомологов, но и биологическое.
Что такое гомологический ряд
Гомологический ряд — это химические соединения, имеющие аналогичный структурный тип, но различающиеся по количеству повторения элементарных единиц вещества. Различие структурных компонентов, а именно одинаковых единиц, и называется гомологической разностью. Гомологами называют вещества, которые находятся в одном и том же гомологическом ряду.
Различие структурных компонентов, а именно одинаковых единиц, и называется гомологической разностью. Гомологами называют вещества, которые находятся в одном и том же гомологическом ряду.
Примером гомологов могут служить спирты, алканы, алкины, кетоны. Если рассматривать гомологичный ряд на примере алканов — простейших представителей (характерная формула: C n H 2 n+2), то видим сходства в структуре ряда представителей данного рода веществ: метан Ch5, этан C2H6, пропан C3H8 и так далее; метиленовые звенья Ch3 являются гомологической разностью в ряде этих веществ.
Общие представления о структуре и гомологии соединений
Представление о гомологии веществ в органической химии базируется на понимании того, что как физические, так и химические качественные характеристики веществ могут определяться молекулярной структурой. Свойства гомологических соединений могут зависеть от строения углеродного скелета и функциональной группы определенного соединения.
Определить химические свойства и, следовательно, принадлежность гомолога к конкретному классу возможно по его функциональной группе. В качестве примера можно обратить внимание на карбоксильную группу, которая отвечает за проявление кислых свойств и принадлежность вещества к карбоновым кислотам. Однако определить уровень проявления химических или физически качеств можно, изучая не только функциональную группу, но и углеродный молекулярный скелет.
В качестве примера можно обратить внимание на карбоксильную группу, которая отвечает за проявление кислых свойств и принадлежность вещества к карбоновым кислотам. Однако определить уровень проявления химических или физически качеств можно, изучая не только функциональную группу, но и углеродный молекулярный скелет.
Существуют соединения, в которых углеродные скелеты схожи, иными словами, изомерия в них отсутствует. Такие гомологи записываются следующим образом: X — (CH 2) n — Y. Количество метиленовых n-звеньевых единиц является гомологичным и относится к классу соединений одного вида. Подобные виды гомологов являются ближайшими.
Гомологический ряд веществ носит некоторые общие закономерности изменения свойств от младших представителей к старшим. Подобное явление способно нарушаться, что связано с образованием водородной связи при наличии группы, которая может их образовывать.
Гомология альдегидов
Альдегиды — ряд соединений органического типа, содержащих в себе альдегидную группу — COH. В веществах данного типа карбоксильная группа взаимосвязана с водородным атомом и одной радикальной группой.
В веществах данного типа карбоксильная группа взаимосвязана с водородным атомом и одной радикальной группой.
Гомологический ряд альдегидов имеет общую формулу R-COH. Одним из элементарных представителей является формальдегид (H-COH), в нем альдегидная группа связана с H. В других, предельных представителях данного ряда соединений водородный атом заменяется на алкин. Общая формула: C n C 2 n+1 -COH.
Альдегиды рассматриваются в качестве веществ, которые произошли в результате замены в парафиновом углеводородном атоме H на группу альдегидную группу. Для таких химических соединений изомерия и гомология является аналогичной другим производным предельных однозамещенных углеводородов.
Наименование альдегидов составляется в зависимости от названия кислоты с таким же количеством углеродных атомов в молекуле, например: Ch4-CHO — уксусный альдегид, Ch4Ch3-CHO — пропионовый альдегид, (Ch4)2CH-CHO — изомасляный альдегид и т. д.
Гомология алкинов
Алкины — это углеводородные химические соединения, несущие в себе тройные связи между атомами C. Они образовывают ряд гомологов с характерной формулой C n H 2 n-2 . Общая особенность положения углеродного атома при тройном количестве связей — состояние sp-гибридизации.
Они образовывают ряд гомологов с характерной формулой C n H 2 n-2 . Общая особенность положения углеродного атома при тройном количестве связей — состояние sp-гибридизации.
Гомологический ряд алкинов: этин (C2h3), пропин (C3h5), бутин (C4H6), пентин (C5H8), гексин (C6h20), гептин (C7h22), октин (C8h24), нонин (C9h26), децин (C10h28).
Физические свойства алкинов определяются аналогичным образом с алкенами. Например, температура кипения и плавления постепенно возрастает с увеличением длины главенствующей цепи углерода и молекулярной массой. К химическим свойствам можно отнести реакции галогенирования, гидрогалогенирования, гидратацию, полимеризацию. Для алкинов также характерны реакции замещения.
Гомология в биологии
Гомологический ряд используется в биологии, однако носит несколько иной характер. Н. И. Вавилов открыл закон, в соответствии с которым происхождение видов и даже родов растений, сходных между собой, влечет протекание изменчивости по параллельным путям. Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.
Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.
Заключение
Гомологический ряд веществ, характеризующихся общей формульной структурой, но отличающихся гомологической разностью, позволил человеку увеличить химический потенциал веществ, открывать и получать множество новых соединений, используемых во всех сферах жизнедеятельности. Лучше понять фундаментальное явление о том, что физические и химические качественные характеристики могут определяться молекулярной структурой соединения.
К вопросу о формировании понятий «гомологи» и «изомеры»
Начальный этап изучения курса органической химии требует формирования его основополагающих понятий «гомологи» и «изомеры», с которыми обучающиеся не встречались ранее, хотя явление изометрии достаточно распространено и среди неорганических веществ. В связи с этим изучение классов органических соединений целесообразно начинать с составления и анализа содержания систематизирующих таблиц для соответствующих гомологических рядов, что позволит заложить основу знаний, обеспечить дальнейшее осмысленное восприятие учебного материала курса. Приведу конкретные примеры.
В связи с этим изучение классов органических соединений целесообразно начинать с составления и анализа содержания систематизирующих таблиц для соответствующих гомологических рядов, что позволит заложить основу знаний, обеспечить дальнейшее осмысленное восприятие учебного материала курса. Приведу конкретные примеры.
Фрагмент таблицы для гомологического ряда алкенов CnH2n
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
2 | С2Н4 | СН2=СН2 |
|
|
3 | С3Н6 | СН2=СН-СН3 |
|
|
4 | С4Н8 | СН2=СН-СН2СН3 | СН3-СН=СН-СН3 | СН2=С(СН3)-СН3 |
5 | С5Н10 | СН2=СН-СН2СН2СН3 | СН3-СН=СН-СН2-СН3 | СН2=С(СН3)СН2СН3 |
6 | С6Н12 | СН2=СН-(СН2)3СН3 | СН3СН=СН(СН2)2СН3 | СН2=С(СН3)(СН2)2СН3 |
В горизонтальных фрагментах таблицы приведены формулы структурных изомеров соответствующих составов, начиная с n=4, например гекс-1-ен, гекс-2-ен, 2-метилпент-1-ен. Анализ особенностей их строения позволяет обучающимся с достаточной долей самостоятельности сделать вывод о том, какие именно изменения в строении молекул привели к возникновению приведенных изомеров. Из табличных данных следует, что для алкенов возможна структурная изомерия на основании изменения положения кратной связи, так называемая «позиционная» изомерия (при этом последовательность соединения атомов углерода в молекуле может не меняться), а так же изомерия углеродного скелета при неизменном положении кратной связи. Очевидно, что возможно одновременное сочетание того и другого варианта изменений в строении молекулы. Вертикальные фрагменты приведенной таблицы содержат структурные формулы так называемых ближайших гомологов, иначе говоря более сходных и близких друг к другу с точки зрения строения молекул. Вводя более узкое (по сравнению с понятием «гомологи») понятие ближайших гомологов обязательно следует подчеркнуть, что используемая характеристика «ближайшие» ни в коем случае не должна расцениваться как синоним характеристики «соседние», то есть следующие в таблице друг за другом и отличающиеся по составу только на одну метиленовую группу СН2.
Анализ особенностей их строения позволяет обучающимся с достаточной долей самостоятельности сделать вывод о том, какие именно изменения в строении молекул привели к возникновению приведенных изомеров. Из табличных данных следует, что для алкенов возможна структурная изомерия на основании изменения положения кратной связи, так называемая «позиционная» изомерия (при этом последовательность соединения атомов углерода в молекуле может не меняться), а так же изомерия углеродного скелета при неизменном положении кратной связи. Очевидно, что возможно одновременное сочетание того и другого варианта изменений в строении молекулы. Вертикальные фрагменты приведенной таблицы содержат структурные формулы так называемых ближайших гомологов, иначе говоря более сходных и близких друг к другу с точки зрения строения молекул. Вводя более узкое (по сравнению с понятием «гомологи») понятие ближайших гомологов обязательно следует подчеркнуть, что используемая характеристика «ближайшие» ни в коем случае не должна расцениваться как синоним характеристики «соседние», то есть следующие в таблице друг за другом и отличающиеся по составу только на одну метиленовую группу СН2. Ближайшие гомологи не обязательно должны являться соседями по гомологическому ряду, и наоборот, соседние гомологи не всегда будут ближайшими по отношению друг к другу. Например, бут-1-ен и гекс-1-ен по отношению друг к другу являются гомологами ближайшими на основании одинакового положения кратной связи в их молекулах и линейного строения углеродной цепи, но при этом они не являются соседями по гомологическому ряду. И наоборот, бут-1-ен и пент-2-ен, являясь соседями по гомологическому ряду, ближайшими гомологами по отношению друг к другу не являются. В связи с разным положением кратной связи они будут обычными гомологами. Таким образом, в данной таблице обычные гомологи записаны по диагонали. Аналогичные таблицы составляются для гомологических рядов других классов органических соединений.
Ближайшие гомологи не обязательно должны являться соседями по гомологическому ряду, и наоборот, соседние гомологи не всегда будут ближайшими по отношению друг к другу. Например, бут-1-ен и гекс-1-ен по отношению друг к другу являются гомологами ближайшими на основании одинакового положения кратной связи в их молекулах и линейного строения углеродной цепи, но при этом они не являются соседями по гомологическому ряду. И наоборот, бут-1-ен и пент-2-ен, являясь соседями по гомологическому ряду, ближайшими гомологами по отношению друг к другу не являются. В связи с разным положением кратной связи они будут обычными гомологами. Таким образом, в данной таблице обычные гомологи записаны по диагонали. Аналогичные таблицы составляются для гомологических рядов других классов органических соединений.
Фрагмент таблицы для гомологического ряда предельных одноатомных спиртов CnH2n+2O
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
1 | СН4О | СН3-ОН |
|
|
2 | С2Н6О | СН3-СН2-ОН |
|
|
3 | С3Н8О | СН3-СН2-СН2-ОН | СН3-СН(ОН)-СН3 |
|
4 | С4Н10О | СН3-СН2-СН2-СН2-ОН | СН3СН(ОН)СН2СН3 | СН3СН(СН3)СН2-ОН |
5 | С5Н12О | СН3-(СН2)3-СН2-ОН | СН3СН(ОН)(СН2)2СН3 | СН3СН(СН3)(СН2)2ОН |
Как и в предыдущей таблице, составленной для гомологического ряда алкенов, в горизонтальных фрагментах этой таблицы приведены формулы структурных изомеров, например бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол. В вертикальных фрагментах расположились ближайшие гомологи, например пропан-2-ол, бутан-2-ол и пентан-2-ол, относящиеся к типу вторичных спиртов. При этом, будучи ближайшими, пропан-2-ол и пентан-2-ол не являются соседями по гомологическому ряду. В других столбцах таблицы так же оказались ближайшие по отношению друг к другу гомологи. На основе анализа общности их строения целесообразно одновременно проклассифицировать предельные одноатомные спирты на три типа: первичные, вторичные и третичные. Обычные гомологи расположились в разных столбцах таблицы по диагонали, например бутан-1-ол и пентан-2-ол. При этом являясь соседними в гомологическом ряду, они не будут ближайшими.
В вертикальных фрагментах расположились ближайшие гомологи, например пропан-2-ол, бутан-2-ол и пентан-2-ол, относящиеся к типу вторичных спиртов. При этом, будучи ближайшими, пропан-2-ол и пентан-2-ол не являются соседями по гомологическому ряду. В других столбцах таблицы так же оказались ближайшие по отношению друг к другу гомологи. На основе анализа общности их строения целесообразно одновременно проклассифицировать предельные одноатомные спирты на три типа: первичные, вторичные и третичные. Обычные гомологи расположились в разных столбцах таблицы по диагонали, например бутан-1-ол и пентан-2-ол. При этом являясь соседними в гомологическом ряду, они не будут ближайшими.
Фрагмент таблицы для гомологического ряда алифатических аминов CnH2n+3N
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
1 | СН5N | СН3-NH2 |
|
|
2 | C2H7N | CH3-CH2-NH2 | (CH3)2NH |
|
3 | C3H9N | CH3—CH2-CH2-NH2 | CH3-NH-CH2-CH3 | (CH3)3N |
Как и в предыдущих случаях в строчках приведенной таблицы записаны формулы структурных изомеров, а в столбцах — формулы ближайших гомологов. При этом в столбце первичных аминов в качестве изомера состава С3Н9N присутствует формула пропиламина, а не изопропиламина, несмотря на то, что он тоже является первичным. По своему строению молекула пропиламина наиболее близка к молекуле этиламина, так как и в том, и в другом случае аминогруппа связана с первичным атомом углерода. Содержание таблицы так же позволяет выявить типы аминов, одновременно сравнив подход к их определению с подходом к определению типов спиртов. При одинаковом строении углеводородного радикала, присутствующего в молекуле, амины и спирты могут принадлежать к разным типам. Например, изопропиламин и изопропиловый спирт (пропан-2-ол) содержат в своих молекулах одинаковый углеводородный радикал – изопропил, но при этом являются представителями разных типов своих классов: первичного и вторичного соответственно. Содержание подобного рода таблиц позволяет наглядно проиллюстрировать явление структурной изомерии, сформировать понятия «гомолог» и «ближайший гомолог».
При этом в столбце первичных аминов в качестве изомера состава С3Н9N присутствует формула пропиламина, а не изопропиламина, несмотря на то, что он тоже является первичным. По своему строению молекула пропиламина наиболее близка к молекуле этиламина, так как и в том, и в другом случае аминогруппа связана с первичным атомом углерода. Содержание таблицы так же позволяет выявить типы аминов, одновременно сравнив подход к их определению с подходом к определению типов спиртов. При одинаковом строении углеводородного радикала, присутствующего в молекуле, амины и спирты могут принадлежать к разным типам. Например, изопропиламин и изопропиловый спирт (пропан-2-ол) содержат в своих молекулах одинаковый углеводородный радикал – изопропил, но при этом являются представителями разных типов своих классов: первичного и вторичного соответственно. Содержание подобного рода таблиц позволяет наглядно проиллюстрировать явление структурной изомерии, сформировать понятия «гомолог» и «ближайший гомолог».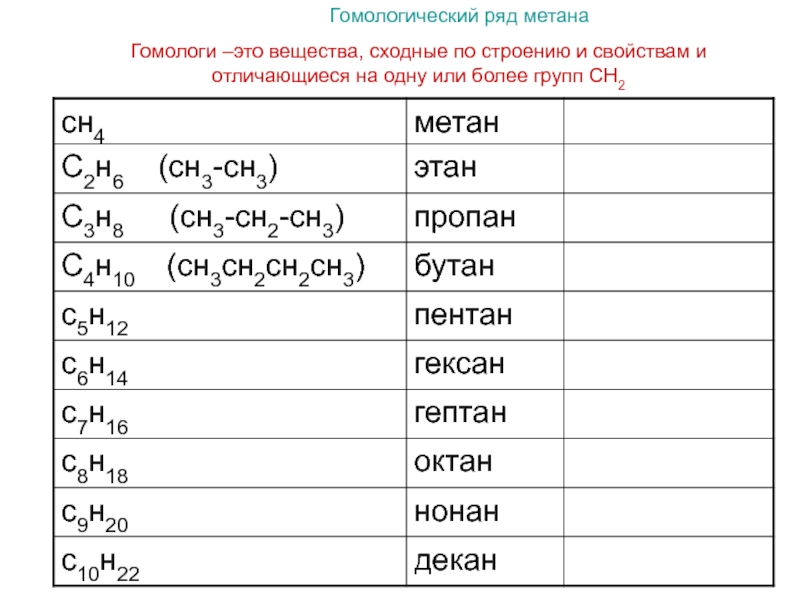
Систематическая работа обучающихся с одинаково структурированными таблицами, составленными для гомологических рядов разных классов органических соединений, помогает сформировать представление об общности химических явлений, освоить некоторые фундаментальные понятия органической химии, закрепить приобретенные знания, развить самостоятельность и логику химического мышления. Все это составит прочную основу для дальнейшего успешного изучения предмета.
Гомологический ряд
Предельными (насыщенными) углеводородами называются углеводороды, в молекулах которых атомы углерода связаны между собой простой связью, причём все единицы валентности, не затраченные на связь между атомами углерода, насыщены атомами водорода.
Представителями предельных углеводородов являются метан CH4; этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14. Однако этот ряд можно продолжить. Существуют углеводы C30H62, C50H102, C70H142, С100Н202.
Однако этот ряд можно продолжить. Существуют углеводы C30H62, C50H102, C70H142, С100Н202.
Если рассматривать углеводороды ряда метана, то нетрудно заметить, что каждый последующий углеводород можно произвести от соответствующего предыдущего замещением одного атома водорода группой CH3 (метил). Таким образом, состав молекулы последующего углеводорода увеличивается на группу CH2.
Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или несколько структурных единиц (обычно на группу CH2), называется гомологическим рядом, а каждый из углеводов – членом гомологического ряда или гомологом. Если расположить гомологи в порядке возрастания их относительной молекулярной массы, они образуют гомологический ряд.
Группа CH2 называется гомологической разностью или гомологической разницей. Общая формула предельных углеводородов CnH2n + 2, где n – число атомов углерода в молекуле.
Общая формула предельных углеводородов CnH2n + 2, где n – число атомов углерода в молекуле.
Если от молекулы углеводорода отнять атом водорода, то остаток молекулы с открытой связью называется углеводородным радикалом (обозначается буквой R). В свободном виде радикалы из-за большой реакционной способности не существуют.
Явление гомологии – существование рядов органических соединений, в которых формула любых двух соседей ряда отличается на одну и ту же группу (чаще всего CH2). Физико-химические свойства соединений изменяются по ходу гомологического ряда. В органической химии в основе понятие гомология основывается на фундаментальном положении о том, что химические и физические свойства соединения обусловлены структурой его молекул: эти свойства определяются и функциональными группами соединения, и его углеродным скелетом.
Весь комплекс химических свойств и, следовательно, отнесённость соединения к определённому классу, определяется именно функциональными группами, но степень проявления химических свойств или физические зависит от углеродного скелета молекулы.
При отсутствии изомерии в случае подобия углеродных скелетов соединений формулу гомологичных соединений можно записать как X–(СН2)n–Y, соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений. Итак, соединения-гомологи принадлежат к одному классу соединений, а свойства ближайших гомологов наиболее близки.
В гомологических рядах наблюдается определённая закономерное изменение свойств от младших членов ряда к старшим, но такая закономерность соблюдается не всегда, в некоторых случаях она может нарушаться. Чаще всего это происходит в начале ряда, потому что образуются водородные связи при наличии функциональных групп, способных к их образованию.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14, гептан C7H16, октан – С8Н18, нонан – С9Н20, декан – С10Н22, ундекан – С11Н24, нодекан – С12Н26, тридекан – С13Н28, тетрадекан – С14Н30, пентадекан – С15Н32, эйкозан – С20Н42, пентакозан – С25Н52, триаконтан – С30Н62, тетраконтан – С40Н82, гектан – С100Н202.
Остались вопросы? Не знаете, что такое гомологический ряд?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Ароматические углеводороды — Что такое Ароматические углеводороды?
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6.
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
Гомологическая серия: определение и идентификация — видео и стенограмма урока
Что такое гомологичная серия?
Гомологическая серия в органической химии представляет собой группу органических соединений (соединений, содержащих атомы C), которые отличаются друг от друга одной метиленовой (Ch3) группой. Например, метан, этан и пропан являются частью гомологического ряда. Единственное различие между этими молекулами состоит в том, что они имеют разное количество групп Ch3.
Каждый член гомологичного ряда называется гомологом , что также может быть записано как «гомолог».Например, метан и этан являются гомологами и принадлежат к одному гомологическому ряду. Они отличаются друг от друга на одну группу Ch3. Формула метана — Ch5, а формула этана — C2 H6.
Химические свойства
Гомологи имеют схожие химические свойства, поскольку функциональная группа молекулы не изменяется.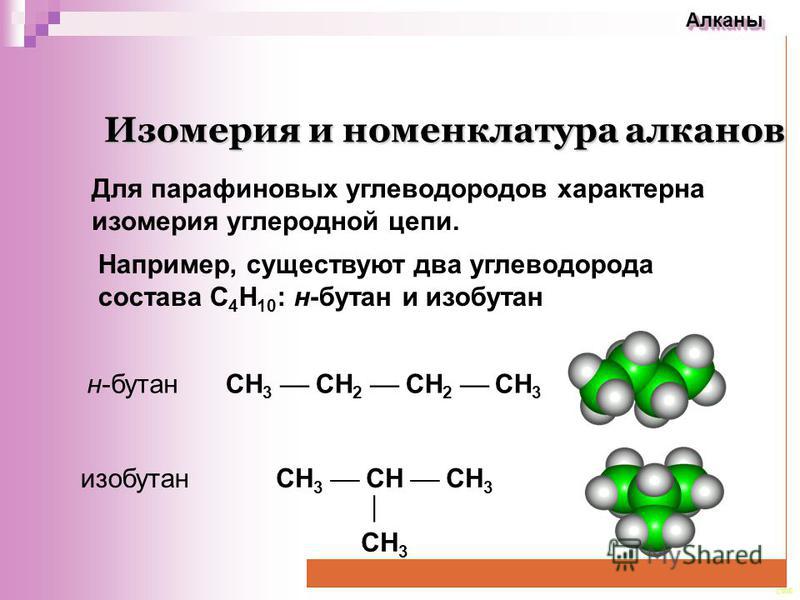 Помните, что функциональная группа — это просто область молекулы, которая реакционноспособна или может изменяться в ходе химических реакций. Поскольку функциональная группа одинакова для каждой молекулы в гомологичном ряду, гомологи обладают сходной реакционной способностью.Некоторыми примерами функциональных групп в гомологическом ряду являются спирты (-OH), карбоновые кислоты (-COOH), альдегиды (COH), кетоны (C = O) и амины (N), среди многих других. Поэтому, когда вы хотите идентифицировать гомологи, функциональная группа будет такой же. Единственное, что изменится, — это длина углеродной цепи.
Помните, что функциональная группа — это просто область молекулы, которая реакционноспособна или может изменяться в ходе химических реакций. Поскольку функциональная группа одинакова для каждой молекулы в гомологичном ряду, гомологи обладают сходной реакционной способностью.Некоторыми примерами функциональных групп в гомологическом ряду являются спирты (-OH), карбоновые кислоты (-COOH), альдегиды (COH), кетоны (C = O) и амины (N), среди многих других. Поэтому, когда вы хотите идентифицировать гомологи, функциональная группа будет такой же. Единственное, что изменится, — это длина углеродной цепи.
Физические свойства
Итак, если функциональная группа не меняется, чем интересны гомологические серии? Что они могут рассказать нам о молекулах? Причина, по которой гомологические ряды интересны при изучении химии, заключается в том, что если есть изменение в физических свойствах, это связано с дополнительной метиленовой группой.
Например, точка кипения пентана составляет 36,1 ° C, в то время как точка кипения гомолога гексана составляет 68,7 ° C. Что вызывает такой скачок температуры кипения на 30 градусов? Оба являются алканами (все атомы C и H связаны одинарными связями). У них нет разных функциональных групп, так что это не может быть причиной увеличения. Повышение температуры кипения происходит из-за увеличения лондонских сил дисперсии или притяжения между молекулами. В гексане больше атомов углерода и водорода, чем в пентане, поэтому у него больше лондонских дисперсионных сил.Чтобы разрушить притяжение и перевести молекулы из жидкого состояния в газовое, требуется больше энергии, поэтому температура кипения увеличивается.
Что вызывает такой скачок температуры кипения на 30 градусов? Оба являются алканами (все атомы C и H связаны одинарными связями). У них нет разных функциональных групп, так что это не может быть причиной увеличения. Повышение температуры кипения происходит из-за увеличения лондонских сил дисперсии или притяжения между молекулами. В гексане больше атомов углерода и водорода, чем в пентане, поэтому у него больше лондонских дисперсионных сил.Чтобы разрушить притяжение и перевести молекулы из жидкого состояния в газовое, требуется больше энергии, поэтому температура кипения увеличивается.
Другие типы гомологичных серий
Гомологические серии не ограничиваются только органическими соединениями. Есть некоторые неорганические молекулы, которые тоже могут иметь гомологические ряды! Например, у силанов есть гомологические ряды. Вместо того чтобы различаться по количеству метиленовых групп, они различаются по количеству групп Sih3.
Краткое содержание урока
Гомологический ряд в органической химии — это группы молекул, которые имеют одинаковую базовую структуру, включая одну и ту же функциональную группу . Они различаются только количеством метиленовых (Ch3) групп . Химические свойства гомологических рядов схожи, потому что они имеют одну и ту же функциональную группу. Однако физические свойства гомологов отличаются из-за увеличенных лондонских сил дисперсии . Другие молекулы, помимо органических соединений, также могут иметь гомологический ряд. Один из примеров — силаны.
Они различаются только количеством метиленовых (Ch3) групп . Химические свойства гомологических рядов схожи, потому что они имеют одну и ту же функциональную группу. Однако физические свойства гомологов отличаются из-за увеличенных лондонских сил дисперсии . Другие молекулы, помимо органических соединений, также могут иметь гомологический ряд. Один из примеров — силаны.
2.8: Углеводороды и серия гомологичных
Задача обучения
- углеводороды классифицируются как насыщенные и ненасыщенные
- классифицирует углеводороды как алканы, алкены, алкины, циклоалканы или ароматические соединения (арены).
- применить гомологический ряд к органическим молекулам с 1-10 атомами углерода
Классификация углеводородов
Углеводороды — это органические соединения, которые содержат только углерода и водорода.Присущая углеводородам способность связываться с самими собой известна как катенация, и позволяет углеводородам образовывать более сложные молекулы, такие как циклогексан и бензол. Связь происходит из-за того, что характер связи между атомами углерода совершенно неполярный.
Связь происходит из-за того, что характер связи между атомами углерода совершенно неполярный.
Четыре основных класса углеводородов: алканы, алкены, алкины и арены. Ароматические соединения получили свои названия из-за того, что многие из этих соединений на заре открытия были сгруппированы, потому что они были маслами с ароматным запахом.Ниже приводится краткое описание классификации углеводородов.
Насыщенные углеводороды (алканы) являются простейшими из углеводородов. Они полностью состоят из одинарных связей и насыщены водородом. Общая формула для насыщенных углеводородов: C n H 2n +2 (при условии нециклической структуры). Насыщенные углеводороды являются основой нефтяного топлива и встречаются как линейные, так и разветвленные. В простейших алканах атомы углерода связаны в прямую цепь; они называются нормальными алканами.Они названы в соответствии с количеством атомов углерода в цепи. Самый мелкий алкан — метан:
Ненасыщенные углеводороды имеют двойные и / или тройные связи между атомами углерода. Алкены с двойной связью называются алкенами и имеют общую формулу C n H 2n (при условии нециклических структур). Те, которые содержат тройные связи, называются алкинами и имеют общую формулу C n H 2n-2 . Наименьший алкен — этен — имеет два атома углерода и также известен под своим общим названием этилен, а самый маленький алкин — этин, также известный как ацетилен.
Алкены с двойной связью называются алкенами и имеют общую формулу C n H 2n (при условии нециклических структур). Те, которые содержат тройные связи, называются алкинами и имеют общую формулу C n H 2n-2 . Наименьший алкен — этен — имеет два атома углерода и также известен под своим общим названием этилен, а самый маленький алкин — этин, также известный как ацетилен.
Циклоалканы представляют собой углеводороды, содержащие одно или несколько углеродных колец, к которым присоединены атомы водорода. Приставка «цикло» добавляется к имени для обозначения кольцевой структуры. Общая формула насыщенного углеводорода, содержащего одно кольцо: C n H 2n .
Ароматические углеводороды, также известные как арены, представляют собой углеводороды, содержащие по крайней мере одно ароматическое кольцо. Ароматические соединения содержат бензольное звено. Сам бензол состоит из шести атомов углерода в кольце с чередующимися одинарными и двойными связями C – C:
Для большинства соединений для выяснения их структуры потребуется информация, выходящая за рамки химической формулы. Однако соотношение C: H в химической формуле может дать представление о химической структуре.
Однако соотношение C: H в химической формуле может дать представление о химической структуре.
Например, давайте рассмотрим некоторые из возможных структур и химических формул углеводородов, содержащих шесть атомов углерода.
Насыщенный алкан имеет самое высокое отношение водорода к углероду. Ненасыщенный алкен и шестичленное алкановое кольцо имеют одну и ту же химическую формулу. Важно помнить об этих отношениях. Ненасыщенный алкин имеет более низкое отношение водорода к углероду, чем алкены со второй пи-связью.Бензольные кольца имеют самое низкое отношение водорода к углероду — 1: 1.
Упражнение
1. Классифицируйте следующие соединения: насыщенные и ненасыщенные. Для ненасыщенных углеводородов уточните классификацию, указав, является ли соединение алкеном, алкином или ареном.
- Ответ
1.
Количество атомов углерода, непрерывно связанных вместе, является важной структурной характеристикой и описывается с помощью гомологичной серии. На первом курсе по органической химии обычно все, что нужно запомнить, — это первые десять имен гомологической серии. Конечно, ваш профессор установит стандарт. Большинство префиксов знакомы по греческим префиксам бинарных ковалентных соединений. Это префиксы для первых четырех длин углеродных цепей, которые могут быть незнакомы. Интересно, что три из этих углеводородов часто встречаются в повседневной жизни. Метан является основным компонентом метеоризма и является ингредиентом, который воспламеняется при зажигании пердуна — не пытайтесь это делать дома.Пропан и бутан являются газами при комнатной температуре. Они хранятся под давлением для создания жидкого состояния. Пропан — это топливо для барбекю, а бутан используется в зажигалках. Суффикс «анэ» используется для различения самой длинной непрерывной углеродной цепи, в то время как более короткие углеродные ответвления (заместители) обозначаются суффиксом «ил».
На первом курсе по органической химии обычно все, что нужно запомнить, — это первые десять имен гомологической серии. Конечно, ваш профессор установит стандарт. Большинство префиксов знакомы по греческим префиксам бинарных ковалентных соединений. Это префиксы для первых четырех длин углеродных цепей, которые могут быть незнакомы. Интересно, что три из этих углеводородов часто встречаются в повседневной жизни. Метан является основным компонентом метеоризма и является ингредиентом, который воспламеняется при зажигании пердуна — не пытайтесь это делать дома.Пропан и бутан являются газами при комнатной температуре. Они хранятся под давлением для создания жидкого состояния. Пропан — это топливо для барбекю, а бутан используется в зажигалках. Суффикс «анэ» используется для различения самой длинной непрерывной углеродной цепи, в то время как более короткие углеродные ответвления (заместители) обозначаются суффиксом «ил».
Упражнение
2. Заполните приведенную ниже таблицу.
| Концентрированная структурная формула | Химическое название |
| пропан | |
| C 6 H 6 | |
| Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 |
- Ответ
2.
Концентрированная структурная формула Химическое название Канал 3 Канал 2 Канал 3 пропан C 6 H 6 бензол Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 гексан
Авторы и авторство
Гомологичное определение и примеры
Гомологическое определение
прил.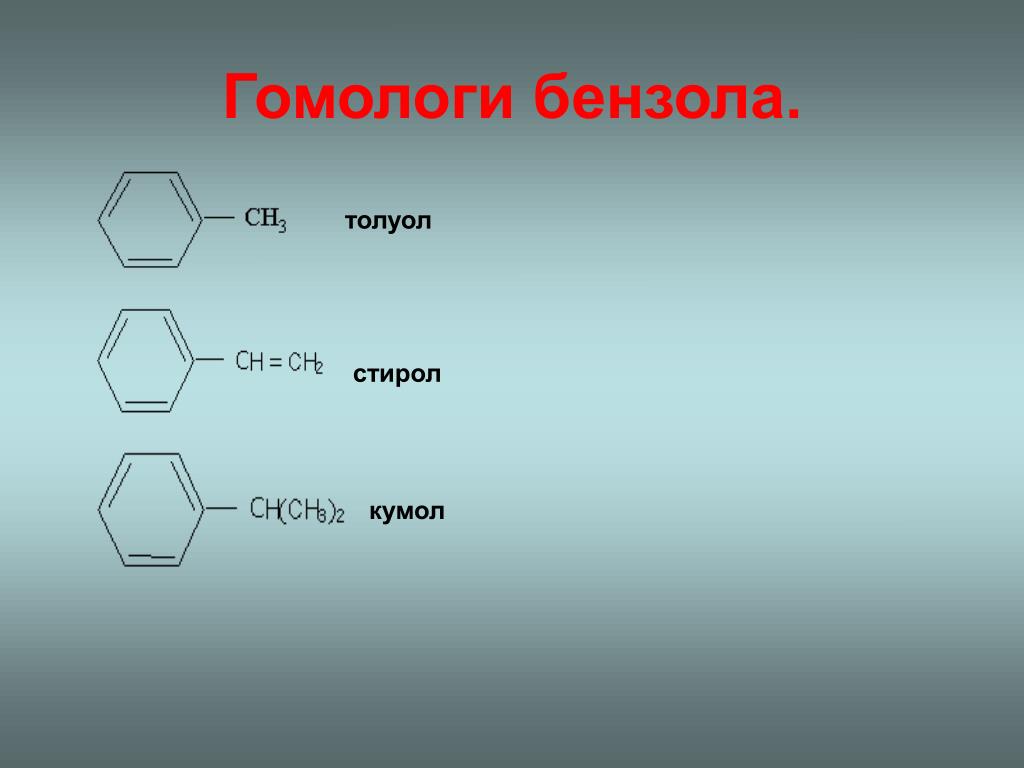 , həˈmɒləɡəs
, həˈmɒləɡəs
Имеющие похожие или соответствующие характеристики. Например, гомологичные структуры — это структуры, имеющие схожие анатомические особенности, но они не обязательно имеют одинаковую функцию
Гомологичное определение
Что такое гомологичное? В общей науке слово « гомологичный » используется для обозначения степени сходства. Это может быть должность, структура, функция или характеристики. В химии , гомологичный относится к серии молекул или соединений, которые различаются на постоянное приращение.Например, алканы представляют собой гомологичный ряд углеводородов: метан, этан, пропан и так далее.
Они имеют аналогичные химические свойства, которые следуют тенденциям. Например, с увеличением длины их цепочки (добавлением CH 2 ) температура кипения также увеличивается.
Что означает гомологичный в биологии и генетике? По сути, оба они определяют гомологичность как наличие соответствующих частей, сходных структур или одинаковых анатомических положений.
В биологии он используется, например, для обозначения частей или структур тела, указывающих на общее эволюционное происхождение, как в « гомологичных структурах ».
В генетике он используется для обозначения пары хромосом, которые имеют аналогичную структуру. Называемые гомологичными хромосомами , они представляют собой хромосомы, которые расположены парами на основе соответствующей длины хромосомы и последовательности гена.
Этимология: от греческого homologos , что означает «согласный», «корреспондент».
Сравнить: гетерологичны.
Гомологичный и гетерологичный
И гетерологичный, и гомологичный являются описательными словами, но имеют противоположные значения. В то время как гомологичный относится к биологическим объектам, имеющим соответствующие или похожие признаки, гетерологичный используется для описания объекта, признаки которого заметно отличаются друг от друга.
Например, гетерологичная опухоль — это опухоль, содержащая цитологические элементы или ткань, отличную от места образования опухоли.Напротив, гомологичная опухоль представляет собой опухоль, состоящую из клеток или ткани, напоминающих ткань, в которой она образуется. (Ссылка 1)
Гомологические примеры
Гомологические структуры
Гомологичные структуры — это части тела организмов, которые имеют одинаковые анатомические особенности, что указывает на общего предка или происхождение в результате развития. У них может быть одна и та же черта, но они не обязательно выполняют одну и ту же функцию. Например, передние конечности летучих мышей и человека являются гомологичными структурами.
Кости передних конечностей летучих мышей такие же, как у людей. Это указывает на общий предковый организм. На рисунке ниже показаны анатомические особенности передних конечностей различных животных. Не только летучие мыши и люди имеют одинаковые компоненты костей передних конечностей.
Кошки, киты, ящерицы и птицы имеют одинаковые или соответствующие кости передних конечностей, а именно плечевую, лучевую, локтевую, запястную и фаланги. Однако у этих передних конечностей у разных животных разные основные функции.
Например, летучие мыши используют свои передние конечности в основном для скольжения. Птицы используют их для полета. Кошки и ящерицы используют их для прогулок и лазанья.
Киты используют их для купания. У людей отсутствует перепонка крыла, и они двуногие, поэтому их руки могут выполнять множество, но ограниченный набор функций, например тянуться, хвататься, лазать, плавать и так далее.
Гомологичные хромосомы
Гомологичные хромосомы — это парные хромосомы.Хромосомы в паре имеют одинаковую последовательность гена, локусы и расположение центромеры. У них одинаковая хромосомная длина. Тем не менее они могут различаться по аллелям.
Клетка человека, например, имеет в общей сложности 46 хромосом в ядре. Половина из них (23 хромосомы) принадлежит матери, а другая половина (23 хромосомы) — отцу. При оплодотворении эти хромосомы объединяются, образуя новое ядро внутри зиготной клетки, которое впоследствии вырастает и превращается в нового человека.Каждая клетка человеческого тела будет содержать эти два набора хромосом.
Половина из них (23 хромосомы) принадлежит матери, а другая половина (23 хромосомы) — отцу. При оплодотворении эти хромосомы объединяются, образуя новое ядро внутри зиготной клетки, которое впоследствии вырастает и превращается в нового человека.Каждая клетка человеческого тела будет содержать эти два набора хромосом.
22 из этих пар аутосомы и гомологичны. Оставшаяся пара — это пара половых хромосом. Две X-хромосомы также гомологичны, но пара половых хромосом, состоящая из X и Y, будет не гомологичной, а гетерологичной. На диаграмме ниже показан пример.
Связанные термины
Ссылки
- гетерологичная опухоль. (2020). TheFreeDictionary.Com. https: // медицинский словарь.thefreedictionary.com/heterologous+tumor
© BiologyOnline. Контент предоставлен и модерируется редакторами BiologyOnline.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Сравнительно: гомологичные и аналогичные полимеры
Примечание редактора: Что могут выявить различия в структуре и функциях внутри химического семейства? И чем эти идеи могут оказаться полезными? В этом выпуске «Сравнительно говоря» Энтони Дж. О’Леник-младший более подробно иллюстрирует гомологичные и аналогичные полимеры. Дополнительные сведения в этой сравнительной серии см. В разделе «Сравнительная речь».
Дополнительные сведения в этой сравнительной серии см. В разделе «Сравнительная речь».
Взаимосвязь между структурой и функцией между химическими веществами является одной из основных причин для изучения ряда связанных химикатов и использования их различий для определения тенденций в пределах химического семейства.Это важное направление в органической химии, но крайне важное для химии полимеров.
Два типа взаимосвязей оказываются наиболее плодотворными для изучения эффектов и создания родственных молекул. Один — это исследование гомологического ряда соединений; другой — аналогичный ряд родственных соединений.
Гомологи
Гомолог — это соединение, принадлежащее к ряду соединений, которое отличается друг от друга повторяющейся единицей, такой как группа -CH 2 -.Это означает, что в серии не происходит замещения одной функциональной группы на другую и не происходит отщепления функциональной группы.
Примером в органической химии являются углеводороды. В рамках одного гомологического ряда можно определить бутан, гептан-гексан и т. Д. Можно посмотреть их точки кипения, точки замерзания и, возможно, даже растворимость в различных растворителях.
В рамках одного гомологического ряда можно определить бутан, гептан-гексан и т. Д. Можно посмотреть их точки кипения, точки замерзания и, возможно, даже растворимость в различных растворителях.
Этот тип исследования может быть применен к полимерам. Рассмотрим следующую молекулу цетилдиметикона (см. , рисунок 1, ):
, где R — (CH 2 ) 15 -CH 3
Эта молекула представляет собой алкилдиметикон.Группа R является олеофильной, содержится в группе a . Группа, растворимая в силиконе, включает все, что находится в группе b и концевых концах. Поскольку a, увеличивается относительно b, аналогично увеличивается процентное содержание алкильной группы для . Следовательно, если рассматривать растворимость в маслах различной полярности, можно связать% алкила с растворимостью.
Стоит отметить, что также может быть создан ряд гомологов, в которых C16-алкил заменен другими алкильными цепями (C4-C32). Эти материалы будут демонстрировать не только измененную растворимость, но и измененную температуру плавления. Другими словами, гомологи — это материалы, в которых количество групп изменено, но не добавляются новые группы и не удаляются существующие группы из молекулы. Напротив, аналоги (описанные ниже) — это материалы, в которых одна или несколько групп заменены другой группой.
Эти материалы будут демонстрировать не только измененную растворимость, но и измененную температуру плавления. Другими словами, гомологи — это материалы, в которых количество групп изменено, но не добавляются новые группы и не удаляются существующие группы из молекулы. Напротив, аналоги (описанные ниже) — это материалы, в которых одна или несколько групп заменены другой группой.
Таблица 1 показывает результаты такого эксперимента. Он не только показывает, что существуют цетилдиметиконовые полимеры, растворимые в силиконовой жидкости с вязкостью 350, но и полимеры, растворимые как в минеральном масле, так и в силиконе; и те, которые растворимы в триглицериде C8-10.И это при том, что три растворителя не растворяются друг в друге. Графическое представление показано на рис. , рис. 2 .
Почти 20 лет назад было сделано предсказание для алкилдиметикона, который растворим как в силиконе, так и в минеральном масле; это было описано в статье, описывающей трехмерную систему HLB. 1 Такая совместимость — основа хорошего формулирования.
1 Такая совместимость — основа хорошего формулирования.
Например, выбор подходящего алкилсиликона для минимизации синерезиса в пигментированных продуктах, стабилизации масляной фазы эмульсии или изменения эстетики улучшается, если конкретный алкилсиликон растворяется в фазе, в которой он будет составлен.
Различные полимеры алкилдиметикона могут быть оценены путем добавления их в состав масляных фаз, состоящих из нескольких компонентов, чтобы в конечном итоге прийти к наилучшему кандидату для смешанной системы.
Аналоги
В отличие от гомологов, аналоги — это соединения, принадлежащие к ряду соединений, которые отличаются друг от друга заменой одной функциональной группы другой функциональной группой. Примерами из органической химии являются аналогичные поверхностно-активные вещества лаурет-2 сульфат натрия и лаурет-2 фосфат натрия.
Этот тип исследования может быть применен и к полимерам. Рассмотрим ту же самую молекулу цетилдиметикона, показанную на Рис. 1 ; но на этот раз a и b остаются постоянными, а R изменяется следующим образом.
1 ; но на этот раз a и b остаются постоянными, а R изменяется следующим образом.
Для полимера A: R — (CH 2 ) 3 -O- (CH 2 CH 2 O) 8 H
Для полимера B: R — (CH 2 ) 3 -O-CH 2 CH- (OH) -CH 2 -N + — (CH 3 ) 3 Класс Класс —
Первоначально можно было ожидать значительных различий в растворимости, поскольку заряжен четвертичный, а не ПЭГ.Однако растворимость этих двух полимеров в нескольких растворителях очень похожа, как показано в Таблице 2 .
Обратное сообщение
В нижней строке? Работая с близкими химическими веществами, не упускайте из виду сходства и различия аналогов и гомологов.
Номер ссылки
1. 3D HLB,
Cosm & Toil 111 41 (октябрь 1996 г.), доступно на surfatech. com/pdfs/3D_HLB.pdf (доступно 27 ноября 2017 г.)
com/pdfs/3D_HLB.pdf (доступно 27 ноября 2017 г.)Homologous Sery — обзор
Прогноз удержания и Идентификация аналита
Прогнозирование удерживания в пределах гомологического ряда возможно благодаря линейным отношениям, которые обычно наблюдаются между параметрами удерживания, log k , и углеродным числом аналитов, n ( Рисунок 2 ).Наклоны линий B для различных серий гомологов, хроматографированных в одних и тех же условиях, очень похожи, тогда как точки пересечения A могут различаться:
Рис. 2. Графики log k в зависимости от числа атомов углерода, n , аналита для ВЭЖХ на полифункциональном диоксиде кремния, связанном с C 18 , с чистым метанольным элюентом при 25 ° C: n -алканы (□), метил- n -алканоаты (•) и n — алканолы (○).
Перепечатано из Tchapla, A.; Herson, S .; Lessellier, E .; Колин, Х. Дж . Хроматограф . А . 1993 , 656 , 81–112, с разрешения Elsevier Science.
А . 1993 , 656 , 81–112, с разрешения Elsevier Science.[6] logk = A + Bn
Иногда наблюдаются линейные корреляции между параметрами удерживания и дескрипторами молекулярной массы аналитов, которые не являются гомологами. Хороший прогноз удерживания в ряду связанных неполярных аналитов, таких как полициклические ароматические углеводороды (ПАУ) или алкилбензолы, можно получить, используя объем Ван-дер-Ваальса в качестве структурного дескриптора.
Дескрипторы объемности могут учитывать разделение аналитов, когда дисперсионные взаимодействия (взаимодействия Лондона) являются единственными взаимодействиями, эффективными в данной хроматографической системе, или когда различия в полярных взаимодействиях между аналитами не являются значительными.
Способность аналита принимать участие в полярных взаимодействиях трудно охарактеризовать с помощью одного дескриптора. Следовательно, простые QSRR, включающие дескрипторы полярности аналита, например, дипольные моменты, встречаются редко.
Обычно в хроматографии (кроме аффинной хроматографии) влияние формы молекулы на удерживание имеет второстепенное значение по сравнению с влиянием размера и полярности молекул. В случае плоских / неполярных изомеров ПАУ удерживание линейно связано с дескриптором формы (степенью удлинения молекулы аналита).
Имеется множество отчетов о хороших показателях индекса молекулярной связности (индекса Рэндича) и его модификаций при прогнозировании удерживания конгенерированных аналитов, включая изомеры.Корреляции хороши, когда удерживание происходит на неполярных стационарных фазах, но не когда задействованы полярные фазы. В то время как на неполярных фазах неспецифические дисперсионные взаимодействия определяют различия в удерживании между аналитами, более специфические полярные взаимодействия становятся дискриминационными в случае полярных фаз (и полярных аналитов).
Использование замещающих электронных констант для получения простого QSRR с реальной способностью предсказывать удерживание редко бывает успешным. Более широкое применение в этом отношении находят гидрофобные константы заместителя Ханса, π , и фрагментарные гидрофобные константы Реккера или Ханса-Лео, f .Суммы этих констант (плюс поправки из-за внутримолекулярных взаимодействий) хорошо учитывают удерживание в системах жидкостной хроматографии с обращенной фазой.
Более широкое применение в этом отношении находят гидрофобные константы заместителя Ханса, π , и фрагментарные гидрофобные константы Реккера или Ханса-Лео, f .Суммы этих констант (плюс поправки из-за внутримолекулярных взаимодействий) хорошо учитывают удерживание в системах жидкостной хроматографии с обращенной фазой.
Что касается последних систем, даже лучшие прогнозы дает эмпирический параметр — логарифм коэффициента разделения n -октанол – вода, log P . Другой полезный эмпирический предсказатель удерживания иногда оказывается точкой кипения, T b , например, точкой кипения изомерных углеводородов в ГХ.
Прогнозирование удерживания различных замещенных производных исходных соединений в данной системе разделения может быть основано на правиле Мартина:
[7] logkS = logkP + ∑i = 1nτi
In eqn [7], k P — параметр удерживания исходного соединения, k S — соответствующее значение для производного, несущего n заместителей, а сумма представляет собой приращения удерживания из-за индивидуальных заместителей τ i . Имея соответствующие значения для представляющих интерес функциональных групп, нужно только определить удерживание родительской структуры, чтобы иметь возможность рассчитать удержание производного инструмента. Чтобы получить надежные прогнозы, в уравнение [7] вводятся поправочные коэффициенты для учета взаимных взаимодействий между заместителями (электронных, стерических и водородных связей). Однако в случае полифункциональных аналитов взаимодействия между заместителями делают прогнозы удерживания довольно ограниченными.
Имея соответствующие значения для представляющих интерес функциональных групп, нужно только определить удерживание родительской структуры, чтобы иметь возможность рассчитать удержание производного инструмента. Чтобы получить надежные прогнозы, в уравнение [7] вводятся поправочные коэффициенты для учета взаимных взаимодействий между заместителями (электронных, стерических и водородных связей). Однако в случае полифункциональных аналитов взаимодействия между заместителями делают прогнозы удерживания довольно ограниченными.
Полуэмпирическое описание систем ВЭЖХ с обращенной фазой, позволяющее прогнозировать относительное удерживание и селективность в серии аналитов, было разработано Jandera.Подход заключается в определении индексов взаимодействия, а также структурных липофильных и полярных индексов. Подходящий набор стандартных контрольных аналитов необходим для калибровки шкалы удерживания (или селективности).
Многопараметрические QSRR, основанные на LSER, обладают высокой предсказательной силой в отношении удерживания обращенно-фазовой ВЭЖХ. Модель, разработанная Абрахамом и соавторами для прогнозирования коэффициента распределения n -октанол – вода, log P , оказывается полезной также в случае log k из обращенно-фазовой жидкостной хроматографии:
Модель, разработанная Абрахамом и соавторами для прогнозирования коэффициента распределения n -октанол – вода, log P , оказывается полезной также в случае log k из обращенно-фазовой жидкостной хроматографии:
[8] logk = c0 + c1Vx + c2π2H + c3∑α2H + c4∑β2H + c5R2
В уравнении [8] V x — это так называемый характеристический объем МакГоуэна, который можно просто рассчитать по молекулярной структуре; π 2 H — диполярность / поляризуемость аналита, которая может быть определена с помощью газовой хроматографии и других измерений; Α2H — эффективная или суммарная кислотность водородной связи; ∑β2H — эффективная или суммарная основность водородной связи; и R 2 представляет собой избыточную молярную рефракцию, которая может быть получена из измерений показателя преломления и является дополнительной величиной.Структурные дескрипторы на основе LSER доступны для большого количества соединений.
Экспериментально определенный ионный радиус I r и энергия ионизации E i , сопровождаемая атомной массой, A m , дают трехпараметрическое уравнение регрессии, предсказывающее капиллярную электрофоретическую подвижность катионы металлов. Уравнение QSRR показывает, что атомная масса приближается к факторам замедления (отрицательный вклад в подвижность), тогда как ионный радиус является приблизительной мерой эффективного заряда аналита.Энергия ионизации может играть роль вторичного, но существенного поправочного коэффициента к эффективному заряду. К сожалению, нет хороших QSRR для прогнозирования удерживания ХЭ органических аналитов.
Типичный многопараметрический подход к прогнозированию удерживания неизвестного соединения на основе структурных особенностей и хроматографических свойств других репрезентативных соединений состоит в создании множества дескрипторов аналита, которые затем регрессируют по данным удерживания. Структурные дескрипторы обычно получают методами вычислительной химии для оптимизированных по энергии конформаций. Были разработаны программные системы, которые производят и обрабатывают сотни квантово-химических, молекулярных моделей, топологических и полуэмпирических аддитивно-конститутивных дескрипторов после создания эскиза молекулы на компьютере. Соблюдая все правила и рекомендации для значимой статистики, выбирается минимальное количество дескрипторов (некоррелированных), которые необходимы для создания уравнения QSRR с хорошей предсказательной способностью.Дескрипторы, которые в конечном итоге служат для предсказания удержания новых аналитов, иногда имеют неясное физическое значение. Например, трудно придать определенный физический смысл таким дескрипторам, указанным в прогнозном QSRR как «площадь поверхности положительно заряженной части молекулы, деленная на общую площадь поверхности» или «общая энтропия молекулы при 300 К, деленная на число атомов ». Тем не менее, для нескольких групп соединений предсказание удерживания с помощью QSRR достаточно надежно для целей идентификации, особенно когда нет лучшей альтернативы ( таблицы 2 и 3 ).
Структурные дескрипторы обычно получают методами вычислительной химии для оптимизированных по энергии конформаций. Были разработаны программные системы, которые производят и обрабатывают сотни квантово-химических, молекулярных моделей, топологических и полуэмпирических аддитивно-конститутивных дескрипторов после создания эскиза молекулы на компьютере. Соблюдая все правила и рекомендации для значимой статистики, выбирается минимальное количество дескрипторов (некоррелированных), которые необходимы для создания уравнения QSRR с хорошей предсказательной способностью.Дескрипторы, которые в конечном итоге служат для предсказания удержания новых аналитов, иногда имеют неясное физическое значение. Например, трудно придать определенный физический смысл таким дескрипторам, указанным в прогнозном QSRR как «площадь поверхности положительно заряженной части молекулы, деленная на общую площадь поверхности» или «общая энтропия молекулы при 300 К, деленная на число атомов ». Тем не менее, для нескольких групп соединений предсказание удерживания с помощью QSRR достаточно надежно для целей идентификации, особенно когда нет лучшей альтернативы ( таблицы 2 и 3 ). Примерные прогнозные QSRR относятся к полихлорированным дибензофуранам и бифенилам; анаболические стероиды, стимуляторы и наркотики, используемые в качестве допинговых агентов; производные барбитуровой кислоты; полиароматические и нитрованные ПАУ; и т. д.
Примерные прогнозные QSRR относятся к полихлорированным дибензофуранам и бифенилам; анаболические стероиды, стимуляторы и наркотики, используемые в качестве допинговых агентов; производные барбитуровой кислоты; полиароматические и нитрованные ПАУ; и т. д.
Таблица 2. Модель QSRR, учитывающая удержание в обращенной фазе ВЭЖХ 124 запрещенных веществ, перечисленных Всемирным антидопинговым агентством (WADA), полученная с использованием молекулярных дескрипторов, определенных в таблице 3
| t HS F5 = 9.67 (± 1,16) R2p + 3,67 (± 1,14) BELe6 + 1,70 (± 0,15) ALogP R = 0,97, R 2 = 0,95, Radj2 = 0,95, F = 778 RMSE = 3,45, p. & lt; 0,05, Н НАБОР = 124 QLOO2 = 0,94, QS LOO = 3,49 QLMO2 = 0,93, QS LMO = 4,03, N LMO = 14 QEXT2 = 0,93, QS EXT = 3.  69, N EXT = 22 69, N EXT = 22 |
N — количество соединений, включенных в (обучающий (TS) / внешний (EXT)) наборы данных; R , коэффициент корреляции; R 2 , квадрат коэффициента корреляции; R adj 2 , скорректированный квадрат коэффициента корреляции; RMSE — среднеквадратичная ошибка; F , коэффициент дисперсии; p , значимость переменных в модели; и Q LOO 2 , Q LMO 2 и Q EXT 2 , коэффициенты корреляции из соответствующих методологий валидации.
На основании данных Goryński, K .; Бойко, Б .; Новачик, А .; Buciński, A .; Pawliszyn, J .; Калисзан, Р. Анал . Хим. Acta 2013 , 797 , 13–19.
Таблица 3. Молекулярные дескрипторы, используемые в модели QSRR, описанной в Таблица 2
| Символ | Блок | Определение |
|---|---|---|
| R2p | GETAWAY | атомные поляризуемости |
| BELe6 | Дескрипторы собственных значений нагрузки | Наименьшее собственное значение n. 6 матрицы Бердена, взвешенной по атомным электроотрицательностям Сандерсона 6 матрицы Бердена, взвешенной по атомным электроотрицательностям Сандерсона |
| ALogP | Молекулярные свойства | Коэффициент распределения октанол Гхош – Криппена – вода |
Получено из Todeschini, R .; Consonni, V. Справочник по молекулярным дескрипторам ; Wiley-VCH: New York, 2008.
Существуют QSRR с полезной прогностической силой, которые содержат только физически интерпретируемые термины. ВЭЖХ с обращенной фазой удержание простых ароматических растворенных веществ на типичных колонках с октадецил силикагелем было связано с дескриптором молекулярной объемности (полная энергия), дескриптором полярности (локальный диполь) и энергией наивысшей занятой молекулярной орбитали (ВЗМО) аналитов.Хороший прогноз удерживания около 50 ароматических кислот методом жидкостной хроматографии был осуществлен с использованием в качестве регрессоров вычисленного теоретического логарифма коэффициента распределения n -октанол – вода (log P ), дипольного момента, главных осей эллипсоида, суммы зарядов на атомах кислорода и азота, энергии ВЗМО и электрофильной сверхделокализуемости ароматического атома углерода.
Рисунок 3 иллюстрирует прогнозирующую производительность QSRR для 216 точек данных удерживания ВЭЖХ.Точки даны для 36 аналитов, хроматографированных в шести элюентах на неподвижной фазе диола. Элюантами служил гептан, содержащий 0,5% тетрагидрофурана, диоксана, этанола, пропанола, октанола и диметилформамида. В , рис. 3 , экспериментально измеренные данные log k нанесены на график против значений, предсказанных уравнением [9]:
Рисунок 3. График log k , предсказанный уравнением [9], против экспериментальных данных, определенных на диоле. колонка для 36 производных халкона с гептановым элюентом, содержащим 0.5% тетрагидрофуран, диоксан, этанол, пропанол, октанол или диметилформамид.
Перепечатано с разрешения Azzaoui, K .; Morin-Allory, L. Chromatographia 1996 , 42 , 389–395. Авторское право Friedrich Vieweg & amp; Sohn.[9] logk = 0,100поляризуемостьаналит − 0,400logPanalyte − 0,330EHOMOanalyte + 1,106EHOMOeluant + 0,401ELUMOeluant
со значениями n = 216, R = 0,97, с = 0,097 = и 1 F. В этом уравнении n — количество точек данных, используемых для вывода уравнения регрессии, R — коэффициент множественной корреляции, s — стандартная ошибка оценки, а F — значение F — проверка значимости; E LUMO обозначает энергию низшей незанятой молекулярной орбитали, а E HOMO обозначает энергию HOMO.
В этом уравнении n — количество точек данных, используемых для вывода уравнения регрессии, R — коэффициент множественной корреляции, s — стандартная ошибка оценки, а F — значение F — проверка значимости; E LUMO обозначает энергию низшей незанятой молекулярной орбитали, а E HOMO обозначает энергию HOMO.
Рисунок 3 реалистично отражает фактическую прогностическую силу QSRR.Прогнозирующие уравнения QSRR обычно применяются в семействе аналитов, для которого они были получены, и могут использоваться для предварительной идентификации хроматографических пиков.
В последние годы для построения трехмерной модели QSRR для прогнозирования данных удерживания применялся метод трехмерной количественной взаимосвязи между структурой и биологической активностью, известный как сравнительный анализ молекулярного поля (CoMFA). Модель CoMFA 3-D QSRR получается путем систематического отбора проб стерических и электростатических полей, окружающих набор молекул аналита, и последующего сопоставления различий в этих полях с соответствующими различиями в удерживании.
 Горят синим пламенем, выделяя большое количество тепла
Горят синим пламенем, выделяя большое количество тепла
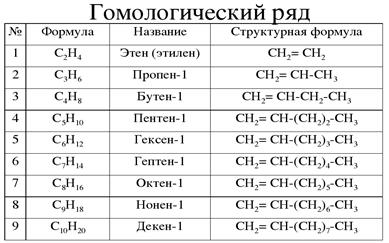 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.