Тема №17 «Алкены» | CHEM-MIND.com
Алкены
Оглавление
- Непредельные углеводороды
- Строение алкенов
- Гомологический ряд алкенов
- Изомерия и номенклатура алкенов
- Физические свойства алкенов
- Химические свойства алкенов
- Шпаргалка
- Задания для самопроверки

Непредельные углеводороды
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения

Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло).
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной.

Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π-связи.
Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь, располагаются перпендикулярно плоскости молекулы.
Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

www.chem-mind.com
Алкены. Строение, номенклатура, изомерия и физические свойства
На уроке вы начнете изучать новый гомологический ряд углеводородов, который относится уже к непредельным углеводородам. Тема: «Алкены. Строение, номенклатура, изомерия и физические свойства». Вы узнаете о том, что представляют собой алкены: строение алкенов и их физические свойства, а также изомерия и номенклатура.
Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4:
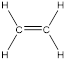
Двойную связь обозначают с помощью суффикса —ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
CH3-CH2-CH2-CH=CH-CH3
гексен-2 (гексен-4)
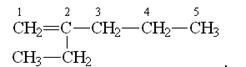
2-этилпентен-1
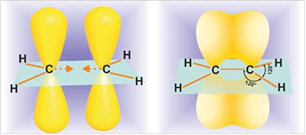
Рис. 1. Строение этилена
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью. Рис. 2. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. Рис. 3. В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
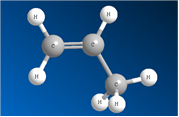
Рис. 2. Модель молекулы этена
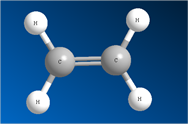
Рис. 3. Модель молекулы пропена
1. Изомерия углеродного скелета.
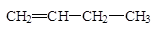 |
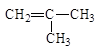 |
| бутен-1 | 2-метилпропен |
2. Изомерия положения двойной связи.
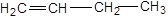 |
 |
| бутен-1 | бутен-2 |
3. Межклассовая изомерия (с циклоалканами)
Тема №15 «Алканы» | CHEM-MIND.com
Оглавление
- Строение алканов
- Гомологический ряд метана
- Изомерия и номенклатура
- Физические свойства
- Химические свойства
- Шпаргалка
- Задания для самопроверки
 Строение алканов
Строение алканов
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле CnH2n+2. В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации.
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109° 28′. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентан.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи. Связи углерод — углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм (1,54 • 1010 м). Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.

Гомологический ряд метана
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
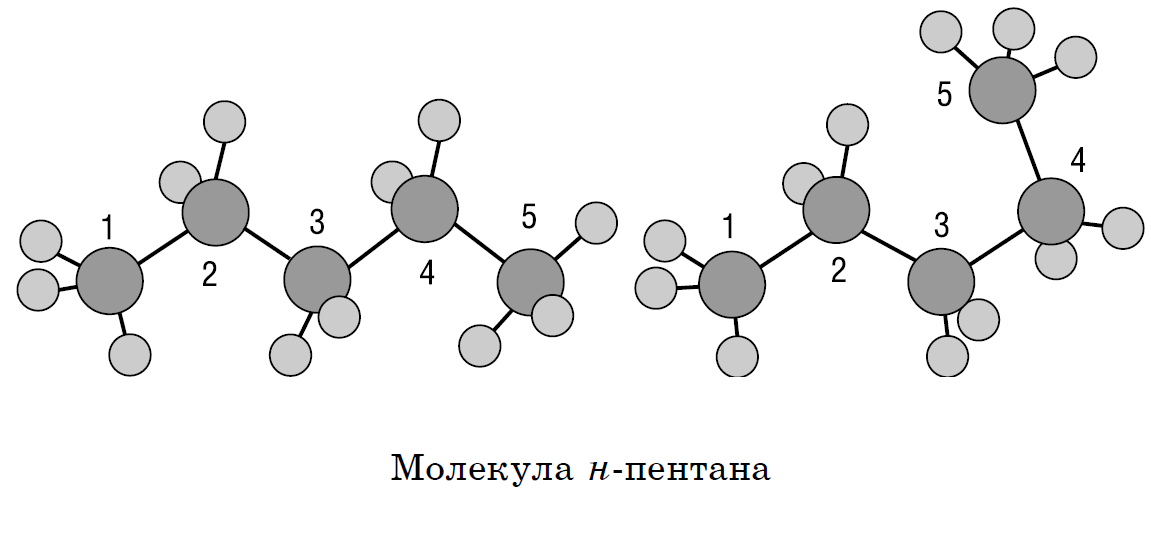

Предельные углеводороды составляют гомологический ряд метана.

Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от дру
www.chem-mind.com
Алкены — номенклатура, получение, характерные химические свойства » HimEge.ru
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Строение этилена
Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
himege.ru
Химические свойства алкенов | CHEMEGE.RU
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
| Например, уравнение сгорания пропилена: |
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
| Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен |
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Поделиться ссылкой:
chemege.ru
Урок по теме «Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов». 10-й класс
Цели урока:
- изучить строение алкенов; выявить их существенные отличия от алканов; рассмотреть виды изомерии алкенов;
- основываясь на особенностях строения, спрогнозировать химические свойства алкенов.
Задачи.
Образовательные – познакомить учащихся с гомологическим рядом алкенов, рассмотреть особенности их строения, изомерию и номенклатуру. Развить представления об изомерии на примере алкенов и умение давать названия соединений по систематической номенклатуре.
Воспитательные – продолжить формирование мотивации учебной деятельности, продемонстрировать значимость знаний строения веществ для объяснения их свойств.
Развивающие – на основе теоретических знаний развивать умения учащихся сравнивать, анализировать, обобщать, логически рассуждать, устанавливать взаимосвязь строения и свойств веществ.
Тип урока: урок формирования новых знаний.
Оборудование:
1. Комплект для построения шаростержневых моделей молекул.
2. Таблица “Схема образования молекулы этилена”.
3. Раздаточный материал: Таблица 1 “Гомологический ряд алкенов”, таблица 2 “Номенклатура алкенов”, таблица 3 “Количественные характеристики химических связей”, таблица “Строение молекулы этилена”.
4. Презентация по теме “Алкены”.
Ход урока
I. Организационный этап урока – проверка готовности учащихся к уроку, приветствие, положительный настрой на урок.
II. Актуализация знаний
На предыдущем уроке мы с вами обобщили знания о предельных углеводородах. Нам необходимо вспомнить основные понятия.
Работа учащихся на местах:
— Из перечисленных веществ выпишите формулы предельных УВ (на доске записаны формулы : C4H8, CH4, C5H12, C2H4, C3H6, C7H16, C8H18, C8H16, C5H10) и дайте им названия. (Проверка по слайду №1)
— Как иными словами мы называли данные УВ? (Насыщенные, алканы)
— Какова их общая формула? (CnH2n+2)
— Какой вид изомерии характерен для данных УВ? (Изомерия углеродного скелета)
— Назовите вещества (проверка слайд № 2):
Один учащийся тем временем решает задачу у доски на вывод химической формулы:
Задача. Выведите молекулярную формулу УВ, если известно, что массовая доля углерода в данном веществе составляет 87,5%, массовая доля водорода – 14,3%. Плотность данного вещества по водороду равна 14.
(Ответ: C2H4)
III. Мотивация и постановка учебной задачи.
Будет ли УВ, формулу которого мы вывели в задаче относится к предельным УВ? Почему? (Не отвечает общей формуле алканов). К какому классу УВ его можно отнести? Напишите структурную формулу данного УВ, исходя из того, что валентность углерода в органических соединениях равна четырём.
Является ли данный УВ насыщенным?
Данный УВ не является насыщенным. Данный УВ используют широко для обработки фруктов и овощей, чтобы ускорить их созревание. Сегодня его широко применяют для получения многих видов пластмасс. Как вы думаете о каком веществе идет речь? Это этилен.
IV. Открытие нового знания
Какова же тема урока?
Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов.
Запись темы в тетрадь.
Постановка целей урока
| Фронтальная беседа. Раскройте сущность термина “непредельные углеводороды”. Составьте, используя понятие гомологи, гомологическая разность, гомологический ряд алкенов. Может ли гомологический ряд алкенов начинаться с УВ, в состав которого входит только один атом углерода. Почему? Какова общая формула гомологического ряда алкенов? Попробуйте сформулировать определение, какие углеводороды называются алкенами? |
Учитель записывает на
доске молекулярную формулу этилена. Учащиеся, используя понятие гомологи составляют несколько формул ближайщих гомологов этилена и на основании записанных формул выводят общую формулу гомологического ряда алкенов. Определение “алкены” и общую формулу гомологического ряда алкенов записывают в тетрадь. |
| Работа в парах. Задание 1. Подчеркните формулы веществ, которые можно отнести к алкенам: С4Н8, СН4, С5Н12, С2Н4, С3Н4, С7Н16, СН2, С6Н6, С8Н16, С5Н10. Назовите алкены (по аналогии с алканами, изменяя -ан на –ен) |
Учащиеся получают на
печатной основе задания, выполняют эти задания и
проверяют по образцу. Далее учащиеся успешно
справившиеся с заданием, объясняют правильность выполнения задания. В помощь учащимся предлагается таблица № 1 (названия алкенов по ИЮПАК и тривиальные названия) |
Однако данные названия не отражают строение данных УВ.
| Задание 2. Работа в
парах. Рассмотрите содержание таблицы 2 “Номенклатура алкенов”. Попробуйте сформулировать алгоритм по составлению названий у алкенов. Проверка правильности составления алгоритма (с помощью учителя) |
Работа над
составлением алгоритма формирует такие способы
познавательной деятельности как
системно-информационный анализ, моделирование, перевод информации из знаковой системы в словесную, используя химический язык. |
||||||||||
| Задание 3. Работа в
парах. Дайте названия следующим углеводородам по систематической номенклатуре: Как выполнить обратное действие, т.е. составить формулу по названию? (алгоритм даёт учитель) Задание 4. Напишите структурные формулы
следующих алкенов: |
Используя алгоритм,
составленный в предыдущем задании, учащиеся
называют алкены (проверка по эталону – образцу,
слайд № 3). Проверка по образцу (слайд № 4). Объяснение правильности выполнения задания |
||||||||||
| Фронтальная беседа,
направленная на изучение строения алкенов. Какие виды химической связи образуют двойную связь? Что такое сигма-связь, что такое пи-связь? За счет перекрывания каких орбиталей образуется сигма- связь, пи-связь в молекуле этилена? |
Для ответов на вопрос
используют таблицу № 3 “Количественные
характеристики химической связи”, плакат
“Строение молекулы этилена”. В ходе фронтальной беседы у учащихся формируется умение работать с различными источниками для получения химической информации, совершенствование умения объяснять строение веществ, используя язык химии. |
||||||||||
| Рассмотрите таблицу 3 и
ответьте на следующие вопросы: Какая связь прочнее: двойная или одинарная? Подтвердите характеристиками. Какая связь прочнее: сигма или пи? Какая связь будет разрываться в первую очередь? Какой тип реакции будет характерен для алкенов? Задание 5. Индивидуальная работа. Соберите модели молекул этилена, пропилена и
ответьте на вопросы: |
Данное задание
является проблемной задачей, для решения которой
ученикам необходимо использовать способ
исследования проблемных ситуаций, выдвижение
предположений, приведение доказательства
выдвигаемых предположений, оно продолжает
формировать у учащихся умение устанавливать
причинно-следственные связи и прогнозировать
химические свойства, основываясь на знании
строения вещества. Для выполнения данного задания учащиеся составляют шаростержневые модели структурных формул алкенов, При этом развиваются умение моделировать и объяснять строение алкенов. |
||||||||||
| Фронтальная работа. Что такое изомеры? Какие виды изомерии характерны для алкенов? Задание 7. Работа по учебнику стр. 34. Заполните таблицу “Виды изомерии алкенов”
Все ли алкены имеют геометрические изомеры? Каково необходимое и достаточное условие существования у алкена цис-, транс-изомеров? Напишите структурные формулы веществ: |
После фронтального
обсуждения учащиеся самостоятельно заполняют
таблицу. Данное задание является проблемной задачей, для решения которой ученикам необходимо использовать способ исследования проблемных ситуаций, выдвижение предположений, приведение доказательства выдвигаемых предположений. Запись на доске и в тетради (если необходимо, помогает учитель) |
V. Закрепление
Закрепление осуществляется в ходе выполнения учащимися самостоятельной тестовой работы с самопроверкой по эталону.
1. Вставьте в текст соответствующие слова и символы из скобок “Алкенами называются УВ, содержащие в молекуле одну…. (одинарную, двойную, тройную) связь и имеющие общую формулу …. (СnН2n+2, СnН2n, СnН2n-2). Длина углерод-углеродной связи в этилене ….(больше, меньше), чем в этане, и равна ….(0,154 нм, 0,120 нм, 0,134 нм)
2./ Двойная связь в алкенах состоит из:
А) одной сигма- и одной пи- связи
Б) двух пи-связей
В) двух сигма-связей
Г) верного ответа среди перечисленных нет
VI. Подведение итогов, рефлексия.
| С чем вы познакомились сегодня на
уроке? Что нового узнали? Что вызвало
затруднение? Какие способы вы использовали при выполнении различных заданий? |
Рефлексия позволяет увидеть, как оценивают учащиеся то, чему, каким действиям и обобщённым умениям они научились или учатся. |
VII. Домашнее задание. 1-2 мин.
Параграф 4 до стр.35, Упр.1,2. Задача 7, 8 (на выбор).
Раздаточный материал к уроку. (Приложение 2)
urok.1sept.ru
Конспект урока химии «Алкены. Гомологический ряд»
Тема урока: Электронное и пространственное строение алкенов, гомологический ряд алкенов. Номенклатура и изомерия алкенов.
Цели урока: Рассмотреть электронное и пространственное строение алкенов, гомологический ряд алкенов, на примере этилена показать новый вид изомерии, формировать навыки учащихся в составлении формул алкенов, умении называть вещества, изучить области применения ацетилена.
Оборудование: карточки с заданиями, модели алканов, циклоалканов, алкенов, презентация к уроку «Применение ацетилена и его гомологов».
Ход урока.
Орг. момент.
Приветствие, готовность к уроку, наличие тетрадей, учебников, текстов для работы, чистые листочки для самостоятельной работы)
Учитель объявляет Тему и цель урока.
МОТИВАЦИЯ: Зачем я принесла на урок ЯБЛОКО? (Учащиеся делают предположения, учитель: «Ответ мы узнаем в конце урока»
АКТУАЛИЗАЦИЯ: (вопр. по ТЕКСТУ)
Ответить на вопросы:
Раскрыть Первое и Второе положения теории химического строения органических веществ А. М. Бутлерова.
Дать определение алканов.
Раскройте понятие гомологический ряд?
Гомологи- ?
Перечислить названия алканов.
Общая формула алканов?
Общая формула циклоалканов.
Перечислить названия циклоалканов.
Изомерия- ?
Изомеры- ?
Назовите Правила составления названий органических веществ.
(МЫ ПОВТОРИЛИ ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ, КОТОРЫЕ ИСПОЛЬЗУЕМ СЕГОДНЯ НА УРОКЕ)
ПЛАН УРОКА.
Номенклатура.
Гомологический ряд алкенов.
Общая формула.
Определение класса алкенов.
Структура.
Электронная формула.
Изомерия алкенов.
Применение алкенов. Просмотр презентации.
Домашнее задание. § 9. Определения выучить. Стр. 43. Упр. 2, 4, 6, 8, 9
Номенклатура.
УЧ- ЛЬ: Новое знакомство обычно начинается с имени. Выясним имена наших новых знакомых.
Как составляются названия алкенов по систематической номенклатуре? (обратимся к вашему тексту)
УЧ- СЯ: По СИСТЕМАТИЧЕСКОЙ номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.), общее название углеводородов данного ряда алкены, но за этиленом и пропиленом сохранились старые названия.
УЧ- ЛЬ: Заполним таблицу. ГОМОЛОГИЧЕСКИЙ РЯД. (Фронтальная работа)
2. Гомологический ряд.
алканы
алкены
Название
Молекулярная формула
Название
Молекулярная формула
этан
С2Н6
Этен (этилен)
С2Н4
пропан
С3Н8
пропен (пропилен)
С3Н6
бутан
С4Н10
бутен
С4Н8
пентан
С5Н12
пентен
С5Н10
децен
ВЫВОД:
4. Определение: АЛКЕНЫ- углеводороды с общей формулой______________
Вспомним общую формулу циклоалканов: (ЗАПОМНИМ ЭТО)
УЧ- ЛЬ: 5. Структура.
Подробнее рассмотрим строение этилена (этена).
ДЕМОНСТР.: шаростержневая модель этана.
Превращаем в этилен. (ДВОЙНАЯ СВЯЗЬ)
Простейшим алкеном является этилен — C2H4
Структурная и электронная формулы этилена имеют вид:
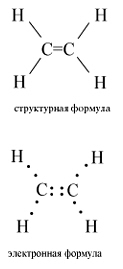
УЧ- СЯ: Найти полное определение в учебнике. Прочитать. Выучить дома.
УЧ- СЯ:
Запомните!
SP2 –гибридизация:
1) Плоское строение
2) Угол – HCH — 120°
3) Длина (-С=С-) связи – 0,134 нм
4) Связи — σ, П
5) Невозможно вращение относительно (-С=С-) связи
УЧ- СЯ: Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака П — связь не разомкнулись.
УЧ- ЛЬ: 7. Изомерия алкенов
Гомологи:
СH2=CH2 этен
СH2=CH—CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2—СН3 пентен-1
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии — изомерия положения кратной связи и межклассовая изомерия.
Во-вторых, в ряду алкенов проявляется пространственная изомерия, связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
РАБОТА В ПАРАХ:
Структурная изомерия алкенов
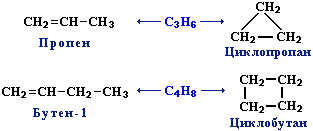
1. Изомерия углеродного скелета (начиная с С4Н8):

2. Изомерия положения двойной связи (начиная с С4Н8):

3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис—транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс-изомере.
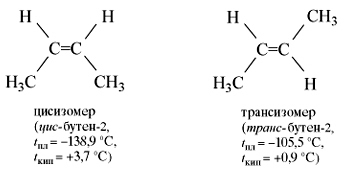 ,
,
После подготовки уч-ся у доски отвечают по своей работе. (4 ученика)
Зачем же я принесла ЯБЛОКО? (этилен- естественный фактор созревания)
(Этилен синтезируется в бактериях, грибах, низших и высших растениях, причем в больших количествах, это естественный фактор созревания, растения на стадии созревания плодов образуют этилен. Народное средство, ускоряющее процесс созревания, — окуривание дымом. Действующее начало в дыме — этилен.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; Закончившие рост, но еще зеленые плоды, помещали в герметические камеры при температуре 20 — 22о С. В эти камеры периодически подается этилен из расчета 0,2 — 1 литр на 1 м3 . Конкретное количество этилена зависит от вида плодов)
Осенний листопад- это тоже процесс с участием этилена.
Применение алкенов. Просмотр презентации.
Закрепление материала
Алгоритм составления названий.
Номеруем самую длинную цепь с того конца, где ближе двойная связь
Называем радикалы, начиная с простейшего, указываем их число и местоположение.
Называем самую длинную цепь.
Указываем месторасположение двойной связи цифрой в конце названия через дефис.
Самостоятельная работа. ( по вариантам)
Вар-т №1.
Вар-т №2.
ВЫВОД ПО УРОКУ: (делают уч-ся по вопросам из схемы урока).
Алкены- ?
Общая ф-ла-?
Виды изомерии-?
Что можете добавить?
ИТОГИ УРОКА.
УЧ-ЛЬ:
Рассмотрели новый класс соединений, продолжим со свойствами знакомиться на последующих уроках.
Оценка за С. Р. будет выставлена с учетом вашей работы на уроке.
Домашнее задание у вас записано в ТЕКСТАХ к уроку. § 9. Определения выучить. Стр. 43. Упр. 2, 4, 6, 8, 9
infourok.ru