Марганцовая кислота: применение и свойства
Марганцовая кислота является неорганическим нестабильным соединением с формулой HMnO4. Ее нельзя спутать ни с каким другим веществом, поскольку ей свойственен яркий, насыщенный фиолетово-красный цвет.
Это сильный электролит, в котором молекулы (электрически нейтральные частицы) практически полностью диссоциированы на ионы. При том что существует она лишь в растворах, ибо как отдельное вещество не получена. Впрочем, обо всех ее особенностях можно рассказать и подробней.
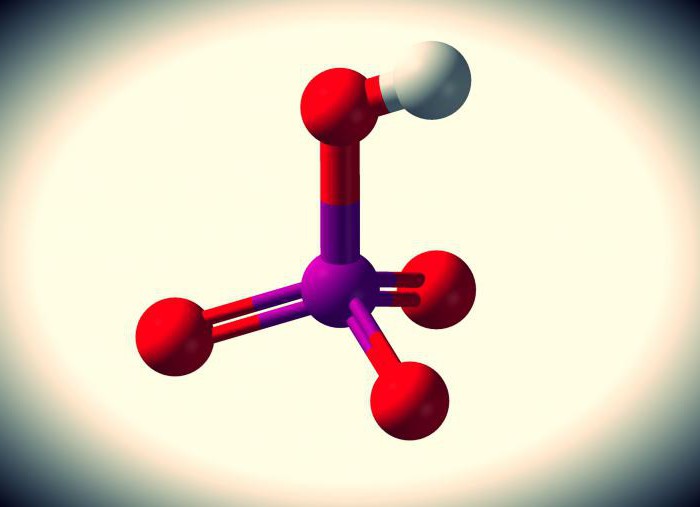
Химические свойства
B жидкостях марганцовая кислота постепенно разлагается. Данный процесс сопровождается выделением кислорода (халькоген, химически активный неметалл).
Вследствие этого образуется осадок диоксида марганца. Вот как выглядит данный процесс с участием марганцовой кислоты в формуле: 4HMnO4 → 4MnO2↓+ 3О2↑+ 2Н2О.
Получившееся соединение — это MnO2. Темно-коричневый порошок, который не растворяется в воде. Является самым устойчивым соединением марганца, который относится к группе черных металлов.
Также рассматриваемое соединение демонстрирует особенности, являющиеся общими для сильных кислот. В частности, вступает в реакции нейтрализации — взаимодействует со щелочами, образуя соли и воду. Как правило, подобные процессы экзометричны, то есть сопровождаются выделением теплоты. Вот один из примеров: HMnO4 + NaOH → NaMnO4 +Н2О.
Еще стоит упомянуть, что марганцовая кислота, как и ee перманганаты (соли), является мощным окислителем, акцептором электронов. Вот пример, демонстрирующий это: 2HMnO4 + 14HCl → 2MnCl2 + 5Cl2↑+ 8H2O.

Физические свойства
Как было сказано ранее, марганцовая кислота, графическая формула которой показана выше, в чистом виде не выведена. Максимальная концентрация в водных растворах, имеющих характерную ярко-сиреневую окраску, не превышает 20%.
Данное вещество восприимчиво к показателям температуры. Если она будет меньше 20 °C, то раствор образует кристаллогидрат – твердое тело, возникающее вследствие связи катионов (положительно заряженных ионов) и молекул воды. Его формула такова: HMnO4 ⋅ 2Н2О. Ионное строение: (Н5О2)+ (MnO4)–.
Также, говоря о физических свойствах марганцовой кислоты, стоит отметить ее молярную массу. Она составляет 119,94 г/моль.
Получение кислоты
Наиболее часто данное вещество получают посредством проведения реакции между двумя соединениями – разбавленной серной кислоты и раствора перманганата бария, элемента с высокой хим.активностью. B результате выпадает нерастворимый осадок его сульфата. Но он удаляется посредством фильтрации. Выглядит это так: Ва (MnO4) + H2SO4 → 2HMnO4 + BaSO4↓.
Есть и другой способ получения данной кислоты. Он основан на происходящем на холоде взаимодействии воды и оксида марганца. Это, кстати, маслянистая жидкость, бывающая двух оттенков (буро-зеленого или алого). Каким бы ни был цвет, всегда будет присутствовать металлический блеск. He устойчив при комнатной температуре. А при соединении c горючими веществами воспламеняет их, нередко co взрывом. Так вот, формула реакции выглядит так: Mn2O7 + H2O → 2HMnO4.

Характеристика диоксида
Это вещество, которое уже было упомянуто выше, в большом количестве содержится в земной коре. B виде минерала под названием пиролюзит. Обычно черного или серо-стального цвета. Его кристаллы мелкие, имеют столбчатый или игольчатый облик. Для минерала характерны следующие свойства:
- Пьезоэлектрические. Проявляются в возникновении поляризации диэлектрика – смещении в нем связанных зарядов или поворотом электрических диполей.
- Полупроводниковые. Проявляются в увеличение электрической проводимости c ростом температуры.
Также стоит отметить, что диоксид растворим в соляной кислоте, что сопровождается выделением хлора.
Применение пиролюзита
Электролитический диоксид марганцовой кислоты нашел широкое применение в производстве батарей и гальванических элементов – химических источников электротока, которые обычно основаны на взаимодействии двух металлов или их оксидов в электролите. Также его используют для:
- Образования катализаторов – химических веществ, ускоряющих реакцию, но не входящих в ее состав. Яркий пример – гопкалит. Им заполняют дополнительные патроны к противогазам для защиты от монооксида углерода.
- Образования таких веществ, как марганцовая соль и калиевый перманганат – кристаллов темно-фиолетого, практически черного цвета, которые, растворяясь в воде, приводят к образованию жидкость ярко-малинового оттенка. Формула — KMnO4.
- Обесцвечивания зеленых стекол.
- Изготовления масла и олифы в лакокрасочном производстве.
- Для выделки хромовых кож в кожевенной сфере.
Интересно, что учеными было определено – кусочки пиролюзита из находящейся в южной Франции пещеры Пеш-де-Лазе состоят из чистого диоксида марганца. Считается, что неандертальцы, жившие 350—600 тысяч лет назад, использовали его как катализатор и окислитель реакций горения и окисления.

Перманганат (марганцовка)
Многим знакомо это вещество. Однако o его применении – чуть позже. Важнее отметить, что именно c помощью перманганата протекают многие ОВР марганцовой кислоты (окислительно-восстановительные реакции).
Это обусловлено его исключительными химическими свойствами. B зависимости от водородного показателя (рН) раствора, образованного перманганатом, можно окислить разные вещества, с восстановлением до соединений многих степеней окисления.
Примеров множество. B кислой среде произойдет восстановление до соединений марганца (II), в нейтральной показатель будет равен (IV), a в сильно щелочной – (VI). Вот как это выглядит:
- B кислой среде: 2KMnO4 +5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 +3Н2О.
- B нейтральной: 2KMnO4 + 3K2SO3 + Н2О → 3K2SO4 + 2MnO2 + 2KOH.
- B щелочной: 2KMnO4 + K2SO3 + 2КОН → K2SO4 + 2K2MnO4 + Н2О. Данная реакция в таком виде происходит при недостатке восстановителя и в присутствии высококонцентрированной щелочи. Такие условия обеспечивают замедление гидролиза.
Стоит отметить, что при контакте с концентрированной серной кислотой вещество взрывается. Ho если перманганат аккуратно соединить c этим холодным веществом, то образуется неустойчивый оксид марганца.

Использование марганцовки
Перманганат обсуждаемого вещества обладает мощным антисептическим действием. Особо широко в медицине применяются разбавленные растворы с концентрацией 0.1%, которые использую для обработки ожогов, полоскания горла и промывания ран. Еще это эффективное рвотное средство при отравлении такими алконидами, как аконитин и морфин. Только в таких случаях используют менее концентрированный раствор, разведенный до 0.02-0.1 %.
Фармакологическое действие оказывается нетипично. Когда раствор соприкасается c органическими веществами, выделяется атомарный кислород. Оксид, входящий в его состав, c белками образует такие соединения, как альбуминаты. В малых концентрациях они оказывают вяжущее действие, а в больших – раздражающее, дубящее и прижигающее. Поэтому итоговый эффект зависит от того, как будет разбавлен перманганат марганцовой кислоты – сильно или слабо.

Другие сферы применения
Перманганат калия на самом деле является веществом, активно используемым в разных областях. Кроме медицины, его задействуют:
- При отмывке лабораторной посуды. Отлично удаляет жиры и органические вещества.
- B пиротехнике как окислитель.
- При определении перманганатной окисляемости в процессе оценки качества воды по ГОСТ 2761-84 (метод Кубеля).
- При тонировании фотоснимков.
- Для травления дерева. Жидкость используется как морилка (вещество, придающее цвет).
- Для рискованного выведения тату. Жидкость выжигает кожу, и ткани c краской отмирают. Это больно, a еще остаются шрамы.
- B качестве окислителя в процессе образования пара- и метафталевых кислот.
Напоследок хотелось бы оговориться, что перманганат калия входит в четвертый список прекурсоров российского Постоянного комитета по контролю наркотиков.
fb.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / «Химический алфавит (словарь)» — названия, сокращения, приставки, обозначения веществ и соединений. / / Таблица названий (наименований) кислот и их солей. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
dpva.ru
Перманганат калия — это… Что такое Перманганат калия?
Слева направо (водные растворы): pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия:- в кислой среде:
- в нейтральной среде:
- в щелочной среде:
- в щелочной среде на холоде:
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K 2MnO4 на MnO2 и KMnO4.
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счет этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приемом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на нее анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Гиперчувствительность.
Побочные действия
Аллергические реакции, при использовании концентрированных растворов — ожоги и раздражение. Передозировка. Симптомы: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отечная, темно-коричневого, фиолетового цвета, возможен отек гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и одышкой. Смертельная доза для детей — около 3 г, для взрослых — 0.3-0.5 г/кг. Лечение: метиленовый синий (50 мл 1 % раствора), аскорбиновая кислота (в/в — 30 мл 5 % раствора), цианокобаламин — до 1 мг, пиридоксин (в/м — 3 мл 5 % раствора).
Способ применения и дозы
Наружно, в водных растворах для промывания ран (0.1-0.5 %), для полоскания рта и горла (0.01-0.1 %), для смазывания язвенных и ожоговых поверхностей (2-5 %), для спринцевания (0.02-0.1 %) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Взаимодействие
Химически несовместим с некоторыми органическими веществами (уголь, сахар, танин) и легкоокисляющимися веществами — может произойти взрыв.
Другие сферы применения
- Применяется для определения перманганатной окисляемости при оценке качества воды согласно ГОСТ 2761-84 по методу Кубеля [1].
- Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ.
- Растворы (концентрации примерно 3 г/л) широко применяются при тонировании фотографий.
- В пиротехнике применяют в качестве сильного окислителя.
- Применяют в качестве катализатора разложения перекиси водорода в космических жидкостно-ракетных двигателях.
- Водный раствор перманганата калия используется для травления дерева, в качестве морилки.
- Водный раствор применяется также для выведения татуировок. Результат достигается посредством химического ожога, при котором отмирают ткани, в которых содержится красящее вещество. Данный метод немногим отличается от простого срезания кожи, обычно он менее эффективен и более неприятен, так как ожоги заживают намного дольше. Татуировка не удаляется полностью, на ее месте остаются шрамы.
- Перманганат калия или бихромат натрия используются в качестве окислителя при получении мета- и парафталевые кислот из мета- и параксилолов соответственно. (См. Терефталевая кислота)
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Галерея
Порошок перманганата калия
(под микроскопом)
Примечания
Литература
- Вульфсон Н. С. — Препаративная органическая химия с.656,657
- Казанский Б. А. (ред.) — Синтезы органических препаратов (Сборник 3) с.145
- Реми Г. — Курс неорганической химии (Том 1) с.817
См. также
Ссылки
Wikimedia Foundation. 2010.
dic.academic.ru
Химические свойства и способы получения кислот
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
2HI— + 2Cu+2 Cl2 → 2HCl + 2Cu+Cl + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
5. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействет с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
6. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
7. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Поделиться ссылкой:
chemege.ru
Классификация и характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка ( ), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака  две стрелки
две стрелки  . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH  CH3COO— + H+
CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4  H+ + H2PO4—
H+ + H2PO4—
H2PO4—  H+ + HPO42-
H+ + HPO42-
HPO42-  H+ + PO43-
H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn  ZnSO4 + H2
ZnSO4 + H2
2HCl + Fe  FeCl2 + H2
FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO  ZnSO4 + H2O
ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH  H2O + NaCl
H2O + NaCl
3H2SO4 + 2Al(OH)3  Al2(SO4)3 + 6H2O
Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
CH3COONa + SO2↑ + H2O
HCOONa + HCl  HCOOH + NaCl
HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2  3S↓+ 2H2O
3S↓+ 2H2O
scienceforyou.ru
Перманганат калия | Контроль Разума
Калия перманганат (распространённое название в быту — марганцовка) (лат. Kalii permanganas) — калиевая соль марганцевой кислоты (KMnO4).
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
2MnO2 +3 Cl2 + 8KOH → 2KMnO4 + 6KCl + 4H2O
2K2MnO4 + Cl2 → 2KMnO4 + 2KCl
3K2MnO4+2H2O → 2KMnO4+ MnO2 + 4KOH
2K2MnO4 + 2H2O → 2KMnO4 +H2↑ + 2KOH
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Физические свойства Править
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления σ 1,59 (при 20°C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
Термодинамические свойства Править
Химические свойства Править
Сильный окислитель. Стандартные окислительно-восстановительные потенциалы приведены в таблице.
В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия:
в кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
в нейтральной среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
в щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O, KMnO4 + K2SO3 + KOH → K2SO4 + K3MnO4 + H2O (на холоду)
Однако надо отметить, что в последняя реакция (в щелочной среде) идёт по указаной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
2KMnO4 + 2H2SO4 → 2KHSO4 + Mn2O7 + H2O,при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный
mind-control.fandom.com
Кислоты — классификация, получение и свойства » HimEge.ru
Кислоты — электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H2 + Cl2 = 2HCl,
H2 + S = H2S.
2) Взаимодействие кислотных оксидов с водой
(получают кислородсодержащие кислоты)
SO3 + H2O = H2SO4,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl,
SiO32- + 2H+ = H2SiO3.
4) Электролиз водных растворов солей
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4.
1) Растворы кислот кислые на вкус, изменяют окраску индикаторов:
лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H+ + Cl—.
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H+ + HSO4—,
HSO4— = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-
2) Взаимодействие с металлами
Ca + 2HCl = CaCl2 + H2
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
Cu + 4HNO3 = Cu(NO3)2+ 2NO2↑+2H2O
Cu +2H2SO4 конц = CuSO4+SO2↑ + 2H2O
3) Взаимодействие с основными оксидами
CaO + 2HCl = CaCl2 + H2O
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + 2KOH = K2SO4 + 2H2O,
2H+ + 2OH— = 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O,
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Многоосновные кислоты образуют кислые и средние соли:
H2SO4 + NaOH = NaHSO4 + H2O,
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O,
CO32- + 2H+ = CO2 + H2O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4,
SiO32- + 2H+ = H2SiO3.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn+7O4 + 16HCl— = Cl20 + 2KCl + 2Mn+2Cl2 + 8H2O,
H2S-2 + Br20 = S0 + 2HBr—.
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H2S+4O3 + Cl20 + H2O = H2S+6O4 + 2HCl—.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O,
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O.
himege.ru