ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).

Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т. д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).

Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.

Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
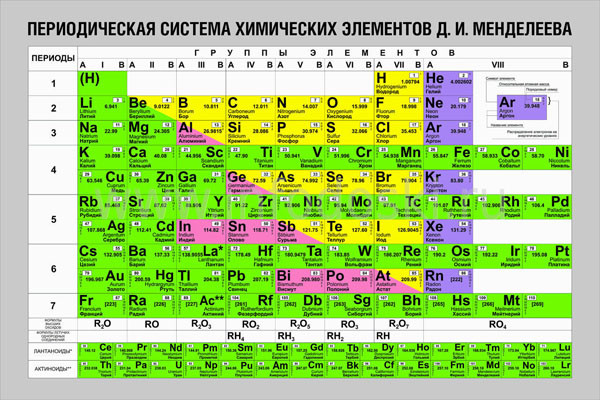
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
bigenc.ru
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.


Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.


Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.


Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
himi4ka.ru
Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона
Тема: Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Урок: Структура Периодической системы химических элементов. Объяснительная и предсказательная функции периодического закона
В начале XX века было открыто строение атома и стало ясно, что

Рис. 1. «Длинная» форма таблицы
Дальнейшее развитие Периодической системы заключалось в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент, 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткой форме таблица изображена на Рис. 2.
1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку. Рис. 1.
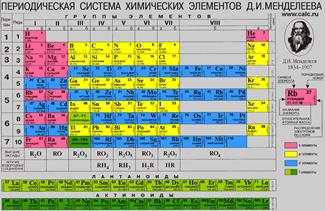
Рис. 2. «Короткая форма»

Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента. Рис. 3.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.

Рис. 4. Вторая группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы. Рис. 4.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.

Рис. 5. Химический элемент бром
Рассмотрим элемент Br. Рис. 5. Его порядковый номер – 35, относительная атомная масса – 80. Находится в 4-ом периоде, в 7-ой главной подгруппе.

Рис. 6. Химический элемент платина
Рассмотрим элемент платину. Рис. 6.
Символ – Pt, порядковый номер – 78, относительная атомная масса – 195. Находится в 6-м периоде, в 8-й побочной подгруппе.
В состав каждой группы входит элементы с одинаковым числом валентных электронов. Следовательно, они будут обладать схожими химическими свойствами.
Это отражается в названии некоторых групп элементов.
— Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
— Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
— Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.
— Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
— 8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
С момента открытия Периодического закона и Периодической системы химических элементов Д.И. Менделеева, химия перестала быть описательной наукой. Теперь при помощи его таблицы можно предсказывать свойства любого химического элемента. Дальнейшее развитие физики и химии полностью подтвердило правоту Д.И. Менделеева, так были открыты семейства инертных газов. Для радиоактивных элементов были сначала описаны свойства, а затем они были получены. Периодический закон и Периодическая система химических элементов Д.И. Менделеева носят фундаментальный характер, являются основным законом природы.
Подведение итога урока
На уроке вы изучили тему «Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона». Вы узнали о значении Периодической таблицы Менделеева, ее функциях и возможностях.
Список литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. 2011. – 176 с.: ил.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. – Дрофа, 2001. – 224 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
3. Hemi.nsu.ru (Источник).
Домашнее задание
1. №№ 193, 194 (с. 143) Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
2. Какие названия имеют некоторые группы химических элементов?
3. Сформулируйте Периодический закон. Чем отличается современная формулировка закона от данной Д.И. Менделеевым?
interneturok.ru
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ | Энциклопедия Кругосвет
Содержание статьиПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ представляет собой классификацию химических элементов в соответствии с периодическим законом, устанавливающим периодическое изменение свойств химических элементов по мере увеличения их атомной массы, связанного с увеличением заряда ядра их атомов; поэтому заряд ядра атома совпадает с порядковым номером элемента в периодической системе и называется атомным номером элемента. Периодическая система элементов оформляется в виде таблицы (периодическая таблица элементов), в горизонтальных рядах которой – периодах – происходит постепенное изменение свойств элементов, а при переходе от одного периода к другому – периодическое повторение общих свойств; вертикальные столбцы – группы – объединяют элементы со сходными свойствами. Периодическая система позволяет без специальных исследований узнать о свойствах элемента только на основании известных свойств соседних по группе или периоду элементов. Физические и химические свойства (агрегатное состояние, твердость, цвет, валентность, ионизация, стабильность, металличность или неметалличность и т.д.) можно предсказывать для элемента на основании периодической таблицы.
В конце 18 и начале 19 вв. химики пытались создавать классификации химических элементов в соответствии с их физическими и химическими свойствами, в частности на основе агрегатного состояния элемента, удельного веса (плотности), электропроводности, металличности – неметалличности, основности – кислотности и т.д.
Классификации по «атомному весу»
(т.е. по относительной атомной массе).
Гипотеза Праута.
В 1805 Дж.Дальтон определил атомные веса нескольких элементов, приняв за единицу атомную массу водорода, а Й.Берцелиус в 1815 значительно уточнил величины атомных весов. Ученые пытались установить простые (целочисленные) соотношения между атомными весами элементов. У.Праут в 1815 предположил, что атомные веса всех элементов связаны простыми кратными отношениями с атомным весом водорода. Но более точные определения атомных весов, выполненные Ж.Дюма и особенно Берцелиусом, а впоследствии и Ж.Стасом, разрушили гипотезу Праута, так как были получены дробные величины атомных весов. И только в начале 20 в., когда стало известно строение атома, идеи Праута возродились.
Триады Доберейнера.
И.Доберейнер в 1816–1829 установил, что для триад сходных элементов, таких, как Cl, Br, I и Ca, Sr, Ba, атомные массы и величины некоторых физических свойств находятся в арифметической прогрессии и для каждого второго элемента свойство можно предсказать как среднее между свойствами двух крайних. Существование такой прямой взаимосвязи для всех элементов казалось вероятным, но количественная оценка была невозможна из-за путаницы между атомными и эквивалентными весами до тех пор, пока С.Канниццаро в 1858 не пересмотрел величины атомных весов.
Октавы Ньюлендса.
Дж.Ньюлендс в 1864, анализируя все известные триады и расширяя по возможности их в семейства по 4–5 элементов, получил общую таблицу, что позволило ему предположить существование одного или двух неоткрытых элементов. Затем он перестроил классификацию элементов в порядке увеличения атомного веса и обнаружил периодическую повторяемость свойств у каждого восьмого элемента. К сожалению, Ньюлендс не оставил свободные места в таблице для неоткрытых элементов, а его предложение назвать новую таблицу законом октав встретило холодный прием.
Периодический закон.
Два других химика, русский ученый Д.И.Менделеев и немецкий ученый Л.Мейер независимо друг от друга предложили классификацию элементов в виде семейств, в которых периодически повторяются сходные свойства, когда элементы расположены в порядке увеличения атомного веса. Оба опубликовали свои таблицы (Менделеев – в 1869, а Мейер – в 1870) и дали формулировку нового открытого периодического закона. Уверенность Менделеева в правильности периодического закона была так велика, что он не колеблясь исправил известные значения атомных весов на основании открытого закона. Он предсказал существование и довольно точно описал свойства трех новых, еще неизвестных тогда элементов, которые были открыты через несколько лет: галлия (1875), скандия (1879) и германия (1886).
Периодическая таблица.
Менделеев расположил элементы в порядке увеличения их атомного веса и в 1869 предложил таблицу размещения семейств элементов (табл. 1). Модифицированная форма таблицы (табл. 2), в которой семейства (группы) элементов расположены в колонках, была предложена им в 1871 и существует до настоящего времени. Наряду с ней получила распространение развернутая форма таблицы. См. также ХИМИЯ; ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
| Таблица 1. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ, ОПУБЛИКОВАННАЯ МЕНДЕЛЕЕВЫМ В 1869 (первая версия) | |||||
| Ti = 50 | Zr = 90 | ? = 180 | |||
| V = 51 | Nb = 94 | Ta = 182 | |||
| Cr = 52 | Mo = 96 | W = 186 | |||
| Mn = 55 | Rh = 104,4 | Pt = 197,4 | |||
| Fe = 56 | Ru = 104,4 | Ir = 198 | |||
| Ni = | Co = 59 | Pd = 106,6 | Os = 199 | ||
| H = 1 | Cu = 63,4 | Ag = 108 | Hg = 200 | ||
| Be = 9,4 | Mg = 24 | Zn = 65,2 | Cd = 112 | ||
| B = 11 | Al = 27,4 | ? = 68 | Ur = 116 | Au = 197? | |
| C = 12 | Si = 28 | ? = 70 | Sn = 118 | ||
| N = 14 | P = 31 | As = 75 | Sb = 122 | Bi = 210? | |
| O = 16 | S = 32 | Se = 79,4 | Te = 128? | ||
| F = 19 | Cl = 35,5 | Br = 80 | I = 127 | ||
| Li = 7 | Na = 23 | K = 39 | Rb = 85,4 | Cs = 133 | Tl = 204 |
| Ca = 40 | Sr = 87,6 | Ba = 137 | Pb = 207 | ||
| ? = 45 | Ce = 92 | ||||
| ?Er = 56 | La = 94 | ||||
| ?Yt = 60 | Di = 95 | ||||
| ?In = 75,6 | Th = 118 | ||||
| Таблица 2. МОДИФИЦИРОВАННАЯ ТАБЛИЦА МЕНДЕЛЕЕВА | |||||||||||||||||||||||||
| Группа | I | II | III | IV | V | VI | VII | VIII | 0 | ||||||||||||||||
| Формула оксида или гидрида Подгруппа | R2O А В | RO А В | R2O3 В А | RH4 RO2 В А | RH3 R2O5 В А | RH2 RO3 В А | RH R2O7 В А | ||||||||||||||||||
| Период 1 | 1 H Водород 1,0079 | 2 He Гелий 4,0026 | |||||||||||||||||||||||
| Период 2 | 3 Li Литий 6,941 | 4 Be Бериллий 9,0122 | 5 B Бор 10,81 | 6 C Углерод 12,011 | 7 N Азот 14,0067 | 8 O Кислород 15,9994 | 9 F Фтор 18,9984 | 10 Ne Неон 20,179 | |||||||||||||||||
| Период 3 | 11 Na Натрий 22,9898 | 12 Mg Магний 24,305 | 13 Al Алюминий 26,9815 | 14 Si Кремний 28,0855 | 15 P Фосфор 30,9738 | 16 S Сера 32,06 | 17 Cl Хлор 35,453 | 18 Ar Аргон 39,948 | |||||||||||||||||
| Период 4 | 19 K Калий 39,0983 29 Cu Медь 63,546 | 20 Ca Кальций 40,08 30 Zn Цинк 65,39 | 21 Sc Скандий 44,9559 31 Ga Галлий 69,72 | 22 Ti Титан 47,88 32 Ge Германий 72,59 | 23 V Ванадий 50,9415 33 As Мышьяк 74,9216 | 24 Cr Хром 51,996 34 Se Селен 78,96 | 25 Mn Марганец 54,9380 35 Br Бром 79,904 | 26 Fe Железо 55,847 | 27 Co Кобальт 58,9332 | 28 Ni Никель 58,69 | 36 | ||||||||||||||
| Период 5 | 37 Rb Рубидий 85,4678 47 Ag Серебро 107,868 | 38 Sr Стронций 87,62 48 Cd Кадмий 112,41 | 39 Y Иттрий 88,9059 49 In Индий 114,82 | 40 Zr Цирконий 91,22 50 Sn Олово 118,69 | 41 Nb Ниобий 92,9064 51 Sb Сурьма 121,75 | 42 Mo Молибден 95,94 52 Te Теллур 127,60 | 43 Tc Технеций [97] 53 I Иод 126,9044 | 44 Ru Рутений 101,07 | 45 Rh Родий 102,9055 | 46 Pd Палладий 106,4 | 54 | ||||||||||||||
| Период 6 | 55 Cs Цезий 132,9054 79 Au Золото 196,9665 | 56 Ba Барий 137,33 80 Hg Ртуть 200,59 | 57* La Лантан 138,9055 81 Tl Таллий 204,38 | 72 Hf Гафний 178,49 82 Pb Свинец 207,21 | 73 Ta Тантал 180,9479 83 Bi Висмут 208,9804 | 74 W Вольфрам 183,85 84 Po Полоний [209] | 75 Re Рений 186,207 85 At Астат [210] | 76 Os Осмий 190,2 | 77 Ir Иридий 192,2 | 78 Pt Платина 195,08 | 86 | ||||||||||||||
| Период 7 | 87 Fr Франций [223] | 88 Ra Радий 226,0254 | 89** Ac Актиний 227,028 | 104 [261] | 105 [258] | 106 [260] | 107 [262] | 108 [265] | 109 [266] |
| |||||||||||||||
| * | 58 Ce 140,12 | 59 Pr 140,9077 | 60 Nd 144,24 | 61 Pm [145] | 62 Sm 150,36 | 63 Eu 151,96 | 64 Gd 157,25 | 65 Tb 158,9254 | 66 Dy 162,50 | 67 Ho 164,9304 | 68 Er 167,26 | 69 Tm 168,9342 | 70 Yb 173,04 | 71 Lu 174,967 | |||||||||||
| ** | 90 Th 232,0381 | 91 Pa 231,0359 | 92 U 238,0289 | 93 Np 237,0482 | 94 Pu [244] | 95 Am [243] | 96 Cm [247] | 97 Bk [247] | 98 Cf [251] | 99 Es [252] | 100 Fm [257] | 101 Md [258] | 102 No [259] | 103 Lr [260] | |||||||||||
| *Лантаноиды: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций. **Актиноиды: торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий. Примечание. Атомный номер указан над символом элемента, атомная масса указана под символом элемента. Величина в скобках – массовое число наиболее долгоживущего изотопа. | |||||||||||||||||||||||||
Периоды.
В этой таблице Менделеев расположил элементы в горизонтальных рядах – периодах. Таблица начинается с очень короткого периода, содержащего только водород и гелий. Следующие два коротких периода содержат по 8 элементов. Затем располагаются четыре длинных периода. Все периоды, кроме первого, начинаются со щелочного металла (Li, Na, K, Rb, Cs), и все периоды заканчиваются благородным газом. В 6-м периоде находится серия из 14 элементов – лантаноиды, которой формально нет места в таблице и ее обычно располагают под таблицей. Другая аналогичная серия – актиноиды – находится в 7-м периоде. Эта серия включает элементы, полученные в лаборатории, например бомбардировкой урана субатомными частицами, и также размещается под таблицей ниже лантаноидов.
Группы и подгруппы.
При расположении периодов друг под другом элементы располагаются в колонки, образуя группы, нумеруемые цифрами 0, I, II,…, VIII. Предполагается, что элементы внутри каждой группы проявляют сходные общие химические свойства. Еще бóльшее сходство наблюдается у элементов в подгруппах (A и B), которые образуются из элементов всех групп, кроме 0 и VIII. Подгруппа А называется главной, а В – побочной. Некоторые семейства имеют названия, например, щелочные металлы (группа IA), щелочноземельные металлы (группа IIA), галогены (группа VIIA) и благородные газы (группа 0). В группе VIII находятся переходные металлы: Fe, Co и Ni; Ru, Rh и Pd; Os, Ir и Pt. Находящиеся в середине длинных периодов, эти элементы более сходны друг с другом, чем с элементами, стоящими до и после них. В нескольких случаях порядок увеличения атомных весов (точнее, атомных масс) нарушается, например, в пáрах теллур и иод, аргон и калий. Это «нарушение» необходимо для сохранения сходства элементов в подгруппах.
Металлы, неметаллы.
Диагональ от водорода к радону примерно делит все элементы на металлы и неметаллы, при этом неметаллы находятся выше диагонали. (К неметаллам относят 22 элемента – H, B, C, Si, N, P, As, O, S, Se, Te, галогены и инертные газы, к металлам – все остальные элементы.) Вдоль этой линии располагаются элементы, которые обладают некоторыми свойствами металлов и неметаллов (металлоиды – устаревшее название таких элементов). При рассмотрении свойств по подгруппам сверху вниз наблюдается увеличение металлических свойств и ослабление неметаллических свойств.
Валентность.
Наиболее общее определение валентности элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях. Иногда валентность элемента заменяют близким ему понятием степени окисления (с.о.). Степень окисления соответствует заряду, который приобрел бы атом, если бы все электронные пары его химических связей сместились в сторону более электроотрицательных атомов. В любом периоде слева направо происходит увеличение положительной степени окисления элементов. Элементы I группы имеют с.о., равную +1 и формулу оксида R2O, элементы II группы – соответственно +2 и RO и т.д. Элементы с отрицательной с.о. находятся в V, VI и VII группах; считается, что углерод и кремний, находящиеся в IV группе, не имеют отрицательной степени окисления. Галогены, имеющие степень окисления –1, образуют соединения с водородом состава RH. В целом положительная степень окисления элементов соответствует номеру группы, а отрицательная равна разности восемь минус номер группы. Из таблицы нельзя определить наличие или отсутствие других степеней окисления.
Физический смысл атомного номера.
Истинное понимание периодической таблицы возможно только на основе современных представлений о строении атома. Порядковый номер элемента в периодической таблице – его атомный номер – значительно важнее величины его атомного веса (т.е. относительной атомной массы) для понимания химических свойств.
Строение атома.
В 1913 Н.Бор использовал ядерную модель строения атома для объяснения спектра атома водорода, наиболее легкого и поэтому наиболее простого атома. Бор предположил, что атом водорода состоит из одного протона, составляющего ядро атома, и одного электрона, вращающегося вокруг ядра.
Определение понятия атомного номера.
В 1913 А.ван ден Брук предположил, что порядковый номер элемента – его атомный номер – должен идентифицироваться с числом электронов, вращающихся вокруг ядра нейтрального атома, и с положительным зарядом ядра атома в единицах заряда электрона. Однако необходимо было экспериментальное подтверждение идентичности заряда атома и атомного номера. Бор далее постулировал, что характеристическое рентгеновское излучение элемента должно подчиняться такому же закону, что и спектр водорода. Так, если атомный номер Z идентифицируется с зарядом ядра в единицах заряда электрона, то частоты (длины волн) соответствующих линий в рентгеновских спектрах различных элементов должны быть пропорциональны Z2, квадрату атомного номера элемента.
В 1913–1914 Г.Мозли, изучая характеристическое рентгеновское излучение атомов различных элементов, получил блестящее подтверждение гипотезы Бора. Работа Мозли таким образом подтвердила предположение ван ден Брука об идентичности атомного номера элемента с зарядом его ядра; атомный номер, а не атомная масса, является истинной основой для определения химических свойств элемента.
Периодичность и атомная структура.
Квантовая теория Бора строения атома развивалась в течение двух десятилетий после 1913. Предложенное Бором «квантовое число» стало одним из четырех квантовых чисел, необходимых для характеристики энергетического состояния электрона. В 1925 В.Паули сформулировал свой знаменитый «принцип запрета» (принцип Паули), согласно которому в атоме не может быть двух электронов, у которых бы все квантовые числа были одинаковые. Когда этот принцип применили к электронным конфигурациям атомов, периодическая таблица приобрела физическое обоснование. Так как атомный номер Z, т.е. положительный заряд ядра атома, возрастает, то и количество электронов должно возрастать для сохранения электронейтральности атома. Эти электроны определяют химическое «поведение» атома. Согласно принципу Паули, по мере увеличения значения квантового числа электроны заполняют электронные слои (оболочки) начиная с ближайших к ядру. Завершенный слой, который заполнен всеми электронами в соответствии с принципом Паули, является наиболее стабильным. Поэтому благородные газы, такие, как гелий и аргон, имеющие полностью завершенные электронные структуры, устойчивы к любому химическому воздействию.
Электронные конфигурации.
В следующей таблице приведены возможные количества электронов для различных энергетических состояний. Главное квантовое число n = 1, 2, 3,… характеризует энергетический уровень электронов (1-й уровень располагается ближе к ядру). Орбитальное квантовое число l = 0, 1, 2,…, n – 1 характеризует орбитальный момент импульса. Орбитальное квантовое число всегда меньше главного квантового числа, а максимальное его значение равно главному минус 1. Каждому значению l отвечает определенный тип орбитали – s, p, d, f … (это обозначение происходит от спектроскопической номенклатуры 18 в., когда различные серии наблюдаемых спектральных линий назывались sharp, principal, diffuse и fundamental).
| Таблица 3. ЧИСЛО ЭЛЕКТРОНОВ В РАЗЛИЧНЫХ ЭНЕРГЕТИЧЕСКИХ СОСТОЯНИЯХ АТОМА | |||
| Главное квантовое число | Орбитальное квантовое число | Количество электронов на оболочке | Обозначение энергетического состояния (тип орбитали) |
| 1 | 0 | 2 | 1s |
| 2 | 0 | 2 | 2s |
| 1 | 6 | 2p | |
| 3 | 0 | 2 | 3s |
| 1 | 6 | 3p | |
| 2 | 10 | 3d | |
| 4 | 0 | 2 | 4s |
| 1 | 6 | 4p | |
| 2 | 10 | 4d | |
| 3 | 14 | 4f | |
| 5 | 0 | 2 | 5s |
| 1 | 6 | 5p | |
| 2 | 10 | 5d | |
| 5 | 14 | 5f | |
| 4 | 18 | 5g | |
| 6 | 0 | 2 | 6s |
| 1 | 6 | 6p | |
| 2 | 10 | 6d | |
| … | … | … | … |
| 7 | 0 | 2 | 7s |
Короткие и длинные периоды.
Низшая полностью завершенная электронная оболочка (орбиталь) обозначается 1s и реализуется у гелия. Следующие уровни – 2s и 2p – соответствуют застройке оболочек атомов элементов 2-го периода и при полной застройке, у неона, содержат в сумме 8 электронов. С увеличением значений главного квантового числа энергетическое состояние низшего орбитального числа для большего главного может оказаться ниже энергетического состояния наиболее высокого орбитального квантового числа, соответствующего меньшему главному. Так, энергетическое состояние 3d выше, чем 4s, поэтому у элементов 3-го периода происходит застройка 3s— и 3p-орбиталей, заканчиваясь формированием устойчивой структуры благородного газа аргона. Далее происходит последовательная застройка 4s-, 3d— и 4p-орбиталей у элементов 4-го периода, вплоть до завершения внешней устойчивой электронной оболочки из 18 электронов у криптона. Это и приводит к появлению первого длинного периода. Аналогично происходит застройка 5s-, 4d— и 5p-орбиталей атомов элементов 5-го (т.е. второго длинного) периода, завершаясь электронной структурой ксенона.
Лантаноиды и актиноиды.
Последовательное заполнение электронами 6s-, 4f-, 5d— и 6p-орбиталей у элементов 6-го (т.е. третьего длинного) периода приводит к появлению новых 32 электронов, которые формируют структуру последнего элемента этого периода – радона. Начиная с 57 элемента, лантана, последовательно располагаются 14 элементов, мало отличающихся по химическим свойствам. Они образуют серию лантаноидов, или редкоземельных элементов, у которых застраивается 4f-оболочка, содержащая 14 электронов.
Серия актиноидов, которая располагается за актинием (атомный номер 89), характеризуется застройкой 5f-оболочки; она также включает 14 элементов, весьма близких по химическим свойствам. Элемент с атомным номером 104 (резерфордий), следующий за последним из актиноидов, уже отличается по химическим свойствам: он является аналогом гафния. Для элементов за резерфордием приняты названия: 105 – дубний (Db), 106 – сиборгий (Sg), 107 – борий (Bh), 108 – хассий (Hs), 109 – мейтнерий (Mt).
Применение периодической таблицы.
Знание периодической таблицы позволяет химику предсказывать с определенной степенью точности свойства любого элемента, прежде чем он приступит к работе с ним. Металлурги, например, считают периодическую таблицу полезной для создания новых сплавов, так как, используя периодическую таблицу, можно заменить один из металлов сплава, подобрав ему замену среди его соседей по таблице так, что с определенной степенью вероятности не произойдет значительного изменения свойств образующегося из них сплава.
www.krugosvet.ru
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тема: Строение атома. Периодический закон
Урок: Периодический закон и периодическая система химических элементов Д.И. Менделеева
В период становления науки химии ученые пытались привести в систему сведения об известных к тому времени нескольких десятков химических элементов. Эта проблема увлекла и Д.И. Менделеева. Он искал закономерности и взаимосвязи, которые бы охватывали все элементы, а не только часть из них. Менделеев считал важнейшей характеристикой элемента массу его атома. Проанализировав все известные к тому времени сведения о химических элементах и расположив их в порядке возрастания их атомных масс, в 1869 году он сформулировал периодический закон.
Формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значения атомных масс.
К моменту формулировки периодического закона еще не было известно строение атома и существования элементарных частиц. Также впоследствии было установлено, что от атомных масс свойства вещества не зависят, как это предполагал Менделеев. Хотя, не обладая этими сведениями, Д. И. Менделеев не сделал в своей таблице ни единой ошибки.
После открытия Мозли, который установил экспериментально, что заряд ядра атома совпадает с порядковым номером химического элемента, указанным Менделеевым в его таблице, в формулировку его закона внесли изменения.
Современная формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.

Рис. 1. Графическим выражением периодического закона является Периодическая система химических элементов Д. И. Менделеева
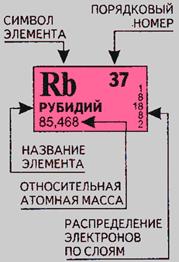
Рис. 2. Рассмотрим принятые в ней обозначения на примере рубидия
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса. Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти по разности между относительной атомной массой и количеством протонов, т. е. порядкового номера.
N(n0) = Ar — Z
Количество относительная порядковый
нейтронов атомная масса номер элемента
Например, для изотопа хлора 35Cl количество нейтронов равно: 35-17=18
Составными частями периодической системы являются группы и периоды.
Периодическая система содержит восемь групп элементов. Каждая группа состоит их двух подгрупп: главной и побочной. Главные обозначены буквой а, а побочные – буквой б. Главная подгруппа содержит больше элементов, чем побочная. В главной подгруппе содержатся s- и p-элементы, в побочной – d-элементы.
Группа – столбец периодической системы, в котором объединены химические элементы, обладающие химическим сходством вследствие сходных электронных конфигураций валентного слоя. Это основополагающий принцип построения периодической системы. Рассмотрим это не примере элементов первых двух групп.
Табл. 1
|
Элемент |
Конфигурация валентных электронов |
Элемент |
Конфигурация валентных электронов |
|
H |
1s1 |
|
|
|
Li |
2s1 |
Be |
2s2 |
|
Na |
3s1 |
Mg |
3s2 |
|
K |
4s1 |
Ca |
4s2 |
|
Rb |
5s1 |
Sr |
5s2 |
|
Cs |
6s1 |
Ba |
6s2 |
Из таблицы видно, что элементы первой группы главной подгруппы имеют один валентный электрон. Элементы второй группы главной подгруппы имеют два валентных электрона.
Некоторые главные подруппы имеют свои особенные названия:
Табл. 2
|
I-a |
Щелочные металлы |
|
II-a |
Щелочноземельные металлы |
|
V-a |
Пниктогены |
|
VI-a |
Халькогены |
|
VII-a |
Галогены |
|
VIII-a |
Благородные (инертные) газы |
Строка, называемая периодом, — это последовательность элементов, расположенных в порядке увеличения зарядов их ядер, которая начинается с щелочного металла (или водорода) и заканчивается благородным газом.
Номер периода равен количеству электронных уровней в атоме.
Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп (Рис. 3) и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп (Рис. 1).
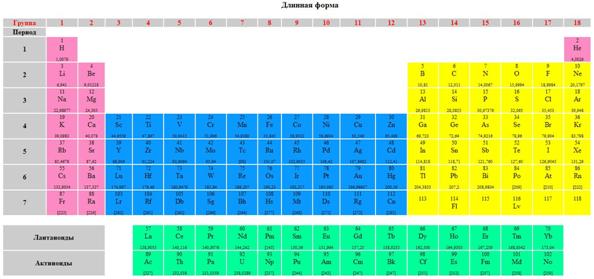
Рис. 3
Периодическая повторяемость строения валентных электронов в атоме – это важнейший критерий, который объясняет и предсказывает свойства многих элементов. См. табл. 3.
Табл. 3
|
Электронные конфигурации валентного слоя атомов элементов от лития до кальция |
||||||
|
Элемент |
Li |
Be |
B |
C |
N |
O |
|
Z |
3 |
4 |
5 |
6 |
7 |
8 |
|
Электронная конфигурация |
2s1 |
2s2 |
2s22p1 |
2s22p2 |
2s22p3 |
2s22p4 |
|
Элемент |
F |
Ne |
Na |
Mg |
Al |
Si |
|
Z |
9 |
10 |
11 |
12 |
13 |
14 |
|
Электронная конфигурация |
2s22p5 |
2s22p6 |
3s1 |
3s2 |
3s23p1 |
3s23p2 |
|
Элемент |
P |
S |
Cl |
Ar |
K |
Ca |
|
Z |
15 |
16 |
17 |
18 |
19 |
20 |
|
Электронная конфигурация |
3s23p3 |
3s23p4 |
3s23p5 |
3s23p6 |
4s1 |
4s2 |
У каждой группы есть формула высшего оксида, т. е. оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов V группы формула высшего оксида – R2O5. Это N2O5, P2O5, As2O5, V2O5…. По составу высшего оксида элемента можно определить его свойства. Оксиды состава R2O, RO основные. R2O3 — чаще всего амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента R, чем ярче выраженными кислотными свойствами обладает его оксид. Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.
Изменение атомного радиуса
В группах: для элементов главных подгрупп сверху вниз увеличивается число энергетических уровней. Энергетический уровень – это и есть расстояние, на котором находится электрон от ядра. Значит, по группе вниз атомный радиус увеличивается.
В периодах: по периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра. Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается.
Электроотрицательность
Электроотрицательность – это способность атома перетягивать на себя электроны связи.
Это величина, которая отражает «желание» атома отдать свои валентные электроны или принять чужие валентные электроны. Чем выше электроотрицательность, тем сильнее атом хочет принять чужие валентные электроны. Существует несколько основных шкал электроотрицательности. Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность (X) измеряется в относительных величинах (таблица 4).
|
Элемент |
Х |
Элемент |
Х |
|
Cs |
0,79 |
H |
2,20 |
|
K |
0,82 |
C |
2,55 |
|
Na |
0,93 |
S |
2,58 |
|
Li |
0,98 |
I |
2,66 |
|
Ca |
1,00 |
Br |
2,96 |
|
Mg |
1,31 |
N |
3,04 |
|
Be |
1,57 |
Cl |
3,16 |
|
Si |
1,90 |
O |
3,44 |
|
B |
2,04 |
F |
3,98 |
|
P |
2,19 |
|
|
Таблица 4. Электроотрицательности (X) некоторых элементов. Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательность по Полингу – это свойство атомов, связанных химическими связями, т. е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века.
Наибольшей электроотрицательностью обладают элементы, находящиеся в правом верхнем углу Периодической системы. Соответственно, наименьшей – элементы, находящиеся в нижнем левом углу. Аналогично меняются и металлические свойства простых веществ, образованных данными элементами. Металлы легко отдают свои валентные электроны, соответственно, они имеют низкую электроотрицательность. Поэтому металлы находятся в нижнем левом углу Периодической системы, а типичные неметаллы – в правом верхнем.
Закономерности изменения периодических свойств приведены в табл. 5.
|
Параметр |
По группе вниз |
По периоду вправо |
|
Заряд ядра |
Увеличивается |
Увеличивается |
|
Число валентных электронов |
Не меняется |
Увеличивается |
|
Число энергетических уровней |
Увеличивается |
Не меняется |
|
Радиус атома |
Увеличивается |
Уменьшается |
|
Электроотрицательность |
Уменьшается |
Увеличивается |
|
Металлические свойства |
Увеличиваются |
Уменьшаются |
|
Степень окисления в высшем оксиде |
Не меняется |
Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется |
Увеличивается |
Табл. 5
Подведение итога урока
Вы узнали о строении Периодической системы элементов Д. И. Менделеева, а также о закономерностях изменения основных свойств химических элементов по ней.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. А.В. Мануйлов, В.И. Родионов. Основы химии. Интернет-учебник.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик (Источник).
Домашнее задание
1. №№3-5 (с. 22) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Сравните электронную конфигурацию атомов углерода и кремния. Какую валентность и степени окисления они могут проявлять в химических соединениях? Приведите формулы соединений этих элементов с водородом. Приведите формулы их соединений с кислородом в высшей степени окисления.
3. Напишите электронные формулы внешних оболочек следующих элементов: 14Si, 15P, 16S, 17Cl, 34Se, 52Te. Три элемента из этого ряда являются химическими аналогами (проявляют похожие химические свойства). Какие это элементы?
interneturok.ru
«Таблица менделеева» — Яндекс.Знатоки
Сразу четыре новых элемента были добавлены в периодическую систему химических элементов по решению Международного союза теоретической и прикладной химии (IUPAC). Решение это было принято после того, как руководство союза признало соответствие открытых элементов всем необходимым критериям. Это первое дополнение таблицы Менделеева с 2011 года, а четыре новых элемента, наконец, полностью закрыли седьмой ряд периодической системы. Особенно приятно во всей этой истории то, что новые элементы были открыты российскими учёными или при их непосредственном участии.
Первым новым элементом стал Унунтрий (Uut) под номером 113. Он был открыт ещё в 2004 году русско-американской командой учёных. В том же году новый элемент удалось синтезировать и учёным из японского института RIKEN. В течение нескольких последующих лет японцам удалось повторить этот опыт дважды, поэтому руководство IUPAC приняло решение назвать элемент в честь них. Это будет первый элемент периодической системы, названный в честь азиатских исследователей. Вероятнее всего, его переименуют в «рикений».
«Для японских учёных это событие даже куда более важное, чем выиграть золото на Олимпийских играх», — поделился своим восторгом Риоджи Нойори, нобелевский лауреат в области химии и бывший президент института RIKEN.
Вторым элементом стал Унунпентий (Uup) под номером 115. Он был открыт всё той же командой исследователей в 2003 году. Руководство IUPAC сошлось во мнении, что приоритет в его открытии принадлежит учёным из Объединённого института ядерных исследований (г. Дубна, Россия) и Ливерморской национальной лаборатории (США).
Третий новый элемент – это Унунсептий (Uus) под номером 117. Учёные российского Объединённого института ядерных исследований сумели получить его в 2009 году. Для его синтеза была использована мишень из изотопа 97-го элемента, полученного в Окриджской национальной лаборатории (США).
И замыкает четвёрку Унуноктий (Uuo) под номером 118. Изначально его открытие было приписано американским учёным из Беркли, но позднее выяснилось, что их данные были ошибочны и даже фальсифицированы. Первое же настоящее событие распада 118-го элемента было зафиксировано российскими учёными из всё того же ОИЯИ в городе Дубны в 2002 году. Что ж, остаётся только поздравить российских, американских и японских исследователей со столь выдающимися достижениями.
yandex.ru
Таблица Менделеева. Такая разная. : moris_levran — LiveJournal
1 марта 1869 года Менделеев закончил свою работу «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. «Открытие Д.И. Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков». Академик А.И. Русанов.«Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой». Проф. А. Н. Реформатский.
«Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения. Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана». Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. «По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает». Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.
Открытию периодического закона предшествовало 15 лет напряженной работы. Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.
Так называемая короткопериодная или короткая форма ТМ 
Длиннопериодная или длинная форма ТМ
Сверхдлинная.
Флаги государств, обозначающие страну, где впервые открыли данный элемент.
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым — синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах «малых» и «больших» звёзд. Розовым цветом — вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые — созданные в лабораториях искусственно. Но это ещё не вся история… 
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас. 

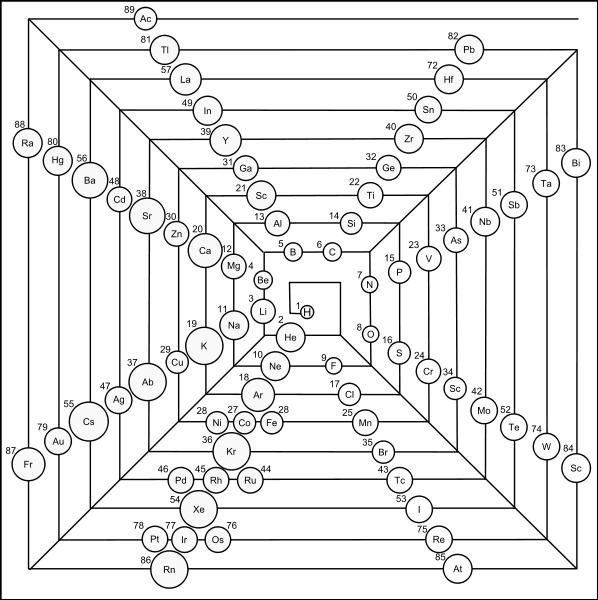
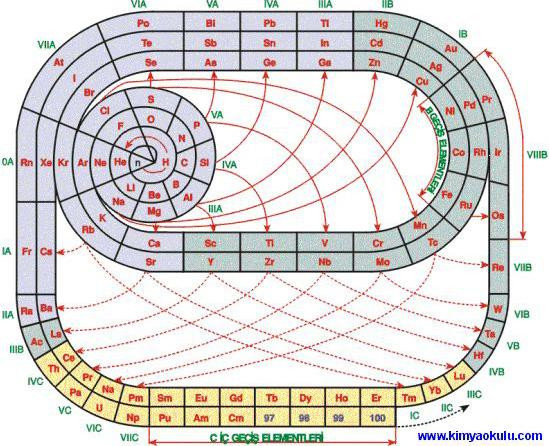
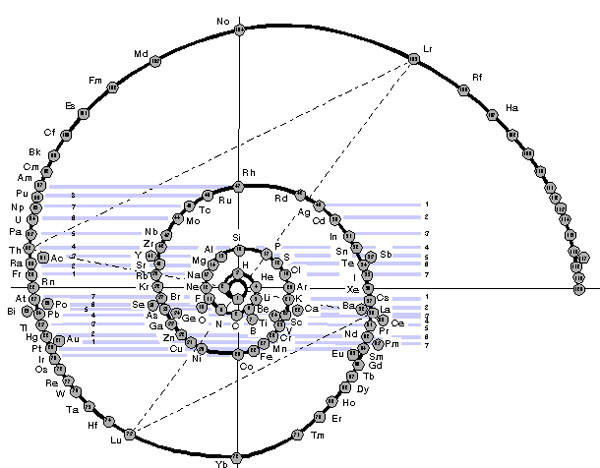
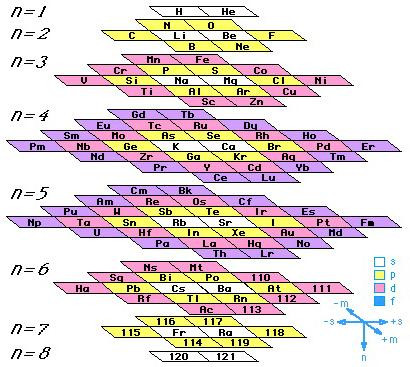
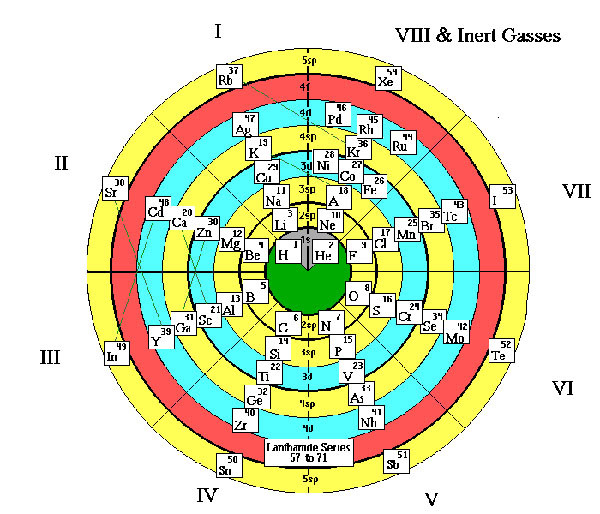
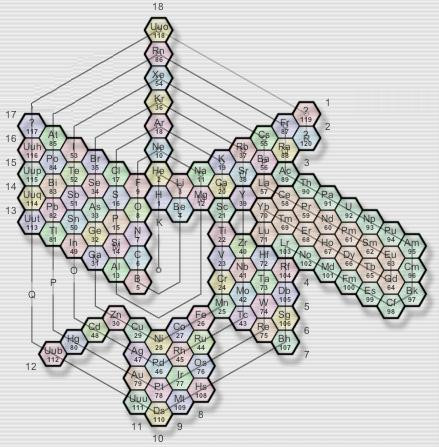
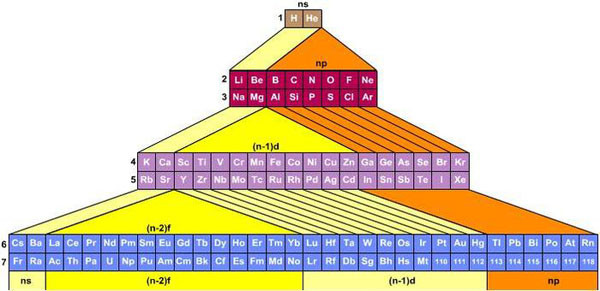
Таблица-башня
Предложена в 2006-ом Виталием Циммерманом на основе идей Чарльза Джанета. Он изучал орбитальное заполнение атомов — то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов. Таблица предельно проста и функциональна.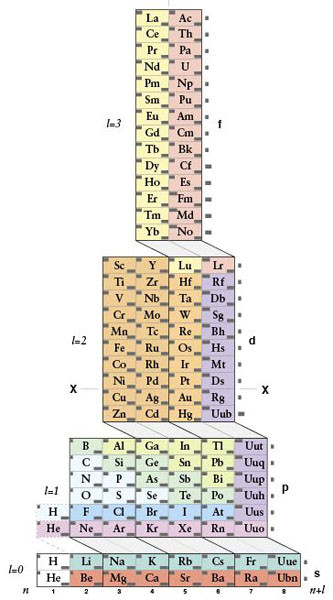



Таблица — спираль.
В 1964-ом Теодор Бенфей предложил поставить в центр таблицы водород (H), а прочие элементы разместить вокруг него по спирали, которая раскручивается по часовой стрелке. Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Таблица — радужная спираль.
Изобретена в 1975 химиком Джеймсом Хайдом. Он увлекался кремнийорганическими соединениями, поэтому в основание таблицы попал именно кремень, так как у него большое число связей с другими элементами. Различные категории элементов так же объединены по секторам и отмечены нужным цветом. Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.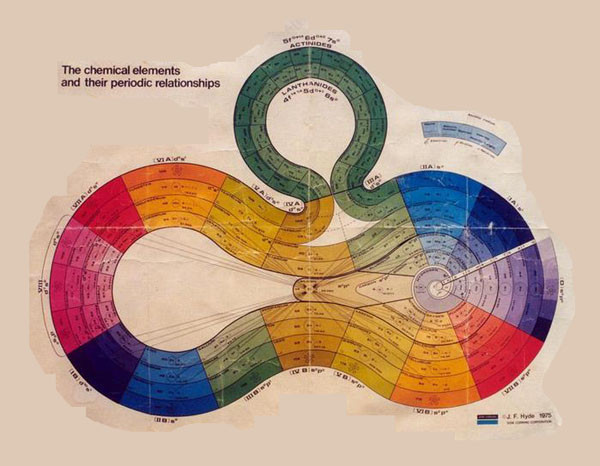


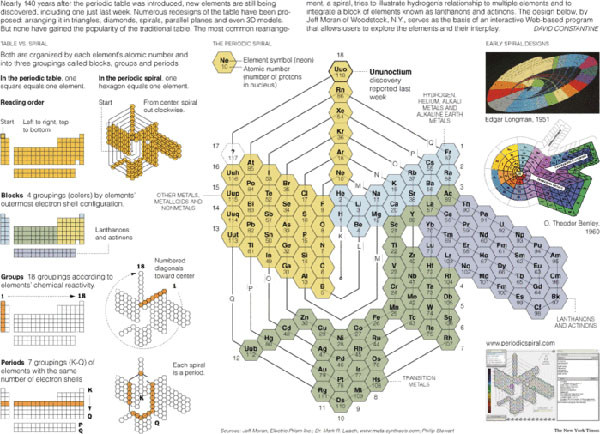

Эти таблицы отображают последовательность заполнения электронных оболочек. Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Таблица изотопов. Здесь отображено время «жизни» различных изотопов, их стабильность в зависимости от массы ядра. Впрочем, это уже не таблица Менделеева, это совсем другая (ядерная физика) история…
moris-levran.livejournal.com