h3O2, степень окисления кислорода и водорода в нем
Общие сведения о пероксиде водорода и степени окисления в h3O2
Молекула пероксида водорода имеет угловое строение (рис. 1). Энергия связи О-О (210кДж/моль) значительно меньше энергии связи О-Н (468 кДж/моль).
Рис. 1. Строение молекулы пероксида водорода с указанием валентных углов между связями и длин химических связей.
Вследствие несимметричного распределения связей Н-О молекула пероксида водорода сильно полярна (дипольным момент равен 0,7×10-29Кл×м). Между молекулами пероксида водорода возникает прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода – сиропообразная жидкость (плотность – 1,44 г/см3), с довольно высокой температурой кипения (150,2oC). Температура плавления равна 0,41oC. Она имеет бледно-голубую окраску. Брутто-формула – H2O2. Молярная масса – 34 г/моль.
Пероксид водорода – хороший ионизирующий растворитель. С водой смешивается в любых соотношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата H
h3O2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав пероксида водорода, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Пероксид водорода, как и вода, представляет собой гидрид кислорода, а которых водород, как известно, проявляет степень окисления (+1). Для нахождения степени окисления кислорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + 2×х = 0;
2 + 2х = 0;
2х = -2;
x = -1.
Значит степень окисления кислорода в пероксиде водорода равна (-1):
H+12O—12.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Гимназия №4 г. Могилева
Урок решения задач по теме «Химическая связь»
Цель: обобщить и закрепить знания, полученные по теме: «Виды химической связи», подготовиться к контрольному тесту.
Задачи: актуализировать личностный смысл учащихся к обобщению и систематизации знаний;
— создать содержательные и организационные условия для обобщения и систематизации знаний, овладения умениями и опытом деятельности;
— обеспечить развитие умений сравнивать, выделять главное, классифицировать, анализировать, обобщать, делать выводы;
— содействовать развитию умений осуществлять самоконтроль, самооценку и самокоррекцию учебной деятельности,
— помочь учащимся осознать ценность совместной деятельности;
— обеспечить развитие у учащихся монологической и диалогической речи;
— воспитывать осознание роли науки в жизни общества.

Вопросы к уроку раздаются учащимся на первом уроке темы: «Виды химической связи»
Ход урока
I. Учитель знакомит учащихся с целью урока.
II.Фронтальный опрос:
1. Что мы подразумеваем под видами химической связи?
2. Почему атомы соединяются в молекулы?
3. Из скольких атомов состоят молекулы инертных газов и почему?
4.Какие виды химической связи известны?
Для повторения теоретической составляющей темы у вас на столе находятся следующие задания, которые вы будете выполнять в течение урока, невыполненные остаются на дом и результат их выполнения повлияет на отметку самостоятельной работы на следующем уроке.
Итак, вопросы для теоретического повторения:
1. Укажите тип химической связи для следующих веществ
CaCl2, N2, h3SO4, HBr, Zn, P2O5, Na2S, h3S
2.Запишите схему образования химических связей в следующих веществах:
CaCl2, Ch5, Br2
3. Определите валентность и степень окисления кислорода в соединениях:
Определите валентность и степень окисления кислорода в соединениях:
h3O, h3O2, [h4O]+
При взаимодействии водорода с некоторым газообразным простым веществом Х было получено газообразное водородное соединение НnХ.
а) Установите формулу водородного соединения, если известно, что при растворении его в воде образуется сильная кислота.
б) Вычислите объем н.у и число молекул вещества Х, вступившего в реакцию, если в результате растворения водородного соединения в воде, было получено 500 мл. вещества (р=1,149г/мл) с массовой долей НnХ, равной 30 %.
5. В природе вещества встречаются в трех агрегатных состояниях. В каких? Для какого агрегатного состояния вещества справедлив термин «кристаллическая решетка»?
6. Что называется кристаллической решеткой? Какие типы кристаллических решеток вы знаете?
7. Далее работаем по вариантам
Вариант 1 Ионные решетки
Вариант 2 Атомные решетки
Вариант 3 Молекулярные решетки
Вариант 4 Металлические решетки
Выбрать признаки характерные для данных решеток по следующим параметрам:
1.
 Частицы, находящиеся в узлах решетки
Частицы, находящиеся в узлах решетки 2.Характер связи между частицами
3.Прочность связи
4.Физические свойства веществ
5.Примеры
Варианты ответов:
1.а) катионы и анионы
б) молекулы
в) атомы
г) атомы и катионы
2.а) межмолекулярные силы притяжения и отталкивания, возможно образование водородных связей
в) ковалентная неполярная или ковалентная полярная связи (образование общих электронных пар)
г) металлическая связь (делокализация связывающих электронов)
3.а) слабая
б) очень прочная
в) разная прочность
г) прочная
4.
 а) металлический блеск, тепло- и электропроводность, пластичность, твердость различная, t пл, t кип различные
а) металлический блеск, тепло- и электропроводность, пластичность, твердость различная, t пл, t кип различные б) очень высокие t пл, нерастворимость в воде, нелетучесть, твердость
в) t пл, t кип низкие, хрупкость, летучесть, агрегатное состояние различное
г) тугоплавкость, тепло- и электропроводность (проводники второго рода), агрегатное состояние при комнатной температуре твердое.
5). I2, h3O, CO2, NaCl, KOH, Ba(NO3)2, C, Si, SiO2, Cu, К, Zu
«Химическая гимнастика»
Учитель называет:
1. Химический элемент – вращение плечами назад,
вещество — вращение плечами вперёд;
кислород, озон, углерод, алмаз, кремний, горный хрусталь, сера, железо, магний, вода, мел, сахар.
8.Определите степени окисления и валентность всех атомов в соединениях
N2h5, K2O, OF2, Cl2O7, KMnO4, C2H6, HNO3
9.
 Выполняем тест в рабочей тетради см. приложение 1
Выполняем тест в рабочей тетради см. приложение 1
Контрольная работа по «Химии»
Контрольная работа № 4
№11
Какова степень окисления кислорода в молекуле h3O2.?привести примеры реакций в которых проявляются окислительные свойства пероксида водорода
Ответ:
Пероксид водорода (перекись водорода), h3O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата h3O2•2h3O.
Вследствие несимметричности
молекула h3O2 сильно полярна (μ = 0,7·10−29
Кл·м). Относительно высокая вязкость
жидкого пероксида водорода обусловлена
развитой системой водородных связей.
Поскольку атомы кислорода 
Химические свойства
Оба атома кислорода
находятся в промежуточной
Na_2SO_3 + H_2O_2 = Na_2SO_4 + H_2O
Mn(OH)_2 + H_2O_2 =MnO(OH)_2 + H_2O
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
2AgNO_3 + H_2O_2 =2Ag + O_2 + 2HNO_3
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому h3O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на h3O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
2H_2O_2 =2H_2O + O_2
Однако очень чистый
пероксид водорода устойчив.
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или перекидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная h4PO5 и пероксидисерная h3S2O8 кислоты.
Окислительно-
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
H_2O_2 + 2KI + H_2SO_4 = I_2 + K_2SO_4 + 2H_2O}
При действии сильных окислителей h3O2 проявляет восстановительные свойства, выделяя свободный кислород:
{O_2^{2-} = O_2 + 2e^-}
например:
{3H_2O_2 + 2KMnO_4 = 2MnO_2 + 2KOH + 3O_2 + 2H_2O}
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
5H_2O_2 + 2KMnO_4 + 3H_2SO_4 = 5O_2 + 2MnSO_4 + K_2SO_4 + 8H_2O}
Окисление органических соединений
пероксидом водорода (например, сульфидов
и тиолов) целесообразно проводить
в среде уксусной кислоты.
№23
ЧЕМ ОБЪЯСНЯЕТЬСЯ высокая устойчивость молекулы cl2?Постройте энергетическую диаграмму молекулярных орбиталей для молекулы cl2?
Ответ:
Термическая устойчивость
молекул увеличивается при  Вследствие
этого между атомами в молекулах С12, Вг2
и J2 возникает дополнительное взаимодействие
невалентного характера. Поскольку на
внешнем электронном слое атомов фтора
нет свободных d — ячеек, то в молекулах
F2 дативные связи существовать не могут.
[1]
Вследствие
этого между атомами в молекулах С12, Вг2
и J2 возникает дополнительное взаимодействие
невалентного характера. Поскольку на
внешнем электронном слое атомов фтора
нет свободных d — ячеек, то в молекулах
F2 дативные связи существовать не могут.
[1]
Термическая устойчивость молекул в ряду HF, HC1, НВг, HI резко падает, HI — соединение эндотермическое, разлагается при слабом нагревании. [2]
Термическая устойчивость молекул в ряду HF, HC1, HBr, HI резко падает, HI — соединение эндотермическое, разлагается при слабом нагревании. [3]
Термическая устойчивость молекул в ряду HF, HC1, НВг, HI резко падает, Hi — соединение эндотермическое, разлагается при слабом нагревании. [4]
Термическая устойчивость
молекул увеличивается при 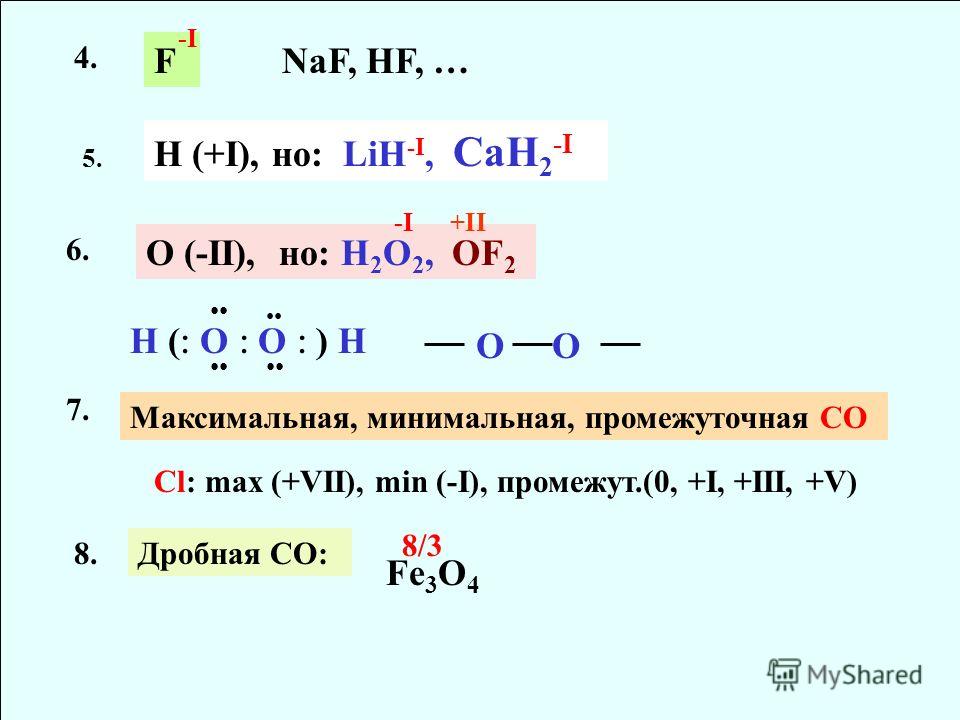 Уменьшение устойчивости
молекул в ряду С 2 — 1з объясняется увеличением
радиусов атомов галогенов, а следовательно,
увеличением длины связи и понижением
ее энергии. [5]
Уменьшение устойчивости
молекул в ряду С 2 — 1з объясняется увеличением
радиусов атомов галогенов, а следовательно,
увеличением длины связи и понижением
ее энергии. [5]
Несмотря на термическую устойчивость молекул, вода весьма активна в химическом отношении. Оксиды многих металлов и неметаллов, соединяясь с водой, образуют основания и кислоты. [6]
Экспериментально было установлено, что термическая устойчивость молекул, содержащих эти связи, меняется в ряду: парафиновые олефиновые ацетиленовые. [7]
Органические ПАВ, вследствие их уникальной дифильности, оказываются поверхностно-активными на большинстве межфазных границ, разумеется, в области термической устойчивости молекул ПАВ. [8]
Термическая устойчивость
молекул в ряду ЬЬО-ЬЬРо падает, реакции
разложения обратимы. Температуры плавления
и кипения, плотность воды ле подчиняются
общей закономерности изменения этих
свойств в ряду FbS-FhPo. Аномальные свойства
воды связаны с малым размером молекул
ЬЬО и образованием водородных связей
между ними. [9]
[9]
Термическая устойчивость молекул в ряду НаО — НгРо падает, реакции разложения обратимы. Температуры плавления и кипения, плотность воды не подчиняются общей закономерности изменения этих свойств в ряду HaS-НаРо. Аномальные свойства воды связаны с малым размером молекул НаО и образованием водородных связей между ними. [10]
Термическая устойчивость молекул в ряду ШО-ШРо падает, реакции разложения обратимы. Температуры плавления и кипения, плотность воды ле подчиняются общей закономерности изменения этих свойств в ряду bhS — НзРо. Аномальные свойства воды связаны с малым размером молекул НзО и образованием водородных связей между ними. [11]
Из приведенных примеров
видно, что в каждом отдельном
случае должны быть подобраны условия
процесса десорбции адсорбата. При
этом следует учитывать как термическую
устойчивость молекул адсорбированного
вещества в полостях цеолитов ( если адсор-бат
является целевым продуктом), так и порог
термической устойчивости цеолитов.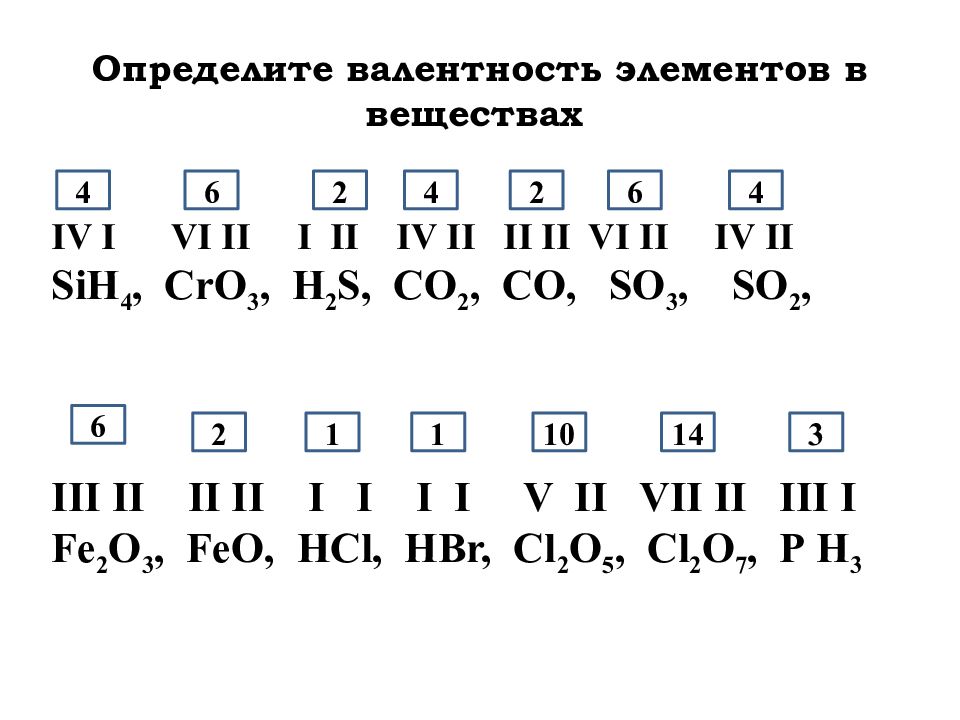 [12]
[12]
Необычно изменяется в ряду галогенов и их термическая устойчивость. Как видно из значений энергий диссоциации, приведенных выше, термическая устойчивость молекул галогенов при переходе от F2 к С12 увеличивается, а затем в ряду С1 — Ь постепенно уменьшается. Последнее легко объясняется возрастанием радиусов атомов в ряду С1 Вг I, вследствие чего ослабляется притяжение электронов, осуществляющих связь в молекуле, к ядрам атомов. Повышение же устойчивости молекул при переходе от Fa к С12 вызвано особенностями химической связи. В то время как в молекуле F2 связь осуществляется только одной парой валентных электронов, в молекулах С12, Вг2 и 12 наряду с этой связью возникают также донорно-акцептор-ные связи. [13]
№35
Какие кислородные соединения образуют сера(6) ,селен(6) ,теллур(6)?
Их получение, строение молекул и свойства. Как изменяют кислотные свойства оксидов ЭО3 и сила соответствующих им кислот в ряду S-Se-Te?
Ответ:
В подгруппу кислорода
входит пять элементов: кислород, сера,
селен, теллур и полоний (радиоактивный
металл). Это р-элементы VI группы периодической
системы Д.И.Менделеева. Они имеют групповое
название – халькогены, что означает «образующие
руды».
Это р-элементы VI группы периодической
системы Д.И.Менделеева. Они имеют групповое
название – халькогены, что означает «образующие
руды».
Свойства элементов подгруппы кислорода
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
У атома кислорода на
2р-подуровне два неспаренных
электрона. Его электроны не могут
разъединяться, поскольку отсутствует
d-подуровень на внешнем (втором) уровне,
т. е. отсутствуют свободные  Поэтому валентность кислорода всегда
равна двум, а степень окисления -2 и +2 (например,
в Н2О и ОF2). Таковы же валентность и степени
окисления у атома серы в невозбужденном
состоянии. При переходе в возбужденное
состояние (что имеет место при подводе
энергии, например при нагревании) у атома
серы сначала разъединяются Зр-, а затем
3s-электроны (показано стрелками). Число
неспаренных электронов, а, следовательно,
и валентность в первом случае равны четырем
(например, в SO2), а во втором — шести (например,
в SO3). Очевидно, четные валентности 2, 4,
6 свойственны аналогам серы — селену,
теллуру и полонию, а их степени окисления
могут быть равны -2, +2, +4 и +6.
Поэтому валентность кислорода всегда
равна двум, а степень окисления -2 и +2 (например,
в Н2О и ОF2). Таковы же валентность и степени
окисления у атома серы в невозбужденном
состоянии. При переходе в возбужденное
состояние (что имеет место при подводе
энергии, например при нагревании) у атома
серы сначала разъединяются Зр-, а затем
3s-электроны (показано стрелками). Число
неспаренных электронов, а, следовательно,
и валентность в первом случае равны четырем
(например, в SO2), а во втором — шести (например,
в SO3). Очевидно, четные валентности 2, 4,
6 свойственны аналогам серы — селену,
теллуру и полонию, а их степени окисления
могут быть равны -2, +2, +4 и +6.
Водородные соединения
элементов подгруппы кислорода
отвечают формуле Н2R (R — символ элемента):
Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами.
При растворении их в воде образуются
кислоты. Сила этих кислот возрастает
с ростом порядкового номера элемента,
что объясняется уменьшением энергии
связи в ряду соединений Н2R. Вода, диссоциирующая
на ионы Н+ и ОН-, является амфотерным электролитом.
Вода, диссоциирующая
на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
Оксид серы (VI)— бесцветная жидкость, затвердевающая при температуре 16,8°С в твердую кристаллическую массу. Он очень сильно поглощает влагу, образуя серную кислоту: SO3+Н2O= h3SO4
Таблица 20. Свойства оксидов серы
Растворение оксиды серы (VI)
в воде сопровождается выделением значительного
количества теплоты.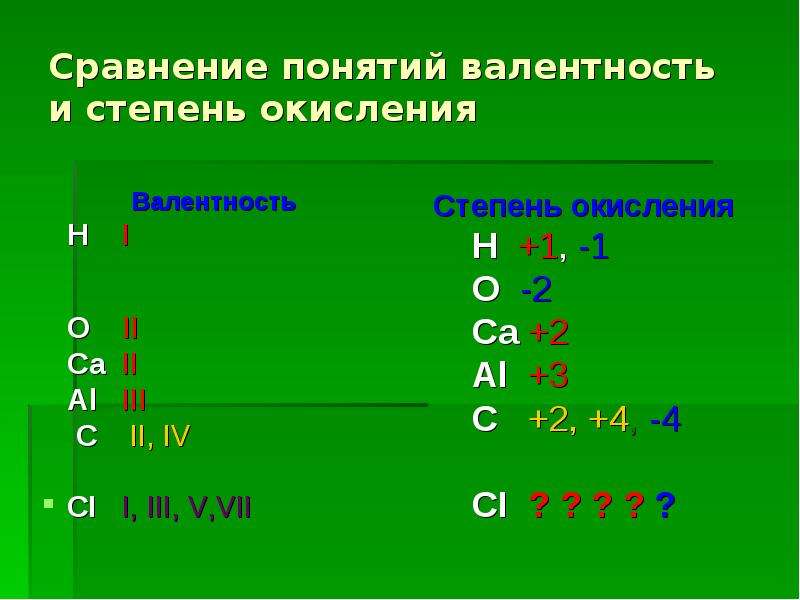 Оксид серы (VI) очень
хорошо растворим в концентрированной
серной кислоте. Раствор SO3 в безводной
кислоте называется олеумом. Олеумы
могут содержать до 70% SO3.
Оксид серы (VI) очень
хорошо растворим в концентрированной
серной кислоте. Раствор SO3 в безводной
кислоте называется олеумом. Олеумы
могут содержать до 70% SO3.
Получение
1. Оксид серы (VI) получают
окислением сернистого газа
2SO2+O2=2SO3
2. Другим способом окисления
SO2 до SO3 является использование в
качестве окислителя оксида
Образующийся оксид азота (II) при взаимодействии с кислородом воздуха легко и быстро превращается в оксид азота (IV): 2NO+О2=2NO2
который вновь может использоваться в окислении SO2. Следовательно, NO2 выполняет роль переносчика кислорода. Этот способ окисления SO2 до SO3 называется нитрозным. Молекула SO3 имеет форму треугольника, в центре которого
находится атом серы:
Такое строение обусловлено
взаимным отталкиванием связывающих
электронных пар. На их образование
атом серы предоставил шесть внешних
электронов.
На их образование
атом серы предоставил шесть внешних
электронов.
Химические свойства
1. SO3 — типичный кислотный оксид.
2. Оксид серы (VI) обладает
свойствами сильного
Применение
Оксид серы (VI) используют для производства серной кислоты. Наибольшее значение имеет контактный способ получения
серной кислоты. По этому способу можно получить h3SO4 любой концентрации, а также олеум. Процесс состоит из трех стадий: получение SO2; окисление SO2 в SO3; получение h3SO4.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Какова валентность h3O2?
Какова валентность h3O2? Валентность пероксида равна 2. Валентность многоатомных ионов представляет собой абсолютное значение заряда иона.
Сколько валентных электронов имеет h3O2? Общее количество валентных электронов в h3O2 равно 14.
Что такое элемент h3O2? Перекись водорода — это высокореакционное химическое вещество, содержащее элементы водород и кислород.
Как найти валентность? Если число электронов во внешней оболочке составляет от одного до четырех, считается, что соединение имеет положительную валентность.Для соединений с четырьмя, пятью, шестью или семью электронами валентность определяется путем вычитания электрона из восьми. Все благородные газы, кроме гелия, имеют восемь электронов.
Какова валентность h3O2? – Часто задаваемые вопросы
Какова валентность оксида?
Валентность оксида равна -2.
Сколько связывающих электронов у h3O2?
Перекись водорода имеет два электрона между двумя атомами кислорода. Они соединены одинарной связью. Одинарные связи состоят из двух электронов.
Что означает 3% h3O2?
Когда вы используете перекись, используйте перекись медицинского назначения, крепость которой составляет 3%. Это означает, что это 97% воды и 3% перекиси. «Медицинский класс достаточно крепок для домашнего использования», — говорит доктор Бирс. Вы также можете купить более концентрированную форму перекиси водорода, называемую пищевой перекисью, с концентрацией до 35%.
Что имеет h3O2?
Перекись водорода, химическое вещество, которое выглядит как бесцветная жидкость, используется в широком спектре чистящих средств и средств личной гигиены, включая краски и отбеливатели для волос, зубную пасту и жидкости для полоскания рта, чистящие средства для ванных комнат и пятновыводители для белья.
Что такое 9-й класс валентности?
Объединяющая способность атома элемента образовывать химическую связь называется его валентностью. Валентность элемента есть. (1) Равно числу валентных электронов. (2) Равно количеству электронов, необходимому для заполнения восьми электронов в валентной оболочке.
(2) Равно количеству электронов, необходимому для заполнения восьми электронов в валентной оболочке.
Что такое валентность углерода?
Внешняя электронная конфигурация углерода 2, 4. Таким образом, он имеет 4 валентных электрона. Итак, валентность углерода равна 4,
.Какова валентность железа и железа?
Валентность элемента всегда является целым числом.Некоторые элементы обладают более чем одной валентностью, т. е. имеют переменную валентность. В сульфате железа [II] или сульфате железа, т. е. FeSO4, валентность железа равна двум. В сульфате железа [III] или сульфате железа, т. е. Fe2(SO4)3, валентность железа равна трем.
Какова валентность железа в Fe2O3?
Валентность железа в Fe2O3 равна 3. Формула оксида железа (III) представлена как Fe2O3. Формула получена путем определения валентности соединения.
Является ли CaO известью?
Оксид кальция (CaO), широко известный как негашеная или негашеная известь, является широко используемым химическим соединением.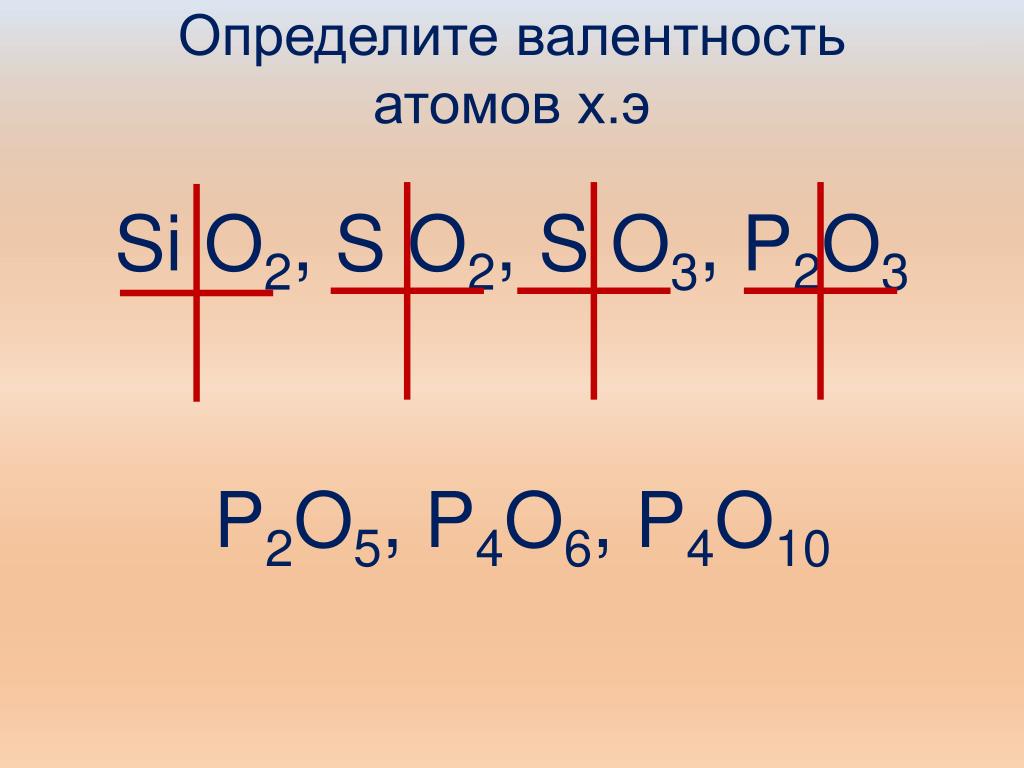 Это белое, едкое, щелочное кристаллическое твердое вещество при комнатной температуре. Оксид кальция, который выдерживает обработку без реакции в строительных продуктах, таких как цемент, называется свободной известью.
Это белое, едкое, щелочное кристаллическое твердое вещество при комнатной температуре. Оксид кальция, который выдерживает обработку без реакции в строительных продуктах, таких как цемент, называется свободной известью.
Сколько всего атомов в h3O2?
Молекулярная формула перекиси водорода: h3O2; в каждой молекуле два атома Н и два атома О.
Каково общее число валентных электронов в O3?
Озон (O3)
Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.осталось 14 электронов.
Является ли h3O2 линейным?
Примечание. Поскольку перекись водорода не является линейной по форме и имеет структуру открытой книги со спинами 0-O, поэтому не должно быть путаницы при выборе правильного варианта, который является нелинейным, как упоминалось выше.
Является ли h3O2 кислотой?
Перекись водорода является слабой кислотой и может образовывать гидроперекись или пероксидные соли или производные многих металлов.
Какой тип связи у h3O2?
Перекись водорода h3O2 имеет структуру H—O—O—H, где каждая черточка в этой структурной формуле представляет собой одинарную ковалентную связь.То есть каждая связь включает пару общих электронов, формально с одним электроном от каждого из атомов на концах связи.
Что означает 30% h3O2?
30% вес/объем означает, что у вас есть 30 граммов соединения в 1 литре раствора. 0,1 моль означает, что в 1 л раствора содержится 0,1 моль соединения. 0,1 моль h3O2 равен 3,401 грамма h3O2. Итак, нужно взять 11,3 мл раствора и развести до 1000 мл.
Что означают 20 объемов h3O2?
20 объемов h3O2 означает, что 20 литров кислорода получают на СТП разложением 1 литра раствора h3O2 2h3O2→2h3O+O2 2 моль 1 моль 68 г 22.4 литра при нормальных условиях 22,4 литра кислорода получается из 68 г h3O2 ∴ 20 литров кислорода получается из = 6822,4×20=60,7gh3O2 ∴ 1000 мл раствора h3O2 содержит 60,7 г h3O2 100 мл
Что означает 10 объемов h3O2?
Это означает, что 1 мл h3O2 даст 10 мл кислорода при н. т.п.
т.п.
Является ли h3O2 жидкостью?
Перекись водорода представляет собой бесцветную жидкость при комнатной температуре с горьким вкусом. Небольшие количества газообразной перекиси водорода естественным образом присутствуют в воздухе.Перекись водорода нестабильна, легко разлагается на кислород и воду с выделением тепла.
Нужно ли чистить зубы после использования перекиси водорода?
Продолжайте добавлять перекись водорода, пока не получите однородную пасту. Нанесите пасту на зубы с помощью зубной щетки. Оставьте пасту на зубах на две минуты. Тщательно промыть зубную пасту, полоскать горло водой.
Каково отношение количества кислорода в воде к количеству перекиси водорода?
Соотношения соединения водорода и кислорода в воде и перекиси водорода составляют 1:8 и 1:16.
Кто открыл протон?
Прошло 100 лет с тех пор, как Эрнест Резерфорд опубликовал свои результаты, доказывающие существование протона. На протяжении десятилетий протон считался элементарной частицей.
Роль электрогенерируемого in situ мостика h3O2···в деградации тетрациклина, регулируемой механохимическим закреплением Si-O Cu2+ в качестве электронного челнока во время процесса E-пероксона
https://doi.org/10.1016/j.apcatb.2021.120930Get права и содержаниеОсновные моменты
- •
Улучшенный Е-пероксон был достигнут за счет стратегии гетерогенного интерфейса.
- •
TC может эффективно минерализоваться в ходе реакции CuSi-BM 60 /E-пероксона.
- •
Повышение валентности в активных центрах за счет измельчения в шаровой мельнице способствовало переносу электронов.
- •
Si-O···Cu···HO-OH* проявляет сильное взаимодействие с H 2 O 2 .
- •
Интерфейсный комплекс уменьшил разрыв HOMO-LUMO и улучшил генерацию ROS.
Abstract
Эффективная минерализация тетрациклина (ТЦ) и механизм реакции были исследованы путем создания гетерогенных H 2 O 2 ···мостиков, связанных с активными центрами в соединениях с более высокой валентностью. CuSi-BM 60 был синтезирован путем закрепления Cu 2+ на функциональных группах Si-O MCM-48 с помощью механохимической технологии для облегчения обработки электропероксоном (E-пероксон). Результаты показали, что катализаторы в виде электронного челнока усиливают перенос электронов и образование активных форм кислорода (АФК), демонстрируя полную деградацию тетрациклина (ТС) и превосходную минерализацию (73.2%, 60 мин). Участки Cu значительно увеличили взаимодействие с электрогенерированным in situ H 2 O 2 , создавая неравномерное распределение электронного облака за счет мостика связи Si-O···Cu···HO-OH*, что увеличило длину связи HO /угол вблизи Cu и уменьшение орбитальной щели между уровнями энергии. Эта работа позволила по-новому взглянуть на комплекс опосредованного шаровым измельчением Cu 2+ с H 2 O 2 , сопровождающийся циклом расщепления связи HO и регенерацией для эффективного производства ROS во время E-пероксона.
CuSi-BM 60 был синтезирован путем закрепления Cu 2+ на функциональных группах Si-O MCM-48 с помощью механохимической технологии для облегчения обработки электропероксоном (E-пероксон). Результаты показали, что катализаторы в виде электронного челнока усиливают перенос электронов и образование активных форм кислорода (АФК), демонстрируя полную деградацию тетрациклина (ТС) и превосходную минерализацию (73.2%, 60 мин). Участки Cu значительно увеличили взаимодействие с электрогенерированным in situ H 2 O 2 , создавая неравномерное распределение электронного облака за счет мостика связи Si-O···Cu···HO-OH*, что увеличило длину связи HO /угол вблизи Cu и уменьшение орбитальной щели между уровнями энергии. Эта работа позволила по-новому взглянуть на комплекс опосредованного шаровым измельчением Cu 2+ с H 2 O 2 , сопровождающийся циклом расщепления связи HO и регенерацией для эффективного производства ROS во время E-пероксона.
Ключевые слова
Ключевые слова
Гетерогенные E-Peroxone
Якорь Cu
TetracyCline
TetracyCline
Электронный трансфер
Интерфейсный Комплекс
Рекомендуемые статьи со статей оцифровки (0)
Смотреть полный текст© 2021 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Сколько валентных электронов в h3O2? — Ответы на все
Сколько валентных электронов в h3O2?
14 валентных электронов
Какова валентность h3O2?
Валентность пероксида равна 2.Валентность многоатомных ионов – это абсолютное значение заряда иона. Валентность ионов можно представить как…
Что такое точечная структура Льюиса у h3O2?
Структура Льюиса перекиси водорода (h3O2) содержит две связи O-H и одну связь O-O. Кроме того, у каждого атома кислорода есть две неподеленные пары. Представления о числе полных валентных электронов атомов кислорода и водорода используются для построения структуры Льюиса h3O2.
Какая формула у h3O2?
Перекись водорода — это химическое соединение с формулой h3O2.В чистом виде это очень бледно-голубая жидкость, немного более вязкая, чем вода.
Перекись является щелочной или кислотной?
Перекись водорода — слабая кислота, образующая гидроперекись или пероксидные соли со многими металлами.
Повышает ли перекись водорода pH?
Вода, используемая для приготовления коммерческих растворов h3O2, как правило, очень высокого качества (т. е. деионизированная, с низкой кислотностью) и поэтому не оказывает существенного влияния на (реальный) pH продукта… Каково значение pH растворов h3O2?
| Самый низкий | Умеренный | Самый высокий |
|---|---|---|
| Электронный (травление) | Стандартный | Металлургический |
| Фармацевтика | Разбавление | |
| Реагент (лабораторный) | ||
| NSF |
Лимон нейтрален?
Лимонный сок в своем естественном состоянии является кислым с рН около 2, но после метаболизма он фактически становится щелочным с рН значительно выше 7. Итак, вне организма любой может увидеть, что лимонный сок очень кислый. Однако доказано, что после полного переваривания его действие оказывает подщелачивающее действие со многими преимуществами для здоровья.
Итак, вне организма любой может увидеть, что лимонный сок очень кислый. Однако доказано, что после полного переваривания его действие оказывает подщелачивающее действие со многими преимуществами для здоровья.
Каков рН яблочного уксуса?
Помимо уксусной кислоты яблочный уксус может также содержать небольшое количество яблочной и лимонной кислот. pH яблочного уксуса составляет около 2-3, что считается умеренно кислым. (pH — это показатель кислотности, где 1 — самый кислый, а 7 — нейтральный.)
Используется ли h3o2 для смягчения воды?
Как и хлор, перекись водорода является сильным окислителем и может быстро устранить запахи.Однако, в отличие от хлора, перекись водорода не оставляет следов химических побочных продуктов. При введении перекиси водорода в воду выделяется большое количество растворенного кислорода и имеет место сильный окислительный эффект.
Какое УФ убивает грибок?
ультрафиолетовый
Полезен ли солнечный свет для грибка на ногах?
Ежедневное пребывание под прямыми солнечными лучами может занять от трех до шести месяцев, чтобы избавить ваш ноготь от грибка. Обеспечьте своим ногам как можно больше естественного света.Ношение сандалий — один из способов помочь вашим ногам получать больше солнечного света.
Обеспечьте своим ногам как можно больше естественного света.Ношение сандалий — один из способов помочь вашим ногам получать больше солнечного света.
Полезен ли солнечный свет при грибковых инфекциях?
Грибы любят темноту, и однажды мы сможем обратить этот факт против них, чтобы бороться с грибковыми инфекциями. Новые исследования показывают, что способ, которым грибок Cryptococcus neoformans обнаруживает свет, играет определенную роль в его вирулентности.
«Валентность и молекулярная структура», лекция 3. Видеоклип: лекция 3, часть 5. (6:39)
Линус Полинг: Очень важное использование валентности, старомодной валентности, было в уравнениях баланса
для окислительно-восстановительных реакций.Теперь эта вэйланс, старая идея вэйланса,
заменены рядом новых и более точных понятий, у нас остается проблема
что-то делать с окислительно-восстановительными реакциями, и эта проблема
решается введением другого понятия — понятия степени окисления.
Числа окисления, присвоенные атомам, позволяют нам отслеживать электроны в Простой способ.В то время как другие аспекты валентности, которые мы обсуждали, меньше, менее искусственны, на самом деле это попытка понять, на что похожа природа, просто что электроны делают в комплексе, таком как ион гексаммина кобальта, окисление число по своей природе искусственно. Это то, что мы вводим с использованием определенных правил.
Одно из правил относительно степени окисления состоит в том, что в элементе степень окисления
число атомов равно нулю.Например, в молекуле хлора Cl 2 каждый атом хлора начинается с семнадцати электронов, два из которых являются
разделены, но мы разделим эти два электрона между двумя атомами, так что каждый атом по-прежнему
имеет семнадцать, без результирующего заряда, и мы говорим, что для Cl 2 в Cl степень окисления каждого атома равна нулю. Аналогично для водорода аналогично
для меди, алюминия или любого другого металла электроны делятся поровну
среди атомов, и в той мере, в какой существует каждый атом, в той мере, в какой весь металл
электрически нейтральны, отдельные атомы также должны быть электрически нейтральны.
Аналогично для водорода аналогично
для меди, алюминия или любого другого металла электроны делятся поровну
среди атомов, и в той мере, в какой существует каждый атом, в той мере, в какой весь металл
электрически нейтральны, отдельные атомы также должны быть электрически нейтральны.
В случае такой молекулы, как H 2 O, O, H, H, электроны, общие для двух атомов разных элементов,
кислород и водород относятся к более электроотрицательным элементам. В настоящее время,
кислород, вы же помните шкалу электроотрицательности, кислород более электроотрицательный, чем
водород. Мы приписываем эти электроны кислороду, так что кислород становится O-2, водород
это H плюс один.Сумма степеней окисления в молекуле должна равняться нулю. потому что молекула электрически нейтральна. Если мы рассмотрим ион гидроксония, H,
H, H, здесь ион гидроксония, имеющий положительный заряд, снова приписываем электрону
пары, которые являются общими с водородом для атома кислорода. Кислород имеет степень окисления
минус два, водород плюс один, водород плюс один, водород плюс один, и сумма
степени окисления для всех атомов в сумме дают плюс один, что является зарядом на
сложный ион.
потому что молекула электрически нейтральна. Если мы рассмотрим ион гидроксония, H,
H, H, здесь ион гидроксония, имеющий положительный заряд, снова приписываем электрону
пары, которые являются общими с водородом для атома кислорода. Кислород имеет степень окисления
минус два, водород плюс один, водород плюс один, водород плюс один, и сумма
степени окисления для всех атомов в сумме дают плюс один, что является зарядом на
сложный ион.
Теперь перекись водорода, H 2 O 2 , степени окисления могут быть присвоены одним из двух способов. Мы можем сказать, что
водород имеет степень окисления плюс один, два атома кислорода эквивалентны, поэтому
чтобы молекула была электрически нейтральной, кислород должен иметь степень окисления
минус один. Или, зная строение молекулы, она имеет такое строение, на самом деле,
известно, что существует двугранный угол между плоскостью H-O-O и другой плоскостью H-O-O.
самолет о нас показан здесь.О-О, расстояние, ну не знаю, 1,47 ангстрем, расстояние О-Н,
0,96 ангстрем и так далее, и электронная структура, которую мы можем ему присвоить,
Вот этот. Эта пара электронов должна быть отнесена к этому атому кислорода. Общий
пара разделилась так, что у этого атома кислорода всего семь, один, два, три, четыре, пять,
шесть, семь, да, семь электронов, окружающих ядро, и, конечно же, два электрона
гелиевой оболочки тоже.Это означает, что атом кислорода оказывается с зарядом
минус один. Степень окисления кислорода минус два почти у всех оксидов. Минус
в пероксидах одинарная связь О-О, а в элементарном веществе ноль.
Или, зная строение молекулы, она имеет такое строение, на самом деле,
известно, что существует двугранный угол между плоскостью H-O-O и другой плоскостью H-O-O.
самолет о нас показан здесь.О-О, расстояние, ну не знаю, 1,47 ангстрем, расстояние О-Н,
0,96 ангстрем и так далее, и электронная структура, которую мы можем ему присвоить,
Вот этот. Эта пара электронов должна быть отнесена к этому атому кислорода. Общий
пара разделилась так, что у этого атома кислорода всего семь, один, два, три, четыре, пять,
шесть, семь, да, семь электронов, окружающих ядро, и, конечно же, два электрона
гелиевой оболочки тоже.Это означает, что атом кислорода оказывается с зарядом
минус один. Степень окисления кислорода минус два почти у всех оксидов. Минус
в пероксидах одинарная связь О-О, а в элементарном веществе ноль.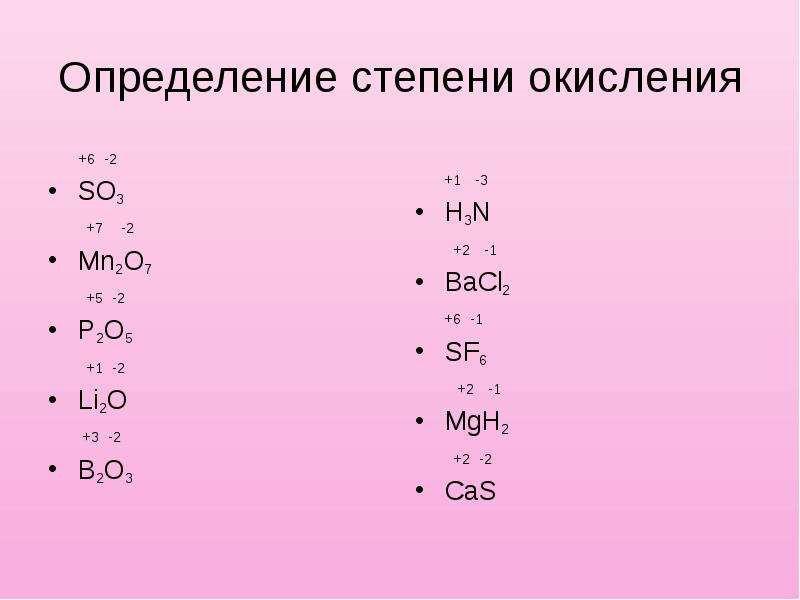
Мы можем обсуждать степени окисления других элементов, не обсуждая, в некоторых соединений, не обсуждая распределение электронов.Например, рассмотрим перманганат-ион MnO4 с зарядом минус один. Кислород, это не перекись, свойства не такие, как у вещества, содержащего одинарную кислород-кислородную связь, поэтому мы приписываем кислороду степень окисления минус два. Их четыре атомы кислорода. Это дает всего восемь отрицательных зарядов; один из них остался в самом ионе.Следовательно, марганца должно быть плюс семь.
Ну конечно с электронной структурой, какой бы ни была электронная структура
то есть каждый атом кислорода должен иметь четыре электронные пары на своей валентной оболочке, либо общие
или неразделенные, некоторые из них, вероятно, делились с марганцем, но кислорода гораздо больше
электроотрицательнее марганца, марганец находится где-то в этой области, так что мы
отнесли бы эти электронные пары к кислороду, а не к марганцу. Все семь валентностей
у него отняли электроны марганца, это марганец с окислением
число плюс семь.
Все семь валентностей
у него отняли электроны марганца, это марганец с окислением
число плюс семь.
11.16: Числа окисления и окислительно-восстановительные реакции
Окислительно-восстановительные реакции могут включать перенос протонов и другие процессы разрыва и образования связей, а также перенос электронов, и поэтому с этими уравнениями гораздо труднее иметь дело, чем с уравнениями, описывающими кислотно-щелочное взаимодействие. базовые реакции.Чтобы иметь возможность распознавать окислительно-восстановительные реакции, нам нужен метод для тщательного учета всех электронов. Это делается путем присвоения степени окисления каждому атому до и после реакции.
Например, в NO 3 – азоту присвоена степень окисления +5, а каждому кислороду – степень окисления –2. Это произвольное присвоение соответствует тому, что азот потерял свои первоначальные пять валентных электронов из-за электроотрицательных атомов кислорода. С другой стороны, в NO 2 азот имеет степень окисления + 4 и может считаться имеющим один валентный электрон, то есть на один электрон больше, чем в NO 3 – . .
С другой стороны, в NO 2 азот имеет степень окисления + 4 и может считаться имеющим один валентный электрон, то есть на один электрон больше, чем в NO 3 – . .
Это произвольно назначенное увеличение на один электрон соответствует восстановлению атома азота при переходе от NO 3 – к NO 2 . Как правило, восстановлению соответствует понижение степени окисления некоторого атома. Окисление соответствует увеличению степени окисления некоторого атома.Применяя правила степени окисления к следующему уравнению, мы получаем
 Азот восстанавливался электронами, пожертвованными медью, поэтому медь была восстановителем.Медь окислялась, потому что ее электроны были приняты окислителем, азотом (или нитрат-ионом).
Азот восстанавливался электронами, пожертвованными медью, поэтому медь была восстановителем.Медь окислялась, потому что ее электроны были приняты окислителем, азотом (или нитрат-ионом). Хотя они полезны и необходимы для распознавания окислительно-восстановительных реакций, числа окисления являются в высшей степени искусственным средством. Атом азота в NO 3 – на самом деле не имеет заряда +5, который можно уменьшить до +4 в NO 2 . Вместо этого у обоих видов существуют ковалентные связи и обмен электронными парами между азотом и кислородом, и азот, конечно, не полностью потерял свои валентные электроны в пользу кислорода.Даже несмотря на то, что это может (и должно) вызвать у вас подозрения в достоверности степеней окисления, они, несомненно, являются полезным инструментом для обнаружения процессов переноса электрона. До тех пор, пока они используются только для этой цели, а не означают, что атомы в ковалентных видах действительно имеют большие заряды, которые часто подразумевают степени окисления, их использование вполне правомерно.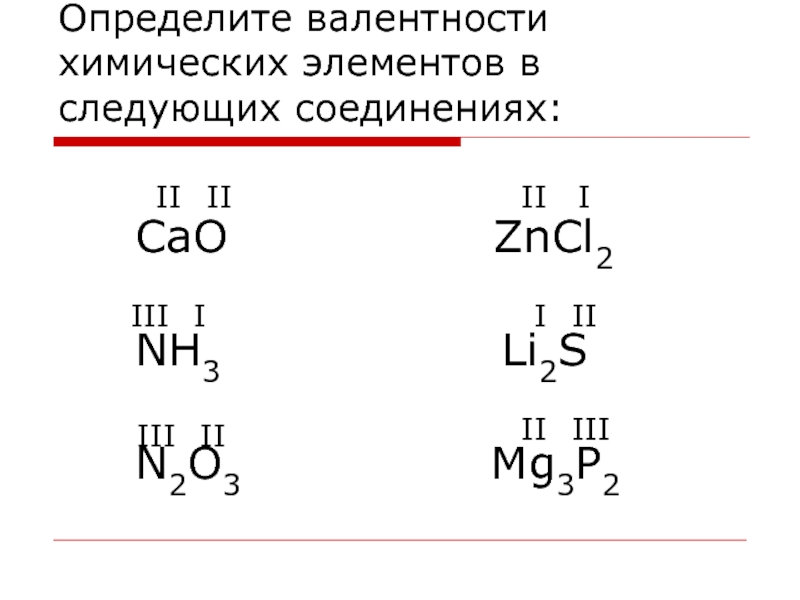
Ниже приведены общие правила для степеней окисления, взятые со следующей страницы Основного учебника по аналитической химии: Степени окисления
.Определение степеней окисления
Подсчет числа переданных электронов является неэффективным и трудоемким способом определения степеней окисления.Эти правила обеспечивают более простой метод:
- Степень окисления несвязанного элемента равна нулю. Это применимо независимо от структуры элемента: Xe, Cl 2 , S 8 , а большие структуры углерода или кремния имеют нулевую степень окисления.
- Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю.
- Сумма степеней окисления всех атомов иона равна заряду иона.
- Более электроотрицательному элементу в веществе присваивается отрицательная степень окисления. Менее электроотрицательному элементу присваивается положительная степень окисления. Помните, что электроотрицательность максимальна в правом верхнем углу таблицы Менделеева и уменьшается в левом нижнем углу.

- Некоторые элементы почти всегда имеют одинаковые степени окисления в своих соединениях:
| Элемент | Обычная степень окисления | Исключения |
| Металлы группы 1 | Всегда +1 | |
| Металлы группы 2 | Всегда +2 | |
| Кислород | Обычно -2 | Пероксиды и F 2 O (см. ниже) |
| Водород | Обычно +1 | Гидриды металлов (-1) (см. ниже) |
| Фтор | Всегда -1 | |
| Хлор | обычно -1 | Соединения с O или F (см. ниже) ниже) |
Исключения:
Водород в гидридах металлов : Гидриды металлов включают такие соединения, как гидрид натрия, NaH.Здесь водород существует в виде иона гидрида, H —. Степень окисления простого иона, подобного гидриду, равна заряду иона, в данном случае -1.
Альтернативно, сумма степеней окисления в нейтральном соединении равна нулю. Поскольку металлы группы 1 в своих соединениях всегда имеют степень окисления +1, отсюда следует, что водород должен иметь степень окисления -1 (+1 -1 = 0).
Кислород в пероксидах : Пероксиды включают пероксид водорода, H 2 O 2 .Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его.
Кислород в F 2 O : Отклонение здесь связано с тем фактом, что кислород менее электроотрицателен, чем фтор; фтор имеет приоритет со степенью окисления -1. {–} + S}\)
{–} + S}\)
Решение:
а) Соответствующие степени окисления:
Единственные атомы, которые изменяются, это Mn, от +7 до +2, восстановление, и S, от +4 до +6, окисление.Реакция представляет собой окислительно-восстановительный процесс. SO 2 окисляется MnO 4 – , поэтому MnO 4 – является окислителем. MnO 4 – был восстановлен с помощью SO 2 , поэтому SO 2 является восстановителем.б) Степени окисления
показывают, что окислительно-восстановительного потенциала не произошло. Это кислотно-щелочная реакция, потому что переносится протон, но не электроны.
c) H 2 S окислился, потеряв два электрона с образованием элементарного S.Поскольку H 2 S отдает электроны, он является восстановителем. HClO принимает эти электроны и восстанавливается до Cl – . Поскольку он принимает электроны, HClO является окислителем.
Поскольку он принимает электроны, HClO является окислителем.
Фотоактивированное разложение сточных вод, имитирующих катионный красный GTL, с использованием пероксида водорода, катализируемого Ce-Fe/Al2O3
Чжан Япин, Вэй Чаохай. Фоторазложение катионной красной GTL, имитирующей сточные воды, с использованием перекиси водорода, катализируемой Ce-Fe/Al2O3[J].Китайский журнал экологической инженерии, 2007 г., 1(9): 15-19.
| Ссылка: | Чжан Япин, Вэй Чаохай. Фоторазложение катионной красной GTL, имитирующей сточные воды, с использованием перекиси водорода, катализируемой Ce-Fe/Al2O3[J]. Китайский журнал экологической инженерии , 2007, 1(9): 15-19. |
- 1.
Институт экологической инженерии, Университет Джимей, Сямынь 361021
- 2.
Школа экологических наук и инженерии, Южно-Китайский технологический университет, Гуанчжоу 510640
- Дата получения: 07.
 15.2007
15.2007
Дата принятия: 30.03.2007
Аннотация
Исследовано разложение катионных красных сточных вод, имитирующих GTL, гетерогенной фото-реакцией Фентона с использованием катализатора Ce-Fe/Al2O3.Было исследовано влияние начальной концентрации h3O2, загрузки катализатора, начального значения pH и различных процессов на эффективность деградации. В то же время для изучения изменения валентности Fe во время реакции фото-Фентона были приняты спектроскопия диффузного отражения, инфракрасная спектроскопия с преобразованием Фурье, XPS. Результаты показывают, что катионный красный GTL, который имеет стабильную структуру, может быть разложен гетерогенной системой фото-Фентона, скорость удаления TOC 92,40% была достигнута при pH 6, температуре реакции 20 ℃, времени реакции 90 минут, 2 г / л. загрузка катализатора, 340 мг/л h3O2 и 11 Вт с низким ртутным светом до 50 мг/л GTL-содержащих имитированных сточных вод.Fe(Ⅲ) при облучении превращается в Fe(Ⅱ) в ходе фотореакции Фентона.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
 15.2007
15.2007