Свойства поваренной соли — Справочник химика 21
Ниже приведены физико-химические свойства поваренной соли [c.11]Кислотам противостоит группа веществ, называемых основани ями. (Сильные основания получили название щелочей.) Эти вещества имеют горький вкус, химически активны, меняют цвета-красителей, но на противоположные по сравнению с кислотами и т. д. Растворы кислот нейтрализуют растворы оснований. Другими словами, смесь кислоты и основания, взятых в определенной соотношении, не проявляет свойств ни кислоты, ни основания. Эта смесь представляет собой раствор соли, которая обычно химически значительно менее активна, чем кислота или основание. Таким образом, при смешении соответствующих количеств раство- ров сильной и едкой кислоты (соляной кислоты) с сильной и едкой щелочью (гидроксидом натрия) получается раствор хлорида натрия, т. е. обыкновенной поваренной соли. [c.53]
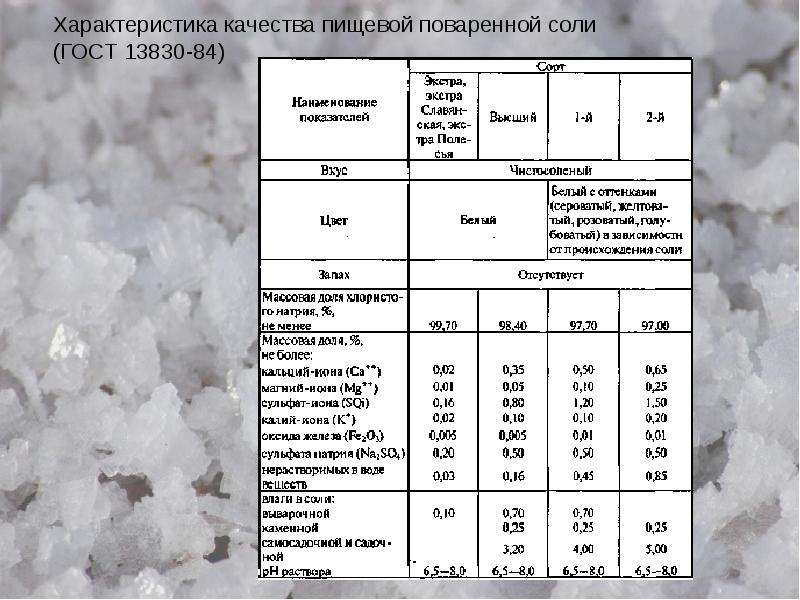
Свойства поваренной соли и ее растворов
 45]
45]Основным сырьем при производстве хлора и каустической соды служит поваренная соль. В небольших масштабах используется I также хлористый калий. Ниже приведены некоторые наиболее важные физико-химические свойства поваренной соли и хлористого калия [c.197]
Вода может принимать участие в химических реакциях при электролизе не только как восстановитель, но и как окислитель. Это свойство воды проявляется при электролизе растворов солей активных металлов. Рассмотрим электролиз раствора поваренной соли. [c.163]
С незапамятных времен поваренная соль используется при заготовлении пищи впрок. Поваренная соль применяется для предохранения органических веществ от гниения — для консервирования мяса, засолки рыбы и растительных продуктов, а также для засолки кож в кожевенном производстве. Благодаря этому свойству поваренная соль оказалась первым антисептиком она применялась, по свидетельству писателей I в., в виде порошка или раствора для обеззараживания свежих ран.
Белый обожженный диатомит получается при обжиге в присутствии флюсов, например при обжиге в течение около 1 ч при температуре до 1000°С с добавлением поваренной соли в количестве до 10%. Рассматриваемый сорт диатомита отличается особо благоприятными свойствами в качестве вспомогательного веще- [c.346]
Свойства поваренной соли [c.33]
Приведены свойства поваренной соли различного назначения и ее растворов. Рассмотрена сырьевая база производства хлорида натрия, включая галитовые отходы калийного и других производств, технология добычи технической соли, ее растворения и очистки образующихся рассолов. Особое внимание уделено получению солебрикетов, технических и кормовых сортов соли, подготовке соли и рассолов для производства карбоната натрия, хлора, гидроксида натрия, хлората натрия и др., а также вопросам коррозии аппаратуры.
Коллигативные свойства можно использовать для определения молекулярной массы вещества. Например, если, зная массу т растворенного вещества, определить температуру замерзания (кипения) раствора, то. найдя понижение, повышение) температуры замерзания (кипения) раствора, можно вычислить число молей п раств оренного вещества, а затем и саму молекулярную массу вещества М = т1п. Таким образом можно определить степень диссоциации или ассоциации вещества в растворе. В этом случае следует умножить правую часть уравнений (355) и (356) на введенный Вант-Гоффом в соответствии с уравнением (322) коэффициент . Понижение температуры замерзания раствора повареной соли примерно в два раза больше, чем для раствора сахарозы той же моляльной концентрации. На практике чаще используют криоскопический метод, так как он более прост в экспериментальном исполнении, а кроме того, как правило, криоскопическая константа для одного и того же растворителя больше, чем эбулиоскопическая. Для растворителя камфары, например, =40 К-кг/моль. [c.281]
Например, если, зная массу т растворенного вещества, определить температуру замерзания (кипения) раствора, то. найдя понижение, повышение) температуры замерзания (кипения) раствора, можно вычислить число молей п раств оренного вещества, а затем и саму молекулярную массу вещества М = т1п. Таким образом можно определить степень диссоциации или ассоциации вещества в растворе. В этом случае следует умножить правую часть уравнений (355) и (356) на введенный Вант-Гоффом в соответствии с уравнением (322) коэффициент . Понижение температуры замерзания раствора повареной соли примерно в два раза больше, чем для раствора сахарозы той же моляльной концентрации. На практике чаще используют криоскопический метод, так как он более прост в экспериментальном исполнении, а кроме того, как правило, криоскопическая константа для одного и того же растворителя больше, чем эбулиоскопическая. Для растворителя камфары, например, =40 К-кг/моль. [c.281]
Из способов консервирования посредством удаления влаги известны сушка, соление, замораживание.
 Лучший из них — соление, основанное на обезвоживающих свойствах поваренной соли и повышении осмотического давления в жидкой среде, окружающей микробы, в результате чего наступает плазмолиз— сморщивание клеток микробов и прекращение их жизнедеятельности. [c.115]
Лучший из них — соление, основанное на обезвоживающих свойствах поваренной соли и повышении осмотического давления в жидкой среде, окружающей микробы, в результате чего наступает плазмолиз— сморщивание клеток микробов и прекращение их жизнедеятельности. [c.115] Рассматривая механизм химических реакций, следует прежде всего иметь в виду, что характер взаимодействия существенно зависит от агрегатного состояния реагентов и продуктов. Реагенты и продукты, вместе взятые, образуют так называемую физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковыми химическими составом и свойствами и отделенных от остальных частей системы поверхностью раздела, называют фазой. Например, если в стакан с водой внести кристаллы поваренной соли, то в первый момент образуется двухфазная система, которая превратится в однофазную после растворения соли. Смеси газов при нормальных условиях однофазны независимо от их природы. Жидкие системы могут быть однофазны (вода и спирт) или многофазны (вода и бензол, вода и ртуть).
В случае применения концентрированных растворов неорганических веществ сказывается влияние физических свойств жидкости на характеристики газожидкостного пенного слоя [234, 250, 280]. Например, происходит менее активное обновление межфазной поверхности вследствие увеличения вязкости и поверхностного натяжения жидкости и связанного с этим изменения гидродинамической обстановки в пенном слое (см. гл. I). Однако при скоростях газа, превышающих 2,5—3 м/с, высокая турбулентность фаз в значительной степени превалирует над влиянием физических свойств жидкости. При скоростях газа, меньших 2 м/с, влияние физических свойств становится ощутимым [234, 250, 280]. Значения кинетических показателей тепло- и массопередачи для слоя пены, образованного концентрированными растворами, меньше, чем для воды и разбавленных растворов (при тех же условиях технологического режима). В качестве примера можно привести результаты опытов по теплопередаче в слое пены для некоторых производственных растворов [232, 234] — для так называемой слабой жидкости производства соды и для концентрированных растворов поваренной соли.
Значения кинетических показателей тепло- и массопередачи для слоя пены, образованного концентрированными растворами, меньше, чем для воды и разбавленных растворов (при тех же условиях технологического режима). В качестве примера можно привести результаты опытов по теплопередаче в слое пены для некоторых производственных растворов [232, 234] — для так называемой слабой жидкости производства соды и для концентрированных растворов поваренной соли.
Сырьем являются природные газы, продукты нефтепереработки, каменный уголь, горючие сланцы, древесина, поваренная соль, известь и др. Готовые химические продукты значительно отличаются своими физико-химическими свойствами и находятся в различном агрегатном состоянии жидкости, газы, порошки, гранулы, стекловидные массы. [c.27]
Наиболее ценное свойство алюминия — его легкость (алюминий в 3 раза легче стали). Именно по этой причине он так широко используется в авиационной промышленности. В этих же целях потребляются и большие количества магния — еще более легкого металла.
Свои результаты вы используете, чтобы определить, какие из них — металлы, какие — неметаллы, а какие относятся к элементам с промежуточными свойствами. Вы изучите внешний вид элементов, чтобы составить впечатление о таких свойствах, как цвет, отражательная способность, физическое состояние (являются ли они кристаллическими, как, например, поваренная соль). Ударя образец молотком, вы определите, ковкий ли это материал или хрупкий. Также вы можете испытать вещество на электрическую прово-
Для снижения температуры плавления поваренной соли к электролиту добавляют некоторые соли. Однако эти добавки не должны содержать ионы, способные восстанавливаться на катоде вместе с натрием, ухудшать свойства электролита (электропроводность, плотность, вязкость и др.) и способствовать разряду на аноде какого-либо нежелательного продукта, например кислорода. [c.520]
Однако эти добавки не должны содержать ионы, способные восстанавливаться на катоде вместе с натрием, ухудшать свойства электролита (электропроводность, плотность, вязкость и др.) и способствовать разряду на аноде какого-либо нежелательного продукта, например кислорода. [c.520]
Кроме воды, для тушения пожаров можно применять водные растворы двууглекислого и углекислого натрия, поташа, хлористого аммония, поваренной соли, глауберовой соли, аммиачнофосфорных солей, сернокислой меди, а также четыреххлористый углерод, бромэтил и другие соединения галогенов. Огне-гасительное действие водных растворов солей отличается от огнегасительных свойств воды тем, что соли, выпадая из раствора, образуют на поверхности горящего вещества изолирующие пленки, отнимающие дополнительное тепло, которое затрачивается на последующее разложение этих солей в зоне горения при этом выделяются инертные огнегасительные газы. [c.447]
Фаза — это однородность, обладающая во всех элементах объема одинаковыми химическими и термодинамическими свойствами и отделенная от других фаз поверхностью раздела.
 Фаза может быть разбита на отдельные части, но это не увеличивает числа фаз в системе. Например, в насыщенном растворе поваренной соли при наличии на дне сосуда любого числа кристалликов соли и пара над раствором будем иметь одну кристаллическую, одну жидкую и одну парообразную фазы. Здесь кристаллическая и парообразная фазы— чистые (однокомпонентные), а раствор — смешанная (многокомпонентная) фаза. [c.40]
Фаза может быть разбита на отдельные части, но это не увеличивает числа фаз в системе. Например, в насыщенном растворе поваренной соли при наличии на дне сосуда любого числа кристалликов соли и пара над раствором будем иметь одну кристаллическую, одну жидкую и одну парообразную фазы. Здесь кристаллическая и парообразная фазы— чистые (однокомпонентные), а раствор — смешанная (многокомпонентная) фаза. [c.40] В качестве примеров сопоставим свойства атомов, молекул и ионов хлора, водорода и натрия. Хлор — желто-зеленый газ, сильно ядовит, с резким удушливым запахом. Ионы хлора, входящие в состав поваренной соли, не ядовиты, не окрашены, не имеют запаха. Атомарный водород не имеет ни цвета, ни вкуса, ни запаха. А ионы водорода придают кислый вкус раствору, в котором содержатся и изменяют цвет лакмусовой бумажки. Атомы натрия бурно взаимодействуют с водой, тогда как ионы свободно растворяются в ней.
Свойство поваренной соли понижать в растворе температуру замерзания воды с древних времен используется для борьбы с гололедом на дорогах. Предприятия коммунального и дорожного хозяйства в зимнее время года давно применяют поваренную соль для посыпки дорог, для предупреждения аварий и травматизма. На посыпку дорог используется в основном попутная соль калийных производств. По данным ГИПРОДОРНИИ, потребность в поваренной соли только для автодорожных предприятий РСФСР к 1990 г. составит 1,8 млн. т/год. [c.16]
Предприятия коммунального и дорожного хозяйства в зимнее время года давно применяют поваренную соль для посыпки дорог, для предупреждения аварий и травматизма. На посыпку дорог используется в основном попутная соль калийных производств. По данным ГИПРОДОРНИИ, потребность в поваренной соли только для автодорожных предприятий РСФСР к 1990 г. составит 1,8 млн. т/год. [c.16]
Бывают случаи, когда для улучшения эксплуатационных свойств бетонных констр укций приходится их подвергать действию веществ, заведомо агрессивных. Так, в зимнее время для предотвращения образования наледей и облегчения очистки от льда и снега дорожные покрытия нередко посыпают поваренной солью или хлоридом кальция. [c.187]
Образуюи1неся при электролитической диссоциации ионы в отличие от нейтральных атомов и молекул имеют электрический заряд и поэтому обладают совершенно иными свойствами. Так, например, атомарный водород является энергичным восстановителем, в то время как нон водорода обладает окислительными свойствами. Поваренная соль, содержащая ион хлора, употребляется в пищу, тогда как свободный-хлор (0,01% и выше) отравляет организм человека. [c.14]
Поваренная соль, содержащая ион хлора, употребляется в пищу, тогда как свободный-хлор (0,01% и выше) отравляет организм человека. [c.14]
В последнее время ВНИИСоль провел ряд научных работ по изучению опыта смежных отраслей промышленности в области сушки комкующихся материалов, созданию эффективных сушильных аппаратов, анализу работы сушилок в соляной промышленности и исследованию свойств поваренной соли как объекта сушки. Результаты этих работ были использованы для оценки перспективности применения различных сушилок для поваренной соли [20]. [c.183]
Стехиометрические нарушения, а также инородные примеси неизбежно вызовут местные искажения геометрического порядка в кристалле. Все эти нарушения могут в ряде случаев привести к тому, что кристалл окажется разделенным трещинами на отдельные микрокристаллические блоки, в той или другой степени скрепленные друг с другом. Такое блочное строение характерно для многих кристаллических тел (например, различные силикагели, алюмогели, активированный уголь и др,), имеющих важное значение в гетерогенном катализе. Таким образом, в реальном кристалле, кроме обусловленных термодинамическими причинами тепловых дефектов, имеются необратимые нарушения, связанные с историей образования данного образца, так называемые биографические дефекты. Поскольку нарушения решетки приводят к энергетической неравноценности отдельных элементов кристалла, наличие этих нарушений облегчает образование и дополнительного количества тепловых дефектов, число которых может быть значительно больше, чем в идеальном кристалле. Отклонения от свойств идеального кристалла могут быть обнаружены и экспериментально. Так, сухие кристаллы поваренной соли разрушаются при натяжениях порядка 4 кГ/см , в то время как теоретический расчет дает величину порядка 200 кГ1см . Если же эксперимент проводить с кристаллом, погруженным в насыщенный раствор соли, т, е, в условиях, когда возможно залечивание микродефектов, опытная нагрузка приближается к теоретической. Изучение интенсивности отражения от кристалла рентгеновских лучей (Ч, Г. Дарвин) показало, что многие кристаллические тела состоят из совокупности микрокристаллов, повернутых друг к другу под различными углами.
Таким образом, в реальном кристалле, кроме обусловленных термодинамическими причинами тепловых дефектов, имеются необратимые нарушения, связанные с историей образования данного образца, так называемые биографические дефекты. Поскольку нарушения решетки приводят к энергетической неравноценности отдельных элементов кристалла, наличие этих нарушений облегчает образование и дополнительного количества тепловых дефектов, число которых может быть значительно больше, чем в идеальном кристалле. Отклонения от свойств идеального кристалла могут быть обнаружены и экспериментально. Так, сухие кристаллы поваренной соли разрушаются при натяжениях порядка 4 кГ/см , в то время как теоретический расчет дает величину порядка 200 кГ1см . Если же эксперимент проводить с кристаллом, погруженным в насыщенный раствор соли, т, е, в условиях, когда возможно залечивание микродефектов, опытная нагрузка приближается к теоретической. Изучение интенсивности отражения от кристалла рентгеновских лучей (Ч, Г. Дарвин) показало, что многие кристаллические тела состоят из совокупности микрокристаллов, повернутых друг к другу под различными углами. При этом было установлено, что для большинства кристаллических тел линейный размер отдельных блоков равен 10 -ь10- см. Такой же результат был получен и при исследовании лауэграмм механически деформируемых кристаллов (А. Ф. Иоффе). Объемная блочная [c.340]
При этом было установлено, что для большинства кристаллических тел линейный размер отдельных блоков равен 10 -ь10- см. Такой же результат был получен и при исследовании лауэграмм механически деформируемых кристаллов (А. Ф. Иоффе). Объемная блочная [c.340]
Важнейшие соединения этого класса — алюмосиликаты (например, нефелин Na [AlSi04]). От алюмосиликатов следует отличать силикаты алюминия, в которых алюминий не входит в каркас и имеет обычно октаэдрическую координацию, например гранат АЬСаз [3104]з. Структура силикатов определяет их свойства. Слоистые силикаты — слюды легко раскалываются на тонкие пластины, т. е. обладают спайностью. Каркасные алюмосиликаты с широкими каналами в структуре называются цеолитами и служат в качестве молекулярного сита, пропускающего молекулы только определенного размера. Кроме того, они играют роль ионообменников — легко обменивают содержаш ийся в них ион натрия на кальций и магний. В этом качестве они прекрасное средство уменьшения жесткости воды. При истощении обменной способности цеолита он может быть регенерирован обработкой 5—10%-ным раствором поваренной соли. [c.139]
При истощении обменной способности цеолита он может быть регенерирован обработкой 5—10%-ным раствором поваренной соли. [c.139]
По причинам медицинского характера людям с высоким давлением крови рекомендуют ограничить содержание ионов натрия в пище. Хлорид калия служит доступным заменителем обычной поваренной соли Na l. Напишите формулу хлорида калия. Почему его свойства напоминают свойства хлорида натрия [c.134]
Однако эта теория сразу же встретилась с затруднениями. Так, в соляной кислоте не удалось обнаружить кислород. Лавуазье считал, что со временем это будет сделано. Он предположил, что соляная кислота является кислородным соединением некоторого радикала, названного им мурием (muria — старинное латинское название поваренной соли). Тем не менее, тщательные исследования состава синильной и сероводородной кислот, выполненные Бертолле, и дальнейшее исследование состава соляной кислоты, проведенное Гей-Люссаком и Тенаром (Франция) и Дэви (Англия), показали, что кислород в этих веществах не содержится. То же самое было установлено для фтороводородной, иодоводо-родной и бромоводородной кислот. Эти факты находились в непреодолимом противоречии с кислородной теорией Лавуазье. Кроме того, эта теория не объясняла, почему оксиды металлов, которые тоже содержат кислород, обладают не кислотными, а основными свойствами. [c.231]
То же самое было установлено для фтороводородной, иодоводо-родной и бромоводородной кислот. Эти факты находились в непреодолимом противоречии с кислородной теорией Лавуазье. Кроме того, эта теория не объясняла, почему оксиды металлов, которые тоже содержат кислород, обладают не кислотными, а основными свойствами. [c.231]
Рекомендации ВНИИсоль по материальному оформлению установок для получения хлористого натрия. Для защиты металлических поверхностей, не подверженных эрозии кристаллами поваренной соли, следует применять лакокрасочные материалы. Лучшим материалом является эпоксидная шпаклевка ЭП-0010, обладающая высокими защитными свойствами и высокой адгезией поверхности металла. Кроме того, она не требует предварительной грунтовки поверхности, подлежащей защите. [c.116]
Поваренная соль (Na l) применяется для усиления структурно-механических свойств растворов из натриевых глин. Вводится ее около 0,1-0,3%, при дальнейшем увеличении концентрации соли может произойти коагуляция, флокуляция, потеря прочности структуры. [c.57]
[c.57]
В алкиламмониевых солях ион аммония играет ту же роль, что. и натрий в поваренной соли. Поэтому можно предполагать, что свободный аммоний или его алкильные производные по своим химическим свойствам должны быть близки щелочным металлам. Сравнительно давно были предприняты попытки (Муассан) выделить свободные радикалы аммония. Шлубах показал, что тетраэтиламмоний ( 2Hs)4N может быть получен ei растворе в жидком аммиаке, если подвергать электролизу сильно охлажденный раствор иодистого тетраэтиламмония в жидком аммиаке или действовать на хлористый тетраэтиламмоний литием, растворенным в жидком аммиаке [c.165]
При действии на растворы полисахаридов бактериями определенного вида протекают процессы, направленность которых приводит к получению новых сложных по химическому строению веществ — биополимеров. В зависимости от синтеза (температуры, концентрации растворов, содержания примесей и т. д.) при использовании различных видов и штаммов бактерий, свойства получаемых препаратов колеблются в широких пределах. В зарубежной практике бурения испытан ряд биополимеров ХЗ, ХР8 и др. По литературным данным, биополимеры обладают достаточно высокой стабилизирующей способностью в присутствии большого количества поваренной соли и водорастворимых солей двух-и поливалентных металлов. Некоторые из биополимеров обладают особыми свойствами селективного взаимодействия с выбуренными горными породами, флокулируя последние. При этом они не взаимодействуют или слабо взаимодействуют с другими компонентами промывочных жидкостей. Биополимеры с флокулирующими горные породы свойствами особенно перспективны при применении безглинистых промывочных жидкостей с низкой водоотдачей (водные растворы защитных коллоидов). Благодаря применению биополимеров такие системы в процессе бурения не обогащаются твердой фазой за счет выбуриваемых пород, т. е. не переходяг в естественные суспензии. Водные растворы биополимеров находят применение в качестве промывочных жидкостей при бурении [c.153]
В зарубежной практике бурения испытан ряд биополимеров ХЗ, ХР8 и др. По литературным данным, биополимеры обладают достаточно высокой стабилизирующей способностью в присутствии большого количества поваренной соли и водорастворимых солей двух-и поливалентных металлов. Некоторые из биополимеров обладают особыми свойствами селективного взаимодействия с выбуренными горными породами, флокулируя последние. При этом они не взаимодействуют или слабо взаимодействуют с другими компонентами промывочных жидкостей. Биополимеры с флокулирующими горные породы свойствами особенно перспективны при применении безглинистых промывочных жидкостей с низкой водоотдачей (водные растворы защитных коллоидов). Благодаря применению биополимеров такие системы в процессе бурения не обогащаются твердой фазой за счет выбуриваемых пород, т. е. не переходяг в естественные суспензии. Водные растворы биополимеров находят применение в качестве промывочных жидкостей при бурении [c.153]
К-4. В результате неполного гидролиза полиакрилонитрила в присутствии щелочи получают реагент К-4. По стабилизирующим свойствам и термостойкости реагент К-4 мало отличается от гипана-0,7. Воздействие реагента К-4 на предельное СНС промывочных жидкостей несколько отличается от действия гипана. При концентрации реагента К-4 до 0,3%) величина СНС снижается незначительно и остается достаточно высокой даже в случае минерализации промывочной жидкости вплоть до полного насыщения поваренной солью. Исследованиями У. Д. Ма-маджанова и М. К. Турапова показана высокая термоустой- [c.163]
По стабилизирующим свойствам и термостойкости реагент К-4 мало отличается от гипана-0,7. Воздействие реагента К-4 на предельное СНС промывочных жидкостей несколько отличается от действия гипана. При концентрации реагента К-4 до 0,3%) величина СНС снижается незначительно и остается достаточно высокой даже в случае минерализации промывочной жидкости вплоть до полного насыщения поваренной солью. Исследованиями У. Д. Ма-маджанова и М. К. Турапова показана высокая термоустой- [c.163]
По данным лабораторных исследований, метас обеспечивает устойчивое снижение водоотдачи неминерализованных промывочных жидкостей, подвергшихся прогреву до 250° С. По своим защитным свойствам в условиях высоких температур и минерализации (поваренная соль, сульфат натрия) метас соответствует гипану-0,7 или превосходит его [55]. [c.165]
Достаточно высокие техгсико-экономические показатели бурения при сохранении устойчивости стенок скважин в солевом комплексе имеют место при применении гидрофобных эмульсий (эмульсии второго рода) или, как их чаш,е называют, инвертные или обращ,енные эмульсии. Инвертные эмульсии могут содержать большое количество воды (до 80%) и обладать свойствами РНО, т. е. инертностью к разбуриваемым породам, в том числе к солям. При этом вода, содержаш,аяся в эмульсиях, как правило, сильно-минерализованная, содерлгит хлористый кальций, поваренную соль вплоть до насыш,ения и другие соли. [c.222]
Инвертные эмульсии могут содержать большое количество воды (до 80%) и обладать свойствами РНО, т. е. инертностью к разбуриваемым породам, в том числе к солям. При этом вода, содержаш,аяся в эмульсиях, как правило, сильно-минерализованная, содерлгит хлористый кальций, поваренную соль вплоть до насыш,ения и другие соли. [c.222]
Белки чрезвычайно разнообразны. При переходе от одного белка к другому не только и зменяется качественный и количественный аминокислотный состав, но наблюдаются также большие различия в ф изико-химических свойствах. Многие белки, подобно альбуминам, образуют в воде коллоидные растворы другие, например глобулины, не растворяются в воде, но растворимы в растворах нейтральных солей (поваренная соль и др.) кератин, эластин, фиброин и аналогичные им белки характеризуются полной нерастворимостью. Между белками, образующими коллоидные растворы, в свою очередь, существуют различия в отношении способности к высаливанию и осаждению. Эти различия в растворимости используются для разделения белков наряду с описанными [c. 395]
395]
Другое важное понятие при рассмотрении фазового равновесия — компонент. Компонент — это однородная по химическим свойствам часть термодинамической системы, которая может быть выделена из нее и может существовать изолированно неограниченное время. Так, водный раствор поваренной соли, хотя и состоит из частиц Na , l и Н. О, является двухкомпонентной системой. Действительно, в изолированном состоянии существуют только молекулы поваренной соли Na l и воды HjO, а ионы Na» и С1 существовать в отдельности не могут. [c.191]
Все окружающие нас предметы состоят из различных веществ. Каждое вещество обладает набором характерных свойств, которые не зависят от формы, размеров и прочих характеристик предмета, который сделан из данного вещества. Какие это свойства Давайте представим медный таз, медную проволоку и украшение из меди. Такие разные гю весу, форме, размерам, они имеют одинаковый красноватый цвет, одинаковую плотность, все эти предметы начнут плавиться при одной и той же температуре Г будут растворяться в концентрированной серной кислоте, но останутся невредимы в разбавленной соляной, т. е. проявят одинаковые физические и химические свойства. А поваренную соль мы узнаем и в супе, и в соляной колонне, и в красивых кристаллах по характерному вкусу. Присутствие небольших количеств аммиака мы определяем по резкому Т. е. все эти свойства являюгся типичными характеристиками вещества. А вот среди характеристик предмета мы укажем вещество (или смесь веществ), из которого он состоит. [c.16]
е. проявят одинаковые физические и химические свойства. А поваренную соль мы узнаем и в супе, и в соляной колонне, и в красивых кристаллах по характерному вкусу. Присутствие небольших количеств аммиака мы определяем по резкому Т. е. все эти свойства являюгся типичными характеристиками вещества. А вот среди характеристик предмета мы укажем вещество (или смесь веществ), из которого он состоит. [c.16]
Вещества с ионным характером связи при обычных условиях, как правило, являются твердыми, с высокими температурз ми плавления и кипения, расплавы этих соединений и растворы проводят электрический ток. Например, температура плавления Na l равна 800°С, а температура кипения 1454°С. Эти свойства объясняются тем, что ионы в веществах типа поваренной соли Na I сильно взаимодействуют друг с другом вследствие тою, что положительно заряженный ион натряя притягивает к себе отрицательно заряженный ион хлора, [c.75]
В 1869 г. профессор Киевского университета Борщов в классической работе О свойствах и строении коллоидов, участвующих в образовании растительных и животных организмов четко сформулировал представления о коллоидах- Коллоидные системы он характеризовал как системы многофазные (гетерогенные), отличая их от истинных растворов как систем однофазных (гомогенных). Борщов считал, что вещества могут существовать как в кристаллическом, так и в коллоидном состоянии, переходить из одного состояния в другое. Эти представления полностью подтверждены последующими работами. В частности, великий русский химик Менделеев еще в девяностых годах прошлого столетия указывал, что почти все тела в природе могут находиться в коллоидном состоянии. Впоследствии это положение экспериментально было подтверждено В еймарном. Он показал, что даже такие типичные, по Грему, кристаллоиды, как поваренная соль и хлористый кальций, могут быть получены в коллоидном состоянии в органических растворителях. [c.8]
Борщов считал, что вещества могут существовать как в кристаллическом, так и в коллоидном состоянии, переходить из одного состояния в другое. Эти представления полностью подтверждены последующими работами. В частности, великий русский химик Менделеев еще в девяностых годах прошлого столетия указывал, что почти все тела в природе могут находиться в коллоидном состоянии. Впоследствии это положение экспериментально было подтверждено В еймарном. Он показал, что даже такие типичные, по Грему, кристаллоиды, как поваренная соль и хлористый кальций, могут быть получены в коллоидном состоянии в органических растворителях. [c.8]
Исследовательская работа «Поваренная соль и ее свойства»
МУНИЦИПАЛЬНОЕ ОБЩЕОБРЗОВАТЕЛЬНОЕ БЮДЖЕТНОЕ УЧЕРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОАТЕЛЬНАЯ ШКОЛА с.ОКТЯБРЬСКОЕ МУНИЦИПАЛЬНОГО РАЙОНА СТЕРЛИТАМАКСКИЙ РАЙОН
РЕСПУБЛИКИ БАШКОРТОСТАН
Выполнила: учениц 8 класса МОБУ СОШ с. Октябрьское
Октябрьское
Шайжанова Альбина Акбулатовна
Руководитель: учитель химии Исхакова Руфина Ураловна
2014
СОДЕРЖАНИЕ
Введение………………………………………………………………………………………………………………….3 стр.
Глава I.Основная часть
1.1.Обзор литературы
1.1.1.История поваренной соли…………………………………………………………………4 стр.
1.1.2.Способы добычи и основные месторождения поваренной соли……………………4 стр.
1.1.3.Значимость соли, её свойства и состав………………………………………………5 стр.
1.1.4. Советы по использованию соли……………………………………………………..7 стр.
Глава II. Экспериментальная часть
2.1.Описание проведенных испытаний………………………………………………………………………8 стр.
2.2.Результаты………………………………………………………………………………….9 стр.
2.3.Выводы……………………………………………………………………………………. 9стр.
9стр.
Заключение…………………………………………………………………………………………………………………10 стр.
Библиографический справочник………………………………………………………………………………….11 стр.
Приложение………………………………………………………………………………………………………………..12 стр.
ВВЕДЕНИЕ
Хлорид натрия NaCl — хорошо растворимая в воде соль, известна под названием поваренная. Соль является минеральным веществом. Без нее невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищи. Значение соли отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека.»Хлеб да соль» — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значении соли. Хлеб и соль стали символом гостеприимства и радушия русской нации. Говорят: “Чтобы узнать человека, надо с ним пуд соли съесть». [1]. Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли. Одна присказка «без золота прожить можно, а без соли нельзя» чего стоит! Значит соль важный минерал и в связи с этим у нее особые свойства. Тема нашего исследования «Поваренная соль и ее свойства»
Значение соли отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека.»Хлеб да соль» — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значении соли. Хлеб и соль стали символом гостеприимства и радушия русской нации. Говорят: “Чтобы узнать человека, надо с ним пуд соли съесть». [1]. Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли. Одна присказка «без золота прожить можно, а без соли нельзя» чего стоит! Значит соль важный минерал и в связи с этим у нее особые свойства. Тема нашего исследования «Поваренная соль и ее свойства»
Актуальность данного исследования заключается в том, чтобы изучить свойства соли, выяснить – действительно ли соль необходима людям. Привлечь учащихся к участию в изучении данной темы.
Гипотеза: если изучим свойства соли, тогда поймем, почему соль важный минерал.
Цель работы: изучить свойства соли. Для достижения данной цели мы поставили следующие задачи:
изучить литературу по данной проблеме;
изучить физические и химические свойства поваренной соли
провести эксперимент по определению физических и химических свойств школе и дома;
проанализировать результаты исследования и сделать выводы.
Объектом исследования явилась поваренная соль.
Предметом исследования стали физические и химические свойства поваренной соли.
Методы исследования:
Наблюдение
Изучение литературы
Проведение опыта
Обработка результатов
Фотографирование.

Базой исследования стали школьная химическая лаборатория МОБУ СОШ с. Октябрьское, Стерлитамакского района Республики Башкортостан.
Работа состоит из введения, двух глав, обобщений и выводов, библиографии, приложения.
ГЛАВА I. ОСНОВНАЯ ЧАСТЬ
1.1.Обзор литературы
История поваренной соли.
Необходимость соли для жизни была известна со времен глубочайшей древности. Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 3-4 тыс.лет до нашей эры.
А ведь соль когда-то была дорогим товаром. Ломоносов писал, что в то время за четыре небольших куска соли можно было купить раба. Соль подавали на стол в дорогих солонках, ее берегли, экономили, хвастались ею: наличие соли на столе было признаком достатка и благополучия.[6]
Солью запасались на случай бедствий и ею расплачивались вместо денег. Латинское слово «salarium» и английское слово «salary», означающие «жалованье», «зарплата», — имеют «солевое» происхождение. [2]. Из-за соли происходили народные волнения и военные столкновения – например, знаменитые «соляные бунты» и войны за месторождения каменной соли и соляные водоемы. Ценность соли породила целый ряд пословиц, поговорок, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека. Одна присказка «без золота прожить можно, а без соли нельзя» чего стоит!
Латинское слово «salarium» и английское слово «salary», означающие «жалованье», «зарплата», — имеют «солевое» происхождение. [2]. Из-за соли происходили народные волнения и военные столкновения – например, знаменитые «соляные бунты» и войны за месторождения каменной соли и соляные водоемы. Ценность соли породила целый ряд пословиц, поговорок, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека. Одна присказка «без золота прожить можно, а без соли нельзя» чего стоит!
С очень древнего времени отношение к соли развивалось в двух направлениях: «священная» соль — символ вечности, чистоты, непорочности, постоянства и «проклятая» соль — символ зла, беды, несчастья. С одной стороны, соль очищала своей святостью, а с другой — оскверняла своим магическим свойством.[4]
Вера в магическое действие соли была настолько сильной, что среди многих народов соль стала служить талисманом во всех случаях жизни. Соль предохраняла человека, его жилье, домашних животных от колдовства, нечистой силы, «дурного» глаза. Священную в церкви соль воины брали в дорогу для предохранения от встречи с колдунами и ведьмами. В легенде о Тилле Уленшпигеле говорится: «В ночь оборотней, когда все грешные души выходят из ада, надо три раза левой рукой перекреститься и сказать: «Соль! Соль! Соль!» Это знак бессмертия и никакая нечистая сила тебя не тронет».
Священную в церкви соль воины брали в дорогу для предохранения от встречи с колдунами и ведьмами. В легенде о Тилле Уленшпигеле говорится: «В ночь оборотней, когда все грешные души выходят из ада, надо три раза левой рукой перекреститься и сказать: «Соль! Соль! Соль!» Это знак бессмертия и никакая нечистая сила тебя не тронет».
В дни Великого поста соль считалась сильным средством против дьявола и талисманом против приколдованных болезней. Отсюда и произошел древний тирольский обычай посыпать солью великопостные крендели. [7].
Соль стала очень рано одной из самых важных единиц обмена. Было время, когда на Руси княжеским дружинам платили солью, а в царской России соль входила в состав жалованья. На протяжении многих веков в разных государствах, где соли было мало, она ценилась очень высоко.
Первое упоминание о солеварении на Руси датируется XII веком. Но тогда торговля солью была вольным промыслом. Ее продавали наряду с мехами, кожей, воском и медом. Между тем вывозить соль в больших объемах за границу не разрешалось. А при царе Михаиле Федоровиче продажа соли иностранцам каралась смертной казнью. Добывать соль было трудно во все времена.
Между тем вывозить соль в больших объемах за границу не разрешалось. А при царе Михаиле Федоровиче продажа соли иностранцам каралась смертной казнью. Добывать соль было трудно во все времена.
Самые крупные месторождения каменной соли были на Урале в районе Донбасса и в Прикаспийской низменности.
В России еще в XVI веке известные русские предприниматели Строгановы самые большие доходы получали от добычи соли. С предгорий Урала соль отправлялась в Москву, Казань, Нижний Новгород, Калугу, даже за границу. [3]
1.1.2. Способы добычи и основные месторождения поваренной соли.
В земной коре и на ее поверхности наряду с залежами различных нерастворимых в воде минералов находятся залежи растворимых минералов — солей, встречающихся как в виде твердых отложений, так и в виде растворов.
Соляные месторождения — это остатки высохшего древнего океана. Соляные пласты могут располагаться и под землей (глубина их залегания может достигать) более 1 км, и на поверхности — в этом случае они часто образуют соляные озера. Эти залежи возникали на протяжении многих периодов жизни земли, когда создавались благоприятные для их появления климатические условия. Источником этих залежей является морская вода, из солей которой образовались и месторождения ископаемых солей, и соляные озера, и подземные рассолы. При испарении морской воды концентрация солей постепенно повышалась.
Соляные пласты могут располагаться и под землей (глубина их залегания может достигать) более 1 км, и на поверхности — в этом случае они часто образуют соляные озера. Эти залежи возникали на протяжении многих периодов жизни земли, когда создавались благоприятные для их появления климатические условия. Источником этих залежей является морская вода, из солей которой образовались и месторождения ископаемых солей, и соляные озера, и подземные рассолы. При испарении морской воды концентрация солей постепенно повышалась.
Хлорид натрия находится в природе уже в готовом виде. Но особенно его много в морской воде и в соленых озерах, в больших массах он встречается в виде твердой каменной соли. Подсчитано, что в морской воде всех морей и океанов содержится столько соли, что она могла бы покрыть весь земной шар пластом толщиной в 45м. [5]
Твердая или каменная соль образует под землей огромные горы, не уступающие по величине высоким пикам Памира и Кавказа. Основание этой горы лежит на глубине 5-8 километров, а вершины поднимаются до земной поверхности и даже выступают из нее. Также гигантские горы называют соляными куполами.
Также гигантские горы называют соляными куполами.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия — «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Существовал способ производства соли – «выжиганием». Этот способ использовали около тех побережий современной Германии, где недалеко от воды находились залежи торфа. При шторме или приливе соленая морская вода насыщала торф. Когда вода уходила, торф подсыхал, а соль оставалась. Постепенно в нем накапливалось много соли. Насыщенный торф выкапывали и сжигали, а золу выщелачивали в воде и раствор выпаривали.
Соль в чистом виде практически не существует, обычно имеет различные примеси.
В России и странах СНГ наибольшее количество поваренной соли получают, добывая каменную и самосадочную соль. Выварочную и бассейновую соли производят незначительное количество — менее 5%.
Выварочную и бассейновую соли производят незначительное количество — менее 5%.
Одним из распространенных способов добычи поваренной соли является открытый способ. Разработку данным способом производят тогда, когда верхний горизонт соляного пласта находится на небольшой глубине. Соль таким способом добывают на глубине до 20 метров, а порой и до 150 метров. В этом случае устраивают карьер или разнос, для этого пласт соли разрыхляется (дробится) механическим или взрывным способом, чтобы удалить верхний слой покровных пород, затем производят выемку соли. На крупных разработках для этой цели используют экскаваторы, скреперы с лебедками или с тракторной тягой, механические лопаты и другие механизмы. Одним из недостатков добычи соли открытым способом является загрязнение соли наносами пыли, а особенно заливание карьера атмосферными осадками и почвенными.[3]
1.1.3. Значимость соли, её свойства и состав.
Используется соль в быту и в промышленности.
Лишь 3% от всего количества добытой соли попадает в наши желудки. 3,5% применяют в стиральных и моечных машинах для снятия накипи. Соль также используют в красильных и кожевенных цехах, в комбикормовой промышленности и, как и прежде, в изготовлении рыбных и других консервов и солений.
Ещё 12% соли расходуется в коммунальном хозяйстве. Её разбрасывают на мостовых и тротуарах, чтобы таяли лёд и снег. Для окружающей среды, конечно вредно, что такое количество соли попадает в почву, реки и озёра. Поэтому соль разрешается использовать только городским службам, чтобы уменьшить количество несчастных случаев и автомобильных аварий в течение зимы.[5]
Основная часть – 80% — соли используется в производстве соды, хлора, соляной кислоты. А ещё соль необходима при производстве стекла, алюминия, мыла, медикаментов, бумаги и многого другого. [5]
Хлорид натрия Na CI – хорошо растворимая в воде соль, известна под названием поваренная соль. Без этой соли невозможна жизнь растений, животных, человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно переваривание и усвоение пищи.
Без этой соли невозможна жизнь растений, животных, человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно переваривание и усвоение пищи.
В теле человека до 3кг минеральных солей, из которых 5/6 входит в состав скелета, значительную долю занимает поваренная соль. При весе 50кг в нашем организме содержится около 150г соли.
Поваренная соль – необходимая составная часть пищи. Она «отвечает» за то, чтобы жидкость в клетках и вокруг них распределялась равномерно. Кроме того, без неё невозможна деятельность наших нервов и мускулов. Так же в небольших количествах она содержится в желудочном соке. Чтобы постоянно иметь в организме достаточное количество соли, мы должны съедать 10-12г соли ежедневно. За год человек потребляет 4,5кг соли. А за 70 лет жизни 200-300кг. Хронический недостаток соли в организме может привести:
А за 70 лет жизни 200-300кг. Хронический недостаток соли в организме может привести:
к головокружениям и обморокам;
нарушениям сердечной деятельности;
резкому сокращению выделения пищеварительных соков;
снижению аппетита;
уменьшению количества воды в крови и организме.
Ежедневная добавка 3-4 г соли в пищу снимает эти болезненные явления. Грудной ребёнок получает соль с молоком матери. Однако чрезмерное потребление соли вредно для здоровья:
нарушается деятельность сердца, почек;
возникают отёки ног;
повышается кровяное давление.[7]
В народе сложены поговорки и пословицы о соли:
Надо пуд соли вместе съесть, чтобы друга узнать.
Без соли, без хлеба — половина обеда.
Без хлеба не сытно, без соли не сладко.
Без хлеба смерть, без соли смех.
Думай не думай, а лучше хлеба-соли не придумаешь.
За хлебом-солью каждая шутка хороша.
И старая кобыла до соли лакома.
Сердись, бранись, дерись, а за хлебом-солью сходись.
Соли не жалей, так и есть веселей.
Щепотка соли делает сахар слаще.
Значит, первое свойство соли – то, что она соленая на вкус. Поэтому ее используют для соления пищи. Кроме того, люди видели, что мясо, натертое солью, не гниет и сохраняется так же долго, как мясо, провяленное на солнце или прокопченное в дыму костра. Соль стали использовать для консервирования. Консервирование солением различных пищевых продуктов: мяса, рыбы, овощей, грибов – основано на антисептических или противогнилостных свойствах. т.е. на способности убивать бактерии или микробы, вызывающие гниение веществ растительного или животного происхождения. [4].
[4].
Соль, попавшая в ранку, щиплет, но потерпеть стоит, ведь соль останавливает кровь, убивает инфекции, подсушивает и ускоряет заживление. Не зря наша кровь по составу похожа на солевой раствор. В период Первой мировой войны раненых спасали тем, что вместо потерянной крови вливали им в сосуды подсоленную дождевую воду. Опытные хирурги, накладывали повязки с раствором соли на раны, особенно на гнойные. В результате рана быстро очищалась, спадала температура. Итак, второе свойство – антисептическое.
Раньше на Руси использовали соль как универсальное средство для борьбы с колдунами и порчей нечестивой силой, преследующей людей. Соль – белого цвета — воспринималась как частичка чудодейственного зелья, способного остановить «нечистых». Итак, третье свойство соли – оттягивание отрицательной энергии. Четвертое свойство соли – растворимость.[7]
1.1.4. Советы по использованию соли.
1. Чтобы сохранить живые цветы дольше, необходимо в вазу с водой насыпать немного соли.
Чтобы сохранить живые цветы дольше, необходимо в вазу с водой насыпать немного соли.
Чтобы оконные стекла не запотевали, между рамами издавна ставили стаканчики с солью.
Замерзшие оконные стекла также можно легко очистить крепким раствором соли.
Стеклянная посуда лучше блестит, когда ее после мытья ополаскивают подсоленной водой.
Зимой солью посыпают дороги, потому что температура замерзания соляного раствора намного ниже, чем температура замерзания воды.
Перед тем как зажечь свечу, обмакните ее в соленую воду — свеча не будет оплывать, будет гореть ровнее и дольше.
Запах масляной краски, который держится в квартире после ремонта, быстрее исчезнет, если в нескольких местах поставить тарелки с солью.
Вода в грелке долго не остынет, если в нее добавить хотя бы половину чайной ложки соли.

Коржики и бисквиты не пригорят на железном листе, если дно духовки посыпать мелкой солью.
Если картофель солить в конце жарки, то он будет иметь хрустящую корочку.
Если убежавшее молоко пролилось на горячую плиту, надо засыпать залитое место солью, и накрыть его мокрой бумагой — запах не распространится по всему помещению.
Чтобы предупредить насморк, каждый день нужно втягивать в нос соленую воду — поочередно в одной и другой ноздрей.
Если болит горло, можно в стакан с горячей водой добавить по одной чайной ложке соли, несколько капель йода, а затем этим раствором полоскать горло или закапывать нос.
Если в платок насыпать 2-3 столовые ложки соли, нагреть, положить на нос или грудь как компресс, это хорошо помогает при кашле и насморке.
Зубы станут белыми, если 2 раза в неделю чистить их питьевой содой, пополам смешанной с солью.

Соль, мука и вода – это все, что необходимо для приготовления соленого теста. Соленое тесто – это изумительный по своей доступности и пластичности материал! Из него можно сделать все что угодно! Например, забавные объемные и плоские фигурки, красочное панно и т.д.
ГЛАВА II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Описание проведенных испытаний
Описание физических свойств и внешнего вида поваренной соли.
Хлорид натрия имеет вид бесцветных кристаллов, крупного помола. (Приложение №1)
Магнитные свойства: не притягивается
Плотность: 2,16
Температура плавления 800,8 С
Температура кипения 1465 С.
Коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. [5]
(Приложение №1)
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия хлороводорода, гидроксида натрия.
Оборудование: Хлорид натрия – NaCl, соляная кислота — HCl, гидроксид натрия – NaOH, вода (холодная и горячая), химические стаканы, штатив с пробирками, ложечка
Ход работы:
1. В два химических стакана налили горячую и холодную воду. В каждый стакан внесли поваренную соль (одну чайную ложку). При интенсивном перемешивании наблюдали за скоростью растворимости поваренной соли в холодной и горячей воде.
В два химических стакана налили горячую и холодную воду. В каждый стакан внесли поваренную соль (одну чайную ложку). При интенсивном перемешивании наблюдали за скоростью растворимости поваренной соли в холодной и горячей воде.
2.В пробирки с растворами хлороводорода и гидроксида натрия внесли несколько кристаллов поваренной соли. (Приложение №2)
Опыт №2. Сравнение скорости замерзания пресной и соленой воды.
Химикаты и оборудование: хлорид натрия — NaCl, пресная вода, ложечка,1,5 пластиковые бутылки (две штуки), чашка для воды.
Ход работы:
В чашку налили пресную воду, добавили в нее несколько чайных ложек соли. Налили в бутылку, обозначенной цифрой I. В бутылку, которая обозначена цифрой II, налили пресную воду. И наблюдали в течение 12 часов.(Приложение №3)
Опыт №3. Описание химических свойств поваренной соли.
Химикаты и оборудование: Серная кислота – H2SO4 , хлорид натрия – NaCl, нитрат серебра – AgNO3, сульфат меди – CuSO4, азотная кислота — HNO3 , соляная кислота – HCl, уксусная кислота – CH3COOH, гидроксид натрия – NaOH. Штатив с пробирками, спиртовка, держатель, стеклянная лопаточка, платочек обработанный солью, фарфоровые чашечки, химические стаканы, штатив.
Штатив с пробирками, спиртовка, держатель, стеклянная лопаточка, платочек обработанный солью, фарфоровые чашечки, химические стаканы, штатив.
Ход работы.
1.Действие на поваренную соль растворами кислот разной силы.
В четыре пробирки внесли по 2 грамма поваренной соли и в каждую добавили серной кислоты, азотной кислоты, соляной кислоты, уксусной кислоты.(Приложение №4)
2. Действие на раствор поваренной соли щелочи – гидроксида натрия.
В пробирку налили 2 мл поваренной соли и добавили гидроксид натрия.
3.Взаимодействие раствора поваренной соли с солями.
В две пробирки налили по 2 мл поваренной соли и добавили нитрат серебра и сульфат меди.
4.Сжигание поваренной соли.
В фарфоровую чашечку внесли поваренную соль и подожгли. Приготовили два платочка. Один смочили в крепком растворе поваренной соли и высушили. Подожгли.(Приложение №5)
2.2.Результаты по проведенным испытаниям.
1.Результаты по описанию внешнего вида и физических свойств.
В пробирку налили 2 мл поваренной соли и добавили нитрат серебра.
Изучая литературу мы выяснили, что поваренная соль имеет плотность 2,16, температура плавления 800,8 Со, температура кипения 1465 Со, коэффициент растворимости поваренной соли (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
Самостоятельно выяснили, что не притягивается магнитом, имеет вид бесцветных кристаллов, не имеет запаха, не имеет цвета.
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия хлороводорода, гидроксида натрия:
хлорид натрия умеренно растворяется в воде;
хлорид натрия растворяется в холодной и горячей воде практически одинаково;
растворимость хлорида натрия в присутствии хлороводорода и гидроксида натрия не значительна.
Опыт№2. Пресная вода замерзла в течение 4 часов при температуре -20 С0. Соленая вода начала замерзать через 7 часов.
2.2. Результаты химических свойств.
Опыт №3.
1.Взаимодействие поваренной соли с растворами кислот разной силы.
2NaCl + H2SO4= Na2SO4 + 2HCl↑ выделяется бесцветный газ с резким запахом — хлороводород
NaCl + HNO3 = NaNO3 + HCl↑ выделяется бесцветный газ с резким запахом — хлороводород
NaCl + HCl =
NaCl + CH3COOH =
2.Взаимодействие поваренной соли со щелочами.
NaCl + NaOH =
3.Взаимодействие поваренной соли с солями.
NaCl + AgNO3 = AgCl↓ + NaNO3
белый творожный осадок
NaCl + CuSO4 =
4.Реакция соли на огонь.
Соль не горит. При смачивании спиртом, спирт сгорает, а соль нет.
Платочек, обработанный поваренной солью не горит.
2.3.Выводы
1. Выводы по описанию внешнего вида поваренной соли и физическим свойствам.
Поваренная соль имеет кристаллическое строение, не притягивается магнитом, температура плавления и кипения – высокие, плотность 2,16. Умеренно растворяется в воде, растворимость мало зависит от температуры: растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия. Соленая вода плохо замерзает при низких температурах. Поэтому ею посыпают дороги зимой и поливают соляным растворам.
Умеренно растворяется в воде, растворимость мало зависит от температуры: растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия. Соленая вода плохо замерзает при низких температурах. Поэтому ею посыпают дороги зимой и поливают соляным растворам.
2.Выводы по химическим свойствам:
Поваренная соль взаимодействует с сильными кислотами с образованием хлороводорода – газа с резким запахом.
Со щелочами не взаимодействует.
Поваренная соль взаимодействует с нитратом серебра с образованием белого творожистого осадка. Ионы серебра Ag + являются реактивом на хлорид — иона Сl—. С сульфатом меди реакция не идет.Соль не горит, поэтому ее можно использовать как пропитку для бумаги или материала от пожаров.
`
ЗАКЛЮЧЕНИЕ
Соль является минеральным веществом. Без нее невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищи. Значение соли отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека. Значит соль важный минерал и в связи с этим у нее особые свойства, поэтому темой нашего исследования стала изучение свойств поваренной соли. Выдвинутая рабочая гипотеза в ходе исследования нами была проверена и доказана, т..е.изучить свойства соли, выяснить – действительно ли соль необходима людям. Сформулируем выводы по работе:
Значение соли отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых подчеркивалось глубокое значение соли в жизни человека. Значит соль важный минерал и в связи с этим у нее особые свойства, поэтому темой нашего исследования стала изучение свойств поваренной соли. Выдвинутая рабочая гипотеза в ходе исследования нами была проверена и доказана, т..е.изучить свойства соли, выяснить – действительно ли соль необходима людям. Сформулируем выводы по работе:
Изучая литературу мы выяснили, что поваренная соль имеет плотность 2,16, температура плавления 800,8 Со, температура кипения 1465 Со, коэффициент растворимости поваренной соли (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
Выяснили что: не притягивается магнитом, имеет вид бесцветных кристаллов, не имеет запаха, не имеет цвета.
Умеренно растворяется в воде, но растворимость в холодной и горячей воде практически одинакова.

Не растворяется в присутствии хлороводорода и гидроксида натрия.
Подсоленная вода не замерзает, поэтому ее используют коммунальные службы зимой, посыпая дорожки или обрабатывая соляным раствором дороги.
Не горит, поэтому насыщенным раствором соли можно использовать в качестве противопожарной пропитки для бумаги, ткани.
Хлорид натрия взаимодействует с нитратом серебра с образованием творожистого осадка. Ионы серебра Ag + являются реактивом на хлорид — иона Сl—. С сульфатом меди реакция не идет.
Взаимодействует с сильными кислотами, с образованием хлороводорода.
С щелочами не взаимодействует.
В ходе исследования я для себя сделала самый главный вывод, что мы используем вещества, не задумываясь над тем, почему у них те или иные свойства, а наука химия, дает ответ на эти вопросы. Кроме того, в ходе экспериментов я открыла для себя новое свойство для поваренной соли – это его не горючесть, т. е. я, могу предложить использовать в качестве противопожарной пропитки для бумаги, ткани.
е. я, могу предложить использовать в качестве противопожарной пропитки для бумаги, ткани.
БИБЛИОГРАФИЧЕСКИЙ СПРАВОЧНИК
1. О.С. Габриелян. Химия.8 класс. Москва. Дрофа. 2011
2. А.И. Бусев Определения, понятия, термины в химии. Москва. Просвещение.1981.
3. ru.wikipedia.
4.http://livescience.ru
5.http://n-t.ru/ri/kk/hm03.htm
6.medicinform.net
7.http://livescience.ru
ПРИЛОЖЕНИЕ
П
риложение№1. Химикаты и оборудование. Внешний вид поваренной соли.
П
риложение №2. Растворимость поваренной соли.
Приложение №3. Результаты замерзания пресной и соленой воды.
Приложение №4.Химические свойства поваренной соли.
П
риложение №5. Опыт: Сжигание пропитанного раствором соли платочка.
Опыт: Сжигание пропитанного раствором соли платочка.
Хлорид натрия, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Исследование по теме «Поваренная соль и ее свойства»
МУНИЦИПАЛЬНОЕ ОБЩЕОБРЗОВАТЕЛЬНОЕ БЮДЖЕТНОЕ УЧЕРЕЖДЕНИЕ СРЕДНЯЯ
ОБЩЕОБРАЗОАТЕЛЬНАЯ ШКОЛА с.ОКТЯБРЬСКОЕ МУНИЦИПАЛЬНОГО РАЙОНА
СТЕРЛИТАМАКСКИЙ РАЙОН РЕСПУБЛИКИ БАШКОРТОСТАН
Выполнила: учениц 8 класса МОБУ СОШ с.Октябрьское
Шайжанова Альбина Акбулатовна
Руководитель: учитель химии Исхакова Руфина Ураловна 2014
СОДЕРЖАНИЕ
поваренной
Введение………………………………………………………………………………………………………………………….3 стр.
Глава I.Основная часть
1.1.Обзор литературы
1.1.1.История
соли…………………………………………………………………..4
1.1.2. Способы добычи и основные месторождения поваренной соли…………………… 4
1.1.3.Значимость соли,
её свойства и состав……………………………………………….5
Глава II.
2.1. Экспериментальная часть
2.1. 1. Описание внешнего вида
2.1. 2. Описание проведенных испытаний
2. 2.Результаты
2.2.1.Результаты по описанию внешнего вида поваренной соли
2.2.2. Результаты по проведенным испытаниям
2.3.Выводы
2.3.1.Выводы по описанию внешнего вида поваренной соли
2.3.2.Выводы по проведенным испытаниям
Заключение
Библиографический справочник
Приложение.
2 ВВЕДЕНИЕ
Хлорид натрия NaCl — хорошо растворимая в воде соль, известна под названием
поваренная. Соль является минеральным веществом. Без нее невозможна жизнь растений,
животных и человека, так как она обеспечивает важнейшие физиологические процессы в
организмах: в крови соль создает необходимые условия для существования красных кровяных
телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную
кислоту, без которой было бы невозможным переваривание и усвоение пищи.
2.Результаты
2.2.1.Результаты по описанию внешнего вида поваренной соли
2.2.2. Результаты по проведенным испытаниям
2.3.Выводы
2.3.1.Выводы по описанию внешнего вида поваренной соли
2.3.2.Выводы по проведенным испытаниям
Заключение
Библиографический справочник
Приложение.
2 ВВЕДЕНИЕ
Хлорид натрия NaCl — хорошо растворимая в воде соль, известна под названием
поваренная. Соль является минеральным веществом. Без нее невозможна жизнь растений,
животных и человека, так как она обеспечивает важнейшие физиологические процессы в
организмах: в крови соль создает необходимые условия для существования красных кровяных
телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную
кислоту, без которой было бы невозможным переваривание и усвоение пищи. Значение соли
отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых
подчеркивалось глубокое значение соли в жизни человека.»Хлеб да соль» вот одно из
пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема
пищи, подчеркивая равноценное с хлебом значении соли. Хлеб и соль стали символом
гостеприимства и радушия русской нации. Говорят: “Чтобы узнать человека, надо с ним пуд
соли съесть». [1]. Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг),
так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли. Одна присказка «без
золота прожить можно, а без соли нельзя» чего стоит! Значит соль важный минерал и в связи с
этим у нее особые свойства. Тема нашего исследования «Поваренная соль и ее свойства»
Актуальность данного исследования заключается в том, чтобы изучить свойства соли,
выяснить – действительно ли соль необходима людям.
Значение соли
отражено в многочисленных пословицах, поговорках, обычаях, афоризмов, в которых
подчеркивалось глубокое значение соли в жизни человека.»Хлеб да соль» вот одно из
пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема
пищи, подчеркивая равноценное с хлебом значении соли. Хлеб и соль стали символом
гостеприимства и радушия русской нации. Говорят: “Чтобы узнать человека, надо с ним пуд
соли съесть». [1]. Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг),
так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли. Одна присказка «без
золота прожить можно, а без соли нельзя» чего стоит! Значит соль важный минерал и в связи с
этим у нее особые свойства. Тема нашего исследования «Поваренная соль и ее свойства»
Актуальность данного исследования заключается в том, чтобы изучить свойства соли,
выяснить – действительно ли соль необходима людям. Привлечь учащихся к участию в изучении
данной темы.
Гипотеза: если изучим свойства соли, тогда поймем, почему соль важный минерал.
Цель работы: изучить свойства соли. Для достижения данной цели мы поставили
следующие задачи:
изучить литературу по данной проблеме;
изучить физические и химические свойства поваренной соли
провести эксперимент по определению физических и химических свойств школе и
дома;
проанализировать результаты исследования и сделать выводы.
Объектом исследования явилась поваренная соль.
Предметом исследования стали физические и химические свойства поваренной соли.
Методы исследования:
Наблюдение
Изучение литературы
Проведение опыта
Обработка результатов
Фотографирование.
Базой исследования стали школьная химическая лаборатория МОБУ СОШ с. Октябрьское,
Стерлитамакского района Республики Башкортостан.
Работа состоит из введения, двух глав, обобщений и выводов, библиографии, приложения.
3 ГЛАВА I. ОСНОВНАЯ ЧАСТЬ
1.1.Обзор литературы
1.1.1. История поваренной соли.
Привлечь учащихся к участию в изучении
данной темы.
Гипотеза: если изучим свойства соли, тогда поймем, почему соль важный минерал.
Цель работы: изучить свойства соли. Для достижения данной цели мы поставили
следующие задачи:
изучить литературу по данной проблеме;
изучить физические и химические свойства поваренной соли
провести эксперимент по определению физических и химических свойств школе и
дома;
проанализировать результаты исследования и сделать выводы.
Объектом исследования явилась поваренная соль.
Предметом исследования стали физические и химические свойства поваренной соли.
Методы исследования:
Наблюдение
Изучение литературы
Проведение опыта
Обработка результатов
Фотографирование.
Базой исследования стали школьная химическая лаборатория МОБУ СОШ с. Октябрьское,
Стерлитамакского района Республики Башкортостан.
Работа состоит из введения, двух глав, обобщений и выводов, библиографии, приложения.
3 ГЛАВА I. ОСНОВНАЯ ЧАСТЬ
1.1.Обзор литературы
1.1.1. История поваренной соли. Необходимость соли для жизни была известна со времен глубочайшей древности.
Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 34 тыс.лет до
нашей эры.
А ведь соль когдато была дорогим товаром. Ломоносов писал, что в то время за четыре
небольших куска соли можно было купить раба. Соль подавали на стол в дорогих солонках, ее
берегли, экономили, хвастались ею: наличие соли на столе было признаком достатка и
благополучия.
Солью запасались на случай бедствий и ею расплачивались вместо денег. Латинское слово
«salarium» и английское слово «salary», означающие «жалованье», «зарплата», имеют «солевое»
происхождение. [2]. Изза соли происходили народные волнения и военные столкновения –
например, знаменитые «соляные бунты» и войны за месторождения каменной соли и соляные
водоемы. Ценность соли породила целый ряд пословиц, поговорок, афоризмов, в которых
подчеркивалось глубокое значение соли в жизни человека. Одна присказка «без золота прожить
можно, а без соли нельзя» чего стоит!
С очень древнего времени отношение к соли развивалось в двух направлениях: «священная»
соль — символ вечности, чистоты, непорочности, постоянства и «проклятая» соль — символ
зла, беды, несчастья.
Необходимость соли для жизни была известна со времен глубочайшей древности.
Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 34 тыс.лет до
нашей эры.
А ведь соль когдато была дорогим товаром. Ломоносов писал, что в то время за четыре
небольших куска соли можно было купить раба. Соль подавали на стол в дорогих солонках, ее
берегли, экономили, хвастались ею: наличие соли на столе было признаком достатка и
благополучия.
Солью запасались на случай бедствий и ею расплачивались вместо денег. Латинское слово
«salarium» и английское слово «salary», означающие «жалованье», «зарплата», имеют «солевое»
происхождение. [2]. Изза соли происходили народные волнения и военные столкновения –
например, знаменитые «соляные бунты» и войны за месторождения каменной соли и соляные
водоемы. Ценность соли породила целый ряд пословиц, поговорок, афоризмов, в которых
подчеркивалось глубокое значение соли в жизни человека. Одна присказка «без золота прожить
можно, а без соли нельзя» чего стоит!
С очень древнего времени отношение к соли развивалось в двух направлениях: «священная»
соль — символ вечности, чистоты, непорочности, постоянства и «проклятая» соль — символ
зла, беды, несчастья. С одной стороны, соль очищала своей святостью, а с другой — оскверняла
своим магическим свойством.
Вера в магическое действие соли была настолько сильной, что среди многих народов соль
стала служить талисманом во всех случаях жизни. Соль предохраняла человека, его жилье,
домашних животных от колдовства, нечистой силы, «дурного» глаза. Священную в церкви соль
воины брали в дорогу для предохранения от встречи с колдунами и ведьмами. В легенде о Тилле
Уленшпигеле говорится: «В ночь оборотней, когда все грешные души выходят из ада, надо три
раза левой рукой перекреститься и сказать: «Соль! Соль! Соль!» Это знак бессмертия и никакая
нечистая сила тебя не тронет».
В дни Великого поста соль считалась сильным средством против дьявола и талисманом против
приколдованных болезней. Отсюда и произошел древний тирольский обычай посыпать солью
великопостные крендели. [4].
Соль стала очень рано одной из самых важных единиц обмена. Было время, когда на Руси
княжеским дружинам платили солью, а в царской России соль входила в состав жалованья.
С одной стороны, соль очищала своей святостью, а с другой — оскверняла
своим магическим свойством.
Вера в магическое действие соли была настолько сильной, что среди многих народов соль
стала служить талисманом во всех случаях жизни. Соль предохраняла человека, его жилье,
домашних животных от колдовства, нечистой силы, «дурного» глаза. Священную в церкви соль
воины брали в дорогу для предохранения от встречи с колдунами и ведьмами. В легенде о Тилле
Уленшпигеле говорится: «В ночь оборотней, когда все грешные души выходят из ада, надо три
раза левой рукой перекреститься и сказать: «Соль! Соль! Соль!» Это знак бессмертия и никакая
нечистая сила тебя не тронет».
В дни Великого поста соль считалась сильным средством против дьявола и талисманом против
приколдованных болезней. Отсюда и произошел древний тирольский обычай посыпать солью
великопостные крендели. [4].
Соль стала очень рано одной из самых важных единиц обмена. Было время, когда на Руси
княжеским дружинам платили солью, а в царской России соль входила в состав жалованья. На
протяжении многих веков в разных государствах, где соли было мало, она ценилась очень
высоко.
Первое упоминание о солеварении на Руси датируется XII веком. Но тогда торговля солью
была вольным промыслом. Ее продавали наряду с мехами, кожей, воском и медом. Между тем
4 вывозить соль в больших объемах за границу не разрешалось. А при царе Михаиле Федоровиче
продажа соли иностранцам каралась смертной казнью. Добывать соль было трудно во все
времена.
Самые крупные месторождения каменной соли были на Урале в районе Донбасса и в
Прикаспийской низменности.
В России еще в XVI веке известные русские предприниматели Строгановы самые большие
доходы получали от добычи соли. С предгорий Урала соль отправлялась в Москву, Казань,
Нижний Новгород, Калугу, даже за границу. [3]
1.1.2. Способы добычи и основные месторождения поваренной соли.
В земной коре и на ее поверхности наряду с залежами различных нерастворимых в воде
минералов находятся залежи растворимых минералов — солей, встречающихся как в виде
твердых отложений, так и в виде растворов.
На
протяжении многих веков в разных государствах, где соли было мало, она ценилась очень
высоко.
Первое упоминание о солеварении на Руси датируется XII веком. Но тогда торговля солью
была вольным промыслом. Ее продавали наряду с мехами, кожей, воском и медом. Между тем
4 вывозить соль в больших объемах за границу не разрешалось. А при царе Михаиле Федоровиче
продажа соли иностранцам каралась смертной казнью. Добывать соль было трудно во все
времена.
Самые крупные месторождения каменной соли были на Урале в районе Донбасса и в
Прикаспийской низменности.
В России еще в XVI веке известные русские предприниматели Строгановы самые большие
доходы получали от добычи соли. С предгорий Урала соль отправлялась в Москву, Казань,
Нижний Новгород, Калугу, даже за границу. [3]
1.1.2. Способы добычи и основные месторождения поваренной соли.
В земной коре и на ее поверхности наряду с залежами различных нерастворимых в воде
минералов находятся залежи растворимых минералов — солей, встречающихся как в виде
твердых отложений, так и в виде растворов. Соляные месторождения — это остатки высохшего древнего океана. Соляные пласты могут
располагаться и под землей (глубина их залегания может достигать) более 1 км, и на
поверхности — в этом случае они часто образуют соляные озера. Эти залежи возникали на
протяжении многих периодов жизни земли, когда создавались благоприятные для их появления
климатические условия. Источником этих залежей является морская вода, из солей которой
образовались и месторождения ископаемых солей, и соляные озера, и подземные рассолы. При
испарении морской воды концентрация солей постепенно повышалась.
Хлорид натрия находится в природе уже в готовом виде. Но особенно его много в морской
воде и в соленых озерах, в больших массах он встречается в виде твердой каменной соли.
Подсчитано, что в морской воде всех морей и океанов содержится столько соли, что она могла
бы покрыть весь земной шар пластом толщиной в 45м.
Твердая или каменная соль образует под землей огромные горы, не уступающие по величине
высоким пикам Памира и Кавказа.
Соляные месторождения — это остатки высохшего древнего океана. Соляные пласты могут
располагаться и под землей (глубина их залегания может достигать) более 1 км, и на
поверхности — в этом случае они часто образуют соляные озера. Эти залежи возникали на
протяжении многих периодов жизни земли, когда создавались благоприятные для их появления
климатические условия. Источником этих залежей является морская вода, из солей которой
образовались и месторождения ископаемых солей, и соляные озера, и подземные рассолы. При
испарении морской воды концентрация солей постепенно повышалась.
Хлорид натрия находится в природе уже в готовом виде. Но особенно его много в морской
воде и в соленых озерах, в больших массах он встречается в виде твердой каменной соли.
Подсчитано, что в морской воде всех морей и океанов содержится столько соли, что она могла
бы покрыть весь земной шар пластом толщиной в 45м.
Твердая или каменная соль образует под землей огромные горы, не уступающие по величине
высоким пикам Памира и Кавказа. Основание этой горы лежит на глубине 58 километров, а
вершины поднимаются до земной поверхности и даже выступают из нее. Также гигантские горы
называют соляными куполами.
В древности люди использовали несколько способов добычи поваренной соли: естественное
испарение морской воды в «соляных садках», где выпадал хлорид натрия — «морская» соль,
вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной»
соли в подземных рудниках. Существовал способ производства соли – «выжиганием». Этот
способ использовали около тех побережий современной Германии, где недалеко от воды
находились залежи торфа. При шторме или приливе соленая морская вода насыщала торф.
Когда вода уходила, торф подсыхал, а соль оставалась. Постепенно в нем накапливалось много
соли. Насыщенный торф выкапывали и сжигали, а золу выщелачивали в воде и раствор
выпаривали.
Соль в чистом виде практически не существует, обычно имеет различные примеси.
Основание этой горы лежит на глубине 58 километров, а
вершины поднимаются до земной поверхности и даже выступают из нее. Также гигантские горы
называют соляными куполами.
В древности люди использовали несколько способов добычи поваренной соли: естественное
испарение морской воды в «соляных садках», где выпадал хлорид натрия — «морская» соль,
вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной»
соли в подземных рудниках. Существовал способ производства соли – «выжиганием». Этот
способ использовали около тех побережий современной Германии, где недалеко от воды
находились залежи торфа. При шторме или приливе соленая морская вода насыщала торф.
Когда вода уходила, торф подсыхал, а соль оставалась. Постепенно в нем накапливалось много
соли. Насыщенный торф выкапывали и сжигали, а золу выщелачивали в воде и раствор
выпаривали.
Соль в чистом виде практически не существует, обычно имеет различные примеси. В России и странах СНГ наибольшее количество поваренной соли получают, добывая
каменную и самосадочную соль. Выварочную и бассейновую соли производят незначительное
количество — менее 5%.
Одним из распространенных способов добычи поваренной соли является открытый способ.
Разработку данным способом производят тогда, когда верхний горизонт соляного пласта
находится на небольшой глубине. Соль таким способом добывают на глубине до 20 метров, а
порой и до 150 метров. В этом случае устраивают карьер или разнос, для этого пласт соли
разрыхляется (дробится) механическим или взрывным способом, чтобы удалить верхний слой
покровных пород, затем производят выемку соли. На крупных разработках для этой цели
используют экскаваторы, скреперы с лебедками или с тракторной тягой, механические лопаты и
другие механизмы. Одним из недостатков добычи соли открытым способом является
5 загрязнение соли наносами пыли, а особенно заливание карьера атмосферными осадками и
почвенными.
В России и странах СНГ наибольшее количество поваренной соли получают, добывая
каменную и самосадочную соль. Выварочную и бассейновую соли производят незначительное
количество — менее 5%.
Одним из распространенных способов добычи поваренной соли является открытый способ.
Разработку данным способом производят тогда, когда верхний горизонт соляного пласта
находится на небольшой глубине. Соль таким способом добывают на глубине до 20 метров, а
порой и до 150 метров. В этом случае устраивают карьер или разнос, для этого пласт соли
разрыхляется (дробится) механическим или взрывным способом, чтобы удалить верхний слой
покровных пород, затем производят выемку соли. На крупных разработках для этой цели
используют экскаваторы, скреперы с лебедками или с тракторной тягой, механические лопаты и
другие механизмы. Одним из недостатков добычи соли открытым способом является
5 загрязнение соли наносами пыли, а особенно заливание карьера атмосферными осадками и
почвенными. 1.1.3. Значимость соли, её свойства и состав.
Используется соль в быту и в промышленности.
Лишь 3% от всего количества добытой соли попадает в наши желудки. 3,5% применяют в
стиральных и моечных машинах для снятия накипи. Соль также используют в красильных и
кожевенных цехах, в комбикормовой промышленности и, как и прежде, в изготовлении рыбных и
других консервов и солений.
Ещё 12% соли расходуется в коммунальном хозяйстве. Её разбрасывают на мостовых и
тротуарах, чтобы таяли лёд и снег. Для окружающей среды, конечно вредно, что такое
количество соли попадает в почву, реки и озёра. Поэтому соль разрешается использовать только
городским службам, чтобы уменьшить количество несчастных случаев и автомобильных аварий
в течение зимы.
Основная часть – 80% соли используется в производстве соды, хлора, соляной кислоты. А
ещё соль необходима при производстве стекла, алюминия, мыла, медикаментов, бумаги и
многого другого.
1.1.3. Значимость соли, её свойства и состав.
Используется соль в быту и в промышленности.
Лишь 3% от всего количества добытой соли попадает в наши желудки. 3,5% применяют в
стиральных и моечных машинах для снятия накипи. Соль также используют в красильных и
кожевенных цехах, в комбикормовой промышленности и, как и прежде, в изготовлении рыбных и
других консервов и солений.
Ещё 12% соли расходуется в коммунальном хозяйстве. Её разбрасывают на мостовых и
тротуарах, чтобы таяли лёд и снег. Для окружающей среды, конечно вредно, что такое
количество соли попадает в почву, реки и озёра. Поэтому соль разрешается использовать только
городским службам, чтобы уменьшить количество несчастных случаев и автомобильных аварий
в течение зимы.
Основная часть – 80% соли используется в производстве соды, хлора, соляной кислоты. А
ещё соль необходима при производстве стекла, алюминия, мыла, медикаментов, бумаги и
многого другого. Хлорид натрия Na CI – хорошо растворимая в воде соль, известна под названием поваренная
соль. Без этой соли невозможна жизнь растений, животных, человека, так как она обеспечивает
важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия
для существования красных кровяных телец, в мышцах обусловливает способность к
возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно
переваривание и усвоение пищи.
В теле человека до 3кг минеральных солей, из которых 5/6 входит в состав скелета,
значительную долю занимает поваренная соль. При весе 50кг в нашем организме содержится
около 150г соли.
Поваренная соль – необходимая составная часть пищи. Она «отвечает» за то, чтобы жидкость в
клетках и вокруг них распределялась равномерно. Кроме того, без неё невозможна деятельность
наших нервов и мускулов. Так же в небольших количествах она содержится в желудочном соке.
Чтобы постоянно иметь в организме достаточное количество соли, мы должны съедать 1012г
соли ежедневно.
Хлорид натрия Na CI – хорошо растворимая в воде соль, известна под названием поваренная
соль. Без этой соли невозможна жизнь растений, животных, человека, так как она обеспечивает
важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия
для существования красных кровяных телец, в мышцах обусловливает способность к
возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно
переваривание и усвоение пищи.
В теле человека до 3кг минеральных солей, из которых 5/6 входит в состав скелета,
значительную долю занимает поваренная соль. При весе 50кг в нашем организме содержится
около 150г соли.
Поваренная соль – необходимая составная часть пищи. Она «отвечает» за то, чтобы жидкость в
клетках и вокруг них распределялась равномерно. Кроме того, без неё невозможна деятельность
наших нервов и мускулов. Так же в небольших количествах она содержится в желудочном соке.
Чтобы постоянно иметь в организме достаточное количество соли, мы должны съедать 1012г
соли ежедневно. За год человек потребляет 4,5кг соли. А за 70 лет жизни 200
300кг. Хронический недостаток соли в организме может привести:
к головокружениям и обморокам;
нарушениям сердечной деятельности;
резкому сокращению выделения пищеварительных соков;
снижению аппетита;
уменьшению количества воды в крови и организме.
Ежедневная добавка 34 г соли в пищу снимает эти болезненные явления. Грудной ребёнок
получает соль с молоком матери. Однако чрезмерное потребление соли вредно для здоровья:
нарушается деятельность сердца, почек;
возникают отёки ног;
повышается кровяное давление.
В народе сложены поговорки и пословицы о соли:
Надо пуд соли вместе съесть, чтобы друга узнать.
Без соли, без хлеба — половина обеда.
Без хлеба не сытно, без соли не сладко.
Без хлеба смерть, без соли смех.
6 Думай не думай, а лучше хлебасоли не придумаешь.
За хлебомсолью каждая шутка хороша.
И старая кобыла до соли лакома.
Сердись, бранись, дерись, а за хлебомсолью сходись.
За год человек потребляет 4,5кг соли. А за 70 лет жизни 200
300кг. Хронический недостаток соли в организме может привести:
к головокружениям и обморокам;
нарушениям сердечной деятельности;
резкому сокращению выделения пищеварительных соков;
снижению аппетита;
уменьшению количества воды в крови и организме.
Ежедневная добавка 34 г соли в пищу снимает эти болезненные явления. Грудной ребёнок
получает соль с молоком матери. Однако чрезмерное потребление соли вредно для здоровья:
нарушается деятельность сердца, почек;
возникают отёки ног;
повышается кровяное давление.
В народе сложены поговорки и пословицы о соли:
Надо пуд соли вместе съесть, чтобы друга узнать.
Без соли, без хлеба — половина обеда.
Без хлеба не сытно, без соли не сладко.
Без хлеба смерть, без соли смех.
6 Думай не думай, а лучше хлебасоли не придумаешь.
За хлебомсолью каждая шутка хороша.
И старая кобыла до соли лакома.
Сердись, бранись, дерись, а за хлебомсолью сходись. Соли не жалей, так и есть веселей.
Щепотка соли делает сахар слаще.
Значит, первое свойство соли – то, что она соленая на вкус. Поэтому ее используют для
соления пищи. Кроме того, люди видели, что мясо, натертое солью, не гниет и сохраняется так
же долго, как мясо, провяленное на солнце или прокопченное в дыму костра. Соль стали
использовать для консервирования. Консервирование солением различных пищевых продуктов:
мяса, рыбы, овощей, грибов – основано на антисептических или противогнилостных свойствах.
т.е. на способности убивать бактерии или микробы, вызывающие гниение веществ растительного
или животного происхождения. [4].
Соль, попавшая в ранку, щиплет, но потерпеть стоит, ведь соль останавливает кровь, убивает
инфекции, подсушивает и ускоряет заживление. Не зря наша кровь по составу похожа на солевой
раствор. В период Первой мировой войны раненых спасали тем, что вместо потерянной крови
вливали им в сосуды подсоленную дождевую воду. Опытные хирурги, накладывали повязки с
раствором соли на раны, особенно на гнойные.
Соли не жалей, так и есть веселей.
Щепотка соли делает сахар слаще.
Значит, первое свойство соли – то, что она соленая на вкус. Поэтому ее используют для
соления пищи. Кроме того, люди видели, что мясо, натертое солью, не гниет и сохраняется так
же долго, как мясо, провяленное на солнце или прокопченное в дыму костра. Соль стали
использовать для консервирования. Консервирование солением различных пищевых продуктов:
мяса, рыбы, овощей, грибов – основано на антисептических или противогнилостных свойствах.
т.е. на способности убивать бактерии или микробы, вызывающие гниение веществ растительного
или животного происхождения. [4].
Соль, попавшая в ранку, щиплет, но потерпеть стоит, ведь соль останавливает кровь, убивает
инфекции, подсушивает и ускоряет заживление. Не зря наша кровь по составу похожа на солевой
раствор. В период Первой мировой войны раненых спасали тем, что вместо потерянной крови
вливали им в сосуды подсоленную дождевую воду. Опытные хирурги, накладывали повязки с
раствором соли на раны, особенно на гнойные. В результате рана быстро очищалась, спадала
температура. Итак, второе свойство – антисептическое.
Раньше на Руси использовали соль как универсальное средство для борьбы с колдунами и
порчей нечестивой силой, преследующей людей. Соль – белого цвета воспринималась как
частичка чудодейственного зелья, способного остановить «нечистых». Итак, третье свойство
соли – оттягивание отрицательной энергии. Четвертое свойство соли – растворимость.
7 ГЛАВА II. ИССЛЕДОВАНИЕ.
2.1. Экспериментальная часть
2.1. 1. Описание проведенных испытаний
Описание физических свойств поваренной соли.
Хлорид натрия имеет вид бесцветных кристаллов, крупного помола. (Приложение №1)
Магнитные свойства: не притягивается
Плотность: 2,16
Температура плавления 800,8 С
Температура кипения 1465 С.
Коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
(Приложение №1)
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия
хлороводорода, гидроксида натрия.
В результате рана быстро очищалась, спадала
температура. Итак, второе свойство – антисептическое.
Раньше на Руси использовали соль как универсальное средство для борьбы с колдунами и
порчей нечестивой силой, преследующей людей. Соль – белого цвета воспринималась как
частичка чудодейственного зелья, способного остановить «нечистых». Итак, третье свойство
соли – оттягивание отрицательной энергии. Четвертое свойство соли – растворимость.
7 ГЛАВА II. ИССЛЕДОВАНИЕ.
2.1. Экспериментальная часть
2.1. 1. Описание проведенных испытаний
Описание физических свойств поваренной соли.
Хлорид натрия имеет вид бесцветных кристаллов, крупного помола. (Приложение №1)
Магнитные свойства: не притягивается
Плотность: 2,16
Температура плавления 800,8 С
Температура кипения 1465 С.
Коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
(Приложение №1)
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия
хлороводорода, гидроксида натрия. Оборудование: Хлорид натрия – NaCl, соляная кислота HCl, гидроксид натрия – NaOH, вода
(холодная и горячая), химические стаканы, штатив с пробирками, ложечка
Ход работы:
1.В два химических стакана налили горячую и холодную воду. В каждый стакан внесли
поваренную соль (одну чайную ложку). При интенсивном перемешивании наблюдали за
скоростью растворимости поваренной соли в холодной и горячей воде.
2.В пробирки с растворами хлороводорода и гидроксида натрия внесли несколько кристаллов
поваренной соли.
Опыт №2. Сравнение скорости замерзания пресной и соленой воды.
Химикаты и оборудование: хлорид натрия NaCl, пресная вода, ложечка,1,5 пластиковые
бутылки (две штуки), чашка для воды.
Ход работы:
В чашку налили пресную воду, добавили в нее несколько чайных ложек соли. Налили в бутылку,
8 обозначенной цифрой I. В бутылку, которая обозначена цифрой II, налили пресную воду. И
наблюдали в течение 12 часов.
Опыт №3. Описание химических свойств поваренной соли.
Химикаты и оборудование: Серная кислота – h3SO4 , хлорид натрия – NaCl, нитрат серебра –
AgNO3, сульфат меди – CuSO4, азотная кислота HNO3 , соляная кислота – HCl, уксусная
кислота – Ch4COOH, гидроксид натрия – NaOH.
Оборудование: Хлорид натрия – NaCl, соляная кислота HCl, гидроксид натрия – NaOH, вода
(холодная и горячая), химические стаканы, штатив с пробирками, ложечка
Ход работы:
1.В два химических стакана налили горячую и холодную воду. В каждый стакан внесли
поваренную соль (одну чайную ложку). При интенсивном перемешивании наблюдали за
скоростью растворимости поваренной соли в холодной и горячей воде.
2.В пробирки с растворами хлороводорода и гидроксида натрия внесли несколько кристаллов
поваренной соли.
Опыт №2. Сравнение скорости замерзания пресной и соленой воды.
Химикаты и оборудование: хлорид натрия NaCl, пресная вода, ложечка,1,5 пластиковые
бутылки (две штуки), чашка для воды.
Ход работы:
В чашку налили пресную воду, добавили в нее несколько чайных ложек соли. Налили в бутылку,
8 обозначенной цифрой I. В бутылку, которая обозначена цифрой II, налили пресную воду. И
наблюдали в течение 12 часов.
Опыт №3. Описание химических свойств поваренной соли.
Химикаты и оборудование: Серная кислота – h3SO4 , хлорид натрия – NaCl, нитрат серебра –
AgNO3, сульфат меди – CuSO4, азотная кислота HNO3 , соляная кислота – HCl, уксусная
кислота – Ch4COOH, гидроксид натрия – NaOH. Штатив с пробирками, спиртовка, держатель,
стеклянная лопаточка, платочек обработанный солью, фарфоровые чашечки, химические
стаканы, штатив.
Ход работы.
1.Действие на поваренную соль растворами кислот разной силы.
В четыре пробирки внесли по 2 грамма поваренной соли и в каждую добавили серной кислоты,
азотной кислоты, соляной кислоты, уксусной кислоты.
2. Действие на раствор поваренной соли щелочи – гидроксида натрия.
В пробирку налили 2 мл поваренной соли и добавили гидроксид натрия.
3.Взаимодействие раствора поваренной соли с солями.
В две пробирки налили по 2 мл поваренной соли и добавили нитрат серебра и сульфат меди.
4.Сжигание поваренной соли.
В фарфоровую чашечку внесли поваренную соль и подожгли. Приготовили два платочка. Один
смочили в крепком растворе поваренной соли и высушили.Подожгли.
2.2.Результаты по проведенным испытаниям
1.Результаты по описанию внешнего вида и физических свойств.
В пробирку налили 2 мл поваренной соли и добавили нитрат серебра.
Изучая литературу мы выяснили, что поваренная соль имеет плотность 2,16, температура
плавления 800,8 Со, температура кипения 1465 Со, коэффициент растворимости поваренной
соли (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
Штатив с пробирками, спиртовка, держатель,
стеклянная лопаточка, платочек обработанный солью, фарфоровые чашечки, химические
стаканы, штатив.
Ход работы.
1.Действие на поваренную соль растворами кислот разной силы.
В четыре пробирки внесли по 2 грамма поваренной соли и в каждую добавили серной кислоты,
азотной кислоты, соляной кислоты, уксусной кислоты.
2. Действие на раствор поваренной соли щелочи – гидроксида натрия.
В пробирку налили 2 мл поваренной соли и добавили гидроксид натрия.
3.Взаимодействие раствора поваренной соли с солями.
В две пробирки налили по 2 мл поваренной соли и добавили нитрат серебра и сульфат меди.
4.Сжигание поваренной соли.
В фарфоровую чашечку внесли поваренную соль и подожгли. Приготовили два платочка. Один
смочили в крепком растворе поваренной соли и высушили.Подожгли.
2.2.Результаты по проведенным испытаниям
1.Результаты по описанию внешнего вида и физических свойств.
В пробирку налили 2 мл поваренной соли и добавили нитрат серебра.
Изучая литературу мы выяснили, что поваренная соль имеет плотность 2,16, температура
плавления 800,8 Со, температура кипения 1465 Со, коэффициент растворимости поваренной
соли (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Самостоятельно выяснили, что не притягивается магнитом, имеет вид бесцветных кристаллов,
не имеет запаха, не имеет цвета.
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия хлороводорода,
гидроксида натрия:
хлорид натрия умеренно растворяется в воде;
хлорид натрия растворяется в холодной и горячей воде практически
одинаково;
растворимость хлорида натрия в присутствии хлороводорода и
гидроксида натрия не значительна.
Опыт№2. Пресная вода замерзла в течение 4 часов при температуре 20 С0. Соленая вода начала
замерзать через 7 часов.
2.Результаты химических свойств.
Опыт №3.
1.Взаимодействие поваренной соли с растворами кислот разной силы.
2NaCl + h3SO4= Na2SO4 + 2HCl
↑
NaCl + HNO3 = NaNO3 + HCl
NaCl + HCl =
NaCl + Ch4COOH =
2.Взаимодействие поваренной соли со щелочами.
NaCl + NaOH =
выделяется безцветный газ с резким запахом хлороводород
↑
выделяется безцветный газ с резким запахом хлороводород
9 3.Взаимодействие поваренной соли с солями.
NaCl + AgNO3 = AgCl↓ + NaNO3
белый творожный осадок
NaCl + CuSO4 =
4.
Самостоятельно выяснили, что не притягивается магнитом, имеет вид бесцветных кристаллов,
не имеет запаха, не имеет цвета.
Опыт №1. Растворимость в воде в зависимости от температуры и присутствия хлороводорода,
гидроксида натрия:
хлорид натрия умеренно растворяется в воде;
хлорид натрия растворяется в холодной и горячей воде практически
одинаково;
растворимость хлорида натрия в присутствии хлороводорода и
гидроксида натрия не значительна.
Опыт№2. Пресная вода замерзла в течение 4 часов при температуре 20 С0. Соленая вода начала
замерзать через 7 часов.
2.Результаты химических свойств.
Опыт №3.
1.Взаимодействие поваренной соли с растворами кислот разной силы.
2NaCl + h3SO4= Na2SO4 + 2HCl
↑
NaCl + HNO3 = NaNO3 + HCl
NaCl + HCl =
NaCl + Ch4COOH =
2.Взаимодействие поваренной соли со щелочами.
NaCl + NaOH =
выделяется безцветный газ с резким запахом хлороводород
↑
выделяется безцветный газ с резким запахом хлороводород
9 3.Взаимодействие поваренной соли с солями.
NaCl + AgNO3 = AgCl↓ + NaNO3
белый творожный осадок
NaCl + CuSO4 =
4. Соль не горит. При смачивании спиртом, спирт сгорает, а соль нет.
Платочек обработанный поваренной солью не горит.
2.3.Выводы
1. Выводы по описанию внешнего вида поваренной соли и физическим свойствам.
Поваренная соль имеет кристаллическое строение, не притягивается магнитом, температура
плавления и кипения – высокие, плотность 2,16. Умеренно растворяется в воде, растворимость
мало зависит от температуры: растворимость хлорида натрия существенно снижается в
присутствии хлороводорода, гидроксида натрия. Соленая вода плохо замерзает при низких
температурах. Поэтому ею посыпают дороги зимой и поливают соляным растворам.
2.Выводы по химическим свойствам:
Поваренная соль взаимодействует с сильными кислотами с
образованием хлороводорода – газа с резким запахом.
Со щелочами не взаимодействует.
Поваренная соль взаимодействует с нитратом серебра с образованием белого
творожистого осадка. Ионы серебра Ag + являются реактивом на хлорид иона Сl.С
сульфатом меди реакция не идет.
Соль не горит, поэтому ее можно использовать как пропитку для
бумаги или материала от пожаров.
Соль не горит. При смачивании спиртом, спирт сгорает, а соль нет.
Платочек обработанный поваренной солью не горит.
2.3.Выводы
1. Выводы по описанию внешнего вида поваренной соли и физическим свойствам.
Поваренная соль имеет кристаллическое строение, не притягивается магнитом, температура
плавления и кипения – высокие, плотность 2,16. Умеренно растворяется в воде, растворимость
мало зависит от температуры: растворимость хлорида натрия существенно снижается в
присутствии хлороводорода, гидроксида натрия. Соленая вода плохо замерзает при низких
температурах. Поэтому ею посыпают дороги зимой и поливают соляным растворам.
2.Выводы по химическим свойствам:
Поваренная соль взаимодействует с сильными кислотами с
образованием хлороводорода – газа с резким запахом.
Со щелочами не взаимодействует.
Поваренная соль взаимодействует с нитратом серебра с образованием белого
творожистого осадка. Ионы серебра Ag + являются реактивом на хлорид иона Сl.С
сульфатом меди реакция не идет.
Соль не горит, поэтому ее можно использовать как пропитку для
бумаги или материала от пожаров. ЗАКЛЮЧЕНИЕ
10 Библиографический справочник
1. О.С. Габриелян. Химия.8 класс. Москва. Дрофа. 2011
2. А.И. Бусев Определения, понятия, термины в химии. Москва. Просвещение.1981.
1. ru.wikipedia.
1.http://livescience.ru
11 Приложение№1.
12 13 Приложение
14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
ЗАКЛЮЧЕНИЕ
10 Библиографический справочник
1. О.С. Габриелян. Химия.8 класс. Москва. Дрофа. 2011
2. А.И. Бусев Определения, понятия, термины в химии. Москва. Просвещение.1981.
1. ru.wikipedia.
1.http://livescience.ru
11 Приложение№1.
12 13 Приложение
14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
Соль и ее применение
Соль – необходимая приправа к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
В организме человека натрий необходим для сокращения мышц, в том числе сердца, перистальтики кишечника и передачи сигналов нервными клетками. Образующаяся из хлоридного иона соляная кислота необходима для пищеварения; этот ион присутствует и в амилазе слюны. Основная функция соли заключается в регуляции осмотического давления и перемещения жидкости в клетки и из них. В здоровом организме концентрация соли варьирует лишь в очень узких пределах.
ВОЗ (Всемирная организация здравоохранения) рекомендует ежедневно потреблять не более 6 граммов соли. В настоящее время учеными диетологами сформулировано положение, что потреблять поваренную соль надо в меру, соблюдая баланс натрия с калием и магнием.
Пищевая промышленность использует соль для консервирования, выпечки, обработки муки и других продуктов, для хранения мяса, соления рыбы, производства масла и придания вкуса пищевым продуктам.
Помимо потребления соли в пищевой промышленности, продукт в больших объемах используется химической промышленностью, где водный раствор NaCl посредством электролиза разлагается с получением хлора, водорода и каустической соды, также соль применяется для производства кальцинированной соды.
Кроме того, хлорид натрия используется в черной и цветной металлургии, машиностроении и металлообработке, борьбе с обледенением дорог, в производстве охлаждающих растворов, в медицине, косметологии, мыловарении, при обработке мехов и сыромятных кож, нефтяной промышленности для разморозки грунта и др.
Помимо этого, соль активно используют в бытовых и промышленных установках ионообменного умягчения воды, используемых на заводах по производству безалкогольных напитков, на молокозаводах, пивоваренных заводах, табачных фабриках, фармацевтических фабриках, котельных и иных производствах и др., а также в системах водоподготовки домов и городских квартир.
Значительное количество соли используется для нужд теплоэнергетики, в частности при химической очистке воды для котлов тепловых станций.
Помимо указанных направлений потребления поваренной соли стоит отметить потребление продукта животными. Животные нуждаются в соли не меньше человека. Нехватка соли замедляет рост молодых животных, а у зрелых вызывает вялость, снижение надоев молока и потерю веса.
Поскольку корма и листья растений содержат мало соли, следует добавлять ее в корм домашним животным. На современных фермах соль обогащают также витаминами и минеральными веществами, необходимыми для здоровья скота.
Соль всегда была одним из самых ценных продуктов. В VI веке римский историк и советник короля остготов Кассиодор заметил: «Соль необходима всем, в то время как без золота многие могут обойтись». Владельцы месторождений соли оказывались могущественнее монархов, из-за соли вспыхивали войны, образовывались и разрушались государства, ей платили налоги, а раздачей соли гасили крестьянские бунты. На производстве соли в России приобрели капиталы династии Строгановых, на соляных варницах отбывали ссылку декабристы.
В VI веке римский историк и советник короля остготов Кассиодор заметил: «Соль необходима всем, в то время как без золота многие могут обойтись». Владельцы месторождений соли оказывались могущественнее монархов, из-за соли вспыхивали войны, образовывались и разрушались государства, ей платили налоги, а раздачей соли гасили крестьянские бунты. На производстве соли в России приобрели капиталы династии Строгановых, на соляных варницах отбывали ссылку декабристы.
В Средние века города, государства и княжества облагали торговцев огромными налогами за провоз соли через их территорию. Это приводило к войнам, и даже стало причиной основания некоторых городов, например, Мюнхена в 1158 году.
Соль (хлорид натрия NaCl) отвечает за важнейшие функции организма: поддержание давления и работы сердца, проницаемость клеточных мембран, передачу нервных импульсов, сокращение мышечных волокон, поддержание в норме состава крови, участие в процессах пищеварения и работе органов чувств. В организме взрослого человека содержится около 300 г. соли, недостаток поступления NaCl смертельно-опасен для человеческого организма. Полное отсутствие соли человек может выдержать не более 10-11 суток.
соли, недостаток поступления NaCl смертельно-опасен для человеческого организма. Полное отсутствие соли человек может выдержать не более 10-11 суток.
Помимо пищевой промышленности, соль в больших объемах используется химической промышленностью для производства хлора, каустической и кальцинированной соды, продукции нефтехимического комплекса, органического синтеза, стекольного, глиноземного и других производств.
Хлорид натрия используется в черной и цветной металлургии, машиностроении и металлообработке, борьбе с обледенением дорог, в производстве охлаждающих растворов, в медицине, косметологии, мыловарении, при обработке мехов и сыромятных кож, нефтяной промышленности, животноводстве. Значительное количество соли используется для нужд теплоэнергетики, в частности, при химической очистке воды для котлов тепловых станций.
20 способов применения поваренной соли в быту
Как использовать водку и лак для ногтей в домашних делах, мы уже выяснили. Настала очередь соли. Что может обычная поваренная соль в умелых руках?
Что может обычная поваренная соль в умелых руках?
Убрать налёт с вазы или освежить искусственные цветы
Если на любимой вазе остался осадок от цветов, натрите этот налёт солью. Затем смойте тёплой мыльной водой — отложения исчезнут. Тот же фокус помогает справиться с налётом на листьях искусственных растений: опустите их в соляной раствор и подержите некоторое время.
Продлить жизнь венику
Если новому венику устроить баню, подержав его рабочую часть в горячей солёной воде, то он прослужит гораздо дольше. Отмачивайте веник в течение 20 минут, а затем дайте ему как следует просохнуть.
Отмыть пятна красного вина
Если вино пролилось на ковёр или на одежду, нанесите сверху кашицу из влажной соли. Оставьте на 20-30 минут, затем застирайте горячей водой. Кстати, соль неплохо работает и с жирными пятнами, если вам некогда их основательно застирывать. Просто присыпьте жирный развод солью, тогда, по крайней мере, жир не распространится по одежде дальше.
Отмыть водяные разводы с деревянной поверхности
Если на деревянной мебели остались неряшливые следы от стаканов или бутылок с водой, соль снова придёт на помощь. Смешайте её с водой, чтобы получилась кашицеобразная смесь, и аккуратно, не царапая, протрите ей поверхность с помощью губки или мягкой тряпки.
Реанимировать губку
После недолгого использования губки приобретают затасканный вид, хотя на деле ещё могут послужить в хозяйстве. Замочите губки на ночь в соляном растворе: 1/4 чашки соли на литр воды.
Убрать изморозь с окон и рам
Соль уменьшает температурный порог, при котором вода замерзает. Это свойство можно использовать с толком. Протрите стёкла возле рам солёной водой, дайте подсохнуть. Для того чтобы окна не потели, положите между стёклами тряпичный мешочек с солью. Такой же мешочек пригодится автомобилистам: протирайте им время от времени мокрые окна в холодное время года.
Бороться с муравьями
Если ваш дом внезапно атаковали муравьи и под рукой нет никакого специального средства — воспользуйтесь солью. Насыпьте её у дверей, окон или прямо на муравьиной тропе. Это поможет на время остановить вторжение.
Насыпьте её у дверей, окон или прямо на муравьиной тропе. Это поможет на время остановить вторжение.
Удалить пригоревшее молоко с плиты
Соль вообще хорошая штука для чистки посуды и некоторой кухонной утвари. Например, солью можно чистить кофейник, ободки на посуде от чая или кофе. Здорово она справляется и с пригоревшим молоком. Размочите пятно водой, а затем щедро посыпьте солью. Подождите минут 10, затем попробуйте удалить пятно — процесс пойдёт гораздо легче.
Убрать следы от губной помады
Не всякая посудомоечная машина справится со следами от современной губной помады, например, на стакане. Нанесите на край посуды соль, а затем отправьте в посудомойку. А смесь уксуса и соли, добавленная в воду, поможет справиться с жёлтыми пятнами на стекле: просто замочите выцветшее стекло в этом растворе.
Чистить орехи-пеканы
Очистить пекан и извлечь сердцевину бывает не так-то просто. Попробуйте замочить орехи в солёной воде на час-другой. Чиститься будут проще, и само тело ореха можно достать из скорлупы без проблем.
Вернуть яблоку свежий вид
Если яблоко слегка пожухло и сморщилось, искупайте его в слабом солевом растворе. Кожица разгладится и станет более упругой.
Приготовить скраб для тела
Соль можно использовать для отшелушивания старых частиц кожи перед душем. Есть множество рецептов самодельных скрабов, хотя обычно в них участвует морская соль. Но тот же эффект будет достигнут, если просто нанести соль на губку или мочалку и как следует обработать кожу перед купанием. Такие растирания, кстати, очень бодрят и помогают избавиться от утренней сонливости.
Освежить дыхание
Есть старый бабушкин способ: как избавиться от неприятных запахов во рту. Ныне он многими позабыт, а напрасно. Смесь соды (1 чайная ложка), соли (столько же) и воды (полчашки) по-прежнему отменно очищает полость рта.
Чистить холодильник
Не любите химические средства при обработке внутренней части холодильника? Соляной раствор неплохо справится и с этой проблемой, если, конечно, в вашем холодильнике нет стародавних отложений. Пригоршни соли на 3,5-4 литра тёплой воды будет вполне достаточно. Главное, растворите её как следует, чтобы не поцарапать поверхность.
Пригоршни соли на 3,5-4 литра тёплой воды будет вполне достаточно. Главное, растворите её как следует, чтобы не поцарапать поверхность.
Сварить яйца правильно
Добавьте немного соли в воду, где варите яйца. Это укрепит скорлупу, и белок не выльется, даже если яйцо треснет. К тому же, чистить яйца будет значительно проще.
Пожарить еду без брызг масла
Если вы боитесь брызг кипящего масла, добавьте в него на сковородку немного соли, прежде чем выкладывать продукты. Лишняя влага впитается, и брызг станет гораздо меньше.
Бороться с плесенью
Смесь соли и лимонного сока отлично удаляет плесень. Актуально при чистке плитки или ванной комнаты. Также соль может сохранить сыр от плесени: пропитайте соляным раствором салфетку и заверните в неё сыр.
Почистить клавиши пианино
Если пол-лимона обмакнуть в соль, получится природный отбеливатель и чистящее средство для клавиш старого пианино. После нанесения останется лишь аккуратно протереть поверхность сухой тряпочкой.
Сохранять воду горячей
Вода в грелке или бутылке дольше сохранит тепло, если её подсолить.
Удалить следы от пота
Свежие следы от пота на одежде удаляются раствором поваренной соли (1 столовая ложка на стакан воды).
Как видим, соль может быть полезна не только как вкусовая добавка. На каждую домашнюю мелочь мы привыкли покупать в супермаркете отдельный флакон со специальным средством. А ведь со многими домашними проблемами ничуть не хуже справится соль.
Плюсы и минусы поваренной соли. Комментарий к.м.н., ведущего научного сотрудника Еганян Рузанны Азатовны
Поваренная соль — продукт необходимый для жизнедеятельности человека. Она участвует в обмене веществ, обеспечивает осмотическое давление в сосудистом русле, объем крови, формирует потенциал мембран клетки, участвует в стабилизации кислотно-щелочного равновесия организма. Она является мощным консервантом, обеспечивает форму и вес продуктов при приготовлении. Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), ежедневное количество потребляемой соли не должно превышать 5 г. Принимается в расчет и скрытая соль, которая содержится в гастрономических продуктах и хлебобулочных изделиях. В России потребление поваренной соли превышает в среднем 12 г в сутки. При этом в основном это обеспечивается хлебобулочными изделиям и гастрономическими продуктами. Поэтому для снижения потребления поваренной соли мы рекомендуем 3 пути: снизить потребление солений, маринадов, соленых соусов, копченостей, меньше использовать соли при приготовлении пищи, и не досаливать пищу за столом. Эпидемиологические исследования на десятках тысяч людей во многих странах мира показали достоверную связь между уровнем артериального давления и потреблением поваренной соли. В странах с высоким потреблением поваренной соли, например в Китае (14 г в день), риск инсульта и смертность от него в 3-4 раза выше, чем в США, где в среднем потребляют ежедневно на 5 г меньше (8-9 г).
Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), ежедневное количество потребляемой соли не должно превышать 5 г. Принимается в расчет и скрытая соль, которая содержится в гастрономических продуктах и хлебобулочных изделиях. В России потребление поваренной соли превышает в среднем 12 г в сутки. При этом в основном это обеспечивается хлебобулочными изделиям и гастрономическими продуктами. Поэтому для снижения потребления поваренной соли мы рекомендуем 3 пути: снизить потребление солений, маринадов, соленых соусов, копченостей, меньше использовать соли при приготовлении пищи, и не досаливать пищу за столом. Эпидемиологические исследования на десятках тысяч людей во многих странах мира показали достоверную связь между уровнем артериального давления и потреблением поваренной соли. В странах с высоким потреблением поваренной соли, например в Китае (14 г в день), риск инсульта и смертность от него в 3-4 раза выше, чем в США, где в среднем потребляют ежедневно на 5 г меньше (8-9 г). Установлено также, что снижение потребления соли на 2-2,5 г (половина чайной ложки) на 30% снижает риск инфарктов, инсультов, смертности от сердечно-сосудистых заболеваний. С потреблением поваренной соли связано и развитие хронических гастритов, а также артрозов и артритов. В настоящее время появились сведения о неблагоприятном воздействии ограничения поваренной соли у больных диабетом 1 типа. На основании этого в разрабатываемой Стратегии профилактики нашего Центра предусмотрено снижение потребления поваренной соли на 30% . Это одна из девяти добровольных целей, продиктованных ВОЗ для снижения заболеваемости и смертности в различных странах мира. Конечно, ограничить потребление соли человек может и сам, сократив использование соли при употреблении несоленой пищи. Но остается проблема продуктов, которые выпускаются пищевой промышленностью — консервы, готовые соусы, колбасно-ветчинные гастрономические изделия и т.п. И здесь требуются уже совместные усилия и государства, и производителей, и торговли, и общественного питания.
Установлено также, что снижение потребления соли на 2-2,5 г (половина чайной ложки) на 30% снижает риск инфарктов, инсультов, смертности от сердечно-сосудистых заболеваний. С потреблением поваренной соли связано и развитие хронических гастритов, а также артрозов и артритов. В настоящее время появились сведения о неблагоприятном воздействии ограничения поваренной соли у больных диабетом 1 типа. На основании этого в разрабатываемой Стратегии профилактики нашего Центра предусмотрено снижение потребления поваренной соли на 30% . Это одна из девяти добровольных целей, продиктованных ВОЗ для снижения заболеваемости и смертности в различных странах мира. Конечно, ограничить потребление соли человек может и сам, сократив использование соли при употреблении несоленой пищи. Но остается проблема продуктов, которые выпускаются пищевой промышленностью — консервы, готовые соусы, колбасно-ветчинные гастрономические изделия и т.п. И здесь требуются уже совместные усилия и государства, и производителей, и торговли, и общественного питания. Потребителю же можно посоветовать внимательнее изучать упаковки продуктов и не злоупотреблять содержащей соль гастрономией.
Потребителю же можно посоветовать внимательнее изучать упаковки продуктов и не злоупотреблять содержащей соль гастрономией.
Хлорид натрия — структура, свойства, использование, происхождение и получение
Что такое хлорид натрия, NaCl?
Хлорид натрия широко известен как соль, представляющая собой ионное соединение, имеющее химическую формулу (NaCl), представляющую соотношение хлорида и ионов натрия 1:1. Хлорид натрия — это соль, которая в наибольшей степени отвечает за соленость морской воды и внеклеточной жидкости различных многоклеточных организмов. Он обычно используется в качестве приправы и пищевого консерванта в пищевой форме поваренной соли.Определенные огромные количества NaCl используются в многочисленных промышленных процессах и являются основным источником соединений натрия и хлора, которые используются в качестве сырья для дальнейших химических синтезов. Вторым основным применением хлорида натрия является борьба с обледенением дорог в минусовую погоду.
Около 1-5% морской воды состоит из хлорида натрия. Это твердое кристаллическое вещество белого цвета. Его называют солевым раствором в водной форме.
Молекулярная масса NaCl равна 58.44 г/моль.
Это водорастворимое соединение с катионом натрия и анионом хлорида. Она широко известна как поваренная соль и используется в основном в пищевой промышленности для консервации и ароматизации. Значение pH NaCl равно 7.
Структура NaCl
Структура NaCl может быть представлена следующим образом:
[Изображение будет загружено в ближайшее время]
Свойства хлорида натрия белое кристаллическое твердое вещество с плотностью 2.165 г/мл, температура плавления 801°С, температура кипения около 1413°С. Он также доступен в виде водных растворов с различной концентрацией, известных как солевые растворы.
Химические свойства NaCl
Хлорид натрия является легко растворимым соединением в воде и других полярных растворителях и представляет собой стабильное твердое вещество. Он разлагается только при высоких температурах с образованием токсичных паров двуокиси натрия (Na2O) и соляной кислоты (HCl).
Он разлагается только при высоких температурах с образованием токсичных паров двуокиси натрия (Na2O) и соляной кислоты (HCl).
Использование хлорида натрия
Что касается многих применений NaCl, некоторые из них перечислены ниже.
Хлорид натрия хорошо известен как поваренная соль и широко используется в пищевой промышленности для ароматизации и консервации.
Кроме того, он используется для производства различных основных химических веществ, включая гидроксид натрия, пищевую соду, карбонат натрия, соляную кислоту и многое другое. Он также находит применение в текстильной промышленности, нефтеперерабатывающих заводах, целлюлозно-бумажной промышленности, огнезащитных составах, дорожном строительстве и резиновой промышленности.
В производстве кальцинированной соды он используется для производства карбоната натрия с помощью процесса Solvay.
 Эти солевые растворы также используются в различных медицинских целях.
Эти солевые растворы также используются в различных медицинских целях.Соединение также используется в чистящих средствах, таких как шампунь, зубная паста и даже в средствах для смягчения воды.
Использование хлорида натрия в организме человека
Транспортировка и всасывание питательных веществ
И натрий, и хлорид играют важную роль в нашем тонком кишечнике. Натрий помогает вашему организму усваивать сахар, воду, хлорид и аминокислоты (которые являются строительными блоками белка).
Когда хлорид находится в форме соляной кислоты (водород и хлорид), он действует как компонент желудочного сока. И это помогает нашему телу переваривать и усваивать питательные вещества.
Поддержание энергии покоя
Натрий и калий — это электролиты в жидкости внутри и снаружи клеток нашего тела. Баланс между этими двумя частицами влияет на то, как клетки поддерживают энергию тела.
Кроме того, это то, как нервы посылают сигналы в мозг, как сокращаются мышцы и как работает сердце.
Поддержание водного баланса и кровяного давления
Мозг, почки и надпочечники совместно регулируют количество натрия в организме человека. Химические сигналы стимулируют почки удерживать воду, чтобы она могла избавиться от лишней воды с мочой или повторно всосаться в кровоток.
Когда в нашем кровотоке слишком много натрия, мозг дает сигнал почкам выпустить больше воды в кровоток. Это приводит к увеличению объема крови и артериального давления.Уменьшение потребления натрия может привести к тому, что меньше воды будет всасываться в кровоток. В результате снижается артериальное давление.
Наличие хлорида натрия
Обычно большинство химических соединений, состоящих из хлора или натрия, получают из солей. Широко распространен в природе. Соль является важным компонентом растворенных в морской воде материалов.
Чистая соль может быть получена из минералов галита. Хлорид натрия образуется при разработке месторождений, а соляной раствор собирается путем перекачки воды в месторождения.Поэтому соли растворяются, а раствор откачивается.
Выпаривание морской воды является одним из основных методов извлечения соли и чаще всего применяется в таких странах, как Индия. Обычно полученные кристаллы состоят из примесей типа сульфата натрия, сульфата кальция и так далее. Чистые кристаллы получают путем растворения солей в небольшом количестве воды и фильтрации раствора.
Получение хлорида натрия
Однако натрий и хлор реагируют вместе, образуя вещество, знакомое почти всем по всему миру: хлорид натрия, поваренную соль или поваренную соль.
2Na(т) + Cl2(г) → 2NaCl(т)
Каковы типы и свойства солей?
Соли — это ионные соединения, образующиеся в результате реакции нейтрализации кислоты и основания, они состоят из комбинации положительного иона (или положительной атомной группы) с отрицательной атомной группой (или отрицательного иона неметалла, кроме кислорода ).
Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательных ионов), так что продукт является электрически нейтральным (без суммарного заряда), и эти составляющие ионы могут быть неорганическими.
Соли производятся из комбинации положительных ионов с отрицательными ионами, такими как хлорид натрия (столовая соль) NaCl и бромид свинца.
Соли получают из комбинации положительного иона с отрицательной атомной группой, такой как нитрат натрия, карбонат магния и безводный сульфат меди.
Соли получают из комбинации положительной атомной группы с отрицательным ионом, такой как хлорид аммония и бромид аммония.
Соли получают из комбинации положительной атомной группы с отрицательной атомной группой, например, карбонат аммония.
Хлорид натрия
Соли существуют в земной коре или растворены в воде, хлорид натрия (NaCl) является наиболее важным химическим соединением для человеческого организма. Мы получаем соли из моря, крови имеет аналогичный химический баланс натрия, калия, кальция в нашем организме.
Мы получаем соли из моря, крови имеет аналогичный химический баланс натрия, калия, кальция в нашем организме.
Соли бывают разных цветов: хромат натрия желтый, нитрат кобальта красный, дихромат калия оранжевый, перманганат калия фиолетовый, гексагидрат хлорида никеля зеленый, гексагидрат хлорида никеля синий, хлорид натрия бесцветный или может казаться белый в виде порошка или в виде мелких кусочков.
Соленый вкус морской воды обусловлен наличием большого количества солей, таких как хлорид натрия и бромид магния, в морской воде много разнообразных солей.
Различные соли могут иметь пять основных вкусов, соль соленая, например хлорид натрия, сладкая соль, например диацетат свинца, который при попадании внутрь вызывает отравление свинцом, кислая соль, например битартрат калия, горькая такие как сульфат магния, умами или пикантные, такие как глутамат натрия.
Соли сильных кислот и сильных оснований (сильные соли) нелетучи и не имеют запаха, в то время как соли слабых кислот или слабых оснований (слабые соли) могут пахнуть после сопряженной кислоты, такой как ацетаты, такие как уксусная кислота (уксус) и цианиды, такие как цианистый водород (миндаль), или сопряженное основание, такое как соли аммония, такие как аммиак, ионов компонентов.
Некоторые минеральные соли подразделяются на соли, растворенные в воде, и соли, не растворенные в воде, все соли натрия, калия и аммония растворимы в воде, такие как все нитраты и многие сульфаты, сульфат бария, сульфат кальция (умеренно растворимый).
Соли, растворенные в воде, такие как хлорид натрия, сульфат калия, нитрат кальция и сульфид натрия. Ионы, которые прочно связываются друг с другом и образуют высокостабильные решетки, менее растворимы, поскольку эти структуры труднее разрушаются для соединения для растворения.
Большинство карбонатных солей не растворяются в воде, такие как карбонат свинца и карбонат бария, а также растворимые карбонатные соли, такие как карбонат натрия, карбонат калия и карбонат аммония.
Нерастворимые в воде соли, такие как хлорид серебра, йодид свинца и сульфат свинца. Твердые соли не проводят электричество, в отличие от жидких солей, а растворы солей также проводят электричество.
Расплавленные соли и растворы, содержащие растворенные соли, называются электролитами, такими как (хлорид натрия в воде), потому что они способны проводить электричество.
Экономическое значение некоторых обычных кислот, оснований и солей (минералов)
Способы образования солей и типы водных растворов солей
Образование солей. Химическая формула солей и ее название
Щепотка натрия | Химия природы
Натрий, повсеместно присутствующий на Земле в живых организмах, океанах и минералах — вплоть до поваренной соли — может показаться одним из самых обычных элементов. Маргит С. Мюллер подчеркивает, почему мы, как сказочный король, не должны принимать это как должное.
Маргит С. Мюллер подчеркивает, почему мы, как сказочный король, не должны принимать это как должное.
В старинной восточноевропейской сказке король просит трех дочерей описать свою любовь к нему. В то время как две дочери сравнивают свою привязанность с бриллиантами, жемчугом и золотом, третья девушка заявляет: «Отец, я люблю тебя больше, чем соль». Глубоко оскорбленный тем, что его уподобляют чему-то столь обыденному, король изгоняет ее.Принцесса исчезает из королевства, а вместе с ней и вся соль. История продолжается, чтобы убедить короля и читателя в важности, казалось бы, обыденных вещей в жизни, таких как соль. Чтобы сделать то же самое без колдовства, науке пришлось пойти на гораздо большее.
Элементы, составляющие то, что мы называем поваренной солью, натрий и хлор, связаны с сэром Хамфри Дэви. Дэви открыл натрий в 1807 году, выделив его из гидроксида натрия с помощью электролиза, а в 1811 году он дал хлору его название после того, как недвусмысленно признал его чистым элементом — хотя в 1774 году шведский химик Карл Вильгельм Шееле открыл хлор, быть смесью с кислородом.
Предоставлено: © ISTOCKPHOTO.COM/STEVENALLAN
Натрий — щелочной металл, чрезвычайно активно реагирующий с кислородом и водой — был тщательно охарактеризован в годы после его открытия. Отчеты, датируемые более чем 150-летней давностью, ярко описывают 1,2 его химические и физические свойства, в первую очередь его ярко-желтое пламя и его окисление водой, которое выделяет газообразный водород так быстро, что фрагменты натрия, кажется, «танцуют» на поверхности воды. Эти ранние отчеты не только содержат ценную химическую информацию, но и иллюстрируют большую часть волнения, вызванного научным любопытством: читатель может узнать, например, как удар шпателем по кусочкам натрия, шипящим на воде, вызовет громкий хлопок вместе с фонтаном воды. и разбивание чаши 1 .Интенсивный желтый цвет, который натрий придает огню, впоследствии стал прекрасным применением в фейерверках.
В 1957 году первый ядерный реактор, который стал коммерческим источником энергии в США, охлаждался с использованием натрия. Лучший проводник тепла, чем вода, это жидкость с низким давлением паров около 260 ° C, температура, при которой работал реактор. Хотя «Эксперимент с натриевым реактором» через пару лет обернулся катастрофой, повлекшей за собой повреждение активной зоны и выброс некоторого количества радиоактивности, он продемонстрировал возможность использования натрия в качестве теплоносителя 3 .
Лучший проводник тепла, чем вода, это жидкость с низким давлением паров около 260 ° C, температура, при которой работал реактор. Хотя «Эксперимент с натриевым реактором» через пару лет обернулся катастрофой, повлекшей за собой повреждение активной зоны и выброс некоторого количества радиоактивности, он продемонстрировал возможность использования натрия в качестве теплоносителя 3 .
Тем не менее, наиболее важная роль натрия может быть в биологии. Хотя его участие в гипертонии и сердечных заболеваниях создало ему дурную славу, натрий на самом деле поддерживает нашу жизнь. Наши клетки постоянно уравновешивают высокие концентрации калия и низкие концентрации натрия внутри клеток (~140 мМ K + , ~15 мМ Na + ) с противоположным распределением (~5 мМ K + , ~150 мМ Na + ) за пределами. Этот баланс является фундаментальной частью почти всего, что мы делаем, от видения до мышления, не говоря уже о дыхании и биении нашего сердца.Белки в мембране специфических «возбудимых» клеток образуют натриевые каналы, открываемые триггером (связыванием лиганда или изменением напряжения на мембране), что обеспечивает быстрый приток ионов Na + в клетку. Это регулирует секрецию в эндокринных клетках, сокращение мышечных клеток и нейротрансмиссию в нервных клетках — путь связи внутри мозга.
Это регулирует секрецию в эндокринных клетках, сокращение мышечных клеток и нейротрансмиссию в нервных клетках — путь связи внутри мозга.
На самом деле, нарушение притока натрия — очень эффективный способ кого-то убить. Тетродотоксин (ТТХ), соединение, обнаруженное в иглобрюхе (или фугу), которое блокирует потенциал-управляемые натриевые каналы в нервных клетках, является одним из самых токсичных веществ на земле и не имеет известного противоядия.Интоксикация достаточной дозой — чаще всего через блюда из фугу, приготовленные недостаточно тщательно — приводит к смерти от дыхательной недостаточности в течение нескольких минут или часов. Однако те же характеристики делают ТТХ очень ценным исследовательским инструментом для изучения нейронных сетей, составляющих основу работы мозга, понимание которой мы только сейчас начинаем получать.
Химики также недавно получили удивительное представление о природе самого натрия. Янмин Ма и его коллеги продемонстрировали 4 , что сжатие резко изменяет оптические свойства металла. Воздействие на натрий повышающегося давления вызывает последовательную потерю отражения видимого света, превращая его в прозрачный материал при давлении около 200 ГПа. Этот переход приписывается гибридизации между 90 222 p 90 223 и 90 222 d 90 223 электронов, которые отталкиваются остовными электронами и занимают междоузлия внутри решетки натрия.
Воздействие на натрий повышающегося давления вызывает последовательную потерю отражения видимого света, превращая его в прозрачный материал при давлении около 200 ГПа. Этот переход приписывается гибридизации между 90 222 p 90 223 и 90 222 d 90 223 электронов, которые отталкиваются остовными электронами и занимают междоузлия внутри решетки натрия.
От фейерверков и ядерных реакторов до человеческого мозга и структурных открытий натрий, несомненно, является частью захватывающей истории научных открытий, которым пока не видно конца.
Это эссе было выбрано победителем в нашем конкурсе сочинений, см. Редакционную статью этого месяца на p901 для более подробной информации .
Информация об авторе
Филиалы
Маргит С. Мюллер — аспирант кафедры фармакологии и фармакотерапии факультета фармацевтических наук Копенгагенского университета, Universitetsparken 2 DK-2100, Копенгаген, Дания
Маргит С.
 Мюллер
Мюллер
Автор, ответственный за переписку
Маргит С. Мюллер.
Об этой статье
Процитировать эту статью
Müller, M. Щепотка натрия. Nature Chem 3, 974 (2011). https://doi.org/10.1038/nchem.1205
Загрузка цитирования
Опубликовано:
Дата выпуска:
doi : https: / /дои.org/10.1038/nchem.1205
Поделитесь этой статьей
Любой, с кем вы поделитесь следующей ссылкой, сможет прочитать этот контент:
Получить ссылку для общего доступаИзвините, ссылка для общего доступа в настоящее время недоступна для этой статьи.
Предоставлено инициативой Springer Nature SharedIt по обмену контентом.
Безопасность при работе с солью – Информация о безопасности при использовании хлорида натрия
Информация и советы по безопасности при использовании хлорида натрия
Хлорид натрия — это химическое название соли или поваренной соли. Это белое кристаллическое минеральное вещество, которое используется в качестве приправы ко многим продуктам питания, а также во многих ситуациях на рабочем месте для самых разных целей.
Это белое кристаллическое минеральное вещество, которое используется в качестве приправы ко многим продуктам питания, а также во многих ситуациях на рабочем месте для самых разных целей.
Растворы хлорида натрия используются в медицине для лечения или предотвращения потери натрия, вызванной обезвоживанием, чрезмерным потоотделением или другими проблемами. Эти растворы используются для внутривенных (IV) инфузий и инъекций для промывания катетера. В виде солевого раствора хлорид натрия используется для очистки таких предметов, как контактные линзы.
Меры предосторожности при работе с хлоридом натрия
Хотя хлорид натрия в настоящее время не считается опасным для здоровья, при работе с химическим веществом следует соблюдать следующие меры предосторожности, чтобы избежать любых потенциальных опасностей:
- Рабочая зона должна иметь достаточную вытяжную вентиляцию.Регулярно пылесосьте пыль, чтобы свести к минимуму возможность ее воздействия в воздухе.

- Избегайте контакта с глазами и носите защитные очки, если/когда возможен контакт с глазами.
- Избегать контакта с кожей и носить защитную одежду и перчатки.
Борьба с воздействием хлорида натрия
Хотя известно, что обычное обращение с хлоридом натрия не имеет каких-либо значительных последствий или опасностей для здоровья, в случае воздействия следует соблюдать следующие передовые лабораторные методы:
1) Попадание в глаза
При необходимости снимите контактные линзы.Немедленно промойте большим количеством воды в течение не менее пяти минут. Обратитесь за медицинской помощью, если раздражение возникает и не проходит.
2) Контакт с кожей
Снимите загрязненную одежду и промойте пораженный участок большим количеством воды с мылом. Обратитесь за медицинской помощью, если кожа становится раздраженной или появляется сыпь.
3) Вдыхание
Вынести пострадавшего из зоны воздействия и вывести на свежий воздух. Обратитесь за медицинской помощью, если у подвергшегося воздействию человека возникли трудности с дыханием.
Обратитесь за медицинской помощью, если у подвергшегося воздействию человека возникли трудности с дыханием.
4) Проглатывание
Не вызывать рвоту. Если человек в сознании, прополоскать рот большим количеством воды и дать выпить несколько стаканов воды. Обратитесь за медицинской помощью при появлении неблагоприятных симптомов.
Безопасное обращение с разливами хлорида натрия
В случае разлива хлорида натрия необходимо принять следующие меры:
- Пропылесосьте или подметите участок. Избегайте сухой уборки или других методов, при которых поднимается пыль.
- Поместить в закрывающийся контейнер и промаркировать для утилизации.
- Очистите поверхность водой с моющим средством.
Надлежащее хранение хлорида натрия
Хлорид натрия следует хранить в прохладном, сухом, хорошо проветриваемом помещении в надежно закрытой таре. Обязательно держите это химическое вещество подальше от чрезмерного тепла.
Для получения дополнительной информации о хлориде натрия и других химических веществах выполните поиск в нашей базе данных паспортов безопасности материалов здесь.
Гексагональная соль — Новости химии
Джо Альфано / EyeEmGetty Images
- Исследователи использовали алмазный лист и соляную пленку для создания шестиугольных кристаллов соли.
- Хлорид натрия широко распространен в нашей Вселенной, но все же полон сюрпризов.
- Ученые использовали алгоритм поиска кристаллов под названием USPEX, чтобы смоделировать и предсказать их кристаллы.
Ученые впервые использовали сочетание физических и химических свойств, чтобы согнуть соль в шестиугольные кристаллы . Они образовали тонкий слой кристаллической соли на подложке (основном слое) алмаза.
Этот вид эксперимента называется экзотической двумерной структурой, где слово «экзотика» имеет самое буквальное определение: экзо означает снаружи. Эти структуры выходят за рамки того, что мы видим и ожидаем от различных соединений. А двумерность относится к самому строгому математическому смыслу, где «лист» вещества имеет толщину всего в один атом.
Эти структуры выходят за рамки того, что мы видим и ожидаем от различных соединений. А двумерность относится к самому строгому математическому смыслу, где «лист» вещества имеет толщину всего в один атом.
Хлорид натрия, представляющий собой поваренную соль, естественным образом образует кубические кристаллы. И когда формируются кристаллы, их естественные формы отражают атомную структуру , лежащую под ними, что является одной из причин, почему изменение формы имеет такое большое значение.
Пирит (или золото дураков) имеет атомную структуру , аналогичную хлориду натрия, и выражается в драматических кубических кристаллах.Алмазы имеют кубические кристаллы, что делает еще более интересным тот факт, что алмазная подложка в этом эксперименте вместо этого спрессовала соль в шестиугольники. Кубический цирконий, искусственный алмаз, представляет собой особую (кубическую) форму материала, который в природе встречается в виде прямоугольных кристаллов.
Исторически сложилось так, что изменение выраженной формы кристалла требовало изменения атомной структуры. Но теперь ученые используют очень тонкие пленки в сочетании с химическим воздействием, чтобы превратить даже обычную старую поваренную соль в новые формы.
Но теперь ученые используют очень тонкие пленки в сочетании с химическим воздействием, чтобы превратить даже обычную старую поваренную соль в новые формы.
«NaCl — одно из простейших соединений, и считалось, что оно хорошо изучено, и тем не менее, неожиданные сложности, связанные с ним, были обнаружены при высоком давлении и в низкоразмерных состояниях», — объясняют исследователи в своей статье .
Сколковский институт науки и технологий
В результате получился двумерный слой гексагональных кристаллов NaCl «в среднем толщиной всего 6 нанометров — слой, который был подтвержден измерениями рентгеновской и электронной дифракции», — объясняет ScienceAlert .При любом увеличении толщины кубичность возвращалась, показывая, насколько хрупкой и точной должна быть эта шестиугольная структура. Но гексагональной 2D-структуры достаточно, чтобы открыть новые возможности для исследований в области электроники, в которых используется аналогичный слой природного гексагонального кристаллического материала.
Могут ли NaCl или подобные материалы лучше работать в этих технологиях? Конечно, приятно иметь возможность продолжить изучение.
Прежде чем что-то сделать в лаборатории, ученые провели моделирование в краеугольном алгоритме под названием USPEX, что означает Универсальный Предсказатель Структуры: Эволюционная Xtallography.В настоящий момент «моя самая большая слабость в том, насколько я забочусь» на веб-сайте USPEX есть раздел «Текущие ограничения»: «Из-за высокой степени успеха метода мы не видели много ограничений на практике».
Алгоритм USPEX в действии.
Цифры подтверждают это наблюдение: 2D-материалы жизненно важны, но область с лотом еще не исследована. В статье 2006 года создатели объясняют:
«Эволюционные алгоритмы представляют собой привлекательную альтернативу этим методам, поскольку для определенных типов задач они, как известно, очень эффективны при нахождении глобальных минимумов многомерных функций, полностью нелокальны, не предполагают каких-либо предположений о параметре порядка или топологии ландшафта и не требуют исходной структуры.
Использование алгоритма для прогона и оценки потенциальных кристаллических структур устраняет почти все допущения, необходимые исследователям для традиционных «аналоговых» методов, таких как сравнение сходных кристаллических структур различных элементов. Представьте себе покупку одежды в новом магазине, где они требуют показать вашу любимую пару брюк, прежде чем показать вам все, что вам может понравиться, вместо того, чтобы позволить вам прогуляться и посмотреть, что вас интересует.
Оба подхода имеют ценность, но один позволяет вам посмотреть на все и потенциально удивить самого себя.И если что-то до сих пор отличало научные исследования в 21 веке, так это элемент неожиданности.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на фортепиано.ио
Вы можете найти больше информации об этом и подобном контенте на фортепиано.ио
Хлорид натрия
Что произойдет, если соединить хлор (ядовитый газ) с натрием (ядовитый металл)? Вы получаете поваренную соль (хлорид натрия), кристалл, который растворяется в двух основных питательных веществах. Как два токсичных вещества превращаются в питательные вещества? Они соединяются как атомы и разделяются как ионы.
Когда атомы натрия и хлора объединяются, образуя хлорид натрия (NaCl), они переносят электрон.Атом натрия (Na) передает один электрон атому хлора (Cl), так что они оба имеют полные внешние оболочки. С заполненными внешними оболочками они перестают быть химически активными и не могут образовывать ковалентные связи, чтобы стать частью молекулы. Однако с переносом электрона они становятся электрически заряженными и объединяются в соли посредством образования ионных связей.
Ион натрия теперь имеет только десять электронов, но все еще имеет одиннадцать протонов. Это нарушает баланс зарядов между протонами и электронами, что приводит к тому, что атом натрия имеет чистый положительный заряд.Когда это происходит, атом называется положительным ионом . Ион хлорида теперь имеет восемнадцать электронов и семнадцать протонов, поэтому он стал отрицательным ионом .
Это нарушает баланс зарядов между протонами и электронами, что приводит к тому, что атом натрия имеет чистый положительный заряд.Когда это происходит, атом называется положительным ионом . Ион хлорида теперь имеет восемнадцать электронов и семнадцать протонов, поэтому он стал отрицательным ионом .
Поскольку ион натрия имеет положительный заряд, а ион хлора — отрицательный, они притягиваются друг к другу и образуют ионную связь. Ионы образуют соли, а не молекулы, но выполняют множество важных функций в питании.
Натрий и хлор очень реакционноспособны в своих предионных состояниях.Они будут передавать электроны и (в сухих условиях) образовывать соли, когда встречаются друг с другом. Каждый из них будет реагировать с другими элементами, если они не найдут друг друга первыми, поэтому они редко встречаются в природе в их реактивных состояниях.
Они обычно попадают на наши тарелки вместе в виде поваренной соли (или ее растворенных ионов). Однако в нашем организме они не связаны вместе в виде соли, а снова растворяются в отдельных ионах в воде. И хотя они дополняют друг друга во многих биологических процессах, у них также есть свои отдельные роли.
Однако в нашем организме они не связаны вместе в виде соли, а снова растворяются в отдельных ионах в воде. И хотя они дополняют друг друга во многих биологических процессах, у них также есть свои отдельные роли.
Мы уже видели, что происходит при соединении натрия и хлорида. Теперь мы рассмотрим каждый из них в отдельности. Сначала мы рассмотрим их как реактивные атомы и выясним, почему они токсичны в этом состоянии. Затем мы рассмотрим их в их ионной форме и выясним, почему они имеют питательную ценность.
Когда большинство людей думают о натрии, они думают о поваренной соли. В то время как поваренная соль содержит ионизированную форму натрия (в сочетании с хлоридом), неионизированный «металлический» натрий имеет совершенно другой набор химических свойств, чем ионы натрия в поваренной соли.Здесь мы исследуем химические свойства натрия в его реактивном (токсичном) состоянии, а в следующем разделе рассмотрим натрий в его ионном (питательном) состоянии.
Атом натрия (Na) имеет одиннадцать протонов и одиннадцать электронов, что придает ему нейтральный (сбалансированный) электрический заряд. Однако у него только один электрон на внешней оболочке, что делает его химически активным. Чтобы быть химически стабильным, он должен иметь полную внешнюю оболочку. Легче избавиться от одного внешнего электрона, чем приобрести еще семь электронов, поэтому он выглядит так, будто отдает электрон.
Внешние электроны каждого атома натрия не нужны ни одному из атомов натрия, поэтому образуется облако нежелательных электронов. Беспорядочное движение электронов в этом облаке вызывает сдвиги в электрических свойствах отдельных атомов, что, в свою очередь, вызывает слабое притяжение атомов друг к другу. Этот небольшой электрический дисбаланс инициирует металлическую связь при комнатной температуре, в результате чего атомы слипаются в мягкий металл, который можно разрезать ножом.
Соединение атомов металлического натрия друг с другом происходит относительно гладко. Чтобы понять, почему металлический натрий так реактивен, давайте посмотрим, что происходит, когда он вступает в контакт с водой.
Чтобы понять, почему металлический натрий так реактивен, давайте посмотрим, что происходит, когда он вступает в контакт с водой.
Вода (H 2 O) представляет собой молекулу, состоящую из двух атомов водорода, ковалентно связанных с атомом кислорода. Эти связи образуются потому, что атому кислорода нужно два электрона, чтобы заполнить его внешнюю оболочку, а каждому атому водорода нужен один электрон. При образовании молекулы воды удобно заполнять внешние оболочки всех трех атомов, поэтому молекулы воды образуются из двух газов.
Металлический натрий в воде
Молекулярные связи, образованные атомами водорода и кислорода в воде, настолько слабы, что часто разрываются из-за случайной тепловой энергии. Поэтому, когда натрий хочет избавиться от своего лишнего электрона, вода становится легкой мишенью. Одна из водородно-кислородных связей в воде легко разрывается, и атом натрия отдает свой нежелательный электрон, заполняя освободившееся место во внешней оболочке кислорода. Поскольку отданный электрон перемещается из высокоэнергетического состояния вокруг натрия в более низкое энергетическое состояние вокруг кислорода, высвобождается дополнительная энергия.Это видео ScienceFix показывает, насколько взрывоопасной может быть химическая реакция.
Поскольку отданный электрон перемещается из высокоэнергетического состояния вокруг натрия в более низкое энергетическое состояние вокруг кислорода, высвобождается дополнительная энергия.Это видео ScienceFix показывает, насколько взрывоопасной может быть химическая реакция.
Поваренная соль содержит натрий в ионной форме. Вот почему он не взрывается при контакте с водой и имеет пищевую ценность. Он дополняет ион хлорида, потому что они имеют противоположные заряды, которые уравновешивают друг друга во многих биологических процессах. Натрий также дополняет калий, потому что, хотя они оба являются положительными ионами, они также химически различны. Химические различия между натрием и калием полезны для контроля диффузии через наши клеточные мембраны, в то время как электростатические различия между натрием и хлоридом важны для поддержания электрического дисбаланса в тех же самых клеточных мембранах.Чтобы увидеть, как натрий использует эти различия для обеспечения передачи сигнала в нервных и мышечных клетках, см.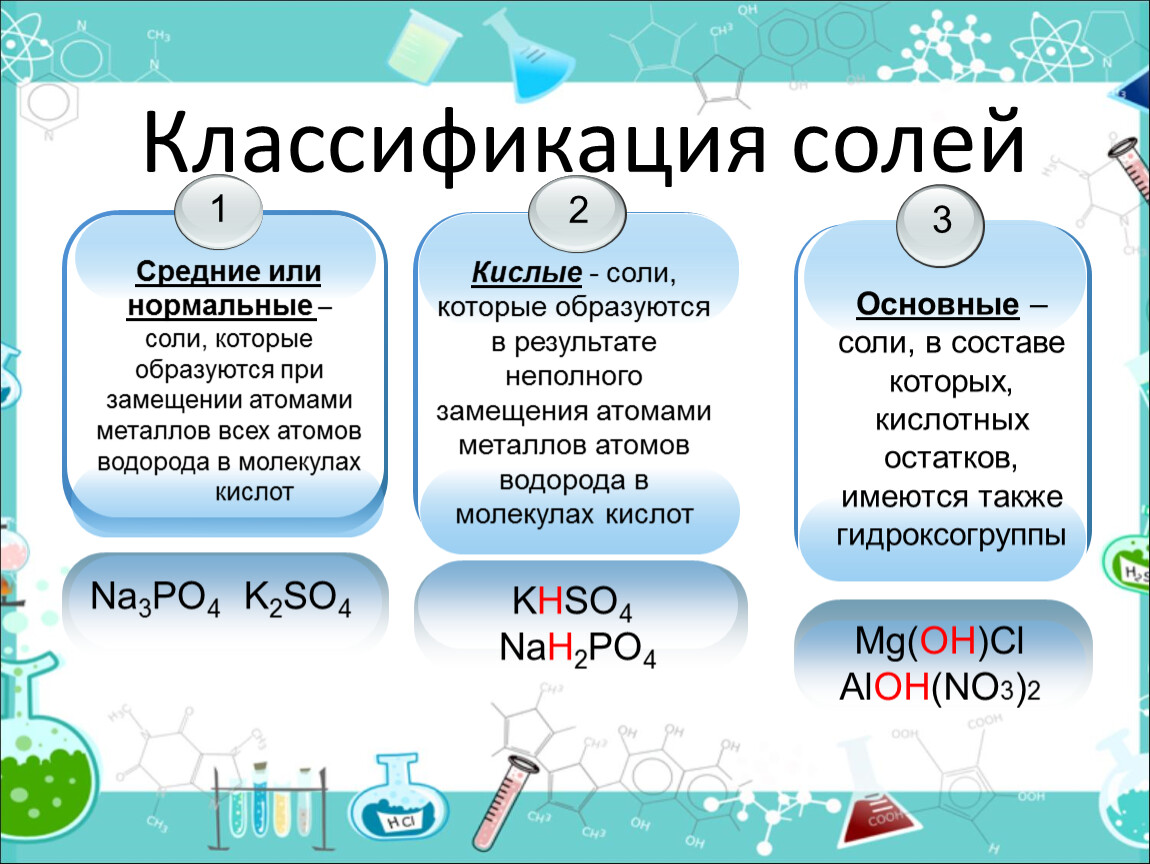 статью о диффузии.
статью о диффузии.
Натрий является важным питательным веществом в клетках животных, но его можно получить слишком много. В то время как низкий уровень натрия может вызвать мышечные спазмы из-за того, что нервные и мышечные клетки не могут контролировать передачу и прием сигнала, слишком много натрия может вызвать такие проблемы, как высокое кровяное давление.
Когда мы потребляем натрий, он всасывается в кровоток и внеклеточное пространство.Хотя для внеклеточных пространств нормально иметь гораздо более высокую концентрацию натрия, чем внутри клетки (дисбаланс используется для передачи сигнала), это может зайти слишком далеко. Если в кровотоке и внеклеточной жидкости накапливается слишком много натрия, это приведет к разбавлению концентрации воды вне клеток. Вода будет диффундировать от высоких концентраций внутри клетки к более низким концентрациям вне клетки, включая кровоток. Это вызывает обезвоживание клеток и повышение артериального давления.
Когда вода вытекает из нервных клеток, расположенных в гипоталамусе, осморецепторы в этих клетках вызывают чувство жажды. Выпивая воду, мы разбавляем натрий в кровотоке, что меняет направление потока воды обратно в клетки. Почки контролируют уровень натрия в кровотоке и в конечном итоге удаляют излишки натрия и воды, выводя их с мочой. Несмотря на этот корректирующий процесс, рутинное чрезмерное потребление натрия может привести к хроническому высокому кровяному давлению, поскольку почки могут лишь компенсировать его.
Выпивая воду, мы разбавляем натрий в кровотоке, что меняет направление потока воды обратно в клетки. Почки контролируют уровень натрия в кровотоке и в конечном итоге удаляют излишки натрия и воды, выводя их с мочой. Несмотря на этот корректирующий процесс, рутинное чрезмерное потребление натрия может привести к хроническому высокому кровяному давлению, поскольку почки могут лишь компенсировать его.
Центр атома хлора (Cl) содержит семнадцать протонов, окруженных семнадцатью электронами, что придает ему нейтральный (сбалансированный) электрический заряд. У него семь электронов на внешней оболочке, и ему нужен еще один, что делает его химически активным. Он заполняет свою внешнюю оболочку, образуя пары с другими атомами хлора, образуя небольшие молекулы, но эти ковалентные связи слабы, и хлор покидает их, когда вступает в контакт с элементом, у которого он может украсть электрон.Из-за своих химических свойств это газ при комнатной температуре, что делает его особенно опасным. Он настолько токсичен при вдыхании, что его использовали в качестве химического оружия во время Первой мировой войны. Мы используем его сегодня в небольших количествах в качестве дезинфицирующего средства.
Он настолько токсичен при вдыхании, что его использовали в качестве химического оружия во время Первой мировой войны. Мы используем его сегодня в небольших количествах в качестве дезинфицирующего средства.
Когда атом хлора вступает в контакт с атомом водорода, образуется молекула хлороводорода (HCl). Это позволяет хлору заполнять свою внешнюю электронную оболочку электроном водорода, но ядро водорода (протон) также приходит на помощь.Когда хлороводород вступает в контакт с водой (H 2 O), он передает протон молекуле воды, которая создает две заряженные молекулы (HCl становится Cl — , а H 2 O становится H 3 O ). +). Эти две молекулы растворяются в дополнительных молекулах воды, образуя очень кислый раствор, называемый соляной кислотой. Если газообразный хлор вдыхается в легкие, он соединяется с водородом (из молекул воды) с образованием хлористого водорода, а затем реагирует с водой с образованием соляной кислоты, вызывая серьезные повреждения. Если хлористый водород выделяется в желудок, он соединяется с водой с образованием соляной кислоты, способствующей пищеварению. В чем разница между токсином и питательным веществом? Иногда это не более чем расположение!
Если хлористый водород выделяется в желудок, он соединяется с водой с образованием соляной кислоты, способствующей пищеварению. В чем разница между токсином и питательным веществом? Иногда это не более чем расположение!
Когда вы переводите хлор в его ионную форму (хлорид), он дает много питательных преимуществ. Будучи отрицательным ионом, хлорид не только играет важную роль в передаче сигнала, но и химически реагирует с водородом и водой, образуя соляную кислоту, раствор, помогающий пищеварению.
Соляная кислота образуется, когда париетальные клетки, выстилающие желудок, используют хлорид-ион (Cl — ) в качестве вспомогательного средства для пищеварения, объединяя его с ионом водорода (протон, H + ), чтобы превратиться в хлороводород (HCl). . Когда париетальные клетки выделяют хлористый водород в желудок, он химически реагирует с водой. В этой реакции хлороводород снова распадается на ион хлора, передавая свой протон молекуле воды. Молекула воды (H 2 O) становится ионом гидроксония (H 3 O + ), когда она получает протон.В присутствии дополнительной воды в желудке эти два противоположно заряженных иона (хлорид и гидроксоний) остаются растворенными. Эта комбинация воды, хлорида и гидроксония образует раствор, называемый соляной кислотой. Соляная кислота является основным компонентом желудочной кислоты, которая переваривает нашу пищу. Низкий уровень кислотности желудочного сока (около 1 или 2) денатурирует (раскрывает) белки в нашей пище, так что ферменты в желудке могут разрушать (переваривать) связи, удерживающие аминокислоты вместе.
Молекула воды (H 2 O) становится ионом гидроксония (H 3 O + ), когда она получает протон.В присутствии дополнительной воды в желудке эти два противоположно заряженных иона (хлорид и гидроксоний) остаются растворенными. Эта комбинация воды, хлорида и гидроксония образует раствор, называемый соляной кислотой. Соляная кислота является основным компонентом желудочной кислоты, которая переваривает нашу пищу. Низкий уровень кислотности желудочного сока (около 1 или 2) денатурирует (раскрывает) белки в нашей пище, так что ферменты в желудке могут разрушать (переваривать) связи, удерживающие аминокислоты вместе.
Хлорид (отрицательный ион) также взаимодействует с натрием и калием (положительными ионами), создавая и поддерживая электростатический дисбаланс, который делает возможной передачу сигналов и перенос питательных веществ через клеточную мембрану. Я исследую эти взаимодействия (включая роль хлора) в статье о диффузии.
Большая часть хлорида в нашем рационе поступает из поваренной соли (хлорида натрия), но он присутствует в самых разных продуктах. В цельных продуктах его особенно много в помидорах, салате и оливках.
В цельных продуктах его особенно много в помидорах, салате и оливках.
Поваренная соль (хлорид натрия) является очень важной частью нашего рациона. В дополнение к своим питательным качествам, он используется в качестве консерванта и усилителя вкуса. Без него вкус многих наших продуктов был бы совсем другим, даже продукты, которые мы не считаем солеными, такие как хлеб и молоко. Это настолько важная часть нашего рациона, что язык развил специальный рецептор для его обнаружения.
Слова соль и поваренная соль относятся к двум разным вещам.Соль относится к целому классу химических соединений, которые удерживаются вместе ионными связями (в отличие от молекулы, которая удерживается вместе ковалентными связями), а поваренная соль относится к определенному соединению (хлориду натрия).
И натрий, и хлорид (в ионной форме) объединяются с другими веществами в другие виды солей, такие как хлорид калия или бикарбонат натрия (пищевая сода). Соли также могут быть созданы из элементов, которые не включают ни натрий, ни хлорид.
Соли также могут быть созданы из элементов, которые не включают ни натрий, ни хлорид.
Слабые ионные связи между натрием и хлоридом растворяются более сильной полярностью молекулы воды, поэтому хлорид натрия не существует в организме в виде соли.Хотя натрий и хлорид взаимодействуют друг с другом в нашем организме, они действуют как отдельные элементы. Их питательная ценность определяется не только их способностью реагировать друг с другом, но и с другими атомами или молекулами. Эти характеристики делают возможными такие процессы, как регулирование давления жидкости и передача электрических импульсов.
Почему в растениях
мало натрия
Присутствие хлорида, калия и натрия в правильных пропорциях создает среду, которая позволяет клетке выполнять свои биологические функции.Это одна из причин, по которой они являются неотъемлемой частью рациона животных. Однако натрий не является важным питательным веществом для растений. Хотя растения могут (и используют) использовать натрий, когда он доступен, они предпочитают калий. И натрий, и калий являются положительными ионами, поэтому калий может заменить натрий, когда речь идет о таких функциях, как электростатический заряд. Тем не менее, они все еще имеют существенные различия в своих химических свойствах.
Хотя растения могут (и используют) использовать натрий, когда он доступен, они предпочитают калий. И натрий, и калий являются положительными ионами, поэтому калий может заменить натрий, когда речь идет о таких функциях, как электростатический заряд. Тем не менее, они все еще имеют существенные различия в своих химических свойствах.
Нам нужен натрий, чтобы настроить градиенты концентрации для передачи сигналов в нервных и мышечных клетках.У растений нет таких клеток, поэтому им не нужен натрий для передачи сигнала. Животные используют натриево-калиевые насосы для снижения уровня давления жидкости внутри хрупких клеточных стенок, чтобы они не лопнули. Растения, с другой стороны, имеют более толстые клеточные стенки, которые не только выдерживают дополнительное давление, но и рассчитывают на то, что оно поможет сохранить структурную целостность (вот почему листья увядают, когда им не хватает воды). Растения используют протонные насосы вместо натриевых/калиевых насосов для поддержания градиента протонов, поэтому они не зависят от натрия в каких-либо критических процессах.
Еще более важным является токсическое действие натрия на растения. Натрий токсичен как для животных, так и для растений в высоких концентрациях. В то время как животные могут компенсировать высокий уровень потребления натрия, выводя его из организма через почки, у растений нет такой возможности. Кроме того, животные могут перестать потреблять натрий, а корни растений автоматически поглощают его из земли при поглощении воды. Если натрий находится в почве в больших количествах, у растения не будет возможности не поглощать его, и нет простого способа избавиться от него после того, как он поглощается.
Достаточно высокий уровень натрия вытянет воду из клеток, что смертельно опасно для всего живого. Вот как он работает как консервант. Вяленая говядина не портится, если хранится в сухом виде, потому что бактерии не могут поддерживать достаточно влаги внутри своих клеток, чтобы размножаться в присутствии такого количества соли. Вот почему люди не могут выжить в морской воде. Наша почка может удалить избыток соли, но только путем смывания ее водой. Содержание натрия в морской воде настолько велико, что для его вымывания требуется больше воды, чем содержится в морской воде.Это компенсирует разницу за счет использования воды из вашего тела, которая обезвоживает вас.
Наша почка может удалить избыток соли, но только путем смывания ее водой. Содержание натрия в морской воде настолько велико, что для его вымывания требуется больше воды, чем содержится в морской воде.Это компенсирует разницу за счет использования воды из вашего тела, которая обезвоживает вас.
Корни растений используют осмос для подачи воды в растение. Это еще одна причина, почему избыток натрия в почве вреден для растений. Натрий меняет направление осмоса, вытягивая воду из растения обратно в почву.
По всем вышеперечисленным причинам во всех свежих фруктах и овощах мало натрия, а во многих — много калия. В консервированных овощах много натрия, потому что он добавляется позже при обработке для улучшения вкуса.Завод его туда не ставил.
Использование растворения для идентификации неизвестного | Глава 5: Молекула воды и растворение
Продемонстрируйте, что разные вещества имеют разную растворимость.
Скажите учащимся, что в этой демонстрации вы будете сыпать соль и сахар в воду, чтобы выяснить, что растворяется лучше. Чтобы сделать этот тест честным, вы будете использовать одинаковое количество (массу) соли и сахара, одинаковое количество воды при одинаковой температуре и будете вращать их одинаковым образом в течение одинакового промежутка времени.
Чтобы сделать этот тест честным, вы будете использовать одинаковое количество (массу) соли и сахара, одинаковое количество воды при одинаковой температуре и будете вращать их одинаковым образом в течение одинакового промежутка времени.
Вопрос для расследования
Что лучше растворяется в воде, соль или сахар?
Материалы для демонстрации
- Весы в граммах
- Градуированный цилиндр
- Вода
- 2 прозрачных пластиковых стаканчика
- 2 маленьких пластиковых стаканчика
- Соль
- Сахар
Подготовка учителя
- Этикетка 1 прозрачный пластиковый стаканчик и 1 маленький стаканчик для соли.
- Пометьте другую прозрачную пластиковую чашку и еще одну маленькую чашку сахаром.
- Отмерьте 5 граммов соли и 5 граммов сахара и поместите их в пару маленьких чашек с надписями.
- Налейте 5 мл воды комнатной температуры в пару больших пустых чашек.
Процедура
- Одновременно всыпать соль и сахар в воду в соответствующие чашки.
 Вращайте каждую чашку одновременно и одинаково в течение примерно 20 секунд.
Вращайте каждую чашку одновременно и одинаково в течение примерно 20 секунд. - Пройдитесь по комнате и покажите учащимся, сколько соли и сахара осталось на дне каждой чашки. Если у вас есть проектор, поставьте чашки на проектор, чтобы весь класс мог сравнить, что осталось нерастворенным в каждой чашке. Спросите учащихся, растворяется ли одно вещество лучше, чем другое.
- Снова вращайте в течение 20 секунд и наблюдайте. Затем вращайтесь еще 20 секунд, и пусть ученики сделают свои последние наблюдения.
- Медленно и осторожно перелейте раствор из каждой чашки обратно в пустую помеченную чашку.Старайтесь не допускать попадания в эти чашки нерастворившихся кристаллов. Покажите учащимся чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.
Ожидаемые результаты
Сахара растворится больше, чем соли. В чашках останется больше нерастворенной соли, чем сахара.
Примечание. Растворимость обычно измеряется количеством граммов вещества, которое растворяется в определенном объеме воды при данной температуре. В предыдущей демонстрации используется этот традиционный способ измерения растворимости. Другой подход может заключаться в сравнении количества молекул или ионов каждого вещества, растворяющегося в воде. Для этого потребуется способ «подсчета» молекул или ионов в каждом веществе.
В предыдущей демонстрации используется этот традиционный способ измерения растворимости. Другой подход может заключаться в сравнении количества молекул или ионов каждого вещества, растворяющегося в воде. Для этого потребуется способ «подсчета» молекул или ионов в каждом веществе.
Обсудите результаты демонстрации и познакомьте с идеей о том, что каждое вещество имеет свою характерную растворимость.
Спросите студентов:
- На дне чашки осталось больше соли или сахара?
- На дне чашки осталось еще не растворившейся соли.
- Что растворяется лучше, соль или сахар?
- Так как сахара на дне чашки было мало или совсем не было, большая его часть должна была раствориться в воде.
- Как вы думаете, мы получили бы такие же результаты, если бы снова попытались растворить соль и сахар?
- Мы, вероятно, получили бы похожие результаты, потому что количество растворяющейся соли или сахара как-то связано с тем, как каждое вещество взаимодействует с водой.

- То, насколько хорошо вещество растворяется в воде, называется его растворимостью. Можно ли ожидать, что разные вещества будут иметь одинаковую или разную растворимость?
- Каждое вещество состоит из молекул своего типа, которые по-разному взаимодействуют с водой. Разные вещества должны иметь разную растворимость.
Скажите учащимся, что они будут сравнивать растворимость четырех различных бытовых кристаллов — соли (хлорид натрия), английской соли (сульфат магния), глутамата натрия (глутамат натрия) и сахара (сахароза).Объясните, что они также будут тестировать неизвестный кристалл, химически такой же, как один из других кристаллов. Поскольку он химически одинаков, он должен иметь такую же растворимость, как и один из кристаллов, которые они будут тестировать. К концу занятия учащиеся должны уметь идентифицировать неизвестное.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся определить неизвестное по внешнему виду.
Сообщите учащимся, что перед выполнением теста на растворимость они внимательно рассмотрят кристаллы, чтобы увидеть, смогут ли они получить некоторые подсказки о личности неизвестного только по внешнему виду. Предложите учащимся выполнить приведенную ниже процедуру и записать свои наблюдения о кристаллах в листе с заданиями.Сообщите учащимся, что они могут смотреть на кристаллы и прикасаться к ним, но не должны пробовать их на вкус.
Вопрос для расследования
Сможете ли вы опознать неизвестный кристалл по внешнему виду?
Материалы для каждой группы
- Черная плотная бумага
- Малярная лента
- Ручка или перманентный маркер
- 5 маленьких пластиковых стаканчиков
- Соль
- Соль Эпсома
- глутамат натрия
- Сахар
- Неизвестно (Грубая кошерная соль)
- Лупа
Подготовка учителя
- Пометьте 5 маленьких пластиковых стаканчиков солью, английской солью, глутаматом натрия, сахаром и неизвестно.

- Добавьте не менее двух чайных ложек каждого кристалла в чашку с маркировкой.
Процедура
- Используйте клейкую ленту и ручку, чтобы пометить четыре угла листа черной плотной бумаги: сахар, соль, английская соль и глутамат натрия. Обозначьте центр Неизвестно.
- Поместите небольшие образцы английской соли, поваренной соли, сахара, глутамата натрия и неизвестного вещества на отмеченные участки плотной бумаги.
Используйте лупу, чтобы внимательно рассмотреть каждый тип кристалла.
Ожидаемые результаты
Все кристаллы белые, но некоторые из них более прозрачны или непрозрачны, чем другие. Каждый тип кристалла также отличается размером и формой.
Обсудите наблюдения учащихся и попросите группы спланировать, как они могут провести тест на растворимость, чтобы идентифицировать неизвестное.
Спросите студентов:
- Что вы заметили в каждом кристалле? Включите любые сходства или различия, которые вы заметили среди них.

- Учащиеся должны описать физические свойства, такие как размер, форма, цвет и текстура. Они также должны описать, являются ли кристаллы блестящими, тусклыми, прозрачными или непрозрачными.
- Можете ли вы определить неизвестное еще?
- На данный момент у учащихся не должно быть достаточно доказательств, чтобы правильно идентифицировать неизвестное. Пока не говорите ученикам, что неизвестное — это грубая кошерная соль. Они обнаружат это к концу этого урока.
Объясните, что одного взгляда на кристаллы недостаточно, чтобы определить неизвестное.Но тест на растворимость даст полезную информацию, если он хорошо контролирует переменные. Попросите учащихся подумать о том, как они могут провести тест на растворимость соли, соли Эпсома, глутамата натрия, сахара и неизвестного вещества. Пусть учащиеся поработают в группах, чтобы обсудить свои идеи и записать простой план в свой рабочий лист.
Попросите группы студентов поделиться своими идеями относительно теста на растворимость и рассмотреть, как каждый план контролирует переменные.

По мере того, как каждая группа представляет свои планы, попросите класс определить, как каждый тест на растворимость контролирует переменные.Все группы, скорее всего, предложат использовать одинаковый объем воды при одинаковой температуре в одинаковых контейнерах и одинаковое количество каждого кристалла. Но могут быть некоторые разногласия в том, как измерить одинаковое количество каждого кристалла. Некоторые учащиеся могут предложить использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали одинаковую массу соли и сахара — по 5 г каждого.
Спросите студентов:
- Лучше использовать одинаковый объем (например, чайную ложку или 5 мл) или одинаковую массу (например, 5 г) каждого кристалла? Почему?
- Скажите учащимся, что вы проведете демонстрацию, которая поможет им понять, следует ли им использовать меру объема или массы, чтобы они могли растворить одинаковое количество каждого кристалла в воде.

Проведите демонстрацию, чтобы показать, что масса лучше, чем объем при измерении равных количеств для теста на растворимость.
Вопрос для расследования
Лучше ли измерять один и тот же объем или одинаковую массу каждого кристалла при проведении теста на растворимость для идентификации неизвестного?
Материалы для демонстрации
- 2 прозрачных пластиковых стаканчика
- Зерновые шарики (хорошо подойдет Kix)
- Пластиковый пакет с застежкой-молнией (размером в четверть)
- Весы
Подготовка учителя
Полностью наполните два прозрачных пластиковых стаканчика овсяными хлопьями.Обе чашки должны быть одинаковыми и содержать одинаковое количество овсяных хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.
Процедура
- Поднимите чашки с хлопьями вверх, чтобы учащиеся могли видеть, что в обоих содержится примерно одинаковое количество хлопьев.

- Поместите чашки в центр каждого конца простых весов, чтобы доказать своим ученикам, что обе содержат одинаковое количество хлопьев.
- Поднимите чашки с хлопьями вверх, чтобы учащиеся могли видеть, что в обоих содержится примерно одинаковое количество хлопьев.
Попросите учащихся сделать прогноз:
- Я собираюсь растолочь шарики хлопьев в одну чашку. Как вы думаете, высота хлопьев в этой чашке будет выше, ниже или такой же, как в другой чашке?
- Студенты, вероятно, скажут, что измельченные хлопья не займут столько места в чашке.
- Пересыпьте хлопья из одной из чашек в пригодный для хранения пластиковый пакет с застежкой-молнией.Выпустите как можно больше воздуха и закройте пакет.
- Положите мешок на землю и тщательно разомните хлопья ногой. Как только хлопья превратятся в порошок, откройте пакет и высыпьте измельченные хлопья обратно в чашку.
Спросите студентов:
- В какой чашке больше хлопьев?
- Учащиеся поймут, что обе чашки содержат одинаковое количество хлопьев, но у некоторых может возникнуть желание сказать, что в чашке с шариками хлопьев больше хлопьев.

- Были ли добавлены или удалены какие-либо хлопья из одной из чашек?
- Укажите, что, хотя измельченные хлопья занимают меньше места, в них остается то же количество вещества (хлопьев), которое было в чашке до того, как они были измельчены.
- Как можно доказать, что эти две чашки содержат одинаковое количество вещества?
- Учащиеся должны предложить поставить чашки на весы, как вы это делали раньше.
Поставьте чашки на противоположные концы весов, чтобы доказать, что масса хлопьев в каждой чашке одинакова.
Ожидаемые результаты
Несмотря на то, что объем зерновых шариков больше, чем объем дробленых зерновых шариков, чашки будут балансировать на весах.
Соотнесите наблюдения учащихся на демонстрации с пятью кристаллами, которые они растворяют в воде.
Предложите учащимся представить, что большие шарики хлопьев представляют собой большие кристаллы, а дробленые хлопья представляют собой маленькие кристаллы.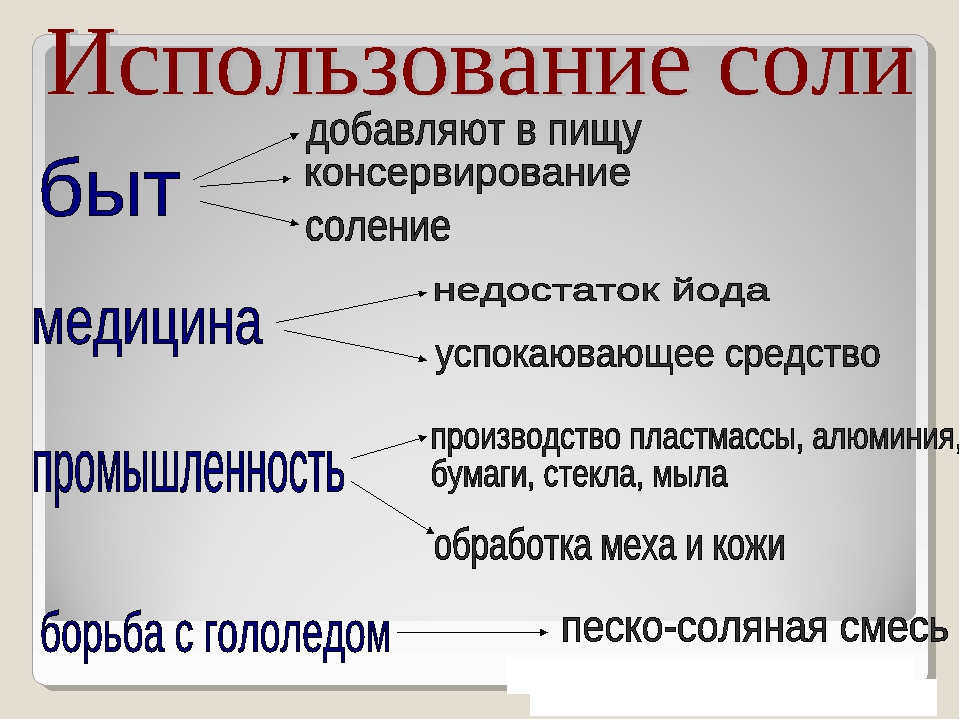 Объясните, что размер и форма кристаллов могут быть разными, но вес показывает, что их масса одинакова. Напомните учащимся, что масса – это мера количества вещества. Поскольку большие и маленькие кристаллы (хлопья) имеют одинаковую массу, обе чашки содержат одинаковое количество вещества. Сделайте вывод, что для измерения равных количеств лучше измерять массу веществ, чем объем.
Объясните, что размер и форма кристаллов могут быть разными, но вес показывает, что их масса одинакова. Напомните учащимся, что масса – это мера количества вещества. Поскольку большие и маленькие кристаллы (хлопья) имеют одинаковую массу, обе чашки содержат одинаковое количество вещества. Сделайте вывод, что для измерения равных количеств лучше измерять массу веществ, чем объем.
Спросите студентов:
- В тесте на растворимость вам нужно будет измерить равные количества пяти кристаллов.Как вы будете измерять равные суммы?
- После этой демонстрации учащиеся должны понять, что измерение массы для теста на растворимость лучше измерения по объему.
Основываясь на том, что наблюдали учащиеся, когда внимательно рассматривали разные кристаллы, а также на доказательствах из демонстрации, они должны понять, что разные кристаллы имеют немного разные размеры или форму. Это приведет к тому, что они будут по-разному упаковываться в ложку, так что в ложке будет больше гранул одного, чем другого.
Примечание. Следующее объяснение может показаться учащимся слишком сложным, но оно приведено здесь, чтобы вы могли подумать и обсудить его со учащимися, если считаете его уместным. Даже если гранулы соли и сахара будут точно такого же размера и формы и точно так же упакованы в ложку, все равно не будет хорошей идеей использовать чайную ложку для измерения равных количеств для теста на растворимость. И вот почему: соль примерно на 25% плотнее сахара. Поэтому чайная ложка соли весит больше чайной ложки сахара почти на 25%.Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара.
Предложите учащимся взвесить по пять граммов каждого кристалла для теста на растворимость.
Материалы для каждой группы
- Весы в граммах
- 5 маленьких пластиковых стаканчиков
- 5 прозрачных пластиковых стаканчиков
- Малярная лента и ручка или перманентный маркер
- Соль
- Соль Эпсома
- глутамат натрия
- Сахар
- Неизвестно (грубая кошерная соль)
- Вода
Процедура
- Используйте клейкую ленту и ручку, чтобы пометить 5 маленьких пластиковых стаканчиков с солью, английской солью, глутаматом натрия, сахаром и неизвестно.

- Таким же образом пометьте 5 больших прозрачных пластиковых стаканчиков.
- Взвесьте 5 г каждого кристалла и поместите каждый в маленькую промаркированную чашку.
Если у вас недостаточно времени, вы можете остановиться здесь и попросить учеников сохранить кристаллы и провести тест в другой день. Если у вас есть время для проведения теста, процедура следующая.
Предложите учащимся растворить четыре известных кристалла и неизвестный в воде комнатной температуры.
Количество воды, используемой в процедуре, является специфическим, и его следует использовать, поскольку оно дает четкие результаты. Вращение кристаллов в воде — хороший способ их смешивания, чтобы помочь им раствориться. Проведите класс так, чтобы все группы одновременно высыпали свои образцы кристаллов в воду. Также скажите учащимся, когда нужно взболтать воду и кристаллы, а когда остановиться и понаблюдать. Будет три 20-секундных интервала.
Вопрос для расследования
Можете ли вы идентифицировать неизвестное вещество с помощью теста на растворимость?
Материалы для каждой группы
- Градуированный цилиндр
- По 5 г соли, английской соли, глутамата натрия, сахара и неизвестного (крупнозернистая кошерная соль)
- 5 прозрачных пластиковых стаканчиков
- Вода
Процедура
- С помощью мерного цилиндра добавьте 5 мл воды комнатной температуры в каждый пустой прозрачный пластиковый стаканчик.

- Сопоставьте каждую пару помеченных чашек так, чтобы каждая чашка из кристалла находилась рядом с соответствующей чашкой с водой.
Когда ваш учитель скажет вам, работайте с вашими партнерами по лаборатории, чтобы одновременно высыпать взвешенное количество каждого кристалла в соответствующую чашку с водой.
- С помощью ваших партнеров по лаборатории взболтайте каждую чашку в одно и то же время одинаковым образом в течение примерно 20 секунд и наблюдайте. Снова покрутите еще 20 секунд и наблюдайте.Вращайтесь снова в течение последних 20 секунд и сделайте свои последние наблюдения.
Медленно и осторожно перелейте раствор из каждой чашки обратно в ее маленькую пустую чашку. Старайтесь не допустить, чтобы нерастворившиеся кристаллы попали в маленькую чашку. Сравните количество кристаллов, оставшихся в каждом прозрачном пластиковом стаканчике.
Ожидаемые результаты
Результаты могут отличаться. Однако больше всего должен раствориться сахар, за ним следует соль Эпсома. MSG должен растворяться немного больше, чем соль и неизвестность.Соль и неизвестность должны казаться растворяющимися в одинаковой степени.
MSG должен растворяться немного больше, чем соль и неизвестность.Соль и неизвестность должны казаться растворяющимися в одинаковой степени.
Обсудите наблюдения учащихся и возможную личность неизвестного.
Спросите студентов:
- Есть ли какие-нибудь кристаллы, которые вы могли бы исключить как неизвестную?
- Основываясь на своих наблюдениях, учащиеся чаще всего исключают сахар и английскую соль как неизвестные.
- В какой чашке или чашках осталось примерно такое же количество нерастворенных кристаллов, как и в неизвестном?
- Неизвестный, соль и глутамат натрия имеют одинаковое количество кристаллов, которые не растворились.
- Как вы думаете, личность неизвестного?
- Учащиеся могут решить, что неизвестным является соль, но в некоторых случаях они могут подумать, что это также может быть глутамат натрия.
- Какие доказательства у вас есть в поддержку вашего вывода?
- Учащиеся должны назвать количество кристаллов, оставшихся в каждой чашке, в качестве доказательства того, что неизвестным является либо соль, либо глутамат натрия.

- Если бы у кого-то в классе были совсем другие выводы и наблюдения, что, по вашему мнению, могло привести к этим различиям?
- Учащиеся должны указать возможные ошибки при взвешивании кристаллов, измерении количества использованной воды, неправильном перемешивании или случайном высыпании кристаллов не в те чашки.
Сообщите учащимся, что их тест показал, что разные вещества имеют разную растворимость. По сути, растворимость – это характерное свойство вещества. Объясните учащимся, что этот тип теста на растворимость может помочь устранить некоторые кристаллы, но может быть недостаточно точным, чтобы идентифицировать неизвестное. Так как у них могут быть сомнения в подлинности неизвестного вещества, учащиеся проведут тест на перекристаллизацию растворов кристаллов, приготовленных во время теста на растворимость.
Предложите учащимся провести еще один тест, чтобы подтвердить личность неизвестного.
Объясните учащимся, что они смогут получить больше информации о личности неизвестного, если позволят раствору растворенных кристаллов перекристаллизоваться. Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах.
Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах.
Примечания по материалам: Испытание на перекристаллизацию следует проводить сразу же после испытания на растворимость с растворами, приготовленными во время испытания на растворимость.Учащиеся будут повторно использовать большие прозрачные пластиковые стаканчики и растворы из части растворения в соответствии с процедурой.
Вопрос для расследования
Помогут ли кристаллы, образующиеся при испарении растворов, идентифицировать неизвестное?
Материалы для каждой группы
- Пять растворов, приготовленных в ходе упражнения, каждый в маленьком пластиковом стаканчике
- 5 прозрачных пластиковых стаканчиков из задания
- Лупа
- Вода
- Бумажные полотенца
Процедура
- Промойте каждый большой прозрачный пластиковый стаканчик водой, чтобы удалить оставшиеся кристаллы.
 Обсушите каждую бумажным полотенцем.
Обсушите каждую бумажным полотенцем. - Осторожно перелейте раствор из каждой маленькой чашки в соответствующую большую прозрачную пластиковую чашку.
- Оставьте растворы на ночь.
- На следующий день с помощью лупы внимательно осмотрите кристаллы сверху и снизу чашки.
Ожидаемые результаты
Соль и неизвестность очень похожи. Соль Эпсома, глутамат натрия и сахар отличаются друг от друга и отличаются от соли и неизвестности.Сахар, возможно, еще не перекристаллизовался, но через некоторое время он сформирует кристаллы.
Спросите студентов:
- Опишите кристаллы в каждой чашке. Как вы думаете, что является личностью неизвестного?
- Учащиеся должны обсудить форму и размер различных кристаллов и заметить, что и соль, и неизвестное выглядят очень похоже.
Скажите учащимся, что неизвестное — это крупная кошерная соль. По химическому составу она такая же, как обычная соль, но процесс изготовления обычной поваренной соли и кошерной соли отличается, и поэтому они выглядят по-разному.
Показать молекулярные модели соли, соли Эпсома, сахара и глутамата натрия.
Спроецируйте изображение Все четыре кристалла.
Объясните: поскольку эти вещества состоят из разных атомов и ионов, связанных друг с другом по-разному, они по-разному взаимодействуют с водой, придавая каждому из них свою характерную растворимость.
- Соль
- Напомните учащимся, что хлорид натрия является ионным соединением.Существует положительный ион натрия (Na + ) и отрицательный ион хлорида (Cl — ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя соль.
- Соль Эпсома
- Скажите учащимся, что английская соль является ионным соединением. Существует положительный ион магния (Mg 2+ ) и отрицательный сульфатный ион (SO 4 2− ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя соль Эпсома.

- глутамат натрия
- MSG состоит из положительного иона натрия (Na + ) и отрицательного иона глутамата, который имеет молекулярную формулу (C 5 H 8 NO 4 — ).Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя глутамат натрия.
- Сахар
- Сахароза не является ионным соединением. Сахароза имеет много связей O–H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
Помогите учащимся рассмотреть сходства и различия в способах растворения соли и сахара в воде.
Скажите учащимся, что в зависимости от растворяемого вещества ионы отделяются друг от друга или молекулы отделяются друг от друга. Соль и сахар являются распространенными примерами растворения обоих типов твердых веществ.
Проецируйте изображение Вода растворяет соль.
Спросите студентов:
- Когда соль растворяется, почему молекулы воды притягиваются к ионам натрия и хлорида?
- Хлорид натрия представляет собой ионное соединение с положительным ионом натрия (Na + ) и отрицательным ионом хлорида (Cl — ).Полярная вода взаимодействует с этими противоположно заряженными ионами, что приводит к ее растворению.
Проецируйте изображение Вода растворяет сахар.
Спросите студентов:
- Когда сахар растворяется, почему молекулы воды притягиваются к молекулам сахарозы?
- Сахароза имеет много связей O–H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
- Каковы сходства и различия между солью, растворяющейся в воде, и сахаром, растворяющимся в воде?
- Ионы натрия и хлорида отделяются друг от друга и по мере растворения окружаются молекулами воды.



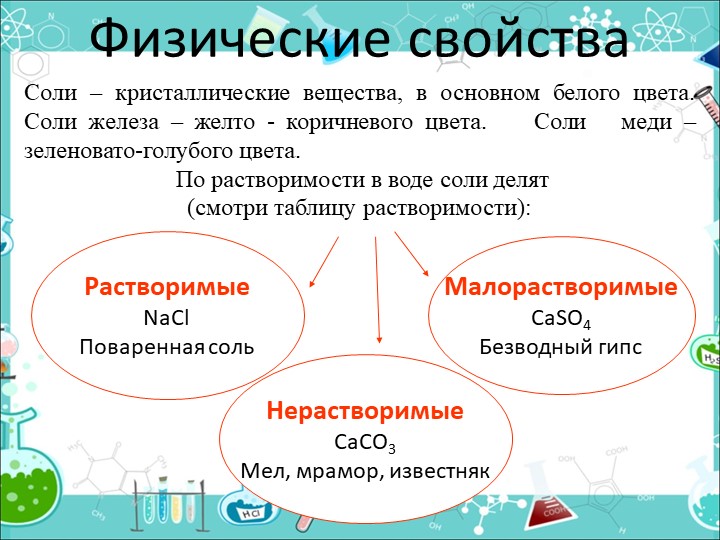

 Эти солевые растворы также используются в различных медицинских целях.
Эти солевые растворы также используются в различных медицинских целях. Мюллер
Мюллер

 Вращайте каждую чашку одновременно и одинаково в течение примерно 20 секунд.
Вращайте каждую чашку одновременно и одинаково в течение примерно 20 секунд.








 Обсушите каждую бумажным полотенцем.
Обсушите каждую бумажным полотенцем.
