Уравнения химических реакций | himiyaklas.ru
Химическая реакция – это превращение одних веществ в другие. Если состав вещества мы выражаем с помощью химических формул, то как записывать химическую реакцию?
Для этого придумали уравнения химических реакций.
Исходные вещества, которые вступили в реакцию называются реагентами.
Вещества, образовавшиеся в результате реакции называются продуктами реакции.
Как записывают химическую реакцию? Слева записывают реагенты, справа – продукты, а между ними ставят реакционную стрелку.
реагенты → продукты
Реагенты и продукты записывают в виде химических формул.
Давайте запишем реакцию образования оксида алюминия Al2O3. Какие вещества будут исходными? Конечно же простые вещества: кислород (O2) и алюминий (Al):
Al + O2 → Al2O3
Но это еще не все. Есть такой физический закон: закон сохранения массы. В приложении к химии он звучит: «масса исходных веществ, равна массе продуктов реакции». А в нашей записи уравнения реакции слева один атом алюминия, а справа – два (Al2O3). Значит надо и слева взять два атома алюминия. Когда нам нужно указать, сколько нужно взять молекул вещества, нужно обозначить это числом перед химической формулой молекулы. Это число называется коэффициентом:
В приложении к химии он звучит: «масса исходных веществ, равна массе продуктов реакции». А в нашей записи уравнения реакции слева один атом алюминия, а справа – два (Al2O3). Значит надо и слева взять два атома алюминия. Когда нам нужно указать, сколько нужно взять молекул вещества, нужно обозначить это числом перед химической формулой молекулы. Это число называется коэффициентом:
2Al + O2 → Al2O3
Теперь непорядок с атомами кислорода. Слева их два (O2), справа три (Al2O3). Непорядок. Мы конечно можем поставить дробный коэффициент:
2Al + 1,5O2 → Al2O3
Тогда и слева будет три атома кислорода (1,5O2), и справа три (Al2O3). Но, запомните раз и навсегда: коэффициенты могут быть только целыми числами. Чтобы в нашем уравнении коэффициенты стали целыми, их нужно просто удвоить:
Запомните, на экзамене все химические уравнения должны быть уравнены. Не уравненная реакция – не считается реакцией, за нее ставят ноль баллов.
Не уравненная реакция – не считается реакцией, за нее ставят ноль баллов.
На данном этапе обучения вы уже можете записывать реакции образования бинарных соединений из простых веществ.
Помимо обычной реакционной стрелки, формул реагентов и продуктов, коэффициентов есть еще несколько обозначений, используемых в записи химических уравнений: (приведенные ниже в качестве примера реакции, пока запоминать не нужно: всему свое время):
- Над реакционной стрелкой указываются условия в которых протекает реакция.
Не все реакции идут при нормальных условиях: часто нужно подогреть, повысить давление и пр. Это указывается над реакционной стрелкой в виде следующих обозначений:
- t° – температура
- кат. – реакция идет в присутствии катализатора. Катализатор – это вещество, которое ускоряет химическую реакцию, но не расходуется
- После химической формулы продукта:
- ↑ – выделение газа
- ↓ – выпадение осадка
- Две реакционные стрелки – в сторону продуктов и обратно.

Так обозначают обратимые реакции. Это реакции, которые протекают в данных условиях как в прямом, так и в обратном направлении. Продукт образуется, и одновременно разлагается на исходные вещества:
Химические превращения чрезвычайно разнообразны, поэтому не удивительно, что существует несколько классификаций реакций. С одной из них мы познакомимся сейчас. Опять же, реакции, написанные ниже, приведены в качестве примера, запоминать их пока не нужно. Различают:
- Реакции соединения.
В ходе этих реакций из нескольких веществ образуется одно:
- Реакции разложения.
Эти реакции – противоположность реакциям присоединения. Из одного вещества образуется несколько – происходит разложение:
- Реакции замещения.
Простое вещество реагирует со сложными и образуется другое сложное вещество и другое простое вещество:
- Реакции обмена.
Два сложных вещества реагируют друг с другом с образованием новых двух веществ. Молекулы обмениваются своими фрагментами.
Молекулы обмениваются своими фрагментами.
Узнаем как составить уравнение химической реакции: примеры
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений — важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.
Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород — это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.

Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+H2.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+H2.
Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Урок по теме: «Химические уравнения» 8 класс.
Урок по теме: «Химические уравнения».
Цели урока:
— углубить и расширить знания учащихся о химических реакциях;
— совершенствовать умение составлять уравнения химических реакций.
Задачи урока:
Образовательные:
— повторение изученного по теме материала;
— умение самостоятельно применять полученные знания.
Развивающие:
— развитие познавательного интереса к предмету химии;
— развитие навыков самостоятельной деятельности, самопроверки, учащихся.
Воспитательные:
— формирование диалектико-материалистических взглядов в результате осуществления взаимопревращений веществ.
Организационный момент.
Повторение и обобщение изученного материала.
Прежде, чем сформулировать тему сегодняшнего урока, я попрошу вас ребята взять листочек, ручку и ответить на несколько моих вопросов.
Если данные вещества в другие не превращаются,
А лишь форма их изменяется,
То явления данные как называются? (Физические явления.)
Приведите примеры физических явлений.
Явления эти знаете вы,
В природе и в быту встречаются они,
А от первых явлений они тем отличаются,
Что из данных веществ, другие легко получаются. (Химические явления.)
Приведите примеры химических явлений.
Великие учёные закон этот открыли
И этим для людей чудо сотворили.
Теперь мы уравнения можем составлять.
Как же сей закон звать и величать? (Закон сохранения массы веществ.)
Кем и когда был открыт закон сохранения массы веществ?
Сформулируйте закон сохранения массы веществ.
Состоит оно из двух частей,
Что знаком равенства соединяются.
До знака — стоят реагенты,
А после — те, вещества, которые получаются. (Химическое уравнение.)
Что такое химическое уравнение?
Как вы думаете, какова тема нашего сегодняшнего урока? (Химические уравнения. Тему формулируют ученики.) Эту тему мы начали изучать с вами на прошлом уроке.
Почему мы уделяем изучению данной темы достаточно большое внимание? (Учащиеся формулируют своё мнение.)
Химия — это наука о веществах, их свойствах и превращениях. Превращения веществ — химические явления (химические реакции). Химическое уравнение — это условная запись химической реакции. Без неё нельзя объяснить ни один химический процесс, произвести расчёты ни учёному, ни ученику.
Теперь давайте определим с вами, что по данной теме мы уже знаем, что умеем делать и чему должны научиться сегодня.
1. Знаем определение химических уравнений.
Знаем определение химических уравнений.2. Знаем формулировку закона сохранения массы веществ.
3. Знаем алгоритм составления химических реакций между простыми веществами.
4. Умеем составлять химические уравнения между простыми веществами.
5. Умеем расставлять коэффициенты в данных схемах.
На основе полученных знаний совершенствовать умение составлять уравнения химических реакций. (Самостоятельно, правильно и желательно быстро составлять химические уравнения. Так сформулировали тему урока ученики.)
3.Самостоятельная работа на уроке каждого ученика. Задания расположены в порядке увеличения их сложности.
Каждый ученик вначале урока получает две карточки с заданиями и первого и второго варианта. Задания одной карточки он выполняет в классе, а второй дома.
Задание № 1.
Составьте уравнения по следующим схемам:
Fe(OH)3 = Fe2O3 + H2OK2O + H2O = KOH
Al(OH)3 + HCl = AlCl3 + H2O
CaO + P2O5 = Ca3(PO4)2
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
CaO + HCl = CaCl2 + H2O
Задание № 2.
Составьте уравнения реакций, протекающих между данными простыми веществами:
Na + P =K + H2 =
P + O2 = P+3O
Ca + O2 =
Mg + N2 =
Na + H2 =
K + N2 =
Ca + P =
N2 + O2 = N+2O
K + Cl2 =
Задание № 3.
Запишите уравнения химических реакций по следующим схемам:
серная кислота + гидроксид калия = сульфат калия + водаоксид лития + вода = гидроксид лития
оксид магния + соляная кислота = хлорид магния + вода
оксид азота (V) + вода = азотная кислота
Выполнение каждого задания проверяем (слайды презентации – 1 и 3 задания, на доске – 2 задание). Ученики сами проверяют свои задания, задают вопросы, выставляют себе оценки. В конце урока они сдают листочки на проверку учителю.
Теперь, ребята, я попрошу вас вспомнить, какую цель мы поставили перед собой вначале урока и ответить каждого на вопрос: «Достигли ли лично вы поставленных целей или нет? В чём это проявляется?» (Каждый ученик отвечает на данные вопросы на отдельном листочке, который лежит у него на столе с начала урока, и сдаёт листок учителю.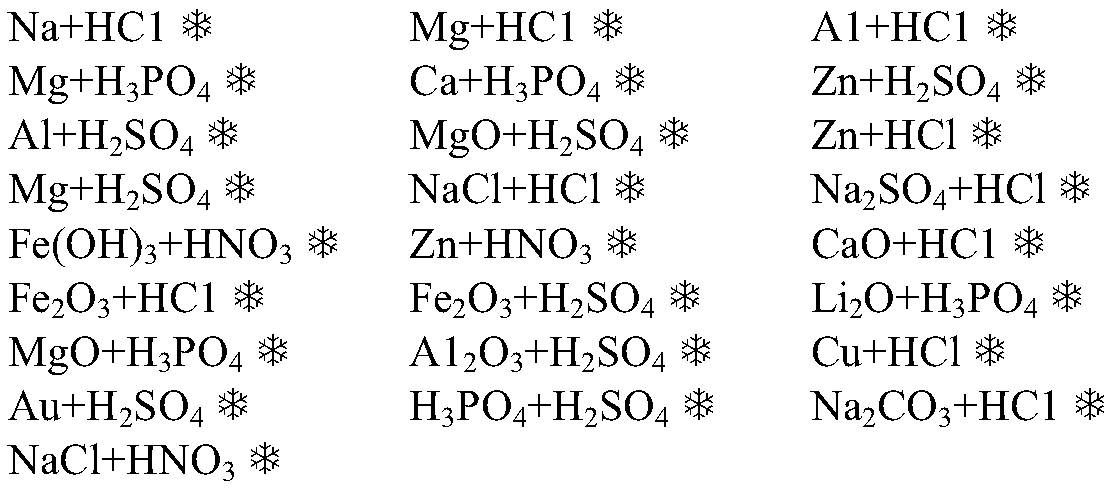
4. Домашнее задание.
Ученики дома выполняют задание другого варианта, которое получили вначале урока:
на «3» необходимо выполнить первое задание;
на «4» — второе;
на «5» — второе и третье.
Конспект к уроку химии «Химические уравнения реакций. Закон сохранения массы вещества» 8 класс | Уроки по Химии
Конспект к уроку химии «Химические уравнения реакций. Закон сохранения массы вещества» 8 класс
12.02.2015 7128 1305 Хайрулина Лилия ЕвгеньевнаЦель урока: сформировать понятие закона сохранения масс, научить составлять уравнения реакций
Задачи урока:
• Образовательная: опытным путём доказать и сформулировать закон сохранения массы веществ.
• Развивающая: дать понятие о химическом уравнении как об условной записи химической реакции с помощью химических формул; начать формирование навыков составления химических уравнений
Ход урока
I. Орг.момент
Орг.момент
II. Опрос фронтальный:
— Что такое физические явления?
— Что такое химические явления?
— Примеры физ и хим явлений
— Условия протекания химических реакций
III. Изучение нового материала
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
 Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
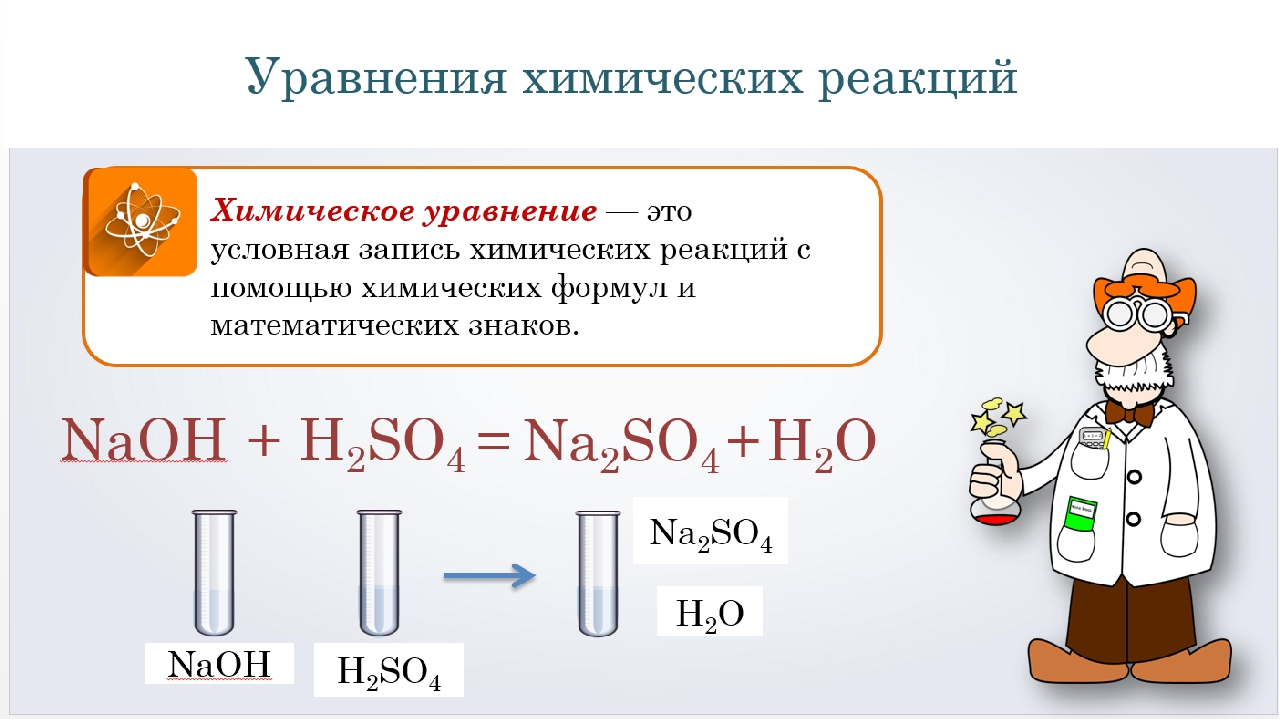
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Посмотрим видео — эксперимент: Нагревание смеси железа и серы.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1.
 В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – h3; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – h3; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 →
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
• Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
• В данном случае это атомы кислорода.
• Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
• Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
• Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
• Получаем окончательный вид уравнения химической реакции.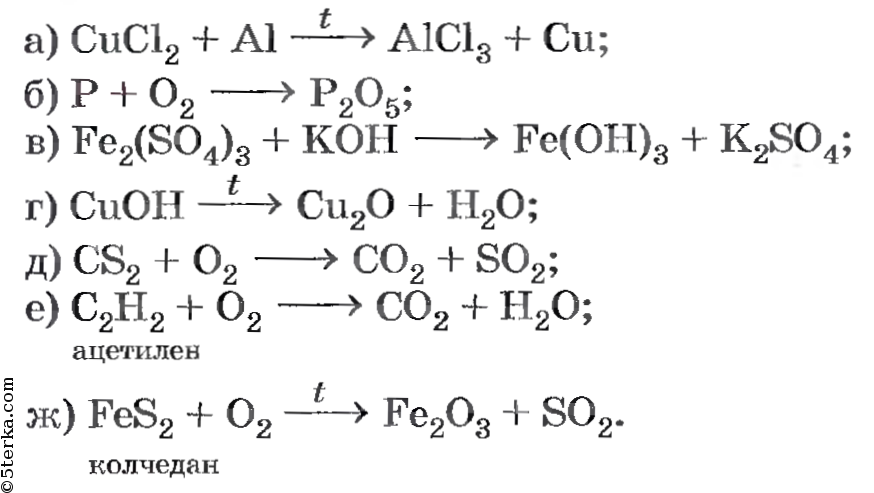
4P + 5O2 = 2P2O5
IV. Закрепление
V. Д/з
Полный текст материала смотрите в скачиваемом файле.
На странице приведен только фрагмент материала.
Балансирующие химические уравнения определение для 10 класса с простыми примерами | КАКАЛИ ГОШ, преподаватель, блогер. Магистр химии.
Балансировка химических уравнений для любых химических изменений очень важна. Из-за этого любое химическое изменение является просто химической реакцией .
Химические изменения , такие как горение магниевой ленты на воздухе, ржавление железа и т.д. являются химической реакцией .
Вещества, которые реагируют на эти химические изменения, называются реагентами или реактивами.Вещества, которые образуются в результате химических превращений , называются продуктами.
Теперь по закону действующих масс массы реагентов и продуктов должны быть равны. Следовательно, уравновешивающих химических уравнений необходимы для химической реакции.
Химическое уравнение — это метод обобщения химической реакции путем поддержания баланса между реагентами и продуктами с помощью химических символов и формулы.
Химическое уравнение выражается записью реагентов слева и продуктов справа.
Стрелка проведена от реагента к продукту. Это означает, что продукт производится из реагента.
Если имеется более одного реагента или продукта, их следует добавить со знаком плюс. Уравнение химических уравнений должно быть сбалансировано.
То есть количество атомов реагента и реагента должно совпадать.Потому что по закону действующих масс массы реагентов и продуктов должны быть равны.
Масса не может быть создана или уничтожена. Таким образом, химическое уравнение умножается с обеих сторон на число, необходимое для сохранения равенства атомного числа атомов двух сторон вещества.
Когда количество атомов с обеих сторон одинаково, химическое уравнение дополняется путем проставления равных меток вместо стрелок.
Во-первых, общее количество различных атомов в левой и правой частях химического уравнения должно быть записано отдельно.Затем нужно сравнить количество первых атомов с обеих сторон.
Если количество первых атомов больше, количество атомов должно быть уравнено путем умножения на соответствующее число на противоположной стороне.
Номер второго атома будет неравным, если номер первого атома равен.
Точно так же количество атомов, подобных второму и третьему, должно быть уравнено путем умножения на соответствующее число.
Таким образом, перед реагентами слева и продуктами справа нужно поставить соответствующее число перед химическим уравнением , чтобы увидеть, одинаково ли число различных атомов с обеих сторон или нет.
Когда число атомов с обеих сторон одинаково, химическое уравнение дополняется путем проставления равных меток вместо стрелок.
Например, при нагревании хлората калия образуется хлорид калия и кислород.
2 KClO3 ⟶ 2 KCl + 3 O2 ↑
В этой реакции три атома кислорода слева и два атома кислорода справа.
Чтобы количество атомов кислорода с обеих сторон было одинаковым, поставьте два перед хлоратом калия слева и 3 перед кислородом справа, чтобы число атомов кислорода с обеих сторон было одинаковым.
Теперь количество атомов K и Cl увеличивается до 2 при размещении 2 перед хлоратом калия.
Итак, если мы поставим 2 перед KCl справа, химическое уравнение будет сбалансировано. Следовательно, уравновешивающее химическое уравнение выражается, как показано ниже.
Другой пример балансировки химического уравнения показан ниже.
Некоторые химические уравнения в качестве примеров приведены ниже для балансировки .
- Балансировка химических уравнений определение для класса 10 с простыми примерами — Академические дети
От академических детей
de:Reaktionsgleichung es:Ecuacin qumica fr:quation chimique
В химии химическое уравнение является символическим представлением химической реакции.
 Например, горение метана в кислороде
Например, горение метана в кислороде- CH 4 + 2 O 2 → CO 2 + 2 H 2 O,
и обратимая реакция процесса Габера
- N 2(г) + 3H 2(г) ↔ 2NH 3(г) + ΔH.
Как вы читаете химические уравнения?
Первое число в наборе, таком как 3H 2 O, говорит о том, сколько имеется молекул вещества.Число в подтексте, следующее за элементом, говорит о том, сколько существует атомов элемента. Буквы обозначают элементы периодической таблицы.
пр. 3H 2 O означает 3 молекулы, каждая из которых содержит 2 части водорода и 1 часть кислорода.
Как сбалансировать химические уравнения?
Чтобы сбалансировать химические уравнения, думайте о обеих сторонах как о балансе, который может пошатнуться. Когда одна сторона тяжелее, она падает, а другая поднимается. То же самое и с химическим уравнением: когда уравнение уравновешено, ни идентичность, ни масса как реагентов, так и продуктов не остаются неизменными.

Как правило, лучше сначала сбалансировать самую сложную молекулу. Большинство химических уравнений можно сбалансировать путем проверки, то есть методом проб и ошибок.
Давайте рассмотрим несколько примеров и пройдемся по ним:
Пример №1. Na + O 2 → Na 2 OЧтобы это уравнение было сбалансированным, в левой части должно быть одинаковое количество Na, как и в правой части. В нынешнем виде 1 Na слева, а 2 Na справа.Мы решаем эту проблему, ставя 2 перед Na слева. Вот так:
2Na + O 2 → Na 2 O
Итак, теперь мы видим 2 Na слева и 2 Na справа. Но как насчет О? Теперь мы должны проверить, сбалансированы ли буквы О в обеих частях уравнения. С левой стороны есть 2 O, а с правой стороны только одна. Это все еще несбалансированное уравнение. Чтобы исправить это, мы должны поставить 2 перед Na 2 O с правой стороны.Теперь наше уравнение гласит:
2Na + O 2 → 2Na 2 O
Обратите внимание, что 2 в правой части «распределены» между Na 2 и O.
 В настоящее время в левой части уравнения есть 2 Na и 2O. В правой части всего 4 Na и 2 O. Опять же, это проблема, должно быть равное количество каждого химического вещества с обеих сторон. Чтобы исправить это, добавим еще 2 Na с левой стороны. Уравнение теперь будет выглядеть так:
В настоящее время в левой части уравнения есть 2 Na и 2O. В правой части всего 4 Na и 2 O. Опять же, это проблема, должно быть равное количество каждого химического вещества с обеих сторон. Чтобы исправить это, добавим еще 2 Na с левой стороны. Уравнение теперь будет выглядеть так:4Na + O 2 → 2Na 2 O
Теперь, как вы можете видеть, у нас есть сбалансированное уравнение, потому что в левой и правой частях уравнения равное количество элементов.
Пример №2. Р 4 + О 2 → Р 4 О 10Это уравнение несбалансировано, потому что в обеих частях уравнения неравное количество нулей. Левая сторона имеет 4 P, а правая сторона имеет 4 P. Итак, баланс P. Давайте посмотрим на О. В левой части 2 О, а в правой 10 О. Чтобы исправить это несбалансированное уравнение, мы должны поставить 5 перед O 2 с левой стороны, чтобы получилось 10 O с обеих сторон.Давайте посмотрим, как это выглядит:
P 4 + 5O 2 → P 4 O 10
Уравнение теперь уравновешено, потому что в левой и правой частях уравнения одинаковое количество веществ.

Пример №3. C 2 H 5 OH + O 2 → CO 2 + H 2 OЭто уравнение более сложное, чем предыдущие примеры; это займет несколько шагов.Самая сложная молекула здесь C 2 H 5 OH, поэтому мы начнем с того, что поставим коэффициент 2 перед CO 2 , чтобы сбалансировать атомы углерода.
C 2 H 5 OH + O 2 → 2CO 2 + H 2 O
Поскольку C 2 H 5 OH содержит 6 атомов водорода, атомы водорода можно уравновесить, поместив 3 перед H 2 O, например:
C 2 H 5 OH + O 2 → 2CO 2 + 3H 2 O
Наконец мы уравновешиваем атомы кислорода.Поскольку справа 7 атомов кислорода и только 3 слева, мы уравновешиваем их, помещая 3 перед O 2 , чтобы получить сбалансированное уравнение:
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
Веб-ссылки
- Онлайн-калькулятор ( http://sciencesoft.
 at/index.jsp?link=solve&lang=en ), который занимается определением коэффициентов химического уравнения:
at/index.jsp?link=solve&lang=en ), который занимается определением коэффициентов химического уравнения:
См. также
Уравновешивание химических уравнений – методы, этапы, примеры
Что такое реагенты?- Реагенты – это вещества или соединения, которые претерпевают химические изменения в результате химической реакции.
- Реагенты присутствуют слева от стрелки, что указывает на протекание химической реакции.
- Количество реагентов в химическом уравнении может различаться в разных реакциях. В некоторых реакциях один реагент может давать один или несколько продуктов, тогда как в других могут присутствовать два или более реагентов.
- В зависимости от химической реакции одно и то же соединение или вещество может действовать как реагент или продукт.
- Некоторые реагенты обладают высокой реакционной способностью и могут подвергаться химическим изменениям без какого-либо катализатора, в то время как для других могут потребоваться катализаторы и особые условия реакции.

- Продукты – это вещества или соединения, которые образуются из реагентов после химической реакции.
- Продукты указаны справа от стрелки, что указывает на развитие химических реакций от реагентов к продуктам.
- Как и реагенты, количество продуктов, образующихся из одних и тех же реагентов, может различаться в разных реакциях в зависимости от наличия катализаторов и условий реакции.
- В обратимых реакциях продукты могут действовать как реагенты, когда химическая реакция обращена.
- Количество и концентрация образующихся продуктов зависят от реакционной способности реагирующих соединений.
- Коэффициент или стехиометрический коэффициент – это общее число молекул химического вещества, принимающих участие в химической реакции.

- Стехиометрические коэффициенты присваиваются различным химическим веществам, чтобы сбалансировать общее число атомов реагентов и продуктов.
- Эти коэффициенты определяют соотношение между количеством реагентов и продуктов химической реакции.
- Стехиометрические коэффициенты также важны для определения общего числа атомов элемента, участвующих в химической реакции.
- Значение стехиометрического коэффициента в различных молекулах, участвующих в реакции, может измениться, чтобы сбалансировать уравнение.
- Нижние индексы — это значения, указывающие на число атомов элементов, присутствующих в молекулах реагентов и продуктов.
- Нижний индекс отражает вклад элементов в различные молекулы и присутствует под аббревиатурой элемента. Нижние индексы пишутся под строкой типа и обычно меньше по размеру.

- При балансировке химического уравнения значения нижних индексов остаются неизменными, но общее число атомов в молекуле должно быть получено путем умножения значения нижнего индекса на стехиометрический коэффициент конкретной молекулы.
- Закон сохранения массы гласит, что в химической реакции реагенты реагируют друг с другом с образованием продуктов, но общая масса реагентов до химического превращения равна общей массе продуктов после химического превращения .
- Другими словами, закон сохранения массы указывает на то, что общая масса химических частиц во время химической реакции сохраняется.
- Закон сохранения массы эквивалентен закону сохранения энергии. Он определяет математическую зависимость между массой реагентов и массой продуктов.
- Закон был выдвинут французским химиком Лавуазье в 1774 г.
 после понимания того, что массу нельзя ни создать, ни разрушить.
после понимания того, что массу нельзя ни создать, ни разрушить. - Закон согласуется с атомной теорией Дальтона, которая утверждает, что атомы не могут ни образовываться, ни разрушаться, и в ходе реакции происходит перегруппировка атомов.В результате общая масса химических частиц в реакции сохраняется.
Сбалансированное химическое уравнение необходимо для получения значимой информации о химическом изменении, происходящем в реакции. Есть два разных метода балансировки химического уравнения.
A. Метод проб и ошибокМетод «нажми и испытай» — это простой метод без определенных правил или указаний.Но следующие шаги можно выполнить, уравновешивая химическое уравнение методом проб и ошибок;
- Все элементарные газы записываются в атомарной форме, а остальные химические соединения записываются в молекулярной форме.
- Сравнивается общее число атомов каждого элемента в реагентах и продуктах.

- Выбирается соединение с наибольшим числом атомов, и балансировка начинается с отдельных атомов.
- Если описанный выше метод не работает, выбирается и уравновешивается молекула с наименьшим числом атомов.
- При балансировке стехиометрический коэффициент следует умножить на нижний индекс, чтобы определить действительное количество атомов в молекуле.
- Предыдущий шаг повторяется до тех пор, пока число различных атомов в реагентах и продуктах не сравняется.
- Элементарные газы уравновешиваются в конце.
Mg 3 N 2 + H 2 O → Mg(OH) 2 + NH 3
я. Чтобы сбалансировать атомы Mg, Mg(OH) 2 умножается на 3.
Mg 3 N 2 + H 2 O → 3Mg(OH) 2 + NH 3
ii.
 Чтобы сбалансировать атом N, NH 3 умножается на 2.
Чтобы сбалансировать атом N, NH 3 умножается на 2.Mg 3 N 2 + H 2 O → 3Mg(OH) 2 + 2NH 3
III. Чтобы сбалансировать атомы H и O, H 2 O умножается на 6.
Mg 3 N 2 + 6H 2 O → 3Mg(OH) 2 + 2NH 3
B. Алгебраический методАлгебраический метод включает присвоение алгебраических переменных в виде стехиометрических коэффициентов каждому химическому веществу, участвующему в реакции. Алгебраические переменные решаются для получения значений каждого из стехиометрических коэффициентов. Ниже приведены шаги балансировки химического уравнения алгебраическим методом;
- Неуравновешенное химическое уравнение записывается в виде молекулярных формул соответствующих химических веществ.
- Алгебраические переменные присваиваются каждому виду как стехиометрический коэффициент в неуравновешенном уравнении.

- Теперь подготовлен набор уравнений для получения значения каждой из алгебраических переменных.
- Эти уравнения могут иметь несколько решений, и необходимо выбрать минимальные значения переменных.
- Значения всех алгебраических переменных подставляются в химическое уравнение, чтобы получить сбалансированное химическое уравнение.
C 6 H 12 O 6 + O 2 → CO 2 + H 2 4 O
я. Алгебраические переменные добавляются в качестве стехиометрического коэффициента к каждому химическому веществу в химическом уравнении.
aC 6 H 12 O 6 + bO 2 → cCO 2 + dH 2 O
ii. Различные уравнения генерируются для всех переменных на основе химической реакции.

Уравнение для «а»
- В реагенте молекулы «а» C 6 H 12 O 6 содержат 6а атомов углерода, а в продукте молекулы «с» CO 2 содержат «с» атомов углерода; 6а=с.
Уравнение для «b»
- В реагенте молекулы «а» C 6 H 12 O 6 содержат 12а атомов водорода, тогда как в продукте молекулы «d» H 2 O содержат «2d» атомов водорода; 12а = 2г.
iii. Общее уравнение для алгебраических переменных затем получается путем анализа различных уравнений.
6а + 2б = 2в + г
iv. Поскольку необходимо вычислить минимальные значения переменных, одной из переменных присваивается значение.
Если а=1,
с= 2а = 6
д= 6а= 6
Значение b можно получить, подставив значения a, c и d в уравнение;
6×1 + 2b = 2×6 + 6
2б= 12; б=6.

v. Значения переменных подставляются в химическое уравнение для получения сбалансированного химического уравнения.
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2
- O Ссылки и источники
- Gautum SD, Pant M и Adhikari NR (2016). Всесторонняя химия, часть 2. Шестое издание. Издатели и дистрибьюторы Heritage, Pvt. ООО
- 3% — https://mrsmeckelborg.weebly.com/uploads/9/1/5/0/
816/7.1_cellular_respiration.pdf
- 1% – https://www.youtube.com/watch?v=qgUn_iypQUg
- 1% – https://www.vedantu.com/chemistry/balancing-chemical-equations
- 1% – https://www.reference.com/science/reactants-products-585ab0606d4a4ba7
- 1% – https://www.reference.com/science/example-law-conservation-mass-931e539862dc8d9f
- 1% — https://www.jiskha.com/questions/601128/mg3n2-6h3o-3mg-oh-2-2nh4-how-many-grams-of-h3o-are-needed-to-produce-150g- из
- 1% — https://www.
 indiastudychannel.com/resources/138937-What-is-hit-and-trial-method-in-mathematics.aspx
indiastudychannel.com/resources/138937-What-is-hit-and-trial-method-in-mathematics.aspx - 1% – https://www.answers.com/Q/When_balancing_a_chemical_equation_why_must_the_formula_subscripts_remain_unchanged
- 1% – https://www.answers.com/Q/How_is_the_law_of_conservation_of_energy_similar_to_the_law_of_conservation_of_mass
- 1% – https://studysoupquestions.com/questions/biology/134251/counting-the-atoms-in-each-substance-in-the-reactants-and-products-is-a-step-in-what- один из следующих
- 1% — https://socratic.org/questions/how-can-i-balance-this-equation-n2-h3-nh4
- 1% – https://opentextbc.ca/introductorychemistry/chapter/calculatory-equinance-constant-values-2/
- 1% – https://en.wikipedia.org/wiki/Conservation_of_mass
- 1% – https://courses.lumenlearning.com/introchem/chapter/the-law-of-conservation-of-mass/
- 1% – https://courses.lumenlearning.com/boundless-chemistry/chapter/reaction-stoichiometry/
- 1% – https://chem.
 libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Chemical_Reactions/Stoichiometry_and_Balancing_Reactions
libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Chemical_Reactions/Stoichiometry_and_Balancing_Reactions - 1% — https://cefrc.Princeton.edu/sites/cefrc/files/Files/2014%20Lecture%20Notes/Pitsch/Lecture1_Fundamentals_2014.pdf
- <1% – https://www.meritnation.com/ask-answer/question/is-there-any-way-of-balacing-a-single-chemical-equation-othe/chemistry/5518157
- <1% — https://www.lcps.org/cms/lib4/VA01000195/Centricity/Domain/12702/Microsoft%20Word%20-%20Unit%209%20Reactions%20-%20%20Student%20Packet%20KEY %202012-13.pdf
- <1% — https://study.com/academy/answer/what-of-the-following-statements-is-true-according-to-dalton-s-atomic-theory-a-atoms-combine-in -простые-фракционные-соотношения-для-образования-соединений-b-все-атомы-хлора-имеют-идентичные-свойства-с-другими-элементами-с-подобной-массой-c-атомами-углерода-могут -бе-ча.html
- <1% – https://science.sciencemag.org/content/56/1444/258
- <1% – https://quizlet.
 com/123115543/chapter-10-chemical-reactions-flash-cards/
com/123115543/chapter-10-chemical-reactions-flash-cards/ - <1% – https://jaminsantiago.files.wordpress.com/2013/04/balancing-chemical-equations-easy-алгебраический-метод.pdf
- <1% – https://en.wikipedia.org/wiki/Chemical_reactant
- <1% – https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Equilibria/Dynamic_Equilibria/Reversible_and_irreversible_reactions
Химическая формула и уравнения
Химическая формула и уравнения — индексы
Химическая формула или уравнение показывает символы элементов в соединении и соотношение элементов друг к другу.Если вещество содержит более одного атома определенного элемента, это количество указывается в химических формулах или уравнениях с помощью индекса и числа после символа элемента. Номер нижнего индекса относится только к элементу, за которым он следует непосредственно. Например, химическая формула воды H 2 O означает, что 2 атома водорода соединяются с 1 атомом кислорода.
Например, химическая формула воды H 2 O означает, что 2 атома водорода соединяются с 1 атомом кислорода.Как написать химическую формулу или уравнение, используя нижние индексы
Чтобы ввести или написать нижний индекс для химической формулы или уравнения, следуйте этим простым инструкциям:- Введите формулу или уравнение, например, h3O
- Выделите номер
- Щелкните Формат
- Выберите Шрифт… Уменьшите размер шрифта числа
- Под заголовком «Эффекты» отметьте поле «Подстрочный индекс»
- Теперь формула будет отображать уравнение с номером в нижнем индексе — H 2 O
Химическая формула и уравнения
Химическая Формула и уравнения – Примеры и значения индексов
Например, химическая формула воды – h3O, что означает, что 2 атома водорода соединяются с 1 атомом кислорода. Химическая формула хлорида натрия (соли) NaCl указывает на то, что один атом натрия соединяется с одним атомом хлора в соотношении один к одному. После символа элемента добавляются нижние индексы, указывающие на количество атомов этого элемента в соединении, если оно больше единицы. Например, формула бромида магния MgBr2 указывает на то, что один атом магния соединяется с двумя атомами брома.
После символа элемента добавляются нижние индексы, указывающие на количество атомов этого элемента в соединении, если оно больше единицы. Например, формула бромида магния MgBr2 указывает на то, что один атом магния соединяется с двумя атомами брома.Значения и примеры химических формул и уравнений
Следующие примеры химических формул и уравнений объясняют их значение.Пример химической формулы соли (хлорида натрия) — NaCl
NaCl
Символ Na указывает на элемент Натрий
Символ Cl указывает на элемент Хлор Для воды — H 2 OH 0 2 O
S O
S O
S YMBol H Указывает, что элемент Hydrogen
символ o Указывает, что элемент Oxygen
индивидуальный индекс указывает 2 атомами водородаХимическая формула и уравнения — Список общих химических формул
В следующем списке химических формул и уравнений показаны некоторые из наиболее распространенных химических формул.
O O 9C 2 H 6 2 H 6 O
6
C 9 H 8 o 4 o 4 o 4 o 4 2
HBR
CUSO 4
6
169074
9 9076 9 O 9 OCommon Chemical Formula
Na
натрия H 2 O
Water C 6 H 12 O 6
глюкоза 9 6 O Alpe H 2 S
Сульфид водорода NaCl
1 16 Ethanol C 2 H 4 O 2 Уксус NH 3
Ammonia MG
C 2 H 4 O 0 2 0 4 O 2 Уксусная кислота
C 4 H 10
бутан NO 3 — Нитрат Си
Медь N 2
Азот СО 2
Диоксид углерода
Н 2 SO 4
Серная кислота
СН 4
Метан
С 12 H 22 O 11
Сахароза
С 3 Н 8
Пропан
NaHCO 3
Пищевая сода
F
Фторид
F 2
H 9 O 2 0
Peroxide
C 0 8 H 10 N 4 O 4 O 2
9011Аспирин
HCl
Соляная кислота
Zn (NO 3 ) 2
Цинк СО
Окись углерода
NaOH
Гидроксид натрия
NaCN
Натрий цианид
Са (CN) девяносто одна тысяча сто семьдесят два 2
цианид кальция
Au
Золото I
Iodine
Sn
TIN C 6 H 6
Benzene
H 2 S
Сероводород
CH 90 110 3 Coch 3
2 H 3 PO 4
16 CHOSPORIC CASS
C 5 H 12
Pentane
CH 3 OH
H 2 CO 3
Cerbonic
Ti
титана
NaClO
Гипохлорит натрия
С2Н6
Этан
(NH 4 ) 2 SO 4
Сульфат аммония
C 8 H 18
Octane
6 C 27 H 46 o
Choleatesterol
C 7 H 6 O 2
216 H 2 SO 3
C 6 H 12 O 12 O 6
6C 6 H 8 O 6
аскорбиновая кислота
CO 2
Сухой лед
NaNO 3
90 716 Nitrate натрия Hio 3
C 3 H 6 o 3
молочная кислота
Водяной Паров
Нет Формулы
Оксид С
углерода Н
Водород С п Н 2n О л Сахар Сульфат N 2 O
Азот 907 16 C 6 H 8 H 8 O 7 7 Лимонная кислота C 8 H 18
Octane C 10 H 16 O
Камфора
AgI Окись серебра Оксид мышьяка
Au- 2 О 3
Золотой триоксида
Au- 2 S
Gold Sulfide
BR 2 9 AL 2 O 3 0
Алюминиевая фольга
Общие химические формулы Список
Химическая формула и уравнения
Приведенный выше список химических веществ l Формула и уравнения содержит подробную информацию об общих химических формулах.
Химические уравнения и реакции
Химические уравнения и реакции
Ан интерактивный обзор для вашего предстоящего экзамена!
***Любой текст выделены розовым цветом ссылки на дополнительную информацию и мероприятия.***
***Любой текст написанное желтым цветом требует, чтобы вы использовали раздаточный материал в Интернете.***
химическая реакция это процесс в котором атомы, присутствующие в исходных веществах, перестраиваются с образованием новых химические соединения, присутствующие в веществах, образующихся в результате реакции.Эти исходные вещества химического реакции называются реагентами , а новые вещества, которые результат называется продуктов .
Вокруг идут химические реакции, а также внутри нас.
 От
фейерверк мы видим 4 го июля, к перевариванию этого
утренний завтрак, химические реакции повсюду! Итак, как мы можем сказать, когда химическая реакция
происходит?
От
фейерверк мы видим 4 го июля, к перевариванию этого
утренний завтрак, химические реакции повсюду! Итак, как мы можем сказать, когда химическая реакция
происходит?Наблюдаемый признаки химической реакции могут включать:
НО ПОМНИТЕ!!!
Единственный способ быть абсолютно уверенным, что произошла химическая реакция
через химический анализ продуктов! Мы могли бы не быть в состоянии наблюдать один из вышеуказанных индикаторов
***Помните наши невидимая кислотно-щелочная реакция???***
~ХИМИЧЕСКИЕ УРАВНЕНИЯ~
Химикат реакцию можно точно обобщить с помощью
правильно написанное химическое вещество уравнение .

Правильно написанный химическое уравнение дает информацию о реагентах, продуктах, межмолекулярные отношения между реагентами и продуктами, и родственные отношения
между реагентами и продукты.
***Что такое три части информации, что химическое уравнение
НЕТ предоставить?***
Так как есть еще так много информации можно получить из химического уравнения,
нам нужно стать специалисты по их написанию!
Но только что является ли правильно написанным химическим уравнением?
Правильно написанное уравнение — это химическое уравнение, которое
1. представляет известные факты
Все реагенты и продукты идентифицированы
Идентификация с помощью химического анализа в лаборатории или из опубликованных экспериментальных результатов
2.
 содержит правильные формулы для реагентов и
продукты.
содержит правильные формулы для реагентов и
продукты. 3. и удовлетворяет закону сохранения массы. (Атомы не могут быть ни созданы, ни уничтожены в обычных химических реакции.)
Одинаковое число атомов каждого элемента появляется на каждая сторона химического уравнения
Чтобы быть уверенным, что химическое уравнение подчиняется закону сохранения массы,
ты должен быть уверен что уравнение уравновешено.Практикуйте свои навыки балансировки с помощью CHEMBALANCER.
Напишите свой ответы на прилагаемый интернет-раздаточный материал.
***Как же ты делаешь???***
Хорошо, хорошо сейчас что мы рассмотрели химические уравнения, давайте посмотрим, сможем ли мы
применять эти концепции в МИНИ ОБЗОРЕ!!!
Направления: Запишите и сбалансируйте правильный химикат уравнения для следующих
реакции на сопроводительный раздаточный материал.
 (Не забудьте указать штат
(Не забудьте указать штат в скобках.)
1. При твердом натрии нитрат нагревается, он разлагается с образованием твердого нитрита натрия и газообразного кислорода.
2. При твердом фосфате кальция и водный раствор серной кислоты реагируют, водный раствор фосфорной кислоты и твердое вещество образуется сульфат кальция.
3. Водный раствор хлорид аммония и гидроксид бария нагревают, и соединения реагируют выделяют газообразный аммиак.хлорид бария раствор и вода также являются продуктами.
4. Газообразный аммиак реагирует с газообразным кислородом для получения газообразного азота и воды.
5. Медь(II) оксид кипятят в водном растворе серной кислоты с образованием сульфата меди(II) и воды.
~5 ОСНОВНОЙ ХИМИЧЕСКИЙ РЕАКЦИИ~
Мы можем классифицировать химические реакции в зависимости от того, как атомы или
молекул реагентов образуют новые группировки.
. Многие химические реакции можно отнести к классу
Многие химические реакции можно отнести к классукак принадлежащий к одной из пяти основных групп.
1. РЕАКЦИИ СИНТЕЗА
Также известная как реакция композиции, синтез реакция — это реакция, в которой два или более веществ объединяются, образуя новое соединение.
Представлен генеральным уравнение:
А + Х АКС
, где A и X могут быть элементы или соединения, а AX представляет собой соединение.
Примеры реакций синтеза включают:
Синтез хлорид натрия
Na (с) + Cl ( г)
Синтез оксида магния
Mg (с) + O 2( г)
Синтез воды
H 2( г) + O 2(г)
2.РЕАКЦИЯ РАЗЛОЖЕНИЯ
Реакция разложения обратная реакции синтеза и представляет собой реакцию, в которой одно соединение подвергается реакция, в результате которой образуются два или более простых вещества.

Представлен генеральным уравнение:
АКС А + Х
, где AX — это соединение и и А и Х могут быть элементы или соединения.
Большинство реакций разложения протекают место только при энергии в виде
электричество или добавляется тепло.
Примеры разложения реакции включают:
Разложение вода
Н 2 О ( л)
Разложение карбоната свинца (II)
PbCO 3(с)
Разложение йодида натрия
НаИ (с)
3. РЕАКЦИИ ОДИНОЧНОЙ ЗАМЕНЫ
А Реакция простого замещения или реакция замещения – это реакция, в которой один элемент заменяет аналогичный элемент в соединении.
Это представлено общим уравнением:
А + ВХ AX + В
или
Y + BX BY + X
, где A, B, X и Y — элементы, а AX, BX и BY — соединения.

Много реакции с одним замещением происходят в воде, и по сравнению с обоими реакции синтеза и разложения, количество энергии, необходимое для реакция однократного замещения меньше.
Примеры реакции с одним замещением включают:
Термитная реакция
Ал (с) + Fe 2 O 3(s)
Реакция твердого кальция и воды
Ca (s) + H 2 O ( л)
Реакция твердого лития и газообразного хлора
Ли (с) + Cl 2( г)
4.РЕАКЦИИ ДВОЙНОЙ ЗАМЕНЫ
Двойной реакция замещения — это реакция, в которой ионы двух соединений обмениваются места в водном растворе с образованием двух новых соединений.
Одно из новых соединений эти формы обычно представляют собой осадок, нерастворимый газ, который пузырится из раствор или молекулярное соединение (обычно вода).

Другой соединение, которое образуется, обычно растворимо и остается в растворе.
Двойная замена реакции представлены общим уравнением:
AX + BY + BX
, где A, X, B и Y в реагентах представляют собой ионы и продукты AY и BX представляют собой ионные или молекулярные соединения.
Примеры реакции двойной замены включают:
Реакции нитрат серебра с хлоридом натрия и нитрат серебра с йодидом натрия
AgNO 3( водн.) + NaCl (водн.)
AgNO 3( водн.) + NaI (водн.)
Реакция серной кислоты и гидроксида натрия
H 2 SO 4( водн. ) + NaOH (водн.)
***Есть два особых случая, которым присвоены определенные имена. их.***
1. Когда реакция идет между двумя ионными соединений и они образуют осадок, эта реакция также называется преципитацией .
 Первое
приведенные выше примеры показывают реакции осаждения.
Первое
приведенные выше примеры показывают реакции осаждения.2. Когда происходит реакция между кислотой ( любым соединением, которое образует ионы водорода ) и основанием ( любым соединением, которое образует гидроксид-ионы ), вода образуется как один продуктов.Это называется нейтрализация . Пример Реакция нейтрализации видна в приведенной выше реакции между серной кислотой и гидроксид натрия.
5. РЕАКЦИИ ГОРЕНИЯ
А горение реакция – это реакция, при которой вещество соединяется с кислородом и высвобождает большое количество энергии в виде тепла и света.
Примеры реакции горения включают:
Три баллона H 2 и один баллон H 2 /O 2 смесь
H 2( г) + O 2(г)
Сжигание метана (углеводород)
CH 4( г) + O 2(г)
Сжигание гексана (углеводород)
C 6 H 14( л) + O 2(г)
***Обычно реакции горения происходят, когда углеводороды реагируют с кислородом с образованием углерода диоксида и воды, и будет иметь общее уравнение
C x H y + O 2 CO 2 + H 2 O
, где x представляет число атомов углерода, а y число
.
атомов водорода в углеводороде
Углеводороды класс соединений, которые в основном состоят из водорода и углерода.***
*** ТЫ ПОСМОТРИТЕ ВСЕ МИНИ-ФИЛЬМЫ, КОТОРЫЕ ПРЕДОСТАВИЛИ
ПРИМЕР ДЛЯ КАЖДОГО ТИПА РЕАКЦИИ???***
Другой раздел рассмотрен Время для еще одного МИНИ-ОБЗОРА!!!
Направления: Запишите или заполните и сбалансируйте каждый из следующих уравнений и
определить каждый как синтез, разложение, одинарное замещение, двойное замещение или сжигание
1.C 3 H 8( г) + О 2(г)
2. Твердый натрий прореагировал с водой дает водный раствор гидроксида натрия и водород
газ.
3. CaCO 3(и)
4.
 AgNO 3( водн.) + KI (водн.)
AgNO 3( водн.) + KI (водн.) 5. Газообразный водород вступает в реакцию с газообразным йодом с образованием газообразного йодистого водорода.
~СЕРИЯ ДЕЙСТВИЙ~
Можно расположить металлы в порядок их химической активности и тем самым установить ряд активности металлов.Серия упражнений помогает предсказать, будут ли реакции однократного замещения металлов ионами металлов а металлов с водой и кислотами произойдет.
Серия мероприятий элементы
Активность металлов
Ли
Руб
K Может реагировать с холодной водой
Ba и кислоты, заменяющие
Sr водород
Ca
Нет данных
мг
Ал
Mn Может реагировать с паром
Zn и кислоты, заменяющие
Cr водород.

Fe
CD
Ко
Ni Может реагировать с кислотами,
Sn вместо водорода.
Pb
Н 2
Sb Реакция с кислородом,
Bi образующие оксиды.
Медь
рт.ст.
Ag Почти не реагирует.
Pt Только форма оксидов
Au косвенно.
Активность галогена Неметаллы
Ф 2
Класс 2
Бр 2
I 2
Некоторые общие тенденции в серии мероприятий перечислены ниже.***У вас есть это как раздаточный материал***
- Элемент заменит из
соединение в водном растворе любой из этих элементов ниже его в
ряд действий.
 Чем больше
интервал между элементами ряда активности, тем больше
склонность к реакции замещения.
Чем больше
интервал между элементами ряда активности, тем больше
склонность к реакции замещения.
- Реакционная способность металлов по отношению к другим элементов уменьшается по мере продвижения вниз по ряду. Стабильность их соединений также уменьшается.
- Металлы группы I периодической таблицы являются наиболее реакционноспособными, за ними следуют элементы группы II.
- Любой металл выше магния заменяет водород из воды
- Любой металл выше кобальта заменяет водород из пара.
- Любой металл выше водорода реагирует с кислоты, замещая водород.
реакции синтеза металлов с кислородом также протекают тем легче, чем выше металл помещается в ряд активности.
- Любой металл выше серебра реагирует с
кислород, образующий оксиды; те, кто ближе к вершине, реагируют быстро.

- Любой металл ниже уровня ртути образует оксиды только косвенно (т.е. не в результате реакции с O 2 ).
Чем активнее металл, тем сильнее он удерживает кислород в оксиде и следовательно, тем сильнее оксид сопротивляется разложению на его элементов при нагреве.
- Оксиды металлов ниже меди разлагаются только при нагревании.
- Оксиды металлов с выходом ниже хрома металлов при нагревании водородом.
- Оксиды металлов выше резиста железа превращение в свободный металл при нагревании с водородом.
большинство активных металлов, скорее всего, не останутся несвязанными с другими веществами. очень долго. Некоторые настолько активны, что они должны быть изолированы от воздуха при хранении.
Элементы в верхней части ряда никогда не встречаются свободными в природа.
- Элементы в нижней части
ряды часто встречаются в природе бесплатно.

Таким образом, серия действий полезна потому что это указывает на возможность реакции данного металла с водой, кислоты, кислород, сера, галогены и соединения другие металлы. Он также дает хорошее представление об относительном стабильность соединений любого металла.
Заключительный раздел пересмотрел последний МИНИ ОБЗОР!!!
Направления: Используя ряд действий, спрогнозируйте будет ли каждая из следующих реакций
встречаются и записывают сбалансированные уравнения, которые вы предсказываете, возникнут. Для тех событий, которые, по вашему прогнозу, не произойдут, просто напишите NR (без реакция).
1. Pb (т) + ZnCl (т)
2. Класс 2( г) + KBr (водный)
3.
 Ал (с) + Pb(NO 3 ) 2(водный)
Ал (с) + Pb(NO 3 ) 2(водный) 4. Cu (с) + FeSO 4( водный)
5. Ni (с) + О 2( г)
Ну вот и подошёл к концу интернет-обзор!
Сопровождающий Раздаточный материал для интернет-обзора необходимо сдать в день экзамена!
И не забудь усердно готовиться к экзамену Пройдите тест, домашние задания и обзорный раздаточный материал! И приходи на урок с любыми вопросами
вы все еще можете имеют!
УДАЧНОГО УЧЕНИЯ!!!
Уравновешивание химических уравнений — практика, метод, примеры
Практика балансировки химических уравнений
Уравновешивание химических уравнений по ионно-электронной формуле и изменение степени окисления используется для уравновешивания окислительно-восстановительного процесса или окислительно-восстановительных реакций при изучении химии.
 Ионно-электронный метод предназначен для уравновешивания частных уравнений окислителя и восстановителя и уравновешивания зарядов этих частных уравнений в растворах кислот и оснований. Другие ручные степени окисления используются для балансировки химических уравнений, созданных путем изменения или расчета степени окисления атомов реагентов и продуктов, присутствующих в химических элементах, молекулах или ионах.
Ионно-электронный метод предназначен для уравновешивания частных уравнений окислителя и восстановителя и уравновешивания зарядов этих частных уравнений в растворах кислот и оснований. Другие ручные степени окисления используются для балансировки химических уравнений, созданных путем изменения или расчета степени окисления атомов реагентов и продуктов, присутствующих в химических элементах, молекулах или ионах.Уравновешивание окислительно-восстановительных реакций ионно-электронным методом
Уравновешивание химических уравнений ионно-электронным методом имеет определенные общие правила или формулы, которые используют для уравновешивания окислительно-восстановительных реакций или окислительно-восстановительных реакций.Используем правила балансировки уравнений ионно-электронным методом:
- Некоторые окислители и восстановители и их химическая формула для балансировки химических уравнений.
- Составьте уравнения частичного баланса, представляющие восстановление окислителя и окисление восстановителя.

- Если реакция происходит в кислом растворе или растворе с низким pH, используйте необходимое количество ионов водорода, чтобы сбалансировать количество атомов, участвующих в частных уравнениях, а для щелочного раствора или раствора с высоким pH мы используем ионы гидроксила.
- Уравновешивание изменений частных химических уравнений путем добавления подходящего количества электронов. Эти электронные частицы включают уравновешивающие полуреакции окисления и восстановления. Умножьте каждое частичное уравнение на подходящий коэффициент для балансировки химических веществ ионизации. Каждое из двух частных уравнений включает одинаковое количество электронов.
- Сложите уравнения в частных производных и сократите сходные виды, которые появляются по обе стороны уравновешивающей химической реакции.
Примеры для балансировки химических уравнений
Балансирующее железо в растворе перманганата калия
Перманганат калия в разбавленной серной кислоте окисляет железо из двухвалентного состояния в трехвалентное за счет изменения электронной конфигурации атома железа.
 Ион перманганата является окислителем, а ион двухвалентного железа является восстановителем в уравновешивающих химических уравнениях.
Ион перманганата является окислителем, а ион двухвалентного железа является восстановителем в уравновешивающих химических уравнениях.MnO 4 – + H + + Fe +2 ⇆ Mn +2 + Fe +3 + H 2 O
Левая часть окончательного уравнения будет содержать MnO 4 – , H + ион и Fe +2 ион, а правая часть будет иметь Mn +2 , вода и Fe +3 . Уравнение в частных производных, представляющее восстановление окислителя, MnO 4 – → Mn +2 .Эта реакция происходит в растворе кислоты, поэтому мы используем ион водорода, чтобы сбалансировать четыре атома кислорода в ионе перманганата.
MnO 4 – + 8H + → Mn +2 + 4H 2 O
Приведенное выше частное уравнение все еще несбалансировано с точки зрения зарядов и уравнения, уравновешивающего введением пяти электронов.

MnO 4 – + 8H + + 5e ⇆ Mn +2 + 4H 2 O
Уравнение в частных производных, описывающее окисление восстановителя, Fe +2 ⇆ Fe +3 + e.Это уравнение, уравновешивающее заряды и реагирующие элементы. Следовательно, чтобы уравновесить заряды уравнений в частных производных, это уравнение умножается на 5, а затем складывается с первым уравнением.
MNO 4 — — + 8H + + 5E ⇆ Mn + 5E + 4H 2 O
5 × (Fe + 2 ⇆ Fe +3 + E)
MNO 4 – + 8H + + 5Fe +2 → Mn +2 + 5Fe +3 + 4H 2 OУравновешивание йодида калия в кислом растворе дихромата
Для уравновешивания окисления йодида калия в кислом растворе дихромата хром восстанавливается из состояния +6 в состояние +3, а ион йода окисляется с образованием элементарной молекулы йода.
. Балансирующие частные уравнения бихроматной стороны и йодной стороны равны
Балансирующие частные уравнения бихроматной стороны и йодной стороны равныCR 2 o 7 O 7 -2 -2 + 14H + + 6E ⇆ 2Cr +3 + 7H 2 O
2i — ⇆ I 2 + 2eДля балансировки общих уравнений йодная сторона умножается на 3 и прибавляется к дихроматной стороне.
CR 2 O 7 O 7 -2 -2 + 14H + + 6E ⇆ 2CR +3 + 7H 2 O
3 (2i — ⇆ I 2 + 2e)
CR 2 O 7 -2 + 14H + + 6I – → 2Cr +3 + 3I 2 + 7H 2 9 OБалансировка перманганат-иона в щелочном растворе
Перманганат-ион в щелочном растворе окисляет Na 2 SnO 2 до Na 2 SnO 3 .Уравнение в частных производных, представляющее восстановление окислителя в щелочном растворе и уравновешивающее химические уравнения с необходимым количеством ионов OH – .

MnO 4 – + 2H 2 O → MnO 2 + 4OH –
Приведенное выше частичное уравнение все еще несбалансировано с точки зрения заряда, уравнение уравновешивается введением трех электронов.
MnO 4 – + 2H 2 O + 3e → MnO 2 + 4OH –
Снова частное уравнение, представляющее окисление восстановителя.
SnO 2 -2 + 2OH – ⇆ SnO 3 -2 + H 2 O + 2e
Следовательно, уравновешивая эти химические уравнения, первое частичное уравнение умножает 2, а второе частичное уравнение умножает на 3 и добавляет к данному окончательному химическому уравнению баланса.
2mno 4 — — + 4H 2 O + 6E ⇆ 2mno 2 + 8OH —
3sno 2 -2 + 6OH — ⇆ 3sno 3 -2 + 3H 2 O + 6E
2mno 4 — + 3sno 2 -2 + H 2 O → 2mno 2 + 3sno 3 -2 + 2OH —Задача: Уравновешивание химического уравнения перманганата и марганца перекисью водорода в кислом растворе.

Решение: Баланс частных уравнений для вышеуказанной химической реакции равен
mno 4 — — + 8H + + 5e ⇆ Mn + 5E + 4H 2 O
H 2 O 2 ⇆ 2H + + O 2 + 2EУравновешивание общих зарядов химических уравнений, умножение на 2 и второе на 5 и сложение.
2mno 4 — + 16H + + 10E 909 + + 10e ⇆ 2mn +2 + 8H 2 o
5h 2 O 2 ⇆ 10h + + 5o 2 + 10e
2мно 4 – + 5Н 2 О 2 + 6Н + ⇆ 2Мн +2 + 8Н 2 О + 5О 109 19011Практические задачи по уравнениям баланса
Задача: Как мы можем сбалансировать уравнение для окисления Mn +2 в MnO 4 – кислой NaBiO 3 ?
Раствор: NaBiO 3 окисляет Mn +2 до MnO 4 – в растворе серной кислоты с образованием иона BiO + .
. Баланс частных уравнений и общего химического уравнения для вышеуказанной химической реакции равен
Баланс частных уравнений и общего химического уравнения для вышеуказанной химической реакции равен2MN +2 + 8H 2 O → 2mno 4 — + 16H + + 10E
5BIO 3 — + 20H + + 10E → 5Bio + + 10H 2 O
2 O
2MN +2 + 5bio 3 — + 4H — → Mno + — + 5bio + + 2H 2 oЗадача: Уравновешивание химического уравнения восстановления нитрат-иона до аммиака алюминием в водном растворе гидроксида натрия.
Решение: Баланс частичного и общего уравнения восстановления нитрат-иона до аммиака алюминием в водном растворе гидроксида натрия равен
.3NO 3 — — + 18H 2 O + 24E 2 0 3 + 27OH — + 27OH 9094 —
8al + 32O — ⇆ 8alo 2 — + 16h 2 o + 24e
3NO 3 – + 8Al + 2H 2 O + 5OH – → 3NH 3 + 8AlO 2 –Уравновешивание химических уравнений методом степени окисления
Уравновешивание окислительно-восстановительных реакций путем изменения степени окисления в сочетании с ионно-электронными методами балансировки химических уравнений.
 Проиллюстрируем этот метод балансировки уравнения окислением железа кислым раствором перманганата.
Проиллюстрируем этот метод балансировки уравнения окислением железа кислым раствором перманганата.MnO 4 – + H + + Fe +2 → Mn +2 + Fe +3 + 4H 2 O
Для балансировки степени окисления Mn в MnO 4 – уменьшается на 5, а железо увеличивается на 1 в приведенных выше уравнениях. Ввод правильных факторов для уравновешивания уменьшения и увеличения степени окисления и иона водорода (раствор кислоты) и молекул воды для баланса химических уравнений.
MnO 4 – + 8H + + 5Fe +2 → Mn +2 + 5Fe +3 + 4H 2
- O
- O
Примеры балансировки по степени окисления
Уравновешивание иодид-иона в кислом растворе дихромата
Cr 2 O 7 -2 + I – → 2Cr +3 + I 2
Степень окисления хрома уменьшается на 2, а степень окисления йода увеличивается на 1.
 Уравновешивание увеличения и уменьшения степени окисления путем подстановки правильного коэффициента в приведенные выше уравнения. Также были добавлены четырнадцать ионов водорода и необходимое количество молекул воды, чтобы сбалансировать приведенное выше уравнение.
Уравновешивание увеличения и уменьшения степени окисления путем подстановки правильного коэффициента в приведенные выше уравнения. Также были добавлены четырнадцать ионов водорода и необходимое количество молекул воды, чтобы сбалансировать приведенное выше уравнение.Cr 2 O 7 -2 + 6I – + 8H + → 2Cr +3 + 3I 2 909 11 2 O 1 109 10 9
Балансировка станнита натрия и станната в щелочном растворе
MnO 4 – + SnO 2 -2 → MnO 2 + SnO 3 -2
Степень окисления марганца уменьшается на 3, а степень окисления олова увеличивается на 2.Следовательно, уравновешивая увеличение и уменьшение степени окисления, добавляя правильный коэффициент, два гидроксильных иона и необходимое количество молекул воды, чтобы сбалансировать приведенное выше химическое уравнение. Следовательно, уравнение баланса для приведенных выше реакций
2MNO 4 — + 3sno 2 -2 + H 2 O → 2mno 2 + 3sno 3 -2 + 2OH —
Уравновешивание йодид-иона и йодат-иона в растворе кислоты
Изменение степени окисления йода в приведенной выше химической связи используется для балансировки этого химического уравнения.

I – (-1) + IO 3 – (+5) → I 2 (0)
Степень окисления йодида увеличивается на 1, а йодат-иона уменьшается на 5. Подставляя правильные коэффициенты для уменьшения и увеличения степени окисления и балансируя приведенное выше уравнение.
I- + IO 3 – + 6H + → I 2 + 3H 2 O
Уравновешивание сернистой кислоты в бихромат-ионе
Уравновешивание химических уравнений для окисления сернистой кислоты в серную кислоту дихроматом калия
3SO 3 -2 -2 + CR 2 O 7 -2 + 8H + → 3SO + → 3so 4 -2 + 2Cr +3 + 4H 2 o
Для уравнений баланса степень окисления двух атомов хрома уменьшается на 6, а степень окисления серы увеличивается на 2.Поэтому мы подставляем правильный коэффициент и необходимое количество ионов водорода и воды, чтобы сбалансировать приведенные выше ионные уравнения.

Приведенное выше обсуждение окислительно-восстановительных реакций полезно для балансировки любых химических уравнений с помощью ионно-электронной формулы и метода степени окисления. Эта формула балансировки использует только балансы химических уравнений окислительно-восстановительных или окислительно-восстановительных реакций при изучении химии или химических наук.
Уравновешивание химических реакций с примерами
Уравновешивание химических реакций с примерами
Теорема сохранения массы:
В химической реакции масса сохраняется, она не теряется и не создается.Таким образом;
- Число атомов элементов сохраняется. Другими словами, сумма атомов в составе реагентов равна сумме атомов продуктов.
- Масса элементов сохраняется. Массы реагентов равны массам продуктов.
- Заряды элементов/соединений сохраняются. Суммарные заряды реагентов равны суммарным расходам продуктов.
- В химической реакции число молекул не всегда сохраняется.
 Например;
Например;
H 2 + Cl 2 → 2HCl
В этой реакции; 1 молекула H 2 и молекула 1Cl 2 реагируют и образуется 2 молекулы HCl.Таким образом, число молекул сохраняется. Наоборот,
2H 2 + O 2 → 2H 2 O
В этой реакции 2 молекулы H 2 реагируют с 1 молекулой O 2 и образуются 2 молекулы H 2 O. Таким образом, количество молекул не сохраняется.
Пример: 4 г вещества А реагируют с 2,5 г вещества В и образуется 1,4 литра газа С и 3,5 г газа D. Найдите молярную массу C.
.Решение:
В химических реакциях масса всегда сохраняется.Так;
A масса + B масса = C масса + D масса
4 + 2,5 = С масса + 3,5
C масса =3 г
В стандартных условиях 1 моль газа составляет 22,4 литра, число молей углерода;
n C =1,4/22,4=1/16 молей
1/16 моль С составляет 3 г
1 моль C X
___________________
Х=48 г
Молярная масса C=48 г
- Балансируя химические уравнения, вы должны балансировать H и O после балансировки других элементов.

- Вы можете умножать коэффициенты реакции на дроби, например 3/2.
Пример: Баланс по химическому уравнению.
C 3 H 4 + O 2 → CO 2 + H 2 O
Реагенты:
3 атома C, 4 атома H, 2 атома O
Продукция:
1 атом C, 3 атома O, 2 атома H,
Чтобы сбалансировать реакцию, мы умножаем CO 2 на 3, и реакция становится;
C 3 H 4 + O 2 → 3CO 2 + H 2 O
Теперь у нас есть 4 атома H в реагентах и 2 атома H в продуктах, поэтому мы умножаем H 2 O на 2, и реакция принимает вид;
C 3 H 4 + O 2 → 3CO 2 + 2H 2 O
Теперь у нас есть 2 атома O в реагентах и 6+2=8 атомов O в продуктах, чтобы сбалансировать O, мы умножаем O 2 в реагентах на 4.

C 3 H 4 + 4O 2 → 3CO 2 + 2H 2 O
Теперь наша реакция сбалансирована.
Балансирующие окислительно-восстановительные реакции (окислительно-восстановительные):
При уравновешивании окислительно-восстановительных реакций вы должны сбалансировать количество атомов и зарядов веществ в реакции. Таким образом, вы должны знать степени окисления атомов элементов. Приведем несколько примеров и попытаемся на них объяснить эту тему.
Пример: Остаток после реакции;
HNO 3 + H 2 S → NO + H 2 O + S
Решение:
Сначала пишем степени окисления всех элементов;
ч + N + N +5 O +5 -2 -2 + H + 2 S -2 → N +2 O -2 + H + 2 О -2 + С 0
Затем запишем полуреакции , которые показывают окисление и восстановление (перенос электрона) элементов.

Сокращение: N +5 +3e — → N +2
Окисление: S -2 → S 0 + 2e —
Чтобы сбалансировать количество полученных и потерянных электронов, мы умножаем реакцию восстановления на 2 и реакцию окисления на 3.
Чтобы уравновесить количество атомов N с обеих сторон, мы добавляем 2 перед молекулами, включая N, и чтобы уравновесить количество атомов S, мы пишем 3 перед всеми веществами, включая S.Теперь реакция становится;
2HNO 3 + 3H 2 S → 2NO + H 2 O + 3S
Теперь мы сбалансируем количество атомов H с обеих сторон, 8 атомов H в левой части и 2 атома H в правой части. Если мы умножаем H 2 O в продуктах, мы уравновешиваем количество атомов H в реакции. Конечная реакция становится;
2HNO 3 + 3H 2 S → 2NO + 4H 2 O + 3S
Вы можете проверить количество O с обеих сторон, оно также сбалансировано.
 У нас есть 6 атомов O в левой части и 6 атомов O в правой части.
У нас есть 6 атомов O в левой части и 6 атомов O в правой части.Будьте осторожны!
Уравновешивающий (+) заряд в ионных реакциях, протекающих в кислой среде, добавить H + , а для уравновешивания числа атомов H и O добавить H 2 O.
Пример: Баланс после реакции в кислой среде;
ClO 3 — + Cr +3 → ClO 2 + Cr 2 O 7 -2
Пишем степени окисления всех элементов, будьте внимательны, не путайте заряд иона и степени окисления элементов.
CL +5 O -2 -2 3 — + CR +3 → CL +4 O -2 -2 2 + CR +6 2 O -2 7 -2
Полуреакции окисления и восстановления;
Сокращение: Класс +5 + e — → Класс +4
Окисление: Cr +3 → Cr +6 + 3e —
Чтобы сбалансировать количество электронов с обеих сторон, мы умножаем полуреакцию восстановления на 6 и полуреакцию окисления на 2.
 Теперь реакция становится;
Теперь реакция становится;6ClO 3 — +2Cr +3 → 6ClO 2 + Cr 2 O 7 -2
Рассчитываем электрические заряды обеих сторон и уравновешиваем их.
Левая сторона: ClO 3 — : 6x(ионный заряд=-1)=-6
Cr +3 : 2x(+3)=+6
-6+6=0
Суммарный электрический заряд в левой части равен нулю.
Правая сторона: Cr 2 O 7 -2 : -2
Суммарный заряд -2, уравновешивая электрический заряд добавляем ионы H + в кислых средах.Таким образом, мы добавляем ион 2H + в правую часть реакции и делаем реакцию сбалансированной.
6ClO 3 — +2Cr +3 → 6ClO 2 + Cr 2 O 7 -2 + 2H
Теперь мы должны сбалансировать количество атомов H в обеих сторонах реакции.
 В левой части нет атома H, но есть атомы 2H в правой части. Чтобы сбалансировать реакцию, мы добавляем 1 молекулу H 2 O в левую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;
В левой части нет атома H, но есть атомы 2H в правой части. Чтобы сбалансировать реакцию, мы добавляем 1 молекулу H 2 O в левую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;6LLO 3 — + 2CR +3 + H 2 O → 6LLO 2 + CR 2 O 7 -2 + 2H +
Будьте осторожны!
Уравновешивающий (-) заряд в ионных реакциях, протекающих в основной среде, добавить ОН — , а для уравновешивания числа атомов Н и О добавить ион ОН — .
Пример: Баланс после реакции в щелочной среде;
Br 2 → Br — +BrO 3 —
Пишем степени окисления всех элементов, будьте внимательны, не путайте заряд иона и степени окисления элементов.
Br 2 0 → Br — +Br +5 O -2 3 —
Полуреакции окисления и восстановления;
Сокращение: Br 0 + e — → Br -1
Окисление: Br 0 → Br +5 + 5e —
Чтобы сбалансировать количество электронов с обеих сторон, мы умножаем полуреакцию восстановления на 5 и полуреакцию окисления на 1.
 Чтобы сбалансировать количество Br в обе стороны, мы добавляем 3 перед Br 2 в реагентах. Теперь реакция становится;
Чтобы сбалансировать количество Br в обе стороны, мы добавляем 3 перед Br 2 в реагентах. Теперь реакция становится;3Br 2 → 5Br — +BrO 3 —
Рассчитываем электрические заряды обеих сторон и уравновешиваем их.
Левая сторона: Br 2 : 0
Суммарный электрический заряд в левой части равен нулю.
Правая сторона: 5Br — +BrO 3 — : -5+(-1)=-6
Суммарный заряд равен -6, уравновешивая электрический заряд, мы добавляем ионы OH — в левую часть основных сред.Таким образом, мы добавляем ион 6OH — в левую часть реакции и делаем реакцию сбалансированной.
3Br 2 +6OH — → 5Br — + BrO 3 —
Теперь мы должны сбалансировать количество атомов H в обеих сторонах реакции. В правой части нет атома H, но есть атомы 6H в левой части.
 Чтобы сбалансировать реакцию, мы добавляем молекулу 3 H 2 O в правую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;
Чтобы сбалансировать реакцию, мы добавляем молекулу 3 H 2 O в правую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;3Br 2 +6OH — → 5Br — + BrO 3 — + 3H 2 O
Теперь все заряды и количество атомов уравновешены.
Экзамены по химическим реакциям и решения задач
.Окислительно-восстановительные (окислительно-восстановительные) реакции< Предыдущая Далее >Стехиометрия химической реакции с примерами 


 Например, горение метана в кислороде
Например, горение метана в кислороде
 В настоящее время в левой части уравнения есть 2 Na и 2O. В правой части всего 4 Na и 2 O. Опять же, это проблема, должно быть равное количество каждого химического вещества с обеих сторон. Чтобы исправить это, добавим еще 2 Na с левой стороны. Уравнение теперь будет выглядеть так:
В настоящее время в левой части уравнения есть 2 Na и 2O. В правой части всего 4 Na и 2 O. Опять же, это проблема, должно быть равное количество каждого химического вещества с обеих сторон. Чтобы исправить это, добавим еще 2 Na с левой стороны. Уравнение теперь будет выглядеть так:
 at/index.jsp?link=solve&lang=en ), который занимается определением коэффициентов химического уравнения:
at/index.jsp?link=solve&lang=en ), который занимается определением коэффициентов химического уравнения:


 после понимания того, что массу нельзя ни создать, ни разрушить.
после понимания того, что массу нельзя ни создать, ни разрушить.
 Чтобы сбалансировать атом N, NH 3 умножается на 2.
Чтобы сбалансировать атом N, NH 3 умножается на 2.


 indiastudychannel.com/resources/138937-What-is-hit-and-trial-method-in-mathematics.aspx
indiastudychannel.com/resources/138937-What-is-hit-and-trial-method-in-mathematics.aspx libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Chemical_Reactions/Stoichiometry_and_Balancing_Reactions
libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Chemical_Reactions/Stoichiometry_and_Balancing_Reactions com/123115543/chapter-10-chemical-reactions-flash-cards/
com/123115543/chapter-10-chemical-reactions-flash-cards/ Например, химическая формула воды H 2 O означает, что 2 атома водорода соединяются с 1 атомом кислорода.
Например, химическая формула воды H 2 O означает, что 2 атома водорода соединяются с 1 атомом кислорода. После символа элемента добавляются нижние индексы, указывающие на количество атомов этого элемента в соединении, если оно больше единицы. Например, формула бромида магния MgBr2 указывает на то, что один атом магния соединяется с двумя атомами брома.
После символа элемента добавляются нижние индексы, указывающие на количество атомов этого элемента в соединении, если оно больше единицы. Например, формула бромида магния MgBr2 указывает на то, что один атом магния соединяется с двумя атомами брома.

 От
фейерверк мы видим 4 го июля, к перевариванию этого
утренний завтрак, химические реакции повсюду! Итак, как мы можем сказать, когда химическая реакция
происходит?
От
фейерверк мы видим 4 го июля, к перевариванию этого
утренний завтрак, химические реакции повсюду! Итак, как мы можем сказать, когда химическая реакция
происходит?
 содержит правильные формулы для реагентов и
продукты.
содержит правильные формулы для реагентов и
продукты.  (Не забудьте указать штат
(Не забудьте указать штат  Многие химические реакции можно отнести к классу
Многие химические реакции можно отнести к классу


 Первое
приведенные выше примеры показывают реакции осаждения.
Первое
приведенные выше примеры показывают реакции осаждения.
 AgNO 3( водн.) + KI (водн.)
AgNO 3( водн.) + KI (водн.) 
 Чем больше
интервал между элементами ряда активности, тем больше
склонность к реакции замещения.
Чем больше
интервал между элементами ряда активности, тем больше
склонность к реакции замещения.

 Ал (с) + Pb(NO 3 ) 2(водный)
Ал (с) + Pb(NO 3 ) 2(водный)  Ионно-электронный метод предназначен для уравновешивания частных уравнений окислителя и восстановителя и уравновешивания зарядов этих частных уравнений в растворах кислот и оснований. Другие ручные степени окисления используются для балансировки химических уравнений, созданных путем изменения или расчета степени окисления атомов реагентов и продуктов, присутствующих в химических элементах, молекулах или ионах.
Ионно-электронный метод предназначен для уравновешивания частных уравнений окислителя и восстановителя и уравновешивания зарядов этих частных уравнений в растворах кислот и оснований. Другие ручные степени окисления используются для балансировки химических уравнений, созданных путем изменения или расчета степени окисления атомов реагентов и продуктов, присутствующих в химических элементах, молекулах или ионах.
 Ион перманганата является окислителем, а ион двухвалентного железа является восстановителем в уравновешивающих химических уравнениях.
Ион перманганата является окислителем, а ион двухвалентного железа является восстановителем в уравновешивающих химических уравнениях.
 Балансирующие частные уравнения бихроматной стороны и йодной стороны равны
Балансирующие частные уравнения бихроматной стороны и йодной стороны равны

 Баланс частных уравнений и общего химического уравнения для вышеуказанной химической реакции равен
Баланс частных уравнений и общего химического уравнения для вышеуказанной химической реакции равен Проиллюстрируем этот метод балансировки уравнения окислением железа кислым раствором перманганата.
Проиллюстрируем этот метод балансировки уравнения окислением железа кислым раствором перманганата. Уравновешивание увеличения и уменьшения степени окисления путем подстановки правильного коэффициента в приведенные выше уравнения. Также были добавлены четырнадцать ионов водорода и необходимое количество молекул воды, чтобы сбалансировать приведенное выше уравнение.
Уравновешивание увеличения и уменьшения степени окисления путем подстановки правильного коэффициента в приведенные выше уравнения. Также были добавлены четырнадцать ионов водорода и необходимое количество молекул воды, чтобы сбалансировать приведенное выше уравнение.

 Например;
Например;


 У нас есть 6 атомов O в левой части и 6 атомов O в правой части.
У нас есть 6 атомов O в левой части и 6 атомов O в правой части. Теперь реакция становится;
Теперь реакция становится; В левой части нет атома H, но есть атомы 2H в правой части. Чтобы сбалансировать реакцию, мы добавляем 1 молекулу H 2 O в левую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;
В левой части нет атома H, но есть атомы 2H в правой части. Чтобы сбалансировать реакцию, мы добавляем 1 молекулу H 2 O в левую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция; Чтобы сбалансировать количество Br в обе стороны, мы добавляем 3 перед Br 2 в реагентах. Теперь реакция становится;
Чтобы сбалансировать количество Br в обе стороны, мы добавляем 3 перед Br 2 в реагентах. Теперь реакция становится; Чтобы сбалансировать реакцию, мы добавляем молекулу 3 H 2 O в правую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;
Чтобы сбалансировать реакцию, мы добавляем молекулу 3 H 2 O в правую часть реакции и уравновешиваем ее. Конечная уравновешенная реакция;