|
1 вариант 1.Химические явления – это 2. Выпишите физические явления Горение бенгальского огня, растворение сахара, намагничивание железа, гниение растений, движение воздуха (ветер), сгорание бензина в двигателе автомобиля, фотосинтез, таяние ледников, получение металлов из руд. 3. Приведите пример трех химических явлений и напишите их признаки. |
2 вариант 1.Признаками физических явления — это 2. Выпишите химические явления
Испарение росы, растворение ржавчины моющим средством, горение спички, процессы дыхания у животных, замерзание воды, получение из графита алмаза, процесс пищеварение у человека, появление налета на медных скульптурах. 3. Приведите пример трех физических явлений и напишите их признаки. |
3 вариант 1.Явление, сопровождающиеся изменением состава вещества называется 2. Выпишите физические явления Распространение запаха духов, ржавление гвоздя, горение дров, скисание молока, засахаривание варенья, выветривание горных пород, образование пара при кипении воды, фотосинтез 3. Приведите пример трех химических явлений и напишите их признаки. |
4 вариант 1.Явления, сопровождающиеся изменение агрегатного состояния вещества или его формы называются …. 2. Выпишите химические явления Почернение серебряных изделий, перемалывание зерна, отбеливание ткани, подгорание картофеля, образование налета в чайнике, выпадение снега, прессовка пластика, горение спички
3. |
Сделать задание по Химии 8 класс
Нужно
Необхдимо сделать задание по Химии в течение недели
Задание 1
Требования к оформлению и решению задач по химии
В каком соотношении находятся числа атомов водорода и кислорода в молекуле воды? В каком массовом соотношении находятся водород и кислород в воде? Задание 2
По следующим записям (прочтение химических формул) составьте молекулярные формулы веществ, используя символы и индексы:
№ Прочтение химических формул Молекулярная формула вещества
1 Феррум-бром-три
2 Калий-эн-о-три
3 Алюминий-о-аш-трижды
4 Эс-о-два
5 Аш-два-цэ-о-три Задание 3
Запишите молекулярные формулы веществ с помощью символов и индексов:
№ Описание Молекулярная формула вещества
1 В состав поваренной соли входит один атом натрия и один атом хлора
2 Молекула кислорода состоит из двух атомов кислорода
3 Молекула азотной кислоты состоит из одного атома водорода, одного атома азота и трех атомов кислорода
4 Двухатомная молекула брома
5 В состав питьевой соды входит один атом натрия, один атом водорода, один атом углерода и три атома кислорода Задание 4
Рассчитайте относительную молекулярную массу (Mr) следующих соединений:
№ Соединение Решение Mr
1 PCl5
2 Cl2O7
3 K3PO4
4 Zn(NO3)2
5 Fe(OH)3 Задание 5
Требования к оформлению и решению задач по химии
Задача.

 Атомы А. сохраняются без изменений в химических процессах
2. Молекулы Б. известно 118 видов таких частиц
В. мельчайшие час
Атомы А. сохраняются без изменений в химических процессах
2. Молекулы Б. известно 118 видов таких частиц
В. мельчайшие час
Физические и химические явления — Персональный сайт учителя химии Куликовой Надежды Владимировны
III. Тепловой эффект химической реакции
Д.И. Менделеев указывал: важнейшим признаком всех химических реакций является изменение энергии в процессе их протекания.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Выделение или поглощение теплоты в процессе химических реакций обусловлено тем, что энергия затрачивается на процесс разрушения одних веществ (разрушение связей между атомами и молекулами) и выделяется при образовании других веществ (образование связей между атомами и молекулами).
Энергетические изменения проявляются либо в выделении, либо в поглощении теплоты.
Реакции, протекающие с выделением теплоты, называются экзотермическими (от греч. «экзо» — наружу).
Реакции протекающие с поглощением энергии называются эндотермическими (от латинского «эндо» — внутрь).
Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q).
Экзотермическая реакция:
Исходные вещества → продукты реакций + Q кДж
Эндотермическая реакция:
Исходные вещества → продукты реакций — Q кДж
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Область химии, занимающаяся изучением тепловых эффектов, химических реакций, называетсятермохимией.
Уравнения химических реакций, в которых указан тепловой эффект, называют
Ответьте на вопрос. Чем физические явления отличаются от химиче ских?
Помню, как в школе на уроке химии, я впервые услышал про химические и физические явления.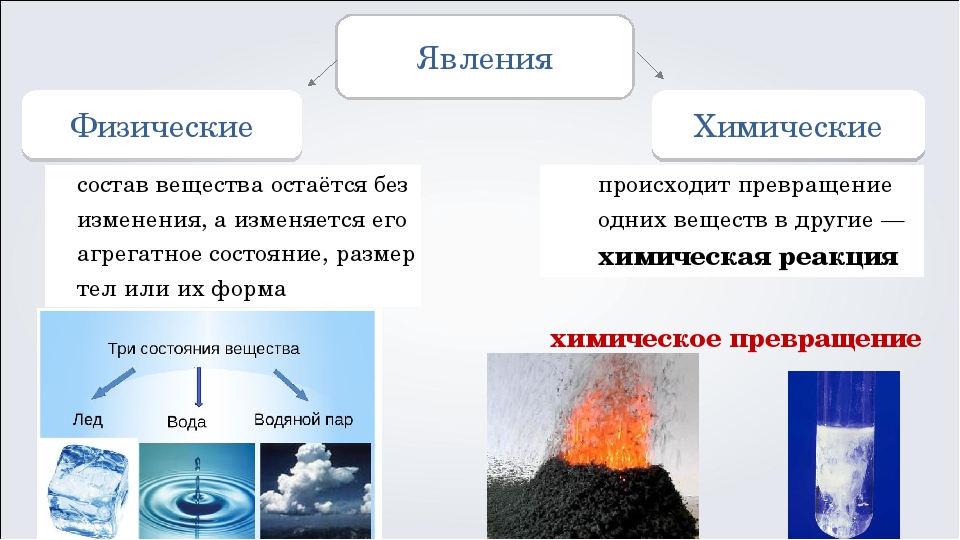 Эта информация меня очень заинтересовала, и я решил для себя разобраться в чем разница между этими понятиями. Возможно, именно эта тема повлияла на то, что я начал изучать химию и поступил на химический факультет. Как бы там ни было, эти явления стали для меня одним из самых больших открытий.
Эта информация меня очень заинтересовала, и я решил для себя разобраться в чем разница между этими понятиями. Возможно, именно эта тема повлияла на то, что я начал изучать химию и поступил на химический факультет. Как бы там ни было, эти явления стали для меня одним из самых больших открытий.
Физические явления
Физические явления — это процессы, при которых исходное вещество не превращается в другое. Это вещество может поменять агрегатное состояние, например: стать из жидкости газом, или изменить форму, но ее структурная формула останется той же. Например, вода в реке, может при похолодании стать льдом или испарится, но это — та же вода. При ковке металла заготовка растягивается, скручивается, но это тоже железо.
Химические явления и их отличие от физических
Химические явления — это процессы, при которых исходное вещество превращается в другое. Таким образом изменяется структурная формула вещества, количество и разновидность атомов элемента. Если на мгновение забыть, что алхимия невозможна, тогда химическое явление можно назвать алхимией, ведь одно вещество превращается в другое. Примером химического явления может быть горение любого вещества, ведь при горении соединение окисляется кислородом. Дерево или целлюлоза с формулой (C6h20O5)n горит, образовывая углекислый газ (СО2) и воду (Н2О). Таким образом, наше исходное вещество целлюлоза поменяло свою структурную формулу, а значит это — химическое явление. Для химических явлений характерно:
Таким образом изменяется структурная формула вещества, количество и разновидность атомов элемента. Если на мгновение забыть, что алхимия невозможна, тогда химическое явление можно назвать алхимией, ведь одно вещество превращается в другое. Примером химического явления может быть горение любого вещества, ведь при горении соединение окисляется кислородом. Дерево или целлюлоза с формулой (C6h20O5)n горит, образовывая углекислый газ (СО2) и воду (Н2О). Таким образом, наше исходное вещество целлюлоза поменяло свою структурную формулу, а значит это — химическое явление. Для химических явлений характерно:
- Появление осадка.
- Изменение цвета.
- Выделение газа.
- Поглощение или выделение теплоты.
Таким образом если оставить ножик под дождем, он покроется ржавчиной и это — химическое явление, ведь чистое железо (Fe) превратится в оксид железа (Fe2O3). Наш ножик из стального цвета станет коричневым, а это один из признаков химического явления.
Наш ножик из стального цвета станет коричневым, а это один из признаков химического явления.
Без химических явлений не существовало бы нашей Вселенной, ведь сама Земля образовалась вследствие миллиардов сложных реакций. И в нашем организме ежесекундно протекают сотни химических явлений, будь то расщепление жиров, или переваривание пищи.
Вещества и их свойства. Физические и химические явления.
Содержание статьи
Разнообразие веществЗа последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние веществаВещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
 Химическая реакция.
Химическая реакция.Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Явления химические — Справочник химика 21
Связные диаграммы совмещенных физико-химических явлений (химические реакции и диффузия в неподвижной среде). Напомним, что в терминах энергетических переменных движущей силой диффузии является не градиент концентрации, а градиент химического потенциала. Для примера рассмотрим случай простой реакции А г В, протекающей в идеальном растворе при наличии одномерной ди( к )узии компонентов в направлении оси ох. Диффузионный поток каждого компонента определяется законом Фика [c.131]
Напомним, что в терминах энергетических переменных движущей силой диффузии является не градиент концентрации, а градиент химического потенциала. Для примера рассмотрим случай простой реакции А г В, протекающей в идеальном растворе при наличии одномерной ди( к )узии компонентов в направлении оси ох. Диффузионный поток каждого компонента определяется законом Фика [c.131] К явлению химической абсорбции тесно примыкает процесс одновременного массопереноса через границу раздела фаз и химической реакции, в котором вблизи границы раздела фаз градиент скорости не равен нулю. [c.115]
Абсорбция СО2 водными растворами карбоната и бикарбоната натрия или калия — процесс, который был исследован рядом авторов. Он представляет практический интерес как метод удаления СО2 из газов и теоретический интерес как легкодоступный для экспериментального исследования явления химической абсорбции. [c.125]
Явление химической индукции известно более ста лет. Его изучали и изучают многие исследователи, так как возникновение индуцированных реакций слулСущность явления состоит в том, что некоторые окислительно-восстановительные реакции не протекают или протекают медленно. Предположим, что в растворе имеются вещества А и С, скорость реакции между которыми равна нулю. [c.374]
Его изучали и изучают многие исследователи, так как возникновение индуцированных реакций слулСущность явления состоит в том, что некоторые окислительно-восстановительные реакции не протекают или протекают медленно. Предположим, что в растворе имеются вещества А и С, скорость реакции между которыми равна нулю. [c.374]
Элемент ФХС есть отдельное явление химическое, механическое, тепловое, диффузионное, электрическое, магнитное. Связь между элементами — это причинно-следственные отношения между явлениями (эффектами). Совокупность элементов ФХС и связей между ними образует структуру ФХС. Структура ФХС имеет ряд особенностей, определяющих специфику химико-технологического процесса как сложной причинно-следственной системы. [c.31]
Предмет и задачи химии. Явления химические и физические. Химические и физические свойства веществ. Химические реакции. [c.7]
Явление химической индукции было подробно изучено Н. А. Шиловым на примере сопряженных реакций окисления. Им было дано объяснение этому явлению. Согласно Н. А. Шилову, химическая индукция объясняется тем, что сопряженные реакции протекают через общие активные промежуточные вещества. [c.234]
Им было дано объяснение этому явлению. Согласно Н. А. Шилову, химическая индукция объясняется тем, что сопряженные реакции протекают через общие активные промежуточные вещества. [c.234]
В данной книге главным образом рассматривается анализ систем газ — жидкость иными словами, явления химической абсорбции. [c.14]
В соответствии с представлениями С. М. Гамзатова, слой I может играть роль мембраны и, следовательно, через него независимо от минерализации поровой воды при определенных условиях (перепаде давления) может просачиваться пресная или опресненная вода. Если такое явление (обратный осмос) будет иметь место, то это приведет к снижению минерализации поровых вод (разбавление). Последнее обусловит новое равновесие — утолщение гидратных оболочек вокруг частиц глинистых минералов, ослабление естественных связей и, в конечном итоге, снижение устойчивости стенок скважин. Видимо, явления химического [c.93]
Поверхностные пленки на твердых телах.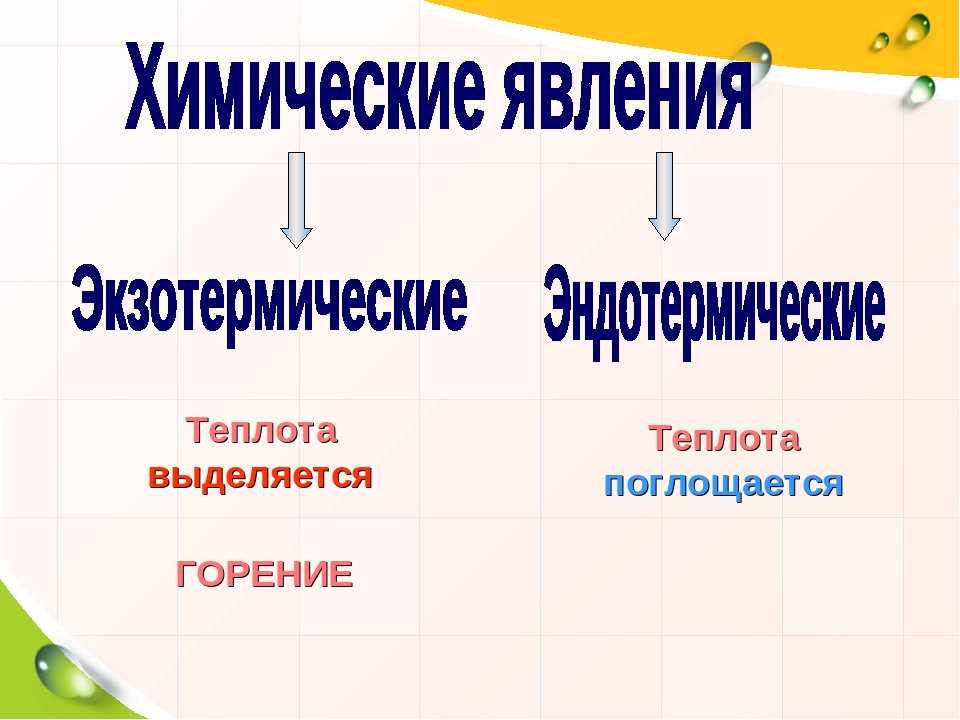 Адсорбция газов на поверхности твердых тел охватывает как явления чисто физической адсорбции, близкой к процессам физической конденсации пара в жидкость, так и явления химической адсорбции. [c.377]
Адсорбция газов на поверхности твердых тел охватывает как явления чисто физической адсорбции, близкой к процессам физической конденсации пара в жидкость, так и явления химической адсорбции. [c.377]
Патерно [27] проинтегрировал дифференциальные уравнения, определяющие явления химического насыщения жидкой фазы для частного случая постоянного состава газовой фазы по длине колонны. Уравнения в интегральной форме хорощо подтверждаются данными, получеными в абсорбере, заполненном упорядоченными шарами. К сожалению, даже для этой сильно упрощенной обстановки, интегральные формы уравнений неявны и требуют для вычислений количества абсорбированного вещества при данном значении № графических решений. Проблема, с другой стороны, сильно упрощается при использовании квазистационарной концепции даже при одновременном учете изменений составов газовой и жидкой фаз. [c.134]
В общем случае необратимых процессов производство энтропии обусловлено как внутренними явлениями (химические реакции, релаксационные явления), так и явлениями переноса (электрического заряда, массы и т. п.). [c.310]
п.). [c.310]
Явление химической индукции возможно только в случае, если обе сопряженные реакции являются сложными, т. е. состоят из нескольких элементарных стадий. [c.234]
Значение адсорбции из растворов в природе и технике. Адсорбция из растворов имеет огромное значение для большинства физико-химических процессов, происходящих в растительных и животных организмах. Явления химических превращений при усвоении питательных веществ обычно начинаются с накопления реагирующих веществ на поверхности природных катализаторов — ферментов. Проникновение веществ в организм через полупроницаемые перегородки также обычно начинается с явления адсорбции, происходящего на поверхности раздела. [c.143]
Для детектирования свободных радикалов имеется и другой магнитный метод, использующий обычный спектрометр ЯМР. Этот метод стал применяться после того, как было открыто явление химически индуцированной динамической поляризации ядер [126, 127]. Если спектр ЯМР снимать в ходе реакции, то одни сигналы могут усиливаться либо в положительном, либо в отрицательном направлении, а другие могут ослабевать. Когда это наблюдается для продукта реакции, это означает, что по крайней мере часть такого продукта образуется через промежуточный свободный радикал [128]. К примеру, возник вопрос, участвуют ли радикальные интермедиаты в реакции обмена между этилиодидом и этиллитием (реакция 12-38). [c.241]
Природа сил притяжения частиц во всех состояниях электрическая, т. е. прямо или косвенно связана с участием электронов. Переход из одного состояния в другое не сопровождается изменением стехиометрического состава вещества, но обязательно связан с большим или меньшим изменением его структуры. В этом смысле переход из одного состояния в другое относится к явлениям химическим. Конечно, здесь, как и всегда, нужно помнить об относительности и условности разграничения, в том числе и разграничения понятий физическое и химическое явление. [c.132]
Явления химического равновесия играют главную роль во всех процессах химической промышленности . [c.180]
Эффективный метод изучения химических реакций, протекающих с промежуточным образованием радикальных пар, основывается на использовании явления так называемой химической поляризации ядер (ХПЯ), о котором вместе с явлением химической поляризации электронов еще будет сказано в главе, посвященной рассмотрению спектроскопии ЭПР. [c.39]
Чрезвычайно широкие возможности для получения активных промежуточных частиц открываются при использовании дополнительных специально подобранных компонентов. Имеется два основных пути использования этих дополнительных компонентов, основанные на двух фундаментальных явлениях химической кинетики — индукции и катализе. [c.305]
Химическая индукция, сопряжение химических реакций — явление, когда одна химическая реакция вызывает или ускоряет (индуцирует) протекание другой реакции, которая в этих условиях не происходит или идет с очень низкой скоростью. Обе реакции называют сопряженными. Явление химической индукции обусловлено тем, что в одной реакции образуются активные промежуточные продукты, вызывающие протекание второй (индуцированной) химической реакции. [c.13]
Сопряженные реакции. Многие химические реакции протекают с участием активных неустойчивых (и потому короткоживущих) промежуточных веществ — атомов, радикалов и т. д. С зтим связано открытое Н. А. Шиловым явление химической индукции, заключающееся в одновременном протекании таких реакций, одна из которых течет лишь в присутствии другой [c.250]
Тем не менее, уравнение (2.3) не может быть строгим, так как оно не предусматривает явления химического насьш1ения, которое рано или поздно должно наступить. Насыщение происходит потому, что при продолжении процесса абсорбции, химический состав жидкой фазы и, следовательно, величина г изменяются со временем. Конечно изменение величины г по мере протекания процесса абсорбции зависит от отдельных рассмотренных процессов. В описании явления такого типа может оказаться полезной концепция квазистационарности. Она предполагает, что в любой [c.32]
Явление химической индукции впервые было исследовано Н. А. Шиловым (1905), который положил начало разработке ее теории. [c.142]
Явление химической индукции впервые было исследовано [c.115]
Адсорбция из растворов имеет огромное значение для большинства физико-химических процессов, происходящих в растительных и животных организмах. Явления химических превращений при усвоении пищи обычно начинаются с накопления реагирующих веществ у поверхности природных катализаторов — ферментов. Проникновение веществ через полупроницаемые перегородки в организме также обыч- [c.53]
Многочисленные исследования показали, что адсорбция из растворов, не осложненная явлениями химической природы, представляет собой обратимый процесс. Как и в случае газов, адсорбция из растворов протекает с большой скоростью, но так как восполнение убыли концентрации в слое, прилегающем к поверхности адсорбента, происходит путем диффузии (которая в растворе протекает медленно), то равновесие между объемом раствора и поверхностью адсорбента устанавливается медленно. Для ускорения достижения равновесия часто приходится прибегать к перемешиванию или встряхиванию раствора, однако такое воздействие мало влияет на скорость адсорбции сильно пористых адсорбентов. [c.289]
В зависимости от внешних условий вещества могут находиться в разных агрегатных состояниях — в газовом, идком, твердом. Прирс да сил притяжения частиц, образующих вещество, во всех состояниях электрическая, т. е. прямо или косвенно связана с участием эл1 .ктронов. Переход из одного агрегатного состояния в другое не сопровождается изменением стехиометрического состава вещества, но обязательно связан с большим или меньшим изменением его структуры. В этом смысле переход из одного состояния в другое относится к явлениям химическим. Конечно, здесь, как и всегда, нужно помнить об относительности и условности разграничения, в том числе и разграничения понятий физическое и химическое явление. [c.99]
Для записи результатов опытов необходимо вести лабораторный журнал (тетрадь с полями для замечаний руководителя) на обложке следует указать фамилию студента, курс, номер группы. Записи в журнале должны быть краткими и четкими. Необходимо отмечать условия проведения данного опыта и наблюдаемые при опыте явления химический процесс следует выражать соответствующими уравнениями. Иногда надо зарисовать (в виде схемы, чертежа) прибор, в котором проводился опыт. [c.7]
Теория жидкого состояния значительно хуже разработана,, чем теория газообразного состояния, и это отчетливо сказывается на уровне теоретической интерпретации явлений химической кинетики в конденсированной фазе. Теория реакций в газовой фазе базируется иа двух следствиях молекулярно-кинетической теории — возможности расчета числа столкновений между реагирующими молекулами и применимости к реагирующей системе максвелл-больцмановского распределения. При переходе к реакциям в растворах приходится рассматривать третий объект — молекулы растворителя. При этом возможны два крайних случая 1) молекулы растворителя не входят в состав активного комплекса, и их взаимодействие с молекулами растворенного вещества сводится к столкновениям н ван-дер-ваальсовому взаимодействию 2) молекулы растворителя входят в состав активного комплекса и в той илн иной мере определяют кинетические свойства последнего. Взаимодействие второго типа, пожалуй, больше относится к каталитическим явлениям и будет рассмотрено ниже. Ограничиваясь первым случаем, рассмотрим, в какой мере методы кинетической теории применимы к реакциям в растворах. Можно лн для подсчета числа столкновений между реагирующими молекулами в растворах использовать газокинетическое уравнение Дать обоснованный ответ на этот вопрос трудно, и приходится ограничиваться критерием практической применимости расчета. Поскольку при изучении реакций в растворах удобно пользоваться значениями концентраций, выраженных в моль1л, газокинетическое выражение для константы скорости запишется в виде [c.181]
В первичной реакции (1) А называется актором, Вх — индуктором, X — активным промежуточным продуктом. В реакции (2) В2 — акцептор, С — конечный устойчивый продукт. Сущность явления химической индукции заключается в том, что образование высокореакционноспособных промежуточных продуктов в первичных реакциях сопровождается значительным уменьшением энергии Гельмгольца (АЛ > 0), обеспечивает возможность протекания других (индуцированных) реакций, в том числе даже сопровождающихся увеличением А (А А > 0), протекание которых становится возможным благодаря участию активных промелсуточных продуктов. Сопряженные реакции играют чрезвычайно важную роль в биологии, так как образование белков и нуклеиновых кислот, протекающее с увеличением энергии Гельмгольца, идет сопряженно с реакцией гидролиза аденозинтрифосфорной кислоты (АТФ), сопровождающейся уменьшением А (АА источником энергии для многообразных химических процессов в клетках. Особо вяжную роль здесь играют ферменты, способствующие полноте использования в индуцируемой реакции свободной энергии индуцирующей. [c.250]
Молекулярно-кинетическое истолкование химических процессов можно встретить в трудах А. М. Бутлерова, А. Кекуле, Н. Н. Бекетова, Л. Мейера. В 1867 г. Л. Пфаундлер применил кинетическую теорию газов к явлениям химического равновесия и к объяснению диссоциации химических соединений. Он развил теорию одновременно совершающихся обратимых реакций как следствие непрерывных изменений состояния молекул . На основе молекулярно-кинетического учения ему удалось показать тесную связь между такими категориями химических равновесий, как процесс диссоциации и реакции двойного обмена. При рассмотрении многих физико-химических явлений и при выводе формул ученые использовали неверную гипотезу, что все молекулы идентичны со всех точек зрения. Между тем, чтобы глубже проникнуть в сущность механизма явления, оказалось необходимым ввести новое цонятие, которое позволило бы более точно и логично подойти к физико-химическому явлению. Эту новую мысль развили Р. Клаузиус, Д. К. Максвелл и Л. Больцман в своих трудах по статистической механике. Новое заключалось в том, что не все мо- [c.329]
Данное определение химических превращений, т. е. химических реакций как превращений, связанных с образованием и (или) разрывом химических связей, как всякое определение реального явления бесконечно сложного мира, несовершенно, неполно. Например, при разбиении атомного или ионного кристалла на более мелкие изменение (разрыв ) химических связей происходит, однако это явление химическим обычно не считается. То же относится к деформации металлического кристалла, возгонке атомного кристалла и т. д. Чтобы все-таки выделить предмет химического исследования, необходимо указать, что химическое изменение сопровождается появлением новых химических индивидов 2. [c.6]
Явление химической нндукции интересно тем, что свободная энергия, выделяющаяся при самопроизвольной реакции, в которой участвует индуктор, может скомпенсировать затрату энергии, необходимой для образования веществ с большим запасом свободной энергии. [c.192]
По термодинамическому признаку. Катализатор может вызывать ЛИИН1 такие процессы, которые могут протекать самопроизвольно, т. е. ие требуют затраты работы реакция идет с уменьшением свободной энергии участвующих веществ. В цепных же реакциях одна реакция, протекающая самопроизвольно, обеспечивает прохождение других реакций, идущих в направлении повьннения свободной энергии частиц. Индуктор является, в противоположность катализатору, источником работы. В этом и заключается явление химической индукции, изученное Шиловым на примере сопряженных реакций окисления. [c.350]
К первой категории исследований в области газо-жидкостных реакций можно отнести работы, в которых выбирались специфические системы не в связи с тем, что они представляли отдельный интерес, а потому, что позволяли проверить некоторые выводы, сделанные на основе теоретического анализа идеализированного явления химической абсорбции. Типичными примерами таких работ является работа Гертиса, ван Менса и Бутае [1], о которой уже упоминалось в главе 5, и Диллона и Перри [2]. Б обеих работах выбран типичный для режима мгновенной реакции процесс абсорбции аммиака растворами уксусной кислоты. Диллон и Перри подтвердили правомерность анализа по относительным вкладам сопротивлений газовой и жидкой фаз в массоперенос, рассмотренный в разделе 9 1. [c.162]
Например, король Шотландии Яков Второй был убит при разрыве пушки в 1460 г. в Роксбурге. В 1645 г. взрыв черного пороха разрушил треть города Бостон и лишил жизни трех человек (этот случай — самый ранний из приводимых в книге [Nash,1976]). В работе [Biasutti,1985] содержатся данные о взрыве в 1769 г. в Брешиа (Италия) 85 т черного пороха, который разрушил 190 домов. Этих примеров, вероятно, достаточно, чтобы говорить о возникновении нового, обусловленного появлением пороха явления — химического взрыва. Новые изобретения XIX в. ввели в обращение более мощные, чем дымный порох, взрывчатые вещества. [c.13]
В настоящее время явление химического транспорта успешно используется в целях глубокой очистки ряда веществ, как простых, так и сложных, а также для получения эпитаксиальных полупроводниковых пленок и монокристаллов. Реагентами, с помощью которых осуществляется перевод очищаемого вещества в транспортируемое соединение, помимо указанных выше оксида углерода (И) и иода служат хлор, бром, галогеноводо-роды, галогениды. Интересно отметить, что при использовании последних процесс переноса обычно протекает через стадию образования соответствующего субгалогенида, т. е. соединения с низшей валентностью. В результате перенос вещества в целом осуществляется за счет реакции диспропорционирования, как это, например, имеет место в случае очистки элементов III— IV групп периодической системы [c.22]
Таким образом, теоретические закономерности из области турбулентных струй оказалось возможным более или менее удовлетворительно иллюстрировать на базе эксперимента с ламинарными струями, турбулизованными вследствие явлений химического сродства. [c.43]
Адсорбция твердыми веществами, по И. Лэнгмюру [17], происходит за счет валентных сил, которыми всегда обладает любая поверхность в силу ее ненасыщенности. Однако за счет химических сил с поверхностью связан лишь первый слой молекул монослой), следующие же слои, образующиеся над поверхностью в виде миниатюрной атмосферы, удерживаются только силами притяжения. Адсорбция монослоем есть, таким образом, явление химическое, и потому она названа хемосорбцией. Поэтому хемосорбция принципиально отличается от обычной, или вандерваальсовой, адсорбции. [c.103]
Па самом деле роль, играемая реакцией 10+, скорее аналогичная роли реакции 3-, чем 11+, поскольку реакция 10+ есть, в сущности, реакцпя диспропорционирова-ния, уничтожающая три свободные валентности и создающая лишь одну новую. Впервые обратили внимание на качественно новую роль, которую может играть эта реакция (как и реакции взаимодействия других активных центров) в нелинейных явлениях химической кинетики, Азатян с сотрудниками [16]. Учет этих явлений особенно важен вблизи пределов воспламенения. [c.274]
Явление химической нндукцни возможно только в случае, если обе сопряженные реакции являются сложными, т. е. состоят из нескольких элементарных стадий. Элементарная реакция не может быть индуцирована другой реакцией. Это вытекает из положения о независимом протекании элементарных реакций, согласно которому константа скорости элементарной реакции не зависит от того, протекают ли од Ювременно в той же системе другие химические процессы. [c.246]
В 1973 г. Рюэль предположил, что некоторые химические реакции, в том числе и реакция Белоусова-Жаботинского, могут протекать хаоттески (явление химической турбулентности), что позднее было подтверждено теоретическими и экспериментальными методами [2]. В качестве одной из моделей таких реакций была предложена модель Гарела-Росслера [3] [c.143]
Достаточно указать, что она определяет равновесие и скорость растворения твердых и жидких веществ, разнообразных химических превращений в растворах и.т. д. Сольватация приводит, с одной стороны, к изменению природы реагирующих частиц (образованию сольватокомплексов, перераспределению ионного заряда, поляризации, блокированию реакционных центров и т. п.), с другой — структуры растворителя и его свойств. Своеобразно проявление сольватации в явлениях химической кинетики. Здесь сольватация исходных веществ, переходного комплекса и продуктов реакции определяет не только скорости и другие кинетические параметры рва кций, но также и их механизмы. Следует отметить, что учет и детальный анализ сольватационного взаимодействия растворителя с переходным комплексом необходим для построения теории реакционной способности молекул и ионов. Так, например, издавна считается, что полярный растворитель благоприятствует протеканию химических реакций, переходный комплекс которых более полярен, чем исходное состояние реагентов. [c.237]
С обоснованием и упрочением идей о существенно различной сродствоем1кости или энергоемкости химических связей, а также с открытием хемосорбции физические и химические теории были отвергнуты. Их рациональные идеи вошли в новые теории катализа в соответствии с одним из утверждений химической теории катализ стал рассматриваться только как явление химического взаимодействия реагентов и катализатора, а в соответствии с физической теорией в учении о катализе получили развитие идеи о роли макроки-нетичеоких факторов. [c.131]
Если диффузия не сопровождается какими-либо побочными явлениями (химическим взаимодействием диффундирующего вещества с студне- и гелеобразователем, адсорбционными и другими процессами), скорость диффузии подчиняется закону Фика (см. диффузию, гл. И), [c.237]
Исходная и основная предпосылка мультиплетной теории связана с представлением о том, что катализ — явление химическое. Поскольку радиус действия валентно-химических сил очень мал, то с достаточной степенью приближения можно считать, что атомы химически взаимодействуют только при соприкосновении, т. е. при своем сближении на расстоянии длины связи. Поэтому в каталитических реакциях должны участвовать не молекулы целиком, а отдельные входящие в них атомы. В реагирующей молекуле теория позволяет выделить группу атрмов, между которыми при реакции [c.70]
Урок на тему: «Физические и химические явления» | Химия
Урок на тему: «Физические и химические явления»
Автор: Подорожная Ирина Владимировна
Организация: ГУ ЛНР «Луганское общеобразовательное учреждение – СОШ №28»
Населенный пункт: ЛНР, г. Луганск
ГУ ЛНР «Луганское общеобразовательное учреждение –
средняя общеобразовательная школа №28»
Конспект урока
по химии
в 8 классе на тему:
«Физические и химические явления»
Урок составлен
учителем химии,
специалистом 2 категории
Подорожной И. В.
Луганск 2017
Цели:
— учебная: закрепить понятия «физические и химические явления», «условия протекания химических реакций», «признаки химических реакций»; ознакомиться с понятием «реакций горения», с условиями и признаками ее протекания;
— развивающая: развить навыки проведения химических реакций, используя правила техники безопасности; развить логическое мышление при сопоставлении физических и химических явлений и установить их сущность; развить познавательную активность и творческие способности обучающихся при выполнении заданий;
— воспитательная: воспитать чувство коллективизма и взаимопонимания при работе в творческих группах; воспитать отношение к химии, как прикладной науке, при изучении применения ряда химических реакций; формирование эстетического вкуса при наблюдении красоты явлений природы, использовании средств искусства для иллюстрации физических и химических явлений.
Тип урока: закрепление знаний, умений, навыков.
Формы работы: доклады учеников, фронтальная беседа, индивидуальная и групповая работа.
Оборудование: компьютер, мультимедийный проектор, карточки с заданиями, картинки с изображением химических и физически явлений, листы формата А2, маркеры, химическая посуда, спиртовка, реактивы (спиртовые растворы фенолфталеина, KI, водные растворы CuSO4, NH4OH, СН3СООН, кристаллические (NH4)2Cr2O7, NaHCO3, сухое горючее), таблетки глюконата кальция, краснокочанная капуста, жидкое моющее средство, вода, картофель.
Ход урока
I. Организационный этап.
II. Проверка домашнего задания.
На прошлом уроке мы с вами познакомились с такими понятиями как физические и химические явления. Давайте вспомним, что о них мы узнали.
Фронтальный опрос..
1. На какие две группы можно разделить все явления?
2. Что такое химические явления?
3. Чем они отличаются от физических?
4. Назовите признаки химических явлений.
5. Приведите примеры физических явлений.
III. Закрепление изученного материала.
Молодцы. Вы уже многое знаете, Но хочу обратиться к словам великого немецкого поэта:
«Мало знать, надо и применять. Мало хотеть, надо и делать».
Гете.
Сегодня мы научимся применять наши знания, научимся распознавать среди огромного многообразия явлений химические, находить их в окружающем нас мире.
В этом нам помогут ребята, ваши одноклассники, которые получили необычное домашнее задние: найти химические явления в окружающем нас мире. Но к решению этой проблем они подошли по-разному.
Доклад первой рабочей группы.
Учитель. Итак, первая группа ребят решила отправиться в волшебную страну Химикандию. Ну что ж, действительно, в этой стране они обязательно должны были найти химические явления. Их проводником их была я, но результаты своих поисков они покажут сами. Ну, что нашли вы химические явления?
Ответ. Нет, мы обнаружили только настоящее волшебство.
Учитель. Ну, что ж давайте вы нас познакомите с вашими находками, а мы с ребятами решим, волшебство это или химические превращения.
Учитель к классу. А вы все внимательно смотрите. Постарайтесь опираясь на ваши знания доказать, что любому волшебству можно найти научное объяснение.
На экране изображение картины Александра Маранова «Аромат цветов».
Учитель. Посмотрите, на эти цветы. Они будто бы порыты корочкой льда. А под силу ли человеку оживить ледяные цветы?
Опыт 1. Ученик 1. Проводит эксперимент «Васильковая роза и розовый василек» [1, с. 400-401].
Для проведения опыта заранее изготавливают из фильтровальной бумаги розу и василек. Бумажную розу надо пропитать раствором медного купороса, а бумажный василек спиртовым раствором фенолфталеина. Красиво разместив влажные цветы в банке, необходимо влить в нее 10 мл нашатырного спирта и закупорить горловину крышкой. Через несколько минут роза станет ярко-синей (васильковой): сульфат меди (II) образует с аммиаком комплексное соединение интенсивно-синего цвета. А василек станет розово-малиновым: индикатор фенолфталеин в щелочной среде окрашивается в малиновый цвет.
Учитель. Беседа с классом.
Ребята, давайте разберемся, действительно ли это волшебство или просто произошла химическая реакция. Как вы думаете? Почему? По какому признаку вы определили, что произошла химическая реакция?
На экране изображение картины Уильяма Тёрнера «Извержение Везувия».
Учитель. Вулканы – мощная сила природы. А может ли человек пробудить вулкан?
Опыт 2. Ученик 2. Проводит эксперимент «Вулкан Беттгера» [1, с. 325-326].
Для его проведения необходимо взять дихромат аммония и насыпать его горкой на термостойкую поверхность (например, кафельную плитку). Сверху делают «кратер», в который помещают небольшой кусочек ваты, смоченный спиртом. Спирт поджигают.
Учитель. Беседа с классом.
Ребята, давайте разберемся, а в этот раз действительно ли было волшебство? Как вы думаете? Почему? По какому признаку вы определили, что произошла химическая реакция?
На экране изображение картины Джани Стрино «Заклинатель змей».
Учитель. Заклинание змей – древнее искусство. Владеют им единицы. А есть ли среди учеников вашего класса заклинатели змей?
Опыт 3. Ученик 3. Проводит эксперимент «Фараоновы змеи»: ученик поджигает сухое горючее, кладет на него несколько таблеток глюконата кальция.
Учитель. Ребята, давайте разберемся, а в этот раз действительно ли было волшебство? Как вы думаете? Почему? По какому признаку вы определили, что произошла химическая реакция?
Вторая рабочая группа.
Учитель. Оказалось, что ребята из второй группы никуда не отправились и даже забыли о полученном здании. И вот вчера они второпях попытались выполнить его, не выходя из дома. Но они так спешили, что могли наделать ошибок. Так что смотрите внимательно, постарайтесь найти ошибки и исправить их.
Ученики 3 и 4. В поисках химических явлений мы оправились на кухню. И вот, что мы обнаружили.
Ученик 3. Проведение эксперимента «Изменение цвета краснокачанной капусты под действием пищевой соды и столового уксуса».
Ученик 4. Проведение эксперимента «Взаимодействие пищевой соды со столовым уксусом».
Ученик 3. Проведение эксперимента «Окрашивание картофеля под действием спиртового раствора KI».
Ученик 4. Смешивает жидкое моющее средство с водой. Пускает мыльные пузыри.
Учитель в ходе беседы с классом определяет, что первые в результате первых трех опытов происходили химические явления, а в результате четвертого – физическое.
Третья рабочая группа.
Ученик 5. Мы тоже времени даром не теряли. И нашли в доме много различных химических явлений. Посмотрите на экран:
Ученики 5 и 6 называют по очереди явления, на экране появляются соответствующие изображения:
— почернело серебряное кольцо в шкатулке;
— мама из молока приготовила простоквашу;
— папа поджарил яичницу;
— я нашел поржавевший гвоздь;
— на кухне закипел чайник;
— мама испекла пирог;
— бабушка зажгла свечу.
Ученик 6. Вот сколько различных химических явлений нам удалось обнаружить. И ни одной ошибки!
Учитель в ходе беседы с классом находит ошибку.
Конечно, наши ребята могут отличить физическое явление от химического. Ошибку они допустили специально, чтоб проверить ваши знания.
Четвертая рабочая группа.
Учитель. Ребята отправились путешествовать по миру. И обнаружили столько разнообразных явлений, что им было очень трудно отличить физические от химических. Давайте им в этом поможем.
После каждой реплики учеников учитель обращает внимание класса на экран с изображением соответствующей картины и в ходе беседы выясняет, о каком явлении идет речь: физическом или химическом.
Ученик 7. Начали мы наше путешествие осенью, и долго любовались пожелтевшей листвой (Исаак Левитан «Золотая осень»).
Ученик 8. Ночью ударил мороз и река, около которой мы разбили лагерь, замерла (А.Н. Шильдер «Зимний лес»).
Ученик 7. Мы побывали в разных странах, и в Германии в Гамбурге увидели удивительный медный памятник Мартину Лютеру, который позеленел от времени (на экране фотография памятника).
Ученик 8. Затем мы попали в жаркие страны, увидели зеленую листву, вспомнили о процессе фотосинтеза (Константин Крыжицкий «Лесная река»).
Учитель в ходе беседы с классом вспоминает, что такое фотосинтез, в чем суть этого процесса.
Ученик 7. На обратном пути мы попали под дождь и промокли (Иван Шишкин «Дождь в дубовом лесу»).
Ученик 8. Для того, чтобы обсохнуть, нам пришлось развести костер (Стивен Лиман «Костер»).
Ученик 7. Утром выглянуло солнышко и высушило лужи (Ефим Волков «Летний день после дождя»).
Ученик 8. На этом наше путешествие окончилось, и мы пришли к вам с отчетом.
Пятая рабочая группа.
Учитель. Ребята оправились в библиотеку. Там они для вас наши литературные загадки. Отгадайте, о каком явлении идет речь.
После выступления каждого ученика в ходе беседы с классом определяется вид явления.
Ученик 9.
…На рукомойнике моём
Позеленела медь.
Но так играет луч на ней,
Что весело глядеть…
А. Ахматова
Ученик 10.
И трещат сухие сучья,
Разгораясь жарко.
Освящая тьму ночную
Далеко и жарко!
И. Суриков
Ученик 11.
Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
Е. Благинина
Ученик 9.
Гвозди гнуться,
Гвозди мнутся,
Гвозди извиваются,
Hад Сеpёжею они
Пpосто издеваются.
В стенку не вбиваются.
Берестов Валентин
Ученик 10.
Серебро, огни и блестки,-
Целый мир
из серебра!
В жемчугах горят березки,
Черно-голые вчера.
Валерий Брюсов
Ученик 11.
Конан Дойль «Этюд в багровых тонах».
Сцена во время первой встречи Шерлока Холмса и Доктора Ватсона.
«В пылу нетерпения он схватил меня за рукав и потащил к своему столу. – Возьмем немножко свежей крови, — сказал он и, уколов длинной иглой свой палец, вытянул пипеткой капельку крови. — Теперь я растворю эту каплю в литре воды. Глядите, вода кажется совершенно чистой. Соотношение количества крови к воде не больше, чем один к миллиону. И все-таки, ручаюсь вам, что мы получим характерную реакцию. — Он бросил в стеклянную банку несколько белых кристалликов и накапал туда какой-то бесцветной жидкости. Содержимое банки мгновенно окрасилось в мутно-багровый цвет, а на дне появился коричневый осадок.»
Учитель.
Проверим, как вы усвоили сегодняшний урок. Возьмите на краю стола листочки с заданием и укажите, о каких явлениях идет речь, поставив знак «+» в соответствующую колонку (приложение 1).
Составление коллажа.
В завершение урока предлагаю применять все знания, полученные на нашем уроке и составить коллаж на тему «Физические и химические явления».
Учитель объединяет учеников в рабочие группы по 5-6 человек и дает задание составить коллаж, используя розданные картинки с изображением химических и физических явлений, лист формата А2 и маркеры.
Коллажи вывешиваются в классе. Ученики получают задание проверить их на наличие ошибок на протяжении недели. Результаты обсуждаются на следующем уроке.
IV. Подведение итогов урока.
V. Домашнее задание: повторить признаки химических реакций, сделать подборку загадок и пословиц о химических и физических явлениях.
Приложение 1.
Фамилия, имя _____________________________
Укажите, о каком явлении идет речь, поставив знак «+» в соответствующую графу.
|
Явление |
Химическое |
Физическое |
|
плавление свинца |
|
|
|
прокисание молока |
|
|
|
образование инея |
|
|
|
горение дров |
|
|
|
гниение дерева |
|
|
|
замерзание воды |
|
|
|
плавление олова |
|
|
|
горение свечи |
|
|
|
образование тумана |
|
|
|
протухание куриного яйца |
|
|
|
образование снежинок |
|
|
|
возгорание спички |
|
|
|
ржавление гвоздя |
|
|
|
испарение бензина |
|
|
|
горение бензина |
|
|
|
почернение серебра |
|
|
|
таяние льда |
|
|
|
плавление парафина |
|
|
|
высыхание луж |
|
|
|
разбился стакан |
|
|
Список использованной литературы.
1. Степин Б., Аликберова Л. Занимательные здания и эффектные опыты по химии. – М.: Дрофа, 2002. – 432 с.
Приложения:
- podorozhnaya-lugansk_36c17.. 20,5 МБ
- podorozhnaya-lugansk.doc.. 82,0 КБ
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горениеПолено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.comПопулярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, называемых продуктами. Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи.Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару.Аммиак — пример основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции. Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы.Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение, производство вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, которые происходят во всех живых системах.
Следует отличать химические реакции от физических изменений.Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH).Таким образом, мы знаем, что произошло химическое изменение или реакция.
Тающий ледТающий лед, водопад Нижнее Чистилище, на притоке реки Соухеган между Мон Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-ГэмпшираИсторический обзор
Концепция химической реакции возникла около 250 лет назад. Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы.Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПервые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов.В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом. Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием в области химических реакций было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ. Такой взгляд на химические реакции точно определяет текущую тему.Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций. Сегодня экспериментальная химия дает бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При создании нового вещества из других веществ химики говорят, что они либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и этот процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS). Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт.Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
Химические явления — обзор
Основы стандартных электродных потенциалов и равновесных потенциалов
Электрохимия касается химических явлений, связанных с разделением зарядов, обычно в жидких средах, таких как растворы. Перенос заряда может происходить однородно в растворе между различными химическими веществами или неоднородно на поверхности электродов в результате окисления или восстановления.Применения чрезвычайно широки. 1 В данной статье речь пойдет об электрохимической коррозии в водных средах.
Относительная легкость окисления металлов при погружении в воду или раствор кислоты была одним из основных строительных блоков для построения таблицы Менделеева. Было обнаружено, что большинство металлов предпочитают существовать в положительной степени окисления. Порядок реакционной способности теперь называется электрохимическим рядом и представляет собой порядок значений электродного потенциала.Теперь мы обсудим эти явления на более фундаментальном уровне.
Электродные потенциалы представляют собой энергию электронов, которая может передаваться от окисленных частиц к восстановленным или наоборот, выраженная в вольтах, и связана с конкретной электродной реакцией, также называемой полуреакцией. Электродные потенциалы имеют обозначение E и выражаются в вольтах (В). Стандартные электродные потенциалы E представляют собой значения этих электродных потенциалов при стандартных условиях, то есть для всех частиц при единичной активности, ai = 1, при 25 ° C и давлении 1 бар.Верхний индекс представляет стандартное состояние, как и для всех термодинамических величин, другим примером является стандартная энергия Гиббса G . Все полуреакции по соглашению записываются как редукции. См. Ссылки. 2,3 для получения дополнительной информации.
Стандартный потенциал электрохимической реакции — это стандартный потенциал гипотетической ячейки, в которой левая половина ячейки на диаграмме ячейки является стандартным водородным электродом (SHE), которому присвоено значение E⦵ = 0.0 В и является эталоном, к которому относятся стандартные потенциалы всех электродных реакций. Правая полуячейка представляет собой исследуемую электродную реакцию. Это соглашение определяет знак значения стандартного электродного потенциала. Поток заряда от одного электрода к другому переносится ионами в растворах электролита, в которые погружены электроды, и, снаружи, проводящими проводами, обычно с электрической нагрузкой.
При записи электрохимической ячейки, соответствующей конкретной реакции, ячейка считывается слева направо.Ячейку можно проиллюстрировать с помощью
Pts | h3g | H + aq∥Zn2 + | Zns
, соответствующих
h3 + Zn2 + ⇌2H + aq + Zn
и полуреакциям с соответствующими E ⦵ значений:
h3⇌2H + aq + 2e − E⦵ = 0,0V
Zn2 ++ 2e − ⇌ZnE⦵ = −0,76V
На этих диаграммах одна вертикальная черта | представляет собой фазовую границу, пунктирная вертикальная черта (┆) представляет собой стык между смешивающимися жидкостями, а двойные пунктирные вертикальные полосы (||) представляют собой жидкостный переход, такой как солевой мостик, в котором любой потенциал жидкого перехода предполагается равным устранено.Функция солевого мостика состоит в том, чтобы просто соединить две полуячейки посредством пути, проводящего раствор, так что может протекать ток. Потенциал ячейки в состоянии равновесия (отсутствие тока) следует измерять с помощью потенциометра.
SHE (E⦵ = 0,0V) состоит из платинового электрода, контактирующего с раствором сольватированных протонов единичной активности и насыщенного газом H 2 с летучестью 1 бар (10 5 Па).
При стандартных условиях потенциал ячейки равен потенциалу правой полуячейки минус потенциал левой полуячейки (из-за того, что потенциалы электродов представлены в виде приведенных в таблице значений), что в данном случае дает E⦵cell, eq = −0.76V.
Энергия Гиббса реакции ячейки, соответствующая этому стандартному потенциалу ячейки, равна
ΔG⦵ = −nFE⦵cell, eq
, где n — число перенесенных электронов, а F — постоянная Фарадея, заряд один моль электронов.
Это уравнение сразу показывает, что чем больше положительное значение потенциала ячейки (или стандартного потенциала электрода), тем больше отрицательное Δ G и тем более вероятно, что окисленные частицы будут восстановлены.И наоборот, чем отрицательнее значение потенциала клетки, тем больше вероятность окисления восстановленных видов. Большинство реакций ион металла / металлический электрод имеют отрицательные значения, наиболее отрицательными являются щелочные металлы группы I, и это отражается в легкости химического и электрохимического окисления самих металлов, что имеет важные последствия для явлений коррозии.
Обычно активности частиц, участвующих в электродных реакциях, не равны единице.Исключение составляют твердые вещества, а также растворитель, которые обычно принимаются равными единице, что обычно является отличным приближением. Адаптация этих соображений к неединичным видам деятельности может быть осуществлена путем применения уравнения Нернста, которое связывает равновесный потенциал со стандартным электродным потенциалом
Eeq = E⦵ + RTnFln∏aOivi∏aRivi
, где ν i — стехиометрические числа каждого вида в электродной реакции и F константа Фарадея.Например, в электродной реакции
PbO2 + 4H ++ 2e − ⇌Pb2 ++ 2h3OE⦵ = + 1.70V
стехиометрическое число PbO 2 и Pb 2 + равно 1, H + равно 4, а n равно 2. Тенденция к снижению по отношению к эталону SHE может значительно отличаться от стандартного значения в соответствии с относительными значениями активности в логарифмическом члене.
Часто бывает полезно использовать концентрации, c i вместо активностей, особенно потому, что количество электронов, переносимых на границе раздела электрод | раствор, прямо пропорционально количеству электронов, а не активности .Число электронов можно напрямую измерить электрохимическими приборами.
Для этой цели уравнение Нернста переписывается как
Eeq = E⦵ + RTnFlnΠOiviΠRivi
, в котором E⦵ — формальный потенциал, зависящий от среды, поскольку он включает члены логарифмического коэффициента активности, а также E ⦵ . Связь между активностями и концентрациями видов выражается как a i = γ i c i , где коэффициент пропорциональности, γ i , является коэффициентом активности.Значение γ i изменяется с концентрацией, поскольку оно отражает результат взаимодействий между химическими частицами, которые мигрируют в растворе, под действием электрического поля между анодом и катодом. Следует помнить, что на деятельность также могут влиять «сторонние» виды, которые не являются частью схемы реакции.
Если окисленные и восстановленные частицы, участвующие в электродной реакции, находятся в равновесии на поверхности электрода, можно непосредственно применить уравнение Нернста.Электродная реакция тогда известна как обратимая реакция, поскольку она подчиняется условию термодинамической обратимости и не зависит от кинетики реакции. Ясно, что применимость уравнения Нернста и, следовательно, обратимость, зависит от времени, отведенного электродной реакции для достижения равновесия.
Экспериментальное определение стандартных электродных потенциалов требует очень тщательных и строгих измерений, а также механизмов, гарантирующих, что активности равны единице, и, в идеале, также следует предусматривать расчет коэффициентов активности для полного понимания.К счастью, стандартный водородный электрод — это почти идеальный электрод сравнения со значениями потенциала, которые меняются всего на десятки микровольт.
Некоторые значения стандартных электродных потенциалов, относящиеся к металлам и их окисленным видам, большинство из которых имеют отношение к коррозионным исследованиям, собраны в Таблице 1 . Можно видеть, что большинство реакций ион металла / металлический электрод имеет отрицательные значения E , что показывает тенденцию металла к окислению, как упоминалось ранее.Важным исключением являются благородные металлы, например золото, платина и серебро. Обширный сборник значений стандартных электродных потенциалов и способов их определения можно найти в работе. 4.
Таблица 1. Выбранные стандартные электродные потенциалы для металлов и других важных электродных реакций в потенциально агрессивной среде
| E ⦵ (В) | |||
|---|---|---|---|
| Ag + + e — ⇌ Ag | + 0.80 | ||
| Al 3 + + 3e — ⇌ Al | — 1,68 | ||
| Au 3 + + 3e — ⇌ Au | + 1,52 | ||
| CO 2 + CO 2 2H + + 2e — ⇌ HCOOH | — 0,11 | ||
| Ca 2 + + 2e — ⇌ Ca | — 2,84 | ||
| Cd 2 + + 2e — Cd | — 0,40 | ||
| Co 2 + + 2e — ⇌ Co | — 0.28 | ||
| Cr2O72− + 14H ++ 6e − ⇌2Cr3 ++ 7h3O | + 1,38 | ||
| Cr 3 + + 3e — ⇌ Cr | — 0,74 | ||
| + 0,34 | |||
| Fe 2 + + 2e — ⇌ Fe | — 0,44 | ||
| Fe 3 + + 3e — ⇌ Fe | 9022 — 0,04|||
| 2H + + 2e — ⇌ H 2 | 0.00 (по определению) | ||
| 2H 2 O + 2e — ⇌ H 2 + 2OH — | — 0,83 | ||
| K + + e — ⇌ K | — 2,93 | ||
| Li + + e — ⇌ Li | — 3,04 | ||
| Mg 2 + + 2e — ⇌ Mg | — 2,36 | ||
| Mn + 2e — ⇌ Mn | — 1.18 | ||
| Na + + e — ⇌ Na | — 2,71 | ||
| Ni 2 + + 2e — ⇌ Ni | — 0,257 | ||
| Ni (OH) 2 + 2e — ⇌ Ni + OH — | — 0,72 | ||
| O 2 + 2H 2 O + 4e — ⇌ 4 OH — | + 0,40 | ||
| O 2 + 4H + + 4e — ⇌ 2H 2 O | + 1.23 | ||
| Pb 2 + + 2e — ⇌ Pb | — 0,13 | ||
| PbO 2 + 4H + + 2e — ⇌ Pb 2 + + 2H 2 O | + 1,70 | ||
| Pt + 2e — ⇌ Pt | + 1,19 | ||
| Sn 2 + + 2e — ⇌ Sn | — 0,14 | 900 + + 2e — ⇌ Sn 2 + | + 0.15 |
| Ti 2 + + 2e — ⇌ Ti | — 1,63 | ||
| Ti 3 + + e — ⇌ Ti 2 + | — 0,37 | ||
| TiO + + e — ⇌ Ti 3 + | + 0,10 | ||
| TiO 2 + H 2 O + 4e — ⇌ Ti + 4OH — | — 1,90 | ||
| В 2 + + 2e — ⇌ В | — 1.13 | ||
| V 3 + + e — ⇌ V 2 + | — 0,26 | ||
| Zn 2 + + 2e — ⇌ Zn | — 0,76 | 12 90n204h 902 — + 2e − ⇌Zn + 4OH− | — 1,29 |
Большинство значений взяты из справ. 4.
Обзор химических реакций — Chemistry LibreTexts
Химические реакции — это процессы, посредством которых химические вещества взаимодействуют с образованием новых химических веществ с различным составом.Проще говоря, химическая реакция — это процесс, при котором реагенты превращаются в продукты. То, как реагируют химические вещества, определяется химическими свойствами элемента или соединения — способами, которыми соединение или элемент претерпевает изменения в составе.
Количественное описание реакций
В мире вокруг нас постоянно происходят химические реакции; все, от ржавой железной ограды до метаболических путей в человеческой клетке, — все это примеры химических реакций.Химия — это попытка классифицировать и лучше понять эти реакции.
Рисунок \ (\ PageIndex {0} \): ржавчина цепи — пример химической реакции.Химическая реакция обычно представлена химическим уравнением, которое представляет переход от реагентов к продуктам. Левая часть уравнения представляет реагенты, а правая часть представляет продукты. Типичная химическая реакция записывается со стехиометрическими коэффициентами, которые показывают относительные количества продуктов и реагентов, участвующих в реакции.За каждым соединением следует в скобках примечание о состоянии соединения 2: (l) для жидкости, (s) для твердого тела, (g) для газа. Символ (водный) также обычно используется для обозначения водного раствора, в котором соединения растворены в воде. Реакция может иметь следующий вид:
\ [\ ce {A (aq) + B (g) \ rightarrow C (s) + D (l)} \ nonumber \]
В приведенном выше примере \ (A \) и \ (B \), известные как реагенты, реагировали с образованием продуктов \ (C \) и \ (D \).
Чтобы написать точное химическое уравнение, должны произойти две вещи:
- Каждый продукт и реагент должны быть записаны с использованием его химической формулы, например.г., \ (H_2 \)
- Количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения. Коэффициенты используются перед химическими формулами, чтобы помочь сбалансировать количество атомов, например,
\ [\ ce {2Mg + O_2 \ rightarrow 2MgO} \ nonumber \]
Пример \ (\ PageIndex {1} \): реакции балансировки
Водород и азот взаимодействуют вместе с образованием газообразного аммиака, запишите химическое уравнение этой реакции.
Решение
Шаг 1: Напишите каждый продукт и реагент, используя его химическую формулу.
\ [\ ce {H_2 + N_2 \ rightarrow NH_3} \ nonumber \]
Шаг 2: Убедитесь, что количество атомов каждого элемента равно с обеих сторон уравнения.
\ [\ ce {3H_2 + N_2 \ rightarrow 2NH_3} \ nonumber \]
Чтобы сбалансировать это уравнение, необходимо использовать коэффициенты. Поскольку в левой части уравнения присутствует только 2 атома азота, к \ (NH_3 \) необходимо добавить коэффициент 2.
Стехиометрия
Коэффициент, который используется для балансировки уравнения, называется стехиометрическим коэффициентом.Коэффициенты говорят нам соотношение каждого элемента в химическом уравнении. Например
\ [\ ce {2Mg + O_2 \ rightarrow 2MgO} \ nonumber \]
означает
- 2 моля MgO производится на каждые 2 моля израсходованного Mg.
- На каждый 1 моль израсходованного O 2 образуется 2 моля MgO.
Когда все реагенты реакции полностью израсходованы, реакция протекает в идеальных стехиометрических пропорциях. Однако часто реакция протекает не в идеальных стехиометрических пропорциях, что приводит к ситуации, когда полностью израсходуется один реагент, но остается некоторое количество другого реагента.Реагент, который полностью израсходован, называется ограничивающим реагентом, и он определяет, сколько продуктов будет произведено.
Пример \ (\ PageIndex {2} \): ограничивающий реагент
4,00 г газообразного водорода в смеси с 20,0 г газообразного кислорода. Сколько граммов воды получается?
Решение
\ [n (H_2) = \ dfrac {4g} {(1,008 \ times2) г / моль} = 1,98 моль \]
Таким образом, теоретически требуется 0,99 моль \ (O_2 \)
n (O 2 ) = n (H 2 ) * (1 моль O 2 /2 моль H 2 ) = 0.99 моль
m (O 2 ) = n (O 2 ) * (16 г / моль * 2) = 31,7 г O 2
Потому что \ (O_2 \) имеет только 20,0 г, что меньше требуемой массы. Это ограничение.
Часто реагенты не реагируют полностью, что приводит к образованию меньшего количества продукта, чем ожидалось. Количество продукта, которое, как ожидается, будет образовано из химического уравнения, называется теоретическим выходом. Количество продукта, которое образуется во время реакции, и есть фактический выход. Для определения процентной доходности:
Процентная доходность = фактическая доходность / теоретическая доходность X 100%
Химические реакции происходят не только в воздухе, но и в растворах.В растворе растворитель — это растворенное соединение, а растворенное вещество — это соединение, в котором растворен растворитель. Молярность раствора — это количество молей растворителя, деленное на количество литров раствора.
\ [\ Molarity = \ dfrac {\ text {количество растворенного вещества (моль)}} {\ text {объем раствора (л)}} \]
\ [\ M = \ dfrac {n} {V} \]
Пример \ (\ PageIndex {3} \): концентрации
100,0 г NaCl растворяют в 50,00 мл воды. Какая молярность раствора?
Решение
а) Найдите количество растворенного вещества в молях.
100,0 г / (22,99 г / моль + 35,45 г / моль) = 1,711 моль
б) Перевести мл в л.
50,00 мл = 0,05000 л
c) Найдите молярность
1,711 моль / 0,05000 л = 34,22 моль / л
Физические изменения в ходе химических реакций
Физическое изменение — это изменение физических свойств. Физические изменения обычно происходят во время химических реакций, но не меняют природу веществ. Наиболее частыми физическими изменениями во время реакций являются изменение цвета, запаха и выделение газа.Однако при физических изменениях могут не произойти химические реакции.
Типы химических реакций
Осаждение или реакция двойного замещения
Реакция, которая происходит, когда водные растворы анионов (отрицательно заряженные ионы) и катионов (положительно заряженные ионы) объединяются с образованием нерастворимого соединения, называется осаждением. Нерастворимое твердое вещество называется осадком, а оставшаяся жидкость — супернатантом. См. Рисунок 2.1
Рисунок \ (\ PageIndex {1} \)Пример из реальной жизни: белый осадок, образовавшийся в результате кислотного дождя на мраморной статуе:
\ [CaCO_3 (вод.) + H_2SO_4 (вод.) \ Стрелка вправо CaSO_4 (s) + H_2O (l) + CO_2 (g) \ nonumber \]
Пример \ (\ PageIndex {4} \): Осадки
Примером реакции осаждения является реакция между нитратом серебра и иодидом натрия.Реакция представлена химическим уравнением:
AgNO 3 (водн.) + NaI (водн.) → AgI (т.) + NaNO 3 (водн.)
Поскольку все вышеперечисленные частицы находятся в водных растворах, они записываются как ионы в форме:
Ag + + NO 3 — (водн.) + Na + (водн.) + I — (водн.) → AgI (s) + Na + (водн.) + NO 3 — (водн.)
Ионы, которые появляются по обе стороны уравнения, называются ионами-наблюдателями.Эти ионы не влияют на реакцию и удаляются с обеих сторон уравнения, чтобы получить итоговое ионное уравнение, как написано ниже:
Ag + (водн.) + I — (водн.) → AgI (s)
В этой реакции твердое вещество AgI известно как осадок. Образование осадка — один из многих индикаторов того, что произошла химическая реакция.
Кислотно-основная реакция или реакция нейтрализации
Реакция нейтрализации происходит при смешивании кислоты и основания.Кислота — это вещество, которое производит ионы H + в растворе, тогда как основание — это вещество, которое производит ионы OH — в растворе. Типичная кислотно-основная реакция дает ионное соединение, называемое солью и водой . Типичная кислотно-основная реакция — это реакция между соляной кислотой и гидроксидом натрия. Эта реакция представлена уравнением:
\ [\ ce {HCl (водн.) + NaOH (водн.) \ Rightarrow NaCl (водн.) + H_2O (l)} \ nonumber \]
В этой реакции \ (HCl \) — кислота, \ (NaOH \) — основание, а \ (NaCl \) — соль.Пример из реальной жизни: пищевая сода реагирует с уксусом — это реакция нейтрализации.
Видео : Реакция уксуса и пищевой соды с объяснением
Окислительно-восстановительные (окислительно-восстановительные) реакции
Окислительно-восстановительная реакция происходит, когда степень окисления атомов, участвующих в реакции, изменяется. Окисление — это процесс увеличения степени окисления атома, а восстановление — это процесс уменьшения степени окисления атома.Если степени окисления каких-либо элементов в реакции изменяются, реакция является окислительно-восстановительной реакцией. Атом, который подвергается окислению, называется восстановителем, а атом, который подвергается восстановлению, называется окислителем. Примером окислительно-восстановительной реакции является реакция между газообразным водородом и газообразным фтором:
\ [H_2 (g) + F_2 (g) \ rightarrow 2HF (g) \ label {redox1} \]
В этой реакции водород окисляется со степени окисления от 0 до +1 и, таким образом, является восстановителем.Фтор восстанавливается от 0 до -1 и, таким образом, является окислителем.
Рисунок \ (\ PageIndex {2} \): Рисунок: В окислительно-восстановительной реакции уравнения \ (\ ref {redox1} \) молекула \ (H_2 \) отдает электроны \ (F_2 \), что приводит к двум \ (HF \ ) молекулыПример из реальной жизни: срезанная поверхность яблока становится коричневатой после длительного пребывания на воздухе.
Видео: Почему яблоки коричневеют?
Реакция горения
Реакция горения — это тип окислительно-восстановительной реакции, во время которой топливо вступает в реакцию с окислителем, что приводит к выделению энергии в виде тепла.Такие реакции являются экзотермическими, что означает, что во время реакции выделяется энергия. Эндотермическая реакция — это реакция с поглощением тепла. В типичной реакции горения в качестве источника топлива используется углеводород, а в качестве окислителя — газообразный кислород. Продуктами такой реакции будут \ (CO_2 \) и \ (H_2O \).
\ [C_xH_yO_z + O_2 \ rightarrow CO_2 + H_2O \; \; \; \ text {(несимметричный)} \]
Такой реакцией будет горение глюкозы в следующем уравнении
\ [C_6H_ {12} O_6 (s) + 6O_2 (g) \ rightarrow 6CO_2 (g) + 6H_2O (g) \]
Пример из жизни: взрыв; жжение.
Видео : Реакции горения бывают разными. Вот коллекция различных примеров, каждый из которых требует кислорода, энергии активации и, конечно же, топлива
.Реакции синтеза
Реакция синтеза происходит, когда одно или несколько соединений объединяются с образованием сложного соединения. Ниже проиллюстрировано простейшее уравнение реакции синтеза.
Примером такой реакции является реакция серебра с газообразным кислородом с образованием оксида серебра:
\ [2Ag (s) + O_2 (g) \ rightarrow 2AgO (s) \]
Пример из реальной жизни: газообразный водород сжигается на воздухе (реагирует с кислородом) с образованием воды:
\ [2H_2 (г) + O_2 (г) \ стрелка вправо 2H_2O (л) \]
Реакция разложения
Реакция разложения противоположна реакции синтеза.Во время реакции разложения более сложное соединение распадается на несколько более простых соединений. Классическим примером этого типа реакции является разложение перекиси водорода на кислород и газообразный водород:
\ [H_2O_2 (l) \ вправо H_2 (г) + O_2 (г) \]
Рисунок \ (\ PageIndex {3} \): Молекула AB распадается на A и BРеакции однократного замещения
Тип окислительно-восстановительной реакции, в которой элемент в соединении заменяется другим элементом.
Пример такой реакции:
\ [Cu (s) + AgNO_3 (водн.) \ Стрелка вправо Ag (s) + Cu (NO_3) _2 (водн.) \]
Это тоже окислительно-восстановительная реакция.
Проблемы
1) C 3 H 6 O 3 + O 2 → CO 2 (г) + H 2 O (г)
а) Что это за реакция?
б) экзотермический или эндотермический? Объяснять.
2) Учитывая окислительно-восстановительную реакцию:
Fe (s) + CuSO 4 (водн.) → FeSO 4 (водн.) + Cu (s)
a) Какой элемент является окислителем, а какой такое восстановитель?
б) Как изменяется степень окисления этих веществ?
3) Учитывая уравнение:
AgNO3 (водн.) + KBr (водн.) → AgBr (s) + KNO 3 (водн.)
a) Какова чистая ионная реакция?
б) Какие виды являются ионами-наблюдателями?
4) 2 HNO 3 (водн.) + Sr (OH) 2 (водн.) → Sr (NO 3 ) 2 (водн.) +2 H 2 O (л)
а ) Какой вид в этой реакции является кислотой, а какой — основанием?
б) Какого вида соль?
c) Если используются 2 моля HNO3 и 1 моль Sr (OH) 2, получается 0.85 моль Sr (NO3) 2, каков процентный выход (по отношению к молям) Sr (NO3) 2?
5) Определите тип следующих реакций:
a) Al (OH) 3 (водн.) + HCl (водн.) → AlCl 3 (водн.) + H 2 O (l)
b ) MnO 2 + 4H + + 2Cl — → Mn 2 + + 2H 2 O (л) + Cl 2 (г)
c) P 4 (т) + Cl 2 (г) → PCl 3 (л)
г) Ca (т) + 2H 2 O (л) → Ca (OH) 2 (водн.) + H 2 (г )
д) AgNO3 (водн.) + NaCl (водн.) → AgCl (т.) + NaNO 3 (водн.)
Решения
1a) Это реакция горения
1b) Экзотермичность, потому что реакции горения выделяют тепло
2a) Cu — окислитель, Fe — восстановитель
2b) Fe изменяется от 0 до +2, а Cu изменяется от +2 до 0.
3a) Ag + (водн.) + Br — (водн.) → AgBr (s)
3b) Ионы-зрители — это K + и NO 3 —
4a) HNO 3 — кислота, а Sr (OH) 2 — основание
4b) Sr (NO 3 ) 2 — соль
4c) Согласно стехиометрическим коэффициентам теоретический выход Sr (NO 3 ) 2 составляет один моль. Фактический выход составил 0,85 моль.Следовательно, процентная доходность:
.(0,85 / 1,0) * 100% = 85%
5a) Кислотно-щелочная
5b) Окисление-восстановление
5c) Синтез
5d) Реакция одиночного замещения
5e) Реакция двойного замещения
Самый быстрый словарь в мире: Vocabulary.com
химическое явление любое природное явление, связанное с химией
физическое явление природное явление, связанное с физическими свойствами материи и энергии
механическое явление физическое явление, связанное с равновесием или движением предметов
геологическое явление: природное явление, связанное со структурой или составом земли
оптическое явление физическое явление, связанное со светом или с его участием
электрическое явление физическое явление, связанное с электричеством
Феномен: любое состояние или процесс, известный через органы чувств
природные явления Все неискусственные явления
химический элемент любое из более чем 100 известных веществ (из которых 92 встречаются в природе), которые не могут быть разделены на более простые вещества и которые по отдельности или в комбинации составляют все вещество
психический феномен Явления, которые кажутся противоречащими физическим законам и предполагают возможность причинной связи психическими процессами
органическое явление природное явление с участием живых растений и животных
химическое обозначение обозначение, используемое химиками для выражения технических фактов в химии
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
химическое машиностроение отрасль машиностроения, которая занимается проектированием, строительством и эксплуатацией установок и оборудования, используемых в промышленных химических процессах
Феномен Тарчанова — изменение электрических свойств кожи в ответ на стресс или тревогу; можно измерить либо путем регистрации электрического сопротивления кожи, либо путем регистрации слабых токов, генерируемых телом
химическая формула: обозначение вещества с использованием обозначений составляющих его элементов
Процесс химического изменения, определяемый составом и структурой веществ
химическая реакция процесс, в котором вещества превращаются в другие
эпифеномен вторичный феномен, являющийся побочным продуктом другого явления
Явления NGSS — Пример научного явления
Считается ли это химической реакцией?
Откуда мы знаем?
Какие химические вещества?
Почему они реагируют?
Откуда берется энергия?
Куда уходит энергия?
Как выпускается?
Как это хранилось в первую очередь?
Есть что-нибудь о материале?
Могут ли вопросы Crosscutting Concept помочь нам в этом разобраться?
1.Какие паттернов я замечаю в этом явлении?
2. Каковы границы этого явления? Каковы его компоненты и как они взаимодействуют с ?
3. Что происходит на ненаблюдаемых уровнях от до , вызывает наблюдаемых функций или процессов?
4. Какая шкала или шкалы объясняют это явление и как я могу описать его количественно ?
5.Каким образом энергия и / или материя проникают в, из или в границы явления?
6. Как структура явления (или его компонентов) соотносится с его функцией ?
7. При каких условиях это явление стабильно ? При каких условиях меняет ?
(Список исходил от блестящего педагога Хизер Майло !!)
Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом. Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)
Твердые тела могут состоять из молекул или представлять собой протяженные структуры с повторяющимися субъединицами (например, кристаллы). (MS-PS1-1)
Вещества химически реагируют характерным образом.В химическом процессе атомы, из которых состоят исходные вещества, перегруппировываются в разные молекулы, и эти новые вещества имеют свойства, отличные от свойств реагентов. (MS-PS1-2), (MS-PS1-3), (MS-PS1-5)
Общее количество атомов каждого типа сохраняется, и, таким образом, масса не изменяется. (MS-PS1-5)
Некоторые химические реакции выделяют энергию, другие накапливают энергию. (MS-PS1-6)
Термин «тепло», используемый в повседневном языке, относится как к тепловой энергии (движению атомов или молекул внутри вещества) и передача этой тепловой энергии от одного объекта к другому.В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4)
Температура системы пропорциональна средней внутренней кинетической энергии и потенциальной энергии на атом или молекулу (в зависимости от того, что является подходящим строительным блоком для материала системы). Детали этой связи зависят от типа атома или молекулы и взаимодействия между атомами в материале.Температура не является прямым показателем общей тепловой энергии системы. Полная тепловая энергия (иногда называемая полной внутренней энергией) системы зависит от температуры, общего числа атомов в системе и состояния материала. (вторичный по отношению к MS-PS1-4)
Что за наука стоит за этим ?? Примечание: не смотрите сюда, пока не попробуете написать свои собственные объяснения! — http://jchemed.chem.wisc.edu/blog/how-does-orange-peel-pop-balloon-chemistry-course
Ожидаемые характеристики
MS-PS1-2.
Анализируйте и интерпретируйте данные о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. [Уточнение: Примеры реакций могут включать сжигание сахара или стальной ваты, реакцию жира с гидроксидом натрия и смешивание цинка с хлористым водородом.] [ Граница оценки: Оценка ограничивается анализом следующих свойств: плотность, плавление точка, температура кипения, растворимость, воспламеняемость и запах.]
Управление химическими реакциями с помощью силы
Рибас-Арино, Дж. И Маркс, Д. Ковалентная механохимия: теоретические концепции и вычислительные инструменты с приложениями к молекулярной наномеханике. Chem. Ред. 112 , 5412–5487 (2012).
CAS PubMed Google Scholar
Турро Н. Дж., Рамамурти В. и Скайано Дж. К. Принципы молекулярной фотохимии (Univ.Sci. Книги, 2009).
Google Scholar
Бард, А. Дж. И Фолкнер, Л. Р. Электрохимические методы: основы и приложения 2-е изд. (Wiley, 2001).
Google Scholar
Бейер М. и Клаузен-Шауманн Х. Механохимия: механическая активация ковалентных связей. Chem. Ред. 105 , 2921–2948 (2005).
CAS PubMed Google Scholar
Эрнандес, Дж. Г. и Больм, К. Изменение селективности продукта с помощью механохимии. J. Org. Chem. 82 , 4007–4019 (2017).
CAS PubMed Google Scholar
Мэй, П. А. и Мур, Дж. С. Механохимия полимеров: методы создания молекулярной силы с помощью вытяжных потоков. Chem.Soc. Ред. 42 , 7497–7506 (2013).
CAS PubMed Google Scholar
Рибас-Арино, Дж., Шига, М. и Маркс, Д. Механохимическая трансдукция внешних сил на механофоры. J. Am. Chem. Soc. 132 , 10609–10614 (2010).
CAS PubMed Google Scholar
Рибас-Арино, Дж., Шига, М.И Маркс Д. Понимание ковалентной механохимии. Angew. Chem. Int. Эд. 48 , 4190–4193 (2009).
CAS Google Scholar
Онг, М. Т., Лейдинг, Дж., Тао, Х., Виршуп, А. М. и Мартинес, Т. Дж. Динамика первых принципов и пути минимальной энергии для механохимического раскрытия цикла циклобутена. J. Am. Chem. Soc. 131 , 6377–6379 (2009).
CAS PubMed Google Scholar
Хикенбот, К.Р. и др. . Смещение путей реакции с помощью механической силы. Природа 446 , 423–427 (2007).
CAS PubMed Google Scholar
Ленхардт, Дж. М., Блэк, А. Л. и Крейг, С. Л. gem -Дихлорциклопропаны как многочисленные и эффективные механофоры в сополимерах полибутадиена при механическом воздействии. J. Am. Chem. Soc. 131 , 10818–10819 (2009).
CAS PubMed Google Scholar
Ленхардт, Дж.М. и др. . Улавливание бирадикального переходного состояния за счет механохимического расширения полимера. Наука 329 , 1057–1060 (2010).
CAS PubMed Google Scholar
Клюкович Х.М. и др. . Улавливание карбонилилидов за счет изменения основной цепи полимера. J. Am. Chem. Soc. 134 , 9577–9580 (2012).
CAS PubMed Google Scholar
Хуанг, З.& Булатов, Р. Хемомеханика: химическая кинетика многомасштабных явлений. Chem. Soc. Ред. 40 , 2359–2384 (2011).
CAS PubMed Google Scholar
Ладентин, Дж. Н. и др. . Силовая таутомеризация в отдельной молекуле. Nat. Chem. 8 , 935–940 (2016).
CAS PubMed Google Scholar
Шулер, Б. и др. . Обратимая циклизация Бергмана посредством атомной манипуляции. Nat. Chem. 8 , 220–224 (2016).
CAS PubMed Google Scholar
Павличек, Н. и др. . Синтез и характеристика триангулена. Nat. Нанотехнология 12 , 308–311 (2017).
Google Scholar
Павличек, Н.И Гросс, Л. Генерация, манипулирование и характеризация молекул с помощью атомно-силовой микроскопии. Nat. Rev. Chem. 1 , 11 (2017).
Google Scholar
Нойман, К. и Надь, А. Силовая спектроскопия одиночных молекул: оптический пинцет, магнитный пинцет и атомно-силовая микроскопия. Nat. Методы 5 , 491–505 (2008).
CAS PubMed PubMed Central Google Scholar
Клаузен-Шауманн, Х., Зейтц, М., Краутбауэр, Р. и Гауб, Х. Э. Силовая спектроскопия с отдельными биомолекулами. Curr. Opin. Chem. Биол. 4 , 524–530 (2000).
CAS PubMed Google Scholar
Stauch, T. & Dreuw, A. Успехи в квантовой механохимии: методы электронной структуры и силовой анализ. Chem. Ред. 116 , 14137–14180 (2016).
CAS PubMed Google Scholar
Гранбуа, М., Бейер, М., Риф, М., Клаузен-Шауман, Х. и Гауб, Х. Э. Насколько прочна ковалентная связь? Наука 283 , 1727–1730 (1999).
CAS PubMed Google Scholar
Маршалек П. Э. и Дюфрен Ю. Ф. Растяжение отдельных полисахаридов и белков с использованием атомно-силовой микроскопии. Chem. Soc. Ред. 41 , 3523–3534 (2012).
CAS PubMed Google Scholar
Риф, М., Oesterhelt, F., Heymann, B. & Gaub, H.E. Силовая спектроскопия одиночных молекул на полисахаридах с помощью атомно-силовой микроскопии. Наука 275 , 1295–1297 (1997).
CAS PubMed Google Scholar
Ли, Х. Б. и др. . Одномолекулярная силовая спектроскопия полисахаридов методом АСМ — наномеханический отпечаток α- (1,4) -связанных полисахаридов. Chem. Phys. Lett. 305 , 197–201 (1999).
CAS Google Scholar
Маршалек, П. Э., Оберхаузер, А. Ф., Панг, Ю. П. и Фернандес, Дж. М. Эластичность полисахарида, определяемая переходами кресло-лодочка глюкопиранозного кольца. Природа 396 , 661–664 (1998).
CAS PubMed Google Scholar
Маршалек, П. Э., Ли, Х. и Фернандес, Дж. М. Снятие отпечатков пальцев на полисахаридах с помощью атомно-силовой микроскопии одиночных молекул. Nat. Biotechnol. 19 , 258–262 (2001).
CAS PubMed Google Scholar
Маршалек, П. Э., Ли, Х., Оберхаузер, А. Ф. и Фернандес, Дж. М. Переходы между креслом и лодкой в одиночных молекулах полисахарида, наблюдаемые с помощью АСМ с нарастанием силы. Proc. Natl Acad. Sci. США 99 , 4278–4283 (2002).
CAS PubMed Google Scholar
Валяев, А., Lim, D. W., Oas, T. G., Chilkoti, A. & Zauscher, S. Индуцированная силой изомеризация пролила цис — транс в эластиноподобных полипептидах. J. Am. Chem. Soc. 129 , 6491–6497 (2007).
CAS PubMed Google Scholar
Rognoni, L., Most, T., Zoldak, G. & Rief, M. Зависимая от силы кинетика изомеризации высококонсервативного переключателя пролина модулирует механочувствительную область филамина. Proc. Natl Acad. Sci. США 111 , 5568–5573 (2014).
CAS PubMed Google Scholar
Hugel, T. и др. . Одномолекулярный оптомеханический цикл. Наука 296 , 1103–1106 (2002).
PubMed Google Scholar
Smith, S. B., Cui, Y. & Bustamante, C. Чрезмерное растяжение B-ДНК: эластичный ответ отдельных двухцепочечных и одноцепочечных молекул ДНК. Наука 271 , 795–799 (1996).
CAS Google Scholar
Бустаманте, К., Смит, С. Б., Липхард, Дж. И Смит, Д. Исследования одномолекулярных соединений в механике ДНК. Curr. Opin. Struct. Биол. 10 , 279–285 (2000).
CAS PubMed Google Scholar
Бьянко, П., Бонджини, Л., Мелли, Л., Долфи, М. и Ломбарди, В.Пиконьютон-миллисекундные силовые шаги раскрывают кинетику перехода и механизм удлинения двухцепочечной ДНК. Biophys. J. 101 , 866–874 (2011).
CAS PubMed PubMed Central Google Scholar
Риф М., Клаузен-Шауманн Х. и Гауб Х. Э. Последовательно-зависимая механика отдельных молекул ДНК. Nat. Struct. Биол. 6 , 346–349 (1999).
CAS PubMed Google Scholar
Вудсайд, М.Т. и др. . Прямое измерение полного, зависимого от последовательности пейзажа фолдинга нуклеиновой кислоты. Наука 314 , 1001–1004 (2006).
CAS PubMed PubMed Central Google Scholar
Вудсайд, М. Т. и др. . Наномеханические измерения зависимых от последовательности ландшафтов складывания шпилек из одной нуклеиновой кислоты. Proc. Natl Acad. Sci. США 103 , 6190–6195 (2006).
CAS PubMed Google Scholar
Маршалек, П. Э. и др. . Промежуточные звенья механического разворачивания в модулях титина. Природа 402 , 100–103 (1999).
CAS PubMed Google Scholar
Lu, H. & Schulten, K. Ключевое событие в силовом разворачивании иммуноглобулиновых доменов Титина. Biophys. Дж. 79 , 51–65 (2000).
CAS PubMed PubMed Central Google Scholar
Каррион-Васкес, М. и др. . Механическое и химическое разворачивание одного белка: сравнение. Proc. Natl Acad. Sci. США 96 , 3694–3699 (1999).
CAS PubMed Google Scholar
Hughes, M. L. и Dougan, L.Физика вытягивания полипротеинов: обзор силовой спектроскопии одиночных молекул с использованием АСМ для изучения разворачивания белков. Rep. Prog. Phys. 79 , 076601 (2016).
PubMed Google Scholar
Вальбуэна, А. и др. . О замечательной механостабильности каркасов и мотиве механического зажима. Proc. Natl Acad. Sci. США 106 , 13791–13796 (2009).
CAS PubMed Google Scholar
Риф, М., Gautel, M., Oesterhelt, F., Fernandex, J.M. & Gaub, H.E. Обратимое разворачивание индивидуальных иммуноглобулиновых доменов тайтина с помощью AFM. Наука 276 , 1109–1112 (1997).
CAS PubMed Google Scholar
Келлермайер, М. С., Смит, С. Б., Гранзье, Х. Л. и Бустаманте, К. Переходы сворачивания-разворачивания в одиночных молекулах тайтина, характеризуемые с помощью лазерного пинцета. Наука 276 , 1112–1116 (1997).
CAS PubMed Google Scholar
Каррион-Васкес, М. и др. . Механическая стабильность убиквитина зависит от сцепления. Nat. Struct. Биол. 10 , 738–743 (2003).
CAS PubMed Google Scholar
Броквелл, Д. Дж. и др. . Геометрия вытягивания определяет механическое сопротивление β-листового белка. Nat. Struct. Биол. 10 , 731–737 (2003).
CAS PubMed Google Scholar
Дитц, Х., Беркемайер, Ф., Бертц, М. и Риф, М. Анизотропная деформационная реакция отдельных белковых молекул. Proc. Natl Acad. Sci. США 103 , 12724–12728 (2006).
CAS PubMed Google Scholar
Штирнеманн, Г., Канг, С. Г., Чжоу, Р. Х. и Берн, Б. Дж. Чем силовое развертывание отличается от химической денатурации. Proc. Natl Acad. Sci. США 111 , 3413–3418 (2014).
CAS Google Scholar
Беркович Р. и др. . Предел скорости эластичного ответа белка зависит от привязи. Proc. Natl Acad. Sci. США 109 , 14416–14421 (2012).
CAS PubMed Google Scholar
Schoeler, C. и др. . Картирование распространения механической силы через биомолекулярные комплексы. Nano Lett. 15 , 7370–7376 (2015).
CAS PubMed PubMed Central Google Scholar
Stacklies, W., Vega, M.C., Wilmanns, M. & Grater, F. Механическая сеть в иммуноглобулине тайтин на основе анализа распределения сил. PLoS Comput. Биол. 5 , e1000306 (2009).
PubMed PubMed Central Google Scholar
Шлирф, М., Ли, Х. и Фернандес, Дж. М. Кинетика разворачивания убиквитина, захваченного с помощью одномолекулярных методов принудительного зажима. Proc. Natl Acad. Sci. США 101 , 7299–7304 (2004).
CAS PubMed Google Scholar
Brujic, J., Hermans, R. I., Garcia-Manyes, S., Walther, K. A. и Fernandez, J. M. Анализ распределения полипротеина во времени с использованием спектроскопии с зажимом силы. Biophys.J. 92 , 2896–2903 (2007).
CAS PubMed PubMed Central Google Scholar
Garcia-Manyes, S., Brujic, J., Badilla, C. L. и Fernandez, J. M. Спектроскопия с силовым зажимом монобелковых мономеров выявляет индивидуальные пути разворачивания и сворачивания I27 и убиквитина. Biophys. J. 93 , 2436–2446 (2007).
CAS PubMed PubMed Central Google Scholar
Ланнон, Х., Vanden-Eijnden, E. & Brujic, J. Методы анализа силы-зажима придают наивысший рейтинг кинетике растянутого экспоненциального разворачивания в убиквитине. Biophys. J. 103 , 2215–2222 (2012).
CAS PubMed PubMed Central Google Scholar
Куо Т. Л. и др. . Исследование статического беспорядка в кинетике Аррениуса с помощью силовой спектроскопии одиночных молекул. Proc. Natl Acad. Sci. США 107 , 11336–11340 (2010).
CAS PubMed Google Scholar
Гарсия-Манес, С., Куо, Т. Л. и Фернандес, Дж. М. Противопоставление индивидуальных реактивных путей в разворачивании белка и восстановлении дисульфидных связей, наблюдаемых в одном белке. J. Am. Chem. Soc. 133 , 3104–3113 (2011).
CAS PubMed PubMed Central Google Scholar
Brujic, J., Херманс, Р. И., Вальтер, К. А. и Фернандес, Дж. М. Спектроскопия одномолекулярных сил выявляет признаки стекловидной динамики в энергетическом ландшафте убиквитина. Nat. Phys. 2 , 282–286 (2006).
CAS Google Scholar
Белл, Г. И. Модели специфической адгезии клеток к клеткам. Наука 200 , 618–627 (1978).
CAS Google Scholar
Чжэн, П.& Li, H. Высококовалентные связи трехвалентного железа и тиолата демонстрируют удивительно низкую механическую стабильность. J. Am. Chem. Soc. 133 , 6791–6798 (2011).
CAS PubMed Google Scholar
Cecconi, C., Shank, E. A., Bustamante, C. & Marqusee, S. Прямое наблюдение трехуровневого сворачивания одиночной белковой молекулы. Наука 309 , 2057–2060 (2005).
CAS PubMed Google Scholar
Джаганнатан, Б., Elms, P.J., Bustamante, C. & Marqusee, S. Прямое наблюдение индуцированного силой переключения в анизотропном механическом пути разворачивания белка. Proc. Natl Acad. Sci. США 109 , 17820–17825 (2012).
CAS PubMed Google Scholar
Гарсия-Манес, С., Дуган, Л., Бадилла, К. Л., Брухич, Дж. И Фернандес, Дж. М. Прямое наблюдение ансамбля стабильных коллапсированных состояний в механическом сворачивании убиквитина. Proc. Natl Acad. Sci. США 106 , 10534–10539 (2009).
CAS PubMed Google Scholar
Garcia-Manyes, S., Dougan, L. & Fernandez, J. M. Осмолит-индуцированное разделение фаз механического сворачивания убиквитина. Proc. Natl Acad. Sci. США 106 , 10540–10545 (2009).
CAS PubMed Google Scholar
Дудко, О.К., Хаммер, Г. и Сабо, А. Собственные скорости и свободные энергии активации из экспериментов по вытягиванию одной молекулы. Phys. Rev. Lett. 96 , 108101 (2006).
PubMed Google Scholar
Дудко О.К., Хаммер Г. и Сабо А. Теория, анализ и интерпретация экспериментов по спектроскопии одномолекулярных сил. Proc. Natl Acad. Sci. США 105 , 15755–15760 (2008).
CAS PubMed Google Scholar
Попа, И., Фернандес, Дж. М. и Гарсиа-Манйес, С. Прямая количественная оценка частоты попыток, определяющих механическое разворачивание убиквитинового белка. J. Biol. Chem. 286 , 31072–31079 (2011).
CAS PubMed PubMed Central Google Scholar
Чанг, Дж., Кушнер, А. М., Вейсман, А. К. и Гуан, З. Прямая корреляция свойств одиночных молекул с объемными механическими характеристиками для биомиметического дизайна полимеров. Nat. Матер. 13 , 1055–1062 (2014).
CAS PubMed Google Scholar
Карузо, М. М. и др. . Химические изменения в полимерных материалах, вызванные механическим воздействием. Chem. Ред. 109 , 5755–5798 (2009).
CAS PubMed Google Scholar
Ли, Б., Ниу, З., Ван, Дж., Слебодник, К. и Крейг, С.L. Относительная механическая прочность слабых связей в сонохимической механохимии полимеров. J. Am. Chem. Soc. 137 , 10826–10832 (2015).
CAS PubMed Google Scholar
Ли, Дж., Нагамани, К. и Мур, Дж. С. Механохимия полимеров: от деструктивного к продуктивному. В соотв. Chem. Res. 48 , 2181–2190 (2015).
CAS PubMed Google Scholar
Ву, Д., Ленхардт, Дж. М., Блэк, А. Л., Ахремитчев, Б. Б. и Крейг, С. Л. Снятие молекулярных напряжений за счет необратимого увеличения длины контура полимера под действием силы. J. Am. Chem. Soc. 132 , 15936–15938 (2010).
CAS PubMed Google Scholar
Ван, Дж. П. и др. . Индуцирование и количественная оценка запрещенной реакционной способности с помощью механохимии одномолекулярных полимеров. Nat. Chem. 7 , 323–327 (2015).
CAS PubMed Google Scholar
Ван, Дж. П., Кузнецова, Т. Б., Крейг, С. Л. Реакционная способность и механизм механически активируемой анти-Вудворда – Хоффмана – ДеПуи реакции. J. Am. Chem. Soc. 137 , 11554–11557 (2015).
CAS PubMed Google Scholar
Ван, Дж. и др. .Поймай и отпусти: орбитальная симметрия направляет динамику реакции из освобожденного «переходного состояния с ловушкой напряжения». J. Org. Chem. 80 , 11773–11778 (2015).
CAS PubMed Google Scholar
Ван Дж., Кузнецова Т. Б. и Крейг С. Л. Одномолекулярное наблюдение механически активированной изомеризации циклопропана цис транс- транс-. J. Am. Chem. Soc. 138 , 10410–10412 (2016).
CAS PubMed Google Scholar
Госсвайлер, Г. Р., Кузнецова, Т. Б., Крейг, С. Л. Характеристика силы и скорости двух датчиков молекулярной силы на основе спиропирана. J. Am. Chem. Soc. 137 , 6148–6151 (2015).
CAS PubMed Google Scholar
Дэвис, Д. А. и др. . Силовая активация ковалентных связей в механореактивных полимерных материалах. Природа 459 , 68–72 (2009).
CAS PubMed PubMed Central Google Scholar
Хуанг, W. и др. . Одномолекулярное исследование силового вращения двойных углерод-углеродных связей в полимерах. САУ Нано 11 , 194–203 (2017).
CAS PubMed Google Scholar
Хэнсон, Д. Э.И Мартин Р. Л. Как далеко может растянуться молекула каучука, прежде чем разорваться? Ab initio исследование упругости при растяжении и разрушения одномолекулярных полиизопрена и полибутадиена. J. Chem. Phys. 130 , 064903 (2009).
PubMed Google Scholar
Ли, Х. и Уокер, Г. К. Твист и крик: механохимия одиночных молекул. ACS Nano 11 , 28–30 (2017).
CAS PubMed Google Scholar
Чен, З. и др. . Механохимическое распаковывание изоляционного полиладдерена на полупроводниковый полиацетилен. Наука 357 , 475–479 (2017).
CAS PubMed Google Scholar
Айнаварапу, С. Р., Виита, А. П., Хуанг, Х. Х. и Фернандес, Дж. М. Одномолекулярный анализ для прямого определения доступных для растворителя дисульфидных связей и исследования их влияния на укладку белка. J. Am. Chem. Soc. 130 , 436–437 (2008).
CAS PubMed Google Scholar
Ланц, М.А. и др. . Количественное измерение короткодействующих сил химической связи. Наука 291 , 2580–2583 (2001).
CAS PubMed Google Scholar
Глейзер, Т., Хедман, Б., Ходжсон, К. О. и Соломон, Э. И. Рентгеновская абсорбционная спектроскопия на K-крае лиганда: прямой анализ ковалентности лиганд-металл. В соотв. Chem. Res. 33 , 859–868 (2000).
CAS PubMed Google Scholar
Чжэн, П. и Ли, Х. Прямые измерения механической стабильности связей цинк-тиолат в рубредоксине с помощью атомно-силовой микроскопии одиночных молекул. Biophys. J. 101 , 1467–1473 (2011).
CAS PubMed PubMed Central Google Scholar
Соломон, Э.И., Горельский С. И., Дей А. Связи металл – тиолат в биоинорганической химии. J. Comput. Chem. 27 , 1415–1428 (2006).
CAS PubMed Google Scholar
Пералес-Кальво, Дж., Лезамиз, А. и Гарсия-Манйес, С. Механохимия структурного цинкового пальца. J. Phys. Chem. Lett. 6 , 3335–3340 (2015).
CAS PubMed Google Scholar
Бидл, А.E. M., Lezamiz, A., Stirnemann, G. & Garcia-Manyes, S. Механохимия меди сообщает о направленности разворачивания в модельных белках купредоксина. Nat. Commun. 6 , 7894 (2015).
CAS PubMed PubMed Central Google Scholar
Соломон, Э. И., Хейр, Дж. У. и Грей, Х. Б. Спектроскопические исследования и структурная модель центров синей меди в белках. Proc. Natl Acad.Sci. США 73 , 1389–1393 (1976).
CAS PubMed Google Scholar
Лю, Дж. и др. . Металлопротеины, содержащие цитохромные, железо-серные или медные окислительно-восстановительные центры. Chem. Ред. 114 , 4366–4469 (2014).
CAS PubMed PubMed Central Google Scholar
Wei, W. и др. .Структурные открытия и удивительно низкая механическая стабильность связи Au – S в золотоспецифическом белке GolB. J. Am. Chem. Soc. 137 , 15358–15361 (2015).
CAS PubMed Google Scholar
Сюэ, Ю. Р., Ли, X., Ли, Х. Б. и Чжан, В. К. Количественная оценка взаимодействий тиол-золото для эффективного контроля силы. Nat. Commun. 5 , 4348 (2014).
CAS PubMed Google Scholar
Чжэн, П., Такаяма, С. Дж., Маук, А. Г. и Ли, Х. Прочность водородной связи модулирует механическую прочность связей трехвалентного железа и тиолата в рубредоксине. J. Am. Chem. Soc. 134 , 4124–4131 (2012).
CAS PubMed Google Scholar
Zheng, P., Chou, C.C., Guo, Y., Wang, Y. & Li, H. Спектроскопия одиночных молекулярных сил выявляет молекулярно-механическую анизотропию металлического центра FeS4 в рубредоксине. Дж.Являюсь. Chem. Soc. 135 , 17783–17792 (2013).
CAS PubMed Google Scholar
Лей, Х. и др. . Обратимое разворачивание и сворачивание металлопротеина ферредоксина, выявленное методом атомно-силовой микроскопии одиночных молекул. J. Am. Chem. Soc. 139 , 1538–1544 (2017).
CAS PubMed Google Scholar
Чжэн, П., Ван, Й. и Ли, Х. Обратимое разворачивание-рефолдинг рубредоксина: исследование с помощью спектроскопии одномолекулярных сил. Angew. Chem. Int. Эд. 53 , 14060–14063 (2014).
CAS Google Scholar
Арантес, Г. М., Бхаттачарджи, А. и Филд, М. Дж. Гомолитический разрыв связей Fe – S в рубредоксине под действием механического напряжения. Angew. Chem. Int. Эд. 52 , 8144–8146 (2013).
CAS Google Scholar
Чжэн, П., Арантес, Г. М., Филд, М. Дж. И Ли, Х. Химические реакции, индуцированные силой на металлическом центре в одной молекуле металлопротеина. Nat. Commun. 6 , 7569 (2015).
CAS PubMed PubMed Central Google Scholar
Актах, Д. и Франк, И. Разрыв связей под действием механического напряжения: когда электроны решают за другую сторону? J. Am. Chem. Soc. 124 , 3402–3406 (2002).
CAS PubMed Google Scholar
Виита, А. П., Айнаварапу, С. Р., Хуанг, Х. Х. и Фернандес, Дж. М. Зависимая от силы химическая кинетика восстановления дисульфидной связи, наблюдаемая с помощью методов одномолекулярных соединений. Proc. Natl Acad. Sci. США 103 , 7222–7227 (2006).
CAS PubMed Google Scholar
Анфинсен, К. Б.& Haber, E. Исследования по восстановлению и повторному образованию дисульфидных связей белка. J. Biol. Chem. 236 , 1361–1363 (1961).
CAS PubMed Google Scholar
Айнаварапу, С. Р. и др. . Длина контура и скорость рефолдинга небольшого белка контролируются сконструированными дисульфидными связями. Biophys. J. 92 , 225–233 (2007).
CAS PubMed Google Scholar
Карл П., Kwok, C.H., Manderson, G., Speicher, D. W. & Discher, D. E. Принудительное разворачивание, модулируемое дисульфидными связями в доменах Ig молекулы клеточной адгезии. Proc. Natl Acad. Sci. США 98 , 1565–1570 (2001).
CAS PubMed Google Scholar
Hogg, P.J. Дисульфидные связи как переключатели функции белка. Trends Biochem. Sci. 28 , 210–214 (2003).
CAS PubMed Google Scholar
Бах Р.Д., Дмитренко О. и Торп С. Механизм реакций тиолат-дисульфидного обмена в биохимии. J. Org. Chem. 73 , 12–21 (2008).
CAS PubMed Google Scholar
Whitesides, G. M., Houk, J. & Patterson, M. A. K. Параметры активации для реакций тиолатдисульфидного обмена в водном растворе. J. Org. Chem. 48 , 112–115 (1983).
CAS Google Scholar
Надь, П.Кинетика и механизмы тиол-дисульфидного обмена, охватывающие пути прямого замещения и пути, опосредованные окислением тиолов. Антиоксид. Редокс-сигнал. 18 , 1623–1641 (2013).
CAS PubMed PubMed Central Google Scholar
Лян, Дж. И Фернандес, Дж. М. Механохимия: по одной связи за раз. ACS Nano 3 , 1628–1645 (2009).
CAS PubMed PubMed Central Google Scholar
Кухарский Т.J. и др. . Кинетика обмена тиол / дисульфид слабо коррелирует с восстанавливающей силой в дисульфидном фрагменте. Angew. Chem. Int. Эд. 48 , 7040–7043 (2009).
CAS Google Scholar
Фернандес, П. А. и Рамос, М. Дж. Теоретическое понимание механизма обмена тиол / дисульфид. Химия 10 , 257–266 (2004).
CAS PubMed Google Scholar
Коти Айнаварапу, С.Р., Виита, А. П., Дуган, Л., Уггеруд, Э. и Фернандес, Дж. М. Измерения удлинения связи в ходе бимолекулярной реакции с помощью спектроскопии одномолекулярных сил. J. Am. Chem. Soc. 130 , 6479–6487 (2008).
PubMed Google Scholar
Li, W. & Grater, F. Атомистические свидетельства того, как сила динамически регулирует обмен тиол / дисульфид. J. Am. Chem. Soc. 132 , 16790–16795 (2010).
CAS PubMed Google Scholar
Лян, Дж. И Фернандес, Дж. М. Кинетические измерения разрыва одиночной молекулы дисульфидной связи. J. Am. Chem. Soc. 133 , 3528–3534 (2011).
CAS PubMed PubMed Central Google Scholar
Эйринг, Х. Активированный комплекс в химических реакциях. J. Chem. Phys. 3 , 107–115 (1935).
CAS Google Scholar
Wiita, A. P. и др. . Силовое исследование химии тиоредоксинового катализа. Природа 450 , 124–127 (2007).
CAS PubMed PubMed Central Google Scholar
Перес-Хименес, Р. и др. . Разнообразие химических механизмов в катализе тиоредоксина, выявленное с помощью силовой спектроскопии одиночных молекул. Nat. Struct. Мол. Биол. 16 , 890–896 (2009).
CAS PubMed PubMed Central Google Scholar
Гарсиа-Манес, С., Лян, Дж., Шошкевич, Р., Куо, Т. Л. и Фернандес, Дж. М. Силовой переключатель реактивности в бимолекулярной химической реакции. Nat. Chem. 1 , 236–242 (2009).
CAS PubMed Google Scholar
Допьеральский, П. и др. . Роль внешних сил в механохимическом разрыве дисульфидных связей с лицом Януса. Nat. Chem. 5 , 685–691 (2013).
CAS PubMed Google Scholar
Бейер, М. К. Механическая прочность ковалентной связи, рассчитанная по теории функционала плотности. J. Chem. Phys. 112 , 7307–7312 (2000).
CAS Google Scholar
Иоцци, М.Ф., Хельгакер Т. и Уггеруд Э. Влияние внешней силы на свойства и реакционную способность дисульфидных связей. J. Phys. Chem. A 115 , 2308–2315 (2011).
CAS PubMed Google Scholar
Балдус, И. Б. и Тертер, Ф. Механическая сила может точно регулировать окислительно-восстановительный потенциал дисульфидных связей. Biophys. J. 102 , 622–629 (2012).
CAS PubMed PubMed Central Google Scholar
Хофбауэр, Ф.& Франк, I. Разрыв дисульфидной связи: окислительно-восстановительная реакция без переноса электрона. Химия 16 , 5097–5101 (2010).
CAS PubMed Google Scholar
Яннуцци М., Лайо А. и Парринелло М. Эффективное исследование поверхностей реактивной потенциальной энергии с использованием молекулярной динамики Кар – Парринелло. Phys. Rev. Lett. 90 , 238302 (2003).
PubMed Google Scholar
Допьеральский, П., Рибас-Арино, Дж., Анджуканди, П., Крупицка, М. и Маркс, Д. Неожиданная механохимическая сложность в механистических сценариях восстановления дисульфидной связи в щелочном растворе. Nat. Chem. 9 , 164–170 (2017).
CAS PubMed Google Scholar
Допиральски П., Рибас-Арино, Дж., Анжуканди, П., Крупицка, М. и Маркс, Д. Инверсия β-элиминирования под действием силы: напряженные дисульфидные связи в щелочном растворе. Angew. Chem. Int. Эд. 55 , 1304–1308 (2016).
CAS Google Scholar
Алегре-Себоллада, Дж., Косури, П., Ривас-Пардо, Дж. А. и Фернандес, Дж. М. Прямое наблюдение изомеризации дисульфидов в одном белке. Nat. Chem. 3 , 882–887 (2011).
CAS PubMed PubMed Central Google Scholar
Косури, П. и др. . Сворачивание белка способствует образованию дисульфидов. Ячейка 151 , 794–806 (2012).
CAS PubMed PubMed Central Google Scholar
Севье С. и Кайзер К. А. Формирование и перенос дисульфидных связей в живых клетках. Nat. Rev. Mol. Cell Biol. 3 , 836–847 (2002).
CAS PubMed Google Scholar
Уилкинсон, Б.И Гилберт, Х. Ф. Дисульфид-изомераза протеина. Biochim. Биофиз. Acta 1699 , 35–44 (2004).
CAS PubMed Google Scholar
Кадокура, Х., Тиан, Х., Зандер, Т., Бардвелл, Дж. К. и Беквит, Дж. Снимки DsbA в действии: обнаружение белков в процессе окислительного фолдинга. Наука 303 , 534–537 (2004).
CAS PubMed Google Scholar
Кан, Т.Б., Фернандес, Дж. М., Перес-Хименес, Р. Мониторинг окислительного фолдинга одиночного белка, катализируемого дисульфид-оксидоредуктазой DsbA. J. Biol. Chem. 290 , 14518–14527 (2015).
CAS PubMed PubMed Central Google Scholar
Гупта В. и Кэрролл К. С. Химия сульфеновой кислоты, обнаружение и время жизни клеток. Biochim. Биофиз. Acta 1840 , 847–875 (2014).
CAS PubMed Google Scholar
Beedle, A. E., Lynham, S. & Garcia-Manyes, S. S-сульфенилирование белка — это мимолетный молекулярный переключатель, который регулирует неферментативное окислительное сворачивание. Nat. Commun. 7 , 12490 (2016).
CAS PubMed PubMed Central Google Scholar
Бидл, А. Э. М., Мора, М., Линхэм, С., Штирнеманн, Г. и Гарсия-Манес, С. Настройка белковой наномеханики с химической реакционной способностью. Nat. Commun. 8 , 15658 (2017).
CAS PubMed PubMed Central Google Scholar
Алегре-Себоллада, Дж. и др. . S-глутатионилирование скрытых цистеинов увеличивает эластичность тайтина, блокируя сворачивание белка. Ячейка 156 , 1235–1246 (2014).
CAS PubMed PubMed Central Google Scholar
Фогель, В.Механотрансдукция с участием мультимодульных белков: преобразование силы в биохимические сигналы. Annu. Rev. Biophys. Biomol. Struct. 35 , 459–488 (2006).
CAS PubMed Google Scholar
Эйзенштейн, М. Механобиология: мера молекулярной мускулатуры. Природа 544 , 255–257 (2017).
CAS PubMed Google Scholar
Пухнер, Э.М. и Гауб, Х. Э. Одномолекулярные механоферментные средства. Annu. Rev. Biophys. 41 , 497–518 (2012).
CAS PubMed Google Scholar
Валле-Ореро, Дж. и др. . Механическая деформация ускоряет старение белка. Angew. Chem. Int. Эд. 56 , 9741–9746 (2017).
CAS Google Scholar
Майя, О. и др. . Структурная основа активации домена тайтинкиназы во время миофибриллогенеза. Природа 395 , 863–869 (1998).
CAS PubMed Google Scholar
Тёртер, Ф., Шен, Дж., Цзян, Х., Гаутель, М. и Грубмюллер, Х. Механически индуцированная активация тайтинкиназы изучалась с помощью моделирования молекулярной динамики силового зонда. Biophys. J. 88 , 790–804 (2005).
PubMed Google Scholar
Пухнер, Э. М. и др. . Механоферментные препараты тайтинкиназы. Proc. Natl Acad. Sci. США 105 , 13385–13390 (2008).
CAS PubMed Google Scholar
Zhang, X., Halvorsen, K., Zhang, C.Z., Wong, W. P. & Springer, T. A. Механоферментное расщепление сверхбольшого сосудистого белка по фактору Виллебранда. Наука 324 , 1330–1334 (2009).
CAS PubMed PubMed Central Google Scholar
дель Рио, А. и др. . Растяжение одиночных молекул палочек талина активирует связывание винкулина. Наука 323 , 638–641 (2009).
CAS PubMed Google Scholar
Яо, М. и др. . Механическая активация связывания винкулина с талином блокирует талин в развернутой конформации. Sci. Отчет 4 , 4610 (2014).
PubMed PubMed Central Google Scholar
Яо, М. и др. . Зависимый от силы конформационный переключатель α-катенина контролирует связывание винкулина. Nat. Commun. 5 , 4525 (2014).
CAS PubMed Google Scholar
Sawada, Y. и др. . Определение силы путем механического удлинения субстрата киназы семейства Src p130Cas. Ячейка 127 , 1015–1026 (2006).
CAS PubMed PubMed Central Google Scholar
Guilluy, C. et al. . Изолированные ядра адаптируются к силе и обнаруживают путь механотрансдукции в ядре. Nat. Cell Biol. 16 , 376–381 (2014).
CAS PubMed PubMed Central Google Scholar
Свифт, Дж. и др. . Ядерный ламин-А масштабируется с увеличением жесткости ткани и усиливает дифференцировку, направленную на матрикс. Наука 341 , 1240104 (2013).
PubMed PubMed Central Google Scholar
Попа, И. и др. . Наномеханика тросов HaloTag. J. Am. Chem. Soc. 135 , 12762–12771 (2013).
CAS PubMed Google Scholar
Попа, И. и др. . HaloTag закрепила линейку для недельных исследований динамики белков. J. Am. Chem. Soc. 138 , 10546–10553 (2016).
CAS PubMed PubMed Central Google Scholar
Pernigo, S. и др. . Структурное понимание сборки и механики M-полосы из комплекса тайтин-обскурин-подобный-1. Proc. Natl Acad. Sci. США 107 , 2908–2913 (2010).
CAS PubMed Google Scholar
Ким, Дж., Zhang, C.Z., Zhang, X. & Springer, T.A. Механически стабилизированная гибкая связь рецептор-лиганд, важная для сосудистой сети. Природа 466 , 992–995 (2010).
CAS PubMed PubMed Central Google Scholar
Pernigo, S. и др. . Связывание миомезина с подобным обскурину-1 на мышечной М-полосе обеспечивает стратегию механической защиты, специфичной для изоформ. Структура 25 , 107–120 (2017).
CAS PubMed PubMed Central Google Scholar
Эчелман Д. Дж., Ли А. К. и Фернандес Дж. М. Механические силы регулируют реакционную способность тиоэфирной связи в бактериальном адгезине. J. Biol. Chem. 292 , 8988–8997 (2017).
CAS PubMed PubMed Central Google Scholar
Аллен, М. П. и Тилдесли, Д.J. (eds) Компьютерное моделирование в химической физике (Springer, 1993).
Google Scholar
Френкель Д. и Смит Б. Понимание молекулярного моделирования: от алгоритмов к приложениям 2-е изд. (Academic Press, 2002).
Google Scholar
Остин К., и др. . Определение внеклеточной жесткости с помощью механических связей, специфичных для изоформ талина. Nat. Cell Biol. 17 , 1597–1606 (2015).
CAS PubMed PubMed Central Google Scholar
Чоудхури, Ф. и др. . Определение единичных молекулярных сил, необходимых для активации надреза с помощью нано-йойо. Nano Lett. 16 , 3892–3897 (2016).
CAS PubMed PubMed Central Google Scholar
Сюй, Б.Q., Xiao, X. Y. & Tao, N. J. Измерения электромеханических свойств одиночных молекул. J. Am. Chem. Soc. 125 , 16164–16165 (2003).
CAS PubMed Google Scholar
Xu, B.Q., Li, X. L., Xiao, X.Y., Sakaguchi, H. & Tao, N.J. Электромеханические свойства и свойства переключения проводимости одиночных молекул олиготиофена. Nano Lett. 5 , 1491–1495 (2005).
CAS PubMed Google Scholar
Фрей, М., Арадхья, С. В., Коентопп, М., Хибертсен, М. С. и Венкатараман, Л. Механика и химия: силы разрыва связи одной молекулы коррелируют со структурой основной цепи молекулы. Nano Lett. 11 , 1518–1523 (2011).
CAS PubMed Google Scholar
Маршалек, П. Э., Гринлиф, В.Дж., Ли, Х., Оберхаузер, А. Ф. и Фернандес, Дж. М. Атомно-силовая микроскопия фиксирует квантовую пластическую деформацию в золотых нанопроводах. Proc. Natl Acad. Sci. США 97 , 6282–6286 (2000).
CAS PubMed Google Scholar
Сотомайор М. и Шультен К. Одномолекулярные эксперименты in vitro и in silico . Наука 316 , 1144–1148 (2007).
CAS PubMed Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.

 3. Приведите пример трех физических явлений и напишите их признаки.
3. Приведите пример трех физических явлений и напишите их признаки.