химический элемент Сера Sulfur-Sulphur — «Химическая продукция»
Что такое
Сера, sulfur-sulphur, характеристики, свойстваСера — это химический элемент S элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Сера класс химических элементов
Элемент S — относится к группе, классу хим элементов (…)
Элемент S свойство химического элемента Сера Sulfur-Sulphur
Основные характеристики и свойства элемента S…, его параметры.
формула химического элемента Сера Sulfur-Sulphur
Химическая формула Серы:
Атомы Сера Sulfur-Sulphur химических элементов
Атомы Sulfur-Sulphur хим. элемента
элемента
Sulfur-Sulphur Сера ядро строение
Строение ядра химического элемента Sulfur-Sulphur — S,
История открытия Сера Sulfur-Sulphur
Открытие элемента Sulfur-Sulphur — точное время открытия серы не установлено, но этот элемент использовался до нашей эры.
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.
Пресвитер Теофил (XII век) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию.
С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы.
Сера в природе
Большие скопления самородной серы (с содержанием > 25 %) редки, они встречаются в местах вулканической активности, им сопутствуют сернистые фумаролы и сернистые воды.
Серная руда разрабатывается в месторождениях самородной серы, добывается из сульфидных руд и промышленных газов.
Серные бактерии могут окислять сероводород от гниющих органических остатков до серы и накапливать её
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит.
Сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Сера Sulfur-Sulphur происхождение названия
Откуда произошло название Sulfur-Sulphur …
Распространённость Сера Sulfur-Sulphur
Как любой хим.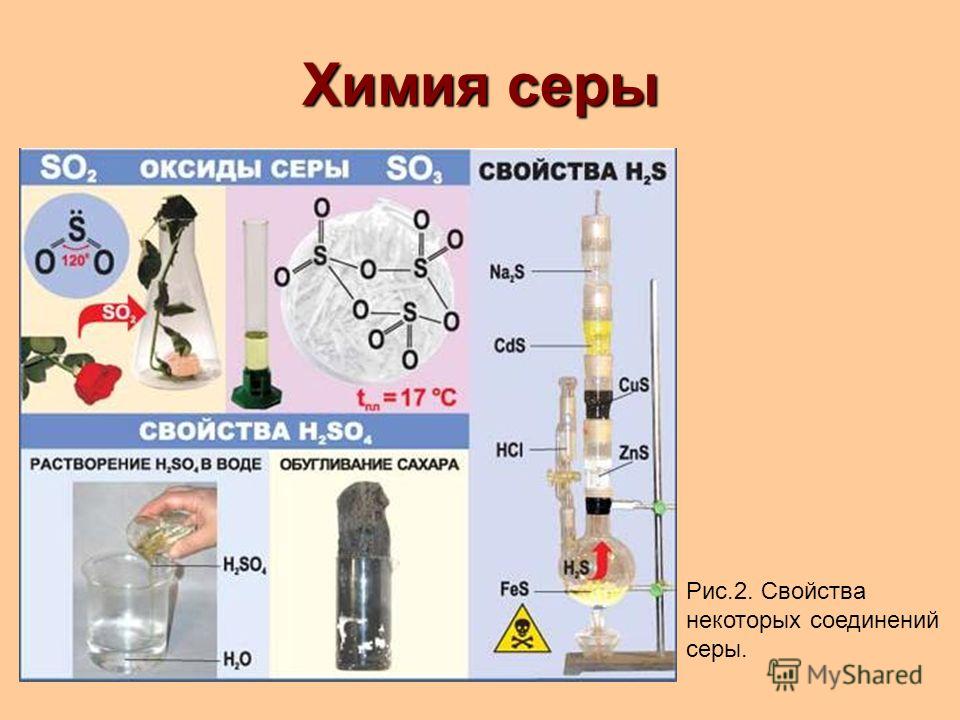
Получение Сера Sulfur-Sulphur
Sulfur-Sulphur — получение элемента —
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
При добыче руды открытым способом экскаваторами снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
 Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.Методы получения серы из серных руд
Известно несколько методов получения серы из серных руд:
- пароводяные,
- фильтрационные,
- термические,
- центрифугальные
- экстракционные.
Сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Серу из природного сернистого газа получают методом Клауса. Для этого используются так называемые серные ямы, где происходит дегазация серы, на выходе получают модифицированную серу — продукт, широко использующийся в производстве асфальта.
Стены ямы обычно делают из кирпича, дно заливают бетоном, а сверху закрывают яму алюминиевой крышей. Так как сера — это весьма агрессивная среда, ямы периодически приходится полностью реконструировать.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Физические свойства Сера Sulfur-Sulphur
Изотопы Sulfur-Sulphur Сера, таблица изотопов серы
Наличие и определение изотопов Sulfur-Sulphur — природная Сера состоит из четырёх стабильных изотопов:
32S (95,02 %), 33S (0,75 %), 34S (4,21 %), 36S (0,02 %).
Получены также искусственные радиоактивные изотопы
31S (T½ = 2,4 с), 35S (T½ = 87,1 сут), 37S (Т½= 5,04 мин) и другие.
Изотопы серы — разновидности атомов (и ядер) химического элемента серы, имеющие разное содержание нейтронов в ядре.
S свойства изотопов Сера Sulfur-Sulphur
| Символ нуклида | Z ( p ) | N( n ) | Масса изотопа( а. е. м. ) | Период полураспада (T 1/2 ) | Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 26 S | 16 | 10 | 26,02788 | 10,0 мс | 0+ |
| 27 S | 16 | 11 | 27,01883 | 15,5 мс | 5/2+ |
| 28 S | 16 | 12 | 28,00437 | 125,0 мс | 0+ |
| 29 S | 16 | 13 | 28,99661 | 187,0 мс | 5/2+ |
| 30 S | 16 | 14 | 29,984903 | 1,178 с | 0+ |
| 31 S | 16 | 15 | 30,9795547 | 2,572 с | 1/2+ |
| 32 S | 16 | 16 | 31. 97207100(15) 97207100(15) | стабилен | 0+ |
| 33 S | 16 | 17 | 32,97145876 | стабилен | 3/2+ |
| 34 S | 16 | 18 | 33,96786690 | стабилен | 0+ |
| 35 S | 16 | 19 | 34,96903216 | 87,51 сут | 3/2+ |
| 36 S | 16 | 20 | 35,96708076 | стабилен | 0+ |
| 37 S | 16 | 21 | 36,97112557 | 5,05 мин | 7/2- |
| 38 S | 16 | 22 | 37,971163 | 170,3 мин | 0+ |
| 39 S | 16 | 23 | 38,97513 | 11,5 с | 5/2- |
| 40 S | 16 | 24 | 39,97545 | 8,8 с | 0+ |
| 41 S | 16 | 25 | 40,97958 | 1,99 с | 7/2- |
| 42 S | 16 | 26 | 41,98102 | 1,013 с | 0+ |
| 43 S | 16 | 27 | 42,98715 | 260,0 мс | 3/2- |
| 43m S | 319 кэВ | 480,0 нс | 7/2- | ||
| 44 S | 16 | 28 | 43,99021 | 100,0 мс | 0+ |
| 45 S | 16 | 29 | 44,99651 | 68,0 мс | 3/2- |
| 46 S | 16 | 30 | 46,00075 | 50,0 мс | 0+ |
| 47 S | 16 | 31 | 47,00859 | 20,0 мс | 3/2- |
| 48 S | 16 | 32 | 48,01417 | 10,0 мс | 0+ |
| 49 S | 16 | 33 | 49,02362 | 200,0 нс | 3/2- |
Химические свойства Сера Sulfur-Sulphur
Определение химических свойств Sulfur-Sulphur
Меры предосторожности Сера Sulfur-Sulphur
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Sulfur-Sulphur
Стоимость Сера Sulfur-Sulphur
Рыночная стоимость S, цена Сера Sulfur-Sulphur
Юникод
В Юникоде есть алхимический символ серы.
Кодировка по Unicode и HTML
| Графема | Unicode | HTML | |||
|---|---|---|---|---|---|
| Код | Название | Шестнадцатеричное | Десятичное | Мнемоника | |
| 🜍 | U+1F70D | ALCHEMICAL SYMBOL FOR SULFUR | 🜍 | 🜍 | — |
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент S
- Соединения серы
- Жупел
- Акарициды
- Ушная сера
- Desulfobulbus propionicus — бактерия, осуществляющая диспропорционирование серы
Характеристика химического элемента №16 (Сера) реферат по химии
Южно-Уральский государственный университет Миасский машиностроительный факультет. Кафедра Технологии производства машин. Итоговый реферат. «Характеристика химического элемента №16 (Сера)» ММФ-144 Выполнил: Лобзев Е.А. Проверил: Мельнеченко В.Г. Миасс 2001 План. 1.История открытия элемента. 2.Распростронение элемента в природе. 3.Физические свойства. 4.Химические свойства. 5.Получение. 6.Приминение. История открытия элемента. Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы.
Кафедра Технологии производства машин. Итоговый реферат. «Характеристика химического элемента №16 (Сера)» ММФ-144 Выполнил: Лобзев Е.А. Проверил: Мельнеченко В.Г. Миасс 2001 План. 1.История открытия элемента. 2.Распростронение элемента в природе. 3.Физические свойства. 4.Химические свойства. 5.Получение. 6.Приминение. История открытия элемента. Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XI в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси.
Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XI в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение «яйца с огнем»), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название «сера» употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр.). По-видимому, это название происходит от санскритского сirа (светло-желтый). С ним связано слово «серый», т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы — жупел (сера горючая) — тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо- саксонское sweblan — убивать), что, возможно, связано с ядовитыми свойствами сернистого газа.
Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение «яйца с огнем»), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название «сера» употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр.). По-видимому, это название происходит от санскритского сirа (светло-желтый). С ним связано слово «серый», т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы — жупел (сера горючая) — тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо- саксонское sweblan — убивать), что, возможно, связано с ядовитыми свойствами сернистого газа. (3) Распространение элемента в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах. Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., а также соли серной кислоты (кристаллогидраты): СаSO4⋅ 2Н2O — гипс, Na2SO4 ⋅ 10h3O — глауберова соль, МgSО4 ⋅ 7h3O — горькая соль и др.(2) Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая.
(3) Распространение элемента в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах. Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., а также соли серной кислоты (кристаллогидраты): СаSO4⋅ 2Н2O — гипс, Na2SO4 ⋅ 10h3O — глауберова соль, МgSО4 ⋅ 7h3O — горькая соль и др.(2) Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой
Наиболее устойчивой
Сера (S, Sulphur) — влияние на организм, польза и вред, описание
История серы
Сера и её соединения сопровождают историю человечества с незапамятных времён. Как правило, использовались не самые приятные запахи – горения серы, сероводорода и сернистого газа, наделяя вещество, которое могло испускать такие зловонья, поистине волшебными или даже божественными свойствами. Недаром одним из традиционных применений серы было изготовление священных курений и использование их во многих обрядах некоторых религий (calorizator). Параллельно серу вводили в состав горючих смесей, применяемых во время военных действий. Антуан Лавуазье, считающийся основателем современной науки химии, первым выяснил элементарную природу серы, которую стали получать из пиритов.
Общая характеристика серы
Сера является элементом XVI группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 16 и атомную массу 32,066. Принятое обозначение S (от латинского sulfur).
Принятое обозначение S (от латинского sulfur).
Физические и химические свойства
Сера является неметаллическим веществом, образующим соли и кислоты. Считается макроэлементом. При взаимодействии с воздухом происходит возгорание серы с образованием газа без цвета, но с резким запахом – сернистого ангидрида.
Продукты питания богатые серой
Богаты серой мясные и рыбные продукты – индейка, говядина, свинина, мясо кролика, курица, говяжья и индюшачья печень, морская рыба (камбала, сардина, окунь, зубатка), перепелиные и куриные яйца, сыр, крупы и бобовые, овощи (белокочанная и брюссельская капуста, лук, чеснок, салат, репа).
Суточная потребность в сере
Норма потребления серы в сутки составляет 0,5-1 г, обычного питания вполне хватает, чтобы получить суточную норму. Спортсменам перед соревнованиями, если нужно набрать массу, серы потребуется до 3 г в сутки, для этого можно увеличить количество белковой пищи или ввести в рацион минеральную воду с содержанием серы.
Полезные свойства серы и его влияние на организм
Сера – незаменимый макроэлемент, без неё невозможны многие важнейшие процессы в организме человека. Сера играет важную роль в процессе свёртываемости крови, защищает протоплазму от вредных бактерий, является важным элементом в синтезе коллагена, поэтому благотворно влияет на состояние кожи, волос и ногтей, замедляет процессы старения организма, оказывает противоаллергическое действие.
Взаимодействие с другими
Сера усваивается быстрее при нормальном количестве в организме железа и фтора, молибден, селен и свинец задерживают усвояемость серы.
Признаки нехватки серы
Признаками дефицита серы в организме считаются:
- Снижение иммунитета и жизненного тонуса;
- Хроническая усталость;
- Запоры;
- Хрупкость ногтей и тусклость волос;
- Воспаления на коже;
- Болезненность суставов.
Признаки избытка серы
Переизбыток серы в организме крайне редок, встречается лишь в регионах, где отмечается пониженное содержание серы.
Применение серы в жизни
Сера – основа для производства серной кислоты, сферы её применения – бумажная и резиновая промышленность, сельское хозяйство, производство пороха и спичек, медицина.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Газоанализатор серы
Сера химический элемент из группы халькогенов с порядковым номером 16 обозначается латинской буквой S. В чистом виде представляет собой хрупкие кристаллы или порошок желтого цвета, в природе сера в основном находится в связанном состоянии: пирит, антимонит, свинцовый блеск и т. д. Значительное количество содержится в полезных ископаемых, в виде ионов солей сера растворена в водоемах, во многом определяя жесткость пресной воды.
Свойства и характеристики
Все 6 электронов внешнего энергетического уровня атома серы являются валентными, при взаимодействии с элементами с более выраженными неметаллическими свойствами, атом отдает 4 или 6 электронов. В процессе реакции с металлами и водородом сера забирает 2 электрона для достижения устойчивого состояния.
В процессе реакции с металлами и водородом сера забирает 2 электрона для достижения устойчивого состояния.
Атомы серы в обычных условиях образуют структуру циклического типа, различают две основные кристаллические формы – ромбовидная из молекул S8 и моноклинная из молекул S6. Ромбовидная α-сера ярко-желтого цвета обладает большей стабильностью, ее плотность 2,07 г/см3, β-сера имеет светло-желтый оттенок и меньшую плотность 1,96 г/см3. При нагревании кристаллы разрушаются и переходят в аморфную форму, приобретая вид темно-коричневой массы. Температура плавления серы составляет 110°C, а при 444,5°C она кипит.
При сгорании на воздухе или в кислородной среде образуются ангидриды серной или сернистой кислоты – триоксид и диоксид. При повышенной температуре сера реагирует с металлами, водородом, углеродом и кремнием, а также взаимодействует с концентрированными кислотами-окислителями.
Сера в промышленности, сельском хозяйстве и медицине
Промышленное применение серы очень обширно, практически ни один индустриальный сектор не обходится без этого химического элемента. Сера применяется в металлургии для придания стальным сплавам специальных свойств, ее используют в процессе вулканизации резины, производстве спичек, взрывчатых веществ, пиротехнических изделий, красящих и отбеливающих составов. Огромное промышленное значение имеют производные серы – кислоты, сульфаты и сульфиты.
Сера применяется в металлургии для придания стальным сплавам специальных свойств, ее используют в процессе вулканизации резины, производстве спичек, взрывчатых веществ, пиротехнических изделий, красящих и отбеливающих составов. Огромное промышленное значение имеют производные серы – кислоты, сульфаты и сульфиты.
Сульфат-ионы применяются как эффективная подкормка большинства сельскохозяйственных культур, наличие серы стабилизирует метаболизм аминокислот в клетках растений. Оксид серы является мощнейшим антимикробным средством, в этом качестве он используется для сохранения плодоовощной продукции и борьбе с болезнями растений.
В медицине сера входит в состав мазей для лечения кожных заболеваний, а серосодержащие водорастворимые препараты при внутреннем применении улучшают синтез кератина и аминокислот, активируют многие биохимические процессы организма.
Продукт окисления серы SO2(диоксид) представляет собой газ 3-го класса опасности, он поражает внутренние органы, оказывая комплексное воздействие на человеческий организм. При небольшом превышении ПДК, которое допускает не более 0,05 мг/м3 среднесуточной нормы, сернистый ангидрид вызывает першение в горле, обильное слезоотделение, насморк и кашель, появляется головная боль и нарушение координации. Увеличение концентрации вещества ведет к слепоте, химическим ожогам органов дыхания, а в итоге к смерти от удушья.
При небольшом превышении ПДК, которое допускает не более 0,05 мг/м3 среднесуточной нормы, сернистый ангидрид вызывает першение в горле, обильное слезоотделение, насморк и кашель, появляется головная боль и нарушение координации. Увеличение концентрации вещества ведет к слепоте, химическим ожогам органов дыхания, а в итоге к смерти от удушья.
Для безопасности сотрудников предприятий, работающих с этим опасным соединением, производственные помещения оснащают современными системами газового анализа. В компании ИНКРАМ можно приобрести эффективные приборы:
— газоанализатор SO2 серии А200, А300
— газосигнализатор серы серии В300, С300
Общая характеристика серы — химия, презентации
Общая
характеристика
серы
Общая характеристика серы
1
- Историческая справка.

- Историческая справка.
2
- Нахождение в природе.
- Нахождение в природе.
3
- Положение в ПСХЭ. Строение атома.
- Положение в ПСХЭ. Строение атома.
4
- Строение и физические свойства.
- Строение и физические свойства.
5
- Химические свойства.
- Химические свойства.
6
- Получение.
- Получение.
7
- Применение.
- Применение.
8
- Проверь свои знания!
- Проверь свои знания!
Общая характеристика серы
Содержание
10/22/16
Историческая справка
- Элементарную природу серы установил
француз (по
образованию юрист, а по призванию химик)
в своих опытах по сжиганию в 1770 году..
- Древнерусское название «сера»
употребляется очень давно. Оно происходит от
Оно происходит от
санскритского слова «сира», что означает светло-желтый.
Антуан Лоран Лавуазье
- Алхимический символ серы
- Химический символ Дальтона
S
- Химический символ Берцелиуса
сера
Нахождение в природе
В земной коре в свободном и связанном состоянии серы находится 0,03% от общего количества атомов, по массе – 0,05%.
Самородная сера — S
Глауберова соль – Na 2 SO 4 ∙10H 2 O
Цинковая обманка — ZnS
Сера в природе
Гипс – CaSO 4 ∙2H 2 O
Киноварь — HgS
Железный колчедан – FeS 2
Свинцовый блеск — PbS
Медный колчедан – Cu 2 S
Положение серы в ПСХЭ.
Строение атома.
Вспомни!
Общая характеристика серы
Вставьте пропущенные слова:
- Сера — элемент VI группы, главной подгруппы.
- Заряд ядра атома cеры равен +16 .

- В ядре атома серы 16 протонов.
- В ядре атома серы 16 нейтронов.
- В атоме серы 16 электронов.
- Атом серы имеет 3 энергетических уровня.
- Электронная оболочка имеет строение 2е, 8е, 6е .
- На внешнем уровне в атоме 6 электронов.
- Высшая степень окисления атома серы равна +6 .
- Простое вещество сера является неметаллом .
- Высший оксид и гидроксид серы имеют
кислотный характер.
Строение атома серы
S
p + = 16
32
Электронное строение
0
n 0 = 16
+16
Валентные возможности
e — = 16
8
2
6
3d 2
3d 1
3d 0
3p 4
3p 3
3p 4
3s 1
3s 2
3s 2
2p 6
2p 6
2s 2
2s 2
1s 2
1s 2
IV,
VI
II,
Валентные возможности —
Краткая электронная формула
8
Сера – простое вещество
8
Аллотропные модификации
Ромбическая
Моноклинная
Пластическая
Аллотро́пия— существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
?
8
2,05Å
Ромбическая сера
- S 8
- Твердая хрупкая
- Цвет лимонно – желтый
- Без вкуса и запаха
- t пл. = 112,8 0 С
- t кип. = 444 0 С
- Плотность — 2,07 г/см
- В воде не растворяется, не смачивается
- Растворяется в сероуглероде
108 0 C
10
96 0 С, при обычных условиях превращается в ромбическую. Выше 96 0 С Вставить Flash : Единая коллекция ЦОР — http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf Ниже 96 0 С 11″Моноклинная сера
- Желтые иглы — S 8
- Без вкуса и запаха
- t пл. = 119 0 С
- t кип. = 444 0 С
- Плотность — 1,96 г/см
- Устойчивая при t 96 0 С, при обычных условиях превращается в ромбическую.

Выше 96 0 С
Вставить Flash : Единая коллекция ЦОР — http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf
Ниже 96 0 С
11
S
S
S
S
S
S
S
Пластическая сера
- Мягкая, похожая на
резину коричневая масса,
растягивающаяся в нити;
- Плотность — 2,046 г/см
- Не растворяется в
сероуглероде
- При хранении становится
хрупкой, желтеет,
превращается в
ромбическую
12
2,05Å
Аллотропия серы
12
Получение пластической серы
108 0 C
t
S
S
S
S
S
S
S
Видео плеер химических экспериментов
13
Природные соединения серы
13
Фотография
Описание минерала
Химический состав
S
Цвет
Серно-желтый, желто-оранжевый, желто-бурый.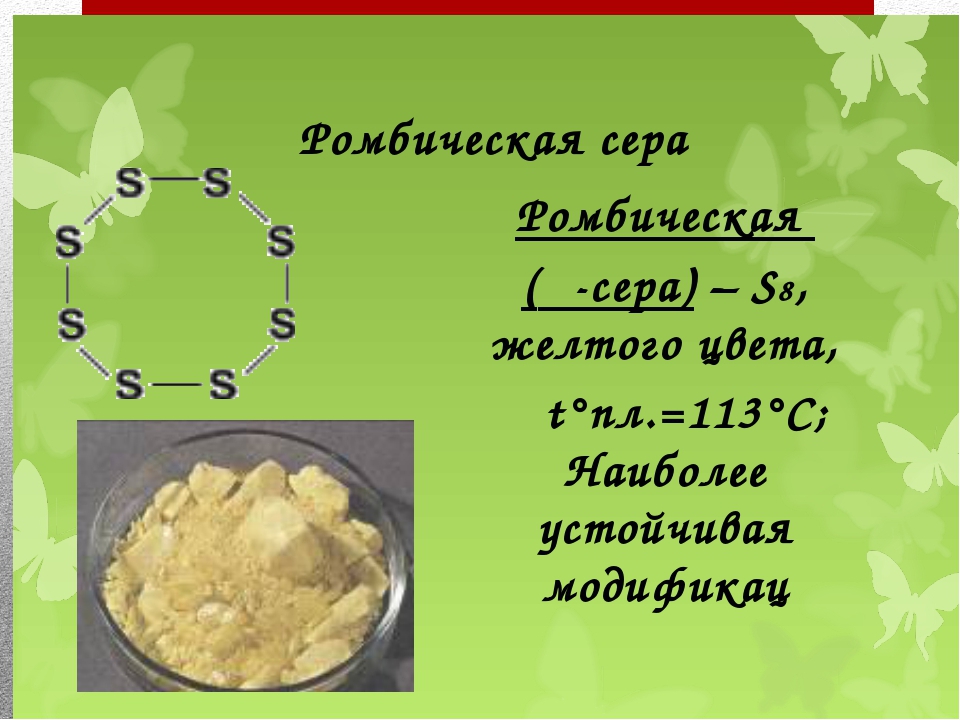
Плотность
2 – 2,1 г/см 3
Твердость
2
Сера
самородная
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
FeS 2
Цвет
Латунно-желтый
Плотность
4,95 — 5,1 г/см 3
Твердость
6 -6,5
Пирит
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
HgS
Цвет
Красный, коричневый, серый
Плотность
8,0 – 8,2 г/см 3
Твердость
2 – 2,5
Киноварь
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
ZnS
Цвет
Серовато-бурый, коричневый, реже желтый, красный
Плотность
3,9 – 4,2 г/см 3
Твердость
3,5 – 4
Сфалерит (цинковая обманка)
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
PbS
Цвет
Свинцово — серый
Плотность
7,2 – 7,6 г/см 3
Твердость
2,5
Галенит (свинцовый блеск)
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
Na 2 SO 4 * 10 H 2 O
Цвет
Бесцветный, белый
Плотность
1. 49 г/см 3
49 г/см 3
Твердость
1.5
Мирабилит (глауберова соль)
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
Цвет
Cu 2 S
Плотность
Синевато-черный, серый, черный, стальной черный
5,5 – 5,8 г/см 3
Твердость
2 — 3
Халькозин (медный колчедан)
Источник информации
W
Природные соединения серы
Фотография
Описание минерала
Химический состав
CaSO 4 ∙ 2H 2 O
Цвет
Белый, серый, красный
Плотность
2,31 – 2,33г/см 3
Твердость
1,5 — 2
Гипс
Источник информации
W
10/22/16
Химические свойства серы
Взаимодействие с водородом
Взаимодействие с металлами
Химические свойства серы
Взаимодействие c окислителями
Взаимодействие с кислородом
Взаимодействие с галогенами
Сера – типичный химически активный неметалл, вступающий в реакции со многими металлами, неметаллами и сложными веществами, но она менее активна по сравнению с кислородом и галогенами. Все эти реакции относятся к окислительно-восстановительным, в которых свободная сера выступает в роли как окислителя, так и восстановителя, проявляя при этом степени окисления S -2 ← S 0 → S +4 → S +6
Все эти реакции относятся к окислительно-восстановительным, в которых свободная сера выступает в роли как окислителя, так и восстановителя, проявляя при этом степени окисления S -2 ← S 0 → S +4 → S +6
Общий вывод
сера
22
Химические свойства серы
23
Взаимодействие с металлами
?
2 Na 0 + S 0 = Na +1 2 S -2
Na + S =
При взаимодействии с металлами сера проявляет окислительные свойства. Реакции протекают при нагревании и приводят к образованию сульфидов. Исключение – благородные металлы: золото, платина и иридий, которые с серой не реагируют.
Al + S =
2Al 0 + 3S 0 = Al +3 2 S -2 3
Fe 0 + S 0 = Fe +2 S -2
Fe + S =
Опыт «Взаимодействие натрия с серой»: http://files. school-collection.edu.ru/dlrstore/3e6b77cf-8fff-882a-d3c3-c50221c6eba9/index.htm
school-collection.edu.ru/dlrstore/3e6b77cf-8fff-882a-d3c3-c50221c6eba9/index.htm
Выводы
Видео плеер химических экспериментов
.
23
Химические свойства серы
23
Взаимодействие с водородом
?
Н 2
S + H 2 = H 2 S ↑
При пропускании водорода через расплав серы появляется характерный запах тухлых яиц, т.к. образуется газообразный сероводород. В этой реакции сера также проявляет окислительные свойства
S
Н 2 О
.
24
Химические свойства серы
25
Взаимодействие с кислородом
?
S + О 2 = SO 2
При нагревании сера вступает в реакцию с кислородом с образованием оксида серы(IV) SO 2 (сернистого газа). В этой реакции сера выступает в роли восстновителя.
Видео плеер химических экспериментов
.
25
Химические свойства серы
25
Взаимодействие с галогенами
?
S 0 + 2Cl 0 2 = S +4 Cl -1 4
S x Cl y
С галогенами (кроме йода) сера проявляет восстановительные свойства, образуя соединения разного состава: SF 6 , SF 4 , SF 2 , SCl 4 , S 2 Cl 2 , S 2 Br 2 . большинство этих соединений легко разлагается водой(гидролиз)
большинство этих соединений легко разлагается водой(гидролиз)
.
10/22/16
Губарева В.А.
26
Химические свойства серы
26
?
Взаимодействие с окислителями
При нагревании сера взаимодействует с сильными окислителями – кислотами и солями, например, с концентрированной серной кислотой, с нитратом калия, хлоратом калия. В этих реакция сера является восстановителем.
S 0 +2H 2 SO 4 = 3S +4 O 2 +2H 2 O
S + H 2 SO 4 =
(Конц.)
S + KClO 3 =
3S + KClO 3 = 2KCl + 3SO 2
Видео плеер химических экспериментов
Выводы
.
27
Расставить коэффициенты методом электронного баланса
27
0 +5 -1 +4
S + KClO 3 → KCl + SO 2 ↑
Электронный баланс
Порядок действий
Окисление
S 0
— 4ē → S +4
S 0
3
3
3
нок
12
3. Составить полуреакции окисления и восстановления
Составить полуреакции окисления и восстановления
1. Расставить степени окисления химических элементов
2. Подчеркнуть элементы, изменившие степень окисления
4. Расставить коэффициенты
Восстановление
Cl +5
Cl +5
+ 6ē → Cl -1
2
2
2
2
— восстановитель
— окислитель
28
10/22/16
Получение серы
28
В промышленных условиях серу получают без подъема руды на поверхность:
- путем выплавления из руды водяным паром
- окислением сероводорода
- восстановлением сернистого газа:
2 H 2 S + O 2 = 2 S + 2H 2 O
SO 2 + C = S + CO 2
SO 2 + 2 CО = S + 2 CO 2
сера
28
Применение серы
28
Круго
ворот
Производство красителей и пигментов, взрывчатых веществ (входит в состав пороха), искусственных волокон, люминофоров, производство спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. В металлургии.
Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. В металлургии.
Другое
28
Проверь свои знания!
31
Выбери правильный ответ
Процесс демеркуризации – это взаимодействие серы с
Восстановительные свойства сера
проявляет в реакции
Количество энергетических уровней
у атома серы.
Сера не будет реагировать с
Для серы не характерны степени
окисления
Вопрос 1
алюминием
ртутью
с кислородом
с водородом
три
два
2 +
4 +
азотом
водородом
А
Б
Б
А
Б
А
Б
А
А
Б
Вопрос 2
Вопрос 3
медью
железом
с ртутью
с натрием
четыре
один
6 +
1 +
кислородом
хлором
Г
В
Г
В
Г
В
Г
Г
В
В
Вопрос 4
Вопрос 5
31
Проверь свои знания!
32
Выберите уравнения реакций, в которых сера
является окислителем
S + Zn = ZnS
S + O 2 =SO 2
Ошибка
Молодец
S + Fe = FeS
S + Cu = CuS
Молодец
Молодец
S + Hg = HgS
3S + 2Al= Al 2 S 3
Ошибка
Молодец
3S+2KClO 3 =2KCl+SO 2
S + 3F 2 = SF 6
Ошибка
Молодец
S + 2Na =Na 2 S
S + H 2 = H 2 S
Молодец
Молодец
S + 2Cl 2 =SCl 4
2H 2 S +3O 2 =2H 2 O+2SO 2
Ошибка
Ошибка
32
Проверь свои знания!
32
32
Используемые источники
32
http://www. alhimikov.net/element/S.html
alhimikov.net/element/S.html
Академик. http://dic.academic.ru/dic.nsf/simvol/776
Популярная библиотека. http://n-t.ru/ri/ps/pb016.htm
http://www.chemnet.ru/rus/history/element/S.html
Викитека. http://ru.wikisource.org/wiki/ЭСБЕ/Сера,_в_технике
http://www.edimka.ru/text/sostav-produktov/sera
http://www.catalogmineralov.ru
http://ru.wikipedia.org/wiki
http://school-collection.edu.ru/
http://www.school316.spb.ru/chemistry/sera/index.html
34
Урок №22. Свойства и применение серы
СЕРА S
Cера в природе
Самородная сера
Украина, Поволжье, Центральная Азия и др
Сульфиды
PbS — свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
h3S – сероводород (в минеральных источниках и природном газе)
Белки
Волосы, кожные покровы, ногти…
Сульфаты
CaSO4 x 2h3O — гипс
MgSO4 x 7h3O – горькая соль (английская)
Na2SO4 x 10h3O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
Ромбическая (a — сера) — S8 t°пл. ρ = 2,07 г/см3. Наиболее устойчивая модификация.
| Моноклинная (b — сера) — S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. | Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
| ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ |
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение электронов по уровням и подуровням
| | Основное состояние 1s22s22p63s23p4 | |
Размещение электронов по | Степень | Валентность |
| | +2, -2 | В основном состоянии II |
| +4 | Первое возбуждённое состояние IV |
| | +6 | Второе возбуждённое состояние VI |
Получение серы
1. Промышленный метод — выплавление из руды с помощью водяного пара.
Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2= 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства серы
Сера — окислитель S0 + 2ē -> S-2 | Сера — восстановитель S — 2ē -> S+2; S — 4ē -> S+4; S — 6ē -> S+6 |
1) Сера реагирует со щелочными металлами без нагревания: 2Na + S -> Na2S ОПЫТ c остальными металлами (кроме Au, Pt) — при повышенной t°: 2Al + 3S –t°-> Al2S3 Zn + S –t°-> ZnS ОПЫТ Cu + S –t°-> CuS ОПЫТ 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S -> H2S 2P + 3S -> P2S3 C + 2S -> CS2 | 1) c кислородом: S + O2 –t°-> S+4O2 2S + 3O2 –t°;pt-> 2S+6O3 2) c галогенами (кроме йода): S + Cl2-> S+2Cl2 3) c кислотами — окислителями: S + 2H2SO4(конц) -> 3S+4O2 + 2H2O S + 6HNO3(конц) -> H2S+6O4 + 6NO2 + 2H2O Реакции диспропорционирования: 4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 + 3H2O
|
Тренажёр
№1 — Характеристика серы по её положению в периодической системе Д. И.
Менделеева
И.
Менделеева
Тренажёр №2 — Химические свойства серы
Тренажёр №3 — Взаимодействие серы с металлами
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
ЗАДАНИЯ
№1. Закончите уравнения реакций:S + O2
S + Na
S + H2
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =Это интересно. ..
..
Содержание серы в организме человека массой 70 кг — 140 г.
В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Знаете ли вы…
· Соединения серы могут служить лекарственными препаратами
· Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею
· Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства
· Железный купорос FeSO4×7H2O используют при анемии
· BaSO4 применяют при рентгенографическом исследовании желудка и кишечника
· Алюмокалиевые квасцы KAI(SO4) 2×12H2O — кровоостанавливающее средство при порезах
·
Минерал Na2SO4×10H2O носит
название «глауберова соль» в честь открывшего его в VIII веке
немецкого химика Глаубера И. Р. Глаубер во время своего
путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался
принимать пищу. Один из местных жителей направил его к источнику. Как только он
выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту
воду, из нее выкристаллизовалась соль Na2SO4×10H2O.
Сейчас ее применяют как слабительное в медицине, при окраске хлопчато-
бумажных тканей. Соль также находит применение в производстве стекла
Р. Глаубер во время своего
путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался
принимать пищу. Один из местных жителей направил его к источнику. Как только он
выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту
воду, из нее выкристаллизовалась соль Na2SO4×10H2O.
Сейчас ее применяют как слабительное в медицине, при окраске хлопчато-
бумажных тканей. Соль также находит применение в производстве стекла
· Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями
· Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Влияние химических элементов на свойства стали.
Условные обозначения химических элементов:
| хром ( Cr ) — Х никель ( Ni ) — Н молибден ( Mo ) — М титан ( Ti ) — Т медь ( Cu ) — Д ванадий ( V ) — Ф вольфрам ( W ) — В | азот ( N ) — А алюминий ( Аl ) — Ю бериллий ( Be ) — Л бор ( B ) — Р висмут ( Вi ) — Ви галлий ( Ga ) — Гл | иридий ( Ir ) — И кадмий ( Cd ) — Кд кобальт ( Co ) — К кремний ( Si ) — C магний ( Mg ) — Ш марганец ( Mn ) — Г | свинец ( Pb ) — АС ниобий ( Nb) — Б селен ( Se ) — Е углерод ( C ) — У фосфор ( P ) — П цирконий ( Zr ) — Ц |
ВЛИЯНИЕ ПРИМЕСЕЙ НА СТАЛЬ И ЕЕ СВОЙСТВА
Углерод — находится в стали обычно в виде химического соединения Fe3C, называемого цементитом. С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
Кремний — если он содержится в стали в небольшом количестве, особого влияния на ее свойства не оказывает.(Полезная примесь; вводят в качестве активного раскислителя и остается в стали в кол-ве 0,4%)
Марганец — как и кремний, содержится в обыкновенной углеродистой стали в небольшом количестве и особого влияния на ее свойства также не оказывает. (Полезная примесь; вводят в сталь для раскисления и остается в ней в кол-ве 0,3-0,8%. Марганец уменьшает вредное влияние кислорода и серы.
Сера — является вредной примесью. Она находится в стали главным образом в виде FeS. Это соединение сообщает стали хрупкость при высоких температурах, например при ковке, — свойство, которое называется красноломкостью. Сера увеличивает истираемость стали, понижает сопротивление усталости и уменьшает коррозионную стойкость. В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
Фосфор — также является вредной примесью. Снижает вязкость при пониженных температурах, то есть вызывает хладноломкость. Обрабатываемость стали фосфор несколько улучшает, так как способствует отделению стружки.
ЛЕГИРУЮЩИЕ ЭЛЕМЕНТЫ И ИХ ВЛИЯНИЕ НА СВОЙСТВА СТАЛИ
Хром (Х) — наиболее дешевый и распространенный элемент. Он повышает твердость и прочность, незначительно уменьшая пластичность, увеличивает коррозионную стойкость; содержание больших количеств хрома делает сталь нержавеющей и обеспечивает устойчивость магнитных сил.
Никель (Н) — сообщает стали коррозионную стойкость, высокую прочность и пластичность, увеличивает прокаливаемость, оказывает влияние на изменение коэффициента теплового расширения. Никель – дорогой металл, его стараются заменить более дешевым.
Вольфрам (В) — образует в стали очень твердые химические соединения – карбиды, резко увеличивающие твердость и красностойкость. Вольфрам препятствует росту зерен при нагреве, способствует устранению хрупкости при отпуске. Это дорогой и дефицитный металл.
Ванадий (Ф) — повышает твердость и прочность, измельчает зерно. Увеличивает плотность стали, так как является хорошим раскислителем, он дорог и дефицитен.
Кремний (С)- в количестве свыше 1% оказывает особое влияние на свойства стали: содержание 1-1,5% Si увеличивает прочность, при этом вязкость сохраняется. При большем содержании кремния увеличивается электросопротивление и магнитопроницаемость. Кремний увеличивает также упругость, кислостойкость, окалиностойкость.
Марганец (Г) — при содержании свыше 1% увеличивает твердость, износоустойчивость, стойкость против ударных нагрузок, не уменьшая пластичности.
Кобальт (К) — повышает жаропрочность, магнитные свойства, увеличивает сопротивление удару.
Молибден (М) — увеличивает красностойкость, упругость, предел прочности на растяжение, антикоррозионные свойства и сопротивление окислению при высоких температурах.
Титан (Т) — повышает прочность и плотность стали, способствует измельчению зерна, является хорошим раскислителем, улучшает обрабатываемость и сопротивление коррозии.
Ниобий (Б) — улучшает кислостойкость и способствует уменьшению коррозии в сварных конструкциях.
Алюминий (Ю) — повышает жаростойкость и окалиностойкость.
Медь (Д) — увеличивает антикоррозионные свойства, она вводится главным образом в строительную сталь.
Церий — повышает прочность и особенно пластичность.
Цирконий (Ц) — оказывает особое влияние на величину и рост зерна в стали, измельчает зерно и позволяет получать сталь с заранее заданной зернистостью.
Лантан, цезий, неодим — уменьшают пористость, способствуют уменьшению содержания серы в стали, улучшают качество поверхности, измельчают зерно.
Элемент Сера Сера
Сера ( сера ) — химический элемент. в периодической таблице, которая имеет символ S и атомный номер 16. Обильный безвкусный мультивалентный неметалл без запаха, сера наиболее известен как желтые кристаллы и встречается во многих сульфидах и сульфатах. минералы и даже в естественном виде (особенно в вулканических регионах).Это важный элемент всех живых организмов и необходим в нескольких аминокислотах и, следовательно, во многих белках. Это прежде всего используется в удобрениях, но также широко используется в порохе, слабительных, спички и инсектициды. Этот неметалл имеет бледно-желтый цвет, мягкий, легкий, с отчетливым запах в сочетании с водородом (запах тухлых яиц). Горит с синее пламя, излучающее специфический удушающий запах (диоксид серы, СО 2 ).Сера нерастворима в воде, но растворима в углероде. дисульфид. Общие степени окисления серы включают -2, +2, +4 и +6. Во всех состояниях, твердом, жидком и газообразном, сера имеет аллотропные свойства. формы, отношения которых до конца не изучены. Кристаллический можно показать, что сера образует 8-членное серное кольцо, S 8 .Сера может быть получена в двух кристаллических модификациях, в орторомбической октаэдры, или в моноклинных призмах, первая из которых более стабилен при обычных температурах. Он используется во многих промышленных процессах, таких как производство серная кислота (H 2 SO 4 ) для аккумуляторов, производство пороха, и вулканизация резины. Сера используется как фунгицид, а также при производстве фосфорных удобрений. Сульфиты используются для отбеливания бумаги и сухофруктов. Сера тоже находит применение в спичках и фейерверках. Используются тиосульфат натрия или аммония. как средства для фиксации фотографий.Английская соль, сульфат магния, банка использоваться как слабительное, как добавка для ванн, как отшелушивающее средство или магний добавка в питание растений. Аминокислоты цистеин, метионин, гомоцистеин и таурин содержат сера, как и некоторые распространенные ферменты, что делает серу необходимым компонентом всех живых клеток. Дисульфидные связи между полипептидами очень важен в сборке и структуре белка. Некоторые формы бактерий используйте сероводород (H 2 S) вместо воды в качестве донор электронов в примитивном процессе, похожем на фотосинтез.Сера поглощается растениями из почвы в виде сульфат-иона. Неорганические формы серы входит в состав железо-серных кластеров, а сера является мостиковым лигандом в сайте Cu A цитохром с оксидазы.Сера (санскрит, sulvere ; лат. sulpur ) была известна в древности и в библейских история Пятикнижия (Бытие). Гомер упомянул «серу, предотвращающую вредителей» в 9 веке до нашей эры и в 424 году до нашей эры племя Бутье разрушило стены города путем сжигания смеси угля, серы и смолы под ними.Где-то в 12 веке китайцы изобрели пистолет. порошок, представляющий собой смесь нитрата калия (KNO 3 ), углерод и сера. Ранние алхимики придавали сере собственный алхимический символ, который представлял собой треугольник на вершине креста. Экспериментируя, алхимики знали, что элемент ртуть может соединяться с серой. В конце 1770-х годов Антуан Лавуазье помог убедить ученых сообщества, что сера была элементом, а не соединением. появлениеСера встречается в природе в больших количествах в сочетании с другими элементами. в сульфидах (например, пиритах) и сульфатах (например, гипсе). Это в свободном виде встречается возле горячих источников и вулканических регионов и в таких рудах, как киноварь, галенит, сфалерит и антимонит. Этот элемент также в небольших количествах содержится в угле и нефти, которые производят диоксид серы при горении. Стандарты топлива все чаще требуют серы быть извлеченным из ископаемого топлива, потому что диоксид серы объединяет с каплями воды, чтобы вызвать кислотный дождь.Эта извлеченная сера затем очищается и составляет большую часть производства серы. Его также добывают на побережье Мексиканского залива США, закачивая горячую воду в серосодержащие отложения (например, соляные купола), которые плавят серу. Затем расплавленная сера перекачивается на поверхность. Через свои основные производные, серная кислота, сера считается одним из наиболее важных элементы, используемые в качестве промышленного сырья. Это имеет первостепенное значение во все отрасли мировых промышленных комплексов и комплексов удобрений.Производство серной кислоты является основным конечным потребителем серы, и ее потребление серной кислоты считается одним из лучших показателей индустриальное развитие страны. Больше серной кислоты производится в США каждый год, чем любое другое химическое вещество.Отличительные цвета вулканической луны Юпитера Ио взяты из различные формы мультина, твердой и газообразной серы. А также есть темная область возле лунного кратера Аристарх, которая может быть серой депозит.Сера также присутствует во многих типах метеоритов. Многие из неприятных запахов органических веществ основаны на серосодержащих веществах. такие соединения, как сероводород, имеющий характерный запах тухлых яиц. Растворенный в воде сероводород является кислым (pK a1 = 7,00, pK a2 = 12,92) и будет реагировать с металлами с образованием серия сульфидов металлов. Встречаются природные сульфиды металлов, особенно те из железа.Сульфиды железа называются железным колчеданом, так называемым золото дураков . Интересно, что пириты могут показывать полупроводниковые свойства. [1] Галенит, сульфид свинца природного происхождения (как детектор в выпрямителе типа «кошачий волос») был, конечно, оригинальным полупроводником. обнаруженный.Полимерный нитрид серы имеет металлические свойства, даже если он не содержит атомов металлов. Это соединение также имеет необычный электрические и оптические свойства.Аморфная или «пластичная» сера производится путем быстрого охлаждения кристаллической серы. Рентгеновские исследования показывают, что аморфная форма может иметь восемь атомов на спиральную спиральную состав К другим важным соединениям серы относятся:
Когда осаждаются сульфидные минералы, изотопное уравновешивание между твердыми частицами и жидкостью может вызвать небольшие различия в DS-34 ценности когенетических минералов.Различия между минералами может использоваться для оценки температуры уравновешивания. DC-13 и dS-34 сосуществующих карбонатов и сульфидов можно использовать для определить pH и летучесть кислорода рудоносного флюида во время рудное образование. В большинстве лесных экосистем сульфаты получают в основном из атмосферы; выветривание рудных минералов и эвапоритов также вносит свой вклад сера.Сера с характерным изотопным составом была используется для определения источников загрязнения, а обогащенная сера добавлен как индикатор в гидологических исследованиях. Отличия в натуральном изобилие также можно использовать в системах, где достаточно вариация в составе С-34 компонентов экосистемы. Озера Скалистых гор считается, что в них преобладают атмосферные источники сульфата. Было обнаружено, что значения dS-34 отличаются от значений в озерах, где, как считается, преобладают водораздельными источниками сульфата. Сероуглерод, сероводород и диоксид серы со всеми следует обращаться осторожно. Помимо того, что токсичен (более токсичен, чем цианид), диоксид серы реагирует с атмосферным вода, чтобы произвести кислотный дождь. При высокой концентрации в атмосфере он вступает в реакцию с водой в легких с образованием там серной кислоты; это вызывает немедленное кровотечение, легкие наполняются кровью и наступает удушье. У существ без легких, таких как насекомые или растения, иначе предотвращает дыхание.Хотя при низких концентрациях он имеет очень неприятный запах, в более высоких концентрациях сера быстро притупляет обоняние, поэтому потенциальные жертвы могут не знать о его присутствии, пока не испытают его возможные смертельные последствия. Элемент традиционно пишется сера в США и Канада, но серы в Великобритании, Новой Зеландии и Австралии. ИЮПАК принял написание «сера», как и Королевское общество. номенклатурного комитета по химии.Номер ссылки | |
10 интересных фактов о сере
Сера — это элемент под номером 16 в периодической таблице, с символом элемента S и атомным весом 32,066. Этот обычный неметалл содержится в продуктах питания, многих бытовых продуктах и даже в вашем собственном теле.
Факты о сере
Вот 10 интересных фактов о сере:
- Сера — жизненно важный элемент. Он содержится в аминокислотах (цистеине и метионине) и белках.Соединения серы — вот почему лук заставляет плакать, почему спаржа дает мочу странный запах, почему чеснок имеет особый аромат и почему тухлые яйца пахнут так ужасно.
- Хотя многие соединения серы имеют сильный запах, чистый элемент не имеет запаха. Соединения серы также влияют на обоняние. Например, сероводород (H 2 S, виновник запаха тухлых яиц) на самом деле притупляет обоняние, поэтому запах сначала очень сильный, а затем исчезает. Это прискорбно, потому что сероводород — токсичный и потенциально смертельный газ.Элементарная сера считается нетоксичной.
- Человечество знает о сере с древних времен. Элемент, также известный как сера, в основном исходит из вулканов. В то время как большинство химических элементов встречаются только в соединениях, сера — один из относительно немногих элементов, которые встречаются в чистом виде.
- При комнатной температуре и давлении сера представляет собой твердое вещество желтого цвета. Обычно он выглядит как порошок, но также образует кристаллы. Одна интересная особенность кристаллов заключается в том, что они самопроизвольно меняют форму в зависимости от температуры.Чтобы наблюдать переход, расплавьте серу, дайте ей остыть до кристаллизации и наблюдайте за формой кристаллов с течением времени.
- Вы были удивлены, что серу можно кристаллизовать, просто охладив расплавленный порошок? Это распространенный метод выращивания металлических кристаллов. Хотя сера является неметаллом, она, как и металлы, не растворяется в воде или других растворителях (хотя она растворяется в сероуглероде). Если вы попробовали проект с кристаллами, еще одним сюрпризом мог быть цвет серной жидкости при нагревании порошка.Жидкая сера может казаться кроваво-красной. Вулканы, извергающие расплавленную серу, демонстрируют еще одну интересную особенность этого элемента: он горит синим пламенем от производимого диоксида серы. Вулканы с серой, кажется, текут с голубой лавой.
- Как вы пишете название элемента номер 16, вероятно, зависит от того, где и когда вы выросли. Международный союз чистой и прикладной химии (IUPAC) принял написание сера в 1990 году, как и Королевское химическое общество в 1992 году.До этого момента в Великобритании и странах, где использовались римские языки, использовалось написание сера, . Первоначальное написание было латинским словом сера, которое было преобразовано в серу по эллинизму.
- Сера имеет множество применений. Это компонент пороха, который, как полагают, использовался в древнем огнемете под названием Greek Fire . Это ключевой компонент серной кислоты, которая используется в лабораториях и при производстве других химикатов. Он содержится в антибиотике пенициллина и используется для дезинфекции от болезней и вредителей.Сера входит в состав удобрений, а также фармацевтических препаратов.
- Сера образуется в результате альфа-процесса в массивных звездах. Это 10-й по численности элемент во Вселенной. Он находится в метеоритах и на Земле в основном возле вулканов и горячих источников. Содержание элемента выше в ядре, чем в земной коре. По оценкам, на Земле достаточно серы, чтобы образовать два тела размером с Луну. Обычные минералы, содержащие серу, включают пирит или дурацкое золото (сульфид железа), киноварь (сульфид ртути), галенит (сульфид свинца) и гипс (сульфат кальция).
- Некоторые организмы могут использовать соединения серы в качестве источника энергии. Примером являются пещерные бактерии, которые производят особые сталактиты, называемые соплями, из которых капает серная кислота. Кислота достаточно концентрирована, чтобы обжечь кожу и прорезать одежду, если вы окажетесь под минералами. Естественное растворение минералов кислотой образует новые пещеры.
- Хотя люди всегда знали о сере, позже она не была признана элементом (за исключением алхимиков, которые также считали элементы огня и земли).Это было в 1777 году, когда Антуан Лавуазье представил убедительные доказательства того, что это вещество действительно было отдельным уникальным элементом, достойным места в таблице Менделеева. Элемент имеет степень окисления от -2 до +6, что позволяет ему образовывать соединения со всеми другими элементами, кроме благородных газов.
Сера | Безграничная химия
Свойства серы
Сера горит синим пламенем, не растворяется в воде и образует многоатомные аллотропы.
Цели обучения
Опишите свойства серы.
Основные выводы
Ключевые моменты
- Сера образует многоатомные молекулы с различными химическими формулами. Самый известный его аллотроп — октасера, S 8 , представляет собой мягкое твердое вещество желтого цвета со слабым запахом. Из-за изменений межмолекулярных взаимодействий он претерпевает фазовые превращения от α-октасеры до β-полиморфа и до γ-серы при высоких температурах.
- При температурах выше точки кипения октасеры происходит деполимеризация. Расплавленная сера имеет темно-красный цвет при температуре выше 200 ° C.Различные аллотропы имеют разную плотность около 2 г / см 3 . Стабильные аллотропы — отличные электроизоляторы.
- Сера горит синим пламенем, образуя двуокись серы с удушающим запахом. Он нерастворим в воде, но растворим в сероуглероде. S + 4 , S 6+ более распространены, чем S 2+ . Более высокие состояния ионизации существуют только с сильными окислителями, такими как фтор, кислород и хлор.
Ключевые термины
- деполимеризация : разложение полимера на более мелкие фрагменты.
- октасера : Наиболее распространенный аллотроп серы (S8), содержащий восемь атомов в кольце.
- аллотроп : Любая форма чистого элемента с совершенно иной молекулярной структурой.
октасера
Сера встречается в различных многоатомных аллотропных формах. Самый известный аллотроп — октасера, cyclo-S 8 . Октасера - мягкое твердое вещество ярко-желтого цвета со слабым запахом, похожим на запах спичек. Плавится при 115.21 ° C, кипит при 444,6 ° C и легко возгоняется.
Циклооктасера : Структура молекулы циклооктасеры, S 8 .
При 95,2 ° C, ниже температуры плавления, циклооктасера превращается из α-октасеры в β-полиморф. Структура кольца S 8 практически не изменяется из-за этого фазового перехода, который влияет на межмолекулярные взаимодействия. Между температурами плавления и кипения октасера снова меняет свою аллотропную форму, превращаясь из β-октасеры в γ-серу.Опять же, это сопровождается более низкой плотностью, но повышенной вязкостью из-за образования полимеров. Однако при еще более высоких температурах вязкость уменьшается по мере того, как происходит деполимеризация. Расплавленная сера приобретает темно-красный цвет при температуре выше 200 ° C. Плотность серы составляет около 2 г / см 3 , в зависимости от аллотропа. Все стабильные аллотропы серы являются отличными электрическими изоляторами.
Химические свойства серы
Сера горит синим пламенем, сопровождающимся образованием диоксида серы, отличается своеобразным удушающим запахом.Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол. Первая и вторая энергии ионизации серы составляют 999,6 и 2252 кДж / моль соответственно. Несмотря на такие цифры, S 2+ встречается редко, а S +4 и S 6+ встречаются чаще. Четвертая и шестая энергии ионизации составляют 4556 и 8495,8 кДж / моль. Величина фигур обусловлена переносом электронов между орбиталями; эти состояния стабильны только с сильными окислителями, такими как фтор, кислород и хлор.
Плавление и горение серы : Сера горит синим пламенем и при плавлении образует кроваво-красную жидкость.
Соединения серы
Сера образует стабильные соединения с большинством элементов, кроме благородных газов.
Цели обучения
Обсудите несколько примеров соединений серы.
Основные выводы
Ключевые моменты
- Сероводород имеет слабую кислотность в воде и чрезвычайно токсичен. Сера может образовывать цепочки с самой собой (цепная реакция).Полисульфиды образуются при восстановлении элементарной серы. Полисульфаны — это протонированные полисульфиды. Восстановление серы дает сульфидные соли.
- Горящая сера образует основные оксиды серы. Оксиды серы образуют множество оксианионов, которые связаны с многочисленными кислотами. Олеум — это раствор пиросерной кислоты и серной кислоты. Пероксиды превращают серу в нестабильные сульфоксиды.
- Соединения серы с галогенами включают гексафторид серы, дихлорид серы и хлорсерную кислоту.Тионилхлорид — обычный реагент в органическом синтезе. Тетранитрид и тиоцианаты тетрасеры представляют собой соединения серы и азота. Сульфиды фосфора многочисленны.
- Основные руды многих металлов — сульфиды. Они образуются при реакции сероводорода с солями металлов. Потускнение — это процесс коррозии металла серой.
- Серосодержащие органические соединения включают тиолы (серные аналоги спиртов) и тиоэфиры (серные аналоги простых эфиров).Соединения со связями углерод – сера встречаются редко. Сероорганические соединения являются причиной некоторых неприятных запахов разлагающихся органических веществ.
- Сера-серные связи являются структурным компонентом белков, придающим им жесткость. Вулканизация — это процесс нагревания резины и серы до образования дисульфидных мостиков между изопреновыми звеньями полимера. Это увеличивает жесткость резины.
Ключевые термины
- катенация : Способность нескольких элементов, особенно углерода, образовывать цепи и кольца путем образования ковалентных связей с атомами одного и того же элемента.
- вулканизация : Процесс отверждения резины с использованием тепла и серы.
Обычные степени окисления серы находятся в диапазоне от -2 до +6. Сера образует устойчивые соединения со всеми элементами, кроме благородных газов. У некоторых органических соединений серы запах зависит от их концентрации. Серосодержащий монотерпеноид меркаптан грейпфрута имеет характерный запах грейпфрута в малых концентрациях, но имеет неприятный запах тиола в больших концентрациях.+ [/ латекс]
Газообразный сероводород и гидросульфид-анион чрезвычайно токсичны для млекопитающих, поскольку они подавляют способность гемоглобина и некоторых цитохромов переносить кислород подобно цианиду и азиду.
Восстановление серы
Восстановление элементарной серы дает полисульфиды, которые состоят из цепочек атомов серы, оканчивающихся центрами S — :
[латекс] 2 \ text {Na} + \ text {S} _8 \ rightarrow \ text {Na} _2 \ text {S} _8 [/ latex]
Лазурит : Лазурит своим синим цветом обязан серному радикалу.
Эта реакция подчеркивает, возможно, единственное наиболее отличительное свойство серы: ее способность катентировать (связываться с собой путем образования цепей). Протонирование этих полисульфид-анионов дает полисульфаны, H 2 S x , где x = 2, 3 и 4.
В конечном итоге восстановление серы дает сульфидные соли:
[латекс] 16 \ text {Na} + \ text {S} _8 \ rightarrow 8 \ text {Na} _2 \ text {S} [/ latex]
Взаимное превращение этих веществ используется в натриево-серных батареях.
Анион-радикал S 3 — придает голубой цвет минералу лазурита. С очень сильными окислителями S 8 может быть окислен, например, с образованием бициклического S 8 2+ .
Оксиды серы
Основные оксиды серы получают сжиганием серы:
[латекс] \ text {S} + \ text {O} _2 \ rightarrow \ text {SO} _2 [/ latex],
[латекс] 2 \ text {SO} _2 + \ text {O} _2 \ rightarrow 2 \ text {SO} _3 [/ latex]
Известны и другие оксиды — монооксид серы и моно- и диоксиды серы, но они нестабильны.Оксиды серы образуют многочисленные оксианионы с формулой SO n 2–. Диоксид серы и сульфиты (SO 3 2-) относятся к нестабильной сернистой кислоте (H 2 SO 3 ). Триоксид и сульфаты серы (SO 4 2-) относятся к серной кислоте. Серная кислота и SO 3 объединяются с образованием олеума, раствора пиросерной кислоты (H 2 S 2 O 7 ) в серной кислоте.
Пероксиды превращают серу в нестабильные соединения, такие как S 8 O, сульфоксид.Пероксимоносерная кислота (H 2 SO 5 ) и пероксидисерные кислоты (H 2 S 2 O 8 ) образуются под действием SO 3 на концентрированный H 2 O 2, и H 2 SO 4 на концентрированном H 2 O 2 соответственно. Соли тиосульфата (S 2 O 3 2-), иногда называемые «гипосульфитами», используются в фотографической фиксации (HYPO) и в качестве восстановителей.Эти соли содержат серу в двух степенях окисления. Дитионит натрия (S 2 O 4 2-) содержит анион дитионита с более высокой степенью восстановления; Дитионат натрия (Na 2 S 2 O 6 ) является первым членом политионовой кислоты (H 2 S n O 6 ), где n может варьироваться от 3 до многих.
Пероксидисерная кислота : Пероксидисерная кислота (H 2 S 2 O 8 ) образуется под действием H 2 SO 4 на концентрированном H 2 O 2 .
Галогениды серы
Существует два основных фторида серы. Гексафторид серы — это плотный газ, используемый в качестве инертного и нетоксичного пропеллента. Тетрафторид серы — редко используемый органический реагент, который очень токсичен. Их хлорированные аналоги — дихлорид серы и монохлорид серы. Сульфурилхлорид и хлорсерная кислота являются производными серной кислоты; тионилхлорид (SOCl 2 ) — обычный реагент в органическом синтезе.
Соединения серы и азота
Важным соединением S – N является каркасный тетранитрид тетрасеры (S 4 N 4 ).Нагревание этого соединения дает полимерный нитрид серы ((SN) x), который имеет металлические свойства, даже если он не содержит атомов металла. Тиоцианаты содержат группу SCN — . Окисление тиоцианата дает тиоцианоген, (SCN) 2 с связностью NCS – SCN. Сульфиды фосфора многочисленны.
Сера с металлами
Основные руды меди, цинка, никеля, кобальта, молибдена и других металлов — сульфиды. Эти материалы, как правило, представляют собой полупроводники темного цвета, которые не подвержены воздействию воды или даже многих кислот.Они образуются при реакции сероводорода с солями металлов. Минерал галенит (PbS) был первым продемонстрированным полупроводником. Он использовался в качестве выпрямителя сигнала в кошачьих усах ранних кристаллических радиоприемников. Улучшение этих руд, обычно путем обжига, является дорогостоящим и экологически опасным. Сера разъедает многие металлы в результате процесса, называемого потускнением.
Органические соединения с серой
Ниже приведены некоторые из основных классов серосодержащих органических соединений:
- Тиолы или меркаптаны (поскольку они захватывают ртуть в качестве хелаторов) являются серными аналогами спиртов; обработка тиолов основанием дает ионы тиолата.
- Тиоэфиры — серные аналоги простых эфиров. Ионы сульфония имеют три группы, присоединенные к катионному серному центру. Диметилсульфониопропионат (ДМСП) является одним из таких соединений, важных в круговороте морской органической серы.
- Сульфоксиды и сульфоны представляют собой тиоэфиры с одним и двумя атомами кислорода, присоединенными к атому серы, соответственно. Самый простой сульфоксид, диметилсульфоксид, является обычным растворителем; обычный сульфон — сульфолан. Сульфоновые кислоты используются во многих моющих средствах.
- Соединения со связями углерод-сера встречаются редко, за исключением сероуглерода, летучей бесцветной жидкости, структурно подобной диоксиду углерода.В отличие от монооксида углерода, моносульфид углерода стабилен только как разбавленный газ, например, в межзвездной среде. Сероорганические соединения являются причиной некоторых неприятных запахов разлагающихся органических веществ.
Вулканизация
Сера-серные связи являются структурным компонентом, повышающим жесткость резины, аналогичным биологической роли дисульфидных мостиков в повышении жесткости белков. В наиболее распространенном типе промышленного «отверждения» или отверждения и упрочнения натурального каучука элементарная сера нагревается с каучуком до тех пор, пока химические реакции не образуют дисульфидные мостики между изопреновыми звеньями полимера.Из-за тепла и серы этот процесс был назван вулканизацией в честь римского бога кузницы и вулканизма.
Свойства серы | Введение в химию
Цель обучения
- Опишите свойства серы.
Ключевые моменты
- Сера образует многоатомные молекулы с различными химическими формулами. Самый известный его аллотроп — октасера, S 8 , представляет собой мягкое твердое вещество желтого цвета со слабым запахом.Из-за изменений межмолекулярных взаимодействий он претерпевает фазовые превращения от α-октасеры до β-полиморфа и до γ-серы при высоких температурах.
- При температурах выше точки кипения октасеры происходит деполимеризация. Расплавленная сера имеет темно-красный цвет при температуре выше 200 ° C. Различные аллотропы имеют разную плотность около 2 г / см 3 . Стабильные аллотропы — отличные электроизоляторы.
- Сера горит синим пламенем, образуя двуокись серы с удушающим запахом.Он нерастворим в воде, но растворим в сероуглероде. S + 4 , S 6+ более распространены, чем S 2+ . Более высокие состояния ионизации существуют только с сильными окислителями, такими как фтор, кислород и хлор.
Условия
- деполимеризация — разложение полимера на более мелкие фрагменты.
- октасера Самый распространенный аллотроп серы (S 8 ), содержащий восемь атомов в кольце.
- аллотроп: Любая форма чистого элемента, имеющая совершенно иную молекулярную структуру.
Октасера
Сера встречается в различных многоатомных аллотропных формах. Самый известный аллотроп — октасера, cyclo-S 8 . Октасера - мягкое твердое вещество ярко-желтого цвета со слабым запахом, похожим на запах спичек. Он плавится при 115,21 ° C, кипит при 444,6 ° C и легко возгоняется.
Циклооктасера Структура молекулы циклооктасеры, S 8 .При 95,2 ° C, ниже температуры плавления, циклооктасера превращается из α-октасеры в β-полиморф.Структура кольца S 8 практически не изменяется из-за этого фазового перехода, который влияет на межмолекулярные взаимодействия. Между температурами плавления и кипения октасера снова меняет свою аллотропную форму, превращаясь из β-октасеры в γ-серу. Опять же, это сопровождается более низкой плотностью, но повышенной вязкостью из-за образования полимеров. Однако при еще более высоких температурах вязкость уменьшается по мере того, как происходит деполимеризация. Расплавленная сера приобретает темно-красный цвет при температуре выше 200 ° C.Плотность серы составляет около 2 г / см 3 , в зависимости от аллотропа. Все стабильные аллотропы серы являются отличными электрическими изоляторами.
Химические свойства серы
Сера горит синим пламенем, сопровождающимся образованием диоксида серы, отличается своеобразным удушающим запахом. Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол. Первая и вторая энергии ионизации серы равны 999.6 и 2252 кДж / моль соответственно. Несмотря на такие цифры, S 2+ встречается редко, а S +4 и S 6+ встречаются чаще. Четвертая и шестая энергии ионизации составляют 4556 и 8495,8 кДж / моль. Величина фигур обусловлена переносом электронов между орбиталями; эти состояния стабильны только с сильными окислителями, такими как фтор, кислород и хлор.
Плавление и сжигание серы Сера горит синим пламенем и при плавлении образует кроваво-красную жидкость. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Это элементаль — Элемент сера
Что в названии? От санскритского слова sulvere и латинского sulphurium .
Сказать что? Сера произносится как SUL-fer .
Сера, десятый по содержанию элемент во Вселенной, была известна с древних времен.Примерно в 1777 году Антуан Лавуазье убедил остальную часть научного сообщества в том, что сера является элементом. Сера входит в состав многих распространенных минералов, таких как галенит (PbS), гипс (CaSO 4 · 2 (H 2 O), пирит (FeS 2 ), сфалерит (ZnS или FeS), киноварь (HgS). ), антимонит (Sb 2 S 3 ), эпсомит (MgSO 4 · 7 (H 2 O)), целестит (SrSO 4 ) и барит (BaSO 4 ). Почти 25% Производимая сегодня сера извлекается при переработке нефти и в качестве побочного продукта при извлечении других материалов из серосодержащих руд.Большая часть производимой сегодня серы добывается из подземных отложений, обычно обнаруживаемых вместе с солевыми отложениями, с помощью процесса, известного как процесс Фраша.
Сера — бледно-желтый, хрупкий материал без запаха. Он отображает три аллотропные формы: ромбическую, моноклинную и аморфную. Орторомбическая форма — наиболее стабильная форма серы. Моноклинная сера существует при температурах от 96 ° C до 119 ° C и при охлаждении возвращается в орторомбическую форму. Аморфная сера образуется при быстром охлаждении расплавленной серы.Аморфная сера мягкая и эластичная и в конечном итоге возвращается к ромбической форме.
Большая часть производимой серы используется в производстве серной кислоты (H 2 SO 4 ). Большое количество серной кислоты, почти 40 миллионов тонн, используется каждый год для производства удобрений, свинцово-кислотных аккумуляторов и во многих промышленных процессах. Меньшие количества серы используются для вулканизации натурального каучука, в качестве инсектицида (греческий поэт Гомер упомянул «серу, предотвращающую вредителей» почти 2800 лет назад!), При производстве пороха и в качестве красителя.
Помимо серной кислоты, сера образует другие интересные соединения. Сероводород (H 2 S) — это газ, который пахнет тухлыми яйцами. Диоксид серы (SO 2 ), образующийся при сжигании серы на воздухе, используется как отбеливающий агент, растворитель, дезинфицирующее средство и как хладагент. В сочетании с водой (H 2 O) диоксид серы образует сернистую кислоту (H 2 SO 3 ), слабую кислоту, которая является основным компонентом кислотных дождей.
Физические свойства — Мой любимый элемент: сера
Сера — неметалл, обнаруженный в периодической таблице Менделеева, и занимает группу номер 16.4. В этом случае в его внешней оболочке присутствует 6 валентных электронов, которые образуют ионные или ковалентные связи с другими атомами.
Уровень энергии 1: 2 электрона
Уровень энергии 2: 8 электронов
Уровень энергии 3: 6 электронов
Физические свойства
1. Радиус
При перемещении слева направо по периодической В таблице атомы начинают уменьшаться в размерах и уменьшаются в радиусе.Это потому, что вы добавляете больше протонов, и эти протоны притягивают электроны к ядру. По мере того, как вы спускаетесь по группе, радиус увеличивается, потому что вы добавляете новый уровень энергии, тем самым увеличивая расстояние электронов от ядра. Сера находится на 3-м энергетическом уровне, и из-за того, что она расположена в крайнем правом углу, она имеет небольшой атомный радиус и увеличенное количество протонов, притягивающих электроны. Это притяжение между ядром и электронами настолько велико, что радиус серы меньше, чем большинство других элементов периодической таблицы.Радиус Sulphur: 127 метров.
2. Плотность
Плотность атома зависит от двух вещей: объема и массы этого атома. Объем по мере того, как вы перемещаетесь по группе, увеличивается, потому что атомный радиус также увеличивается. Однако в этом случае сера имеет небольшой объем из-за ее особенно малого радиуса. Затем масса атома увеличивается по мере того, как вы спускаетесь по группе и движетесь вправо. Эта масса указана в каждой периодической таблице, и из-за увеличения количества протонов и электронов эта масса также будет увеличиваться.Сера имеет большую массу, чем большинство других элементов, но имеет небольшой объем. Математика для вычисления плотности будет выглядеть следующим образом:
Плотность = масса (32,085 г)
———————
объем (15,5 cc)
Плотность = 2,070 г / куб.см
3. Точка плавления и точка кипения
Точка плавления и точка кипения напрямую связаны с прочностью связи между электронами и ядром. Когда эта связь ослабевает, температура кипения и плавления падает.Когда вы перемещаетесь по группе вниз, точки плавления и кипения будут уменьшаться, потому что электроны в этих атомах удаляются от ядра, и связь становится слабее. Сера имеет температуру плавления 388,36 К и точку кипения 717,75 К. В этом случае точки плавления и кипения высоки, потому что связь между электронами и ядром в атоме прочная. Атом серы имеет небольшой радиус, поэтому электроны ближе и больше притягиваются к протонам, удерживая более прочную связь.
Сера — Центр научных исследований
Сера — это химический элемент. Его официальный символ — S, а его атомный номер — 16, что означает, что каждый атом серы имеет в своем ядре 16 протонов. Элементарная сера имеет бледно-желтый цвет. При комнатной температуре это мягкий порошок, который крошится при прикосновении. Элементарная сера не имеет запаха сама по себе, но когда она образует соединение — например, с водородом — она может вонять!
Отложения серы естественным образом находятся в вулканических районах, таких как Роторуа и Уайт-Айленд, а также в больших количествах глубоко под землей в Соединенных Штатах, Польше и Сицилии.По массе сера является пятым по распространенности элементом на Земле.
Черный порошок, сера и несколько вариантов написания
Сера — один из немногих элементов, который встречается в чистом виде, поэтому люди знали и использовали «чистую» элементарную серу очень давно. Записи показывают, что китайцы использовали серу в традиционной медицине более 2600 лет назад. К 7 веку нашей эры они научились смешивать серу с древесным углем и нитратом калия для получения черного пороха (пороха). Древние индийские, греческие и египетские культуры также использовали серу в лекарствах, для дезинфекции и отбеливания тканей.
Сера также упоминается в религиозных писаниях, возраст которых составляет 2600 лет. В английском переводе Библии сера называется «серой» для описания разрушения (на которое способна вулканическая активность) и неприятного запаха, связанного с соединениями серы.
Перенесемся на 2300 лет в 1777 год. После обширных экспериментов Антуан Лавуазье обнаружил, что не может расщепить серу на более простые вещества, поэтому объявил ее элементом.
В последнее время споры велись не о химии, а о правописании.Первоначальный латинский термин был «sulpur». Со временем он стал «серой», а в 3 веке превратился в «серу». Английский язык сохранил написание «ph», в то время как другие языки использовали, например, «f» — zolfo в итальянском и schwefel в немецком. Международный союз чистой и прикладной химии официально принял слово «сера» в 1990 году.
Сера, необходимая для жизни (и неприятный запах)
Сера присутствует во всех тканях живых растений и животных. Он составляет около 0,3% человеческого тела.Это компонент некоторых белков. Он также помогает нашему организму противостоять бактериям, способствует выработке инсулина и помогает поддерживать здоровье суставов, кожи, волос, ногтей и соединительных тканей.
Сбалансированная диета должна удовлетворять потребности организма в сере. Богатые белком продукты — яйца, мясо, птица, рыба, молочные и соевые продукты — являются хорошими источниками диетической серы. Брассика (брокколи и капуста), лук, чеснок и спаржа также являются источником диетической серы.
Когда организм переваривает богатую серой пищу, в качестве побочного продукта образуется сероводород.Это газ, от которого пердит пахнет тухлыми яйцами — и придает Роторуа его знаменитый запах.
Сера необходима для роста растений. Помимо того, что сера важна для некоторых растительных белков, она способствует развитию хлорофилла и фиксации азота в бобовых. Большая часть серы в почве поступает из органических веществ и выветрившихся горных пород. Мы используем удобрения, чтобы обогащать почву важными элементами.
С другой стороны, сера может остановить жизнь. Люди давно используют серу для борьбы с насекомыми, плесенью и бактериями.Высокие концентрации сероводорода (намного превышающие то, что вырабатывается в нашем кишечнике) могут вызвать паралич дыхания, что приведет к смерти. Это просто показывает, что все дело в дозе.
Прочие применения
Сера наиболее широко используется для производства серной кислоты для производства фосфатов для удобрений. Он также используется для упрочнения резины, чтобы сделать такие изделия, как шины, обувь и шланги, более долговечными.
Еще одно обычное применение серы — это спички. Многие спички состоят из хлората калия, серы, порошкового стекла и желатина (который удерживает все материалы на дереве).Проведение спичечной головки по поражающей поверхности вызывает трение и нагрев, а затем — пламя. Хлорат калия выделяет кислород, а сера соединяется с кислородом и поддерживает огонь. Деревянная спичка также служит источником топлива. Характерный запах горящей спички исходит от серы.
Природный газ, используемый для отопления и приготовления пищи, не имеет запаха, цвета и вкуса. Соединения серы добавляются в природный газ, поэтому мы можем обнаружить даже малейшую утечку. Скунсы также используют серу для защиты.Они используют спрей на основе серы, достаточно сильный, чтобы отпугнуть медведей. Он настолько сильный, что с подветренной стороны люди могут почувствовать запах брызг на расстоянии нескольких километров!
Связанное содержание
Узнайте больше о минералах.
В отношении здоровья человека сера является макроминералом. О витаминах и минералах, необходимых для здорового питания, читайте в статье Микронутриенты.
Полезные ссылки
Узнайте больше о сере на этих веб-сайтах:
Загрузите эту бесплатную электронную книгу Making Superphosphate .




 = 113°C;
= 113°C;  065 а.е.м.
065 а.е.м. 36 К (239,38 F)
36 К (239,38 F) 0 E-22 10 6 / м Ом
0 E-22 10 6 / м Ом