Массовая доля растворённого вещества | Решаем химию: вопросы и ответы
С растворами мы сталкиваемся регулярно, причём не только в химии, но и в обычной жизни. Например, чай с сахаром – самый что ни на есть раствор. Строго говоря, даже обычная вода, текущая из крана, – это раствор, потому что в ней растворены различные соли (загляните в чайник и убедитесь, что на стенках есть накипь. Это и есть соли, которые осели на стенках из воды). Растворы бывают концентрированными и разбавленными. В первых концентрация растворённого вещества велика (это когда вы в чашку чая насыпали 5 ложек сахара, во вторых – концентрация растворённого вещества мала (когда в чашу чая вы насыпали сахара совсем чуть-чуть). А вот характеристикой раствора является массовая доля растворённого вещества.
Фото: depositphotos.comФото: depositphotos.com
Массовая доля растворённого вещества в растворе – это отношение массы растворённого вещества к массе всего раствора.
Не забывайте, что масса раствора складывается из массы растворителя и растворённого вещества. Сразу разберём пример, чтобы стало понятно.
Пример 1.
У нас есть 200 г воды и 10 г сахара. Смешиваем воду и сахар и получаем раствор. Так вот масса раствора будет равна массе воды (здесь это растворитель) и сахара (растворённое вещество), то есть 200+10=210 г. Это очень важно, не упускайте этот момент из виду.
Теперь возвратимся к массовой доле. Она обозначается латинской буквой w и рассчитывается по простой формуле:
При этом помните, что
Удобнее выражать массовую долю в процентах, поэтому чаще используется такая формула:
Массовая доля растворенного вещества: задачи
Чтобы уяснить чётко, что же такое массовая доля вещества в растворе, потренируемся решать задачи по химии.
Пример 2.

Смешали 150 г воды и 20 г хлорида натрия NaCl. Определите массовую доля хлорида натрия в полученном растворе.
Решение:
Сначала найдём массу раствора. Она складывается из массы воды и хлорида натрия, то есть 150+20=170 г. Это и есть масса раствора. Теперь ищем массовую долю NaCl:
Ответ: в полученном растворе массовая доля хлорида натрия составляет 11,7%.
Пример 3.
Известно, что в 250 г раствора нитрата калия содержится 10 г нитрата калия. Определите массовую долю нитрата калия.
Решение:
Обратите внимание, что в условии уже дана масса раствора, это существенно облегчает задачу, поскольку можно сразу использовать формулу для определения массовой доли:
Ответ: массовая доля нитрата калия в этом растворе 4%.
Пример 4.
В учебниках по химии встречаются и обратные задачи, когда массовая доля известна и требуется найти массу растворённого вещества или раствора. Например, условие звучит так. Нужно приготовить раствор серной кислоты в воде массой 200 г с массовой долей серной кислоты 64%. Сколько потребуется серной кислоты.
Например, условие звучит так. Нужно приготовить раствор серной кислоты в воде массой 200 г с массовой долей серной кислоты 64%. Сколько потребуется серной кислоты.
Решение:
Давайте разберёмся. У нас должно получиться 200 г раствора, то есть масса раствора 200 г. Массовая доля – 64%. Теперь воспользуемся формулой:
С нашими условиями получается так:
64=mН2SO4/200*100%
Отсюда получаем, что mН2SO4=64*200/100=128 г.
Ответ: для приготовления раствора потребуется 128 г серной кислоты.
Пример 5.
Необходимо приготовить раствор сульфата меди с массовой долей 8%. Масса сульфата меди 12 г. Какова будет масса полученного раствора?
Решение:
Сразу берём формулу
и подставляем данные из условия: wCuSO4=8%, mCuSO4=12 г, тогда
8=12/mраствора*100%
Отсюда mраствора=12/8*100=150 г.
Ответ: масса полученного раствора составит 150 г.
Пример 6.
Ну и как обычно, заключительным будет сложный пример от репетитора по химии. Итак, химик взял 6 г гидроксида натрия, добавил воды и получил раствор с массовой долей гидроксида натрия 10%. Сколько воды он взял?
Решение:
Для начала давайте вспомним, что масса раствора складывается из массы растворённого вещества (гидроксид натрия) и растворителя (вода). Масса гидроксида известна из условия, а вот массу воды нужно найти, поэтому обозначим её Х. Тогда
И это действие было самым сложным. Теперь просто переходим к формуле расчёта массовой доли:
Подставим сюда данные из условия: wNaOH=10%, mNaOH=6 г, тогда
10=6/(6+X)*100%
Решаем:
10*(6+Х)=6*100
Х=54.
Ответ: химик для приготовления раствора взял 54 г воды.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как узнать массовую долю элемента в веществе. Как найти массовую долю вещества по формуле
>>
Массовая доля элемента в сложном веществе
Материал параграфа поможет вам:
> выяснить, что такое массовая доля элемента в соединении, и определять ее значение;
> рассчитывать массу элемента в определенной массе соединения, исходя из массовой доли элемента;
> правильно оформлять решение химических задач.
Каждое сложное вещество (химическое соединение) образовано несколькими элементами. Знать содержание элементов в соединении необходимо для его эффективного использования. Например, лучшим азотным удобрением считают то, в котором содержится наибольшее количество Нитрогена (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько она «богата » на металлический элемент.
Например, лучшим азотным удобрением считают то, в котором содержится наибольшее количество Нитрогена (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько она «богата » на металлический элемент.
Содержание элемента в соединении характеризуют его массовой долей. Эту величину обозначают латинской буквой w («дубль-вэ»).
Выведем формулу для вычисления массовой доли элемента в соединении по известным массам соединения и элемента. Обозначим массовую долю элемента буквой х. Приняв во внимание, что масса соединения — это целое, а масса элемента — часть от целого, составляем пропорцию:
Заметим, что массы элемента и соединения нужно брать в одинаковых единицах измерения (например, в граммах).
Это интересно
В двух соединениях Сульфура- SO 2 и MoS 3 — массовые доли элементов одинаковы и составляют по 0,5 (или 50 %).
Массовая доля не имеет размерности. Ее часто выражают в процентах. В этом случае формула принимает такой вид:
В этом случае формула принимает такой вид:
Очевидным является то, что сумма массовых долей всех элементов в соединении равна 1 (или 100 %).
Приведем несколько примеров решения расчетных задач. Условие задачи и ее решение оформляют таким образом. Лист тетради или классную доску делят вертикальной линией на две неодинаковые части. В левой, меньшей, части сокращенно записывают условие задачи, проводят горизонтальную линию и под ней указывают то, что нужно найти или вычислить. В правой части записывают математические формулы, объяснение, расчеты и ответ.
В 80 г соединения содержится 32 г Оксигена . Вычислить массовую долю Оксигена в соединении.
Массовую долю элемента в соединении также вычисляют, используя химическую формулу соединения. Поскольку массы атомов и молекул пропорциональны относительным атомным и молекулярным массам, то
где N(E) — количество атомов элемента в формуле соединения.
По известной массовой доле элемента можно рассчитать массу элемента, которая содержится в определенной массе соединения.
m(E) = w(E) m(соединения).
Какая масса Нитрогена содержится в аммиачной селитре (азотное удобрение) массой 1 кг, если массовая доля этого элемента в соединении равна 0,35?
Понятие «массовая доля» используют для характеристики количественного состава смесей веществ. Соответствующая математическая формула имеет такой вид:
Выводы
Массовая доля элемента в соединении — это отношение массы элемента к соответствующей массе соединения.
Массовую долю элемента в соединении вычисляют по известным массам элемента и соединения или по его химической формуле.
?
92. Как вычислить массовую долю элемента в соединении, если известны: а) масса элемента и соответствующая масса соединения; б) химическая формула соединения?
93. В 20 г вещества содержится 16 г Брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
94. Вычислите (желательно устно) массовые доли элементов в соединениях с такими формулами: SO 2 , LiH, CrO 3 .
95. Сопоставляя формулы веществ, а также значения относительных атом ных масс, определите, в каком из веществ каждой пары массовая доля первого в формуле элемента больше:
a) N 2 O, NO; б) CO, CO 2 ; в) B 2 O 3 , B 2 S 3 .
96. Выполните необходимые вычисления для уксусной кислоты CH 3 COOH и глицерина C 3 H 5 (OH) 3 и заполните таблицу:
| C x H y O z | M r (C x H y O z) | w(C) | W(H) | W(O) |
97. Массовая доля Нитрогена в некотором соединении равна 28 %. В какой массе соединения содержится 56 г Нитрогена?
98. Массовая доля Кальция в его соединении с Гидрогеном равна 0,952. Определите массу Гидрогена, которая содержится в 20 г соединения.
99. Смешали 100 г цемента и 150 г песка. Какова массовая доля цемента в приготовленной смеси?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииС XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элементов. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах):
Массовая доля элемента в соединении обозначается латинской строчной буквой w («дубль-вэ») и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Например, в состав оксида ртути входят два элемента – ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода (рис. 57). Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
w (O) = 1 – 0,926 = 0,074,
w (О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов (n ) данного элемента в формуле и разделить на относительную молекулярную массу вещества:
Например, для воды (рис. 58):
M r (H 2 O) = 1 2 + 16 = 18,
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Дано:
вещество аммиак NH 3 .
Найти :
w (N), w (H).
Решение
1) Рассчитаем относительную молекулярную массу аммиака:
M r (NH 3) = A r (N) + 3A r (H) = 14 + 3 1 = 17.
2) Найдем массовую долю азота в веществе:
3) Вычислим массовую долю водорода в аммиаке:
w (H) = 1 – w (N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w (N) = 82,35%, w (H) = 17,65%.
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SO 4 .
Дано:
серная кислота H 2 SO 4 .
Найти :
w (H), w (S), w (O).
Решение
1) Рассчитаем относительную молекулярную массу серной кислоты:
M r (H 2 SO 4) = 2A r (H) + A r (S) + 4A r (O) = 2 1 + 32 + 4 16 = 98.
2) Найдем массовую долю водорода в веществе:
3) Вычислим массовую долю серы в серной кислоте:
4. Рассчитаем массовую долю кислорода в веществе:
w (O) = 1 – (w (H) + w (S)) = 1 – (0,0204 + 0,3265) = 0,6531, или 65,31%.
Ответ. w (H) = 2,04%, w (S) = 32,65%, w (O) = 65,31%.
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества. То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Из природных минералов – тенорита и куприта – были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде массовая доля меди составляла 80%, а массовая доля кислорода – 20%. В оксиде меди красного цвета массовые доли элементов составляли соответственно 88,9% и 11,1%. Каковы же формулы этих сложных веществ? Проведем несложные математические расчеты.
Пример 1. Расчет химической формулы черного оксида меди (w (Cu) = 0,8 и w (О) = 0,2).
х, у – по числу атомов химических элементов в его составе: Сu x O y .
2) Отношение индексов равно отношению частных от деления массовой доли элемента в соединении на относительную атомную массу элемента:
3) Полученное соотношение нужно привести к соотношению целых чисел: индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа разделим на меньшее (т.е. любое) из них:
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида меди по известным массовым долям w (Cu) = 88,9% и w (O) = 11,1%.
Дано:
w (Cu) = 88,9%, или 0,889,
w (O) = 11,1%, или 0,111.
Найти:
Решение
1) Обозначим формулу оксида Сu x O y .
2) Найдем соотношение индексов x и y :
3) Приведем соотношение индексов к отношению целых чисел:
Ответ . Формула соединения – Cu 2 O.
А теперь немного усложним задачу.
Задача 3. По данным элементного анализа состав прокаленной горькой соли, использовавшейся еще алхимиками в качестве слабительного средства, следующий: массовая доля магния – 20,0%, массовая доля серы – 26,7%, массовая доля кислорода – 53,3%.
Дано:
w (Mg) = 20,0%, или 0,2,
w (S) = 26,7%, или 0,267,
w (O) = 53,3%, или 0,533.
Найти:
Решение
1) Обозначим формулу вещества с помощью индексов x, y, z : Mg x S y O z .
2) Найдем соотношение индексов:
3) Определим значение индексов x, y, z :
Ответ. Формула вещества – MgSO 4 .
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
2. Рассчитайте массовые доли элементов в веществах: а) углекислом газе CO 2 ;
б) сульфиде кальция СаS; в) натриевой селитре NaNO 3 ; г) оксиде алюминия Al 2 O 3 .
3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 Cl; б) сульфате аммония (NH 4) 2 SO 4 ; в) мочевине (NH 2) 2 CO?
4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида.
6. В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. элемента в вещества обозначается греч. буквой «омега» — ω Э/В и рассчитывается по формуле:
где k — число атомов этого элемента в молекуле.
Какова массовая доля водорода и кислорода в воде (Н 2 О)?
Решение:
M r (Н 2 О) = 2*А r (Н) + 1*А r (О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Рис. 1. Оформление решения задачи 1
Рассчитайте массовую долю элементов в веществе H 3 PO 4 .
1) Вычисляем относительную молекулярную массу вещества:
M r (Н 3 РО 4) = 3*А r (Н) + 1*А r (Р) + 4*А r (О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.34-36)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§15)
4. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
4. Видеоурок по теме «Массовая доля химического элемента в веществе» ().
Домашнее задание
1. с.78 № 2 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005).
С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 34-36 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Понятие «доли» наверняка вам уж знакомо.
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть от целого арбуза, то есть его доля равна 1/4 или 25%.
Чтобы лучше понять, что такое массовая доля представьте себе килограмм конфет (1000г), который мама купила своим трем детям. Из этого килограмма самому младшему ребенку досталась половина всех конфет (несправедливо конечно!). Старшему — лишь 200г, а среднему — 300г.
Значит массовая доля конфет у младшего ребенка составит половину, или 1/2 или 50%. У среднего ребенка будет 30%, а у старшего — 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.д.), а может измеряться в процентах (%). При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
Массовая доля вещества в растворе
Любой раствор состоит из растворителя и растворенного вещества. Вода — самый распространенный неорганический растворитель. Органическими растворителями могут быть спирт, ацетон, диэтиловый эфир и др. Если в условии задачи не указана растворитель, раствор считается водным.
Массовая доля растворенного вещества рассчитывается по формуле:
$\omega_\text{в-ва}=\dfrac{m_\text{в-ва}}{m_\text{р-ра}}(\cdot 100\%)$
Рассмотрим примеры решения задач.
Сколько граммов сахара и воды нужно взять для приготовления 150г 10%-ного раствора сахара?
Решение
m(р-ра)=150г
$\omega$(сахара)=10%=0,1
m(сахара)=?
m(сахара) = $\omega\textrm{(сахара)} \cdot m(p-pa) = 0,1 \cdot 150 \textrm{г} = 15 \textrm{г}$
m(воды)=m(р-ра) — m(сахара) = 150г — 15г=135г.
ОТВЕТ: нужно взять 15г сахара и 135г воды.
Раствор объемом 350 мл. и плотностью 1, 142 г/мл содержит 28 г хлорида натрия. Найти массовую долю соли в растворе.
Решение
V(р-ра)=350 мл.
$\rho$(р-ра)=1,142 г/мл
$\omega(NaCl)$=?
m(р-ра) =V(р-ра) $\cdot \rho$(р-ра)=350 мл $\cdot$ 1,142 г/мл=400г
$\omega(NaCl)=\dfrac{m(NaCl)}{m\textrm{(р-ра)}}=\dfrac{28\textrm{г}} {400\textrm{г}} = 0,07$=7%
ОТВЕТ: массовая доля хлорида натрия $\omega(NaCl)$=7%
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В МОЛЕКУЛЕ
Формула химического вещества, например $H_2SO_4$, несет в себе много важной информации. Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H) : m(S) : m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по схожей формуле:
$\omega_\text{эл-та}=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)$
Найти массовую долю элементов в серной кислоте.
Решение
Способ 1 (пропорция):
Найдем молярную массу серной кислоты:
$M(H_2SO_4) = 1\cdot 2 + 32 + 16 \cdot 4=98\hspace{2pt}\textrm{г/моль}$
Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте составит: $m(S) = Ar(S) \cdot n(S) = 32\textrm{г/моль} \cdot 1$= 32г/моль
Примем массу всей молекулы за 100%, а массу серы — за Х% и составим пропорцию:
$M(H_2SO_4)$=98 г/моль — 100%
m(S) = 32г/моль — Х%
Откуда $X=\dfrac{32\textrm{г/моль} \cdot 100\%}{98\textrm{г/моль}} =32, 65\% =32\%$
Способ 2 (формула):
$\omega(S)=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)=\dfrac{Ar(S)\cdot 1}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{32\textrm{г/моль}\cdot 1}{98\textrm{г/моль}}(\cdot 100\%) \approx32, 7\%$
Аналогично по формуле рассчитаем массовые доли водорода и кислорода:
$\omega(H)=\dfrac{Ar(H)\cdot 2}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{1\textrm{г/моль}\cdot 2}{98\textrm{г/моль}}(\cdot 100\%)\approx2\%$
$\omega(O)=\dfrac{Ar(O)\cdot 4}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{16\textrm{г/моль}\cdot 4}{98\textrm{г/моль}}(\cdot 100\%)\approx65, 3\%$
ТЕМА УРОКА: Массовая доля химического элемента в соединении.
ЦЕЛЬ УРОКА: Научить вычислять массовую долю элементов в соединении по формуле соединения и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Основные понятия. Массовая доля химического элемента.
Планируемые результаты обучения
Предметные. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Метапредметные . Формировать умения устанавливать аналогии, использовать алгоритмы для решения учебных и познавательных задач.
Основные виды деятельности учащихся. Рассчитывать массовую долю элемента в соединении по его формуле. Устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Структура урока
I . Организационный этап
II . Актуализация опорных знаний
III . Изучение нового материала
Изучение нового материала
IV . Закрепление. Подведение итогов урока
V . Домашнее задание
Ход урока
Организационный момент.
Проверка домашнего задания.
Актуализация опорных знаний.
Дайте определения: относительной атомной массе, относительной молекулярной массе.
В каких единицах можно измерить относительную атомную массу.
В каких единицах можно измерить относительную молекулярную массу.
Изучение нового материала.
Работа с учебником. Рабочая тетрадь.
Ребята, допустим у нас есть вещество — серная кислота H 2 SO 4,
можем мы ли узнать какие атомы входят в состав соединения.
А их количество?
А в каком массовом соотношении они соединяются?
Вычисление массовых отношений химических
элементов в сложном веществе. (стр. 51)
А как можно узнать в каких массовых отношениях соединены элементы в соединении формула которого H 2 SO 4 ?
m (H ):
m (S ):
m (O )= 2*2 + 32 + 16*4= 2:32:64 = 1:16:32.
1+16+32 = 49, то есть 49 массовых частей серной кислоты, содержаться 1 массовая часть водорода, 16 массовых частей серы, 32 массовых частей кислорода.
Ребята, а как вы думаете, можем ли мы рассчитать долю каждого элемента в соединении?
Сегодня мы с вами познакомимся с новым понятием массовая доля элемента в соединении.
W — массовая доля элемента в соединении.
n — число атомов элемента.
Mr — относительная молекулярная масса.
Вычисление массовых долей химических элементов
в сложном веществе. (РТ)
1. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №1 (РТ)
Вывод химических формул, если известны массовые доли химических элементов,
входящих в состав данного вещества. (РТ)
2. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №5 (РТ)
Закрепление изученного материала.
РТ стр. 25 №2.
РТ стр. 27 №6.
Подведение итогов урока.
Какие новые понятия вы узнали сегодня на уроке?
Самостоятельная работа.
Домашнее задание:
изучить §15 стр. 51 — 53;
ответить на вопросы №3,4,7 стр. 53-54 (письменно).
П еречень использованной литературы.
Учебник. Химия 8 класс. авт. Г.Е. Рудзитис, Ф.Г. Фельдман. Издательство «Просвещение», 2014.
Рабочая тетрадь по химии. авт. Боровских Т.А.
Массовая доля | Задача 1
Задача 1
Вычислите массовую долю щелочи в растворе образовавшегося при добавлении гидроксида натрия массой 25 г к раствору массой 250г с массовой долей гидроксида натрия 12%.
Решение:
Находим массу NaOH в исходном растворе:
m(в-ва) * 100 m1(NaOH) * 100
W% = ————————; W%1 = ——————————-, где
m(р-ра) m1(р-ра)
W% — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
m1(р=ра) * W% 250 * 12
m1(NaOH) = ———————- = —————- = 30г — масса NaOH в исходном растворе. 100 100
Рассчитаем массу NaOH в конечном растворе:
m2(NaOH) = m1(NaOH) + m(NaOH) = 30 + 25 = 55г.
Рассчитаем массу конечного раствора:
m2(р-ра) = m2(NaOH) + m1(NaOH) = 55 + 250 = 305г.
Вычислите массовую долю щелочи в конечном растворе:
m2(NaOH) * 100 55 * 100
W%2 = —————————— = ———————- = 18%.
m2(р-ра) 305
Ответ: W%2 = 18%.
Український варіант завдання
Завдання 1
Обчисліть масову частку лугу в розчині що утворився при додаванні натрій гідроксиду масою 25г до розчину масою 250г з масовою часткою натрій гідроксиду 12%.
Решение:
Знаходимо масу NaOH в вихідному розчині:
m(в-ва) * 100 m1(NaOH) * 100
W% = ————————; W%1 = ——————————-, де
m(р-ра) m1(р-ра)
W% — масова частка розчиненої речовини; m(в-ва) — маса розчиненої речовини; m(р-ра) — маса розчину.
Тоді
m1(р=ра) * W% 250 * 12
m1(NaOH) = ———————- = —————- = 30г — масса NaOH в вихідному розчині. 100 100
Розрахуємо масу NaOH в кінцевому розчині:
m2(NaOH) = m1(NaOH) + m(NaOH) = 30 + 25 = 55г.
Розрахуємо масу кінцевого розчину:
m2(р-ра) = m2(NaOH) + m1(NaOH) = 55 + 250 = 305г.
Обчисліть масову частку лугу в кінцевому розчині:
m2(NaOH) * 100 55 * 100
W%2 = —————————— = ———————- = 18%.
m2(р-ра) 305
Відповідь: W%2 = 18%.
Задача 2.
При нагревании образца нитрата меди, часть вещества разложилась. При этом выделилось 5,6 л смеси газов. Масса твёрдого остатка составила 26,8г. К этому остатку последовательно добавили 50 мл воды и 10% раствор гидроксида натрия, массой которая потребовалась для полного осаждения ионов меди. Определите массовую долю нитрата натрия в конечном растворе.
Решение:
При нагревании образца нитрата меди выделяется оксид меди, оксид азота IV и кислород:
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
Рассчитаем количество газов, выделившихся при реакции:
5,6л/22/4л/моль = 0, 25 моль.
Из уравнения реакции следует, что на 5 моль смеси выделившихся газов выпадает в осадок 2 моль оксида меди. Исходя из этого, рассчитаем количество и массу выпавшего оксида меди :
5 моль ———— 2 моль
0,25 моль ———х моль х = 0,25 . 2.5 = 0,1моль. m(CuO) = 80 . 0,1 = 8г
Теперь рассчитаем массу оставшегося нитрата меди в осадке:
m[Cu(NO3)2] = m(образц.) – m(CuO) = 26,8г – 8г = 18,8г.
Оставшийся осадок нитрата меди прореагировал с гидроксидом натрия по уравнению:
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Находим массу гидроксида натрия, потраченного на реакцию:
18,8г хг
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
188г 2 * 40
18,8 * 80
Получим: х = ————— = 8г.
188
Зная массу растворенного вещества и массовую долю раствора, рассчитаем массу 10%-го раствора:
m(NaOH) * 100 8г * 100
m1(р-ра) = ———————— = ——————— = 80г.
w1 10
Масса конечного раствора гидроксида натрия равна:
m2(р-ра) = m1(р-ра) + m(H2O) = 80г + 50г = 130г.
Определим массовую долю нитрата натрия в конечном растворе:
w2% = m(NaOH) . 100/ m2(р-ра) = 8г * 100%/130г = 6,15%.
Ответ: 6,15%.
Массовая доля химического элемента в веществе. Расчёт массовой доли химических элементов по формуле вещества
Инструкция
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же растворено, то выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
Если же растворено, то выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
Если в условии задачи не дано значения массы, то его можно рассчитать с помощью нескольких формул, выбрать нужную помогут величины данные в условии. Первая формула для : m = V*p, где m – масса, V – объем, p – плотность. Следующая формула выглядит так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярная масса в свою очередь складывается из атомных масс элементов, входящих в состав вещества.
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком . В результате реакции водород объемом 0,56 л (). Вычислите массовую долю меди в смеси.
В этой задаче проходит , записываем ее уравнение. Из двух веществ с избытком соляной кислоты только магний: Mg + 2HCl = MgCl2 + h3. Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу : m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу : m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Видео по теме
Обратите внимание
Массовая доля не может быть больше единицы или, если она выражается в процентах, больше 100%.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
- Вычисление доли продаж по региону
Массовая доля показывает в процентах или в долях содержание вещества в каком–либо растворе или элемента в составе вещества. Умение вычислить массовую долю полезно не только на уроках химии, но и когда вы хотите приготовить раствор или смесь, например, в кулинарных целях.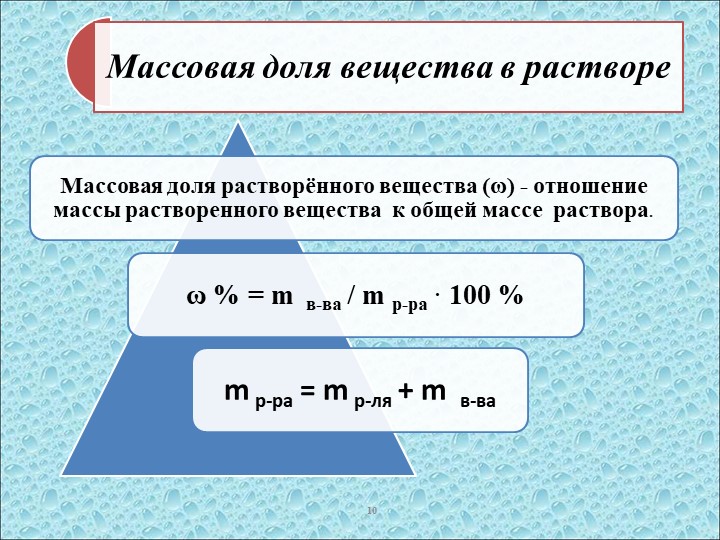 Или изменить процентное отношение, в уже имеющемся у вас составе.
Или изменить процентное отношение, в уже имеющемся у вас составе.
Инструкция
К примеру, вам на зиму необходим минимум в 15 куб. метров березовых дров.
Ищите в справочной плотность березовых дров. Это: 650 кг/м3.
Вычисляйте массу, подставив значения в ту же формулу удельной плотности.
m = 650*15 = 9750 (кг)
Теперь, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и количеством поездок.
Видео по теме
Обратите внимание
Люди постарше больше знакомы с понятием удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Если требуется найти или массовую долю элемента в веществе с известной формулой, воспользуйтесь периодической таблицей элементов. По ней найдите атомные массы элементов, которые в вещества. Если один в формуле несколько раз, умножьте его атомную массу на это число и сложите полученные результаты. Это будет молекулярная масса вещества. Чтобы найти массовую долю любого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Результат множьте на 100 % (ω%=(M0/M)∙100%).
Результат множьте на 100 % (ω%=(M0/M)∙100%).
Например, определите массовую долю химических элементов в медном купоросе. Медный (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома . Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Инструкция
Определите химическую форму вещества, массовые доли элементов которого нужно найти. Возьмите периодическую систему Менделеева и найдите в ней ячейки элементов, соответствующие атомам, входящим в состав молекулы данного вещества. В ячейке найдите массовое число каждого такого элемента . Если найденное значение массового числа элемента дробное, округлите его до ближайшего .
В ячейке найдите массовое число каждого такого элемента . Если найденное значение массового числа элемента дробное, округлите его до ближайшего .
В том случае, когда атомы одного типа встречается в молекуле несколько раз, умножьте на это число их атомную массу. Сложимте массы всех элементов, входящих в состав молекулы, чтобы получить значение в атомных единицах массы. Например, если нужно найти массу молекулы соли, которая сульфат (Na2SO4), определяет атомную массу натрия Ar(Na)=23, серы Ar(S)=32 и Ar(О)=16. Поскольку в молекуле содержится 2 натрия, то для него берите значение 23*2=46, а , у которого 4 атома — 16*4=64. Тогда масса молекулы составит сульфата натрия составит Мr(Na2SO4)=46+32+64=142.
Чтобы подсчитать массовые доли элементов, входящих в состав молекулы данного вещества, найдите отношения масс атомов, входящих в молекулу вещества, к массе молекулы, а результат умножьте на 100%. Например, если рассматривать сульфат натрия Na2SO4, рассчитайте массовые доли его элементов таким образом:- массовая доля натрия составит ω(Na)= 23 2 100%/142=32,4%;
— массовая доля серы составит ω(S)= 32 100%/142=22,5%;
— массовая доля кислорода составит ω(О)= 16 4 100%/142=45,1%.
Массовые доли показывают относительное элементов в данной молекуле вещества. Проверьте правильность вычисления, сложив массовые доли вещества. Их сумма должна составить 100%. В рассматриваемом примере 32,4%+22,5%+45,1%=100%, расчет произведен .
Пожалуй, невозможно найти столь же необходимый для жизни элемент, как кислород. Если без пищи человек может прожить несколько недель, без воды несколько дней, то без кислорода – всего несколько минут. Это вещество находит широкое применение в разных областях промышленности, в том числе химической, а также как компонент ракетного топлива (окислитель).
Инструкция
Часто возникает необходимость определить массу кислорода, находящегося в каком-то замкнутом объеме, или в результате химической реакции. Например: 20 граммов перманганата подвергли термическому разложению, реакция прошла до конца. Сколько граммов кислорода при этом выделилось?
Прежде всего, вспомните, что калия – он же – имеет химическую формулу KMnO4. При нагревании он разлагается, образуя манганат калия – K2MnO4 , основной – MnO2, и O2. Записав уравнение реакции, и подобрав коэффициенты, получите:
Записав уравнение реакции, и подобрав коэффициенты, получите:
2KMnO4 = K2MnO4 + MnO2 + O2
Учитывая, что приблизительная молекулярная масса двух молекул перманганата калия – 316, а молекулярная масса молекулы кислорода, соответственно, 32, путем решения пропорции, вычислите:
20 * 32 /316 = 2,02
То есть при термическом разложении 20 граммов перманганата калия, получается примерно 2,02 грамма кислорода. (Или округленно 2 грамма).
Или, например, требуется определить массу кислорода, находящегося в замкнутом объеме, если известна его температура и давление. Здесь на помощь приходит универсальное уравнение Менделеева – Клапейрона, или по-другому «уравнение состояния идеального газа». Оно имеет такой вид:
PVm = MRT
P – давление газа,
V – его объем,
m – его молярная масса,
М – масса,
R – универсальная газовая постоянная,
Т – температура.
Вы видите, что требуемую величину, то есть массу газа (кислорода), после приведения всех исходных данных в одну систему единиц (давление – , температуру – в градусы Кельвина и т. д.), легко можно вычислить по формуле:
д.), легко можно вычислить по формуле:
Разумеется, реальный кислород – это не идеальный газ, для описания которого и было введено это уравнение. Но при величинах давления и температуры, близких к , отклонения расчетных величин от фактических столь незначительны, что ими смело можно пренебречь.
Видео по теме
Что такое массовая доля элемента ? Из самого названия можно понять, что это величина, указывающая, в каком соотношении находятся масса элемента , входящего в состав вещества, и общая масса этого вещества. Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как можно вычислить массу какого-либо элемента ?
Инструкция
Для наглядности рассмотрите хорошо известный всем углерод, без которого не было бы . Если углерод представляет собою вещество (например, ), то его массовую долю можно смело принять за единицу или за 100%. Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь малых количествах, что ими можно пренебречь. А вот в таких модификациях углерода, как или , содержание примесей довольно высокое, и пренебрежение недопустимо.
А вот в таких модификациях углерода, как или , содержание примесей довольно высокое, и пренебрежение недопустимо.
Если же углерод входит в состав сложного вещества, надо действовать следующим образом: запишите точную формулу вещества, затем, зная молярные массы каждого элемента , входящего в его состав, вычислите точную молярную массу этого вещества (разумеется, с учетом «индекса» каждого элемента ). После этого определить массовую долю , разделив общую молярную массу элемента на молярную массу вещества.
Например, нужно найти массовую долю углерода в уксусной кислоте. Напишите формулу уксусной кислоты: СН3СООН. Для облегчения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
Если нужно исчислить ее в процентном соотношении, соответственно, 0,4 * 100 = 40%. То есть в каждом уксусной кислоты содержится (приблизительно) 400 грамм углерода.
Разумеется, совершенно аналогичным образом можно найти массовые доли всех других элементов. Например, массовая в той же уксусной кислоте вычисляется так: 32/60 = 0,533 или примерно 53,3%; а массовая доля водорода равна 4/60 = 0,666 или примерно 6,7%.
Источники:
- массовые доли элементов
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – h3SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома кислорода и один атом . Надо понимать, что это – лишь эмпирическая формула, она характеризует состав молекулы, но не ее «структурность», то есть расположение атомов относительно друг друга.
Вам понадобится
- — Таблица Менделеева.
Инструкция
Сначала узнайте элементы, в состав вещества, и их . Например: какова будет оксида азота? Очевидно, что в состав молекулы этого два элемента: азот и . Оба они – газы, то есть ярко выраженные . Так какую же валентность имеют азот и кислород в этом соединении?
Оба они – газы, то есть ярко выраженные . Так какую же валентность имеют азот и кислород в этом соединении?
Запомните очень важное правило: неметаллы имеют высшую и низшую валентности. Высшая соответствует номеру группы (в данном случае, 6 для кислорода и 5 для азота), а низшая – разнице между 8 и номером группы (то есть низшая валентность для азота равна 3, а для кислорода — 2). Единственное исключение их этого правила – фтор, который во всех своих проявляет одну валентность, равную 1.
Так какую же валентность – высшую или низшую имеют азот и кислород? Еще одно правило: в соединениях двух элементов, низшую валентность проявляет тот, которых находится в Таблице Менделеева правее и выше. Совершенно очевидно, что в вашем случае это – кислород. Следовательно, в соединении с азотом кислород имеет валентность, равную 2. Соответственно, азот в этом соединении имеет высшую валентность, равную 5.
А теперь вспомните само валентности: это способность атома какого-либо элемента присоединить к себе определенное количество атомов другого элемента. Каждый атом азота в этом соединении « » 5 атомов кислорода, а каждый атом кислорода – 2 атома азота. Какова же азота? То есть, какие индексы имеет каждый элемент?
Каждый атом азота в этом соединении « » 5 атомов кислорода, а каждый атом кислорода – 2 атома азота. Какова же азота? То есть, какие индексы имеет каждый элемент?
Ответить на этот вопрос поможет еще одно правило: сумма валентностей элементов, входящих в соединение, должна быть равной! Какое наименьшее общее кратное для чисел 2и 5? Естественно, 10! Поделив его на величины валентностей азота и кислорода, вы найдете индексы и итоговую формулу соединения: N2O5.
Видео по теме
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Если требуется найти или массовую долю элемента в веществе с известной формулой, воспользуйтесь периодической таблицей элементов. По ней найдите атомные массы элементов, которые в вещества. Если один в формуле несколько раз, умножьте его атомную массу на это число и сложите полученные результаты. Это будет молекулярная масса вещества. Чтобы найти массовую долю любого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Результат множьте на 100 % (ω%=(M0/M)∙100%).
Массовая доля вещества – это отношение массы определенного вещества к массе смеси либо раствора, в котором находится данное вещество. Выражается в долях единицы либо в процентах.
Выражается в долях единицы либо в процентах.
Инструкция
1. Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же вещество растворено, то формула выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже дозволено обнаружить: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю дозволено умножить на 100%.
2. Если в условии задачи не дано значения массы, то его дозволено рассчитать с поддержкой нескольких формул, предпочесть надобную помогут величины данные в условии. Первая формула для нахождения массы: m = V*p, где m – масса, V – объем, p – плотность. Дальнейшая формула выглядит так: m = n*M, где m – масса, n – число вещества, M – молярная масса. Молярная масса в свою очередь складывается из ядерных масс элементов, входящих в состав вещества.
3. Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком серной кислоты. В итоге реакции выделился водород объемом 0,56 л (типичные данные). Вычислите массовую долю меди в смеси. В этой задаче проходит реакция, записываем ее уравнение. Из 2-х веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + h3. Дабы обнаружить массовую долю меди в смеси, нужно подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Смесь медных и магниевых опилок массой 1,5 г обработали избытком серной кислоты. В итоге реакции выделился водород объемом 0,56 л (типичные данные). Вычислите массовую долю меди в смеси. В этой задаче проходит реакция, записываем ее уравнение. Из 2-х веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + h3. Дабы обнаружить массовую долю меди в смеси, нужно подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Массовая доля показывает в процентах либо в долях оглавление вещества в каком–либо растворе либо элемента в составе вещества. Знание вычислить массовую долю благотворно не только на уроках химии, но и когда вы хотите приготовить раствор либо смесь, скажем, в кулинарных целях. Либо изменить процентное отношение, в теснее имеющемся у вас составе.
Знание вычислить массовую долю благотворно не только на уроках химии, но и когда вы хотите приготовить раствор либо смесь, скажем, в кулинарных целях. Либо изменить процентное отношение, в теснее имеющемся у вас составе.
Инструкция
1. Массовая доля вычисляется как отношение массы данного компонента к всеобщей массе раствора. Для приобретения итога в процентах, нужно полученное частное умножить на 100. Выглядит формула дальнейшим образом:?=m (растворенного вещества)/m (раствора)?, % = ?*100
2. Разглядим для примера прямую и обратную задачи.Скажем, вы растворили в 100 граммах воды 5 грамм поваренной соли. Какой процентности раствор вы получили? Решение дюже примитивное. Массу вещества (поваренной соли) вы знаете, масса раствора будет равна сумме из масс воды и соли. Таким образом, следует 5 г поделить на 105 г и итог деления умножить на 100 – это и будет результат: 4,7%-ый раствор у вас получится.Сейчас обратная задача. Вы хотите приготовить 200 гр 10%-ого водного раствора чего желательно. Сколько вещества брать для растворения? Действуем в обратном порядке, массовую долю, выраженную в процентах (10%) разделяем на 100. Получим 0,1. Сейчас составим несложное уравнение, где надобное число вещества обозначим x и, следственно, массу раствора как 200 г+x. Наше уравнение будет выглядеть так: 0,1=x/200г+x. Когда мы его решим то получим что х равняется приблизительно 22,2 г. Проверяется итог решением прямой задачи.
Сколько вещества брать для растворения? Действуем в обратном порядке, массовую долю, выраженную в процентах (10%) разделяем на 100. Получим 0,1. Сейчас составим несложное уравнение, где надобное число вещества обозначим x и, следственно, массу раствора как 200 г+x. Наше уравнение будет выглядеть так: 0,1=x/200г+x. Когда мы его решим то получим что х равняется приблизительно 22,2 г. Проверяется итог решением прямой задачи.
3. Труднее узнать какие числа растворов вестимой процентности нужно взять для приобретения определенного числа раствора с новыми заданными качествами. Тут требуется составить и решить теснее систему уравнений. В этой системе первое уравнение – это выражение знаменитой массы получаемой смеси, через две незнакомые массы начальных растворов. Скажем, если наша цель получить 150 гр раствора, уравнение будет иметь вид x+y=150 г. Второе уравнение – масса растворенного вещества приравненная к сумме этого же вещества, в составе 2-х смешиваемых растворов. Скажем, если хотите иметь 30%-ый раствор, а растворы, которые вы смешиваете 100%-ый, то есть чистое вещество, и 15%-ый, то второе уравнение будет иметь вид: x+0,15y = 45 г. Дело за малым, решить систему уравнение и узнать сколько нужно добавить вещества к 15%-ому раствору, дабы получить 30%-ый раствор. Испробуйте.
Дело за малым, решить систему уравнение и узнать сколько нужно добавить вещества к 15%-ому раствору, дабы получить 30%-ый раствор. Испробуйте.
Видео по теме
Дабы рассчитать количество вещества , узнайте его массу с подмогой весов, выразите ее в граммах и поделите на молярную массу, которую дозволено обнаружить с поддержкой таблицы Менделеева. Для определения числа вещества газа в типичных условиях примените закон Авогадро. Если газ находится в иных условиях, измерьте давление, объем и температуру газа, позже чего рассчитайте количество вещества в нем.
Вам понадобится
- Вам потребуются весы, термометр, манометр, линейка либо рулетка, периодическая таблица Менделеева.
Инструкция
1. Определение числа вещества в твердом теле либо жидкости. Обнаружьте массу исследуемого тела при помощи весов, выразите ее в граммах. Определите, из какого вещества состоит тело, после этого с поддержкой периодической таблицы Менделеева обнаружьте молярную массу вещества . Для этого обнаружьте элементы, входящие в состав молекулы вещества из которого состоит тело. По таблице определите их ядерные массы, если в таблице указывается дробное число, округлите его до целого. Обнаружьте сумму масс всех атомов, входящих в молекулу вещества , получите молекулярную массу, которая численно равна молярной массе вещества в граммах на моль. Позже этого, измеренную ранее массу поделите на молярную массу. В итоге получите количество вещества в молях (?=m/M).
Для этого обнаружьте элементы, входящие в состав молекулы вещества из которого состоит тело. По таблице определите их ядерные массы, если в таблице указывается дробное число, округлите его до целого. Обнаружьте сумму масс всех атомов, входящих в молекулу вещества , получите молекулярную массу, которая численно равна молярной массе вещества в граммах на моль. Позже этого, измеренную ранее массу поделите на молярную массу. В итоге получите количество вещества в молях (?=m/M).
2. Число вещества газа в типичных условиях. Если газ находится типичных условиях (0 градусов Цельсия и 760 мм рт. ст.), обнаружьте его объем. Для этого измерьте объем помещения, баллона либо сосуда, где он находится, от того что газ занимает каждый объем, ему предоставленный. Дабы получить его значение измерьте геометрические размеры сосуда, где он находится с поддержкой рулетки и с поддержкой математических формул, обнаружьте его объем. Особенно классическим случаем является комната в форме параллелепипеда. Измерьте ее длину, ширину и высоту в метрах, после этого перемножьте их и получите объем газа, тот, что в ней находится в кубических метрах. Дабы обнаружить количество вещества газа, полученный объем поделите на число 0,0224 – молярный объем газа при типичных условиях.
Измерьте ее длину, ширину и высоту в метрах, после этого перемножьте их и получите объем газа, тот, что в ней находится в кубических метрах. Дабы обнаружить количество вещества газа, полученный объем поделите на число 0,0224 – молярный объем газа при типичных условиях.
3. Число вещества газа с произвольными параметрами. Измерьте давление газа манометром в паскалях, его температуру в кельвинах, для чего к градусам Цельсия, в которых измеряет термометр, прибавьте число 273. Определите также объем газа в кубических метрах. Дабы обнаружить количество вещества произведение давления и объема поделите на температуру и число 8,31 (универсальную газовую непрерывную), ?=PV/(RT).
Видео по теме
Многие жидкости представляют собой растворы. Именно таковы, в частности, кровь человека, чай, кофе, морская вода. Основой раствора является растворенное вещество. Существуют задачи на нахождение массовой доли этого вещества.
Инструкция
1. Растворами именуются однородные гомогенные системы, которые состоят из 2-х и больше компонентов. Они делятся на три категории:- жидкие растворы;- твердые растворы;- газообразные растворы.К жидким растворам относится, скажем, разбавленная серная кислота, к твердым – сплав железа и меди, а к газообразным – всякие смеси газов. Самостоятельно от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем почаще каждого обыкновенно является вода, которой разбавляют вещество. Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
Растворами именуются однородные гомогенные системы, которые состоят из 2-х и больше компонентов. Они делятся на три категории:- жидкие растворы;- твердые растворы;- газообразные растворы.К жидким растворам относится, скажем, разбавленная серная кислота, к твердым – сплав железа и меди, а к газообразным – всякие смеси газов. Самостоятельно от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем почаще каждого обыкновенно является вода, которой разбавляют вещество. Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
2. Масса каждого раствора представляет собой сумму масс воды и растворенного вещества. Следственно изредка формулу, указанную выше, записывают несколько другим образом:?в=mв/(mв+m(h3O)), где m (раствора)=mв+m(h3O)Скажем, разбавленная азотная кислота состоит из растворителя – воды, и растворенного вещества -кислоты. Из этого следует, что масса растворенного вещества вычисляется дальнейшим образом:?в=mHNO3/mHNO3+mh3O
3. Если масса вещества неведома, а дана лишь масса воды, то в таком случае массовая доля находится по несколько другой формуле. Когда знаменит объем растворенного вещества, массу его находите по дальнейшей формуле:mв=V*?Из этого следует, что массовая доля вещества вычисляется дальнейшим образом:?в=V*?/V*?+m(h3O)
4. Нахождение массовой доли вещества неоднократно осуществляется и в утилитарных целях. Скажем, при отбеливании какого-нибудь материала нужно знать концентрацию пергидроля в растворе перекиси. Помимо того, точное вычисление массовой доли изредка требуется во врачебной практике. Помимо формул и примерного вычисления массовой доли в медицине применяют еще и экспериментальную проверку с подмогой приборов, что дозволяет уменьшить вероятность ошибок.
Помимо формул и примерного вычисления массовой доли в медицине применяют еще и экспериментальную проверку с подмогой приборов, что дозволяет уменьшить вероятность ошибок.
5. Существует несколько физических процессов, в ходе которых меняется массовая доля вещества и состав раствора. 1-й из них, называемый упариванием, представляет собой процесс, обратный растворению вещества в воде. При этом, растворенное вещество остается, а вода всецело упаривается. В этом случае массовая доля быть измерена не может – раствор отсутствует. Прямо противоположный процесс – разбавление концентрированного раствора. Чем огромнее он разбавляется, тем крепче уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не каждая вода, а лишь ее часть. Массовая доля вещества в растворе при этом возрастает.
Видео по теме
Что такое массовая доля элемента ? Из самого наименования дозволено осознать, что это величина, указывающая, в каком соотношении находятся масса элемента , входящего в состав вещества, и всеобщая масса этого вещества. Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как дозволено вычислить массу какого-нибудь элемента ?
Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как дозволено вычислить массу какого-нибудь элемента ?
Инструкция
1. Для наглядности разглядите отлично знаменитый каждому углерод, без которого не было бы органики. Если углерод представляет собою чистое вещество (скажем, алмаз), то его массовую долю дозволено храбро принять за единицу либо за 100%. Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь мелких числах, что ими дозволено пренебречь. А вот в таких модификациях углерода, как каменный уголь либо графит, оглавление примесей достаточно высокое, и такое игнорирование неприемлемо.
2. Если же углерод входит в состав трудного вещества, нужно делать дальнейшим образом: запишите точную формулу вещества, после этого, зная молярные массы всякого элемента , входящего в его состав, вычислите точную молярную массу этого вещества (разумеется, с учетом «индекса» всякого элемента ). Позже этого определить массовую долю , поделив всеобщую молярную массу элемента на молярную массу вещества.
Позже этого определить массовую долю , поделив всеобщую молярную массу элемента на молярную массу вещества.
3. Скажем, надобно обнаружить массовую долю углерода в уксусной кислоте. Напишите формулу уксусной кислоты: СН3СООН. Для упрощения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
4. Если надобно исчислить ее в процентном соотношении, соответственно, 0,4 * 100 = 40%. То есть в всяком килограмме уксусной кислоты содержится (примерно) 400 грамм углерода.
5. Разумеется, абсолютно аналогичным образом дозволено обнаружить массовые доли всех других элементов. Скажем, массовая доля кислорода в той же уксусной кислоте вычисляется так: 32/60 = 0,533 либо приблизительно 53,3%; а массовая доля водорода равна 4/60 = 0,666 либо приблизительно 6,7%.
6. Для проверки точности вычислений сложите процентные доли всех элементов:40% (углерод) + 53,3% (кислород) + 6,7% (водород) = 100%. Счет сошелся.
Счет сошелся.
У вас есть двухсотлитровая бочка. Вы планируете ее всецело заправить дизельным топливом, которое используете для отопления своей мини-котельной. А сколько она будет весить, наполненная соляром? Теперь вычислим.
Вам понадобится
- – таблица удельной плотности веществ;
- – знание изготавливать простейшие математические вычисления.
Инструкция
1. Дабы обнаружить массу вещества по его объему, воспользуйтесь формулой удельной плотности вещества.p = m/vздесь p – удельная плотность вещества;m – его масса;v – занимаемый объем. Массу будем считать в граммах, килограммах и тоннах. Объемы в кубических сантиметрах, дециметрах и мерах. И удельную плотность, соответственно, в г/см3, кг/дм3, кг/м3, т/м3.
2. Выходит, по условиям задачи, у вас есть двухсотлитровая бочка. Это значит: бочка емкостью 2 м3. Двухсотлитровой ее называют, так как воды, с ее удельной плотностью равной единице, в такую бочку входит 200 литров.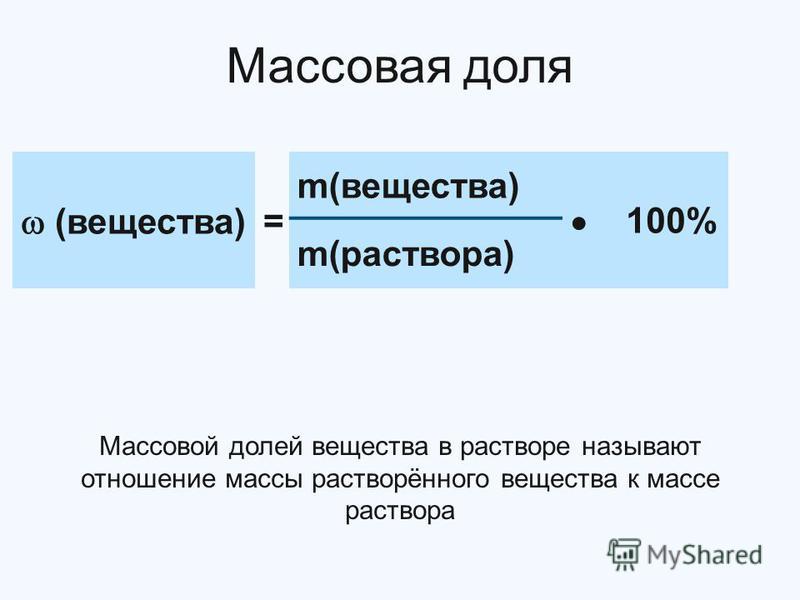 Вас волнует масса. Следственно выводите ее в представленной формуле на первое место.m = p*vВ правой части формулы незнакомо значение р – удельная плотность дизельного топлива. Обнаружьте его по справочнику. Еще проще – задать в поиск запрос в интернете «удельная плотность дизельного топлива».
Вас волнует масса. Следственно выводите ее в представленной формуле на первое место.m = p*vВ правой части формулы незнакомо значение р – удельная плотность дизельного топлива. Обнаружьте его по справочнику. Еще проще – задать в поиск запрос в интернете «удельная плотность дизельного топлива».
3. Обнаружили: плотность летнего дизельного топлива при t = +200 С – 860 кг/м3.Подставляйте значения в формулу:m = 860*2 = 1720 (кг)1 тонна и 720 кг – столько весят 200 литров летнего дизельного топлива. Завесив заблаговременно бочку, дозволено рассчитать всеобщий вес и прикинуть мощность стеллажа под бочку с соляром.
4. В сельской местности пригодным бывает предварительно рассчитать массу нужных по кубатуре дров, дабы определиться с грузоподъемностью транспорта, на котором будут доставляться эти дрова. К примеру, вам на зиму нужен минимум в 15 куб. метров березовых дров. Ищите в справочной литературе плотность березовых дров. Это: 650 кг/м3.Вычисляйте массу, подставив значения в ту же формулу удельной плотности.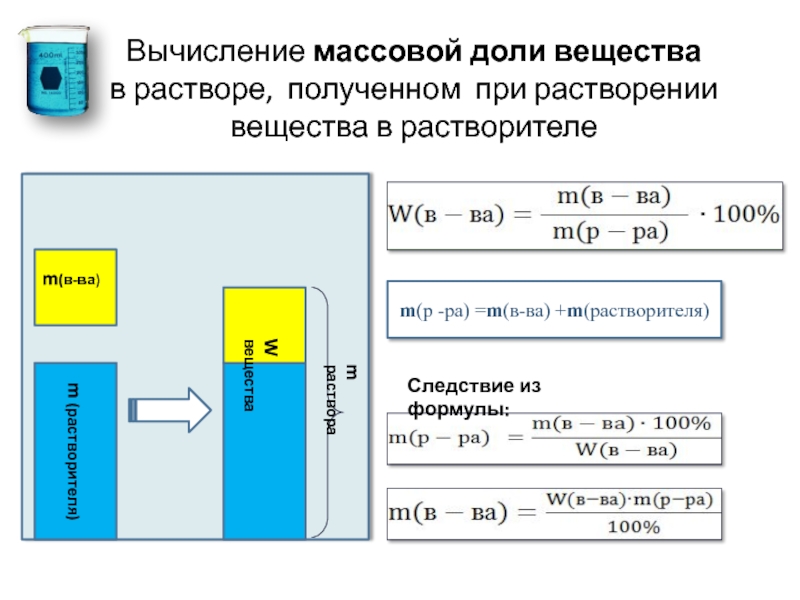 m = 650*15 = 9750 (кг)Сейчас, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и числом поездок.
m = 650*15 = 9750 (кг)Сейчас, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и числом поездок.
Видео по теме
Обратите внимание!
Люди постарше огромнее знакомы с представлением удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его оглавление в больше трудной структуре, скажем, в сплаве либо смеси. Если знаменита всеобщая масса смеси либо сплава, то зная массовые доли составляющих веществ дозволено обнаружить их массы. Обнаружить массовую долю вещества, дозволено зная его массу и массу каждой смеси. Эта величина, может выражаться в дольных величинах либо процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
1. Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с поддержкой весов определите массы веществ, составляющих смесь либо сплав. После этого сложите их. Полученную массу примите за 100%. Дабы обнаружить массовую долю вещества в смеси, поделите его массу m на массу смеси M, а итог умножьте на 100% (?%=(m/M)?100%). Скажем, в 140 г воды растворяют 20 г поваренной соли. Дабы обнаружить массовую долю соли, сложите массы этих 2-х веществ М=140+20=160 г. После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
Для этого с поддержкой весов определите массы веществ, составляющих смесь либо сплав. После этого сложите их. Полученную массу примите за 100%. Дабы обнаружить массовую долю вещества в смеси, поделите его массу m на массу смеси M, а итог умножьте на 100% (?%=(m/M)?100%). Скажем, в 140 г воды растворяют 20 г поваренной соли. Дабы обнаружить массовую долю соли, сложите массы этих 2-х веществ М=140+20=160 г. После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
2. Если требуется обнаружить оглавление либо массовую долю элемента в веществе с вестимой формулой, воспользуйтесь периодической таблицей химических элементов. По ней обнаружьте ядерные массы элементов, которые входят в состав вещества. Если один элемент встречается в формуле несколько раз, умножьте его ядерную массу на это число и сложите полученные итоги. Это будет молекулярная масса вещества. Дабы обнаружить массовую долю всякого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Итог множьте на 100 % (?%=(M0/M)?100%).
Итог множьте на 100 % (?%=(M0/M)?100%).
3. Скажем, определите массовую долю химических элементов в медном купоросе. Медный купорос (сульфат меди II), имеет химическую формулу CuSO4. Ядерные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16?4=64, с учетом того, что в молекуле содержится 4 атома кислорода. Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (?%=(64/160)?100%)=40%. По такому же тезису дозволено определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ?%=(32/160)?100%=20 %, кислорода (О) ?%=(64/160)?100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Массовая доля — это процентное оглавление компонента в смеси либо элемента в веществе. С задачами на вычисление массовой доли сталкиваются не только школьники и студенты. Знание вычислять процентную концентрацию вещества находит абсолютно утилитарное использование и в реальной жизни – там, где требуется составление растворов – начиная со строительства и заканчивая кулинарией.
Знание вычислять процентную концентрацию вещества находит абсолютно утилитарное использование и в реальной жизни – там, где требуется составление растворов – начиная со строительства и заканчивая кулинарией.
Вам понадобится
- – таблица Менделеева;
- – формулы для расчета массовой доли.
Инструкция
1. Рассчитайте массовую долю по определению. Потому что масса вещества слагается из масс элементов, которые его составляют, то на долю всякого составляющего элемента доводится некоторая часть массы вещества. Массовая доля раствора равна отношению массы растворенного вещества к массе каждого раствора.
2. Масса раствора равна сумме масс растворителя (традиционно воды) и вещества. Массовая доля смеси равна отношению массы вещества к массе смеси, содержащей вещество. Полученный итог умножьте на 100%.
3. Обнаружьте массовую долю выхода с поддержкой формулы?=mд/mп, где mп и mд – величина полагаемого и действительного полученного выхода вещества (массы) соответственно. Вычисляйте полагаемую массу из уравнения реакции, пользуясь формулой m=nM, где n – химическое число вещества, M – молярная масса вещества (сумма ядерных масс всех элементов, входящих в вещество), либо формулой m=V?, где V- объем вещества, ? – его плотность. Число вещества в свою очередь при необходимости замените на формулу n=V/Vm либо также находите из уравнения реакции.
Вычисляйте полагаемую массу из уравнения реакции, пользуясь формулой m=nM, где n – химическое число вещества, M – молярная масса вещества (сумма ядерных масс всех элементов, входящих в вещество), либо формулой m=V?, где V- объем вещества, ? – его плотность. Число вещества в свою очередь при необходимости замените на формулу n=V/Vm либо также находите из уравнения реакции.
4. Массовую долю элемента трудного вещества вычислите с подмогой таблицы Менделеева. Сложите ядерные массы всех элементов, входящих в вещество, при необходимости домножая на индексы. Вы получите молярную массу вещества. Обнаружьте молярную массу элемента из таблицы Менделеева. Рассчитайте массовую долю , поделив молярную массу элемента на молярную массу вещества. Умножьте на 100%.
Полезный совет
Обращайте внимание на физический процесс, тот, что имеет место быть. При упаривании не рассчитывайте массовую долю, потому что раствора (воды либо другой всякий жидкости) нет. Не забывайте, что при концентрировании, напротив называемом частичным упариванием, массовая доля вещества возрастает. Если вы разбавляете концентрированный раствор, массовая доля уменьшается.
Если вы разбавляете концентрированный раствор, массовая доля уменьшается.
Массовая доля какого-нибудь компонента в веществе показывает, которая часть от всеобщей массы доводится на атомы именно этого элемента. Применяя химическую формулу вещества и периодическую таблицу Менделеева, дозволено определить массовую долю всего из входящих в формулу элементов. Полученная в итоге величина выражается обычной дробью либо процентами.
Инструкция
1. Если требуется по химической формуле определить массовую долю всякого элемента, составляющего ее, начните с вычисления числа атомов, которое доводится на весь из элементов. Скажем, химическую формулу этанола записывают так: CH?-CH?-OH. А химическая формула диметилового эфира – CH?-O-CH?. Число атомов кислорода (O) в всякой из формул равно единице, углерода (С) – двум, водорода (H) – шести. Обратите внимание, что это различные вещества, потому что идентичное число атомов всего элемента в их молекулах расположено по-различному. Тем не менее, массовые доли всего элемента в диметиловом эфире и этаноле будут идентичны.
Тем не менее, массовые доли всего элемента в диметиловом эфире и этаноле будут идентичны.
2. С применением периодической таблицы определите ядерную массу всякого элемента, входящего в химическую формулу. Это число умножьте на число атомов всякого элемента, рассчитанное на предыдущем шаге. В использованном выше примере формула содержит каждого один атом кислорода, а его атомарная масса из таблицы равна 15,9994. Атомов углерода в формуле два, его атомарная масса равна 12,0108, значит, суммарный вес атомов составит 12,0108*2=24,0216. Для водорода эти цифры равны соответственно 6, 1,00795 и 1,00795*6=6,0477.
3. Определите всеобщую атомарную массу всей молекулы вещества – сложите полученные на предыдущем шаге числа. Для диметилового эфира и этанола эта величина должна быть равна 15,9994+24,0216+6,0477=46,0687.
4. Если итог требуется получить в долях единицы, составьте для всякого элемента, входящего в формулу, индивидуальную дробь. В ее числителе должна стоять величина, рассчитанная для этого элемента на втором шаге, а в знаменатель всей дроби поставьте число из третьего шага. Полученную обычную дробь дозволено округлить до надобной степени точности. В использованном выше примере массовая доля кислорода составляет 15,9994/46,0687?16/46=8/23, углерода – 24,0216/46,0687?24/46=12/23, водорода – 6,0477/46,0687?6/46=3/23.
Полученную обычную дробь дозволено округлить до надобной степени точности. В использованном выше примере массовая доля кислорода составляет 15,9994/46,0687?16/46=8/23, углерода – 24,0216/46,0687?24/46=12/23, водорода – 6,0477/46,0687?6/46=3/23.
5. Для приобретения итога в процентах полученные обычные дроби переведите в формат десятичных и увеличьте в сто раз. В использованном примере массовая доля кислорода в процентах выражается числом 8/23*100?34,8%, углерода – 12/23*100?52,2%, водорода – 3/23*100?13,0%.
Видео по теме
Обратите внимание!
Массовая доля не может быть огромнее единицы либо, если она выражается в процентах, огромнее 100%.
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать методы измерения различных параметров вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элемента. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовая доля элемента в веществе обозначается латинской строчной буквой w (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах (рис. 69). Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Рис. 69.
Диаграмма элементного состава оксида ртути
Например, в состав оксида ртути HgО входят два элемента — ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида ртути:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
Например, для воды (рис. 70):
Давайте потренируемся в решении задач на вычисление массовых долей элементов в сложных веществах.
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SО 4 .
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества.
То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Задача 3. Из природных минералов — тенорита и куприта (рис. 71) были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде (рис. 72), выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1% . Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.
Рис. 71. Минерал куприт
Рис. 72. Оксид меди черного цвета, выделенный из минерала тенорита
3. Полученное соотношение нужно привести к значениям целых чисел: ведь индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
А теперь немного усложним задачу.
Задача 4. По данным элементного анализа, прокаленная горькая соль имеет следующий состав: массовая доля магния 20,0%, массовая доля серы — 26,7% , массовая доля кислорода — 53,3% .
Вопросы и задания
- Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
- Рассчитайте массовые доли элементов в веществах: а) углекислом газе СО 2 ; б) сульфиде кальция CaS; в) натриевой селитре NaNО 3 ; г) оксиде алюминия А1 2 О 3 .
- В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 C1; б) сульфате аммония (NH 4) 2 SО 4 ; в) мочевине (NH 2) 2 СО?
- В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
- Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода — 69,57%.
 Определите формулу оксида.
Определите формулу оксида. - В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе составляют: калий — 56,6%, углерод — 8,7%, кислород — 34,7%. Определите формулу поташа.
В чем суть понятия «массовая доля»?
Массовая доля измеряется в процентах или просто в десятых. Чуть выше мы говорили о классическом определении, которое можно обнаружить в справочниках, энциклопедиях или школьных учебниках химии. Но уяснить суть из сказанного не так просто. Итак, предположим, у нас имеется 500 г какого-то сложного вещества. Сложного в данном случае означает то, что оно не однородно по своему составу. По большому счёту любые вещества, которыми мы пользуемся, являются сложными, даже простая поваренная соль, формула которой – NaCl, то есть она состоит из молекул натрия и хлора. Если продолжать рассуждения на примере поваренной соли, то можно предположить, что в 500 граммах соли содержится 400 г натрия. Тогда его массовая доля будет 80 % или 0,8.
По большому счёту любые вещества, которыми мы пользуемся, являются сложными, даже простая поваренная соль, формула которой – NaCl, то есть она состоит из молекул натрия и хлора. Если продолжать рассуждения на примере поваренной соли, то можно предположить, что в 500 граммах соли содержится 400 г натрия. Тогда его массовая доля будет 80 % или 0,8.
Зачем это нужно дачнику?
Думаю, ответ на этот вопрос вы уже знаете. Приготовление всевозможных растворов, смесей и т. п. является неотъемлемой частью хозяйственной деятельности любого огородника. В виде растворов используются удобрения, различные питательные смеси, а также другие препараты, например, стимуляторы роста «Эпин», «Корневин» и т.д. Кроме того, часто приходится смешивать сухие вещества, например, цемент, песок и другие компоненты, или обычную садовую землю с приобретенным субстратом. При этом рекомендуемая концентрация указанных средств и препаратов в приготовленных растворах или смесях в большинстве инструкций приводится именно в массовых долях.
Таким образом, знание как вычислить массовую долю элемента в веществе поможет дачнику правильно приготовить необходимый раствор удобрения или питательной смеси, а это, в свою очередь, обязательно отразится на будущем урожае.
Алгоритм вычисления
Итак, массовая доля отдельного компонента – это отношение его массы к общей массе раствора или вещества. Если полученный результат нужно перевести в проценты, то надо умножить его на 100. Таким образом, формулу для вычисления массовой доли можно записать так:
W = Масса вещества / Масса раствора
W = (Масса вещества / Масса раствора) х 100 %.
Пример определения массовой доли
Предположим, что мы имеем раствор, для приготовления которого в 100 мл воды было добавлено 5 г NaCl, и теперь необходимо вычислить концентрацию поваренной соли, то есть ее массовую долю. Масса вещества нам известна, а масса полученного раствора представляет собой сумму двух масс – соли и воды и равняется 105 г. Таким образом, делим 5 г на 105 г, умножаем результат на 100 и получаем искомую величину 4,7 %. Именно такую концентрацию будет иметь соляной раствор.
Именно такую концентрацию будет иметь соляной раствор.
Более практичная задача
На практике же дачнику чаще приходится сталкиваться с задачами другого рода. Например, необходимо приготовить водный раствор какого-либо удобрения, концентрация которого по массе должна быть 10 %. Чтобы точно соблюсти рекомендуемые пропорции, нужно определить, какое понадобится количество вещества и в каком объеме воды его нужно будет растворить.
Решение задачи начинается в обратном порядке. Сначала следует разделить выраженную в процентах массовую долю на 100. В результате получим W= 0,1 – это массовая доля вещества в единицах. Теперь обозначим количество вещества как х, а конечную массу раствора – М. При этом последнюю величину составляют два слагаемых – масса воды и масса удобрения. То есть М = Мв + х. Таким образом, мы получаем простое уравнение:
W = х / (Мв + х)
Решая его относительно х, получим:
х = W х Мв / (1 – W)
Подставляя имеющиеся данные, получаем следующую зависимость:
х = 0,1 х Мв / 0,9
Таким образом, если для приготовления раствора мы возьмем 1 л (то есть 1000 г) воды, то для приготовления раствора нужной концентрации понадобиться примерно 111-112 г удобрения.
Решение задач с разбавлением или добавлением
Предположим, мы имеем 10 л (10 000 г) готового водного раствора с концентрацией в нем некого вещества W1 = 30 % или 0,3. Сколько понадобится добавить в него воды, чтобы концентрация снизилась до W2 = 15 % или 0,15? В этом случае поможет формула:
Мв = (W1х М1 / W2) – М1
Подставив исходные данные, получим, что количество добавляемой воды должно быть:
Мв = (0,3 х 10 000 / 0,15) – 10 000 = 10 000 г
То есть добавить нужно те же 10 л.
Теперь представим обратную задачу – имеется 10 л водного раствора (М1 = 10 000 г) концентрацией W1 = 10 % или 0,1. Нужно получить раствор с массовой долей удобрения W2 = 20 % или 0,2. Сколько нужно будет добавить исходного вещества? Для этого нужно воспользоваться формулой:
х = М1 х (W2 – W1) / (1 – W2)
Подставив исходные значение, получим х = 1 125 г.
Таким образом, знание простейших основ школьной химии поможет огороднику правильно приготовить растворы удобрений, питательные субстраты из нескольких элементов или смеси для строительных работ.
Массовая доля элемента в веществе — Учебник по Химии. 7 класс. Григорович
Учебник по Химии. 7 класс. Григорович — Новая программа
Химическая формула вещества содержит определенную информацию. Она не только отображает качественный состав вещества (т. е. информацию о химических элементах, из которых она состоит), но и его количественный состав.
Например, в молекуле воды на два атома Гидрогена приходится один атом Оксигена. Суммарная относительная атомная масса атомов Гидрогена равна 2 (2 • Аr(Н) = 2 • 1 = 2), а относительная атомная масса атома Оксигена равна 16 (Аr(О) = 16). Следовательно, на 2 массовые части Гидрогена в воде приходится 16 массовых частей Оксигена.
Чтобы описать количественный состав веществ, используют массовую долю элемента в соединении, которую можно вычислить по химической формуле. Массовая доля элемента показывает, какая часть массы вещества приходится на атомы данного элемента. Ее вычисляют как отношение атомной массы данного элемента с учетом числа его атомов в молекуле к относительной молекулярной массе вещества:
где w(Е) — массовая доля химического элемента Е, выраженная в долях единицы;
п — число атомов элемента Е, обозначенное индексом в формуле соединения;
А — относительная атомная масса элемента Е;
Мr — относительная молекулярная масса вещества.
Физическая суть массовой доли заключается в том, что она показывает массу атомов данного элемента в 100 г вещества. Массовая доля может выражаться в долях единицы или процентах. Чтобы перевести доли единицы в проценты, необходимо полученные по формуле значения умножить на 100 %. Сумма массовых долей всех элементов, которые входят в состав соединения, должна быть равна 1 или 100 %.
Пример 1. Вычислите массовые доли химических элементов в углекислом газе СO2.
Решение:
Вычислим относительную молекулярную массу углекислого газа:
Mr(СO2) = Ar(С) + 2 • Ar(О) = 12 + 2 • 16 = 44
Вычислим массовые доли Карбона и Оксигена:
Сумма массовых долей Карбона и Оксигена в углекислом газе должна быть равна 1, поэтому массовую долю Оксигена можно определить, вычитая из единицы массовую долю Карбона:
w(O) = 1 — w(С) = 1 — 0,273 = 0,727
Ответ: w(C) = 27,3 %, w(О) = 72,7 %
Пример 2. Вычислите массу атомов Оксигена, содержащихся в воде массой 1 кг.
Вычислите массу атомов Оксигена, содержащихся в воде массой 1 кг.
Решение:
Вычислим массовую долю Оксигена в воде:
Массовая доля элемента показывает часть массы вещества, приходящуюся на данный элемент. Вычислим массу атомов Оксигена в воде массой 1 кг:
m(O) = w(O) • m(Н2O) = 0,889 • 1000 г = 889 г
Ответ: m(O) = 889 г.
Законы Пруста и Дальтона
До начала XIX в. измерениям масс веществ не придавали особого значения и в науке бытовала мысль, что состав вещества может изменяться в зависимости от способа его получения.
Жозеф Луи Пруст (1754-1826)
Выдающийся французский химик, сын аптекаря. С 11 лет изучал аптекарское дело. В лаборатории своего отца в одиночестве любил смешивать реактивы, в результате чего чуть не отравился ядовитым газом. С 14 лет изучал химию в Париже. Был руководителем кафедры химии в университете Мадрида. Пруст проводил исследования в различных областях химии — минералогии, фармации, аналитической химии, изучал пороховые смеси. Он изобрел лекарство от цинги и некоторые пищевые добавки, разработал технологию выделения сахара из винограда и свеклы. Открыл закон постоянства состава веществ.
Он изобрел лекарство от цинги и некоторые пищевые добавки, разработал технологию выделения сахара из винограда и свеклы. Открыл закон постоянства состава веществ.
И действительно, почему соединение всегда должно содержать, скажем, 4 г элемента X и 1 г элемента Y? Почему оно не может содержать 4,1 или 3,9 г X? Но если материя состоит из атомов, то соединение образуется в результате соединения одного атома X с одним атомом Y в одну молекулу, и никак иначе. В таком случае соотношения масс атомов X и Y должны быть постоянными и ни от чего не зависеть.
Проведя многочисленные опыты, французский химик Ж. Л. Пруст доказал постоянство соотношений масс элементов в различных веществах. На основании своих экспериментов он сформулировал закон постоянства состава вещества, который утверждает, что любое вещество имеет постоянный состав независимо от способа его получения. Например, кислород можно получить разложением разных веществ, но его формула всегда будет одинаковой — O2.
Позднее Дж. Дальтон определил, что атомы разных элементов могут соединяться в разных соотношениях, но эти соотношения всегда кратны относительным атомным массам элементов. Например, атомы Карбона и Оксигена могут образовывать молекулы СО (угарный газ) и СO2 (углекислый газ). Но в этом случае образуются разные вещества, для каждого из которых характерно постоянство состава. Эти исследования Дальтона со временем оформились в закон кратных соотношений.
Выводы:
1. Химическая формула содержит информацию о количественном составе вещества. По химической формуле можно определить соотношение масс атомов разных химических элементов в веществе.
2. По химической формуле вычисляют массовую долю элемента в веществе как отношение массы атомов данного элемента к относительной молекулярной массе вещества. Массовая доля элемента показывает, какая часть массы вещества приходится на данный химический элемент.
Контрольные вопросы
1. Каким способом можно определить количественный состав веществ?
Каким способом можно определить количественный состав веществ?
2. Как определяется массовая доля элемента в веществе? Приведите формулу для ее вычисления.
3. Какова физическая суть понятия «массовая доля элемента в веществе»?
4. Выберите правильные утверждения: а) по химической формуле можно узнать, какие химические элементы входят в состав вещества; б) по химической формуле можно узнать соотношение атомов разных элементов в веществе; в) по химической формуле можно узнать, сколько атомов каждого элемента входит в состав молекулы вещества; г) по химической формуле можно узнать форму молекулы вещества.
5. Выберите правильный ответ. Массовая доля элемента в веществе показывает; а) во сколько раз масса одного атома больше массы молекулы; б) массу атомов данного химического элемента в 100 г вещества;
в) отношение массы атомов данного химического элемента к молекулярной массе; г) сколько атомов каждого элемента входит в состав молекулы.
Задания для усвоения материала
1.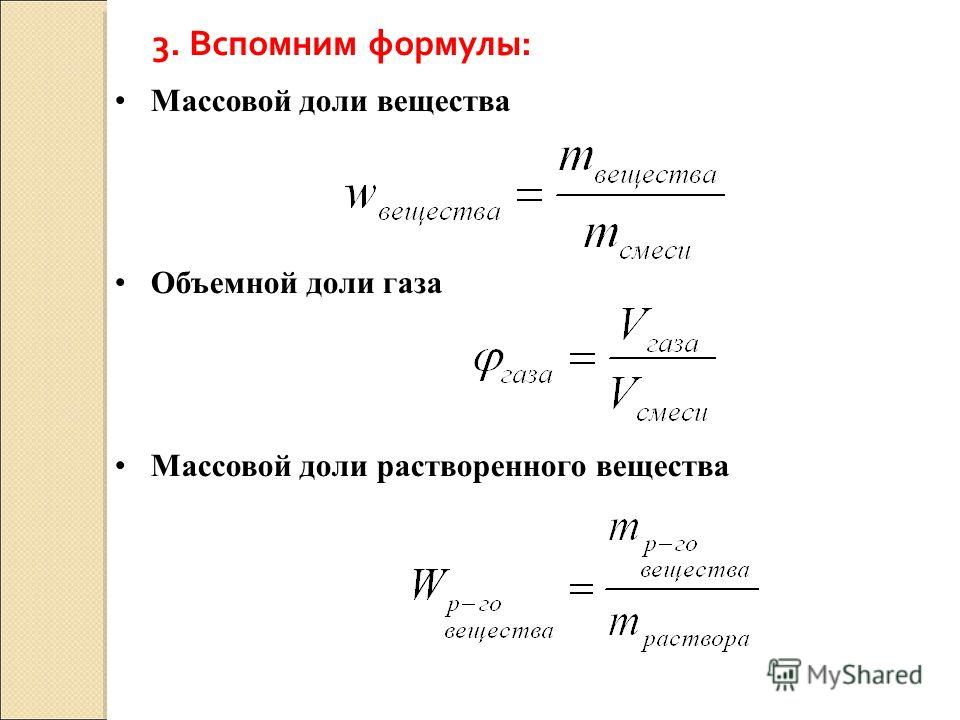 Вычислите массовые доли всех элементов в соединениях со следующими химическими формулами; a) NO2; б) РbСl2; в) Na2CO3; г) H2SO4; Д) Ва3(РO4)2.
Вычислите массовые доли всех элементов в соединениях со следующими химическими формулами; a) NO2; б) РbСl2; в) Na2CO3; г) H2SO4; Д) Ва3(РO4)2.
2. Формула глюкозы С6Н12O6, формула сахарозы С12Н22O11 В каком веществе массовая доля Оксигена больше?
3. Вычислите массу атомов Гидрогена, которые содержатся в аммиаке NH3 массой 10 г.
4. Масса воды на Земле оценивается приблизительно в 1,45 • 1018 тонн. Вычислите, какая масса атомов Гидрогена и Оксигена содержится в этой массе воды.
Интересно, что…
По соотношениям масс атомов в XIX в. были определены химические формулы почти всех известных к тому времени веществ. Возможность выражения состава вещества простыми соотношениями стала одним из доказательств существования атомов.
ГДЗ к учебнику можно найти тут.
Химия массовая доля элемента в соединении. Как найти массовую долю вещества по формуле. В чем суть понятия «массовая доля»
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. элемента в вещества обозначается греч. буквой «омега» — ω Э/В и рассчитывается по формуле:
где k — число атомов этого элемента в молекуле.
Какова массовая доля водорода и кислорода в воде (Н 2 О)?
Решение:
M r (Н 2 О) = 2*А r (Н) + 1*А r (О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Рис. 1. Оформление решения задачи 1
Рассчитайте массовую долю элементов в веществе H 3 PO 4 .
1) Вычисляем относительную молекулярную массу вещества:
M r (Н 3 РО 4) = 3*А r (Н) + 1*А r (Р) + 4*А r (О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.34-36)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§15)
4. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
4. Видеоурок по теме «Массовая доля химического элемента в веществе» ().
Домашнее задание
1. с.78 № 2 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005).
С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 34-36 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Из курса химии известно, что массовой долей называют содержание определенного элемента в каком-нибудь веществе. Казалось бы, такие знания обычному дачнику ни к чему. Но не спешите закрывать страницу, так как умение вычислять массовую долю для огородника может оказаться очень даже полезным. Однако, чтобы не запутаться, давайте поговорим обо всем по порядку.В чем суть понятия «массовая доля»?
Массовая доля измеряется в процентах или просто в десятых. Чуть выше мы говорили о классическом определении, которое можно обнаружить в справочниках, энциклопедиях или школьных учебниках химии. Но уяснить суть из сказанного не так просто. Итак, предположим, у нас имеется 500 г какого-то сложного вещества. Сложного в данном случае означает то, что оно не однородно по своему составу. По большому счёту любые вещества, которыми мы пользуемся, являются сложными, даже простая поваренная соль, формула которой – NaCl, то есть она состоит из молекул натрия и хлора. Если продолжать рассуждения на примере поваренной соли, то можно предположить, что в 500 граммах соли содержится 400 г натрия. Тогда его массовая доля будет 80 % или 0,8.
Сложного в данном случае означает то, что оно не однородно по своему составу. По большому счёту любые вещества, которыми мы пользуемся, являются сложными, даже простая поваренная соль, формула которой – NaCl, то есть она состоит из молекул натрия и хлора. Если продолжать рассуждения на примере поваренной соли, то можно предположить, что в 500 граммах соли содержится 400 г натрия. Тогда его массовая доля будет 80 % или 0,8.
Зачем это нужно дачнику?
Думаю, ответ на этот вопрос вы уже знаете. Приготовление всевозможных растворов, смесей и т. п. является неотъемлемой частью хозяйственной деятельности любого огородника. В виде растворов используются удобрения, различные питательные смеси, а также другие препараты, например, стимуляторы роста «Эпин», «Корневин» и т.д. Кроме того, часто приходится смешивать сухие вещества, например, цемент, песок и другие компоненты, или обычную садовую землю с приобретенным субстратом. При этом рекомендуемая концентрация указанных средств и препаратов в приготовленных растворах или смесях в большинстве инструкций приводится именно в массовых долях.
Таким образом, знание как вычислить массовую долю элемента в веществе поможет дачнику правильно приготовить необходимый раствор удобрения или питательной смеси, а это, в свою очередь, обязательно отразится на будущем урожае.
Алгоритм вычисления
Итак, массовая доля отдельного компонента – это отношение его массы к общей массе раствора или вещества. Если полученный результат нужно перевести в проценты, то надо умножить его на 100. Таким образом, формулу для вычисления массовой доли можно записать так:
W = Масса вещества / Масса раствора
W = (Масса вещества / Масса раствора) х 100 %.
Пример определения массовой доли
Предположим, что мы имеем раствор, для приготовления которого в 100 мл воды было добавлено 5 г NaCl, и теперь необходимо вычислить концентрацию поваренной соли, то есть ее массовую долю. Масса вещества нам известна, а масса полученного раствора представляет собой сумму двух масс – соли и воды и равняется 105 г. Таким образом, делим 5 г на 105 г, умножаем результат на 100 и получаем искомую величину 4,7 %. Именно такую концентрацию будет иметь соляной раствор.
Именно такую концентрацию будет иметь соляной раствор.
Более практичная задача
На практике же дачнику чаще приходится сталкиваться с задачами другого рода. Например, необходимо приготовить водный раствор какого-либо удобрения, концентрация которого по массе должна быть 10 %. Чтобы точно соблюсти рекомендуемые пропорции, нужно определить, какое понадобится количество вещества и в каком объеме воды его нужно будет растворить.
Решение задачи начинается в обратном порядке. Сначала следует разделить выраженную в процентах массовую долю на 100. В результате получим W= 0,1 – это массовая доля вещества в единицах. Теперь обозначим количество вещества как х, а конечную массу раствора – М. При этом последнюю величину составляют два слагаемых – масса воды и масса удобрения. То есть М = Мв + х. Таким образом, мы получаем простое уравнение:
W = х / (Мв + х)
Решая его относительно х, получим:
х = W х Мв / (1 – W)
Подставляя имеющиеся данные, получаем следующую зависимость:
х = 0,1 х Мв / 0,9
Таким образом, если для приготовления раствора мы возьмем 1 л (то есть 1000 г) воды, то для приготовления раствора нужной концентрации понадобиться примерно 111-112 г удобрения.
Решение задач с разбавлением или добавлением
Предположим, мы имеем 10 л (10 000 г) готового водного раствора с концентрацией в нем некого вещества W1 = 30 % или 0,3. Сколько понадобится добавить в него воды, чтобы концентрация снизилась до W2 = 15 % или 0,15? В этом случае поможет формула:
Мв = (W1х М1 / W2) – М1
Подставив исходные данные, получим, что количество добавляемой воды должно быть:
Мв = (0,3 х 10 000 / 0,15) – 10 000 = 10 000 г
То есть добавить нужно те же 10 л.
Теперь представим обратную задачу – имеется 10 л водного раствора (М1 = 10 000 г) концентрацией W1 = 10 % или 0,1. Нужно получить раствор с массовой долей удобрения W2 = 20 % или 0,2. Сколько нужно будет добавить исходного вещества? Для этого нужно воспользоваться формулой:
х = М1 х (W2 – W1) / (1 – W2)
Подставив исходные значение, получим х = 1 125 г.
Таким образом, знание простейших основ школьной химии поможет огороднику правильно приготовить растворы удобрений, питательные субстраты из нескольких элементов или смеси для строительных работ.
>>
Массовая доля элемента в сложном веществе
Материал параграфа поможет вам:
> выяснить, что такое массовая доля элемента в соединении, и определять ее значение;
> рассчитывать массу элемента в определенной массе соединения, исходя из массовой доли элемента;
> правильно оформлять решение химических задач.
Каждое сложное вещество (химическое соединение) образовано несколькими элементами. Знать содержание элементов в соединении необходимо для его эффективного использования. Например, лучшим азотным удобрением считают то, в котором содержится наибольшее количество Нитрогена (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько она «богата » на металлический элемент.
Содержание элемента в соединении характеризуют его массовой долей. Эту величину обозначают латинской буквой w («дубль-вэ»).
Выведем формулу для вычисления массовой доли элемента в соединении по известным массам соединения и элемента. Обозначим массовую долю элемента буквой х. Приняв во внимание, что масса соединения — это целое, а масса элемента — часть от целого, составляем пропорцию:
Обозначим массовую долю элемента буквой х. Приняв во внимание, что масса соединения — это целое, а масса элемента — часть от целого, составляем пропорцию:
Заметим, что массы элемента и соединения нужно брать в одинаковых единицах измерения (например, в граммах).
Это интересно
В двух соединениях Сульфура- SO 2 и MoS 3 — массовые доли элементов одинаковы и составляют по 0,5 (или 50 %).
Массовая доля не имеет размерности. Ее часто выражают в процентах. В этом случае формула принимает такой вид:
Очевидным является то, что сумма массовых долей всех элементов в соединении равна 1 (или 100 %).
Приведем несколько примеров решения расчетных задач. Условие задачи и ее решение оформляют таким образом. Лист тетради или классную доску делят вертикальной линией на две неодинаковые части. В левой, меньшей, части сокращенно записывают условие задачи, проводят горизонтальную линию и под ней указывают то, что нужно найти или вычислить. В правой части записывают математические формулы, объяснение, расчеты и ответ.
В 80 г соединения содержится 32 г Оксигена . Вычислить массовую долю Оксигена в соединении.
Массовую долю элемента в соединении также вычисляют, используя химическую формулу соединения. Поскольку массы атомов и молекул пропорциональны относительным атомным и молекулярным массам, то
где N(E) — количество атомов элемента в формуле соединения.
По известной массовой доле элемента можно рассчитать массу элемента, которая содержится в определенной массе соединения. Из математической формулы для массовой доли элемента вытекает:
m(E) = w(E) m(соединения).
Какая масса Нитрогена содержится в аммиачной селитре (азотное удобрение) массой 1 кг, если массовая доля этого элемента в соединении равна 0,35?
Понятие «массовая доля» используют для характеристики количественного состава смесей веществ. Соответствующая математическая формула имеет такой вид:
Выводы
Массовая доля элемента в соединении — это отношение массы элемента к соответствующей массе соединения.
Массовую долю элемента в соединении вычисляют по известным массам элемента и соединения или по его химической формуле.
?
92. Как вычислить массовую долю элемента в соединении, если известны: а) масса элемента и соответствующая масса соединения; б) химическая формула соединения?
93. В 20 г вещества содержится 16 г Брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
94. Вычислите (желательно устно) массовые доли элементов в соединениях с такими формулами: SO 2 , LiH, CrO 3 .
95. Сопоставляя формулы веществ, а также значения относительных атом ных масс, определите, в каком из веществ каждой пары массовая доля первого в формуле элемента больше:
a) N 2 O, NO; б) CO, CO 2 ; в) B 2 O 3 , B 2 S 3 .
96. Выполните необходимые вычисления для уксусной кислоты CH 3 COOH и глицерина C 3 H 5 (OH) 3 и заполните таблицу:
| C x H y O z | M r (C x H y O z) | w(C) | W(H) | W(O) |
97. Массовая доля Нитрогена в некотором соединении равна 28 %. В какой массе соединения содержится 56 г Нитрогена?
Массовая доля Нитрогена в некотором соединении равна 28 %. В какой массе соединения содержится 56 г Нитрогена?
98. Массовая доля Кальция в его соединении с Гидрогеном равна 0,952. Определите массу Гидрогена, которая содержится в 20 г соединения.
99. Смешали 100 г цемента и 150 г песка. Какова массовая доля цемента в приготовленной смеси?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииПонятие «доли» наверняка вам уж знакомо.
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть от целого арбуза, то есть его доля равна 1/4 или 25%.
Чтобы лучше понять, что такое массовая доля представьте себе килограмм конфет (1000г), который мама купила своим трем детям. Из этого килограмма самому младшему ребенку досталась половина всех конфет (несправедливо конечно!). Старшему — лишь 200г, а среднему — 300г.
Значит массовая доля конфет у младшего ребенка составит половину, или 1/2 или 50%. У среднего ребенка будет 30%, а у старшего — 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.д.), а может измеряться в процентах (%). При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
Массовая доля вещества в растворе
Любой раствор состоит из растворителя и растворенного вещества. Вода — самый распространенный неорганический растворитель. Органическими растворителями могут быть спирт, ацетон, диэтиловый эфир и др. Если в условии задачи не указана растворитель, раствор считается водным.
Если в условии задачи не указана растворитель, раствор считается водным.
Массовая доля растворенного вещества рассчитывается по формуле:
$\omega_\text{в-ва}=\dfrac{m_\text{в-ва}}{m_\text{р-ра}}(\cdot 100\%)$
Рассмотрим примеры решения задач.
Сколько граммов сахара и воды нужно взять для приготовления 150г 10%-ного раствора сахара?
Решение
m(р-ра)=150г
$\omega$(сахара)=10%=0,1
m(сахара)=?
m(сахара) = $\omega\textrm{(сахара)} \cdot m(p-pa) = 0,1 \cdot 150 \textrm{г} = 15 \textrm{г}$
m(воды)=m(р-ра) — m(сахара) = 150г — 15г=135г.
ОТВЕТ: нужно взять 15г сахара и 135г воды.
Раствор объемом 350 мл. и плотностью 1, 142 г/мл содержит 28 г хлорида натрия. Найти массовую долю соли в растворе.
Решение
V(р-ра)=350 мл.
$\rho$(р-ра)=1,142 г/мл
$\omega(NaCl)$=?
m(р-ра) =V(р-ра) $\cdot \rho$(р-ра)=350 мл $\cdot$ 1,142 г/мл=400г
$\omega(NaCl)=\dfrac{m(NaCl)}{m\textrm{(р-ра)}}=\dfrac{28\textrm{г}} {400\textrm{г}} = 0,07$=7%
ОТВЕТ: массовая доля хлорида натрия $\omega(NaCl)$=7%
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В МОЛЕКУЛЕ
Формула химического вещества, например $H_2SO_4$, несет в себе много важной информации. Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H) : m(S) : m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H) : m(S) : m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по схожей формуле:
$\omega_\text{эл-та}=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)$
Найти массовую долю элементов в серной кислоте.
Решение
Способ 1 (пропорция):
Найдем молярную массу серной кислоты:
$M(H_2SO_4) = 1\cdot 2 + 32 + 16 \cdot 4=98\hspace{2pt}\textrm{г/моль}$
Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте составит: $m(S) = Ar(S) \cdot n(S) = 32\textrm{г/моль} \cdot 1$= 32г/моль
Примем массу всей молекулы за 100%, а массу серы — за Х% и составим пропорцию:
$M(H_2SO_4)$=98 г/моль — 100%
m(S) = 32г/моль — Х%
Откуда $X=\dfrac{32\textrm{г/моль} \cdot 100\%}{98\textrm{г/моль}} =32, 65\% =32\%$
Способ 2 (формула):
$\omega(S)=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)=\dfrac{Ar(S)\cdot 1}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{32\textrm{г/моль}\cdot 1}{98\textrm{г/моль}}(\cdot 100\%) \approx32, 7\%$
Аналогично по формуле рассчитаем массовые доли водорода и кислорода:
$\omega(H)=\dfrac{Ar(H)\cdot 2}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{1\textrm{г/моль}\cdot 2}{98\textrm{г/моль}}(\cdot 100\%)\approx2\%$
$\omega(O)=\dfrac{Ar(O)\cdot 4}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{16\textrm{г/моль}\cdot 4}{98\textrm{г/моль}}(\cdot 100\%)\approx65, 3\%$
Массовая доля в соединении формула.
 Расчёт массовой доли химических элементов по формуле вещества
Расчёт массовой доли химических элементов по формуле веществаДаже в одном грамме вещества может содержаться до тысячи различных соединений. Каждое соединение отвечает за определенное свойство вещества, а бывает так, что это не определенное вещество, а смесь. В любом случае на производстве часто возникает ситуация утилизации химических отходов и задача использования вторичного сырья. Именно химические реакции, позволяющие найти и выделить определенное вещество являются главенствующими. Но для этого надо сначала узнать как найти массовую долю.
Понятие массовой доли вещества отражает его содержание и концентрацию в сложной химической структуре, будь то смесь или сплав. Зная общую массу сплава или смеси, можно найти массы составляющих их веществ, при условии, что известны их массовые доли. Как найти массовую долю, формула обычно выражается в виде дроби: массовая доля вещества масса вещества/масса всей смеси.
Давайте проведем небольшой эксперимент! Для этого нам понадобятся периодическая таблица химических элементов им. Менделеева, весы и калькулятор.
Менделеева, весы и калькулятор.
Как найти массовую долю вещества
Необходимо определить массовую долю вещества, вещество находится в виде смеси. Первоначально кладем на весы само вещество. Получили массу вещества. Зная определенную массу вещества в смеси мы с легкостью получим его массовую долю. К примеру есть 170г. воды. В них находится 30 грамм вишневого сока. Общая масса=170+30=230 грамм. Поделим массу вишневого сока к общей массе смеси: 30/200=0.15 или 15% .
Как найти массовую долю раствора
Решение данной проблемы может понадобиться при определении концентрации пищевых растворов(уксус) или лекарственных препаратов. Дана масса раствора KOH, он же гидроксид калия, массой в 400 грамм. KOH (масса самого вещества) составляет 80 грамм. Необходимо найти массовую долю желчи в полученном растворе. Формула нахождения решения: KOH (масса раствора гидроксида калия) 300 г, масса растворенного вещества (KOH) 40 г. Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Как найти массовую долю углерода в углеводороде
Для этого используем таблицу Менделеева. Ищем вещества в таблице. В таблице приведена атомная масса элементов. 6 углеродов с атомной массой 12 и 12 водородов с атомной массой равной 1. m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль, ω (С) = 6 m1(С) / m (C6h22) = 6 х 12 / 84 = 85%
Определение массовой доли на производствах производится в специальных химических лабораториях. Для начала берется небольшой образец, на который испытывают различные химические реакции. Или внедряют лакмусовые бумажки, которые могут показать наличие того или иного компонента. После выяснения первоначальной структуры вещества можно начинать выделение компонентов. Это достигается за счет простых химических реакций, когда одно вещество контактирует с другим и получается новое, возможен осадок. Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать методы измерения различных параметров вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элемента. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовая доля элемента в веществе обозначается латинской строчной буквой w (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах (рис. 69). Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Рис. 69.
Диаграмма элементного состава оксида ртути
Например, в состав оксида ртути HgО входят два элемента — ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида ртути:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
Например, для воды (рис. 70):
Давайте потренируемся в решении задач на вычисление массовых долей элементов в сложных веществах.
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SО 4 .
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества.
То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Задача 3. Из природных минералов — тенорита и куприта (рис. 71) были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде (рис. 72), выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1% . Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.
В черном оксиде (рис. 72), выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1% . Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.
Рис. 71. Минерал куприт
Рис. 72. Оксид меди черного цвета, выделенный из минерала тенорита
3. Полученное соотношение нужно привести к значениям целых чисел: ведь индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
А теперь немного усложним задачу.
Задача 4. По данным элементного анализа, прокаленная горькая соль имеет следующий состав: массовая доля магния 20,0%, массовая доля серы — 26,7% , массовая доля кислорода — 53,3% .
Вопросы и задания
- Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
- Рассчитайте массовые доли элементов в веществах: а) углекислом газе СО 2 ; б) сульфиде кальция CaS; в) натриевой селитре NaNО 3 ; г) оксиде алюминия А1 2 О 3 .

- В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 C1; б) сульфате аммония (NH 4) 2 SО 4 ; в) мочевине (NH 2) 2 СО?
- В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
- Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода — 69,57%. Определите формулу оксида.
- В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе составляют: калий — 56,6%, углерод — 8,7%, кислород — 34,7%. Определите формулу поташа.
Инструкция
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же растворено, то выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
При желании массовую долю можно умножить на 100%.
Если в условии задачи не дано значения массы, то его можно рассчитать с помощью нескольких формул, выбрать нужную помогут величины данные в условии. Первая формула для : m = V*p, где m – масса, V – объем, p – плотность. Следующая формула выглядит так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярная масса в свою очередь складывается из атомных масс элементов, входящих в состав вещества.
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком . В результате реакции водород объемом 0,56 л (). Вычислите массовую долю меди в смеси.
В этой задаче проходит , записываем ее уравнение. Из двух веществ с избытком соляной кислоты только магний: Mg + 2HCl = MgCl2 + h3. Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу : m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Видео по теме
Обратите внимание
Массовая доля не может быть больше единицы или, если она выражается в процентах, больше 100%.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
- Вычисление доли продаж по региону
Массовая доля показывает в процентах или в долях содержание вещества в каком–либо растворе или элемента в составе вещества. Умение вычислить массовую долю полезно не только на уроках химии, но и когда вы хотите приготовить раствор или смесь, например, в кулинарных целях. Или изменить процентное отношение, в уже имеющемся у вас составе.
Инструкция
К примеру, вам на зиму необходим минимум в 15 куб. метров березовых дров.
метров березовых дров.
Ищите в справочной плотность березовых дров. Это: 650 кг/м3.
Вычисляйте массу, подставив значения в ту же формулу удельной плотности.
m = 650*15 = 9750 (кг)
Теперь, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и количеством поездок.
Видео по теме
Обратите внимание
Люди постарше больше знакомы с понятием удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Если требуется найти или массовую долю элемента в веществе с известной формулой, воспользуйтесь периодической таблицей элементов. По ней найдите атомные массы элементов, которые в вещества. Если один в формуле несколько раз, умножьте его атомную массу на это число и сложите полученные результаты. Это будет молекулярная масса вещества. Чтобы найти массовую долю любого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Результат множьте на 100 % (ω%=(M0/M)∙100%).
Например, определите массовую долю химических элементов в медном купоросе. Медный (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома . Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Медный (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома . Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества А x В y в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х: У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H 2 SO 4 и выразите их в процентах.
Определите массовые доли химических элементов в серной кислоте H 2 SO 4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H 2 SO 4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2: 98 = 0,0204, или 2,04%;
ω(S) = 32: 98 = 0,3265, или 32,65%;
ω(О) = 64: 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al 2 O 3 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr(Al 2 O 3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54: 102 = 0,53 = 53%
ω(O) = 48: 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т. е. ω(Х) = m(Х) / m,
е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl 2 ·2H 2 O.
Молярная масса BaCl 2 ·2H 2 O составляет:
М(BaCl 2 ·2H 2 O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl 2 ·2H 2 O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H 2 O. Отсюда можно определить массу воды, содержащейся в BaCl 2 ·2H 2 O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl 2 ·2H 2 O.
ω(H 2 O) = m(H 2 O)/m(BaCl 2 · 2H 2 O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag 2 S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Определяем количество вещества серебра, находящегося в аргентите: n(Ag) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag 2 S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag 2 S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag 2 S) = n(Ag 2 S) · М(Ag2S) = 0,025 · 248 = 6,2 г. Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag 2 S) = m(Ag 2 S) / m = 6,2/25 = 0,248 = 24,8%. | |
Разница между мольной и массовой долей
Автор: Мадху
Ключевое различие — мольная доля и массовая доля Молярная доля и массовая доля — это термины, используемые для выражения соотношений между различными компонентами в соединениях. Ключевое различие между мольной долей и массовой долей состоит в том, что мольная доля имеет дело с молями различных компонентов соединения, тогда как массовая доля имеет дело с массами различных компонентов в соединении . Мольную долю можно преобразовать в массовую долю того же соединения и наоборот.
Мольную долю можно преобразовать в массовую долю того же соединения и наоборот.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое мольная доля
3. Что такое массовая доля
4. Сходства между мольной долей и массовой долей
5. Параллельное сравнение — мольная доля и массовая доля в табличной форме
6. Резюме
Что такое мольная доля?
Мольная доля — это соотношение между количествами компонентов в смеси, выраженное их числом молей.Это отношение молей одного компонента к сумме молей всех компонентов смеси. Это может быть дано ниже.
Мольная доля = моль компонента / сумма молей всех компонентов (масса смеси)
или
X i = n i / n всего
Мольные доли всех компонентов равны 1, так как мольные доли являются соотношением. Мольную долю можно использовать для выражения мольного процента путем умножения мольной доли на 100. Мольную долю также можно назвать долей количества, потому что моль дает количество составляющего. Мольная доля не имеет единицы измерения, поскольку представляет собой соотношение между молями (единицы сокращаются).
Мольную долю также можно назвать долей количества, потому что моль дает количество составляющего. Мольная доля не имеет единицы измерения, поскольку представляет собой соотношение между молями (единицы сокращаются).
Рисунок 01: Плотность NaCl в зависимости от мольной доли
Расчет мольной доли
Давайте рассмотрим примерную задачу, чтобы понять, что такое мольная доля.
Вопрос:
Найдите мольную долю NaCl при растворении 0,1 моль NaCl в 100 граммах чистой воды.
Ответ:
Количество молей воды = 100 г / 18 гмоль -1
= 5,56 моль
Сумма молей всех составляющих = 0,1 (NaCl) + 5,56 (H 2 O)
= 5,66 моль
Мольная доля NaCl = 0,1 моль / 5,66 моль
= 0,018
Что такое массовая доля?
Массовая доля — это отношение массы компонента к общей массе смеси. Поскольку это соотношение между массами, массовая доля не имеет единицы измерения (единицы сокращаются). Его можно представить в виде уравнения (приведено ниже).
Его можно представить в виде уравнения (приведено ниже).
Массовая доля = масса компонента / сумма масс всех компонентов (масса смеси)
или
W i = m i / m всего
Массовая доля всех компонентов равна 1, поскольку массовая доля является соотношением. Массовые доли отдельных компонентов всегда меньше 1. Массовая доля также может быть указана в массовых процентах.Здесь массовая доля умножается на 100. В расчетах элементного анализа массовая доля относится к соотношению между массой химического элемента и соединения. Массовая доля не зависит от температуры, поскольку масса не изменяется при изменении температуры.
Расчет с массовой долей
Вопрос:
Найдите массу сахарозы в растворе сахарозы (500 г), в котором вода имеет массовую долю 0,65.
Ответ:
Общая масса смеси = 500 г
Массовая доля воды = 0. 65
65
Тогда массовая доля сахарозы = 1-0,65 = 0,35
Масса сахарозы = 0,35 х 500 г
= 175 г
Каковы сходства между мольной долей и массовой долей?
- Оба термина выражают отношения.
- И мольная доля, и массовая доля выражены без единиц измерения.
- Оба дают значения, которые либо равны, либо меньше 1.
- Оба не зависят от температурных изменений.
В чем разница между мольной долей и массовой долей?
Молярная доля и массовая доля | |
| Мольная доля — это отношение молей одного компонента к сумме молей всех компонентов в смеси. | Массовая доля — это отношение массы компонента к общей массе смеси. |
| Компоненты | |
| Мольная доля рассчитывается с использованием молей компонентов. | Массовая доля рассчитывается с использованием масс компонентов. |
Резюме — мольная доля в сравнении с массовой долей
Молярная доля и массовая доля используются для выражения относительных долей различных компонентов в смеси. Оба являются безразмерными членами, так как отношения имеют одну и ту же единицу, и, таким образом, единицы взаимно сокращаются. Ключевое различие между мольной долей и массовой долей состоит в том, что мольная доля связана с молями различных компонентов соединения, тогда как массовая доля связана с массами различных компонентов в соединении.
Оба являются безразмерными членами, так как отношения имеют одну и ту же единицу, и, таким образом, единицы взаимно сокращаются. Ключевое различие между мольной долей и массовой долей состоит в том, что мольная доля связана с молями различных компонентов соединения, тогда как массовая доля связана с массами различных компонентов в соединении.
Артикул:
1. «Молярная доля». Википедия, Фонд Викимедиа, 12 марта 2018 г., доступно здесь.
2. «Молярная фракция», Chemsteam, доступно здесь.
3. «Массовая доля (химия).”Википедия, Фонд Викимедиа, 3 марта 2018 г., доступно здесь.
Изображение предоставлено:
1. «Мольная доля соли» Автор Jzana — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Молярная доля и массовая доля одинаковы?
Что такое мольная доля?
Единицей концентрации в химии является мольная доля, которая, как было установлено, равна количеству молей компонента, деленному на общее количество молей в растворе.
Молярная доля — это безразмерный термин, поскольку он представляет собой отношение между двумя значениями. В сумме мольная доля всех компонентов раствора равна 1.
.Важно определить мольную долю при объединении двух реакционноспособных компонентов, так как соотношение двух компонентов известно, если известна мольная доля каждого из них.
Более того, умножение мольной доли на 100 дает только мольный процент, который совпадает с мольной долей, но с другой точки зрения.
Различные концентрации, включая молярность, молярность и массовый процентный состав, могут давать мольные доли. Более того, при составлении фазовых диаграмм мольная доля используется очень часто.
Более того, при составлении фазовых диаграмм мольная доля используется очень часто.
Кроме того, по сравнению с молярной концентрацией он не зависит от температуры и не требует знания соответствующих фазовых плотностей.
Взвесив соответствующие массы элементов, можно получить смесь с известными мольными долями.
Для мольных долей x = 0.1 и x = 0,9 измерение является симметричным, а роли «растворителя» и «растворенного вещества» обратимы.
Кроме того, мольная доля смеси идеальных газов может быть указана как отношение парциального давления к полному смешанному давлению.
Что такое массовая доля?
Отношение массы вещества к общей массе смеси — это массовая доля вещества.
Он также известен в процентах, как процент по массе или массовый процент. Поскольку массовая доля является отношением массы к массе, величина не имеет размеров.
Массовая доля вещества, являющегося интенсивным количеством, не зависит от давления, температуры и места расположения материала.
Если не наблюдается химического изменения или чистой физической передачи какого-либо вещества, оно остается постоянным.
Таким образом, массовые проценты вещества будут одинаковыми во всем мире.
Кроме того, мы также называем массовые доли весовыми долями. Однако символ m / m представлен как массовая доля, а символ w / w присваивается массовой доле.
Таким же образом массовый процент часто называют массовым процентом. Символ m / m% используется для обозначения массовых процентов, а знак w / m% используется для обозначения массовых процентов.
Разница между мольной и массовой долей?
Химическое соединение состоит из растворителя и растворенного вещества и при химическом анализе образует химическую смесь.
Однако терминология, используемая для выражения соотношений между различными компонентами соединения, — это мольная доля и массовая доля.
Хотя обе фракции довольно похожи и представляют собой соотношения между компонентами соединения, они не являются одинаковыми количествами или терминами.
Однако существует важная связь между мольной долей и массовой долей в химической смеси.
Отношение массы растворенного вещества к общей массе смеси известно как массовая доля.
Тем не менее, мольная доля относится к молям различных составляющих частей соединения, тогда как массовая доля относится к массам отдельных компонентов соединения, и это объясняет основное различие между обоими величинами.
Кроме того, мольная доля и массовая доля одного и того же соединения могут быть взаимно преобразованы друг в друга.
Может ли мольная доля быть больше 1?
Еще одна мера концентрации в химии — мольная доля химического соединения.
Как мы узнали выше, мольная доля — это просто количество молей по отношению к общему количеству молей этого конкретного вещества.
Мольная доля вещества всегда находится в диапазоне от 0 до 1, поскольку она никогда не может превышать все количество молей в смеси.
Таким образом, она никогда не может быть больше 1. Обычно мольная доля выражается знаком X, однако для вещества
Обычно мольная доля выражается знаком X, однако для вещества
i мольная доля определяется как
Xi = ni / n всего
, где общее количество молей в смеси составляет n всего
Надеемся, вам понравилась эта статья. Вы можете использовать калькулятор молекулярной массы на домашней странице или найти другие полезные блоги в разделе блога.
Массовая доля— определение (v1) Национального института рака
{{PublicationType | capitalize}} рейтинг
ОпределениеQeios ID: {{публикации.qeios_id}}
Открытый доступ CC BY Авторские права: © {{PublicationYear}} {{publishing. presentation_authors [0] .full_name + (publishing.presentation_authors.length> 1? ‘Et al’: »)}}. Это публикация в открытом доступе, распространяемая на условиях CC BY 4.0 Лицензия, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
presentation_authors [0] .full_name + (publishing.presentation_authors.length> 1? ‘Et al’: »)}}. Это публикация в открытом доступе, распространяемая на условиях CC BY 4.0 Лицензия, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Проверьте {{PublicationType | capitalize}} Источник информации об авторских правах и лицензии.
ДекларацииСвязанные определения ({{публикации.
 ranked_siblings.length}})
ranked_siblings.length}})Спасибо за ваш вклад в сообщество.
Закрывать% PDF-1.4
%
408 0 obj>
эндобдж
xref
408 226
0000000016 00000 н.
0000006352 00000 п.
0000006555 00000 н.
0000006581 00000 н.
0000006629 00000 н.
0000006664 00000 н.
0000007039 00000 п.
0000007151 00000 н.
0000007263 00000 н.
0000007375 00000 н.
0000007487 00000 н.
0000007599 00000 н.
0000007745 00000 н.
0000007898 00000 п.
0000008043 00000 н.
0000008122 00000 н.
0000008201 00000 н.
0000008280 00000 н.
0000008359 00000 п.
0000008439 00000 н.
0000008518 00000 н.
0000008597 00000 н.
0000008675 00000 н.
0000008754 00000 н.
0000008832 00000 н.
0000008911 00000 н.
0000008989 00000 п.
0000009068 00000 н.
0000009146 00000 п.
0000009225 00000 н.
0000009303 00000 п.
0000009382 00000 п.
0000009460 00000 н.
0000009539 00000 н.
0000009617 00000 н.
0000009696 00000 п.
0000009775 00000 п. 0000009855 00000 н.
0000009935 00000 н.
0000010015 00000 п.
0000010095 00000 п.
0000010175 00000 п.
0000010255 00000 п.
0000010333 00000 п.
0000010410 00000 п.
0000010489 00000 п.
0000010567 00000 п.
0000010646 00000 п.
0000010724 00000 п.
0000010803 00000 п.
0000010881 00000 п.
0000010960 00000 п.
0000011038 00000 п.
0000011117 00000 п.
0000011195 00000 п.
0000011274 00000 п.
0000011352 00000 п.
0000011431 00000 п.
0000011509 00000 п.
0000011588 00000 п.
0000011667 00000 п.
0000011745 00000 п.
0000011824 00000 п.
0000011902 00000 п.
0000011981 00000 п.
0000012061 00000 п.
0000012141 00000 п.
0000012221 00000 п.
0000012301 00000 п.
0000012381 00000 п.
0000012461 00000 п.
0000012538 00000 п.
0000012614 00000 п.
0000012692 00000 п.
0000012770 00000 п.
0000012849 00000 п.
0000012927 00000 п.
0000013006 00000 п.
0000013084 00000 п.
0000013163 00000 п.
0000013241 00000 п.
0000013320 00000 п.
0000013398 00000 п.
0000013477 00000 п.
0000013555 00000 п.
0000009855 00000 н.
0000009935 00000 н.
0000010015 00000 п.
0000010095 00000 п.
0000010175 00000 п.
0000010255 00000 п.
0000010333 00000 п.
0000010410 00000 п.
0000010489 00000 п.
0000010567 00000 п.
0000010646 00000 п.
0000010724 00000 п.
0000010803 00000 п.
0000010881 00000 п.
0000010960 00000 п.
0000011038 00000 п.
0000011117 00000 п.
0000011195 00000 п.
0000011274 00000 п.
0000011352 00000 п.
0000011431 00000 п.
0000011509 00000 п.
0000011588 00000 п.
0000011667 00000 п.
0000011745 00000 п.
0000011824 00000 п.
0000011902 00000 п.
0000011981 00000 п.
0000012061 00000 п.
0000012141 00000 п.
0000012221 00000 п.
0000012301 00000 п.
0000012381 00000 п.
0000012461 00000 п.
0000012538 00000 п.
0000012614 00000 п.
0000012692 00000 п.
0000012770 00000 п.
0000012849 00000 п.
0000012927 00000 п.
0000013006 00000 п.
0000013084 00000 п.
0000013163 00000 п.
0000013241 00000 п.
0000013320 00000 п.
0000013398 00000 п.
0000013477 00000 п.
0000013555 00000 п.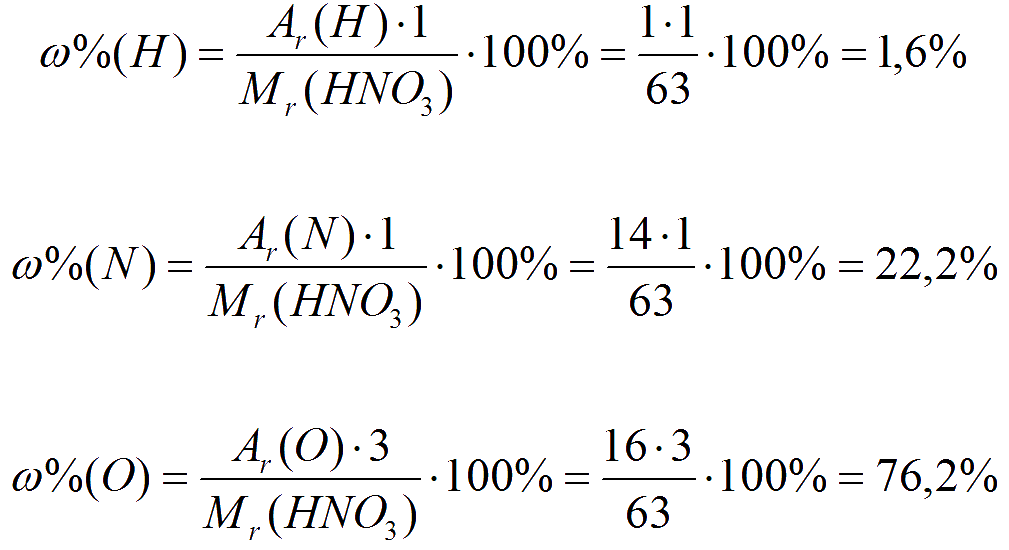 0000013634 00000 п.
0000013713 00000 п.
0000013791 00000 п.
0000013870 00000 п.
0000013948 00000 п.
0000014027 00000 п.
0000014105 00000 п.
0000014184 00000 п.
0000014262 00000 п.
0000014342 00000 п.
0000014422 00000 п.
0000014501 00000 п.
0000014580 00000 п.
0000014659 00000 п.
0000014737 00000 п.
0000014816 00000 п.
0000014894 00000 п.
0000014973 00000 п.
0000015051 00000 п.
0000015130 00000 п.
0000015208 00000 п.
0000015287 00000 п.
0000015365 00000 п.
0000015443 00000 п.
0000015522 00000 п.
0000015600 00000 п.
0000015679 00000 п.
0000015757 00000 п.
0000015836 00000 п.
0000015914 00000 п.
0000015993 00000 п.
0000016071 00000 п.
0000016149 00000 п.
0000016228 00000 п.
0000016307 00000 п.
0000016386 00000 п.
0000016465 00000 п.
0000016544 00000 п.
0000016623 00000 п.
0000016702 00000 п.
0000016781 00000 п.
0000016858 00000 п.
0000016936 00000 п.
0000017013 00000 п.
0000017092 00000 п.
0000017171 00000 п.
0000017249 00000 п.
0000017328 00000 п.
0000013634 00000 п.
0000013713 00000 п.
0000013791 00000 п.
0000013870 00000 п.
0000013948 00000 п.
0000014027 00000 п.
0000014105 00000 п.
0000014184 00000 п.
0000014262 00000 п.
0000014342 00000 п.
0000014422 00000 п.
0000014501 00000 п.
0000014580 00000 п.
0000014659 00000 п.
0000014737 00000 п.
0000014816 00000 п.
0000014894 00000 п.
0000014973 00000 п.
0000015051 00000 п.
0000015130 00000 п.
0000015208 00000 п.
0000015287 00000 п.
0000015365 00000 п.
0000015443 00000 п.
0000015522 00000 п.
0000015600 00000 п.
0000015679 00000 п.
0000015757 00000 п.
0000015836 00000 п.
0000015914 00000 п.
0000015993 00000 п.
0000016071 00000 п.
0000016149 00000 п.
0000016228 00000 п.
0000016307 00000 п.
0000016386 00000 п.
0000016465 00000 п.
0000016544 00000 п.
0000016623 00000 п.
0000016702 00000 п.
0000016781 00000 п.
0000016858 00000 п.
0000016936 00000 п.
0000017013 00000 п.
0000017092 00000 п.
0000017171 00000 п.
0000017249 00000 п.
0000017328 00000 п. 0000017406 00000 п.
0000017484 00000 п.
0000017561 00000 п.
0000017639 00000 п.
0000017716 00000 п.
0000017793 00000 п.
0000017869 00000 п.
0000017948 00000 п.
0000018027 00000 п.
0000018106 00000 п.
0000018185 00000 п.
0000018264 00000 п.
0000018343 00000 п.
0000018422 00000 п.
0000018501 00000 п.
0000018759 00000 п.
0000019317 00000 п.
0000019462 00000 п.
0000037163 00000 п.
0000037691 00000 п.
0000038061 00000 п.
0000038462 00000 п.
0000038539 00000 п.
0000039223 00000 п.
0000039755 00000 п.
0000040221 00000 п.
0000049262 00000 п.
0000049599 00000 п.
0000049971 00000 н.
0000050426 00000 п.
0000050597 00000 п.
0000050812 00000 п.
0000051462 00000 п.
0000052196 00000 п.
0000052470 00000 п.
0000052631 00000 п.
0000052846 00000 п.
0000053567 00000 п.
0000054333 00000 п.
0000055058 00000 п.
0000055278 00000 п.
0000056025 00000 п.
0000056247 00000 п.
0000056579 00000 п.
0000056671 00000 п.
0000057428 00000 п.
0000057978 00000 п.
0000064360 00000 п.
0000017406 00000 п.
0000017484 00000 п.
0000017561 00000 п.
0000017639 00000 п.
0000017716 00000 п.
0000017793 00000 п.
0000017869 00000 п.
0000017948 00000 п.
0000018027 00000 п.
0000018106 00000 п.
0000018185 00000 п.
0000018264 00000 п.
0000018343 00000 п.
0000018422 00000 п.
0000018501 00000 п.
0000018759 00000 п.
0000019317 00000 п.
0000019462 00000 п.
0000037163 00000 п.
0000037691 00000 п.
0000038061 00000 п.
0000038462 00000 п.
0000038539 00000 п.
0000039223 00000 п.
0000039755 00000 п.
0000040221 00000 п.
0000049262 00000 п.
0000049599 00000 п.
0000049971 00000 н.
0000050426 00000 п.
0000050597 00000 п.
0000050812 00000 п.
0000051462 00000 п.
0000052196 00000 п.
0000052470 00000 п.
0000052631 00000 п.
0000052846 00000 п.
0000053567 00000 п.
0000054333 00000 п.
0000055058 00000 п.
0000055278 00000 п.
0000056025 00000 п.
0000056247 00000 п.
0000056579 00000 п.
0000056671 00000 п.
0000057428 00000 п.
0000057978 00000 п.
0000064360 00000 п. 0000067322 00000 п.
0000084230 00000 п.
0000086815 00000 п.
0000105942 00000 н.
0000106387 00000 п.
0000106596 00000 п.
0000106649 00000 н.
0000106970 00000 п.
0000107176 00000 н.
0000107551 00000 п.
0000107620 00000 н.
0000107995 00000 н.
0000108064 00000 н.
0000108439 00000 п.
0000108508 00000 н.
0000108565 00000 н.
0000108743 00000 н.
0000108826 00000 н.
0000108911 00000 п.
0000109017 00000 н.
0000109150 00000 н.
0000109275 00000 п.
0000109441 00000 п.
0000109540 00000 п.
0000109645 00000 н.
0000109787 00000 п.
0000109887 00000 н.
0000110013 00000 н.
0000110139 00000 п.
0000110264 00000 н.
0000110397 00000 н.
0000110516 00000 п.
0000110661 00000 п.
0000110765 00000 н.
0000110846 00000 н.
0000110962 00000 н.
0000111117 00000 н.
0000111251 00000 н.
0000111365 00000 н.
0000111482 00000 н.
0000111635 00000 н.
0000111753 00000 н.
0000111872 00000 н.
0000112005 00000 н.
0000004816 00000 н.
трейлер
] >>
startxref
0
%% EOF
633 0 obj> поток
xUkpUlC6MMM — D) ʣ () (@ `䡢 ˻d2 줅 Ϊia (f $ Mi3
№3 L {9,
0000067322 00000 п.
0000084230 00000 п.
0000086815 00000 п.
0000105942 00000 н.
0000106387 00000 п.
0000106596 00000 п.
0000106649 00000 н.
0000106970 00000 п.
0000107176 00000 н.
0000107551 00000 п.
0000107620 00000 н.
0000107995 00000 н.
0000108064 00000 н.
0000108439 00000 п.
0000108508 00000 н.
0000108565 00000 н.
0000108743 00000 н.
0000108826 00000 н.
0000108911 00000 п.
0000109017 00000 н.
0000109150 00000 н.
0000109275 00000 п.
0000109441 00000 п.
0000109540 00000 п.
0000109645 00000 н.
0000109787 00000 п.
0000109887 00000 н.
0000110013 00000 н.
0000110139 00000 п.
0000110264 00000 н.
0000110397 00000 н.
0000110516 00000 п.
0000110661 00000 п.
0000110765 00000 н.
0000110846 00000 н.
0000110962 00000 н.
0000111117 00000 н.
0000111251 00000 н.
0000111365 00000 н.
0000111482 00000 н.
0000111635 00000 н.
0000111753 00000 н.
0000111872 00000 н.
0000112005 00000 н.
0000004816 00000 н.
трейлер
] >>
startxref
0
%% EOF
633 0 obj> поток
xUkpUlC6MMM — D) ʣ () (@ `䡢 ˻d2 줅 Ϊia (f $ Mi3
№3 L {9,
Концентрация преобразования | Neutrium
В этой статье подробно описаны наиболее распространенные методы количественного определения концентрации компонента в смеси, а также подробно описано, как преобразовать эти концентрации. Концентрация обычно выражается в молях на объем, массе на объем, массовых процентах, объемных процентах, мольных процентах и частях на миллион. Используя свойства плотности и / или молекулярной массы, можно выполнить преобразование между любыми из вышеуказанных мер.
Концентрация обычно выражается в молях на объем, массе на объем, массовых процентах, объемных процентах, мольных процентах и частях на миллион. Используя свойства плотности и / или молекулярной массы, можно выполнить преобразование между любыми из вышеуказанных мер.
| : | масса компонента | ||||
| : | Молекулярная масса | ||||
| : | Частей на миллион | ||||
| на миллион | |||||
| : | Частей на миллион, на основе объема | ||||
| : | Частей на миллион, на основе молей | ||||
| : | Объемная доля | ||||
| : | Массовая доля | : | Мольная фракция | ||
| : | Плотность или масса на объемную концентрацию |
Ниже в таблице приведены преобразования концентраций между многими показателями концентрации. Во всех случаях мы описываем концентрацию вещества 1 в общем веществе, и это используется в нижних индексах формул ниже.
Во всех случаях мы описываем концентрацию вещества 1 в общем веществе, и это используется в нижних индексах формул ниже.
Щелкните, чтобы перейти к разделу для преобразования из:
Мол. Фракция
| Преобразовать в | Стандартные единицы | Преобразовать из моль / моль (x) | ||
|---|---|---|---|---|
| масса / масса * | ||||
| объем / объем * | — | |||
| молярная концентрация | моль / л | |||
| масса / объем | г / л | |||
| мкмоль / моль | ||||
| частей на миллион (вес частей на миллион) | мг / кг | |||
| частей на миллион (объем частей на миллион) | мкл / л |
| Преобразовать в | Стандартные единицы | Преобразовать из массы / массы (м) | ||
|---|---|---|---|---|
| моль / моль * | — | объем | объем | |
| молярная доля | моль / л | |||
| масса / объем | г / л | |||
| частей на миллион (частей на миллион моль) | мкмоль / моль | 903 млн (ppm вес) | мг / кг | |
| частей на миллион (ppm объема) | мкл / л |
* умножьте на 100 для получения массы, моля или объема%.
Объемная доля
| Преобразовать в | Стандартные единицы | Преобразовать из объема / объема (?) | ||
|---|---|---|---|---|
| моль / моль * | — | масса / | масса / | масса|
| молярная доля | моль / л | |||
| масса / объем | г / л | |||
| частей на миллион (частей на миллион моль) | мкмоль / моль | 903 млн (ppm вес) | мг / кг | |
| частей на миллион (ppm объема) | мкл / л |
* умножьте на 100 для получения массы, моля или объема%.
Молярная концентрация
| Преобразовать в | Стандартные единицы | Преобразовать из молярной концентрации (c) | |
|---|---|---|---|
| моль / моль * | — | масса | |
| объем / объем * | — | ||
| масса / объем | г / л | ||
| частей на миллион (ppm моль) | мкмоль / моль | мг / кг | |
| частей на миллион (объем частей на миллион) | мкл / л |
* умножьте на 100 для получения массы, моля или объема%.
Масса на объем
| Преобразовать в | Стандартные единицы | Преобразовать из массы / объема (м 1 / v tot ) |
|---|---|---|
| моль / моль * | — | |
| масса / масса * | — | |
| объем / объем * | — | |
| молярная доля | моль / л | |
| частей на миллион48 (ppm моль) моль | ||
| частей на миллион (масса частей на миллион) | мг / кг | |
| частей на миллион (объем частей на миллион) | мкл / л |
* масса, умножьте на 100 для получения массы моль или% об.
Частей на миллион (ppm моль)
| Конвертировать в | Типичные единицы | Конвертировать От ppm моль | |
|---|---|---|---|
| моль / моль * | мкмоль / моль | — | |
| объем / объем * | — | ||
| молярная доля | моль / л | ||
| масса / объем | г / л ppm веса) | мг / кг | |
| частей на миллион (ppm объема) | мкл / л |
* умножьте на 100 для получения массы, моля или объема%.
Частей на миллион (вес частей на миллион)
| Преобразовать в | Типовые единицы | Преобразовать из веса частей на миллион | |
|---|---|---|---|
| моль / моль * | — | ||
| объем / объем * | — | ||
| молярная доля | моль / л | ||
| масса / объем | г / л | ||
| частей на миллион частей на миллион моль | ) | мкмоль / моль | |
| частей на миллион (объемных частей на миллион) | мкл / л |
* умножьте на 100 для получения массы, моля или объема%.
Частей на миллион (объем в миллионных долях)
| Преобразовать в | Стандартные единицы | Преобразовать из объема в миллионных долях | ||
|---|---|---|---|---|
| моль / моль * | — | |||
| объем / объем * | — | |||
| молярная доля | моль / л | |||
| частей на миллион (ppm моль) | мкмоль / моль | 901 объем | г / л | |
| частей на миллион (масса частей на миллион) | мг / кг |
* умножьте на 100 для получения массы, моля или объема%.
Теги статьи
Распределение молярной массы | MATSE 202: Введение в полимерные материалы
Распределение молярной массы
Когда вы впервые узнали о молярной массе молекул, вы узнали, что молярная масса связана с идентичностью соединения; например, H 2 O всегда имел молярную массу 18 г / моль. Если бы молярная масса не была 18 г / моль, это не могла быть вода! С полимерами дело обстоит иначе. Возьмем полипропилен, например:
Полипропилен
Источник: Лорен Зарзар
Молярная масса этого полимера может составлять 420 г / моль (если степень полимеризации 10) или 21000 г / моль (если степень полимеризации 500).Хотя молярная масса сильно различается, обе эти молекулы представляют собой полипропилен. Для полимеров почти всегда существует молярное массовое распределение . Пример распределения приведен на рисунке 1.10. Хотя эта кривая выглядит непрерывной, мы знаем, что на самом деле это не может быть — масса полимера действительно меняется в дискретных единицах, в зависимости от размера повторяющейся единицы. Однако мы обычно рисуем распределения как непрерывную функцию.
Однако мы обычно рисуем распределения как непрерывную функцию.
Рисунок 1.10: Типичная кривая молярно-массового распределения весовой доли для полимера с наиболее вероятным распределением молярной массы и повторяющейся единичной молярной массой 100 г моль -1 .
Источник: На основе рисунка 1.4 Янга, Роберта Дж. И Питера А. Ловелла.
Введение в полимеры, третье издание, CRC Press, 2011.
Поскольку существует распределение по молярной массе, у нас есть выбор, как на самом деле определить характеристическую молярную массу для образца. Существует три общих подхода к вычислению молярной массы из распределения, дающих нам три различных значения: M¯n (среднечисленная молярная масса) , M¯w, (средневзвешенная молярная масса) и M¯z ( z-средняя молярная масса) .Из рисунка 1.10 вы заметите, что Mn Mn определяется как сумма произведений молярной массы полимера каждого размера на его мольную долю (X). M¯n = ∑ XiMi = ∑ NiMi∑ Ni Иногда нам проще работать с массовыми долями (wi), чем с мольными долями, поскольку массу часто легче измерить.Весовая доля wi определяется как масса молекул с молярной массой Mi, деленная на общую массу всех присутствующих молекул: wi = NiMi∑ NiMi Таким образом, мы можем определить Mw: M¯w = ∑ wiMi = ∑ NiMi2∑ NiMi Сравните M¯w с M¯n — заметили ли вы, как M¯w является функцией, если Mi возведен в квадрат? Следовательно, полимеры большего размера имеют большее влияние на M¯w, чем на M¯n, искажая значение M¯w, чтобы оно было больше, чем M¯n. Перейдите на следующую страницу, где вы можете попробовать решить практические задачи по молярной массе. Вспомните из общей химии, что мольная доля равна отношению количества молей (или молекул) типа полимера (N) к общему количеству молей (или молекул). По сути, это то же самое, что и ваше «среднее» арифметическое!
Вспомните из общей химии, что мольная доля равна отношению количества молей (или молекул) типа полимера (N) к общему количеству молей (или молекул). По сути, это то же самое, что и ваше «среднее» арифметическое! ПРОБЛЕМА ПРАКТИКИ


 Определите формулу оксида.
Определите формулу оксида.

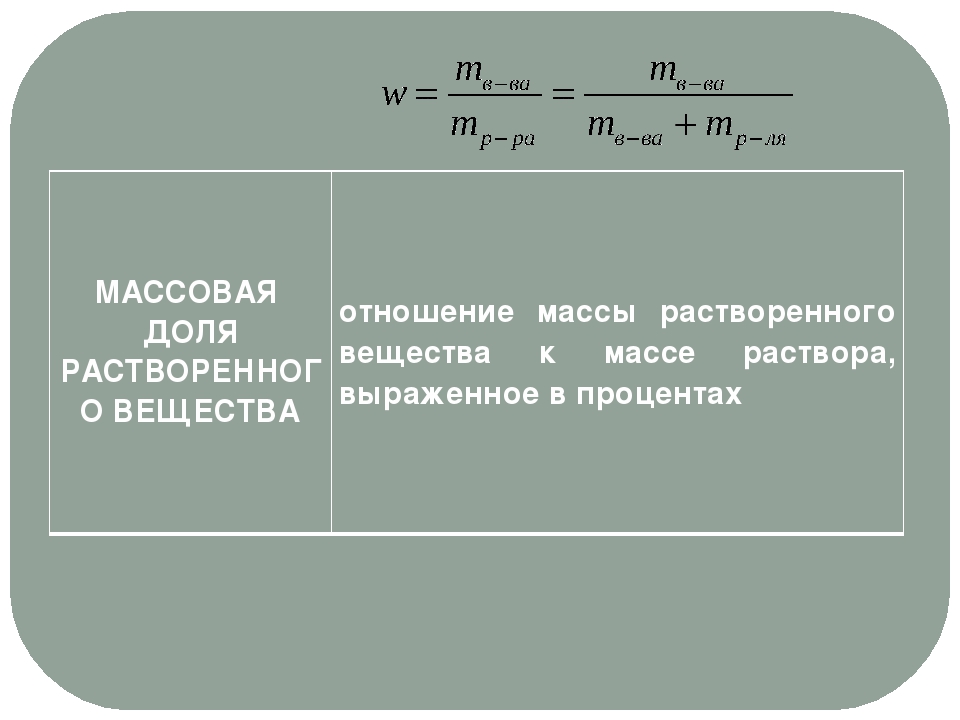 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.