Урок химии «Основные классы неорганических веществ»
Цель урока. Обобщить сведения о классификации веществ, составе основных классов сложных неорганических веществ, закрепить умения учащихся классифицировать неорганические вещества, осуществлять индуктивное и дедуктивное обобщения во процессе классификации веществ, довести эти умения до оптимального уровня.
Образовательные задачи:
- применение обобщения знаний, умений и навыков в новых условиях – создание проблемной ситуации;
- контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
- уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
- уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «класс вещества».
Развивающие задачи:
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и
умения работать в проблемной ситуации.

Воспитательные задачи:
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Оборудование: презентация, цифровые образовательные ресурсы: интерактив «Классификация кислот», интерактив «Классификация оснований», минилаборатория, оксиды фосфора, кальция, цинка, гидроксид натрия, меди, цинка, железа, азотная, серная, фосфорная, кремниевая кислоты, соли
Тип урока: урок обобщения и систематизации знаний
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Систематизация и обобщение знаний.
4. Закрепление.
5. Домашнее задание.
6. Рефлексия
ХОД УРОКА
I. Организационный момент
Проверяется готовность к уроку, раздаются план
урока (Приложение 1),
инструкции для выполнения лабораторной работы,
лист наблюдений (Приложение
2), минилаборатория, объявляются этапы
урока.
Организовывается работа учащихся на начальном
этапе урока, вспоминаются советы учителя о том,
как лучше организовать работу на уроке, чтобы
сохранить свое здоровье и здоровье своих
одноклассников.
1. Как удобней и полезней для здоровья сидеть на
уроке?
2. Почему на уроке учитель просит тишины?
Вступительное слово учителя. (Презентация. Слайды 1-3).
Постановка цели с опорой на знания учащихся. Мы с
вами в течение учебного года узнали, какие бывают
классы неорганических соединений.
Скажите, пожалуйста, какие классы веществ мы
изучили на прошлых уроках? (Мы изучили
классификацию неорганических веществ. И знаем,
что бывают оксиды, кислоты, основания, соли).
И прежде чем перейти к самому уроку. Давайте
вместе подумаем, что мы будем сегодня делать на
уроке.
Как вы думаете, какова цель нашего урока?
(Цель урока – обобщить и систематизировать
сведения о классификации неорганических
веществ)
II. Промежуточный контроль знаний по темам «Оксиды», «Кислоты», «Основания», «Соли» по технологии «Взаимопередачи заданий»
Учащиеся выполняют тест, в группах по 2 или 4
человека – 5 минут (Приложение 2).
После того, как учащиеся выполнят тест,
необходимо поставить оценку себе и проверить
работу соседа и поставить оценку соседу по парте. Учитель просит класс поднять руки, кто написал
тест на 5 или 4 балла. На закрытой доске или на
экране медиапроектора открывают заранее
подготовленные ответы теста для самопроверки.
Учитель просит класс поднять руки, кто написал
тест на 5 или 4 балла. На закрытой доске или на
экране медиапроектора открывают заранее
подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты (Слайд 4)
Тест по теме «Классификация неорганических веществ»
Время выполнения – 5 минут.
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку «число и состав исходных веществ и продуктов реакции», определите простое или сложное вещество, если вещество сложное определите класс вещества
III. Изучение нового учебного материала
Учебная цель: закрепить знания, умения, навыки по классификации неорганических веществ.
Вывод цели данного этапа урока с помощью учеников
В результате этого урока мы с вами должны
непосредственно рассмотреть разделение оксидов,
кислот, оснований, солей на группы, признаки,
положенные в основу классификаций. В ходе урока
мы должны обобщить, систематизировать признаки
классификаций, закрепить эти умения и навыки.
В ходе урока
мы должны обобщить, систематизировать признаки
классификаций, закрепить эти умения и навыки.
Моя цель на уроке рассказать вам об этом, помочь вам запомнить эти классификации, и мы продолжим учиться определять не только классы веществ, но и разделение на группы внутри класса.
Сегодня эти части урока будут проходить в форме игры. У вас будет 4 учителя. Они будут обобщать, и систематизировать каждый по определенному классу веществ. Они имеют право вас спрашивать, в конце урока поставить вам оценки. После объяснения ваших новых учителей. Мы проверим, как вы вспомнили классификацию веществ и выясним, кто у нас самый «классный» химик, и определим, кто у нас самый «классный» учитель.
Основные положения учебного материала, который вы сегодня должны освоить.
1. Классификация оксидов. Объяснение
материала заранее подготовленным учеником.
Актуализация знаний: Фронтальный опрос. Что такое оксиды? (Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления – 2)
Слайды 5-7
Оксиды делят на несолеобразующие – они не реагируют ни с кислотами, ни с щелочами, не образуют солей. Это всего четыре оксида: CO, SiO, N2O, NO
Остальные оксиды являются солеобразующими.
Среди них выделяют две группы. Кислотные
оксиды, этим оксидам соответствуют кислоты,
и, как правило – это оксиды неметаллов, или
металлов побочных подгрупп в высшей степени
окисления. Вторая группа основные оксиды –
это оксиды металлов в степени окисления +1, +2, +3
Заполнение таблицы с опорой на знания учеников
| Оксиды | Второй элемент металл или неметалл | Группа оксида | С чем реагирует: с кислотой, основанием или ни с чем |
SO3 |
неметалл |
кислотный |
с основанием |
SO2 |
|||
SiO2 |
|||
P2O5 |
|||
CrO3 |
|||
CO |
неметалл |
несолеобразующий |
– |
N2O |
|||
Na2O |
металл |
основный |
с кислотой |
FeO |
|||
Fe2O3 |
|||
CaO |
Закрепление:
1.
2. Классификация кислот
Актуализация знаний: Фронтальный опрос. Какие кислоты вы знаете?
Слайд 8
Учитель демонстрирует образцы кислот, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое кислоты и на какие группы они делятся,
класс работает вместе с доской или
самостоятельно. В учебнике страница 210, таблица 10.
Кислоты – это сложные вещества, состоящие из
положительно заряженных ионов водорода и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы кислот | Формулы кислот |
| Наличие кислорода | Кислородсодержащие | H2SO4 HNO3 H2CO3 |
| Бескислородные | HCl H2S | |
| Основность | Одноосновные | HCl HNO3 |
| Двухосновные | H2SO4 H2CO3 H2S | |
| Трехосновные | H3PO4 | |
| Растворимость | Нерастворимые | H2SiO3 |
| Растворимые | все остальные |
Закрепление:
1. Что такое трехосновная кислота?
Что такое трехосновная кислота?
3. Классификация оснований
Актуализация знаний: Фронтальный опрос. Что такое щелочи?
Слайд 10
Учитель демонстрирует образцы оснований,
ученик у доски с помощью таблиц на слайдах
объясняет, что такое основания и на какие группы
они делятся, класс работает вместе с доской или
самостоятельно. В учебнике страница 215, таблица 11.
Основания – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных гидроксид-ионов
| Признак классификации | Типы оснований | Формулы оснований |
| Кислотность | Однокислотные | NaOH KOH |
| Двухкислотные | Ca(OH)2 Fe(OH)2 | |
| Трехкислотные | Al(OH)3 Fe(OH)3 | |
| Растворимость | Растворимые щелочи | NaOH KOH Ca(OH)2 |
| Нерастворимые | Al(OH)3 Fe(OH)2 Fe(OH)3 |
Закрепление:
1. Что такое щелочи?
Что такое щелочи?
4. Классификация солей
Актуализация знаний: Фронтальный опрос. Приведите примеры солей?
Слайды 11, 12
Учитель демонстрирует образцы солей, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое соли и на какие группы они делятся, класс
работает вместе с доской или самостоятельно.
Соли – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы солей |
Формулы солей, названия |
| Состав, наличие ионов водорода или гидроксид-ионов | Средние | Na2SO4 сульфат натрия |
| Кислые | NaHSO4 гидросульфат натрия | |
| Основные | MgOHNO3 гидроксонитрат магния.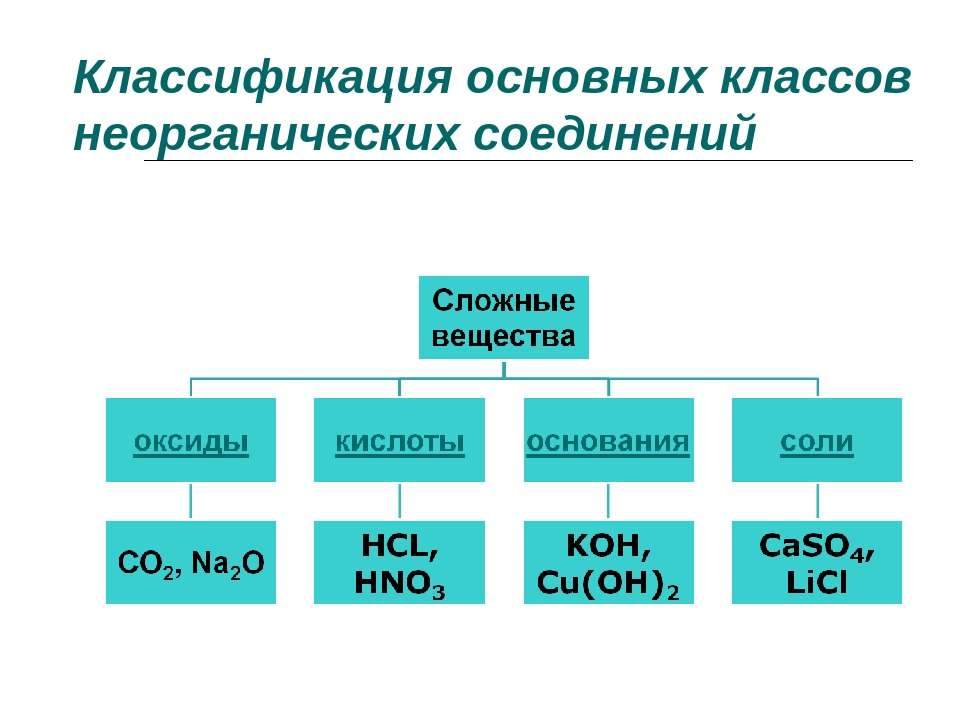 |
|
| Растворимость | Растворимые | заполнить самостоятельно по |
| Нерастворимые | таблице растворимости |
Закрепление, фронтальный опрос:
1. Что такое кислые соли?
2. Как меняется название кислых солей по
сравнению со средними?
IV. Закрепление учебного материала
Выполнение Лабораторной работы « Классификация неорганических веществ» (Приложение 2), работа в группах
Организация работы класса.
Класс делится на малые группы по 4 человека,
например, по скорости работы или по желанию
учащихся.
Определение самого «классного» химика, самого
«классного» учителя.
Фронтальный опрос: если будет время.
Какой класс веществ для вас показался самым
сложным и почему?
Во всех группах учащимся раздаются инструкции
лабораторной работы.
Использование ЦОР ( дополнительный материал,
если будет время)
Слайд 13
Интерактив. Классификация Кислот Упражнение 1
Интерактив. Классификация Оснований Упражнение 2
[1]
V. Домашнее задание
Представлено в рабочих листах.
Цель: закрепить навыки классификации веществ до оптимального уровня, уметь применять полученные знания в новой ситуации( проблемный вопрос)
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок
Проблемный вопрос. Почему и кислоты и
основания объединяются в группу гидроксиды? Что
у них общего и чем они отличаются?
Параграфы 38-41[3], написать по 2 типичных уравнения
реакций для каждого класса веществ Закончить
таблицу оксиды
Вы можете также сделать свое домашнее задание, по
выбору. Придумать свои упражнения или взять их из
других источников.
VI. Рефлексия
Рефлексия
Фронтальное обсуждение результатов урока с
классом.
Понравился ли вам урок? Оцените, как изменились
за урок ваши знания.
Свои впечатления выразить рисунком.
Веселая рожица – понравился урок, знаний
прибавилось.
серьезная рожица – трудно сказать, но что-то
новое узнал и запомнил
и недовольная рожица – не понравился урок,
ничего не узнал
Список литературы
1. Химия 8, 9 класс. Мультимедийное приложение к
учебнику О.С.Габриеляна. Электронное учебное
издание. ООО «Дрофа» 2011.
2. Планирование
к учебнику «Химия», 8, 9 класс, Габриелян О.С.
Единая коллекция цифровых образовательных
ресурсов
3. Габриелян О.С. Химия 8 класс. Учебник , М.:
Дрофа, 2011.
Технологическая карта урока по химии «Основные классы неорганических соединений»
Цель:
Организовать деятельность учащихся по обобщению, закреплению, углублению знаний об основных классах неорганических соединений, организовать проверку знаний.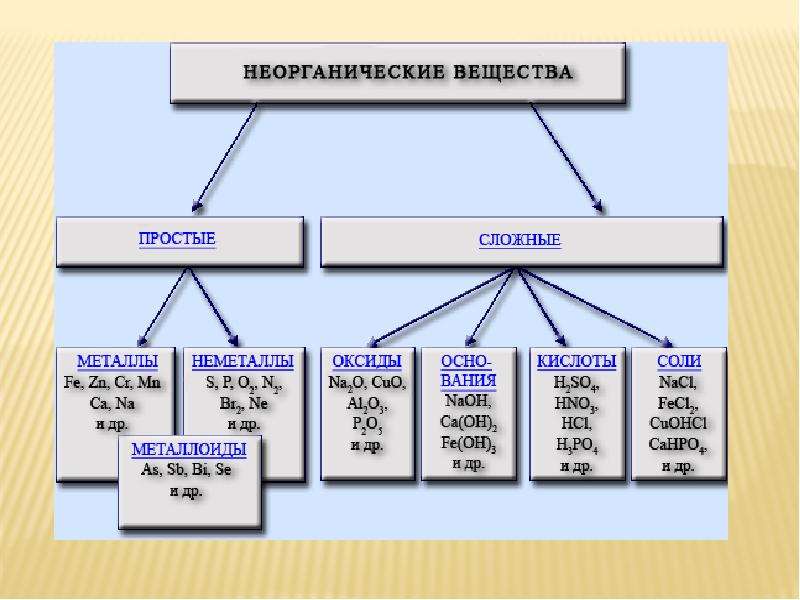
Задачи:
Образовательные: способствовать повторению, углублению и обобщению знаний об классификации, свойствах, применении основных классов неорганических соединений.
Развивающие: Способствовать развитию «химического» мышления, умения использовать терминологию, ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать информацию.
Воспитательные: формирование интереса к учению, стремления добиваться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия их способностей на уроке.
Планируемые результаты:
Предметные:
Знать: Знать классификацию, области применения основных классов неорганических соединений.
Уметь: Характеризовать свойства основных классов неорганических соединений.
Личностные: воспитание чувства само- и взаимоуважения; воспитание интереса к химии как науки; формирование навыков самоорганизации, формировать положительное отношение к учению, к познавательной деятельности, желание совершенствовать имеющиеся знания, осознавать свои трудности и стремиться к их преодолению, участвовать в творческом, созидательном процессе; навыков самооценки результатов учебной деятельности на основе критерия её успешности.
Метапредметные: развитие речи; формирование умений работать с информацией делать выводы; умение организовывать работу в группе (самостоятельно определять цели, роли, задавать вопросы, вырабатывать решения) развитие читательских умений, поиска нужной информации
развитие умений работать с разными видами информации: текст, рисунок, знак, схема, развитие умений с достаточно полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации; умение адекватно, подробно, сжато, выборочно передавать содержание текста формирование умения слушать и слышать собеседника постановка вопросов – инициативное сотрудничество в поиске и сборе информации.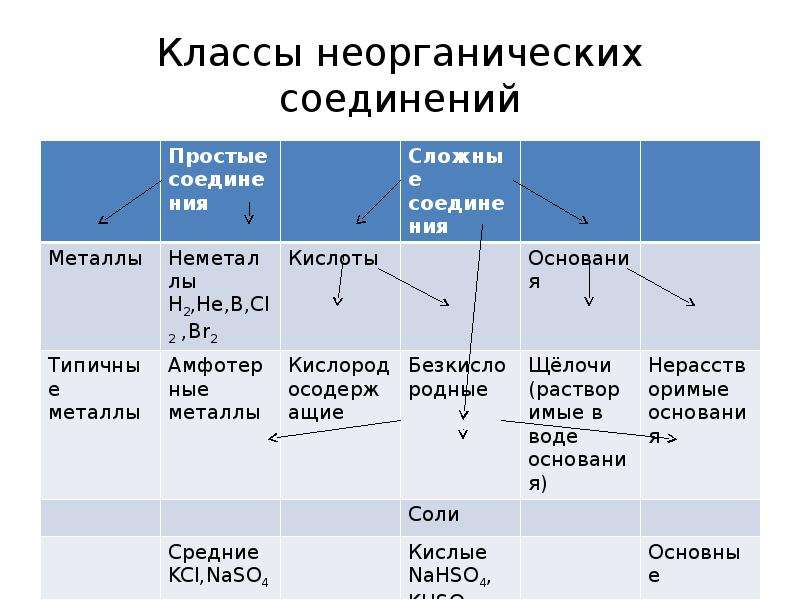
УУД:
Познавательные: Работать с учебником. Анализировать, сравнивать, обобщать, интегрировать данные, делать выводы. Усвоение фактического материала по предмету.
Коммуникативные: Формулировать мысли во внутренней и внешней речи. Умение планировать учебное сотрудничество с учителем и сверстниками. Умение слушать и понимать других, работать в группах учитывая позицию собеседника.
Регулятивные: Умение определять цель деятельности на уроке и планировать свою работу.
Личностные: Самоопределение – ответственное отношение к обучению. Самоконтроль, самооценка, самоанализ.
Этапы урока.
1. Организационный этап (2 мин).
Деятельность учителя.
Приветствует учащихся, определяет готовность к уроку. Определение отсутствующих.
2. Актуализация знаний и постановка учебной проблемы (5 мин)
Загадывает загадки:
«Их получают путем горения или сложных веществ разложения.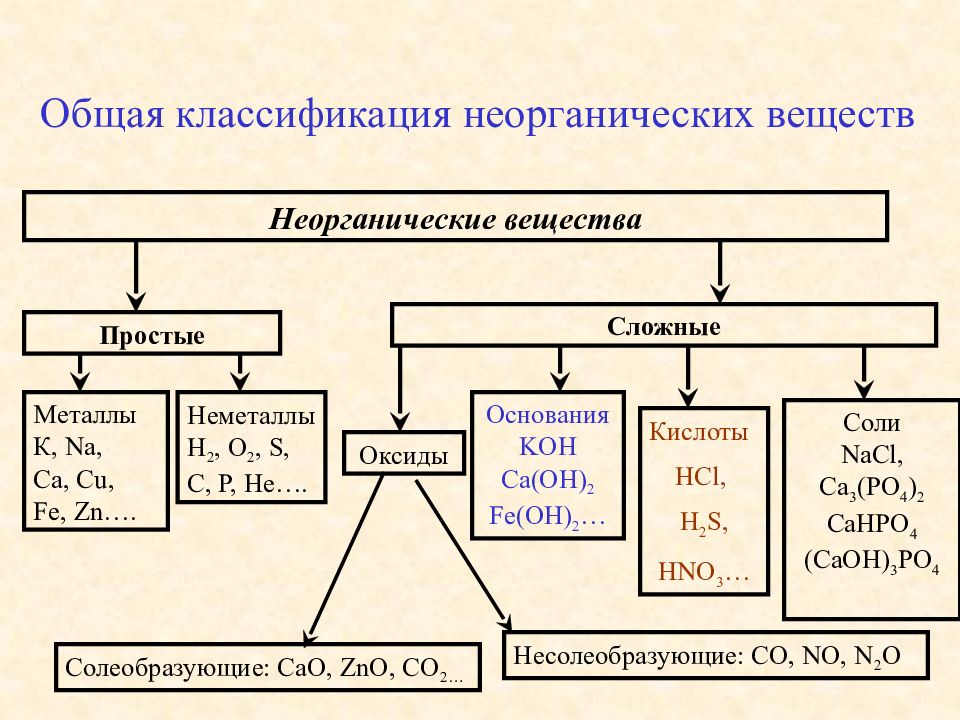
В них два элемента, один – кислород. Я отнесу к ним и известь, и лед».
Какие это вещества?
«Они имеют кислый вкус.
В них изменяет цвет лакмус с фиолетового на красный».
«В каких веществах у фенолфталеина бывает не жизнь, а сплошная малина?»
«Хлориды и нитраты,
Сульфаты, карбонаты
Я без труда и боли
объединю в класс…»
Определение темы урока.
Формулировка вместе с учащимися цели и задач урока.
Предлагает обобщить и углубить знания по теме, изготовив проект в виде схемы-конспекта, по предложенному плану и литературе.
Весь материал — в документе.
Основные классы неорганических соединений
Модуль состоит из одного кадра, на котором представлена схема классификации сложных веществ. В том числе, ученику предлагается просмотреть и прослушать интерактивную схему классификации сложных веществ по классам путём выбора активных зон на ней.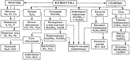
Тип: Информационный;
версия: 1.0.0.2 от 24.02.2009
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Категория пользователей
Обучаемый, ПреподавательКласс
8Контактное время
15 минутИнтерактивность
СредняяДисциплины
Химия / Неорганическая химия / Понятия, определения и законы неорганической химии / Состав вещества / Основные классы неорганических соединенийСтатус
Завершенный вариант (готовый, окончательный)Тип ИР сферы образования
Информационный модульМесто издания
МоскваЯзык
РусскийКлючевые слова
оксидыАвтор
Издатель
Правообладатель
Морозов Михаил Николаевич
Марийский государственный технический университет
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл.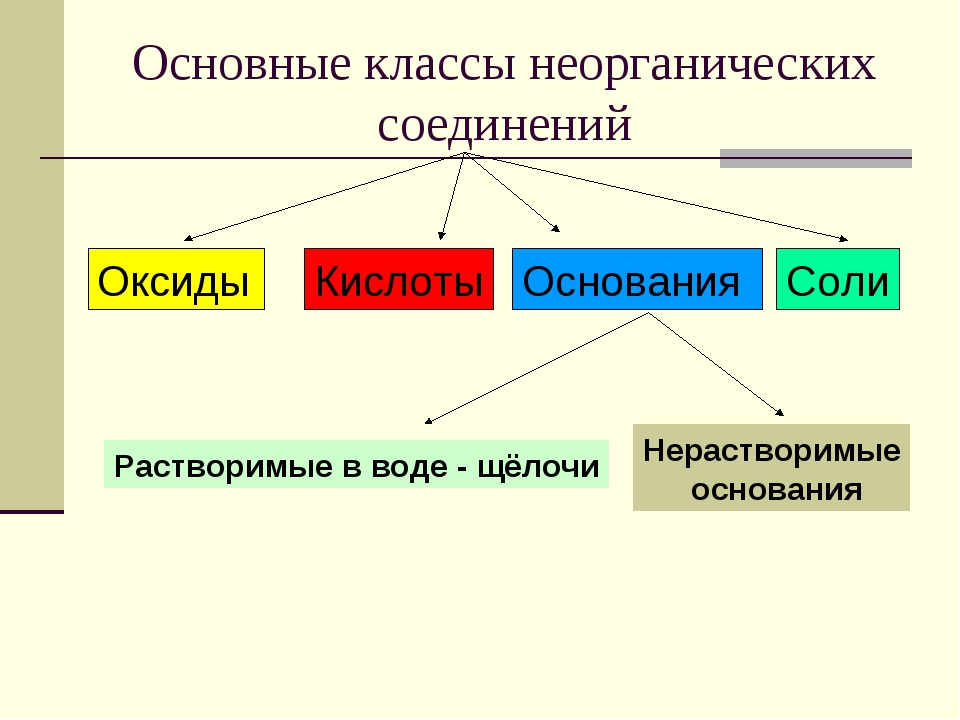 , 3,
, 3,
Сайт — http://www.mmlab.ru
Эл. почта — info@mmlab.ru
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул. , 51
, 51
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/htmlОбъем цифрового ИР
2 471 070 байтПроигрыватель
OMS-player версии от 1.0Категория модифицируемости компьютерного ИР
открытыйПризнак платности
бесплатныйНаличие ограничений по использованию
есть ограниченияРубрикация
Ступени образования
Основное общее образованиеЦелевое назначение
УчебноеТип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)Классы общеобразовательной школы
8Уровень образовательного стандарта
ФедеральныйХарактер обучения
БазовоеВикторина по химии «Основные классы неорганических веществ»; 8 класс — Презентации — Химия
Итоговая работа по химии по теме
«Основные классы неорганических веществ»
8 класс
Работа
выполнена в MSExcel
и предназначена для проверки знаний
учащихся по данной теме.
Работа содержит 7 основных листов:
Итоговая работа.
На данном листе информация об авторе и для кого предназначена работа.
Инструкция по выполнению работы.
На данном листе дана общая инструкция для выполнения всех заданий и выделена ячейка с общей оценкой.
Викторина по теме «Основные классы неорганических веществ».
Нужно ответить на 10 вопросов и ввести ответы в ячейки. Если ответ верен, то засчитывается 1 балл, если не верен, то 0 баллов. Максимальное число баллов за это задание – 10.
Инструкция к кроссворду по теме «Основные классы неорганических веществ»
Кроссворд по теме «Основные классы неорганических веществ».
Нужно ответить на 11 вопросов по данной теме. Для этого надо ввести свои ответы в ячейки кроссворда.
Проверка результатов кроссворда.

Если ответ на кроссворд верен, то он оценивается в 1 балл. В случае неверного ответа дается 0 баллов. Максимальное количество баллов в данном задании – 11.
Задание на соответствие.
В данном задании необходимо к молекулярной формуле найти соответствующее название. Если ответ верен, то дается 1 балл, если нет – 0 баллов.
К заданию на соответствие дана подробная инструкция на самом листе с заданием. Максимальное количество баллов за всю работу – 31. На листе с общей инструкцией выводится результат как среднее арифметическое всех оценок, которые ученик получил за задания. Если ученик не приступил к задания, то он получает за него «2»
Ответы к викторине:
1 Сложные
2 Кислоты
3 Щелочь
4 Оксиды
5 Кислород
6 Индикаторы
7 Щелочи
8 Соли
9 Вода
10 Водород
Ответы к кроссворду:
1 Соли
2 Одноосновные
3 Оксиды
4 Кислые
5 Кислородные
6 Основные
7 Кислоты
8 Кислотные
9 Основания
10 Средние
11 Щелочи
Ответы на соответствие:
1 Гидроксид натрия
2 Серная кислота
3 Хлорид калия
4 Оксид углерода (IV)
5 Гидроксид кальция
6 Угольная кислота
7 Карбонат натрия
8 Сульфат меди
9 Соляная кислота
10 Гидроксид лития
Пароль 1234
Классы неорганических соединений | Задачи 149
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba2+ и Cl– не связываются с ионами H+ и OH– с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca2+ и CO3– связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl– и OH–, которые не связываются друг с другом, молекулами CaCO3 и ионами воды H+ и OH—.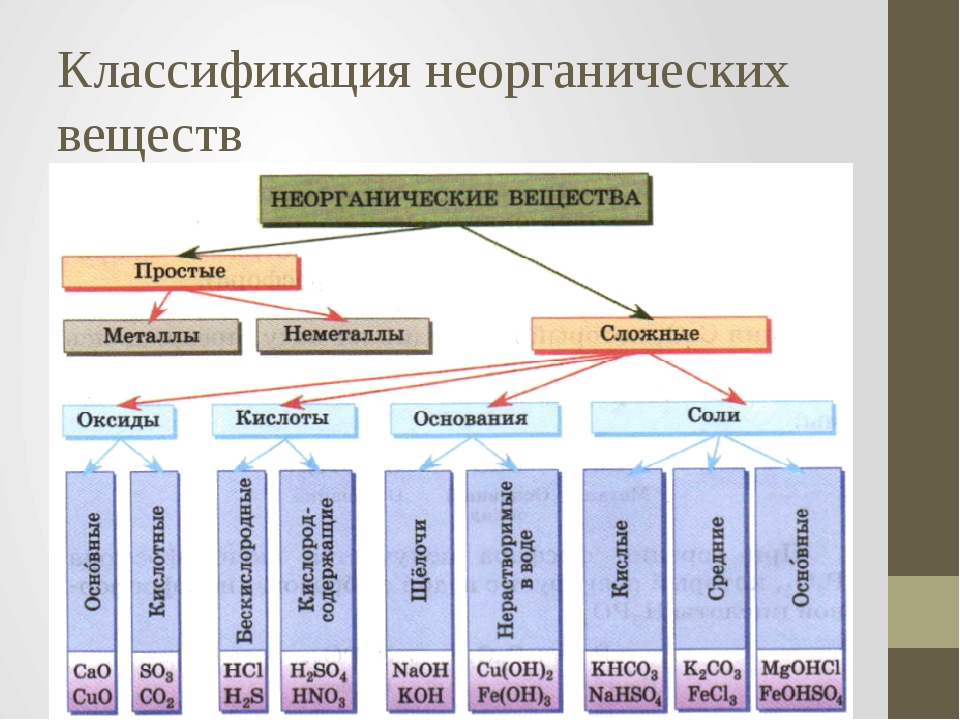 Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
NaCl ⇔ Na+ + Cl-;
AgNO3 ⇔ Ag+ + NO3—.
Ионы Ag+ и Cl— связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na+ и NO3—, которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K+ + Cl—;
NaNO3 ⇔ Na+ + NO3—.
Образовавшиеся ионы K+, Na+, Cl— и NO3— не связываются друг с другом и ионами воды H+ и OH— и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла.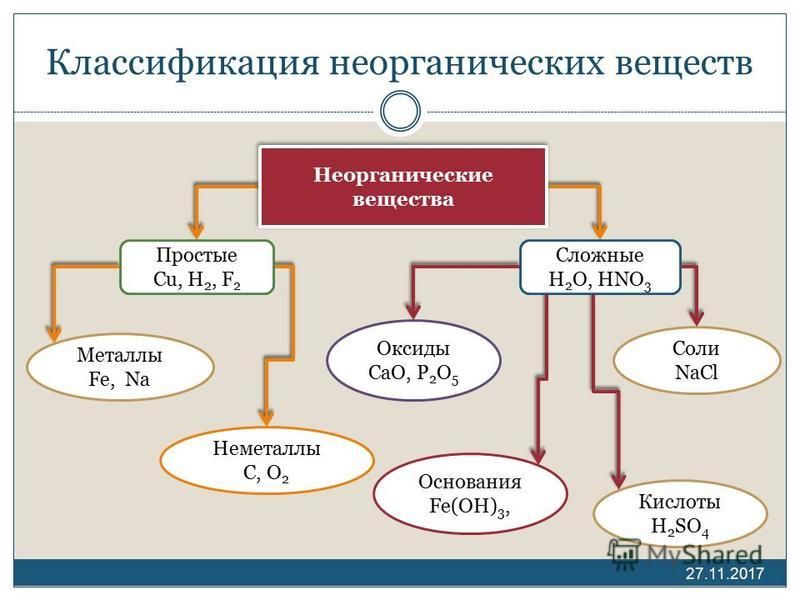 При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
Р2О5 + h3O → 2HPO3;
Р2О5 + 3H2O → 2H3PO4.
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
CO2 + H2O → H2CO3
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
2NO2 + H2O → HNO2 + HNO3
В присутствии избытка кислорода в воде образуется только азотная кислота:
4NO2 + O2 + 2H2O → 4HNO3
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
SO2 + H2O → H2SO3.
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
Zn(ОН)2 + 2HCl →ZnCl2 + 2H2O
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
CaO + 2HCl → CaCl2 + H2O
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag+ и NO3—, а соляная кислота как электролит распадается на ионы H+ и Cl—. Ионы Ag+ и Cl—, соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
Ионы Ag+ и Cl—, соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
AgNO3 + HCl →AgC↓ + HNO3
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Н3Р04 ⇔ 3H+ + PO43-;
H2SO4⇔ 2H+ + SO42-;
HCl ⇔ H+ + Cl—.
Ионы PO43-, SO42-, H+ и Cl— не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
HNO3 + NaOH → NaNO3 + H2O
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
CO2 + 2NaOH → NaO3 + H2O
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu2+ + SO42-;
NaOH ⇔ Na+ + OH—
Ионы Cu2+ и OH— связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6]4-:
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Р2О5 + 6NaOH → 2Na3PO4
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
Ma + 2HCl → MaCl2 + H2↑
б) Действием кислоты на основание:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
в) Действием кислоты на соль:
MgSO4 + 2HCl → MgCl2 + H2SO4
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
CuS + 10HNO3 → Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
CaF2 + H2SO4 → CaSO4 + 2HF
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
NaOH + HCl → NaCl + H2O;
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена).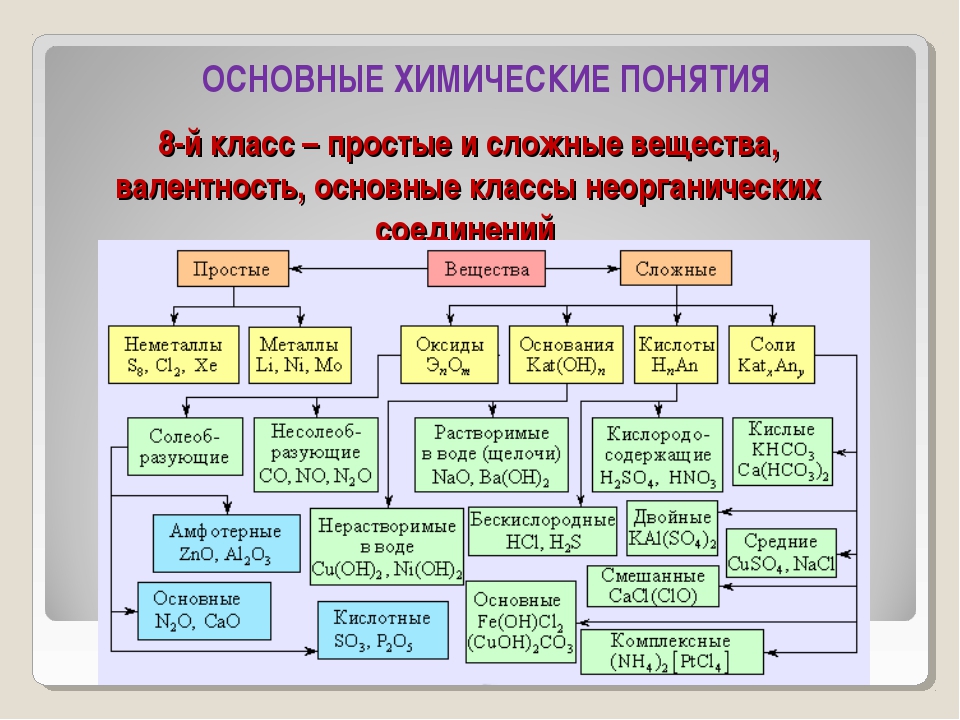 При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
AgNO3 + HCl → AgCl↓ + HNO3;
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Автоматизированная классификация соединений с использованием химической онтологии | Journal of Cheminformatics
Химическая терминология: соединения и классы соединений
Термины именованных объектов, связанные с химическими соединениями, используемые в биомедицинских документах или базах данных, включают не только названия соединений, но также термины для общих классов соединений, химических каркасов, производных классов, химических заместителей и функциональные группы — для целей поиска информации (IR) важно идентифицировать, классифицировать и разделять значения этих различных терминов.Каждое из этих понятий представляет классы химической онтологии, демонстрирующие определенные структурные особенности, позволяющие различать эти общие термины, как обсуждается в следующих разделах.
Химики используют различные выражения для создания терминов класса соединений из определенного названия соединения – например, «основа», «каркас», «производное», «класс соединения» часто используются суффиксы или «замещенный» является общим префиксом, который генерирует терм класса. К сожалению, значение терминов различных химических классов часто не определено точно, и их использование может значительно различаться по историческим причинам и в зависимости от класса соединений.Например, 2-этилимидазол 1 без сомнения принадлежит к классу соединений, имеющих имидазольный каркас, основную цепь, или являющихся производными имидазола или замещенным имидазолом. Напротив, прегнан 2 иллюстрирует более сложный случай – как и в случае 2-этилимидазола, это соединение можно рассматривать как 17-этилпроизводное каркаса андростан 3 . Однако это предполагает неправильную классификацию соединений, поскольку прегнаны не считаются производными андростан, хотя 2 содержит андростан 3 в качестве субструктуры (рис. 1).Это конкретное, структурно нелогичное соглашение об именах восходит к принципиально разной биологической активности конкретных соединений с прегнановым или андростановым остовом, что приводит к восприятию того, что андростаны и прегнаны не демонстрируют отношения родитель-потомок, а скорее являются родственными понятиями в той же иерархической структуре. уровень. Таким образом, любой специалист по химической онтологии оценит это знание, и структурное определение класса соединения андростан должно содержать определение, что любой андростан НЕ должен содержать углеродную замену в положении C-17.
1).Это конкретное, структурно нелогичное соглашение об именах восходит к принципиально разной биологической активности конкретных соединений с прегнановым или андростановым остовом, что приводит к восприятию того, что андростаны и прегнаны не демонстрируют отношения родитель-потомок, а скорее являются родственными понятиями в той же иерархической структуре. уровень. Таким образом, любой специалист по химической онтологии оценит это знание, и структурное определение класса соединения андростан должно содержать определение, что любой андростан НЕ должен содержать углеродную замену в положении C-17.
Структуры 2-этилимидазола 1, прегнана 2 и андростана 3.
Требование о том, что определенные структурные особенности не должны присутствовать в данном классе соединений, не только ограничивается сложными примерами, полученными из натуральных продуктов, такими как показано выше, но скорее представляет собой общую черту химических классов.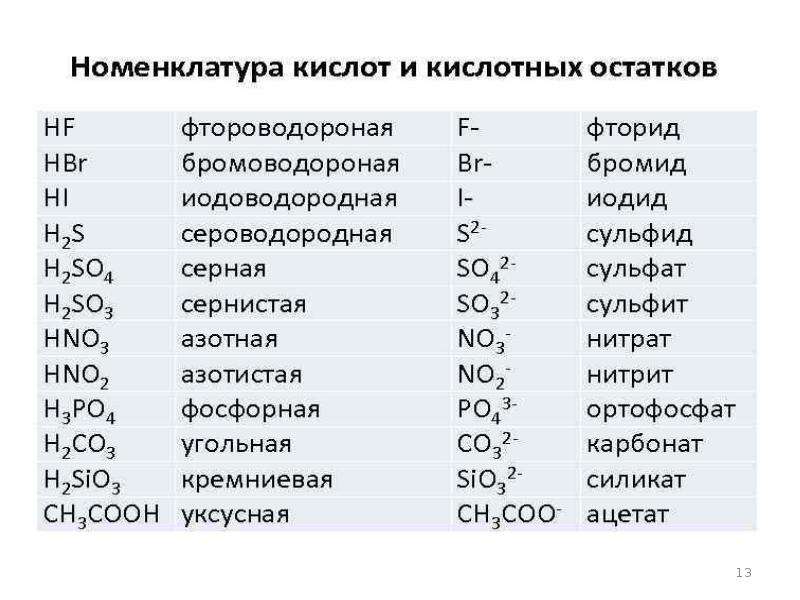 Например, алканы — это соединения, которые содержат только атомы углерода и водорода, но не атомы любого другого типа.Точно так же насыщенные соединения не должны содержать двойных связей, неорганические соединения не должны содержать углерод-углеродных связей и т. д. Эти несколько примеров должны показать, что правильные определения химических классов должны содержать довольно сложные наборы определений структуры. Еще одним следствием является также то, что простой поиск подструктуры, т.е. использование андростанового каркаса в качестве запроса подструктуры приведет к неправильной классификации и не должно использоваться для сложных задач онтологической составной классификации.Вместо этого структурные требования должны определяться наборами структурных условий, которые должны присутствовать или отсутствовать — каждое из них инициирует запрос структуры и имеет логические правила, которые обрабатывают наборы совпадений и дают окончательное решение, будет ли конкретное соединение или класс соединений или нет.
Например, алканы — это соединения, которые содержат только атомы углерода и водорода, но не атомы любого другого типа.Точно так же насыщенные соединения не должны содержать двойных связей, неорганические соединения не должны содержать углерод-углеродных связей и т. д. Эти несколько примеров должны показать, что правильные определения химических классов должны содержать довольно сложные наборы определений структуры. Еще одним следствием является также то, что простой поиск подструктуры, т.е. использование андростанового каркаса в качестве запроса подструктуры приведет к неправильной классификации и не должно использоваться для сложных задач онтологической составной классификации.Вместо этого структурные требования должны определяться наборами структурных условий, которые должны присутствовать или отсутствовать — каждое из них инициирует запрос структуры и имеет логические правила, которые обрабатывают наборы совпадений и дают окончательное решение, будет ли конкретное соединение или класс соединений или нет. относятся к изучаемому классу онтологий химии.
относятся к изучаемому классу онтологий химии.
Определение соединений
Международный союз теоретической и прикладной химии (IUPAC) разработал исчерпывающую терминологию общих химических терминов и определений классов соединений [19], которая может служить руководством для разработки экспертной химической онтологии.Например, согласно ИЮПАК химическое соединение — это чистое химическое вещество, состоящее из двух или более химических элементов с фиксированным соотношением атомов и имеющее уникальную и определенную химическую структуру. Это требование может быть переведено в подходящее структурное представление с использованием одной или нескольких таблиц соединений (CT) для одних и тех же определенных атомов. Таблицы соединений могут быть представлены различными форматами файлов, такими как SMILES, MOL, MOL2, MRV, CML или другими.
В этом контексте интересно рассмотреть пример витамина С для точного определения соединения и возможных наборов структурных определений. Витамин С может быть описан с помощью КТ неводородных атомов, связанных друг с другом таким же образом, но соединение атомов водорода витамина С, а также порядок связи между неводородными атомами могут различаться в разных таутомерах витамина С. (Фигура 2). Поскольку соотношение этих таутомеров зависит от таких факторов, как температура, растворитель, рН и других, мы предлагаем, чтобы все таутомеры по отдельности или в комбинации считались действительными представлениями одного и того же химического соединения и приводили к набору из трех структурных определений для описания соединения класса витамина С.Поскольку каждое из этих определений структуры является действительным представлением витамина С, эти определения должны быть связаны логикой ИЛИ, что означает, что соединение, которое удовлетворяет только одному из этих структурных определений, должно быть членом этого класса химических соединений.
Витамин С может быть описан с помощью КТ неводородных атомов, связанных друг с другом таким же образом, но соединение атомов водорода витамина С, а также порядок связи между неводородными атомами могут различаться в разных таутомерах витамина С. (Фигура 2). Поскольку соотношение этих таутомеров зависит от таких факторов, как температура, растворитель, рН и других, мы предлагаем, чтобы все таутомеры по отдельности или в комбинации считались действительными представлениями одного и того же химического соединения и приводили к набору из трех структурных определений для описания соединения класса витамина С.Поскольку каждое из этих определений структуры является действительным представлением витамина С, эти определения должны быть связаны логикой ИЛИ, что означает, что соединение, которое удовлетворяет только одному из этих структурных определений, должно быть членом этого класса химических соединений.
3 таутомерные формы витамина С.
Правило 1 онтологии химии : Химическое соединение — это класс соединений, имеющий фиксированное соотношение определенных атомов и химическую структуру, которая может быть выражена одной таблицей соединений неводородных атомов и одной или несколькими таблицами соединений, включающими атомы водорода а также ордера на облигации, связанные логикой ИЛИ.
В соответствии с этим правилом соединения, которые встречаются в виде различных микрочастиц, например, в виде нейтральных или цвиттер-ионных частиц, таких как аминокислоты, должны быть представлены двумя или более таблицами соединений как представлениями одного и того же соединения. Правило 1 также оказывается полезным, если учесть, что в химических базах данных для одного и того же соединения могут быть найдены разные КТ, особенно если структуры не нормализованы одним и тем же процессом до того, как структурное представление будет введено в базу данных.Таким образом, независимо от того, какой CT из возможных реально находится в базе данных, этой записи данных будет присвоен правильный класс.
Правило 1, однако, не распространяется, например, на полимеры, которые представляют собой смеси соединений и поэтому должны обрабатываться по-разному. Кроме того, следует иметь в виду, что таблицы соединений основаны на теории связанных валентностей (VB), которая уже представляет собой упрощение молекулярной реальности. Таким образом, помимо известных проблем с металлоорганическими соединениями, даже некоторые определенные чистые органические соединения не могут быть хорошо представлены VB-теорией, например, в некоторых пенталенах на самом деле связь между неводородными атомами и их валентность могут изменяться или не поддаются определению [20]. ].Однако предлагаемый метод позволяет проводить прямую аннотацию соединений в базах данных, обычно представляющих конкретное соединение только по одному КТ из различных возможных. Поскольку требуемые CT различных микровидов могут быть сгенерированы из одной исходной структуры с помощью методов автоматической нормализации структуры, также должна быть возможность автоматически генерировать различные наборы определений структур для химической онтологии, а инструменты преобразования структуры в имя могут автоматически генерировать их соответствующие имена. Соединения, которые не соответствуют правилу 1, представляют собой, например, соли, которые могут быть описаны либо в их ионной, либо в ковалентной форме с двумя CT — например, с использованием SMILES [Na+].[Cl-] или [Na] [Cl] для хлорида натрия. Чтобы зафиксировать их как одно соединение, окончательно требуется нормализация структур.
Соединения, которые не соответствуют правилу 1, представляют собой, например, соли, которые могут быть описаны либо в их ионной, либо в ковалентной форме с двумя CT — например, с использованием SMILES [Na+].[Cl-] или [Na] [Cl] для хлорида натрия. Чтобы зафиксировать их как одно соединение, окончательно требуется нормализация структур.
Стереоизомеры представляют собой еще одну интересную проблему для эксперта в области химической онтологии — например, термин «молочная кислота» может относиться к встречающейся в природе D-(-)-молочной кислоте, также известной как (R)-молочная кислота, где явный спецификация стереохимии опущена в тексте.В качестве альтернативы, это может относиться к рацемату рацмолочной кислоты, который представляет собой смесь 50:50 (S)-молочной кислоты и (R)-молочной кислоты, или к 2-гидроксипропановой кислоте с неизвестной или неопределенной стереохимией. Таким образом, в онтологии данная стереохимическая ситуация может быть представлена тремя дочерними составными узлами C[C@@H](O)C(O)=O (R-молочная кислота), C[C@H](O)C( O)=O (S-молочная кислота) и C[C@@H](O)C(O)=OC[C@H](O)C(O)=O (rac-молочная кислота), связанные с узел родительского соединения без стереохимической информации CC(O)C(=O)O.
В другом примере определенный стереоизомер D-глюкозы может быть представлен фуранозой, пиранозой и структурой с открытой цепью. Таким образом, D-глюкоза может быть представлена в виде онтологической концепции, которая включает в себя три связанных SMILES, соединенных логикой ИЛИ для определения этого соединения. Обратите внимание, что в примере стереохимия при атоме С-1 не определена.
[H]OC([H])([H])[C@@]([H])(O[H])[C@@]1([H])OC([H])( O[H])[C@]([H])(O[H])[C@@]1([H])O[H] OR
[H]OC([H])([H ])[C@@]1([H])OC([H])(O[H])[C@]([H])(O[H])[C@@]([H]) (O[H])[C@]1([H])O[H] OR
[H]OC([H])([H])[C@@]([H])(O[ H])[C@@]([H])(O[H])[C@]([H])(O[H])[C@@]([H])(O[H]) C([H])=O
Подобно описанным проблемам стереохимии и изомеров соединений, мы можем рассматривать соединения с различными изотопными заменами либо как синонимы изотопно неопределенного соединения, либо, также в зависимости от цели онтологии, как дочерние понятия того же самого.В целом IUPAC разработал обширные рекомендации по именованию соединений, которые могут служить прототипом и руководством для разработки химической онтологии [21].
Представление классов соединений
Основываясь на приведенном выше определении соединений, классы соединений можно рассматривать как наборы соединений с химической структурой, выраженной различными таблицами соединений, соединенными логикой ИЛИ. Подходящее представление классов соединений было дано Дэвидом Вейнингером с помощью логических выражений в нотации SMARTS [22], которые позволяют точно определить структурные элементы, которые должны или не должны присутствовать в соединениях, принадлежащих к назначенному классу соединений.Например, определение первичного амина может быть дано выражением SMARTS [N;h3v3][#6;!$(C=[O,S,N,P])], которое требует, чтобы два атома водорода были связаны с трехвалентный атом азота, соединенный с двумя атомами водорода и атомом углерода, который не должен быть связан с кислородом, серой, азотом или фосфором двойной связью. Однако, чтобы охватить всю сложность определений химических классов, недостаточно использовать только одно выражение SMARTS. Используя несколько SMARTS, можно построить почти любое определение класса химических соединений, если они объединены логическими операциями И, ИЛИ и НЕ.
Используя несколько SMARTS, можно построить почти любое определение класса химических соединений, если они объединены логическими операциями И, ИЛИ и НЕ.
Следующие примеры иллюстрируют этот метод: Циклоалканы представляют собой соединения, которые содержат только насыщенные атомы углерода и водорода и по крайней мере одну кольцевую систему. Это определение может быть представлено как [#6R]@[#6R] И НЕ ([#6R]:[#6R] ИЛИ [#6R]#[#6R] ИЛИ [#6R]=[#6R] ИЛИ [# 2,#3,#4,#5,#7,…,#104]), что означает, что полное выражение и классификация верны только в том случае, если исследуемое соединение соответствует всем критериям SMARTS. В то время как [#6R]@[#6R] обозначает структуру, которая содержит кольцевую связь между двумя атомами углерода, «чистый» циклоалкан не должен содержать никаких ароматических, двойных или тройных связей, а также любых других элементов, кроме углерода и водорода.Эти наборы логических выражений должны быть реализованы с помощью подходящей системы поиска структур, которая понимает выражения SMARTS для автоматической классификации соединений в базах данных, таких как программные инструменты ChemAxon [23] или Daylight [24].
Однако при использовании SMARTS возникает несколько проблем, требующих особого внимания в химической онтологии. Например, если в SMARTS-описании класса молекул должны использоваться списки атомов, правильное назначение тетраэдрической стереохимии R или S или стереохимии двойной связи E/Z невозможно, поскольку оно может измениться при использовании атомов из списка с разными приоритетами. .Эту проблему можно обойти, используя два отдельных выражения SMARTS, соединенных логикой И, одно без списков атомов, определяющих правильную стереохимию, и одно без стереохимии, но со всеми списками атомов.
Другая проблема заключается в предотвращении замещения углерода у определенного атома углерода (например, в андростане 3 у атома C-17). Все возможные валентности должны быть определены неуглеродным списком, а также должны быть рассмотрены двойные связи (например, возможное замещение кетогруппы у этого атома).
Правило 2 онтологии химии : Определение составного класса может быть построено на основе логически связанных критериев SMARTS.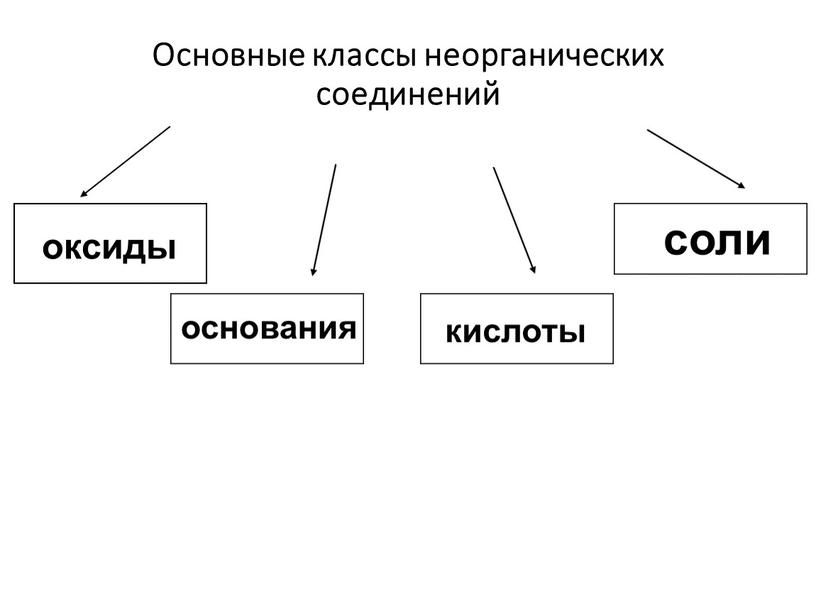 Все наборы разрешенных или запрещенных SMARTS связаны логикой ИЛИ. Два выражения SMARTS, которые должны быть действительными одновременно, должны быть связаны логикой И, например, SMARTS, содержащий информацию о стереохимии, и SMARTS, содержащий списки атомов. Полный набор разрешенных и запрещенных SMARTS-выражений, наконец, связан с логикой И-НЕ: (SMART-1 ИЛИ SMART-2 ИЛИ…) И НЕ (SMART-x ИЛИ SMART-(x+1) ИЛИ…).
Все наборы разрешенных или запрещенных SMARTS связаны логикой ИЛИ. Два выражения SMARTS, которые должны быть действительными одновременно, должны быть связаны логикой И, например, SMARTS, содержащий информацию о стереохимии, и SMARTS, содержащий списки атомов. Полный набор разрешенных и запрещенных SMARTS-выражений, наконец, связан с логикой И-НЕ: (SMART-1 ИЛИ SMART-2 ИЛИ…) И НЕ (SMART-x ИЛИ SMART-(x+1) ИЛИ…).
Как уже упоминалось ранее, многие классы соединений (например, «монотерпены» или «липиды») не характеризуются одним общим критерием субструктуры. Однако может быть проще определить такие классы через их дочерние элементы или потомки, которые имеют определенные структурные определения — эксперт должен будет решить, какие классы следует добавить к родительскому термину, назначив потомков, которые имеют наборы определений SMARTS.
Принимая во внимание типичное использование терминов химических классов в научной литературе, нам кажется, что также имеет смысл различать два основных типа классов соединений:
Классы соединений с узким определением структуры (как показано выше для циклоалканов).
 Это будет иметь место для классов, которые традиционно интерпретируются в соответствии с их историческими биологическими, биофизическими или другими производными характеристиками, такими как, например, моносахариды, липиды, стероиды или монотерпены. Часто в терминологии этих составных классов используется форма множественного числа «s».
Это будет иметь место для классов, которые традиционно интерпретируются в соответствии с их историческими биологическими, биофизическими или другими производными характеристиками, такими как, например, моносахариды, липиды, стероиды или монотерпены. Часто в терминологии этих составных классов используется форма множественного числа «s».Составные классы с широким определением структуры. Это могут быть классы производных или замещенных соединений, которые были химически модифицированы, чтобы также содержать замены, которые обычно не обнаруживаются в соединениях, которым присвоено узкое определение.Например, такие соединения, как пер-О-бензилглюкоза, не встречаются в природе, но могут быть синтезированы химическим путем и могут быть отнесены к классу «производных глюкозы».
Другие примеры широких и узких определений родственных классов:
Узкий класс «карбоновых кислот» потребует присутствия группы СООН, в то время как широкий класс «производных карбоновых кислот» может включать сложные эфиры карбоновых кислот, хлориды или даже амидины, но в любом случае соединения, в которых группа СООН модифицирована.
 Очевидно, что классы «карбоновые кислоты» и «производные карбоновых кислот» находятся на одном иерархическом уровне.
Очевидно, что классы «карбоновые кислоты» и «производные карбоновых кислот» находятся на одном иерархическом уровне.Аналогичным образом, «витамины» означают группу конкретных и определенных соединений, в то время как «производные витаминов» представляют собой химически модифицированные витамины и не должны рассматриваться как витамины в узком смысле.
Правило 3 онтологии химии : Составные классы могут быть определены узкими или широкими определениями структуры, включающими одно или несколько определений SMARTS, связанных с логикой И, ИЛИ и НЕ.
Для облегчения понимания мы предлагаем, чтобы название узкого класса было составным именем класса во множественном числе, а производный более широкий класс содержал термин «производные».
Приведенные выше определения, конечно, произвольны, и взгляды на то, что является узким или широким классом, могут значительно варьироваться от химика к химику. Например, считается ли бензимидазол потомком «имидазолов», «производных имидазола» и «бензолов» или нет, будет зависеть от принципов дизайна, используемых для построения онтологии.По нашему мнению, системы с конденсированными кольцами, такие как «бензимидазолы», скорее должны представлять собой отдельный онтологический класс — в данном случае они являются дочерними элементами «бициклических гетероциклических систем колец», а не замещенными имидазолами. Чтобы предотвратить аннотацию бензимидазола как имидазола, можно использовать определения SMARTS, которые требуют, чтобы каждый атом имидазольного кольца был частью только одной кольцевой системы.
Например, считается ли бензимидазол потомком «имидазолов», «производных имидазола» и «бензолов» или нет, будет зависеть от принципов дизайна, используемых для построения онтологии.По нашему мнению, системы с конденсированными кольцами, такие как «бензимидазолы», скорее должны представлять собой отдельный онтологический класс — в данном случае они являются дочерними элементами «бициклических гетероциклических систем колец», а не замещенными имидазолами. Чтобы предотвратить аннотацию бензимидазола как имидазола, можно использовать определения SMARTS, которые требуют, чтобы каждый атом имидазольного кольца был частью только одной кольцевой системы.
Взаимосвязи в химических онтологиях
Обширный обзор возможных взаимосвязей между химическими соединениями был предложен Дж.Гордон [25]. Chebi определяет 10 различных типов отношений, таких как обычно используемые IS_A и Отношения IS_PART , но и Chemistry Special , , IS_CONJUGATE_ACID_OF , IS_TAUTOMER_OF , IS_PARENT_HYDRIDE и IS_ENANTIOMER_OF , как определено правилами IUPAC. Чтобы обеспечить более плавную интеграцию химической онтологии с простыми поисковыми системами, в настоящее время мы использовали только отношение is_a , предоставив онтологию в форме направленного ациклического графа (DAG), также известного как таксономия.Поскольку отношение is_a является транзитивным и направленным, все свойства родительского класса, такие как принадлежность к лекарству, также являются свойствами связанных дочерних классов соединений. Транзитивность всех свойств концепта является важной особенностью отношения is_a (если A → B И B → C, то также верно, что A → C).
Чтобы обеспечить более плавную интеграцию химической онтологии с простыми поисковыми системами, в настоящее время мы использовали только отношение is_a , предоставив онтологию в форме направленного ациклического графа (DAG), также известного как таксономия.Поскольку отношение is_a является транзитивным и направленным, все свойства родительского класса, такие как принадлежность к лекарству, также являются свойствами связанных дочерних классов соединений. Транзитивность всех свойств концепта является важной особенностью отношения is_a (если A → B И B → C, то также верно, что A → C).
Типичной проблемой ручных назначений являются избыточные или отсутствующие связи между классами онтологии. Таким образом, ручное построение онтологий может привести как к переназначениям, так и к отсутствию назначений.Отсутствующие ссылки приведут к уменьшению количества попаданий — например, узел MeSH «стероиды» не был связан как дочернее понятие с классом «терпены» — поэтому поиск по термину запроса «терпены» в PubMed не будет возвращать стероиды как результаты запроса, которые может ожидать эксперт.
Редакторы Ontology имеют инструменты рассуждений для обнаружения таких логических ошибок, как обнаружение избыточных ссылок или процедур циклической проверки. Последний может сообщить об ошибке, если существует цепочка из одной или нескольких ссылок, которые делают термин предком самого себя, что не допускается в онтологиях типа DAG.Логическая природа определений, основанных на структуре, позволяет осуществлять логические проверки или рассуждения, специфичные для химии, например, проверку того, удовлетворяет ли соединение SMILES всем определениям SMARTS его родительских химических классов в иерархической цепочке узлов. Химическое рассуждение может также проверять, какие субструктурные части соединения соответствуют соответствующим SMARTS интересующего класса соединений, облегчая тем самым разработку онтологии.
Химическое правило онтологии 4 : Когда классы онтологии связаны отношением is_a , дочерний узел наследует все свойства, такие как все определения SMARTS родительской составной структуры, связанные с логикой И.
Полезный редактор химических онтологий будет реализовывать это правило и будет назначать соединения конкретному дочернему классу только в том случае, если выполняются все критерии предка, а также дополнительные свойства SMARTS этого класса.
Химическая онтология
Мы разработали прототип химической онтологии, используя предложенные правила, как описано выше для системы классификации, основанной на структуре. Особое внимание уделялось натуральным продуктам, т.е. стероиды или сахара, но также и к классам гетероциклических соединений и классам соединений, представляющим особый интерес для медицинской химии.Кроме того, классификации на основе свойств, такие как витамины, ароматизаторы и ароматизаторы, лекарства и соединения FEMA, были определены с помощью списков конкретных соединений. Не описаны полимеры, включая большие пептиды, белки и полимеры нуклеиновых кислот, а также комбинаторные библиотеки или смеси. Чтобы отразить логику этих составных классов, SMARTS можно заменить на Daylights CHORTLES [26] или формат Marvin с поддержкой Markush от ChemAxon [23] в качестве свойств класса для автоматического назначения.
Прототипная химическая онтология была построена в «удобочитаемом» формате OBO и содержит 3800 классов соединений, в общей сложности около 13 000 синонимов и около 2800 классов, определяемых выражениями SMARTS.Глубина классификации DAG составляет 15 уровней. Иерархические узлы верхнего уровня:
Классификация действий и использования, содержащая биологические агенты, фармакологические агенты, специальные агенты и ядовитые агенты
Производная классификация, например натуральные продукты
Структурная классификация, такая как соединения, элементы, ионы и радикалы
Узел структурной классификации классифицирует соединения по группам, связанным со структурой.Следующий нижний уровень узла классификации соединений содержит узлы: ациклические соединения, циклические соединения, заряженные соединения, соединения элементов, гетеросоединения, органические соединения и неорганические соединения.
Для целей этой статьи и для большей ясности мы включили два свободно доступных поддерева этой онтологии, чтобы продемонстрировать изложенные общие принципы построения сгенерированной химической онтологии. Онтология A (A.obo, см. рисунок 3 и дополнительный файл 1: A.obo) является примером классификации функциональных групп, таких как эфиры, в то время как онтология B (B.obo, см. рис. 4 и дополнительный файл 2: B.obo) представляет собой экспертное знание более сложных определений классов, таких как андростан и прегнан. Все остальные классы были удалены из полной онтологии, не относящиеся к классификации эфирных или андростановых и прегнановых соединений.
Рисунок 3Онтология поддерева A.obo, описывающая функциональные группы, напр. эфиры.
Рисунок 4 Онтология Б.obo, описывающий поддерево андростан и прегнан.
Автоматическое назначение соединений
Ручное назначение соединений классам соединений возможно для нескольких тысяч соединений, но невозможно для больших баз данных соединений или файлов структурных данных. Кроме того, ручное назначение всегда чревато ошибками. Поэтому мы использовали сконструированную онтологию, описанную выше, для автоматического отнесения соединений к соответствующим химическим классам.
Все соединения были подвергнуты оценке структуры с определениями онтологии, и для каждого пути самый глубокий соответствующий узел онтологии был назначен в качестве родителя соответствующего соединения. Для тестирования автоматизированной аннотации соединений была построена химическая база данных соединений, содержащая их химические названия и синонимы, полученные из общедоступных источников. В среднем каждое соединение PubChem было отнесено к 15 классам исходных соединений с помощью этой процедуры.
Например, акроптилин (рис. 5) подразделяется на 19 категорий: производные алкенов, алкилхлориды, сложные эфиры карбоновых кислот, эпоксиды, лактоны, вторичные спирты, третичные спирты, спиро-, гетеро-, полициклические, хлор-, углерод- , соединения кислорода и производные натуральных продуктов, биодоступные соединения, свинцовоподобные молекулы, соединения Липинского, липофильные соединения, низкомолекулярные соединения.В ХЭБИ у акроптилина есть только два родителя: азуленофуран и сесквитерпеновый лактон.
5) подразделяется на 19 категорий: производные алкенов, алкилхлориды, сложные эфиры карбоновых кислот, эпоксиды, лактоны, вторичные спирты, третичные спирты, спиро-, гетеро-, полициклические, хлор-, углерод- , соединения кислорода и производные натуральных продуктов, биодоступные соединения, свинцовоподобные молекулы, соединения Липинского, липофильные соединения, низкомолекулярные соединения.В ХЭБИ у акроптилина есть только два родителя: азуленофуран и сесквитерпеновый лактон.
Чтобы проиллюстрировать эффективность классификации этого подхода, мы отнесли 198 соединений из [18] к полной иерархии химических классов. Из этого тестового набора соединение было отнесено непосредственно к среднему числу 8 классов. Мы определили точность аннотации для этого тестового набора на уровне 95% (см. прилагаемый дополнительный файл 3). Основная причина неправильного или отсутствующего аннотирования классов связана с неверным пониманием химического класса «циклоарены». Циклоарены определяются как полициклические ароматические соединения, в которых аннелирование ареновых звеньев образует макроциклическую структуру. Ошибочно онтологический класс «циклоарены» рассматривался в нашей исходной онтологии просто как циклические ароматические системы.
Циклоарены определяются как полициклические ароматические соединения, в которых аннелирование ареновых звеньев образует макроциклическую структуру. Ошибочно онтологический класс «циклоарены» рассматривался в нашей исходной онтологии просто как циклические ароматические системы.
Чтобы более подробно описать эффективность классификации, мы также присвоили этот тестовый набор включенным частям нашей полной иерархии, онтологии A и онтологии B. Для онтологии эфирного класса A мы могли бы отнести все соединения, содержащие эфирные группы, к их соответствующим эфирным классам. .Никаких ложных заданий и пропусков заданий для существующих классов зафиксировано не было (точность 100%). Присвоенные соединения показаны на рисунке 6.
Рисунок 620 соединений из тестового набора из 198 соединений, которые были отнесены к классам эфиров.
Далее мы оценили эффективность назначения соединений, используя онтологию B, содержащую классы андростан и прегнан. Для этой цели мы выбрали соединения из базы данных с 28 683 050 миллионами соединений, созданной из источника данных PubChem.Обратите внимание, что для ясности соединения были назначены только самому глубокому дочернему узлу в иерархии. Были получены следующие частоты: андростаны – 502, 5α-андростаны – 1664, 5β-андростаны – 226, прегнаны – 189, 5α-прегнаны – 743, 5β-прегнаны – 394 уникальных номера соединений PubChem. Полный набор результатов можно найти в предоставленном дополнительном файле 4. Назначение полной базы данных PubChem заняло 30 минут в 4-ядерной системе Linux. Точность отнесения к классу «5β-андростаны» определяли методом ручного осмотра.Таким образом, 221 из 226 соединений, присвоенных PubChem, были правильно отнесены к 5β-андростанам, в то время как 2 соединения PubChem фактически были смесями соединений. Для 3 из 226 соединений спорно, следует ли их считать 5β-андростанами, поскольку их заместители настолько велики, что эти заместители сами могут рассматриваться как каркасы.
Для этой цели мы выбрали соединения из базы данных с 28 683 050 миллионами соединений, созданной из источника данных PubChem.Обратите внимание, что для ясности соединения были назначены только самому глубокому дочернему узлу в иерархии. Были получены следующие частоты: андростаны – 502, 5α-андростаны – 1664, 5β-андростаны – 226, прегнаны – 189, 5α-прегнаны – 743, 5β-прегнаны – 394 уникальных номера соединений PubChem. Полный набор результатов можно найти в предоставленном дополнительном файле 4. Назначение полной базы данных PubChem заняло 30 минут в 4-ядерной системе Linux. Точность отнесения к классу «5β-андростаны» определяли методом ручного осмотра.Таким образом, 221 из 226 соединений, присвоенных PubChem, были правильно отнесены к 5β-андростанам, в то время как 2 соединения PubChem фактически были смесями соединений. Для 3 из 226 соединений спорно, следует ли их считать 5β-андростанами, поскольку их заместители настолько велики, что эти заместители сами могут рассматриваться как каркасы.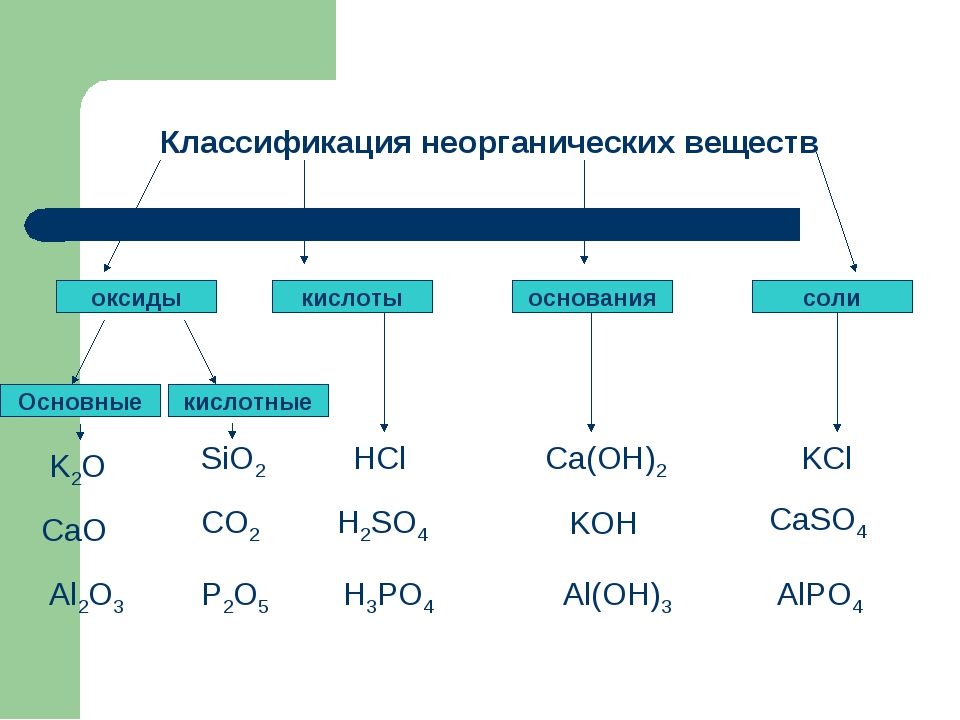 Таким образом, точность аннотации в этом примере составляет около 98%.
Таким образом, точность аннотации в этом примере составляет около 98%.
Типы соединений
Типы соединений — перекись водорода
Химическая формула соединения, известного нам как вода, H 2 O, что указывает на то, что 2 атома водорода соединяются с 1 атомом кислорода.Однако, если добавить еще один атом кислорода, создается новое соединение, называемое перекисью водорода — H 2 O 2 , что указывает на то, что 2 атома водорода объединяются с 2 атомами кислорода, создавая соединение перекиси водорода.
Бинарное соединение
Бинарное соединение образуется из двух типов элементов — их состояния вещества приводят к следующим типам соединений:
Металл + Металл = Металлическое Соединение
Металл + Неметалл = Ионное соединение
Неметалл + Неметалл = Ковалентное соединение
Типы соединений — Категории — Ионные, молекулярные и кислоты
Большинство типов соединений попадают в одну из трех категорий, называемых ионными соединениями, молекулярные соединения или кислоты.
Типы соединений
Ионные соединения
Типы соединений — ионы, катионы, анионы
Ион представляет собой атом или группу атомов, несущих электрический заряд. Типы соединений, называемые «ионными соединениями», состоят из комбинаций 90 107 положительно заряженных ионов, 90 108, называемых КАТИОНАМИ (которые обычно представляют собой металлы — произносится как «катион»), и 90 107 отрицательно заряженных ионов, называемых АНИОНАМИ (которые обычно представляют собой неметаллы). — произносится как «на глаз»).Как правило, соединение не будет иметь заряда.
Положительно заряженные ионы называются катионами, потому что они мигрируют к катоду (отрицательному полюсу) в растворе – они склонны терять электроны и образуют катионы
Отрицательно заряженные ионы называются анионами, потому что они мигрируют к положительному ) и поэтому известны как анионы — неметаллы имеют тенденцию приобретать электроны и образовывать анионы
Затем положительные катионы и отрицательные анионы притягиваются друг к другу, образуя ионные связи.

Ионные соединения проводят электроэнергию при растворении в воде или при расслоении
Типы ионных соединений
Типы различных типов ионных соединений:
NaCl (хлорид натрия)
CABR2 Бромид кальция)
Молекулярные соединения
Типы соединений. В чем разница между соединением и молекулой?
Молекулярное соединение.В чем разница между соединением и молекулой?
молекула образуется при химическом соединении двух или более атомов
молекулы являются соединениями
Типы соединений — молекулярные соединения
Молекулярные соединения состоят из комбинаций неметаллов .Бинарное молекулярное соединение состоит только из двух элементов. Примеры: h3O (вода).
Примеры: h3O (вода).
Молекулярные соединения легко идентифицировать, так как они состоят только из двух неметаллических элементов
Молекулярные соединения не проводят электричество Соединения:
Примечание. Молекулярный водород (H 2 ), молекулярный кислород (O 2 ) и молекулярный азот (N 2 ) являются соединениями , а не , поскольку каждое из них состоит из одного элемента.
Кислоты
Типы соединений — Кислоты
Кислоты представляют собой водородосодержащие соединения. Кислоты легко распознать — они состоят из водорода и аниона (водород всегда идет первым) и не имеют заряда.Типы соединений – примеры кислот
Примеры различных типов кислот состоят из водорода и анионов, и они не имеют зарядов:H 2 SO 4 (Серная кислота)
HNO 3 (азотная кислота).

Определение класса для класса 532 — ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — ЧАСТЬ КЛАССА 532
РАЗДЕЛ I – ОПРЕДЕЛЕНИЕ КЛАССА
Класс 532 является родительским классом для серии классов Класса 532, иерархическое расположение которых показано ниже в строках с Другие классы и внутри этого класса.
Класс 532 и его интегральные классы (т. е. классы 532 серии) включают мономерные органические соединения углерода и полимерные органические соединения углерода, не являющиеся твердыми синтетическими смолами, природными каучуки или углеводороды.
Для более полного описания связи этого класс и его неотъемлемые классы к остальной части Соединенных Штатов Система классификации патентов в отношении химических соединений классы композиций, см. Линии с другими классами внутри этого Класс.
РАЗДЕЛ II — ЛИНИИ ДРУГИХ КЛАССОВ И ВНУТРИ ЭТОГО КЛАССА
А. ИЕРАРХИЧЕСКИЕ ОТНОШЕНИЯ
Расположение класса 532 и его неотъемлемых классов по зонтик Class 260 и его иерархическая связь с классами в нем выглядит следующим образом:
Класс 260 Иерархия
Класс 260/1 (Разные органические соединения углерода)
Класс 518 (процессы Фишера-Тропша)
Класс 520/1 (синтетические смолы и натуральные Каучуки)
.
 Класс 521 (ионообменные полимеры, сотовые продукты, отходы
восстановление полимера)
Класс 521 (ионообменные полимеры, сотовые продукты, отходы
восстановление полимера). Класс 522 (химия полимеров с волновой энергией)
. Класс 523/1 (Композиции синтетических смол с Нереакционноспособный материал)
. . Класс 524
. Класс 525 (Химически обработанные синтетические смолы, композиции синтетических смол)
. Класс 526 (Прочие процессы, синтетические смолы из Только этиленненасыщенные мономеры)
.Класс 527 (Синтетические смолы из определенных природных источников)
. Класс 528 (Синтетические смолы из растительного сырья неизвестного происхождения). Состав или указанный реагент)
Класс 530 (натуральные смолы, пептиды, белки, лигнины)
Класс 532 (в настоящее время здесь нет патентов; предполагаемый остаток в будущем Подкласс после отмены класса 260)
. Класс 534 (Соединения радиоактивных или редкоземельных металлов, Азо и диазосоединения)
. Класс 536 (Углеводы)
.
 Класс 540/1 (гетероциклические соединения углерода: циклопентаногидрофенантрен
Содержащие четырехчленные лактамы, порфирины, азапорфирины, гетероген азота
Кольца с семью или более гетероатомами)
Класс 540/1 (гетероциклические соединения углерода: циклопентаногидрофенантрен
Содержащие четырехчленные лактамы, порфирины, азапорфирины, гетероген азота
Кольца с семью или более гетероатомами). . Класс 544 (шестичленные азотные гетероциклы с двумя или более гетероатомов)
. . Класс 546 (Шестичленные гетерокольца с одним кольцом Азот)
. . Класс 548 (пяти-, четырех- или трехчленный азот Кольца гетеро)
. . Класс 549 (Кислородные или серные гетерокольца)
.Класс 552 (азиды, трифенилметаны, хиноны, гидрохиноны, Стероиды)
. Класс 554 (Жиры, производные жиров)
. Класс 556 (тяжелые металлы, соединения алюминия или кремния)
. Класс 558 (эфиры)
. Класс 560 (сложные эфиры, включая карбоновые)
. Класс 562 (кислоты, галогенангидриды кислот, ангидриды кислот, селен и теллур соединения)
. Класс 564 (аминосоединения азота)
. Класс 568 (Соединения бора, фосфора, серы или кислорода)
.
 Класс 260/665R (Соединения углерод-легкие металлы)
Класс 260/665R (Соединения углерод-легкие металлы). Класс 570 (галогенные соединения)
Класс 585 (Углеводороды)
B. ССЫЛКА НА КЛАСС 260 ОПРЕДЕЛЕНИЕ КЛАССА
Определение класса Class 260 применимо почти во всех отношении к предмету серии классов 532 класса. Определение класса Class 260 обеспечивает всестороннее обсуждение таких тем как:
1. что представляет собой органическое соединение,
2.смеси, классифицируемые по подклассам соединений,
3. правило размещения патента,
4. родо-видовые отношения,
5. таутомерные формы,
6. Взаимоотношения между промежуточным и конечным продуктом и другие темы.
Определение класса 260 необходимо прочитать, чтобы получить полное представление предмета класса 532 и его составных классов.
Класс 532 в настоящее время имеет только один подкласс. Этот подкласс не имеет патентов. Когда реклассификация класса 260 будет завершена, и класса 260 больше не существует, этот подкласс будет остаточным дом для предмета серии классов 532 класса.

C. МНОГОЭТАПНЫЙ СИНТЕЗ ПРЕТЕНЗИИ
Многие из расписаний в этой Серии классов обеспечивают процесс подклассы. Они имеют отступ под составными подклассами и охватывают способы получения соединений, предусмотренных указанным составные подклассы.
Подклассы процессов обычно основаны на типе реакции (например, «путем гидрирования») или по типу исходного материал (например, «из нитросодержащего соединения») или на комбинации вышеперечисленного (например, «путем гидрирования нитросодержащего соединения»).
Во многих патентах заявлены многоступенчатые процессы. Проблема, о которой шаг утверждения многоэтапного процесса определяет, что классификация решена следующим образом: слово «непосредственно» будет уместно используется в названии подкласса, когда последний шаг формирования состав для контроля. Если «напрямую» не появляются в заголовке, шаг, который определяет классификацию, может быть до последнего шага подготовки. Рассмотрим следующее две претензии.

Пункт I. Способ получения X путем алкилирования A с получением B, изомеризация B с образованием C и восстановление C с образованием X.
Пункт II. Способ получения X путем восстановления A до B, алкилирования B для получения C и изомеризации C для получения X.
, которые должны быть размещены в следующей таблице:
1 . Соединения X
2 . . Приготовлено непосредственно путем редукции
3 . . Получен алкилированием
Пункт I отнесен к подклассу 2, поскольку использование термина «непосредственно» в утверждение о процессе означает, что задействованный шаг приводит непосредственно к получение желаемого соединения.
Пункт II относится к подклассу 3.Он не помещается в подкласс 2, так как в пункте II этап уменьшения не приводит к прямому получение соединения X, т. е. восстановление не является последним этапом в изготовление соединения. Подкласс 3, который не указывает «напрямую», примет пункт II из-за стадии алкилирования.

Этот пункт дополнительно иллюстрируется размещением пунктов формулы I и II, выше, в следующем графике:
4 . Соединения X
5 . . Получен алкилированием
6 .. Приготовлено непосредственно путем редукции
Пункт I и Пункт II должны быть отнесены к подклассу 5, поскольку этот подкласс обеспечивает алкилирование независимо от того, является ли соединение X получают непосредственно на стадии алкилирования или нет. Это было бы нецелесообразно относить претензии к подклассу 6, поскольку предусмотрен любой процесс получения соединения X, который включает алкилирование для подкласса 5.
Этапы очистки или восстановления не повлияют на классификацию на приведенных выше иллюстрациях.Классификация определяется контролирующий этап синтеза.
D. ОСОБЫЕ ПРАВИЛА КЛАССИФИКАЦИИ СОЛЕЙ
Правило, используемое при классификации и перекрестных ссылках уточнены родовые притязания на соли в этой серии классов. здесь. Это правило относится только к солям и не считается аналогично и не применяется к другим типам заявленного раскрытия.

Патент, в котором контрольная формула относится к «соединению» (например, кислота или основание), и где формула изобретения включает общую ссылку к солям, таким как: «и фармакологически приемлемые его соль», «или терапевтически полезная кислота их аддитивные соли», «и нетоксичные гетероциклические их аминовые соли» и т.д., будет иметь свою первоначальную классификацию определяется по «составу» без учета общая ссылка на их соли. Патент, в котором общая ссылка на соли находится в отдельном пункте формулы изобретения, который зависит по иску к «союзу» считается равнозначным а также будет иметь свою первоначальную классификацию, определяемую «составным» без относительно общей ссылки на их соли.
Перекрестная ссылка такого патента на соль обязательна только тогда, когда ясно, что конкретная соль действительно была сделана как подтверждается: (а) «рабочим примером» конкретного соль, (b) свойство конкретной соли, такое как ее температура плавления, инфракрасное сканирование, ядерно-магнитный резонанс и др.
 , или (c) пример
использования определенной соли, например, при лечении животных.
Другие перекрестные ссылки солей, например, входящие в состав
списка в раскрытии является необязательным и должен быть сделан только тогда, когда
явно полезно.
, или (c) пример
использования определенной соли, например, при лечении животных.
Другие перекрестные ссылки солей, например, входящие в состав
списка в раскрытии является необязательным и должен быть сделан только тогда, когда
явно полезно.Когда в формуле указывается конкретная соль, все соединение будет учитываться при определении исходной классификации, т.е. оригинал будет размещен на основе первого появившегося подкласс, предусматривающий кислоту, основание или соль.Конкретная соль считается изложенным в формуле изобретения, когда структура солеобразующая часть ясна из формулы изобретения или когда в формуле указано что тяжелый металл или конкретное гетерокольцо (например, «и замещенные морфолинсодержащие соли» и т.д.) присутствует в солеобразующей части.
Прочие претензии рассматриваются так же, как контрольная претензия при рассмотрении того, где сделать перекрестную ссылку, т. Е. Любую общую ссылку к солям пренебрегают, как объяснялось выше.
E.
 КЛАССИФИКАЦИЯ СОЕДИНЕНИЙ НЕИЗВЕСТНОЙ СТРУКТУРЫ, ВХОДЯЩИХ В ЭТОТ
СЕРИИ ИЛИ КЛАССЫ.
КЛАССИФИКАЦИЯ СОЕДИНЕНИЙ НЕИЗВЕСТНОЙ СТРУКТУРЫ, ВХОДЯЩИХ В ЭТОТ
СЕРИИ ИЛИ КЛАССЫ.Классификация соединений неизвестной структуры в этой серии классов достигается путем рассмотрения двух возможных методов для классифицируя их и используя тот, который приводит к наивысшему Классификация в Серии. Два метода: 1. Классифицировать по элементу или группе элементов, которые, как известно, являются частью состав. 2. Классифицировать на основе используемого органического реагента чтобы сделать компаунд.
При рассмотрении первого метода соединения классифицируются на основе любой частичной структуры соединения, которая известна или который можно найти, найдя названное соединение в опубликованных источниках. Например, если в патенте указан конкретный алкалоид и если можно найти структуру или частичную структуру этого алкалоида, патент классифицируется в соответствии с этой структурой или частичной структурой. Патенты, заявляющие о безымянных алкалоидах, в целом были засекречены.
 в классе 546, подклассе 1, исходя из предположения, что алкалоиды обычно
включают кольцо, состоящее из одного атома азота и пяти атомов углерода.
в классе 546, подклассе 1, исходя из предположения, что алкалоиды обычно
включают кольцо, состоящее из одного атома азота и пяти атомов углерода.Другая ситуация с неизвестными структурами связана с «окисленными углеводород», в котором не раскрывается структура продуктов. Они помещены в класс 568 в отступ под «кислородсодержащие». Все, что есть известны о них элементы, которые они содержат. Однако, осерненный углеводы неизвестной структуры помещаются с углеводами на основе органического сырья. «Серосодержащие» подклассы ниже в ряду, чем углеводы в классе 568.сульфурированный нитросодержащие органические соединения относятся к категории «сера содержащий», потому что это выше в расписании класса 568 чем «нитросодержащий».
Соединения, которые описаны как углеводы, белки, лигнины, крахмал и др., и которые предусмотрены по титулам Серии считаются известными структурами, хотя точные структура в патенте не указана. Они будут классифицируются как известные соединения и не будут рассматриваться как соединения неизвестной структуры или неопределенного состава.

F. ЛИНИИ МЕЖДУ КЛАССАМИ СОСТАВА И ЭТОЙ СЕРИИ КЛАССОВ
В целом, классы 532-570 используют смеси органические соединения только если смеси:
(А) являются результатом химического процесса или синтеза, при котором одновременно образуется множество соединений углерода,
(B) являются результатом процесса разделения, при котором множество соединения углерода выделяются одновременно из природного источника, или
(С) в результате примеси органических соединений с консервантом или стабилизаторы, единственной функцией которых является предотвращение химического или физическое изменение в соединениях углерода.
Напротив, классы состава, как правило, включают смеси в состав которых входят органические соединения углерода, если смеси образуются простым физическим смешиванием предварительно приготовленных соединений (кроме тех, консервированные или стабилизированные смеси в (C) выше).
Следующие правила предназначены для предоставления рекомендаций по размещению патенты в соответствии с изложенными выше принципами, но заменены любыми конкретными строками класса наоборот:
(1) Если смесь обычно относится к серии 532-570.
 подвергается химической обработке в целом (где вся смесь ведет себя
в реакции в виде соединения) полученный продукт будет по-прежнему
быть классифицированы в серии 532-570.(См. 5 и 9 ниже).
подвергается химической обработке в целом (где вся смесь ведет себя
в реакции в виде соединения) полученный продукт будет по-прежнему
быть классифицированы в серии 532-570.(См. 5 и 9 ниже).(2) Если смесь обрабатывается для разделения ее компонентов, с последующим их повторным смешиванием смесь будет считаться поддающиеся отнесению к соответствующему классу состава на основе раскрытого полезность.
(3) Если состав смеси изменен путем добавления ингредиент, которого изначально не было, полученный продукт будет считается поддающимся классификации в соответствующем классе состава на основе по раскрытой полезности.
(4) Если смесь обрабатывается для удаления компонента, заявленный продукт, если он все еще является смесью, будет считаться классифицируемым в соответствующем классе состава на основе раскрытой полезности.
(5) Если смесь подвергается химической обработке, компонентов реагируют (по раскрытию), получающаяся смесь прореагировавшие и непрореагировавшие компоненты будут считаться классифицируемыми в соответствующем классе состава на основе раскрытой полезности.
 (См. 1, выше.).
(См. 1, выше.).(6) Если заявлена смесь, которая по раскрытию может быть получают либо (1) в виде реакционной смеси, либо (2) путем физического смешивания ингредиенты, и в продукте нет ограничений по реакции претензий и заявлений об отсутствии реакции, или если есть претензии к оба метода изготовления продукта, смесь будет классифицироваться в соответствующий класс состава на основе раскрытой полезности.
(7) Если осуществляется реакция между двумя или более соединениями в присутствии дополнительного соединения, которое намеренно остается как значительная часть конечной смеси, смесь будет отнесены к соответствующему классу состава на основе раскрытых полезность.(например, A + B + D Æ C + D).
(8) Если два или более соединений реагируют в условиях где используется избыток одного из реагентов, так что он остаются значительной частью композиции, полученная смесь будут отнесены к соответствующему классу состава на основе раскрытая полезность. (например, A + B в избытке Æ C + B).

(9) Когда смесь соединений взаимодействует с другим соединением и приводит к смеси, она будет классифицирована в соответствующем класс состава на основе раскрытой полезности, за исключением случаев, когда исходная смесь сама по себе относится к серии 532-570 (т.г., (A + B + C) + D → AD + BD + CD) (См. 1, выше).
(10) Когда два или более соединений реагируют под контролем условия для получения желаемой результирующей смеси, она будет классифицирована в соответствующем классе состава на основе раскрытой полезности. Намерение должно состоять в том, чтобы получить смесь, имеющую полезность в качестве конкретной смесь. Реакционные смеси, как правило, классифицируются как соединения по к полученному желаемому соединению. Многие реакционные смеси полезны из-за желаемого соединения, образованного в результате реакции, в то время как другое компоненты смеси бесполезны; эти реакционные смеси относятся к соединениям.Не менее двух компонентов реакции смесь должна быть необходима для заявленной полезности реакции смесь классифицируется как композиция.

Серия классов 532-570 также включает соединения углерода, предусмотренные Серией, при смешивании или растворении в растворитель, служивший реакционной средой для синтеза органическое соединение, если только смесь или раствор, образованные таким образом, заявлено или раскрыто исключительно как имеющее функцию или полезность предусмотрено в классе композиции.
Водный раствор соединения, предусмотренного в 532-570 Серии классов, независимо от того, сохранились они или нет, классифицируются в этом Серия, если не заявлено использование водного раствора или раскрывается однократное использование для него, и в этом случае классификация в указанном классе. Если раскрывается использование множественного числа, см. иерархию правила изложены в разделе ЛИНИИ С ДРУГИМИ КЛАССАМИ И ВНУТРИ ЭТОГО КЛАСС, в определении класса 252. Однако гель или другой коллоид система, состоящая из водного раствора соединения, предусмотренного для в серии классов 532-570 относится к классу 516 (см.
 подклассы 98+ для гелей), даже если не заявлено об использовании
или раскрыты.
подклассы 98+ для гелей), даже если не заявлено об использовании
или раскрыты.Патенты, содержащие заявки на новый краситель на основе углеродных соединений и претензии к волокну или материалу, окрашенному им, классифицируются в 532-570 Серии классов, за исключением случаев, когда процесс окрашивания также утверждал.
Серия классов 532-570 также включает соединения углерода, предусмотренные Серией, при смешивании с консервантом единственной функцией которого является предотвращение физических или химических изменений в соединение углерода, если не заявлено, что образованная таким образом смесь имеет функция или утилита, предусмотренная в классе композиции.»Сохранение агент» включает агент, который ингибирует химическое разложение, коррозия или спекание соединения углерода к которому он добавлен. Консервированные соединения, классифицируемые в 532-570 Серии классов классифицируются на основе углеродного соединения. сохраняется, даже если консервант сам по себе является углеродным соединением предусмотрено в предыдущем подклассе.

РАЗДЕЛ III. ССЫЛКИ НА ДРУГИЕ КЛАССЫ
ПОСМОТРЕТЬ ИЛИ ПОИСК КЛАСС:
506, Технология комбинаторной химии: метод, библиотека, Устройство для химической или биологической библиотеки или процесса создания указанной библиотеки. РАЗДЕЛ IV – ГЛОССАРИЙ
АЦИКЛИЧЕСКИЙ
Этот термин обозначает соединение, не содержащее кольца.
АЦИКЛИЧЕСКИЙ АТОМ
Этот термин обозначает атом, который не является членом кольца. Фигура 1 содержит ациклический азот, а рис. 2 не содержит ациклический азот
Рисунок 1
Рисунок 2
ACYCLIC BONDING
Применительно к связыванию или присоединению определенных частей, этот термин означает, что фрагменты связаны друг с другом исключительно атомами и связями, не входящими в кольцо.
 То
соединения на рисунке 3 показывают кислород, присоединенный к гетероциклу
ациклическая связь. Обратите внимание, что серосодержащее соединение также имеет азот
и сера присоединена к гетерокольцу ациклической связью.
То
соединения на рисунке 3 показывают кислород, присоединенный к гетероциклу
ациклическая связь. Обратите внимание, что серосодержащее соединение также имеет азот
и сера присоединена к гетерокольцу ациклической связью.Рисунок 3
Соединения на рисунке 4 будут исключены из подкласса требуется кислород, присоединенный к гетерокольцу ациклической связью, поскольку карбоциклическое кольцо находится между кислородом и гетероциклом в каждой структуры.
Рисунок 4
АЛИЦИКЛИЧЕСКОЕ КОЛЬЦО ИЛИ СИСТЕМА КОЛЬЦ
Этот термин обозначает карбоциклическое кольцо, которое не является бензольным кольцо или полициклокарбоциклическая система колец, которая не имеет бензольное кольцо как один из циклос.
АЛКЕНИЛ
Этот термин обозначает ациклическую углеродную цепь, которая содержит углерод-углеродная двойная связь и представлена формулой -C n H 2n-1 .

АЛКЕНИЛЕН
Этот термин обозначает ациклическую углеродную цепь, которая содержит углерод-углеродная двойная связь и представлена формулой -(С н Н 2н-2 )-.
АЛКИЛ
Этот термин обозначает ациклический углерод или насыщенный ациклический углеродная цепь представлена формулой -C n H 2n+1 .
АЛКИЛЕНЫ
Этот термин обозначает ациклический углерод или насыщенный ациклический углеродная цепь представлена формулой C n H 2n- .
АЛКИНИЛОВЫЙ
Этот термин обозначает ациклическую углеродную цепь, которая содержит тройная связь углерод-углерод и представлена формулой -(С н Н 2н-3 )-.
АЛКИНЛЕН
Этот термин обозначает ациклическую углеродную цепь, которая содержит тройная связь углерод-углерод и представлена формулой -(С н Н 2н-4 ).

АМИНОАЗОТ
Обозначает любой азот в органическом соединении, кроме азот в неорганическом ионе аддитивной соли, нитро (-NO 2 ) или нитрозо (-NO).Составные части «аддукта» будут считаться связанными друг с другом ионно, за исключением случаев, когда видно, что способ присоединения неионный.
АРИЛ КОЛЬЦО ИЛИ СИСТЕМА КОЛЬЦ
Этот термин обозначает бензольное кольцо или полициклокарбоциклический кольцевая система, имеющая бензольное кольцо в качестве одного из циклос.
ПРИКРЕПЛЕННЫЕ ИЛИ НЕПОСРЕДСТВЕННО ПРИКРЕПЛЕННЫЕ
Эти термины используются, чтобы показать, что указанные фрагменты связаны только связями.
НЕПОСРЕДСТВЕННО ПРИКРЕПЛЕННЫЙ
Этот термин означает, что по крайней мере один атом, а также связи, соединяет указанные фрагменты.
БЕНЗОЛОВОЕ КОЛЬЦО
Этот термин включает во всех случаях, за исключением случаев, когда напротив, замещенные бензольные кольца, в том числе замещение в виде дополнительного сплавленного или мостикового кольца или кольцевая система.

Так, например, если подкласс гласит: «Бензол кольцо, связанное непосредственно с пятичленным гетероциклом», часть, связанная непосредственно с гетероциклом, может представлять собой фенил, хлорфенил, динитрофенил, нафтил и др.Все, что необходимо для удовлетворения терминология подкласса заключается в том, что замещенный или незамещенный бензольное кольцо может быть связано непосредственно с гетероциклом.
КАРБОЦИКЛИЧЕСКИЙ
Этот термин обозначает кольцо или кольцевую систему, в которой все элементы кольца являются углеродами.
ЦЕПЬ
Этот термин обозначает множество атомов, которые соединяют определенные группы или атомы. Атомы цепи должны быть связаны неионным путем. друг к другу и к указанным группам или атомам.Если цепь может не включать никаких членов кольца, он будет обозначен как ациклический. Когда цепочка может включать кольцевых членов, в заголовке будет указано, что цепь может включать кольцо. Цепочка заканчивается там, где она присоединяется к указанные группы или атомы и не включает в себя какую-либо их часть.
 Цепь может иметь заместители, но заместители не являются частью
цепи.
Цепь может иметь заместители, но заместители не являются частью
цепи.КЛАТРАТЫ И ИНТЕРКАЛЯТЫ (СОЕДИНЕНИЯ ВКЛЮЧЕНИЯ)
Клатраты и интеркалаты (соединения включения) как таковые, классифицируются иерархически и подчиняются ограничениям, установленным четвертый в классах соединений (элементов) на основе инкапсулянта и инкапсулировать.Например, клатрат мочевины и водорода. перекись относится к классу 564, подклассу 32, мочевине и органическому соединение класса 564, подкласса 1.5, декстран и йод класса 536, подкласс 112 и т. д. Если в патенте не указано, что материал является либо клатратом, либо интеркалатом, делается предположение что материал представляет собой либо продукт с покрытием, либо инкапсулированный, классифицированный в классе 428, подклассах 402+.
СОДЕРЖИТ
Этот термин следует толковать широко.В подклассе, который указывает галоген, содержащий, например, галоген может быть присоединен с другими частями соединения посредством ионной связи или неионной связи.

Кроме того, элемент, содержащийся в материале, может быть в любом форма. В подклассе, таком как катализатор, содержащий тяжелые металлы (или материал) используемый—, металл может быть в элементарном или составном форма.
ЦИКЛ
Этот термин относится к кольцу полициклокольцевой системы.
ТЯЖЕЛЫЙ МЕТАЛЛ
Этот термин обозначает любой металл, имеющий удельный вес больше чем четыре и включает мышьяк.
ГЕТЕРО КОЛЬЦО
Этот термин обозначает кольцо, содержащее углерод и по крайней мере один атом из группы, состоящей из азота, кислорода, серы, селена и теллур в качестве членов кольца; и не содержит другого элемента, как кольцевой член.
Чтобы квалифицироваться как гетерокольцо, неионогенная связь должна существовать между все члены кольца. Внутренние солевые соединения, такие как бетаины, сульфобетаины, и т. д., при этом два кольцевых элемента присоединены друг к другу с помощью ионных связи, не считаются гетерокольцами.

ВКЛЮЧАЯ ГИДРОГЕНИРОВАННЫЕ
Этот термин в качестве выражения в скобках используется после название гетероциклического кольца или системы колец, которое является ненасыщенным, например, оксазолы и т. д. Например, если подкласс называется «1, 3-оксазолы (включая гидрогенизированные)»,
Выражение в скобках «(включая гидрированный)» означает что подкласс является общим для полностью ненасыщенных 1,3-оксазолов и к 1,3-оксазолам, в которых одна или две двойные связи в кольце имеют заменена одинарной связью; я.е., подкласс является общим для оксазолы, оксазолины и оксазолидины.
Когда название такого гетероциклического кольца используется в отступах где не указана степень насыщения или ненасыщенности кольца, название гетероциклического кольца снова будет истолковано как общее ко всем возможным степеням насыщения и ненасыщенности кольца.
Если, например, подкласс, озаглавленный «Азот, связанный непосредственно к кольцевому углероду оксазольного кольца были отступы под «1, 3-оксазолы (включая гидрогенизированные) азотистого подкласса быть истолковано как охватывающий азот, связанный непосредственно с кольцевым углеродом оксазола, оксазолина или оксазолидина.

При использовании после названия гетероциклической кольцевой системы, таких как хинолин, выражение в скобках указывает на то, что подкласс является общим для соединений, имеющих полностью ненасыщенную форму кольцевой системы, а также к соединениям, в которых любое количество кольцевые двойные связи кольцевой системы были заменены одинарными связями. Утверждение, сделанное выше, вновь применимо и к гетероциклическим кольцевые системы.
СОЕДИНЕНИЯ ВКЛЮЧЕНИЯ
См. КЛАТРАТЫ И ИНТЕРКАЛЯТЫ (СОЕДИНЕНИЯ ВКЛЮЧЕНИЯ).
ПРОМЕЖУТОЧНЫЕ
См. КЛАТРАТЫ И ИНТЕРКАЛЯТЫ (СОЕДИНЕНИЯ ВКЛЮЧЕНИЯ).
ЛЕГКИЙ МЕТАЛЛ
Этот термин обозначает любой металл, имеющий удельный вес менее чем четыре.
МЕТАЛЛЫ И НЕМЕТАЛЛЫ
Водород, бор, углерод, кремний, азот, фосфор, кислород, сера, селен, теллур, благородные газы и галогены, включая астат, считаются неметаллами. Все остальные элементы, включая мышьяк, считаются металлами.

МОНОЦИКЛИЧЕСКОЕ КОЛЬЦО
Этот термин обозначает кольцо, которое не является частью полициклокольца. система.
НИТРОЦИКЛИЧЕСКИЙ
Этот термин обозначает кольцо или кольцевую систему, в которой все элементы кольца являются азотами.
НЕИОННАЯ СВЯЗКА
Применяется в отношении связывания или прикрепления определенных фрагментов обозначает отсутствие ионной связи между фрагментами. Если фрагменты присоединены непосредственно, связи между ними должны быть ковалентными или координировать.Если фрагменты присоединены косвенно, каждый атом соединительной цепи должны быть присоединены ковалентными или координатными связывание с другим атомом соединительной цепи или с одним из части. Однако соединительная цепь может иметь заместители на ней. которые включают ионную связь. Будут приведены некоторые примеры соединений, которые могут быть отнесены к подклассу со следующим названием: «Кислородные присоединены косвенно к шестичленному гетерокольцу неионными склеивание».
 Два типичных соединения, которые можно было бы классифицировать
в таком подклассе показаны на рисунке 5.
Два типичных соединения, которые можно было бы классифицировать
в таком подклассе показаны на рисунке 5.Рисунок 5
Три соединения, показанные на рисунке 6, также будут классифицированы в таком подклассе, но они не типичны.
Три нетипичных примера на рис. 6 считаются соответствуют названию, так как между гетеро кольцо и кислород, в котором каждый атом связан с гетеро кольцо, кислород или другой атом цепи неионными связями.Ионная связь между кольцевым азотом и кислородом в две внутренние соли бетаина являются дополнительными и не удерживают бетаины из такого подкласса.
Рисунок 6
Однако конструкция, показанная на рисунке 7, исключена. так как кислород не связан косвенно (или напрямую) с шестичленным гетерокольца неионогенной связью.
Рисунок 7
Кислород N-оксида, как показано на рисунке 8, считается присоединены к кольцу неионогенной связью (координатной связью).

Рисунок 8
СИСТЕМА POLYCYCLO RING
Этот термин обозначает соединение, содержащее конденсированные или мостиковые кольца. Система полициклических колец должна содержать не менее двух колец. и каждое кольцо системы должно иметь два или более общих атома с другим кольцом системы. Все участники кольца должны быть прикреплены между собой за счет неионогенной связи. Полициклокольцевая система представляет собой обычно только часть соединения.Отступы, такие как бицикло и трицикло ограничивают количество колец или циклов в полицикло система колец ровно к двум кольцам и трем кольцам соответственно. Для полициклосистем, имеющих мосты, система рассматривается как состоит только из наименьшего числа самых маленьких колец, которые будут учитывают все атомы и валентности. Это соответствует номенклатуре используется The Ring Index, второе издание (1960). Пример использования этой системы номенклатуры показано на рисунках 9 и 10, на которых показаны два разных возможных способа представления одно и то же соединение.

Рисунок 9 Рисунок 9
Рисунок 10Представленное соединение следует рассматривать как A (C 4 N-C 4 N-C 2 O) трициклосистема, как на рисунке 9, а не как (C 4 N-C 4 NO-C 2 O) система трицикло, как, возможно, показано на рисунке 10. Прежняя интерпретация это тот, у которого наименьшее количество самых маленьких колец, что составляет все атомы и валентности.
Проиллюстрирован еще один пример принципа, изложенного выше. соединением на рисунке 11, которое рассматривается как бициклосистема состоит из C 2 N 2 уплотнительного кольца и уплотнительное кольцо C 4 ; это не считается диазином кольцо для классификации.
Рисунок 11
Другим примером является 3-азабицикло[3.
 1.0]гексан,
показан на рисунке 12, который классифицируется как пирролидин с учетом
структура пятичленного кольца и трехчленного кольца, а
чем с пиперидинами, что потребовало бы считать его шестичленным
звенеть.
1.0]гексан,
показан на рисунке 12, который классифицируется как пирролидин с учетом
структура пятичленного кольца и трехчленного кольца, а
чем с пиперидинами, что потребовало бы считать его шестичленным
звенеть.Рисунок 12
Аналогично, структура, показанная на рисунке 13, считается представлять собой пентациклическую кольцевую систему, состоящую из трех шестичленных карбоциклических кольца, одно пятичленное гетерокольцо, состоящее из одного кольцевого кислорода и четыре атома углерода в кольце, и одно шестичленное кольцо, состоящее из одного азот в кольце и пять атомов углерода в кольце.
Рисунок 13
Соли бетаина иногда изображаются в виде кольцевых структур, например.г., как показано на рисунке 14.
Рисунок 14
Однако, рисунок 14 не является полициклической кольцевой системой, потому что неионная связь между атомами N и O отсутствует.
 Быть
рассматривается как гетерокольцо, неионная связь должна существовать между всеми
члены кольца. Связь между атомами N и O на рисунке
14 является ионным, и такое соединение классифицируется как представленное
Рисунок 15.
Быть
рассматривается как гетерокольцо, неионная связь должна существовать между всеми
члены кольца. Связь между атомами N и O на рисунке
14 является ионным, и такое соединение классифицируется как представленное
Рисунок 15.Рисунок 15
Конструкция типа, показанного на рисунке 16, считается быть полициклокольцевой системой, состоящей из пяти колец:
Рисунок 16
КОЛЬЦО ГЕТЕРОАТОМ
Этот термин обозначает азот, кислород, серу, селен или теллур как член кольца, т. е. как один из членов, образует гетерокольцо.
КОЛЬЦО АЗОТ
Этот термин означает, что азот является одним из членов, образуют кольцо. Азот, связанный непосредственно с кольцом, не является кольцевым азотом. Аналогично используются такие термины, как кольцевая сера и кольцевой кислород.
СИСТЕМА SPIRO и SPIRO RING
Эти термины обозначают совместное использование одного общего члена кольца только ровно двумя кольцами.
. Рисунок 17 двумя кольцами также используется третьим кольцом. Следующие две структуры, показанные на
На рис. 17 показаны спиросистемы:
Следующие две структуры, показанные на
На рис. 17 показаны спиросистемы:Рисунок 18
Общий кольцевой элемент должен быть присоединен к двум кольцевым элементам каждого из колец неионогенной связью, и неионогенная связь должна существуют между всеми членами кольца, чтобы кольцо было рассматривается как гетерокольцо.Таким образом, структуры, показанные на рисунках 19 и 20 исключены из категории «спирокольца». системы», потому что между атомами азота существует ионная связь гетероциклический атом и ациклический атом (атом кислорода в каждом случае) в образовании этих внутренних солей бетаина.
Рисунок 19
Рисунок 20
Эти две структуры будут рассмотрены и классифицированы в формы, изображенные соответственно на рисунках 21 и 22.

Рисунок 21
Рисунок 22
Химия углерода
Химия углерода настолько важна, что ей посвящена целая отрасль химии — органическая химия. Количество соединений, содержащих углерод, значительно превышает количество всех других соединений вместе взятых. Этот курс исследует, как преподавать особую природу углерода, некоторые важные классы соединений, которые он образует, и их наиболее важные реакции.Это поможет вам помочь вашим ученикам понять, как сложность этих соединений приводит к вариациям молекулярных структур и пространственному расположению атомов — теме изомерии — и как мы можем использовать различные методы, чтобы узнать больше об этих структурах. Темы, которые учащиеся традиционно считают трудными, такие как механизмы реакции, подробно раскрываются, а ресурсы анализируются, чтобы дать конкретные подходы к помощи учащимся в классе.

Пройдя этот курс, вы сможете:
- уверенно преподавать ключевые аспекты химии углерода.
- помочь учащимся понять и представить структуры соединений углерода;
- уверенно знакомить учащихся с функциональными группами, их основными специфическими реакциями и принципами реакций с участием соединений углерода;
- помочь учащимся объяснить факторы, которые приводят к изменению физических свойств соединений углерода;
- уверенно преподают об органическом синтезе и методах определения строения соединений углерода.
Загрузите свой план разработки курса, чтобы вести учет своего обучения и развития.
Бесплатный курс для зарегистрированных пользователей Этот курс требует, чтобы вы вошли в систему с вашим идентификатором RSC для полного доступа.

Классификация элементов и соединений | Химия
3.4: Классификация элементов и соединений
Чистые вещества состоят только из одного вида материи. Чистое вещество может быть элементом или соединением. Элемент состоит только из одного типа атомов, в то время как соединение состоит из двух или более типов атомов, связанных друг с другом химической связью. Элементы классифицируются как атомарные или молекулярные в зависимости от природы их основных единиц.
Соединения — это чистые вещества, состоящие из двух или более элементов в фиксированных, определенных пропорциях.Соединения классифицируются как ионные или молекулярные (ковалентные) в зависимости от присутствующих в них связей.
Молекулярные соединения
Молекулярные соединения (или ковалентные соединения) возникают, когда два или более различных атома неметалла используют общие электроны для образования ковалентных связей.
 Основными единицами молекулярных соединений являются дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, монооксид углерода молекулярного соединения состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода.Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны.
Основными единицами молекулярных соединений являются дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, монооксид углерода молекулярного соединения состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода.Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны.Молекулярные соединения можно идентифицировать по их физическим свойствам. В нормальных условиях молекулярные соединения часто существуют в виде газов, легкокипящих жидкостей и легкоплавких твердых тел, хотя существуют и исключения.
Ионные соединения
Когда элемент, состоящий из атомов, легко отдающих электроны (металл), реагирует с элементом, состоящим из атомов, которые легко отдают электроны (неметалл), обычно происходит перенос электронов с образованием ионов.Соединение, образующееся в результате этого переноса, стабилизируется за счет электростатического притяжения (ионных связей) между ионами противоположного заряда, присутствующими в соединении.
 Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон с образованием катиона натрия, Na + , а каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон к образуют анион хлорида, Cl — , полученное соединение, NaCl, состоит из ионов натрия и ионов хлорида в соотношении один ион Na + на каждый ион Cl — .
Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон с образованием катиона натрия, Na + , а каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон к образуют анион хлорида, Cl — , полученное соединение, NaCl, состоит из ионов натрия и ионов хлорида в соотношении один ион Na + на каждый ион Cl — .Соединение, которое содержит ионы и удерживается вместе ионными связями, называется ионным соединением. Ионные соединения представляют собой твердые вещества, которые обычно плавятся при высоких температурах и кипят при еще более высоких температурах. В твердой форме ионное соединение не является электропроводным, поскольку его ионы не могут течь. Однако в расплавленном состоянии он может проводить электричество, поскольку его ионы могут свободно перемещаться в жидкости.
В каждом ионном соединении общее количество положительных зарядов катионов равно общему количеству отрицательных зарядов анионов.
 Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.
Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.Многие ионные соединения содержат многоатомные ионы в виде катиона, аниона или того и другого. Как и в случае с простыми ионными соединениями, эти соединения также должны быть электрически нейтральными, поэтому их формулы можно предсказать, рассматривая многоатомные ионы как отдельные единицы. Мы используем круглые скобки в формуле, чтобы указать группу атомов, которые ведут себя как единое целое. Например, формула фосфата кальция, одного из минералов в наших костях, такова: Ca 3 (PO 4 ) 2 .Эта формула показывает, что на каждые две фосфатные группы (PO 4 ) 3− приходится три иона кальция (Ca 2+ ). Группы (PO 4 ) 3− представляют собой дискретные единицы, каждая из которых состоит из одного атома фосфора и четырех атомов кислорода и имеет общий заряд 3–. Соединение электрически нейтрально, и его формула показывает общее количество трех атомов Ca, двух атомов P и восьми атомов O.

Этот текст взят из Openstax, Chemistry 2e, Section 2.6: Молекулярные и ионные соединения.
Органическая химия – обзор
1.01.2.1 Высшая школа
Органическая химия является основой медицинской химии. Мне очень повезло, что профессор Уильям С. Джонсон из Висконсинского университета в Мэдисоне принял меня в качестве аспиранта в 1946 году. Моя докторская диссертация касалась полного синтеза натуральных продуктов, и целью был стероид. Мои знания в области полного синтеза натуральных продуктов сделали меня привлекательным кандидатом для работы в фармацевтической промышленности по причинам, которые остались традицией, широко принятой в крупных фармацевтических компаниях, но не в биотехнологических компаниях.Привлекательность натурального продукта как синтетической цели отчасти заключается в том, что цель была установлена природой, что придает ей ауру легитимности. Наиболее сложная часть в синтезе сложного природного продукта часто связана с ретросинтетическим анализом его синтеза, который обычно определяется главным профессором, а не студентом или докторантом.
 Сменявшие друг друга руководители отделов медицинской химии в крупных фармацевтических компаниях обучались полному синтезу натуральных продуктов, и они, в свою очередь, как правило, отдавали предпочтение кандидатам с аналогичным опытом, когда делали предложения о работе.Это предпочтение имеет тенденцию становиться самореализующимся предложением.
Сменявшие друг друга руководители отделов медицинской химии в крупных фармацевтических компаниях обучались полному синтезу натуральных продуктов, и они, в свою очередь, как правило, отдавали предпочтение кандидатам с аналогичным опытом, когда делали предложения о работе.Это предпочтение имеет тенденцию становиться самореализующимся предложением.Природа накопила опыт в использовании таких реакций, как альдольная конденсация и других, и они используются неоднократно. Отчасти благодаря этому химики могут полагаться на объемы литературы, посвященной этим реакциям. Безусловно, в любом синтезе натуральных продуктов будет один или несколько шагов, требующих творческого подхода, которые в конечном итоге определят разницу между успехом и неудачей.
Ситуация совершенно иная при синтезе ненатуральных продуктов, которые в настоящее время обычно разрабатываются для проявления заранее определенных физических, химических или биологических свойств.Уровень техники может быть незначительным или вообще отсутствовать, чтобы направлять синтез.
 Позвольте мне привести один пример: мой коллега из Пенсильванского университета, профессор Амос Б. Смит, III, признанный лидер в области полного синтеза натуральных продуктов, и я инициировали в 1988 году программу по разработке и синтезу ингибиторов протеолитических ферментов с использованием основанных на пирролиноне соединений. имитаторы аминокислот. Интересно, что хиральные миметики аминокислот на основе пирролинона не были описаны. Усилия оказались полезными, поскольку они привели к ингибитору протеазы ВИЧ-1, который имеет лучшие фармакокинетические свойства, чем его пептидный предшественник, как потому, что пирролиновые связи стабильны по отношению к протеазам, так и потому, что транспорт через мембраны требует меньшего штрафа за десольватацию. 2 Также сообщалось о рентгеновской кристаллической структуре комплекса фермент-ингибитор. 2 В недавней публикации Smith et al. сообщил о «полном синтезе» неестественного тетрапирролинона, имитирующего β-поворот пептидного гормона соматостатина.
Позвольте мне привести один пример: мой коллега из Пенсильванского университета, профессор Амос Б. Смит, III, признанный лидер в области полного синтеза натуральных продуктов, и я инициировали в 1988 году программу по разработке и синтезу ингибиторов протеолитических ферментов с использованием основанных на пирролиноне соединений. имитаторы аминокислот. Интересно, что хиральные миметики аминокислот на основе пирролинона не были описаны. Усилия оказались полезными, поскольку они привели к ингибитору протеазы ВИЧ-1, который имеет лучшие фармакокинетические свойства, чем его пептидный предшественник, как потому, что пирролиновые связи стабильны по отношению к протеазам, так и потому, что транспорт через мембраны требует меньшего штрафа за десольватацию. 2 Также сообщалось о рентгеновской кристаллической структуре комплекса фермент-ингибитор. 2 В недавней публикации Smith et al. сообщил о «полном синтезе» неестественного тетрапирролинона, имитирующего β-поворот пептидного гормона соматостатина. По нынешним стандартам, и особенно по собственным стандартам Смита, это не внушительное сооружение. Однако синтез, включая подготовку необходимых неестественных строительных блоков, включал около 53 шагов и требовал 46 человеко-месяцев.Синтез каждого из четырех строительных блоков, имитирующих аминокислоты, потребовал около 11 стадий, хотя только один из пирролинонов содержал функциональную боковую цепь. Таким образом, полный синтез ненатуральных продуктов может быть сложной задачей. Кроме того, полный синтез ненатурального продукта не может быть опубликован, если он не обладает заранее определенными физическими и/или биологическими свойствами. Наконец, при полном синтезе натуральных продуктов достаточно очень небольшого количества материала, чтобы установить идентичность с натуральным продуктом.В случае ненатуральных продуктов может потребоваться значительное количество материала, чтобы определить, обладает ли вещество желаемыми свойствами. По этим причинам я считаю, что полный синтез натуральных продуктов больше не следует рассматривать как единственное подходящее обучение для потенциальных сотрудников большой фармы.
По нынешним стандартам, и особенно по собственным стандартам Смита, это не внушительное сооружение. Однако синтез, включая подготовку необходимых неестественных строительных блоков, включал около 53 шагов и требовал 46 человеко-месяцев.Синтез каждого из четырех строительных блоков, имитирующих аминокислоты, потребовал около 11 стадий, хотя только один из пирролинонов содержал функциональную боковую цепь. Таким образом, полный синтез ненатуральных продуктов может быть сложной задачей. Кроме того, полный синтез ненатурального продукта не может быть опубликован, если он не обладает заранее определенными физическими и/или биологическими свойствами. Наконец, при полном синтезе натуральных продуктов достаточно очень небольшого количества материала, чтобы установить идентичность с натуральным продуктом.В случае ненатуральных продуктов может потребоваться значительное количество материала, чтобы определить, обладает ли вещество желаемыми свойствами. По этим причинам я считаю, что полный синтез натуральных продуктов больше не следует рассматривать как единственное подходящее обучение для потенциальных сотрудников большой фармы.
Моей первой синтетической целью, когда я был аспирантом в Мэдисоне, был эстрон. Поскольку профессора Уильям С. Джонсон и Альфред Л. Уайлдс были признанными лидерами в синтезе стероидов, они были быстро проинформированы о потрясающих результатах, полученных доктором Филипом Хенчем в клинике Майо в первом клиническом испытании кортизона в апреле 1949 года.Поэтому профессор Джонсон переключил меня с полного синтеза эстрона на синтез кортизона. Мне сказали только, что кортизон «что-то сделал» в клинике. Оглядываясь назад, я удивляюсь, что больше не задал своему наставнику никаких вопросов. Профессор Джонсон остается для меня идеальным главным профессором из-за его этических и научных стандартов, его преданности исследованиям и своим ученикам, а также благодаря его творчеству. Будучи выпускником Оберлинского колледжа, я прошел сравнительно немного курсов по химии.Поэтому, будучи аспирантом первого курса в Мэдисоне, я был обеспокоен тем, смогу ли я конкурировать с однокурсниками из более крупных университетов, которые потратили гораздо больше часов на химию.
 Это беспокойство, однако, не оказалось проблемой, предполагая, возможно, что существует не так много химии, которую можно усвоить на уровне бакалавриата. Более того, доктор Джонсон был терпим к любому, кто хотел находиться в лаборатории по вечерам и в выходные дни. Мне также очень повезло, что в моей лаборатории обучались как профессор Джонсон, так и профессор Альфред Л.Дикие земли. Профессор Уайлдс любезно проявил интерес к моей подготовке и внес значительный вклад в мое образование. Сегодняшнему читателю этого учебника будет трудно понять, что в 1950 году, когда я получил докторскую степень в Университете Висконсина, спектроскопия ядерного магнитного резонанса (ЯМР) была неизвестна, а в Мэдисоне не было возможностей инфракрасного спектра. Меня всегда поражало, что в начале двадцатого века структура стероидов, как скелета, так и заместителей, была выяснена в результате очень напряженной и блестящей работы с использованием таких ничем не примечательных реагентов, как перманганат калия и уксусный ангидрид.
Это беспокойство, однако, не оказалось проблемой, предполагая, возможно, что существует не так много химии, которую можно усвоить на уровне бакалавриата. Более того, доктор Джонсон был терпим к любому, кто хотел находиться в лаборатории по вечерам и в выходные дни. Мне также очень повезло, что в моей лаборатории обучались как профессор Джонсон, так и профессор Альфред Л.Дикие земли. Профессор Уайлдс любезно проявил интерес к моей подготовке и внес значительный вклад в мое образование. Сегодняшнему читателю этого учебника будет трудно понять, что в 1950 году, когда я получил докторскую степень в Университете Висконсина, спектроскопия ядерного магнитного резонанса (ЯМР) была неизвестна, а в Мэдисоне не было возможностей инфракрасного спектра. Меня всегда поражало, что в начале двадцатого века структура стероидов, как скелета, так и заместителей, была выяснена в результате очень напряженной и блестящей работы с использованием таких ничем не примечательных реагентов, как перманганат калия и уксусный ангидрид. Таким образом, чтение истории ранних исследований стероидов всегда оказывало на меня очень унизительное воздействие. Я считаю, что это печально, что современные учебники, а часто и классные лекции по органической химии, вообще стали бесчеловечными. Утверждается, что так многому нужно научиться, что нет ни времени, ни места, чтобы назвать имена химиков, на чьих плечах мы стоим. Возможно, так, но, на мой взгляд, мы платим высокую цену за эту исключительную заботу о «фактах» за счет нашего бесценного научного наследия.
Таким образом, чтение истории ранних исследований стероидов всегда оказывало на меня очень унизительное воздействие. Я считаю, что это печально, что современные учебники, а часто и классные лекции по органической химии, вообще стали бесчеловечными. Утверждается, что так многому нужно научиться, что нет ни времени, ни места, чтобы назвать имена химиков, на чьих плечах мы стоим. Возможно, так, но, на мой взгляд, мы платим высокую цену за эту исключительную заботу о «фактах» за счет нашего бесценного научного наследия.В 1940-х годах ультрафиолетовая спектроскопия хорошо зарекомендовала себя как инструмент спектроскопии, но ее ценность для химиков-органиков была поставлена под сомнение. Заметным исключением был профессор Уайлдс. Поскольку он был очень щедр на свое время, УФ-спектроскопия внесла значительный вклад в мою кандидатскую диссертацию. Например, я смог использовать это обучение, чтобы обнаружить, что перегруппировка двойной связи произошла на этапе омыления в полном синтезе эквиленина профессором Джонсоном, что привело к переходу двойной связи из сопряжения со сложным эфиром/кислотой в сопряжение.
 с кетоном.Я был так взволнован этим открытием, что ожидал, что мир остановится, как только новости станут известны. Это оказалось не так! Более того, одного химика-физика из моей экзаменационной комиссии позабавило, что химик-органик-синтетик серьезно относится к УФ-спектрам. Только гораздо позже, когда я поступил на факультет Пенсильванского университета, я понял, что немногие, даже хорошо подготовленные химики-органики, оптимально используют УФ-спектроскопию. Приведу лишь один пример: немногие химики-медики используют УФ-спектроскопию для определения точной концентрации испытуемого соединения в водном растворе перед биологическим анализом.Меня также забавляет, когда аспиранты записываются на время ЯМР, в то время как УФ-спектр сразу же предоставил бы нужную информацию.
с кетоном.Я был так взволнован этим открытием, что ожидал, что мир остановится, как только новости станут известны. Это оказалось не так! Более того, одного химика-физика из моей экзаменационной комиссии позабавило, что химик-органик-синтетик серьезно относится к УФ-спектрам. Только гораздо позже, когда я поступил на факультет Пенсильванского университета, я понял, что немногие, даже хорошо подготовленные химики-органики, оптимально используют УФ-спектроскопию. Приведу лишь один пример: немногие химики-медики используют УФ-спектроскопию для определения точной концентрации испытуемого соединения в водном растворе перед биологическим анализом.Меня также забавляет, когда аспиранты записываются на время ЯМР, в то время как УФ-спектр сразу же предоставил бы нужную информацию.Помимо профессоров Джонсона и Уайлдса, я также получил большую пользу от курса профессора Сэмюэля МакЭлвейна о роли электронных понятий в органической химии, разработанном Лоури, Косселем, Ремиком, Ингольдом и другими.
 В сочетании с исследованием H.C. Брауна о стерических эффектах, два столпа медицинской химии двадцатого века были на месте.Наконец, для меня было привилегией пройти курс профессора Гомера Адкинса по продвинутой органической химии. Он был единственным профессором, которого я встречал, который преподавал философию науки, подчеркивая скептицизм, воплощенный в его наблюдении, что «логика — это организованный способ с уверенностью идти не так».
В сочетании с исследованием H.C. Брауна о стерических эффектах, два столпа медицинской химии двадцатого века были на месте.Наконец, для меня было привилегией пройти курс профессора Гомера Адкинса по продвинутой органической химии. Он был единственным профессором, которого я встречал, который преподавал философию науки, подчеркивая скептицизм, воплощенный в его наблюдении, что «логика — это организованный способ с уверенностью идти не так».Понимание названий органических соединений
Если вам нужно было назвать это самостоятельно:
Откуда вы знаете, в каком порядке следует писать различные алкильные группы в начале названия? Условие состоит в том, что вы пишете их в алфавитном порядке, поэтому этил предшествует метилу, который, в свою очередь, предшествует пропилу.
Циклоалканы
В циклоалкане атомы углерода объединены в кольцо — отсюда цикло .
Пример: Напишите структурную формулу циклогексана .

гексан показывает 6 атомов углерода без углерод-углеродных двойных связей. цикло показывает, что они в кольце. Нарисовав кольцо и вставив правильное количество атомов водорода, чтобы удовлетворить требования к связыванию атомов углерода, мы получим:
Алкены
Пример 1: Напишите структурную формулу пропилена .
prop подсчитывает 3 атома углерода в самой длинной цепи. en говорит вам, что существует двойная углерод-углеродная связь. Это означает, что углеродный скелет выглядит так:
Добавление водорода дает:
Пример 2: Напишите структурную формулу бут-1-ена .
, но подсчитывает 4 атома углерода в самой длинной цепи, а en говорит вам, что существует двойная углерод-углеродная связь.
 Число в названии говорит вам, где двойная связь начинается с .
Число в названии говорит вам, где двойная связь начинается с .В приведенном выше примере с пропиленом номер не нужен, потому что двойная связь должна начинаться с одного из концевых атомов углерода. Однако в случае бутена двойная связь может быть либо в конце цепи, либо в середине, поэтому название должно кодировать ее положение.
Углеродный скелет:
И полная структура:
Между прочим, вы с таким же успехом могли бы решить, что правый углерод был углеродом номер 1, и изобразить структуру как:Пример 3: Напишите структурную формулу 3-метилгекс-2-ена .
Самая длинная цепь имеет 6 атомов углерода ( hex ) с двойной связью, начинающейся со второго ( -2-en ).
Но на этот раз метильная группа присоединена к цепи на атоме углерода номер 3, что дает вам основную структуру:
Добавление атомов водорода дает окончательную структуру:
Будьте очень внимательны, считая связи вокруг каждого атома углерода, когда вы вставляете атомы водорода.
 На этот раз было бы очень легко сделать ошибку, написав букву Н после третьего атома углерода, но это дало бы этому углероду всего 5 связей.
На этот раз было бы очень легко сделать ошибку, написав букву Н после третьего атома углерода, но это дало бы этому углероду всего 5 связей.Соединения, содержащие галогены
Пример 1: Напишите структурную формулу 1,1,1-трихлорэтана .
Это двухуглеродная цепь ( eth ) без двойных связей ( и ). На первый атом углерода приходится три атома хлора.
Пример 2: Напишите структурную формулу 2-бром-2-метилпропана .
Сначала разберитесь с углеродным скелетом. Это трехуглеродная цепь без двойных связей и метильная группа на втором атоме углерода.
Нарисуйте атом брома, который также находится на втором атоме углерода.
И, наконец, вставьте атомы водорода.
Если вам нужно было назвать это самостоятельно:
Обратите внимание, что вся углеводородная часть названия написана вместе — как метилпропан — прежде чем вы начнете добавлять к названию что-либо еще.

Пример 2: Напишите структурную формулу 1-йод-3-метилпент-2-ен .
На этот раз самая длинная цепь состоит из 5 атомов углерода ( пентаграммы ), но имеет двойную связь, начинающуюся с атома углерода номер 2. Существует также метильная группа на углероде номер 3.
Теперь нарисуйте йод на углероде номер 1.
Придание окончательной структуры:
.

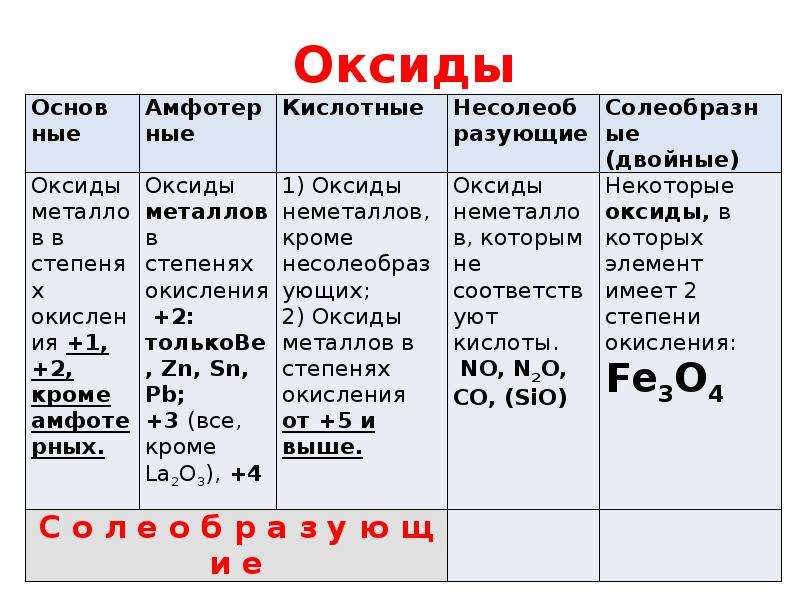
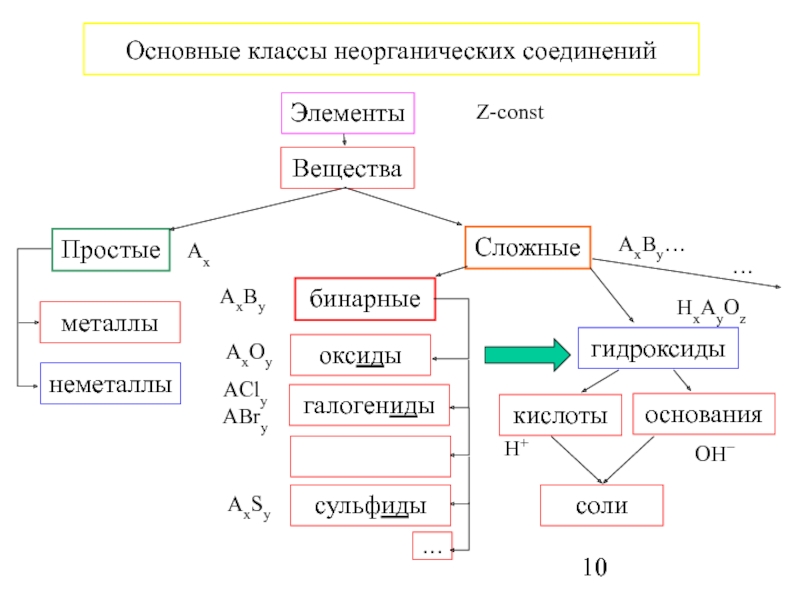 Это будет иметь место для классов, которые традиционно интерпретируются в соответствии с их историческими биологическими, биофизическими или другими производными характеристиками, такими как, например, моносахариды, липиды, стероиды или монотерпены. Часто в терминологии этих составных классов используется форма множественного числа «s».
Это будет иметь место для классов, которые традиционно интерпретируются в соответствии с их историческими биологическими, биофизическими или другими производными характеристиками, такими как, например, моносахариды, липиды, стероиды или монотерпены. Часто в терминологии этих составных классов используется форма множественного числа «s». Очевидно, что классы «карбоновые кислоты» и «производные карбоновых кислот» находятся на одном иерархическом уровне.
Очевидно, что классы «карбоновые кислоты» и «производные карбоновых кислот» находятся на одном иерархическом уровне.
 Класс 521 (ионообменные полимеры, сотовые продукты, отходы
восстановление полимера)
Класс 521 (ионообменные полимеры, сотовые продукты, отходы
восстановление полимера) Класс 540/1 (гетероциклические соединения углерода: циклопентаногидрофенантрен
Содержащие четырехчленные лактамы, порфирины, азапорфирины, гетероген азота
Кольца с семью или более гетероатомами)
Класс 540/1 (гетероциклические соединения углерода: циклопентаногидрофенантрен
Содержащие четырехчленные лактамы, порфирины, азапорфирины, гетероген азота
Кольца с семью или более гетероатомами) Класс 260/665R (Соединения углерод-легкие металлы)
Класс 260/665R (Соединения углерод-легкие металлы)
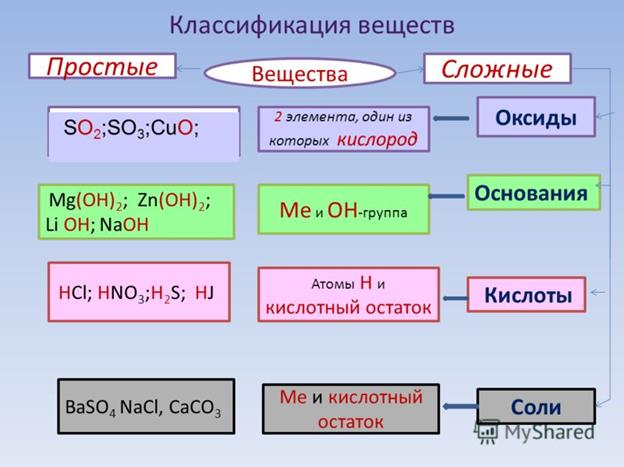

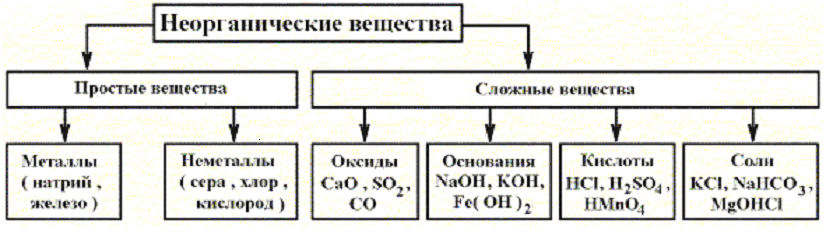 , или (c) пример
использования определенной соли, например, при лечении животных.
Другие перекрестные ссылки солей, например, входящие в состав
списка в раскрытии является необязательным и должен быть сделан только тогда, когда
явно полезно.
, или (c) пример
использования определенной соли, например, при лечении животных.
Другие перекрестные ссылки солей, например, входящие в состав
списка в раскрытии является необязательным и должен быть сделан только тогда, когда
явно полезно. КЛАССИФИКАЦИЯ СОЕДИНЕНИЙ НЕИЗВЕСТНОЙ СТРУКТУРЫ, ВХОДЯЩИХ В ЭТОТ
СЕРИИ ИЛИ КЛАССЫ.
КЛАССИФИКАЦИЯ СОЕДИНЕНИЙ НЕИЗВЕСТНОЙ СТРУКТУРЫ, ВХОДЯЩИХ В ЭТОТ
СЕРИИ ИЛИ КЛАССЫ.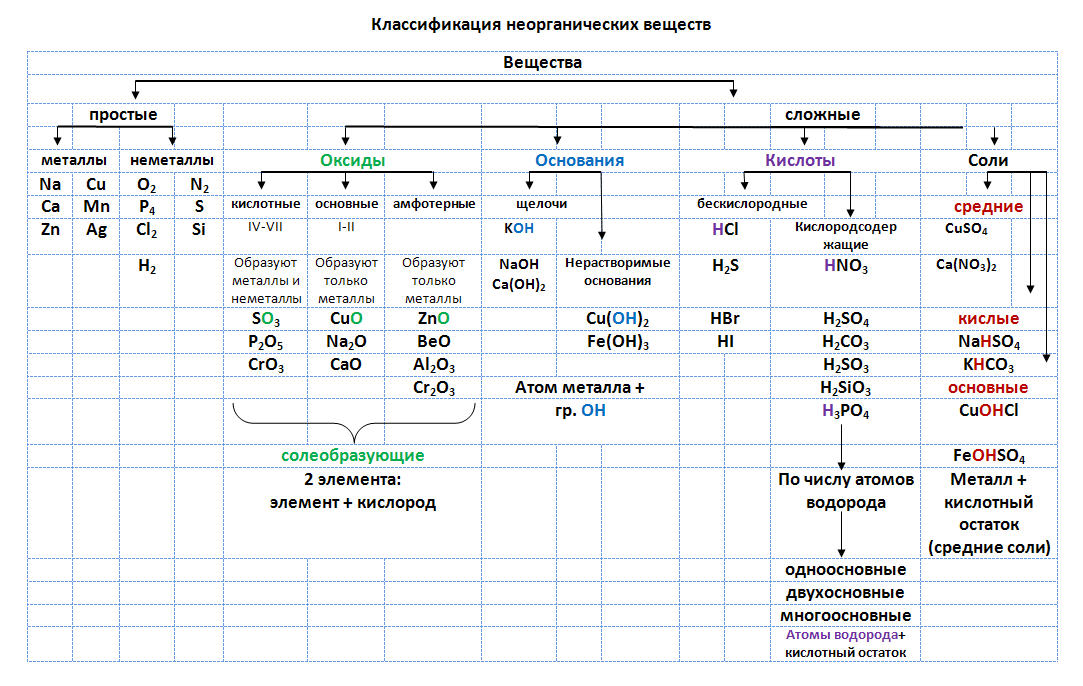 в классе 546, подклассе 1, исходя из предположения, что алкалоиды обычно
включают кольцо, состоящее из одного атома азота и пяти атомов углерода.
в классе 546, подклассе 1, исходя из предположения, что алкалоиды обычно
включают кольцо, состоящее из одного атома азота и пяти атомов углерода.
 подвергается химической обработке в целом (где вся смесь ведет себя
в реакции в виде соединения) полученный продукт будет по-прежнему
быть классифицированы в серии 532-570.(См. 5 и 9 ниже).
подвергается химической обработке в целом (где вся смесь ведет себя
в реакции в виде соединения) полученный продукт будет по-прежнему
быть классифицированы в серии 532-570.(См. 5 и 9 ниже).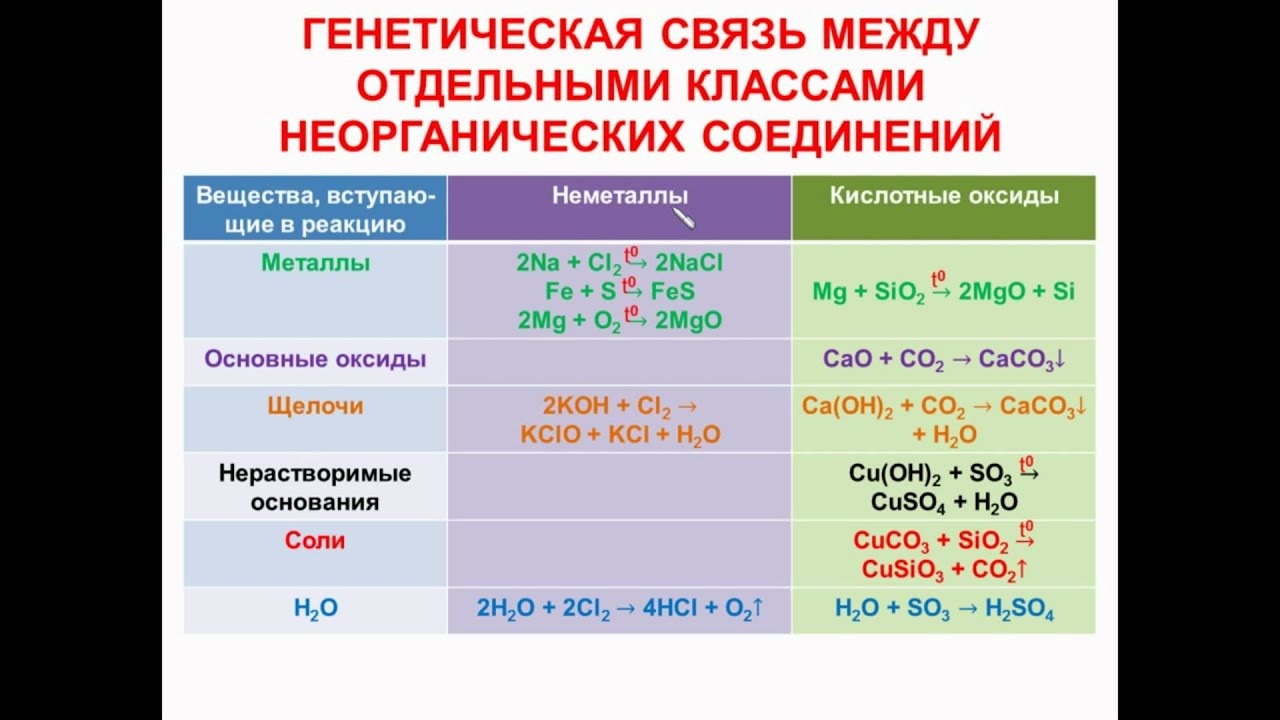 (См. 1, выше.).
(См. 1, выше.).

 подклассы 98+ для гелей), даже если не заявлено об использовании
или раскрыты.
подклассы 98+ для гелей), даже если не заявлено об использовании
или раскрыты.
 То
соединения на рисунке 3 показывают кислород, присоединенный к гетероциклу
ациклическая связь. Обратите внимание, что серосодержащее соединение также имеет азот
и сера присоединена к гетерокольцу ациклической связью.
То
соединения на рисунке 3 показывают кислород, присоединенный к гетероциклу
ациклическая связь. Обратите внимание, что серосодержащее соединение также имеет азот
и сера присоединена к гетерокольцу ациклической связью.


 Цепь может иметь заместители, но заместители не являются частью
цепи.
Цепь может иметь заместители, но заместители не являются частью
цепи.



 Два типичных соединения, которые можно было бы классифицировать
в таком подклассе показаны на рисунке 5.
Два типичных соединения, которые можно было бы классифицировать
в таком подклассе показаны на рисунке 5.
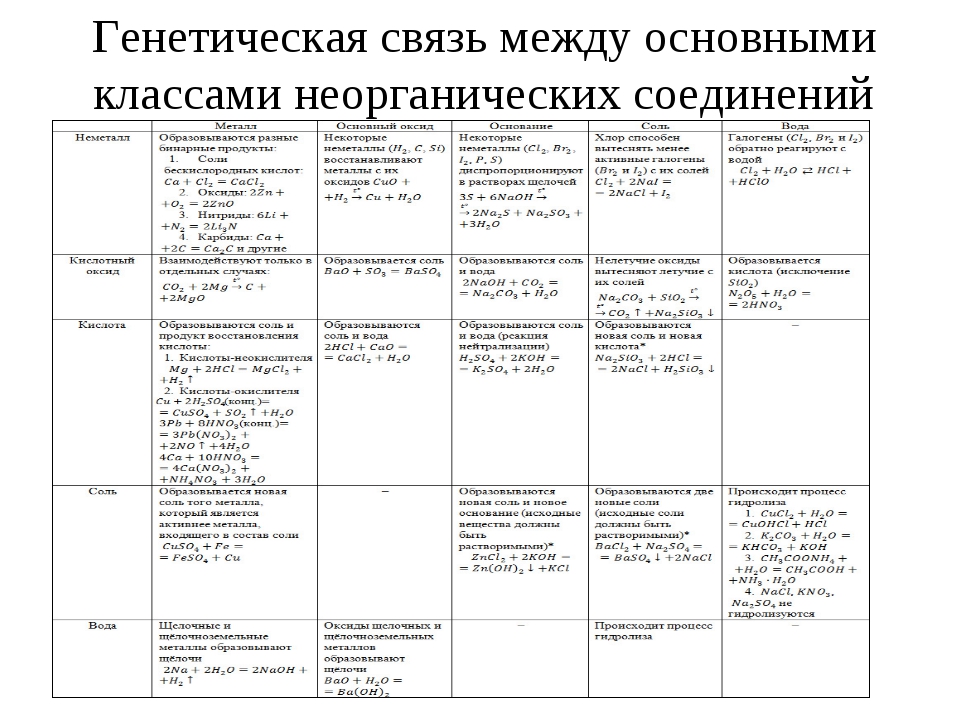 1.0]гексан,
показан на рисунке 12, который классифицируется как пирролидин с учетом
структура пятичленного кольца и трехчленного кольца, а
чем с пиперидинами, что потребовало бы считать его шестичленным
звенеть.
1.0]гексан,
показан на рисунке 12, который классифицируется как пирролидин с учетом
структура пятичленного кольца и трехчленного кольца, а
чем с пиперидинами, что потребовало бы считать его шестичленным
звенеть. Быть
рассматривается как гетерокольцо, неионная связь должна существовать между всеми
члены кольца. Связь между атомами N и O на рисунке
14 является ионным, и такое соединение классифицируется как представленное
Рисунок 15.
Быть
рассматривается как гетерокольцо, неионная связь должна существовать между всеми
члены кольца. Связь между атомами N и O на рисунке
14 является ионным, и такое соединение классифицируется как представленное
Рисунок 15.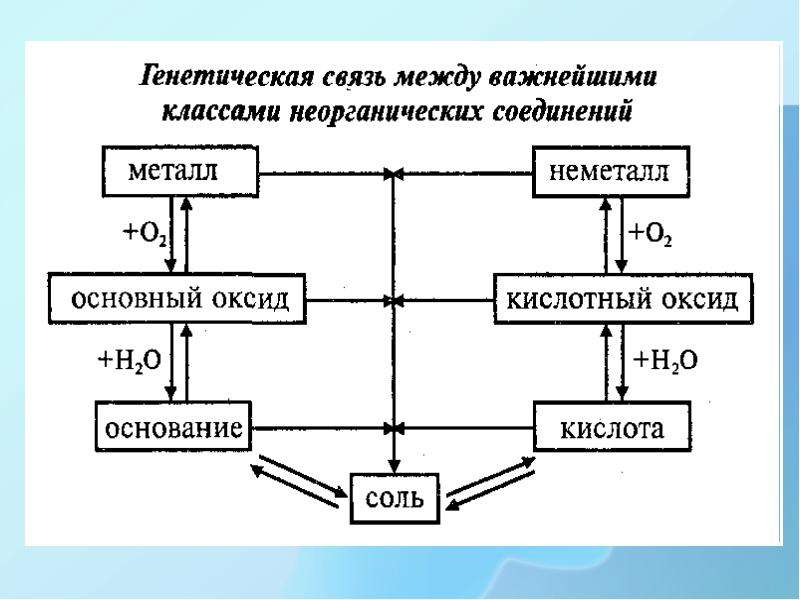 Следующие две структуры, показанные на
На рис. 17 показаны спиросистемы:
Следующие две структуры, показанные на
На рис. 17 показаны спиросистемы:


 Основными единицами молекулярных соединений являются дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, монооксид углерода молекулярного соединения состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода.Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны.
Основными единицами молекулярных соединений являются дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, монооксид углерода молекулярного соединения состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода.Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны. Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон с образованием катиона натрия, Na + , а каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон к образуют анион хлорида, Cl — , полученное соединение, NaCl, состоит из ионов натрия и ионов хлорида в соотношении один ион Na + на каждый ион Cl — .
Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон с образованием катиона натрия, Na + , а каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон к образуют анион хлорида, Cl — , полученное соединение, NaCl, состоит из ионов натрия и ионов хлорида в соотношении один ион Na + на каждый ион Cl — . Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.
Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.
 Сменявшие друг друга руководители отделов медицинской химии в крупных фармацевтических компаниях обучались полному синтезу натуральных продуктов, и они, в свою очередь, как правило, отдавали предпочтение кандидатам с аналогичным опытом, когда делали предложения о работе.Это предпочтение имеет тенденцию становиться самореализующимся предложением.
Сменявшие друг друга руководители отделов медицинской химии в крупных фармацевтических компаниях обучались полному синтезу натуральных продуктов, и они, в свою очередь, как правило, отдавали предпочтение кандидатам с аналогичным опытом, когда делали предложения о работе.Это предпочтение имеет тенденцию становиться самореализующимся предложением. Позвольте мне привести один пример: мой коллега из Пенсильванского университета, профессор Амос Б. Смит, III, признанный лидер в области полного синтеза натуральных продуктов, и я инициировали в 1988 году программу по разработке и синтезу ингибиторов протеолитических ферментов с использованием основанных на пирролиноне соединений. имитаторы аминокислот. Интересно, что хиральные миметики аминокислот на основе пирролинона не были описаны. Усилия оказались полезными, поскольку они привели к ингибитору протеазы ВИЧ-1, который имеет лучшие фармакокинетические свойства, чем его пептидный предшественник, как потому, что пирролиновые связи стабильны по отношению к протеазам, так и потому, что транспорт через мембраны требует меньшего штрафа за десольватацию. 2 Также сообщалось о рентгеновской кристаллической структуре комплекса фермент-ингибитор. 2 В недавней публикации Smith et al. сообщил о «полном синтезе» неестественного тетрапирролинона, имитирующего β-поворот пептидного гормона соматостатина.
Позвольте мне привести один пример: мой коллега из Пенсильванского университета, профессор Амос Б. Смит, III, признанный лидер в области полного синтеза натуральных продуктов, и я инициировали в 1988 году программу по разработке и синтезу ингибиторов протеолитических ферментов с использованием основанных на пирролиноне соединений. имитаторы аминокислот. Интересно, что хиральные миметики аминокислот на основе пирролинона не были описаны. Усилия оказались полезными, поскольку они привели к ингибитору протеазы ВИЧ-1, который имеет лучшие фармакокинетические свойства, чем его пептидный предшественник, как потому, что пирролиновые связи стабильны по отношению к протеазам, так и потому, что транспорт через мембраны требует меньшего штрафа за десольватацию. 2 Также сообщалось о рентгеновской кристаллической структуре комплекса фермент-ингибитор. 2 В недавней публикации Smith et al. сообщил о «полном синтезе» неестественного тетрапирролинона, имитирующего β-поворот пептидного гормона соматостатина.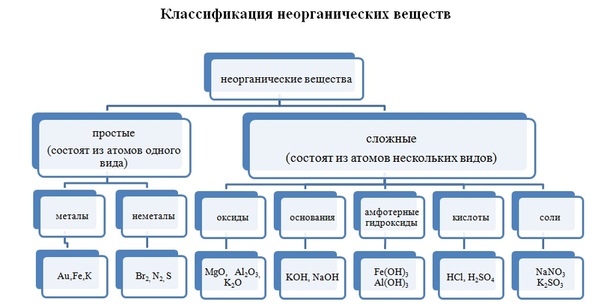 По нынешним стандартам, и особенно по собственным стандартам Смита, это не внушительное сооружение. Однако синтез, включая подготовку необходимых неестественных строительных блоков, включал около 53 шагов и требовал 46 человеко-месяцев.Синтез каждого из четырех строительных блоков, имитирующих аминокислоты, потребовал около 11 стадий, хотя только один из пирролинонов содержал функциональную боковую цепь. Таким образом, полный синтез ненатуральных продуктов может быть сложной задачей. Кроме того, полный синтез ненатурального продукта не может быть опубликован, если он не обладает заранее определенными физическими и/или биологическими свойствами. Наконец, при полном синтезе натуральных продуктов достаточно очень небольшого количества материала, чтобы установить идентичность с натуральным продуктом.В случае ненатуральных продуктов может потребоваться значительное количество материала, чтобы определить, обладает ли вещество желаемыми свойствами. По этим причинам я считаю, что полный синтез натуральных продуктов больше не следует рассматривать как единственное подходящее обучение для потенциальных сотрудников большой фармы.
По нынешним стандартам, и особенно по собственным стандартам Смита, это не внушительное сооружение. Однако синтез, включая подготовку необходимых неестественных строительных блоков, включал около 53 шагов и требовал 46 человеко-месяцев.Синтез каждого из четырех строительных блоков, имитирующих аминокислоты, потребовал около 11 стадий, хотя только один из пирролинонов содержал функциональную боковую цепь. Таким образом, полный синтез ненатуральных продуктов может быть сложной задачей. Кроме того, полный синтез ненатурального продукта не может быть опубликован, если он не обладает заранее определенными физическими и/или биологическими свойствами. Наконец, при полном синтезе натуральных продуктов достаточно очень небольшого количества материала, чтобы установить идентичность с натуральным продуктом.В случае ненатуральных продуктов может потребоваться значительное количество материала, чтобы определить, обладает ли вещество желаемыми свойствами. По этим причинам я считаю, что полный синтез натуральных продуктов больше не следует рассматривать как единственное подходящее обучение для потенциальных сотрудников большой фармы.
 Это беспокойство, однако, не оказалось проблемой, предполагая, возможно, что существует не так много химии, которую можно усвоить на уровне бакалавриата. Более того, доктор Джонсон был терпим к любому, кто хотел находиться в лаборатории по вечерам и в выходные дни. Мне также очень повезло, что в моей лаборатории обучались как профессор Джонсон, так и профессор Альфред Л.Дикие земли. Профессор Уайлдс любезно проявил интерес к моей подготовке и внес значительный вклад в мое образование. Сегодняшнему читателю этого учебника будет трудно понять, что в 1950 году, когда я получил докторскую степень в Университете Висконсина, спектроскопия ядерного магнитного резонанса (ЯМР) была неизвестна, а в Мэдисоне не было возможностей инфракрасного спектра. Меня всегда поражало, что в начале двадцатого века структура стероидов, как скелета, так и заместителей, была выяснена в результате очень напряженной и блестящей работы с использованием таких ничем не примечательных реагентов, как перманганат калия и уксусный ангидрид.
Это беспокойство, однако, не оказалось проблемой, предполагая, возможно, что существует не так много химии, которую можно усвоить на уровне бакалавриата. Более того, доктор Джонсон был терпим к любому, кто хотел находиться в лаборатории по вечерам и в выходные дни. Мне также очень повезло, что в моей лаборатории обучались как профессор Джонсон, так и профессор Альфред Л.Дикие земли. Профессор Уайлдс любезно проявил интерес к моей подготовке и внес значительный вклад в мое образование. Сегодняшнему читателю этого учебника будет трудно понять, что в 1950 году, когда я получил докторскую степень в Университете Висконсина, спектроскопия ядерного магнитного резонанса (ЯМР) была неизвестна, а в Мэдисоне не было возможностей инфракрасного спектра. Меня всегда поражало, что в начале двадцатого века структура стероидов, как скелета, так и заместителей, была выяснена в результате очень напряженной и блестящей работы с использованием таких ничем не примечательных реагентов, как перманганат калия и уксусный ангидрид. Таким образом, чтение истории ранних исследований стероидов всегда оказывало на меня очень унизительное воздействие. Я считаю, что это печально, что современные учебники, а часто и классные лекции по органической химии, вообще стали бесчеловечными. Утверждается, что так многому нужно научиться, что нет ни времени, ни места, чтобы назвать имена химиков, на чьих плечах мы стоим. Возможно, так, но, на мой взгляд, мы платим высокую цену за эту исключительную заботу о «фактах» за счет нашего бесценного научного наследия.
Таким образом, чтение истории ранних исследований стероидов всегда оказывало на меня очень унизительное воздействие. Я считаю, что это печально, что современные учебники, а часто и классные лекции по органической химии, вообще стали бесчеловечными. Утверждается, что так многому нужно научиться, что нет ни времени, ни места, чтобы назвать имена химиков, на чьих плечах мы стоим. Возможно, так, но, на мой взгляд, мы платим высокую цену за эту исключительную заботу о «фактах» за счет нашего бесценного научного наследия. с кетоном.Я был так взволнован этим открытием, что ожидал, что мир остановится, как только новости станут известны. Это оказалось не так! Более того, одного химика-физика из моей экзаменационной комиссии позабавило, что химик-органик-синтетик серьезно относится к УФ-спектрам. Только гораздо позже, когда я поступил на факультет Пенсильванского университета, я понял, что немногие, даже хорошо подготовленные химики-органики, оптимально используют УФ-спектроскопию. Приведу лишь один пример: немногие химики-медики используют УФ-спектроскопию для определения точной концентрации испытуемого соединения в водном растворе перед биологическим анализом.Меня также забавляет, когда аспиранты записываются на время ЯМР, в то время как УФ-спектр сразу же предоставил бы нужную информацию.
с кетоном.Я был так взволнован этим открытием, что ожидал, что мир остановится, как только новости станут известны. Это оказалось не так! Более того, одного химика-физика из моей экзаменационной комиссии позабавило, что химик-органик-синтетик серьезно относится к УФ-спектрам. Только гораздо позже, когда я поступил на факультет Пенсильванского университета, я понял, что немногие, даже хорошо подготовленные химики-органики, оптимально используют УФ-спектроскопию. Приведу лишь один пример: немногие химики-медики используют УФ-спектроскопию для определения точной концентрации испытуемого соединения в водном растворе перед биологическим анализом.Меня также забавляет, когда аспиранты записываются на время ЯМР, в то время как УФ-спектр сразу же предоставил бы нужную информацию. В сочетании с исследованием H.C. Брауна о стерических эффектах, два столпа медицинской химии двадцатого века были на месте.Наконец, для меня было привилегией пройти курс профессора Гомера Адкинса по продвинутой органической химии. Он был единственным профессором, которого я встречал, который преподавал философию науки, подчеркивая скептицизм, воплощенный в его наблюдении, что «логика — это организованный способ с уверенностью идти не так».
В сочетании с исследованием H.C. Брауна о стерических эффектах, два столпа медицинской химии двадцатого века были на месте.Наконец, для меня было привилегией пройти курс профессора Гомера Адкинса по продвинутой органической химии. Он был единственным профессором, которого я встречал, который преподавал философию науки, подчеркивая скептицизм, воплощенный в его наблюдении, что «логика — это организованный способ с уверенностью идти не так».
 Число в названии говорит вам, где двойная связь начинается с .
Число в названии говорит вам, где двойная связь начинается с . На этот раз было бы очень легко сделать ошибку, написав букву Н после третьего атома углерода, но это дало бы этому углероду всего 5 связей.
На этот раз было бы очень легко сделать ошибку, написав букву Н после третьего атома углерода, но это дало бы этому углероду всего 5 связей.
