11 класс. Химия. Окислительно-восстановительные реакции — Окислительно-восстановительные реакции
Комментарии преподавателя1. Понятие ОВР, определение окислителей и восстановителей
Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Изменение степеней окисления происходит из-за перехода электронов от восстановителя к окислителю. Степень окисления – это формальный заряд атома, если считать, что все связи в соединении являются ионными.
Окислитель – это вещество, молекулы или ионы которого принимает электроны. Если элемент является окислителем, его степень окисления понижается.
О02 +4е-→ 2О-2 (Окислитель, процесс восстановления)
Процесс приема веществами электронов называется восстановлением. Окислитель в ходе процесса восстанавливается.
Восстановитель – это вещество, молекулы или ионы которого отдают электроны. У восстановителя степень окисления повышается.
S0 -4е- →S+4 (Восстановитель, процесс окисления)
Процесс отдачи электронов называется окислением. Восстановитель в ходе процесса окисляется.
2. Составление схемы электронного баланса
Пример №1. Получение хлора в лаборатории
В лаборатории хлор получают из перманганата калия и концентрированной соляной кислоты. В колбу Вюрца помещают кристаллы перманганата калия. Закрывают колбу пробкой с капельной воронкой. В воронку наливается соляная кислота. Соляная кислота приливается из капельной воронки. Сразу же начинается энергичное выделение хлора. Через газоотводную трубку хлор постепенно заполняет цилиндр, вытесняя из него воздух. Рис. 1.
Рис. 1
На примере этой реакции рассмотрим, как составлять электронный баланс.
1. Запишем схему этой реакции:
Запишем схему этой реакции:
KMnO4 + HCI = KCI + MnCI2 + CI2 + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
K+Mn+7O-24 + H+CI- = K+CI- + Mn+2CI-2 + CI02 + H+2O-2
Степени окисления поменяли марганец и хлор.
3. Составляем схему, отражающую процесс перехода электронов:
Mn+7+5е- = Mn+2 окислитель, процесс восстановление
2 CI- -2е- = CI02 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Mn+7+5е- = Mn+2 2
2 CI- -2е- = CI02 5
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
2KMnO4 + ? HCI = ?KCI + 2MnCI2 + 5CI2 +? h3O
Однако перед формулой соляной кислоты не поставлен коэффициент, так как не все хлоридные ионы участвовали в окислительно-восстановительном процессе. Метод электронного баланса позволяет уравнивать только ионы, участвующие в окислительно-восстановительном процессе. Поэтому нужно уравнять количество ионов, не участвующих в окислительно-восстановительной реакции. А именно катионов калия, водорода и хлоридных анионов. В результате получается следующее уравнение:
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8h3O
Пример №2. Взаимодействие меди с концентрированной азотной кислотой. Рис. 2.
В стакан с 10 мл кислоты поместили «медную» монету. Быстро началось выделение бурого газа (особенно эффектно выглядели бурые пузырьки в еще бесцветной жидкости). Все пространство над жидкостью стало бурым, из стакана валили бурые пары. Раствор окрасился в зеленый цвет. Реакция постоянно ускорялась. Примерно через полминуты раствор стал синим, а через две минуты реакция начала замедляться. Монета полностью не растворилась, но сильно потеряла в толщине (ее можно было изогнуть пальцами).
Рис. 2
1. Запишем схему этой реакции:
Cu + HNO3 = Cu (NO3)2 + NO2↑ + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
Cu0 + H+N+5O-23 = Cu+2(N+5O-23)2 + N+4O-22↑ + H+2O-2
Степени окисления поменяли медь и азот.
3. Составляем схему, отражающую процесс перехода электронов:
N+5+е- = N+4 окислитель, процесс восстановление
Cu0 -2е- = Cu+2 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 1 и 2. Это 2. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
N+5+е- = N+4 2
Cu0 -2е- = Cu+2 1
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
Cu + ?HNO3 = Cu (NO3)2 + 2NO2↑ + 2h3O
Азотная кислота участвует не только в окислительно-восстановительной реакции, поэтому коэффициент сначала не пишется. В результате, окончательно получается следующее уравнение:
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2h3O
3. Классификация ОВР
Классификация окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции.
Это реакции, в которых окислителем и восстановителем являются разные вещества.
Н2S-2 + Cl02 → S0 + 2HCl-
2. Внутримолекулярные реакции, в которых окисляющиеся и останавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H+2O-2 → 2H02 + O02
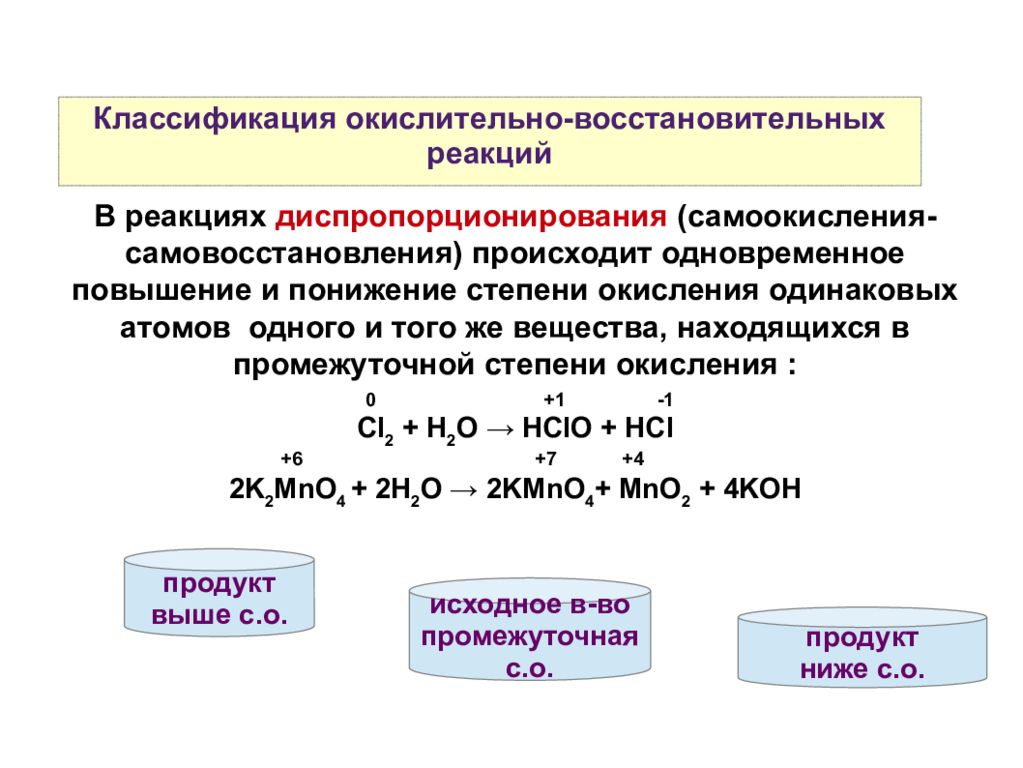
3. Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl02 + h3O → HCl+O + HCl-
4. Конпропорционирование (Репропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления
Конпропорционирование (Репропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления
5. N-3h5N+5O3 → N+2O + 2h3O
4/ Факторы, влияющие на продукты окисления
Факторы, влияющие на конечные продукты реакции
При протекании окислительно-восстановительных реакций, конечные продукты зависят от многих факторов.
· Состав реагирующих веществ
· Температура
· Концентрация
· Кислотность среды
ИСТОЧНИКИ
источник видео — http://www.youtube.com/watch?v=l2j57kNSLEk
источник видео — http://www.youtube.com/watch?v=bz65sRqJUjQ
источник презентации — http://ppt4web.ru/khimija/okislitelnovosstanovitelnye-reakcii3.html
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
Окислительно-восстановительные реакции в природе — Справочник химика 21
Окислительно-восстановительные реакции играют важную роль в природе и технике. В качестве примеров окислительно-восстано-вительных процессов, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека. Процессы горения топлива, протекающие в топках парогенераторов тепловых электростанций и в двигателях внутреннего сгорания, являются примером окислительновосстановительных реакций. [c.182]Применение окислителей. Существует большой выбор соединений, применяемых в качестве окислителей перманганат калия, хромовый ангидрид и хромовая смесь, азотная кислота, двуокись свинца и двуокись селена, тетраацетат свинца, перекись водорода, хлорное железо и многие другие. Направление и интенсивность действия окислителя на органические соединения зависят от характера окисляемого вещества, природы окислителя, температуры, pH среды и т.
 д. Так, например, при окислении анилина хромовой кислотой образуется хинон, перманганатом калия в кислой среде — анилиновый черный, перманганатом калия в нейтральной или щелочной среде — азобензол и нитробензол. Окисление проводится в большинстве случаев в водной или уксуснокислой среде. При определении коэффициентов в уравнениях окислительно-восстановительных реакций удобно пользоваться расчетной схемой, основанной на формальном представлении о степени окисления атомов, входящих в состав соединения. [c.129]
д. Так, например, при окислении анилина хромовой кислотой образуется хинон, перманганатом калия в кислой среде — анилиновый черный, перманганатом калия в нейтральной или щелочной среде — азобензол и нитробензол. Окисление проводится в большинстве случаев в водной или уксуснокислой среде. При определении коэффициентов в уравнениях окислительно-восстановительных реакций удобно пользоваться расчетной схемой, основанной на формальном представлении о степени окисления атомов, входящих в состав соединения. [c.129] Межмолекулярные (межатомные) окислительно-восстановительные реакции характеризуются тем, что атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Другими словами, одни вещества (простые или сложные), вступающие в химические реакции, являются окислителями, а другие — восстановителями. Межмолекулярные процессы составляют наиболее обширную группу окислительно-восстановительных реакций. Примерами могут служить реакции с участием простых и сложных веществ, а также различных атомных и молекулярных частиц (радикалов, ионов и ион-радикалов)
Окислительно-восстановительные реакции самые распространенные и играют большую роль в природе и технике. Они являются основой жизни на Земле, так как с ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических элементах и аккумуляторах. Они широко используются в мероприятиях по охране природы. [c.226]
Составление уравнений реакций. При записи окислительно-восстановительных реакций обычно показывают, сколько электронов отдано окислителем и сколько приобретено восстановителем. Условно принято окисление отождествлять с отдачей электронов, а восстановление — с приобретением электронов, т. е. не принимается во внимание строение частиц, природа химической связи в них и механизм протекающего процесса. Ради [c.203]
При записи окислительно-восстановительных реакций обычно показывают, сколько электронов отдано окислителем и сколько приобретено восстановителем. Условно принято окисление отождествлять с отдачей электронов, а восстановление — с приобретением электронов, т. е. не принимается во внимание строение частиц, природа химической связи в них и механизм протекающего процесса. Ради [c.203]
Окисление — восстановление — один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд биологических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления — восстановления. Получение простых веществ, например железа, хрома, марганца, никеля, кобальта, вольфрама, меди, серебра, цинка, серы, хлора, иода и т. д., и ценных химических продуктов, например аммиака, щелочей, сернистого газа, азотной, серной и других кислот, основано на окислительно-восстановительных реакциях. Производство строительных материалов, пластических масс, удобрений, медикаментов и т. д. было бы невозможно без использования окислительно-восстановительных процессов. На процессах окисления — восстановления в аналитической химии основаны методы объемного анализа пер-манганатометрия, иодометрия, броматометрия и др., играющие важную роль при контролировании производственных процессов и выполнении научных исследований.
При записи окислительно-восстановительных реакций обычно показывают, сколько электронов отдано окислителем и сколько приобретено восстановителем. Условно принято окисление отождествлять с отдачей электронов, а восстановление — с приобретением электронов, т. е. не принимаются во внимание строение частиц, природа химической связи в них и механизм протекающего процесса. Ради упрощения записи обычно указывают степени окисления лишь тех атомов, у которых она меняется. Условным является и приписывание окислительно- [c.92]
Ради упрощения записи обычно указывают степени окисления лишь тех атомов, у которых она меняется. Условным является и приписывание окислительно- [c.92]
Для разработки научных основ приготовления катализаторов высокой активности прежде всего необходимо выявить природу каталитически активных участков его поверхности. Нам представляется, что в гетерогенном катализе окислительно-восстановительных реакций природа каталитически активных участков может быть однотипной. Современные представления о физике и химии твердого состояния и, в частности, металлов и полупроводников позволяют высказать предположение, что каталитически активными участками являются окислительно-восстановительные микросистемы, например контакт металла с твердым раствором его ионов. Если в твердом растворе имеется достаточная концентрация катионов разной валентности, то катализатор будет иметь соответствующий окислительновосстановительный потенциал. Следует указать, что в этом случае гетерогенный катализ будет осуществляться в основном катионами переменной валентности по той же схеме, как и в гомогенном катализе в жидких растворах. Поэтому в указанном смысле нет принципиального различия между гомогенным и гетерогенным катализом окислительно-восстановительных реакций. Различие будет заключаться в том, что в жидких растворах катионы подвижны (например, Fe и Fe» ) и передача электронов возможна при их сталкивании друг с другом и с реагентами [7], тогда как в твердых растворах катионы пространственно фиксированы и передача электронов возможна не только при непосредственном контакте с реагентами, но и через кристаллическую решетку твердой фазы. [c.101]
Для устранения этого противоречия делались попытки ввести понятие пристеночного тока , причем даже предполагалось электризацию рассматривать вне связи с двойным слоем. ОднакО природа пристеночного тока в этих работах оставалась неопределенной. Согласно современной теории электризации, источник пристеночного тока — окислительно-восстановительные реакции на стенках трубопровода. В соответствии с этим, предположив для определенности, что на стенке адсорбируются отрицательные ионы, механизм электризации при движении жидкости в колонне насосно-компрессорных труб можно описать следующим образом. [c.116]
В соответствии с этим, предположив для определенности, что на стенке адсорбируются отрицательные ионы, механизм электризации при движении жидкости в колонне насосно-компрессорных труб можно описать следующим образом. [c.116]
Железо входит составной частью во многие биосистемы, в частности гемопротеины и системы небелковой природы (например, содержащиеся в микроорганизмах). В химии жизненных процессов существенную роль играют окислительно-восстановительные реакции порфириновых комплексов железа, которое может в них находиться в состояниях Fe(II) и Ре(III). В Зтих реакциях участвуют как электроны лигандов (их я-орбиталей), так и желе- [c.124]
Если же соединение или простое вещество содержит атомы элемента в промежуточной степени окисления, то оно может вести себя двояко оно может и приобретать и терять электроны. В первом случае оно ведет себя как окислитель, во втором — как восстановитель. Его поведение определяется химической природой партнера, с которым оно взаимодействует, условиями и характером среды, в которой протекает окислительно-восстановительная реакция. [c.123]
Особая трудность описания механизма окислительно-восстановительных реакций состоит в том, что путь превращения какого-либо вещества зависит от природы другого участника реакции, для которого, в свою очередь, путь превращения зависит от природы первого вещества. [c.335]
Встречаются комплексы, в которых окисляется как центральный ион, так и лиганды независимо друг от друга. Так, например, с помощью потенциометрического титрования установлено, что при окислении оксалатов платины (И) получаются два потенциала один из них отвечает окислению платины, а другой — оксалат-ионам. Таким образом, течение окислительно-восстановительных реакций комплексных соединений зависит от природы связи различных лигандов с центральным ионом. [c.136]
Нужно вывести общее уравнение окислительно-восстановительных реакций, зная природу реагентов и продуктов, образующихся в ходе реакции. Любая химическая реакция должна удовлетворять законам сохранения массы и электрических зарядов. [c.281]
Любая химическая реакция должна удовлетворять законам сохранения массы и электрических зарядов. [c.281]
Можно указать также еще ряд явлений неорганической химии, таких, как гидролиз солей, окислительно-восстановительные реакции, растворение аммиака, гидразина, гидроксиламина в воде, обычная трактовка которых не только далека от совершенства, но порой противоречит как опытным данным, так и современным теоретическим представлениям о природе молекул. [c.6]
Значительная часть свойств координационных соединений обус ловлена электронной конфигурацией центрального иона, донор ными и акцепторными свойствами лигандов и природой связи между лигандом и центральным ионом. По этой причине большее место в этой главе будет уделено этим аспектам химии координа ционных соединений, нежели вопросам стереохимии, типам изо мерин, реакциям замещения и окислительно-восстановительным реакциям. Здесь не будет рассмотрено и возрастающее значение координационных соединении в области аналитической химии, биохимии и электрохимии. Для детального изучения этих и других аспектов химии координационных соединений полезны многие прекрасные руководства . [c.232]
Окислительно-восстановительные потенциалы редокс-пар и, следовательно, потенциалы окислительно-восстановительных реакций зависят от природы реакции (т. е. от природы реагентов и растворителя), концентраций реагентов, pH среды, температуры, присутствия других веществ в растворе. От тех же факторов зависит и направление протекания окислительно-восстановительной реакции. [c.162]
Окисление — восстановление один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд биологических процессов в основе своей являются окислительно-восстановительными реакциями. [c.75]
Течение окислительно-восстановительных реакций комплексных соединений зависит от природы связи различных лигандов с центральным ионом. [c.166]
[c.166]
I. Предмет электрохимии и ее задачи. Вся область химии пронизана явлениями, имеющими электрическую природу. Сюда относятся такие важнейшие процессы, как образование внутримолекулярных (валентных) связей, окислительно-восстановительные реакции, явления гидратации, ионизации в растворах, ассоциация, комплексообразование и т. д. Все это говорит о весьма широкой связи химических явлений с явлениями электрическими. [c.315]
Классификация хроматографических методов анализа. Разнообразие хроматографических методов, различающихся по физико-химической основе и технике выполнения анализа, не позволяет классифицировать их по какому-либо одному критерию. Наиболее важные показатели, отражающие физико-химическую сущность и особенности техники анализа, следующие агрегатное состояние разделяемых веществ — газ (пар) или жидкость (раствор) природа сорбента — твердое вещество или жидкость характер взаимодействия между сорбентом и разделяемыми веществами — распределение молекул или ионов менаду двумя фазами, образование координационных соединений в фазе или на поверхности сорбента, протекание окислительно-восстановительных реакций при контакте разделяемых веществ с сорбентом техника выполнения анализа — в колонке, капилляре, на бумаге, в тонком слое сорбента. [c.7]
Окислительно-восстановительные реакции крайне многочисленны и многообразны. Они постоянно происходят в природе в виде процессов, поддерживающих жизнедеятельность организмов, в виде горения, гниения, коррозии и т. п. Получение металлов из руд, производство лекарственных препаратов, выработка энергии и многие другие задачи производительной деятельности человека решаются на основе сознательного использования реакций окисления—восстановления. [c.230]
Окислительно-восстановительные потенциалы редокс-пар зависят от природы участников окислительно-восстановительной реакции и растворителя, температуры, давления (в основном тогда, когда хотя бы один и реагентов — газ), присутствия посторонних электролитов и других веществ. [c.153]
[c.153]
Как следует из рассмотренных примеров, на направление и скорость окислительно-восстановительных реакций влияют многие факторы природа реагирующих веществ, характер среды, концентрация, температура, катализаторы и некоторые другие. [c.223]
Окислительно-восстановительные реакции являются самыми распространенными и играют большую роль в природе и технике их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе, они лежат в основе металлургических процессов, с их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные химические продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в химических источниках тока — гальванических элементах и аккумуляторах. Не меньшую роль играют эти реакции и в биологических процессах фотосинтез, дыхание, обмен веществ — все эти процессы основаны на окислительно-восстановительных реакциях. [c.154]
Окислительно-восстановительные реакции являются самыми распространенными и играют большую роль в природе п технике. [c.137]
Природа электрода, так же как и сгепень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце — преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. В результате этого процесса получаются два основных конечных продукта — изопропиловый спирт СН3СНСН3 и пннакон (СНзСОНСНз)2. [c.432]
Кислый гудрон, образующийся при сернокислотной очистке нефтепродуктов, имеет очень сложную природу, даже когда очистке подвергается бензин или керосин. В кислом гудроне содержатся эфиры и спирты, которые образуются при взаимодействии кислоты с олефинами сульфокислоты, которые образуются прп сульфировании ароматики, нафтенов и фенолов соли, которые образуются при реакции кислоты с азотистыми основаниями нафтеновые кислоты, сернистые соединения и асфальтены, для которых серная кислота является селективным растворителелк К этому перечню соединений следует еще добавить продукты окислительно-восстановительных реакций, т. е. смолы и растворимые в кислоте углеводороды, а также воду и свободную серную кислоту. Гурвич [66] считает, что в кислом гудроне присутствует много непрочных соединений кислоты с углеводородами эти соединения легко разлагаются при хранении кислого гудрона или при разбавлении его водой. Очевидно, что соотношение между перечисленными компонентами кислого гудрона будет различным в различных конкретных случаях и зависит как от природы очищаемого нефтепродукта, так и от технологического режима очистки и от крепости применяемой кислоты. [c.236]
В кислом гудроне содержатся эфиры и спирты, которые образуются при взаимодействии кислоты с олефинами сульфокислоты, которые образуются прп сульфировании ароматики, нафтенов и фенолов соли, которые образуются при реакции кислоты с азотистыми основаниями нафтеновые кислоты, сернистые соединения и асфальтены, для которых серная кислота является селективным растворителелк К этому перечню соединений следует еще добавить продукты окислительно-восстановительных реакций, т. е. смолы и растворимые в кислоте углеводороды, а также воду и свободную серную кислоту. Гурвич [66] считает, что в кислом гудроне присутствует много непрочных соединений кислоты с углеводородами эти соединения легко разлагаются при хранении кислого гудрона или при разбавлении его водой. Очевидно, что соотношение между перечисленными компонентами кислого гудрона будет различным в различных конкретных случаях и зависит как от природы очищаемого нефтепродукта, так и от технологического режима очистки и от крепости применяемой кислоты. [c.236]
Что вызывает протекание окислительно-восстановительных реакций Из-за той легкости, с которой многие элементы-металлы вступак т во взаимодействие с другими элементами, они находятся в природе в виде ионов (составных частей минералов) и образуют ионные вещества. Получение металла из его минерала обычно требует затрат энергии, а также ист1эчника электронов или, иначе говоря, восстановителя. В табл. II.8 показаны применяемые в настоящее время методы восстановления, восстановители и источники энергии. Рассмотрим их подробнее. [c.152]
Характе )ной особенностью почвенных условий является необрати.мость большинства реакций окисления и восстановления, протекающих в почве. Обратимые реакции, которые полностью подчиняются всем рассмотренным выше теоретическим положениям, свойственны только некоторым окислитсльно-восста-новительным системам — окислению и восстановлению железа (ре +5а ре +), марганца (Мп + =г2 Мп2+), азота (N +5= N + ) и др. С другой стороны, в почве протекает большое число окислительно-восстановительных реакций биохимической природы. [c.260]
С другой стороны, в почве протекает большое число окислительно-восстановительных реакций биохимической природы. [c.260]
Метод полуреакций (ионно-электронного баланса). В методе полуреакцпй составляют ионные уравнения для окисления восстановителя и восстановления окпслп-теля с заключительным суммированием этих уравнений в оби ее ионное уравнение. Физическая природа рассматриваемых процессов будет гюиятна, если мы учтем, что каждая окислительно-восстановительная реакция можег быть использована для получения электрического тока при ее проведении в гальваническом элементе (в полуэлементах) (рнс. 6.1). [c.146]
Возможц ость взаимодействия реагирующих веществ в окислительно-восстановительной реакции определяется также устойчивостью и прочностью возникающих химических связей в образующихся соединениях, что зависит не только от природы компонентов, входящих в данное вещество, но и от внешних условий и от среды, в которой протекает процесс. [c.147]
Существуют такие вещества, которые в одних реакциях могут бьпь окислителями, а в других—восстановителями, в зависимости от природы партнера-реагента и условий протекания окислительно-восстановительной реакции. Такие вещества иногда называют редокс-амфотерными. [c.147]
Возможность протекания любой окислительно-восстановительной реакции в реальных условиях обусловлена рядом причин температурой, природой окислителя и восстановителя, pH среды, концентрэдией веществ, участвующих в реакции, и т. д. Учесть все эти факторы [c.204]
Межмолекулярные (межионные) реакции. В этом случае элек-троноактивные частицы имеют различную химическую природу и находятся в разных веществах (в разных молекулах или ионах). К этому типу относятся все ранее рассмотренные окислительно-восстановительные реакции. [c.293]
При реакции происходит перемеще[[ие электронов от восстановителя к окислителю, т. к. в восстановителе они связаны с ядром слабее, чем в окислителе. Следовательно, предсказание осуществления окислительно-восстановительной реакции возможно на основе знания энергетических уровней электронов в исходных веществах. Энергетические уровни электронов у восстановителя и окислителя зависят от их природы, состояния и окружающей среды. Они характеризуются потенциалами ионизации, сродством к электрону и окислительно-восстановительным потенциалам. Рассмотрим с этих позиций в качестве примера взаимодействие магпия с хлором и определим направление этой окислительно-восстановительной реакции. Магний—элемент ПА группа периодической системы, активный металл, сильный восстановитель. Распределение электронов в атоме следующее—1 5 , 28 2р 35 . Энергия возбуждения одного из двух внешних электронов мала и полностью перекрывается энергией образования химических связей. Поэтому один из электронов 35—подуровня может перейти на Зр — подуровень. В этом случае электронная структура атома будет иметь два неспаренных электрона, и, следовательно,он может проявлять валентность, равную двум. [c.32]
Следовательно, предсказание осуществления окислительно-восстановительной реакции возможно на основе знания энергетических уровней электронов в исходных веществах. Энергетические уровни электронов у восстановителя и окислителя зависят от их природы, состояния и окружающей среды. Они характеризуются потенциалами ионизации, сродством к электрону и окислительно-восстановительным потенциалам. Рассмотрим с этих позиций в качестве примера взаимодействие магпия с хлором и определим направление этой окислительно-восстановительной реакции. Магний—элемент ПА группа периодической системы, активный металл, сильный восстановитель. Распределение электронов в атоме следующее—1 5 , 28 2р 35 . Энергия возбуждения одного из двух внешних электронов мала и полностью перекрывается энергией образования химических связей. Поэтому один из электронов 35—подуровня может перейти на Зр — подуровень. В этом случае электронная структура атома будет иметь два неспаренных электрона, и, следовательно,он может проявлять валентность, равную двум. [c.32]
Большинство химических реакций, протекаюи их в приборах, заводских реакторах, живых организмах и в природе, — это реакции окисления-восстановления. Такие реакции широко используются в аналитической химии для открытия, разделения и количественного определения веш,еств. Сущность окислительно-восстановительных реакций заключается в переходе некоторого числа электронов от восстановителя к окислителю. Процессы растворения металлов в воде, растворах кислот, оснований и солей также являются окислительно-восстановительными. [c.90]
Эффективность окислительных или восстановительных свойств данного вещества зависит от его природы, от условий протекания окислительно-восстановительной реакции и определяется величиной электродного потенциала редокс-пары (окислительно-восстановительного потенциала редокс-пары, редокс-потеьциала). Этот потенциал эксие- [c.147]
Программа проведения вступительных испытаний по дисциплине «Химия»
Программа по химии состоит из двух разделов. В первом разделе представлены основные теоретические понятия химии, которыми должен владеть абитуриент с тем, чтобы уметь обосновывать химические и физические свойства веществ, перечисленных во втором разделе, посвященном элементам и их соединениям.
В первом разделе представлены основные теоретические понятия химии, которыми должен владеть абитуриент с тем, чтобы уметь обосновывать химические и физические свойства веществ, перечисленных во втором разделе, посвященном элементам и их соединениям.
Экзаменационный билет может содержать до 10 заданий с дифференцированной оценкой, охватывающих все разделы программы для поступающих. На экзамене можно пользоваться микрокалькуляторами и справочными таблицами, такими как «Периодическая система химических элементов», «Растворимость оснований, кислот и солей в воде», «Ряд стандартных электродных потенциалов».
Часть I. Основы теоретической химии
- Предмет химии. Место химии в естествознании. Масса и энергия. Основные понятия химии. Вещество. Молекула. Атом. Электрон. Ион. Химический элемент. Химическая формула. Относительная атомная и молекулярная масса. Моль. Молярная масса.
- Химические превращения. Закон сохранения массы и энергии. Закон постоянства состава. Стехиометрия.
- Строение атома. Атомное ядро. Изотопы. Стабильные и нестабильные ядра. Радиоактивные превращения, деление ядер и ядерный синтез. Уравнение радиоактивного распада. Период полураспада.
- Двойственная природа электрона. Строение электронных оболочек атомов. Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном и возбужденном состояниях, принцип Паули, правило Хунда.
- Периодический закон Д.И.Менделеева и его обоснование с точки зрения электронного строения атомов. Периодическая система элементов.
- Химическая связь. Типы химических связей: ковалентная, ионная, металлическая, водородная. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Энергия связи. Потенциал ионизации, сродство к электрону, электроотрицательность. Полярность связи, индуктивный эффект. Кратные связи. Модель гибридизации орбиталей. Связь электронной структуры молекул с их геометрическим строением (на примере соединений элементов 2-го периода).
 Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях.
Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях. - Валентность и степень окисления. Структурные формулы. Изомерия. Виды изомерии, структурная и пространственная изомерия.
- Агрегатные состояния вещества и переходы между ними в зависимости от температуры и давления. Газы. Газовые законы. Уравнение Клайперона-Менделеева. Закон Авогадро, молярный объем. Жидкости. Ассоциация молекул в жидкостях. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные.
- Классификация и номенклатура химических веществ. Индивидуальные вещества, смеси, растворы. Простые вещества, аллотропия. Металлы и неметаллы. Сложные вещества. Основные классы неорганических веществ: оксиды, основания, кислоты, соли. Комплексные соединения. Основные классы органических веществ: углеводороды, галоген-, кислород- и азотосодержащие вещества. Карбо- и гетероциклы. Полимеры и макромолекулы.
- Химические реакции и их классификация. Типы разрыва химических связей. Гомо- и гетеролитические реакции. Окислительно-восстановительные реакции.
- Тепловые эффекты химических реакций. Термохимические уравнения. Теплота образования химических соединений. Закон Гесса и его следствия.
- Скорость химической реакции. Представление о механизмах химических реакций. Элементарная стадия реакции. Гомогенные и гетерогенные реакции. Зависимость скорости гомогенных реакций от концентрации (закон действующих масс). Константа скорости химической реакции, ее зависимость от температуры. Энергия активации.
- Явление катализа. Катализаторы. Примеры каталитических процессов. Представление о механизмах гомогенного и гетерогенного катализа.
- Обратимые реакции. Химическое равновесие. Константа равновесия, степень превращения. Смещение химического равновесия под действием температуры и давления (концентрации). Принцип Ле Шателье.
- Дисперсные системы. Коллоидные системы.
 Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы.
Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы. - Электролиты. Растворы электролитов. Электролитическая диссоциация кислот, оснований и солей. Кислотно-основные взаимодействия в растворах. Протонные кислоты, кислоты Льюиса. Амфотерность. Константа диссоциации. Степень диссоциации. Ионное произведение воды. Водородный показатель. Гидролиз солей. Равновесие между ионами в растворе и твердой фазой. Произведение растворимости. Образование простейших комплексов в растворах. Координационное число. Константа устойчивости комплексов. Ионные уравнения реакций.
- Окислительно-восстановительные реакции в растворах. Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов. Электролиз растворов и расплавов. Законы электролиза Фарадея.
Часть II. Элементы и их соединения
Неорганическая химия
Абитуриенты должны на основании Периодического закона давать сравнительную характеристику элементов в группах и периодах. Характеристика элементов включает: электронные конфигурации атома; возможные валентности и степени окисления элемента в соединениях; формы простых веществ и основные типы соединений, их физические и химические свойства, лабораторные и промышленные способы получения; распространенность элемента и его соединений в природе, практическое значение и области применения соединений. При описании химических свойств должны быть отражены реакции с участием неорганических и органических соединений (кислотно-основные и окислительно-восстановительные превращения), а также качественные реакции.
- Водород. Изотопы водорода.
 Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода.
Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода. - Галогены. Галогеноводороды. Галогениды. Кислородсодержащие соединения хлора.
- Кислород. Оксиды и пероксиды. Озон.
- Сера. Сероводород, сульфиды, полисульфиды. Оксиды серы (IV) и (VI). Сернистая и серная кислоты и их соли. Эфиры серной кислоты. Тиосульфат натрия.
- Азот. Аммиак, соли аммония, амиды металлов, нитриды. Оксиды азота. Азотистая и азотная кислоты и их соли. Эфиры азотной кислоты.
- Фосфор. Фосфин, фосфиды. Окисды фосфора (III) и (V). Галогениды фосфора. Орто-, мета- и дифосфорная кислоты. Ортофосфаты. Эфиры фосфорной кислоты.
- Углерод. Изотопы углерода. Простейшие углеводороды: метан, этилен, ацетилен. Карбиды кальция, алюминия и железа. Оксиды углерода (II) и (IV). Карбонилы переходных металлов. Угольная кислота и ее соли.
- Кремний. Силан. Силицид магния. Оксид кремния (IV). Кремнивые кислоты, силикаты.
- Бор. Трифторид бора. Орто- и тетраборная кислоты. Тетраборат натрия.
- Благородные газы. Примеры соединений криптона и ксенона.
- Щелочные металлы. Оксиды, пероксиды, гидроксиды и соли щелочных металлов.
- Щелочноземельные металлы, бериллий, магний: их оксиды, гидроксиды и соли. Представление о магнийорганических соединениях (реактив Гриньяра).
- Алюминий. Оксид, гидроксид и соли алюминия. Комплексные соединения алюминия. Представления об алюмосиликатах.
- Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидрооксид меди (II). Соли серебра и меди. Комплексные соединения серебра и меди.
- Цинк, ртуть. Оксиды цинка и ртути. Гидроксид цинка и его соли.
- Хром. Оксиды хрома (II), (III) и (VI). Гидрооксиды и соли хрома (II) и (III). Хроматы и дихроматы (VI). Комплексные соединения хрома (III).
- Марганец. Оксиды марганца (II) и (IV). Гидрооксид и соли марганца (II). Манганат и перманганат калия.

- Железо, кобальт, никель. Оксиды железа (II), (II)-(III) и (III). Гидроксиды и соли железа (II) и (III). Ферраты (III) и (VI). Комплексные соединения железа. Соли и комплексные соединения кобальта (II) и никеля (II).
Органическая химия
Характеристика каждого класса органических соединений включает: особенности электронного и пространственного строения соединений данного класса, закономерности изменения физических и химических свойств в гомологическом ряду, номенклатуру, виды изомерии, основные типы химических реакций и их механизмы. Характеристика конкретных соединений включает физические и химические свойства, лабораторные и промышленные способы получения, области применения. При описании химических свойств необходимо учитывать реакции с участием как радикала, так и функциональной группы.
- Структурная теория как основа органической химии. Углеродный скелет. Функциональная группа. Гомологические ряды. Изомерия: структурная и пространственная. Представление об оптической изомерии. Взаимное влияние атомов в молекуле. Классификация органических реакций по механизму и заряду активных частиц.
- Алканы и циклоалканы. Конформеры.
- Алкены и циклоалкены. Сопряженные диены.
- Алкины. Кислотные свойства алкинов.
- Ароматические углеводороды (арены). Бензол и его гомологи. Стирол. Реакции ароматической системы и углеводородного радикала. Ориентирующее действие заместителей в бензольном кольце (ориентанты I и II рода). Понятие о конденсированных ароматических углеводородах.
- Галогенопроизводные углеводородов: алкил-, арил-, и винилгалогениды. Реакции замещения и отщепления.
- Спирты простые и многоатомные. Первичные, вторичные и третичные спирты. Фенолы. Простые эфиры.
- Карбонильные соединения: альдегиды и кетоны. Предельные, непредельные и ароматические альдегиды. Понятие о кето-енольной таутомерии.
- Карбоновые кислоты. Предельные, непредельные и ароматические кислоты.
 Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды, галогенангидриды, сложные эфиры, амиды. Жиры.
Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды, галогенангидриды, сложные эфиры, амиды. Жиры. - Нитросоединения: нитрометан, нитробензол.
- Амины. Алифатические и ароматические амины. Первичные, вторичные и третичные амины. Основность аминов. Четвертичные аммониевые соли и основания.
- Галогензамещенные кислоты. Оксикислоты: молочная, винная и салициловая кислоты. Аминокислоты: глицин, аланин, цистеин, серин, фенилаланин, тирозин, лизин, глутаминовая кислота. Пептиды. Представление о структуре белков.
- Углеводы. Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза. Циклические формы моносахаридов. Понятие о пространственных изомерах углеводов. Дисахариды: целлобиоза, мальтоза, сахароза. Полисахариды: крахмал, целлюлоза.
- Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
- Реакции полимеризации и поликонденсации. Отдельные типы высокомолекулярных соединений: полиэтилен, полипропилен, полистирол, поливинилхлорид, политетрафторэтилен, каучуки, сополимеры, фенол-формальдегидные смолы, искусственные и синтетические волокна.
Окислительно-восстановительные реакции в органической химии
Теория ОВР в органической химии
Окисление органических веществ. Зависимость продуктов реакции окисления органических веществ от среды. Применение метода электронного баланса в органических реакциях.
Окислительно-восстановительные реакции с участием органических веществ встречаются в заданиях С3 и вызывают наибольшие затруднения у школьников. Как правило, большинство выпускников пишут схемы окислительно-восстановительных реакций, показывая окислитель [O], не указывая продукты ОВР, кроме основного; вызывает затруднение и расстановка коэффициентов в органических ОВР.
Мы рассмотрим:
Графический метод определения степени окисления в органических веществах;
Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов;
Метод макроподстановки при расставлении коэффициентов в органических ОВР
1. Графический метод определения степени окисления в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления)
Рассмотрим такой случай:
Пример 1. Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
5С -2/5 – 22е 5С+4 2 1
Окисление
S+6 + 2е S+4 22 11
восстановление
С5Н10О4 + 11H2SO4 5CO2 + 16H2O + 11SO2
В большинстве случаев окислению подвергаются не все атомы органического вещества, а только некоторые. В этом случае в электронный баланс вносятся только атомы, изменившие степень окисления, а, следовательно, нужно знать степень окисления каждого атома. Легче всего это сделать графическим методом:
Легче всего это сделать графическим методом:
1) изображается полная структурная формула вещества;
2) по каждой связи стрелкой показывается смещение электрона к наиболее электроотрицательному элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома – столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим несколько примеров:
Н
Н С С О
Н О Н
Углерод карбоксильной группы смещает от себя 3 электрона, его степень окисления +3, углерод метильного радикала притягивает к себе 3 электрона от водорода, его степень окисления – 3.
Cl
Н С С О
H H
Углерод альдегидной группы отдает 2 электрона (+2) и притягивает к себе 1 электрон ( — 1), итого степень окисления углерода альдегидной группы +1. Углерод радикала притягивает 2 электрона от водорода (-2) и отдает 1 электрон хлору (+1), итого степень окисления этого углерода -1.
Н Н
Н С С С ≡ С Н
Н Н
У первого углерода (начинаем считать справа) степень окисления -1, у второго 0, так как мы считаем все связи углерод-углерод неполярными, у третьего – 2, у четвертого – 3.
2. Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов
Все ОВР в органике можно условно разделить на 3 группы:
Полное окисление и горение. В качестве окислителей используются кислород (другие вещества, поддерживающие горение, например оксиды азота), концентрированные азотная и серная кислота, можно использовать твердые соли, при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и т.п.), другие окислители (например, оксид меди (II)). В этих реакциях наблюдается разрушение всех химических связей в органическом веществе.
 Продуктами окисления органического вещества являются углекислый газ и вода.
Продуктами окисления органического вещества являются углекислый газ и вода.Мягкое окисление. В этом случае не происходит разрыва углеродной цепи. К мягкому окислению относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера), окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В качестве окислителей в этих случаях используются разбавленные растворы перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида серебра, оксид меди (II), гидроксид меди (II).
Пример 2. Окисление этилена водным раствором перманганата калия при обычных условиях (реакция Вагнера) :
CH2=CH2 + KMnO4 + H2O HO-CH2-CH2-OH + MnO2 + KOH
Степень окисления углерода в этилене – 2, в этиленгликоле – 1. В балансе учитываем оба атома углерода, так как они соединены неполярной связью.
2С -2 – 2е 2С-1 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 2 окислитель
Восстановление
3CH2=CH2 + 2KMnO4 + 4H2O 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
Пример 3. Окисление этаналя подкисленным раствором перманганата калия при нагревании :
CH3-CHО + KMnO4 + H2SO4 CH3-COOH + MnSO4+ K2SO4 + H2O
Степень окисления углерода в альдегидной группе +1, в карбоксильной группе +3, это используем в балансе, метильный радикал в реакции не участвовал, его не имеет смысла учитывать.
С+1 – 2е С+3 5 восстановитель
Окисление
Mn+7 + 5е Mn+2 2 окислитель
Восстановление
5CH3-CHО + 2KMnO4 + 3H2SO4 5CH3-COOH + 2MnSO4+ K2SO4 + 3H2O
Деструктивное окисление. Происходит в более жестких условиях, чем мягкое окисление, сопровождается разрывом некоторых углерод-углеродных связей. В качестве окислителей используются более концентрированные растворы перманганата калия, дихромата калия при нагревании. Среда этих реакций может быть кислой, нейтральной и щелочной. От этого будут зависеть продукты реакций.
Деструкция (разрыв углеродной цепи) происходит у алкенов и алкинов – по кратной связи, у производных бензола – между первым и вторым атомами углерода, если считать от кольца, у третичных спиртов – у атома, содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе. Если при деструкции оторвался фрагмент, содержащий 1 атом углерода, то он окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или) карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов бензола, у кетонов, алкенов).
Ниже в схемах представлены возможные варианты окисления производных бензола в кислой и щелочной среде. Разными цветами выделены атомы углерода, участвующие в окислительно-восстановительном процессе. Выделение цветом позволяет проследить «судьбу» каждого атома углерода.
Схема 1. Окисление производных бензола в кислой среде
Окисление производных бензола в кислой среде
Схема 2. Окисление производных бензола в щелочной среде
Несколько сложнее составить уравнение реакции окисления в нейтральной среде. Точно определить, какие продукты получатся, можно только при расстановке коэффициентов. Рассмотрим последовательно такой случай.
Пример 4. Окисление фенилацетилена водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по тройной связи, образуется бензоат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3. Кстати, при расстановке коэффициентов может выясниться, что воду нужно перенести в правую часть уравнения:
С6Н5—С≡СН + KMnO4 + H2O С6Н5—СООК + MnO2 + KOH+ КНСО3
С 0 – 3е С+3
С -1– 5е С+4 8 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 8 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + 2KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
2KOH+ 3КНСО3 2К2СО3 + КНСО3 + 2H2O, изменим продукты реакции:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 18 без учета воды, следовательно, воду нужно перенести в правую часть:
3С6Н5—С≡СН + 8KMnO4 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3+ H2O
Пример 5. Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3.
Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3.
CH3-CH2—CH=CH2 + KMnO4 + H2O С2Н5—СООК + MnO2 + KOH+ КНСО3
С -1 – 4е С+3
С -2 – 6е С+4 10 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 10 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + 4KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+ 3КНСО3 3К2СО3 + КOH + 3H2O, изменим продукты реакции:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть:
3CH3-CH2—CH=CH2 + 10KMnO4 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3 + 4H2O
3. Метод макроподстановки при расставлении коэффициентов в органических ОВР
Метод макроподстановки при расставлении коэффициентов в органических ОВР
В случае, когда множество атомов углерода меняют степень окисления, рассматривается каждый атом отдельно, а затем все отданные атомами углерода электроны складываются. В этом и состоит сущность макроподстановки. Рассмотрим пример 6. Пользуясь схемой 1, составим формулы продуктов реакции окисления.
+ KMnO4 + H2SO4
+ CO2 + CH3COOH + MnSO4 + K2SO4 + H2O
Теперь определим степени окисления всех атомов углерода, которые будут меняться: в гидроксильной группе – 1, в альдегидной группе +1, в метильном радикале – 3, в этильном радикале будет менять степень окисления только атом, связанный с СН, его степень окисления – 2, в СН степень окисления С – 1. Первые от бензольного кольца атомы углерода приобрели степень окисления +3, метильный радикал превратился в углекислый газ +4, углерод этильного радикала – в карбоксильную группу +3.
С -1 – 4е С+3
С +1 – 2е С+3
С -1 – 4е С+3 22 5
С -3 – 7е С+4
С -2 – 5е С+3
Окисление
Mn+7 + 5е Mn+2 22 окислитель
Восстановление
ИЛИ
С -1 +С +1 +С -1 +С -3 +С -2 – 22 е 4С+3 + С+4
— 6 е +16 е
Расставим коэффициенты (органические вещества записаны в виде молекулярных формул, но так записывать не обязательно)
5С12Н16О2+ 22KMnO4 + 33H2SO4 5С9Н6О6 + 5CO2 + 5CH3COOH + 22MnSO4 + 11K2SO4 + 38H2O
Задание 4.
1) Составьте уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена – 1,3 подкисленным раствором перманганата калия при нагревании.
2) Составьте уравнение реакции окисления стирола водным раствором перманганата калия при нагревании.
3) Составьте уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным раствором перманганата калия при нагревании.
Для расставления коэффициентов используйте метод макроподстановки.
Общая и неорганическая химия. В 2 ч. Часть 1. Теоретические основы
Explaining Thermodynamics1.1.1. Первый закон термодинамики
1.1.1. Первый закон термодинамики
Introduction to Energy and Work1. 1.1. Первый закон термодинамики
1.1. Первый закон термодинамики
1.1.1. Первый закон термодинамики
1.1.1. Первый закон термодинамики
1.1.1. Первый закон термодинамики
1.1.1. Первый закон термодинамики
What is the First Law of Thermodynamics?1.1.1. Первый закон термодинамики
Первый закон термодинамики
1.1. Основные положения химической термодинамики
1.1.1. Первый закон термодинамики
Экзо- и эндотермические реакции1.1.1. Первый закон термодинамики
Crystal Structure and the Laws of Thermodynamics1. 1.3. Второй закон термодинамики. Энтропия
1.3. Второй закон термодинамики. Энтропия
1.1.3. Второй закон термодинамики. Энтропия
Does This Reaction Break the Second Law of Thermodynamics?1.1.3. Второй закон термодинамики. Энтропия
Entropy and the Arrow of Time1.1.3. Второй закон термодинамики. Энтропия
How To Debunk Perpetual Motion Machines1. 1.3. Второй закон термодинамики. Энтропия
1.3. Второй закон термодинамики. Энтропия
1.1.3. Второй закон термодинамики. Энтропия
What is the Second Law of Thermodynamics?1.1.3. Второй закон термодинамики. Энтропия
What is the Third Law of Thermodynamics?1.1.3. Второй закон термодинамики. Энтропия
Реакция Белоусова-Жаботинского. Колебательные реакции
Колебательные реакции1.1.3. Второй закон термодинамики. Энтропия
Скорость реакции1.2.1. Скорость химических реакций и ее зависимость от различных факторов
Осмос. Химический сад2.2.3. Осмотическое давление раствора. Закон Вант-Гоффа
Диссоциация. Сильные и слабые электролиты. Проводник второго рода2. 4. Электролитическая диссоциация. Степень и константа диссоциации
4. Электролитическая диссоциация. Степень и константа диссоциации
2.4. Электролитическая диссоциация. Степень и константа диссоциации
pH of 10 Common Household Liquids2.6. Ионное произведение воды и рН раствора
What is pH | How to Calculate pH2.6. Ионное произведение воды и рН раствора
History of the Atom (Dalton, Thomson, Rutherford, and Bohr Models)Глава 3. Строение атома и периодический закон Д. И. Менделеева
Строение атома и периодический закон Д. И. Менделеева
Глава 3. Строение атома и периодический закон Д. И. Менделеева
3.3. Квантовые числа и их характеристики
3.3. Квантовые числа и их характеристики
3.3. Квантовые числа и их характеристики
Орбитальная модель атома. Квантовые числа3. 3. Квантовые числа и их характеристики
3. Квантовые числа и их характеристики
3.3. Квантовые числа и их характеристики
3.4. Распределение электронов в атомах элементов. Принцип Паули. Правила Клечковского
3.4. Распределение электронов в атомах элементов. Принцип Паули. Правила Клечковского
How to Write Electron Configuration3.5. Электронные формулы. Правило Гунда
Электронно-структурные формулы атомов элементов3. 5. Электронные формулы. Правило Гунда
5. Электронные формулы. Правило Гунда
3.5. Электронные формулы. Правило Гунда
Introduction to the Periodic Table3.7. Структура периодической системы Д. И. Менделеева
Investigating the Periodic Table with Experiments3.7. Структура периодической системы Д. И. Менделеева
3. 7. Структура периодической системы Д. И. Менделеева
7. Структура периодической системы Д. И. Менделеева
3.7. Структура периодической системы Д. И. Менделеева
Закономерности изменения строения атомов и свойств элементов3.7. Структура периодической системы Д. И. Менделеева
Как пользоваться таблицей Менделеева3.7. Структура периодической системы Д. И. Менделеева
Ionic Bonds vs Covalent Bonds (Which is STRONGER?)4. 1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
4.1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
What is a metal? (Metallic Bonds)4.1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
4.1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
Химическая связь4. 1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
1. Типы химической связи. Теория образования ионной, ковалентной, полярной связей
4.6. Полярность связи и явление поляризации
Окислительно-восстановительные реакции. Основные понятия5.1. Основные понятия теории окислительно-восстановительных реакций
Метод ионно-электронного баланса5.1.3. Составление уравнений ОВР
Метод электронного баланса5. 1.3. Составление уравнений ОВР
1.3. Составление уравнений ОВР
5.1.3. Составление уравнений ОВР
Примеры окислительно-восстановительных реакций5.1.3. Составление уравнений ОВР
Реакции с изменением степени окисления атомов (часть 1)5.1.3. Составление уравнений ОВР
Реакции с изменением степени окисления атомов (часть 2)5. 1.3. Составление уравнений ОВР
1.3. Составление уравнений ОВР
5.2.3. Химические источники тока
How to Make a Simple Battery5.2.3. Химические источники тока
5.2.3. Химические источники тока
Как производятся аккумуляторы для электромобилей5. 2.3. Химические источники тока
2.3. Химические источники тока
5.2.3. Химические источники тока
Окислительно-восстановительные потенциалы5.2.4. Окислительно-восстановительные потенциалы. Направление протекания ОВР
Электролиз. Получение хлора, получение свинца5.2.6. Электролиз
Окислительно-восстановительные реакции
Окислительно-восстановительные
реакции часто довольно громоздки и,
тем не менее, их нужно уметь
уравнивать. Для этой цели используют
предельно простую модель молекулы.
Прежде всего вводят понятие о
степени окисления атома в молекуле.
Начнем с конкретных примеров.
Степень окисления атомов в молекулах
простых веществ (h3, F2, O2, O3,
графит, алмаз, металлы) принимается
равной нулю. Атомы щелочных
металлов во всех соединениях с
неметаллами имеют степень окисления
равную +1 (если вспомнить о ионном
характере связи в этих молекулах, то
это действительно так). Атомы фтора
(самого активного из всех неметаллов)
во всех соединениях имеют степень
окисления равную -1. В соединениях с
металлами, где имеется ионный тип
связи, это действительно так. Но выше
мы уже видели, что в молекуле HF
электронная пара, образующая
химическую связь, лишь немного
смещена к атому фтора и у него
(исходя из величины дипольного
момента) появляется заряд равной -0.4.
При введении понятия «степень
окисления» постулируется, что все
ковалентные полярные связи
становятся ионными. И только после
этого нужно вычислиь тот заряд,
который был бы у данного атома, а
величину этого заряда в целых
единицах принимают за степень
окисления.
Для этой цели используют
предельно простую модель молекулы.
Прежде всего вводят понятие о
степени окисления атома в молекуле.
Начнем с конкретных примеров.
Степень окисления атомов в молекулах
простых веществ (h3, F2, O2, O3,
графит, алмаз, металлы) принимается
равной нулю. Атомы щелочных
металлов во всех соединениях с
неметаллами имеют степень окисления
равную +1 (если вспомнить о ионном
характере связи в этих молекулах, то
это действительно так). Атомы фтора
(самого активного из всех неметаллов)
во всех соединениях имеют степень
окисления равную -1. В соединениях с
металлами, где имеется ионный тип
связи, это действительно так. Но выше
мы уже видели, что в молекуле HF
электронная пара, образующая
химическую связь, лишь немного
смещена к атому фтора и у него
(исходя из величины дипольного
момента) появляется заряд равной -0.4.
При введении понятия «степень
окисления» постулируется, что все
ковалентные полярные связи
становятся ионными. И только после
этого нужно вычислиь тот заряд,
который был бы у данного атома, а
величину этого заряда в целых
единицах принимают за степень
окисления.
Атомы кислорода во всех соединениях (кроме O2, O3, h3O2 и ее производных, F2O) имеют степень окисления равную -2.
Дальше начинается элементарный подсчет. Любая молекула в целом электронейтральна: сумманое число положительных степеней окисления в молекуле равно суммарному числу отрицательных степеней окисления. Рассмотрим оксиды азота:
Так как степень окисления атомов
кислорода равна -2, то степень
окисления атомов азота можно легко
подсчитать (они приведены под
формулами оксидов).
Водород в соединениях с металлами (в молекулах гидридов металлов) имеет степень окисления равную -1. Водород в соединениях с неметаллами (как самый слабый из неметаллов) имеет степень окисления равную +1.
Итак, степень окисления атома в молекуле равна тому заряду, который был бы на данном атоме, если бы все ковалентные полярные связи стали ионными.
В качестве примера уравнивания окислительно- восстановительной реакции рассмотрим реакцию горения угля:
C + O2 = CO2,
Подытожим все сказанное.
Химические реакции, в которых атомы одного или нескольких элементов изменяют свою степень окисления, называются окислительно- восстановительными.
Окислители — это вещества, которые в результате химической реакции присоединяют к себе электроны (в разобранной реакции это и кислород, и молекулы кислорода, и атомы кислорода — можно использовать любое название).
Восстановители — это вещества, которые в результате химической реакции отдают электроны (в разобранной реакции это углерод или атом углерода).
Восстановители в результате окислительно-восстановительной реакции окисляются (у атомов восстановителя отбираются электроны).
Окислители в результате окислительно-восстановительной реакции восстанавливаются (атомы окислителя присоединяют к себе электроны).
В сульфате меди степень окисления атома меди равна +2 (Cu+2), атома кислорода -2 (О-2). При электролитической диссоциации в растворе появляются реальные ионы:
CuSO4 = Cu2+ + SO42-.
Чтобы подчеркнуть, что это реальные
ионы, числа пишут перед знаком
заряда (а в степенях окисления атомов
— наоборот).
Кроме метода электронного баланса при уравнивании окислительно- восстановительных реакций часто используется метод электронно- ионного баланса. Он иногда имеет определенные преимущества.
Окислители
Из простых веществ наиболее сильными окислителями являются неметаллы. Прежде всего это фтор и галогены. Активным окислителем является кислород (стоит на втором месте по окислительной способности после фтора). Из кислот наиболее сильными окислителями являются концентрированная азотная и концентрированная серная, из солей, особенно в кислой среде, — перманганаты и бихроматы, из оксидов — высшие оксиды неметаллов: SO3, Cl2O7 и металлов: CrO3, MnO2, Mn2O7, PbO2.
Восстановители
Из простых веществ наиболее сильными восстановительными свойствами обладают щелочные и щелочноземельные металлы. Все прочие металлы обычно располагают в электрохимический ряд напряжений:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Sn, Pb, H, Cu, Hg, Ag, Au
При высоких температурах сильными восстановительными способностями обладают углерод, окись углерода, водород.
другие статьи:
- Агрегатные состояние вещества
- Строение атома — развитие моделей
- Квантовая механика и строение атома водорода
- Электронные конфигурации атомов и периодический закон
- Ядра атомов. Радиоактивность и изотопы
- Строение молекул. Типы химической связи
- Квантовая механика молекул и теория химической связи. Метод молекулярных орбиталей. Теория спин-валентности
- Окислительно-восстановительные реакции
- Химическая термодинамика
- Химическая кинетика и катализ
- Химическое равновесие.
 Обратимые и необратимые реакции
Обратимые и необратимые реакции - Электрохимия. Свойства электролитов. Электролиз
[РУКОВОДСТВО] КОМАНДНАЯ ХИМИЯ: FUTMobile
Во-первых, извините за мой английский, но я стараюсь изо всех сил .. Я из Голландии.
Teamchemistry помогает вам создавать лучшие шансы. В этом сезоне ваша химия намного важнее, чем рейтинг вашей команды. Вы можете лучше иметь команду 82 ovr с командной химией 120, чем команду 85 ovr с командной химией 50.
Вы можете создать командную химию, связывая игроков друг с другом. 80+ игроков любят центральный защитник с вратарём.
Я надеюсь, что смогу объяснить всем, кто не знает, как работает командная химия, как это работает.
САМЫЙ ВАЖНЫЙ СОВЕТ.
В ЭТОЙ ИГРЕ ИГРОКИ ПРЕДОСТАВЛЯЮТ ХИМИЮ ДРУГИМ ИГРОКАМ. ЕГО НЕ НРАВИТСЯ ИГРА ДЛЯ КОНСОЛИ, ЧТО ОНА ЗАВИСИТ ОТ СОБСТВЕННОЙ СИТУАЦИИ.
На каких плеерах работает?
Командная химия работает только с 80+ игроками. Это означает, что если вы свяжете 79 игроков с 80 игроками, это не сработает.Где я могу найти teamchemistry?
Вы можете найти свою командную химию рядом с вашим общим рейтингом.Ниже вы можете включить командную химию, чтобы увидеть химию каждого игрока.
3. Как я могу рассчитать химию каждого игрока?
Если вы посмотрите на детали игрока, вы увидите некоторую статистику в правом углу. Вы видите такую статистику.
Итак, теперь вы знаете, как узнать, что игрок дает другим игрокам, связанным с ним в его данных.
Здесь вы можете видеть, что игроки дают +2 химии его связанным испанским игрокам, +3 его связанным игрокам «Челси» и +1 его связанным игрокам PL.
Если вы посмотрите на своих стартовых игроков с включенной химией команды, вы увидите это.
Здесь вы можете увидеть всю химию игрока. Слева (синие числа) вы видите, что игроки получают от связанных игроков. Справа (белые числа) вы видите, что он может дать всем своим связанным игрокам.
Справа (белые числа) вы видите, что он может дать всем своим связанным игрокам.
Итак, в качестве примера мы пересчитаем наших вратарей. Его химия (9/12).
Он понимает химию своих связанных игроков. Он связан только с 2 игроками. 2 центральных защитника.
Центральный защитник слева дает 4 химии всем связанным игрокам «Челси», 1 игрокам PL и 1 игрокам из Испании. Это означает, что Кепа (хранитель) получит этот химию: 4 потому что он игрок «Челси», 1 потому что он игрок PL и 1 потому что он испанский игрок. Это означает, что он получает 6 очков химии от левого центрального защитника. Правый центральный защитник дает 2 очка химии Кепе, потому что он игрок PL, и 1, потому что он испанец, так что это 3 химии.
6 + 3 химия — это 9 химия.
Теперь вы можете пересчитать собственную команду, чтобы убедиться, что теперь вы знаете, как работает химия.
Если есть советы по улучшению этого руководства, отправьте сообщение, чтобы я мог сделать его лучше для всех.
Объяснение химии в FIFA 20 — как улучшить командную химию, индивидуальную химию и максимальную химию в Ultimate Team • Eurogamer.net
Химия в FIFA 20 Ultimate Team важна. Очень важный.
На самом деле оказывается, что нахождение идеальной комбинации индивидуальной химии , командной химии и стилей химии — трех факторов, которые мы объясним ниже — может дать вам колоссальное увеличение в сумме на 90 баллов в атрибутах каждого игрока, в среднем примерно на 10 очков увеличивается для каждого навыка, на который влияет модификатор стиля химии.Это примерно эквивалентно превращению серебряной карты в золотую или стандартной золотой в первоклассную по форме редкую карту.
Они могут иметь огромное значение для вашей команды — как положительное, так и отрицательное. После того, как сообщество подробно рассказало о статистике, атрибутах и маленьких зеленых шевронах, EA Sports наконец-то раскрыла некоторые цифры, поэтому мы объясним, как все это работает, ниже в нашем руководстве по , как увеличить химический состав в FIFA 20 Ultimate Team .
Объяснение химии в FIFA 20: командная, индивидуальная и принцип работы химии в FUT
Понимание химии в FUT может показаться немного сложным для начала, особенно когда вы начинаете смотреть на фактические уравнения, лежащие в основе этого.А пока мы начнем с самого начала, объясняя, что такое химия и как она работает.
В FIFA Ultimate Team есть два типа химии, которые составляют общий рейтинг химии, плюс модификаторы стиля химии, которые влияют на их работу. Вот ключевые термины:
- Химия отдельных игроков — Оценка каждого игрока из 10.
- Командная химия — Оценка из 100 для всей команды.
- Общая химия — это скрытое число, которое происходит от комбинации химии отдельных игроков и сыгранности команды.Высокая общая химия увеличит атрибуты игрока; низкий общий химический состав фактически уменьшит их.
- Стили химии — Модификаторы, которые влияют на то, какие характеристики увеличиваются и насколько они увеличиваются, когда у вас сильная общая химия.
В конечном счете, причина, по которой вам нужен высокий уровень игрока и командная химия, заключается в том, что они увеличивают или уменьшают атрибуты ваших игроков, когда они вступают в матч, потенциально на огромную величину.
Интересно, однако, что химия игроков и командная химия не влияют на увеличение атрибута равномерно.Фактически, согласно сообщению, в котором EA Sports наконец-то раскрыла цифры химии еще в 2016 году, химия игрока составляет 75%, а командная химия — только 25% прироста атрибута игрока. Другими словами, гораздо важнее, чтобы ваша карта Обамеянга имела максимальное количество химии 10 Игрок , чем то, что ваша Командная химия насчитывала 100 — хотя это, конечно, все же помогает.
Как работает химия FIFA и как она влияет на статистику игроков?
Разобравшись с основами, мы можем перейти к деталям.
Определяется ли изменение атрибутов игрока его скрытым рейтингом Общая химия , который, как и командная химия, отмечается из 100. Если общий рейтинг химии больше 50 из 100, атрибуты игрока увеличиваются. Если он ниже 50, они уменьшатся, а если он упадет до 50, они останутся прежними. Насколько они увеличиваются или уменьшаются, зависит от того, насколько выше или ниже 50 общий химический состав этого игрока.
Наконец, EA Sports раскрыла точные цифры для этого, поэтому теперь мы точно знаем, на сколько атрибуты игрока увеличатся, если у них будет не идеальная общая химия (так, если ваша карта Роналду имеет стиль химии, который увеличивает его результативность на 15, когда у него общая химия 100, но у него только 90 из 100 общей химии в вашем стартовом XI, теперь мы знаем, что его завершение будет увеличено на 12 вместо этого.Подробнее об этом ниже!).
Как правило, это случай, когда чем выше общая химия, тем больше будет увеличение, при этом 100общее означает максимальное увеличение (которое дает 90 очков атрибутов, разбросанных по атрибутам в соответствии с прилагаемым стилем химии), а также низкий Общая химия ниже 50, тем больше снижение.
Итак, если вы хотите точно знать, какими будут индивидуальные атрибуты игрока в любой момент, вам сначала нужно узнать, какова их общая химия, затем вам нужно знать, на какие атрибуты влияет стиль химии, который вы прикрепили, и затем, наконец, вам нужно знать, как эта общая химия влияет на атрибуты этого химического стиля.Простой! Иш. Итак, начнем с общей химии.
Вот Люк Шоу, получающий максимально возможные улучшения своих характеристик благодаря 100 из 100 командной химии и 10 из 10 индивидуальной химии. Какие атрибуты усиливаются на какое количество зависит от выбранного стиля химии.Как рассчитать общий химический состав игрока:
- Умножьте его индивидуальный химический состав на 10, а затем на 0,75
- Умножьте командный химический состав на 0,25
- Сложите два результата вместе
Так, например, если У меня есть Криштиану Роналду с сыгранностью 9 игроков, а его командная химия — 90, то есть 67. 5 + 22,5, в сумме общая химия составляет 90 из 100. Это больше 50, поэтому атрибуты Роналду увеличились бы на , на , и это тоже немного больше, чем на 50, так что они увеличатся довольно сильно — почти на максимальную величину, в факт.
5 + 22,5, в сумме общая химия составляет 90 из 100. Это больше 50, поэтому атрибуты Роналду увеличились бы на , на , и это тоже немного больше, чем на 50, так что они увеличатся довольно сильно — почти на максимальную величину, в факт.
Какие атрибуты увеличиваются и на какую максимальную величину они могут увеличиваться, определяется стилями химии , которые мы объясняем — вместе с позициями, которые они лучше всего подходят — в нашем руководстве по стилям химии FIFA 20.
Здесь также стоит иметь в виду, что рейтинги химии рассчитываются в начале матча и, таким образом, на не влияют никакие замены , расстановки или общие изменения в управлении командой, сделанные после начала матча.
Насколько Химия увеличивает или уменьшает атрибуты игрока?
Точные числа теперь наконец доступны, так что вот формула:
- Общий химический состав — 50 = X
- X, деленное на 50 = Y
- Y, умноженное на «Максимальное значение ускорения» (максимальное значение атрибута может быть усиленным стилем химии) = изменение атрибута
Давайте поместим это в пример, чтобы показать это в действии, снова используя Роналду и его 90-ю общую химию, с прикрепленным стилем снайперской химии, и мы хотим выяснить влияние который имеет атрибут завершения.Как вы увидите в большом списке, который мы собрали в нашем руководстве по стилям химии, «Максимальное значение усиления» для атрибута завершения, предоставляемого стилем снайперской химии, составляет 15. Или, другими словами, с максимальной химией, карта Роналду с стиль Sniper Chem получит +15 к завершению.
- 90-50 = 40
- 40/50 = 0,8
- 0,8 x 15 = 12
- Итак, карта Роналду с общим уровнем химии 90 и стилем химии снайпера получит +12 к его завершающему атрибуту.
Вот еще пара вещей, о которых следует помнить:
- Максимальное увеличение, если у игрока 100 командных характеристик и 10 индивидуальных характеристик, составляет всего 90 очков атрибутов, распределенных в соответствии с химическим составом игрока. Стиль (даже если у них просто Базовый, он все равно распространяется по определенным атрибутам).
- Максимальное уменьшение, если у игрока указано 0 Командная химия и 0 Индивидуальная химия, это уменьшение на 25 очков в для каждого атрибута .
Хотите узнать больше о FIFA 20? Пока что у нас есть ключевые детали объяснения химии FUT и список стилей химии и затронутые атрибуты, подробное руководство по режиму FIFA 20 Volta и подробности о том, как быстро заработать монеты Volta в FIFA 20, список лучших потенциальных вундеркиндов FIFA 20. : лучшие молодые игроки и скрытые жемчужины, полные рейтинги игроков FIFA 20 и лучшие игроки 100, незавершенный список игроков FIFA 20 Ones to Watch OTW, а также полный список значков FIFA 20.Наконец, ознакомьтесь с нашими страницами SBC о решении SBC Teemu Pukki, решении SBC Йозефа Мартинеса и решении SBC Роберта Левандовски, а также на страницах, посвященных пятизвездочным скиллерам FIFA 20, а также лучшим голкиперам FIFA 20, лучшим защитникам FIFA 20, лучшим FIFA 20 полузащитники, лучшие вингеры FIFA 20 и лучшие нападающие FIFA 20, чтобы подробно изучить каждую позицию. Наконец, просмотрите последние формы в FIFA 20 TOTW, номер 40 на этой неделе, а также в нашем полном списке карт и игроков FIFA 20 Ultimate Scream.
Как повысить химию в FIFA Ultimate Team
Индивидуальная химия игроков и командная химия увеличиваются одинаково, с различными факторами, повышающими или понижающими их рейтинги.Для максимальных результатов вам нужно получить 10 и 100 соответственно, но стоит подчеркнуть, что Invididual Chemistry более важен, чем Team Chemistry, когда дело доходит до расчета в целом.
Вот как повысить химию в FIFA 20:
- Позиция игрока — Позиция игрока, отмеченная под его карточкой, будет отображаться как красная, оранжевая или зеленая. Красный означает, что они полностью не на своей позиции, что снижает сыгранность игроков и команды.Оранжевый означает, что они частично не на своей позиции, что снижает сыгранность игроков и команд. Зеленый цвет означает, что они находятся в предпочитаемой ими позиции, что увеличивает сыгранность игроков и команд.
- Ссылки на игроков — Обозначаются цветными линиями между игроками, они снова будут отображаться как красные, оранжевые или зеленые. На этот раз цвет связи определяется общими чертами двух связанных игроков (вне клуба, лиги и национальности). Красный не означает ничего общего, что снижает сыгранность игроков и команд.Оранжевый означает одну общую черту: увеличение сыгранности игроков и команд — обратите внимание, что это отличается от результата оранжевого индикатора положения игрока. Зеленый цвет означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на оранжевый. Реальный результат, однако, определяется всеми ссылками от игрока: красный отображается как -1, оранжевый как +1 и зеленый как +2. Суммируя все ссылки, вы захотите, чтобы этот игрок получил от них повышение химии.
- Менеджер — Подобно связям игроков, национальность и лига менеджера (но не клуб) влияют как на игрока, так и на командную игру. Каждый игрок, который разделяет лигу или национальность с менеджером, получит повышение химии, о чем свидетельствует маленький зеленый значок галстука на их карточке.
- Лояльность — Игроки, сыгравшие 10 или более матчей за ваш клуб, получат бонус за лояльность, увеличивающий их химический состав на 1. Об этом свидетельствует значок зеленого щита на их карточке.
Стоит отметить, что, хотя все эти факторы влияют как на командную химию, так и на химию игрока, для определенного игрока все же возможно иметь высокую командную химию и более низкую химию отдельного игрока.
Это потому, что количество командной химии, которую вы сгенерируете из вышеперечисленных факторов, может в сумме значительно превышать 100, необходимых для ее максимума — например, требуется всего лишь полный набор оранжевых связей между игроками, чтобы набрать 100 очков командной химии. , поэтому добавление некоторых зеленых ссылок означает, что вы можете поставить вратаря впереди и при этом сравнительно легко попасть в отметку 100.
Точно так же вы, очевидно, можете обойтись несколькими красными ссылками в вашем командном листе, если у вас достаточно зелени и апельсинов, чтобы их составить. Игроки в сообществе, по сути, сделали свой собственный вызов, пытаясь достичь NLW или, например, команд, которые не тратят впустую, где у каждого игрока ровно 9 игроков — ни больше, ни меньше — это опрокидывается до 10. добавив менеджера или бонуса лояльности.
Вот Люк Шоу, получающий массу вычитаний из своих атрибутов благодаря низкому общему химическому составу, вызванному очень низким индивидуальным химическим составом всего 2 из 10.Наконец, несколько слов о заменах в FIFA Ultimate Team. В своем предыдущем сообщении на форуме EA Sports пояснила, что на замену фактически не влияют обычные факторы химии отдельных игроков, перечисленные выше. Вместо этого все запасные входят в игру с фиксированным индивидуальным рейтингом химии 5 из 10, что означает, что при вводе в формулу выше их скрытый общий показатель химии будет иметь максимум 62,5 из 100. Командная химия ниже 100. конечно, понизит его дальше.
Таким образом,запасных игроков могут быть заменены на любую позицию — так что ваш LW Ronaldo может быть использован как ST — без какого-либо ущерба для их химического рейтинга.Вместо этого на их производительность влияет только командная химия, которая, как мы упоминали выше, рассчитывается до начала матча и не зависит от замен, расстановок или других изменений в управлении командой в середине игры.
Это также означает, что существует жесткое ограничение на то, насколько их атрибуты могут быть увеличены с помощью стилей химии. Поместите 62,5 общей химии в приведенную выше формулу, и показатель финиша Роналду будет увеличен всего на 4 балла (с округлением до 3,75) из максимальных 15.
FIFA 20: Имеет ли значение химия и как она влияет на качество игрока?
Химия — самая важная часть построения вашей Ultimate Team — вот как все это работает и как максимизировать ее в игре
FIFA Ultimate Team (FUT) позволяет FIFA 20 игрокам создавать команды своей мечты, но включает в себя игровая механика, известная как Chemistry , чтобы люди не могли просто вставить 11 игроков в состав, чтобы создать суперкоманду.
Химия — один из самых запутанных аспектов игры для новичков, когда они впервые начинают свое приключение в FUT, но при правильном понимании она может позволить геймерам создавать гибридные команды, включающие нескольких игроков с высоким рейтингом — даже если Криштиану Роналду и Лайонел Месси в том же XI.
Плохая химия оказывает негативное влияние на вашу команду и фактически может сделать игроков хуже, чем их рейтинги, в то время как высокая и максимальная химия повышает рейтинг, даже заставляя игроков быстрее бегать и стрелять и передавать мяч более точно.
Выбор редакции
Содержание
- Что такое индивидуальный подход игроков?
- Что такое командная химия?
- Как химия влияет на качество плеера?
- Какой химический состав есть у заменителей?
- Какие атрибуты улучшает химия?
Каждый игрок в стартовом составе получает оценку химии от 1 до 10 .Это определяется игроками, которые находятся непосредственно вокруг них на поле, а также их положением в составе. Химические преимущества этих факторов обозначены тремя цветами: красным , оранжевым или зеленым .
красный индикатор положения означает, что игрок полностью вне позиции, например нападающий, играющий в защите. Оранжевый означает, что они частично не в рабочем состоянии, например центральный защитник играет на позиции крайнего защитника. Зеленый означает, что они находятся в правильном положении.
Карты смены позиции можно купить, чтобы улучшить счет позиции игрока, например превращая полузащитника в атакующий полузащитник или левого вингера в левый полузащитник. Однако нет доступной карты позиции, чтобы сменить игрока с одной стороны поля на другую, например левый защитник превращается в правого защитника.
Главный определяющий фактор для индивидуальных взаимоотношений игроков — это их связей с другими игроками на поле. В зависимости от построения у игрока будет от двух до пяти ссылок на ближайших игроков.Они обозначены линиями, соединяющими игроков, и имеют ту же цветовую схему, что и индикатор положения: красный, оранжевый или зеленый.
Связи игроков рассчитываются по тому, сколько вещей имеет общий игрок с соседним игроком — по национальности, лиге и клубу.
Красный цвет не указывает на ничего общего, оранжевый указывает на что-то общее, а зеленый указывает на две или более общих черты. Общее количество ссылок со всеми соседними игроками затем используется для расчета индивидуальной химии ссылок, используя оценку, состоящую из -1 для красных ссылок, +1 для оранжевых ссылок и +2 для зеленых ссылок.
Иконки автоматически имеют оранжевую связь со всеми соседними игроками и зеленые ссылки с игроками той же национальности.
Химия игрока также может быть усилена на , добавив в ваш отряд подходящего менеджера . У менеджеров есть атрибуты как национальности, так и лиги, и они дадут каждому игроку +1 к их химии, если какая-либо из этих черт является общей.
Последнее, что дает повышение +1, — это лояльность игроков . Об этом свидетельствует цветной щит на каждой карте игрока.Прозрачный щит указывает на отсутствие лояльности игрока, а зеленый — на полную лояльность.
Любой игрок, полученный в наборах, через ИПК или Задачи, в которых вы являетесь «Первым владельцем», автоматически получит полную лояльность, но игроки, купленные на трансферном рынке, должны сыграть 10 игр с вашим клубом, прежде чем они получат полную лояльность.
Вернуться к началу
После того, как вы построите полную стартовую XI, соединив игроков друг с другом с помощью ссылок и добавив менеджера, вашей команде будет присвоен общий рейтинг химии из 100.
Расчет для этого прост — сложите все очки химии отдельных игроков вместе , чтобы получить общую сумму. В результате вы можете получить 100 очков сыгранности в команде без того, чтобы у каждого игрока было 10 очков химии. Это позволяет создавать гибридные команды из более чем одной лиги или страны.
Вернуться к началу
При проведении матчей в FIFA 20 и командная, и индивидуальная химия используются для расчета того, какие бонусы получает игрок.Следующая формула используется для определения того, какое усиление применяется к их атрибутам:
(командная химия * 0,25) + ((химия игрока * 10) *. 75)
Если это число больше 50, игроки получат усиленные атрибуты до максимального значения 99. Ровно 50 очков не влияет на атрибуты, в то время как все, что меньше 50, означает, что атрибуты игрока фактически уменьшаются.
Игрок с индивидуальным показателем химии 10, выстраивающийся в команду с уровнем химии 100, получит максимальное усиление, как показано в приведенном ниже примере расчета:
(командная химия *.25) + ((Химия игрока * 10) *. 75)
(100 * 0,25) + ((10 * 10) *. 75)
= 25 + 75
= 100
Игрок с индивидуальным показателем химии 7, выстраивающийся в команду с уровнем химии 100, получает усиление своих характеристик, но это будет меньше максимального количества очков, как показано в приведенном ниже примере расчета:
(командная химия * 0,25) + ((химия игрока * 10) *. 75)
(100 * 0,25) + ((7 * 10) * 0,75)
= 25 + 53
= 78
Вернуться к началу
Поскольку запасным игрокам не присваиваются индивидуальные рейтинги химии, как игрокам в стартовом составе XI, им автоматически присваивается рейтинг химии игроков, равный пяти, независимо от того, какие связи они могут иметь или не иметь с остальной частью вашей команды.В результате и Месси, и Роналду получат одинаковый счет со скамейки запасных для команды, полностью построенной из игроков Ла Лиги.
Расчет такой же, как и формула для игроков в стартовом XI, но каждый заменяющий получит только небольшое повышение своих атрибутов из-за того, что их химия игрока по умолчанию равна пяти. Это показано в примере ниже, где командная химия составляет 100:
. (командная химия * 0,25) + ((химия игрока * 10) *. 75)
(100 *.25) + ((5 * 10) *. 75)
= 25 + 37,5
= 62,5
Вернуться к началу
К каждому игроку применен свой химический стиль, на что указывает значок внизу каждой карты.
Новым игрокам применен стиль химии Basic , который будет улучшать атрибуты во всех шести областях: темп, стрельба, пас, дриблинг, отбор и физический.
Другие стили химии сосредотачиваются на двух или трех из этих областей и обеспечивают более значительные улучшения некоторых конкретных атрибутов, чем стиль базовой химии, который применяет небольшие улучшения ко многим атрибутам.
Например, базовый стиль химии дает максимум +5 ко всем этим атрибутам: ускорение, позиционирование, завершение, сила удара, залпы, штрафы, обзор, дальний пас, короткий пас, кривая, ловкость, контроль мяча, дриблинг, маркировка, Обычный отбор, скользящий отбор, прыжки и сила.
Химический стиль Hunter фокусируется на двух областях: темп и стрельба и обеспечивает следующие усиления при максимальной химии: ускорение (+15), скорость спринта (+10), позиционирование (+15), завершение (+10), Сила удара (+10), дальние удары (+5), залпы (+10), штрафы (+15).
Вернуться к началу
Таблица приоритетов функциональных групп для номенклатуры — основная органическая химия
Как определить, какая функциональная группа имеет «приоритет» для целей наименования
Вот небольшая номенклатурная дилемма.
Допустим, вы пытаетесь дать название молекуле. Вам знакомы такие знакомые суффиксы именования, как -ol, -ene, -ane, -oic acid и т. Д. Но затем вы сталкиваетесь с молекулой, которая имеет множественных функциональных групп.
Чем вы занимаетесь? Какой суффикс вы дадите молекуле?
Нам нужна какая-то система приоритетов для номенклатуры. Итак, ИЮПАК (подумайте о «Министерстве магии», но для химиков) разработал его. Если у вас есть молекула, содержащая, скажем, карбоновую кислоту и кетон, обратитесь к таблице. Функциональная группа с наивысшим приоритетом будет той, которая дает суффикс имени молекулы. Таким образом, в примере №1 выше суффикс молекулы будет «-ойная кислота», а не «-он», потому что карбоновым кислотам отдается более высокий приоритет.Однако, если кетон присутствует со спиртом (пример 3), мы будем использовать суффикс «-он», потому что кетоны имеют более высокий приоритет для номенклатуры, чем спирты.
[Вы можете спросить: на чем это основано? Это произвольное согласие ИЮПАК [источник], хотя следует отметить, что существует некоторая корреляция между степенью окисления углерода и приоритетом (более окисленные группы имеют более высокий приоритет). Однако на самом деле это пример того, что вам нужно либо найти, запомнить, либо попросить компьютер сделать за вас.Это не концептуально. ]
[Примечание: здесь учтены последние рекомендации Синей книги ИЮПАК (издание 2013 г.)]
Группы с наивысшим приоритетом: карбоновые кислоты, сульфоновые кислоты, сложные эфиры, галогенангидриды, амидыОбратите внимание, что все это производные карбоновых кислот, за исключением сульфоновых кислот. ИЮПАК описывает гораздо больше деталей, чем нам нужно здесь. [Примечание]. Для записи, эти «правила старшинства» можно найти в разделе P-41 Синей книги, стр. 428 издания 2013 г.]
«Правила старшинства» продолжаются в следующем порядке, где мы вишневые: подбираем самые распространенные примеры.
Следующие в очереди: нитрил, альдегид, кетон, спирт, тиол, амин
Опять же, это не полный список — здесь мы выбираем наиболее часто встречающиеся функциональные группы.
Алкены и алкины
Если в молекуле присутствуют кратные углерод-углеродные связи, они считаются заместителями с более низким приоритетом (или «старшинством», согласно IUPAC), чем амины.
Итак, для молекулы с алкеном и спиртом , спирт имеет приоритет, а молекула имеет суффикс «-ol».Наличие двойной связи отмечается с помощью локанта, за которым следует префикс «en-». Например, пент-4-ен-1-ол.
Если нет групп с более высоким приоритетом, суффиксом для молекулы, содержащей алкен, будет «-ен», например, в пент-1-ене.
Для алкина соответствующий префикс — «-yn», а суффикс — «yne».
На этом этапе методология наименования молекул немного меняется. В отсутствие одной из вышеуказанных функциональных групп суффиксом всегда будет «-ан», «-ен» или «-ин», в зависимости от того, присутствует ли в молекуле какая-либо ненасыщенность, и любые заместители более низкого ранга будут быть префиксами.
Алкены против алкинов: что имеет «приоритетное значение»?Это подводит нас к общему источнику путаницы в номенклатуре. Когда в молекуле присутствуют алкен и алкин , что имеет приоритет?
Это зависит от того, что вы подразумеваете под «приоритетом».
Для названия «-ene» стоит перед «-yne» в алфавитном порядке. Итак, когда алкен и алкин присутствуют в одной и той же молекуле, окончание всегда будет «ин».
Для целей номера с номером , если существует связь между алкеном и алкином для определения самого низкого локатора, алкен имеет приоритет.
ИЮПАК говорит об этом так:
Верно. Перейдем к другим функциональным группам.
Функциональные группы, которые всегда являются префиксами: галогениды, алкоксиды, азиды, нитро
Некоторые функциональные группы были признаны недостойными когда-либо получать собственные суффиксы.В целях номенклатуры они навсегда остаются вне поля зрения, подчиняются окончанию -ane, -ene или -yne родительского углеводорода (или «родительского гидрида», как его называет IUPAC).
Эти группы включают галогениды (бром, хлор, фтор, йод), простые эфиры («алкокси»), азидные и нитро функциональные группы. Источник: Таблица 5.1, Раздел P-59.1.9 Синей книги 2013 г. (стр. 630).
Некоторые примеры с несколькими функциональными группами
Вот несколько примеров применения порядка приоритетов функциональных групп для решения задач номенклатуры.Функциональная группа с наивысшим рейтингом становится суффиксом — он выделяется красным цветом.
Это охватывает большинство функциональных групп, с которыми вы встретитесь в Организации 1 / Организации 2, если вы столкнетесь с тиокетоном или какой-либо другой причудливой сущностью, вы, вероятно, захотите посмотреть Ройш или Википедию.
FIFA Mobile 20 Team Chemistry and Perks Guide
С момента своего появления Химия была очень важным аспектом в FIFA Mobile 20 . Внутриигровая химия дает преимущества в VS Attack в виде лучших шансов.Независимо от того, что вы делаете в FIFA Mobile, высокий уровень химии будет положительным моментом для вашей команды. Перки , представленные в этом году, также играют жизненно важную роль в улучшении вашего максимального уровня химии в FIFA Mobile 20.
FIFA Mobile 20 Химия: Введение
Командная химия — это то маленькое число, которое появляется справа, когда вы входите в матчи VS, где несбалансированная химия регулирует ваши шансы.
В матчах VSA химия так же важна, как и ОБЩ.Chemistry появляется только в против , это не имеет значения ни в каких других играх на ловкость или в матчах.Только против атаки и лига против лиги . Химический дисбаланс очень похож на дисбаланс OVR, поэтому он определяет ваши шансы. Чем выше ваша химия и командный ОБЩ по сравнению с оппонентом, тем больше у вас будет шансов во время противостояния. Чем хуже баланс, тем результативнее будут контратаки. Если вы сражаетесь лицом к лицу или просто играете в матчи кампании и игры на ловкость, это ни на что не повлияет. Химия вам даже не пригодится.
Химия открывается после достижения 7-го уровня и доступна только между 80 игроками с рейтингом и выше, т.е. элитными .Они обозначены сплошными линиями, соединяющими игроков. По сравнению с пунктирными линиями, соединяющими золотых игроков и ниже. Серые линии не означают никакого химического состава , а жирные неоновые Зеленые линии на другом конце спектра означают наличие химического вещества .
Как повысить командную игру в FIFA Mobile
Chemistry — это, по сути, количественная разбивка связей между игроками в вашем стартовом составе. Каждому игроку из ваших стартовых 11 дается возможное количество очков химии 12 для основных игроков или 13 и выше для участников программы событий.Иконки, например, обладают уникальной химией, которая позволяет им связываться со всеми игроками, независимо от их лиги или страны.
1. Избегайте гибридных отрядов без необходимости
Очки химии делятся между их командой, лигой и национальностью , с добавлением программы / события для участников событий. Каждому из этих атрибутов присваивается оценка, основанная на игроках, находящихся поблизости через их соединительные линии. Таким образом, по умолчанию наличие команды из одной лиги, национальности или даже клуба упрощает максимальную химию.
Пример : Суарес у нападающего получает 4 линии соединения игроков, потому что он связан с флангами, а также с центральной серединой. Однако у вратаря есть связи только с центральными защитниками, поэтому набрать максимум очков химии труднее в четырехбэк-формации.
Возвращаясь к Суаресу, мы видим, что из-за его четырех связей у него 47 очков химии, но только первые 15 засчитываются в окончательный результат команды. Альба — левый защитник, у него 21 возможный из-за другой программы.Несмотря на то, что у него 26 очков химии между его командой, он в конечном итоге набирает 21 очко за команду по сравнению с Суаресом, у которого гораздо больше химии, но он достигает максимума 15. Понимание этих аспектов делает возможным создание смешанной команды.
2. Предпочитайте использовать карты нового события, а не игроков основного / старого события
Если смотреть с точки зрения химии, числа на левой стороне эмблемы команды означают значение химии, которое он получает от своих товарищей по команде, в то время как числа в правой части указывают значение химии, которое он передает каждому из своих связанных товарищей по команде взамен. .У каждого игрока разные химические характеристики, если смотреть со стороны игрока.
Как мы видим, игроки из последних событий, таких как Bundesliga Rivals , Top Transfers и Easter , могут получить максимальное количество очков даже до 27 по сравнению с игроками прошлых программ, такими как Команда года. , которые дают от 15 до 21. Вам нужно использовать самые последние программные карты, чтобы повысить свой уровень химии. Чем больше вы используете базовых карт или игроков прошедшего события, тем сложнее будет поднять свой химикат, чтобы достичь максимума.
3. Проверьте игроков перед покупкой
Вы можете увидеть статистику химии отдельных игроков на странице с подробностями об игроке в правом нижнем углу под биографией игрока, вам нужно проверить эту статистику, когда вы исследуете игроков, которых хотите добавить в свой состав, особенно если вы пытаетесь добиться высоких химия особенно на гибрид или смешанная команда . Это позволит вам добиться максимальных результатов в этой смешанной команде из разных команд, даже лиг или национальностей.
Примечание: Химия не имеет отношения к вашей должности. Это все, что связано с вашими ссылками. Вы можете поменяться местами между членами своей команды, и это никак не повлияет на ваш результат по химии. Позиция буквально не имеет ничего общего с химией, она влияет только на усиление, связанное с игроком.
В прошлом сезоне химический состав команды к концу сезона достиг 120 единиц. В этом сезоне вы можете расширить это число за 120 с помощью перков.
FIFA Mobile 20 Perks: Введение
Перков недавно были представлены в этом году, где игроки могут участвовать в турнирах League vs League и заработать очков навыков .Эти очки навыков можно использовать для продвижения по пути прогресса и получения наград для вашей учетной записи.
Ваше вознаграждение в очках навыков за победу, ничью и поражение в турнире лиги также увеличивается с ростом вашего ранга славы в лиге. По мере того, как вы зарабатываете очки навыков, вы сможете потратить их в дереве навыков, чтобы заработать составов , OVR , Max Chemistry и Chemistry Boost .
Добавление химии с помощью перков
Есть макс. Перков химии , которые повышают максимальную химию команды на 10 ед.В настоящее время на курсе перков доступно в общей сложности 150 макс. Химии. Это означает, что вы можете увеличить свою команду до 270 человек по химии. Поскольку в будущих обновлениях будет добавлено больше перков, вы можете подняться еще выше.
Этот перк увеличивает ваш счет по химии на 10.Помимо повышения уровня химии в вашей команде, есть также другие перки химии, которые добавляют бонусной химии к существующей команде. Это не просто максимум, который вы можете взять в свою команду, но они фактически добавляют химию прямо поверх того, что у вас уже есть.Прямо сейчас есть плюс 55 в пределах вашей максимальной химии 270, если у вас есть все эти перки. Так что, если в вашей команде 250 хим, даже с перками вы получите максимум 270.
Вы можете повысить свой счет химии с помощью перков.Помните , когда вы ищете возможных игроков для включения в свой состав, вы можете проверить их химическую статистику на странице с подробностями. вы даже можете посмотреть на игроков на рынке , щелкнув по ним и просмотрев их биографические данные. Это подводит итог.Химия объяснила!
Не стесняйтесь задавать любые вопросы в разделе комментариев ниже, я обязательно отвечу всем.
Надеюсь, вы найдете это руководство FIFA Mobile 20 Team Chemistry and Perks Guide полезным. Чтобы увидеть больше подобных руководств, обязательно подпишитесь на Gamingonphone в Facebook и Twitter.
Руководство по химии FIFA 20 для Ultimate Team
Это крупнейшее и наиболее полное руководство по химии в FIFA 20 для Ultimate Team.Мы провели глубокий поиск и нашли все, что можно обсудить по этой теме, включая влияние химии, замены, управление командой и способы достижения наилучшего возможного взаимодействия. Поскольку химия чрезвычайно важна в FUT 20, обязательно прочтите это руководство.
FIFA 20 ХИМИЯ
ОПРЕДЕЛЕНИЕ | ОСНОВЫ | ФАКТОРЫ | БОНУС | ЛУЧШАЯ ХИМИЯ | ЗАМЕНЫ | СТИЛИ | СОВЕТЫ | ОШИБКИ | МНЕНИЕ | FAQ
ФИФА 20 Химия
Что такое химия в FIFA 20 для Ultimate Team?
Наши игровые навыки — не единственное, что важно для победы в матче.Эффективность наших игроков на поле и команды в целом напрямую зависит от трех основных факторов:
✔️ Атрибуты игрока;
✔️ Химия;
✔️ Фитнес игрока.
Игра FIFA 20 Chemistry играет фундаментальную роль в производительности вашей команды, поэтому ее нельзя игнорировать. Он показывает, насколько хорошо игрок будет играть в игре. Низкие значения химии будут препятствовать способностям игроков, в то время как высокие значения химии приведут к хорошей игре.
Он оценивает здоровье каждого члена клуба. Другими словами, химия — это фактор, который помогает игре, взаимодействуя со знакомством игрока с его позиционированием, отношениями с другими игроками и менеджером.
В конце концов, это то, чем занимается химия. Возьмите все эти ситуации, взвесьте, насколько они могут принести пользу команде, и перенесите их на четыре строки этой оценки. В общем, введение в химию в Ultimate Team сделано для того, чтобы придать игре больше логики и сделать создание команды более сложным, интересным и разнообразным.
Основные понятия
Что нужно знать о FIFA 20 Chemistry
Первая идея, которая должна присутствовать, — это то, что химия важна для успеха любой команды. По крайней мере, так говорят EA. В предыдущих выпусках они заявляли, что « — бронзовая команда с химией 100 может без больших трудностей выиграть золотую команду без химии ». Вот почему к этому нужно относиться серьезно, когда вы планируете создать новую команду.
Другая важная концепция, которая не всегда присутствует, состоит в том, что существует два вида химии: индивидуальная химия каждого игрока и химия команды. Оба влияют на игру игроков на поле.
Индивидуальный химический состав варьируется от 0 до 10, а химический состав команды — от 0 до 100. Значения химического состава можно просмотреть в меню активного отряда, как показано на изображении выше. Химический состав команды всегда отображается слева, в то время как индивидуальный состав команды находится прямо под карточкой игрока и может быть отображен только в том случае, если вы выберете представление «Информация об игроке».
Любой игрок должен иметь цель построить команду с максимально возможной химией. Чем выше значение, тем лучше. Приоритет должен быть отдан индивидуальной химии, близкой или равной 10. Также хорошо получить 100 очков химии в команде.
Химический состав команды зависит исключительно от выбора игрока. Он выше или ниже в зависимости от игроков, которых он выберет для стартовых одиннадцати, менеджера, которого он выберет на скамейку запасных, и расположения каждого из игроков.Таким образом, он меняется от матча к матчу.
Теперь, когда вы уже знаете, что такое химия, пора узнать, что она делает на практике.
Химия напрямую влияет на потенциальную эффективность команды во время матча. Точнее, по атрибутам игроков. Таким образом, в начале каждого матча на атрибуты игроков напрямую влияет их индивидуальная химия, а также зависимость команды от активного стиля химии. Значение химии, которое используется в игре, представляет собой средневзвешенное значение химии отдельного игрока (75%) и химии отряда (25%).
В отличие от многих людей, иметь индивидуальное значение химии, равное 10, гораздо важнее, чем значение 100 на индикаторе химии отряда. Даже потому, что индивидуальная химия не только весит три четверти химии, используемой в игре, но также напрямую влияет на химию отряда.
Как влияет химия в FIFA 20
Что влияет на химию и как ее улучшить?
Химия измеряет несколько факторов, которые считаются достаточно важными, чтобы повлиять на производительность игрока.
Вот что влияет на игрока. Химия в FIFA 20 Ultimate Team:
✔️ Его ПОЗИЦИЯ
Если он играет в своей естественной позиции или, по крайней мере, в аналогичной позиции.
✔️ Его ССЫЛКИ с товарищами по команде
Если рядом с ним игроки одной национальности или играют в той же лиге или / или клубе, что и он.
Позиция игрока
Игроки привыкли играть на определенной позиции, но они могут адаптироваться к аналогичным позициям.То же самое происходит в FUT 20.
Согласно своему расположению, игрок может оказаться в одной из следующих ситуаций:
✔️ Играет в своей естественной позиции;
✔️ Играть в позиции, очень похожей на его естественную позицию;
✔️ Игра в позиции, которая имеет некоторое сходство с естественной позицией;
✔️ Игра в позиции, которая сильно отличается от естественной позиции.
Состояние позиции находится непосредственно под карточкой игрока: зеленый означает, что он играет на своей естественной позиции, оранжевый означает, что он играет на адаптированной позиции, а красный означает, что он играет на позиции, которая сильно отличается от естественной. должность.
Естественное положение игрока показано на его карточке. Позиция, на которой он собирается играть, отображается в меню активного отряда. Первая ситуация (зеленая) относится к случаям, когда обе позиции совпадают. Это величайшая ситуация, приносящая пользу химии.
Когда игроку поручено играть в странной для себя позиции, это сильно влияет на химический состав. Вратари — хороший тому пример. Они могут только хорошо играть по воротам и являются единственными игроками, которые не могут адаптироваться к любой другой позиции.
Когда предпочтительная позиция игрока не совпадает с позицией, которую он собирается играть, это можно исправить, применив карту модификатора позиции. Эти карты могут быть успешно применены только в том случае, если они показывают текущую предпочтительную позицию игрока и ту, которую он будет играть. Вы можете узнать об этом подробнее здесь.
Чтобы узнать, к каким позициям игрок может адаптироваться, обратитесь к следующей таблице:
Зеленый — естественное положение | Желтый — очень похоже | Апельсин — некоторое сходство | Красный — совсем другойОтношения с другими игроками
Чем больше у двух игроков общего, тем выше будет химия и лучше они будут играть.
Химические связи — это связи между игроками в команде. Когда два игрока помещаются рядом друг с другом, они образуют соединение. Эта связь представлена цветной ссылкой в соответствии с интенсивностью связи (нация, лига и клуб). Поскольку Иконки не связаны ни с какой лигой или клубом, есть небольшие различия в том, как рассчитать их химический состав в FIFA 20. По сути, они хорошо связываются с другими иконками, как обычные игроки связываются со своими товарищами по команде.
Ссылки по химииможно разделить на четыре категории, как вы можете видеть в следующей таблице.
| КАТЕГОРИЯ | ИГРОК | ЗНАЧОК | |||
|---|---|---|---|---|---|
| 🌍 НАЦИЯ | ⚽ ЛИГА | 🏴 КЛУБ | 🌍 НАЦИЯ | ⭐ ЗНАЧОК | |
| ⚫⚪⚪⚪ ГЕРМАНИЯ | ❌ | ❌ | ❌ | – | – |
| ⚫⚫⚪⚪ СЛАБАЯ СВЯЗЬ | ✅ | ❌ | ❌ | ||
| ⚫⚫⚪⚪ СЛАБАЯ СВЯЗЬ | ❌ | ✅ | ❌ | ❌ | ❌ |
| ⚫⚫⚫⚪ СИЛЬНАЯ ТЯГА | ✅ | ✅ | ❌ | ✅ | ❌ |
| ⚫⚫⚫⚪ СИЛЬНАЯ ТЯГА | ❌ | ✅ | ✅ | ❌ | ✅ |
| ⚫⚫⚫⚫ HYPER LINK | ✅ | ✅ | ✅ | ✅ | ✅ |
Мертвые звенья — самые слабые и, следовательно, самые неблагоприятные для химии.Гипер — самые сильные и самые полезные соединения для химии.
Независимо от формирования команды, игрок должен быть связан с 2, 3, 4, 5, 6 или 7 товарищами по команде. Чем сильнее эти связи, тем выше будет индивидуальная химия игрока. Вот почему большинство команд FUT 20 построены на основе лиги или национальности. Таким образом можно исключить мертвые звенья и гарантировать высокую химию.
Отношения между игроками тоже можно улучшить, но для этого необходимо скорректировать команду.Прежде чем покупать игроков для команды, геймеры должны проверить интенсивность связей, которые они получат. Если они настолько слабы, что могут повлиять на химию, они должны найти игроков, которые могут хорошо сочетаться в зависимости от их национальности, лиги или клуба.
Интенсивность связи между двумя игроками — это просто графическое представление. Это не означает, что эти игроки, в частности, хорошо играют друг с другом, если их соединение зеленого цвета. Что действительно имеет значение для индивидуальной химии, так это сумма интенсивностей связей, которые имеет конкретный игрок.Это влияет на характеристики каждого игрока, и не обязательно на его отношения с товарищами по команде.
Цветные ссылки: зеленый для гипер и сильной ссылки, оранжевый для слабой и красный для мертвой ссылки.Бонусная химия
Как получить до двух дополнительных очков химии?
Как мы уже объясняли, химия FIFA 20 основана на позиции игрока и его связях. Однако также доступна дополнительная химия. Они основаны на:
✔️ Его отношения с МЕНЕДЖЕРОМ
Если его менеджер из той же лиги или национальности
✔️ Его ЛОЯЛЬНОСТЬ клубу
Если он сыграл более 10 матчей или если это его первый клуб
Отношения с менеджером
Расширять контракты — не единственная роль менеджера.Каждому игроку он может дать дополнительное очко химии.
Есть две характеристики менеджера, которые будут влиять на химию игрока:
✔️ Его ГРАЖДАНСТВО
✔️ Его ЛИГА
У хорошо понимающего менеджера больше шансов на успех, чем у менеджера с худшими отношениями с игроками. Вот почему химия улучшается, если национальность менеджера и / или лига менеджера такая же, как у большинства игроков.
Национальность и лига игроков и менеджеров указаны на лицевой стороне их карточек.Чтобы получить бонус менеджера, вы должны попытаться сопоставить национальность менеджера или лигу менеджеров с большим количеством игроков из начальных одиннадцати. Обратите внимание, что это может быть не всегда так. Например: если все игроки, кроме одного, принадлежат к одной конкретной лиге и уже имеют индивидуальную химию 10, может быть лучше попытаться сопоставить лигу менеджеров с лигой единственного игрока, у которого нет возможной более высокой химии.
Если лига тренера не совпадает с лигой игрока, это можно исправить, применив карту модификатора лиги.Вы можете узнать об этом подробнее здесь.
Бонусы менеджера представлены значками на карточке игрока. Зеленый значок означает, что игрок получает бонус, потому что он, по крайней мере, той же национальности или той же лиги, что и менеджер.
Верность клубу
Лояльность была разработана для дополнительного вознаграждения игроков UT за открытие пакетов или удержание игрока на продолжительное количество игр. После 10 матчей игры с одним и тем же игроком или с использованием игрока, взятого из колоды, игрок получит бонус к своей индивидуальной химии.Ему нужна только одна из этих двух вещей, чтобы получить бонус.
Получить этот бонус очень просто. Даже если покупка пакетов необычна, игроку просто нужно сыграть 10 матчей с этой картой, чтобы получить бонус.
Бонусы лояльности представлены значками на карточке игрока. Зеленый значок означает, что игрок получает бонус, потому что он сыграл десять или более матчей в этом клубе или потому что это его первый клуб (или оба).
Лучшая химия из возможных
Насколько высока может быть индивидуальная химия?
Вы уже поняли, что для достижения высокого уровня химии вы должны поставить каждого игрока на его естественные позиции и установить между ними прочные связи.Однако, поскольку химическая математика немного сложна, вы не всегда знаете, занижаете или переоцениваете эти два фактора. Вот почему мы предлагаем вам простой метод достижения максимальной химии в нужном количестве.
Начнем по ссылкам. Предполагая, что каждая лига, клуб или национальность представляют собой одно очко, соотношение между этими очками и количеством ссылок говорит нам, достигнете ли вы максимальной химии в четырех различных сценариях:
✔️ Игроки в нужной позиции и с бонусом менеджера или бонусом лояльности
Сумма очков должна быть равна или больше количества ссылок
✔️ Игроки в правильной позиции без бонуса
Сумма очков должна быть 1.В 6 раз больше, чем количество ссылок
✔️ Игроки на соответствующей должности и с бонусом менеджера или бонусом лояльности
Сумма очков должна быть в 1,6 раза больше, чем количество ссылок
✔️ Игроки на соответствующей должности и с бонусом менеджера и бонусом лояльности
Сумма очков должна быть равна или больше количества ссылок
Вам нужна помощь, чтобы понять, как это работает? Давайте посмотрим на пример. Представьте, что игрок на своей исходной позиции соединяется с тремя товарищами по команде, все из одной страны, но из разных лиг и клубов.У этого игрока будет 3 очка и 3 ссылки, что означает, что он достигнет максимальной химии, только если он также получит бонус менеджера или бонус за лояльность.
Как вы знаете, для достижения хорошей химии нужно больше, чем просто хорошие ссылки. В следующей таблице показано максимальное количество химии, которое может получить игрок, играя не в своей естественной позиции. Эти значения не включают в себя бонус менеджера и бонус за лояльность, поэтому можно добавить еще два балла.
| ЕСТЕСТВЕННОЕ ПОЛОЖЕНИЕ | ПОЛОЖЕНИЕ, ГДЕ ИГРОК | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ГК | РБ | CB | LB | RWB | LWB | CDM | СМ | CAM | RM | LM | RW | LW | CF | РФ | LF | ST | |
| ГК | 10 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| РБ | 2 | 10 | 5 | 5 | 9 | 2 | 2 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| CB | 2 | 5 | 10 | 5 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| LB | 2 | 5 | 5 | 10 | 2 | 9 | 2 | 2 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 2 | 2 |
| RWB | 2 | 9 | 2 | 2 | 10 | 5 | 2 | 2 | 2 | 5 | 2 | 5 | 2 | 2 | 2 | 2 | 2 |
| LWB | 2 | 2 | 2 | 9 | 5 | 10 | 2 | 2 | 2 | 2 | 5 | 2 | 5 | 2 | 2 | 2 | 2 |
| CDM | 2 | 2 | 5 | 2 | 2 | 2 | 10 | 9 | 5 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| CM | 2 | 2 | 2 | 2 | 2 | 2 | 9 | 10 | 9 | 5 | 5 | 2 | 2 | 2 | 2 | 2 | 2 |
| САМ | 2 | 2 | 2 | 2 | 2 | 2 | 5 | 9 | 10 | 2 | 2 | 2 | 2 | 9 | 2 | 2 | 2 |
| RM | 2 | 5 | 2 | 2 | 5 | 2 | 2 | 5 | 2 | 10 | 5 | 9 | 2 | 2 | 5 | 2 | 2 |
| LM | 2 | 2 | 2 | 5 | 2 | 5 | 2 | 5 | 2 | 5 | 10 | 2 | 9 | 2 | 2 | 5 | 2 |
| RW | 2 | 2 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 9 | 2 | 10 | 5 | 2 | 9 | 2 | 2 |
| LW | 2 | 2 | 2 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 9 | 5 | 10 | 2 | 2 | 9 | 2 |
| CF | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 9 | 2 | 2 | 2 | 2 | 10 | 5 | 5 | 9 |
| РФ | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 5 | 2 | 9 | 2 | 5 | 10 | 5 | 5 |
| LF | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 5 | 2 | 9 | 5 | 5 | 10 | 5 |
| ST | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 9 | 5 | 5 | 10 |
Химия заменителей
Как химия FIFA 20 работает на замену?
Запасные не учитываются при расчете химии в FIFA 20.И уж тем более резервов. Химический состав команды учитывает только суммирование индивидуальных химикатов стартовых одиннадцати. Кроме того, находясь на скамейке запасных, запасные не участвуют во взаимоотношениях игроков. Это означает, что у них нет индивидуальной химии, и их вклад в химию отряда просто нулевой.
До сих пор мы полагаем, что это очень легко понять. Однако возникают очень уместные вопросы: если мы произведем замену, каков будет химический состав игрока, который выходит, и как это повлияет на химию команды? Что будет, если мы поменяем расстановку во время матча?
Начнем с химии заменителей.Согласно официальной информации, предоставленной EA, каждый игрок, который выходит на замену, делает это со статической индивидуальной химией, равной 5. Как и любой другой игрок, на его характеристики также влияет химия команды (25%), но он этого не делает. влияют на эту химию. Неважно, какого игрока он заменит, потому что он не примет химию этого игрока. У него всегда будет индивидуальная химия 5, независимо от того, какие качественные связи он установит с товарищами по команде. То есть вам не нужно выбирать игроков на скамейку запасных, которые имеют ту же национальность, лигу или клуб, что и те, кто входит в начальные одиннадцать, потому что химия того, кто входит, всегда будет одинаковым, независимо от того, какого игрока является.То же самое и с его позицией: не имеет значения позиция игрока, который входит. Химия будет одинаковой, идет ли он к воротам или занимает любую другую позицию на поле.
Для тех, кто не знал о том, что здесь объяснялось, это может рассматриваться как возможность. Становится возможным использовать того игрока, которого мы всегда хотели, но не могли использовать, потому что он совсем не подходил для нашей команды. Мы также можем адаптировать игроков к другим позициям, которые обычно не имеют качественного выбора. Однако у всего есть своя цена.В этом случае контракты были бы потрачены. Кроме того, нам пришлось бы прервать матч, желательно в начале, чтобы произвести эти замены, что было бы довольно скучно.
Поскольку это одна из самых распространенных ошибок, мы должны помнить, что вы должны делать замену только в том случае, если игрок, который входит, достаточно лучше, чтобы подавить разницу в химии между ним и тем, кто выходит. И эта разница все еще значительна. Например, Дэнни Роуз на старте может играть лучше, чем почти все левые защитники, если они его заменят, за исключением Дэвида Алабы, Алекса Сандро и, возможно, Марсело.
Вот еще один интересный факт: когда в игре, управление командой не влияет на химию, это включает, но не ограничивается изменениями расстановки и позиции. Это означает, что вы можете менять расстановку и тактику сколько угодно раз, чтобы это не повлияло на характеристики игроков. Кроме того, вы также можете свободно менять положение игроков, чтобы это не мешало их игре. Да, вы можете поставить RW Mbappé как ST без потери качества, если вы делаете это во время игры.
Стили химии FIFA 20
Что такое стили химии и как они работают?
Стили химии были созданы для перераспределения характеристик, которые получат повышение химии. Эти расходные материалы позволяют вам выбирать, какие характеристики будут изменены, но не в зависимости от того, насколько они будут изменены. Это зависит от вашей химии. Если вы получите индивидуальную химию 10, вы получите максимально возможное улучшение выбранных вами характеристик.
На карточке игрока мы можем найти две вещи о стилях химии в FIFA 20.Первый — это название стиля, который активен в этом проигрывателе. Второй — маленькие стрелки, показывающие, на какие характеристики будет влиять химия и максимально возможное повышение характеристик. Эти стрелки могут быть белыми или зелеными. Белая стрелка указывает на возможное усиление, которое не получено, что будет означать, что у игрока в настоящее время недостаточно высокий уровень химии, чтобы получить максимальную выгоду. Зеленая стрелка указывает, что характеристика будет повышена. Чем больше стрелок на статистику, тем больше будет доступное усиление.Чем больше зеленых стрелок на статистику, тем больше будет повышение. Максимальное количество заполняемых шевронов — 6. Эти шевроны являются только индикаторами. Не обязательно означает, что рассматриваемый атрибут будет увеличен на то же количество очков, что и количество шевронов, закрашенных зеленым.
Существует 24 стиля химии, и все они имеют максимум шесть стрелок, которые можно назначить различным атрибутам. Когда игрок выпускается на карту, его химический стиль является базовым (BAS), стартовым стилем.Это означает, что все его шесть атрибутов могут быть улучшены одним и тем же способом с помощью одной стрелки. Одна зеленая стрелка дает небольшое усиление связанного атрибута, две зеленые стрелки дают среднее усиление, а три дают максимально возможное усиление. Для стилей химии, влияющих на три атрибута, максимальное усиление каждого из них — две зеленые стрелки. Для стилей химии, влияющих на два атрибута, максимальное усиление каждого из них — три зеленые стрелки.
Стили химии — важная часть химии, и по этой причине это длинный предмет.Чтобы сделать это руководство как можно короче, мы попросим вас прочитать здесь больше о стилях.
Стартовые наконечники
С чего начать, чтобы получить хорошую химию в FIFA 20?
Если вы читали то, что мы написали в этой статье, то вы уже знаете, что делать, чтобы создать команду с хорошей химией. Для тех, кто все еще чувствует себя немного дезориентированным, мы дадим несколько советов о том, как создать команду с хорошей химией в FIFA 20 Ultimate Team.
Во-первых, нам удобно определить, что такое «хорошая химия». Для нас команда с очень хорошим химическим составом — это команда, у которой все индивидуальные химические свойства равны 10. Очевидно, что не всегда возможно создать команду нашей мечты, полную индивидуальных химикатов из 10, но мы должны постараться сделать их никогда не ниже 7.
Если вы еще не являетесь экспертом в этом вопросе, первым делом нужно определить, что будет общего у игроков. Нам нужно, чтобы у них были хотя бы слабые связи, поскольку наиболее нормальным для нас является принадлежность к национальности или лиге для построения нашей команды.Команда, в которой все игроки из одной лиги или одной национальности, будет иметь очень хороший химический состав, поскольку игроки находятся на своих естественных позициях. Согласно нашей таблице, все они получат, по крайней мере, индивидуальную химию на 9. Достаточно иметь менеджера этой лиги или национальности, чтобы получить максимально возможную химию.
Мы не должны забывать копить монеты, чтобы инвестировать в химию. Как уже было сказано, позиционирование игроков может корректироваться в большинстве случаев, если у нас есть для этого бюджет.Если все игроки играют на своих естественных позициях, это значит, что наполовину прошло.
Один из приемов создания этой команды — это знать, как ее спланировать, прежде чем мы начнем. Недостаточно просто иметь общее представление, потому что мы можем начать покупать игроков и в конце понять, что у нас недостаточно связей. Итак, если мы уже выбрали, что будет общего у наших игроков, пора визуализировать, что мы собираемся сделать для нашей команды. Нарисовать царапину или использовать концепт-команду — это хороший ход.
Если вы уже создали команду с хорошими связями между игроками и с игроками на их естественных позициях, вы уже сделали самую сложную часть. Самые простые очки химии даются активным менеджером и лояльностью. Убедитесь, что национальность и лига менеджера хорошо представлены среди игроков с более низким уровнем химии, и, если вы не используете игроков, которые у вас собраны в пакетах, постарайтесь как можно скорее достичь десяти игр, чтобы извлечь выгоду из двух дополнительных очков.
Если вы сделали все, что мы здесь сказали, то мы гарантируем вам, что химия вашей команды будет максимально возможной. Если вы планируете создать гибридную команду с высоким уровнем химии, ознакомьтесь с нашими специальными приемами здесь.
Распространенные химические ошибки
Какую осторожность нужно проявлять при создании команды с хорошей химией?
Есть три основных типа ошибок при создании команды с хорошей химией в FIFA 20 Ultimate Team:
✔️ Игроки недооценивают важность химии.
В первой ситуации некоторые игроки, кажется, не знают, как химия влияет на игру, или просто считают, что это всего лишь миф.Они скорее построят команду из игроков, которые им нравятся, независимо от химии. Они не знают, что их развитие может быть лучше, если они немного изменят команду, заменив нескольких игроков. Не нужно отказываться от всех своих предпочтений. Если только они не начинают FUT 20, этих игроков можно легко идентифицировать по тому, что их химия ниже 60 (невозможно увидеть индивидуальную химию противника).
✔️ Игроки переоценивают химию
Есть и те, кто ставит химию превыше всего.В экстремизме нет необходимости. Если вы будете следовать всем нашим основным советам, вы сможете попасть в эту группу. Фактически, любой, у кого есть все стартовые одиннадцать с индивидуальной химией 10, может оказаться в этой ситуации. FUT 20 позволяет игрокам достичь максимальной химии несколькими способами. Если мы применим все эти методы для достижения химии выше максимального значения, мы определенно переоценим эту концепцию. Проблема в том, что мы можем нанести ущерб качеству или разнообразию нашей команды, не пользуясь этим.Вот почему так важно знать, как химия работает в FIFA 20. Обладая этими знаниями, мы можем создавать команды, у которых есть только то, что действительно необходимо для достижения максимальной химии. Команды, состоящие исключительно из игроков одной лиги, клуба или национальности, почти всегда являются типичными случаями «химического мусора».
✔️ Игроки не дают правильного баланса химии.
Третья группа, вероятно, самая распространенная: те, кто допускает ошибки при построении команды из-за отсутствия знаний о том, как это делать.Это происходит потому, что во многих случаях большинство источников информации недостаточно ясны или даже неверны в отношении того, что они говорят об этой теме. Геймеры FUT придерживаются здравого смысла, считая, что хорошая химия — это 100 единиц химии. Это неправильно. У нас может быть командная химия из 100, в которой индивидуальная химия одного игрока равна нулю. На самом деле это не желаемая химия. Индивидуальная химия на самом деле больше влияет на атрибуты, установленные во время матчей. У этих игроков обычно есть командная химия из 100, но несбалансированная индивидуальная химия.У кого-то 10, у кого-то меньше 8. Есть также некоторые игроки, которые считают химию более важными, чем химию. Это неправда. Один игрок без химии не нуждается в химическом стиле. Это не имеет никакого эффекта.
Наше мнение о FIFA 20 Chemistry
Что не так с химией?
Мы полностью независимы, и это здорово для нас, когда мы можем хвалить или критиковать то, что мы считаем хорошим или плохим.В целом, мы считаем, что EA выполняет достойную работу. Это правда, что есть проблемы с сервером, предметы, которые застревают в куче обмена, постоянные ошибки игрового процесса и т.д. Но когда дело доходит до правил, FUT была хорошо сделанной и реализованной игрой. Система химии — хороший тому пример. Оно работает. Или так не будет?
Не все имеет смысл в химии FIFA 20. Мы не понимаем, почему EA так скрывает это. Большая часть информации, которую мы опубликовали в этой статье, недоступна для обычного игрока, который не хочет тратить дни, пытаясь понять, как работает химия.
Лучший пример того, что мы говорим, — это то, как ссылки и позиции игроков распределяются в соответствии с цветами, которые указывают на интенсивность. Гипер и сильные связи окрашены в зеленый цвет, что не позволяет различать их между собой. Кроме того, статус позиции игрока обозначается только одним цветом, оранжевым, что не позволяет провести различие между теми, к которым игрок сможет адаптироваться. Достаточно просто ввести еще один цвет.Мы можем только думать, что это было сделано намеренно, чтобы они могли держать секреты химии подальше от игроков.
Наш химический анализ не заканчивается на EA. Игроки также участвуют в игре. Многие настаивают на том, что в игре нет химии. Мы считаем, что это неправда, но мы понимаем сомнения, особенно после Chemgate. Этот сбой был обнаружен сообществом FIFA в 2016 году, когда они обнаружили, что бонусы за химические характеристики не применяются должным образом ко всем картам, не относящимся к 1-му дню.Они всегда предполагали, что индивидуальная химия равна 4, что означает, что их характеристики не получили никакого повышения (0 зеленых шевронов) от стилей. Другими словами, игроки платили больше за карты, которые должны были работать лучше, чем соответствующие NIF, но они этого не сделали.
Есть также те, кто считает, что химию следует исключить из FUT 20. Мы уважаем их мнение, но считаем, что эти люди вообще не понимают, как работает FUT. Частью удовольствия от этого игрового режима является возможность создать команду, с которой мы сможем идентифицировать себя.Если бы не было химии, задача построения команды была бы меньше, а разнообразие команд уменьшилось бы.
FIFA 20 Часто задаваемые вопросы по химии
Наиболее часто задаваемые вопросы о химии FIFA 20
В: Что такое химия?
A: Химия показывает, насколько хорошо игрок потенциально будет выступать в игре.
Q: Стоит ли создавать команду с высокой Химией?
А: Да.Высокая химия означает лучшую производительность для ваших игроков.
В: Что влияет на химию игрока?
A: Его должность, его связи с товарищами по команде и с менеджером, а также его преданность клубу.
Q: Как получить бонус за лояльность?
A: Используйте карту, которую вы получили в колоде, или сыграйте с одним и тем же игроком 10 матчей.
В: Что важнее: индивидуальная химия или химия команды?
A: Индивидуальная химия.
Q: Какая максимальная химия возможна?
A: 10 для индивидуальной химии и 100 для командной химии.
В: Добавляют ли менеджеры какие-либо бонусы непосредственно к командной химии?
A: Нет. Менеджеры увеличивают индивидуальную химию, что, в свою очередь, увеличивает командную химию.
Q: Нужен ли мне менеджер, чтобы достичь максимальной химии?
A: Нет, но помогает. Менеджер не улучшает химию команды напрямую.Они могут дать один балл индивидуальной химии. В некоторых случаях возможно получить индивидуальную химию 10 даже без бонусов.
Q: Есть ли разница между золотыми, серебряными и бронзовыми менеджерами?
A: По химии нет.
Q: Не могу получить максимальную химию. Какой минимум вы мне порекомендуете?
A: Если по какой-то причине вы не можете получить максимум химии, вы должны попытаться набрать как минимум 7 баллов индивидуальной химии и 90 баллов за химию команды.
В: У меня уже есть отряд с уровнем химии 100. Это все, что имеет значение, верно?
A: Нет. Атрибуты игроков в игре изменены компонентом, в котором эти 100 весят 25%, а индивидуальная химия весит 75%. Из-за этого, помимо гарантии 100 очков за химию команды, важно получить наилучшую индивидуальную химию (10) для максимально возможного количества игроков.
В: Может ли индивидуальная химия игрока превзойти 10?
A: Теоретически да.Математически индивидуальная химия варьируется от 0 до 12. Это дает игрокам новые способы достичь максимальной химии. На практике значение химического состава выше 10 имеет тот же эффект, что и значение химического состава 10.
В: Что лучше: игрок с высокой индивидуальной химией в команде с низким уровнем химии или игрок с низкой индивидуальной химией в команде с высоким уровнем химии?
A: Для этого игрока лучший вариант — это первый вариант. Однако, если в команде низкий уровень химии, это может указывать на то, что у других игроков тоже низкий уровень химии, и это нехорошо.Если вы хотите узнать, какая химия в игре у каждого игрока, используйте это уравнение: Химия = (Индивидуальная химия x 0,75) + (Командная химия x 0,025)).
В: Игрок, у которого плохие связи с некоторыми товарищами по команде и хорошие связи с другими, играет с ними по-другому?
A: Нет. Красные соединения — это просто графические обозначения. То, как играет каждый игрок, зависит исключительно от его индивидуальных особенностей и химии команды. Он будет играть со всеми одинаково.
В: Что такое стиль химии?
A: Стили химии позволяют игрокам выбирать, на какие характеристики будет влиять химия.
Q: Что означают белая и зеленая стрелки?
A: Белая стрелка указывает на возможное повышение, которое не получено. Зеленая стрелка указывает, что характеристика будет повышена. Чем больше зеленых стрелок на статистику, тем больше будет повышение.
В: Что произойдет, если я не получу максимум химии?
A: Чем выше химия, тем выше будет усиление.Если у вас низкий химический состав, ваша статистика получит более низкие бонусы.
Объяснение системы химии в FIFA 21 Ultimate Team
Укрепление химии в FIFA 21 Ultimate Team — это простой способ повысить возможности вашей команды на поле. Эта система использует общие нации, лиги и клубы для соединения игроков, обеспечивая повышение характеристик, зависящее от расположения и лояльности, чтобы ваша команда лучше играла в сети. Система химии в FIFA 21 многогранна. Это также может сбивать с толку, поэтому в этом руководстве мы рассмотрим всю структуру, чтобы помочь вам разобраться в том, как все это работает, чтобы вы могли сосредоточиться на своей игровой производительности, как только вы нажмете неуловимая 100 химическая цель.У каждого игрока в Ultimate Team есть химическая статистика, набранная из 10. Когда вы смотрите на свой внутриигровой отряд, один раз щелкните правым джойстиком вправо, чтобы увидеть рейтинг под карточкой игрока. Просматривая этот оверлей, вы должны увидеть, где находятся сильные и слабые звенья в вашей команде. Общее количество командных взаимодействий ограничено 100, поэтому вы хотите улучшить химию отдельных игроков, чтобы достичь этой цели.
Вы играли в FIFA 21: Next Level Edition?
ДА НЕТ
Химия увеличивается, когда два игрока, связанных выбранной вами формацией, разделяют нацию, лигу или клуб.Итак, если у вас бок о бок есть два игрока из одной страны, одной лиги и одного клуба, у вас будет идеальная химическая связь 10/10 между этими двумя членами команды, при условии, что они находятся в нужном месте. в вашем построении, играя роль, обозначенную их карточкой игрока.Вы должны видеть линии, соединяющие игроков в вашей команде, с цветной системой светофоров, показывающей, насколько плохой или идеальным является химия между каждым игроком.
Красные ссылки появляются, когда игроки не принадлежат к одной лиге, стране или клубу.На изображении выше вы можете увидеть, как у моего LM Nakajima есть красная ссылка с моим CM Iniesta. Это потому, что у них нет ничего общего. Иньеста — испанец, играет в лиге J1 — Накадзима — японец, играет в лиге NOS.
Желтые ссылки появляются, когда у двух игроков есть что-то общее. Вы можете увидеть пример этого на изображении выше, посмотрев на связь между моим CM Iniesta и другим CM, Marcos Junior. Джуниор — бразилец, но он играет в той же лиге, что и Иньеста, хотя и за другой клуб.Значит, у них приличная химия, но могло быть и лучше.
Зеленые ссылки появляются, когда у двух игроков более одного общего. В этом примере вы можете видеть, что мой CM Iniesta имеет зеленую ссылку на мой CB Vermaelen. У них разные национальности, но они играют в одной лиге за один клуб, поэтому связь зеленая. Было бы даже лучше, если бы они были одной национальности, но в любом случае это дает 10/10 баллов по химии.
Если вы все еще боретесь со своей химией даже с игроками с хорошими связями, есть еще несколько аспектов системы, которые необходимо понять.
Прежде всего, это позиционирование. Само собой разумеется, но если вы используете игрока в своей расстановке в роли, где он находится вне позиции, это негативно повлияет на вашу химию. Если вы пытаетесь сыграть CAM-игроком в схеме 4-4-2, в которой есть только слоты CM в центре поля, этот игрок получит желтый оттенок в круге, обозначающем его позицию под карточкой игрока.
Вы можете исправить это, нажав X / Square на нарушившем игроке и переместив правый стик в нижний правый угол радиального колеса.Если они не в позиции, игра порекомендует вам поискать карту модификатора позиции на трансферном рынке. Их можно купить, чтобы изменить положение игрока вручную, чтобы лучше соответствовать вашему построению и обеспечить существенный удар по химии.
Есть также системы лояльности и химии менеджеров, которые по-своему влияют на химию игроков. Если вы один раз щелкнете правым джойстиком вправо, глядя на свой отряд, вы увидите два символа прямо над показателем химии, щит и букву «M».Щит может стать зеленым, когда игрок достигнет лояльности к клубу, которая автоматически зарабатывается, если вы получили игрока в наборе. Если вы купили игрока на трансферном рынке, вам придется сыграть с ним десять игр, чтобы разблокировать щит лояльности, который обеспечит вам еще больше химии для этого игрока.
Помимо этого, вы также можете использовать своего менеджера, чтобы повысить химию своей команды, что вы можете найти справа от запасной скамейки запасных. Вам нужен менеджер, соответствующий основной национальности и лиге, используемой вашим клубом Ultimate Team.К сожалению, не существует менеджера любой национальности, поэтому вам, возможно, придется пойти на компромисс. Однако вам не нужно идти на компромисс, когда дело касается лиги менеджеров, так как вы можете отправиться на трансферный рынок и приобрести модификатор «Лига менеджеров» на вкладке «Расходные материалы». Как только это будет сделано, вы увидите, что щит M станет зеленым, если у менеджера есть что-то общее с игроками, что даст толчок в химии.
Стили химии — еще один расходный материал, доступный на трансферном рынке, который не улучшает химию при применении, но улучшает атрибуты в зависимости от статистики химии игрока.
Если вы серьезно относитесь к своей команде и хотите улучшить ее способности в игре, то потратите деньги на правильные расходные материалы для химического стиля — это справедливое использование ваших монет. Тем не менее, стиль химии бесполезен, когда используется игроком с низкой индивидуальной химией, поэтому убедитесь, что вы используете его только на игроках с относительно высокой статистикой химии, чтобы воспользоваться преимуществами.
Если вы использовали наши советы для достижения высокого уровня взаимопомощи в своей команде, вот все стили игры FIFA 21 Chemistry Styles, которые помогут вам настроить каждого игрока в вашей команде.
Стили химии вратаря
- Кошка — улучшает рефлексы, скорость и позиционирование
- Перчатка — улучшает ныряние, управляемость и позиционирование
- Щит — улучшает удары ногами, рефлексы и скорость
- Стена — улучшает ныряние, управляемость и Ногами
- Sentinel — улучшает защиту и физическое состояние
- Guardian — улучшает ведение и защиту
- Anchor — улучшает темп, защиту и физическое состояние
- Backbone — улучшает прохождение, защиту и физику
- Gladiator — улучшает стрельбу и Защита
- Тень — улучшает темп и защиту
- Движок — улучшает темп, дриблинг и передачу
- Architect — улучшает передачу и физику
- Artist — улучшает передачу и дриблинг
- Catalyst — улучшает темп и передачу
- Maestro — улучшает броски, передачи и Дриблинг
- Powerhouse — улучшает передачу и защиту
- Охотник — улучшает темп и стрельбу
- Ястреб — улучшает темп, стрельбу и физику
- Снайпер — улучшает стрельбу и ведение
- Финишер — улучшает стрельбу и физику
- Снайпер — улучшает стрельбу и передачу
- Стрелок — улучшает стрельбу, дриблинг и физическую подготовку
 Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях.
Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о молекулярных орбиталях. Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы.
Растворы. Механизм образования растворов. Растворимость веществ и ее зависимость от температуры и природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация, объемная доля. Отличие физических свойств раствора от свойств растворителя. Твердые растворы. Сплавы. Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода.
Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода.
 Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды, галогенангидриды, сложные эфиры, амиды. Жиры.
Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды, галогенангидриды, сложные эфиры, амиды. Жиры. Продуктами окисления органического вещества являются углекислый газ и вода.
Продуктами окисления органического вещества являются углекислый газ и вода. Обратимые и необратимые реакции
Обратимые и необратимые реакции