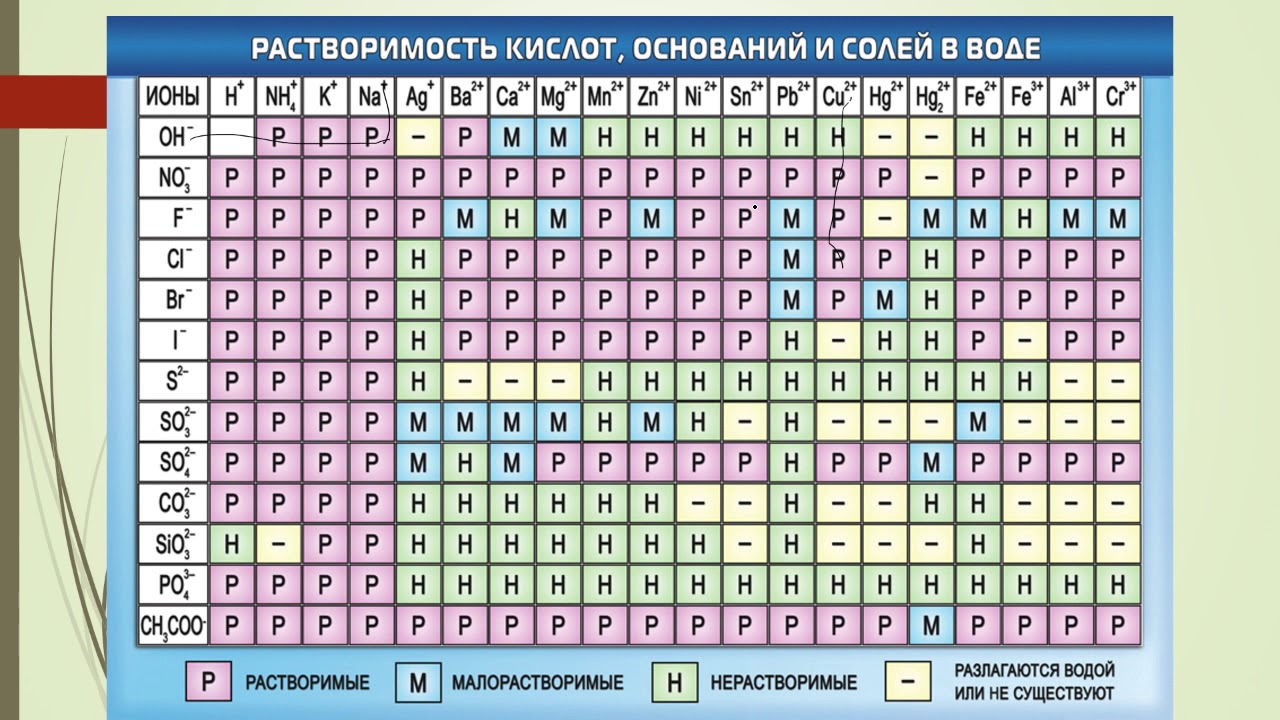
Определение кислотности
Кислотность водного раствора обусловлена наличие в нем положительных водородных ионов Н+ и оценивается концентрацией в 1 литре раствора C(H+) (моль/л или г/л). В абсолютно чистой воде концентрации ионов Н+ и ОН– равны и раствор нейтрален. В кислых растворах преобладают ионы Н+, в щелочных – ионы ОН–, однако их произведение в любых условиях постоянно. Следовательно, увеличение концентрации одного типа ионов приводит к уменьшению концентрации другого типа в том же количестве. На практике степень кислотности (или щелочности) раствора выражается
водородным показателем рН (от латинского «пундус гидрогениум» — вес водорода), представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов рН = –lgC(H+). Эта величина может изменяться в небольших пределах – всего от –1 до 15 (а чаще – от 0 до 14). При этом изменению концентрации ионов Н+ в 10 раз соответствует изменение рН на одну единицу. Таким образом, концентрация водородных ионов в среде с рН = 5 в 10, 100 и 1000 раз выше, чем в среде с рН = 6, 7 и
8 соответственно.
Кислыми называют растворы, в которых рН 7, и, чем ближе это значение к 14, тем раствор считается более щелочным. Установленная шкала кислотности идет от рН = 0 (крайне высокая кислотность) до рН = 14 (крайне высокая щелочность). Нейтральная среда имеет показатель ph, равный 7 (при комнатной температуре).
Показатель рН непосредственно влияет на нормальное протекание всех биохимических процессов у живых организмов. Очень важно, чтобы все процессы проходили при строго заданной кислотности. В частности, это необходимо для нормального функционирования биологических катализаторов – ферментов (при выходе за эти пределы их активность может резко снижаться). В клетках организма рН имеет значение около 7, во внеклеточной жидкости – 7,4. Наиболее чувствительны к изменению ph нервные окончания, которые находятся вне клеток. Кроме того, организм использует данное изменение ph в сигнальных целях: при механических или термических повреждениях тканей стенки клеток разрушаются и их содержимое попадает на нервные окончания.
Для определения степени кислотности используют специальные приборы — рН-метры, которые бывают весьма недешевы. Такие приборы измеряют электрический потенциал специального электрода (ЭДС), погруженного в раствор, и этот потенциал зависит от концентрации ионов водорода в растворе, и весьма вероятно измерить его с высокой точностью.
Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус. Метиловый оранжевый при рН 4,4 – желтый; лакмус при рН 8 – синий и т.д. В домашних условия без наличия этих индикаторов для определения кислотности среды вполне пригодны естественные красители из красной капусты и черной смородины.
Метиловый оранжевый при рН 4,4 – желтый; лакмус при рН 8 – синий и т.д. В домашних условия без наличия этих индикаторов для определения кислотности среды вполне пригодны естественные красители из красной капусты и черной смородины.
Приборы для измерения водородного показателя (рН метры):
КИСЛОТНОСТЬ БАЗ & ИНДИКАТОРЫ
Безопасный pH базы для ногтей: значение, способы замеров
(копирование только со ссылкой на @cni_corporation)Тема безопасности материалов для маникюра становится все более острой. В 2019 году наблюдается бум онихализиса и аллергии на материалы для ногтей, клиенты все чаще жалуются на истонченные испорченные ногти, на которых невозможно продолжать носить гелевый маникюр или гель-лак.
Нейл-индустрия впервые столкнулась с такими масштабными последствиями накопительного характера и если не вникнуть в корень проблем, ситуация будет лишь усугубляться.
Одним из вопросов безопасности материалов для ногтей является кислотность базовых покрытий.
База – следующий за праймером слой, который, по сути, находится в непосредственном контакте с ногтевой пластиной и оказывает прямое воздействие на здоровье ногтей.
Мастера маникюра в условиях недостатка информации проводят собственные эксперименты, пытаясь в домашних условиях определить рН материалов, которыми пользуются. В народе все средства называются «лакмусами», но правильнее говорить индикаторные полоски.
Какой рН для ногтей лучше?
Подробно эту тему мы разбирали в статье «Воздействие кислот на натуральную ногтевую пластину»Если коротко, то:
Происходит подмена понятий. Зачастую мастера маникюра и даже производители путают значение рН кожи и ногтей. Чего категорически нельзя делать.
НЕ ПУТАЙТЕ КОЖУ С НОГТЕМ
Для ногтя не вредно воздействие слабокислых веществ, +/- 2 единицы по шкале рН.
Отсюда возник миф: можно использовать кислые базы, у которых рН=3, так как они лишь на 2 единицы отличаются от рН кожи (рН=5).
Объект применения базы — ноготь. При pН ногтя 7,2, база с рН=3 отличается на 4 единицы! Это уже кислая среда, которая разрушает ноготь!
рН ногтя =7,2, для ногтя слабокислыми являются базы с рН от 5 до 7.
Базовые знания о показателе рН
Комментарий к теме индикаторов и кислотности баз мы взяли у главного химика корпорации CNI, Ольги Чикильдиной.
Не углубляясь в химию и не разбирая понятия об ионном произведении воды, водородном показателе и т.д., можно сказать, что показатель pH характеризует количественные значения кислотно-щелочного баланса конкретной среды.
Различают три основных типа сред водных растворов:
-
Нейтральная среда —рН = 7
-
Кислая среда — рН < 7
-
Щелочная среда — рН > 7
При значениях водородного показателя рН:
-
от 0 до 3 среда водного раствора считается сильнокислой,
-
от 4 до 6 — слабокислой,
-
7 — нейтральной,
-
от 8 до 10 — слабощелочной,
-
от 11 до 14 — сильнощелочной.

Таким образом, чем меньше рН, тем больше кислотность водного раствора. И наоборот, чем выше рН, тем больше щелочность водного раствора.
Как определить рН среды
Водородный показатель веществ можно определить с помощью:
-
кислотно-щелочных индикаторов,
-
универсальной индикаторной бумаги (менее точно)
-
рН-метра (значительно более точно).
Но измерения эти можно провести только в том случае, если исследуемое средство или субстанция представляют собой водный раствор, или если его можно растворить в воде, и получить тем самым его водный раствор или вытяжку.
Как определить кислотность или щелочность среды раствора при помощи универсальной индикаторной бумаги
Цвет полоски универсальной индикаторной бумаги изменяется в зависимости от рН раствора, которым она смочена.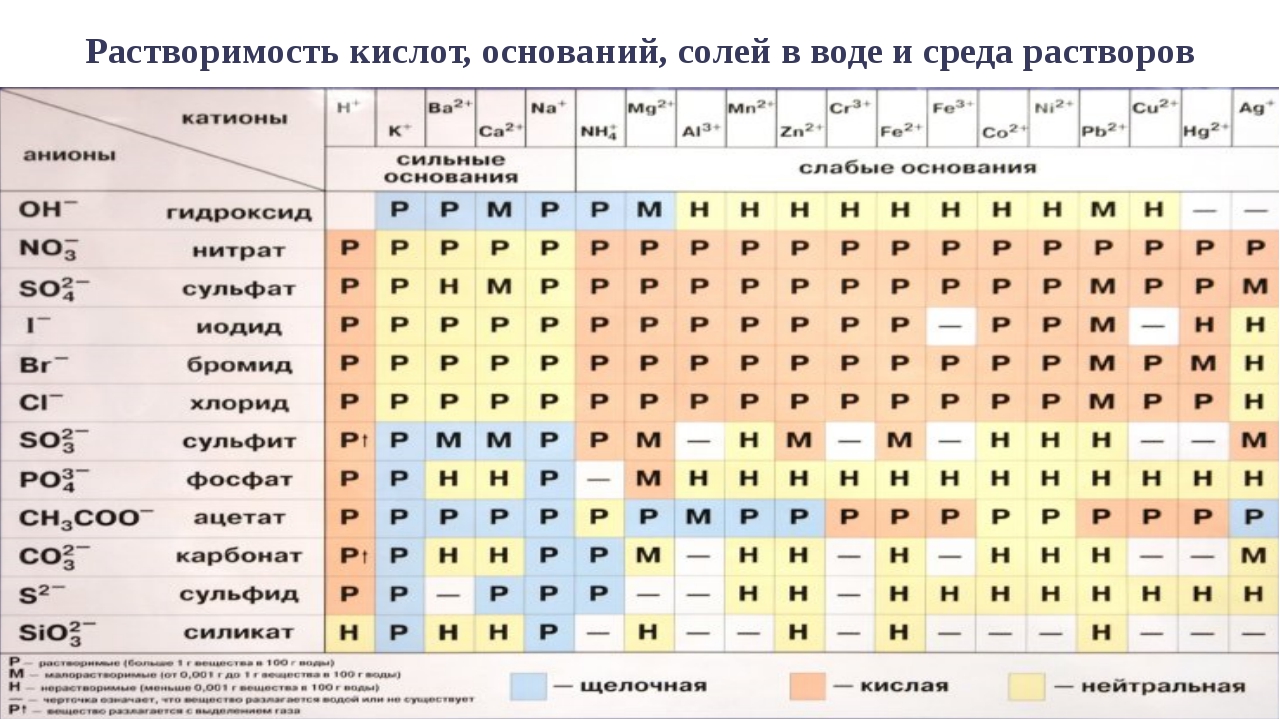
Необходимо пропитать полоску исследуемым раствором, и немедленно сравнить изменения цвета с эталонной шкалой на упаковке. Наиболее близкий цвет и будет значением кислотности.
- Синий цвет – щелочная средная.
- Оливковый цвет – нейтральная среда
- Желтый, светло-оранжевый – слабокислая среда.
- От оранжевого до малинового – кислая среда.
Как бы не так!
Можно ли измерять кислотность гелей для ногтей индикаторной бумагой?
Многие гели гидрофобные. Они не растворяются в воде. Тогда как проводить измерение индикаторными полосками, ведь водный раствор – обязательное условие.
Нет необходимости растворять гель в воде, чтобы узнать о наличии в его составе кислот.
Внешне гель однородный, но это не одно вещество. Гели, гель-лаки — это многокомпонентные субстанции со сложным составом. В их составе и олигмеры, и мономеры-сшиватели, и фотоинициаторы, и фотостабилизаторы, и много других вспомогательных компонентов. Все эти самостоятельные вещества превратятся в полимер, в единое целое, после полимеризации материала в лампе под действием УФ-света.
Гели, гель-лаки — это многокомпонентные субстанции со сложным составом. В их составе и олигмеры, и мономеры-сшиватели, и фотоинициаторы, и фотостабилизаторы, и много других вспомогательных компонентов. Все эти самостоятельные вещества превратятся в полимер, в единое целое, после полимеризации материала в лампе под действием УФ-света.
Для нейл-производителей самыми дешевыми мономерами-сшивателями как раз и являются акриловая и метакриловая кислоты. И если кислоты присутствуют в составе материала, то смоченная в воде полоска индикаторной бумаги, покажет наличие кислоты в исследуемой субстанции.
Как в домашних условиях можно проверить кислотность гелей На примере продукции CNI мы показываем, как приблизительно измерить уровень рН при помощи индикаторной бумаги. 1. Смачиваем индикаторную полоску в воде2. Наносим базовый гель Smart Base на влажный конец
3. Не теряя времени, подносим индикаторную бумагу с нанесенным гелем к эталонной шкале.
4. Сравниваем изменение цвета полоски со шкалой на упаковке.
В ходе этого опыта видно, что значение рН для базы Smart находится в безопасном для ногтя диапазоне от 5 до 6.
Минусы измерения кислотности баз при помощи индикаторной бумаги
Оценка кислотности геля при помощи индикаторной бумаги недостоверна только по одной причине: мы увидим наличие кислоты только на поверхности, с которой соприкоснулась увлажнённая индикаторная бумага. То есть говорить о значении рН всего материала некорректно.
То есть главный недостаток такого метода измерения в том, что он дает лишь приблизительное значение рН. Ожидать от домашнего теста лабораторной точности не следует.
ВЫВОДЫ:
- сильно кислые базы вредят ногтям
- гели можно считать «кислыми», если в их состав входят различные органические кислоты в высоких концентрациях;
- то что при помощи универсальной индикаторной бумаги нельзя измерить кислотность гелей – миф;
- индикаторной бумагой можно выявить кислоты в геле и приблизительно оценить кислотность материала, точного значения рН вы не получите;
- оптимальная кислотность материалов для ногтей находится в диапазоне 5-7 единиц по шкале рН.
Общая характеристика кислот — урок. Химия, 8–9 класс.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.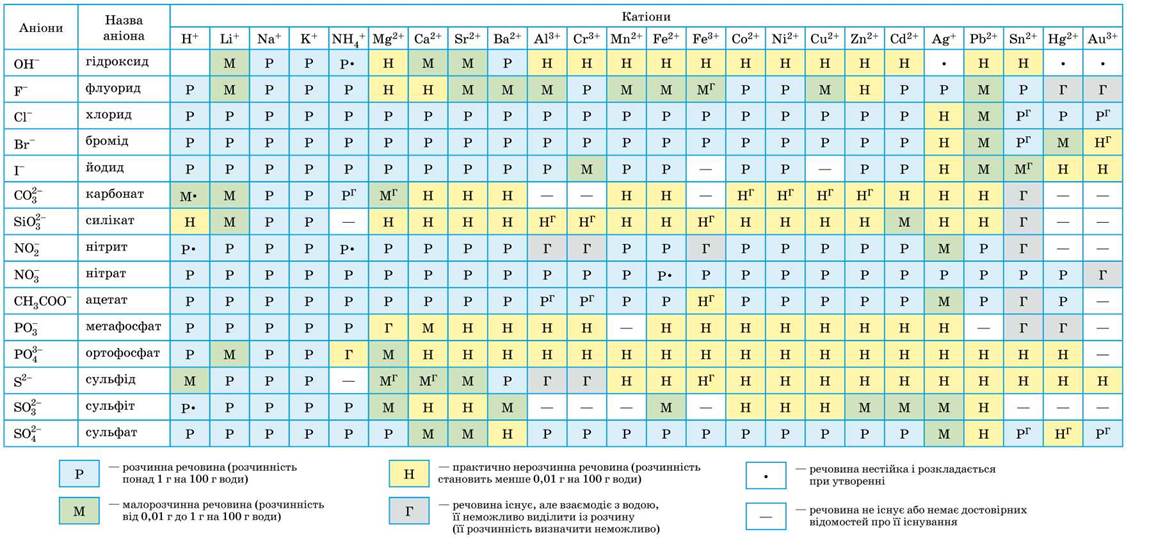
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH.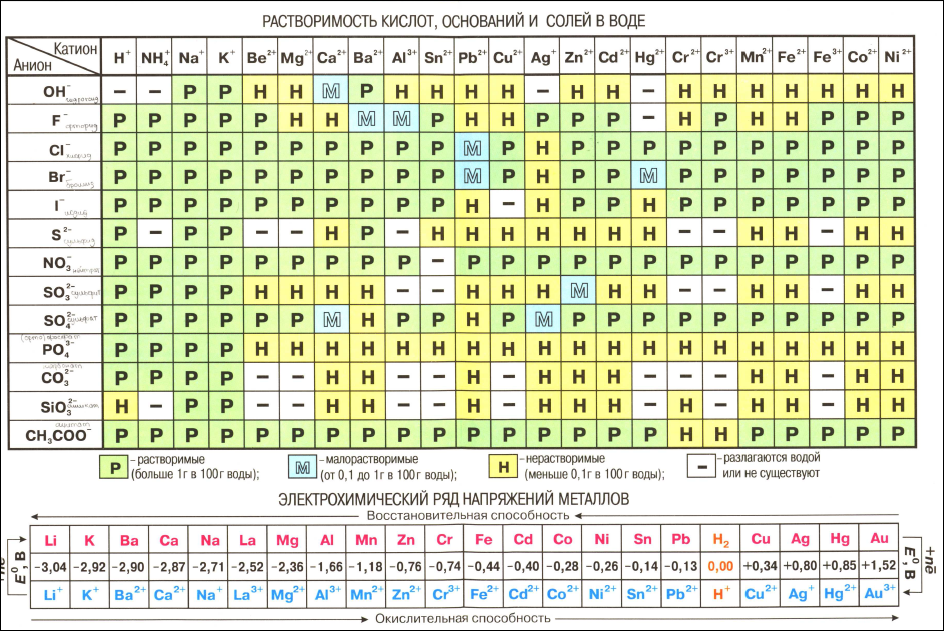 Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Кислотность, алкоголь, pH, acidity, ABV, летучая кислотность
В этой статье мы отвечаем на вопросы что такое кислотность вина и как ее определяют. Что такое pH и зачем его знать потребителю. Что такое градус алкоголя.
Градус алкоголя
Одно из этих сокращенией очень простое — ABV означает английское «alcohol by volume», те. содержание алкоголя (в нашем случае — этанола) в объёме жидкости. Обычно измеряется в процентах. А в разговорной речи называется градусом. Например, выражение сорокаградусная водка означает, что в предложенном растворе содержится 40% — сорок объёмных процентов алкоголя.
Объемный процент или градус измеряется в количестве милилитров «чистого» этанола в объеме 100 мл при температуре 20 градусов Цельсия.
В двух словах понятно, что если на бутылке указано ABV 5. 5%, как, например, на некоторых винах Москато д’Асти, то это слабогазированное и слабоалкогольное вино можно легонько потягивать весь вечер не опасаясь заполучить назавтра похмельный синдром. Как говорится, в кефире алкоголя больше(с)!
5%, как, например, на некоторых винах Москато д’Асти, то это слабогазированное и слабоалкогольное вино можно легонько потягивать весь вечер не опасаясь заполучить назавтра похмельный синдром. Как говорится, в кефире алкоголя больше(с)!
Кстати, именно поэтому Москато д’Асти и другое итальянское игристое, Проссеко, так популярны на голливудских вечеринках. Все весь вечер ходят с бокалом в руке, а пьяных нет. И домой можно самому за рулем уехать. Хотя судя по новостям, участников этих вечеринок последнее соображение не очень волнует.
Немного теории — что такое
pHНа интуитивном уровне мы все примерно понимаем, что такое кислотность. Степень «кислости», если так можно сказать. В химии же этот термин — кислотность, лат. aciditas, англ. acidity — обозначает характеристику активности ионов водорода в растворах и жидкостях.
Различают истинную (активную) и общую (титруемую) кислотность. В водных растворах неорганические вещества, т.е. соли, кислоты и щелочи (растворенные), разделяются на составляющие их ионы.
При этом положительнозаряженные ионы водорода H+ являются носителями кислотных свойств, а отрицательно заряженные ионы OH− (их еще называют гидроксилами) – носителями щелочных свойств.
Сто лет назад химиками был введен специальный водородный показатель, который принято обозначать символами рН.
Немного математики
Не-нудники(c) и не-математики(c) могут пропустить этот абзац. А для оставшихся сообщим, что для водных растворов действует уравнение равновесия — произведение активности ионов H+ и OH- постоянно. В так называемых нормальных условиях, т.е. при температуре воды 22°C и нормальном давлении, оно равно 10 в минус 14-ой степени.
Датский биохимик Серенсен в 1909 году ввел в обращение водородный показатель рН, по определению равный десятичному логарифму активности водородных ионов, взятому с минусом:
рН = — lg (активность Н+ )
В нейтральной среде, как мы только что сказали, активности ионов равны, т. е. произведение активности H+ на активность OH- равна квадрату активности H+. И равна 10 в минус 14-ой степени.
е. произведение активности H+ на активность OH- равна квадрату активности H+. И равна 10 в минус 14-ой степени.
Значит, после деления 14 на 2, отрицательный десятичный логарифм будет равен 7. Это означает, что (при температуре 22 °C) кислотность чистой воды, то есть нейтральная кислотность, равна семи единицам: pH = 7.
Растворы и жидкости считаются кислыми, если их pH меньше 7, и щелочными, если больше.
Обычно изделия пищевой промышленности, включая вино, имеют, как правило, кислую реакцию. Щелочную реакцию имеют химические разрыхлители теста (сода, карбонат аммония) и изделия, приготовленные с их применением, например печенье и пряники.
Три вида кислотности
Вернемся к вину. Термин»кислотность» — один из самых употребимых при анализе, описании и производстве вин. Практически кислотность — одна из самых главных характеристик и химии вина, и вкуса. В виноделии различают три вида кислотности:
- общую или титруемую
- активную или истинную — это и есть [водородный] показатель активности pH
- летучую кислотность
Титруемая кислотность
Титруемая или общая кислотность определяет содержание в соке или вине всех свободных кислот и их кислых солей в совокупности.
Величина её определяется количеством щелочи (например, едкого натра или калия), необходимой для нейтрализации этих кислот. То есть такое количество щелочи, которое надо добавить в вино, чтобы получить из него абсолютно нейтральный раствор (pH=7.0).
Измеряется общая кислотность в граммах на литр.
Активная кислотность
Активная или истинная кислотность pH. Математически — это отрицательный логарифм концентрации водородных ионов, как было сказано выше. Технически, это наиболее точная характеристика кислотности вина.
Она зависит от количества наиболее сильных кислот содержащихся в вине. Сильными называются кислоты, имеющие наибольшую константу (Кд) диссоциации [кислоты].
Пример типичных кислот упорядоченных по «силе», то есть по убыванию константы диссоциации (степени кислоты):
- Лимонная Кд = 8.4•10-4
- Янтарная Кд = 7.4•10-4
- Яблочная Кд = 3.95•10-4
- Молочная Кd = 1.4•10-4
От величины рН зависит количественное соотношение первичных и вторичных продуктов брожения, склонность вина к окислению, кристаллическим и биологическим помутнениям, подверженность дефектам и сопротивляемость болезням вина.
Примеры
Простое объяснение логарифмической зависимости. Раствор с рН = 3 в десять раз более кислый, чем раствор с рН = 4. Или, более практический пример, вино с pH = 3.2 на 25% кислее вина с pH = 3.3.
При необходимости исправить кислотность вина, виноделы добавляют смесь 1.9 г/л молочной кислоты и 2.27 г/л винной (диоксиянтарной или тартаровой) кислоты. Это позволяет уменьшить pH приблизительного на 0.1 (в диапазоне от 3 до 4).
А если, например, вино получилось с pH=3.7 и винодел хочет его довести до pH=3.5, он увеличит эту «дозу» в два раза.
Величина рН для некоторых продуктов
В таблице ниже указаны величины кислотности некоторых распространенных продуктов и чистой воды при разной температуре:
| Продукт | Кислотность, рН |
| Лимонный сок | 2,1 |
| Вино, приблизительно | 3,5 |
| Томатный сок | 4,1 |
| Апельсиновый сок | 4,2 |
| Черный кофе | 5,0 |
| Чистая вода при 100 °С | 6,13 |
| Чистая вода при 50 °С | 6,63 |
| Свежее молоко | 6,68 |
| Чистая вода при 22 °С | 7,0 |
| Чистая вода при 0° С | 7,48 |
Летучая кислотность
Летучая кислотность (volatile acidity или, сокращенно, VA) – это та часть кислот в вине, которую можно уловить носом.
В отличие от тех кислот, которые ощутимы на вкус (о чем мы говорили выше).
Летучая кислотность, или иными словами, скисание вина — один из распространенных дефектов. Основные виновники его — уксусная кислота (пахнет уксусом) и её эфир – этилацетат (пахнет лаком для ногтей).
Бактерии, ответственные за летучую кислотность, активно развиваются в условиях низкой кислотности и высокого содержания сахаров. В малых концентрациях летучая кислотность придает вину пикантность. А при превышении порога уксусно-лаковая составляющая забивает полезные ароматы и портит вкус вина.
Понравилось это:
Нравится Загрузка…
Что означает показатель водородный показатель кислотности pН и как выбрать мыло с «правильным» pН
Водородный показатель pH — важная характеристика косметической продукции, в том числе и мыла. Рассказываем, что это за показатель и как он влияет на выбор мыла для различных типов кожи.
Рассказываем, что это за показатель и как он влияет на выбор мыла для различных типов кожи.
Что такое pH
Водородный показатель, pH (на латыни potentia Hydrogenii — сила водорода, или pondus Hydrogenii — вес водорода, произносится «пэ аш») – величина, характеризующая меру активности ионов водорода в растворе, количественно показывающая его кислотность. Это понятие было введено более ста лет назад, в 1908 году, датским химиком С. П. Сёренсеном.
Если проще, то рН показывает, насколько кислым или щелочным является раствор вещества. Обычно pH изменяется в интервале от 0 до 14 (хотя при некоторых концентрациях может и выходить за эти пределы). Значение 7 — нейтральная реакция — соответствует чистой дистиллированной воде. Если рН менее 7 — это кислая реакция, если более 7 — то реакция щелочная.
Как измерить pH
Измерить рН можно с помощью индикаторных полосок, которые изменяют свой цвет в зависимости от реакции среды, или с помощью специального прибора — рН-метра (на фото выше).
Для живых организмов этот показатель очень важен, так как многие биохимические процессы могут идти только при определенных значениях рН. Например, в норме рН артериальной крови человека 7,36–7,44 единиц и изменение его даже на несколько десятых говорит о серьезных нарушениях здоровья, требующих медицинского вмешательства. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Какой показатель pH считается нормальным
Показатель рН кожи индивидуален для каждого человека, при этом рН колеблется даже для разных участков тела одного человека. В среднем рН кожи человека составляет 5,5, то есть кожа имеет слабокислую реакцию. Причем надо понимать, что рН кожи человека определяется для тончайшей пленки на верхнем ороговевшем слое эпидермиса, образуемой выделениями потовых и сальных желез кожи. Ее также называют кислотной мантией кожи. Кислую реакцию поверхности кожи формируют в основном органические кислоты — молочная, лимонная, уксусная.
Кожа — это самый большой орган человека, одной из важнейших функций которого является защита организма от неблагоприятных воздействий окружающей среды. Кислотная мантия — это надежный барьер на пути многих микроорганизмов, которые не могут существовать в кислой среде.
Кислотно-щелочной баланс зависит также от типа кожи. Так сухая кожа имеет более кислую реакцию от 3 до 5,2, а жирному типу кожи свойственен pH 5,7-7. У нормального типа кожи рН 5,2-5,7 единиц:
pH мыла и выбор мыла для разного типа кожи
Кислотность кожи может изменяться под воздействием факторов внешней среды: действие прямого солнечного света, изменение потоотделения, загрязнение, длительное воздействие кислотных или щелочных сред (жесткая вода, моющие средства и др.).
рН обычного твердого мыла от 9 до 11 единиц (слабощелочная реакция), рН жидкого мыла от 6 до 7 единиц (слабокислая реакция, близкая к нейтральной). Любые моющие средства увеличивают рН кожи, т. к. смывают не только загрязнения, но и воздействуют на поверхностный липидно-кислотный слой.
к. смывают не только загрязнения, но и воздействуют на поверхностный липидно-кислотный слой.
Кроме того, при использовании средств для мытья следует помнить, что, когда на поверхности кожи достаточно много воды (например, во время водной процедуры), органические кислоты, определяющие величину рН кожи, полностью расщепляются и быстро удаляются с ее поверхности. Это сдвигает pH в нейтральную сторону к показателю 7.
Даже при умывании только водой, без использования мыла, будет изменяться состояние pH кожи. При первом нанесении воды на одно и то же место рН имеет кислую реакцию, а при втором и третьем, она будет близка к нейтральной.
Восстанавливается рН на поверхности кожи довольно быстро.
Выбирая моющее средство для ухода, необходимо учитывать эти факторы. Поскольку мыло извлекает из поверхностного слоя кожи не только загрязнения, но и жиры, порой чрезмерно ее высушивая, в туалетные мыла добавляют вещества, которые помогают сохранить нормальное содержание жиров и влаги в коже и самое благоприятное для нее значение кислотности.
Людям с сухим типом кожи следует аккуратно пользоваться мылом, и по возможности выбирать мыло с увлажняющими и питательными добавками, например, крем-мыло детское «Мой малыш» или жидкое мыло «Мой малыш».
Для жирного типа кожи можно использовать антибактериальное мыло с маслом чайного дерева «Мой доктор» и «Рецепты чистоты», которое поможет бороться с повышенной активностью микроорганизмов, развивающихся в секрете сальных желез, и предотвратит появление угрей и других кожных высыпаний.
Для людей с чувствительным типом кожи лучше отдать предпочтение мылу с глицерином. Глицерин не только увлажняет и оказывает смягчение, но и защитит от вредных воздействий. В линейке мыла НМЖК это «Глицериновое» мыло с ароматами «Зеленый чай» и «Морской ветер», а также «Глицериновое» мыло в линейке «Рецепты чистоты».
Уровень pH: Щелочные, кислотные и нейтральные препараты
Что такое уровень pH (водородный показатель)?
В химии водородный показатель (pH уровень) является мерой кислотности или щелочности (основности) в водном растворе. Без воды в составе нельзя измерять pH, поэтому не бывает pH показателей таких косметических средств как: жидкие кристаллы, масла, лаки для волос (там где нет воды в составе. Аналогичная ситуация и с осветляющими порошками (правда только пока они находятся в сухом виде, так как если добавить в него окислитель, где содержится вода, то уже этой смеси измерить pH можно).
Без воды в составе нельзя измерять pH, поэтому не бывает pH показателей таких косметических средств как: жидкие кристаллы, масла, лаки для волос (там где нет воды в составе. Аналогичная ситуация и с осветляющими порошками (правда только пока они находятся в сухом виде, так как если добавить в него окислитель, где содержится вода, то уже этой смеси измерить pH можно).
Величина pH измеряется в пределах от 0 до 14. Чистая дистиллированная вода при температуре 25 °C считается нейтральной. Растворы же с уровнем pH ниже 7 — кислые, а выше 7 — щелочные. Хотя на вид эти цифры не сильно различаются, надо понимать, что уровень pH имеет логарифмическую шкалу и поэтому реальная разница — это 10 в степени равной разнице между значениями. Так например разница между pH 3,5 и pH 5,5 — означает, что продукт с pH 3,5 в 100 раз кислее, чем второй показатель (10 во второй степени). Аналогично и со щелочностью, если сравнивать pH 7 и 10, то продукт с pH 10 в 1000 раз более щелочной, чем нейтральный с pH 7.
Волосы на растворы разных pH реагируют по разному. В кислых средах (но не экстремально кислых, при которых уже даже белок разъедается) кутикульный слой волоса старается закрыться (если он есть на волосах, так как в случае поврежденных волос его просто нет, что отчетливо видно на фото в статье о пористости), в щелочных средах — напротив, кутикульный слой разрыхляется и становится пористым, а очень концентрированные щелочи тоже могут разрушать белки волоса и не хуже, чем концентрированные кислоты.
Подробнее о pH воды
В жизни мы в основном встречаемся не с дистиллированной водой, а с водой из водопроводного крана, поэтому уровень pH воды (кислотность воды) зачастую может колебаться в пределах слабокислых — слабощелочных сред. Вода со слабокислым pH подходит для волос. Ее свойства способствуют закрытию кутикулы и поддержанию искусственного цвета волос. Нейтральный pH в принципе не оказывает по губного воздействия на волосы, однако требует уже обязательного применения масок и кондиционеров для волос, чтобы дополнительно стимулировать закрытие кутикулы и поддерживать цвет.
Слабощелочные воды напротив раскрывают кутикульный слой волос и способствуют вымыванию искусственных цветов, а также вызывают тусклость и спутываемость волос. В таком случае без применения кислотных кондиционеров не обойтись, так как природного увлажнения может не хватить для восстановления естественных условий для волос.
При уходе за окрашенными и завитыми волосами стоит поддерживать кислотный pH, так как именно он способствует сохранению цвета и формы волос. Для этого на косметическом рынке существуют специальные серии препаратов максимально подходящие под каждый случай.
Реакция нейтрализации
Кислые и щелочные растворы, равно как чистые кислоты и щелочи — это вещества, которые имеют противоположные характеристики, могут реагировать друг с другом и нейтрализовывать друг друга (гасить). В химии реакция нейтрализации — это реакция между кислотой и щелочным веществом (иначе его еще называют основанием) с образованием соли и воды. Если они равные по силе концентрации, то в результате — мы получаем близкий к нейтральному pH.
Всегда при смешивании в 1 миске или на 1 голове сразу щелочных и кислотных продуктов эта реакция будет протекать и парикмахеры с ней сталкиваются регулярно. Так например все знают, что окислительные эмульсии содержат небольше количество кислоты, которая делает продукт стабильным, а краска содержит щелочь. Когда мы эти два продукта смешиваем в миске, то получаем в первые секунды нейтрализацию. Так как щелочей в краске гораздо больше, чем кислоты в окислителе, то в результате мы получаем состав щелочной, но сама реакция нейтрализации протекает и кислота гасится.
Это активно используют, например, когда после осветляющих сильнощелочных препаратов при смывании наносят кислотные шампунь и кондиционер, что приводит к мягкой нейтрализации остатков щелочей в волосах и восстановлению pH волос и кожи головы до оптимального уровня.
Показатель pH волос
Показатель pH определяется только для водных растворов, но волосы не являются раствором, при этом неоднократно в рекламе можно услышать понятия типа: «pH кожи», «pH волос». О каком показателе тут говорят?
О каком показателе тут говорят?
Ответе на этот вопрос достаточно прост. За показатель pH кожи и волос принимают pH природного водно-жирового (гидролипидного) слоя здорового человека, покрывающего кожу и волосы. Фактически это pH кожных выделений, которые вырабатываются кожей и распределяются по длине волос при расчесывании. pH кожи, как и волос, около 5, причем зависит пола, возраста и целого ряда других факторов, включая место на теле человека. К примеру, pH кожи головы – 4-5,5, в то время как показатель в зоне подмышек будет равен 6,5.
Многие заболевания кожи связаны с изменением pH и тогда уже этот уровень не является нормальным. Например, грибковые инфекции приводят к защелачиванию кожных выделений, а псориаз смещает этот показатель наоборот в более кислую сторону.
В косметике обычно оптимальным значением pH кожи головы и волос считают 5-5,5 (ближе к 5,5) и стараются его поддерживать уходом.
pH косметики для волос
Сейчас на рынке есть множество косметических средств и процедур с волосами, которые по разному воздействуют на pH волос. Какие-то препараты смещают уровень pH в щелочную сторону, тем самым нарушая естественные условия и структуру волос, а какие-то препараты, наоборот возвращают кислотную среду, пытаясь нейтрализовать любые пагубные воздействия. Поэтому целесообразно разделить все препараты для работы с волосами на три группы: кислотные, щелочные и нейтральные и рассматривать их отдельно.
Какие-то препараты смещают уровень pH в щелочную сторону, тем самым нарушая естественные условия и структуру волос, а какие-то препараты, наоборот возвращают кислотную среду, пытаясь нейтрализовать любые пагубные воздействия. Поэтому целесообразно разделить все препараты для работы с волосами на три группы: кислотные, щелочные и нейтральные и рассматривать их отдельно.
Важно! При химических реакциях на волосах составы смесей сильно могут меняться по мере прохождения реакций и pH таких продуктов тоже будет меняться. Например, при осветлении, щелочной состав осветляющего порошка реагирует с перекисью в результате этого образуется вода, летит аммиак (что слышно по запаху) и т.п. При этом очень важно для состава, чтобы показатель pH сильно не падала, так как чрезмерное закисление будет отрицательно влиять на эффективность. Поэтому чтобы pH продукта был стабильным несмотря на химические реакции в осветляющий порошок обязательно добавляют буферные вещества, которые как раз помогают составу удерживать pH продукта в течении всего времени выдержки и гарантированного срока хранения продукта.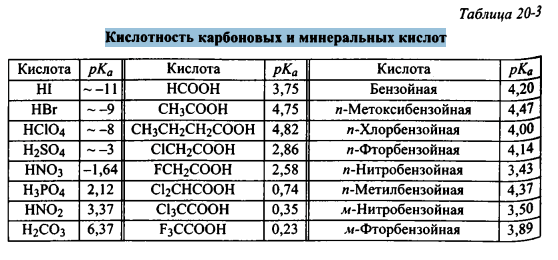
Щелочные препараты для волос
В эту группу входят препараты для окрашивания волос, завивки и выпрямления. Все они имеют два обязательных условия для работы: проникновение во внутрь волоса и проведение внутренних изменений в волосах. Так как в здоровые натуральные волосы очень сложно проникнуть любому препарату, то для раскрытия волоса в эти препараты добавляют щелочные компоненты.
Перманентные (стойкие) краски для волос имеют pH 9-11. Эта величина очень сильно зависит от производителя, а также от степени осветления волос. Наиболее щелочными всегда являются осветляющие ряды красителя, так как им не просто нужно проникнуть в волос, но и произвести очень сильные изменения внутри волоса — осветлить пигмент.
На том же уровне pH находятся препараты для химической завивки. Их pH колеблется в диапазоне 6,8—9,1 и зависит от типа препарата, а также под какой волос данный препарат рассчитан. Например, завивки которые дают лишь легкую волну (без жестких локонов — «безтиогликолевый тип завивок») имеют более низкий pH, а более сильные по воздействию тиогликолевые завивки — более щелочные.
Современные тиогликолевые препараты для химического выпрямления волос имеют pH на уровне 10 и являются достаточно щадящими, по сравнению со щелочным выпрямлением, которое использовалось еще лет 10 назад и имело pH равное 13.
В отдельные группы препаратов по уровню pH стоит выделить спец-осветляющие красители и деколорирующие кремы и масла. Эта группа из-за сильного осветляющего воздействия, которое от нее требуется, имеет высокий уровень щелочности в районе 10-11.
Последний препарат в данной группе — осветляющий порошок. Он относится к наиболее щелочной группе препаратов, которая сейчас присутствует на косметическом рынке. pH этой группы в среднем имеет значение 12 (как уже упоминалось — это pH продукта в смеси с окислителем в стандартной пропорции).
Менее щелочными являются тонирующие краски — их pH лежит в диапазоне 8-9. Семипераманентные могут быть как слегка щелочными, так и относиться к кислотным продуктам (все зависит от состава и применяемых пигментов).
По факту все приведенные значения pH — это «средняя температура по больнице», причем не понятно по какому количеству пациентов построенная, так как каждый производитель делает продукты по своим собственным формулам и может несколько менять эти показатели. По этой причине в интернете по этой теме нет единых стандартов, и каждый автор приводит свою собственную усредненную статистику. И всегда можно найти точные значения отдельных брендов, которые могут не попадать в указанные диапазоны. Но в целом приведенные цифры позволяют увидеть как соотносятся по щелочности продукты между собой.
По этой причине в интернете по этой теме нет единых стандартов, и каждый автор приводит свою собственную усредненную статистику. И всегда можно найти точные значения отдельных брендов, которые могут не попадать в указанные диапазоны. Но в целом приведенные цифры позволяют увидеть как соотносятся по щелочности продукты между собой.
Индикаторные полоски меняют свой цвет в зависимости от pH среды в которую погружаются.
Если необходимо узнать значение pH того или иного продукта, вам его может либо дать представитель производителя, либо его нужно будет мерять самому специальными приборами — pH-метрами или индикаторными тест-полосками
Кислотные препараты для волос
В этой группе препаратов находятся практически все средства по уходу за волосами. Это разнообразные маски, кондиционеры, кислотные шампуни, лосьоны и прочее. Задача этих препаратов — ухаживать за волосами и поддерживать их здоровый вид. От них не требуется изменений, противоречащих природе волос, поэтому в щелочах в составе препаратов нет необходимости. Более того смещенный уровень pH после агрессивных процедур необходимо возвращать к природному, поэтому препараты в этой группе все имеют в своем составе кислоты.
Более того смещенный уровень pH после агрессивных процедур необходимо возвращать к природному, поэтому препараты в этой группе все имеют в своем составе кислоты.
Самая обширная подгруппа среди кислотных препаратов — это маски и кондиционеры (бальзамы). Их pH находится в пределах 3,5-6,0 и зависит от назначения препарата. Так, наиболее кислые маски, это те, которые используются после агрессивных парикмахерских процедур, типа осветления. Чуть более в нейтральную сторону маски — это зачастую домашний уход, который наносится просто после мытья головы, а кислотные — салонный (например кислотные кондиционеры после окрашивания волос).
Кислотные шампуни чаще всего встречаются в салонной косметике, но и бытовые кислотные шампуни также не редкость,. Их pH колеблется 4,5-6,5.
Препараты для волос с нейтральным pH
В эту группу стоит отнести препараты, pH которых наиболее близок к нейтральному значению. Сюда стоит отнести временные (физические красители), а также нейтральные и слабощелочные шампуни.
Нейтральная группа шампуней сменила на косметическом рынке своих предшественников — щелочных шампуней (представители которых в профессиональных сериях встречаются все реже и реже). Ведь задача шампуня — хорошо вымыть поверхность волоса, а не почистить его изнутри. Хотя порой можно услышать от всяких гуру, что на нашем рынке почти все шампуни щелочные — это не совсем так, хотя и могло быть правдой лет 10-15 назад.
Как показывают исследования рынков шампуней в Бразилии 2014 года, опубликованные в Международном журнале трихологии (International Journal of Trichology) — большая часть популярных продуктов на рынке на тот момент, — шампуни с pH в диапазоне 5,5-7 (а именно 88 из 123 протестированных), а в профессиональных сериях основная масса тестируемых продуктов даже находится в диапазоне pH 5-6. На нашем рынке эти показатели могут отличаться, но не кардинально, так как местные производители косметики следять за применяемыми технологиями, как нашими, так и европейскими.
Шампуни с нейтральным pH — это сейчас достаточно дешевый и работающий вариант, по сравнению с кислотными.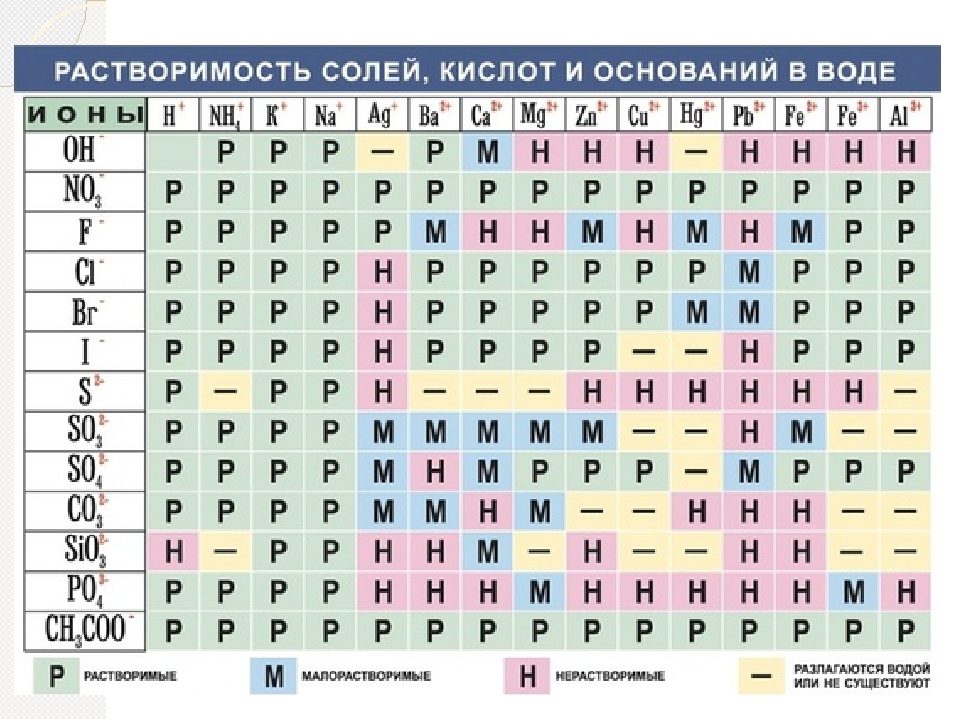 Их pH находится в пределах 6,5-7,5. Согласно данным бразильских исследователей в этом диапазоне находится примерно 43% от тестированных шампуней. В этой же группе также присутствуют щелочные детские шампуни “без слез”, pH которых находиться в пределах примерно 6,5-7. Данная величина pH считается нормальной для детских продуктов, так как более кислые или щелочные шампуни вызывают раздражение глаз у детей, а следовательно — недопустимы.
Их pH находится в пределах 6,5-7,5. Согласно данным бразильских исследователей в этом диапазоне находится примерно 43% от тестированных шампуней. В этой же группе также присутствуют щелочные детские шампуни “без слез”, pH которых находиться в пределах примерно 6,5-7. Данная величина pH считается нормальной для детских продуктов, так как более кислые или щелочные шампуни вызывают раздражение глаз у детей, а следовательно — недопустимы.
Последний представитель нейтральной группы — это временный (физический краситель), его pH близка к нейтральному, но все же зачастую смещена в слабо щелочную область и колеблется в пределах 6,5-8. Это связано с тем, что любая краска наиболее эффективно закрепляется только на рыхлой от щелочного воздействия поверхности волоса.
Еще несколько важных моментов
Хотя точные показатели pH того или иного продукта может указать вам только производитель (как вариант еще можно померять самим при наличии соот вующего инструментария), но… в целом зания особенности работы того или иного продукта можно приблизительно понять к какому виду продуктов по pH его стоит отнести и использовать в соответствии с этим.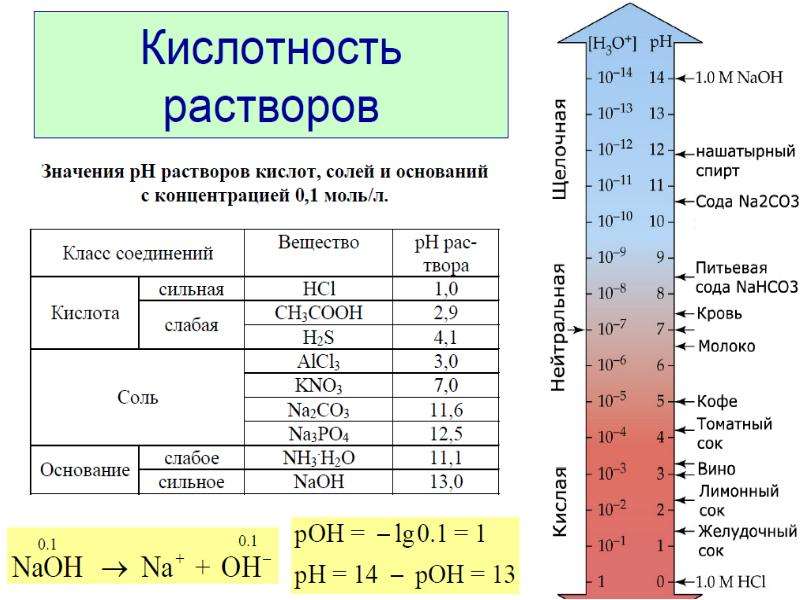 И всегда следует помнить об оптимальном pH для кожи и волос, потому что сильные перегибы по показателю pH в обе стороны будут оказывать негативный эффект на волосы. И при любой работе с косметикой важно стремиться к балансу: после сильного защелачивания применять закисляющий уход, а после сильного закисления и защелачивать хотя бы с помощью обильного смывания составов с волос водой, pH которой все равно более щелочной в сравнении с pH волос и кожи головы.
И всегда следует помнить об оптимальном pH для кожи и волос, потому что сильные перегибы по показателю pH в обе стороны будут оказывать негативный эффект на волосы. И при любой работе с косметикой важно стремиться к балансу: после сильного защелачивания применять закисляющий уход, а после сильного закисления и защелачивать хотя бы с помощью обильного смывания составов с волос водой, pH которой все равно более щелочной в сравнении с pH волос и кожи головы.
Кислотность и основность
Во всех химиях, которые вы изучали до сих пор, под кислотностью и основностью почти всегда имелось в виду определение Аррениуса – кислота это вещество, отдающее протон, а основание – гидроксид-ион. Это хорошее и правильное определение, но для органики почти бесполезное. В определении Аррениуса кислота может быть сама по себе, и основание – тоже само по себе, ведь проверяют каждое из них с помощью какой-то третьей вещи – протона или гидроксид-иона. Можно так и сказать – в этой банке кислота, а в той банке основание, а может и сама щелочь! Мало кто задумывается о том, что это возможно только в одном случае – если речь идет о водных растворах. Вода собственно и оказывает эту услугу – забирает протон у кислоты и становится ионом H3O+ гидроксония, или отдает протон основанию и становится гидроксид-ионом HO–. Гидроксоний-ион – это единый и универсальный представитель любой кислоты, ведь все кислоты только этим и различаются – сколько гидроксоний-ионов получится в растворе кислоты определенной концентрации. В воде все кислоты суть одно и то же – гидроксоний. И основания все тоже одно и то же – гидроксид-ионы. А если еще и учесть, что гидроксоний и гидроксид намертво связаны друг с другом константой диссоциации самой воды, то все становится совсем просто – есть единственный существенный показатель что кислотности, что основности – pH. А химическая природа кислоты и основания важны только для того, чтобы понять, сможем мы из них надоить нужный нам pH или нет. Мы говорим: “подкислить или подщелочить”, совершенно не концентрируясь на том, чем это сделать – любой кислотой или основанием, которое есть под рукой, лишь бы сила была достаточна.
Вода собственно и оказывает эту услугу – забирает протон у кислоты и становится ионом H3O+ гидроксония, или отдает протон основанию и становится гидроксид-ионом HO–. Гидроксоний-ион – это единый и универсальный представитель любой кислоты, ведь все кислоты только этим и различаются – сколько гидроксоний-ионов получится в растворе кислоты определенной концентрации. В воде все кислоты суть одно и то же – гидроксоний. И основания все тоже одно и то же – гидроксид-ионы. А если еще и учесть, что гидроксоний и гидроксид намертво связаны друг с другом константой диссоциации самой воды, то все становится совсем просто – есть единственный существенный показатель что кислотности, что основности – pH. А химическая природа кислоты и основания важны только для того, чтобы понять, сможем мы из них надоить нужный нам pH или нет. Мы говорим: “подкислить или подщелочить”, совершенно не концентрируясь на том, чем это сделать – любой кислотой или основанием, которое есть под рукой, лишь бы сила была достаточна.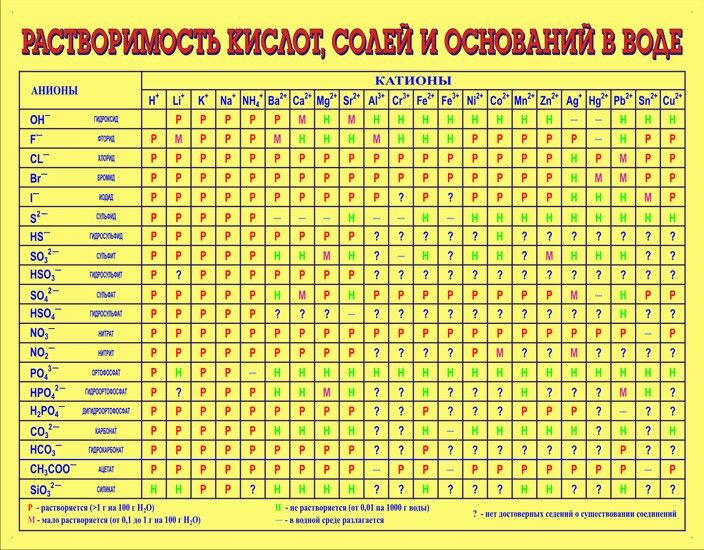 Солянкой – отлично, серной – пойдет, а у меня хлорная есть – туда ее, какая разница. А если мы в результате подкисления хотим получить слабокислый раствор, например, с pH в районе 5, то пойдет и уксусная, и фосфорная, но и те же соляная с серной, просто подкислять придется осторожно, контролируя pH индикатором или pH-метром.
Солянкой – отлично, серной – пойдет, а у меня хлорная есть – туда ее, какая разница. А если мы в результате подкисления хотим получить слабокислый раствор, например, с pH в районе 5, то пойдет и уксусная, и фосфорная, но и те же соляная с серной, просто подкислять придется осторожно, контролируя pH индикатором или pH-метром.
Вода – это действительно уникальный растворитель, в ней все просто и элегантно, ионы в ней свободны, и все, что написано на бумаге, так и происходит в реальности, и все равны перед константой ее диссоциации. И самое главное – в водном растворе у каждой кислоты и каждого основания есть своя, одна и вполне определенная константа кислотности или основности, и они сведены в обширные и общедоступные таблицы. Все наперед известно, и любое равновесие можно взять и рассчитать.
Да, там все же есть проблема – все это хорошо только в разбавленных растворах, а в растворах с большой концентрацией наступают всякие сложности, и чем крепче раствор, тем круче сложности. В концентрированных растворах перестают соблюдаться простые законы, pH теряет смысл, и вообще начинает казаться, что кто-то подменил растворитель, и воды больше нет. На самом деле это действительно так, ведь если вы покопаетесь в памяти, то вспомните, что в корректных формулах всяких равновесий вместо концентраций присутствует какая-то загадочная термодинамическая активность, на которую все плюют, потому что в разбавленных растворах она практически не отличается от концентрации. А в концентрированных – отличается и совершенно драматически. Настолько драматически, что большинство нормальных людей предпочитает держаться подальше от концентрированных растворов. И мы так поступим. Поэтому в рассуждениях о кислотности и основности в водных растворах почти всегда избегают больших концентраций.
В концентрированных растворах перестают соблюдаться простые законы, pH теряет смысл, и вообще начинает казаться, что кто-то подменил растворитель, и воды больше нет. На самом деле это действительно так, ведь если вы покопаетесь в памяти, то вспомните, что в корректных формулах всяких равновесий вместо концентраций присутствует какая-то загадочная термодинамическая активность, на которую все плюют, потому что в разбавленных растворах она практически не отличается от концентрации. А в концентрированных – отличается и совершенно драматически. Настолько драматически, что большинство нормальных людей предпочитает держаться подальше от концентрированных растворов. И мы так поступим. Поэтому в рассуждениях о кислотности и основности в водных растворах почти всегда избегают больших концентраций.
С проблемой корректности использования концентрация в выражениях равновесий связанао еще одно недоразумение. Довольно часто спрашивают, почему в выражениях констант кислотности или основности нет концентрации воды, и иногда даже её туда суют, думая, что исправили какой-то большой недосмотр.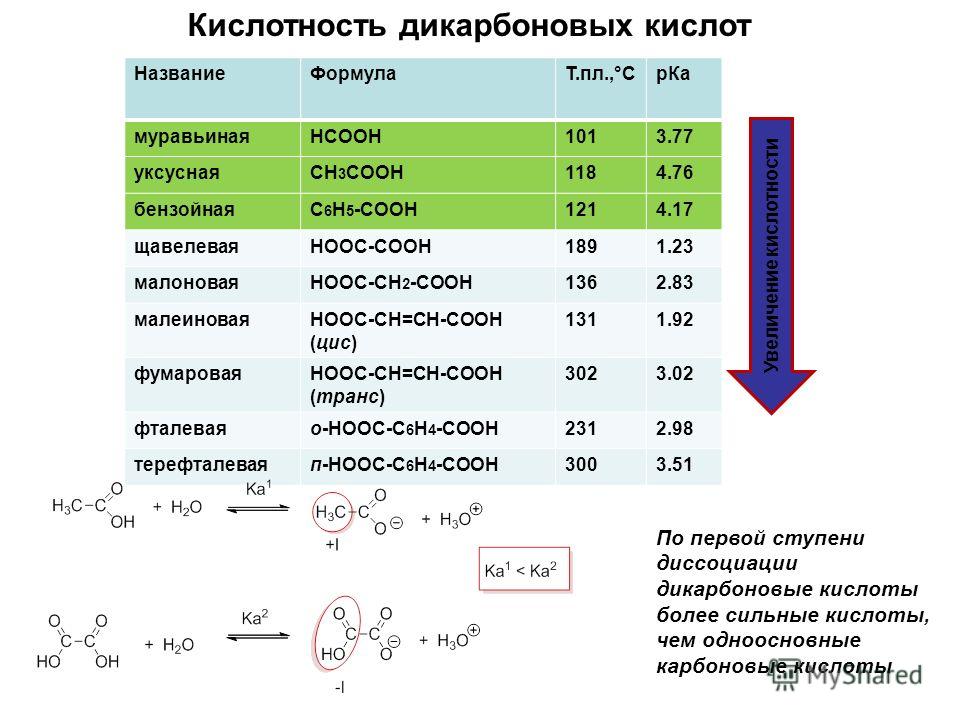 Но напрасно. А вот всё поэтому – потому что в корректных формулах равновесий не концентрации, а термодинамические активности, и мы договорились, что мы на это плюём, потмоу что подразумеваем, что все такие измерения проводятся в разбавленных растворах, где концентрация почти не отличается от активности, и одну можно смело заменить другой. Концентрации всех растворенных частиц – исходных электролитов и получившихся из них ионов. Но не самой воды! Вода – растворитель, ее заведомо много, поэтому ни в коем случае нельзя считать, что в выражениях констант можно заменить термодинамическую активность воды ее концентрацией. Это будет эпический провал, та самая ошибка, которая хуже, чем преступление – это насилие над самой природой констант равновесия. А в чём природа констант равновесия? В неразрывной связи с измененим стандартной энергии Гиббса, мы все знаем эту формулу, только почему-то забываем. Сами выражения констант равновесия (все эти произведения концентраций делённые на произведения других концентраций) есть не что иное как простейшее математическое следствие известного закона равновесий – в равновесии энергия Гиббса системы минимальна, а для того, чтобы найти положение равновесия, нам нужно оценить изменение стандартной энергии Гиббса правой части равновесия относительно левой части.
Но напрасно. А вот всё поэтому – потому что в корректных формулах равновесий не концентрации, а термодинамические активности, и мы договорились, что мы на это плюём, потмоу что подразумеваем, что все такие измерения проводятся в разбавленных растворах, где концентрация почти не отличается от активности, и одну можно смело заменить другой. Концентрации всех растворенных частиц – исходных электролитов и получившихся из них ионов. Но не самой воды! Вода – растворитель, ее заведомо много, поэтому ни в коем случае нельзя считать, что в выражениях констант можно заменить термодинамическую активность воды ее концентрацией. Это будет эпический провал, та самая ошибка, которая хуже, чем преступление – это насилие над самой природой констант равновесия. А в чём природа констант равновесия? В неразрывной связи с измененим стандартной энергии Гиббса, мы все знаем эту формулу, только почему-то забываем. Сами выражения констант равновесия (все эти произведения концентраций делённые на произведения других концентраций) есть не что иное как простейшее математическое следствие известного закона равновесий – в равновесии энергия Гиббса системы минимальна, а для того, чтобы найти положение равновесия, нам нужно оценить изменение стандартной энергии Гиббса правой части равновесия относительно левой части. Я специально не пишу тут никаких формул – на свете полно мест, где они выписаны, и вы сами их писали неоднократно в разных разделах физической химии. Так вот, нужно вспомнить еще одну вещь – все термодинамические функции, которые имеют размерность энергии (внутренняя энергия, энтальпия, свободная энергия, энергия Гиббса) не имеют абсолютной шкалы измерения, но отсчитываются от стандартных состояний веществ. Это такая конвенция, о которой раз и навсегда договорились, и все этим пользуются и не задают вопросов. Это произвол? Да, но общепринятый. В разных системах такими нулевыми уровнями принимают разные вещи. Например, в растворах, точкой отсчета, нулем энергии Гиббса считают чистый растворитель в стандартных условиях. А термодинамическая активность связана с энергией Гиббса, как мы знаем, логарифмической зависимостью. Вот и вся система – уровень энергии Гиббса чистого растворителя (любого!) равен нулю, а термодинамическая активность, логарифмом которой и является эта энергия, значит равна единице.
Я специально не пишу тут никаких формул – на свете полно мест, где они выписаны, и вы сами их писали неоднократно в разных разделах физической химии. Так вот, нужно вспомнить еще одну вещь – все термодинамические функции, которые имеют размерность энергии (внутренняя энергия, энтальпия, свободная энергия, энергия Гиббса) не имеют абсолютной шкалы измерения, но отсчитываются от стандартных состояний веществ. Это такая конвенция, о которой раз и навсегда договорились, и все этим пользуются и не задают вопросов. Это произвол? Да, но общепринятый. В разных системах такими нулевыми уровнями принимают разные вещи. Например, в растворах, точкой отсчета, нулем энергии Гиббса считают чистый растворитель в стандартных условиях. А термодинамическая активность связана с энергией Гиббса, как мы знаем, логарифмической зависимостью. Вот и вся система – уровень энергии Гиббса чистого растворителя (любого!) равен нулю, а термодинамическая активность, логарифмом которой и является эта энергия, значит равна единице. Вот поэтому в выражениях констант равновесий в водных растворах и нет воды – она там есть, на самом деле, просто зачем писать параметр, величина которого равна единице. Если хотите, пишите, конечно. Именно поэтому на вопрос, какова константа диссоциации воды в воде, мы без вопросов отвечаем – это десять в минус четырнадцатой степени. И та же величина описывает и кислотность воды в воде – это и есть константа кислотности. Она же известна как ионное произведение. И pK кислотности воды в воде равна 14 – строго 14. Здесь нет вообще повода для разногласий, и любой, кто заглянет в любой хороший учебник химической термодинамики в раздел, где обсуждают константы равновесий и энергии Гиббса, немедленно в этом убедится.
Вот поэтому в выражениях констант равновесий в водных растворах и нет воды – она там есть, на самом деле, просто зачем писать параметр, величина которого равна единице. Если хотите, пишите, конечно. Именно поэтому на вопрос, какова константа диссоциации воды в воде, мы без вопросов отвечаем – это десять в минус четырнадцатой степени. И та же величина описывает и кислотность воды в воде – это и есть константа кислотности. Она же известна как ионное произведение. И pK кислотности воды в воде равна 14 – строго 14. Здесь нет вообще повода для разногласий, и любой, кто заглянет в любой хороший учебник химической термодинамики в раздел, где обсуждают константы равновесий и энергии Гиббса, немедленно в этом убедится.
В этом месте кто-нибудь обязательно возмутится и спросит – а как это, что любой растворитель задает ноль энергии Гиббса и имеет единичную активность? Но растворы ведь такие разные, это невозможно. В этом непонимание и самой химической термодинамики и вообще экспериментальной основы химии как науки.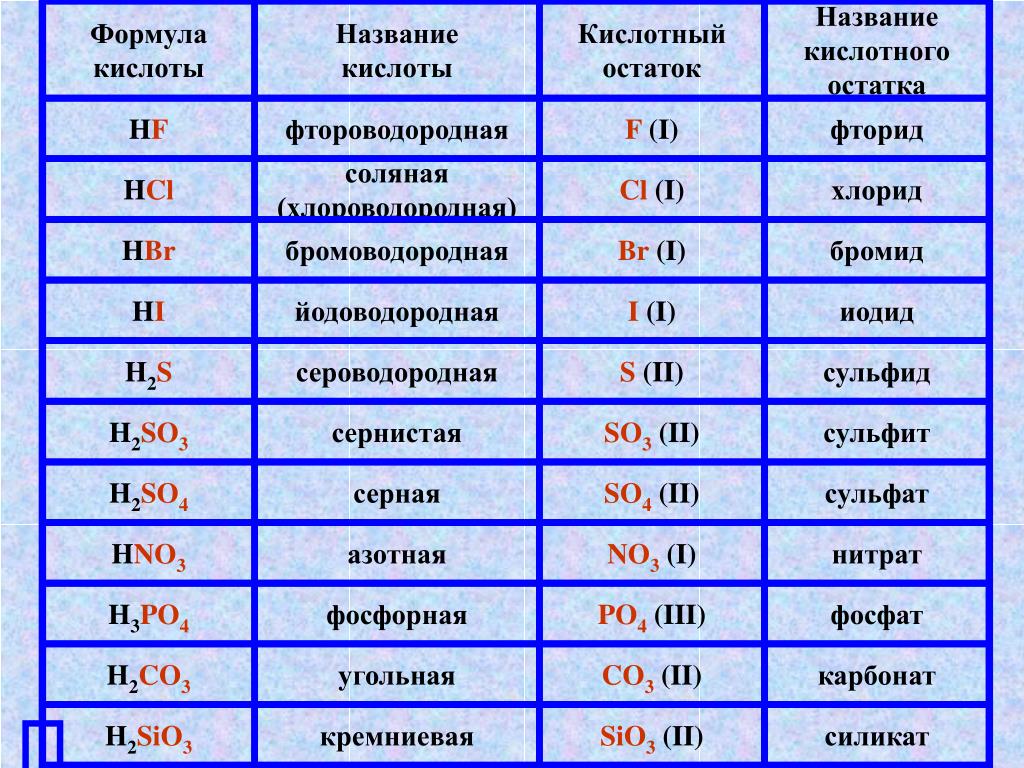 Химия изучает и описывает реальные процессы. И плевать хотела на нереальные, то есть такие, которые выходят за пределы химии. Мы ведь и для химических элементов считаем нулями стандартное состояние основного аллотропа элемента. И не паримся, что и водород, и графит, и металлическая платина – все нули. Мы не можем превратить водород в уголь, а уголь в платину. В этом месте обязательно найдется знаток космогонии, который скажет, как же не можем, а откуда тогда все взялось? Мы же знаем, что сначала был один водород (и гелий, но черт с ним, в химии гелия нет), а потом звезды сварили из водорода все остальные элементы, весьма драматическим образом. Значит можно сравнивать разные элементы по энергиям! Можно, но это не забота химии. Нам, химикам, плевать на это. Мы не звёзды, звёзды не мы. Не в этом смысле, по крайней мере, а в другом-то звёзды, конечно. В наших колбах никогда не загорится плазма, достаточная для термоядерного синтеза. Надеюсь, по крайней мере. Если кто-нибудь не уронит кузькину мать на наши лаборатории.
Химия изучает и описывает реальные процессы. И плевать хотела на нереальные, то есть такие, которые выходят за пределы химии. Мы ведь и для химических элементов считаем нулями стандартное состояние основного аллотропа элемента. И не паримся, что и водород, и графит, и металлическая платина – все нули. Мы не можем превратить водород в уголь, а уголь в платину. В этом месте обязательно найдется знаток космогонии, который скажет, как же не можем, а откуда тогда все взялось? Мы же знаем, что сначала был один водород (и гелий, но черт с ним, в химии гелия нет), а потом звезды сварили из водорода все остальные элементы, весьма драматическим образом. Значит можно сравнивать разные элементы по энергиям! Можно, но это не забота химии. Нам, химикам, плевать на это. Мы не звёзды, звёзды не мы. Не в этом смысле, по крайней мере, а в другом-то звёзды, конечно. В наших колбах никогда не загорится плазма, достаточная для термоядерного синтеза. Надеюсь, по крайней мере. Если кто-нибудь не уронит кузькину мать на наши лаборатории. Вот и с растворами ьакая же история, только не такая драматическая. Мы никогда не имеем дело с процессами, в которых один раствор в одном чистом расторителе в равновесном процессе преврщается в другой раствор в другом растворителе. Здесь очень важно слово “равновесном”. Попробуйте придумать такой процесс, если не верите. А пока не придумали, и не верифицировали вашу идею, придется смириться с тем, что химику совершенно до лампочки то, что в самых разных растворах в разны растворителях получаются одинаковые точки отсчета энергий Гиббса. Вообще-то это даже очень удобно. Основоположники химической термодинамики ох и неглупые были люди, прямо изумление берет какие неглупые!
Вот и с растворами ьакая же история, только не такая драматическая. Мы никогда не имеем дело с процессами, в которых один раствор в одном чистом расторителе в равновесном процессе преврщается в другой раствор в другом растворителе. Здесь очень важно слово “равновесном”. Попробуйте придумать такой процесс, если не верите. А пока не придумали, и не верифицировали вашу идею, придется смириться с тем, что химику совершенно до лампочки то, что в самых разных растворах в разны растворителях получаются одинаковые точки отсчета энергий Гиббса. Вообще-то это даже очень удобно. Основоположники химической термодинамики ох и неглупые были люди, прямо изумление берет какие неглупые!
Но в органической химии проблем гораздо больше. В органической химии очень редко используют воду как растворитель, особенно как единственный растворитель (довольно часто можно встретить смеси воды с другими растворителями, но почти никогда – чистую воду).
2.5: Факторы, определяющие кислотность
Периодические тенденции
Сначала мы сосредоточимся на отдельных атомах и подумаем о тенденциях, связанных с положением элемента в периодической таблице. Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам, таким как боковые цепи аланина, лизина и серина.
Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам, таким как боковые цепи аланина, лизина и серина.
Мы можем видеть четкую тенденцию кислотности, двигаясь слева направо по второму ряду таблицы Менделеева от углерода к азоту и к кислороду.Ключом к пониманию этой тенденции является рассмотрение гипотетического сопряженного основания в каждом случае : чем стабильнее (слабее) сопряженное основание, тем сильнее кислота . Посмотрите, где заканчивается отрицательный заряд в каждом сопряженном основании. В анионе этила отрицательный заряд несет углерод, в то время как в анионе метиламина и анионе этоксида заряды расположены на азоте и кислороде соответственно. Вспомните периодический тренд электроотрицательности: она также увеличивается по мере продвижения слева направо по ряду, а это означает, что кислород является наиболее электроотрицательным из трех, а углерод — наименее. Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд . Таким образом, анион этоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этила является наименее стабильным (самая высокая энергия, самый основный).
Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд . Таким образом, анион этоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этила является наименее стабильным (самая высокая энергия, самый основный).
Мы можем использовать тот же набор идей, чтобы объяснить разницу в основности между водой и аммиаком.
Глядя на значения pK и для соответствующих сопряженных кислот, мы знаем, что аммиак является более щелочным, чем вода.Кислород, как более электроотрицательный элемент, крепче держится за свою неподеленную пару, чем азот. Таким образом, неподеленная пара азота с большей вероятностью оторвется и образует новую связь с протоном — другими словами, она является более основной. Опять же, более реакционноспособное (более сильное) сопряженное основание означает менее реакционноспособную (более слабую) сопряженную кислоту.
При перемещении по вертикали в пределах данного столбца таблицы Менделеева мы снова наблюдаем четкую периодическую тенденцию кислотности. Лучше всего это иллюстрируется галогенидами: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по колонке.
Лучше всего это иллюстрируется галогенидами: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по колонке.
Наоборот, кислотность галоидокислот увеличивается по мере продвижения вниз по столбцу.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. Поскольку фтор является наиболее электроотрицательным элементом галогена, можно было бы ожидать, что фторид также является наименее основным ионом галогена. Но на самом деле это не менее стабильная , а самая основная! Оказывается, при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности.Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в ионе йода отрицательный заряд распределен по значительно большему объему:
Это иллюстрирует фундаментальную концепцию органической химии, которая достаточно важна, чтобы выделить ее красным цветом:
Электростатические заряды, как положительные, так и отрицательные, более стабильны, когда они «рассредоточены», чем когда они ограничены одним атомом .
Мы будем видеть, как эта идея снова и снова выражается на протяжении всего нашего изучения реактивности органических веществ в различных контекстах.Пока эта концепция применяется только к влиянию атомного радиуса на стабильность аниона. Поскольку фторид является наименее стабильным (наиболее основным) из сопряженных галогенидных оснований, HF является наименее кислой из галогенкислот, лишь немного более сильной, чем уксусная кислота. HI с pK a около -9 является одной из самых сильных известных кислот.
Что еще более важно для изучения биологической органической химии, эта тенденция говорит нам о том, что тиолы более кислые, чем спирты. Например, pK a тиоловой группы на боковой цепи цистеина составляет приблизительно 8.3, в то время как pK a для гидроксила в боковой цепи серина составляет порядка 17,
. Повторяю: сила кислоты увеличивается при движении вправо по строке периодической таблицы и при движении вниз по столбцу.
| Пример 7.6 |
|---|
Изобразите структуру сопряженного основания, которое образовалось бы, если соединение, указанное ниже, прореагировало с 1 молярным эквивалентом гидроксида натрия: Решение |
Эффект резонанса
В предыдущем разделе мы обратили внимание на периодические тенденции — различия кислотности и основности между группами, где обменный протон был связан с разными элементами.Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Несмотря на то, что они оба являются кислородными кислотами, значения pK и этанола и уксусной кислоты сильно различаются.Что делает карбоновую кислоту намного более кислой, чем спирт? Как и прежде, начнем с рассмотрения сопряженных базисов.
У обоих видов отрицательный заряд сопряженного основания удерживается кислородом, поэтому периодические тренды вызывать нельзя. Однако для уксусной кислоты есть ключевое отличие: можно привлечь резонансный вкладчик, в котором отрицательный заряд локализован на втором кислороде группы. Согласно нашим «правилам резонанса», две формы резонанса для сопряженного основания равны по энергии.Как вы, возможно, помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном кислороде, ни на другом: скорее, он разделен между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В ионе этоксида, напротив, отрицательный заряд «заперт» на одном кислороде — ему больше некуда деваться.
Теперь пришло время вспомнить утверждение из предыдущего раздела, которое было настолько важным, что было выделено жирным шрифтом в отдельном абзаце — на самом деле, оно настолько важно, что мы просто повторим его еще раз: «Электростатические заряды , будь то положительные или отрицательные, более стабильны, когда они «растянуты», чем когда они ограничены одним атомом.«Теперь мы видим эту концепцию в другом контексте, где заряд «распыляется» (иными словами, делокализуется) за счет резонанса , а не просто за счет размера задействованного атома
. Делокализация заряда в результате резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточное для того, чтобы объяснить разницу более чем в 12 pK a единиц между этанолом и уксусной кислотой (и помните, что pK a — это логарифмическое выражение). , поэтому мы говорим о разнице более чем на 10 90 103 12 90 104 между константами кислотности для двух молекул). Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
Ион ацетата намного более стабилен, чем ион этоксида, и все из-за эффектов делокализации резонанса.
Эффект резонанса также хорошо объясняет, почему атом азота является основным, когда он находится в амине, но , а не , когда он является частью амидной группы. Напомним, что в амиде связь углерод-азот имеет значительный характер двойной связи из-за второго резонансного фактора, в котором неподеленная пара азота является частью р-связи.
В то время как неподеленная электронная пара аминного азота «застревает» в одном месте, неподеленная пара амидного азота делокализована в результате резонанса.Обратите внимание, что в данном случае мы расширяем наше основное утверждение, чтобы сказать, что плотность электронов — в форме неподеленной пары — стабилизируется резонансной делокализацией, даже если в этом нет отрицательного заряда. Вот еще один способ подумать об этом: неподеленная пара на амидном азоте недоступна для связи с протоном — эти два электрона слишком «комфортны», будучи частью делокализованной системы пи-связи. Напротив, неподеленная пара на атоме азота амина не является частью делокализованной p-системы и очень готова к образованию связи с любым кислотным протоном, который может оказаться поблизости.
Напротив, неподеленная пара на атоме азота амина не является частью делокализованной p-системы и очень готова к образованию связи с любым кислотным протоном, который может оказаться поблизости.
Часто требуется тщательное размышление, чтобы предсказать самый кислый протон в молекуле. Аскорбиновая кислота, также известная как витамин С, имеет pK и 4,1.
В этой молекуле четыре гидроксильных группы — какая из них наиболее кислая? Если мы рассмотрим все четыре возможных сопряженных основания, то обнаружим, что есть только одно, для которого мы можем делокализовать отрицательный заряд на двух атомов кислорода.
| Пример 7.7 |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Индуктивный эффект
Сравните значения pK и уксусной кислоты и ее моно-, ди- и трихлорпроизводных:
Присутствие хлора явно увеличивает кислотность группы карбоновой кислоты, но аргумент здесь не имеет отношения к делокализации резонанса, потому что для хлорированных молекул нельзя привлечь никаких дополнительных резонансных вкладчиков.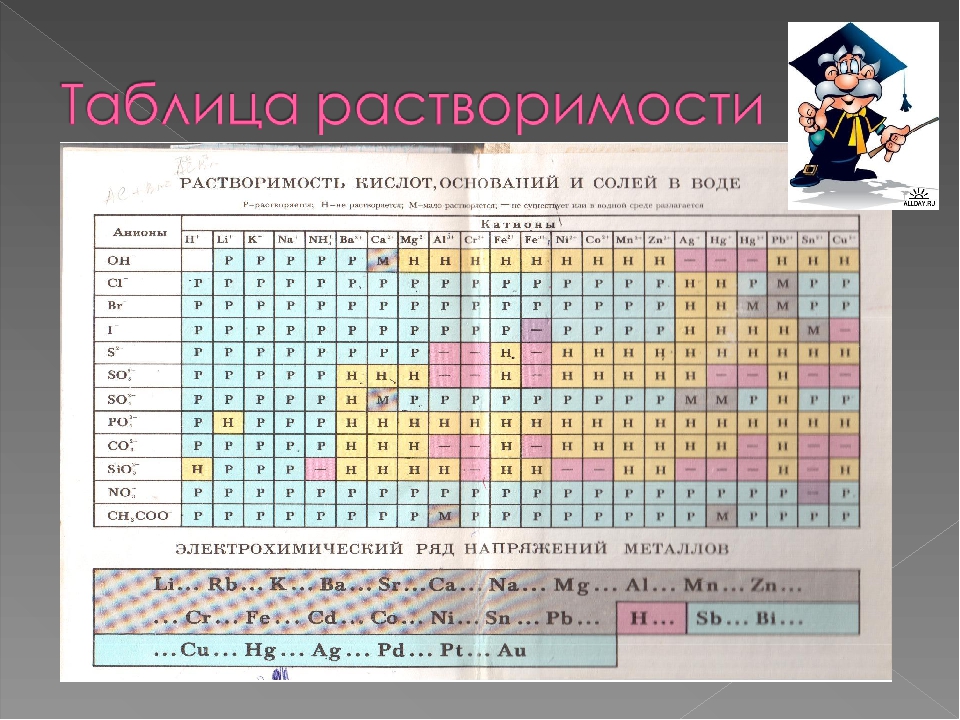 Скорее, объяснение этого явления связано с чем-то, что называется индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой .Обратите внимание, что эффект снижения pK a каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей значений pK a между спиртом и карбоновой кислотой. В целом резонансные эффекты более мощные, чем индуктивные эффекты .
Скорее, объяснение этого явления связано с чем-то, что называется индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора называется электроноакцепторной группой .Обратите внимание, что эффект снижения pK a каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей значений pK a между спиртом и карбоновой кислотой. В целом резонансные эффекты более мощные, чем индуктивные эффекты .
Индуктивный электроноакцепторный эффект хлора проявляется через ковалентные связи, и его влияние заметно уменьшается с расстоянием — таким образом, хлор, находящийся на расстоянии двух атомов углерода от группы карбоновой кислоты, имеет уменьшенный эффект по сравнению с хлором, удаленным всего на один углерод.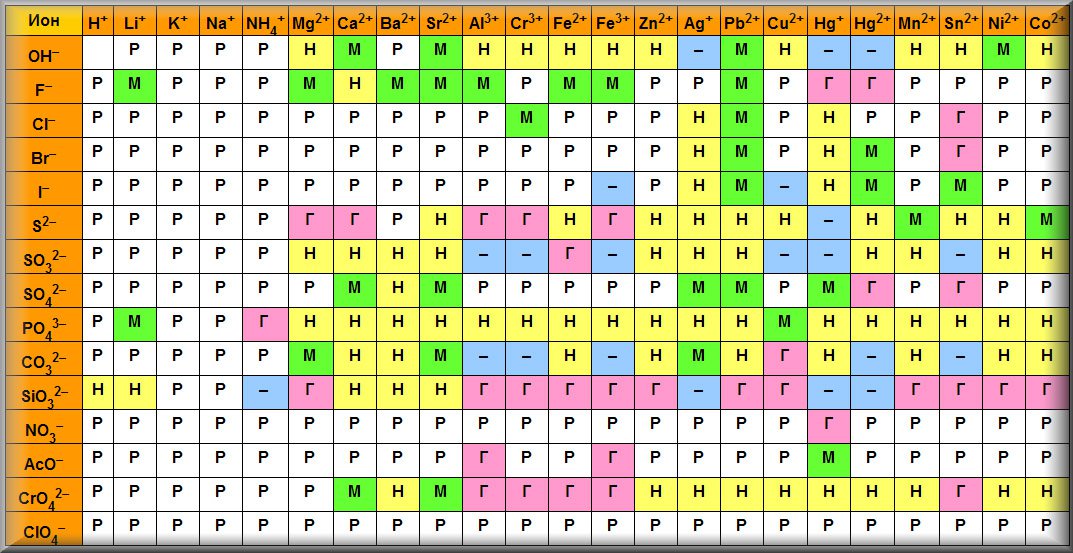
| Пример |
|---|
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
7.4: Влияние структуры на кислотность и щелочность
Теперь, когда мы знаем, как количественно определить силу кислоты или основания, наша следующая задача — понять фундаментальные причины, по которым одно соединение является более кислотным или более основной, чем другой.Это большой шаг: мы впервые используем наши знания об органической структуре и применяем их к вопросу об органической реакционной способности. Многие из идей, которые мы впервые рассмотрим здесь, будут применяться на протяжении всей книги по мере того, как мы будем рассматривать многие другие типы органических реакций.
Периодические тренды
Сначала мы сосредоточимся на отдельных атомах и подумаем о тенденциях, связанных с положением элемента в периодической таблице. Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам с теми же функциями, например боковые цепи аминокислот аланин (алкан), лизин (амин ) и серин (спирт).
Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и этанол, но концепции в равной степени применимы и к более сложным биомолекулам с теми же функциями, например боковые цепи аминокислот аланин (алкан), лизин (амин ) и серин (спирт).
Горизонтальный периодический тренд кислотности и щелочности:
Мы можем видеть четкую тенденцию кислотности, двигаясь слева направо по второму ряду таблицы Менделеева от углерода к азоту и к кислороду. Ключом к пониманию этой тенденции является рассмотрение гипотетического сопряженного основания в каждом случае: чем стабильнее (слабее) сопряженное основание, тем сильнее кислота. Посмотрите, где заканчивается отрицательный заряд в каждом сопряженном основании. В сопряженном основании этана отрицательный заряд несет атом углерода, а в сопряженном основании метиламина и этанола отрицательный заряд приходится на азот и кислород соответственно.Помните из раздела 2.4А, что электроотрицательность также увеличивается по мере того, как мы движемся слева направо по ряду периодической таблицы, а это означает, что кислород является наиболее электроотрицательным из трех атомов, а углерод — наименее.
Примечание
Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд. Более слабые основания имеют отрицательный заряд на более электроотрицательных атомах; более сильные основания имеют отрицательный заряд на менее электроотрицательных атомах.
Таким образом, анион метоксида является наиболее стабильным (самая низкая энергия, наименее основный) из трех сопряженных оснований, а анион этилкарбаниона является наименее стабильным (самая высокая энергия, самый основный).И наоборот, этанол — самая сильная кислота, а этан — самая слабая кислота.
Двигаясь по вертикали в пределах данного столбца таблицы Менделеева, мы снова наблюдаем четкую периодическую тенденцию кислотности. Лучше всего это видно на примере галогенкислот и галогенидов: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по колонке.
Вертикальный периодический тренд кислотности и щелочности:
И наоборот, кислотность галоидокислот увеличивается по мере продвижения вниз по колонке.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. Поскольку фтор является наиболее электроотрицательным элементом галогена, можно было бы ожидать, что фторид также является наименее основным ионом галогена. Но на самом деле он наименее стабильный и самый простой! Оказывается, при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности. Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в ионе йодида отрицательный заряд распределен по значительно большему объему:
Это иллюстрирует фундаментальную концепцию органической химии:
Электростатические заряды, как положительные, так и отрицательные, более стабильны, когда они «распределены» по большей площади.
Мы будем видеть, как эта идея снова и снова выражается на протяжении всего нашего изучения реактивности органических веществ в различных контекстах. Пока мы применяем эту концепцию только к влиянию атомного радиуса на базовую прочность. -\]
-\]
Мы знаем, что HCl (\(pK_a\)-7) более сильная кислота, чем HF (\(pK_a\)3.2), поэтому равновесие реакции находится на стороне продукта: реакция экзергоническая, и «движущая сила» толкает реагент к продукту.
Чем объясняется эта движущая сила? Сначала рассмотрим фактор заряда: как мы только что узнали, хлорид-ион (со стороны продукта) более стабилен, чем фторид-ион (со стороны реагента). Это частично объясняет движущую силу, переходящую от реагента к продукту в этой реакции: мы идем от менее стабильного иона к более стабильному иону.
А как насчет общей энергии связи, другого фактора движущей силы? Если вы обратитесь к таблице энергий связи, вы увидите, что связь HF на стороне продукта более энергична (сильнее), чем связь H-Cl на стороне реагента: 570 кДж/моль против 432 кДж/моль соответственно).Это также способствует движущей силе: мы движемся от более слабой (менее стабильной) связи к более сильной (более стабильной) связи.
Резонансные эффекты
В предыдущем разделе мы обратили внимание на периодические тенденции — различия кислотности и основности между группами, где обменный протон был связан с разными элементами.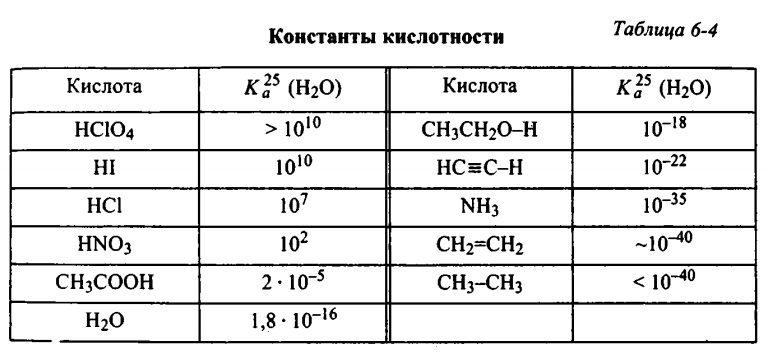 Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов.Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор/акцептор протонов.Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но полученные нами выводы будут в равной степени справедливы для всех групп спирта и карбоновой кислоты.
Несмотря на то, что они оба являются кислородными кислотами, значения pKa этанола и уксусной кислоты резко различаются. Что делает карбоновую кислоту намного более кислой, чем спирт? Как и прежде, начнем с рассмотрения устойчивости сопряженных оснований, помня, что более стабильное (более слабое) сопряженное основание соответствует более сильной кислоте.
У обоих видов отрицательный заряд сопряженного основания расположен на кислороде, поэтому периодические тренды вызывать нельзя. Однако для уксусной кислоты есть ключевое отличие: два резонансных вклада могут быть привлечены для сопряженного основания, а отрицательный заряд может быть делокализован (разделен) между двумя атомами кислорода. {12}\) между значениями \(K_a\) для двух молекул!)
{12}\) между значениями \(K_a\) для двух молекул!)
Эффект резонанса также хорошо объясняет, почему атом азота является основным, когда он находится в амине, но не основным, когда он является частью амидной группы.Напомним, что в амиде связь углерод-азот имеет значительный характер двойной связи из-за незначительного, но все же важного вклада резонанса, в котором неподеленная пара азота является частью связи \(\pi\).
В то время как неподеленная пара азота амина «застревает» в одном месте, неподеленная пара атома азота амида делокализована резонансом. Обратите внимание, что в данном случае мы расширяем наше основное утверждение, чтобы сказать, что плотность электронов — в форме неподеленной пары — стабилизируется резонансной делокализацией, даже если в этом нет отрицательного заряда.Вот еще один способ подумать об этом: неподеленная пара на амидном азоте недоступна для связи с протоном — эти два электрона слишком «комфортны», будучи частью делокализованной системы \(\pi \)-связей.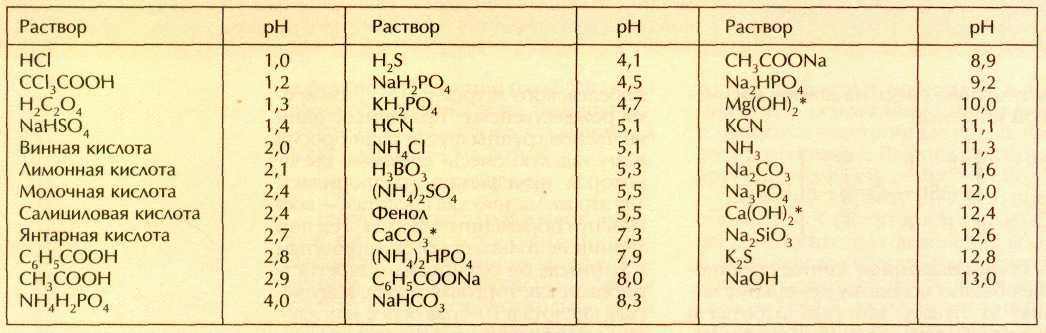 Неподеленная пара на аминном азоте, напротив, не так удобна — она не является частью делокализованной системы \(\pi \) и доступна для образования связи с любым кислотным протоном, который может оказаться поблизости.
Неподеленная пара на аминном азоте, напротив, не так удобна — она не является частью делокализованной системы \(\pi \) и доступна для образования связи с любым кислотным протоном, который может оказаться поблизости.
Если амидная группа протонирована, она будет находиться на кислороде, а не на азоте.
Упражнение 7.4.1
- Изобразите структуру Льюиса азотной кислоты \(HNO_3\).
- Азотная кислота является сильной кислотой — она имеет \(pK_a\) -1,4. Приведите структурный аргумент, объясняющий его силу. Ваш ответ должен включать структуру сопряженного основания азотной кислоты.
Упражнение 7.4.2
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения.
Упражнение 7.4.3
Часто требуется тщательное размышление, чтобы предсказать самый кислый протон в молекуле. Аскорбиновая кислота, также известная как витамин С, имеет \(pK_a\) 4,1 — тот факт, что он находится в диапазоне карбоновых кислот, предполагает, что отрицательный заряд сопряженного основания может быть делокализован резонансом до двух атомов кислорода.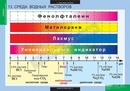 . Что, если четыре протона \(OH\) в молекуле являются наиболее кислыми? Нарисуйте структуру аскорбата, сопряженного основания аскорбиновой кислоты, затем нарисуйте второй компонент резонанса, показывающий, как отрицательный заряд делокализован ко второму атому кислорода.
. Что, если четыре протона \(OH\) в молекуле являются наиболее кислыми? Нарисуйте структуру аскорбата, сопряженного основания аскорбиновой кислоты, затем нарисуйте второй компонент резонанса, показывающий, как отрицательный заряд делокализован ко второму атому кислорода.
- Подсказка
Попробуйте депротонировать каждую группу \(OH\) по очереди, а затем используйте свои навыки рисования резонанса, чтобы выяснить, может ли произойти делокализация заряда.
Индуктивные эффекты
Сравните значения \(pK_a\) уксусной кислоты и ее моно-, ди- и трихлорпроизводных:
Присутствие атомов хлора явно увеличивает кислотность карбоксильной группы, но аргумент здесь не имеет отношения к делокализации резонанса, потому что для хлорированных молекул нельзя привлечь никаких дополнительных резонансных вкладчиков.Скорее, объяснение этого явления связано с так называемым индуктивным эффектом. Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора можно назвать электроноакцепторной группой.Обратите внимание, что эффект снижения \(pK_a\) каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей в значениях \(pK_a\) между спиртом и карбоновой кислотой. Как правило, резонансные эффекты более сильны, чем индуктивные.
Атом хлора более электроотрицателен, чем водород, и поэтому способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. По сути, атомы хлора способствуют дальнейшему распределению электронной плотности сопряженного основания, что, как мы знаем, оказывает стабилизирующее действие. В этом контексте заместитель хлора можно назвать электроноакцепторной группой.Обратите внимание, что эффект снижения \(pK_a\) каждого атома хлора, хотя и значительный, не столь драматичен, как эффект делокализации резонанса, иллюстрируемый разницей в значениях \(pK_a\) между спиртом и карбоновой кислотой. Как правило, резонансные эффекты более сильны, чем индуктивные.
Поскольку индуктивный эффект зависит от электроотрицательности, фторсодержащие заместители имеют более выраженный \(pK_a\)-снижающий эффект, чем хлорсодержащие заместители.
Кроме того, индуктивность осуществляется через ковалентные связи, и ее влияние заметно уменьшается с расстоянием — таким образом, хлор, находящийся на расстоянии двух атомов углерода от группы карбоновой кислоты, оказывает меньшее влияние по сравнению с хлором, находящимся всего на расстоянии одного атома углерода.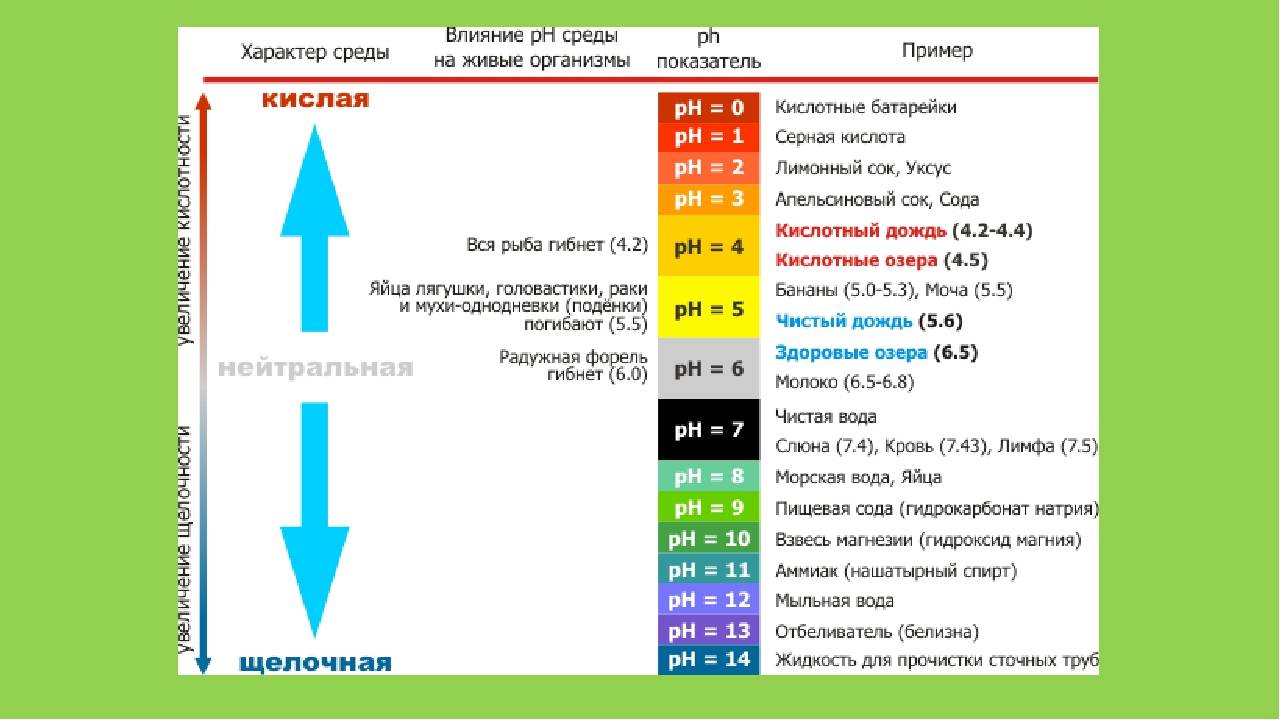
Упражнение 7.4.4
Расположите приведенные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения.
Авторы и авторство
5 ключевых факторов, влияющих на кислотность в органической химии
Пять ключевых факторов, влияющих на кислотность
Сегодня мы поговорим о том, что стоит за тенденциями кислотности для различных молекул, и обсудим наиболее важные факторы, определяющие эти значения.
Раньше я писал тоном школьной учительницы о том, что pKa является одним из самых важных показателей, которые вы можете изучить в органической химии, и незнание некоторых основных значений pKa перед экзаменом очень похоже на то, как если бы вы подошли к покерному столу, не зная ценности рук: ты потеряешь рубашку.
Давайте быстро рассмотрим основы кислотности и щелочности. Вот сокращенная версия:
- Кислоты Бренстеда являются донорами протонов, кислоты Льюиса являются акцепторами электронных пар .
 Обратное: основание Бренстеда = акцептор протона, основание Льюиса = донор электронной пары.
Обратное: основание Бренстеда = акцептор протона, основание Льюиса = донор электронной пары. - Сопряженное основание получается при удалении протона (H+) из соединения. Например, HO – является сопряженным основанием воды. O 2- является сопряженным основанием HO – . И наоборот, сопряженные кислоты — это то, что вы получаете, когда добавляете протон к соединению. Сопряженная кислота воды H 3 O + .
- Быстрый тест: рН 1 кислотный или щелочной? pKa аналогичен pH в том смысле, что низкие (и даже отрицательные значения) обозначают сильные кислоты. Это потому, что рКа основано на равновесии:
- В соответствии с этим все, что стабилизирует сопряженное основание, увеличивает кислотность. Следовательно, pKa также является мерой стабильности основания конъюгата. Иными словами, сильные кислоты имеют слабые сопряженные основания, и наоборот.
Разобравшись с этим, приступим.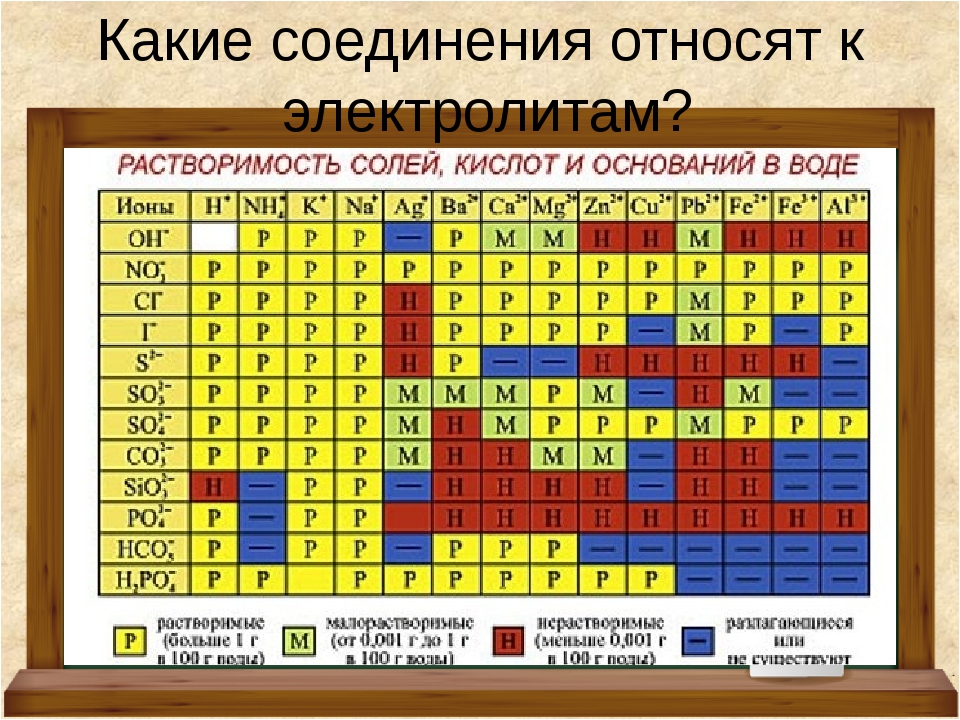
Оглавление
- Фактор № 1 — Плата.
- Фактор №2 – Роль атома
- Фактор №3 – Резонанс
- Фактор №4 – Индуктивные эффекты
- Фактор №5 – Орбитали
1.Фактор №1 – Зарядка.
Удаление протона H+ уменьшает формальный заряд атома или молекулы на одну единицу. Это, конечно, проще всего сделать, когда атом изначально несет заряд +1, и становится все труднее, когда общий заряд становится отрицательным. Тенденции кислотности отражают это:
Обратите внимание, что когда сопряженное основание (B-) становится отрицательным, второе депротонирование дает дианион (B 2-). Хотя это далеко не невозможно, формирование дианиона может быть затруднено из-за накопления отрицательного заряда и соответствующего электронного отталкивания.
2. Фактор №2 – Роль атома Этот пункт вызывает много путаницы из-за наличия двух, казалось бы, противоречащих друг другу тенденций.
Вот первый пункт: кислотность увеличивается, когда мы идем через строк в периодической таблице. Это имеет смысл, верно? Понятно, что HF более электроотрицательна, чем h3O, Nh4 и Ch5, из-за большей электроотрицательности фтора по сравнению с кислородом, азотом и углеродом. Фтор, несущий отрицательный заряд, является счастливым фтором.
Но вот что кажется странным. Сама по себе HF не является «сильной» кислотой, по крайней мере, в том смысле, что она полностью ионизируется в воде. HF является более слабой кислотой, чем HCl, HBr и HI. Что тут происходит?
Можно привести два аргумента, почему это так. Первая причина связана с более короткой (и прочной) связью HF по сравнению с более крупными галогеноводородами. Второе связано с устойчивостью сопряженного основания . Фторид-анион F(–) — крошечный и злобный зверек с наименьшим ионным радиусом среди всех других ионов, несущих единственный отрицательный заряд.Поэтому его заряд распределяется по меньшему объему, чем у более крупных галогенидов, что энергетически невыгодно: с одной стороны, F(-) требует сольватации, что приведет к меньшему энтропийному члену в Δ Гс.
Обратите внимание, что эта тенденция также сохраняется для h3O и h3S, причем h3S примерно в 10 миллионов раз более кислый.
3. Фактор №3 – РезонансОгромным стабилизирующим фактором для сопряженного основания является возможность делокализации отрицательного заряда посредством резонанса.Классическими примерами являются фенол (C6H5OH), который примерно в миллион раз более кислый, чем вода, и уксусная кислота (pKa ~5).
Однако будьте осторожны — для системы π недостаточно просто быть рядом с протоном — электроны сопряженного основания должны находиться на орбитали, которая допускает эффективное перекрытие (для подлого вопроса с подвохом в этом
4. Фактор № 4 – Индуктивные эффектыЭлектроотрицательные атомы могут притягивать к себе отрицательный заряд, что может привести к значительной стабилизации сопряженных оснований.Взгляните на эти примеры:
Как и ожидалось, этот эффект будет связан с двумя основными факторами: 1) электроотрицательностью элемента (чем более электроотрицательно, тем более кислотно) и расстоянием между электроотрицательным элементом и отрицательным зарядом. .
.
Опять же, кислотность хорошо связана со стабильностью сопряженного основания. И стабильность сопряженного основания зависит от того, насколько хорошо оно может приспособиться к новой паре электронов.В эффекте, близком к электроотрицательности, чем больше s-характер на орбитали, тем ближе электроны будут к ядру и тем ниже по энергии (= стабильны!) они будут.
Посмотрите, какая разница между pKa ацетилена и алканов – 25! Это 10 в степени 25, например, «в 100 раз больше, чем число Авогадро». Просто чтобы дать вам представление о масштабе. Это удивительная вещь в химии — диапазон в силе различных явлений внушает благоговейный трепет.
На самом деле я нашел мнемонику, которая может помочь вам запомнить эти эффекты. Это заслуга доктора Кристин Пруис, старшего преподавателя Университета штата Аризона в Темпе.
C 9005
C Rarge
A TOM
R Esonance
D
D IPOLE I Nduction
O RBITALL
= Cardio.
Осторожнее с мнемоникой, но вот.
Как пользоваться таблицей pKa
Ключевой навык — как пользоваться таблицей pKa
Сегодня мы поговорим об невероятно важном навыке, на овладение которым может уйти некоторое время, но который приносит огромные дивиденды.Мы рассмотрим точные детали , как использовать таблицу pKa. [Предыстория pKa — прочтите этот пост] Понимание правильного использования таблицы pKa даст вам возможность распознавать, какие кислотно-щелочные реакции будут происходить, а какие нет. По мере того, как вы проходите через Организацию 1 и Организацию 2, она будет увеличиваться до и часто до . Возможно, будет полезно вернуться назад и рассмотреть некоторые факторы, влияющие на кислотность, о которых говорилось ранее.
Содержание
- Пример кислотно-основного вопроса
- Ключевое правило кислотно-основных реакций: в благоприятной кислотно-основной реакции более сильная кислота плюс более сильное основание дает более слабую кислоту и более слабое основание
- Используйте принцип «Чем слабее кислота, тем сильнее сопряженное основание» для получения силы оснований из таблицы pKa
- Выделите четыре компонента кислотно-основной реакции (кислота, основание, сопряженная кислота, сопряженное основание ) и оцените, соответствует ли реакция ключевому правилу
- Работа с соединениями, подобными, но не указанными в таблице pKa
1.
 Пример вопроса
Пример вопросаДопустим, вам задан следующий вопрос:
Под кислотностью здесь имеется в виду кислотность по Бренстеду, другими словами, способность отдавать протон.
Допустим, нам дана таблица pKa со следующими значениями.
2. Ключевое правило кислотно-основных реакций: более сильная кислота плюс более сильное основание дает более слабую кислоту и более слабое основание
С чего мы начнем с этой проблемой?
- Помните, что таблица pKa ранжирует молекулы в порядке их кислотности, от сильнокислотных (т.г. HCl с pKa от –8) до слабокислой (например, метан, pKa ~50).
- От чего в первую очередь зависит, произойдет ли кислотно-щелочная реакция? Мы применяем следующий принцип к кислотно-основным реакциям: Более сильная кислота будет реагировать с более сильным основанием с образованием более слабой кислоты и более слабого основания.
- Для определения силы кислоты достаточно легко использовать таблицу pKa – сразу видно, что H 2 O (pKa 15) является более сильной кислотой, чем NH 3 (pKa 38) .
 Вопрос в том, как мы определяем базовую прочность?
Вопрос в том, как мы определяем базовую прочность?
Вот как мы это делаем. Вытяните сопряженные основания кислот на вашей таблице pka, удалив протон.
Nh4 -> Nh3(-) или Ch5 -> Ch4 (-).
3. Используйте принцип «Чем слабее кислота, тем сильнее сопряженное основание» для получения силы оснований из таблицы рКа
. Чем слабее кислота, тем сильнее сопряженное основание. Используя этот принцип, вы также можете использовать таблицу pKa, чтобы получить сильные стороны оснований. Я называю это обратной таблицей pKa.Вот таблица pKa с сопряженными основаниями:
4. Нарисуйте четыре компонента кислотно-основной реакции (кислота, основание, сопряженная кислота, сопряженное основание) и оцените, соответствует ли реакция ключу Правило
4 .Вот как мы применяем это знание к проблеме.
Найдите кислоту в таблице pKa. Найдите основание в обратной таблице pKa. Проведите кислотно-основную реакцию, то есть добавьте протон к основанию и удалите протон из кислоты.
Найдите основание в обратной таблице pKa. Проведите кислотно-основную реакцию, то есть добавьте протон к основанию и удалите протон из кислоты.
5. Оценить : Новая кислота сильнее или слабее? Новая база сильнее или слабее?
6. Примеры.
Пример A: У нас есть CH 4 и HO(-) Мы можем найти CH 4 в таблице pKa – у него pKa 50.Ион гидроксида, HO(-), равен , а не в левой части таблицы pKa, но равен в «обратной» таблице pKa — это сопряженное основание воды, H 2 O. Таким образом, CH 4 является кислотой, а HO(-) является основанием в этой реакции.
Выполняя предложенную кислотно-основную реакцию, мы переносим протон от CH 4 к HO (-). Таким образом, продуктами этой реакции будут CH 3 (-) и вода.
Теперь мы задаем вопрос – как они соотносятся по силе с нашими исходными кислотами и основаниями? Вода имеет pKa ~15, а CH 4 имеет pKa 50. Наш продукт представляет собой более сильную кислоту. Из обратной таблицы pKa мы также отмечаем, что CH 3 (-) является более сильным основанием, чем HO(–). Наш продукт представляет собой более прочную основу.
Наш продукт представляет собой более сильную кислоту. Из обратной таблицы pKa мы также отмечаем, что CH 3 (-) является более сильным основанием, чем HO(–). Наш продукт представляет собой более прочную основу.
Вердикт — реакции не будет. Нам нужно перейти к более слабой кислотно-основной паре (см. № 2 выше). Поэтому мы пишем «НР».
Вот еще пример.
Пример B – Возьмите HCΞCH и NH 2 (–). HCΞCH имеет pKa 25; с другой стороны, NH 2 (-) находится в таблице сопряженных оснований.Выделение продуктов кислотно-основной реакции даст нам NH 3 ( более слабая кислота, чем HCΞCH) и HCΞC(–) ( более слабое основание, чем NH 2 (–). Эта реакция пойдет.
Пример C : Возьмем NH 3 и HCl. На этот раз мы можем найти как HCl, так и Nh4 в таблице pKa. Но HCl имеет pKa (–8), а NH 3 имеет pKa 38.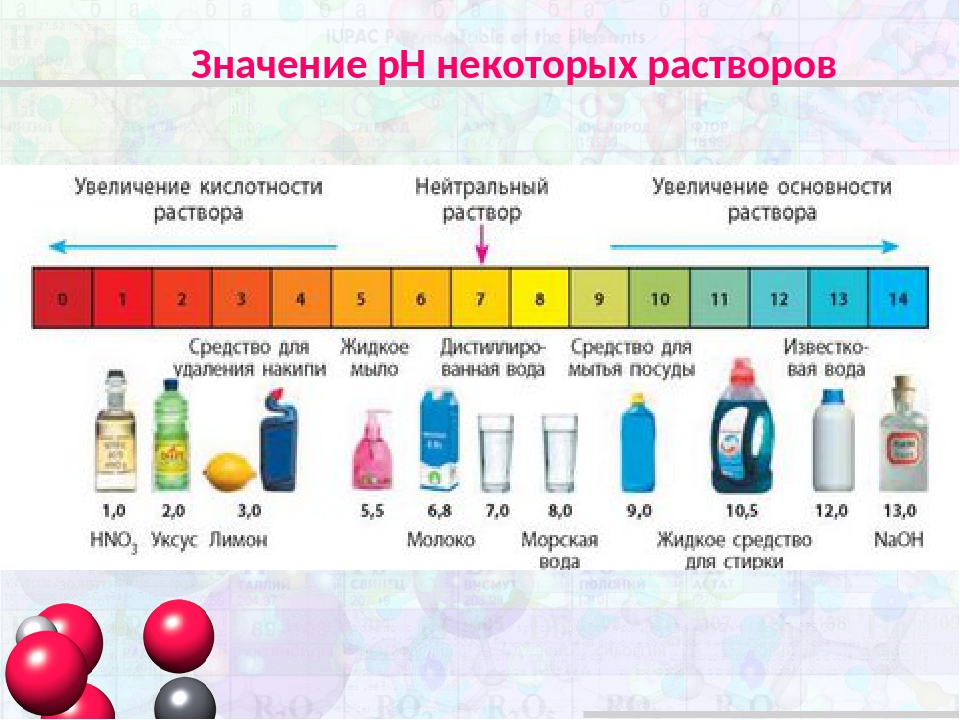 Очевидно, что здесь HCl будет действовать как кислота, а NH 3 — как основание.
Очевидно, что здесь HCl будет действовать как кислота, а NH 3 — как основание.
Мы можем записать нашу кислотно-основную реакцию: HCl + NH 3 → NH 4 (+) Cl(–)
Наш кислый продукт, Nh5, имеет pKa 9. Наш продукт является более слабой кислотой чем HCl. Наш основной продукт Cl(-) находится ниже NH 3 по нашей обратной шкале pKa. Наш продукт является более слабым основанием, чем Nh4. Вывод: эта реакция тоже идет. И действительно, если вы окажетесь в морозильной хижине с бутылкой концентрированной HCl и водным раствором аммиака, которые составят вам компанию, сложение их вместе определенно согреет ваш день.Это единственная ситуация, в которой я бы рекомендовал это.
5. Работа с соединениями, которые похожи, но не включены в таблицу pKa
В. Как поступить с соединением, которое похоже, но не включено в таблицу? Возьмем, к примеру, гексан. Хотя технически его нет в списке, его поведение достаточно похоже на поведение метана — в конце концов, они оба алканы — поэтому мы делаем предположение, что pKa примерно одинаковы.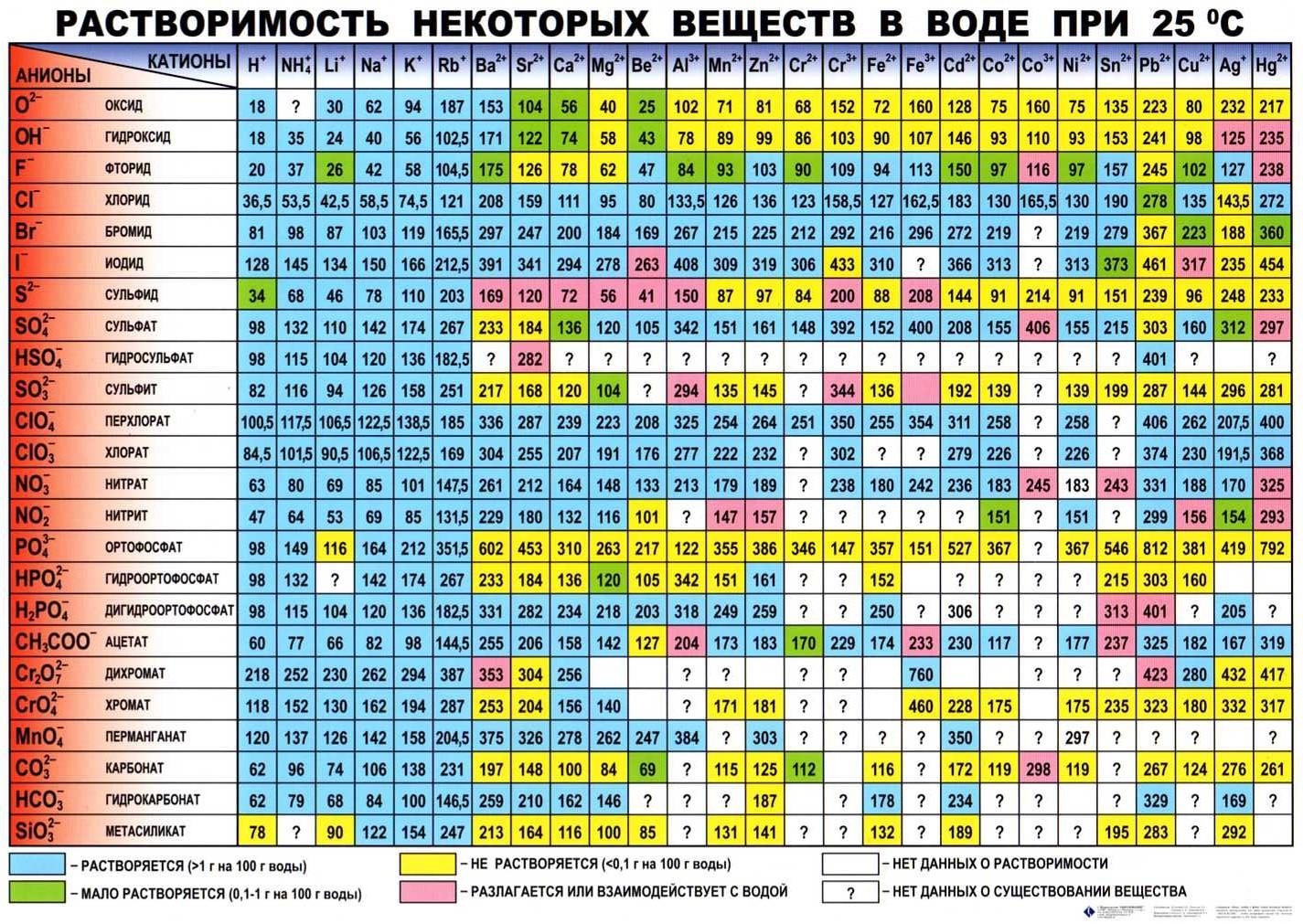 Точно так же аминоподобный триметиламин [N(CH 3 ) 3 ] будет вести себя аналогично NH 3 в реакции с HCl.
Точно так же аминоподобный триметиламин [N(CH 3 ) 3 ] будет вести себя аналогично NH 3 в реакции с HCl.
Последняя точка на крупноформатном виде. Обратите внимание на шаблон. Сопряженное основание метана (H 3 C(-) ) достаточно сильное, чтобы депротонировать все, что ниже его в таблице pKa (то есть почти все). Метиллитий, CH 3 Li, является невероятно сильным основанием. И наоборот, ацетилид-ион HCC(-) достаточно силен, чтобы эффективно депротонировать любую кислоту с pKa ниже ~25, а ацетат-ион (Ch4COO(-)) еще слабее и способен депротонировать только любую кислоту с pKa ниже 5.
Вот почему я сравниваю такое сильное основание, как метиллитий, с флеш-роялем в покере — оно, по сути, победит любую руку (кислоту), с которой столкнется.
Next Post: Практическое правило для кислотно-щелочных реакций
14.3 Относительная сила кислот и оснований — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Рационализировать тенденции кислотно-щелочной прочности по отношению к молекулярной структуре
- Выполнение расчетов равновесия для слабых кислотно-щелочных систем
- Потренируйтесь самостоятельно рисовать резонансные структуры сопряженного основания фенола!
- Именно из-за особой кислотности фенола (и других ароматических спиртов) NaOH можно использовать для эффективного депротонирования фенола, но не для нормальных спиртов, таких как этанол.Покажите уравнения этих реакций и объясните разницу, используя значения p K a .
относительные силы кислот и оснований по их константам ионизации
Кислотные и щелочные константы ионизации
Относительная сила кислоты или основания – это степень, в которой они ионизуются при растворении в воде.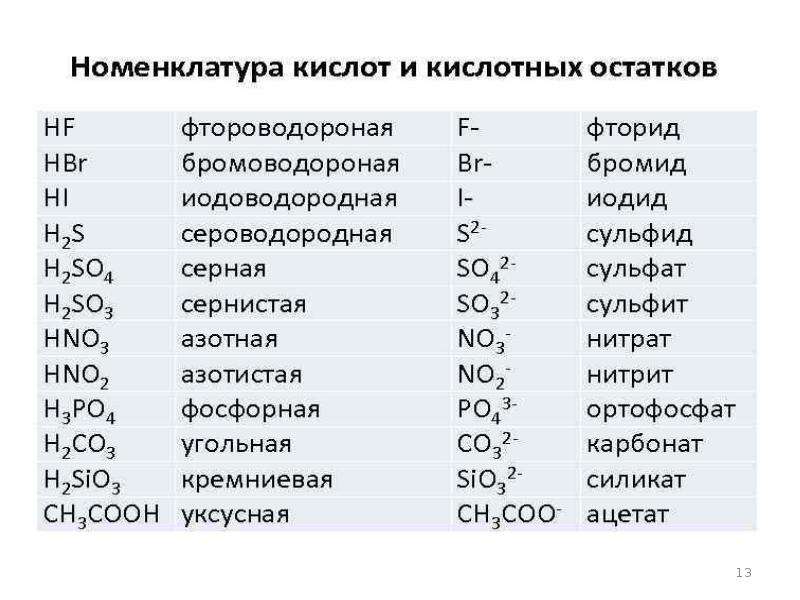 Если реакция ионизации практически завершена, кислоту или основание называют сильным ; если происходит относительно небольшая ионизация, кислота или основание слабы. Как будет видно из оставшейся части этой главы, слабых кислот и оснований намного больше, чем сильных. Наиболее распространенные сильные кислоты и основания перечислены на рис. 14.6.
Если реакция ионизации практически завершена, кислоту или основание называют сильным ; если происходит относительно небольшая ионизация, кислота или основание слабы. Как будет видно из оставшейся части этой главы, слабых кислот и оснований намного больше, чем сильных. Наиболее распространенные сильные кислоты и основания перечислены на рис. 14.6.
Фигура 14,6 Некоторые из распространенных сильных кислот и оснований перечислены здесь.
Относительная сила кислот может быть определена путем измерения их констант равновесия в водных растворах.В растворах одинаковой концентрации более сильные кислоты ионизируются в большей степени и поэтому дают более высокие концентрации ионов гидроксония, чем более слабые кислоты. Константа равновесия кислоты называется константой ионизации кислоты, K a . Для реакции кислоты HA:
HA(водн.)+h3O(л)⇌h4O+(водн.)+A-(водн.), HA(водн.)+h3O(ж)⇌h4O+(водн.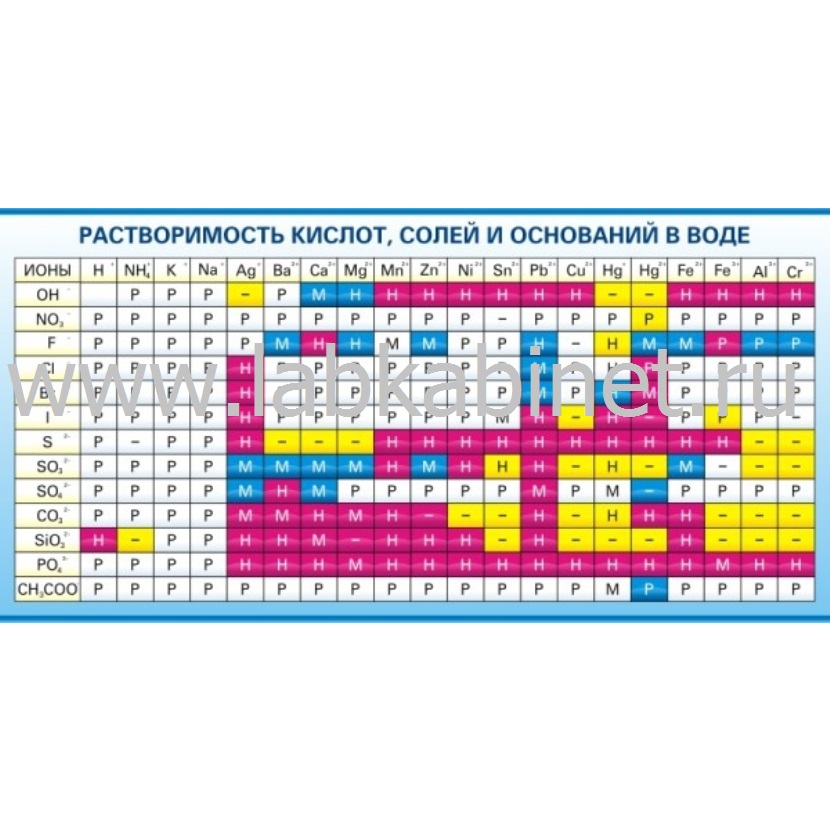 )+A-(водн.) ,
)+A-(водн.) ,записывается константа кислотной ионизации
Ka=[h4O+][A-][HA]Ka=[h4O+][A-][HA], где концентрации являются равновесными.Хотя вода является реагентом в реакции, она также является и растворителем, поэтому мы не включаем [H 2 O] в уравнение. Чем больше K a кислоты, тем больше концентрация h4O+h4O+ и A − по отношению к концентрации неионизированной кислоты HA в равновесной смеси и тем сильнее кислота. Кислота классифицируется как «сильная», когда она подвергается полной ионизации, и в этом случае концентрация ГК равна нулю, а константа ионизации кислоты неизмеримо велика ( K a ≈ ∞).Кислоты, которые частично ионизированы, называются «слабыми», и их константы кислотной ионизации могут быть измерены экспериментально. Таблица констант ионизации для слабых кислот приведена в Приложении H.
Чтобы проиллюстрировать эту идею, ниже показаны три уравнения ионизации кислот и значения K a . Константы ионизации увеличиваются от первого к последнему из перечисленных уравнений, указывая на то, что относительная сила кислоты увеличивается в следующем порядке:
Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2-(водн.)Ka=1.8×10−5Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2−(водн.)Ka=1,8×10−5
HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)Ka=4,6×10-4HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)Ka=4,6× 10−4
HSO4-(водн.)+h3O(водн.)⇌h4O+(водн.)+SO42-(водн.)Ka=1,2×10-2HSO4-(водн.)+h3O(водн.)⇌h4O+(водн.)+SO42-(водн.)Ka= 1,2×10−2
Константы ионизации увеличиваются от первого к последнему из перечисленных уравнений, указывая на то, что относительная сила кислоты увеличивается в следующем порядке:
Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2-(водн.)Ka=1.8×10−5Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2−(водн.)Ka=1,8×10−5
HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)Ka=4,6×10-4HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)Ka=4,6× 10−4
HSO4-(водн.)+h3O(водн.)⇌h4O+(водн.)+SO42-(водн.)Ka=1,2×10-2HSO4-(водн.)+h3O(водн.)⇌h4O+(водн.)+SO42-(водн.)Ka= 1,2×10−2
Другой мерой силы кислоты является процент ее ионизации. Процент ионизации слабой кислоты определяется по составу равновесной смеси:
% ионизации=[h4O+]экв[HA]0×100% ионизации=[h4O+]экв[HA]0×100, где числитель эквивалентен концентрации сопряженного основания кислоты (по стехиометрии [A — ] = [H 3 O + ]).В отличие от значения K a , процент ионизации слабой кислоты зависит от начальной концентрации кислоты, обычно уменьшаясь по мере увеличения концентрации. Для подтверждения такого поведения можно использовать расчеты равновесия, подобные описанным далее в этой главе.
Для подтверждения такого поведения можно использовать расчеты равновесия, подобные описанным далее в этой главе.
Пример 14,7
Расчет процента ионизации от pH
Рассчитайте процент ионизации 0,125- М раствора азотистой кислоты (слабая кислота) с рН 2.09.Решение
Процент ионизации кислоты: [h4O+]экв[HNO2]0×100[h4O+]экв[HNO2]0×100Преобразование предоставленного pH в молярность иона гидроксония дает
[h4O+]=10-2,09=0,0081M[h4O+]=10-2,09=0,0081MПодстановка этого значения и заданной начальной концентрации кислоты в уравнение процентной ионизации дает
8,1×10-30,125×100=6,5%8,1×10-30,125×100=6,5%(Напомним, что приведенное значение pH 2,09 является логарифмическим, поэтому оно содержит только две значащие цифры, что ограничивает достоверность вычисленного процента ионизации.)
Проверьте свои знания
Рассчитайте процентную ионизацию 0,10- М раствора уксусной кислоты с рН 2,89.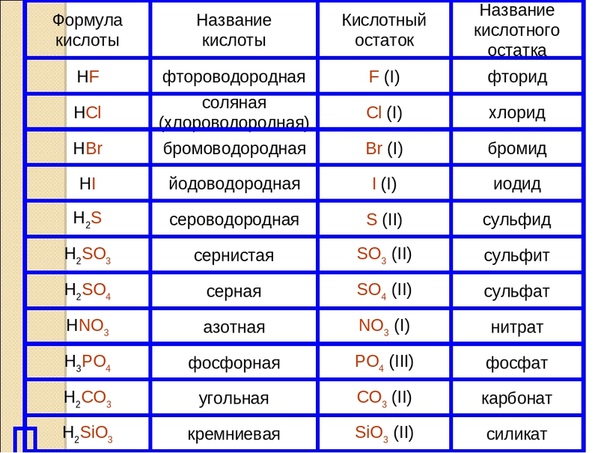
Ссылка на обучение
Просмотр моделирования сильных и слабых кислот и оснований на молекулярном уровне.
Так же, как и для кислот, относительная сила основания отражается величиной его константы ионизации основания ( K b ) в водных растворах. В растворах одинаковой концентрации более сильные основания ионизируются в большей степени и, таким образом, дают более высокие концентрации гидроксид-ионов, чем более слабые основания.Более сильное основание имеет большую константу ионизации, чем более слабое. Для реакции основания B:
B(водн.)+h3O(ж)⇌HB+(водн.)+OH-(водн.), B(водн.)+h3O(ж)⇌HB+(водн.)+OH-(водн.),константа ионизации записывается как
Kb=[HB+][OH-][B]Kb=[HB+][OH-][B] Проверка данных для трех слабых оснований, представленных ниже, показывает, что прочность основания увеличивается в ряду NO2- )+h3O(ж)⇌Ch4CO2H(водн.)+OH-(водн.)Kb= 5.6×10−10Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH−(водн.)Kb=1,8×10−5NO2-(водн.)+h3O(ж)⇌HNO2(водн.)+OH-(водн. )Kb=2,17×10−11Ch4CO2−(водн.)+h3O(ж)⇌Ch4CO2H(водн.)+OH−(водн.)Kb=5,6×10−10Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH −(водн.)Kb=1,8×10−5
)+h3O(ж)⇌Ch4CO2H(водн.)+OH-(водн.)Kb= 5.6×10−10Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH−(водн.)Kb=1,8×10−5NO2-(водн.)+h3O(ж)⇌HNO2(водн.)+OH-(водн. )Kb=2,17×10−11Ch4CO2−(водн.)+h3O(ж)⇌Ch4CO2H(водн.)+OH−(водн.)Kb=5,6×10−10Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH −(водн.)Kb=1,8×10−5
Таблица констант ионизации для слабых оснований приведена в Приложении I. Что касается кислот, относительная сила основания также отражается в его проценте ионизации, вычисляемом как
% ионизации = [OH-] экв / [B] 0 × 100% % ионизации = [OH-] экв / [B] 0 × 100%, но будет варьироваться в зависимости от константы ионизации основания и начальной концентрации раствора.
Относительная сила сопряженных кислотно-основных пар
Кислотно-основная химия Бренстеда-Лоури — перенос протонов; таким образом, логика предполагает связь между относительными силами сопряженных кислотно-основных пар. Сила кислоты или основания количественно определяется ее константой ионизации, K a или K b , которая представляет степень реакции ионизации кислоты или основания. Для сопряженной кислотно-щелочной пары HA / A − уравнения равновесия ионизации и выражения констант ионизации равны
Для сопряженной кислотно-щелочной пары HA / A − уравнения равновесия ионизации и выражения констант ионизации равны
Сложение этих двух химических уравнений дает уравнение автоионизации воды:
HA(водн.)+h3O(л)+A-(водн.)+h3O(ж)⇌h4O+(водн.)+A-(водн.)+OH-(водн.)+HA(водн.)HA(водн.)+h3O(ж. )+A-(водн.)+h3O(ж)⇌h4O+(водн.)+A-(водн.)+OH-(водн.)+HA(водн.) 2h3O(ж)⇌h4O+(водн.)+OH-(водн.)2h3O(ж)⇌h4O+(водн.)+OH-(водн.)Как обсуждалось в другой главе о равновесии, константа равновесия суммированной реакции равна математическому произведению констант равновесия дополнительных реакций, поэтому
Ka×Kb=[h4O+][A−][HA]×[ HA][OH-][A-]=[h4O+][OH-]=KwKa×Kb=[h4O+][A-][HA]×[HA][OH-][A-]=[h4O+][ ОН-] = кВт Это уравнение устанавливает связь между константами ионизации для любой сопряженной кислотно-основной пары, а именно, их математическое произведение равно ионному произведению воды, K w . Преобразовав это уравнение, становится очевидной взаимосвязь между силами сопряженной кислотно-основной пары:
Преобразовав это уравнение, становится очевидной взаимосвязь между силами сопряженной кислотно-основной пары:
Обратно-пропорциональное соотношение между K a и K b означает, что чем сильнее кислота или основание, тем слабее их сопряженный партнер . На рис. 14.7 показано это соотношение для нескольких сопряженных кислотно-основных пар.
Фигура 14,7 Показаны относительные силы нескольких сопряженных кислотно-основных пар.
Фигура 14,8 На этом рисунке показаны силы сопряженных кислотно-основных пар по отношению к силе воды в качестве эталонного вещества.
Перечень сопряженных кислотно-основных пар, показанный на рис. 14.8, составлен так, чтобы показать относительную силу каждого вида по сравнению с водой, элементы которой выделены в каждой из колонок таблицы. В столбце кислот те вещества, которые перечислены ниже воды, являются более слабыми кислотами, чем вода. Эти виды не подвергаются кислотной ионизации в воде; они не являются кислотами Бренстеда-Лоури.Все перечисленные выше виды воды являются более сильными кислотами, которые в некоторой степени переносят протоны в воду при растворении в водном растворе с образованием ионов гидроксония. Части выше воды, но ниже иона гидроксония представляют собой слабые кислоты , подвергающиеся частичной кислотной ионизации, где те, что выше иона гидроксония, представляют собой сильные кислоты , полностью ионизированные в водном растворе.
В столбце кислот те вещества, которые перечислены ниже воды, являются более слабыми кислотами, чем вода. Эти виды не подвергаются кислотной ионизации в воде; они не являются кислотами Бренстеда-Лоури.Все перечисленные выше виды воды являются более сильными кислотами, которые в некоторой степени переносят протоны в воду при растворении в водном растворе с образованием ионов гидроксония. Части выше воды, но ниже иона гидроксония представляют собой слабые кислоты , подвергающиеся частичной кислотной ионизации, где те, что выше иона гидроксония, представляют собой сильные кислоты , полностью ионизированные в водном растворе.
Если все эти сильные кислоты полностью ионизированы в воде, то почему в колонке указано, что они различаются по силе, причем азотная кислота является самой слабой, а хлорная – самой сильной? Обратите внимание, что единственным кислотным видом, присутствующим в водном растворе любой сильной кислоты, является H 3 O + ( aq ), что означает, что ион гидроксония является самой сильной кислотой, которая может существовать в воде; любая более сильная кислота будет полностью реагировать с водой с образованием ионов гидроксония. Этот предел кислотной силы растворенных веществ в растворе называется эффектом выравнивания . Чтобы измерить разницу в силе кислот для «сильных» кислот, кислоты должны быть растворены в растворителе, который менее щелочной , чем вода. В таких растворителях кислоты будут «слабыми», поэтому любые различия в степени их ионизации можно определить. Например, бинарные галогеноводороды HCl, HBr и HI являются сильными кислотами в воде, но слабыми кислотами в этаноле (увеличение силы HCl < HBr < HI).
Этот предел кислотной силы растворенных веществ в растворе называется эффектом выравнивания . Чтобы измерить разницу в силе кислот для «сильных» кислот, кислоты должны быть растворены в растворителе, который менее щелочной , чем вода. В таких растворителях кислоты будут «слабыми», поэтому любые различия в степени их ионизации можно определить. Например, бинарные галогеноводороды HCl, HBr и HI являются сильными кислотами в воде, но слабыми кислотами в этаноле (увеличение силы HCl < HBr < HI).
В правой колонке рис. 14.8 перечислены вещества в порядке возрастания базовой прочности сверху вниз. Следуя той же логике, что и в левой колонке, вещества, перечисленные над водой, являются более слабыми основаниями, поэтому они не подвергаются ионизации основаниями при растворении в воде. Соединения, расположенные между водой и сопряженным с ней основанием, гидроксид-ионом, являются слабыми основаниями, которые частично ионизируются. Перечисленные ниже гидроксид-ионы представляют собой сильные основания, которые полностью ионизируются в воде с образованием гидроксид-ионов (т.э., они выровнены до гидроксида). Сравнение столбцов кислот и оснований в этой таблице подтверждает обратную связь между силой сопряженных кислотно-основных пар. Например, все сопряженные основания сильных кислот (верхняя часть таблицы) имеют незначительную силу. Сильная кислота обладает неизмеримо большим K a , поэтому ее сопряженное основание будет иметь K b , которое практически равно нулю:
Перечисленные ниже гидроксид-ионы представляют собой сильные основания, которые полностью ионизируются в воде с образованием гидроксид-ионов (т.э., они выровнены до гидроксида). Сравнение столбцов кислот и оснований в этой таблице подтверждает обратную связь между силой сопряженных кислотно-основных пар. Например, все сопряженные основания сильных кислот (верхняя часть таблицы) имеют незначительную силу. Сильная кислота обладает неизмеримо большим K a , поэтому ее сопряженное основание будет иметь K b , которое практически равно нулю:
сильная кислота:Ka≈∞сопряженное основание:Kb=Kw/Ka=Kw/∞≈0сильная кислота:Ka≈∞сопряженноеоснование:Kb=Kw/Ka=Kw/∞≈0
Аналогичный подход можно использовать для подтверждения наблюдения, что сопряженные кислоты сильных оснований ( K b ≈ ∞) имеют незначительную силу ( K a ≈ 0).
Пример 14,8
Расчет констант ионизации для сопряженных кислотно-основных пар
Используйте K b для нитрит-иона, NO2-,NO2-, чтобы рассчитать K a для его сопряженной кислоты.Раствор
K b для NO2-NO2- приведен в этом разделе как 2,17 ×× 10 −11 . Сопряженная кислота NO2-NO2- представляет собой HNO 2 ; K a для HNO 2 можно рассчитать по соотношению: Ka×Kb=1.0×10−14=KwKa×Kb=1,0×10−14=KwРешение для K a дает
Ka=KwKb=1,0×10−142,17×10−11=4,6×10−4Ka=KwKb=1,0×10−142,17×10−11=4,6×10−4Этот ответ можно проверить, найдя K a для HNO 2 в Приложении H.
Проверьте свои знания
Определите относительную кислотность Nh5+Nh5+ и HCN, сравнив их константы ионизации. Константа ионизации HCN приведена в Приложении H как 4,9 × × 10 −10 .Константа ионизации Nh5+Nh5+ не указана, но константа ионизации его сопряженного основания, NH 3 , указана как 1,8 × × 10 -5 .
Константа ионизации HCN приведена в Приложении H как 4,9 × × 10 −10 .Константа ионизации Nh5+Nh5+ не указана, но константа ионизации его сопряженного основания, NH 3 , указана как 1,8 × × 10 -5 .Отвечать:
Nh5+Nh5+ является чуть более сильной кислотой ( K a для Nh5+Nh5+ = 5,6 × × 10 −10 ).
Расчеты кислотно-щелочного равновесия
В главе, посвященной химическому равновесию, представлены несколько типов расчетов равновесия и различные математические стратегии, полезные при их выполнении.Эти стратегии обычно полезны для равновесных систем независимо от класса химической реакции, и поэтому их можно эффективно применять к задачам кислотно-щелочного равновесия. В этом разделе представлены несколько примеров упражнений, включающих расчеты равновесия для кислотно-щелочных систем.
Пример 14,9
Определение
K a по равновесным концентрациям Уксусная кислота является основным компонентом уксуса (рис. 14.9), придающим ему кислый вкус.В равновесии раствор содержит [CH 3 CO 2 H] = 0,0787 M и [h4O+]=[Ch4CO2-]=0,00118M. [h4O+]=[Ch4CO2-]=0,00118M. Каково значение K a для уксусной кислоты?
14.9), придающим ему кислый вкус.В равновесии раствор содержит [CH 3 CO 2 H] = 0,0787 M и [h4O+]=[Ch4CO2-]=0,00118M. [h4O+]=[Ch4CO2-]=0,00118M. Каково значение K a для уксусной кислоты?Фигура 14,9 Уксус содержит уксусную кислоту, слабую кислоту. (кредит: модификация работы «HomeSpot HQ»/Flickr)
Решение
Соответствующее уравнение равновесия и его выражение для константы равновесия показаны ниже. Подстановка приведенных равновесных концентраций позволяет прямо рассчитать K a для уксусной кислоты.Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2−(водн.)Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2−(водн.) Ka=[h4O+][Ch4CO2-][Ch4CO2H]=(0,00118)(0,00118)0,0787=1,77×10-5Ka=[h4O+][Ch4CO2-][Ch4CO2H]=(0,00118)(0,00118)0,0787=1,77×10- 5Проверьте свои знания
Ион HSO4-HSO4-, слабая кислота, используемая в некоторых бытовых чистящих средствах: HSO4-(водн. )+h3O(л)⇌h4O+(водн.)+SO42-(водн.)HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)
)+h3O(л)⇌h4O+(водн.)+SO42-(водн.)HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)Чему равна константа ионизации этой слабой кислоты, если равновесная смесь имеет следующий состав: [h4O+][h4O+] = 0.027 М ; [HSO4-]=0,29М; [HSO4-]=0,29М; и [SO42-]=0,13M?[SO42-]=0,13M?
Отвечать:
K a для HSO4-HSO4- = 1,2 ×× 10 −2
Пример 14.10
Определение
K b по равновесным концентрациям Кофеин, C 8 H 10 N 4 O 2 является слабым основанием. Каково значение K b для кофеина, если равновесный раствор имеет [C 8 H 10 N 4 O 2 ] = 0.050 M , [C8h20N4O2H+][C8h20N4O2H+] = 5,0 × × 10 −3 M , и [OH − ] = 2,5 × × 10 −3 9Решение
Соответствующее уравнение равновесия и его выражение для константы равновесия показаны ниже. Замена предоставленных равновесных концентраций позволяет прямо рассчитать K b для кофеина.
C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)
Kb=[C8h20N4O2H+][OH-][C8h20N4O2]=(5.0×10-3)(2,5×10-3)0,050=2,5×10-4Kb=[C8h20N4O2H+][OH-][C8h20N4O2]=(5,0×10-3)(2,5×10-3)0,050=2,5× 10−4
Замена предоставленных равновесных концентраций позволяет прямо рассчитать K b для кофеина.
C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)
Kb=[C8h20N4O2H+][OH-][C8h20N4O2]=(5.0×10-3)(2,5×10-3)0,050=2,5×10-4Kb=[C8h20N4O2H+][OH-][C8h20N4O2]=(5,0×10-3)(2,5×10-3)0,050=2,5× 10−4Проверьте свои знания
Какова константа равновесия ионизации иона HPO42–HPO42–, слабого основания? HPO42-(водн.)+h3O(л)⇌h3PO4-(водн.)+OH-(водн.)HPO42-(водн.)+h3O(ж)⇌h3PO4-(водн.)+OH-(водн.), если состав равновесной смеси следующий: [OH − ] = 1,3 × × 10 −6 M ; [h3PO4-]=0,042М; [h3PO4-]=0,042М; и [HPO42-]=0,341M?[HPO42-]=0,341M?
Отвечать:
K b для HPO42-=1.6×10-7HPO42-=1,6×10-7
Пример 14.11
Определение
K a или K b от pH рН 0,0516- М раствора азотистой кислоты HNO 2 равен 2,34. Что такое K ?
HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)
Что такое K ?
HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)HNO2(водн.)+h3O(ж)⇌h4O+(водн.)+NO2-(водн.)Решение
Представленная концентрация азотистой кислоты представляет собой формальную концентрацию , которая не учитывает никаких химических равновесий, которые могут быть установлены в растворе.Такие концентрации рассматриваются как «начальные» значения для расчетов равновесия с использованием подхода таблицы ICE. Обратите внимание, что начальное значение иона гидроксония указано как приблизительно ноль, потому что присутствует небольшая концентрация H 3 O + (1 × 10 -7 M ) из-за автопротолиза воды. Во многих случаях, таких как все, представленные в этой главе, эта концентрация намного меньше, чем концентрация, создаваемая ионизацией рассматриваемой кислоты (или основания), и ею можно пренебречь.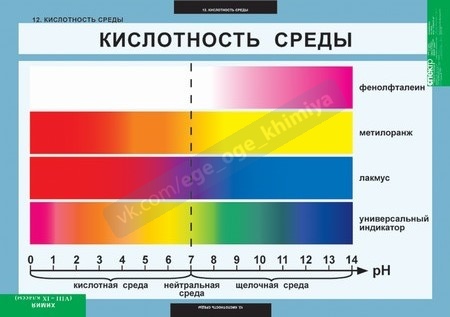
Приведенное значение pH представляет собой логарифмическую меру концентрации ионов гидроксония в результате кислотной ионизации азотистой кислоты, поэтому оно представляет «равновесное» значение для таблицы ICE:
[h4O+]=10-2,34=0,0046M[h4O+]=10-2,34=0,0046MТаблица ICE для этой системы тогда
Наконец, рассчитайте значение константы равновесия, используя данные таблицы:
Ka=[h4O+][NO2-][HNO2]=(0,0046)(0,0046)(0,0470)=4,6×10-4Ka=[h4O+][NO2-][HNO2]=(0,0046)(0,0046)(0.0470)=4,6×10−4Проверьте свои знания.
рН раствора хозяйственного аммиака, 0,950- М раствора NH 3, составляет 11,612. Что такое K b для NH 3 .Пример 14.12
Расчет равновесных концентраций в слабом растворе кислоты
Муравьиная кислота, HCO 2 H, является одним из раздражителей, вызывающих реакцию организма на укусы и укусы некоторых муравьев (рис.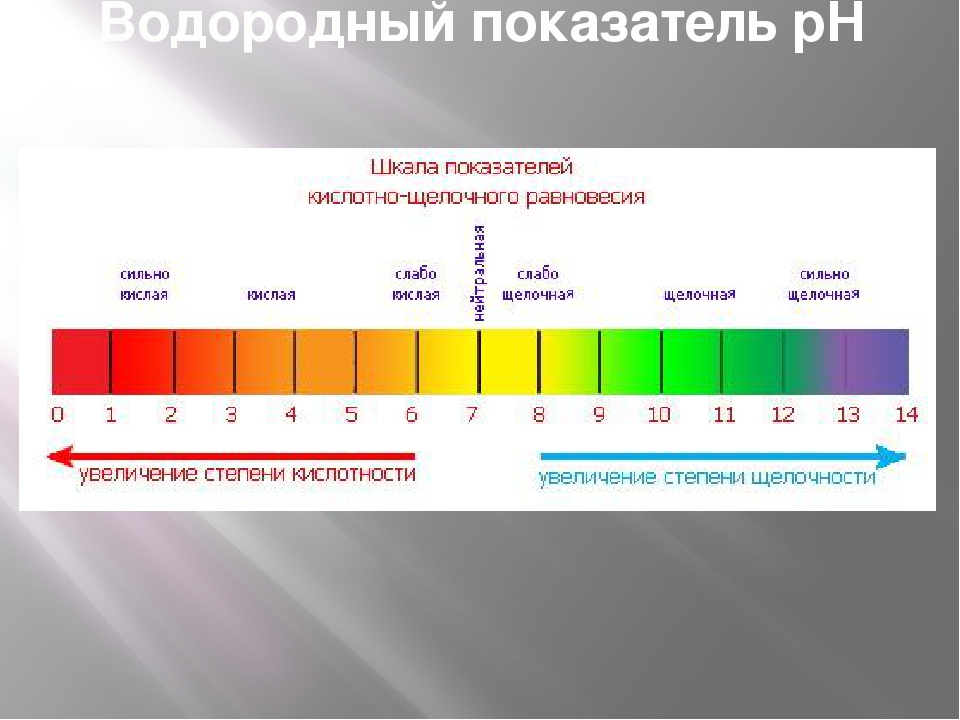 14.10).
14.10).Фигура 14.10 Боль от укусов и укусов некоторых муравьев вызывается муравьиной кислотой.(кредит: Джон Танн)
Какова концентрация иона гидроксония и рН раствора 0,534- М муравьиной кислоты?
HCO2H(водн.)+h3O(ж)⇌h4O+(водн.)+HCO2-(водн.)Ka=1,8×10-4HCO2H(водн.)+h3O(ж)⇌h4O+(водн.)+HCO2-(водн.)Ka=1,8× 10−4Решение
Таблица ICE для этой системы —
. Подстановка условий равновесной концентрации в выражение K a дает
Относительно большая начальная концентрация и малая константа равновесия позволяют сделать упрощающее предположение, что x будет намного меньше, чем 0,534, и поэтому уравнение принимает вид
.
Решение уравнения для x дает
Чтобы проверить предположение, что x мало по сравнению с 0. 534, его относительную величину можно оценить:
534, его относительную величину можно оценить:
Поскольку x составляет менее 5% от исходной концентрации, предположение верно.
Как определено в таблице ICE, x равно равновесной концентрации иона гидроксония:
х=[h4O+]=0,0098Mx=[h4O+]=0,0098MНаконец, pH рассчитывается как
. pH=-log[h4O+]=-log(0,0098)=2,01pH=-log[h4O+]=-log(0.0098)=2,01Проверьте свои знания
Лишь небольшая часть слабой кислоты ионизируется в водном растворе. Какова процентная ионизация 0,100- М раствора уксусной кислоты, СН 3 СО 2 Н? Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2-(водн.)Ka=1,8×10-5Ch4CO2H(водн.)+h3O(ж)⇌h4O+(водн.)+Ch4CO2-(водн.)Ka=1,8× 10−5Отвечать:
процента ионизации = 1,3%
Пример 14.
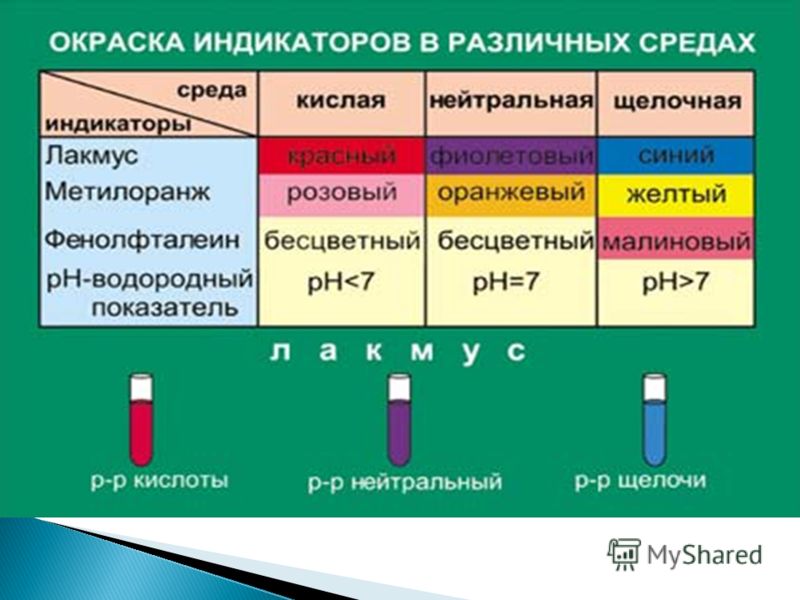 13
13Расчет равновесных концентраций в растворе слабого основания
Найдите концентрацию гидроксид-иона, рОН и рН 0.25- М раствор триметиламина, слабое основание: (Ch4)3N(водн.)+h3O(ж)⇌(Ch4)3NH+(водн.)+OH-(водн.)Kb=6,3×10-5(Ch4)3N(водн.)+h3O(ж)⇌(Ch4)3NH+ (водн.)+OH-(водн.)Kb=6,3×10-5Решение
Таблица ICE для этой системы —.
Подстановка условий равновесной концентрации в выражение K b дает
Предположим, что x << 0.25 и решение для x дает
Это значение составляет менее 5% от исходной концентрации (0,25), поэтому предположение оправдано.
Как определено в таблице ICE, x равно равновесной концентрации гидроксид-иона:
Расчетное значение рОН равно
.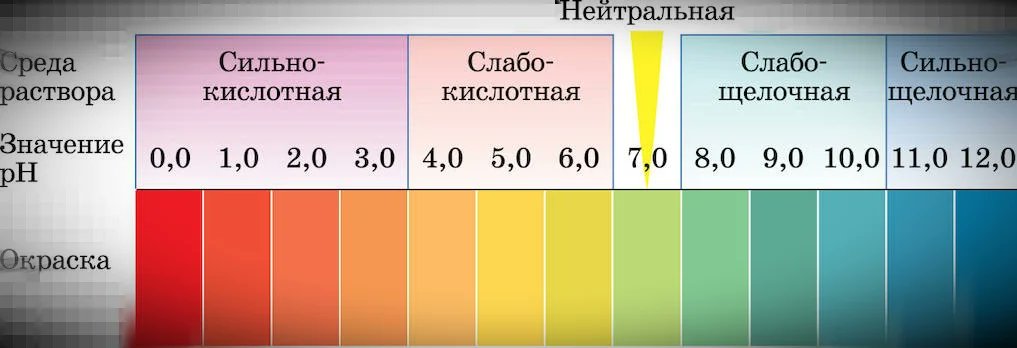
Используя отношение, введенное в предыдущем разделе этой главы:
позволяет вычислить pH:
Check Your Learning
Рассчитайте концентрацию ионов гидроксида и процент ионизации 0,0325- M раствора аммиака, слабого основания с K b из 1,76 × × 10 −5 .В некоторых случаях сила слабой кислоты или основания и их формальная (начальная) концентрация приводят к заметной ионизации.Хотя стратегия ICE по-прежнему эффективна для этих систем, алгебра немного сложнее, потому что нельзя сделать упрощающее предположение о том, что x можно пренебречь. Вычисления такого рода показаны в примере 14.14 ниже.
Пример 14.14
Расчет равновесных концентраций без упрощения предположений
Бисульфат натрия, NaHSO 4 , используется в некоторых бытовых чистящих средствах в качестве источника ионов HSO4-HSO4-, слабой кислоты. Каков рН 0,50- М раствора HSO4-?HSO4-?
HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)Ka=1,2×10-2HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)Ka= 1,2×10−2
Каков рН 0,50- М раствора HSO4-?HSO4-?
HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)Ka=1,2×10-2HSO4-(водн.)+h3O(ж)⇌h4O+(водн.)+SO42-(водн.)Ka= 1,2×10−2Решение
Таблица ICE для этой системы —.
Подстановка условий равновесной концентрации в выражение K a дает
Если предположить, что x << 0.5, упрощая и решая вышеприведенное уравнение, получаем
Это значение x явно не намного меньше, чем 0,50 M ; скорее это примерно 15% от исходной концентрации:
Когда мы проверяем предположение, мы вычисляем:
Поскольку упрощающее предположение для этой системы неприемлемо, выражение для константы равновесия решается следующим образом:
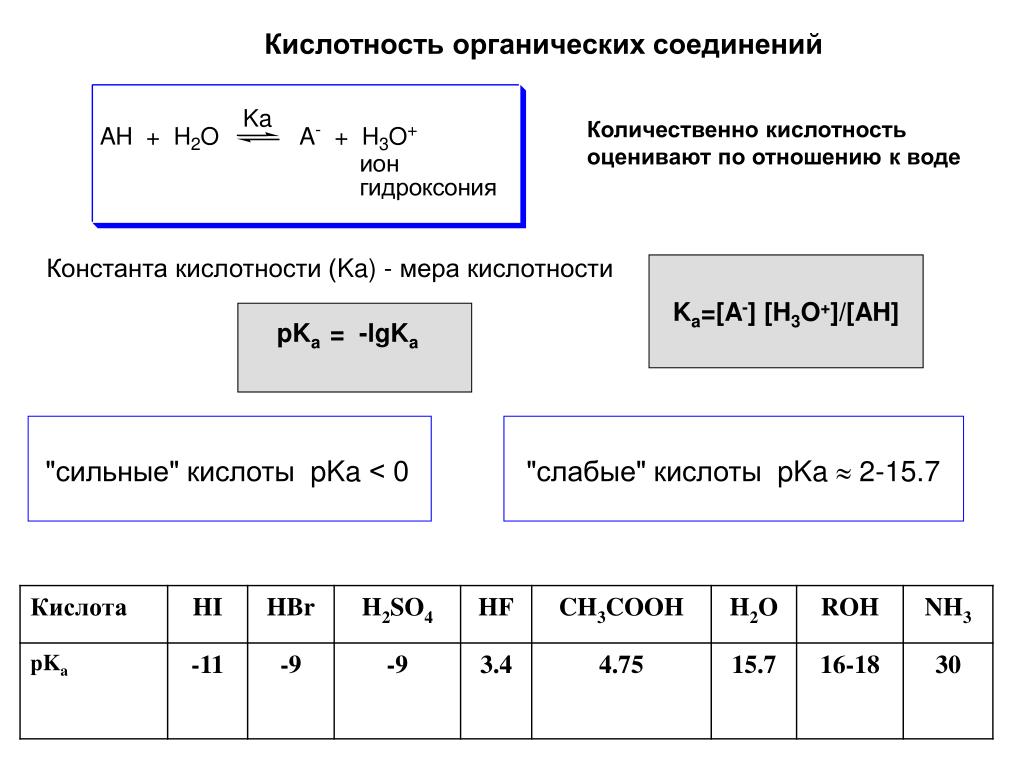 2×10−2=(x)(x)0,50−xKa=1,2×10−2=(x)(x)0,50−x
2×10−2=(x)(x)0,50−xKa=1,2×10−2=(x)(x)0,50−x
Преобразование этого уравнения дает
Запись уравнения в квадратной форме дает
Решение двух корней этого квадратного уравнения приводит к отрицательному значению, которое можно отбросить как физически нерелевантное, и положительному значению, равному x . Как определено в таблице ICE, x соответствует концентрации гидроксония.
Проверьте свои знания
Рассчитайте рН 0,010- М раствора кофеина, слабого основания: C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)Kb=2,5×10-4C8h20N4O2(водн.)+h3O(ж)⇌C8h20N4O2H+(водн.)+OH-(водн.)Kb=2,5× 10−4Влияние молекулярной структуры на кислотно-основную силу
Бинарные кислоты и основания
В отсутствие какого-либо выравнивающего эффекта кислотная сила бинарных соединений водорода с неметаллами (А) увеличивается по мере того, как прочность связи Н-А уменьшается вниз по группе в периодической таблице. Для группы 17 порядок возрастания кислотности следующий: HF < HCl < HBr < HI. Аналогично, для группы 16 порядок увеличения силы кислоты следующий: H 2 O < H 2 S < H 2 Se < H 2 Te.
Для группы 17 порядок возрастания кислотности следующий: HF < HCl < HBr < HI. Аналогично, для группы 16 порядок увеличения силы кислоты следующий: H 2 O < H 2 S < H 2 Se < H 2 Te.
В периодической таблице кислотная сила бинарных водородных соединений увеличивается с увеличением электроотрицательности атома неметалла, поскольку увеличивается полярность связи H-A. Таким образом, порядок возрастания кислотности (для удаления одного протона) во втором ряду: CH 4 < NH 3 < H 2 O < HF; по третьему ряду SiH 4 < PH 3 < H 2 S < HCl (см. рис. 14.11).
Фигура 14.11 На рисунке показаны тренды сил бинарных кислот и оснований.
Тройные кислоты и основания
Тройные соединения, состоящие из водорода, кислорода и некоторого третьего элемента («Е»), могут быть структурированы, как показано на изображении ниже.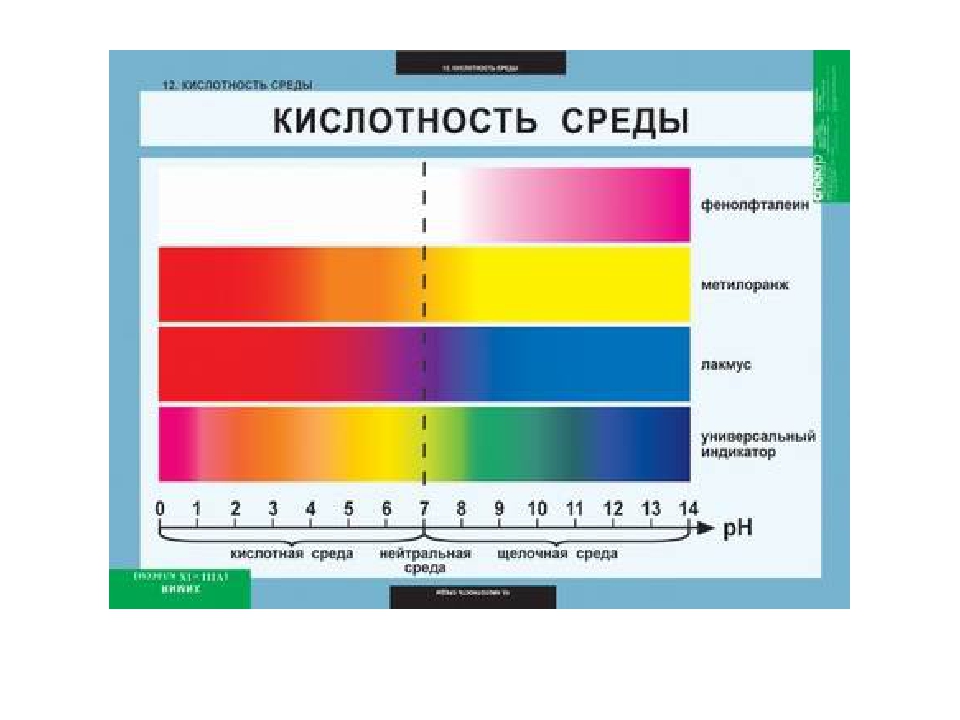 В этих соединениях центральный атом E связан с одним или несколькими атомами O, и по крайней мере один из атомов O также связан с атомом H, что соответствует общей молекулярной формуле O m E(OH) n .Эти соединения могут быть кислотными, основными или амфотерными в зависимости от свойств центрального атома Е. Примеры таких соединений включают серную кислоту, O 2 S(OH) 2 , сернистую кислоту, OS(OH) 2 , азотную кислоту, O 2 NOH, хлорную кислоту, O 3 ClOH, алюминий. гидроксид, Al(OH) 3 , гидроксид кальция, Ca(OH) 2 , и гидроксид калия, KOH:
В этих соединениях центральный атом E связан с одним или несколькими атомами O, и по крайней мере один из атомов O также связан с атомом H, что соответствует общей молекулярной формуле O m E(OH) n .Эти соединения могут быть кислотными, основными или амфотерными в зависимости от свойств центрального атома Е. Примеры таких соединений включают серную кислоту, O 2 S(OH) 2 , сернистую кислоту, OS(OH) 2 , азотную кислоту, O 2 NOH, хлорную кислоту, O 3 ClOH, алюминий. гидроксид, Al(OH) 3 , гидроксид кальция, Ca(OH) 2 , и гидроксид калия, KOH:
Если центральный атом Е имеет низкую электроотрицательность, его притяжение к электронам слабое.У центрального атома существует небольшая тенденция к образованию прочной ковалентной связи с атомом кислорода, и связь — между элементом и кислородом разрывается легче, чем связь b между кислородом и водородом. Следовательно, связь a является ионной, ионы гидроксида выделяются в раствор, и материал ведет себя как основание — это имеет место в случае Ca(OH) 2 и KOH. Более низкая электроотрицательность характерна для более металлических элементов; следовательно, металлические элементы образуют ионные гидроксиды, которые по определению являются основными соединениями.
Следовательно, связь a является ионной, ионы гидроксида выделяются в раствор, и материал ведет себя как основание — это имеет место в случае Ca(OH) 2 и KOH. Более низкая электроотрицательность характерна для более металлических элементов; следовательно, металлические элементы образуют ионные гидроксиды, которые по определению являются основными соединениями.
Если, с другой стороны, атом E имеет относительно высокую электроотрицательность, он сильно притягивает электроны, которые он разделяет с атомом кислорода, делая связь a относительно сильно ковалентной. Связь кислород-водород, связь b , при этом ослабляется, поскольку электроны смещаются в сторону E. Связь b полярна и легко выделяет ионы водорода в раствор, поэтому материал ведет себя как кислота. Высокие электроотрицательности характерны для более неметаллических элементов.Таким образом, неметаллические элементы образуют ковалентные соединения, содержащие кислотные группы -ОН, которые называются оксикислотами.
Увеличение степени окисления центрального атома Е также увеличивает кислотность оксикислоты, потому что это увеличивает притяжение Е для электронов, которые он разделяет с кислородом, и тем самым ослабляет связь ОН. Серная кислота, H 2 SO 4 или O 2 S(OH) 2 (со степенью окисления серы +6), более кислая, чем серная кислота, H 2 SO 3 , или OS(OH) 2 (со степенью окисления серы +4).Точно так же азотная кислота HNO 3 или O 2 NOH (степень окисления N = +5) является более кислой, чем азотистая кислота, HNO 2 или ONOH (степень окисления N = +3). В каждой из этих пар степень окисления центрального атома больше у более сильной кислоты (рис. 14.12).
Фигура 14.12 По мере увеличения степени окисления центрального атома Е увеличивается и кислотность.
Гидроксильные соединения элементов с промежуточной электроотрицательностью и относительно высокими степенями окисления (например, элементы, находящиеся вблизи диагональной линии, отделяющей металлы от неметаллов в периодической таблице), обычно амфотерны.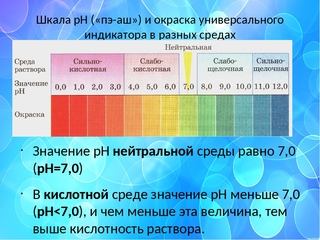 Это означает, что гидроксисоединения действуют как кислоты, когда они реагируют с сильными основаниями, и как основания, когда они реагируют с сильными кислотами. Амфотерность гидроксида алюминия, который обычно существует в виде гидрата Al(H 2 O) 3 (OH) 3 , отражается в его растворимости как в сильных кислотах, так и в сильных основаниях. В сильных основаниях относительно нерастворимый гидратированный гидроксид алюминия Al(H 2 O) 3 (OH) 3 превращается в растворимый ион [Al(h3O)2(OH)4]−,[ Al(h3O)2(OH)4]-, по реакции с гидроксид-ионом:
Это означает, что гидроксисоединения действуют как кислоты, когда они реагируют с сильными основаниями, и как основания, когда они реагируют с сильными кислотами. Амфотерность гидроксида алюминия, который обычно существует в виде гидрата Al(H 2 O) 3 (OH) 3 , отражается в его растворимости как в сильных кислотах, так и в сильных основаниях. В сильных основаниях относительно нерастворимый гидратированный гидроксид алюминия Al(H 2 O) 3 (OH) 3 превращается в растворимый ион [Al(h3O)2(OH)4]−,[ Al(h3O)2(OH)4]-, по реакции с гидроксид-ионом:
В этой реакции протон переносится с одной из связанных с алюминием молекул H 2 O на гидроксид-ион в растворе.Таким образом, соединение Al(H 2 O) 3 (OH) 3 в данных условиях действует как кислота. С другой стороны, при растворении в сильных кислотах он превращается в растворимый ион [Al(h3O)6]3+[Al(h3O)6]3+ по реакции с ионом гидроксония:
3h4O+(водн. )+Al(h3O)3(OH)3(водн.)⇌Al(h3O)63+(водн.)+3h3O(л)3h4O+(водн.)+Al(h3O)3(OH)3(водн.)⇌ Al(h3O)63+(водн.)+3h3O(ж)
)+Al(h3O)3(OH)3(водн.)⇌Al(h3O)63+(водн.)+3h3O(л)3h4O+(водн.)+Al(h3O)3(OH)3(водн.)⇌ Al(h3O)63+(водн.)+3h3O(ж)В этом случае протоны передаются от ионов гидроксония в растворе к Al(H 2 O) 3 (OH) 3 , и соединение действует как основание.
3.4 Влияние структуры на кислотность и щелочность – Органическая химия I
Мы узнали, что разные функциональные группы имеют разную кислотность. В этом разделе мы поймем основные причины этого, а именно , почему одна группа более кислая, чем другая. Многие из концепций, которые мы изучим здесь, будут продолжать применяться на протяжении всего курса по мере того, как мы будем заниматься многими другими органическими темами.
3.4.1 Эффект элемента
A. Периодический тренд: электроотрицательность
Эффект элемента связан с отдельным в ом, который соединяется с водородом (имейте в виду, что кислотность связана со способностью отдавать определенный водород).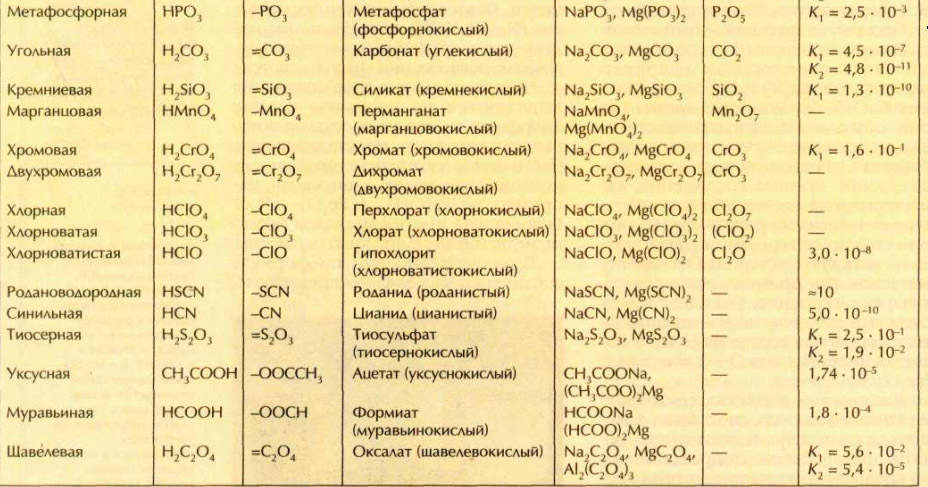 Давайте сравним кислотность атомов водорода в этане, метиламине и этаноле, как показано ниже.
Давайте сравним кислотность атомов водорода в этане, метиламине и этаноле, как показано ниже.
Четкая тенденция изменения кислотности этих соединений такова: кислотность увеличивается для элементов слева направо по второму ряду таблицы Менделеева, от C до N, а затем до O.Это согласуется с возрастающей тенденцией электроотрицательности вдоль периода слева направо. Связь между электроотрицательностью и кислотностью можно объяснить тем, что атом с более высокой электроотрицательностью способен лучше приспосабливаться к отрицательному заряду сопряженного основания, тем самым лучше стабилизируя сопряженное основание. Следовательно, чем стабильнее сопряженное основание, тем слабее сопряженное основание и тем сильнее кислота . Для обсуждений в этом разделе тенденция стабильности (или основности) сопряженных оснований часто помогает объяснить тенденцию кислотности.
Относительная кислотность элементов в тот же период составляет:
Для элементов того же периода, чем более электроотрицательный атом, тем сильнее кислота; t Кислотность возрастает слева направо по периоду.
B. Группа (вертикальная) Тренд: Размер атома
При перемещении по вертикали в пределах данной группы периодической таблицы наблюдается тенденция к увеличению кислотности сверху вниз.Это можно проиллюстрировать на примере галокислот HX и галогенидов, как показано ниже: кислотность HX увеличивается сверху вниз, а основность сопряженных оснований X – уменьшается сверху вниз.
Кислотность H в тиольной SH-группе также выше, чем у соответствующей спиртовой ОН-группы, следуя той же тенденции. Например, p K a CH 3 CH 2 SH составляет ~10, что намного более кисло, чем этанол CH 3 CH 2 OH с ap K 2 ~ 16.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. При вертикальном перемещении в той же группе периодической таблицы размер атома переопределяет его электроотрицательность по отношению к основности.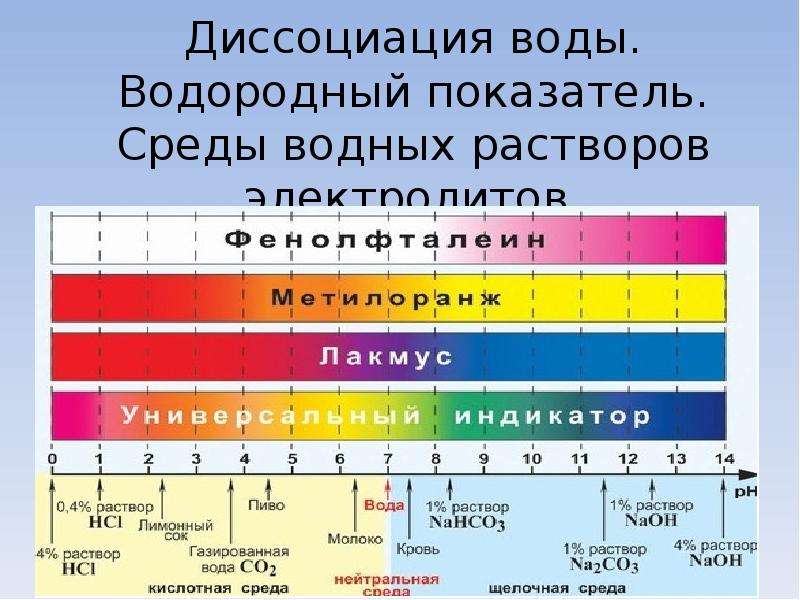 Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в йодид-ионе отрицательный заряд распределен по значительно большему объему, поэтому I — более стабилен и менее щелочен, что делает HI более кислой.
Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в йодид-ионе отрицательный заряд распределен по значительно большему объему, поэтому I — более стабилен и менее щелочен, что делает HI более кислой.
Рисунок 3.4а Стабильность иона фтора и йодида
Относительная кислотность элементов в той же группе составляет:
Для элементов одной группы: чем больше размер атома, тем сильнее кислота; кислотность возрастает сверху вниз по группе.
3.4.2. Эффект резонанса
Эффект резонанса объясняет разницу кислотности этанола и уксусной кислоты.Как для этанола, так и для уксусной кислоты водород связан с атомом кислорода, поэтому эффект элемента не имеет значения. Однако значения p K a (и кислотность) этанола и уксусной кислоты сильно различаются. Что делает карбоновую кислоту намного более кислой, чем спирт? Как указывалось ранее, мы начнем с рассмотрения стабильности сопряженных оснований, помня, что более стабильное (более слабое) сопряженное основание соответствует более сильной кислоте.
Для ацетата, сопряженного основания уксусной кислоты, могут быть привлечены два резонансных вкладчика, и, следовательно, отрицательный заряд может быть делокализован (разделен) между двумя атомами кислорода.Однако у этоксид-иона, сопряженного основания этанола, нет другого резонансного вкладчика, поэтому отрицательный заряд локализован на атоме кислорода. Как мы узнали из раздела 1.3 , частицы, которые вносят больший вклад в резонанс, приобретают стабильность , поэтому ацетат более стабилен, чем этоксид, и слабее в качестве основания, поэтому уксусная кислота является более сильной кислотой, чем этанол.
Делокализация заряда в результате резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточное, чтобы объяснить большую разницу более чем в 10 p K a единиц между этанолом и уксусной кислотой.Поскольку p K a = –log K a , это означает, что между значениями K a для двух молекул существует коэффициент около 10 10 !
p K a группы OH в спирте составляет около 15, однако OH в феноле (группа OH, связанная с бензольным кольцом) имеет pK a около 10, что намного сильнее по кислотности, чем другие спирты.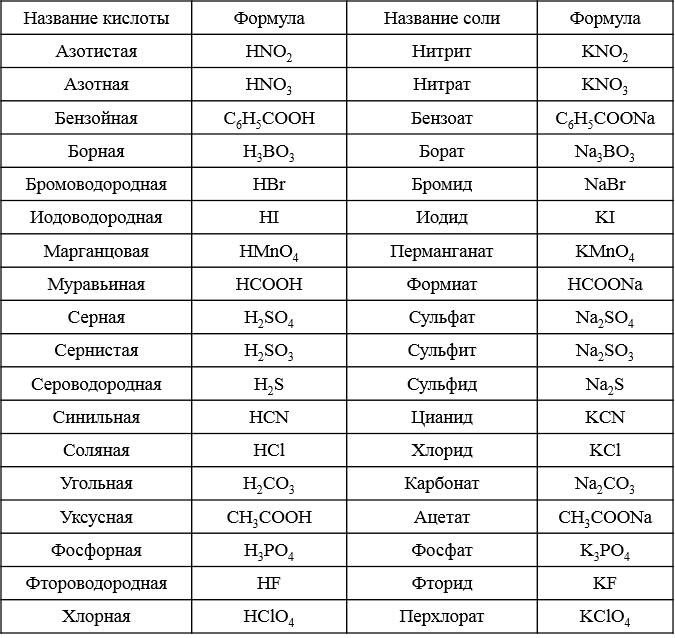 Объясните разницу.
Объясните разницу.
Решение :
Разницу можно объяснить эффектом резонанса.Резонансного эффекта на сопряженное основание этанола, как упоминалось ранее, не возникает. Однако сопряженное основание фенола стабилизируется эффектом резонанса еще с четырьмя резонансными вкладчиками, а отрицательный фактор делокализован на бензольном кольце, поэтому сопряженное основание фенола гораздо более стабильно и является более слабым основанием. Следовательно, фенол гораздо более кислый, чем другие спирты.
Ответы на практические вопросы Глава 3
3. 4.3 Индуктивный эффект
4.3 Индуктивный эффект
Сравним значения p K a уксусной кислоты и ее моно-, ди- и трихлорпроизводных:
Рис. 3.4b Уксусная кислота и ее моно-, ди- и трихлорированные производные
Присутствие атомов хлора явно увеличивает кислотность карбоксильной группы, и аргумент здесь, по-видимому, не связан с влиянием элемента.Резонансный эффект здесь тоже ни при чем, поскольку для хлорированных молекул нельзя привлечь никаких дополнительных резонансных вкладчиков. Скорее, объяснение этого явления связано с чем-то, что называется индуктивным эффектом . Атом хлора более электроотрицательный, чем водород, и, таким образом, способен «индуцировать» или «притягивать» электронную плотность к себе через σ-связи между ними и, следовательно, помогает распределять электронную плотность сопряженного основания, карбоксилата и стабилизировать его.Заместитель хлора можно назвать электроноакцепторной группой из-за индуктивного эффекта.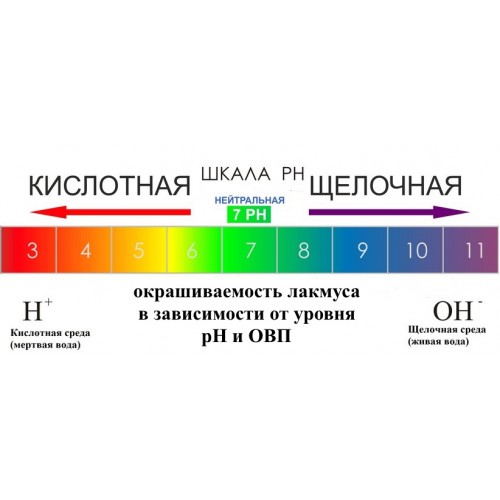
Индуктивный эффект — это эффект рассеивания заряда электроотрицательных атомов через σ-связи. Индуктивный эффект вызывает привыкание; большее количество атомов хлора оказывает в целом более сильное действие, что объясняет повышение кислотности от моно к ди-, к трихлорированной уксусной кислоте. На следующей диаграмме в качестве примера показан индуктивный эффект трихлорацетата.
Рис. 3.4c. Трихлорацетат был стабилизирован благодаря индуктивному эффекту
. Поскольку индуктивный эффект зависит от электроотрицательности, фторсодержащие заместители обладают более сильным индуктивным эффектом, чем хлорсодержащие заместители, что делает трифторуксусную кислоту (TFA) очень сильной органической кислотой.
Рисунок 3.4d трихлоруксусная кислота (pKa = 0,64) и трифторуксусная кислота (TfOH) (pKa = -0,25)
Кроме того, поскольку индуктивный эффект осуществляется через ковалентные связи, его влияние значительно уменьшается с расстоянием — таким образом, хлор состоит из двух атомов углерода.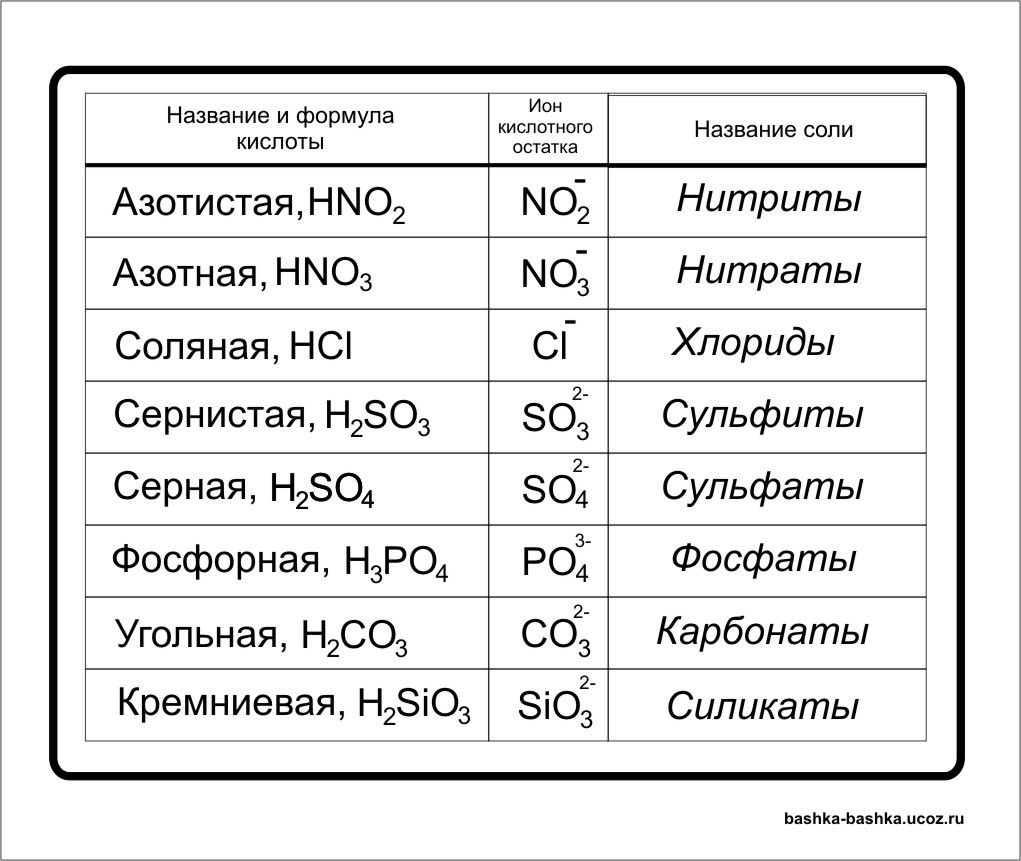 вдали от группы карбоновой кислоты оказывает более слабое действие по сравнению с хлором, удаленным всего на один атом углерода.
вдали от группы карбоновой кислоты оказывает более слабое действие по сравнению с хлором, удаленным всего на один атом углерода.
3.4.4 Эффект гибридизации
Чтобы представить эффект гибридизации, мы рассмотрим разницу кислотности между алканом, алкеном и алкином.
Атом водорода связан с атомом углерода во всех трех функциональных группах, поэтому эффект элемента не вызывается. Кроме того, учитывая сопряженную основу каждого из них, дополнительный вклад в резонанс невозможен.
Основное различие между сопряженными базовыми анионами заключается в гибридизации атома углерода, то есть sp 3 , sp 2 и sp соответственно для алкана, алкена и алкина.Разные гибридизации приводят к разным s символам , то есть проценту s орбиталей от общего количества орбиталей. Гибридизация sp 3 означает 25% s символов (одна s и три p орбиталей, поэтому s символ составляет 1/4 = 25%), sp 2 гибридизация имеет 33,3% признак, а количество составляет 50% для sp-гибридизации.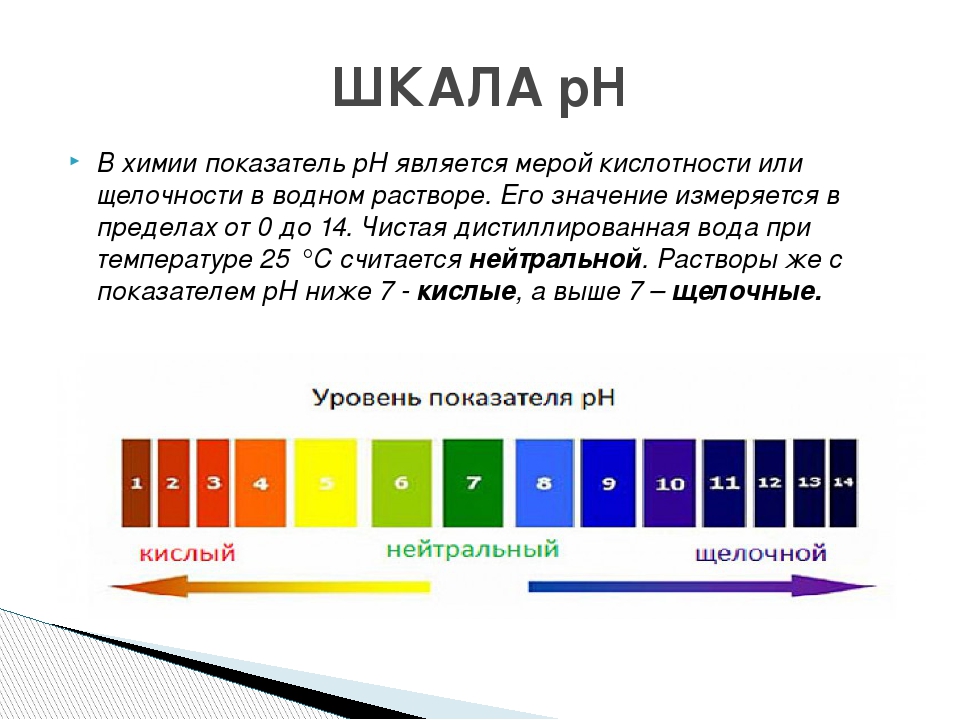 Электроны 2 s орбиталей находятся на более низком энергетическом уровне, чем электроны 2 p орбиталей, потому что 2 s намного ближе к ядру.Так, у аниона с характером больше s электроны находятся ближе к ядру и испытывают более сильное притяжение, поэтому анион имеет меньшую энергию и более стабилен.
Электроны 2 s орбиталей находятся на более низком энергетическом уровне, чем электроны 2 p орбиталей, потому что 2 s намного ближе к ядру.Так, у аниона с характером больше s электроны находятся ближе к ядру и испытывают более сильное притяжение, поэтому анион имеет меньшую энергию и более стабилен.
Относительная стабильность трех анионов (сопряженных оснований) также может быть проиллюстрирована картой электростатического потенциала, на которой более светлый цвет (менее красный) указывает на меньшую электронную плотность аниона и более высокую стабильность.
Рисунок 3.4e Карта электростатического потенциала соединения.основания
Это можно также сформулировать в более общем виде, что большее количество символов s в гибридных орбиталях делает атом более электроотрицательным. Для одного и того же атома sp-гибридный атом более электроотрицательный, чем sp 2 гибридный атом, который более электроотрицательный, чем sp 3 гибридный атом.
Как структура кислот и оснований влияет на значения pH и pKa — видео и расшифровка урока
Резонанс
Кислоты находятся в равновесии со своим сопряженным основанием.Сила кислоты (pKa) зависит от стабильности основания. Когда протон покидает кислоту, он оставляет свои электроны. Они суперотрицательны, и на сопряженном основании имеется большой отрицательный заряд.
Вы знаете, что если есть концентрированный отрицательный заряд, то база не очень устойчива. Однако если заряд можно размазать, то основание более устойчиво, а значит, мы имеем более сильную кислоту. Если в молекуле есть электроны, распределенные более чем по одной связи, она имеет резонанс .
Как вы думаете, что имеет более низкую pKa: пропанол или пропановая кислота?
Если вы выбрали пропановую кислоту, вы правы! Когда пропановая кислота теряет протон, две молекулы кислорода разделяют отрицательный заряд, создавая резонанс и, следовательно, стабилизируя основание и создавая сильную кислоту.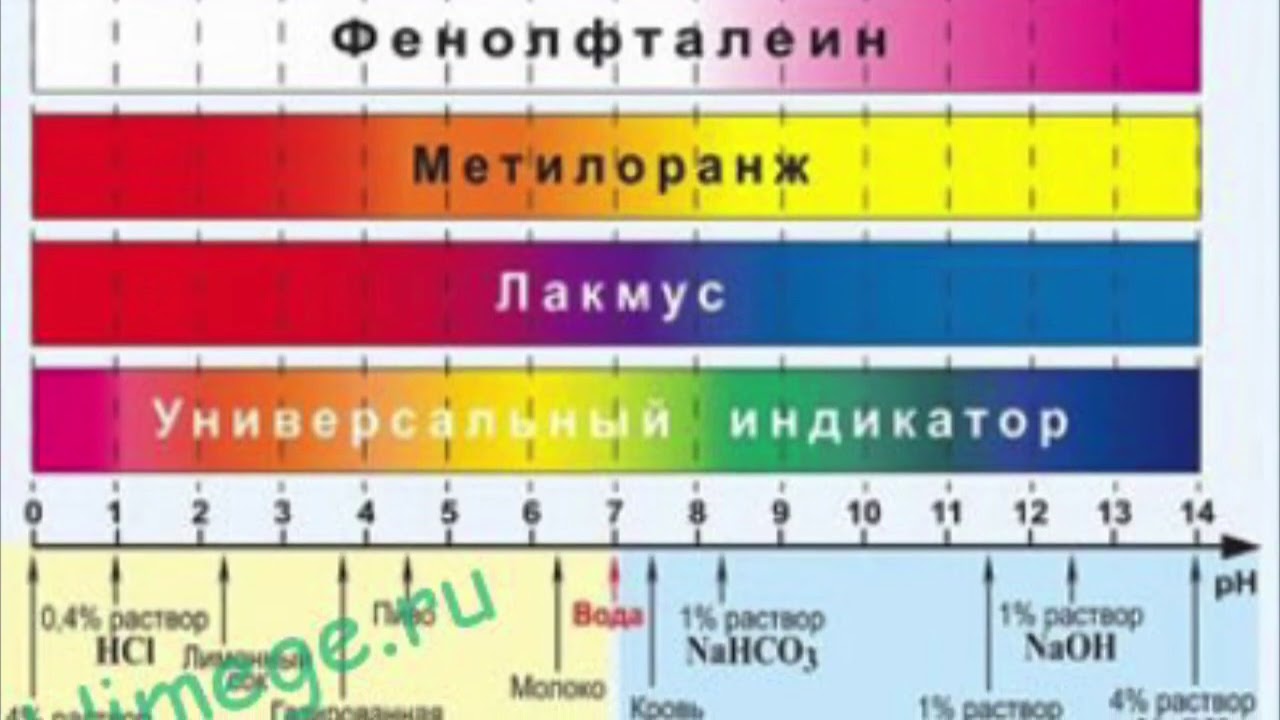 Когда пропанол теряет протон, резонанса нет.
Когда пропанол теряет протон, резонанса нет.
Размер атома
Помните, более сильная кислота имеет более стабильное основание.Одна вещь, которая влияет на стабильность основания, — это размер иона. Ион большего размера может лучше разместить отрицательный заряд. Представьте, что у заряда есть больше места для распространения.
К счастью, мы можем использовать периодические тренды для предсказания размера иона. Это означает, что мы можем предсказать более стабильное основание и, следовательно, более сильную кислоту. Размер иона увеличивается по мере того, как мы идем сверху вниз по столбцу периодической таблицы. (Размер иона также увеличивается справа налево, но это не влияет на стабильность основания из-за электроотрицательности, о которой мы поговорим чуть позже).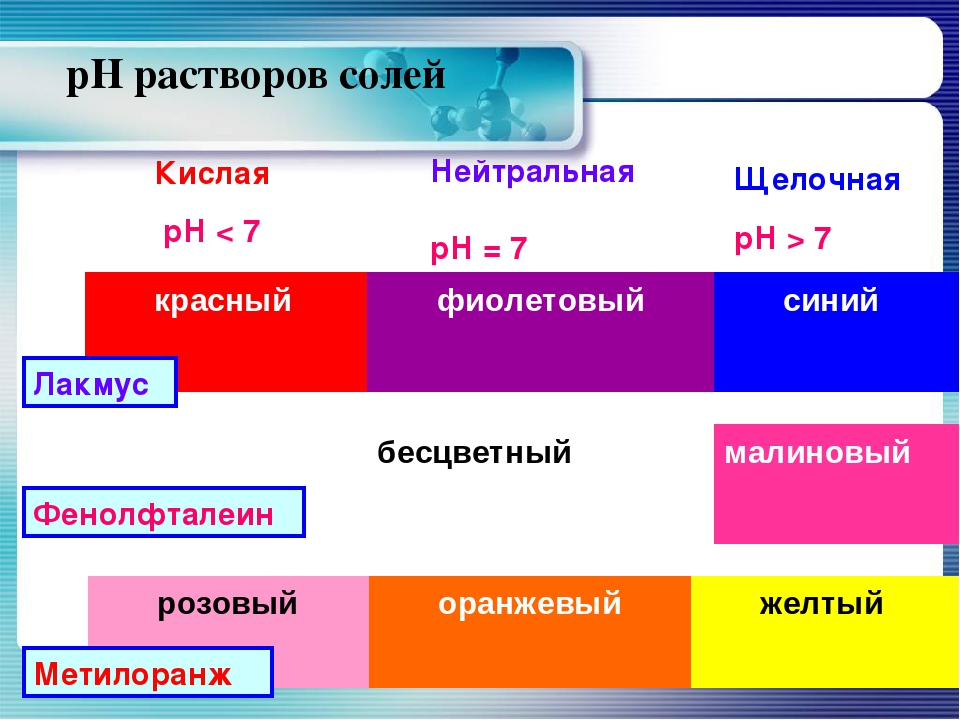
Итак, что имеет более низкую pka, соляную кислоту (HCl) или бромистоводородную кислоту (HBr)?
Если вы ответили бромистоводородная кислота, то вы правы! Br- больше, чем Cl-. Это означает, что Br- является более стабильным основанием, поэтому HBr является более сильной кислотой. pKa HBr составляет -9, а pKa HCl -7.
Электроотрицательность
Помните, что электроотрицательность — это способность атома притягивать электроны.Электроотрицательность увеличивается при движении слева направо по строке периодической таблицы. Он также увеличивается по мере продвижения вверх по колонке, но размер атома больше влияет на кислотность. Представьте, что это драка. Электроотрицательность «выигрывает» по горизонтали в периодической таблице, тогда как размер атома «выигрывает» по вертикали.
Если атом очень электроотрицательный, он может разместить дополнительные электроны, которые остаются, когда кислота теряет протон. Поэтому база более стабильна.
Итак, какая кислота сильнее HCl или h3 S?
Если вы выбрали HCl, вы правы! Cl более электроотрицательный, чем S, поэтому он «более счастлив», когда у него есть дополнительные электроны по сравнению с S. Таким образом, Cl- более стабильное основание, а HCl более сильная кислота.
Индуктивный эффект
Знаете ли вы, что когда электроотрицательный атом присоединен близко к кислому водороду, это может повлиять на pKa? Электроотрицательный атом уберет электронную плотность, помогая стабилизировать отрицательный заряд, остающийся после удаления протона. Это означает, что основание будет более стабильным и приведет к более сильной кислоте.
Это означает, что основание будет более стабильным и приведет к более сильной кислоте.
Какая кислота сильнее: бромуксусная кислота или хлоруксусная кислота?
Если вы выбрали хлоруксусную кислоту, вы правы! Хлор более электроотрицателен, чем бром, поэтому он забирает большую электронную плотность, стабилизируя сопряженное основание кислоты.
Чем ближе электроотрицательный атом к кислому водороду, тем больше он уменьшает электронную плотность, что приводит к более сильной кислоте.
Краткий обзор урока
Молекулярную структуру можно использовать для предсказания кислотности соединения. pH раствора зависит от концентрации кислоты. pKa описывает, сколько кислотных ионов вещество производит в растворе, или, в нашем случае, указывает, сколько протонов диссоциирует с образованием ионов гидроксония.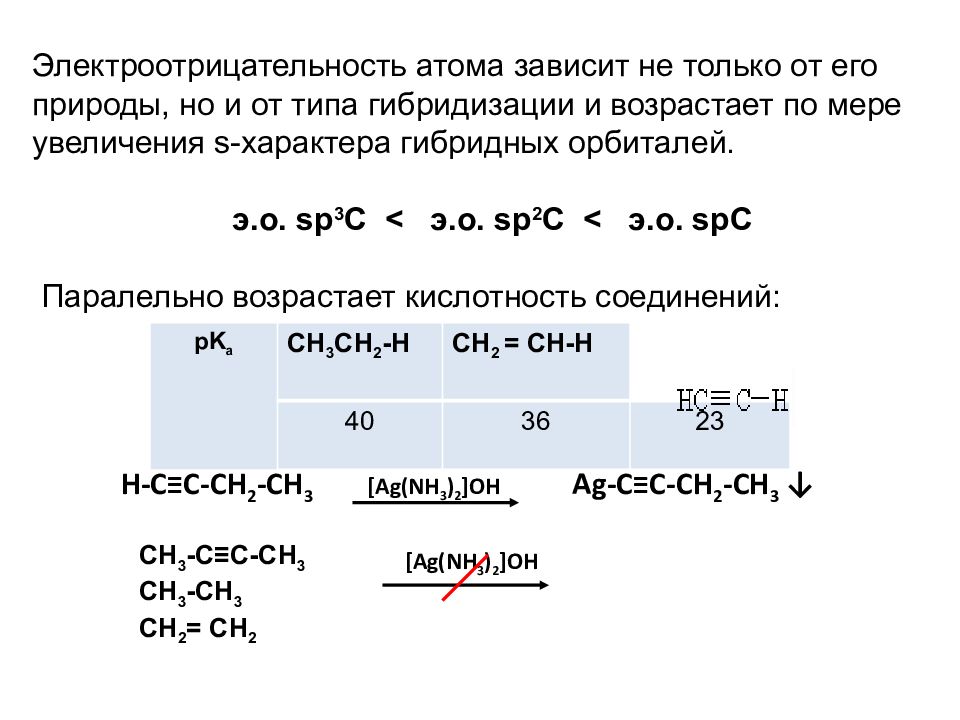

 Обратное: основание Бренстеда = акцептор протона, основание Льюиса = донор электронной пары.
Обратное: основание Бренстеда = акцептор протона, основание Льюиса = донор электронной пары. Вопрос в том, как мы определяем базовую прочность?
Вопрос в том, как мы определяем базовую прочность?