Состав кислот. Соли
I. Состав кислот. Соли.
Образовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
Состав кислот.
Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего необходимо знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет
уравнения химических реакций. Класс помогает ему
в ответах.
Класс помогает ему
в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
Название кислоты |
Формула кислоты |
Название соли |
|
Соляная кислота |
НСl |
С1 — |
Хлориды |
Серная кислота |
H2SO4 |
SO4 = |
Сульфаты |
Сернистая кислота |
Н2SО3 |
SO3= |
Сульфиты |
| Азотная кислота | НNО3 |
NO3 — |
Нитраты |
Ортофосфорная кислота |
Н3РO4 |
РO4= |
Ортофосфаты |
Сероводородная кислота |
H2S |
S = |
Сульфиды |
Угольная кислота |
Н2СО3 |
Карбонаты |
|
Кремниевая кислота |
Н2SiO3 |
SiO3 = |
Силикаты |
Бромоводородная кислота |
НВr |
Br — |
Бромиды |
Фтороводородная кислота |
HF |
F — |
Фториды |
Иодоводородная кислота |
HI |
I — |
Иодиды |
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
- Из чего состоят кислоты?
- Дайте определение — что такое кислоты?
- Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
- Как узнать валентность кислотного остатка?
- Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
Кислоты |
|
Бескислородные |
Кислородсодержащие |
HCl, HBr, HY (одноосновные) H2S (двухосновная) |
HNO3 (одноосновная), H2SO4 (двухосновная), H3PO4 (трехосновные) |
III. Закрепление изученного материала.
Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
- азотная кислота – НNО3
- серная кислота – H2SО4
- ортофосфорная кислота – НзРО4
- метафосфорная кислота – НРО3
- сероводородная кислота – H2S
- хлорная кислота – НClO4
- соляная кислота – НС1
- мышьяковая кислота – Н3АsO4
Задание 3 группы
- сернистая кислота – Н2SО3
- бромоводородная кислота – НВr
- кремниевая кислота – Нг8Юз
- пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов
внутри группы.
Проверьте правильность ответов
внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
K (I) |
||||
Al (III) |
||||
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
Ag (I) |
||||
Cu (II) |
||||
Б) по названию составьте формулы солей:
иодид кальция, сльфит калия, силикат лития,
сульфат хрома (III).
Задание 2 для третьей группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
Fe (II) |
||||
Fe (III) |
||||
Б) по названию составьте формулы солей:
карбонат натрия, бромид магния, сульфид калия,
сульфат марганца (II).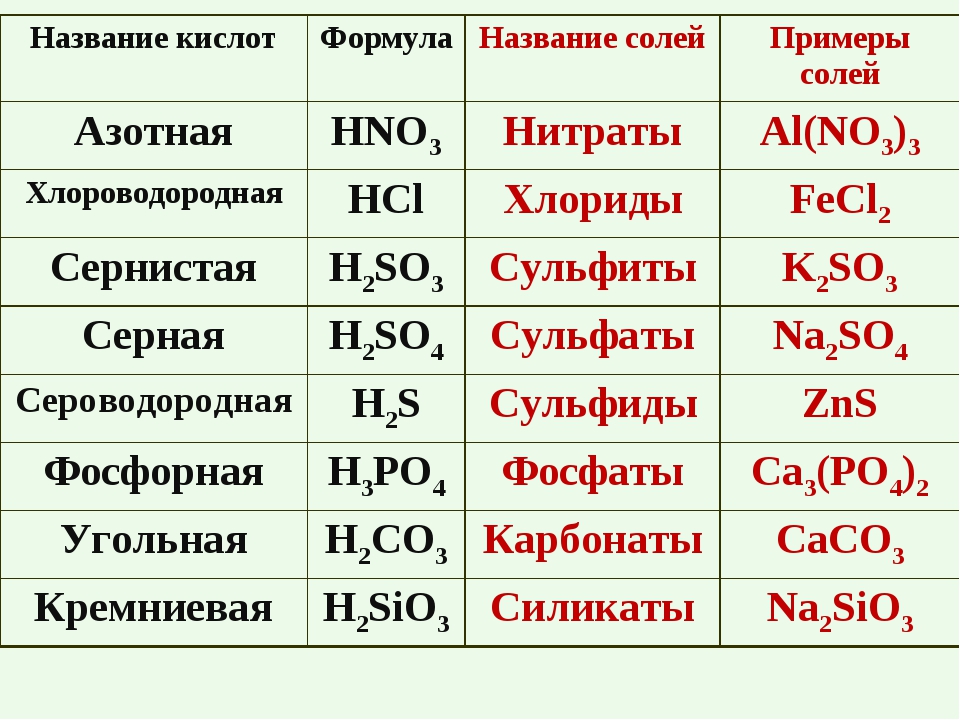
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание:
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Рудзитис Г.Е. Фельдман Ф.Г. Химия. 8 класс средней школы. М.: Просвещение., 1993г.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
Формулы и названия некоторых неорганических кислот, их солей
Формулы, названия, графические формулы некоторых кислот и названия их солей
Названия солей(международные)
1
HF
фтороводородная (плавиковая)
H-F
фториды
2
HCL
хлороводородная (соляная)
H-CL
хлориды
3
HBr
бромоводородная
H-Br
бромиды
4
HI
йодоводородная
H-I
йодиды
5
H2S
сероводородная
H-S-H
сульфиды
6
HCN
циановодородная
(синильная)
H-C≡N
цианиды
7
HCNS
родановодородная
H-C≡N=S
роданиды
8
HN3
Азотистоводородная
(азидоводород)
азиды
9
HCLO4
хлорная
перхлораты
10
HCLO3
хлорноватая
хлораты
11
HCLO2
хлористая
хлориты
12
HCLO
хлорноватистая
H-O-CL
гипохлориты
13
HBrO3
бромноватая
броматы
14
HBrO
бромноватистая
H-O-Br
гипобромиты
15
HIO4
йодная
перйодаты
16
HIO3
йодноватая
йодаты
17
HIO
йодноватистая
H-O-I
гипойодиты
18
HMnO4
марганцовая
перманганаты
19
H2MnO4
марганцовистая
манганаты
20
H2SO4
серная
сульфаты
21
H2SO3
сернистая
сульфиты
22
H2S2O7
дисерная (пиросерная)
дисульфаты
(пиросульфаты)
23
H2S2O3
тиосерная
тиосульфаты
24
H2SO5
пероксомоносерная
—
пероксосульфаты
25
H2S2O8
пероксодисерная
пероксодисульфаты
26
H2CrO4
хромовая
хроматы
27
H2Cr2O7
дихромовая
дихроматы
28
H3CrO3
ортохромистая
H-O
H-O
H-O
ортохромиты (хромиты)
29
HCrO2
метахромистая
H-O- Cr =O
метахромиты
30
HNO3
азотная
нитраты
31
HNO2
азотистая
нитриты
32
H3PO4
(орто) фосфорная
(орто) фосфаты
33
HPO3
метафосфорная
метафосфаты
34
H4P2O7
дифосфорная,
пирофосфорная
дифосфаты
35
H3PO5
надфосфорная,
пероксомонофосфорная
36
H3PO3
фосфористая
фосфиты
37
H3PO2
фосфорноватистая
гипофосфиты
38
H3AsO4
ортомышьяковая
ортоарсенаты
39
H4As2O7
димышьяковая
диарсенаты
40
HAsO3
метамышьяковая
H O As O
O
метаарсенаты
41
HAsO2
метамышьяковистая
метарсениты
42
H3AsO3
ортомышьяковистая
ортоарсениты
43
HSbO2
метасурьмянистая
H O Sb O
метаантимониты
44
H3SbO3
сурьмянистая
H O
H O Sb
H O
ортоантимониты
45
H3SbO4
ортосурьмяная
ортоантимонаты
46
HSbO3
метасурьмяная
H O Sb O
O
метаантимонаты
47
H2CO3
угольная
H O
C O
H O
карбонаты
48
H2CS3
тритиоугольная
SH—CS—SH
тиокарбонаты
49
H2SiO3
Метакремниевая
метасиликаты
50
H4SiO4
ортокремниевая
OH
HO Si OH
OH
ортосиликаты
Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O.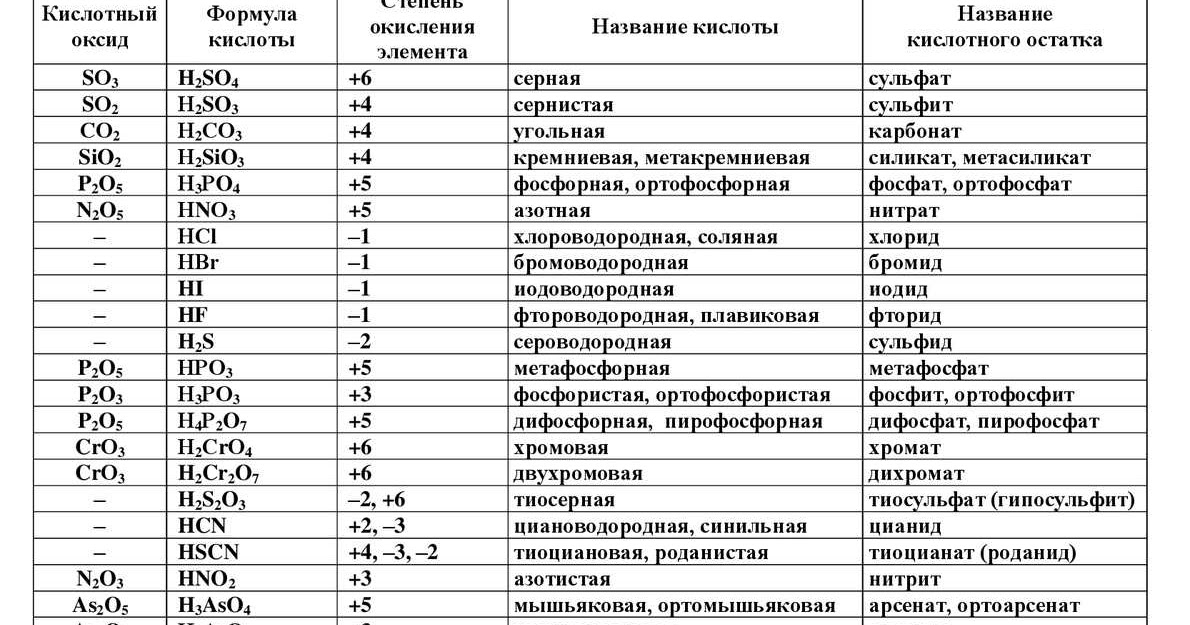 Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
51
H3ALO3
ортоалюминиевая
ортоалюминаты
52
HALO2
метаалюминиевая
H-O-AL=O
метаалюминаты
53
H2ZnO2
цинковая
H-O
Zn
H-O
цинкаты
54
H3BO3
ортоборная
ортобораты
55
HBO2
метаборная
H-O-B=O
метабораты
56
H2B4O7
тетраборная
тетрабораты
Правила построения названий кислородсодержащих кислот
Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс(ная, овая, истая и пр.) кислота.
Суффикс -ная, -вая характерен для кислот, содержащих элемент в высшей степени окисления.

+7
Например, HCLO4— хлорная
+6
H2SO4— серная
+6
H2CrO4-хромовая
+5
HNO3— азотная
2. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, +5
HCLO3 — хлорноватая
+3
HCLO2 — хлористая
+1
HCLO — хлорноватистая
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.

Например,
+5
HPO3 — метафосфорная кислота
+5
H3PO4 — ортофосфорная кислота.
Для того, чтобы различить кислоты, содержащие разное количество атомов кислотообразующего элемента в одной степени окисления, применяют числовые приставки:
+6
H2Cr2O7 — дихромовая кислота;
+6
H2Cr3O10 — трихромовая кислота;
+4
H2S2O5 — дисернистая кислота;
+3
H2B 4O7 — тетраборная кислота.
Оксокислоты, в которых атомы кислорода замещены на атомы серы (частично или полностью) или на пероксогруппы (-О-О-), получают к своему названию приставку соответственно тио- или пероксо- (по необходимости, с числовой приставкой):
H2S2O3 (H2SO3S) — тиосерная кислота;
H2CS3 — тритиоугольная кислота;
HNO4 (HNO2(O2)) — пероксоазотная кислота;
H2S2O8 (H2S2O6(O2) — пероксодисерная кислота.
Кислоты, названия и формулы кислот
Классификация, формулы и названия неорганических кислот названия соответствующих солей [c.332]Формулы и названия бескислородных кислот и кислотных остатков [c.39]
Объяснить причину возникновения изомерии только с помощью структурных формул Кекуле невозможно. Первый шаг в этом направлении был сделан в 1848 г. французским химиком Луи Пастером (1822—1895). Кристаллизуя из водного раствора винограднокислый натрий-аммоний при комнатной температуре, Пастер обнаружил, что образованные в этих условиях кристаллы асимметричны. Причем наблюдаются две формы кристаллов правая и левая (при одинаковой ориентации кристаллов небольшая характерная грань у одних кристаллов находилась слева, а у других — справа). Пастер сумел под увеличительным стеклом при помощи пинцета тщательно разделить оба типа кристаллов. Свойства растворов этих кристаллов оказались полностью идентичными исключение составляла только их оптическая активность — растворы обладали противоположным вращением. Превратив кристаллы, обладающие в растворе правым вращением, в кислоту, Пастер обнаружил, что получил известную ранее природную правовращающую винную кислоту, из кристаллов другого типа получался ее оптический изомер — ранее не известная левовращающая винная кислота. Отсюда Пастер сделал вывод, что в кристаллах виноградной кислоты содержится равное количество молекул право- и левовращающих винных кислот и именно поэтому виноградная кислота оптически неактивна. Соединения, подобные виноградной кислоте, стали называть рацемическими (от латинского названия виноградной кислоты). [c.87]
Превратив кристаллы, обладающие в растворе правым вращением, в кислоту, Пастер обнаружил, что получил известную ранее природную правовращающую винную кислоту, из кристаллов другого типа получался ее оптический изомер — ранее не известная левовращающая винная кислота. Отсюда Пастер сделал вывод, что в кристаллах виноградной кислоты содержится равное количество молекул право- и левовращающих винных кислот и именно поэтому виноградная кислота оптически неактивна. Соединения, подобные виноградной кислоте, стали называть рацемическими (от латинского названия виноградной кислоты). [c.87]
Общие формулы кислот и их названия НКО. . новати-стая кислота НКОг. . . истая кислота — НКОз. . новатая кислота нно . . . пая кислота [c.311]
Формула кислоты Название кислоты Кислотный остаток Название солей [c.332]
А теперь еще раз взгляните на формулу карбоксильной группы. Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты. [c.154]
Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты. [c.154]
Предельные одноосновные кислоты имеют состав, соответствующий общей формуле СпНа Ог. Простейшей карбоновой кислотой является муравьиная кислота НСО2Н. Названия и важнейшие свойства предельных одноосновных кислот приведены в табл. П1.9 Приложения. Кислоты, содержащие до трех атомов углерода,— подвижные жидкости, смешивающиеся с водой в любых соотношениях кислоты, содержащие от четырех до девяти атомов углерода, — малорастворимые в воде маслянистые жидкости, а свыше [c.151]
Названия распространенных кислотных гидроксидов состоят из двух слов собственного названия с окончанием яя и группового слова кислота . Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе) [c.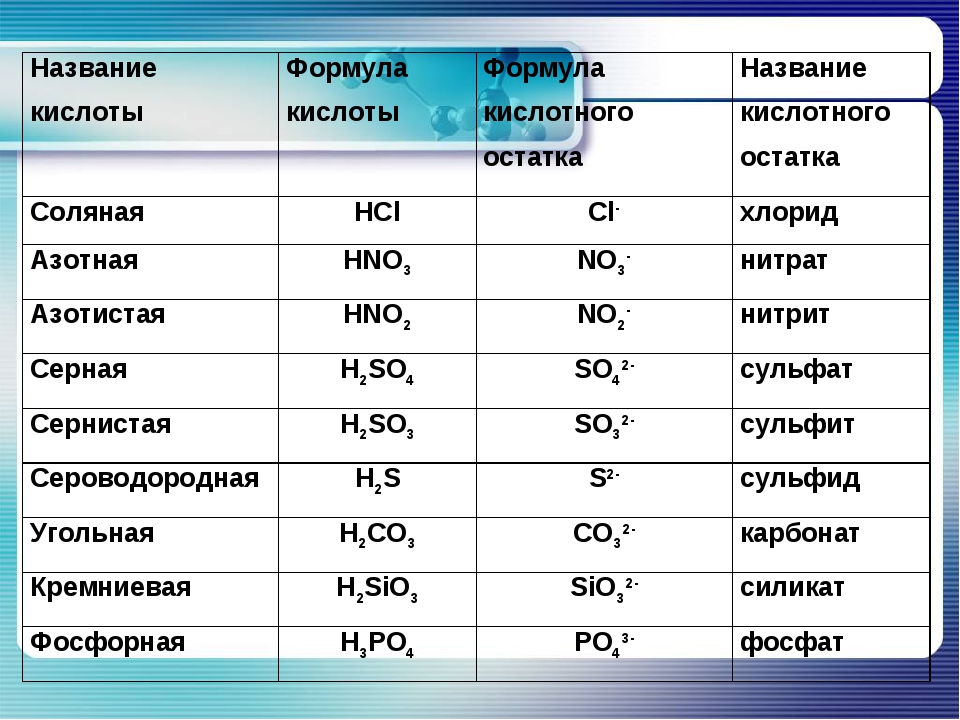 9]
9]
Ниже приведены формулы и названия первых пяти дикарбоновых кислот. Сначала даны исторические (тривиальные) названия кислот, а затем рациональные. Для успешного усвоения номенклатуры органических соединений особенно полезно запомнить названия этих кислот, так как они часто встречаются в литературе [c.176]
Напишите формулы кислоты и основания, образуемые железом в трехвалентном состоянии . .. и. … Они носят названия. .. и. .. [c.68]
Название кислородных кислот Формула Название тио-серных кислот Формула Название солей тиокислот [c.276]
Для иллюстрации принципа построения названий по рациональной номенклатуре рассмотрим простой пример — вещество с тривиальным (несистематическим, случайным) названием пивалиновая кислота (СНз)зС—СООН. Структуру этого вещества можно связать с более простым представителем гомологического ряда карбоновых кислот — уксусной кислотой формулу пивалиновой кислоты можно получить из формулы уксусной кислоты, заменив в последней три атома водорода на метильные группы СН3. Такой подход и отражен в рационалыюм названии триметилуксусная кислота [c.57]
Такой подход и отражен в рационалыюм названии триметилуксусная кислота [c.57]
Приведите примеры формул и названий бескислородных кислот и их кислотных остатков. [c.43]
Выведите формулы всех изомерных карбоновых кислот С5Н10О2. Назовите их по заместительной и рациональной номенклатурам. Каково общее тривиальное название этих кислот [c.48]
Каким из следующих оксидов соответствуют кислоты Напишите формулы и названия этих кислот [c.43]
Эмпирическая формула ВКК Название кислоты Эмпирическая формула ВКК Название кислоты [c.596]
На примере фумаровой кислоты можно рассказать еще об одной разновидности изомерии, которая наблюдается иногда (не всегда) при наличии в молекуле двойной связи. Молекулу такого состава, как у фумаровой кислоты, можно нарисовать двумя способами. Слева приведена формула фумаровой кислоты, а справа — совсем другое соединение с иными свойствами, которое носит название малеиновой кислоты [c. 164]
164]
Рациональная номенклатура аналогична рациональной номенклатуре альдегидов кислоты рассматривают либо как алкилзамещенную уксусную кислоту (в формуле выбирают груп-иировку С—СООН), либо в основу кладут тривиальное название нормальной кислоты, соответствующей самом длинной цепи с карбоксильной группой. Так, в наших примерах а) трнметил-уксусная (или о ,а-диметил-пропионовая) кислота б) изобутил-уксусная (или у-метил-валериановая) кислота. [c.47]
Пикриновая кислота. Другим очень важным ароматическим тринитропроизводным является 2,4,6-тринитрофенол, или пикриновая кислота. Название пикриновая кислота было предложено для 2,4,6-тринитрофенола французским химиком Дюма в 1836 г. из-за горького вкуса соединения ( пикрос — горький). Формула пикриновой кислоты [c.158]
Сначала итальянский химик Рафаэль Пириа (1814—1865) выделил из ивовой коры салициловую кислоту (от латинского саликс — ива). Потом он определил химический состав этого вещества и успешно синтезировал его. Салициловая (старое название спираевая ) кислота отвечает формуле НОС6Н4СООН в ее молекуле имеется бензольное кольцо с гидроксильной (ОН) и карбоксильной (СООН) группами.. Салициловая кислота сейчас находит применение как наружное бактерицидное средство в виде спиртового раствора — салицилового спирта. Заслуживает упоминания и салол — фени-ловый эфир салициловой кислоты, который был синтезирован еще в 1886 г. с целью соединить химически в одном веществе антисептические свойства фенола (карболовой кислоты) и противовоспалительную активность салициловой кислоты. [c.128]
Салициловая (старое название спираевая ) кислота отвечает формуле НОС6Н4СООН в ее молекуле имеется бензольное кольцо с гидроксильной (ОН) и карбоксильной (СООН) группами.. Салициловая кислота сейчас находит применение как наружное бактерицидное средство в виде спиртового раствора — салицилового спирта. Заслуживает упоминания и салол — фени-ловый эфир салициловой кислоты, который был синтезирован еще в 1886 г. с целью соединить химически в одном веществе антисептические свойства фенола (карболовой кислоты) и противовоспалительную активность салициловой кислоты. [c.128]
Соединения кислотного характера были обнаружены в нефти еш е в середине прошлого века. Одна из причин их обнаружения и исследования заключалась в том, что по сравнению с углеводородами керосиновых фракций (керосин вначале был основным целевым продуктом переработки нефти) нафтеновые кислоты имеют гораздо большую химическую активность. Осветительный керосин с большим количеством органических кислот был плохим по качеству, поэтому его подвергали щелочной очистке.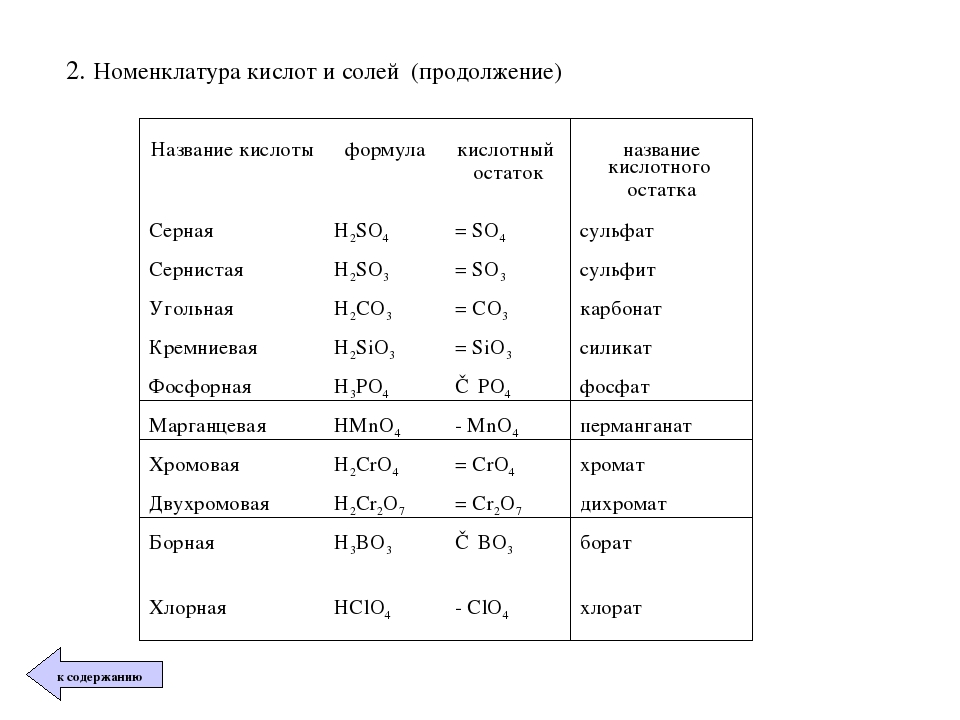 Максимальное количество нафтеновых кислот содержалось в бакинских нефтях, и в этих нефтях впервые в 1874 г. Эйхлору удалось обнаружить и исследовать кислородные соединения кислотного характера. Он выделил из сураханской нефти 12 кислот и первоначально присвоил им формулу С П2 02- Однако дальнейшими исследованиями было установлено, что низкомолекулярным кислотам отвечает формула С Н2 202. Эти кислоты получили название нафтеновых кислот [50]. [c.48]
Максимальное количество нафтеновых кислот содержалось в бакинских нефтях, и в этих нефтях впервые в 1874 г. Эйхлору удалось обнаружить и исследовать кислородные соединения кислотного характера. Он выделил из сураханской нефти 12 кислот и первоначально присвоил им формулу С П2 02- Однако дальнейшими исследованиями было установлено, что низкомолекулярным кислотам отвечает формула С Н2 202. Эти кислоты получили название нафтеновых кислот [50]. [c.48]
Эти соединения, имеющие общую формулу С Н2п 1 СООН или, что то же самое, С Н2 202, получили название нафтеновых кислот. Карбоксильная группа почти всех нафтеновых кислот не присоединена непосредственно к циклу, а удалена от него одной или более метиленовыми группами [6]. [c.26]
Это кислоты общей формулы С,1И2п-1 СООН, являющиеся производными нафтеновых углеводородов — циклопентана и цнклогек сана, откуда и происходит их название. Нафтеновые кислоты на ходятся в средних фракциях нефтей, выкипающих выше 250 , в количестве нескольких процентов. Установлено, что большинство нафтеновых кислот, встречающихся в нефтн, являются производным циклопентана, причем карбоксильная группа, как правило, удалена от ядра на 1—5 атомов углерода [c.96]
Установлено, что большинство нафтеновых кислот, встречающихся в нефтн, являются производным циклопентана, причем карбоксильная группа, как правило, удалена от ядра на 1—5 атомов углерода [c.96]
Витамин С был впервые выделен в кристаллическом виде (Сцент-Гьорги) из коры надпочечников и впоследствии получил название -аскорбиновой кислоты. Его элементарная формула СбНвОб-В результате исследований, главным образом Хеуорса, Херста, Каррера и Михеля, было установлено, что он имеет следующее строение (Хеуорс, Херст, Эйлер) [c.898]
Напишите формулы кислот а ) о-бензолдикар-боновой б) л(-бензолдикарбоновой в) п-бензолдикарбоновой. Укажите их тривиальные названия. [c.101]
Формула Степень окисления хлора Название кислоты Название солеЛ [c.177]
Напишите структурные формулы и дайте другие названия следующим кислотам а) изомасляная б) триметилуксусная в) 2-метилгексановая [c.77]
Названия кислот следует образовывать с приставками мета или орто, если это способствует уточнению формулы кислоты, например, ортомышьяковая НзА504, ме-тамышьяковая НАзОз. [c.32]
[c.32]
Напишите структурные формулы и названия изомерных кислот, имеющих формулу jHioOj. [c.301]
Приведите структурные формулы кислот (в скобках указаны систематические названия) а) а-оксимасляной (2-гидро-ксибутановой) б) Р-бромизомасляной (З-бром-2-метилпропановой) [c.98]
Никотиновая кислота впервые была получена Губером в 1867 г. окислением алкалоида никотина бихроматом калия в присутствии серной кислоты спустя 3 года этим же автором было найдено, что никотиновая кислота-является пиридинкарбоновой кислотой. Название никотиновая кислота введено Вейделем в 1873 г., по учившим ее окислением никотина азотной кислотой и приписавшим ей неправильную суммарную формулу. В течение [c.657]
В зависимости от условий гидроокиси и кислоты могут вести себя и как основания и как кислоты. Например, формулами Т1(0Н)4 и Н4ТЮ4 обозначается одно и то же вещество. Но первая формула говорит о способности вещества реагировать с кислотами, т. е. вести себя как основание, В данном случае это вещество называется. … Вторая формула относится к кислоте и характеризует способность этого вещества реагировать с щелочами. Этому его поведению отвечает название. … [c.66]
Но первая формула говорит о способности вещества реагировать с кислотами, т. е. вести себя как основание, В данном случае это вещество называется. … Вторая формула относится к кислоте и характеризует способность этого вещества реагировать с щелочами. Этому его поведению отвечает название. … [c.66]
Названия галогенангидридов кислот определяются названиями галогенов и кислот, производными которых являются рассматриваемые соединения. Так, галогенангидриды 502С12, РОВгз и В1з имеют следующие графические формулы и названия [c.39]
Подобные оптически недеятельные соединения получили название рацемических веществ, или рацематов, от названия виноградной кислоты a idum ra emi um, на которой впервые было замечено явление оптической недеятельности, обусловленной присутствием равных количеств противоположно вращающих изомеров. В парах, растворах и расплавах рацематы, по-видимому, являются смесью обеих оптически деятельных форм. Так, при определении молекулярного веса виноградной кислоты по понижению температуры замерзания ее раствора получена величина, соответствующая формуле HgOe. Точно так же плотность паров эфиров виноградной кислоты соответствует простым, а не удвоенным молекулам. В кристаллической же решетке, как это показывает рентгенографический анализ, узлы заняты удвоенными молекулами. [c.294]
Точно так же плотность паров эфиров виноградной кислоты соответствует простым, а не удвоенным молекулам. В кристаллической же решетке, как это показывает рентгенографический анализ, узлы заняты удвоенными молекулами. [c.294]
Установлено, что важными составляющими белков являются двадцать три аминокислоты. Названия этих кислот приведены в табл. 14.1 там же указаны формулы характеристических групп К. Некоторые аминокислоты имеют дополнительную карбоксильную группу или дополнительную аминогруппу. Так, имеется двухосновная диаминокислота — цистин, очень близкая к простой аминокислоте цистеину. Четыре из указанных в таблице аминокислот содержат гетероциклические кольца (кольца, состоящие из атомов углерода и одного или нескольких атомов других элементов, в данном случае атомов азота). Две из приведенных аминокислот — аспарагин и глутамин — родственны двум другим — аспарагиновой и глутаминовой кислотам, от которых аспарагин и глутамин отличаются только тем, что имеют вместо дополнительной карбоксильной группы амидную группу [c.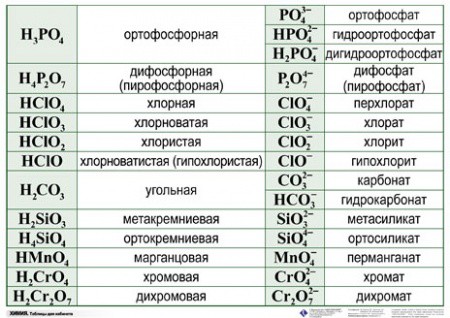 385]
385]
Кислоты в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Понятие о кислотах:
Из курса природоведения вы знаете об уксусной кислоте, в 7 классе упоминалась серная кислота. Кислый вкус лимонам придает именно лимонная кислота. Обратите внимание, слово «кислота» есть в каждом из этих словосочетаний. Это потому, что эти вещества принадлежат к одной группе сложных веществ — кислотам. При этом, серная кислота — неорганическое вещество, а уксусная и лимонная — органические.
Что же представляют собой кислотыКислоты — сложные вещества. Подобно оксидам, они состоят из двух частей, а объединить их в одну группу позволяет наличие атомов водорода.
Ознакомимся с приведенными формулами кислот:
Качественный состав этих формул подтверждает наличие одного или нескольких атомов водорода.
Разделим формулы кислот черточкой на две части так, чтобы в первой были атомы водорода:
Оставшуюся часть называют кислотным остатком.
Вторая часть формул кислот отличается от первой части по составу.
Атомы водорода есть и в составе аммиака но он не относится к классу кислот. Ведь кислотам свойственен еще один общий признак — способность атомов водорода замещаться атомами металлов и образовывать при этом соли.
Кислоты — это сложные вещества, которые содержат атомы водорода, способные замещаться металлом, и кислотный остаток.
Названия кислотОзнакомьтесь с таблицей 1, в нее внесены неорганические кислоты, с которыми вы будете сталкиваться чаще всего.
До сих пор вы рассматривали валентность как способность атомов одного химического элемента соединяться или замещать определенное количество атомов другого элемента. Отныне ваши знания об этой физической характеристике атомов пополнятся информацией о валентности кислотных остатков. Оказывается, что кислотные остатки также способны совмещать определенное количество атомов или групп атомов.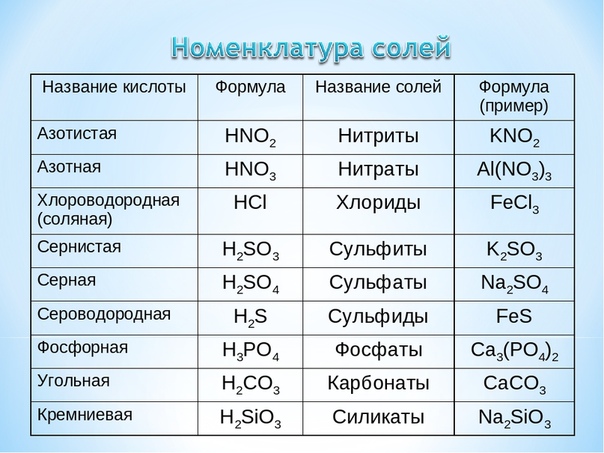
Запись общей формулы кислот имеет такой вид:
Таким образом, валентность кислотного остатка равна количеству атомов водорода.
Физические свойства кислотНеорганические кислоты, в основном, — жидкости. Среди них совсем мало твердых веществ (из приведенных в таблице 1 лишь ортофосфорная), нет газообразных.
Кислоты бесцветны, плотность всех кислот больше единицы. Они хорошо растворяются в воде (за исключением некоторых, в частности кремниевой).
И название класса соединений — кислоты, и восприятие вкусового ощущения — кислый — слова однокоренные. И это не случайно, ведь кислоты, в основном, кислые на вкус. Вы это знаете из собственного опыта, употребляя кисломолочные продукты (кефир, йогурт), фрукты, квашеные и свежие овощи (лимоны, яблоки и т. п.).
Запомните! В химическом кабинете ни в коем случае нельзя пробовать кислоты и любые другие вещества на вкус! Это очень опасно!
Кислоты повреждают слизистые оболочки органов пищеварения, при вдыхании паров раздражают слизистые оболочки органов дыхания, попадая на кожу, вызывают покраснения, болевые ощущения, а при большой концентрации — тяжелые ожоги. Кислоты портят одежду — на месте их попадания сразу или со временем появляется дыра. Некоторые кислоты имеют резкий неприятный запах, например соляная, серная, азотная.
Кислоты портят одежду — на месте их попадания сразу или со временем появляется дыра. Некоторые кислоты имеют резкий неприятный запах, например соляная, серная, азотная.
Однако работа с кислотами в школьном химическом кабинете безопасна, так как учащиеся работают с разбавленными кислотами, а не с чистыми веществами. При этом нельзя допускать попадания кислот на одежду или тело и особенно в глаза.
Плотности всех кислот больше единицы, то есть они тяжелее воды. Существует правило приготовления растворов кислот: кислоту льют в воду (не наоборот!) небольшими порциями, помешивая стеклянной палочкой. Почему именно так? Имея плотность большую, чем плотность воды, кислота проходит сквозь толщу воды на дно сосуда и смешивается с водой. Если же сделать наоборот — воду лить в кислоту, — вода будет скапливаться на поверхности кислоты, от сильного разогревания (в результате химического взаимодействия) она закипит, а ее брызги могут попасть на тело или одежду. Если так приготовить раствор серной кислоты, то в результате сильного разогревания стеклянный сосуд может даже треснуть.
Однако кислоты не разрушают стекло (исключение — плавиковая кислота некоторые пластмассы и резину. Поэтому во время работы с кислотами вам не помешает передник из поливинилхлоридного материала.
Запись состава кислот с помощью структурных формулКак вы уже знаете, структурные формулы показывают не только количественный и качественный состав молекул, но и порядок соединения атомов в них. Как записывать структурные формулы кислот?
Пример 1. Записать структурную формулу соляной кислоты
Зная, что одна черточка в структурной формуле соответствует одной единице валентности, а водород и кислотный остаток этой кислоты одновалентны, записываем:
Пример 2. Записать структурную формулу серной кислоты.
Чтобы правильно записать структурную формулу кислоты, молекулярная формула которой следует помнить, что в молекулах кислородсодержащих кислот атомы водорода соединены с атомами кислорода:
Итоги:
- Кислоты — класс неорганических соединений, молекулы которых состоят из атомов водорода, способных замещаться атомами металлов, и кислотного остатка.

- Валентность кислотного остатка определяется количеством атомов водорода, которые могут быть замещены атомами металла.
- Работая с кислотами, необходимо помнить об их химических свойствах и строго придерживаться правил безопасной работы с ними.
Тривиальные названия кислот (серная, соляная и др.) появились в последнем десятилетии XVIII ст., когда в 1792 году о них сообщил от имени своих коллег-химиков французский ученый Антуан Лавуазье на заседании Парижской академии. А до этого кислоты назывались произвольно. Среди нескольких названий серной кислоты было и название «купоросная», карбонатной — «воздушная».
Новая химическая номенклатура внедрялась медленно. В России к предложенным названиям обратились лишь через 100 лет. В частности, еще в 1875 г. в Петербургской академии наук обсуждалась возможность применения для кислоты названия «Водород серович четырехкислов», подобно фамилии, имени и отчеству человека.
Способность металлов вытеснять водород из кислот
Вернемся к определению кислот как сложных веществ, в молекулах которых атомы водорода способны замещаться атомами металлов, и подтвердим это опытным путем.
Опыт 1. Поместим в пробирку немного магниевых опилок, дольем к ним воды и будем наблюдать. При комнатной температуре никаких изменений не происходит.
Опыт 2. Поместим в пробирку немного магниевых опилок, дольем к ним разбавленного раствора серной кислоты (1 часть кислоты и приблизительно 5 частей воды) и быстро закроем пробирку пробкой с газоотводной трубкой. При комнатной температуре магний активно взаимодействует с кислотой, о чем свидетельствует выделение пузырьков газообразного вещества.
Соберем газ способом вытеснения воды и испытаем его. Для этого наполненную газом пробирку закроем под водой стеклянной пластиной и извлечем пробирку из сосуда.
Выясним, какой газ мы собрали. Вам известно, что кислород поддерживает горение и в сосуде с ним горящая спичка или тлеющая щепка ярко загорятся. Наличие водорода также можно установить с помощью горящей спички — пламени ее достаточно, чтобы поджечь водород. Исходя из того, что в составе серной кислоты есть и атомы водорода, и атомы кислорода, проверим, какой газ — водород или кислород — мы собрали: поднеся зажженную спичку к отверстию пробирки, услышим приглушенный хлопок (взрыв).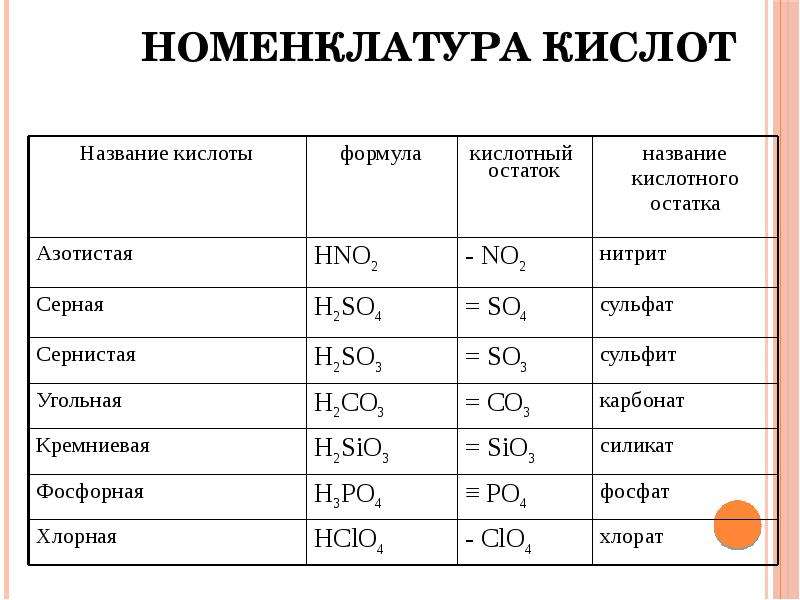 Окисление водорода спровоцировало небольшой взрыв, а яркого горения спички не наблюдалось.
Окисление водорода спровоцировало небольшой взрыв, а яркого горения спички не наблюдалось.
Магний вытеснил из кислоты не кислород, а водород, о чем свидетельствует продукт реакции — водород:
Следовательно, в результате реакции образовалось простое газообразное вещество. Оно не имеет запаха и цвета, потому мы и обнаружили его только после сожжения образовавшегося водорода.
Проанализируйте состав другого продукта этой реакции и сделайте вывод, простое это вещество или сложное. Образованное вещество относится к классу неорганических соединений — солям. С представителем этого класса соединений — поваренной солью — вы уже встречались, разделяя смесь соли и воды испарением. Воспользуемся этим способом и проверим опытным путем наличие соли в растворе. Для этого несколько капель образовавшегося после реакции раствора выпарим на стеклянной пластине. После испарения воды на ней останется небольшое количество соли белого цвета.
Продолжим исследование способности атомов металлических элементов замещать атомы водорода в молекулах кислот, но уже на примере других металлов, и проделаем опыт с соляной кислотой и цинком.
Опыт 3. Поместим (осторожно!) на дно пробирки несколько гранул металла цинка, дольем к ним разбавленную соляную кислоту и будем наблюдать. Довольно быстро поверхность гранул покроется пузырьками газообразного вещества. Подогреем содержимое пробирки, и газ станет выделяться активнее. (Вспомните, как определяется относительная плотность газов по воздуху. Вычислите плотность водорода по воздуху и предложите, как нужно правильно держать пробирку, чтобы она наполнилась водородом.) Расчеты подтверждают, что водород в 14,5 раза легче воздуха. Следовательно, чтобы наполнить пробирку водородом, ее нужно держать вверх дном. Соберем водород в сухую пробирку способом вытеснения воздуха и испытаем его.
Как и в предыдущем опыте, раздается приглушенный хлопок. Следовательно, цинк вытеснил атомы водорода из молекул соляной кислоты, из атомов образовались молекулы водорода, и опыт это только что подтвердил:
На стенках пробирки появились капельки воды — продукта окисления водорода:
Запомните! Реакция горения водорода сопровождается взрывом. Поэтому для безопасности ее проведения объем водорода не должен превышать вместимости пробирки.
Поэтому для безопасности ее проведения объем водорода не должен превышать вместимости пробирки.
Опыт 4. К медным опилкам добавим разбавленную соляную кислоту. Наблюдение показывает, что реакции не происходит: цвет меди и раствора не изменился, образования газообразного вещества не наблюдается. Подогреем содержимое пробирки и еще раз убедимся в отсутствии каких-либо изменений, т. е. медь не вытесняет водород из кислоты.
Таким образом, опытным путем мы выяснили, что одни металлы способны вытеснять водород из кислот, другие — нет. Это свойство металлов исследовал русский ученый Николай Николаевич Бекетов и по способности металлов вытеснять водород из кислот составил в 1863 г. вытеснительный ряд металлов, или ряд активности металлов:
Николай Николаевич Бекетов (1827 — 1911) — известный ученый в области физики и химии, русский по происхождению. Много лет работал профессором Харьковского университета (в настоящее время Харьковский национальный университет имени В.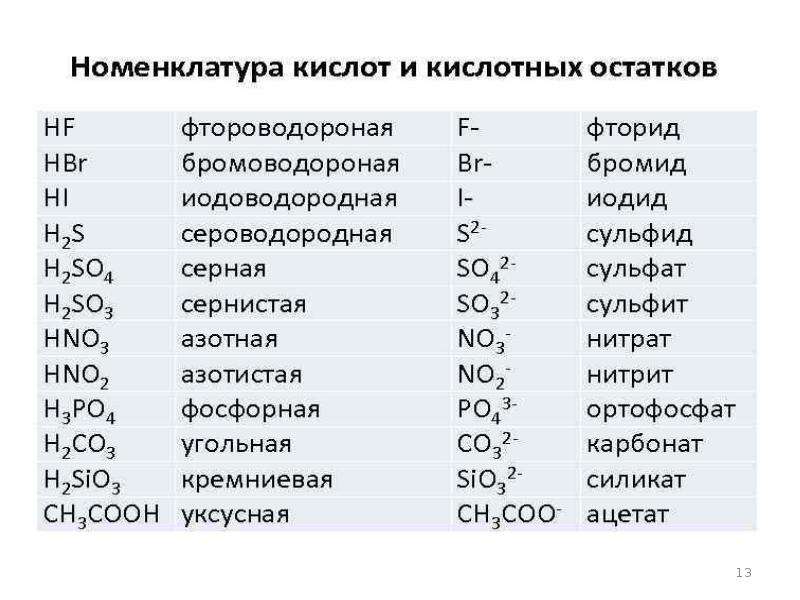 Н. Каразина). Ученый стоял у истоков одной из отраслей химической науки — физической химии. Ему принадлежит открытие одного из способов добычи металлов из руд-оксидов — алюминотермия. При этом способе используют свойства алюминия при определенной температуре вступать в реакцию с оксидом металла с последующим окислением. В результате выделяется металл в виде простого вещества высокой степени чистоты. Так добывают высокой чистоты железо, хром, кобальт, никель, марганец.
Н. Каразина). Ученый стоял у истоков одной из отраслей химической науки — физической химии. Ему принадлежит открытие одного из способов добычи металлов из руд-оксидов — алюминотермия. При этом способе используют свойства алюминия при определенной температуре вступать в реакцию с оксидом металла с последующим окислением. В результате выделяется металл в виде простого вещества высокой степени чистоты. Так добывают высокой чистоты железо, хром, кобальт, никель, марганец.
В 1863 г. Бекетов составил вытеснительный ряд металлов (ряд активности металлов).
Все металлы, расположенные в ряду активности металлов слева от водорода, вытесняют водород из кислот. Эта способность металлов ослабевает от лития к свинцу. Металлы, расположенные в вытеснительном ряду после водорода, не вытесняют водород из кислот, т. е. не взаимодействуют с кислотами. Эта закономерность не распространяется на азотную кислоту, которая взаимодействует с металлами, расположенными не только до водорода, но и после него, однако одним из продуктов реакции является не водород, а вода.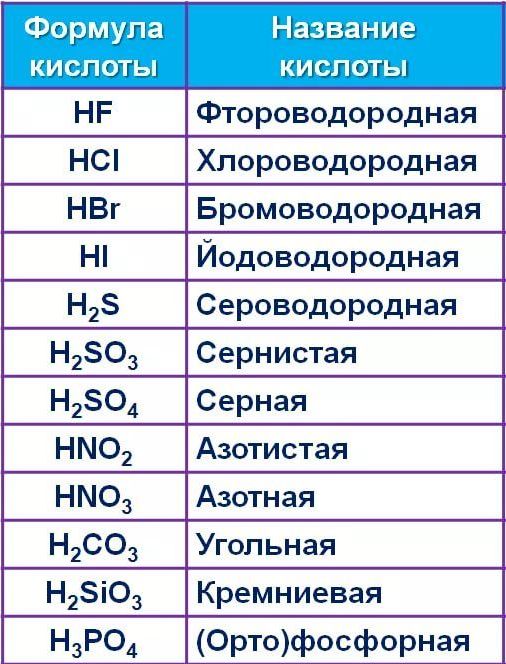 Аналогично реагирует с металлами и концентрированная серная кислота.
Аналогично реагирует с металлами и концентрированная серная кислота.
Наличие в ряду активности металлов водорода дает возможность сделать вывод о том, будет ли взаимодействовать металл с кислотой.
Следует также знать, что металлы вытесняют водород не только из кислот, но и из воды, в которой кислота растворена, поэтому запись лишь одного уравнения (металл + кислота) не всегда отвечает действительности.
В проведенных нами опытах активность металлов изменялась так:
Выясним место металлов в ряду активности и убедимся, что результаты этих опытов отвечают закономерности, установленной М. М. Бекетовым. Поэтому можем представить полученные результаты в виде химических уравнений:
Понятие об индикаторахИндикаторами называют вещества или тела, с помощью которых обнаруживают конкретный признак другого вещества, тела или материала. Например, у электромонтеров есть прибор, который называется индикатором электрического тока. В химической лаборатории, а также лабораториях, где проверяют качество продуктов питания, также нужны индикаторы — вещества, с помощью которых определяют наличие кислот или оснований в растворе.
В химической лаборатории, а также лабораториях, где проверяют качество продуктов питания, также нужны индикаторы — вещества, с помощью которых определяют наличие кислот или оснований в растворе.
В школьной химической лаборатории пользуются в основном такими индикаторами: лакмусом, метиловым оранжевым (метилоранжем), фенолфталеином. Используют или их растворы, или индикаторные бумажные полоски (пропитанная индикатором бумага с последующим ее высушиванием).
На чем основывается применение индикаторов? Они приобретают различную окраску в воде, растворах кислот и оснований.
В воде лакмус приобретает фиолетовый цвет, метилоранж, — оранжевый, фенолфталеин — бесцветен.
Под воздействием кислот или оснований индикаторы изменяют свой цвет. При этом происходят сложные химические реакции, уравнения которых мы записывать не будем. А вот явлением, которое их сопровождает — изменением цвета, — воспользуемся уже при выполнении лабораторного опыта 1.
Итоги:
- Вытеснительный ряд металлов, или ряд активности металлов — это ряд, в котором металлы расположены по их способности вытеснять водород из кислот.

- Металлы, расположенные в ряду активности до водорода, вытесняют водород из кислот, металлы, расположенные в ряду активности после водорода,— не вытесняют.
- Качественной реакцией на водород является его взаимодействие с кислородом, во время которого слышится приглушенный хлопок — взрыв. Чтобы эта реакция состоялась, достаточно зажженную спичку поднести к отверстию пробирки с водородом.
- Кислоту в растворе можно обнаружить с помощью индикаторов лакмуса и метилового оранжевого.
Как было выяснено опытным путем, в растворах разных кислот все индикаторы имеют одинаковый цвет. Это свидетельствует о том, что к изменению цвета индикаторов причастен водород, потому что он входит в состав всех кислот, тогда как кислотные остатки у них разные. Действие на индикаторы оказывают не нейтральные атомы водорода, а его положительно заряженные ионы (Вспомните, как в 7 классе вы научились различать атомы и ионы.) Если вы были внимательны, то обратили внимание на то, что в каждом опыте использовались водные растворы кислот, потому что чистые кислоты не действуют на индикаторы.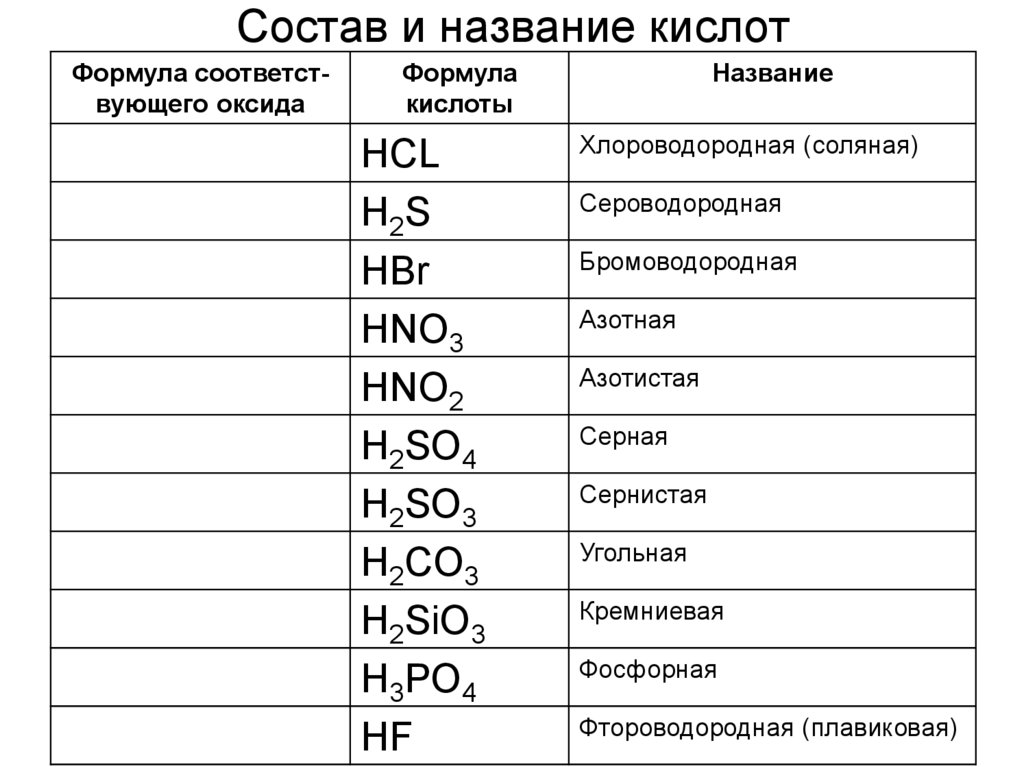 Вода нужна для того, чтобы молекула кислоты распалась на положительно заряженные ионы (катионы) водорода и негативно заряженные ионы (анионы) кислотного остатка. При этом число образованных из одной молекулы кислоты катионов водорода равно числу его атомов в составе молекулы кислоты, в то время как анион кислотного остатка образуется один:
Вода нужна для того, чтобы молекула кислоты распалась на положительно заряженные ионы (катионы) водорода и негативно заряженные ионы (анионы) кислотного остатка. При этом число образованных из одной молекулы кислоты катионов водорода равно числу его атомов в составе молекулы кислоты, в то время как анион кислотного остатка образуется один:
Стрелки в обоих направлениях вместо знака «равенства» означают, что происходит не только образование ионов, но и обратный процесс, — ионы объединяются в молекулы.
Обратите внимание: каким бы сложным не был кислотный остаток, он образует единый ион и сохраняет свою целостность.
Итак, с помощью лакмуса, метилового оранжевого, универсального бумажного индикатора можно определить присутствие в растворе катионов водорода, или созданную ими кислую среду.
Определение кислотПрочитав название параграфа, кое-кто вспомнит вкус лимона или апельсина. В самом деле, такой вкус обусловливают соединения, общее название которых — кислоты (рис. 10).
10).
Кислота — соединение, молекула которого содержит один или несколько атомов Гидрогена, способных при химических реакциях замещаться на атомы металлического элемента.
Все кислоты имеют молекулярное строение. Для них существуют две общие формулы — Кислот, которые отвечают первой формуле, немного. Их образуют неметаллические элементы VI и VII групп периодической системы.
Примеры химических формул кислот:
При замещении атомов Гидрогена в молекулах кислот, например, на атомы Натрия, образуются соединения* с такими формулами:
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком. Для кислоты с формулой кислотным остатком является атом Хлора, для кислоты — группа атомов
Количество атомов Гидрогена в молекуле кислоты определяет валентность кислотного остатка. Например, кислотный остаток одновалентный (молекула содержит один атом Гидрогена), а остаток — двухвалентный (в молекуле два атома Гидрогена). Таким образом, понятие «валентность» применяют не только для атомов, но и для групп соединенных между собой атомов.
Таким образом, понятие «валентность» применяют не только для атомов, но и для групп соединенных между собой атомов.
Элемент, который образует кислоту, называют кислотообразующим. Покажем, как можно определять значение его валентности в кислотах с общей формулой В качестве примера возьмем соединение, имеющее формулу
* — Общее название этих соединений — соли.
Запишем над символами Гидрогена и Оксигена значения валентности этих элементов:
Количество единиц валентности для 4-х атомов Оксигена составляет а для 2-х атомов Гидрогена — Значение валентности атома Сульфура равно разнице между первым и вторым числом, т. е.
Поскольку кислоты — молекулярные соединения, то для них используют графические формулы. Составлять такие формулы для молекул кислот с общей формулой очень просто. Покажем, как это сделать для молекулы кислоты, которая состоит из атомов трех элементов, а также для ее кислотного остатка.
Пример №
Составить графические формулы молекулы кислоты и ее кислотного остатка.
Решение
Способ 1. Мы только что выяснили, что элемент Сульфур в кислоте шестивалентен. Записываем вокруг кислотообразующего атома 6 черточек:
Все эти черточки (единицы валентности) должны также «принадлежать» 4-м двухвалентным атомам Оксигена. Размещаем атомы Оксигена вокруг атома Сульфура. Двум атомам Оксигена «выделяем» по две черточки, а для двух других остается по одной:
черточке (Оксиген — двухвалентный элемент). Записываем эти черточки и получаем графическую формулу кислотного остатка
Из этой формулы видно, что остаток кислоты двухвалентен. Дописываем слева и справа по атому Гидрогена и получаем графическую формулу молекулы кислоты
Способ 2. Записываем химическую формулу соединения, выделив в ней группы атомов (гидроксильные группы):
Гидроксильная группа одновалентна: Соединяем черточкой каждую группу с атомом Сульфура:
Поскольку атом Сульфура шестивалентный, размещаем вокруг него еще четыре черточки и к каждой их паре записываем по атому Оксигена:
Классификация кислотКислоты отличаются друг от друга. Их делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
Их делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
Существуют безоксигеновые и оксигенсодержащие кислоты. Названия этих групп кислот указывают на отсутствие или наличие в молекулах соединений атомов Оксигена.
Примеры кислот каждой группы:
Безоксигеновых кислот известно немного. Их общая формула — Это не чистые вещества, а водные растворы газообразных соединений некоторых неметаллических элементов с Гидрогеном:
Оксигенсодержащих кислот намного больше. Они имеют общую формулу
Другой признак для классификации кислот — количество атомов Гидрогена в молекуле соединения. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты, а также несколько кислот с более высокой основностью. Примеры кислот соответствующих групп:
По химической активности кислоты делят на сильные и слабые. Сильные кислоты, в отличие от слабых, активно взаимодействуют со многими веществами. Известны также несколько кислот средней силы. Примеры кислот различной активности (см. также форзац 2):
Известны также несколько кислот средней силы. Примеры кислот различной активности (см. также форзац 2):
Кислоты имеют химические и тривиальные названия. Формулы и названия важнейших кислот указаны в таблице 1.
Это интересно. Цианидная кислота HCN — безоксигеновая кислота, образованная тремя элементами. Она является сильным ядом.
Химические названия кислот состоят из двух слов. Второе слово во всех названиях — кислота. Корень первого слова происходит от названия элемента, который образует кислоту (хлоридная кислота — соединение Хлора). Первое слово названия безоксигеновой кислоты имеет суффикс «ид» ( — сульфидная кислота). Для оксигенсодержащей кислоты это слово может иметь разные суффиксы. Если кислотообразующий элемент проявляет в соединении наивысшую валентность, то используют суффикс «ат» — сульфатная кислота), а если низшую — «ит» — сульфитная кислота). В химических названиях кислот есть еще и приставки «мета», «орто» (табл. 1).
1).
Тривиальные названия большинства кислот происходят от названий простых веществ или соединений элементов с Гидрогеном.
Кислота кислотный оксид. Для каждой оксигенсодержащей кислоты существует оксид. Его называют кислотным оксидом. Значение валентности кислотообразующего элемента в кислоте и в соответствующем оксиде — одно и то же:
Распространенность в природеНа нашей планете встречается немало кислот. Карбонатная кислота образуется в результате растворения в природной воде углекислого газа Во время извержений вулканов в атмосферу поступают сероводород и сернистый газ Первое соединение, растворяясь в воде, образует сульфидную кислоту, а второе, реагируя с водой, — сульфитную.
Растительный и животный мир богат на кислоты, которые принадлежат к органическим соединениям. Лимонная, яблочная, щавелевая кислоты содержатся в некоторых фруктах, ягодах, овощах (рис. 11), муравьиная кислота — в муравьях (поэтому их укусы ощутимы), пчелином яде, крапиве. При скисании молока, вина, фруктовых и ягодных соков образуются соответственно молочная и уксусная кислоты. Молочная кислота содержится также в квашеной капусте, силосе для скота; она накапливается в мышцах во время их работы. В желудочном соке есть неорганическая кислота — хлоридная.
11), муравьиная кислота — в муравьях (поэтому их укусы ощутимы), пчелином яде, крапиве. При скисании молока, вина, фруктовых и ягодных соков образуются соответственно молочная и уксусная кислоты. Молочная кислота содержится также в квашеной капусте, силосе для скота; она накапливается в мышцах во время их работы. В желудочном соке есть неорганическая кислота — хлоридная.
Выводы:
Кислота — соединение,молекула которого содержит один или несколько атомов Гидрогена, способных в результате реакций замещаться на атомы металлического элемента. Для кислот существуют две общие формулы — и
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком.
Все кислоты имеют молекулярное строение.
Существуют безоксигеновые и оксигенсодержащие кислоты. По количеству атомов Гидрогена в молекуле различают одноосновные, двухосновные, трехосновные кислоты, а по химической активности — сильные и слабые.
Каждой оксигенсодержащей кислоте соответствует оксид, который называют кислотным. В оксиде и кислоте значение валентности кислотообразующего элемента одно и то же.
В оксиде и кислоте значение валентности кислотообразующего элемента одно и то же.
Кислоты имеют химические и тривиальные названия.
Кислоты распространены в природе.
Свойства и применение кислотФизические свойства кислот: Молекулярное строение кислот обусловливает их физические свойства. Молекулы в кислоте притягиваются друг к другу слабо (в отличие от противоположно заряженных ионов в основном оксиде или основании). Поэтому кислоты имеют низкие температуры плавления, почти все в обычных условиях являются жидкостями. Они растворяются в воде (кроме кислоты ), во многих случаях — неограниченно, т. е. смешиваются с водой в любых соотношениях с образованием растворов. При растворении некоторых кислот выделяется значительное количество теплоты (рис. 24).
Вам известно, что безоксигеновые кислоты представляют собой водные растворы газов — соединений некоторых неметаллических элементов с Гидрогеном (например, ). Эти газы выделяются из своих растворов даже в обычных условиях.
Летучей кислотой, т. е. такой, которая переходит в газообразное состояние при умеренном нагревании, является нитратная кислота а также несколько других. Летучие кислоты имеют запах.
Ортофосфатная кислота ортоборатная (борная) метасиликатная 3 — твердые вещества. Они, а также сульфатная кислота нелетучи.
Карбонатная и сульфитная кислоты существуют лишь в водном растворе. Соответствующие им оксиды взаимодействуют с водой не полностью, а кислоты, которые образуются, частично разлагаются на оксиды и воду:
Большинство кислот токсичны. Они вызывают серьезные отравления, ожоги кожи. Поэтому работать с кислотами надо очень осторожно, соблюдая правила техники безопасности. При попадании раствора кислоты на руку следует сначала смыть его проточной водой, затем обработать кожу разбавленным раствором соды (для удаления остатков кислоты) и хорошо промыть руку водой.
Химические свойства кислот: Способность кислот реагировать с другими веществами в значительной мере зависит от их устойчивости, летучести, растворимости в воде. Это необходимо учитывать, рассматривая химические свойства кислот.
Это необходимо учитывать, рассматривая химические свойства кислот.
Действие па индикаторы: Кислоты в водных растворах изменяют окраску индикаторов (рис. 25), но не всех и не так, как щелочи.
Большинство известных вам кислот реагируют с металлами с выделением водорода и образованием солей (рис. 26). Среди них — все безоксигеновые кислоты, сульфатная (в разбавленном растворе):
В этих реакциях атомы металлического элемента, которые содержатся в простом веществе, замещают атомы другого элемента (Гидрогена) в сложном веществе.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
С названными кислотами взаимодействуют не все металлы. Возможность осуществления реакции между металлом и кислотой можно определить, используя ряд активности металлов. Его составил отечественный химик Н. Н. Бекетов на основании результатов изучения многих реакций металлов с кислотами и солями. Приводим большую часть этого ряда в современном виде (см. также форзац 2):
Н. Бекетов на основании результатов изучения многих реакций металлов с кислотами и солями. Приводим большую часть этого ряда в современном виде (см. также форзац 2):
Формула неметалла водорода делит ряд на две части. Металлы, размещенные в левой части ряда, взаимодействуют с названными выше кислотами (при этом выделяется водород), а размещенные справа — не реагируют с ними (рис. 27):
Николай Николаевич Бекетов (1827—1911)
Выдающийся русский и украинский химик, академик Петербургской академии наук. Исследовал реакции солей с металлами и водородом в водных растворах. Предложил вытеснительный ряд, или ряд активности металлов (1865). Дал формулировку закона действующих масс, сходную с современной. Открыл и описал металлотермию — один из методов получения металлов. Проводил термохимические исследования. Содействовал становлению физической химии — одной из важнейших химических наук. Работал профессором в Харьковском университете (1855—1887), впервые читал курс лекций по физической химии как самостоятельной научной дисциплине. Был президентом Русского физико-химического общества.
Был президентом Русского физико-химического общества.
Во время реакций нитратной, а также концентрированного раствора сульфатной кислоты с металлами вместо водорода образуются другие вещества (рис. 28).
Реакции с основными оксидами и основаниямиХарактерным свойством всех кислот является способность взаимодействовать с соединениями противоположного типа — основными оксидами и основаниями. Продуктами каждой реакции являются соль и вода. Эти химические превращения были рассмотрены в предыдущих параграфах. Примеры соответствующих химических уравнений:
Реакции с солямиРеакции кислот с солями относят к реакциям обмена. Не все они возможны. Назовем случаи, когда эти реакции происходят (рис. 29).
• Продукт реакции — соль или кислота — выпадает в осадок (это выясняем по таблице растворимости):
• Кислота-продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа:
(Сокращение «тв» означает «твердое вещество >>, а «конц» — «концентрированный раствор». )
)
• Кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, — слабой. Примерами могут служить три последние реакции.
Оксигенсодержащие кислоты при нагревании, а карбонатная и сульфитная — в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды:
Одним из продуктов разложения сульфатной кислоты при умеренном нагревании является сульфур(VI) оксид, а при сильном нагревании этот оксид сам начинает разлагаться:
Реакция термического разложения нитратной кислоты имеет свою особенность. Это соединение разлагается на три вещества — нитроген(VI) оксид, кислород и воду (оксид соответствующий нитратной кислоте, весьма неустойчив):
Изложенный материал обобщен в схеме 3.
Схема 3. Химические свойства кислот
Применение кислот:
Наибольшее применение получили сульфатная, хлоридная, нитратная и ортофосфатная кислоты (табл. 4). Их получают на химических заводах в большом количестве.
4). Их получают на химических заводах в большом количестве.
Наверное, в каждой семье в домашнем хозяйстве есть уксус. Это — разбавленный водный раствор уксусной кислоты
(Подготовьте рассказ о том, для чего используют уксус.) В быту, повседневной жизни применяются и другие кислоты. Лимонная кислота является пищевым продуктом и консервантом, аскорбиновая — витамином С. (Уксусная, лимонная и аскорбиновая кислоты — органические соединения.) Раствор борной кислоты применяют как дезинфицирующее средство, а раствор сульфатной кислоты заливают в аккумуляторы автомобилей.
Выводы:
Кислоты — молекулярные вещества, растворимые в воде. Они изменяют окраску индикаторов, но не так, как щелочи.
Кислоты взаимодействуют с большинством металлов с выделением водорода и образованием солей. Такие реакции называют реакциями замещения. Возможность их осуществления определяют с помощью ряда активности металлов.
Кислоты реагируют с основными оксидами и основаниями с образованием солей и воды, а также с солями (продукты реакции — другие кислота и соль). Оксигенсодержащие кислоты разлагаются при нагревании.
Оксигенсодержащие кислоты разлагаются при нагревании.
Кислоты находят широкое применение в различных сферах.
Способы получения кислотПрежде чем выбрать способ получения кислоты, нужно выяснить, безоксигеновой или оксигенсодержащей она является, а также — сильной или слабой, летучей или нелетучей, растворимой или нерастворимой в воде.
Реакция между водородом и неметалломЭто способ получения безоксигеновых кислот:
Продукты таких реакций — хлороводород, сероводород, другие газообразные соединения неметаллических элементов VI или VII группы с Гидрогеном — растворяют в воде и получают кислоты.
На взаимодействии хлора с водородом основано промышленное производство хлоридной кислоты.
Реакция между кислотным оксидом и водойТакую реакцию используют для получения оксигенсодержащих кислот:
Первая реакция происходит на завершающей стадии производства сульфатной кислоты. Осуществлять аналогичную реакцию между оксидом и водой для промышленного получения нитратной кислоты нецелесообразно, так как этот оксид неустойчив. Исходным веществом служит нитроген(IV) оксид:
Осуществлять аналогичную реакцию между оксидом и водой для промышленного получения нитратной кислоты нецелесообразно, так как этот оксид неустойчив. Исходным веществом служит нитроген(IV) оксид:
На этой реакции основан общий способ получения кислот — и безоксигеновых, и оксигенсодержащих. Продуктами являются другие соль и кислота.
Такую реакцию обмена можно осуществить с использованием растворов соли и кислоты, если удовлетворяется одно из двух условий:
• продукт реакции — новая соль или новая кислота — нерастворим в воде (это определяем по таблице растворимости):
• кислота, которую нужно получить, является слабой, а кислота, которая вступает в реакцию, — сильной (соответствующая информация помещена в §7):
Для получения сильной и летучей кислоты (в том числе и безоксигеновой) реакцию проводят не в растворе, а между твердой солью и нелетучей кислотой. Взаимодействию веществ способствует нагревание:
Пример №
Можно ли получить хлоридную кислоту с помощью реакции между калий хлоридом и сульфатной кислотой? Если да, то в каких условиях?
Решение
Продуктами реакции должны быть новые соль и кислота:
По таблице растворимости определяем, что все соединения растворимы в воде.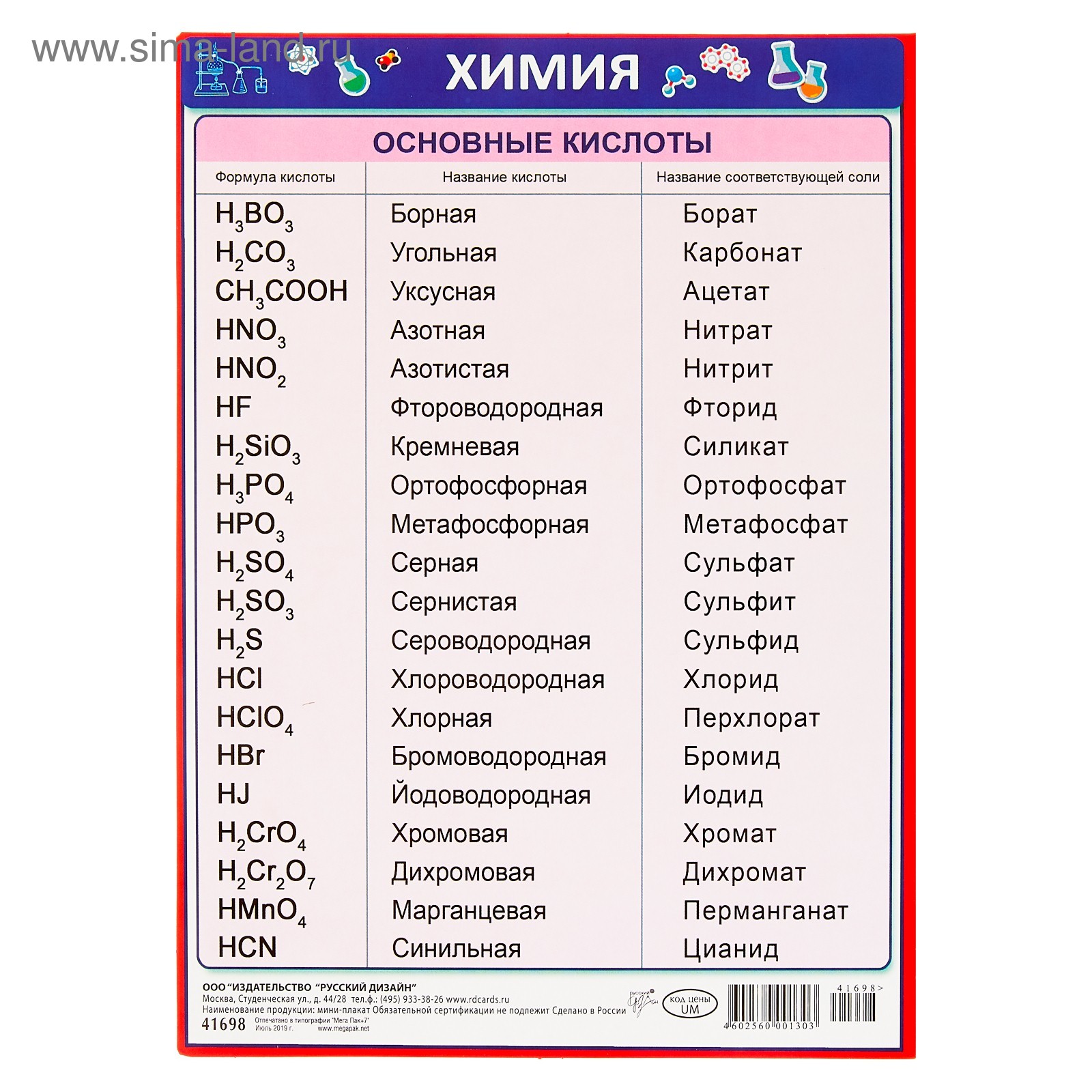 Сульфатная и хлоридная кислоты — сильные, но отличаются по физическим свойствам: первая — нелетучая, а вторая — летучая (это водный раствор газа хлороводорода).
Сульфатная и хлоридная кислоты — сильные, но отличаются по физическим свойствам: первая — нелетучая, а вторая — летучая (это водный раствор газа хлороводорода).
Реакцию можно осуществить только в отсутствие воды. Тогда хлороводород будет выделяться из реакционной смеси.
Итак, для получения хлороводорода и хлоридной кислоты нужно взять твердый калий хлорид и чистую сульфатную кислоту или ее концентрированный раствор. Чтобы ускорить взаимодействие твердого и жидкого веществ, необходимо нагревание (в растворе реакции обмена происходят мгновенно).
Запишем соответствующее химическое уравнение, указав условия осуществления реакции (рис. 41):
Изложенное обобщено в схеме 8.
Выводы:
Безоксигеновые кислоты получают с помощью реакций водорода с неметаллами с последующим растворением продуктов в воде.
Оксигенсодержащие кислоты получают взаимодействием кислотных оксидов с водой. Общий метод получения кислот основан на реакции обмена между солью и кислотой.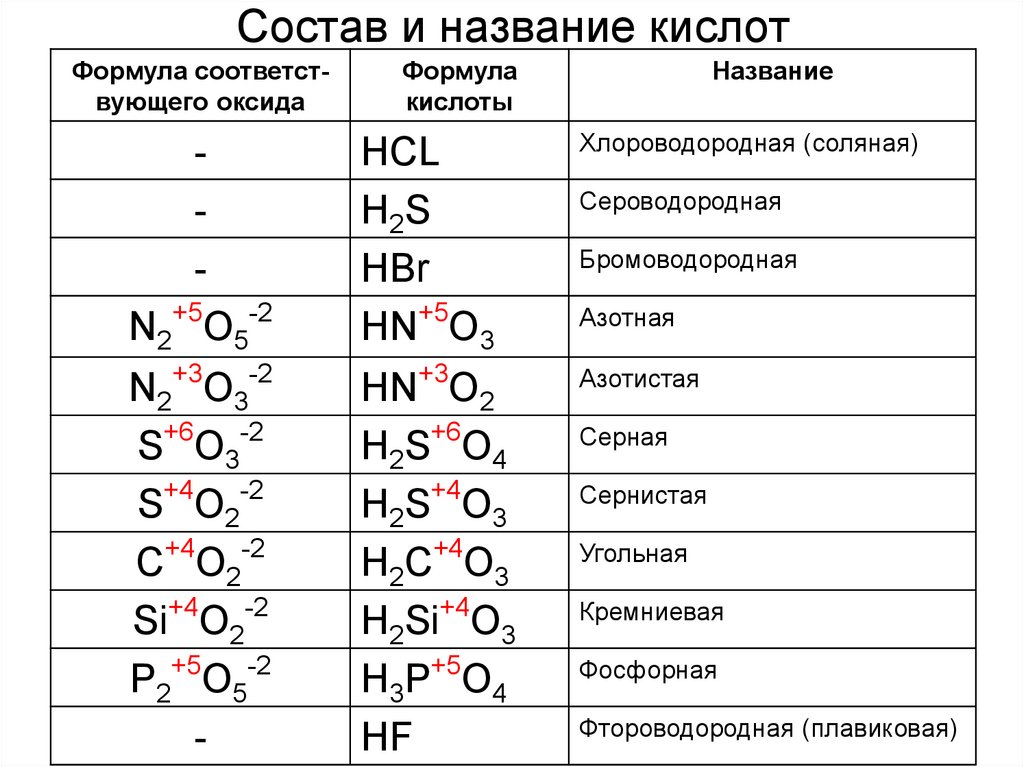
Классификация кислот
Ваших знаний о кислотах вполне достаточно, чтобы рассмотреть классификацию соединений этого класса. Прежде всего существуют кислоты, кислотные остатки которых содержат кислород, а есть кислотные остатки без атомов кислорода. Это дало возможность разделить кислоты на кислородсодержащие (например: и бескислородные (например:
Кроме того, в составе молекул разных кислот может быть неодинаковое число атомов водорода, которые в реакциях с основаниями замещаются металлическим элементом. Это дало возможность классифицировать кислоты на одноосновные и многоосновные. (Подумайте и приведите примеры одноосновных и многоосновных кислот.)
Химические свойства кислотКислоты проявляют достаточно высокую химическую активность с металлами, оксидами металлов, гидроксидами, а во многих случаях и солями. При этом кислотный остаток выступает единым целым и в неизменном виде переходит из состава кислоты в состав образовавшейся соли.
Обобщим известные вам свойства кислот и дополним их новыми.
Действие растворов кислот на индикаторыКак индикаторы кислой среды используются: лакмус (водный раствор), метиловый оранжевый (водный раствор), лакмусовые и универсальные бумажные индикаторы. Последние изготавливают способом пропитки специальной бумаги не одним, а несколькими чувствительными к кислой и щелочной средам веществами. Поэтому ими можно сразу обнаружить обе среды.
Ранее вы узнали о таком индикаторе, как фенолфталеин. Обратите внимание — это вещество не является индикатором кислой среды. Как известно, лакмус и метиловый оранжевый (метилоранж) в кислой среде имеют розово-красный цвет, универсальный индикатор — от оранжевого до темно-красного (зависит от содержания кислоты в растворе — если кислота очень разбавлена, то цвет оранжевый, если в растворе содержимое кислоты значительное, то — темно-красный или близкий к нему).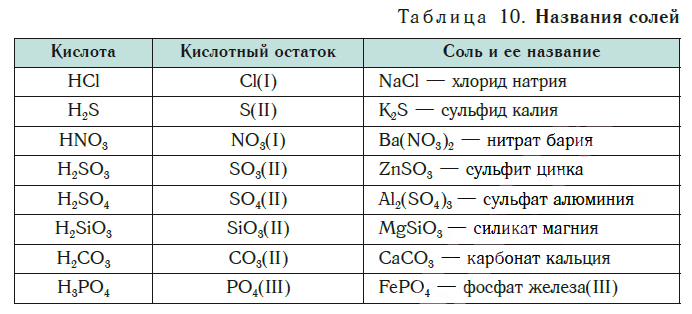
Заметим, что на индикаторы действуют, изменяя их цвет, лишь водные растворы кислот.
Взаимодействие кислот с металламиВы уже знакомы с опытами, которые подтверждают, что металлы, размешенные в вытеснительном ряду до водорода, замещают водород в молекулах кислот, в результате чего образуется соль и выделяется газообразное вещество водород. Тогда как металлы, размещенные в вытеснительном ряду после водорода, не замещают водород в молекулах кислот (вспомните, что азотная кислота является исключением):
В 7 классе вы узнали о реакциях замещения. Взаимодействие металлов с кислотами относится к этому типу реакций, ведь атомы металла, то есть простого вещества, замещают атомы водорода в молекуле кислоты, которая относится к сложным веществам.
Реакции замещения — это реакции, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Схематически это можно записать так:
Взаимодействие кислот с оксидами металловКислоты взаимодействуют с оксидами металлов (как с основными, так и с амфотерными), независимо от места расположения металла в вытеснительном ряду.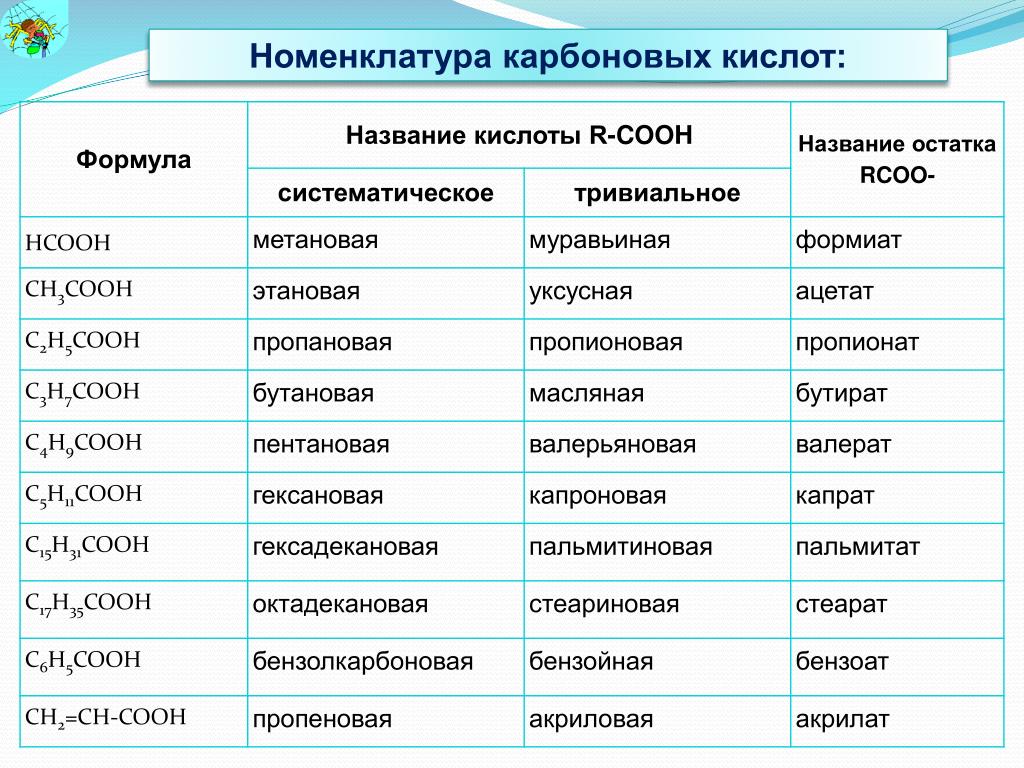 В результате взаимодействия образуются соль и вода:
В результате взаимодействия образуются соль и вода:
К какому типу реакций относится это взаимодействие?
Из уравнений реакций видно, что простых веществ нет, есть лишь сложные, которые при реакции обменялись своими составными частями. Следовательно, взаимодействие кислот с оксидами металлов относится к реакциям обмена.
Взаимодействие кислот с основаниямиИсследуем это взаимодействие, поскольку его вы еще не изучали.
Опыт 1. Нальем в химический стакан раствор гидроксида натрия и измерим его температуру. Прибавим к нему соляной кислоты (вполне понятно, что до реакции ее температура равна температуре раствора щелочи и температуре воздуха в комнате).
Видимых внешне изменений не наблюдается. Но измерив температуру раствора в химическом стакане, видим, что она возросла. То есть выделилось тепло, а это является одним из признаков химической реакции.
Запишем уравнение наблюдаемого химического явления:
Опыт 2. Нальем в химический стакан раствор гидроксида калия и капнем несколько капель фенолфталеина (рис. 9, а). Раствор сразу стал малиновым. В закрепленной в штативе бюретке (рис. 9, б), наполненной раствором серной кислоты, откроем кран настолько, чтобы кислота не лилась струей, а падала отдельными каплями в стакан со щелочью, и понаблюдаем за тем, что будет происходить в стакане с гидроксидом калия. Вскоре отметим, что первоначальная ярко-малиновая окраска раствора в стакане становится менее яркой, а затем и вовсе исчезает.
Нальем в химический стакан раствор гидроксида калия и капнем несколько капель фенолфталеина (рис. 9, а). Раствор сразу стал малиновым. В закрепленной в штативе бюретке (рис. 9, б), наполненной раствором серной кислоты, откроем кран настолько, чтобы кислота не лилась струей, а падала отдельными каплями в стакан со щелочью, и понаблюдаем за тем, что будет происходить в стакане с гидроксидом калия. Вскоре отметим, что первоначальная ярко-малиновая окраска раствора в стакане становится менее яркой, а затем и вовсе исчезает.
Это доказывает, что щелочи в стакане не осталось. Запишем уравнение реакции и выясним, какие вещества образовались из гидроксида калия и серной кислоты:
Как и в первом опыте, щелочь и кислота обменялись составными частями, о чем свидетельствуют продукты реакции — сложные вещества соль и вода. Следовательно, реакции между основаниями и кислотами относятся к реакциям обмена.
До сих пор для проведения опытов мы использовали растворимые в воде основания — щелочи. Реагируют ли кислоты с нерастворимыми основаниями? Выясним это опытным путем.
Реагируют ли кислоты с нерастворимыми основаниями? Выясним это опытным путем.
Опыт 3. В две пробирки поместим немного гидроксида меди — твердого вещества голубого цвета. К одной дольем 2—3 мл воды, а ко второй — столько же серной кислоты. Содержимое обеих пробирок подогреем. В пробирке с основанием и водой изменения не происходят, а в пробирке с основанием и кислотой раствор стал синего цвета. Появление окраски — признак химического явления:
Опытным путем мы установили, что кислоты вступают в реакцию обмена как с растворимыми основаниями (щелочами), так и с нерастворимыми.
Реакция между кислотой и основанием с образованием соли и волы называется реакцией нейтрализации.
«Нейтральный» значит — тот, который не принадлежит ни одному ни другому. Относительно реакции кислот с основаниями это означает, что после реакции не остается ни кислой, ни щелочной среды, а она становится нейтральной.
Взаимодействие кислот с солямиКислоты взаимодействуют с солями, если среди продуктов реакции есть осадок или газ.
Опыт 4. В химический стакан нальем серной кислоты и прибавим раствор нитрата бария. Сразу же наблюдаем образование белого осадка. Запишем уравнение реакции и выясним, какой из продуктов реакции образовал осадок:
Соляная кислота не может быть осадком, а следовательно, в осадке находится сульфат бария. Проверим наше предположение по таблице растворимости солей, кислот и оснований в воде. Действительно, сульфат бария — это нерастворимая соль.
Опыт 5. В химический стакан положим кусочек мела и дольем азотной кислоты. Сразу же начинается реакция, которая сопровождается выделением газообразного вещества. (Какое это вещество?) Поскольку карбонат кальция — соль угольной кислоты, а ей отвечает оксид углерода можем предположить, что выделяется именно этот оксид. Соляная кислота содержит атомы водорода, из них может образоваться водород. Поэтому проведем качественное определение газа, который выделяется. Поднесенная к отверстию химического стакана спичка сразу же гаснет, и этот процесс не сопровождается приглушенным хлопком. Следовательно, выделяется углекислый газ. Запишем уравнение реакции:
Следовательно, выделяется углекислый газ. Запишем уравнение реакции:
Рассмотрите уравнения реакций, которые происходили в опытах 4 и 5, и сделайте вывод, к какому типу реакций они относятся.
Итоги:
- Классификация кислот.
- Общие свойства кислот:
- В реакциях обмена кислотный остаток кислот переходит из состава кислоты в состав соли как единое целое.
В отличие от растворов других кислот, азотная кислота взаимодействует почти со всеми металлами, за исключением золота, платины. При этом образуется не два, а три продукта реакции. Для всех реакций общим является образование соли и воды. Что же касается третьего вещества, то в зависимости от активности металла и содержания кислоты в растворе это могут быть оксиды азота с разной его валентностью простое вещество азот или аммиак Например:
Характерно, что растворы со значительным содержимым азотной кислоты (свыше 60 %) не взаимодействуют с железом. Поэтому по железной дороге такую кислоту транспортируют в стальных цистернах.
Поэтому по железной дороге такую кислоту транспортируют в стальных цистернах.
Получение соляной кислоты и ее свойства
Изучая свойства оксидов, вы выяснили, что кислотные оксиды (за некоторым исключением, в частности оксид кремния вступают в реакцию соединения с водой и образуют кислоты:
Но все это — кислородсодержащие кислоты. А как получают бескислородные кислоты, например соляную? Способы ее получения в промышленности и в лаборатории разные. Рассмотрим их.
Вы, наверное, обратили внимание, что в тексте учебника ни разу не было написано «раствор соляной кислоты», потому что эта кислота является ничем иным, как раствором газообразного хлорида водорода (хлороводорода) в воде. Поэтому, чтобы получить соляную кислоту, нужны хлороводород и вода-раство-ритель.
В промышленности хлороводород получают в специально построенных печах синтеза (от гр. синтез — составление, соединение), где происходит реакция соединения водорода с хлором, сопровождающаяся выделением света и тепла (вспомните, какое общее название имеют реакции с такими признаками):
Полученный таким способом газ растворяют в воде (точнее — в соляной кислоте с низким содержанием хлороводорода).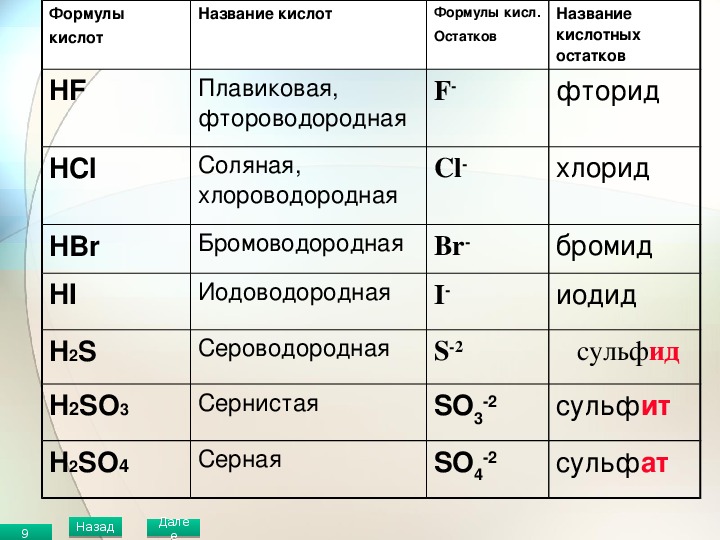 Благодаря высокой растворимости хлороводорода в воде удается получить соляную кислоту с содержанием этого газа до 40 % по массе.
Благодаря высокой растворимости хлороводорода в воде удается получить соляную кислоту с содержанием этого газа до 40 % по массе.
Существует лабораторный способ получения соляной кислоты. Получают ее в приборе, изображенном на рисунке 10, из твердой кристаллической соли хлорида натрия, действуя на нее раствором серной кислоты с высоким содержанием (60— 70 %) растворенного вещества. Такие растворы называют концентрированными. Растворы с низким содержанием растворенного вещества получили название разбавленных.
Реакцию проводят при нагревании:
Опыт 1. Заполним 1/4 объема пробирки хлоридом натрия и добавим серной кислоты столько, чтобы она смочила соль. Поскольку хлороводород — газообразное вещество, то благодаря нагреванию его молекулы активно двигаются, оставляют сосуд, где они образовались, и по газоотводной трубке попадают в пробирку, заполненную на 1/3 водой.
Обратите внимание, прибор собран так, что конец газоотводной трубки не касается воды. Поскольку тяжелее воздуха и воды, он направляется в сосуд с водой и растворяется в ней (видно, как образованная кислота струится вниз).
Поскольку тяжелее воздуха и воды, он направляется в сосуд с водой и растворяется в ней (видно, как образованная кислота струится вниз).
Хлороводород хорошо растворяется в воде, поэтому можно быстро получить соляную кислоту, необходимую для проведения последующих опытов.
Опыт 2. Отольем немного полученного раствора хлороводо-рода в чистую пробирку и испытаем его на наличие кислой среды с помощью индикатора, например метилового оранжевого. Раствор приобретает розовую окраску.
Воспользуемся полученной соляной кислотой для последующих опытов.
Опыт 3. К пробирке с кислотой и индикатором прибавим щелочь. Розовая окраска раствора изменяется на оранжевую. Следовательно, произошла нейтрализация кислоты щелочью:
Опыт 4. Поместим в пробирку немного карбоната натрия и прибавим к нему часть полученной соляной кислоты. Активное выделение газа свидетельствует о химическом явлении. Поднесенная к отверстию пробирки спичка гаснет. Следовательно, выделяется углекислый газ:
Опыт 5. К остальной кислоте прибавим раствор нитрата серебра Сразу же образуется белый творожистый осадок (подобный скипевшемуся молоку):
К остальной кислоте прибавим раствор нитрата серебра Сразу же образуется белый творожистый осадок (подобный скипевшемуся молоку):
Образованный осадок не растворяется в воде и не взаимодействует с другими кислотами. На основании проведенных наблюдений делаем вывод.
С помощью раствора нитрата серебра можно отличить соляную кислоту от других кислот.
Взаимодействие соляной кислоты с металлами исследуйте самостоятельно, выполнив в классе лабораторный опыт 2, описанный в рубрике «Страница естествоиспытателя».
По рисункам 11 и 12 узнайте о распространенности кислот в природе и их применении.
- — производство химических волокон, взрывчатых веществ, удобрений, моющих средств, красок, лекарственных препаратов, эфиров, сульфатов; в гальванических элементах и аккумуляторах.
- — травление, паяние металлов, получение хлоридов, добыча металлов из руд
- — производство удобрений, взрывчатых веществ, целлюлозы, получение разных солей
- — получение ортофосфатов; изготовление полировочных смесей, катализаторов, лекарственных средств, безалкогольных напитков
Итоги:
- Соляная кислота — одноосновная бескислородная кислота, которая проявляет все общие свойства кислот.

- В промышленности соляную кислоту получают из водорода и хлора, растворяя образовавшийся газообразный продукт реакции хлороводород в воде.
- В лаборатории соляную кислоту получают взаимодействием кристаллического хлорида натрия и концентрированной серной кислоты.
- Наличие соляной кислоты можно обнаружить не только с помощью индикаторов, но и добавлением раствора нитрата серебра. Образуется нерастворимый в воде и других кислотах творожистый осадок белого цвета — хлорид серебра
В XV ст. кислота состава поражала воображение алхимиков тем, что дымила на воздухе, обжигала язык, вызывала кашель, разъедала металлы и разрушала ткани. Называли ее в ту пору «кислым спиртом». В XVII ст. бытовало другое, достаточно необычное название — «дух из солей». Происхождение названия легко объясняется. Дело в том, что кислоту тогда получали способом, которым мы сегодня получили ее в лаборатории, — из хлорида натрия и концентрированной серной кислоты. Кстати, этот способ, как промышленный, продержался с конца XVII в. до 60-х годов XX века.
до 60-х годов XX века.
Бескислородные и кислородсодержащие кислоты получают соединением простых и сложных веществ.
1. При получении бескислородных кислот водород взаимодействует с неметаллом, а полученное газообразное вещество растворяется в воде:
2. Кислородсодержащие кислоты образуются в результате взаимодействия кислотного оксида и воды:
Классификация| Кислота | Название кислоты | Кислотный остаток | Валентность кислотного остатка |
| H3PO4 | ? | ? | ? |
| ? | ? | ? | |
| ? | Метакремниевая кислота | ? | ? |
Какие кислоты вы знаете? Приведите примеры кислотных остатков. Какие методы получения кислот вы знаете?
В VII классе при изучении темы водорода вы ознакомились с некоторыми представителями кислот (соляная и серная кислоты). Теперь же вы более подробно ознакомитесь со всеми представителями кислот.
Теперь же вы более подробно ознакомитесь со всеми представителями кислот.
Классификация: Атомы или группы атомов, соединенные с водородом в молекулах кислот, называются кислотными остатками. Заряд кислотного остатка всегда отрицательный ( ) и по своему числовому значению он равен основности кислоты.
Кислоты классифицируются по составу, основности и по силе.
Активность кислот определяется степенью концентрации ионов водорода, образовавшихся в их водных растворах (моль/л).
Число атомов водорода, способных замещаться атомами металла в молекуле кислоты, показывает основность кислоты и соответствует валентности кислотного остатка.
Количество атомов водорода, соединенных с атомом кислорода в кислородсодержащих кислотах, и количество атомов водорода, соединенных с атомами неметаллов в бескислородных кислотах, соответствует основности кислоты.
НоменклатураНазвания кислот заимствованы из латинского названия образующих их неметаллов. В бескислородных кислотах к окончанию названий элементов, образующих кислоты, добавляется суффикс «ид». Если в кислородсодержащих кислотах элемент, образующий кислоту, обладает высокой валентностью, то к его окончанию добавляется суффикс «ат», а если средней валентностью то суффикс «ит».
В бескислородных кислотах к окончанию названий элементов, образующих кислоты, добавляется суффикс «ид». Если в кислородсодержащих кислотах элемент, образующий кислоту, обладает высокой валентностью, то к его окончанию добавляется суффикс «ат», а если средней валентностью то суффикс «ит».
| сульфид (сероводородная кислота) | сульфит (сернистая кислота) | сульфат (серная кислота) |
Если кислотообразующий элемент образует несколько кислот с одинаковой валентностью (степенью окисления), то к началу названия кислоты, у которой к одному атому данного элемента присоединено наибольшее количество атомов кислорода, добавляется приставка «орто», а при наименьшем количестве атомов кислорода приставка «мета». К названию же кислородсодержащих кислот, полученных путем нагревания этих кислот, добавляется приставка «пиро».
| метафосфорная кислота | пирофосфорная кислота | ортофосфорная кислота |
| IP 3O | IP 3,5O | IP 4O |
При образовании элементами более двух кислородсодержащих кислот пользуются названиями с добавлением суффиксов -н-, -ат-, -новат-, -ист-, -новагист-.
хлорноватистая кислота | хлористая кислота | хлорноватая кислота | хлорная кислота |
Последовательность расположения элементов в молекулах кислот можно проследить по их графическим формулам.
угольная кислота | серная кислота | ортофосфорная кислота | хлорная кислота |
Линии между атомами в этих формулах выражают валентность элементов.
При непосредственном взаимодействии неметаллов с водородом
| H2 + F2 → 2HF | H2 +Cl2 2НС1 |
| H2 +Br2 2HBr | H2 + I2 — 2HI |
Кислотные оксиды, непосредственно взаимодействуя с водой, образуют соответствующую кислоту. SiO2 не вступает в реакцию с водой.
SO3 +H2O→ H2SO4 CO2 + H2O → H2CO3
При вступлении в реакцию с водой NO2 и P2Os, в зависимости от условий, образуются различные продукты.
При взаимодействии солей с кислотами
Наиболее часто применяемый способ получения кислот взаимодействие солей с кислотами.
органические кислоты, H2CO3, H2S, H2SiO3
В этом ряду каждая кислота вытесняет из солей следующую за ней кислоту. Поскольку HCl, HNO3, Н3РО4 одинаково сильные кислоты, они не вытесняют друг друга.
Поскольку HCl, HNO3, Н3РО4 одинаково сильные кислоты, они не вытесняют друг друга.
При получении кислот подобным способом исходные вещества соль должна быть в твёрдом состоянии, а кислота более концентрированной и малолетучей. Серная кислота более сильная и малолетучая. Вот почему обычно при получении других кислот используют именно эту кислоту
2NaCl(тв.) + H2SO4(конц.) Na2SO4 + 2HC1↑
Ca3(PO4)2(тв.) + 3H2SO4(конц.) 3CaSO4↓ + 2H3PO4
Физические и химические свойства кислотОпределите типы химических реакций.
На основе какого правила был составлен ряд активности металлов? В получении какого простого вещества применяется реакция металлов с разбавленными кислотами (кромеразбавленного HNO3)?
Физические свойства:
По своему агрегатному состоянию кислоты классифицируются следующим образом. Кислоты хорошо растворяются в воде (кроме мегакремниевой кислоты).
Кислоты хорошо растворяются в воде (кроме мегакремниевой кислоты).
Водные растворы газообразных хлорида водорода (хлороводорода), бромида водорода (бромоводорода) и йодида водорода (йодоводорода) образуют соответствующие кислоты. Водные растворы кислот имеют кислый вкус. Кислоты, как и щелочи, меняют цвет индикаторов.
| Кислый вкус ряда употребляемых нами плодов (яблок, алычи, лимона и др.) и ягод объясняется наличием в их составе органических кислот. Зачастую эти кислоты носят названия тех плодов, в составе которых они содержатся. Например, яблочная кислота, лимонная кислота и др. |
При хранении в открытом сосуде неустойчивых кислот (HNO3, H2CO3, H2SO3 и др.), а также кислот, полученных при растворении газов, их масса уменьшается или в результате разложения, или же за счет выделения газа из раствора. При хранении в отрытом сосуде растворов гигроскопических (водопоглощающих) кислот (например, H2SO4 (конц. ) ,) их масса увеличивается.
) ,) их масса увеличивается.
Возьмите четыре пробирки. Поместите в каждую из пробирок по отдельному куску металлов Mg, Zn, Fe u Си и добавьте к ним немного 20% него раствора соляной кислоты. Что вы наблюдаете? Запишите уравнения реакций. |
В результате изучения взаимодействия кислот с металлами был составлен ряд активности металлов.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Химическая активность уменьшается
C уменьшением активности металлов уменьшается и скорость протекания их реакций с одной и той же кислотой. Металлы, расположенные в ряду активности до водорода, при вступлении в реакцию с разбавленными кислотами (кроме разбавленной HNО3) вытесняют из них водород. А металлы, расположенные в ряду активности после водорода, не вступают в реакцию с разбавленными кислотами (кроме разбавленной HNO3).
Cu + H2SO4(разб.) реакция не протекает Fe + H2SO4(разб.) → FeSO4 + H2 ↑
Взаимодействие кислот с неметаллами
C+4HNO3(конц.) CO2 +4NO2 + 2H2O
ЗР + SHNO3(конц.) + 2H2O ЗН3PO4 + 5NO
Взаимодействие кислот с аммиаком. Кислоты вступают с аммиаком в реакцию соединения. При вступлении в реакцию одноосновных кислот с аммиаком, независимо от соотношения молей, всегда получается нормальная соль.
NH3+ HNO3→ NH4NO3
В результате реакции соединения многоосновных кислот с аммиаком, в зависимости от соотношения молей, образуются разные соли.
2NH3 +H2SO4 → (NH4)2SO4
Разложение кислот. Некоторые кислоты разлагаются с выделением воды.
H2SiO3SiO2+ H2O
Кислоты
3.
 5 Кислоты
5 КислотыЦели обучения
- Определить кислота .
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты, и эти соединения обладают интересными химическими свойствами. Первоначально определим кислотное ионное соединение катиона Н+, растворенного в воде. в виде ионного соединения катиона Н + , растворенного в воде.(Мы расширим это определение в главе 12 «Кислоты и основания».) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», слово, описывающее что-то растворенное в воде). Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную систему номенклатуры. Если кислота состоит только из водорода и одного другого элемента, ее название будет гидро- + основа другого элемента + -кислота . Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, соединения назывались бы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения, однако при растворении в воде они рассматриваются как кислоты.)
Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, соединения назывались бы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения, однако при растворении в воде они рассматриваются как кислоты.)
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона.Как правило, если название аниона оканчивается на -ate, название кислоты представляет собой основу названия аниона плюс -ic acid ; если название родственного аниона оканчивается на -ite, название соответствующей кислоты представляет собой основу названия аниона плюс -ous acid . В таблице 3.9 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вы должны быть знакомы. Вы должны узнать большинство анионов в формулах кислот.
Таблица 3.9 Названия и формулы кислот
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 | уксусная кислота |
| HClO 3 | хлористоводородная кислота |
| HCl | соляная кислота |
| HBr | бромистоводородная кислота |
| Привет | иодистоводородная кислота |
| ВЧ | фтористоводородная кислота |
| HNO 3 | азотная кислота |
| Н 2 С 2 О 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| Н 2 SO 4 | серная кислота |
| Н 2 SO 3 | сернистая кислота |
Примечание. Метка «водный» опущена для ясности. Метка «водный» опущена для ясности. | |
Пример 10
Назовите каждую кислоту, не обращаясь к Таблице 3.9 «Названия и формулы кислот».
- HBr
- Н 2 SO 4
Раствор
- Название бинарной кислоты: гидро- + название основы + -кислота . Поскольку эта кислота содержит атом брома, ее называют бромистоводородной кислотой.
- Поскольку эта кислота получена из сульфат-иона, название кислоты является основой названия аниона + -ic acid . Название этой кислоты – серная кислота.
Проверь себя
Назовите каждую кислоту.
- ВЧ
- HNO 2
Ответы
- фтористоводородная кислота
- азотистая кислота
Все кислоты имеют схожие свойства. Например, кислоты имеют кислый вкус; на самом деле кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием в пище кислот. Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Например, кислоты имеют кислый вкус; на самом деле кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием в пище кислот. Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты очень распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди прочих соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.). Щавелевая кислота, H 2 C 2 O 4 (водн.), содержится в шпинате и других зеленых листовых овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но ее также можно купить в хозяйственных магазинах в качестве чистящего средства для бетона и каменной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Ключевые выводы
- Кислота представляет собой соединение иона H + , растворенного в воде.
- Кислоты имеют собственную систему наименования.
- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
Упражнения
Назовите формулы каждой кислоты.
- хлорная кислота
- иодистоводородная кислота
Назовите формулы каждой кислоты.
- сероводородная кислота
- фосфористая кислота
Назовите каждую кислоту.

- HF(водн.)
- HNO 3 (водный)
- H 2 C 2 O 4 (водный)
Назовите каждую кислоту.
- H 2 SO 4 (водный)
- H 3 ПО 4 (водный)
- HCl (водн.)
Назовите кислоту, содержащуюся в пище.
Назовите некоторые общие свойства кислот.
Ответы
- фтористоводородная кислота
- азотная кислота
- щавелевая кислота
щавелевая кислота (ответы могут быть разными)
Номенклатура
НоменклатураНоменклатура
Задолго до того, как химики узнали формулы химических соединений, они разработали систему
номенклатуры , которая дала каждому соединению уникальное название. Сегодня мы часто используем химические
формулы, такие как NaCl, C 12 H 22 O 11 и Co(NH 3 ) 6 (ClO 4 ) 3 ,
описывать химические соединения. Но нам по-прежнему нужны уникальные имена, однозначно идентифицирующие
каждое соединение.
Сегодня мы часто используем химические
формулы, такие как NaCl, C 12 H 22 O 11 и Co(NH 3 ) 6 (ClO 4 ) 3 ,
описывать химические соединения. Но нам по-прежнему нужны уникальные имена, однозначно идентифицирующие
каждое соединение.
Общие названия
Некоторые соединения известны так давно, что систематическая номенклатура не может конкурировать с хорошо зарекомендовавшими себя общеупотребительными именами.Примеры соединений, для которых распространены названия включают воду (H 2 O), аммиак (NH 3 ) и метан (CH 4 ).
Наименование ионных соединений
(металлы с неметаллами)
Названия ионных соединений записывают, перечисляя название положительного иона
с последующим названием отрицательного иона.
| NaCl | хлорид натрия | ||
| (NH 4 ) 2 SO 4 | сульфат аммония | ||
| NaHCO 3 | бикарбонат натрия |
Поэтому нам нужен ряд правил, позволяющих однозначно называть положительные и отрицательные ионы, прежде чем мы сможем назвать соли, которые образуют эти ионы.
Наименование положительных ионов
Одноатомные положительные ионы имеют название элемента, из которого они образованы.
| Нет данных + | натрий | Цинк 2+ | цинк | |
| Ca 2+ | кальций | Н + | водород | |
| К + | калий | Ср 2+ | стронций |
Некоторые металлы образуют положительные ионы в более чем одной степени окисления. Один из самых ранних
методы различения этих ионов использовали суффиксы -ous и -ic добавлено к латинскому названию элемента для обозначения низшей и высшей степеней окисления,
соответственно.
Один из самых ранних
методы различения этих ионов использовали суффиксы -ous и -ic добавлено к латинскому названию элемента для обозначения низшей и высшей степеней окисления,
соответственно.
| Fe 2+ | черные | Fe 3+ | железо | |
| Сн 2+ | оловянный | Сн 4+ | олово | |
| Медь + | медь | Медь 2+ | медь |
Теперь химики используют более простой метод, в котором заряд иона обозначается символом Римская цифра в скобках сразу после названия элемента.
| Fe 2+ | железо(II) | Fe 3+ | железо (III) | |
| Сн 2+ | олово(II) | Сн 4+ | олово(IV) | |
| Медь + | медь(I) | Медь 2+ | медь(II) |
Многоатомные положительные ионы часто имеют общие названия, оканчивающиеся суффиксом -оний .
| Н 3 О + | гидроксоний |
| НХ 4 + | аммоний |
Наименование отрицательных ионов
Отрицательные ионы, состоящие из одного атома, называются с добавлением суффикса -ide к основе названия элемента.
| Ф — | фторид | О 2- | оксид |
| Класс — | хлорид | С 2- | сульфид |
| Бр — | бромид | Н 3- | нитрид |
| I — | йодид | Р 3- | фосфид |
| Н — | гидрид | С 4- | карбид |
Общие многоатомные отрицательные ионы
| -1 ионы | ||||
| ОХС 3 — | бикарбонат | ХСО 4 — | гидросульфат (бисульфат) | |
| CH 3 CO 2 — | ацетат | ClO 4 — | перхлорат | |
| № 3 — | нитрат | ClO 3 — | хлорат | |
| № 2 — | нитрит | ClO 2 — | хлорит | |
| MnO 4 — | перманганат | ClO — | гипохлорит | |
| Китайская — | цианид | ОХ — | гидроксид | |
| -2 иона | ||||
| СО 3 2- | карбонат | О 2 2- | пероксид | |
| СО 4 2- | сульфат | CrO 4 2- | хромат | |
| СО 3 2- | сульфит | Cr 2 O 7 2- | дихромат | |
| С 2 О 3 2- | тиосульфат | ГПО 4 2- | гидрофосфат | |
| -3 иона | ||||
| Заказ на поставку 4 3- | фосфат | АсО 4 3- | арсенат | |
| БО 3 3- | борат |
Наименование многоатомных ионов
На первый взгляд, номенклатура многоатомных отрицательных ионов в таблице выше
кажется безнадежным. Однако есть несколько общих правил, которые могут внести некоторый порядок в
этот кажущийся хаос.
Однако есть несколько общих правил, которые могут внести некоторый порядок в
этот кажущийся хаос.
Название иона обычно оканчивается либо на -ite , либо на -ate . -ite окончание указывает на низкую степень окисления. Таким образом, ион NO 2 — является нитрит-ион.
Окончание -ate указывает на высокую степень окисления. № 3 — ион, например, нитрат-ион.
Префикс гипо используется для обозначения самой низкой степени окисления. ClO- ион, например, представляет собой ион гипохлорита.
Префикс к — (как в гипер-) используется для обозначения самого высокого уровня окисления состояние. Таким образом, ион ClO 4 — является ионом перхлората.
Есть лишь несколько исключений из этих обобщений.
Названия гидроксида (OH —), цианида (CN —) и пероксида (O 2 2-)
ионы, например, имеют окончание -ide , потому что когда-то считалось, что они
одноатомные ионы.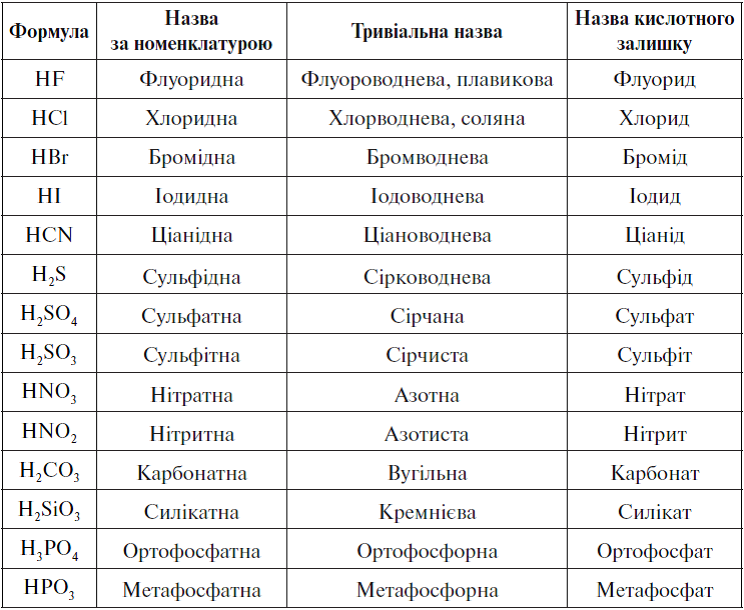
| Практическая задача 5 Кости и зубная эмаль в вашем теле содержат ионные соединения, такие как фосфат кальция и гидроксиапатит. Предсказать формулу фосфата кальция, который содержит ионы Ca 2+ и PO 4 3-. Рассчитайте значение x , если формула гидроксиапатита Ca x (PO 4 ) 3 (OH). Нажмите здесь, чтобы проверьте свой ответ на практическое задание 5 |
Наименование простых ковалентных соединений
(Неметаллы с неметаллами)
Степени окисления также играют важную роль в названии простых ковалентных соединений. То
название атома в положительной степени окисления указано первым.Суффикс -ide затем добавляется к основе названия атома в отрицательной степени окисления.
| HCl | хлористый водород |
| № | оксид азота |
| БрКл | хлорид брома |
Как правило, химики пишут формулы, в которых элемент в положительной степени окисления Сначала пишется, а затем элемент (элементы) с отрицательной степенью окисления.
Число атомов элемента в простых ковалентных соединениях указывается добавлением один из следующих греческих префиксов к имени элемента.
| 1 моно- | 6 шестигранник | ||
| 2 ди- | 7 гепта- | ||
| 3 три- | 8 окта- | ||
| 4 тетра- | 9 нона- | ||
| 5 пента- | 10 дека- |
Префикс mono — используется редко, так как является избыточным. Главное исключение
к этому правилу относится окись углерода (СО).
Главное исключение
к этому правилу относится окись углерода (СО).
Наименование кислот
Простые ковалентные соединения, содержащие водород, такие как HCl, HBr и HCN, часто растворяются в воде с образованием кислот. Эти решения названы путем добавления префикса hydro — к названию соединения, а затем заменив суффикс -ide на -ic . Для например, хлороводород (HCl) растворяется в воде с образованием соляной кислоты; водород бромид (HBr) образует бромистоводородную кислоту; цианистый водород (HCN) образует синильную кислоту.
Многие многоатомные отрицательные ионы, богатые кислородом, из таблицы 2.1 образуют кислоты, названные заменив суффикс — ate на -ic и суффикс -ite на -ous .
| Кислоты, содержащие ионы, оканчивающиеся на иде часто стать | водородная кислота | |||
| Класс — | хлорид | HCl | соляная кислота | |
| Ф — | фторид | ВЧ | фтористоводородная кислота | |
| С 2- | сульфид | Н 2 С | сероводородная кислота | |
| | ||||
| Кислоты, содержащие ионы, оканчивающиеся на обычно стать | -иловая кислота | |||
| CH 3 CO2 — | ацетат | CH 3 CO 2 H | уксусная кислота | |
| СО 3 2- | карбонат | H 2 CO 3 | угольная кислота | |
| БО 3 3- | борат | Н 3 БО 3 | борная кислота | |
| № 3 — | нитрат | HNO 3 | азотная кислота | |
| СО 4 2- | сульфат | H 2 SO 4 | серная кислота | |
| ClO 4 — | перхлорат | HClO 4 | хлорная кислота | |
| Заказ на поставку 4 3- | фосфат | H 3 Заказ на покупку 4 | фосфорная кислота | |
| MnO 4 — | перманганат | HMnO 4 | пермарганцевая кислота | |
| CrO 4 2- | хромат | H 2 CrO 4 | хромовая кислота | |
| ClO 3 — | хлорат | HClO 3 | хлористоводородная кислота | |
| Кислоты, содержащие ионы, оканчивающиеся на ite обычно стать | кислота | |||
| ClO 2 — | хлорит | HClO 2 | хлорноватистая кислота | |
| № 2 — | нитрит | HNO 2 | азотистая кислота | |
| СО 3 2- | сульфит | H 2 SO 3 | сернистая кислота | |
| ClO — | гипохлорит | HClO | хлорноватистая кислота | |
Сложные кислоты можно назвать, указав на присутствие кислого водорода следующим образом.
| NaHCO 3 | гидрокарбонат натрия (также известный как бикарбонат натрия) |
| NaHSO 3 | гидросульфит натрия (также известный как бисульфит натрия) |
| КН 2 Заказ на покупку 4 | калия дигидрофосфат |
Answers — Назовите кислоты
Answers — Назовите кислоты| Арканзас
Государственный университет отделение Химии и Физика |
Напишите формулы каждой из кислот, перечисленных ниже:
| Азотная кислота | HNO 3 |
| Синильная кислота | HCN (водный) |
| Хлорная кислота | HClO 3 |
| Уксусная кислота | СН 3 СООН |
| Бромистоводородная кислота | HBr (водный) |
| Сернистая кислота | H 2 SO 3 |
| Хлористая кислота | HClO 2 |
| Борная кислота | H 3 BO 3 |
| Соляная кислота | HCl (водн. ) ) |
| Фосфорная кислота | H 3 Заказ на покупку 4 |
| Азотистая кислота | HNO 2 |
| Плавиковая кислота | HF (водный) |
| Хлорная кислота | HClO 4 |
| Йодоводородная кислота | HI (водный) |
| Фосфористая кислота | H 3 Заказ на покупку 3 |
| Углекислота | H 2 CO 3 |
| Серная кислота | H 2 SO 4 |
| Муравьиная кислота | HCOOH |
Назовите каждую из следующих кислот:
| HClO 4 | перхлорная кислота |
| HCOOH | муравьиная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| HCl (водный) | соляная кислота |
| Н 3 БО 3 | борная кислота |
| Н 2 SO 4 | серная кислота |
| HNO 2 | азотистая кислота |
| HI (водный) | йодоводородная кислота |
| СН 3 СООН | уксусная кислота |
| HF (водный) | плавиковая кислота |
| H 3 Заказ на покупку 3 | фосфористая кислота |
| HCN (водный) | синильная кислота |
| HClO 3 | хлористоводородная кислота |
| H 2 CO 3 | угольная кислота |
| Н 2 SO 3 | сернистая кислота |
| HClO 2 | хлорноватистая кислота |
| HNO 3 | азотная кислота |
| HBr (водный) | бромистоводородная кислота |
НЕДЕЛЯ 2: ГЛАВА 5: Химические формулы и названия
НЕДЕЛЯ 2: ГЛАВА 5: Химические формулы и названияНЕДЕЛЯ ВТОРАЯ — ГЛАВА 5: Химические формулы и имена
В этой главе основное внимание будет уделено присвоению названий химическим соединениям. Разные
типы соединений (такие как молекулярные или ионные соединения или кислоты) имеют
немного другие правила наименования или «номенклатура» .
Будет важно, чтобы вы знали названия элементов и имена ионов.
и заряды, чтобы иметь возможность называть соединения. Пока вы не станете знакомы
с названиями и зарядами, держите под рукой общую таблицу ионов из главы 4
когда вы работаете с задачами, в конце этой главы есть список для повторения).
Мы выучим систематические названия соединений, однако многие соединения
также имеют «общие имена», под которыми они известны.
Разные
типы соединений (такие как молекулярные или ионные соединения или кислоты) имеют
немного другие правила наименования или «номенклатура» .
Будет важно, чтобы вы знали названия элементов и имена ионов.
и заряды, чтобы иметь возможность называть соединения. Пока вы не станете знакомы
с названиями и зарядами, держите под рукой общую таблицу ионов из главы 4
когда вы работаете с задачами, в конце этой главы есть список для повторения).
Мы выучим систематические названия соединений, однако многие соединения
также имеют «общие имена», под которыми они известны.
ОБУЧЕНИЕ ЗАДАЧИ:
- Ионные соединения
- Формулы
- Имена
- Молекулярные соединения
- Формулы
- Имена
- Кислоты
- Бинарные кислоты
- Оксикислоты
ИОННЫЙ
СОЕДИНЕНИЯ:
Помните, что ионные соединения:
Далее мы можем разделить ионные соединения на простые бинарные ионные соединения или ионные соединения с многоатомными ионами
Бинарные ионные соединения: как катион, так и анион в соединении
происходят от одного элемента, который потерял или приобрел один или несколько
электроны. Некоторые примеры:
Некоторые примеры:
Na + Cl — Ca 2+ O 2- H +
Ионные соединения с многоатомными ионами: катион и/или анион формируется из группы элементов, и эта группировка либо положительно или отрицательно заряжены. Вот некоторые примеры:
.CO 3 2- PO 4 3- NH 4 + СО 4 2-
Являются ли соединения простыми бинарными или соединениями с многоатомными Ионы, правила именования почти такие же.
Некоторые элементы могут образовывать ионы с разными зарядами. Это особенно распространен в переходных металлах (металлы группы В). Вот некоторые примеры:
.Cu + Cu 2+ Fe 2+ Fe 3+
Называние ионных соединений, в которых встречаются эти типы ионов, лишь немного
иначе, чем для простых бинарных соединений с ионами, которые имеют только
одиночный заряд. Сначала краткое изложение зарядов и названий катионов и анионов и
тогда номенклатура рулит!
Сначала краткое изложение зарядов и названий катионов и анионов и
тогда номенклатура рулит!
Резюме предсказания зарядов ионов:
Элементы группы 1А (металлы) всегда образуют катион +1
Элементы группы 2А (металлы) всегда образуют +2 катиона
Элементы группы 6А (неметаллы) обычно образуют -2 аниона
Элементы группы 7А (неметаллы) обычно образуют анионы -1
H обычно образует катион +1
Резюме Именование Ионов:
- Простые катионы обычно называют в честь элемента, из которого они получены
- например, Mg 2+ называется ионом магния
- простые анионы обычно называются по имени корня по имени корня элемент, от которого они получены с окончанием — ide
- например, Cl — называется хлор ид ион
- многоатомные ионы не обязательно называются по названиям атомов
из которых состоит многоатомный ион, вы должны знать названия этих ионов.

- существует закономерность в отношении некоторых категорий многоатомных анионов — многоатомных ионы, в которых разница между ними заключается в числе атомов О, которые они содержат или оксианионов таких как № 3 — и № 2 — или SO 4 2- и SO 3 2- или ClO — и ClO 2 — и ClO 3 — и ClO 4 —
Ион | Имя | Ион | Имя | |
№ 3 — | нитрат-ион | ClO — | гипохлорит-ион | |
№ 2 — | нитрит-ион | ClO 2 — | хлорит-ион | |
СО 4 2- | сульфат-ион | ClO 3 — | хлорат-ион | |
СО 3 2- | сульфит-ион | ClO 4 — | перхлорат-ион |
- вышеуказанные ионы встречаются либо парами, либо квартетами, и наблюдается закономерность в суффиксе или окончании
- для ионов, которые встречаются парами, ион с наибольшим количеством атомов О заканчивается — ели и ион с наименьшим числом атомов О оканчивается на — ite
- для ионов, образующих квартет, ион с наибольшим количеством атомов O имеет как суффикс (- ели ), так и префикс ( на -) и ионы с наименьшие атомы О имеют суффикс (- ite ) и префикс ( гипо -) — два иона в середине следуют той же схеме, что и для пар оксианионов
Номенклатура Правила для ионных соединений:
- катионы всегда указываются первыми в полном названии
- названы по названию элемента, из которого образуются простые катионы получены
- , если катион многоатомный (NH 4 + для пример) используется название полиатомного иона (именно поэтому вам нужно знать названия наиболее распространенных катионов и анионов, как простых, так и многоатомный!)
- анионы всегда указываются последними в полном наименовании
- анионы названы по корневому названию элемента плюс окончание -ide
- например, Cl — , так как он получен из хлора, называется хлор ide ион
- , так как многоатомные анионы содержат несколько атомов, не существует «корневого элемент», и у них есть определенные имена, которые вы должны знать
- например, SO 4 2- сульфат, а SO 3 2- сульфит; NO 3 — является нитратом, а NO 2 — нитрит
- для ионов, имеющих более одного возможного заряда, заряд ион должен быть указан на имя
- например: Fe 2 O 3 оксид железа(III), катион Fe 3+ и
FeO оксид железа(II), катион Fe 2+ - это относится в первую очередь к переходным металлам и некоторым тяжелым металлам группы А металлы
- для соединений с многоатомными ионами:
- знать названия, заряды и формулы важных многоатомных ионов
- многоатомных ионов, как и простые ионы, рассматриваются как отдельные сущности.
 или единиц
или единиц - например, CO 3 2- представляет собой единый блок с -2 заряд
- правила наименования и формул такие же, как и для простых бинарных ионных соединений
- Катионы
примеры:
ионов Комбинированный | Формула | Имя |
Na + и Cl — | NaCl | хлорид натрия |
Na + и SO 4 2- | Нет 2 SO 4 | сульфат натрия |
NH 4 + и S 2- | (NH 4 ) 2 S | сульфид аммония |
Ва 2+ и N 3- | Ва 3 С 2 | нитрид бария |
Ал 3+ и О 2- | Ал 2 О 3 | оксид алюминия |
Fe 2+ и Cl — | FeCl 2 | хлорид железа(II) |
Fe 3+ и Cl — | FeCl 3 | железа(III) хлорид |
Cu + и O 2- | Медь 2 О | оксид меди(I) |
Cu 2+ и O 2- | CuO | оксид меди(II) |
Обратите внимание, что, поскольку Na + , натрий, Ba 2+ , барий и
Al 3+ , алюминий в приведенных выше примерах не имеет другие
возможные обвинения (мы узнаем почему то есть в главе 9), это не
необходимо указывать заряд римскими цифрами в скобках в
имя.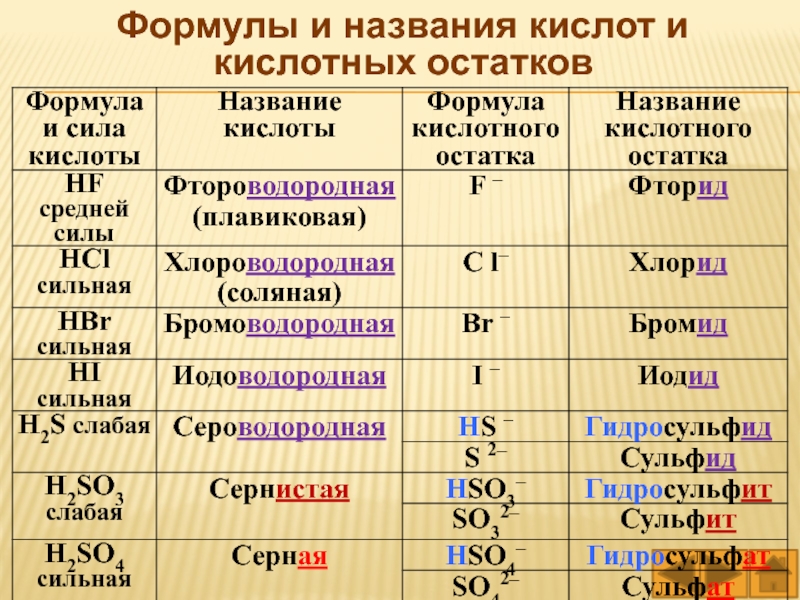
Также обратите внимание, что многоатомные ионы указаны в скобках, когда их больше. чем одна единица этого присутствующего многоатомного иона, а нижний индекс снаружи в скобках указано количество многоатомной единицы.
ДВОИЧНЫЙ МОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ:
Помните, молекулярные соединения это:
- химические соединения неметаллов и неметаллов (нет вовлечены ионы!)
- более металлический элемент (элемент левее на периодической таблица) названа первой
- более металлический элемент назван по названию элемента — с нет , окончание
- другой элемент, без металлического элемента , назван вторым с окончанием -ide
- , потому что у нас нет ионов (и их зарядов), которые можно было бы использовать для определения относительного отношение атомов мы должны указать в названии, сколько каждого элемента подарок
- для обозначения количества каждого из элементов в молекулярном соединении мы используем префиксы:
Префикс | Значение | Формула | Имя | |
моно | один | НЕТ | монооксид азота | |
по | два | Н 2 О | диоксид азота | |
три | три | Н 2 О 3 | ди азот три оксид | |
тетра | четыре | ККл 4 | углерод тетра хлорид | |
пента | пять | SiF 4 | кремний тетра фторид | |
шестигранник | шесть | СО 3 | сера три оксид | |
гепта | семь | П 2 О 5 | пятиокись дифосфора | |
окта | восемь | СО | окись углерода | |
нона | девять | СО 2 | двуокись углерода |
КИСЛОТЫ:
- кислоты представляют собой соединения, которые производят ионы водорода (H + ) при растворенный в воде
- у них кислый вкус
- они окрашивают лакмус в красный цвет
- имеют рН менее 7
- обычно формула кислоты начинается с одного или нескольких атомов Н
- существует два типа кислот: Двоичные Кислоты и оксикислоты
Двоичный Кислоты:
- бинарные кислоты содержат атомы H (которые высвобождаются как H + , когда кислота растворяется) и простой анион, такой как Cl — или Br — или S 2-
- например: HCl соляная
кислота
H 2 S сероводородный кислота - при наименовании бинарных кислот необходимо добавлять префикс ( гидро -), суффикс (- ic ), и терм кислота к корневому названию неметаллического элемента (анион)
- например: HF фтористоводородный кислота
Оксикислоты:
- оксикислоты содержат атомы H (которые высвобождаются как H + , когда кислота растворяется) и оксианион, такой как SO 4 2- или № 3 —
- например: H 2 SO 4 серная
кислота оксианион
название: сульфат
H 2 SO 3 сернистый кислота оксианион название: сульфит
HC 2 H 3 O 2 уксусная кислота название оксианиона: ацетат - при наименовании оксикислот необходимо добавлять суффикс (- ic или — ous ), а терм кислота к корневому названию оксианиона
- например: HNO 3 азотная
кислота оксианион
название: нитрат
HNO 2 закись азота кислота оксианион имя: нитрит - обратите внимание, что когда название оксианиона заканчивается на — ели , название кислоты оканчивается на — ic и когда название оксианиона оканчивается на — или , название кислоты оканчивается на — ous
Проблемы:
- Напишите химические формулы и названия образовавшихся ионных соединений между следующими:
- натрий и кислород Na 2 O оксид натрия
- алюминий и кислород Al 2 O 3 оксид алюминия
- литий и азот Li 3 N нитрид лития
- Напишите химические формулы молекулярных соединений, названных ниже:
- триоксид серы SO 3
- трибромид азота NBr 3
- тетраоксид ксенона XeO 4
- Назовите следующие кислоты:
- HBrO 2 бромистый кислота
- HIO кислота
- Приведите формулы следующих кислот:
- HBrO 4 пербромистый кислота
- H 2 S сероводородная кислота
Вот обзор названий и зарядов некоторых распространенных ионов:
ОБЩИЕ УСТРОЙСТВА
Положительный | Отрицательный | ||
| Водород | Н + | Гидроксид | ОХ — |
| Натрий | № + | Фтор | Ф — |
| Калий | К + | Хлорид | Класс — |
| Аммоний | НХ 4 + | Бромид | Бр — |
| Серебро | Аг + | Йодид | я — |
| Медь(I) | Медь + | Нитрат | № 3 — |
| Медь(II) | Cu +2 | Нитрит | № 2 — |
| Барий | Ба +2 | Перхлорат | ClO 4 — |
| Кальций | Ca +2 | Хлорат | ClO 3 — |
| Цинк | Zn +2 | Хлорит | ClO 2 — |
| Никель | Ni +2 | Гипохлорит | ClO — |
| Магний | Мг +2 | Ацетат | С 2 Н 3 О 2 — |
| Кобальт(II) | Co +2 | Сульфид | С -2 |
| Железо(II) | Fe +2 | Сульфат | СО 4 -2 |
| Марганец(II) | Мн +2 | Сульфит | СО 3 -2 |
| Меркурий(II) | рт. ст. +2 ст. +2 | Оксид | О -2 |
| Алюминий | Аль +3 | Карбонат | СО 3 -2 |
| Железо(III) | Fe +3 | Фосфат | Заказ на поставку 4 -3 |
| Хром(III) | Кр +3 | Бисульфат | ХСО 4 — |
| Кобальт(III) | Co +3 | Бикарбонат | ОХО 3 — |
| Цианид | КН — | ||
| Хромат | CrO 4 -2 | ||
| Дихромат | Cr 2 O 7 -2 | ||
Нажмите здесь, чтобы перейти к главе 6 Химические реакции и уравнения
Пользовательский поиск на самом деле это просто особый класс ионных соединений, где катион всегда H + .
Правила наименования кислот, не содержащих кислорода в анионе:
HCl, который содержит анион хлорид, называется гидро хлор ic acid . HCN, который содержит анион цианид, называется гидро циан иловая кислота . Правила наименования оксикислот (анион содержит элемент кислород):
HNO 3 , который содержит многоатомный ион нитр ат , называется нитр ic кислота. HNO 2 , который содержит многоатомный ион нитр ит , называется нитр или кислота. Highlight для выявления аниона имени и кислоты Имя
Называть ковалентные соединения с именами двоичных Ионные соединения Многоатомные ионы Обозначение многоатомными ионами Обозначение римскими цифрами Написание формулы Обозначение кислот Демонстрационные видеоролики о химических веществах |
Поиск химической формулы
Пожалуйста, следуйте инструкциям ниже, чтобы провести поиск (Помощь):
Помощь в поиске химической формулы
Правила для химических формул
(Вернуться к поиску)- Введите последовательность символов элемента, за которыми следуют числа
указать количество желаемых элементов (например,г.
 , C6H6).
, C6H6). - Используйте правильный регистр для символов элементов. Если правильный случай не используется, формула может быть неоднозначной и интерпретация выбранный не может быть желаемым.
- Элементы могут быть в любом порядке.
- Если требуется только один из заданных атомов, вы можете опустить номер после символа элемента.
- Круглые скобки можно использовать для группировки атомов.
- Будет добавлено несколько спецификаций для атома. Это означает, что Ch4(Ch3)4Ch4 будет обрабатывается так же, как C6h24 .
- Чтобы указать один или несколько заданных атомов, используйте вопросительный знак (?) после символа элемента.
- Указать любое количество (в том числе нулевое) заданных элемент, используйте звездочку (*) после символа элемента.
- Чтобы явно указать ион, поместите заряд в
конец формулы. Если заряд превышает
один заряд надо включать после + или символ - (например, C60-2 ).

Примеры химических формул
(Вернуться к поиску)| Химическая формула | Спецификация поиска |
|---|---|
| C2h5 | Виды с двумя C и четырьмя H. |
| CH3CH3 | видов с двумя C, и четырех H. |
| CH4CH | видов с двумя C и четырьмя H. |
| (CH3) 2 | видов с двумя C, и четыре ч |
| C2H*F? | Виды с двумя C, нулем или более H и одним или более F. |
Варианты поиска (шаг 2)
(Вернуться к поиску)- Точно соответствуют указанным изотопам
- Если флажок установлен, этот параметр указывает, что поиск
должны соответствовать изотопам, указанным в формуле поиска.Например, если эта опция не отмечена, поиск по h3 будет соответствовать видам, содержащим
атомы дейтерия и трития.
 Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.
Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска. - Разрешить элементы, не указанные в формуле
- Если флажок установлен, этот параметр указывает, что виды содержащие элементы, не указанные в формуле также будет соответствовать. Например, поиск Te2 найдет все виды, которые содержат ровно два атома теллура и любое число другие атомы.Проверка только этой опции эквивалентна к «частичному поиску формулы», доступному ранее с этого сайта.
- Этот параметр указывает, что виды содержат больше атомы, чем указано для данного элемента, будут сопоставлены. Например, поиск Te только с если этот флажок установлен, будут найдены все теллур, дителлур, трителлур и др.
- Исключить ионы из поиска
- Если этот параметр отмечен, поиск не будет соответствуют ионам, если заряд явно не указан в формула.
Правила для типов данных (шаг 4)
(Вернуться к поиску)- Если проверяется один или несколько типов данных,
поиск будет ограничен видами, которые
содержать хотя бы один из указанных типов данных.

- Если ни один из типов данных не проверен, не будет никаких ограничений на поиск.
%PDF-1.6
%
1912 0 объект
>
эндообъект
1927 0 ОБЖ
>поток
приложение/pdf2013-04-16T04:16:08.7-04:00приложение/pdf конечный поток
эндообъект
79 0 объект
>
эндообъект
1905 0 ОБЖ
>
эндообъект
86 0 объект
>
эндообъект
87 0 объект
>
эндообъект
88 0 объект
>
эндообъект
89 0 объект
[1902 0 Р]
эндообъект
90 0 объект
[1903 0 Р]
эндообъект
91 0 объект
[1904 0 Р]
эндообъект
92 0 объект
[1898 0 Р]
эндообъект
93 0 объект
>
эндообъект
94 0 объект
>
эндообъект
95 0 объект
>
эндообъект
96 0 объект
>
эндообъект
97 0 объект
>
эндообъект
98 0 объект
>
эндообъект
99 0 объект
>
эндообъект
100 0 объект
>
эндообъект
101 0 объект
>
эндообъект
102 0 объект
>
эндообъект
103 0 объект
>
эндообъект
104 0 объект
>
эндообъект
105 0 объект
>
эндообъект
106 0 объект
>
эндообъект
107 0 объект
>
эндообъект
108 0 объект
>
эндообъект
109 0 объект
>
эндообъект
110 0 объект
>
эндообъект
111 0 объект
>
эндообъект
112 0 объект
>
эндообъект
113 0 объект
>
эндообъект
114 0 объект
>
эндообъект
115 0 объект
>
эндообъект
116 0 объект
>
эндообъект
117 0 объект
>
эндообъект
118 0 объект
>
эндообъект
119 0 объект
>
эндообъект
120 0 объект
>
эндообъект
121 0 объект
>
эндообъект
122 0 объект
>
эндообъект
123 0 объект
>
эндообъект
124 0 объект
>
эндообъект
125 0 объект
>
эндообъект
126 0 объект
>
эндообъект
127 0 объект
>
эндообъект
128 0 объект
>
эндообъект
129 0 объект
>
эндообъект
130 0 объект
>
эндообъект
131 0 объект
>
эндообъект
132 0 объект
>
эндообъект
133 0 объект
>
эндообъект
134 0 объект
>
эндообъект
135 0 объект
>
эндообъект
136 0 объект
>
эндообъект
137 0 объект
>
эндообъект
138 0 объект
>
эндообъект
139 0 объект
>
эндообъект
53 0 объект
>/MediaBox[0 0 540 720]/Parent 1908 0 R/Ресурсы>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Rotate 0/StructParents 17/Tabs/S/Type/Page>>
эндообъект
54 0 объект
>поток
х[K60ǙH$K@Co h!a;H
?˔lm=M1iR»iJ3ç w|s.

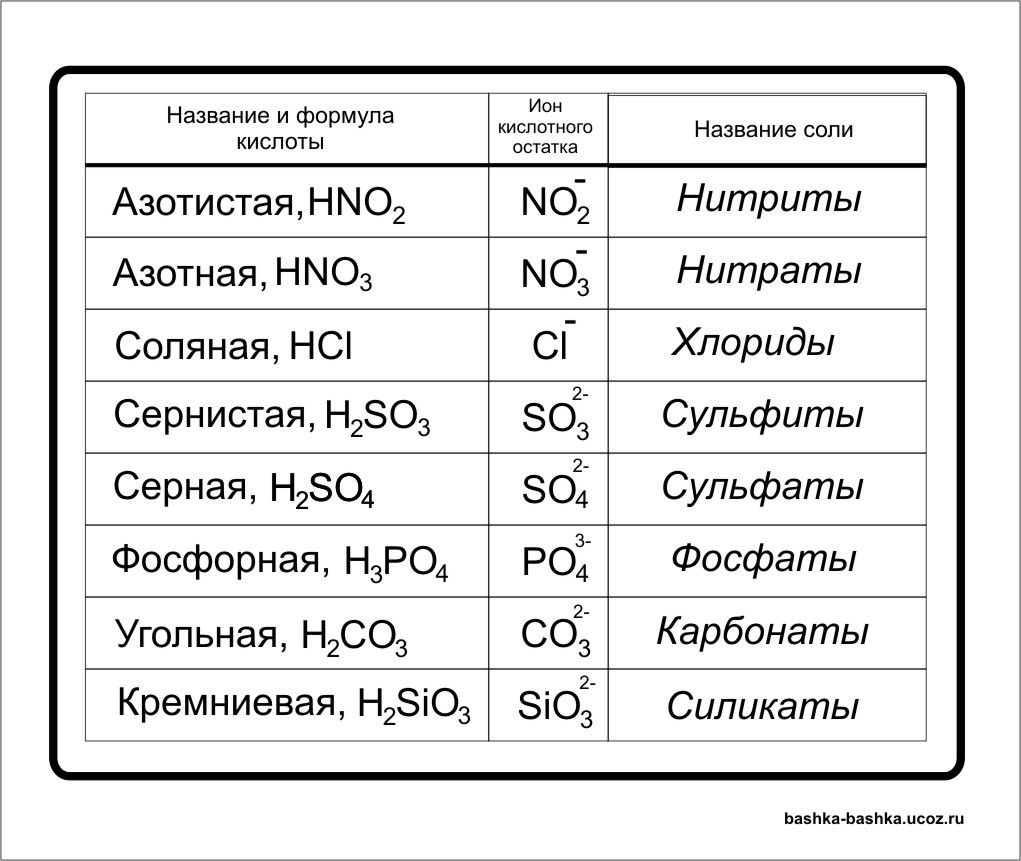






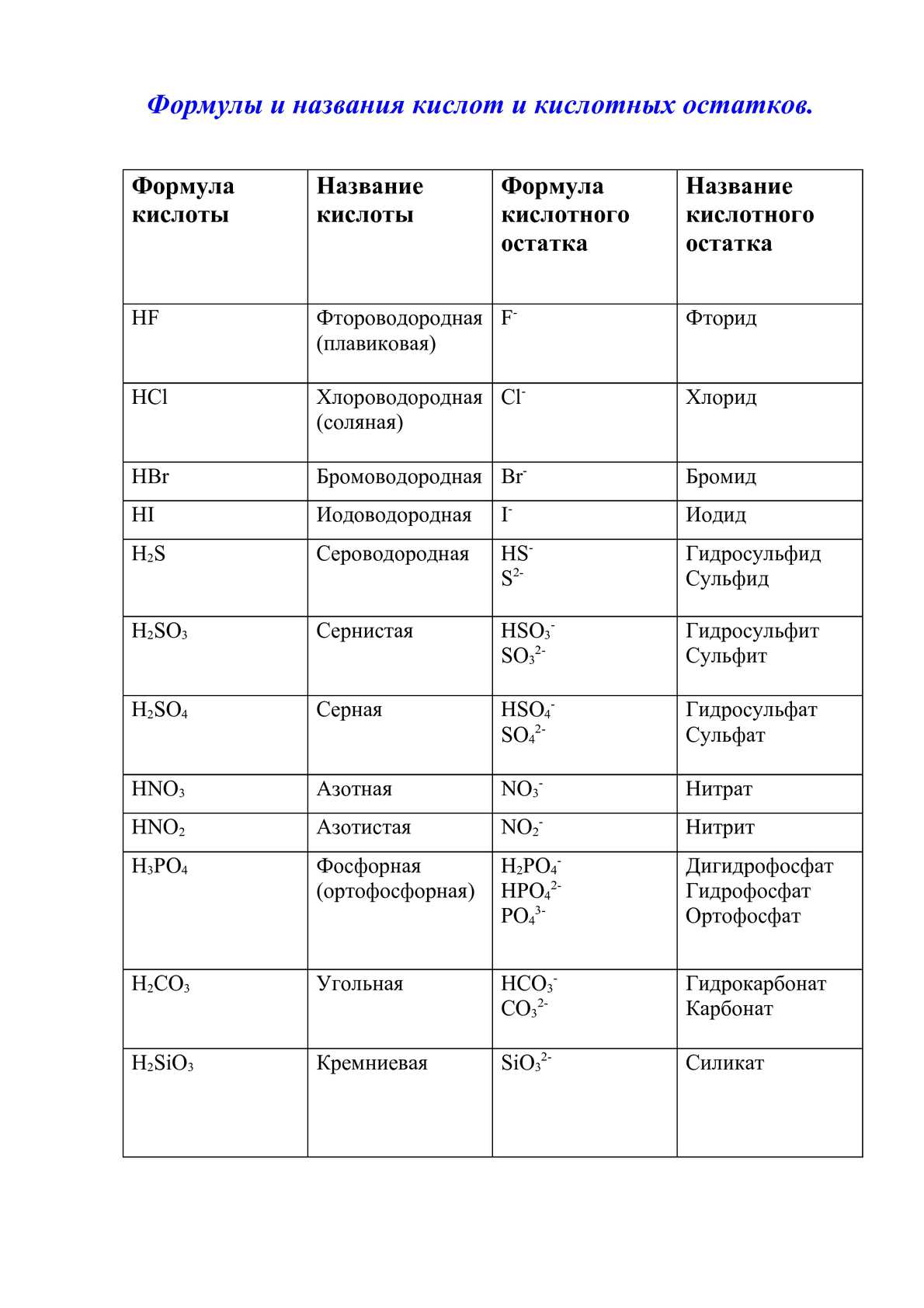
 или единиц
или единиц Таким образом, если в формуле водород написан первым, то это обычно указывает на то, что водород представляет собой катион H + и что соединение представляет собой кислоту. При растворении в воде кислоты образуют ионы H + (также называемые протонами, поскольку удаление одного электрона из нейтрального атома водорода оставляет после себя один протон).
Таким образом, если в формуле водород написан первым, то это обычно указывает на то, что водород представляет собой катион H + и что соединение представляет собой кислоту. При растворении в воде кислоты образуют ионы H + (также называемые протонами, поскольку удаление одного электрона из нейтрального атома водорода оставляет после себя один протон).
 О. 3 является
О. 3 является , C6H6).
, C6H6).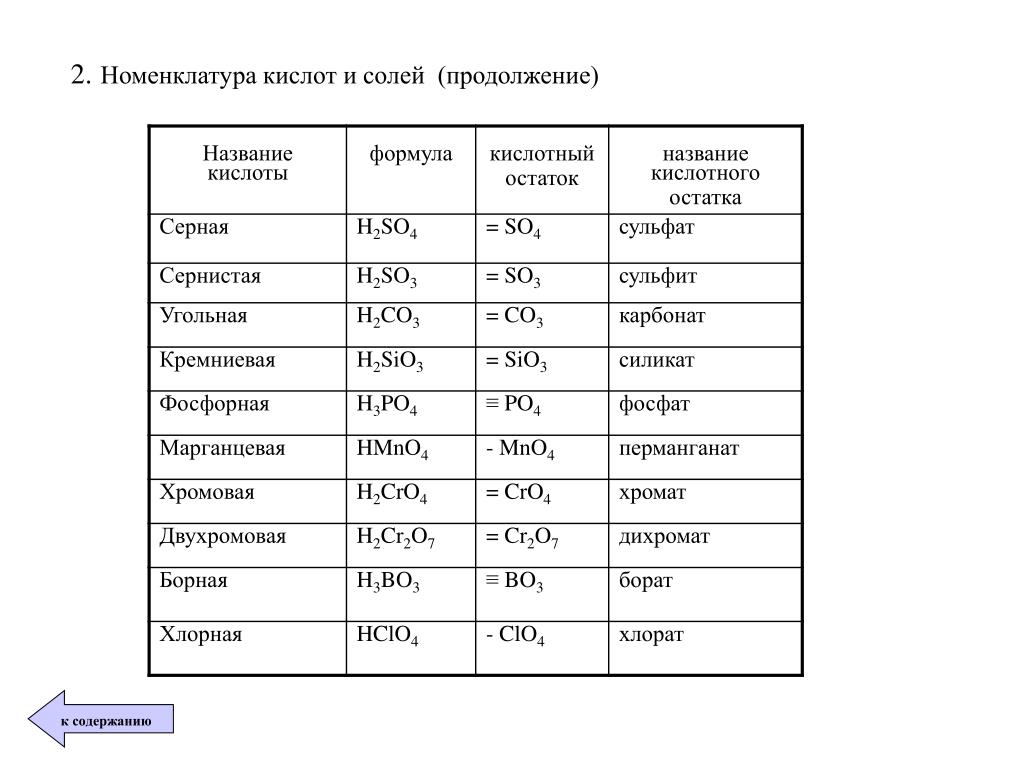
 Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.
Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.