| Азотистая кислота | HNO2 |
| Азотисто- водородная кислота | HN3 |
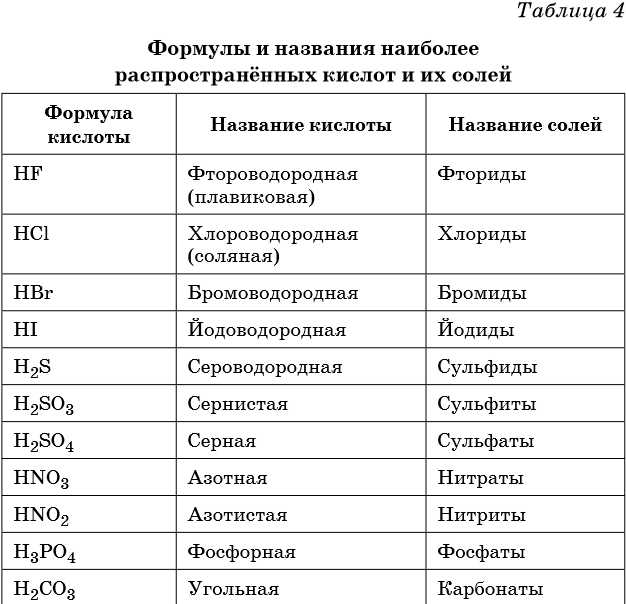
| Азотная кислота | HNO3 |
| Азулен | C10H8 |
| Акрилонитрил | H2C(CH)CN |
| Аланин Ala | C3H7NO2 |
| Альбит | N4H4 |
| Алюминат бария | Ba(AlO2)2 |
| Алюминат кобальта(II) | CoAl2O4 |
| Алюминат лития | AlLiO2 |
| Алюминат магния | Mg(AlO2)2 |
| Алюминат натрия | AlNaO2 |
| Алюминат цинка | Zn(AlO2)2 |
| Амид ион | NH2− |
| Амид цезия | CsNH2 |
| Аммиак | NH3 |
| Андалузит | Al2O5Si |
| Антимонид галлия | GaSb |
| Антимонид индия | InSb |
| Антимонид кадмия | CdSb |
| Антимонид кобальта | CoSb |
| Антимонид марганца(II) | Mn3Sb2 |
| Антимонид меди(III) | Cu3Sb |
| Антимонид никеля(II) | Ni3Sb2 |
| Антимонид хрома | CrSb |
| Антимонид хрома(II) | Cr3Sb2 |
| Антимонид цинка | ZnSb |
| Антимонид цинка | Zn3Sb2 |
| Антрацен | C14H10 |
| Аргинин | C6H14N4O2 |
| Арсенат бария | Ba(AsO4)2 |
| Арсенат бора | BAsO4 |
| Арсенат цинка | Zn3(AsO4)2 |
| Арсенид бора | BAs |
| Арсенид галлия | GaAs |
| Арсенид индия | InAs |
| Арсенид иттрия | YAs |
| Арсенид кадмия | Cd3As2 |
| Арсенид кобальта | CoAs |
| Арсенид кобальта(II) | CoAs2 |
| Арсенид магния | Mg3As2 |
| Арсенид марганца(II) | Mn3As2 |
| Арсенид марганца(III) | MnAs |
| Арсенид меди(I) | Cu3As |
| Арсенид никеля(III) | NiAs |
| Арсенид таллия | AsTl |
| Арсенид хрома(II) | Cr3As2 |
| Арсенид цинка | Zn3As2 |
| Арсенит бария | Ba(AsO3)2 |
| Арсенит цинка | Zn(AsO2)2 |
| Арсин | AsH3 |
| Аскорбиновая кислота | HC6H7O6 |
| Аспарагин | C4H8N2O3 |
| Аспарагиновая кислота Asp | C4H7NO4 |
| Аспартам | C14H18N2O5 |
| Аспирин | C9H8O4 |
| Ацетальдегид | CH3CHO |
| Ацетамид | CH3CONH2 |
| Ацетат | CH3COO− |
| Ацетат | C2H3O2− |
| Ацетат бария | Ba(C2H3O2)2 |
| Ацетат бериллия | Be(C2H3O2)2 |
| Ацетат висмута (III) | Bi(C2H3O2)3 |
| Ацетат галлия | Ga(C2H3O |
| Ацетат кадмия | Cd(C2H3O2)2 |
| Ацетат кальция | Ca(C2H3O2)2 |
| Ацетат кобальта(II) | Co(C2H3O2)2 |
| Ацетат ртути(II) | Hg(C2H3O2)2 |
| Ацетат свинца — тригидрат | Pb(CH3COO)2 · 3H2O |
| Ацетат серебра | AgC2H3O2 |
| Ацетат цезия | CsC2H3O2 |
| Ацетилацетонат бериллия | Be(C5H7O2)2 |
| Ацетилен | C2H2 |
| Ацетилен | HCCH или C 2H2 |
| Ацетиленид серебра | Ag2C2 |
| Ацетил- салициловая кислота | C9H8O4 |
| Ацетил- салициловая кислота | HC9H7O4 |
| Ацетилхлорид | CH3COCl |
| Ацетоаминофен | C8H9NO2 |
| Ацетоацетат этила | C6H10O3 |
| Ацетон | CH3COCH3 |
| Ацетон | (CH3)2CO |
| Бадделеит | ZrO2 |
| Барит | |
| Бензальдегид | C6H5CHO |
| Бензилацетат | CH3COOCH2 |
| Бензиловый спирт | C6H5CH2OH |
| Бензоат | C6H5COO− |
| Бензоат натрия | NaC6H5COO |
| Бензоилхлорид | C6H5COCl |
| Бензойная кислота | C6H5COOH |
| Бензол | C6H6 |
| Бензофенон | C13H10O |
| Бертолетова соль (хлорат калия) | KClO3 |
| Бифенил | C12H10 |
| Боразол | B3N3H6 |
| Борат алюминия | AlBO2 |
| Борат висмута(III) | BiBO3 |
| Борат цезия | CsBO2 |
| Боргидрид бериллия | Be(BH4)2 |
| Борид бериллия | BeB2 |
| Борид иттрия | YB6 |
| Борид кальция | CaB6 |
| Борид кальция | CaB6 |
| Борид кобальта | Co2B |
| Борид кобальта(II) | CoB |
| Борид церия | CeB6 |
| Борид циркония | ZrB2 |
| Борная кислота | B(OH)3 |
| Бром | Br2 |
| Бромат | BrO3− |
| Бромат лития | LiBrO3 |
| Бромат серебра | |
| Бромат цезия | CsBrO3 |
| Бромдииодид индия(III) | InBrI2 |
| Бромид аммония | NH4Br |
| Бромид бария | BaBr2 |
| Бромид бериллия | BeBr2 |
| Бромид бора | BBr3 |
| Бромид ванадия(II) | VBr2 |
| Бромид ванадия(III) | VBr3 |
| Бромид висмута(III) | BiBr3 |
| Бромид вольфрама(II) | WBr2 |
| Бромид вольфрама(III) | WBr3 |
| Бромид вольфрама(IV) | WBr4 |
| Бромид вольфрама(V) | WBr5 |
| Бромид вольфрама(VI) | WBr6 |
| Бромид галлия | GaBr3 |
| Бромид гафния(IV) | HfBr4 |
| Бромид германия | GeBr4 |
| Бромид золота(I) | AuBr |
| Бромид золота(III) | AuBr3 |
| Бромид индия(I) | InBr |
| Бромид индия(III) | InBr3 |
| Бромид иода(I) | IBr |
| Бромид иода(III) | IBr3 |
| Бромид иттербия(II) | YbBr2 |
| Бромид иттербия(III) | YbBr3 |
| Бромид иттрия | YBr3 |
| Бромид кадмия | CdBr2 |
| Бромид кальция | CaBr2 |
| CoBr2 | |
| Бромид лития | LiBr |
| Бромид марганца(II) | MnBr2 |
| Бромид меди(I) | CuBr |
| Бромид меди(II) | CuBr2 |
| Бромид молибдена(II) | MoBr2 |
| Бромид молибдена(III) | MoBr3 |
| Бромид натрия | NaBr |
| Бромид никеля(II) | NiBr2 |
| Бромид ниобия(V) | NbBr5 |
| Бромид ртути(I) | Hg2Br2 |
| Бромид ртути(I) | HgBr |
| Бромид ртути(II) | HgBr2 |
| Бромид серебра(I) | AgBr |
| Бромид тантала (III) | TaBr3 |
| Бромид тантала (V) | TaBr5 |
| Бромид хрома(II) | CrBr2 |
| Бромид хрома(III) | CrBr3 |
| Бромид цезия | CsBr |
| Бромид церия(III) | CeBr3 |
| Бромид цинка | ZnBr2 |
| Бромид циркония | ZrBr4 |
| Бромоводород | HBr |
| Бромэтан | CH3CH2Br |
| Бромэтан | C2H5Br |
| Бутан | C4H10 |
| Бутанол-1 | CH3CH2CH2 CH2OH |
| Бутиловый спирт | C4H9OH |
| Валин | C5H11NO2 |
| Винилацетат | CH3COOCHCH2 |
| Винилхлорид | C2H3Cl |
| Винная кислота | H2C4H4O6 |
| Висмутид магния | Mg3Bi2 |
| Висмутид марганца(III) | MnBi |
| Витамин B1 | HC12H17ON4SCl2 |
| Витерит | |
| Вода | H2O |
| Водород | H2 |
| Волластонит | CaSiO3 |
| Вольфрамат бария | BaWO4 |
| Вольфрамат ион | WO42− |
| Вольфрамат кадмия | CdWO4 |
| Вольфрамат кальция | CaWO4 |
| Вольфрамат кобальта(II) | CoWO4 |
| Вольфрамат магния | MgWO4 |
| Вольфрамат меди(II) | CuWO4 |
| Вольфрамат ртути(II) | HgWO4 |
| Вольфрамат цезия | Cs2WO4 |
| Галенит | PbS |
| Галит | NaCl |
| Гашёная известь | Ca(OH)2 |
| Гексаборид бария | BaB6 |
| Гексабромид диалюминия | Al2Br6 |
| Гексагидрат бромата меди (II) | Cu(BrO3)2 · 6H2O |
| Гексагидрат хлората меди (II) | Cu(ClO3)2 · 6H2O |
| Гексадекан | C16H34 |
| Гексаиодид диалюминия | Al2I6 |
| Гексан | C6H14 |
| Гекса- оксидифторид | O6F2 |
| Гекса- тиоциано- платинат (IV) аммония | (NH4)2[Pt(SCN)6] |
| Гексафторид диалюминия | Al2F6 |
| Гекса- фтороалюминат калия | AlF6K3 |
| Гекса- фтороалюминат лития | AlF6Li3 |
| Гекса- фтороалюминат натрия(криолит) | AlF6Na3 |
| Гекса- фторосиликат бария | BaSiF6 |
| Гекса- хлороалюминат калия | AlCl6K3 |
| Гекса- хлороалюминат натрия | AlCl6Na3 |
| Гекса- хлороплатинат (IV) аммония | (NH4)2[PtCl6] |
| Гекса- цианоферрат (III) кобальта(II) | Co3(Fe(CN)6)2 |
| Гептадекан | C17H36 |
| Гептан | C7H16 |
| Гидразин | H2NNH2 |
| Гидразин | N2H4 |
| Гидрат сульфата кальция | CaSO4 · 0. 5H2O 5H2O |
| Гидрид кальция | CaH2 |
| Гидрид натрия | NaH |
| Гидрид-фторид аргона | ArFH |
| Гидрид-хлорид аргона | ArClH |
| Гидрокарбонат | HCO3− |
| Гидрокарбонат натрия | NaHCO3 |
| Гидроксид алюминия | Al(OH)3 |
| Гидроксид бария | Ba(OH)2 |
| Гидроксид бериллия | Be(OH)2 |
| Гидроксид галлия | Ga(OH)3 |
| Гидроксид золота(III) | Au(OH)3 |
| Гидроксид индия(III) | In(OH)3 |
| Гидроксид кадмия | Cd(OH)2 |
| Гидроксид кальция | Ca(OH)2 |
| Гидроксид кобальта(II) | Co(OH)2 |
| Гидроксид кобальта(III) | Co(OH)3 |
| Гидроксид магния | Mg(OH)2 |
| Гидроксид марганца(II) | Mn(OH)2 |
| Гидроксид меди(II) | Cu(OH)2 |
| Гидроксид натрия | NaOH |
| Гидроксид неодима | Nd(OH)3 |
| Гидроксид никеля(II) | Ni(OH)2 |
| Гидроксид цезия | CsOH |
| Гидроксид цинка | Zn(OH)2 |
| Гидроксид циркония | Zr(OH)4 |
| Гидроксил | OH− |
| Гидроксиламин | NH2OH |
| Гидроксоний | H3O+ |
| Гидросульфат | HSO4− |
| Гидросульфат лития | LiHSO4 |
| Гидросульфид аммония | NH4HS |
| Гидросульфит | HSO3− |
| Гидрофосфат | HPO42− |
| Гидрофосфат цезия | Cs2HPO4 |
| Гидрохинон | C6H6O2 |
| Гиллеспит | BaFeSi4O10 |
| Гипофосфит кальция | Ca(H2PO2)2 |
| Гипохлорит кальция | Ca(OCl)2 |
| Гистидин | C6H9N3O2 |
| Глиоксилат бутила | C6H10O3 |
| Глицин | H2NCH2COOH |
| Глицин Gly | C2H5NO2 |
| Глутамин | C5H10N2O3 |
| Глутаминовая кислота | C5H9NO4 |
| Глюкоза | C6H12O6 |
| Дезоксирибоза | C5H10O4 |
| Декан | C10H22 |
| Диборан | B2H6 |
| Дибромид серебра | Ag3Br2 |
| Дибромиодид индия(III) | InBr2I |
| Дигенит | Cu9S5 |
| Дигидрат бромата бария | Ba(BrO3)2·2H2O |
| Дигидрат бромата ртути(II) | Hg(BrO3)2 · 2H2O |
| Дигидрат селенита меди(II) | CuSeO3 · 2H2O |
| Дигидро- арсенат аммония | (NH4)H2AsO4 |
| Дигидро- фосфат | H2PO4− |
| Дииодид галлия | GaI2 |
| Диметил- гидразин | (CH3)2NNH2 |
| Диметиловый эфир | CH3OCH3 |
| Диметил- оксалат | (CH3)2C2O4 |
| Диметил- сульфид | CH3SCH3 |
| Диметил сульфоксид DMSO | C2H6OS |
| Диметил сульфонио- пропионат DMSP | (CH3)2S + CH2CH2 COO− |
| Диоксид железа | FeO2 |
| Диоксид кремния | SiO2 |
| Диоксид мышьяка | AsO2 |
| Диоксид углерода | CO2 |
| Диоксид хлора | ClO2 |
| Диоксид циркония | ZrO2 |
| Диоксид- дибромид вольфрама(VI) | WO2Br2 |
| Диоксид- дииодид вольфрама(VI) | WO2I2 |
| Диоксид-дихлорид вольфрама(VI) | WO2Cl2 |
| Диоксид- фторид ксенона | XeO2F2 |
| Дисерная кислота | H2S2O7 |
| Дисиликат бария | BaSi2O5 |
| Дисульфид кобальта | CoS2 |
| Дителлурид алюминия | AlTe2 |
| Ди- трет- бутилпероксид DTBP | (CH3)3 COOC(CH3)3 |
| Дифосфид димышьяка | As2P2 |
| Дифтор- дихлорметан фреон-12 | CCl2F2 |
| Дифторид алюминия | AlF2 |
| Дифторид дикислорода, диоксидифторид | O2F2 |
| Дифторид кислорода | OF2 |
| Дифторид озона, триоксидифторид | O3F2 |
| Дифторид серебра | AgF2 |
| Дифторид- хлорид алюминия | AlClF2 |
| Дифтороксид алюминия | AlF2O |
| Дихлорид галлия | GaCl2 |
| Дихлорид серебра(II) | Ag2Cl2 |
| Дихлорметан | CH2Cl2 |
| Дихлоро- гексаоксид | Cl2O6 |
| Дихлорэтилен | C2H4Cl2 |
| Дихромат лития | Li2Cr2O7 |
| Дихромат серебра(I) | Ag2Cr2O7 |
| Дихромат цезия | Cs2Cr2O7 |
| Дицианоаурат (I) натрия | NaAu(CN)2 |
| Диэтиламин | (C2H5)2NH |
| Диэтиловый эфир | C4H10O |
| Диэтиловый эфир этоксиэтан | CH3CH2 OCH2CH3 |
| Додекан | C12H26 |
| Известняк | CaCO3 |
| Изоамилацетат | CH3 COO(CH2)2 CH(CH3)2 |
| Изолейцин | C6H13NO2 |
| Изопропиловый спирт пропанол-2 изопропанол | (CH3)2CHOH |
| Иод | I2 |
| Иодат | IO3− |
| Иодат кадмия | Cd(IO3)2 |
| Иодат кальция | Ca(IO3)2 |
| Иодат кобальта (II) | Co(IO3)2 |
| Иодат лития | LiIO3 |
| Иодат меди (I) | CuIO3 |
| Иодат меди (II) | Cu(IO3)2 |
| Иодат ртути (II) | Hg(IO3)2 |
| Иодат серебра | AgIO3 |
| Иодат цинка | Zn(IO3)2 |
| Иодид бария | BaI2 |
| Иодид бериллия | BeI2 |
| Иодид бора | BI3 |
| Иодид висмута (III) | BiI3 |
| Иодид вольфрама (II) | WI2 |
| Иодид вольфрама (IV) | WI4 |
| Иодид галлия | GaI3 |
| Иодид германия (IV) | GeI4 |
| Иодид золота (I) | AuI |
| Иодид золота (III) | AuI3 |
| Иодид индия (I) | InI |
| Иодид индия (II) | InI2 |
| Иодид индия (III) | In(IO3)3 |
| Иодид индия (III) | InI3 |
| Иодид иттербия (II) | YbI2 |
| Иодид иттербия (III) | YbI3 |
| Иодид кадмия | CdI2 |
| Иодид кальция | CaI2 |
| Иодид кобальта(II) | CoI2 |
| Иодид магния | MgI2 |
| Иодид марганца (II) | MnI2 |
| Иодид меди(I) | CuI |
| Иодид мышьяка (III) | AsI3 |
| Иодид натрия | NaI |
| Иодид неодима (III) | NdI2 |
| Иодид никеля (II) | NiI2 |
| Иодид ниобия(V) | NbI5 |
| Иодид ртути (I) | Hg2I2 |
| Иодид ртути (II) | HgI2 |
| Иодид серебра (I) | AgI |
| Иодид тантана (V) | TaI5 |
| Иодид хрома (II) | CrI2 |
| Иодид хрома (III) | CrI3 |
| Иодид цезия | CsI |
| Иодид церия(II) | CeI2 |
| Иодид церия (III) | CeI3 |
| Иодид цинка | ZnI2 |
| Иодид циркония | ZrI4 |
| Иодметан метилиодид | CH3I |
| Иодноватая кислота | HIO3 |
| Иодоводород | HI |
| Ион аммония | NH4+ |
| Ион озонида | O3− |
| Ион пероксида | O22− |
| Ион супероксида | O2− |
| Кадмиевая обманка | CdS |
| Кадмоселит | CdSe |
| Кальцит | CaCO3 |
| Каменная соль | NaCl |
| Камфора | C10H16O |
| Каприлат цинка | Zn(C8H15O2)2 |
| Карбамат аммония | NH4CO2NH2 |
| Карбид алюминия | Al4C3 |
| Карбид бария | BaC4 |
| Карбид бериллия | Be2C |
| Карбид бора | B4C |
| Карбид вольфрама | W2C |
| Карбид иттрия | YC2 |
| Карбид кальция | CaC2 |
| Карбид кремния | SiC |
| Карбид хрома(II) | Cr3C2 |
| Карбид церия | CeC |
| Карбид церия(III) | Ce2C3 |
| Карбид циркония | ZrC |
| Карбонат | CO32− |
| Карбонат бария | BaCO3 |
| Карбонат висмутила | (BiO)2CO3 |
| Карбонат кадмия | CdCO3 |
| Карбонат кальция | CaCO3 |
| Карбонат магния | MgCO3 |
| Карбонат марганца (II) | MnCO3 |
| Карбонат натрия | Na2CO3 |
| Карбонат серебра(I) | Ag2CO3 |
| Карбонат цезия | Cs2CO3 |
| Карбонат цинка | ZnCO3 |
| Карбонил вольфрама (VI) | W(CO)6 |
| Кварц | SiO2 |
| Кеатит | Li(AlSi2O6) |
| Кетен | CH2CO |
| Киноварь | HgS |
| Кислород | O2 |
| Ковеллин | CuS |
| Кремниевая кислота | H2SiO3 |
| Криолит | Na3AlF6 |
| Кубан | C8H8 |
| Кубанит | CuFe2S3 |
| Лейцин | C6H13NO2 |
| Лизин | C6H14N2O2 |
| Лимонная кислота | C6H8O7 |
| Линолевая кислота | C18H32O2 |
| Магнетит | FeO4 |
| Малахит | Cu2CO3(OH)2 |
| Малонат | C3H3O4− |
| Мальтоза | C12H22O11 |
| Манганат бария | BaMnO4 |
| Манганит | MnOOH |
| Медный купорос | [Cu(H2O)4] SO4 · H2O |
| Метаарсенит натрия | NaAsO2 |
| Метаванадат висмута (III) | Bi(VO3)5 |
| Метаванадат кальция | Ca(VO3)2 |
| Метаванадат магния | Mg(VO3)2 |
| Метаванадат меди(II) | Cu(VO3)2 |
| Метаванадат натрия | NaVO3 |
| Метаванадат никеля(II) | Ni(VO3)2 |
| Метаванадат цинка | Zn(VO3)2 |
| Метан природный газ | CH4 |
| Метаниобат бария | BaNb2O6 |
| Метаниобат кальция | Ca(NbO3)2 |
| Метаниобат лития | Li2NbO3 |
| Метаниобат натрия | NaNbO3 |
| Метаниобат цезия | CsNbO3 |
| Метаниобат цинка | Zn(NbO3)2 |
| Метановая кислота | HCOOH |
| Метанол | CH3OH |
| Метасиликат бария | BaSiO3 |
| Метасиликат кадмия | CdSiO3 |
| Метасиликат кальция | CaSiO3 |
| Метасиликат лития | Li2SiO3 |
| Метасиликат магния | MgSiO3 |
| Метасиликат меди(II) | CuSiO3 |
| Метасиликат цезия | Cs2SiO3 |
| Метатанталат кадмия | Cd(TaO3)2 |
| Метатанталат натрия | NaTaO3 |
| Метатанталат цинка | Zn(TaO3)2 |
| Метатитанат лития | Li2TiO3 |
| Метатитанат магния | MgTiO3 |
| Метатитанат натрия | Na2TiO3 |
| Метатитанат никеля(II) | NiTiO3 |
| Метатитанат цезия | CsTaO3 |
| Метатитанат цинка | ZnTiO3 |
| Метафосфат бария | Ba(PO3)2 |
| Метацирконат кадмия | CdZrO3 |
| Метацирконат лития | Li2ZrO3 |
| Метацирконат марганца(II) | MnZrO3 |
| Метацирконат натрия | Na2ZrO3 |
| Метацирконат цинка | ZnZrO3 |
| Метилмеркаптан | CH3SH |
| Метионин | C5H11NO2S |
| Молибдат бария | BaMoO4 |
| Молибдат висмута (III) | Bi2(MoO4)3 |
| Молибдат кадмия | CdMoO4 |
| Молибдат кальция | CaMoO4 |
| Молибдат кобальта(II) | CoMoO4 |
| Молибдат магния | MgMoO4 |
| Молибдат меди(II) | CuMoO4 |
| Молибдат серебра | Ag2MoO4 |
| Молибдат цезия | Cs2MoO4 |
| Молочная кислота | HC3H5O3 |
| Монобромид алюминия | AlBr |
| Моногидрат бензоата ртути (II) | Hg(C7H5O2)2 · H2O |
| Моногидрат бромата бария | Ba(BrO3)2 · H2O |
| Моногидрат нитрата ртути (II) | Hg(NO3)2 · H2O |
| Моногидрат сульфата индия (III) | In2(SO4)3 · H2O |
| Моноиодид алюминия | AlI |
| Монооксид алюминия | AlO |
| Монооксид мышьяка | AsO |
| Монооксид углерода угарный газ | CO |
| Монотеллурид алюминия | AlTe |
| Монофторид алюминия | AlF |
| Монохлорид алюминия | AlCl |
| Мочевина | NH2CONH2 |
| Мочевина | (NH2)2CO |
| Мрамор | CaCO3 |
| Муллит | Al6O13Si2 |
| Муравьиная кислота | HCOOH |
| Мышьяковая кислота | H3AsO4 |
| Натрия гипохлорит | NaOCl |
| Нафталин | C10H8 |
| Негашёная известь | CaO |
| Никотиновая кислота | C5H4NCOOH |
| Ниобат бария | Ba(NbO3)2 |
| Ниобат дибария- натрия | Ba2Na(NbO3)5 |
| Ниобат кадмия | Cd2Nb2O7 |
| Ниобат меди (II) | Cu(NbO3)2 |
| Нитрат | NO3− |
| Нитрат алюминия | Al(NO3)3 |
| Нитрат аммония | NH4NO3 |
| Нитрат аммония-церия(IV) | NH4Ce(NO3)5 |
| Нитрат бария | Ba(NO3)2 |
| Нитрат гуанидиния | C(NH2)3NO3 |
| Нитрат кадмия | Cd(NO3)2 |
| Нитрат кальция | Ca(NO3)2 |
| Нитрат кобальта (II) | Co(NO3)2 |
| Нитрат кобальта (III) | Co(NO3)3 |
| Нитрат лития | LiNO3 |
| Нитрат магния | Mg(NO3)2 |
| Нитрат марганца (II) | Mn(NO3)2 |
| Нитрат меди (II) | Cu(NO3)2 |
| Нитрат натрия | NaNO3 |
| Нитрат серебра(I) | AgNO3 |
| Нитрат хрома(III) | Cr(NO3)3 |
| Нитрат цезия | CsNO3 |
| Нитрат цинка | Zn(NO3)2 |
| Нитрид алюминия | AlN |
| Нитрид аммония | (NH4)3N |
| Нитрид бария | Ba3N2 |
| Нитрид бериллия | Be3N2 |
| Нитрид бора | BN |
| Нитрид галлия | GaN |
| Нитрид кальция | Ca3N2 |
| Нитрид церия | CeN |
| Нитрид цинка | Zn3N2 |
| Нитрид циркония | ZrN |
| Нитрит | NO2− |
| Нитрит бария | Ba(NO2)2 |
| Нитрит кальция | Ca(NO2)2 |
| Нитрит цинка | Zn(NO2)2 |
| Нитроглицерин | C3H5(NO3)3 |
| Нонадекан | C19H40 |
| Нонан | C9H20 |
| Одид германия(II) | GeI2 |
| Озон | O3 |
| Окись алюминия | AlO2 |
| Оксалат | C2O42− |
| Оксалат бария | BaC2O4 |
| Оксалат кадмия | CdC2O4 |
| Оксалат кальция | CaC2O4 |
| Оксалат кобальта (II) | CoC2O4 |
| Оксалат магния | MgC2O4 |
| Оксалат меди (II) | CuC2O4 |
| Оксалат натрия | Na2C2O4 |
| Оксалат серебра | Ag2C2O4 |
| Оксалат цезия | Cs2C2O4 |
| Оксид азота (I) | N2O |
| Оксид азота (II) | NO |
| Оксид азота (III) | N2O3 |
| Оксид азота (IV) | NO2 |
| Оксид азота (IV) | N2O4 |
| Оксид азота (V) | N2O5 |
| Оксид алюминия | Al2O3 |
| Оксид алюминия (I) | Al2O |
| Оксид алюминия (II) | Al2O2 |
| Оксид алюминия-кремния | AlOSi |
| Оксид алюминия- магния | Al2MgO4 |
| Оксид бария | BaO |
| Оксид бериллия- алюминия | Al2BeO4 |
| Оксид бериллия- алюминия | Al6BeO10 |
| Оксид берилллия бромеллит | BeO |
| Оксид бора | B2O3 |
| Оксид ванадия (III) | V2O3 |
| Оксид висмута (III) | Bi2O3 |
| Оксид вольфрама(IV) | WO2 |
| Оксид вольфрама (VI) | WO3 |
| Оксид галлия | Ga2O3 |
| Оксид германия (II) | GeO |
| Оксид германия (IV) | GeO2 |
| Оксид дейтерия | D2O |
| Оксид железа (III) никеля(II) | NiFe2O4 |
| Оксид золота (III) | Au2O3 |
| Оксид индия (III) | In2O3 |
| Оксид иттербия (III) | Yb2O3 |
| Оксид иттрия | Y2O3 |
| Оксид кадмия | CdO |
| Оксид кальция | CaO |
| Оксид кобальта(II) | CoO |
| Оксид кобальта (II) — алюминия | Al2CoO4 |
| Оксид магния | MgO |
| Оксид марганца (II) | MnO |
| Оксид марганца (III) | Mn2O3 |
| Оксид марганца (IV) | MnO2 |
| Оксид меди (II) | CuO |
| Оксид меди (II) — железа (II) | CuFe2O4 |
| Оксид молибдена (IV) | MoO2 |
| Оксид мышьяка (III) | As2O3 |
| Оксид мышьяка (V) | As2O5 |
| Оксид неодима (III) | Nd2O3 |
| Оксид никеля (II) | NiO |
| Оксид ниобия (III) | Nb2O3 |
| Оксид ртути (II) | HgO |
| Оксид серебра (I) | AgO |
| Оксид серебра (I) | Ag2O |
| Оксид титана (IV) | TiO2 |
| Оксид трития | T2O |
| Оксид урана- бария | BaU2O7 |
| Оксид хлора (III) | Cl2O3 |
| Оксид хлора (VI) | Cl2O6 |
| Оксид хлора (VII) | Cl2O7 |
| Оксид хрома (III) | Cr2O3 |
| Оксид хрома(IV) | CrO2 |
| Оксид хрома(VI) | CrO3 |
| Оксид цезия | Cs2O |
| Оксид церия (III) | Ce2O3 |
| Оксид церия (IV) | CeO2 |
| Оксид цинка | ZnO |
| Оксид-борид золота | AuBO |
| Оксид- тетрафторид ксенона | XeOF4 |
| Оксисульфат ванадия | VSO5 |
| Оксоборид алюминия | AlBO |
| Оксобромид мышьяка (III) | AsBrO |
| Оксоиодид висмута (III) | BiOI |
| Оксофторид алюминия | AlFO |
| Оксохлорид алюминия | AlClO |
| Оксохлорид висмута (III) | BiOCl |
| Оксохлорид мышьяка (III) | AsClO |
| Оксохлорид мышьяка(V) | AsCl3O |
| Октагидрат оксохлорида гафния (IV) | HfOCl2 · 8H2O |
| Октадекагидрат сульфата галлия | Ga2(SO4)3 · 18H2O |
| Октадекан | C18H38 |
| Октан | C8H18 |
| Ортоарсенат галлия | GaAsO4 |
| Ортоарсенат ртути (II) | Hg3(AsO4)2 |
| Ортобензо- хинон | C6H4O2 |
| Ортованадат бария | Ba3(VO4)2 |
| Ортованадат кальция | Ca3(VO4)2 |
| Ортованадат магния | Mg3(VO4)2 |
| Ортованадат натрия | Na3VO4 |
| Ортованадат хрома (III) | CrVO4 |
| Ортованадат цезия | Cs3VO4 |
| Ортовольфрамат висмута (III) | Bi2(WO4)3 |
| Ортовольфрамат лития | Li2WO4 |
| Ортовольфрамат никеля (II) | NiWO4 |
| Ортомолибдат лития | Li2MoO4 |
| Ортомолибдат марганца (II) | MnMoO4 |
| Ортомолибдат никеля(II) | NiMoO4 |
| Ортомолибдат цинка | ZnMoO4 |
| Ортосиликат кобальта(II) | Co2SiO4 |
| Ортосиликат лития | Li2SiO4 |
| Ортосиликат магния | Mg2SiO4 |
| Ортосиликат никеля(II) | Ni2SiO4 |
| Ортосиликат цинка | Zn2SiO4 |
| Ортосиликат циркония | ZrSiO4 |
| Ортофосфат бария | Ba3(PO4)2 |
| Ортофосфат бора | BPO4 |
| Ортофосфат висмута(III) | BiPO4 |
| Ортофосфат галлия | GaPO4 |
| Ортофосфат калия | К3РО4 |
| Ортофосфат меди (II) | Cu3(PO4)2 |
| Ортофосфат никеля(II) | Ni3(PO4)2 |
| Ортофосфат серебра | Ag3PO4 |
| Ортофосфат цезия | Cs3PO4 |
| Основной ацетат гафния(IV) | HfOH(C2H3O2)3 |
| Пантолактон | C6H10O3 |
| Парабензо- хинон | C6H4O2 |
| Пентагидрат нитрата висмута (III) | Bi(NO3)3·5H2O |
| Пентагидрат селената меди(II) | CuSeO4 · 5H2O |
| Пентадекан | C15H32 |
| Пентан | C5H12 |
| Пентаокси- дифторид | O5F2 |
| Пентафтор- бензоат | NaC6F5COO |
| Пентафтор- бензойная кислота | C6F5COOH |
| Пентафторид хлора | ClF5 |
| Пентоксид тетрамышьяка | As4O5 |
| Перекись водорода | H2O2 |
| Перксенат бария | Ba2XeO6 |
| Перксенат ион | XeO64− |
| Перксеноновая кислота | H4XeO6 |
| Перманганат бария | Ba(MnO4)2 |
| Перманганат серебра | AgMnO4 |
| Перовскит | CaTiO3 |
| Пероксид бария | BaO2 |
| Пероксид ванадия | V2O5 |
| Пероксид кальция | CaO2 |
| Пероксид натрия | Na2O2 |
| Пероксид цинка | ZnO2 |
| Пероксоди- серная кислота | H2S2O8 |
| Перхлорат аммония | NH4ClO4 |
| Перхлорат бария | Ba(ClO4)2 |
| Перхлорат кальция | Ca(ClO4)2 |
| Перхлорат кобальта(II) | Co(ClO4)2 |
| Перхлорат серебра | AgClO4 |
| Перхлорат хлора | ClOClO3 |
| Перхлорат цезия | CsClO4 |
| Пиридин | C5H5N |
| Пиридиний | HC5H5N+ |
| Пированадат бария | Ba2V2O7 |
| Пированадат натрия | Na4V2O7 |
| Пированадат- ион | V2O74− |
| Пирокатехин | C6H6O2 |
| Пирофосфат бария | Ba2P2O7 |
| Пирофосфат магния | Mg2P2O7 |
| Пирофосфат цинка | Zn2P2O7 |
| Плавиковая кислота | HF |
| Полутяжёлая вода | HDO |
| Пролин | C5H9NO2 |
| Пропан | C3H8 |
| Пропан | H3CCH2CH3 |
| Пропанамид | CH3CH2CONH2 |
| Пропанол-1 | CH3CH2CH2OH |
| Пропанол-1 пропанол-2 | C3H8O |
| Пропен | CH3CHCH2 |
| Пропиловый пируват | C6H10O3 |
| Пропин | CH3CCH |
| Пропионовая кислота | CH3CH2COOH |
| Резорцин | C6H6O2 |
| Рутил | TiO2 |
| Сахароза | C12H22O11 |
| Селенат бария | BaSeO4 |
| Селенат золота (III) | Au2(SeO4)3 |
| Селенат кальция | CaSeO4 |
| Селенат лития | Li2SeO4 |
| Селенат магния | MgSeO4 |
| Селенат натрия | Na2SeO4 |
| Селенат серебра | Ag2SeO4 |
| Селенат цезия | CsSeO4 |
| Селенид алюминия(I) | Al2Se |
| Селенид бария | BaSe |
| Селенид висмута (III) | Bi2Se3 |
| Селенид висмута (III) | Bi2Se3 |
| Селенид вольфрама (IV) | WSe2 |
| Селенид золота (III) | Au2Se3 |
| Селенид индия (III) | In2Se3 |
| Селенид кадмия | CdSe |
| Селенид кальция | CaSe |
| Селенид кобальта(II) | CoSe |
| Селенид магния | MgSe |
| Селенид меди(I) | Cu2Se |
| Селенид меди (II) | CuSe |
| Селенид мышьяка (I) | As2Se |
| Селенид мышьяка (III) | As2Se3 |
| Селенид мышьяка (V) | As2Se5 |
| Селенид никеля (II) | NiSe |
| Селенид ртути (II) | HgSe |
| Селенид хрома (III) | Cr2Se3 |
| Селенид цинка | ZnSe |
| Селенит бария | BaSeO3 |
| Селенит кадмия | CdSeO3 |
| Селенит кальция | CaSeO3 |
| Селенит кобальта (II) | CoSeO3 |
| Селенит лития | Li2SeO3 |
| Селенит магния | MgSeO3 |
| Селенит натрия | Na2SeO3 |
| Селенит ртути (II) | HgSeO3 |
| Селенит серебра | Ag2SeO3 |
| Селенит цинка | ZnSeO3 |
| Селеновая кислота | H2SeO4 |
| Серин | C3H7NO3 |
| Серная кислота | H2SO4 |
| Сернистая кислота | H2SO3 |
| Сероводород | H2S |
| Сероуглерод | CS2 |
| Силан | SiH4 |
| Силикат алюминия | Al2O5Si |
| Силикат алюминия | Al2O5Si |
| Силикат алюминия | Al2O7Si2 |
| Силицид бария | BaSi2 |
| Силицид хрома (II) | Cr3Si2 |
| Силицид церия | CeSi2 |
| Силицид циркония | ZrSi2 |
| Соляная кислота | HCl |
| Станнат бария | BaSn3 |
| Станнат кобальта (II) | Co2SnO4 |
| Станнат цинка | ZnSnO3 |
| Стеариновая кислота | CH3 (CH2)16COOH |
| Стеариновая кислота | C18H36O2 |
| Субфторид серебра | Ag2F |
| Сульфанилат натрия | NaNH2C6H4SO3 |
| Сульфаниловая кислота | NH2C6H4SO3H |
| Сульфат аммония | (NH4)2SO4 |
| Сульфат бария | BaSO4 |
| Сульфат бериллия | BeSO4 |
| Сульфат гафния (IV) | Hf(SO4)2 |
| Сульфат кадмия | CdSO4 |
| Сульфат кальция | CaSO4 |
| Сульфат кобальта (II) | Co2SO4 |
| Сульфат лития | Li2SO4 |
| Сульфат магния | MgSO4 |
| Сульфат меди(II) | CuSO4 |
| Сульфат натрия | Na2SO4 |
| Сульфат никеля | NiSO4 |
| Сульфат свинца (II) | PbSO4 |
| Сульфат серебра | Ag2SO4 |
| Сульфат хрома (III) | Cr2(SO4)3 |
| Сульфат цезия | Cs2SO4 |
| Сульфат церия (IV) | Ce(SO4)2 |
| Сульфат цинка | ZnSO4 |
| Сульфид алюминия | Al2S3 |
| Сульфид алюминия | Al2S3 |
| Сульфид алюминия (I) | Al2S |
| Сульфид бария | BaS |
| Сульфид бериллия | BeS |
| Сульфид бора | B2S3 |
| Сульфид висмута (III) | Bi2S3 |
| Сульфид вольфрама(IV) | WS2 |
| Сульфид вольфрама(VI) | WS3 |
| Сульфид галлия | Ga2S3 |
| Сульфид железа (II) | FeS |
| Сульфид железа-меди | CuFeS2 |
| Сульфид железа- меди | CuFe2S3 |
| Сульфид золота (I) | Au2S |
| Сульфид золота (III) | Au2S3 |
| Сульфид индия (II) | InS |
| Сульфид индия (III) | In2S3 |
| Сульфид иттербия (III) | Yb2S3 |
| Сульфид иттрия | Y2S3 |
| Сульфид кадмия | CdS |
| Сульфид кальция | CaS |
| Сульфид кобальта(II) | CoS |
| Сульфид кобальта (II) | Co2S3 |
| Сульфид магния | MgS |
| Сульфид марганца(II) | MnS |
| Сульфид меди | Cu9S5 |
| Сульфид меди (I) | Cu2S |
| Сульфид меди (II) | CuS |
| Сульфид молибдена (IV) | MoS2 |
| Сульфид мышьяка (V) | As2S5 |
| Сульфид натрия | Na2S |
| Сульфид никеля | NiS2 |
| Сульфид никеля (II) | NiS |
| Сульфид ртути (II) | HgS |
| Сульфид свинца | PbS |
| Сульфид серебра (I) | Ag2S |
| Сульфид хрома (III) | Cr2S3 |
| Сульфид цезия | Cs2S |
| Сульфид церия (II) | CeS |
| Сульфид церия (III) | Ce2S3 |
| Сульфид цинка | ZnS |
| Сульфид циркония | ZrS2 |
| Сульфид- арсенид никеля | NiAsS |
| Сульфин | H2CSO |
| Сульфит бария | BaSO3 |
| Сульфит кадмия | CdSO3 |
| Сульфит цезия | Cs2SO3 |
| Супероксид цезия | CsO2 |
| Сфалерит | ZnS |
| Танталат лития | LiTaO3 |
| Теллурат кадмия | CdTeO4 |
| Теллурат кальция | CaTeO4 |
| Теллурат лития | Li2TeO4 |
| Теллурат натрия | Na2TeO4 |
| Теллурат хрома (III) | Cr2(TeO4)3 |
| Теллурат цезия | Cs2TeO4 |
| Теллурат цинка | ZnTeO4 |
| Теллурид алюминия (I) | Al2Te |
| Теллурид висмута (III) | Bi2Te3 |
| Теллурид вольфрама (IV) | WTe2 |
| Теллурид галлия | Ga2Te3 |
| Теллурид галлия (II) | GaTe |
| Теллурид золота | AuTe |
| Теллурид индия (II) | InTe |
| Теллурид индия (III) | In2Te3 |
| Теллурид кадмия | CdTe |
| Теллурид кальция | CaTe |
| Теллурид кобальта (II) | CoTe |
| Теллурид марганца (II) | MnTe |
| Теллурид меди (I) | Cu2Te |
| Теллурид меди (II) | CuTe |
| Теллурид ртути (II) | HgTe |
| Теллурид серебра (I) | Ag2Te |
| Теллурид хрома (III) | Cr2Te3 |
| Теллурид цинка | ZnTe |
| Теллуристая кислота | H2TeO3 |
| Теллурит бария | BaTeO3 |
| Теллурит кальция | CaTeO3 |
| Теллурит лития | Li2TeO3 |
| Теллурит меди(II) | CuTeO3 |
| Теллурит натрия | Na2TeO3 |
| Теллурит ртути (II) | HgTeO3 |
| Теллурит цинка | ZnTeO3 |
| Теллуровая кислота | H6TeO6 |
| Теллуровисмутит | |
| Тетра- бромооксид вольфрама(VI) | WOBr4 |
| Тетра- гемигидрат нитрата индия (III) | In(NO3)3·4,5H2O |
| Тетра- гидрат нитрата кальция | Ca(NO3)2 · 4H2O |
| Тетра- гидрат перхлората ртути(I) | HgClO4 · 4H2O |
| Тетра- гидрат хлорида индия(III) | InCl3·4H2O |
| Тетра- гидрофуран | C4H8O |
| Тетрадекан | C14H30 |
| Тетраиодид димышьяка | As2I4 |
| Тетра- иодомеркурат бария | BaHgI4 |
| Тетра- карбонил никеля | Ni(CO)4 |
| Тетра- нитроборат (III) натрия | Na[B(NO3)4] |
| Тетра- оксид ксенона | XeO4 |
| Тетра- оксид тримышьяка | As3O4 |
| Тетра- оксидифторид | O4F2 |
| Тетра- сульфид димышьяка | As2S4 |
| Тетра- сульфид тетрамышьяка | As4S4 |
| Тетра- фенилгерман | (C6H5)4Ge |
| Тетра- фтороалюминат калия | AlF4K |
| Тетра- фтороалюминат лития | AlF4Li |
| Тетра- фторэтилен | C2F4 |
| Тетрахлорид углерода | CCl4 |
| Тетрахлорид циркония | ZrCl4 |
| Тетра- хлорметан | |
| Тетра- хлороалюминат калия | AlCl4K |
| Тетра- хлороалюминат натрия | AlCl4Na |
| Тетра- хлороалюминат рубидия | AlCl4Rb |
| Тетра- хлороалюминат цезия | AlCl4Cs |
| Тетра- хлорооксид вольфрама (VI) | WOCl4 |
| Тиамина гидрохлорид | HC12H17ON4SCl2 |
| Тиомолибдат натрия | Na2MoS4 |
| Тиосульфат бария | BaS2O3 |
| Тиосульфат натрия | Na2S2O3 |
| Тиоцианат аммоний-ртуть (II) | (NH4)2Hg(SCN)4 |
| Тиоцианат бария | Ba(SCN)2 |
| Тиоцианат железа | Fe(CNS)3 |
| Тиоцианат калия | KCNS |
| Тиоцианат меди (I) | CuSCN |
| Тиоцианат ртути (II) | Hg(SCN)2 |
| Тиоцианат серебра | AgSNC |
| Тиоцианат цезия | CsSCN |
| Тиоцианат цинка | Zn(SCN)2 |
| Тирозин | C9H11NO3 |
| Титанат бария | BaTiO3 |
| Титанат кадмия | CdTiO3 |
| Титанат кальция | CaTiO3 |
| Титанат кобальта(II) | CoTiO3 |
| Титанат меди(II) | CuTiO3 |
| Титанат стронция | SrTiO3 |
| Титанат цезия | Cs2TiO3 |
| Титанит кобальта(II) | Co2TiO4 |
| Титановая кислота | H2TiO3 |
| Толуол | C7H8 |
| Треонин | C4H9NO3 |
| Трет- бутиловый спирт | (CH3)3COH |
| Трет- бутилхлорид | (CH3)3CCl |
| Трибромид алюминия | AlBr3 |
| Трибромид мышьяка | AsBr3 |
| Трибромид серебра(III) | Ag3Br3 |
| Трибромид цезия | CsBr3 |
| Трибромооксид вольфрама(V) | WOBr3 |
| Тригидрат нитрата меди (II) | Cu(NO3)2 · 3H2O |
| Тригидрат перхлората ртути (II) | Hg(ClO4)2 · 3H2O |
| Тригидрат теллурата бария | BaTeO4·3H2O |
| Тридекан | C13H28 |
| Трииодид | I3− |
| Трииодид азота | NI3 |
| Трииодид алюминия | AlI3 |
| Трииодид серебра (III) | Ag3I3 |
| Трииодид цезия | CsI3 |
| Трикарбонато- кобальтат (III) натрия | Na3[Co(CO3)3] |
| Триоксид ксенона | XeO3 |
| Триоксид тетрамышьяка | As4O3 |
| Триоксофторид хлора | ClO3F |
| Триптофан | C11H12N2O2 |
| Трисульфид тетрамышьяка | As4S3 |
| Трифосфид мышьяка | AsP3 |
| Трифторид алюминия | AlF3 |
| Трифторид бора | BF3 |
| Трифторид хлора | ClF3 |
| Трихлорид алюминия | AlCl3 |
| Трихлорид мышьяка | AsCl3 |
| Трихлорид серебра (III) | Ag3Cl3 |
| Трихлорид серебра- меди | AgCl3Cu2 |
| Трихлорооксид вольфрама (V) | WOCl3 |
| Угольная кислота | H2CO3 |
| Уксусная кислота | C2H4O2 |
| Уксусная кислота этановая кислота | CH3COOH |
| Ундекан | C11H24 |
| Фенилаланин | C9H11NO2 |
| Фенол | C6H5OH |
| Флюорит | CaF2 |
| Формальдегид | CH2O |
| Формальдегид | H2CO |
| Формамид | HCONH2 |
| Формат марганца (II) | Mn(CHO2)2 |
| Формат натрия | NaHCOO |
| Формиат | CHO2− |
| Формиат | HCOO− |
| Формиат аммония | HCOONH4 |
| Формиат бария | Ba(CHO2)2 |
| Формиат бериллия | Be(CHO2)2 |
| Формиат кальция | Ca(CHO2)2 |
| Фосген | COCl2 |
| Фосфат индия (III) | InPO4 |
| Фосфат кадмия | Cd3(PO4)2 |
| Фосфат лантана (III) | LaPO4 |
| Фосфат хрома(III) | CrPO4 |
| Фосфат цинка | Zn3(PO4)2 |
| Фосфат циркония | Zr3(PO4)4 |
| Фосфид алюминия | AlP |
| Фосфид алюминия- галлия- индия | AlGaInP |
| Фосфид бора | BP |
| Фосфид индия | InP |
| Фосфид иттрия | YP |
| Фосфид кадмия | Cd3P2 |
| Фосфид кальция | Ca3P2 |
| Фосфид магния | Mg3P2 |
| Фосфид марганца (II) | Mn3P2 |
| Фосфид меди (I) | Cu3P |
| Фосфид мышьяка (III) | AsP |
| Фосфид мышьяка (III) | As3P |
| Фосфид цинка | Zn3P2 |
| Фосфид циркония | ZrP2 |
| Фосфорная кислота | H3PO4 |
| Фруктоза | C6H12O6 |
| Фталевая кислота | H2C8H4O4 |
| Фторид бария | BaF2 |
| Фторид бериллия | BeF2 |
| Фторид бора | B2F4 |
| Фторид висмута (III) | BiF3 |
| Фторид вольфрама (IV) | WF4 |
| Фторид вольфрама(V) | WF5 |
| Фторид вольфрама (VI) | WF6 |
| Фторид гафния (IV) | HfF4 |
| Фторид золота (III) | AuF3 |
| Фторид иттербия (II) | YbF2 |
| Фторид иттербия (III) | YbF3 |
| Фторид иттрия | YF3 |
| Фторид кадмия | CdF2 |
| Фторид калия | KF |
| Фторид кальция | CaF2 |
| Фторид кобальта (II) | CoF2 |
| Фторид кобальта (III) | CoF3 |
| Фторид ксенона (I) | XeF |
| Фторид ксенона (II) | XeF2 |
| Фторид ксенона (IV) | XeF4 |
| Фторид ксенона (VI) | XeF6 |
| Фторид лития | LiF |
| Фторид магния | MgF2 |
| Фторид марганца (II) | MnF2 |
| Фторид мышьяка (III) | AsF3 |
| Фторид мышьяка (V) | AsF5 |
| Фторид серебра (I) | AgF |
| Фторид урана (IV) | UF4 |
| Фторид урана (VI) | UF6 |
| Фторид хлора | ClF |
| Фторид хрома (II) | CrF2 |
| Фторид хрома (III) | CrF3 |
| Фторид хрома (IV) | CrF4 |
| Фторид хрома (V) | CrF5 |
| Фторид хрома (VI) | CrF6 |
| Фторид цезия | CsF |
| Фторид церия (III) | CeF3 |
| Фторид церия (IV) | CeF4 |
| Фторид цинка | ZnF2 |
| Фторид циркония | ZrF4 |
| Фторид- дихлорид алюминия | AlCl2F |
| Фторид- тетрахлорид мышьяка | AsCl4F |
| Фторид- хлорид алюминия | AlClF |
| Фторид- хлорид аргона | ArClF |
| Фторноватистая кислота | HOF |
| Фтороводород | HF |
| Фтортрихлор- метан фреон-11 | CFCl3 |
| Фульминат серебра | AgONC |
| Халькозит | Cu2S |
| Халькопирит | CuFeS2 |
| Хинин | C20H24O2N2 |
| Хинон | C6H4O2 |
| Хиолит | Al3F14Na5 |
| Хлор | Cl2 |
| Хлорат кальция | Ca(ClO3)2 |
| Хлорат магния | Mg(ClO3)2 |
| Хлорат серебра | AgClO3 |
| Хлорат цезия | CsClO3 |
| Хлорат цинка | Zn(ClO3)2 |
| Хлорид алюминия- калия | Al2Cl9K3 |
| Хлорид аммония | NH4Cl |
| Хлорид бария | BaCl2 |
| Хлорид бериллия | BeCl2 |
| Хлорид бора | BCl3 |
| Хлорид бора | B2Cl4 |
| Хлорид брома | BrCl |
| Хлорид ванадия (II) | VCl2 |
| Хлорид ванадия (III) | VCl3 |
| Хлорид висмута (III) | BiCl3 |
| Хлорид вольфрама (II) | WCl2 |
| Хлорид вольфрама (III) | WCl3 |
| Хлорид вольфрама (IV) | WCl4 |
| Хлорид вольфрама (V) | WCl5 |
| Хлорид вольфрама (VI) | WCl6 |
| Хлорид галлия | GaCl3 |
| Хлорид железа (II) | FeCl2 |
| Хлорид золота (I) | AuCl |
| Хлорид золота (III) | AuCl3 |
| Хлорид индия (I) | InCl |
| Хлорид индия (II) | InCl2 |
| Хлорид индия (III) | InCl3 |
| Хлорид иода (I) | ICl |
| Хлорид иода (III) | ICl3 |
| Хлорид иттербия (II) | YbCl2 |
| Хлорид иттербия (III) | YbCl3 |
| Хлорид иттрия | YCl3 |
| Хлорид кадмия | CdCl2 |
| Хлорид калия | KCl |
| Хлорид калия | KCl |
| Хлорид кальция | CaCl2 |
| Хлорид кобальта (II) | CoCl2 |
| Хлорид лантана (III) | LaCl3 |
| Хлорид магния | MgCl2 |
| Хлорид марганца (II) | MnCl2 |
| Хлорид меди(I) | CuCl |
| Хлорид меди (II) | CuCl2 |
| Хлорид молибдена (II) | MoCl2 |
| Хлорид молибдена (III) | MoCl3 |
| Хлорид молибдена (V) | MoCl5 |
| Хлорид натрия | NaCl |
| Хлорид неодима (II) | NdCl2 |
| Хлорид никеля (II) | NiCl2 |
| Хлорид ниобия (III) | NbCl3 |
| Хлорид ниобия (V) | NbCl5 |
| Хлорид нитрила | NO2Cl |
| Хлорид ртути (I) | Hg2Cl2 |
| Хлорид ртути (II) | HgCl2 |
| Хлорид серебра (I) | AgCl |
| Хлорид тантала (V) | TaCl5 |
| Хлорид хрома (II) | CrCl2 |
| Хлорид хрома (III) | CrCl3 |
| Хлорид хрома (IV) | CrCl4 |
| Хлорид цезия | CsCl |
| Хлорид церия (III) | CeCl3 |
| Хлорид цинка | ZnCl2 |
| Хлористая кислота | HClO2 |
| Хлористый алюминий | AlCl2 |
| Хлорметан метилхлорид | CH3Cl |
| Хлорная кислота | HClO4 |
| Хлорноватая кислота | HClO3 |
| Хлорноватистая кислота | HClO |
| Хлороводород | HCl |
| Хлороформ трихлорметан трихлорид метила | CHCl3 |
| Хлоруксусная кислота | CH2ClCOOH |
| Хромат аммония | (NH4)2CrO4 |
| Хромат бария | BaCrO4 |
| Хромат бария- калия | BaK2(CrO4)2 |
| Хромат кадмия | CdCrO4 |
| Хромат кобальта (II) | CoCrO4 |
| Хромат лития | Li2CrO4 |
| Хромат магния | MgCrO4 |
| Хромат цезия | Cs2CrO4 |
| Хромат (V) бария | Ba3(CrO4)2 |
| Хромат (VI) серебра (I) | Ag2CrO4 |
| Хромилхлорид | CrO2Cl2 |
| Хромит кобальта (II) | CoCr2O4 |
| Хромит цинка | ZnCr2O4 |
| Хромовая кислота | H2CrO4 |
| Цвиттер- ион | H3N+CH2COO− |
| Церианит | CeO3 |
| Цианамид кальция | CaCN2 |
| Цианат | CNO− |
| Цианид | CN− |
| Цианид бария | Ba(CN)2 |
| Цианид золота (I) | AuCN |
| Цианид кадмия | Cd(CN)2 |
| Цианид калия | KCN |
| Цианид кальция | Ca(CN)2 |
| Цианид кобальта (II) | Co(CN)2 |
| Цианид кобальта (III) | Co(C2H3O2)3 |
| Цианид лития | LiCN |
| Цианид натрия | NaCN |
| Цианид серебра | AgCN |
| Цианид цезия | CsCN |
| Цианид цинка | Zn(CN)2 |
| Циановодород | HCN |
| Циануровая кислота | C3N3(OH)3 |
| Циануровый триазид | C3N12 |
| Циклобутан | C4H8 |
| Циклогексан | C6H12 |
| Цикло- пентадиенил- анион | C5H5− |
| Циклопентан | C5H10 |
| Циклопропан пропилен | C3H6 |
| Цинкат натрия | Na2ZnO2 |
| Циркон | ZrSiO4 |
| Цирконат бария | BaZrO3 |
| Цирконат- ион | ZrO32− |
| Цистеин Cys | C3H7NO2S |
| Цитрат | C6H5O73− |
| Цитрат висмута (III) | BiC6H5O7 |
| Цихлоро- тетраоксид | ClOClO3 |
| Частично тритированная вода | HTO |
| Щавелевая кислота | HOOCCOOH |
| Эйкозан | C20H42 |
| Эсколаит | Cr2O3 |
| Этан | C2H6 |
| Этанол | CH3CH2OH |
| Этанол этиловый спирт | C2H5OH |
| Этиламин | C2H5NH2 |
| Этилат | C2H5O− |
| Этилат лития | LiC2H5O |
| Этилен | C2H4 |
| Этиленгликоль | CH2OHCH2OH |
| Этилендиамин | NH2CH2CH2NH2 |
| Эфедрин | C10H15ON |
| Дисилицид циркония | ZrSi2 |
| Перхлорат калия | KClO4 |
| 1,1,2 — трифтор- трихлорэтан, Фреон — 113 | CFCl2CF2Cl |
| 1,3 — бутадиен | CH2CHCHCH2 |
| 2- броммасляная кислота 4- броммасляная кислота | C4H7BrO2 |
| 2- бутен | CH3CHCHCH3 |
| 2- гермауксусная кислота | GeH3COOH |
| 2- гидрокси- пропилакрилат | C6H10O3 |
| 2- метилпропан | C4H10 |
| 4- ацетилмасляная кислота | C6H10O3 |
Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица Менделеева. Названия. Электронные формулы. Молярные массы. Структурные формулы. Таблицы степеней окисления и валентности. Изотопы. Поделиться:
| ||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||
Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.
Free xml sitemap generator Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.
Free xml sitemap generator | |||
Химические формулы веществ. Валентность химических элементов.
7 кл. Химия. Урок №________ ________________
Тема: Химические формулы веществ. Валентность химических элементов.
Цель урока: Познакомить учащихся с понятием валентность; сформировать понятие валентность и умение определять валентность по химическим формулам и составлять химические формулы по валентности. Развивать умение записывать химические формулы веществ, зная валентность элементов, входящих в состав данного вещества. Приобретение навыков самостоятельной работы. Воспитывать познавательный интерес к предмету.
Тип урока: комбинированный.
Оборудование: таблицы и схемы
Ход урока:
1. Организационный момент
Организационный момент
2. Проверка домашнего задания. Устный опрос учащихся
3. Актуализация знаний.
Сегодня мы с вами повторим материал, который изучали на прошлом уроке «Химическая формула». Относительная молекулярная масса». Потренируемся в вычислении относительной молекулярной массы. А затем перейдем к изучению новой темы.
Итак, первый вопрос: что такое химическая формула? (предполагаемый ответ – химическая формула – это запись, выражающая качественный и количественный состав данного вещества).
А что такое, качественный и количественный состав вещества? (предполагаемый ответ – качественный состав – это какие элементы входят в состав данного вещества, а количественный – в каком соотношении).
Что такое, индекс и коэффициент в химической формуле? (предполагаемый ответ – индекс обозначает число атомов каждого химического элемента, входящего в состав молекулы, пишется справа внизу от символа элемента. Коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
Коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
Что означает следующая запись:
2Сl, 2Сl2, 3Сl2, 5НСl
Предполагаемый ответ:
2Сl – два атома хлора;
2Сl2 – две молекулы хлора;
3Сl2 – три молекулы хлора;
5НСl – пять молекул хлороводорода.
Следующий вопрос: Что такое относительная молекулярная масса, как она обозначается и как рассчитывается?
Предполагаемый ответ – относительная молекулярная масса – показывает во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода; обозначается Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом индексов.
Давайте рассчитаем Мr молекулы следующего вещества:
Мr(Al2(SO4)3) = Ar(Al)2 + Ar(S)3 + Ar(O)12 = 54 + 96 + 192 = 342
Значит относительная молекулярная масса Al2(SO4)3 равна 342.
4. Мотивация учебной и познавательной деятельности учащихся. Итак, а теперь переходим к изучению новой темы. В конце урока мы напишем небольшую самостоятельную работу по новой теме, поэтому слушайте внимательно и переписывайте записи с доски. Запишите тему урока: «Валентность химических элементов».
5. Объяснение нового материала по теме «Валентность химических элементов»
Только что мы с вами вспомнили, что такое химическая формула. Каждое вещество имеет свою химическую формулу, которая выражает его качественный и количественный состав, т.е. какие элементы и в каком количестве входят в состав одной молекулы данного вещества.
А как же узнают состав каждого вещества. С помощью сложных экспериментов. Однако, зная валентность можно составить формулу любого вещества. Итак, запишем, что же такое валентность:
Валентность – это способность атомов удерживать при себе определенное число атомов других элементов.
Валентность атома водорода принята за единицу.
I I I I
НСl H2O NH3 CH4
Cледовательно, атом водорода не может присоединять больше одного атома другого элемента, но другие элементы могут присоединять один (НСl), два (H2O), три (NH3), четыре (CH4) и более атомов водорода (показать шаростержневые модели этих молекул).
Валентность обозначается римской цифрой, которая ставится над знаком химического элемента в формуле вещества.
А кислород? Атом кислорода всегда двухвалентен.
II II II
H2O SO3 CO2
Атомы одних химических элементов имеют постоянную валентность, а других переменную (т.е. в разных соединениях один и тот же элемент может проявлять разную валентность):
VI IV II
SO3 SO2 H2S
В учебнике на странице 25 в таблице приведены валентности химических элементов в соединениях. Жирным шрифтом обозначены те элементы, которые имеют постоянную валентность (Na, К, Н, О и др.).
Жирным шрифтом обозначены те элементы, которые имеют постоянную валентность (Na, К, Н, О и др.).
Зная формулы веществ, состоящих из двух элементов, и валентность одного из них, можно определить валентность другого элемента. Например, СuO – оксид меди (II). Мы знаем, что валентность кислорода равна двум. Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Запишем правила определения валентности по формулам их соединений.
Правила определения валентности элементов в соединениях:
1. Записать химическую формулу вещества и указать валентность известного элемента.
Например, оксид углерода (IV) имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II
II
СО2
2. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
3. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности.
Индекс при атоме углерода равен 1, значит:
4 : 1 = IV – это и есть валентность атома углерода
IV II
СО2
Разберем еще один пример:
II
Fe2O3
1. Валентность кислорода постоянна и равна II.
2. НОК: 3 × II = 6
3. 6 : 2 = III – это и есть валентность атома железа
III II
Fe2O3
Определим валентность химических элементов в следующих соединениях:
СаО ZnCl2
N2O3 Li2S
NH3 Mg3P2
Валентность атомов кислорода вы уже знаете, а валентность других элементов, имеющих постоянную валентность, находим по таблице.
Вы уже умеете определять валентность химических элементов в соединениях, формулы которых известны. А теперь рассмотрим как, зная валентность составить химические формулы.
Для составления химической формулы, нужно знать валентность элементов в данном соединении. Валентности некоторых элементов представлены в таблице учебника.
Правила составления химических формул по валентности:
1. Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl..O..
Валентность кислорода равна двум, валентность алюминия постоянна, находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl..O..
2. Определить НОК чисел, обозначающих валентность обоих элементов.
НОК – наименьшее из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел.
НОК II и III – 6
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
III II
Аl2O3
Разберем еще один пример: соединение серы с водородом, при чем валентность серы указана, так как сера имеет переменную валентность.
II
Н..S..
1.Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т. е. индекс при атоме водорода равен 2
е. индекс при атоме водорода равен 2
4. Записываем формулу с учетом индексов:
I II
Н2S
В названии веществ, имеющих переменную валентность, в скобках пишут валентность данного элемента в этом соединении:
СuO – оксид меди (II)
Cu2O – оксид меди (I)
Расставим индексы в формулах следующих соединений:
II III
К..S.. Мg..N..
IV I
Мg..Si.. С..Сl..
II I I
Fe..Сl.. Са..F..
6. Закрепление материала, повторение ключевых моментов.
Итак, сегодня на уроке мы узнали, что такое валентность, как определить валентность элементов, формула которого известна, и наоборот, зная валентность составить химическую формулу. Сейчас мы проверим, как вы усвоили данную тему, для этого напишем самостоятельную работу.
I вариант
1. Определите валентность химических элементов в следующих соединениях:
СО, ZnS, SiН4
2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) железа (II)
б) азота (IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) бария
б) железа (III)
II вариант
1. Определите валентность химических элементов в следующих соединениях:
HBr, Ca3P2, MgCl2
2. Расставьте индексы в химических формулах следующих соединений:
Расставьте индексы в химических формулах следующих соединений:
VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) калия
б) кремния(IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) алюминия
б) кальция
III вариант
1. Определите валентность химических элементов в следующих соединениях:
NO, Na2S, СaCl2
2. Расставьте индексы в химических формулах следующих соединений:
I II
а) Ag.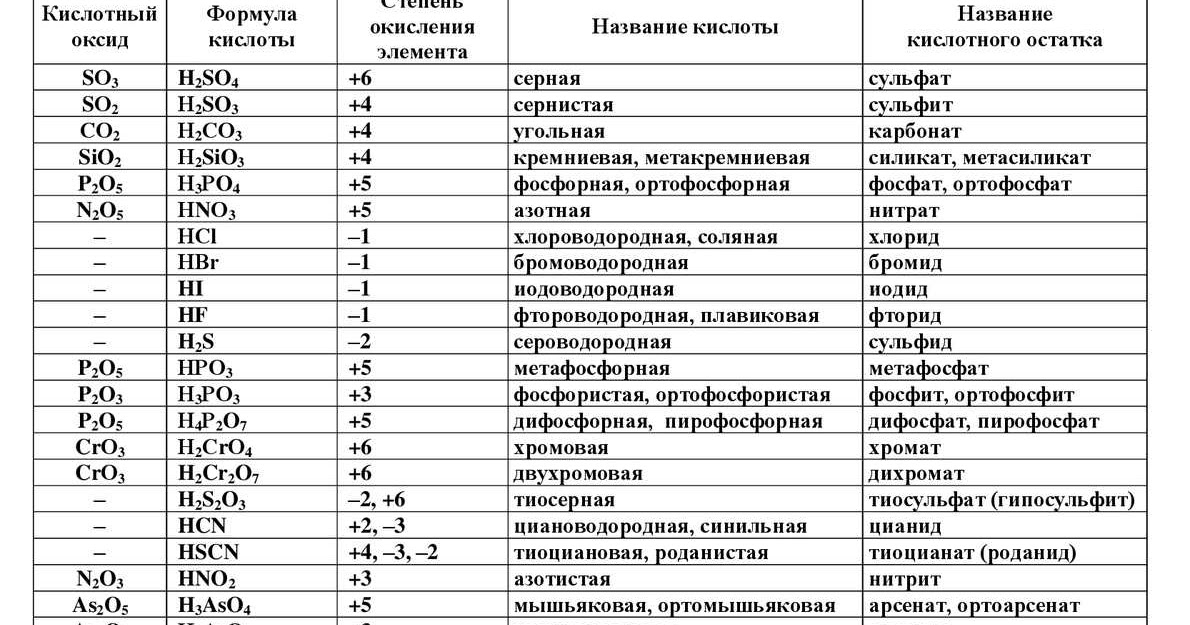 .S..
.S..
II
б) Аl..S..
IV
в) Si..H..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) хлора (VII)
б) бария
4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
а) железа (III)
б) меди (II)
IV вариант
1. Определите валентность химических элементов в следующих соединениях:
NaI, SiCl4, MgS
2. Расставьте индексы в химических формулах следующих соединений:
I
а) N..O..
I
б) Ba.. Cl..
Cl..
IV
в) Si..O..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) cеры(VI)
б) углерода(II)
4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
а) cеребра (I)
б) алюминия
7. Подведение итогов урока. Оценивание.
8. Домашнее задание выучить конспект, выполнить задание
I вариант
1. Определите валентность химических элементов в следующих соединениях:
СО, ZnS, SiН4
2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl. .I..
.I..
V I
в) Р..Cl..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) железа (II)
б) азота (IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) бария
б) железа (III)
II вариант
1. Определите валентность химических элементов в следующих соединениях:
HBr, Ca3P2, MgCl2
2. Расставьте индексы в химических формулах следующих соединений:
VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu. .S..
.S..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) калия
б) кремния(IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) алюминия
б) кальция
III вариант
1. Определите валентность химических элементов в следующих соединениях:
NO, Na2S, СaCl2
2. Расставьте индексы в химических формулах следующих соединений:
I II
а) Ag..S..
II
б) Аl..S..
IV
в) Si..H..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) хлора (VII)
б) бария
4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
а) железа (III)
б) меди (II)
IV вариант
1. Определите валентность химических элементов в следующих соединениях:
NaI, SiCl4, MgS
2. Расставьте индексы в химических формулах следующих соединений:
I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) cеры(VI)
б) углерода(II)
4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
а) cеребра (I)
б) алюминия
Формулы химические — Справочник химика 21
На основании атомистической теории Дальтона, гипотезы Авогадро, закона Дюлонга и Пти и метода Канниццаро стало возможным получать атомные массы элементов ио данным химического анализа, плотности газов и удельной теплоемкости твердых тел. Все это привело к известной нам таблице атомных масс, помещенной на внутренней стороне обложки этой книги. Объяснение формул химических соединений, которые стало возможным получать на этой основе, представляло собой очередную важнейшую задачу химии. [c.294]
Все это привело к известной нам таблице атомных масс, помещенной на внутренней стороне обложки этой книги. Объяснение формул химических соединений, которые стало возможным получать на этой основе, представляло собой очередную важнейшую задачу химии. [c.294]
Для определения брутто-формулы химического соединения используют данные его качественного и количественного элементного анализа. Это осуществляется в следующей последовательности. [c.130]
Определение эмпирической формулы химического соединения [c.98]
Нахождение формулы химического соединения по его известным массовым долям элементов. (Звездочкой отмечены задачи повышенной трудности.) [c.209]
Определение истинных формул химических [c.14]
Как мы знаем, все твердые вещества как кристаллического, так и непериодического строения имеют остов, вид и мерность которого определяют строение вещества. Атом представляет собой систему, состоящую из валентных электронов и атомного остова. Атомное ядро отклоняется от положения равновесия весьма незначительно и практически локализовано внутри атома, тогда как валентные электроны совершают колебания с амплитудой, равной междуатомным расстояниям. Поэтому по местонахождению ядер можно определить, какое положение занимают данные атомы в молекулах и кристаллах. Зная, что степень перекрывания волновых функций достигает максимума при сближении атомов на определенное расстояние (речь идет о средних межатомных расстояниях в твердом теле, которые могут быть найдены, например, рентгеноструктурным методом) и резко уменьшается на несколько большем расстоянии, можно точно установить, какие атомы связаны между собой химическими связями. Химические связи между атомами в формулах химических соединений принято обозначать черточками. Например, хотя в молекуле дело- [c.60]
Атом представляет собой систему, состоящую из валентных электронов и атомного остова. Атомное ядро отклоняется от положения равновесия весьма незначительно и практически локализовано внутри атома, тогда как валентные электроны совершают колебания с амплитудой, равной междуатомным расстояниям. Поэтому по местонахождению ядер можно определить, какое положение занимают данные атомы в молекулах и кристаллах. Зная, что степень перекрывания волновых функций достигает максимума при сближении атомов на определенное расстояние (речь идет о средних межатомных расстояниях в твердом теле, которые могут быть найдены, например, рентгеноструктурным методом) и резко уменьшается на несколько большем расстоянии, можно точно установить, какие атомы связаны между собой химическими связями. Химические связи между атомами в формулах химических соединений принято обозначать черточками. Например, хотя в молекуле дело- [c.60]
Химические формулы. Химическими формулами пользуются для обозначения состава простых и сложных веществ. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода. [c.27]
Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода. [c.27]
Электронные формулы Химические формулы, в которых точками обозначают внешние электроны каждого атома, участвующие в образовании химических связей [c.549]
Задание. Как влияет концентрация раствора нелетучего вещества на температуры его кристаллизации и кипения Проанализируйте формулу химического потенциала растворителя. Вспомните, что химический потенциал характеризует способность компонента выделяться из данной фазы. [c.187]
Воспользуемся формулой химического потенциала идеального газа (4.49) и перейдем к парциальным давлениям [c.127]
Установление простейших и истинных формул химических соединений [c. 14]
14]
Из сказанного следует, что в методе ВС каждая МО формируется из двух АО, а химическая связь объясняется взаимодействием двух электронов с антипараллельными спинами. Это наглядно и удобно, так как такая пара электронов аналогична валентному штриху в структурных формулах химических соединений. Однако существуют соединения, обусловленные химической связью с одним или несколькими электронами, обобществленными разными атомами, свойства которых трудно описать с помощью метода ВС. По этой причине большее распространение в настоящее время получил метод молекулярных орбиталей (метод МО), разработанный Малликеном, Гундом, Хюккелем и др. [c.31]
Такое соотношение отвечает как формуле НСО2, так и формулам Н2С 04, НзС зОй и т. д. Чтобы сделать вывод об истинной формуле химического соединения, надо определить его молекулярную массу. Если она окажется равной 90, то вопрос тем самым реп1ится в пользу формулы И2С2О4. [c.14]
[c.14]
В другом примере рассмотрим предсказание формулы химического соединения на основании периодической таблицы. [c.127]
В основе газификации жидких и твердых видов топлива в промышленных установках ЗПГ лежат сложные химические реакции. Если в разных процессах производства ЗПГ одни реакции являются доминирующими и, следовательно, одни формулы химического равновесия более -существенны, чем другие (например реакции углерода с паром в процессе риформинга и углерода с водородом — при гидрогазификации), то на практике, вероятно, при любых методах газификации устанавливаются равновесные условия всех четырнадцати реакций, упомянутых выше. [c.98]
Для определения состава смесей парафиновых и нафтеновых углеводородов пользуются графиком (фиг. 10), где удельные рефракции нафтенов разных рядов и парафинов, вычисленные из атомных рефракций, даны как функция молекулярного веса фракции. Значения удельной рефракции нафтенов представлены серией кривых, каждая из которых отвечает представителям нафтеновых углеводородов отдельного ряда. По этому графику, зная показатель преломления, удельный и молекулярный веса фракции, можно определить 1) среднее число колец в молекуле 2) общую формулу химического состава. Например, для некоторой фракции найдены удельная рефракция 0,3225 и молекуля1рный вес 450. По графику (фиг. 10) определяем среднее число колещ в молекуле— три и эмпирическая формула для углеводородов фракции— СлНгл-4, что при молекулярном весе 450 дает Сзз.ч Нво,4. Для дальнейшей характеристики фракции нужно задаться типом нафтенов. [c.182]
По этому графику, зная показатель преломления, удельный и молекулярный веса фракции, можно определить 1) среднее число колец в молекуле 2) общую формулу химического состава. Например, для некоторой фракции найдены удельная рефракция 0,3225 и молекуля1рный вес 450. По графику (фиг. 10) определяем среднее число колещ в молекуле— три и эмпирическая формула для углеводородов фракции— СлНгл-4, что при молекулярном весе 450 дает Сзз.ч Нво,4. Для дальнейшей характеристики фракции нужно задаться типом нафтенов. [c.182]
Запись данных опыта. Составить последовательный ряд формул химических соединений, которые были получены в работе, начиная с безводного сульфата меди, кончая металлической, медью. Написать уравнения реакций, протекавших при получении каждого последующего вещества из предыдущего. Отметить приемы работы, с которыми пришлось встретиться впервые. [c.29]
Так же как и в случае реального газа, удобно сохранить внешний вид формулы химического потенциала и для неидеального раствора. Тогда все термодинамические зависимости, полученные для идеального раствора, сохранят свой вид для любого раствора. С этой целью вводится термодинамическая величина, называемая активностью. [c.182]
Тогда все термодинамические зависимости, полученные для идеального раствора, сохранят свой вид для любого раствора. С этой целью вводится термодинамическая величина, называемая активностью. [c.182]
С формулами химического уравнения связывают определенные количества вещества обычно формуле вещества отвечает его количество, равное 1 молю, например [c.365]
Определить на рис. 8 1) число и род фаз, число степеней свободы в системе, заданной точкой М. 2) указать изменения состава жидкой фазы при охлаждении системы состава Л1 3) установить формулу химического соединения, образующегося в системе гОз—5102 4) определить, какие фазы образуются при охлаждении до 1900° С жидкого расплава, содержащего 80% АЬОз 5) определить количества равновесных фаз, образующихся при охлаждении 100 г расплава, содержащего 80% АЬОз, до 1700° С. [c.72]
Расчеты по формулам химических соединений [c.20]
Расчеты по формулам. Химическая формула может дать много сведений о веществе. Прежде всего она показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента имеется в его молекуле. Затем она позволяет рассчитать ряд величин, характеризующих данное вещество. Укажем важнейшие из этих расчетов. [c.35]
Химическая формула может дать много сведений о веществе. Прежде всего она показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента имеется в его молекуле. Затем она позволяет рассчитать ряд величин, характеризующих данное вещество. Укажем важнейшие из этих расчетов. [c.35]
Активностью а, компонента раствора называется термодинамическая величина, подстановка которой вместо концентрации в формулу химического потенциала компонента идеального раствора делает ее справедливой для реального раствора. [c.182]
СТЕХИОМЕТРИЧЕСКАЯ ФОРМУЛА — химическая формула молекулы, отвечающая идеальному составу химического соединения и удовлетворяющая [c.238]
По формулам химических соединений можно определять молекулярную массу вещества, его количественный состав, содержание (в отношениях масс или процентах) каждого элемента в данном веществе. [c.20]
Прежде чем перейти к номенклатуре неорганических веществ, напомним, что состав вещества отображается с помощью химической формулы. Химическая формула отображает атомы каких видов и в каких количественных соотношениях составляют вещество. Соотношение количеств атомов каждого вида обозначается индексом (вообще, химическая формула — это более общее понятие, включающее брутто-формулу, струетурную, графическую и т. д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
Химическая формула отображает атомы каких видов и в каких количественных соотношениях составляют вещество. Соотношение количеств атомов каждого вида обозначается индексом (вообще, химическая формула — это более общее понятие, включающее брутто-формулу, струетурную, графическую и т. д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
ФОРМУЛА ХИМИЧЕСКАЯ — условная запись буквами латинского алфавита и числовыми индексами состава химического соединения или простого вещества.
 Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]О д н о к о м п о н е н т н ы й р е а л ь н ы ii газ и компонент смеси реальных газов. Для вывода формулы химического потенциала в реальном ra- je имеется два способа. Во-первых, можно вести рассуждение так я е, как и для идеального газа, но при интегрировании пользоваться не уравнением Менделеева — Клапейрона, а каким-либо эмпирическим уравнением состояния. Этот способ применялся до 20-х годов нашего века. Помимо трудностей, связанных с интегрированием, этот способ неудобен еще и потому, что не существует универсального уравнения состояния реального газа. Поэтому для каждого реального газа получается свое выражение для химического потенциала. [c.58]
По возможности кратко опишите порядок операций для установления формулы химического вещества по известному его составу (в %). Ответ оценивается по степени краткости и универсальности применения созданного Вами предписания (алгоритм действия). Если Вам трудно составить алгоритм, воспользуйтесь числовыми данными и проведите по ним расчет например, при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 5. [c.16]
Если Вам трудно составить алгоритм, воспользуйтесь числовыми данными и проведите по ним расчет например, при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 5. [c.16]
Блестящим дальнейшим развитием атомно-молекулярного учения в доквантовый период явилась классическая теория химического строения, созданная в первую очередь работами замечательного русского химика А. М. Бутлерова (1828—1886), который обосновал утверждение, что структурные формулы — формулы химического строения — открывают последовательность химических связей атомов в молекулах . [c.13]
Предельно кратко опишите порядок операций для установления формулы химического вещества по известному его составу (в %). Оценка производится по степени краткости и универсальности применения созданного вами предписания (это так называемый алг0 ритм действия). Если вам трудно это сделать по памяти, воспользуйтесь примером при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 3. Написанный вами алгоритм проверьте, предложив решить задачу человеку, не знакомому с решением такого типа задач. [c.17]
Написанный вами алгоритм проверьте, предложив решить задачу человеку, не знакомому с решением такого типа задач. [c.17]
Установить формулу химического соединения, состоящего из 50,8% КзгО и 49,2% Si02 (масс, доли, %). 4. Указать температуру, при которой начнется кристаллизация расплава, содержащего 70% (масс, доли, %) Si02. Указать температуру, при которой закончится процесс кристаллизации. [c.73]
Согласно этой формуле химический сдвиг б измеряется относительно стандартного вещества, магнитные ядра которого структурно эквивалентны. Так, для резонанса на протонах стандартами служат тетраметилсилан, циклогексан, вода и др. На рис. 8.23, а расстояние между максимумами СНз- и Hj-rpynn равно 98 Гц [c.217]
Рассчитайте по эмпирическим формулам химические сдвиги метинового протона в изобутане и протонов метилено аой группы в н-бутане. [c.135]
Написать формулы химических соединений, зная их процентный состав а) 8—50%, 0—50% б) Н—1,597о. N-22,22%, 0-76,19%. [c.356]
N-22,22%, 0-76,19%. [c.356]
Химия для поступающих в вузы 1985 (1985) — [ c.15 ]
Химия для поступающих в вузы 1993 (1993) — [ c.14 ]
Учебник общей химии (1981) — [ c.24 , c.533 ]
Справочник Химия изд.2 (2000) — [ c.26 ]
Курс общей химии (1964) — [ c.17 ]
Неорганическая химия (1979) — [ c.20 ]
Неорганическая химия (1950) — [ c.38 ]
Неорганическая химия (1950) — [ c.31 ]
Химия Издание 2 (1988) — [ c.14 ]
Сочинения Научно-популярные, исторические, критико-библиографические и другие работы по химии Том 3 (1958) — [
c. 56
,
c.57
,
c.80
,
c.142
,
c.172
,
c.173
,
c.175
,
c.176
,
c.178
,
c.180
,
c.181
,
c.185
,
c.189
,
c.192
,
c.195
,
c.201
,
c.209
,
c.211
,
c.216
,
c.217
,
c.220
,
c.
56
,
c.57
,
c.80
,
c.142
,
c.172
,
c.173
,
c.175
,
c.176
,
c.178
,
c.180
,
c.181
,
c.185
,
c.189
,
c.192
,
c.195
,
c.201
,
c.209
,
c.211
,
c.216
,
c.217
,
c.220
,
c. 221
,
c.224
,
c.225
,
c.227
,
c.232
,
c.234
,
c.235
,
c.245
,
c.246
,
c.248
,
c.249
,
c.251
,
c.252
,
c.255
,
c.256
,
c.260
,
c.262
,
c.272
,
c.273
,
c.275
,
c.277
]
221
,
c.224
,
c.225
,
c.227
,
c.232
,
c.234
,
c.235
,
c.245
,
c.246
,
c.248
,
c.249
,
c.251
,
c.252
,
c.255
,
c.256
,
c.260
,
c.262
,
c.272
,
c.273
,
c.275
,
c.277
]
Основы общей химии Том 2 Издание 3 (1973) — [
c. 27
,
c.33
,
c.59
,
c.568
,
c.591
,
c.591
,
c.594
]
27
,
c.33
,
c.59
,
c.568
,
c.591
,
c.591
,
c.594
]
Общая химия (1968) — [ c.51 ]
Химические формулы.
Как составлять формулы химических соединений? Предлалагаем посмотреть следующий видеоролик.
Формула простого вещества (элемента) или соединения, существующих в форме молекул, состоит из символов одного или нескольких элементов, входящих в молекулу, и указывает число атомов каждого элемента в одной молекуле. Такая разновидность химической формулы называется молекулярной формулой. Например, одна молекула кислорода содержит два атома кислорода. Она имеет формулу O2. Одна молекула аммиака содержит один атом азота и три атома водорода и имеет формулу Nh4.
Она имеет формулу O2. Одна молекула аммиака содержит один атом азота и три атома водорода и имеет формулу Nh4.
Формула металлического ионного или координационного ковалентного кристалла указывает простейшее соотношение между числом атомов или ионов каждого вида в его кристаллической решетке. Формула многоатомного (комплексного) иона указывает соотношение между числом атомов каждого элемента, входящего в данный ион. Например, в кристаллической решетке флюорита (фторида кальция) на каждый ион кальция приходится два фторид-иона. Поэтому флюорит имеет формулу CaF2.
Структурная формула ковалентного простого вещества или соединения показывает, как связаны между собой атомы в каждой его молекуле (табл. 4.3). Если в такой формуле полностью указаны все связи, она называется развернутой структурной формулой.
Эмпирическая формула соединения указывает простейшее соотношение между числом различных атомов или ионов в данном веществе. Для кристаллов координационного типа можно указать только эмпирическую формулу. Однако для ковалентных веществ, состоящих из простых молекул, молекулярная формула обычно представляет собой целочисленное кратное их эмпирической формулы (табл. 4.3).
Однако для ковалентных веществ, состоящих из простых молекул, молекулярная формула обычно представляет собой целочисленное кратное их эмпирической формулы (табл. 4.3).
Таблица 4.3. Молекулярная формула
Существуют две наиболее распространенные системы химической номенклатуры. Одна из них разработана Международным союзом теоретической и прикладной химии (ИЮПАК), а другая-Ассоциацией научного образования (ASE). Обе эти системы имеют много общего. Однако система ИЮПАК в большей мере основана на использовании тривиальных названий. Многие вещества имеют тривиальные названия. Эти названия часто являются традиционными и хорошо установленными, но не согласуются ни с какой систематической номенклатурой. Однако еще важнее то, что они не дают сведений о химическом составе вещества; например, вода (h3O) и озон (O3).
Система ASE в большей мере основана на использовании систематических . названий. Эти названия образуются по вполне определенным правилам. В данной книге используется номенклатура ASE, хотя во многих случаях она совпадает с номенклатурой ИЮПАК.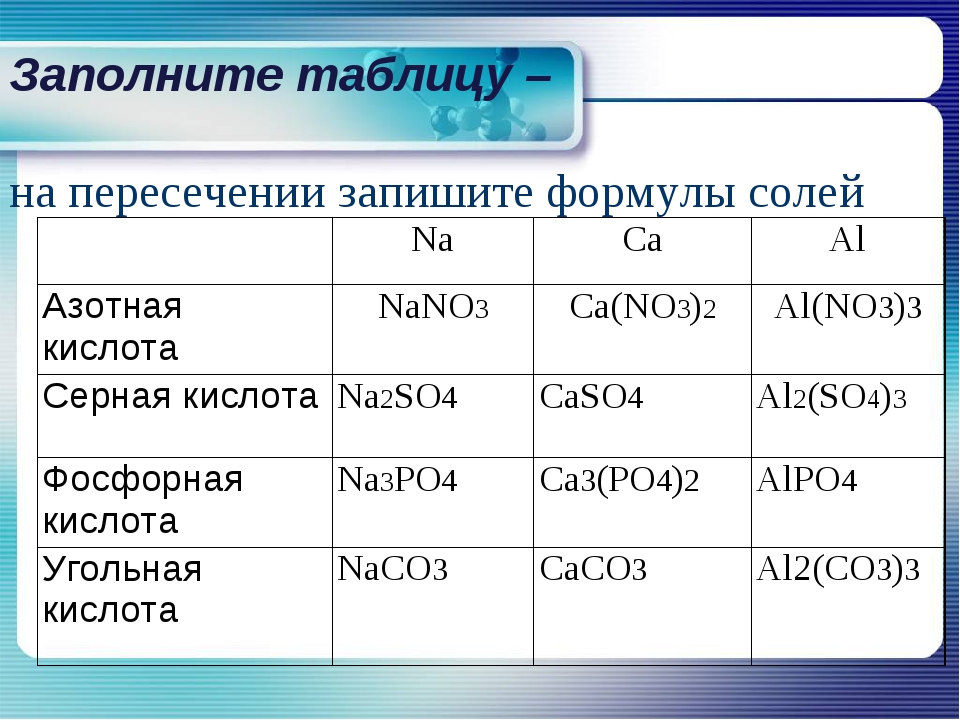
Важнейшим правилом номенклатуры является требование, чтобы название вещества имело однозначный смысл. Например, оксид магния-однозначное название, поскольку магний образует только один оксид, MgO. Однако оксид углерода — неоднозначное название, поскольку углерод образует два оксида, СО и CO2. Поэтому СО называется моноксид углерода, a CO2-диоксид углерода.
Систематические названия, особенно по номенклатуре ИЮПАК, в значительной мере основаны на использовании численных приставок, указывающих количество одинаковых атомов или групп в формуле вещества (табл. 4.4). Приставку моно- часто опускают. Например, моноксид азота (NO) называют также оксидом азота.
Таблица 4.4. Численные приставки
Названия «медный купорос», «сернокислая медь», «сульфат меди», «гидрат сульфата меди» и «пентагидрат сульфата меди(II)» означают одно и то же соединение с формулой CuSO4 *5h3O.
Оглавление:
Химические формулы.
 Относительная молекулярная масса
Относительная молекулярная массаЦель урока:
Личностные:
- Развитие ответственного отношения к учению, способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
- Формирование целостного мировоззрения.
Метапредметные:
- Развитие умений определять способы действий в рамках предложенных условий и требований.
- Развитие умение осуществлять контроль своей деятельности в процессе достижения результата.
- Развитие компетентности в области использования информационно-коммуникационных технологий.
Предметные:
- Формирование первоначальных представлений о
веществах: понятия “химическая формула”,
“индекс”, “коэффициент”, “относительные
атомная и молекулярная массы”.

- Овладение основами химической грамотности: умение писать и читать формулы веществ.
- Формирование навыков расчёта относительной молекулярной массы вещества.
Тип урока: урок введения нового материала с использованием электронно-образовательных ресурсов и самостоятельной исследовательской деятельности учащихся.
Формы работы учащихся: фронтальная, индивидуальная, мини-группы (в парах).
Оборудование: Таблица Д.И.Менделеева, ПК, экран, опорные схемы (приложение 1), карточка для организации игры “Химическое лото”, комплект шаростержневых моделей, лоток для моделей молекул, комплект цветных магнитов, магнитная доска.
ЭТАПЫ УРОКА
1. Актуализация знаний. Повторение символов химических элементов и их названий.
Учитель:
Начнём урок со строк Степана Щипачёва:
“В природе ничего другого нет,
Ни здесь, ни там, в космических глубинах.
Все от песчинок малых до планет
Из элементов состоит единых”
Все вещества окружающих нас тел живой и неживой природы состоят из химических элементов. Чтобы изучить свойства веществ и превращения одних веществ в другие, необходимо знать химический язык. Знаки химических элементов — это “буквы” химического языка. Проверим знания химических элементов.
За работу на уроке вы получаете “аурики” – показатель вашей активности. Название “Аурики” образовано от латинского названия химического элемента – драгоценного металла – Аурум (Золото). После урока вы вернёте их, в обмен на оценку.
Игра. “Химическое лото”. Работа по индивидуальным карточкам (приложение 2).
Зачеркните знак химического элемента, о
котором идёт речь в строках стихотворения. (При
чтении стихотворных строк ученик, выполнивший
задание, держит руку на локте вместе с ручкой –
сигнал выполнения работы).
Взаимопроверка (по слайду презентации), оценивание, подведение итогов игры.
Критерии оценивания:
- 16 – “5”
- 12 — 15 – “4”
- 9 – 11 – “3”
Карточки трёх учащихся (по желанию) - индивидуальная проверка учителем после урока.
Приложение 2
| Na | H | K | Mg |
| О | Cu | Ag | P |
| N | Fe | Au | Сl |
| Hg | Ca | C | S |
| Унылая пора! Очей очарованье! Приятна мне твоя прощальная краса — Люблю я пышное природы увяданье, В багрец и в золото одетые леса.  |
А. С. Пушкин |
| В их стройно зыблемом строю Лоскутья сих знамен победных, Сиянье шапок этих медных, Насквозь простреленных в бою. |
А. С. Пушкин |
| И квакуши, как шарики ртути, Голосами сцепляются в шар. |
О. Мандельштам |
| И вспышками магния, кроя с балконов Смертельною известью лица, В агонии красных огней и вагонов В лице изменялась столица. |
В. Катаев |
| О, если бы вы знали, Какой за ним уход! Он принимает калий, Ему дают азот. |
Вера Инбер |
| Воды минеральные бьют из-под земли, Кальцием и натрием насыщены они.  |
Г. Колпакова |
| О, мощный властелин судьбы! Не так ли ты над самой бездной На высоте, уздой железной Россию поднял на дыбы? |
А. С. Пушкин |
| Тогда услышал я (о диво!) запах скверный; Как будто тухлое разбилось яйцо. Иль карантинный страж курил жаровней серной. |
А.С. Пушкин |
Учитель: Назовите не закрашенные элементы (за правильный ответ — дополнительный балл).
Физ.минутка. Предлагаю немного отдохнуть и устроить “Стрельбу глазами” [ 1 ]
Задание:
- В периодической системе найдите самый сильный элемент – неметалл – окислитель -7 группа, главная подгруппа, 2 период. (F)
- Переведите свой взгляд влево, на элемент,
стоящий в том же периоде в 3 группе.
 (B)
(B) - Переведите взгляд вниз, на самый сильный металл – 7 период. (Fr)
- Переведите взгляд вверх и вправо, на элемент 6 группы, главной подгруппы, 2 период, образующий вещество, которое поддерживает горение. (O)
- Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, содержащийся в градусниках. (Hg)
- Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5. (Cl)
- Переведите взгляд вниз и влево, на элемент, 2 группы, главной подгруппы, с порядковым номером 56. (Вa)
- Переведите взгляд на элемент, который возглавляет группу инертных газов в периодической системе Менделеева. (Не)
- Переведите свой взгляд вниз и влево, на элемент, атомы которого образуют драгоценный металл желтого цвета. (Au)
2. Введение новых знаний. Создание и решение
проблемной ситуации. Исследовательское
моделирование.
Создание и решение
проблемной ситуации. Исследовательское
моделирование.
Учитель: Что означают знаки (символы) химических элементов?
Учащиеся: Символы химических элементов используют для обозначения атомов определённого вида; удобное международное сокращение греческих или латинских названий элементов.
Учитель: Знаки химических элементов - это знаковые модели. Давайте попробуем создать предметные модели частиц, из которых состоят вещества. Начнем с атомов. Чем отличаются друг от друга атомы разных видов, т.е. разных химических элементов?
Учащиеся: Атомы разных видов отличаются массой, размерами, строением.
Учитель: Вам выданы шаростержневые
модели. Для того, чтобы показать отличие атомов
друг от друга, шарики разного цвета. Это – цвет
моделей, шариков, но не атомов. Атомы не окрашены.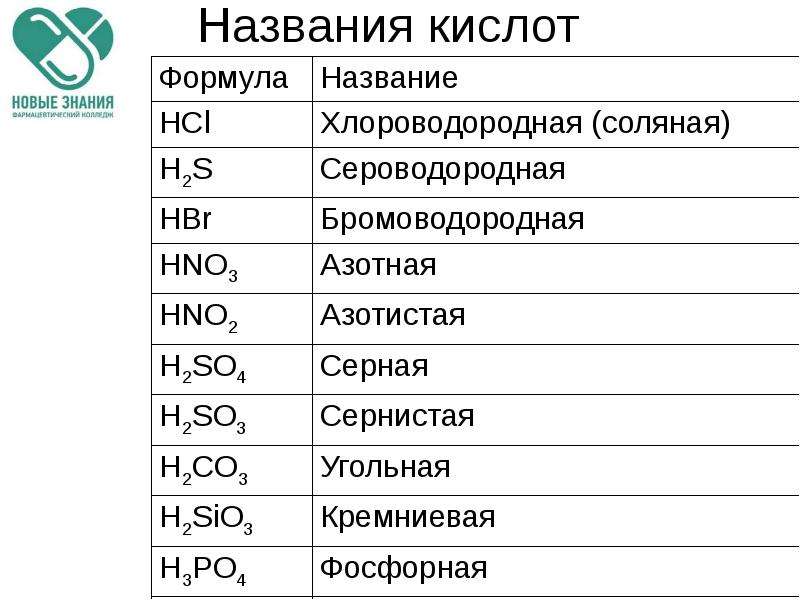 Рассмотрите их. Модели атомов кислорода красного
(оранжевого) цвета. Модели атомов азота – синего
цвета. Шарики чёрного цвета – обозначают атомы
углерода.
Рассмотрите их. Модели атомов кислорода красного
(оранжевого) цвета. Модели атомов азота – синего
цвета. Шарики чёрного цвета – обозначают атомы
углерода.
Характеристика моделей атомов (инструкция на комплекте шаростержневых моделей).
водород белый углерод чёрный кислород красный (оранжевый) азот синий сера жёлтый галогены зелёный алюминий тёмно-серый
(На доске — магнитные модели, записи. Учащиеся,
одновременно с учителем, делают рисунки и записи
в опорном конспекте – выделенное поле для
работы).
Учащиеся,
одновременно с учителем, делают рисунки и записи
в опорном конспекте – выделенное поле для
работы).
Учитель: Положите на лоток три шарика, обозначающие атомы элемента водорода. Какой символ можно использовать для обозначения?
Учащиеся: Н (аш)
Учитель: Как учесть их количество?
Учащиеся: Записать цифру три перед знаком элемента водорода.
Учитель: Вы за партой работаете в парах. Сколько атомов водорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру шесть перед знаком элемента водорода.
Учитель: Выложите в лотке модели двух атомов кислорода.
Делаем рисунок и соответствующую запись (2О). Сколько атомов кислорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру четыре перед
химическим знаком элемента кислорода.
Учитель: Но во многих веществах атомы объединяются друг с другом.
Например, самый лёгкий газ водород, состоит из молекул. Каждая состоит из двух атомов элемента водорода. Создайте модель молекулы газа водорода, используя металлический стержень для соединения атомов.
1 молекула газа водорода, состоит из двух атомов (Н2).
Выложите на лоток две молекулы газа водорода.
Две молекулы газа водорода, каждая состоит из двух атомов.
Как это записать, используя знаки? (2 Н2)
- индекс
- коэффициент
Учитель: Давайте сосчитаем все молекулы газа водорода, созданные сегодня с помощью моделей? (Запись 12 Н2 )
Цифры в данной записи называются: индекс, коэффициент. Попробуйте объяснить, что означает индекс? Коэффициент? Где записывается индекс? Коэффициент?
Работа по заполнению таблицы в опорной схеме.
Учащиеся: Индекс указывает на число атомов в молекуле, коэффициент – на число отдельных частиц.
Учитель: Молекула воды состоит из одного атома кислорода и двух атомов водорода, расположенных под углом. Соберите модель на столах (на доске – магнитная модель, рисунок в тетради, запись) (Н2О)
Сколько молекул воды в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Поставим коэффициент два перед записью.
Учитель: Как вы думаете, чем модели молекул похожи? Чем модели отличаются друг от друга?
Учащиеся: В одной группе – молекула состоят из одинаковых атомов, в другой – из разных.
Учитель: Вещества, которые состоят из
одинаковых атомов одного химического элемента,
называют простыми. Работа по заполнению таблицы.
Работа по заполнению таблицы.
Учитель: Дайте определение сложным веществам.
Учащиеся: Сложные вещества состоят из атомов разного вида.
Учитель: Итак, состав веществ записывается знаковыми моделями, т.е. химическими формулами.
О чем говорит нам химическая формула?
Учащиеся: О том, из каких атомов состоит вещество, в каком количестве атомы входят в состав вещества.
Учитель: Качественный состав вещества показывает, из атомов каких химических элементов оно состоит.
Количественный состав показывает число атомов каждого химического элемента в составе вещества.
Следовательно, химическая формула описывает КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ вещества.
3. Первичное закрепление знаний, умений,
навыков (с использованием слайдов №3 — №13
презентации, при необходимости осуществляется
проверка в виде голосового сопровождения к
презентации при нажатии на значок).
Порядок действий:
- Прочитать химическую формулу.
- Дать характеристику состава сложного вещества (качественный и количественный состав).
Чтение химических формул, определение качественного и количественного состава сложных веществ. ДЛЯ СЛОЖНЫХ ВЕЩЕСТВ (За правильный ответ — “аурик”).
H2O, AgNO3, Al, HCl, Cu, C, NaCl, Mg, O2, CO, CaCO3
4. Игра. Будь внимателен!
Учитель: На какие группы можно разделить предложенные формулы веществ? (Слайд №14 презентации).
Учащиеся: Можно разделить на простые и сложные вещества.
Учитель: Определим, где простые, а где сложные
вещества в этом перечне. Если показываемое
вещество простое, 1 хлопок в ладоши (поднять одну
руку), если сложное – 2 хлопка (поднять две руки,
работает весь класс). Слайд №15 презентации к
уроку.
H2O, AgNO3, Al, HCl, Cu, C, NaCl, Mg, O2, CO, CaCO3
Встречаемся ли мы с предложенными веществами в повседневной жизни?
Рассказ учащегося о применении предложенных веществ (учебный проект). Слайд №16 презентации к уроку.
Физ.минутка. Гимнастика для глаз с использованием кружков, расположенных на окне.
Посмотреть на круг, приклеенный на стекло, на счет 1–4, потом перевести взгляд вдаль на счет 1–6. Повторить 4–5 раз.
Крепко зажмурить глаза (считать до 3), открыть глаза и посмотреть вдаль (считать до 5). Повторить 4–5 раз.
Закрыть глаза и посидеть спокойно, медленно считая до 5.
Открыть глаза, потянуться, на счёт 1-4 медленно поднимаем руки вверх, на счёт 1-4 опускаем руки, кладём на парту. Повторить 3-4 раза.
5. Введение новых знаний. Вычисление
относительной молекулярной массы.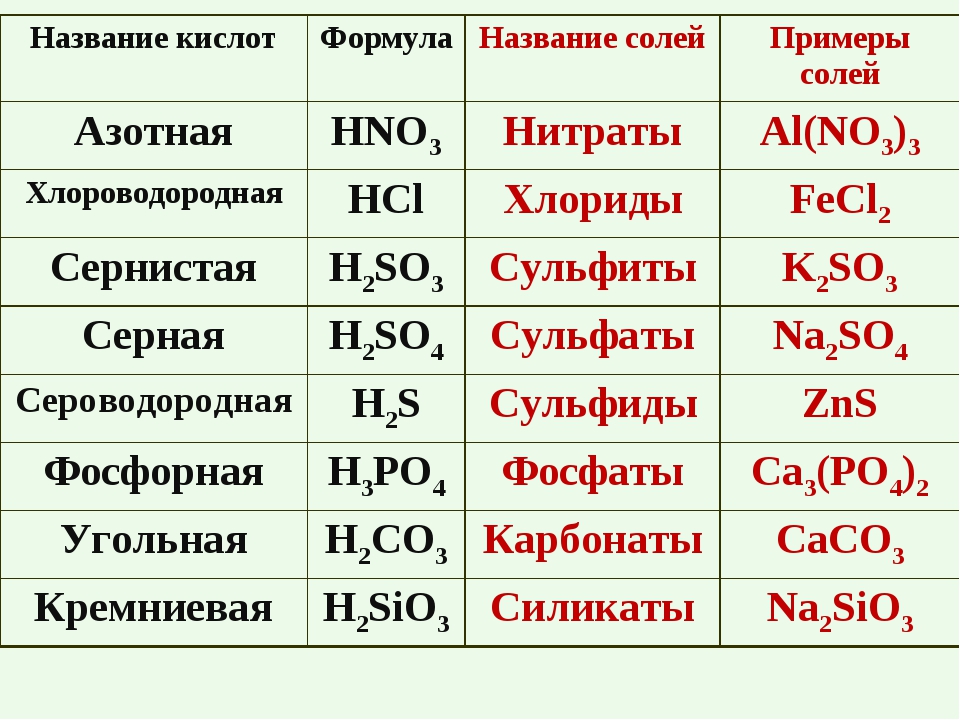
Учитель: Одной из основных характеристик
вещества является его относительная
молекулярная масса Mr. Слайд №17 презентации к
уроку (или работа с ЭОР в сети интернет).
http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»>http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»
Видеомодуль коллекции ЭОР http://fcior.edu.ru. 1,2 слайды.
Рисунок 1
Учитель: Молекулы также как и атомы, имеют массу, которая также очень мала, поэтому в расчётах используют относительную молекулярную массу.
Как вы считаете, как можно найти массу молекулы, зная массу атомов? Конечно, сложить атомные массы между собой, но при этом не надо забывать, что атомов в молекуле может быть не один и это тоже нужно учитывать.
Относительная молекулярная масса вещества (Mr)
– это число, показывающее во сколько раз масса
молекулы данного вещества больше 1/12 массы атома
углерода. Это безразмерная величина
Это безразмерная величина
Мы умеем определять относительную атомную массу ХЭ. Где можно найти и проверить цифровое значение относительной атомной массы?
Учащиеся: Можно найти в периодической системе химических элементов Д.И.Менделеева.
Учитель: А как можно определить относительную массу молекулы?
Учащиеся: Относительная молекулярная масса вещества равна сумме относительных атомных масс атомов, входящих в состав молекулы с учетом их индексов.
AxByCz где A, B, C — знаки Эl x, y, z – количество атомов этих Эl
Mr = Ar(A)*X + Ar(B)*Y + Ar(C)*Z
6. Первичное закрепление изученного материала (работа с опорной схемой).
Последовательность действий при определении относительной молекулярной массы.
Алгоритм. Вычисление относительной
молекулярной массы по химической формуле.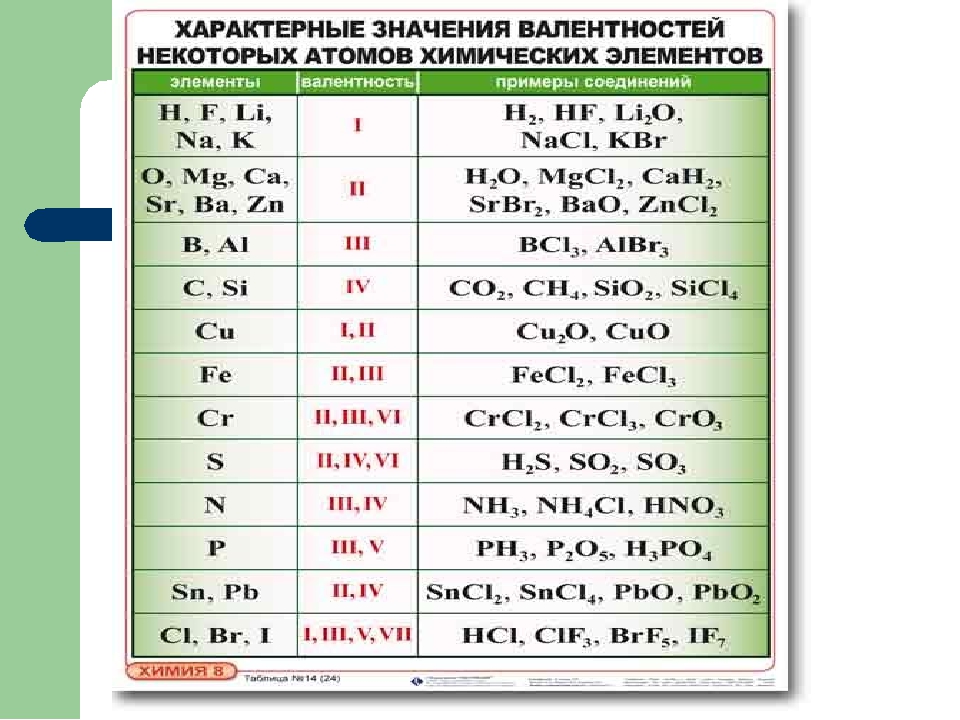
1. Найти значения относительных атомных масс элементов в периодической системе.
2. Умножить число атомов на значение относительной атомной массы для каждого элемента.
3. Сложить полученные значения.
Работа с тренажёром “Вычисление относительной молекулярной массы” (http://fcior.edu.ru/card/12971/trenazher-vychislenie-otnositelnoy-molekulyarnoy-massy-veshestv.html)
Слайд №18 презентации к уроку (или работа с ЭОР в сети интернет).
Рисунок 2
Определение относительной молекулярной массы веществ по предложенным формулам (работа с опорной схемой).
| молекула | значение Мr |
| Н2О | Мr(Н2О)= 2Ar (Н) +1Ar(О)= 2·1 +1·16 = 18 |
| H2SO4 | Мr(H2SO4) = Ar( ) + Ar ( ) + Ar ( ) = |
| HNO3 | Мr(HNO3) = Ar( ) + Ar( ) + Ar( ) = |
| Fe2O3 | Мr(Fe2O3) = Ar + Ar = |
| SO3 | Мr( ) = |
| NaOH | Мr( ) = |
| H3PO4 | Мr ( ) = |
| N2 | Мr ( ) = |
| H2O2 | Мr ( ) = |
7. Закрепление знаний, умений, навыков.
Cамостоятельная работа.
Закрепление знаний, умений, навыков.
Cамостоятельная работа.
Сравнение относительных молекулярных масс. Вставьте знак, больше, меньше, равно, выполнив вычисления. Слайд №19 презентации к уроку.
| Mr (Н2SO4) | Mr (Н3РO4) | |
| Mr (SO3) | Mr (MgO) | |
| 5 Mr (CH4) | 2 Mr (NaOH) | |
| Mr (NH3) | Mr (PH3) |
8. Итог. Рефлексия.
Учитель: С какими понятиями мы
познакомились сегодня на уроке.
| Я узнал много нового. | ||
| 2. | На уроке было над чем подумать. | |
| 3. | Мне это пригодиться в жизни. | |
| 4. | На все возникшие вопросы я получил(а) ответы. | |
| 5. | На уроке я поработал добросовестно. |
9. Домашнее задание. П.12
Индивидуальное задание (по вариантам, приложение 3).
Сайт “Мир ХИМИИ” Раздел “Учащимся. 8 класс” Урок №14.
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ (если на уроке остаётся несколько свободных минут):
1. Найдите и запишите значения относительных
молекулярных масс:
Найдите и запишите значения относительных
молекулярных масс:
1) хлорида меди (II), состоящей из одного атома меди и двух атомов хлора;
2) оксида фосфора(V), состоящего из двух атомов фосфора и пяти атомов кислорода;
3) двухатомной молекулы хлора.
| молекула | значение Мr |
| Мr( ) = | |
| Мr( ) = | |
| Мr( ) = |
Приложение 4
Приложение 5
Приложение 6
Источники информации.
- Е. П. Пак. Типы химических реакций. Игра-путешествие. 8 класс. “Первое сентября. Химия” N19 (761), 1-15.11.2008
- Баженов А.
 А. Тренажер к уроку химии. 8 класс.
“Чтение химических формул”
А. Тренажер к уроку химии. 8 класс.
“Чтение химических формул”
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1 |
а) |
б) |
в) |
г) |
д) |
|
Формула вещества |
Принадлежит к классу |
Название вещества |
Валентность кислотного остатка (в кислоте, соли) |
Растворимость (по таблице растворимости на форзаце 2 учебника) |
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде) |
|
CaO |
Оксид основный |
Оксид кальция |
|
|
твёрд. |
|
H2S |
Кислота |
Сероводородная кислота |
II |
Р(растворимое вещество) |
|
|
NaCl |
Соль |
Хлорид натрия (повареная соль) |
I |
Р |
твёрд., белый, растворим. |
|
Ca3(PO4)2 |
Соль |
Фосфат кальция |
III |
Н (нерастворимое вещество) |
|
|
N2O5 |
Оксид кислотный |
Оксид азота (V) |
|
|
|
|
AgNO3 |
Соль |
Нитрат серебра |
I |
Р |
|
|
Mg |
Металл |
Магний |
|
|
твёрд. |
|
FeSO4 |
Соль |
Сульфат железа (II) |
II |
Р |
|
|
HNO3 |
Кислота |
Азотная кислота |
I |
Р |
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр. 144
144
Предмет: ХИМИЯ
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HCl |
Хлороводородная (соляная) |
Cl |
I |
Хлорид |
— |
|
HF |
Фтороводородная (плавиковая) |
F |
I |
Фторид |
— |
|
HBr |
Бромоводородная |
Br |
I |
Бромид |
— |
|
HI |
Иодоводородная |
I |
I |
Иодид |
— |
|
H2S |
Сероводородная |
S |
II |
Сульфид |
— |
|
H2SO3 |
Сернистая |
SO3 |
II |
Сульфит |
SO2 |
|
H2SO4 |
Серная |
SO4 |
II |
Сульфат |
SO3 |
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
|
HNO3 |
Азотная |
NO3 |
I |
Нитрат |
N2O5 |
|
H2CO3 |
Угольная |
CO3 |
II |
Карбонат |
CO2 |
|
H2SiO3 |
Кремниевая |
SiO3 |
II |
Силикат |
SiO2 |
|
H3PO4 |
Фосфорная (Ортофосфорная) |
PO4 |
III |
Фосфат (Ортофосфат) |
P2O5 |
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HNO3 |
|
|
|
Нитрат |
N2O5 |
|
|
Иодоводородная |
|
|
|
— |
|
H3PO4 |
|
|
|
|
|
|
|
Сернистая |
SO3 |
|
|
|
|
H2CO3 |
|
|
|
|
|
|
HCl |
|
|
|
Хлорид |
— |
|
|
Кремниевая |
|
|
|
|
|
HF |
|
|
|
|
— |
|
|
|
|
|
Сульфид |
— |
|
|
|
|
|
Бромид |
— |
|
|
Серная |
|
|
|
|
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Предмет: ХИМИЯ
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
Кислотами называются сложные вещества ………..
Валентность кислотного остатка находят ………..
К бескислородным кислотам относят: ….., ……, ……, …..
К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты |
||||||
|
Бес-кисло- родные |
Кислород- содержащие |
растворимые
|
нераст-воримые |
одно- основные |
двух-основные |
трёх-основные |
Выполните задания №1, №2, №3 на стр. 142
142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцевая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная,плавиковая |
F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
Основаниями называются …………
По характеру свойств различают ………
К щелочам относят …………….
Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид |
Кислотный оксид |
Амфотерный оксид |
Безразличный оксид |
Щёлочь |
Нерастворимое основание |
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. Классификация оснований по числу групп ОН: n=1 однокислотное n=2 двухкислотное n=3 трехкислотное Физические свойства Большинство оснований – твёрдые вещества с различной растворимостью в воде. СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ ЩЁЛОЧЕЙ 1. Металл + H2O = ЩЁЛОЧЬ + Н2↑ 2Na + 2H2O = 2NaOH + H2 Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra) 2. Na2O + H2O = 2 NaOH Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra) НЕРАСТВОРИМЫХ ОСНОВАНИЙ СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Химические формулы
Это пятая лекция по общей химии. Охватываемые темы: эмпирические и молекулярные формулы, изомеры и периодическая таблица.
Охватываемые темы: эмпирические и молекулярные формулы, изомеры и периодическая таблица.
При написании формул химических соединений существует множество методов, которые можно использовать в зависимости от информации, которую вы хотите сообщить:
Молекулярные формулы— это представления молекулы, которые включают в себя список как элементов в молекуле, так и количество этих атомов в формуле:
Например, молекулярная формула воды H 2 O.Эта формула читается как два атома водорода и один атом кислорода составляют молекулу воды. Обратите внимание, что нижний индекс 2 в формуле указывает на количество атомов элемента, за которым следует.
Например: Если бы формула была C 2 H 4 O 2 , это означало бы, что в молекуле было 2 атома углерода, 4 водорода и 2 кислорода.
Другим способом представления воды может быть ее структурная формула:
.
Эта формула показывает, что оба атома водорода связаны с кислородом, но не друг с другом.Еще одно представление воды называется объемной моделью структурной формулы, и оно будет выглядеть так:
.И еще одно представление молекулы — это то, что мы называем эмпирической формулой, которая просто описывает соотношение атомов в молекуле. Это означает, что представление показывает наименьшее целочисленное соотношение атомов в молекуле:
.Позже мы будем использовать массы и моли, чтобы найти эмпирические и молекулярные формулы, но сейчас важно просто знать определения.
Изомеры
Изомер — это причудливое слово для различных ориентаций, которые атомы могут принимать в молекулах с точно таким же числом и соотношением атомов. Например,
Если вы внимательно посмотрите на эти две структуры, то заметите, что, хотя связи между атомами различны, число атомов и их соотношения абсолютно одинаковы = C 4 H 8 , что делает две структуры изомерами.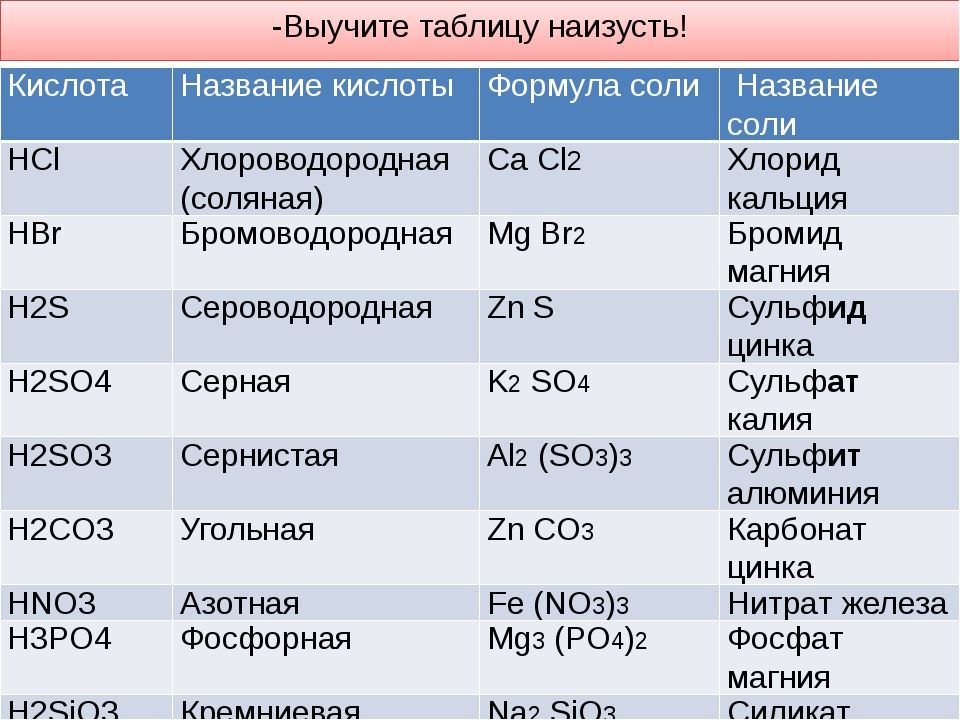 Другой тип изомера — это тот, в котором присоединения выглядят очень похоже, но различаются тем, как они прикрепляются в пространстве, — это так называемые пространственные или геометрические изомеры,
Другой тип изомера — это тот, в котором присоединения выглядят очень похоже, но различаются тем, как они прикрепляются в пространстве, — это так называемые пространственные или геометрические изомеры,
Обратите внимание, что ионы хлорида, хотя и присоединенные к углероду, либо находятся на противоположных сторонах друг от друга.
Периодическая таблица
Периодическая таблица — это инструмент, необходимый большинству химиков. В таблице перечислены все известные элементы и даже указаны позиции возможных искусственных элементов будущего.
Элементы, показанные серым цветом, созданы руками человека. Они производят эти элементы, сталкивая атомы внутри ядерных реакторов.
Для ваших целей есть несколько фрагментов информации, которую вы можете получить из периодической таблицы, которая поможет вам в ваших расчетах, а также в определении типа связи элемента.
Сначала давайте обратим внимание на состояния большинства элементов:
Большинство из них твердые. Показано в черном цвете. В природе есть только две жидкости: ртуть и бром. Газы показаны красным и включают несколько элементов первого периода, а также благородные газы (группа 8).
Строки в периодической таблице называются Периодами , а столбцы называются Группами . Периоды разделены тем, как заполняются электроны вокруг атома. Мы обсудим это в последующих лекциях.Пока же мы остановимся на обсуждении общих черт этих элементов, объединенных в группы.
Группа I называется Щелочные металлы. Эти металлы имеют сходные свойства в том, что они мягкие для металлов и их можно резать ножом. Это также металлы с низкой плотностью, и некоторые из них могут плавать на воде.
Группа II называется щелочноземельными металлами. Причиной такого названия является их реакция с водой:
В результате реакции образуется гидроксидное основание и газообразный водород. Щелочь определяется как основание, которое растворяется в воде, поэтому эти металлы являются щелочными по своим свойствам. Эти металлы также мягче большинства других металлов и имеют низкую плотность.
Щелочь определяется как основание, которое растворяется в воде, поэтому эти металлы являются щелочными по своим свойствам. Эти металлы также мягче большинства других металлов и имеют низкую плотность.
Группы с 3 по 12 называются переходными металлами. Эти металлы несколько различаются по свойствам, но все они являются хорошими проводниками тепла и электричества. Они не такие мягкие и более плотные, чем щелочные или щелочноземельные металлы. Их можно выковать или согнуть в определенную форму, и они менее реакционноспособны, чем щелочные или щелочноземельные металлы.Когда они реагируют, они часто создают окрашенные соединения.
Группы 13 и 14 в периодической таблице не имеют конкретных названий, а содержат начало металлоидного сегмента периодической таблицы:
Металлоиды (показаны зеленым цветом) — это элементы, обладающие свойствами как металлов, так и неметаллов по внешнему виду. Они образуют «забор» между металлами и неметаллами в периодической таблице и могут действовать одинаково в реакциях обоих.
Они образуют «забор» между металлами и неметаллами в периодической таблице и могут действовать одинаково в реакциях обоих.
Группа 15 называется группой Pnictogen (p не используется) на основании того, что азот входит в группу.Название происходит от греческого слова «задыхаться». Это связано с тем, что чистый газообразный азот обладает удушающими свойствами, поэтому его часто используют для пожаротушения. Свойства этой группы смешанные: некоторые из них являются газами, а некоторые — металлоидами. Причина, по которой они были сгруппированы вместе, заключалась в их электронных конфигурациях (более поздние лекции) и их способности создавать ионы -3.
Группа 16 называется группой халькогена. Название также происходит от греческого происхождения, и элементы в группе называются халькогенами, потому что кислород и сера обычно встречаются в «рудах».Chalco означает «руда», а gen означает «формация». «Руда» — это встречающийся в природе твердый материал, из которого можно выгодно извлечь металл или ценный минерал. Помимо естественной склонности групп к образованию руд, они также были сгруппированы на основе их электронной конфигурации, а также общего образования ионов -2.
Помимо естественной склонности групп к образованию руд, они также были сгруппированы на основе их электронной конфигурации, а также общего образования ионов -2.
Группа 17 называется группой галогенов. Галогены также имеют смешанные свойства с двумя газами (F 2 и Cl 2 ), одним жидким (Br 2 ) и остальными твердыми веществами.Все они двухатомные и имеют низкие температуры плавления и кипения, но их наиболее важной особенностью является их реакционная способность с металлами, образующими многие из наиболее распространенных и полезных солей (например, NaCl). Все они также образуют ионы -1.
Группа 18 называется группой благородных газов. Эти газы также называют инертными газами, поскольку одно из их наиболее важных свойств заключается в том, что они по большей части не реагируют с другими элементами. Соединений, содержащих благородный газ, очень мало.Также все они без запаха и цвета. Они не образуют ионов.
Они не образуют ионов.
Есть две извлеченные строки периодической таблицы, которые, если бы они были в самой таблице, поместились бы непосредственно перед блоком переходного металла:
Это лантаниды и актиниды. Вместе они называются редкоземельными металлами. По своим свойствам они действуют подобно большинству металлов, но актиниды обладают дополнительным свойством радиоактивности.
Вы должны знать периодическую таблицу и, самое главное, следующие сегменты:
Так как эти знания позволят вам определить тип соединения (ионный или ковалентный), которое может образоваться.
Вы также должны знать названия и символы первых 56 элементов, а также платины, золота, ртути, свинца и урана. Вы можете использовать карточки ниже, чтобы помочь вам выучить их.
Тренировочные карточки Chem21
Вернуться домой
Вернуться к сегменту 1
Список распространенных формул | |||||||
| Что такое химическая формула для натрия | Na | Na | натрий | ||||
| Что такое химическая формула для воды | ч 2 O | Вода | |||||
| Что такое химическая формула для глюкозы | C 6 H 12 O 6 9 6 9 | глюкоза | |||||
| Что такое химическая формула для алкоголя | C 2 H 2 H 6 O | OСпирт | |||||
| Что такое химическая формула для сульфатных групп | сульфатная группа | ||||||
| Что такое химическая формула для сероводорода3 | H 2 S | Сероводород | |||||
| Химическая формула Соль | NaCl | соль | |||||
| Что такое химическая формула для молекулы кислорода | O 2 Oxygen | ||||||
| Что такое химическая формула для этанола | 2 h 6 h 6 oэтанол | ||||||
| Что такое химическая формула для уксуса | C 2 H 4 O 2 O 2 O 2 | Vinegar | |||||
| Что такое химическая формула для аммиака | NH 3 | Ammonia | |||||
| Что такое химическая формула для магния | мг | ||||||
| Что такое химическая формула для уксусной кислоты | C 2 ч 2 ч 4 O 2 | Уксусная кислота | |||||
| Химическая формула Бутан | C 4 H 10 | Butane | |||||
| Что такое химическая формула для ацетата | CH 3 CO 2 — | ацетат | |||||
| Что Химическая формула для нитрата | NO 3 3 — | Nitroate | |||||
| Что такое химическая формула для меди | CU | CORE | |||||
| Что такое химическая формула молекулы азота | N 2 | ||||||
| Что такое химическая формула для диоксида углерода | CO 2 2 | углекислый газ | |||||
| Что такое химикат для серной кислоты | H 2 SO 4 | Серная кислота | Что такое химическая формула для метана | 6||||
| Что такое химическая формула для сахарозы | C 12 H 22 O 11 | Sucrose | |||||
| Что такое химическая формула для пропана | 6пропан | Что такое химическая формула для пищевой соды | Nahco 3 | 8 | 3 | ||
| Что такое химическая формула для фторида | F0153 | фторид | |||||
| Что является формулой для молекулы фторирования | F 2 | Фтор | |||||
H 2 O 2 49 | |||||||
| Химическая формула для кофеина | C 8 H 10 N 4 O 2 2 9 | Caffeine | |||||
| Что такое формула для хлорида натрия (соль) | NaCl | хлорид натрия | |||||
| Что такое химическая формула для аспирина | C C 9 H 8 O 4 9 | 9 | |||||
HCL | Гидрохлорическая кислота | ||||||
| Какова химическая формула нитрата цинка | Zn(NO 3 900 14) 2 | ||||||
| Что такое химическая формула для монооксида углерода | CO | 8 | 8|||||
| Что такое формула для гидроксида натрия | NaOH | 9003 | Гидроксид натрия | ||||
| Что такое формула для цианида (цианид натрия) | NACN | 8 цианид натрия | |||||
| Что является для цианида (цианид кальция) | CA ( CN) 2 | ||||||
| Что является формулой для золота | AU | Gold | Что такое химическая формула для йода | I | |||
| Химическая формула олова | Sn 90 153 | TIN | |||||
| Что такое химическая формула для бензола | C 6 H 6 6 8Benzene | ||||||
| Что такое формула сероводорода36 H 2 S | 9003 | сероводород водорода | |||||
| химическая формула для ацетона3 CH 3 Coch 3 Acetone | 4 | ||||||
| Химическая формула для фосфорной кислоты H 3 PO 4 фосфорной кислоты | |||||||
| Что такое химическая формула для Pentane | C 5 H 12 12Pentane | ||||||
| Что такое химическая формула для метанола | CH 3 OH | Метанол | |||||
| Что такое химическая формула для гидробромированной кислоты | HBr | 3 | |||||
карбоновая кислота | |||||||
| Что такое химическая формула для титана | Ti | ||||||
| Что такое химическая формула для гипохлота натрия | NaClo | 8||||||
| Что такое химическая формула для Этан | C2H6 | Этан | |||||
| Что такое химическая формула для аммония сульфата | (NH 4 ) 2 SO 4 | ||||||
| Какова химическая формула октана | 9? 0028 C 8 H 18 H 18 | ||||||
| Что такое химическая формула для сульфата меди | CUSO 4 | сульфат меди | |||||
| Что такое химическая формула Для холестерина | C 27 h 46 h 46 o | холестерин | |||||
| Что является формулой для бензойной кислоты | C 7 H 6 O 2 | Бензойная кислота | |||||
| Что является формулой для серной кислоты | H 2 SO 3 3 | Что такое формула для галактозы | C 6 ч 6 ч. | Галактоза | |||
| Формула аскорби C CICE | C 6 H 8 o 8 o 6 | аскорбиновая кислота | |||||
| Что такое формула для сухого льда | CO 2 | сухой лед | |||||
| Что такое формула для нитрата натрия | Nano 3 | ||||||
| Что такое формула для оксида кальция (быстрый) | CAO | оксид кальция | |||||
| Что является формулой для йодной кислоты | HIO 3 | ||||||
| Что является формулой для молочной кислоты | C 3 H 6 O 3 | Молочная кислота | |||||
| Формула бромида магния | MgBr 9 0013 2 | молодой кислоты | |||||
| Что такое формула для водяного пара | H O | Водяной пар | |||||
| Что является формулой для оксида | NO Formula | Оксид | |||||
| Что является формулой для углерода | C | C | |||||
| Что является формулой для водорода | H | 8 ГЛББ||||||
| Что является формулой для Сахар | C N H N H N H N O N O N | NЧто является формулой для сульфата | 9012 | ||||
| Что является формулой для оксида азота | N 2 O | Азот | |||||
| Формула лимонной кислоты | C 6 H 8 O 7 | Лимонная кислота | |||||
| Формула для октана C 8 H 18 18 Octane | | ||||||
| Формула для Camphor | C 10 H 16 O | Camphor | |||||
| AGI | серебряный оксид | ||||||
Mysenic Trioxide | |||||||
| Формула для золота триоксида3 | AU 2 O 3 | Gold Trioxide | |||||
AU 838 | Gold Sulfide | ||||||
| Формула для Bromine | BR 2 | Бром | |||||
| Формула для алюминиевой фольги | Al 2 O 3 O 3 | Алюминиевая фольга | |||||
| Что такое химическая формула для кислотного дождя SO2 (диоксид серы) + NO2 (диоксид азота) + H3O (вода) = кислотный дождь | кислотный дождь | ||||||
Список общих формул | |||||||
Периодическая таблица элементов
- 1.
 Напишите символы
Напишите символы - Бинарные ионные соединения:
- Хлорид натрия: Натрий представляет собой Na, а хлорид представляет собой Cl
- Нитрид магния: Магний представляет собой Mg, а нитрид представляет собой N
- Карбонат аммония: аммоний — NH 4 , а карбонат — CO 3
- 2.Определите валентность или заряд каждого символа и запишите его надстрочным индексом.
- Двоичные ионные соединения:
- хлорид натрия: Na +1 , Cl -1 , Cl -1 , Cl -1
- Нитрид магния: MG +2 , N -3
- Террические ионные соединения:
- Бариум Фосфат: BA +2 , PO 4 -3
- Карбонат аммония: NH 4 +1 , Карбонат CO 3 -2
- 3.
 Определите общее кратное зарядов и уравновесьте суммарный положительный и отрицательный заряд катиона и аниона.
Определите общее кратное зарядов и уравновесьте суммарный положительный и отрицательный заряд катиона и аниона.Примеры:
- Бинарные ионные соединения:
- Хлорид натрия: Поскольку каждый натрий равен +1, а каждый хлорид равен -1, то потребуется один Na+, чтобы сбалансировать один хлорид с -1.
- Нитрид магния: Поскольку каждый магний равен +2, а каждый нитрид равен -3, тогда потребуется три Mg +2 , чтобы сбалансировать два нитрида с -3 .
- Трехкомпонентные ионные соединения:
- Фосфат бария: Поскольку каждый барий равен +2, а каждый фосфат равен -3, тогда потребуется три Ba +2 , чтобы сбалансировать два фосфата с -3 .
- Карбонат аммония: Поскольку каждый аммоний равен +1, а каждый карбонат равен -2, то потребуется два NH 4 +1 , чтобы сбалансировать один карбонат с -2 .
- 4. Количество звеньев катиона и аниона, определенное на шаге 3 выше, становится нижним индексом, который ставится сразу после соответствующего символа.
 Используйте скобки () в случае многоатомных ионов.
Используйте скобки () в случае многоатомных ионов.Примеры:
- Бинарные ионные соединения:
- Хлорид натрия: NaCl
- Нитрид магния: Mg 3 N 2 .
- Тровые ионные соединения:
- барий фосфат: ba 3 (po 4 ) 2
- карбонат аммония: (NH 4 ) 2 CO 3
- 3.
Большинство химических соединений имеют два названия. Первое название – катион (положительный ион), второе – анион (отрицательный ион). В бинарном соединении первым именем будет ион металла. Второе название будет ион неметалла. В тройном соединении первым именем будет ион металла, за исключением аммония. Второе название почти всегда будет многоатомным ионом. Примеры:
Примеры:
2.4 химические формулы – Химия
Цели обучения
К концу этого раздела вы сможете:
- Символизируйте состав молекул, используя молекулярные формулы и эмпирические формулы
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в которой используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле.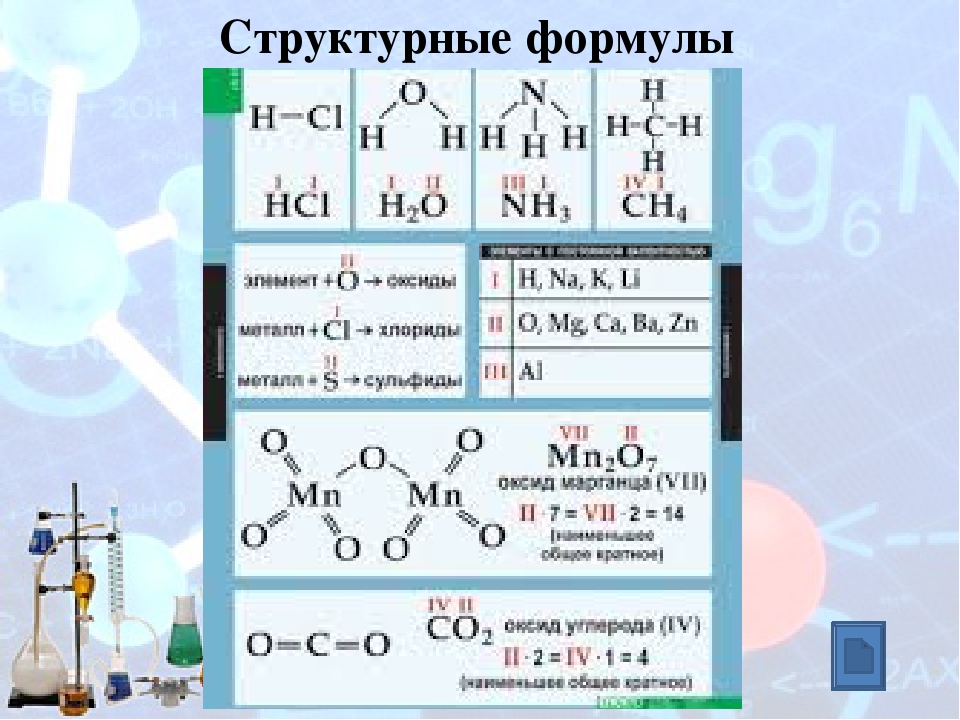 (Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула для соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома С и четырех атомов Н, указывающие на количество атомов в молекуле (рис. 1).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2).
2).
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое.Выражение 2H 2 представляет собой две молекулы двухатомного водорода (рис. 3).
Рисунок 3. Символы H, 2H, H 2 и 2H 2 представляют очень разные объекты. Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов и простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титан (Ti) и кислород (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана (рис. 4).
Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов и простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титан (Ti) и кислород (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана (рис. 4).
Как обсуждалось ранее, мы можем описать соединение с помощью молекулярной формулы, в которой нижние индексы указывают фактическое количество атомов каждого элемента в молекуле соединения. . Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, выглядит так: C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
(Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, выглядит так: C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Пример 1
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Каковы молекулярная и эмпирическая формулы глюкозы?
Раствор
Молекулярная формула C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O.Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?
Ответ:
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Вы можете исследовать построение молекул с помощью онлайн-симуляции.
Ли Кронин
Чем занимаются химики? Согласно Lee Cronin (рис. 7), химики создают очень сложные молекулы, «разбивая» маленькие молекулы и «реконструируя» их. Он задается вопросом, можем ли мы «сделать действительно классный универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «применить» химию?
Он задается вопросом, можем ли мы «сделать действительно классный универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «применить» химию?
В выступлении на TED в 2012 году Ли описывает одну увлекательную возможность: объединить набор химических «чернил» с 3D-принтером, способным изготавливать реакционный аппарат (крошечные пробирки, стаканы и т. п.), чтобы создать «универсальный набор инструментов для химии». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных на ваш генетический состав, окружающую среду и состояние здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». Полный текст его выступления можно посмотреть на сайте TED.
Рисунок 7. Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. Самый молодой руководитель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и выступил с более чем 150 приглашенными докладами.Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, но также затрагивают нанонауку, солнечное топливо, синтетическую биологию и даже искусственную жизнь и эволюцию. (кредит: изображение предоставлено Ли Кронином)
Самый молодой руководитель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и выступил с более чем 150 приглашенными докладами.Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, но также затрагивают нанонауку, солнечное топливо, синтетическую биологию и даже искусственную жизнь и эволюцию. (кредит: изображение предоставлено Ли Кронином)Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одинаковой молекулярной формулой могут иметь разную связь между атомами и, следовательно, разную структуру. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы. Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с одинаковой химической формулой, но разной молекулярной структурой (рис. 8). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с одинаковой химической формулой, но разной молекулярной структурой (рис. 8). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.

Существует множество типов изомеров (рис. 9). Уксусная кислота и метилформиат являются структурными изомерами , соединениями, в которых молекулы различаются тем, как атомы связаны друг с другом.Существуют также различные типы пространственных изомеров , в которых относительная ориентация атомов в пространстве может быть различной. Например, сложный карвон (содержащийся в семенах тмина, мяте колосовой и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отражением друг друга. S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
Рисунок 9. Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве.(кредит внизу слева: модификация работы «Miansari66»/Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр) Выберите эту ссылку, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Молекула зеркала: карвон»).
Молекулярная формула использует химические символы и нижние индексы для указания точного количества различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное соотношение атомов в соединении.Структурная формула указывает на расположение связей атомов в молекуле. Шаростержневые модели и модели с заполнением пространства показывают геометрическое расположение атомов в молекуле. Изомеры – это соединения с одинаковой молекулярной формулой, но разным расположением атомов.
Химия Упражнения в конце главы
- Объясните, почему символ атома кислорода и формула молекулы кислорода различаются.
- Объясните, почему символ элемента серы отличается от формулы молекулы серы.
- Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г) - Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Определите эмпирические формулы следующих соединений:
(а) кофеин, C 8 H 10 N 4 O 2
(b) фруктоза, C 12 H 22 O 11
(c) перекись водорода, H 2 O 2
(d) глюкоза, C 6 H 12 O 6
(e) аскорбиновая кислота (витамин С), С 6 H 8 O 6
- Определите эмпирические формулы следующих соединений:
(а) уксусная кислота, C 2 H 4 O 2
(b) лимонная кислота, C 6 H 8 O 7
(c) гидразин, N 2 H 4
(d) никотин, C 10 H 14 N 2
(д) бутан, C 4 H 10
- Напишите эмпирические формулы следующих соединений:
(а)
(б)
- Откройте симуляцию Build a Molecule и выберите вкладку «Larger Molecules».
 Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.
Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можно ли расположить эти атомы так, чтобы получилось другое соединение?
- Используйте симуляцию «Построить молекулу», чтобы повторить упражнение 8 «Химия, конец главы», но построить молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.

(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия).
- Используйте симуляцию «Построить молекулу», чтобы повторить упражнение 8 «Химия, конец главы», но построить молекулу с тремя атомами углерода, семью атомами водорода и одним атомом хлора.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия)?
Глоссарий
- эмпирическая формула Формула
- , показывающая состав соединения в виде простейшего целочисленного соотношения атомов
- изомеры
- соединений с одинаковой химической формулой, но разной структурой
- молекулярная формула Формула
- , указывающая состав молекулы соединения и дающая фактическое число атомов каждого элемента в молекуле соединения.

- пространственные изомеры
- соединений, в которых относительная ориентация атомов в пространстве различна
- структурная формула
- показывает атомы в молекуле и то, как они связаны
- структурный изомер
- одно из двух веществ, имеющих одинаковую молекулярную формулу, но разные физические и химические свойства, поскольку их атомы связаны по-разному
Решения
Ответы на упражнения по химии в конце главы
1.Символ кислорода элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; нижний индекс 2 в формуле должен использоваться, чтобы отличить двухатомную молекулу от двух одиночных атомов кислорода.
3. (а) молекулярный СО 2 , эмпирический СО 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (c) молекулярный C 2 H 4 , эмпирический CH 2 ; (d) молекулярный H 2 SO 4 , эмпирический H 2 SO 4
5.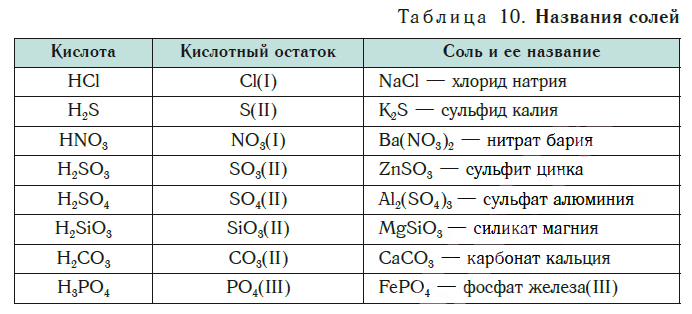 (а) C 4 H 5 N 2 O; (b) C 12 H 22 O 11 ; (в) НО; (г) СН 2 О; (д) С 3 Н 4 О 3
(а) C 4 H 5 N 2 O; (b) C 12 H 22 O 11 ; (в) НО; (г) СН 2 О; (д) С 3 Н 4 О 3
7. (а) CH 2 O; (б) С 2 Н 4 О
9. (а) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разную химическую структуру.Они являются структурными изомерами.
2.4 Химические формулы — химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Символизируйте состав молекул, используя молекулярные формулы и эмпирические формулы
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в котором используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле. (Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, указывающие на количество атомов в молекуле (рис.16). Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Фигура 2.16 Молекулу метана можно представить в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаростержневой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2.17).
2.17).
Фигура 2.17 Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства.Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое.Выражение 2H 2 представляет собой две молекулы двухатомного водорода (рис. 2.18).
Фигура
2.18
Символы H, 2H, H 2 и 2H 2 представляют очень разные сущности.
Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Мы иногда описываем состав этих соединений эмпирической формулой, которая указывает типы присутствующих атомов и простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титан (Ti) и кислород (O) как составляющие диоксида титана и указывает на присутствие в два раза больше атомов элемента кислорода, чем атомов элемента титана (рис. 2.19).
Фигура
2.19
(а) Белая составная двуокись титана обеспечивает эффективную защиту от солнца.(b) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1 к 2. Атомы титана окрашены в серый цвет, а атомы кислорода — в красный. (кредит: модификация работы «ossous»/Flickr)
Атомы титана окрашены в серый цвет, а атомы кислорода — в красный. (кредит: модификация работы «ossous»/Flickr)
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактическое число атомов каждого элемента в молекуле соединения. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола С 6 Н 6 (рис. 2.20).
Фигура
2. 20
Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)
20
Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, выглядит так: C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 2.21) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Фигура 2.21 (a) Уксус содержит уксусную кислоту C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) в виде шаростержневой модели. (кредит: модификация работы «HomeSpot HQ»/Flickr)
Пример 2,6
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?Решение
Молекулярная формула C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O.Простейшее целочисленное отношение атомов C к H к O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?Отвечать:
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Портрет химика
Ли Кронин
Чем занимаются химики? По словам Ли Кронина (рис. 2.22), химики создают очень сложные молекулы, «разбивая» маленькие молекулы и «реконструируя» их. Он задается вопросом, можем ли мы «сделать действительно классный универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «применить» химию?
В выступлении на TED в 2012 году Ли описывает одну увлекательную возможность: объединить набор химических «чернил» с 3D-принтером, способным изготавливать реакционный аппарат (крошечные пробирки, стаканы и т. п.), чтобы создать «универсальный набор инструментов для химии». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных на ваш генетический состав, окружающую среду и состояние здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». Полный текст его выступления можно посмотреть на сайте TED.
п.), чтобы создать «универсальный набор инструментов для химии». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных на ваш генетический состав, окружающую среду и состояние здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». Полный текст его выступления можно посмотреть на сайте TED.
Фигура
2,22
Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. Самый молодой руководитель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и выступил с более чем 150 приглашенными докладами.Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, но также затрагивают нанонауку, солнечное топливо, синтетическую биологию и даже искусственную жизнь и эволюцию. (кредит: изображение предоставлено Ли Кронином)
(кредит: изображение предоставлено Ли Кронином)
Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одинаковой молекулярной формулой могут иметь разную связь между атомами и, следовательно, разную структуру. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы.Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Примерами изомеров являются уксусная кислота и метилформиат — соединения с одинаковой химической формулой, но разной молекулярной структурой (рис. 2.23). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
2.23). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Фигура 2,23 Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разные структуры (и, следовательно, разные химические свойства).
Существует множество типов изомеров (рис. 2.24). Уксусная кислота и метилформиат являются структурными изомерами, соединениями, в которых молекулы различаются тем, как атомы связаны друг с другом.Существуют также различные типы пространственных изомеров, в которых относительная ориентация атомов в пространстве может быть различной. Например, сложный карвон (содержащийся в семенах тмина, мяте колосовой и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отражением друг друга. S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
Фигура 2,24 Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве.(кредит внизу слева: модификация работы «Miansari66»/Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)
Ссылка на обучение
Выберите эту ссылку, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Молекула зеркала: карвон»).
Химическая формула, написание
Пользовательские Поиск
Пользовательский Поиск
Имянация Ковалентных соединений, именования двоичных ионных соединений Полиатомические ионы, именования с полиатомическими ионами Иноподобные ионы с римскими цифрами Imagula Iming Image
|


 Амфолиты. Кислые соли
Амфолиты. Кислые соли Как определить наличие анионов?
Как определить наличие анионов? Пассивная защита. Электродные потенциалы — таблица.
Пассивная защита. Электродные потенциалы — таблица.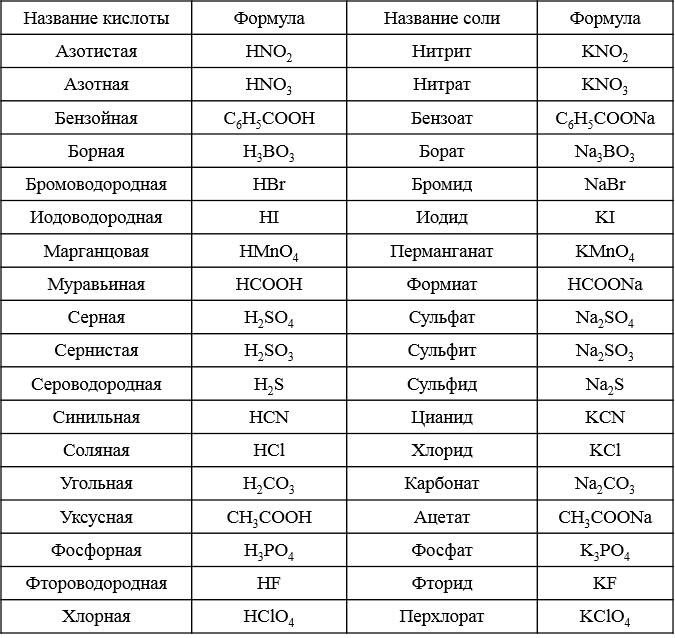

 (B)
(B)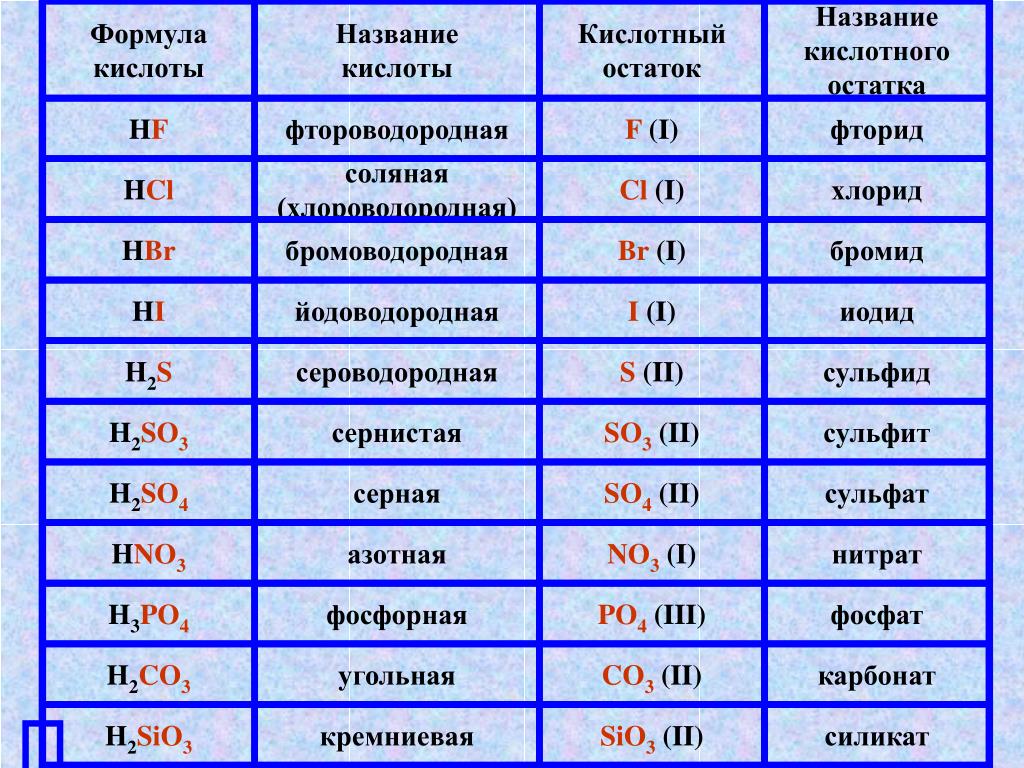 А. Тренажер к уроку химии. 8 класс.
“Чтение химических формул”
А. Тренажер к уроку химии. 8 класс.
“Чтение химических формул” , белый, растворим.
, белый, растворим. , серебристого цвета
, серебристого цвета Кислотный оксид + вода = кислота
Кислотный оксид + вода = кислота  К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ  12 O 6
12 O 6  Напишите символы
Напишите символы Определите общее кратное зарядов и уравновесьте суммарный положительный и отрицательный заряд катиона и аниона.
Определите общее кратное зарядов и уравновесьте суммарный положительный и отрицательный заряд катиона и аниона. Используйте скобки () в случае многоатомных ионов.
Используйте скобки () в случае многоатомных ионов. Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.
Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.