Валентность йода (I), формулы и примеры
Общие сведения о валентности йода
В виде простого вещества йод представляет собой кристаллы черно-серого (темно-фиолетового) цвета с металлическим блеском и резким запахом. Пары йода, также, как и его растворы в органических растворителях, окрашены в фиолетовый цвет.
Валентность йода в соединениях
Йод – пятьдесят третий по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в пятом периоде в VIIA группе. В ядре атома йода содержится 53 протона и 74 нейтрона (массовое число равно 127). В атоме йода есть пять энергетических уровней, на которых находятся 53 электрона (рис. 1).
Рис. 1. Строение атома йода.
Электронная формула атома йода в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64d105s25p5.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что йод способен проявлять валентность I (низшая валентность) в своих соединениях (HI, HIO).
Для атома йода характерно наличие нескольких возбужденных состояний из-за того, что орбитали 5d-подуровня являются вакантными (на четвертом энергетическом слое помимо 5s- и 5p-подуровней есть еще и 5d-подуровень). Сначала распариваются электроны 5p -подуровня и занимают свободные d-орбитали, а после – электроны 5s-подуровня:
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что йод проявляет в своих соединениях валентности III (AuI3, HIO2), V (HIO3) и VII (HIO
4) (высшая валентность).Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Иод, Фтор, Хлор валентность — Справочник химика 21
Какие валентные состояния характерны для фтора, хлора, брома, йода и астатина Дайте развернутое объяснение с учетом особенностей строения их атомов. [c.9]
[c.9]При образовании связей с менее электроотрицательными атомами (для фтора это — все элементы, для хлора — все, кроме фтора и кислорода) валентность всех галогенов равна . Степень окисления -1 и заряд иона 1-. Положительные степени окисления невозможны для фтора. Хлор же проявляет различные положительные степени окисления вплоть до +7 (номер группы). Примеры соединений приведены в Справочной части.
Если сравнить расположение электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления — 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали [c.125]
В то же время сера — аналог кислорода — проявляет переменную валентность 2, 4, 6 хлор — налог фтора проявляет валентность 1, 3, 5, 7. Это объясняется наличием свободных ( -ячеек в третьем энергетическом уровне
Это объясняется наличием свободных ( -ячеек в третьем энергетическом уровне
Изучение фтора, хлора, брома и йода показывает, что эти элементы по химическим свойствам сходны между собой. Все четыре элемента — типичные неметаллы, очень активные, поэтому в природе в свободном состоянии не встречаются. В химических соединениях они проявляют одинаковую валентность и их соединения с одним и тем же элементом проявляют сходные свойства. [c.94]
Как пользоваться таблицами 22, 23, 24 и 25 Помеш,ен-ный в них учебный материал не предназначен для простого заучивания. Руководствуясь им, вы должны повторить и обобщить самое важное, самое существенное об элементах, расположенных в группах периодической системы, о их соединениях, свойствах и применении. Например, следует только взглянуть на схемы распределения электронов по орбиталям фтора F и хлора С1 (табл. 25) — и вы вспомните их общие и отличительные химические свойства. Из этих схем видно, что в атомах фтора и хлора в нормальном состоянии имеется по одному неспаренному электрону.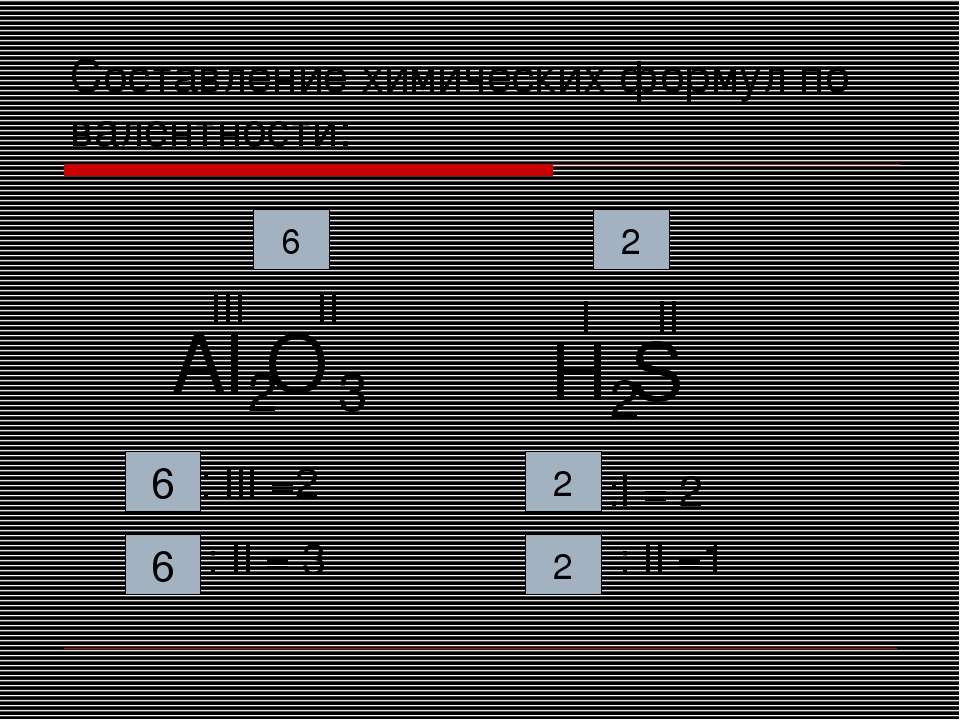
Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и иода. Какие степени окисленности проявляют галогены в своих соединениях [c.221]
Особенности химии фтора. Как и в других группах системы, химия типических элементов — фтора и хлора — имеет целый ряд особенностей. Наиболее ярко это проявляется у фтора. Специфика поведения фтора по сравнению с другими галогенами связана не только с наименьшим радиусом, наибольшими потенциалом ионизации и ОЭО атомов фтора. Главное, что определяет особенности химии фтора,— ограниченные валентные возможности и степени окисления фтора. Атом фтора не располагает -орбиталями, а промотирование электронов на орбитали с главным квантовым числом 3 для него энергетически невыгодно.
Общие сведения. Элементы главной подгруппы V группы — азот, фосфор, мышьяк, сурьма и висмут — в своих кислородных соединениях максимально пятивалентны, по отношению же к водороду они бывают исключи, тельно трехвалентными. Большинство этих элементов пятивалентны также и в отношении других электроотрицательных элементов, прежде всего фтора, хлора, брома и серы. Однако наряду с валентностью пять они всегда проявляют но отношению к ним и валентность три. [c.560]
Электронные конфигурации внешнего валентного слоя галогенов относятся к типу ns np (л = 2, 3, 4 и 5 соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов — способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется. [c.179]
[c.179]
При этом валентная группа каждого атома включает более восьми электронов. В случае фтора расширение валентной группы невозможно, так как фтор в отличие от хлора и др. не имеет незанятых орбит с достаточно низкой энергией. Другой фактор может быть обусловлен тем, что в маленькой молекуле Fa отталкивание неподеленных электронных пар гораздо больше, чем в больших молекулах I2, Вга, 12- [c.141]
В первом разделе данной главы описаны некоторые свойства водорода, углерода, азота, фосфора, мышьяка, сурьмы, (висмута, кислорода, серы, селена, теллура, фтора, хлора, брома и иода. Последующие разделы посвящены их. соединениям между собой, в частности соединениям, в которых они проявляют нормальную валентность и связаны одинарными связями. Соединения неметаллических элементов с кислородом рассмотрены в следующей главе.
[c.172] VII группа. Галогены. К ней относятся элементы главной подгруппы — фтор, хлор, бром, иод, а также нестабильный элемент астат. Все галогены реакционно способны, поскольку во внешней электронной оболочке у них находится семь валентных электронов, и для получения устойчивого одноотрицательного иона достаточно присоединить один электрон. Это обстоятельство характеризует галогены как типичные неметаллы со степенью окисленности —1. [c.38]
Все галогены реакционно способны, поскольку во внешней электронной оболочке у них находится семь валентных электронов, и для получения устойчивого одноотрицательного иона достаточно присоединить один электрон. Это обстоятельство характеризует галогены как типичные неметаллы со степенью окисленности —1. [c.38]
Водородные соединения галогенов. Галогены, соединяясь с водородом, образуют вещества однотипного состава HF, НС1, НВг, HI. Состав этих веществ может быть выражен общей формулой НаШ, где под Hai подразумевается один из галогенов — фтор, хлор, бром, иод, астат. Соединения галогенов с водородом— газы, обладающие резким запахом, дымящие на воздухе. Они отличаются большой растворимостью в воде, при этом образуются кислоты с общей формулой НаШ, сходные по свойствам. По мере повышения зарядов ядер атомов галогенов растет количество промежуточных электронных слоев между ядром атома и его внешним электронным слоем. При этом уменьшается сила связи валентных электронов с ядром атома (уменьшается электроотрицательность с 4,1 у фтора к 2,2 у иода).
Известно, что атом водорода, теряя свой единственный электрон, превращается в протон Н , лишенный электронной оболочки. Поэтому он легко притягивается электронными слоями других атомов или ионов, внедряется в электронные оболочки электроотрицательных элементов (фтора, хлора, кислорода, азота). Можно сказать, что и протоны водорода электростатически притягивают атомы других молекул. Таким образом у атома водорода появляется как бы побочная, вторая валентность.
[c.62] К седьмой группе периодической системы относятся, кроме галогенов — фтора, хлора, брома и и о д а, с которыми мы уже ознакомились, еще элементы марганец Мп и рений Ке. В отличие от галогенов, имеющих в наружной электронной оболочке по семь электронов и являющихся типичными металлоидами, марганец и рений имеют в наружной электронной оболочке только по два электрона и проявляют свойства металлов. С водородом они не образуют соединений. Максимальная положиг тельная их валентность такая же, как и у галогенов, она равна 7 (они могут отдавать электроны не только наружного слоя, но в незаконченного предпоследнего слоя).
Другими словами, следует ожидать проявления физиологической активности у любого фосфорорганического соединения в том случае, если имеется в качестве центрального атома пятивалентный фосфор, который двумя связями соединен с кислородом (или серой). Радикалы Ri и Кг (см. формулу) представляют собой нейтральные радикалы, например алкильные, алкоксильные или даже остатки первичных или вторичных аминов, например (СНз)2М—. Пятая валентность фосфора замещена ациль-ной группой или остатком галоидоводородной (фтор, хлор, бром или йод), синильной или любой другой кислоты. [c.44]
Все элементы подгруппы азота обладают высшим валентным состоянием 54-, соответствующим соединениям их с более электроотрицательными элементами — кислородом, серой, фтором, хлором и бромом. Они образуют с ними также сравнительно устойчивые соединения, где имеют валентность 3+, отвечающую ионам с внешней s -оболочкой, В гидридах они трехвалентны. С возрастанием атомного номера прочность трехвалентных соединений с электроотрицательными элементами — кислородом, серой и галогенами — растет, а пятивалентных — уменьшается. Прочность трехвалентных соединений с электроположительным водородом при этом снижается. Азот и некоторые его аналоги проявляют также положительные валентности 1+, 2-Н и 4-Ь, которые, однако, для них менее характерны. Таким образом, высшая положительная валентность 5-Ь и высшая отрицательная валентность 3—, свойственные всем этим элементам, однозначно указывают на принадлежность их к V группе. [c.80]
Прочность трехвалентных соединений с электроположительным водородом при этом снижается. Азот и некоторые его аналоги проявляют также положительные валентности 1+, 2-Н и 4-Ь, которые, однако, для них менее характерны. Таким образом, высшая положительная валентность 5-Ь и высшая отрицательная валентность 3—, свойственные всем этим элементам, однозначно указывают на принадлежность их к V группе. [c.80]
Иод стоит особняком среди других галогенов вследствие своей способности к образованию относительно устойчивых органических производных, в которых его валентная оболочка содержит не обычное число восемь, а десять электронов. Например, иодбензол реагирует с хлором в растворе хлороформа, образуя дихлорид иодбензола в этом соединении иод имеет валентность, равную трем, и содержит десять электронов на внешней электронной оболочке. Фтор-, хлор- и бромбензолы не реагируют с хлором подобным образом. [c.
 190]
190]Спектральный состав зависит от различий в валентном состоянии активатора, вошедшего в решетку основы, его положения в этой решетке (замещение иона в узле, междуузельное положение), а также от природы атомов основы. В качестве прймера влияния структуры центра свечения на спектр излучения следует привести галофосфат кальция, активированный 8Ь и Мп. Спектр излучения этого люминофора состоит из двух полос, соответствующих излучению 8Ь И Мп, положение и интенсивность свечения которых зависит от концентрации активаторов и соотношения и С1″, входящих в состав галофосфата. Влияние галогенов, например С1 , на положение основной полосы Мп обусловлено тем, что ионы Са — — могут четырьмя различными способами окружать Ионы Мп +. В свою очередь, эти ионы Са » по-разному связаны с сурьмой, фтором, хлором или кислородом. [c.9]
Достоверная интерпретация полученного материала невозможна без специальных расчетов. Известно, однако, что у монозамещенных фтор-, хлор- и бромбензола в рассматриваемой области проявляются колебания типа симметрии Ai, Bi и Вг, которые могут быть интерпретированы соответственно как валентное, деформационное плоскостное и деформационное неилоскостное колебашш связи С—Hal [2, 3]. В связи с этим иред- [c.55]
В связи с этим иред- [c.55]
Хлор также является в высшей степени активным химическим элементом. Однако по своей активности он стоит позади фтора. Так же как и фтор, хлор непосредственно реагирует с большинством элементов, но всегда менее энергично, чем фтор. Он не соединяется непосредственно с азотом и кислородом, а также с углеродом. Однако взаимодействие с этими элементами возможно обходным путем — через другие соединения. С кислородом он образует несколько окислов, правда все они в высшей степени нестойки. В углеводородах хлор замещает водород (частично или полностью). При этом один атом молекулы хлора GI2 соединяется с атомом водорода, а другой — с освободившейся валентностью атома углерода, например СН4 + GI2 = HG1 + Gh4 I. Хлор непосредственно присоединяется к ненасыщенным органическим соединениям, например [c.836]
Фтор во всех соединениях проявляет валентность, равную единице. Остальные галогены проявляют переменную валентность, которая в кислородных соединениях доходит у хлора и иода до семи, а у брома до пяти.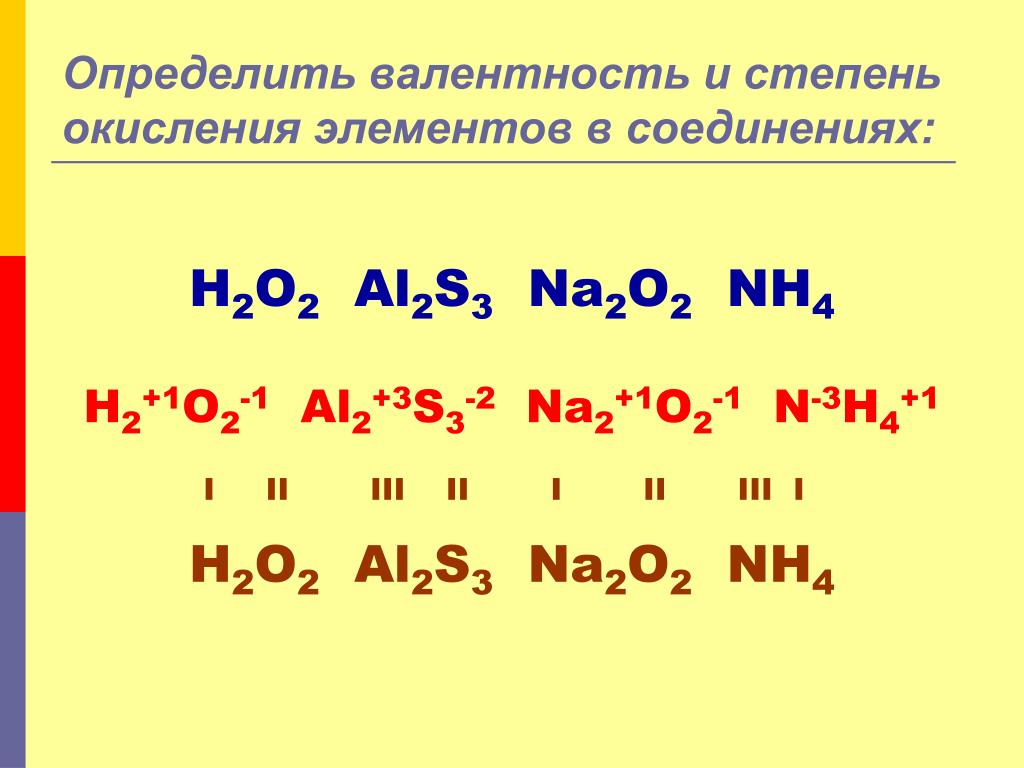 Фтор, хлор и бром не теряют электронов и не превращаются в элементарные катионы. Их соединения с кислородом и другими неметаллами образованы при помощи ковалентных связей. Следовательно, фтор, хлор и бром проявляют свойства только неметаллов. Элементы иод и астат при некоторых условиях могут терять электроны и превращаться в элементарные катионы И и или в сложные катионы, например катион иодила 10 . Иными словами, они проявляют и свойства металлов. Металлические свойства усиливаются от иода к астату. [c.386]
Фтор, хлор и бром не теряют электронов и не превращаются в элементарные катионы. Их соединения с кислородом и другими неметаллами образованы при помощи ковалентных связей. Следовательно, фтор, хлор и бром проявляют свойства только неметаллов. Элементы иод и астат при некоторых условиях могут терять электроны и превращаться в элементарные катионы И и или в сложные катионы, например катион иодила 10 . Иными словами, они проявляют и свойства металлов. Металлические свойства усиливаются от иода к астату. [c.386]
ЦИРКОНИЯ ГАЛОГЕНИДЫ — соединения циркония с фтором, хлором, бромом и иодом, в к-рых Zr проявляет валентность 4, 3 и 2. Соединения 2- и 3-валентного Zr с галогенами — т. наз. субгалогениды, малоустойчивы. Галогениды ZrXj, за исключением красновато-желтого ZrJ4, бесцветны. Их основные физич. свойства представлены ниже. [c.437]
В ряде случаев кремний проявляет свойства, позволяющие предположить, что в достройке валентного октета участвуют Зс -орбитали [6, 7]. При образовании связей с такими электроотрицательными элементами, как фтор, хлор, кислород и азот, валентный октет кремния достраивается, и его координационное число возрастает с 4 до 5 или 6. Существование соединений с такой структурой дает веские доказательства образования spd-гкбридизованных орбиталей. Известно, например, что как гек-сафторсиликатный ион [8] SiFT. так и катион П1 [9] имеют октаэдрическое строение. [c.35]
При образовании связей с такими электроотрицательными элементами, как фтор, хлор, кислород и азот, валентный октет кремния достраивается, и его координационное число возрастает с 4 до 5 или 6. Существование соединений с такой структурой дает веские доказательства образования spd-гкбридизованных орбиталей. Известно, например, что как гек-сафторсиликатный ион [8] SiFT. так и катион П1 [9] имеют октаэдрическое строение. [c.35]
Влияние замещения и сопряжения. Замепгение водорода атомом галогена обычно понижает частоту валентных колебаний двойной связи между углеродными атомами. Величина смещения — наибольшая при замещении йодом, наименьшая — при замеще1ши хлором при замещении фтором частота валентного колебания С=С повышается. Замещение водорода другими электроотрицательными группами, например —0R, —О—СО—R, смещает рассматриваемую частоту в сторону низких частот при одновременном увеличении интенсивности. [c.253]
З-Ь, 5-Ь и 7-Ь. Однако бром является удивительным исключением и валентности 7-Ь не проявляет, хотя его соседи — хлор и иод — эту валентность имеют (ср. в табл. 10 и И сдвиг брома вправо от хлора к фтору). Хлор с кислородом образует и четырехвалентный окисел СЮа, в чем проявляется меньшая электроотрицательность его среди галогенов, отражаемая сдвигом влево к металлам в таблице относительно остальных галогенов. Таким образом, в Vila группе высшая положительная валентность брома (5-Ь) не соответствует номеру группы. [c.80]
в табл. 10 и И сдвиг брома вправо от хлора к фтору). Хлор с кислородом образует и четырехвалентный окисел СЮа, в чем проявляется меньшая электроотрицательность его среди галогенов, отражаемая сдвигом влево к металлам в таблице относительно остальных галогенов. Таким образом, в Vila группе высшая положительная валентность брома (5-Ь) не соответствует номеру группы. [c.80]
Метод валентных связей, валентность
Метод валентных связей
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:
Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
s — s -, s — р-, р – р-, d — d -орбиталей , а также d — s-, d — р– орбиталей.
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
р — р-, р — d-, d — d-, f — p-, f — d— и f — f— орбиталей.
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.

- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp2, sp3).
Типы гибридизации атомных орбиталей
sp3-гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp3-гибридизацией.
sp3-гибридизация орбиталей в молекуле метанаКак видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp3-гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.
Гибридизация орбиталей молекул метана, аммиака, водыsp2-гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
sp2-гибридизация атомов этиленаПлоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp2-гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
sp-гибридизация атомов ацетиленаНиже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4—, TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp2d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4]2— |
| s,p,p,p,d | sp3d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp3d2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)63-, CoF63- |
Гибридные орбитали в пространстве располагаются различным образом:
Пространственное расположение гибридных орбиталей различных типовПодготовка к ЕГЭ.
 Химия элементов (VII группа)
Химия элементов (VII группа)(F,Cl,Br,I,At)
Расположены в главной подгруппе 7 группы
Молекулы простых веществ при н.у. двухатомны – F2,Cl2,Br2,I2.
Относятся к p-элементам
F2 – светло-зеленый газ;
Cl2 – желто-зеленый легко сжижающийся газ;
Br2 – жидкость красно-бурового цвета с желто-бурыми парами;
I2 – Твердое кристаллическое вещество с металлическим блеском, кристаллы-черно-серые, пары фиолетового цвета;
Характерная валентность – I ,могут проявлять также валентность III,V и VII
Характерная СО – (-1) так же устойчивы соединения в СО (кроме F2) (+1)(+5)(+7).
Проявляют окислительные свойства
Усиление кислотных свойств
Получение:
В промышленности – расплавом раствора или расплава NaCl :
В лаборатории – окислением концентрированной соляной кислоты:
Химические свойства:
С простыми веществами:
С кислородом и азотом непосредственно не взаимодействует
Со сложными веществами:
С водой:
HClO при нагревании или воздействии света разлагается
C Щелочами:
На холоде:
При нагревании:
Вытесняет Br и I из солей:
Не реагирует с кислотами
HCl:
С Основаниями:
С основными и амфотерными оксидами:
Металлы до водорода в ряду напряжений вытесняют его из кислоты:
Хлорная известь или хлорка (CaClO2):
Интересные вещества:
Белильная(хлорная) известь – раствор Cl2 в известковой воде, главный компонент – CaOCl2
Каломель – Hg2Cl2
Сулема – HgCl2
Фосген – COCl2
Бертолетова соль – KClO3
Получение:
Электролизом смеси HF и KF:
Химические свойства:
С кислородом и азотом реакция при н. у. не происходит
у. не происходит
(в эл. Разряде на холоде)
Интересные вещества:
Криолит – Na3AlF6
Плавиковая кислота – HF
Флюорит – CaF2
Получение:
Окислением бромидов хлорной водой:
Химические свойства:
Не реагирует с кислородом и азотом при н.у.
Вытесняет йод из соединений:
На холоде:
При нагревании:
Получение:
Окисление иодидов хлорной водой:
Химические свойства:
На холоде:
При нагревании:
Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.

Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH3.
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Структура, энергия и ИК-спектры кластеров I2 * -. Nh3O (n = 1-8): теоретическое исследование
Авторы сообщают теоретические результаты о структуре, связи, энергии и инфракрасных спектрах гидратированных кластеров анион-радикала димера йода, I (2) (-). NH (2) O (n = 1-8), основанные на систематическом исследовании, приведенном ниже. теория функционала плотности. Для каждого кластера размера рассматривается несколько структур начального предположения для определения конформеров минимальной энергии с базисной функцией расщепленной валентности по Гауссу 6-311 ++ G (d, p) (для йода применяется базисный набор тройной расщепленной валентности 6-311).Обнаружено, что в этих гидратированных кластерах возможны три различных типа структур с водородными связями, а именно: симметричные двойные водородные связи, одинарные водородные связи и межводные водородные связи. Но конформеры, имеющие структуры межводных водородных связей, более стабильны по сравнению с конформерами структур с двойными или одинарными водородными связями. Также замечено, что до четырех единиц H (2) O растворителя могут находиться вокруг растворенного вещества в межводной сети водородных связей. Максимум шесть единиц H (2) O независимо связаны с димерным анионом, имеющим четыре двойные водородные связи и две одинарные водородные связи, что позволяет предположить, что число гидратации I (2) (-) равно 6.
NH (2) O (n = 1-8), основанные на систематическом исследовании, приведенном ниже. теория функционала плотности. Для каждого кластера размера рассматривается несколько структур начального предположения для определения конформеров минимальной энергии с базисной функцией расщепленной валентности по Гауссу 6-311 ++ G (d, p) (для йода применяется базисный набор тройной расщепленной валентности 6-311).Обнаружено, что в этих гидратированных кластерах возможны три различных типа структур с водородными связями, а именно: симметричные двойные водородные связи, одинарные водородные связи и межводные водородные связи. Но конформеры, имеющие структуры межводных водородных связей, более стабильны по сравнению с конформерами структур с двойными или одинарными водородными связями. Также замечено, что до четырех единиц H (2) O растворителя могут находиться вокруг растворенного вещества в межводной сети водородных связей. Максимум шесть единиц H (2) O независимо связаны с димерным анионом, имеющим четыре двойные водородные связи и две одинарные водородные связи, что позволяет предположить, что число гидратации I (2) (-) равно 6. Однако конформеры, содержащие звенья H (2) O, независимо связанные с анионом димера йода, не являются наиболее стабильными структурами. Во всех этих гидратированных кластерах нечетный электрон локализован на двух атомах I, и эти два атома связаны трехэлектронной полусвязью. Энергии сольватации, взаимодействия и вертикального отрыва рассчитаны для всех кластеров I (2) (-). NH (2) O. Профили энергии взаимодействия и вертикального отрыва показывают ступенчатое насыщение, что указывает на закрытие геометрической оболочки в гидратированных кластерах, но профиль энергии сольватации не демонстрирует такого поведения.Наблюдается линейная корреляция между рассчитанной энергией взаимодействия и энергией вертикального отрыва. Наблюдается, что образование кластера I (2) (-) — воды вызывает значительные сдвиги по сравнению с обычными модами растяжения O-H изолированного H (2) O. Однако изгибный режим H (2) O остается нечувствительным к последовательному добавлению единиц H (2) O растворителя. Средневзвешенные профили энергии и ИК-спектры представлены для всех гидратированных кластеров на основе статистической совокупности индивидуальных конформеров при комнатной температуре.
Однако конформеры, содержащие звенья H (2) O, независимо связанные с анионом димера йода, не являются наиболее стабильными структурами. Во всех этих гидратированных кластерах нечетный электрон локализован на двух атомах I, и эти два атома связаны трехэлектронной полусвязью. Энергии сольватации, взаимодействия и вертикального отрыва рассчитаны для всех кластеров I (2) (-). NH (2) O. Профили энергии взаимодействия и вертикального отрыва показывают ступенчатое насыщение, что указывает на закрытие геометрической оболочки в гидратированных кластерах, но профиль энергии сольватации не демонстрирует такого поведения.Наблюдается линейная корреляция между рассчитанной энергией взаимодействия и энергией вертикального отрыва. Наблюдается, что образование кластера I (2) (-) — воды вызывает значительные сдвиги по сравнению с обычными модами растяжения O-H изолированного H (2) O. Однако изгибный режим H (2) O остается нечувствительным к последовательному добавлению единиц H (2) O растворителя. Средневзвешенные профили энергии и ИК-спектры представлены для всех гидратированных кластеров на основе статистической совокупности индивидуальных конформеров при комнатной температуре.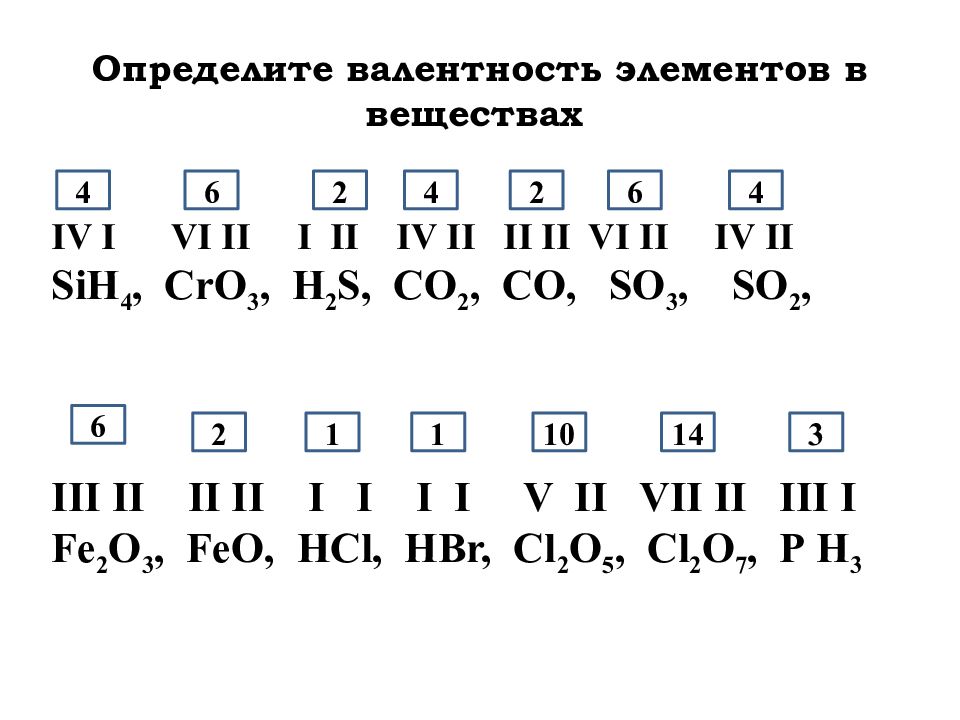
Нарушение правила октетов
Могут быть сконструированы три случая, которые не следуют правилу октетов, и, как таковые, они известны как исключения из правила октетов. Следование правилу октетов для точечных структур Льюиса приводит к наиболее точному изображению стабильных молекулярных и атомных структур, и поэтому мы всегда хотим использовать правило октетов при рисовании точечных структур Льюиса. Однако трудно представить, что одному правилу могли бы следовать все молекулы.Всегда есть исключение, а в данном случае — три исключения. Правило октета нарушается в следующих трех сценариях:
- При нечетном количестве валентных электронов
- Когда валентных электронов слишком мало
- Когда валентных электронов слишком много
Напоминание: всегда используйте правило октетов при рисовании точечных структур Льюиса, эти исключения будут возникать только при необходимости.
Исключение 1: Виды с нечетным числом электронов
Первое исключение из правила октетов — это когда имеется нечетное число валентных электронов. Примером этого может быть молекула оксида азота (II) (\ (NO \)). Атом азота имеет 5 валентных электронов, а атом кислорода — 6 электронов. Всего будет использовано 11 валентных электронов. Правило октета для этой молекулы выполняется в приведенном выше примере, но с 10 валентными электронами. Последний не знает, куда идти. Одинокий электрон называется неспаренным электроном. Но куда деваться неспаренному электрону? Неспаренный электрон обычно помещается в точечную структуру Льюиса, так что каждый элемент в структуре будет иметь наименьший возможный формальный заряд .Формальный заряд — это воспринимаемый заряд отдельного атома в молекуле, когда атомы не вносят равное количество электронов в связи, в которых они участвуют, . Формула для определения официального заряда:
Примером этого может быть молекула оксида азота (II) (\ (NO \)). Атом азота имеет 5 валентных электронов, а атом кислорода — 6 электронов. Всего будет использовано 11 валентных электронов. Правило октета для этой молекулы выполняется в приведенном выше примере, но с 10 валентными электронами. Последний не знает, куда идти. Одинокий электрон называется неспаренным электроном. Но куда деваться неспаренному электрону? Неспаренный электрон обычно помещается в точечную структуру Льюиса, так что каждый элемент в структуре будет иметь наименьший возможный формальный заряд .Формальный заряд — это воспринимаемый заряд отдельного атома в молекуле, когда атомы не вносят равное количество электронов в связи, в которых они участвуют, . Формула для определения официального заряда:
Формальный заряд = [количество валентностей e — , которые атом будет иметь сам по себе] — [количество электронов неподеленной пары на этом атоме] — [количество связей, в которых участвует атом]
Самая идеальная ситуация — полное отсутствие официальных сборов. + \) ион с десятью валентными электронами.
+ \) ион с десятью валентными электронами.
Азот обычно имеет пять валентных электронов. На рисунке 1 он имеет два неподеленных пара электронов и участвует в двух связях (двойная связь) с кислородом. В результате азот имеет формальный заряд +1. Кислород обычно имеет шесть валентных электронов. На рисунке 1 кислород имеет четыре неподеленных пары электронов и участвует в двух связях с азотом. Таким образом, формальный заряд кислорода равен 0. Здесь общая молекула имеет формальный заряд +1 (+1 для азота, 0 для кислорода.+1 + 0 = +1). Однако, если мы добавим к азоту одиннадцатый электрон (потому что мы хотим, чтобы молекула имела наименьший общий формальный заряд ), это сведет к нулю как азот, так и общие заряды молекулы, что является наиболее идеальной ситуацией с формальным зарядом. Именно это и делается для получения правильной структуры Льюиса для монооксида азота:
Рис. 2. Правильная структура Льюиса для молекулы \ (NO \) с 11 валентными электронами.Свободные радикалы
На самом деле существует очень мало стабильных молекул с нечетным числом электронов, поскольку этот неспаренный электрон готов реагировать с другими неспаренными электронами.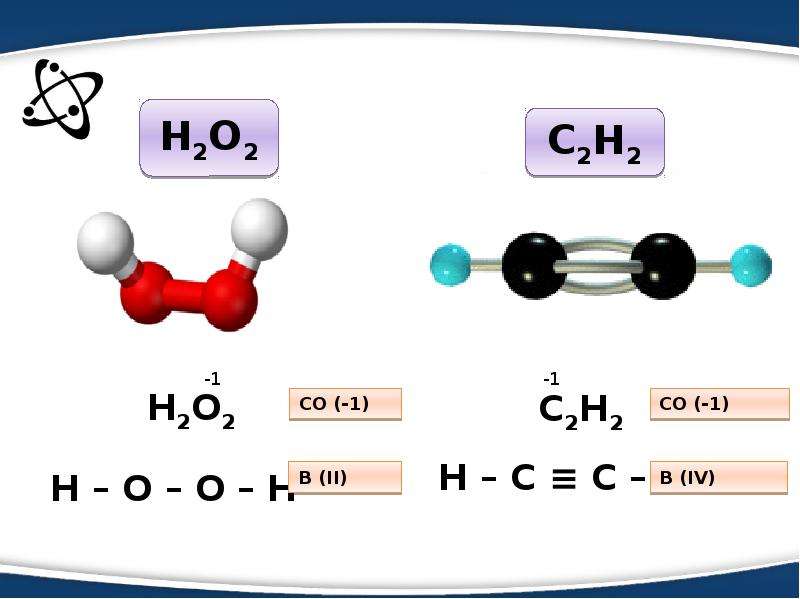 Большинство нечетных видов электронов обладают высокой реакционной способностью, что мы называем свободных радикалов . Из-за своей нестабильности свободные радикалы связываются с атомами, у которых они могут забрать электрон, чтобы стать стабильными, что делает их химически очень активными. Радикалы присутствуют как в качестве реагентов, так и в качестве продуктов, но обычно реагируют с образованием более стабильных молекул, как только могут. Чтобы подчеркнуть существование неспаренного электрона, радикалы обозначаются точкой перед их химическим символом, например, гидроксильным радикалом \ ({\ cdot} OH \).Пример радикала, с которым вы, возможно, уже знакомы, — это газообразный атом хлора, обозначенный \ ({\ cdot} Cl \). Интересно, что молекулы с нечетным числом валентных электронов будут всегда парамагнитными.
Большинство нечетных видов электронов обладают высокой реакционной способностью, что мы называем свободных радикалов . Из-за своей нестабильности свободные радикалы связываются с атомами, у которых они могут забрать электрон, чтобы стать стабильными, что делает их химически очень активными. Радикалы присутствуют как в качестве реагентов, так и в качестве продуктов, но обычно реагируют с образованием более стабильных молекул, как только могут. Чтобы подчеркнуть существование неспаренного электрона, радикалы обозначаются точкой перед их химическим символом, например, гидроксильным радикалом \ ({\ cdot} OH \).Пример радикала, с которым вы, возможно, уже знакомы, — это газообразный атом хлора, обозначенный \ ({\ cdot} Cl \). Интересно, что молекулы с нечетным числом валентных электронов будут всегда парамагнитными.
Исключение 2: неполные октеты
Второе исключение из правила октетов — это когда валентных электронов слишком мало, что приводит к неполному октету. Еще больше случаев, когда правило октетов не дает наиболее правильного изображения молекулы или иона.То же самое и с неполными октетами. Виды с неполными октетами довольно редки и обычно встречаются только в некоторых соединениях бериллия, алюминия и бора, включая гидриды бора. Давайте посмотрим на один такой гидрид, \ (BH_3 \) (Borane).
Еще больше случаев, когда правило октетов не дает наиболее правильного изображения молекулы или иона.То же самое и с неполными октетами. Виды с неполными октетами довольно редки и обычно встречаются только в некоторых соединениях бериллия, алюминия и бора, включая гидриды бора. Давайте посмотрим на один такой гидрид, \ (BH_3 \) (Borane).
Если бы кто-то создал структуру Льюиса для \ (BH_3 \), следуя основным стратегиям рисования структур Льюиса, можно было бы придумать такую структуру (рис. 3):
Рисунок 3: Структура молекулы борана. Проблема с этой структурой в том, что бор имеет неполный октет; у него всего шесть электронов вокруг себя. Атомы водорода, естественно, могут иметь только 2 электрона в своей внешней оболочке (их версия октета), и поэтому нет запасных электронов для образования двойной связи с бором. Можно предположить, что неспособность этой структуры сформировать полные октеты должна означать, что эта связь должна быть ионной, а не ковалентной. Тем не менее, бор имеет электроотрицательность, которая очень похожа на водород, что означает, что, вероятно, существует очень слабый ионный характер в связях водород-бор, и поэтому эта структура Льюиса, хотя она не соответствует правилу октетов, вероятно, является наилучшей из возможных структур. для изображения BH 3 с теорией Льюиса.Одна из причин неполного октета BH 3 заключается в том, что это обычно преходящий вид, временно образующийся в реакциях, включающих несколько этапов.
Тем не менее, бор имеет электроотрицательность, которая очень похожа на водород, что означает, что, вероятно, существует очень слабый ионный характер в связях водород-бор, и поэтому эта структура Льюиса, хотя она не соответствует правилу октетов, вероятно, является наилучшей из возможных структур. для изображения BH 3 с теорией Льюиса.Одна из причин неполного октета BH 3 заключается в том, что это обычно преходящий вид, временно образующийся в реакциях, включающих несколько этапов.
Давайте посмотрим на другую ситуацию с неполным октетом, касающуюся бора, BF 3 (трифтор бора). Как и в случае с BH 3 , первоначальный чертеж структуры Льюиса для BF 3 будет формировать структуру, в которой бор имеет только шесть электронов вокруг себя (рис. 4).
Рисунок 4 Если вы посмотрите на рисунок 4, вы увидите, что атомы фтора обладают дополнительными неподеленными парами, которые они могут использовать для создания дополнительных связей с бором, и вы можете подумать, что все, что вам нужно сделать, это превратить одну неподеленную пару в связь и структура будет правильной.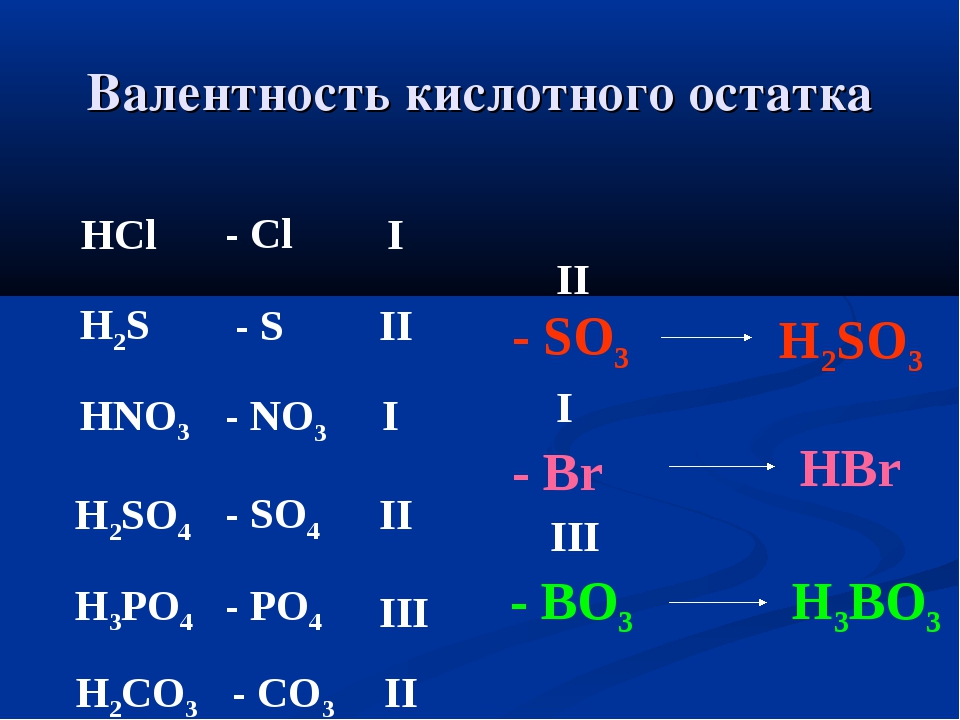 Если мы добавим одну двойную связь между бором и одним из фторов, мы получим следующую структуру Льюиса (рисунок 5):
Если мы добавим одну двойную связь между бором и одним из фторов, мы получим следующую структуру Льюиса (рисунок 5):
Каждый фтор имеет восемь электронов, и атом бора тоже восемь! У каждого атома есть идеальный октет, верно? Не так быстро. Мы должны изучить формальные обвинения в этой структуре. Фтор, который имеет двойную связь с бором, имеет шесть электронов вокруг себя (четыре от двух неподеленных пар электронов и по одному от двух связей с бором). Это на один электрон меньше, чем количество валентных электронов, которое он имел бы естественным образом (элементы седьмой группы имеют семь валентных электронов), поэтому он имеет формальный заряд +1.Два фторана, которые имеют одинарные связи с бором, имеют вокруг себя семь электронов (шесть из трех неподеленных пар и один из одинарных связей с бором). Это то же количество, что и количество валентных электронов, которые они имели бы сами по себе, поэтому оба они имеют формальный заряд, равный нулю. Наконец, бор имеет четыре электрона вокруг себя (по одному от каждой из четырех общих с фтором связей). Это на один электрон больше, чем количество валентных электронов, которое бор имел бы сам по себе, и, как таковой, бор имеет формальный заряд -1.
Это на один электрон больше, чем количество валентных электронов, которое бор имел бы сам по себе, и, как таковой, бор имеет формальный заряд -1.
Эта структура подтверждается тем фактом, что экспериментально определенная длина связи бор-фтор в BF 3 меньше, чем та, которая была бы типичной для одинарной связи (см. Порядок и длины связей). Однако такая структура противоречит одному из основных правил формальных зарядов: предполагается, что отрицательные формальные заряды находятся на более электроотрицательном атоме (ах) в связи, но в структуре, изображенной на рисунке 5, положительный формальный заряд составляет . обнаружен на фторе, который не только является наиболее электроотрицательным элементом в структуре, но и наиболее электроотрицательным элементом во всей периодической таблице (\ (\ chi = 4.0 \)). Бор с другой стороны, с гораздо более низкой электроотрицательностью 2,0, имеет отрицательный формальный заряд в этой структуре. Это формальное несоответствие между зарядом и электроотрицательностью делает эту структуру с двойными связями невозможной.
Однако большая разница в электроотрицательности здесь, в отличие от BH 3 , означает наличие значительных полярных связей между бором и фтором, что означает высокий ионный характер этой молекулы. Это предполагает возможность полуионной структуры, такой как показано на рисунке 6:
. Рис. 6Ни одна из этих трех структур в данном случае не является «правильной».Наиболее «правильная» структура, скорее всего, является резонансом всех трех структур: одной с неполным октетом (рисунок 4), второй с двойной связью (рисунок 5) и одной с ионной связью (рисунок 6). Наиболее способствующей структурой, вероятно, является неполная структура октета (из-за того, что рисунок 5 в принципе невозможен, а рисунок 6 не соответствует поведению и свойствам BF 3 ). Как вы можете видеть, даже когда существуют другие возможности, неполные октеты могут лучше всего отображать молекулярную структуру.
В качестве примечания важно отметить, что BF 3 часто связывается с ионом F — с образованием BF 4 —, а не остается как BF 3 .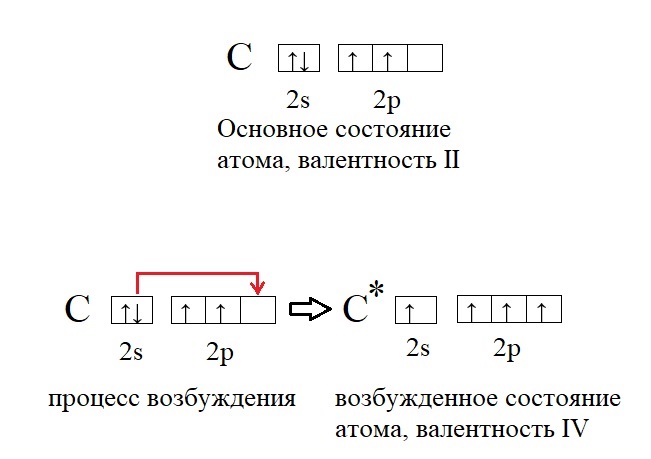 Эта структура завершает октет бора и более распространена в природе. Это иллюстрирует тот факт, что неполные октеты редки, и другие конфигурации обычно более предпочтительны, включая связывание с дополнительными ионами, как в случае BF 3 .
Эта структура завершает октет бора и более распространена в природе. Это иллюстрирует тот факт, что неполные октеты редки, и другие конфигурации обычно более предпочтительны, включая связывание с дополнительными ионами, как в случае BF 3 .
Пример: \ (BF_3 \)
Изобразите структуру Льюиса для трифторида бора (BF 3 ).
Решение
1. Сложите электроны (3 * 7) + 3 = 24
2. Возможности подключения к розыгрышу:
3. Добавьте октеты к внешним атомам:
4. Добавьте дополнительные электроны (24-24 = 0) к центральному атому:
5. Есть ли в центральном электроне октет?
- НЕТ. Имеет 6 электронов
- Добавьте кратную связь (двойную связь), чтобы увидеть, может ли центральный атом получить октет:
6.Центральный бор теперь имеет октет (было бы три резонансные структуры Льюиса)
Однако . ..
..
- В этой структуре с двойной связью атом фтора делится дополнительными электронами с бором.
- Фтор будет иметь частичный заряд «+», а бор — частичный заряд «-», это несовместимо с электроотрицательностью фтора и бора.
- Таким образом, структура BF 3 с одинарными связями и 6 валентными электронами вокруг центрального бора является наиболее вероятной структурой
- BF 3 сильно реагирует с соединениями, имеющими неподеленную пару электронов, которая может использоваться для образования связи с бором:
Исключение 3: Оболочки расширенной валентности
Более распространенными, чем неполные октеты, являются расширенные октеты, когда центральный атом в структуре Льюиса имеет более восьми электронов в своей валентной оболочке.В расширенных октетах центральный атом может иметь десять или даже двенадцать электронов. Молекулы с расширенными октетами включают сильно электроотрицательные концевые атомы и неметаллический центральный атом, находящийся в третьем периоде или ниже , с которым эти концевые атомы связаны. Например, \ (PCl_5 \) является допустимым составным (тогда как \ (NCl_5 \)) не является:
Например, \ (PCl_5 \) является допустимым составным (тогда как \ (NCl_5 \)) не является:
Наблюдаются расширенные валентные оболочки только для элементов периода 3 (т.е. n = 3) и после
Правило «октетов» основано на доступных n s и n p орбиталях для валентных электронов (2 электрона на орбиталях s и 6 на орбиталях p ).Начиная с главного квантового числа n = 3, становятся доступными d-орбитали ( l = 2). Орбитальная диаграмма валентной оболочки фосфора:
Следовательно, элементы третьего периода иногда превышают правило октетов, используя свои пустые d-орбитали для размещения дополнительных электронов. Размер также является важным фактором:
- Чем больше центральный атом, тем большее количество электронов может его окружить
- Расширенные валентные оболочки чаще всего возникают, когда центральный атом связан с небольшими электроотрицательными атомами, такими как F, Cl и O.

В настоящее время ведутся многочисленные научные исследования и исследования причин обнаружения расширенных валентных оболочек. Основная область интереса — выяснить, где находятся лишние пары электронов. Многие химики думают, что существует не очень большая разница в энергии между 3p- и 3d-орбиталями, и поэтому вполне вероятно, что дополнительные электроны легко заполнят 3d-орбиталь, когда расширенный октет более предпочтителен, чем наличие полного октета. Однако этот вопрос все еще является предметом горячих споров, и есть даже споры о том, что делает расширенный октет более предпочтительным, чем конфигурация, которая следует правилу октетов.{-2} \) ион
Сульфат-ион, SO 4 -2 . представляет собой ион, который предпочитает расширенную структуру октета. Строгое соблюдение правила октетов формирует следующую структуру Льюиса:
Рис. 12 Если мы посмотрим на формальные заряды этой молекулы, мы увидим, что все атомы кислорода имеют вокруг себя семь электронов (шесть от трех неподеленных пар и один от связи с серой). Это на один электрон больше, чем количество валентных электронов, которое у них было бы обычно, и поэтому каждый из атомов кислорода в этой структуре имеет формальный заряд -1.В этой структуре сера имеет вокруг себя четыре электрона (по одному от каждой из четырех связей), что на два электрона меньше, чем количество валентных электронов, которое она обычно имела бы, и поэтому она несет формальный заряд +2.
Это на один электрон больше, чем количество валентных электронов, которое у них было бы обычно, и поэтому каждый из атомов кислорода в этой структуре имеет формальный заряд -1.В этой структуре сера имеет вокруг себя четыре электрона (по одному от каждой из четырех связей), что на два электрона меньше, чем количество валентных электронов, которое она обычно имела бы, и поэтому она несет формальный заряд +2.
Если бы вместо этого мы сделали структуру для сульфат-иона с расширенным октетом, она бы выглядела так:
Рис. 13 Если посмотреть на формальные заряды этой структуры, у иона серы шесть электронов (по одному от каждой связи). Это такое же количество, как количество валентных электронов, которое оно должно было бы иметь в природе.Это оставляет серу с формальным нулевым зарядом. Два атома кислорода, которые имеют двойные связи с серой, имеют по шесть электронов вокруг себя (четыре от двух неподеленных пар и по одному от двух связей с серой). Это то же количество электронов, что и количество валентных электронов, которые атомы кислорода имеют сами по себе, и поэтому оба этих атома кислорода имеют формальный заряд, равный нулю. Два атома кислорода с одинарными связями с серой имеют вокруг себя семь электронов в этой структуре (шесть от трех неподеленных пар и один от связи с серой).Это на один электрон больше, чем количество валентных электронов, которое кислород имел бы сам по себе, и поэтому эти два атома кислорода несут формальный заряд -1. Помните, что при использовании формальных зарядов цель состоит в том, чтобы сохранить как можно меньшие формальные заряды (или разницу между формальными зарядами каждого атома). Количество и значения формальных зарядов на этой конструкции (-1 и 0 (разница в 1) на рисунке 12, в отличие от +2 и -1 (разница в 3) на рисунке 12) значительно ниже, чем на структуре. который следует правилу октетов, и в этом случае расширенный октет является правдоподобным и даже предпочтительнее обычного октета.- \) ион.
Два атома кислорода с одинарными связями с серой имеют вокруг себя семь электронов в этой структуре (шесть от трех неподеленных пар и один от связи с серой).Это на один электрон больше, чем количество валентных электронов, которое кислород имел бы сам по себе, и поэтому эти два атома кислорода несут формальный заряд -1. Помните, что при использовании формальных зарядов цель состоит в том, чтобы сохранить как можно меньшие формальные заряды (или разницу между формальными зарядами каждого атома). Количество и значения формальных зарядов на этой конструкции (-1 и 0 (разница в 1) на рисунке 12, в отличие от +2 и -1 (разница в 3) на рисунке 12) значительно ниже, чем на структуре. который следует правилу октетов, и в этом случае расширенный октет является правдоподобным и даже предпочтительнее обычного октета.- \) ион.
Решение
1. Подсчитайте валентные электроны: 7+ (4 * 7) +1 = 36 электронов
2. Нарисуйте соединения:
3. Добавьте октет электронов к внешним атомам:
Добавьте октет электронов к внешним атомам:
4. Добавьте дополнительные электроны (36-32 = 4 ) к центральному атому:
5. Ион ICl 4 –, таким образом, имеет 12 валентных электронов вокруг центрального йода (на орбиталях 5 d )
Расширенные структуры Льюиса также являются правдоподобными изображениями молекул, когда экспериментально определенные длины связей предполагают характеры частичных двойных связей, даже когда одинарные связи уже полностью заполняют октет центрального атома.Несмотря на случаи для расширенных октетов, как упоминалось для неполных октетов, важно помнить, что в целом применяется правило октетов.
Практические задачи
- Изобразите структуру Льюиса для молекулы I 3 — .
- Нарисуйте молекулу ClF 3 .
- Центральный атом для расширенного октета должен иметь атомный номер больше какого?
- Изобразите структуру Льюиса для молекулы NO 2 .

- Какая структура Льюиса более вероятна?
или
ответы
1.
2.
3. 10 (Натрий и выше)
4.
5.
Список литературы
- Petrucci, Ralph H .; Харвуд, Уильям S .; Herring, F. G .; Мадура, Джеффри Д. Общая химия: принципы и современные приложения . 9-е изд. Нью-Джерси. Pearson Education, Inc. 2007.
- Мур, Джон У.; Станицкий, Конрад Л .; Юрс, Питер К. Химия; Молекулярная наука . 2-е изд. 2004.
Авторы и авторство
является I2 полярным или неполярным
Йод (I2) — химическое соединение, которое естественным образом присутствует в океане, воздухе, почве и морской воде. Но самый важный источник йода (I2) — это океаны.
Французский ученый Бернар Куртуа открыл йод в 1811 году.
Цвет йода в воде светло-оранжево-коричневый.
У йода есть свободные электроны, когда на него падает солнечный свет, так что свободные электроны будут отражать свет, и тогда йод будет сиять.
Йод — антисептик, убивающий бактерии, и он может вызывать раздражение кожи.
Является ли I2 полярным или неполярным? Если вам интересно узнать об этом запросе, эта статья поможет вам прояснить всю вашу путаницу.
Формула:
Химическая формула йода — I2.
I2 полярный или неполярный
Пояснение 1:
Йод (I2) — неполярная молекула , потому что молекула йода состоит из двух идентичных атомов йода. Значения электроотрицательности обоих атомов одинаковы, что означает, что электрон создает ковалентную связь, которая одинаково распределяется между двумя атомами йода и не имеет частичного заряда. Следовательно, I2 — неполярная молекула.
Пояснение 2:
Йод (I2) — неполярная молекула , потому что она симметрична по форме, и оба атома йода имеют одинаковый заряд и одинаковую электроотрицательность, так что общий дипольный момент I2 становится равным нулю, что приводит к неполярной молекуле.
Пояснение 3:
Йод (I2) — неполярная молекула из-за его линейной структуры и одинаковой электроотрицательности обоих атомов.
Пояснение 4:
Йод (I2) — неполярная молекула , потому что в йоде связь I-I существует между двумя одинаковыми атомами. Следовательно, существует разница в электроотрицательности двух атомов, поэтому I2 рассматривается как полярная молекула.
СводкаПростой состоит в том, что йод (I2) — полярная молекула, потому что она содержит два атома йода, и оба они неполярны.Для получения подробного обзора ознакомьтесь с приведенным выше абзацем.
При этом также важно знать полярность PcL3, SF3 и SO3.
Молекулярная геометрия йода (I2)
Йод (I2) имеет линейную форму, а его полярность неполярна.
Сводка Я провел надлежащее исследование молекулярной геометрии I2, но не получил больше информации об этом, поэтому, если у вас есть какое-либо представление о его форме в деталях, оставьте комментарий, который поможет нашим читателям.
Структура йода по Льюису (I2)
I2 Структура ЛьюисаВ структуре Льюиса I2 есть два идентичных атома йода.
Чтобы нарисовать структуру Льюиса I2, следуйте приведенным ниже инструкциям.
- Прежде всего, узнайте общее количество валентных электронов в I2 с помощью таблицы Менделеева.
- Йод в группе 7 периодической таблицы Менделеева и имеет семь валентных электронов.
- Из I2 можно определить, что у нас есть два атома йода, поэтому умножьте валентные электроны на два, и получится 7 × 2 = 14.
- У нас есть в общей сложности 14 электронов, эти валентные электроны распределяются вокруг двух атомов йода, образуя химическую связь и завершая октет.
- Убедитесь, что у каждого йода 8 электронов.
- Для образования химической связи добавьте два валентных электрона между двумя атомами йода.
- Как вы можете видеть на приведенном выше рисунке, каждый атом йода имеет восемь валентных электронов, так что это структура Льюиса для I2 .

Если вы все еще не знаете, как нарисовать структуру I2 Льюиса , посмотрите это видео, которое поможет вам прояснить всю вашу путаницу.
I2 Дипольный момент
В структуре I2 оба атома йода присоединены под углом 180 °, и оба имеют одинаковую электроотрицательность; следовательно, дипольный момент I2 будет нулевым.
Если электроотрицательность больше, то может быть больше шансов на больший дипольный момент. Когда есть разница в электроотрицательности и разделении зарядов, возникает дипольный момент.
Вы хотите знать причину, по которой I2 приводит к чистому диполю?
Йод (I2) приводит к чистому диполю из-за его симметричной структуры и равного распределения электронов между двумя атомными центрами, поэтому дипольный момент отсутствует.
Йод (I2) не имеет дипольного момента.
I2 ионный или ковалентный
Йод (I2) образует неполярную двухатомную ковалентную молекулу. Каждая молекула йода состоит из 2 атомов йода, которые удерживаются вместе прочными ковалентными связями.
В I2 оба атома йода делят электроны в равной степени.
СводкаПросто йод (I2) представляет собой ковалентную связь.
Растворяется ли I2 в воде?
Йод (I2) — неполярная молекула, поскольку неполярная молекула не растворяется в воде.
Ионы йода реагируют с иодид-ионом с образованием трииодид-иона. Но когда йод и йодид встречаются в воде, образующийся трийодид-ион растворим в воде, но не в смеси неполярных растворителей.
Йод, растворенный в органических растворителях. Органические растворители также называют растворителями на основе углерода.
Если я говорю о масле, значит, масло — неполярная молекула, и йод — тоже неполярная молекула; следовательно, I2 растворим в масле.
Йод растворим в воде в растворе йодида натрия или калия.
СводкаЙод не растворяется в воде, но если вы хотите растворить его в воде, вы можете легко растворить его с помощью йодида натрия и калия.
Является ли I2 кислотой или основанием Льюиса?
I2 — это кислота Льюиса, а I- — это основание Льюиса , потому что основание Льюиса — это разновидность, которая отдает пару электронов акцептору электронов. В I2 I- отдает электронную пару молекуле I2.
СводкаI2 представляет собой кислоту Льюиса, а I- является основанием Льюиса.
Физические свойства йода (I2)
- Йод не является металлом и имеет резкий запах.
- Плотность 4,933 г / см3.
- Это темно-серый / пурпурно-черный, блестящий, сплошной элемент.
- Йод мало растворим в воде и растворен в некоторых растворителях, например четыреххлористый углерод.

- Температура кипения I2 составляет (I2) 457,4 К (184,3 ° C, 363,7 ° F), а точка плавления составляет (I2) 386,85 K (113,7 ° C, 236,66 ° F).
Выше приведены физические свойства I2, теперь давайте перейдем к его атомным свойствам.
Атомные свойства йода (I2)
- Атомный номер I2 53, а массовое число 126,9045 г / моль.
- Степень окисления йода -1, +1, +3, +5, +7.
- Его удельный вес составляет 4,93 при 20 ° C (68 ° F).
- Атомный вес I2 равен 126,9044, а атомный радиус является эмпирическим: 140 пм.
Выше представлены атомарные свойства I2, теперь давайте перейдем к его использованию.
Использование йода (I2)
- Йод — это минерал, который содержится в некоторых продуктах питания.
- Нашему организму нужен йод для выработки гормонов щитовидной железы, которые контролируют различные функции организма и метаболизм.

- Йод используется в коммерческих целях, например, для печатных красок, красок и т. Д.
- I2 играет важную роль в улучшении здоровья щитовидной железы.
- Йод снижает риск некоторых заболеваний зобом.
Есть много применений йода. Я объяснил некоторые из них.
Связанные вопросы
Является ли i2 газом?
Йод может сублимироваться в пурпурно-розовый газ.Это бесцветный газ, похожий на галогениды водорода. Йод является твердым веществом при комнатной температуре, но если вы его должным образом нагреете, йод сразу перейдет из твердого состояния в газообразное.
Токсичен ли газообразный йод?
Да, йод очень токсичен, он может раздражать слизистые оболочки, покрывающие поверхность внутренних органов. Вдыхание паров йода может вызвать слезы и головную боль.
Почему йод не является газом при комнатной температуре?
Йод является твердым веществом при комнатной температуре, потому что сила притяжения межмолекулярных сил очень мала. Чтобы разрушить эти межмолекулярные силы или разделить их, требуется больше тепловой энергии, поэтому йод находится в твердом состоянии при комнатной температуре.
Чтобы разрушить эти межмолекулярные силы или разделить их, требуется больше тепловой энергии, поэтому йод находится в твердом состоянии при комнатной температуре.
Какая форма йода самая лучшая?
Чистые инкапсуляции йода считаются лучшей формой йода, потому что каждая инкапсуляция йода обеспечивает 225 мкг йода. Йод помогает поддерживать здоровый клеточный метаболизм.
Как узнать, нужен ли мне йод?
Есть несколько симптомов. Если вы чувствуете усталость или слабость в теле, значит, вам нужен йод. Если у вас низкий уровень гормона щитовидной железы, это также симптомы дефицита йода.
Последние мысли
Это все о том, является ли I2 полярным или неполярным, я надеюсь, теперь вам ясно, что I2 является неполярной молекулой . Если вы хотите подробнее узнать, почему I2 неполярный, перейдите к статье второго заголовка.
Во время рисования структуры I2 Льюиса посмотрите видео выше или прочтите приведенные выше пункты.
В I2 нет чистого дипольного момента, потому что I2 делит электроны поровну.
Йод (I2) представляет собой ковалентную связь и слегка растворяется в воде.Тем не менее, если вы хотите легко растворить I2, вы можете растворить его с помощью раствора йодида калия.
Я упомянул свойства I2, использование и многое другое о йоде (I2), но если вы думаете, что мы что-то упустили по теме I2? Сообщите нам в разделе комментариев ниже, мы их добавим.
Тенденции в области энергии ионизации | Grandinetti Group
Энергия ионизации атома — это количество энергии , необходимое для удаления электрона из газообразной формы этого атома или иона.
1 st энергия ионизации — Энергия, необходимая для удаления электрона наивысшей энергии из нейтрального газообразного атома.
Например:
| Na (г) → Na + (г) + е – | I 1 = 496 кДж / моль |
Обратите внимание, что энергия ионизации положительна. Это потому, что требуется энергии для удаления электрона.
Это потому, что требуется энергии для удаления электрона.
2 nd энергия ионизации — Энергия, необходимая для удаления секунды электрона из однозарядного газообразного катиона.
Например:
| Na + (г) → Na 2+ (г) + е – | I 2 = 4560 кДж / моль |
Энергия второй ионизации почти в раз в десять раз больше энергии первой, потому что количество электронов, вызывающих отталкивание, уменьшается.
3 rd энергия ионизации — Энергия, необходимая для удаления третьего электрона из двухзарядного газообразного катиона.
Например:
| Na 2+ (г) → Na 3+ (г) + е – | I 3 = 6913 кДж / моль |
Третья энергия ионизации даже больше второй.
Энергии последовательной ионизации увеличиваются по величине, потому что количество электронов, вызывающих отталкивание, неуклонно уменьшается. Это не плавная кривая. После того, как атом потерял валентные электроны, происходит большой скачок энергии ионизации.Атом, имеющий такую же электронную конфигурацию, что и благородный газ, действительно будет удерживать свои электроны. Таким образом, количество энергии, необходимое для удаления электронов за пределами валентных электронов, значительно превышает энергию химических реакций и связывания. Таким образом, только валентные электроны (, т. Е. , электроны за пределами ядра благородного газа) участвуют в химических реакциях.
Энергии ионизации конкретного атома зависят от среднего расстояния электрона от ядра и эффективного заряда ядра
Эти факторы можно проиллюстрировать следующими тенденциями:
1 st энергия ионизации уменьшается по группе.
Это связано с тем, что электроны с наивысшей энергией в среднем находятся на дальше от ядра. По мере увеличения главного квантового числа размер орбитали увеличивается, и электрон легче удалить.
По мере увеличения главного квантового числа размер орбитали увеличивается, и электрон легче удалить.
Примеры:
Я 1 (Na)> Я 1 (Cs)
Я 1 (Cl)> Я 1 (I)
1 st энергия ионизации увеличивается с течением времени.
Это связано с тем, что электроны в одной и той же основной квантовой оболочке не полностью экранируют увеличивающийся ядерный заряд протонов.Таким образом, электроны удерживаются более плотно и требуют больше энергии для ионизации.
Примеры:
I 1 (Cl)> I 1 (Na)
Я 1 (S)> Я 1 (Мг)
График зависимости энергии ионизации от атомного номера не идеален, потому что есть исключения из правил, которые легко объяснить.
Заполненные и наполовину заполненные подоболочки показывают небольшое повышение стабильности, так же как заполненные оболочки показывают повышенную стабильность. Итак, при попытке удалить электрон из одной из этих заполненных или наполовину заполненных подоболочек обнаруживается немного более высокая энергия ионизации.
Итак, при попытке удалить электрон из одной из этих заполненных или наполовину заполненных подоболочек обнаруживается немного более высокая энергия ионизации.
Пример 1:
Я 1 (Ве)> Я 1 (В)
Ионизировать электрон из бериллия труднее, чем из бора, потому что бериллий имеет заполненную s-подоболочку.
Пример 2:
I 1 (N)> I 1 (O)
Азот имеет наполовину заполненную подоболочку «2p», поэтому ионизовать электрон из азота труднее, чем из кислорода.
Какой элемент имеет более высокую энергию ионизации, цинк или галлий?
Как рассчитать формальный платеж
Эй! Добро пожаловать на курс «Мастер органической химии», на всякий случай, если вы впервые.
В этом сообщении блога я объясняю, как рассчитать формальный заряд молекул. Тем не менее, вы можете найти мои видео, содержащие 10 решенных примеров формальных проблем с зарядкой, еще более полезными. Просто думал, что вы должны знать!
Просто думал, что вы должны знать!
Нужно выяснить, является ли атом отрицательным, положительным или нейтральным? Вот формула для определения «формального заряда» атома:
Формальный заряд = [количество валентных электронов] — [электроны в неподеленных парах + 1/2 количества связывающих электронов]
В этой формуле явно указывается соотношение между количеством связывающих электронов и их отношением к тому, сколько из них формально «принадлежит» атому.
Например, применив это к BH 4 (верхний левый угол на изображении ниже), мы получим:
- Число валентных электронов для бора равно 3 .
- Количество несвязанных электронов ноль .
- Общее количество связывающих электронов вокруг бора равно 8 (полный октет). Половина из них — 4 .
Итак, формальный платеж = 3 — (0 + 4) = 3 — 4 = –1
Однако есть более простой способ сделать это.
Поскольку химическая связь имеет два электрона, «количество связывающих электронов, деленное на 2», по определению равно к числу связей , окружающих атом. Таким образом, мы можем вместо этого использовать эту сокращенную формулу :
Формальный заряд = [количество валентных электронов на атоме] — [несвязанные электроны + количество связей].
Применяем это снова к BH 4 (верхний левый угол).
- Число валентных электронов для бора составляет 3 .
- Количество несвязанных электронов ноль .
- Число связей вокруг бора составляет 4 .
Итак, формальный заряд = 3 — (0 + 4) = 3-4 = –1
Формальный заряд B в BH 4 отрицательный 1.
Применим его к : CH 3 (один справа от ЧД 4 )
- Число валентных электронов для углерода 4
- Число несвязанных электронов два (у него неподеленная пара)
- количество связей вокруг углерода — 3 .

Итак, формальный заряд = 4 — (2 +3) = 4-5 = –1
Формальный заряд C в: CH 3 отрицательный 1.
Тот же формальный заряд, что и BH 4 !
Приведем последний пример. Давайте сделаем CH 3 + (без неподеленных пар на углероде). Это оранжевый в нижнем ряду.
- Число валентных электронов углерода 4
- Число несвязанных электронов ноль
- Число связей вокруг углерода 3 .
Итак, формальный заряд = 4 — (0 +3) = 4 — 3 = +1
Вы можете применить эту формулу к любому атому, который хотите назвать.
Вот диаграмма для некоторых простых молекул в ряду B C N O. Надеюсь, бериллий и фтор не слишком обиделись, что я их пропустил, но для целей этой таблицы они действительно не так интересны.
Обратите внимание на интересный узор в геометрии (выделен цветом): BH 4 (-), CH 4 и NH 4 (+) имеют одинаковую геометрию, как и CH 3 (-), NH 3 и OH 3 (+). Карбокатион CH 3 (+) имеет такую же электронную конфигурацию (и геометрию), что и нейтральный боран, BH 3 . Знакомую изогнутую структуру воды H 2 O разделяет амид-анион NH 2 (-). Эти общие геометрические формы являются одним из интересных следствий теории отталкивания электронных пар валентной оболочки (VSEPR — произносится как « vesper », так же, как «Фавр» произносится как « Farve» ).
Карбокатион CH 3 (+) имеет такую же электронную конфигурацию (и геометрию), что и нейтральный боран, BH 3 . Знакомую изогнутую структуру воды H 2 O разделяет амид-анион NH 2 (-). Эти общие геометрические формы являются одним из интересных следствий теории отталкивания электронных пар валентной оболочки (VSEPR — произносится как « vesper », так же, как «Фавр» произносится как « Farve» ).
Формальная формула заряда также работает для двойных и тройные облигации:
Вот вопрос.Алканы, алкены и алкины нейтральны, поскольку есть четыре связи и нет несвязанных электронов: 4 — [4 + 0] = 0. Для каких других значений [связи + несвязанные электроны] вы также получите нулевое значение, и как могут выглядеть эти структуры? (Вы встретите некоторые из этих структур позже в ходе курса).
И последний вопрос — как вы думаете, почему это называется «формальным обвинением»?
Подумайте, какой будет формальная плата за BF 4 .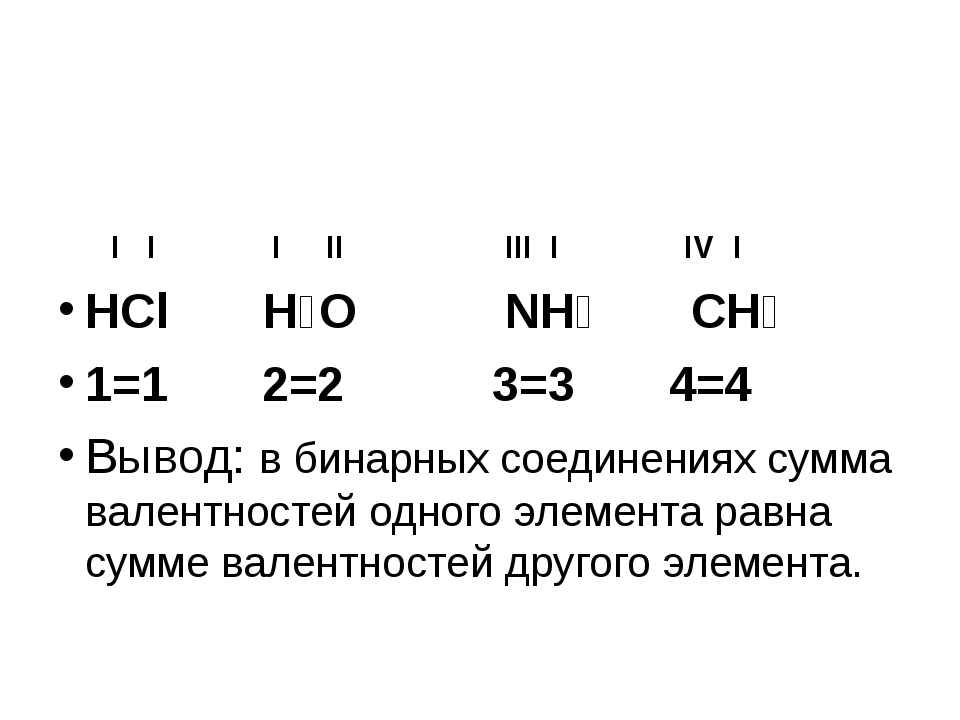 Отрицательный заряд на боре.Какой элемент здесь самый электроотрицательный? Фторид, конечно, с электроотрицательностью 4,0, с тактовой частотой бора 2,0. Как вы думаете, где на самом деле находится отрицательный заряд ?
Отрицательный заряд на боре.Какой элемент здесь самый электроотрицательный? Фторид, конечно, с электроотрицательностью 4,0, с тактовой частотой бора 2,0. Как вы думаете, где на самом деле находится отрицательный заряд ?
Ну, дело не в боре. На самом деле он распространяется через более электроотрицательные фторид-ионы, которые становятся более богатыми электронами. Таким образом, хотя «формальный» адрес отрицательного заряда находится на боре, электронная плотность фактически распределена по фторидам. Другими словами, в данном случае формальное обвинение не имеет ничего общего с действительностью.
Еще одно напоминание — 10 видеороликов с решенными примерами формальных задач заряда, прямо здесь (посмотрите на самый верх страницы)
London Dispersion Forces
London Dispersion Force Лондонские силы рассеяния Лондонская дисперсионная сила — самая слабая межмолекулярная сила.
Лондонская дисперсионная сила — это временная сила притяжения, которая приводит к
когда электроны в двух соседних атомах занимают позиции, которые делают
атомы образуют временные диполи. Эту силу иногда называют индуцированной
диполь-индуцированное дипольное притяжение. Лондонские силы — привлекательные
силы, которые заставляют неполярные вещества конденсироваться в жидкости и замерзать
в твердые частицы при значительном понижении температуры.
Эту силу иногда называют индуцированной
диполь-индуцированное дипольное притяжение. Лондонские силы — привлекательные
силы, которые заставляют неполярные вещества конденсироваться в жидкости и замерзать
в твердые частицы при значительном понижении температуры.
Из-за постоянного движения электронов, атома или молекулы может развить временный (мгновенный) диполь, когда его электроны распределены несимметрично относительно ядра.
Второй атом или молекула, в свою очередь, могут быть искажены внешним видом диполя в первом атоме или молекуле (потому что электроны отталкивают один другой), что приводит к электростатическому притяжению между двумя атомами или молекулы.
Силы дисперсии присутствуют между любыми двумя молекулами (даже полярными молекулами). когда они почти соприкасаются.
Размер молекулы
Силы дисперсии присутствуют между всеми молекулами, независимо от того, являются ли они полярны или неполярны.- Более крупные и тяжелые атомы и молекулы обладают более сильными дисперсионными силами.
 чем меньшие и более легкие.
чем меньшие и более легкие. - В более крупном атоме или молекуле валентные электроны в среднем находятся дальше из ядер, чем в меньшем атоме или молекуле.Они менее тугие удерживаются и могут легче образовывать временные диполи.
- Легкость, с которой электронное распределение вокруг атома или молекулы могут быть искажены, называется поляризуемостью .
Лондонские дисперсионные силы имеют тенденцию быть:
- более сильными между молекулами, которые легко поляризуются.
- слабее между молекулами, которые нелегко поляризуются.
Молекулярная форма
Форма молекул также влияет на величину дисперсионных сил. между ними.- При комнатной температуре неопентан (C 5 H 12 ) представляет собой газ тогда как n -пентан (C 5 H 12 ) является жидкостью.
- Лондонские дисперсионные силы между молекулами n -пентана сильнее
чем между молекулами неопентана, хотя обе молекулы
неполярные и имеют одинаковую молекулярную массу.

- Несколько цилиндрическая форма молекул n -пентана позволяет им контактировать друг с другом более эффективно, чем несколько сферических молекулы неопентана.
| | = С = H | |
| n -пентан n -Пентан представляет собой жидкость при температуре 25 o C. | неопентан Неопентан представляет собой газ при температуре 25 o C. |
Физические последствия лондонских сил рассеяния
Cl 2 и Br 2 имеют примерно одинаковые форма, и ни то, ни другое не полярно.
- При охлаждении как Cl 2 , так и Br 2 образуют твердые вещества. Почему?
- При температуре 25 o C хлор (Cl 2 ) представляет собой газ, тогда как бром (Br 2 ) — жидкость. Почему?
Влияние конкретности на обработку эмоциональной валентности существительных: исследование ERP
Аннотация: Быстрая реакция на эмоциональные слова играет важную роль в социальном общении людей.Сообщалось, что люди имеют преимущество в обработке эмоциональных слов по сравнению с нейтральными словами. Хотя очень важно различать слова, передающие конкретные концепции, и абстрактные концепции при обработке эмоциональных слов, поскольку многие исследования показали, что конкретные слова (например, «стол») обрабатываются быстрее и эффективнее, чем абстрактные слова (например, «правда» ), что называется эффектами конкретности. Однако о представлении и обработке конкретных понятий известно многое, наше понимание абстрактных понятий ограничено, а способ представления абстрактных понятий вызвал большой исследовательский интерес.Недавние исследования обнаружили «эффект абстрактности», то есть преимущество обработки абстрактных слов над конкретными словами, предполагая роль аффективной информации в представлении абстрактных понятий.
Однако о представлении и обработке конкретных понятий известно многое, наше понимание абстрактных понятий ограничено, а способ представления абстрактных понятий вызвал большой исследовательский интерес.Недавние исследования обнаружили «эффект абстрактности», то есть преимущество обработки абстрактных слов над конкретными словами, предполагая роль аффективной информации в представлении абстрактных понятий.
В настоящем исследовании мы разделили эмоциональные существительные на конкретные понятия и абстрактные понятия, чтобы изучить потенциальные различия в обработке, измеряемые потенциалами, связанными с событиями. Задание RSVP с двойной целью использовалось для исследования этапов обработки конкретных и абстрактных существительных в контексте ограниченного внимания.В этом исследовании за плату приняли участие 24 участника-правши (8 мужчин) в возрасте от 18 до 30 лет. Электрическая активность мозга регистрировалась 64-канальной системой, состоящей из оловянных электродов, закрепленных в эластичном колпачке по международной системе 10-20. Помимо поведенческих реакций, компоненты P1, N170 и LPC были выбраны в качестве индикаторов ранних и поздних стадий обработки эмоциональных существительных.
Помимо поведенческих реакций, компоненты P1, N170 и LPC были выбраны в качестве индикаторов ранних и поздних стадий обработки эмоциональных существительных.
Поведенческие результаты показали, что не было эффекта конкретности или абстрактности эмоциональных существительных в контексте ограниченных ресурсов внимания, хотя это отражало «негативную предвзятость» для эмоционального эффекта.Результаты ERP показали, что компонент N170 был модулирован валентностью и конкретностью эмоций, что эмоциональные существительные вызывали значительно большую амплитуду N170, чем нейтральные существительные, а конкретные существительные вызывали значительно большую амплитуду N170, чем абстрактные существительные. Выше два паттерна модуляции компонента N170 наблюдались в левом полушарии, но не в правом полушарии. Компонент LPC также модулировался валентностью и конкретностью эмоций, эмоциональные существительные вызывали значительно большую амплитуду LPC, чем нейтральные существительные, в то время как, в отличие от предыдущих исследований, конкретные существительные вызывали значительно большую амплитуду LPC, чем абстрактные существительные, что могло отражать распределение ресурсов внимания или эффект эмоциональной информации о влиянии конкретности. И, наконец, что не менее важно, существует эффект взаимодействия между конкретностью и эмоциональной валентностью: положительные, отрицательные и нейтральные абстрактные существительные можно было различить по амплитуде LPC соответственно, в то время как он мог различать только эмоциональные конкретные существительные от неэмоциональных существительных. Поздняя стадия эмоциональной обработки существительного соответствовала эффекту абстрактности.
И, наконец, что не менее важно, существует эффект взаимодействия между конкретностью и эмоциональной валентностью: положительные, отрицательные и нейтральные абстрактные существительные можно было различить по амплитуде LPC соответственно, в то время как он мог различать только эмоциональные конкретные существительные от неэмоциональных существительных. Поздняя стадия эмоциональной обработки существительного соответствовала эффекту абстрактности.
Валентность и конкретность эмоций модулируют компоненты ERP на ранних и поздних стадиях обработки существительных в контексте ограниченного внимания.На поздней стадии обработки LPC-амплитуда различает абстрактные существительные с разной валентностью, что указывает на то, что абстрактные существительные имеют более эмоциональную валентность, чем конкретные существительные, и обеспечивает электрофизиологическое доказательство того, что абстрактные слова содержат больше эмоциональной информации.
Ключевые слова: эмоциональные существительные, конкретность, ПРОСЬБА ОТВЕТИТЬ, потенциал, связанный с событием
Номер CLC:
LUO Wenbo, QI Zhengyang.




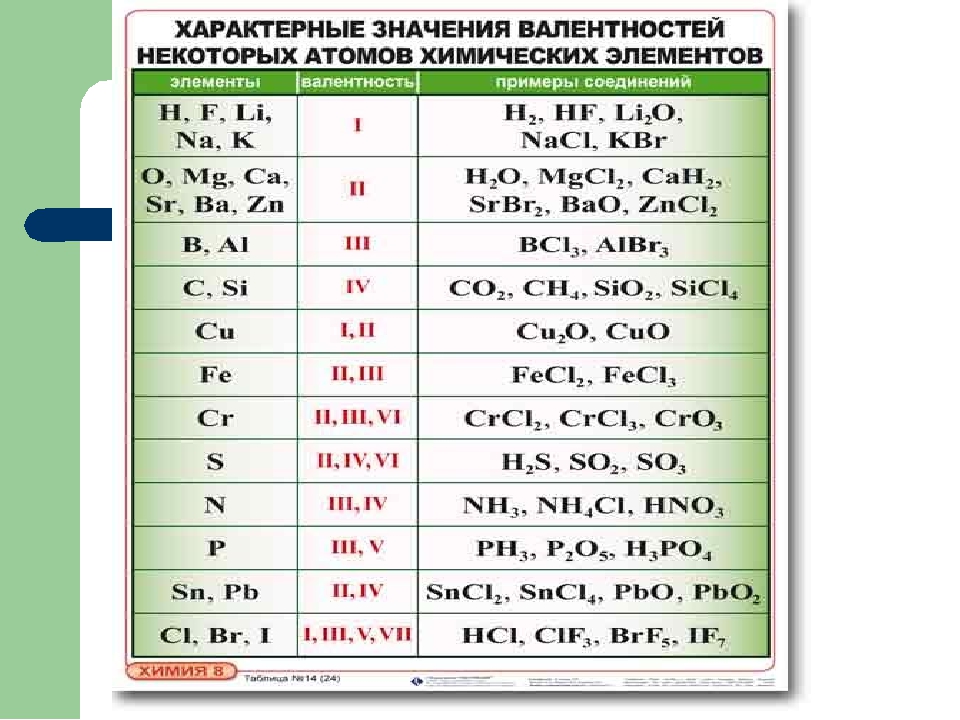
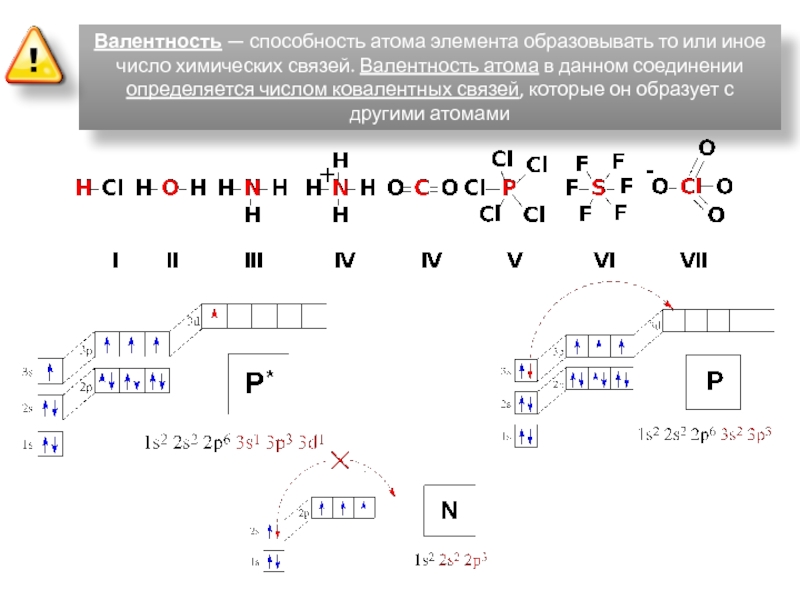
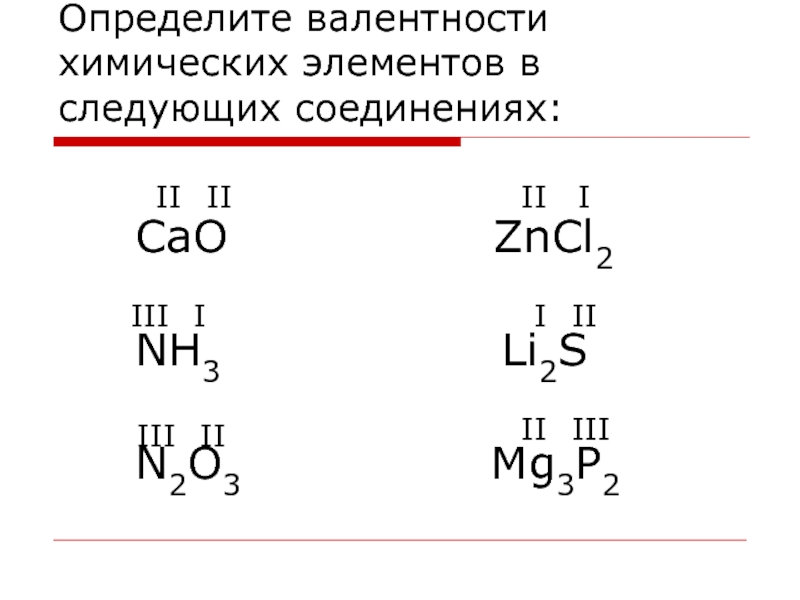
 чем меньшие и более легкие.
чем меньшие и более легкие.