Составление уравнений реакций ионного обмена. Видеоурок. Химия 9 Класс
Данный урок продолжает тему «Реакции ионного обмена». Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Составление уравнений реакций ионного обмена
Составим уравнение реакции между гидроксидом железа (III) и азотной кислотой.
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O
Запишем данное уравнение в ионной форме:
(Гидроксид железа (III) является нерастворимым снованием, поэтому не подвергается электролитической диссоциации. Вода – малодиссоциируемое вещество, на ионы в растворе практически недиссоциировано.)
Fe(OH)3 + 3H+ + 3NO3— = Fe3+ + 3NO3— + 3H2O
Зачеркнем одинаковое количество нитрат-анионов слева и справа, запишем сокращенное ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Данная реакция протекает до конца, т.к. образуется малодиссоциируемое вещество – вода.
Составим уравнение реакции между карбонатом натрия и нитратом магния.
Na2CO3 + Mg(NO3)2 = 2NaNO3 + MgCO3↓
Запишем данное уравнение в ионной форме:
(Карбонат магния является нерастворимым в воде веществом, следовательно, на ионы не распадается.)
2Na+ + CO32-+ Mg2+ + 2NO3— = 2Na+ + 2NO3— + MgCO3↓
Зачеркнем одинаковое количество нитрат-анионов и катионов натрия слева и справа, запишем сокращенное ионное уравнение:
CO32-+ Mg2+ = MgCO3↓
Данная реакция протекает до конца, т.к. образуется осадок – карбонат магния.
Составим уравнение реакции между карбонатом натрия и азотной кислотой.
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 ↑+ H2O
(Углекислый газ и вода – продукты разложения образующейся слабой угольной кислоты.)
2Na+ + CO32- + 2H+ + 2NO3— = 2Na+ + 2NO3—+ CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
Данная реакция протекает до конца, т.к. в результате нее выделяется газ и образуется вода.
Составим два молекулярных уравнения реакций, которым соответствует следующее сокращенное ионное уравнение: Ca2+ + CO32- = CaCO3.
Сокращенное ионное уравнение показывает сущность реакции ионного обмена. В данном случае можно сказать, что для получения карбоната кальция необходимо, чтобы в состав первого вещества входили катионы кальция, а в состав второго – карбонат-анионы. Составим молекулярные уравнения реакций, удовлетворяющих этому условию:
CaCl2 + K2CO3 = CaCO3↓ + 2KCl
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Список рекомендованной литературы
1. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§17)
2. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§9)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме): (Источник).
2. Электронная версия журнала «Химия и жизнь»: (Источник).
Домашнее задание
1. Отметьте в таблице знаком «плюс» пары веществ, между которыми возможны реакции ионного обмена, идущие до конца. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде.
|
Реагирующие вещества |
K2CO3 |
KOH |
AgNO3 |
FeCl3 |
HNO3 |
|
NaOH |
|
|
|
|
|
|
CuCl2 |
|
|
|
|
|
|
HCl |
|
|
|
|
|
2. с. 67 №№ 10,13из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
interneturok.ru
Ионные уравнения. Задача 31 на ЕГЭ по химии. Полные и краткие ионные уравнения
Переходим от полного ионного уравнения к краткому
← Начало статьи
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5. Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение. Начнем, естественно, с молекулярного уравнения:
H2SiO3 + 2KOH = K2SiO3 + 2H2O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K2SiO3 пишем в ионной форме. H2O, естественно, записываем в молекулярной форме:
H2SiO3 + 2K+ + 2OH— = 2K+ + SiO32- + 2H2O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H2SiO3 + 2OH— = SiO32- + 2H2O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH—. Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6. Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение. Основные оксиды реагируют с кислотами с образованием соли и воды:
H2SO4 + CuO = CuSO4 + H2O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H+ + SO42- + CuO = Cu2+ + SO42- + H2O
2H+ + CuO = Cu2+ + H2O
Пример 7. C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение. Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl2 + H2↑.
Полное ионное уравнение записывается без труда:
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl— + H2↑.
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H2. Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H2, HCOH и CH4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H+ = Zn2+ + H2↑.
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8. Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение. Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO3 = Cu(NO3)2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu0 + 2Ag+ + 2NO3
Cu0 + 2Ag+ = Cu2+ + 2Ag↓0.
Дабы уберечь вас от соблазна считать, что Сu2+ и Cu (или Ag+ и Ag) — это «одно и то же», я снабдил нейтральные атомы нулевыми зарядами. Естественно, ионами-наблюдателями являются ионы NO3— (и только они!).
Пример 9. Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение. Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
Полное ионное уравнение:
Ba2+ + 2OH— + 2H+ + SO42- = BaSO4↓ + 2H2O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H+ и OH— — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6. Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH)2 + HNO3 =
- Fe + HBr =
- Zn + CuSO4 =
- SO2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько… непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10. В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. Вспоминая свойства основных классов неорганических соединений, приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH.
Полное ионное уравнение:
Ba2+ + 2OH— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2OH—.
Краткое ионное уравнение:
Ba2+ + SO42- = BaSO4↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO3 + NaCl = NaNO3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K+ + NO3— + Na+ + Cl— = Na+ + NO3— + K+ + Cl—.
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11. Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости!) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Обратите внимание: вместо формулы H2CO3, которая, по идее, должна была образоваться в ходе реакции, мы пишем H2O и CO2. Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + H2O + CO2↑.
Убираем лишнее, получаем краткое ионное уравнение:
CO32- + 2H+ = H2O + CO2↑.
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Пора двигаться дальше. В третьей части статьи мы:
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Продолжение статьи →
www.repetitor2000.ru
Конспект «Реакции ионного обмена. Ионное уравнение»
Реакции ионного обмена. Ионное уравнение
Ключевые слова конспекта: свойства ионов, определение ионов, реакции ионного обмена, ионное уравнение, реакции в растворах электролитов.
Свойства ионов
Число электронов в атоме равно числу протонов. Протоны и нейтроны прочно связаны друг с другом и образуют ядро атома. Ион – атом или часть молекулы, где есть неравное количество электронов и протонов. Если электронов больше, чем протонов, то ион называют отрицательным. Иначе ион называют положительным.
Ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из ионов характерны специфические химические свойства.
Таблица 1. Определение ионов
Определяемый ион | Реактив, содержащий ион | Результат реакции |
| Н+ | Индикаторы | Изменение окраски |
| Ag+ | Cl– | Белый осадок |
| Cu2+ | OH– | Синий осадок |
| S2– | Черный осадок Окрашивание пламени в сине-зеленый цвет | |
| Fe2+ | OH– | Зеленоватый осадок, который с течением времени буреет |
| Fe3+ | OH– | Осадок бурого цвета |
| Zn2+ | OH– | Белый осадок, при избытке ОН– растворяется |
| S2– | Белый осадок | |
| Аl3+ | OH– | Белый желеобразный осадок, который при избытке ОН– растворяется |
| NH4+ | OH– | Запах аммиака |
| Ba2+ | SO42– | Белый осадок Окрашивание пламени в желто-зеленый цвет |
| Ca2+ | CO32– | Белый осадок Окрашивание пламени в кирпично-красный цвет |
| Na+ | Цвет пламени желтый | |
| K+ | Цвет пламени фиолетовый (через кобальтовое стекло) | |
| Cl– | Ag+ | Белый осадок |
| H2SO4* | Выделение бесцветного газа с резким запахом (НСl) | |
| Br– | Ag+ | Желтоватый осадок |
| H2SO4* | Выделение SO2 и Вг2 (бурый цвет) | |
| I– | Ag+ | Желтый осадок |
| H2SO4* | Выделение H2S и I2 (фиолетовый цвет) | |
| SO32– | H+ | Выделение SO2 — газа с резким запахом, обесцвечивающего раствор фуксина и фиолетовых чернил |
| CO32– | H+ | Выделение газа без запаха, вызывающего помутнение известковой воды |
| СН3СОО– | H2SO4 | Появление запаха уксусной кислоты |
| NO3– | H2SO4(конц.) и Cu | Выделение бурого газа |
| SO42– | Ba2+ | Белый осадок |
| PO43– | Ag+ | Желтый осадок |
| OH– | Индикаторы | Изменение окраски индикаторов |
* При определении галогенид-ионов с помощью серной кислоты используют твердую соль.
Ионное уравнение
В водных растворах все электролиты в той или иной степени распадаются на ионы и реакции происходят между ионами.
Сущность реакций в растворах электролитов отражается ионным уравнением. В ионном уравнении учитывается то, что сильный электролит в растворе находится в диссоциированном виде. Формулы слабых электролитов и нерастворимых в воде веществ в ионных уравнениях принято записывать в недиссоциированной на ионы форме. Растворимость электролита в воде нельзя считать критерием его силы. Многие нерастворимые в воде соли являются сильными электролитами, однако концентрация ионов в растворе оказывается низкой вследствие низкой растворимости. Именно поэтому в уравнениях их формулы записывают в недиссоциированной форме.
При составлении ионных уравнений реакций с участием сильных кислот часто для упрощения записывают формулу иона Н+, а не H3O+.
Реакции в растворах электролитов происходят в направлении связывания ионов. Существует несколько форм связывания ионов: образование осадков, выделение газообразных веществ, образование слабых электролитов. Рассмотрим конкретные примеры:
- Образование осадков.
Уравнение в молекулярном виде: Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
Полное ионное уравнение:
Сокращенное ионное уравнение:
- Выделение газов (например, СO2, SO2, H2S, NH3):

- Образование слабых электролитов (например, воды, слабых кислот):
а) КОН + НCl = КCl + H2O
К+ + OH– + Н+ + Cl– = К+ + Cl– + H2O
OH– + Н+ = H2O
б) HNO2 – азотистая кислота (слабая):
NaNO2 + НCl = NaCl + HNO2
Na+ + NO2 + Н+ + Cl– = Na+ + Cl– + HNO2
NO2– + Н+ = HNO2
Иногда реакции в растворах электролитов осуществляются с участием нерастворимых веществ или слабых электролитов в направлении более полного связывания ионов. Например, мрамор растворяется в соляной кислоте с образованием углекислого газа:

Таблица 2. Уравнения ионных реакций

Реакции ионного обмена
Для ионных реакций выражение «в молекулярном виде», как и сама запись, является условным. При анализе приведенных в Таблице 2 уравнений реакций выясняется, что реакции ионного обмена протекают до конца в следующих случаях:
- если выпадает осадок;
- если выделяется газ;
- если образуется малодиссоциирующее вещество, например вода.
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т. е. является обратимой. При составлении уравнений таких реакций, как и при составлении уравнений диссоциации слабых электролитов, ставится знак обратимости.
Чтобы сделать вывод о протекании реакции ионного обмена до конца, надо использовать данные таблицы растворимости солей, оснований и кислот в воде.
Чтобы составить уравнения всех возможных реакций, в которых участвуют хлорид магния и другие растворимые в воде вещества, рассуждают так:
- Убеждаются, растворимо ли в воде взятое вещество, в данном случае хлорид магния MgCl2.
- Приходят к выводу, что хлорид магния MgCl2 будет реагировать только с такими растворимыми в воде веществами, которые способны осадить либо ионы Mg2+, либо хлорид-ионы Сl–.
- Ионы Mg2+ можно осадить: а) ионами ОН–, т. е. нужно подействовать любой щелочью, что приведет к образованию малорастворимого гидроксида магния Mg(OH)2; б) при действии растворимыми в воде солями, содержащими один из следующих анионов:
 . Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.
. Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде. - Хлорид-ионы Сl– можно осадить катионами Ag++ и Pb2+. Поэтому для проведения реакции нужно выбрать растворимые соли, содержащие эти катионы.
При составлении уравнений реакций ионного обмена, в которых образуются газообразные вещества, следует учесть, что анионы  способны реагировать с кислотами с образованием соответствующего газа, например:
способны реагировать с кислотами с образованием соответствующего газа, например: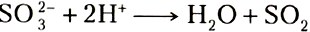
В свете представлений об электролитической диссоциации кислот, оснований и солей общие свойства этих веществ определяются наличием общих ионов, которые входят в их состав
Конспект урока «Реакции ионного обмена. Ионное уравнение».
Следующая тема: «».
uchitel.pro
Задания на тему «Ионные уравнения»


Если в результате реакции выделяется газообразное вещество.
Задание №1.
Определите, может ли осуществляться взаимодействие между растворами следующих веществ, записать реакциив молекулярном,полном, кратком ионном виде:
гидроксид калия и хлорид аммония.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + Nh5Cl = KCl + Nh5OH
так как Nh5OH неустойчивое вещество и разлагается на воду и газ Nh4 уравнение РИО примет окончательный вид
KOH (p) + Nh5Cl (p) = KCl (p) + Nh4 ↑+ h3O
-Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH- + Nh5+ + Cl- = K+ + Cl- + Nh4 ↑+ h3O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH— + Nh5+ = Nh4 ↑+ h3O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (Nh4 ↑) и малодиссоциирующее вещество вода (h3O).
Задание №2
Дана схема:
2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота — H3PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
-Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3
Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд)
где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43- + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ -> 2Na+ + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Задание №1
Посмотрите следующий эксперимент
Взаимодействие карбоната натрия и серной кислоты
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3
Посмотрите следующий эксперимент
Осаждение сульфата бария
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->

соль+металл
Zn + CuSO4 = ZnSO4 + Cu↓
Cu(2+) + SO4(2-) + Zn(0) => Cu(0) + Zn(2+) + So4(2-)
Cu(2+) + Zn(0) => Cu(0) + Zn(2+)
соль+кислота
Na2CO3 + 2HCl(разб. ) = 2NaCl + CO2↑ + h3O
Полная форма:
2Nа+ + CO32− + 2H+ + 2Cl− = 2Na+ + 2Cl− + CO2↑ + h3O
Краткая форма:
2Nа+ + CO32− + 2H+ = 2Na+ + CO2↑ + h3O
соль+щёлочь
CaCl2 + 2NaOH(конц. ) = Ca(OH)2↓ + 2NaCl
Полная форма:
Ca2+ + 2Cl− + 2Na+ + 2OH− = Ca(OH)2↓ + 2Na+ +2Cl−
Краткая форма:
Ca2+ + 2OH− = Ca(OH)2↓
соль+соль
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Полная форма: Ba2+ + 2Cl− + 2Na+ + SO42− = BaSO4↓ + 2Na+ + 2Cl−
infourok.ru
Ионные уравнения реакций | CHEM-MIND.com
Ионные уравнения реакций
Часто меня спрашивают как составлять ионные уравнения?
Как вам уже известно из предыдущих уроков химии, большая часть химических реакций происходит в растворах. А так как все растворы электролитов включают ионы, то можно говорить о том, что реакции в растворах электролитов сводятся к реакциям между ионами.
Вот такие реакции, которые происходят между ионами, носят название ионных реакций. А ионные уравнения – это, как раз и есть уравнения этих реакций. Так как же составлять ионные реакции?
| Алгоритм составления | Пример | |||
| Составить уравнение реакции в молекулярной форме (построить формулы веществ, расставить коэффициенты) | Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 | |||
| С помощью таблицы растворимости определить растворимость каждого вещества (стрелками указать выпадение осадков и выделение газов) | Al2(SO4)3 | BaCl2 | AlCl3 | BaSO4↓ |
| растворимо | растворимо | растворимо | Нерастворимо | |
| Составить полное ионное уравнение (записать ионы диссоциирующих веществ с указанием их числа и зарядов) | Полное ионное уравнение: 2Al3+ + 3SO42— + 3Ba2+ + 6Cl— = 2Al3+ + 6Cl— + 3BaSO4↓ | |||
| Подчеркнуть одинаковые ионы (они не приняли участия в реакции) в левой и правой частях уравнения реакции | 2Al3+ + 3SO42— + 3Ba2+ + 6Cl— = 2Al3+ + 6Cl— + 3BaSO4↓ | |||
| Записать краткое ионное уравнение (выписать формулы ионов или веществ, которые приняли участие в реакции) | Сокращенное ионное уравнение: 3SO42- + 3Ba2+ = 3BaSO4↓ | |||
| Если необходимо, сократите коэффициенты в кратком уравнении | SO42- + Ba2+ = BaSO4↓ | |||
| Сформулируйте вывод на основании краткого ионного уравнения | В реакции участвовали катионы бария и сульфат-анионы, в результате чего образовался нерастворимый сульфат бария | |||
Правила составления ионных уравнений реакций:
- Диссоциацию простых веществ, оксидов, нерастворимых кислот, оснований и солей, а также слабых электролитов не учитывают, записывая вещества в молекулярной форме.
- Если в реакции участвует малорастворимое вещество, то в реакцию оно вступает в виде ионов и записывается в диссоциированном виде, а в качестве продукта реакции малорастворимое вещество считается осадком и записывается в молекулярной форме.
- Сумма зарядов ионов в левой и правой частях уравнения должны быть равны (проверить в кратком ионном уравнении)
Условия протекания ионных уравнений реакций практически до конца (правило Бертолле):
- Выпадение осадка
- Выделение газа
- Образование малодиссоциирующего вещества (например, воды)
Если ни одно из этих условий не выполняется, то ионная реакция в растворе считается обратимой, все ионы в ней находятся в равновесии.
www.chem-mind.com
Внеклассный урок — Примеры составления уравнений реакции ионного обмена
Примеры составления уравнений реакции ионного обмена
НЕОБРАТИМЫЕ РЕАКЦИИ
Реакции с образованием малорастворимых веществ (осадков).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия.
1. Запишем молекулярное уравнение и подберем коэффициенты:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Найдем вещество, которое вызывает протекание реакции. Это Fe(OH)3. Ставим знак осадка ↓:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
3. Укажем силу основания и растворимость солей:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
растворимая сильное осадок растворимая
соль основание соль
4. Запишем полное ионно-молекулярное уравнение (в виде ионов представляем растворимые соли и сильное основание):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
5. Подчеркнем формулы, не участвующие в реакции (это формулы одинаковых ионов в обеих частях уравнения):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
6. Исключим подчеркнутые формулы и получим сокращенное ионно-молекулярное уравнение:
Fe3+ + 3OH – = Fe(OH)3↓
Сокращенное ионно-молекулярное показывает, что сущность реакции сводится к взаимодействию ионов Fe3+ и OH –, в результате чего образуется осадок гидроксида железа(III) Fe(OH)3.
Реакции с образованием слабодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами азотной кислоты и гидроксида калия.
Молекулярное уравнение:
HNO3 + KOH = KNO3 + H2O
сильная сильное растворимая слабый
кислота основание соль электролит
Полное молекулярно-ионное уравнение:
H+ + NO3– + K+ + OH – = K+ NO3– + H2O
Сокращенное ионно-молекулярное уравнение:
H+ + OH – = H2O
Реакции с образованием газообразных веществ.
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами сульфида натрия и серной кислоты.
Молекулярное уравнение:
Na2S + H2SO4 = Na2SO4 + H2S↑
растворимая сильная растворимая газ
соль кислота соль
Полное молекулярно-ионное уравнение:
2Na+ + S2– + 2H+ + SO42– = 2Na+ + SO42– + H2S↑
Сокращенное ионно-молекулярное уравнение:
2H+ + S2– = H2S↑
ОБРАТИМЫЕ РЕАКЦИИ
Разберем процессы, протекающие при сливании растворов нитрата калия и хлорида натрия.
Молекулярное уравнение:
KNO3 + NaCl = KCl + NaNO3
растворимая растворимая растворимая растворимая
соль соль соль соль
Полное молекулярно-ионное уравнение:
K+ + NO3– + Na+ + Cl – ⇄ K+ + Cl – + Na+ + NO3–
В данном случае сокращенное ионно-молекулярное уравнение написать нельзя: согласно теории электролитической диссоциации, реакция не протекает. Если такой раствор выпарить, то получим смесь четырех солей: KNO3, NaCl, KCl, NaNO3.
raal100.narod.ru
Как составлять ионные, молекулярные уравнения?
Молекулярное уравнение это обычное уравнение, которыми мы часто пользуемся на уроке. Например: NaOH+HCl -> NaCl+h3O CuO+h3SO4 -> CuSO4+h3O h3SO4+2KOH -> K2SO4+2h3O и т. д Ионное уравнение. Некоторые вещества растворяются в воде, образуя при этом ионы. Эти вещества можно записать с помощью ионов. А малорастворимые или труднорастворимые оставляем в первоначальном виде. Это и есть ионное уравнение. Например: 1) CaCl2+Na2CO3 -> NaCl+CaCO3-молекулярное уравнение Ca+2Cl+2Na+CO3 -> Na+Cl+CaCO3-ионное уравнение Cl и Na остались такими же, какими они были до реакции, т. н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается: Ca+CO3 -> CaCO3 2) NaOH+HCl -> NaCl+h3O-молекулярное уравнение Na+OH+H+Cl -> Na+Cl+h3O-ионное уравнение Na и Cl остались такими же, какими они были до реакции, т. н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается? OH+H -> h3O Надеюсь, что это принесёт Вам пользу. УДАЧИ!
pb(OH)2 потом pbO потом pb(NO3)2 потом pb (OH)2
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
touch.otvet.mail.ru
 . Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.
. Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.