Общие способы получения оксидов — урок. Химия, 8–9 класс.
1. Оксиды образуются при взаимодействии простых веществ с кислородом.
Например, при сгорании водорода в кислороде образуется оксид водорода (вода):
2h3+O2→2h3O.
При нагревании меди на воздухе она покрывается налётом чёрного цвета, состоящим из оксида меди(\(II\)):
2Cu+O2→2CuO.
2. Оксиды можно получить путём обжига или при сжигании некоторых бинарных соединений.
Например, оксид цинка и оксид серы(\(IV\)) получают обжигом сульфида цинка:
2ZnS+3O2→2ZnO+2SO2.
3. Оксиды образуются при термическом разложении некоторых солей, оснований и кислот.
Например, при обжиге известняка, состоящего из карбоната кальция, образуются оксид кальция и углекислый газ: CaCO3→CaO+CO2.
Оксид меди(\(II\)) образуется при нагревании гидроксида меди(\(II\)): Cu(OH)2→CuO+h3O.
Угольная кислота разлагается даже без нагревания, выделяя оксид углерода(\(IV\)), т. е. углекислый газ: h3CO3→h3O+CO2.
Применение оксидов
Оксиды используются в самых разных отраслях народного хозяйства: в промышленности, в строительстве, при получении других веществ, в медицине, в быту и т. д.
Оксиды используют в промышленности
В промышленности оксиды используются в качестве сырья.
Например, некоторые оксиды используются в качестве пигментов в производстве красок и эмалей. Именно на эти нужды в большом количестве расходуются оксид цинка ZnO, оксид титана(\(IV\)) TiO2 и оксид железа(\(III\)) Fe2O3.
При варке цветных стёкол в качестве пигментов используют оксид кобальта(\(III\)) Co2O3, оксид хрома(\(III\)) Cr2O3 и оксид марганца(\(IV\)) MnO2.
Из оксида серы(\(VI\)) SO3 производят серную кислоту h3SO4, а оксид кальция, или негашёная известь CaO, служит сырьём для получения гидроксида кальция, или гашёной извести Ca(OH)2.

Из оксида кремния SiO2 получают кремний, без которого в наши дни не может обойтись производство солнечных батарей и компьютеров.
Оксиды находят применение в пищевой промышленности и в сельском хозяйстве
В качестве консерванта, а также для дезинфекции теплиц и складских помещений, используют оксид серы(\(IV\)), или сернистый газ SO2. Этот же оксид используют для отбеливания сахара.
Углекислый газ CO2 используют для газирования напитков, а также в производстве сахара.
Оксиды используют для обеспечения безопасности
В качестве надёжного средства для борьбы с огнём используют оксид водорода, т. е. воду h3O, а также оксид кремния SiO2 в виде песка.
Углекислый газ CO2 не поддерживает горения, поэтому им заполняют огнетушители.
кислот, оснований, оксидов, солей. Как получить оксиды, кислоты, соли, основания?
Оксиды- Простое вещество + кислород = оксид
S + O2 = SO2
4P + 5O2 = 2P2O5
2Zn + O2 = 2ZnO - Разложение некоторых солей, кислот и нерастворимых оснований
MgCO3 = MgO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2Fe(OH)3 = Fe2O3 + 3H2O
H2SiO3 = H2O + SiO2
Кислоты
- Кислотный оксид + H2O = кислота (SiO2 с водой не реагирует)
Cl2O7 + H2O = 2HClO4
SO3 + H2O = H2SO4 - H2 + простое вещество-неметалл = летучее водородное соединение
(растворы HF, HCl, HBr, HI, H
H2 + Cl2 = 2HCl (на свету)
H2 + S = H2S (при нагревании) - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HNO3 + Na2SiO3 = H2SiO3 + 2NaNO3
H2SO4 + MgSO3 = H2SO3 (H2O + SO2) + MgSO4
Нерастворимые гидроксиды
- Растворимая соль + щелочь = соль + нерастворимое основание
Ni(NO3)2 + 2KOH = 2KNO3 + Ni(OH)2
FeCl2 + Ca(OH)2 = CaCl2 + Fe(OH)2
Щелочи
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
BaO + H2 O = Ba(OH)2
K2O + H2O = 2KOH - Активный металл + вода = щелочь + H2
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Соли
- Кислотный оксид + основный оксид = соль
SO3 + CaO = CaSO4
N2O5 + K2O = 2KNO3 - Кислотный оксид + щелочь = соль + вода
CO2 + 2NaOH = Na2CO3 + H2O
Cl2O7 + 2KOH = 2KClO4 + H2O - Основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
Fe2O3 + 6HBr = 2FeBr3 + 3H2O - Кислота + основание = соль + вода
H3PO4 + 3KOH = K3
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O - Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
K2SO3 + 2HCl = 2KCl + H2O + SO2 (H2SO3)
NaCl + H2SO4 = NaHSO4 + HCl - Растворимая соль + растворимая соль = нерастворимая соль + соль
CuCl2 + Na2S = CuS + 2NaCl
Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3 - Растворимая соль + щелочь = соль + нерастворимое основание
Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3
MnCl2 + Ca(OH)2 = CaCl2 + Mn(OH)2 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Fe = FeCl2 + H2
2H3PO4 + 6K = 2K3PO4 + 3H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
H2SO4) реагируют с металлами по-другому. - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Fe + CuCl2 = FeCl2 + Cu
Ni + 2AgNO3 = Ni(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой. - Металл + неметалл = соль
2Fe + 3Cl2 = 2FeCl3
Ca + Se = CaSe
Возможно, вам также будут интересны другие разделы справочника по химии:
Получение железосодержащей продукции из железных концентратов.
Хлорное железо (FeCl3) в виде концентрированного раствора применяется в качестве коагулянта, для травления медного проката, в фотографии, ряде синтезов и при выщелачивании различных отходов и концентратов.
Тонкодисперсный оксид железа используют для получения пигментов, для окраски резин и пластмасс. Высокочистый оксид железа находит применение в производстве ферритов различного назначения, для производства Fe-Ni аккумуляторов, высокочистых Fe-порошков и для синтеза высокочистых материалов. Стоимость всех видов этой железосодержащей продукции и, особенно, высокочистых оксидов значительно превосходит стоимость железного концентрата. Очевидно, что производство более дорогостоящей продукции может существенно поднять эффективность производства и сделать выгодной добычу железного концентрата месторождения «Зюдварангер». А снижение тоннажности производства при одновременном увеличении стоимости продаваемой продукции обеспечило бы долгосрочную деятельность предприятия. Так же возможно рассмотрение вариантов вовлечения в переработку Оленегорских или Костомукшских железных концентратов или полный переход на их использование.
В Институте химии КНЦ РАН имеются разработки по получению хлорного железа и высокочистых оксидов железа из некоторых видов железных концентратов. Конкретная технология каждого из железосодержащих продуктов зависит от его чистоты. Технология получения оксидов железа включает выщелачивание концентратов HСl, экстракционную очистку хлорного железа до необходимых кондиций и сжигание растворов хлорного железа с получением порошка оксида железа и соляной кислоты, которая направляется в оборот на растворение концентратов. Технология экологически безопасна, малоотходна и предусматривает регенерацию кислоты.
Конкретная технология каждого из железосодержащих продуктов зависит от его чистоты. Технология получения оксидов железа включает выщелачивание концентратов HСl, экстракционную очистку хлорного железа до необходимых кондиций и сжигание растворов хлорного железа с получением порошка оксида железа и соляной кислоты, которая направляется в оборот на растворение концентратов. Технология экологически безопасна, малоотходна и предусматривает регенерацию кислоты.
Планируемый объем производства 5 тысяч тонн по оксиду железа. Данный объем продукции, по нашим оценкам, может иметь реальный спрос и быть получен при монтаже типовой пирогидролизной установки. Полупродукт данного производства, концентрированный раствор хлорного железа, при необходимости выводится в виде готовой продукции для чего мощности экстракционного оборудования закладываются с запасом, величина которого может быть определена после уточнения объемов потребления FeCl3.
Практически проект может быть реализован в сжатые сроки, т. к. у нас имеется достаточная научная проработка этой технологии, опыт и возможность изготовления экстракционного оборудования, а также хорошая связь с разработчиками и поставщиками пирогидролизного оборудования.
к. у нас имеется достаточная научная проработка этой технологии, опыт и возможность изготовления экстракционного оборудования, а также хорошая связь с разработчиками и поставщиками пирогидролизного оборудования.
Лаборатория разработки и внедрения процессов химической технологии.
<p>Изучение мирового рынка потребления железосодержащей продукции показывает, что помимо ее использования в черной металлургии, она имеет устойчивый спрос и в других областях промышленности. При этом наибольший спрос имеют хлорное железо и оксиды железа.</p>
<p>Хлорное железо (FeCl<sub>3</sub>) в виде концентрированного раствора применяется в качестве коагулянта, для травления медного проката, в фотографии, ряде синтезов и при выщелачивании различных отходов и концентратов.</p>
<p>Тонкодисперсный оксид железа используют для получения пигментов, для окраски резин и пластмасс. Высокочистый оксид железа находит применение в производстве ферритов различного назначения, для производства Fe-Ni аккумуляторов, высокочистых Fe-порошков и для синтеза высокочистых материалов.
<p>В Институте химии КНЦ РАН имеются разработки по получению хлорного железа и высокочистых оксидов железа из некоторых видов железных концентратов. Конкретная технология каждого из железосодержащих продуктов зависит от его чистоты. Технология получения оксидов железа включает выщелачивание концентратов HСl, экстракционную очистку хлорного железа до необходимых кондиций и сжигание растворов хлорного железа с получением порошка оксида железа и соляной кислоты, которая направляется в оборот на растворение концентратов.
 Технология экологически безопасна, малоотходна и предусматривает регенерацию кислоты.</p>
Технология экологически безопасна, малоотходна и предусматривает регенерацию кислоты.</p><p>Планируемый объем производства 5 тысяч тонн по оксиду железа. Данный объем продукции, по нашим оценкам, может иметь реальный спрос и быть получен при монтаже типовой пирогидролизной установки. Полупродукт данного производства, концентрированный раствор хлорного железа, при необходимости выводится в виде готовой продукции для чего мощности экстракционного оборудования закладываются с запасом, величина которого может быть определена после уточнения объемов потребления FeCl<sub>3</sub>.</p>
<p><a href=»/laboratories-and-podrazdel/lab08″>ЛАБОРАТОРИЯ РАЗРАБОТКИ И ВНЕДРЕНИЯ ПРОЦЕССОВ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ </a></p>
Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
Н2 + Cl2 = 2HCl
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
H2SО4(конц. ) + NaCl = 2HCl↑ + NaHSО4
) + NaCl = 2HCl↑ + NaHSО4
- при очень сильном нагревании
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется ~ 450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
2HCl + F2 = Сl2 + 2HF
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
4HCl + O2 = 2Сl2 + 2Н2O
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
HCl → H+ + Cl—
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
2HCl2 + Zn = ZnCl2 + H2
- взаимодействует с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
- реагирует с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
HCl + NH3 = NH4Cl
- взаимодействует с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7.
 При этом анион Cl— окисляется до свободного хлора:
При этом анион Cl— окисляется до свободного хлора:
2Cl—— 2e— = Cl20
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
R-NH2 + HCl → [RNH3]+Cl—
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (
HClO) и ее солиХлорноватистая кислота
очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
- Реакция гипохлоритов с диоксидом углерода и водой :
KClO + H2O + CO2 → KHCO3 + HClO
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO – слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + 2HI → HCl + I2 + H2O
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
HClO + H2O2 → HCl + O2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложение гипохлоритов при нагревании:
Ca(ClO)2 → CaCl2 + O2
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
- Взаимодействуют с другими солями, если продуктом является слабый электролит:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
Хлористая кислота (
HClO2) и ее солиХлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2KClO3 + H2C2O4 + H2SO4 = K2SO4 + CO2 + 2ClO2 + 2H2O
2ClO2 + H2O2 → 2HClO2 + O2
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Химические свойства хлористой кислоты:
- Вступает в реакции с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
- При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
HClO2 + HClO → HClO3 + HCl
5HClO2 + 3H2SO4 + 2KMnO4 → 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
KClO2 → KClO3 + KCl
KClO2 → KCl + O2
- реагируют с сильными кислотами:
NaClO2 + 4HCl(конц) = 2Cl2 + NaCl + 2H2O
- являются слабыми восстановителями и сильными окислителями в кислой среде:
NaClO2 + S = NaCl + SO2
5NaClO2 + 3H2SO4 + 2KMnO4 → 5NaClO3 + 2MnSO4 + K2SO4 + 3H2O
Хлорноватая кислота (
HClO3) и ее солиХлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
- Окисляет некоторые вещества:
6P + 5HClO3 → 3P2O5 + 5HCl
НСlO3 + 6НВr → НСl + 3Вr2 + 3Н2О
HClO3 + 3SO2 + 3H2O → 3H2SO4 + HCl
- Разлагается при слабом нагревании:
6НСlO3(конц) → 4СlO2 + Cl2O7 + 3H2O (40-60ºC)
3НСlO3(конц) → HСlO4 + Cl2 + O2 + H2O (кипечение)
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
- Хлораты сильные окислители.

2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
КСlO3 + 6НСl = КСl + 3Сl2 + 3Н2О
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
4KClO3 → 3KClO4 + KCl
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
2KClO3 → 2KCl + 3O2↑
Хлорная кислота (
HClO4) и ее солиХлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
- Как сильный окислитель окисляет многие вещества:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
5HClO4 + 8As + 12H2O = 8H3AsO4 + 5HCl
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильными окислителями
3KClO4 + 8Al → 3KCl + 4Al2O3
- Взаимодействуют с сильными кислотами:
2KClO4 + 3H2SO4(конц) → 2HClO4↑ + K2SO4
- При нагревании более 550ºС разлагаются:
KClO4 → KCl + 2O2↑
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl
2O)В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
2Cl2 + 3HgO = Hg3O2Cl2↓ + Cl2O↑
2Cl2 + Bi2O3 = 2BiOCl↓ + Cl2O↑
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
Сl2O + H2O = 2HClO
Сl2O + NaOH = 2NaClO + H2O
- Является сильным окислителем:
3Сl2O + 3H2O + 6AgNO3 = 2AgClO + AgCl + 6HNO3
- При температуре выше 20ºС или на свету разлагается:
4Сl2O = 3Сl2 + 2ClO2
Оксид хлора (IV), диоксид хлора, двуокись хлора (
ClO2)ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2↑
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
2KClO3 + H2C2O4 + H2SO4 = 2K2SO4 + 2ClO2↑ + 2CO2 + 2H2O
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
2ClO2 + H2O = HClO2 + HClO3 (холодная вода)
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
2ClO2 + 2NaOH = NaClO2 + NaClO3
- Разлагается в концентрированной хлороводородной кислоте:
2ClO2 + 8HСl(конц) = 5Cl2 + 4H2O
- Проявляет окислительно-восстановительные свойства:
2ClO2 + Na2СO3 = NaClO2 + NaClO3 + CO2
2ClO2 + 10HI(конц) = 2HCl + I2↓ + 4H2O
Оксид хлора (VI), триоксид хлора (ClO
3 (Cl2O6))ClO3 (Cl2O6)
– вязкая жидкость красного цвета. Соприкосновение с органическими веществами
приводит к взрыву.
Соприкосновение с органическими веществами
приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
2ClO2 + 2О3 = 2O2 + Cl2O6
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
4ClO3 = 2ClO2 + 4О2 + Сl2
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
2ClO3 + H2O = HClO4 + HClO3
2ClO3 + 2NaOH = NaClO4 + NaClO3 + H2O
Оксид хлора (VII) (Cl
2О7)Cl2О7 – тяжелая, маслянистая
жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень
взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
P2O5 + 2HClO4 = Cl2O7↑ + 2HPO3
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
Cl2O7 + H2O = HClO4
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
Cl2O7 + 2NaOH = 2NaClO4 + H2O
- При нагревании разлагается:
Cl2O7= 2Cl2 + 7О2
Химия Подготовительные курсы
Тема 1. Основные понятия химии.
Вещество. Атом. Молекула. Химический элемент.
Закон сохранения массы вещества. Классификация неорганических веществ. Закон постоянства состава вещества. Закон Авогадро
Тема 2. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Химическая связь.
2.1 Строение электронных оболочек атомов химических элементов.
2.2 Периодический закон и Периодическая система в свете учения о построении атома.
2.3 Периодические свойства элементов: радиусы атомов, энергия ионизации, электроотрицательность, окислительно-восстановительные свойства. Типы химической связи (Ионная, ковалентная, донорно-акцепторная, водородная)
Тема 3. Физико-химические закономерности протекания химических реакций.
3.1 Предмет химической кинетики. Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры (правило Вант-Гоффа) и концентрации реагентов на скорость реакций.
3. 2 Катализаторы и ингибиторы химических реакций.
2 Катализаторы и ингибиторы химических реакций.
3.3 химическое равновесие. Обратимые и необратимые реакции. Принцип Ле-Шателье. Зависимость положения равновесия от концетрации веществ, температуры и давления. Понятие о термохимии.
Тема 4. Растворы
4.1 Растворимость веществ. Зависимость от внешних факторов.
4.2 Массовая доля вещества в растворе (процентная концетрация), мольная доля вещества в растворе (мольная концетрация).
4.3 Электролиты и неэлектролиты. Теория электролитической диссоциации. Степень диссоциации. Ионные реакции и условия их протекания.
Тема 5. Основные классы неорганических веществ и их взаимозаменяемость.
5.1 Классификация неорганических веществ по классам: оксиды, кислоты, основания, соли (средние), кислые, основные, двойные, смешанные, комплексные) – способы получения и общие типы превращения, их взаимосвязь.
5.2 Гидролиз солей, pH – водных растворов, амфотерность.
5.3 Электролиз. Законы Фарадея.
Тема 6. Обзор химических свойств неметаллов и их наиболее важное соединение.
6.1 Общий обзор элементов VIIA группы. Нахождение в природе, способы получения, физические и химические свойства галогенов, галогеноводородов и их солей, кислородосодержащие соединения хлора, брома и йода. Окислительно-восстановительные реакции. Подбор коэффициентов в уравнениях ОВР с помощью метода электронного баланса.
6.2 Общий обзор элементов VIA группы. Кислород и сера: нахождение в природе, способы получения, физические и химические свойства. Озон. Оксиды серы. Серная кислота: ее промышленное производство, особенности взаимодействия с металлами. Сернистая кислота. Сероводород.
6.3 Общий обзор элементов VA группы. Азот, оксид азота, аммиак, азотная и азотистая кислоты и их соли: получение, физические и химические сводйства. Особенности взаимодействия азотной кислоты с металлами. Особенности солей аммония. Фосфор, фосфин, оксиды фосфора и фосфорные кислоты: получние и свойства.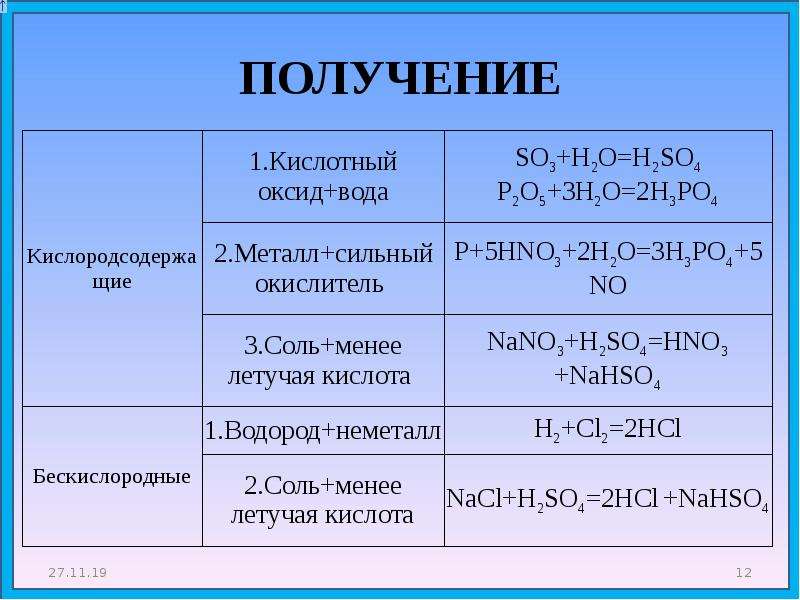 Азотные и фосфорные удобрения.
Азотные и фосфорные удобрения.
6.4 Общий обхор элементов IVA группы. Углерод, кремний их ключевые соединения.
Тема 7. Обзор химических свойств металлов и их наиболее важных соединений.
7.1 Общий обзор элементов IA групп. Химические реакции щелочных металлов и их основных соединений.
7.2 Общий обзор элемент IIA группы. Нахождение в природе. Химические реакции щелочно-земельных металлов и их соединений. Временная и постоянная жесткость воды.
7.3 Алюминий и его соединения.
7.4 Обзор химии соединений d-элементов (железо, хрома, марганца). Нахождения железа в природе. Получение чугуна и стали.
Тема 8. Теория строения органических соединений. Углеводороды.
8.1 Основные понятия органической химии. Основные источники органических соединений веществ. Причины выделения органической химии в отдельную науку. Теория строения органических соединений А.М. Бутлерова. Изомерия. Понятие о номенклатуре органических соединений. Классификация органических веществ.
8.2 Углеводороды: алканы, циклоалканы, алкены, сопряженные диены, алкины, ароматические соединения.
Тема 9. Обзор химических свойств монофункциональных органических соединений.
9.1 Спирты и фенолы (строения, синтез, физические и химические свойства).
9.2 Карбонильные соединения (альдегиды и кетоны) (строение, синтез, физические и химические свойства).
9.3 Карбоновые кислоты и некоторыек их производные (соли и сложные эфиры) . жиры и масла. Мыло.
9.4 Нитросоединения и амины. Анилин. (строения синтез, физические и химические свойства).
Тема 10. Обзор химических свойствполифункциональных органических соединений.
10.1 высокомолекулярные соединения. Полимеры. Аминокислоты, пептиды, белки.
Решение задач по всем темам. Промежуточное и итоговое тестирование.
Взаимодействие оксида меди(II) с серной кислотой | Эксперимент
При использовании описанной ниже процедуры для получения отфильтрованного раствора соли потребуется не более 30 минут.
Экспериментальные работы могут быть начаты без промедления, если разбавленная серная кислота и порошок оксида меди(II) будут предоставлены в готовых отмеренных количествах (см. Примечания по охране труда и технике безопасности).
Эту процедуру могут использовать учащиеся. Демонстрация с помощью учащихся может быть более разумной, если есть реальные сомнения в безопасном поведении или адекватных манипулятивных навыках.
Оборудование
Аппарат
- Защита для глаз
- Стеклянный стакан, 100 см 3
- Коническая колба, 100 см 3
- Шпатель
- Стеклянная палочка для перемешивания
- Воронка с фильтром (примечание 1)
- Фильтровальная бумага (примечание 2)
- Горелка Бунзена
- Штатив
- Марля
- Термостойкий мат
- pH или лакмусовая бумага
Примечания к аппарату
- Полиэтиленовые фильтрующие воронки безопаснее и дешевле, чем стеклянные.
 Важен диаметр воронки фильтра — слишком большая воронка делает фильтрующую установку нестабильной.
Важен диаметр воронки фильтра — слишком большая воронка делает фильтрующую установку нестабильной. - Размер фильтровальной бумаги в сложенном виде должен соответствовать размеру воронки. Подойдет фильтровальная бумага студенческого класса.
Химикаты
- Разбавленная серная кислота, 0,5 М (РАЗДРАЖАЮЩЕЕ), 20 см 3
- Оксид меди(II) (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), около 1 г
Здоровье, безопасность и технические примечания
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Будьте очень осторожны, чтобы не ударить штатив, когда на нем находится стакан. Подумайте о том, чтобы зажать стакан.
- При нагревании оксида меди(II) и разбавленной серной кислоты избегайте выкипания воды и появления сульфата меди, который затем разлагается при чрезмерном нагревании – это небезопасно. Газы двуокиси серы токсичны и могут вызвать затруднение дыхания.

- На заключительном (дополнительном) этапе процедуры не пытайтесь выпарить кислоту для получения кристаллов путем нагревания с помощью горелки Бунзена после фильтрации.Это действие наполнило бы лабораторию ядовитыми парами.
- Предоставьте реагенты в готовых количествах, чтобы уменьшить количество отходов и помочь в организации урока. Все контейнеры должны быть четко промаркированы.
- Оксид меди(II), CuO(s), (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC026. Порошок оксида меди(II) может поставляться в количестве примерно 1 г в маркированных пробирках для образцов или пластиковых лодочках для взвешивания.
- Разбавленная серная кислота, H 2 SO 4 (водн.), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC098a.20 см 3 разбавленной серной кислоты должны поставляться в маленьких маркированных бутылках.
- Сульфат меди(II), CuSO 4 (s), (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см.
 карточку опасности CLEAPSS HC027c.
карточку опасности CLEAPSS HC027c.
Процедура
Этап 1- Добавьте 20 см 3 0,5 М серной кислоты в стакан объемом 100 см 3 . Осторожно нагрейте на штативе с нежным голубым пламенем почти до кипения. (Будьте очень осторожны, чтобы не ударить штатив, когда на нем находится стакан.Рассмотрите возможность зажима стакана.)
- Когда кислота станет достаточно горячей (непосредственно перед тем, как она начнет кипеть), используйте шпатель, чтобы добавить в химический стакан небольшие порции оксида меди (II). Аккуратно перемешивайте смесь в течение полуминуты после каждого добавления. (При добавлении твердого вещества в стакан будьте осторожны, чтобы не ударить стакан.)
- Когда весь оксид меди(II) будет добавлен, продолжайте осторожно нагревать в течение 1–2 минут, чтобы убедиться, что реакция завершена.Затем выключите горелку Бунзена.
 Может быть целесообразно проверить (используя рН или лакмусовую бумагу), чтобы не осталось кислоты. Если кислота была недостаточно горячей, избыток кислоты может сосуществовать с оксидом меди. (Кипячение воды с образованием сульфата меди, который затем разлагается при чрезмерном нагревании, небезопасно. Газообразный диоксид серы ядовит и может вызвать затруднение дыхания.)
Может быть целесообразно проверить (используя рН или лакмусовую бумагу), чтобы не осталось кислоты. Если кислота была недостаточно горячей, избыток кислоты может сосуществовать с оксидом меди. (Кипячение воды с образованием сульфата меди, который затем разлагается при чрезмерном нагревании, небезопасно. Газообразный диоксид серы ядовит и может вызвать затруднение дыхания.) - Дайте стакану немного остыть, пока вы настраиваете этап 2.
- Поместите воронку с фильтром в горлышко конической колбы.
- Сложите фильтровальную бумагу, чтобы она подошла к воронке фильтра, и поместите ее в воронку.
- Убедитесь, что стакан достаточно остыл, чтобы его можно было держать за верхнюю часть. Содержимое должно быть еще горячим.
- Аккуратно взболтайте содержимое, чтобы перемешать, а затем вылейте на фильтровальную бумагу в воронке. Разрешить фильтровать.
- В колбе должен собраться прозрачный голубой раствор.
 Если раствор не прозрачен и в нем остался черный порошок, фильтрацию нужно будет повторить.
Если раствор не прозрачен и в нем остался черный порошок, фильтрацию нужно будет повторить.
- Промойте химический стакан и снова налейте в него прозрачный синий раствор. Напишите на стакане свое имя (имена). Оставьте стакан в теплом месте, где его никто не потревожит, примерно на неделю. Это позволит большей части воды испариться. (Не пытайтесь испарить кислоту путем нагревания горелкой Бунзена после фильтрации. Лаборатория наполнится токсичными парами.)
- Прежде чем вся вода испарится, на дне стакана должны образоваться кристаллы.Отфильтруйте раствор. Соберите кристаллы с фильтровальной бумаги на бумажное полотенце.
Учебные заметки
Практические очкиПредупреждения о безопасности на этапе 1 процедуры особенно важны для младших или неопытных учащихся.
Помните о проблемах, связанных с нагревом младшими или неопытными учащимися мензурок, установленных на штативах, и поднятием горячей стеклянной посуды с раскаленного штатива после нагревания.
Для подъема горячей мензурки хорошим решением является наличие щипцов для мензурок подходящего размера.Но во многих школах их нет. Не поддавайтесь искушению использовать обычные щипцы. Если есть сомнения в безопасности этого шага, учитель должен поднять каждую мензурку на термостойкий коврик.
Химические заметкиБольшинство оксидов металлов реагируют с разбавленными кислотами. Растворимые оксиды и гидроксиды металлов называются щелочами и реагируют с кислотами в растворе. Большинство оксидов металлов представляют собой нерастворимые твердые вещества. Реакция между нерастворимым оксидом металла и разбавленной кислотой часто протекает довольно медленно, поэтому можно наблюдать за ходом реакции по мере исчезновения твердого реагента и образования растворимого продукта.
На этапе 1 учащиеся должны уметь наблюдать за изменением цвета с бесцветного на синий одновременно с исчезновением черного пороха. Синий цвет усиливается по мере использования большего количества черного пороха.
На этапах 2 и 3 младшие школьники должны быть в состоянии использовать свой предыдущий опыт работы с синими растворами/кристаллами, чтобы распознать знакомый цвет сульфата меди. Затем это можно использовать в качестве отправной точки для обучения реакциям кислота + оксид металла → соль + вода.
Старшие школьники, уже знакомые с кислотно-щелочными реакциями, должны быть в состоянии предсказать идентичность образовавшегося соединения, используя изменение цвета в качестве подтверждения этого предсказания.
Символьное уравнение реакции:
CuO(т) + H 2 SO 4 (водн.) → CuSO 4 (водн.) + H 2 O(л)
В противном случае будет достаточно простого словесного уравнения.
Обратите внимание, что нет простого способа продемонстрировать, что вода является другим продуктом.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.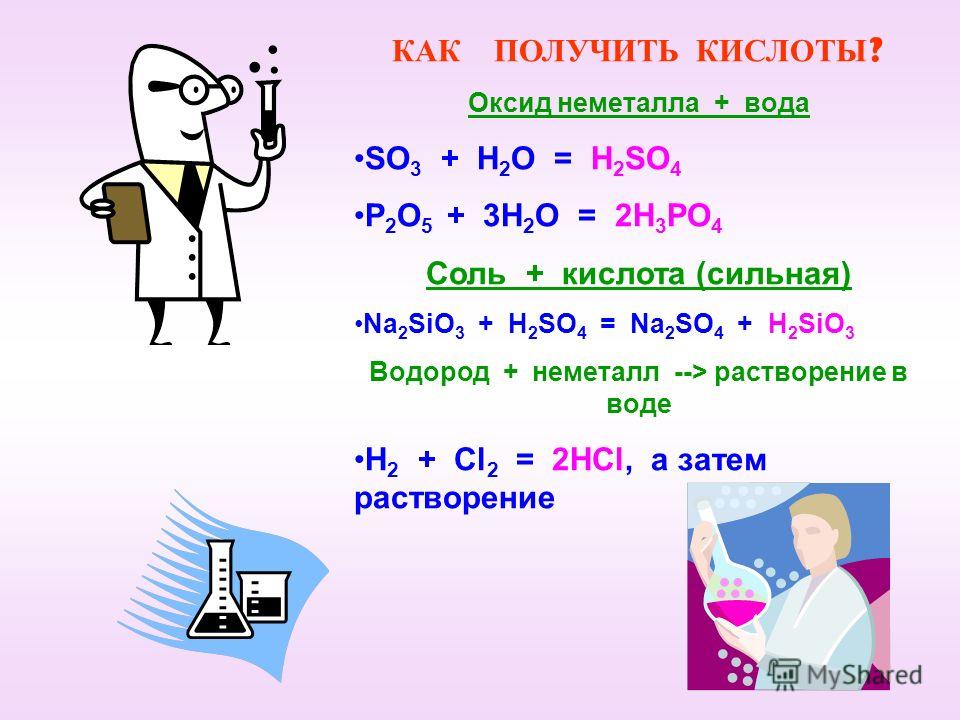 Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Почему, когда ты нарезаешь лук, ты плачешь?
« Назад на страницу «Продукты питания и питание»
Ответ
Нестабильные химикаты.
Лагерь Кирни, Калифорния. Противогаз «Анти-лук». Между 1917-1919 гг. Отдел эстампов и фотографий Библиотеки Конгресса. Лук производит химический раздражитель, известный как син-пропантиал-S-оксид. Он стимулирует слезные железы глаз, поэтому они выделяют слезы. Ученые привыкли винить в нестабильности веществ в нарезанной луковице фермент аллиназу. Однако недавние исследования в Японии доказали, что виновником является синтаза слезоточивого фактора (ранее неизвестный фермент) (Imai et al, 2002).
Процесс идет следующим образом:
- Синтаза слезоточивого фактора выбрасывается в воздух, когда мы режем лук.
- Фермент синтаза превращает сульфоксиды аминокислот лука в сульфеновую кислоту.
- Нестабильная сульфеновая кислота перегруппировывается в син-пропантиал-S-оксид.
- Syn-Propanethial-S-oxide попадает в воздух и вступает в контакт с нашими глазами. Слезные железы раздражаются и производят слезы!
Опубликовано: 19.11.2019. Последнее обновление: 15.12.2021. Автор: Справочно-научный отдел Библиотеки Конгресса
.Похожие сайты
- Готовим лук без слез Внешний (Расширение Университета Небраски-Линкольна)
- Национальная луковая ассоциация Внешний — Этот веб-сайт предоставляет информацию о луке и советы, рецепты, районы выращивания и промышленность.
 «Национальная луковая ассоциация призывает луковую промышленность Соединенных Штатов добровольно приложить все разумные усилия для обеспечения потребителей самым высококачественным, питательным и безопасным луком; и, кроме того, уделять должное внимание вопросам продовольственной безопасности, управление пестицидами и рациональное использование окружающей среды».
«Национальная луковая ассоциация призывает луковую промышленность Соединенных Штатов добровольно приложить все разумные усилия для обеспечения потребителей самым высококачественным, питательным и безопасным луком; и, кроме того, уделять должное внимание вопросам продовольственной безопасности, управление пестицидами и рациональное использование окружающей среды». - Изучение вонючей науки луковых Внешний (NPR, 2 июля 2010 г.) — Интервью с Эриком Блоком, автором (и химиком) книги «Чеснок и другие луковицы: знания и наука ».
- Лук Внешний (Техасский университет A&M) — Предоставляет все виды информации о луке, такие как советы по посадке, сорта, история и законы, а также рецепты лука.

- Почему лук заставляет вас плакать? Внешний (Расширение штата Пенсильвания)
Дополнительная литература
- Дилле, Кэролайн и Сьюзан Белсингер. Луковая книга: щедрость культуры, выращивания и кухни . Лавленд, Колорадо, Interweave Press, 1996 г. 96 стр.
- Блок, Эрик. «Химия чеснока и лука». Scientific American , т. 252, март 1985 г.: 114–119.
- Фрей, Уильям Х. Плач: тайна слез . Миннеаполис, Winston Press, 1985 г. 175 стр.
- Имай, С., и другие. «Биохимия растений: луковый фермент, от которого слезятся глаза». Nature , т. 419, 17 октября 2002 г.: 685.

- Парсонс, Расс. Как читать картошку фри и другие интригующие кулинарные науки . Бостон, Хоутон-Миффлин, 2001 г. п. 1-3.
- Роджерс, Мара Рид. Лук: прославление лука через рецепты, знания и историю . Рединг, Массачусетс, паб Addison-Wesley., 1995 год. 193 стр.
Условия поиска
границ | Воздействие оксигенированных кислот на оксид графена: источник кислородсодержащей функциональной группы
Введение
Оксид графена (GO), очень важный член семейства графенов, имеет широкий спектр применений во многих областях, таких как полевой эффект транзисторы (Jin et al., 2009), датчики (Toda et al., 2015), прозрачные проводящие пленки (Zheng et al., 2014), устройства чистой энергии (Liang et al., 2009) и др., благодаря своему богатому разнообразию и количеству функциональных групп.
Разработано множество методов синтеза ГО, которые можно разделить на восемь (Brisebois and Siaj, 2020): 1) химические (Brodie (Brodie, 1860), Staudenmaier (Staudenmaier, 1898), Hummers (Hummers and Offeman, 1958). ) метод и их вариантные формы, такие как метод Хофмана (Hofmann and König, 1937) и метод Тура (Marcano et al., 2010)), 2) электрохимический (Ambrosi, Pumera, 2016; Pei et al., 2018), 3) микробный отшелушивание графита (Zhu et al., 2013; Чжу и др., 2014; Liu et al., 2015), окислительное химическое вещество для 4) 3D-углеродных структур (Luo et al., 2009; Zhang et al., 2016) и 5) 2D-графена (Nourbakhsh et al., 2010; Zhao et al. , 2012), 6) химическое осаждение из паровой фазы (CVD) (López et al., 2009; Huang et al., 2013), 7) гидротермальные методы для углеводородов (Tang et al., 2012; Krishnan et al., 2014) и 8) методы термического разложения органического вещества, богатого углеродом (Prías-Barragán et al., 2016; Goswami et al., 2017). В настоящее время также разработаны многие другие методы получения ГО.Но в целом его обычно готовят химическими методами (Zhu et al., 2010).
) метод и их вариантные формы, такие как метод Хофмана (Hofmann and König, 1937) и метод Тура (Marcano et al., 2010)), 2) электрохимический (Ambrosi, Pumera, 2016; Pei et al., 2018), 3) микробный отшелушивание графита (Zhu et al., 2013; Чжу и др., 2014; Liu et al., 2015), окислительное химическое вещество для 4) 3D-углеродных структур (Luo et al., 2009; Zhang et al., 2016) и 5) 2D-графена (Nourbakhsh et al., 2010; Zhao et al. , 2012), 6) химическое осаждение из паровой фазы (CVD) (López et al., 2009; Huang et al., 2013), 7) гидротермальные методы для углеводородов (Tang et al., 2012; Krishnan et al., 2014) и 8) методы термического разложения органического вещества, богатого углеродом (Prías-Barragán et al., 2016; Goswami et al., 2017). В настоящее время также разработаны многие другие методы получения ГО.Но в целом его обычно готовят химическими методами (Zhu et al., 2010).
Эти методы используются для реакции графена с сильным окисляющим раствором, таким как хлорат калия (KClO 3 ) с азотной кислотой (HNO 3 ) (методы Броди и Штауденмайера), комбинация перманганата калия (KMnO 4 ) и серная кислота (H 2 SO 4 ) (метод Хаммерса) и др. , так что на поверхности и на краю графена имеется большое количество различных функциональных групп для получения ОГ.Различные методы приводят к разным структурам (Brisebois and Siaj, 2020) из-за сложности водных растворов, что обеспечивает различную эффективность и широкое применение. До сих пор структура ГО остается спорной, хотя существует множество теоретических моделей, которые могут частично объяснить ее строение, например, модель Лерфа-Клиновски (He et al., 1996; Lerf et al., 1997; He et al., 1998; Lerf et al., 1998), модель Декани (Szabó et al., 2005; Szabó et al., 2006; Gao et al., 2009) и т. д. Предыдущие исследования показали, что структура ГО тесно связана с целым рядом факторов. таких как тип и количество раствора (Димиев и др., 2012; Эйглер и др., 2013 г.; Eng et al., 2013), структурные дыры (Erickson et al., 2010), радикальная реакция (Collins et al., 2011; Димиев и др., 2012; Eigler et al., 2013; Yang et al., 2014) и др. На их основе проведено большое количество экспериментальных исследований с большим успехом в деталях по содержанию углерода и кислорода (Erickson et al.
, так что на поверхности и на краю графена имеется большое количество различных функциональных групп для получения ОГ.Различные методы приводят к разным структурам (Brisebois and Siaj, 2020) из-за сложности водных растворов, что обеспечивает различную эффективность и широкое применение. До сих пор структура ГО остается спорной, хотя существует множество теоретических моделей, которые могут частично объяснить ее строение, например, модель Лерфа-Клиновски (He et al., 1996; Lerf et al., 1997; He et al., 1998; Lerf et al., 1998), модель Декани (Szabó et al., 2005; Szabó et al., 2006; Gao et al., 2009) и т. д. Предыдущие исследования показали, что структура ГО тесно связана с целым рядом факторов. таких как тип и количество раствора (Димиев и др., 2012; Эйглер и др., 2013 г.; Eng et al., 2013), структурные дыры (Erickson et al., 2010), радикальная реакция (Collins et al., 2011; Димиев и др., 2012; Eigler et al., 2013; Yang et al., 2014) и др. На их основе проведено большое количество экспериментальных исследований с большим успехом в деталях по содержанию углерода и кислорода (Erickson et al. , 2010; Collins et al., 2011; Димиев и др., 2012). ; Eigler et al., 2013; Yang et al., 2014; Brisebois et al., 2016), типы функциональных групп (He et al., 1996; Лерф и др., 1997; Лерф и др., 1998; Collins et al., 2011), разные типы и пропорции растворов, микроскопический процесс расслоения (Zhang et al., 2009; Tang et al., 2015; Betancur et al., 2018) и др. Между тем, тот факт, что кислородные функциональные группы вводятся (Skaltsas et al., 2013; Ma et al., 2018) через топологические дефекты (Bracamonte et al., 2014) с помощью ультразвуковой обработки, а молекулы растворителя также были уточнены. Все это обеспечивает прочную основу для производства и применения GO.
, 2010; Collins et al., 2011; Димиев и др., 2012). ; Eigler et al., 2013; Yang et al., 2014; Brisebois et al., 2016), типы функциональных групп (He et al., 1996; Лерф и др., 1997; Лерф и др., 1998; Collins et al., 2011), разные типы и пропорции растворов, микроскопический процесс расслоения (Zhang et al., 2009; Tang et al., 2015; Betancur et al., 2018) и др. Между тем, тот факт, что кислородные функциональные группы вводятся (Skaltsas et al., 2013; Ma et al., 2018) через топологические дефекты (Bracamonte et al., 2014) с помощью ультразвуковой обработки, а молекулы растворителя также были уточнены. Все это обеспечивает прочную основу для производства и применения GO.
Тем не менее, технология производства GO все еще находится в стадии изучения, что играет решающую роль в крупномасштабном и стабильном производстве GO и других производных графена, таких как восстановленный оксид графена (rGO). Источник кислородсодержащих функциональных групп, особенно кислорода, является одним из наиболее важных вопросов, поскольку эти группы могут сильно влиять на структуру и свойства ГО (Johari and Shenoy, 2011; Das et al. , 2013). Обычно считается, что кислород поступает из одного компонента раствора, такого как H 2 O 2 (Yang et al., 2014) и KClO 3 (Dreyer et al., 2010), но другие исследования показали, что он также может поступать из воздуха (Skaltsas et al., 2013). В этом процессе вода может усиливать степень окисления и регулировать содержание гидроксильных и эпоксидных групп (Chen et al., 2016). Одна из гипотез состоит в том, что большая часть кислорода поступает из определенных компонентов растворителя и немного из воздуха. Однако возникает вопрос, из какого растворителя, скорее всего, поступает кислород, поскольку многие кислородсодержащие растворители, такие как KMnO 4 , KClO 3 , HNO 3 , H 2 SO 4 , и Т. Д., используются в этих методах. Кроме того, очень важным вопросом является также связь между введением функциональных групп и типом дефектов. Например, является ли дефект избирательным по функциональным группам, хотя тот факт, что эпоксидные функциональные группы могут быть введены через топологические дефекты, вызванные ультразвуковой обработкой и молекулами растворителя, был выяснен (Skaltsas et al.
, 2013). Обычно считается, что кислород поступает из одного компонента раствора, такого как H 2 O 2 (Yang et al., 2014) и KClO 3 (Dreyer et al., 2010), но другие исследования показали, что он также может поступать из воздуха (Skaltsas et al., 2013). В этом процессе вода может усиливать степень окисления и регулировать содержание гидроксильных и эпоксидных групп (Chen et al., 2016). Одна из гипотез состоит в том, что большая часть кислорода поступает из определенных компонентов растворителя и немного из воздуха. Однако возникает вопрос, из какого растворителя, скорее всего, поступает кислород, поскольку многие кислородсодержащие растворители, такие как KMnO 4 , KClO 3 , HNO 3 , H 2 SO 4 , и Т. Д., используются в этих методах. Кроме того, очень важным вопросом является также связь между введением функциональных групп и типом дефектов. Например, является ли дефект избирательным по функциональным группам, хотя тот факт, что эпоксидные функциональные группы могут быть введены через топологические дефекты, вызванные ультразвуковой обработкой и молекулами растворителя, был выяснен (Skaltsas et al. , 2013; Bracamonte et al., 2014; Ма и др., 2018). В среде раствора ультразвуковая обработка также может улучшить уровень окисления GO за счет механической силы сдвига и ударной волны, возникающей при схлопывании кавитационного пузыря (Qi et al., 2014) в процессе УЗИ. Эти вопросы имеют решающее значение для структуры и свойств GO.
, 2013; Bracamonte et al., 2014; Ма и др., 2018). В среде раствора ультразвуковая обработка также может улучшить уровень окисления GO за счет механической силы сдвига и ударной волны, возникающей при схлопывании кавитационного пузыря (Qi et al., 2014) в процессе УЗИ. Эти вопросы имеют решающее значение для структуры и свойств GO.
Решение этих проблем требует глубокого понимания взаимосвязи между графеном и этими оксигенированными растворителями. Здесь мы исследовали взаимосвязь между некоторыми кислородсодержащими кислотами (включая серную кислоту (H 2 SO 4 ), азотную кислоту (HNO 3 ), марганцовую кислоту (HMnO 4 ), хлорную кислоту (HClO 3 ). ) и их смесь кислот), присутствующих в методе Хаммерса, и недефектном и дефектном Стоун-Уэйлсе графене с использованием первых принципов.Мы рассмотрели роль не только отдельных компонентов, но и смесей компонентов, чтобы изучить вклад каждого компонента. Рассмотрим также возмущение этих компонент молекулами воды. Плотность состояний (DOS), энергия адсорбции, длина связи, перенос заряда и перекрывающаяся заселенность в основном использовались для изучения взаимосвязи между молекулами и бездефектным графеном и дефектом Стоуна-Уэйлса. Эта работа представляет собой руководство по изучению источника кислородсодержащих функциональных групп на оксиде графена.
Плотность состояний (DOS), энергия адсорбции, длина связи, перенос заряда и перекрывающаяся заселенность в основном использовались для изучения взаимосвязи между молекулами и бездефектным графеном и дефектом Стоуна-Уэйлса. Эта работа представляет собой руководство по изучению источника кислородсодержащих функциональных групп на оксиде графена.
Детали расчета
В этой работе используется Кембриджский последовательный пакет полной энергии (CASTEP) (Hohenberg and Kohn, 1964; Kohn and Sham, 1965; Vanderbilt, 1990; Clark et al., 2005), который основан на функционале плотности теория (ДПФ). Мы используем функцию Perdew-Burke-Ernzerhof (PBE), принадлежащую функции General Gradient Approximation (GGA), для описания эффекта обменной корреляции (Perdew et al., 1996). Ультрамягкий псевдопотенциал используется для описания реального потенциала электронов (Vanderbilt, 1990).Электронная схема минимизации All Bands/EDFT применяется в конвергенции самосогласованного поля (SCF) (Marzari et al. , 1997). Самосогласованная схема (Neugebauer and Scheffler, 1992) и метод Гримма (Rydberg et al., 2003; Grimme, 2011) используются для диполь-дипольных взаимодействий и коррекции DFT-D2 соответственно. Совокупность связей, основанная на работе Малликена (Mulliken, 1955), и анализ заряда, полученный из работы Хиршфельда (Hirshfeld, 1977), применяются для анализа прочности связи и направления переноса заряда соответственно.
, 1997). Самосогласованная схема (Neugebauer and Scheffler, 1992) и метод Гримма (Rydberg et al., 2003; Grimme, 2011) используются для диполь-дипольных взаимодействий и коррекции DFT-D2 соответственно. Совокупность связей, основанная на работе Малликена (Mulliken, 1955), и анализ заряда, полученный из работы Хиршфельда (Hirshfeld, 1977), применяются для анализа прочности связи и направления переноса заряда соответственно.
В этом исследовании энергия отсечки установлена на уровне 600 эВ. Вакуумное пространство 15 Å применяется, чтобы избежать эффекта периодичности по оси Z. Порог сходимости 1 × 10 –6 эВ/атом применяется в СКФ. В данной работе для расчета использовались два размера модели подложки. Для бездефектного графена в модели 32 атома, а при наличии дефекта Стоуна-Уэйлса — 50 атомов. Для расчета этих моделей применяется сетка K-точек 5 × 5 × 1. Он был увеличен до 7 × 7 × 1 при расчете DOS.Все модели оптимизированы таким образом, чтобы эти силы были меньше 0,02 эВ/Å.
Результаты и обсуждение
В этом исследовании мы создали два типа групп сравнения. Один состоял из одного компонента, а другой состоял из нескольких компонентов. Для первого он включает реакцию H 2 SO 4 , HNO 3 , HMnO 4 и HClO 3 с недефектным графеном и графеном с дефектом Стоуна-Уэйлса соответственно. Последний, с другой стороны, включает четыре типа: смесь H 2 SO 4 и HNO 3 , смесь H 2 SO 4 и HMnO 4 , смесь HNO 3 9 и HMnO 4 и всех трех.
Реакция одного компонента с графеном
Сначала мы изучили случай однокомпонентного без воды. ПЭС однокомпонентных молекул кислоты, реагирующих с недефектным и дефектом Стоуна-Уэйлса графеном, представлены на рис. ) и перекрывающаяся популяция) показаны на рисунке 3, в таблице 1.
РИСУНОК 1 . DOS однокомпонентных молекул кислоты, реагирующих с недефектным графеном в отсутствие воды. (а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет общую плотность состояний (TDOS), а нижняя — локальную плотность состояний (LDOS) OH•. В частности, имеется также LDOS MnO 3 • в нижней части (D) .
(а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет общую плотность состояний (TDOS), а нижняя — локальную плотность состояний (LDOS) OH•. В частности, имеется также LDOS MnO 3 • в нижней части (D) .
РИСУНОК 2 . DOS однокомпонентных молекул кислоты, реагирующих с графеном с дефектом Стоуна-Уэйлса в отсутствие воды. (а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет TDOS, а нижняя — LDOS OH•. В частности, имеется также LDOS MnO 3 • в нижней части (D) .
РИСУНОК 3 . Население зарядов и связей однокомпонентных молекул кислоты, реагирующих с недефектным графеном и дефектом Стоуна-Уэйлса в отсутствие воды.Тень указывает, что это значение отрицательное.
ТАБЛИЦА 1 . Реакция одного компонента на поверхности графена без воды.
Существует лишь слабая физическая адсорбция между этими молекулами и графеном без дефектов или с дефектами Стоуна-Уэйлса, как показано на рисунке 1 и в таблице 1. Величина переноса заряда между этими молекулами и графеном также невелика. Эти заряды переносятся с графена на атомы водорода молекул кислоты, следовательно, плотность состояний OH• на правой стороне энергетического уровня Ферми в некоторой степени рассеивается, особенно на 1s-орбитали атома водорода, как показано на рис. 1А. B, C и рисунки 2A, B, C.Это может быть более четко показано DOS H 2 SO 4 . Как показано на рис. 2А, молекула H 2 SO 4 содержит два OH•, один из которых находится близко к графену, а другой далеко от него. Поэтому тот, что ближе к графену, будет испытывать рассеяние энергии за счет инжекции электронов, а другой останется относительно локальным.
Поэтому тот, что ближе к графену, будет испытывать рассеяние энергии за счет инжекции электронов, а другой останется относительно локальным.
Но для HMnO 4 результаты различны, когда он взаимодействует с бездефектным графеном и графеном с дефектом Стоуна-Уэйлса.Молекула будет диссоциировать с образованием MnO 3 • и OH• при взаимодействии с недефектным графеном. В этом случае MnO 3 • и OH• объединяются вместе, образуя группу за счет сильного кулоновского взаимодействия, которое происходит между двумя атомами кислорода (заселенность связи O-O: 0,23, энергия связи: -2,9152 эВ). В то время как между HMnO 4 и дефектами Стоуна-Уэйлса такой диссоциации не произошло. Атом марганца и атом кислорода в OH• все еще связаны друг с другом относительно прочной ионной связью (заселенность связи Mn-O: 0.15). Таким образом, в случае HMnO 4 , реагирующего с недефектным графеном, существует множество энергетических уровней с сильной локализацией в ПЭС MnO 3 • и OH• вокруг уровня Ферми, особенно в диапазоне −10∼ −5 эВ, которые в основном вносятся 2p-орбиталью атома кислорода, как видно на рисунке 2D. Между тем значения энергии, соответствующие этим уровням, совпадают, что также свидетельствует о наличии сильного кулоновского взаимодействия между MnO 3 • и OH•.Кроме того, уровень справа от уровня Ферми ОН•, образованного при диссоциации, все еще имеет высокую локализацию, что свидетельствует об отпадении этой части от молекулы. В другом случае уровни вблизи уровня Ферми нелокальны, поскольку он не диссоциирует. Другими словами, вблизи уровня Ферми не существует уровней с сильной локализацией. 1s-орбиталь атома водорода справа от уровня Ферми становится размытой из-за заряда, полученного от графена, потому что связь между HMnO 4 и графеном с дефектом Стоуна-Уэйлса является сильной хемосорбцией, как видно на рисунке 2D, рисунке 3, таблице 1.Направление переноса заряда от графена к HMnO 4 . Это явление указывает на то, что дефект Стоуна-Уэйлса действительно обладает селективностью в отношении функциональных групп, поскольку предыдущие исследования показали, что он способствует введению эпоксидных групп (Bracamonte et al.
Между тем значения энергии, соответствующие этим уровням, совпадают, что также свидетельствует о наличии сильного кулоновского взаимодействия между MnO 3 • и OH•.Кроме того, уровень справа от уровня Ферми ОН•, образованного при диссоциации, все еще имеет высокую локализацию, что свидетельствует об отпадении этой части от молекулы. В другом случае уровни вблизи уровня Ферми нелокальны, поскольку он не диссоциирует. Другими словами, вблизи уровня Ферми не существует уровней с сильной локализацией. 1s-орбиталь атома водорода справа от уровня Ферми становится размытой из-за заряда, полученного от графена, потому что связь между HMnO 4 и графеном с дефектом Стоуна-Уэйлса является сильной хемосорбцией, как видно на рисунке 2D, рисунке 3, таблице 1.Направление переноса заряда от графена к HMnO 4 . Это явление указывает на то, что дефект Стоуна-Уэйлса действительно обладает селективностью в отношении функциональных групп, поскольку предыдущие исследования показали, что он способствует введению эпоксидных групп (Bracamonte et al. , 2014). Во время ультразвукового процесса ультразвук также может улучшить уровень окисления (Qi et al., 2014).
, 2014). Во время ультразвукового процесса ультразвук также может улучшить уровень окисления (Qi et al., 2014).
В приведенных выше моделях не учитываются возмущения молекул воды. Поэтому мы рассмотрели влияние молекул воды.DOS для них показаны на рисунках 4, 5. Расчетные данные показаны на рисунке 6, в таблице 2 и в таблице S2.
РИСУНОК 4 . DOS однокомпонентных молекул кислоты, реагирующих с недефектным графеном в водной среде. (а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет TDOS, а нижняя — LDOS OH•.В частности, имеется также LDOS MnO 3 • в нижней части (D) .
РИСУНОК 5 . DOS однокомпонентных молекул кислоты, реагирующих с графеном с дефектом Стоуна-Уэйлса в водной среде. (а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет TDOS, а нижняя — LDOS OH•.В частности, имеется также LDOS MnO 3 • в нижней части (D) .
(а) , (b) , (c) , (d) , и (d) , и (d) 2 it 4 , HCLO 3 , HCLO 3 и HMNO 4 соответственно. На каждой диаграмме верхняя часть представляет TDOS, а нижняя — LDOS OH•.В частности, имеется также LDOS MnO 3 • в нижней части (D) .
РИСУНОК 6 . Население зарядов и связей однокомпонентных молекул кислоты, реагирующих с недефектным графеном и графеном с дефектом Стоуна-Уэйлса в водном состоянии. Тень указывает, что это значение отрицательное.
ТАБЛИЦА 2 . Реакция одного компонента на поверхности графена с водой.
Как и в случае неводных молекул, как недефектный графен, так и графен с дефектом Стоуна-Уэйлса имеют лишь слабую физическую адсорбцию между H 2 SO 4 , HNO 3 и HClO 3 и графеном .Количество заряда, переданного от графена к молекулам, невелико, как показано на рис.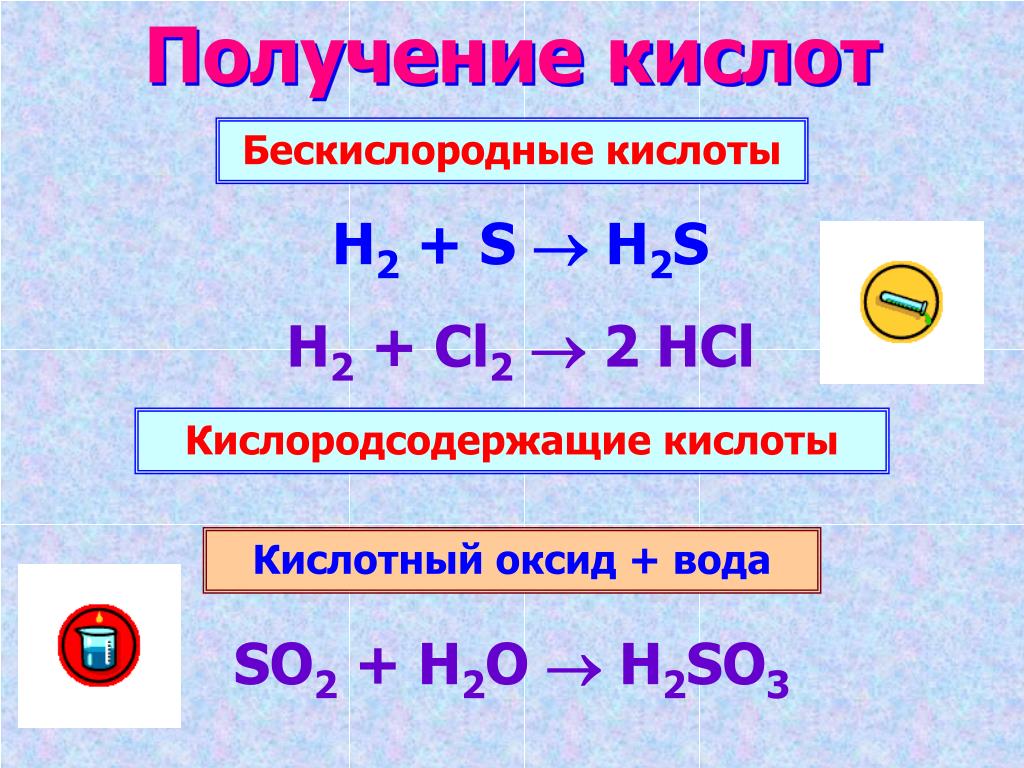 6. Они представлены состояниями состояний, при которых OH• в молекуле диффундирует в некоторой степени вправо от уровня Ферми. Это происходит в основном на 1s-орбитали атомов водорода, как видно на рисунках 4A-C и 5A-C.
6. Они представлены состояниями состояний, при которых OH• в молекуле диффундирует в некоторой степени вправо от уровня Ферми. Это происходит в основном на 1s-орбитали атомов водорода, как видно на рисунках 4A-C и 5A-C.
Диссоциация HMnO 4 противоположна диссоциации без воды. В случае молекул, содержащих воду, реакция между HMnO 4 и недефектным графеном вызывает только тенденцию к диссоциации.Среди них ОН• на молекуле вращается под большим углом к соседнему атому кислорода. Между HMnO 4 и графеном без дефектов существует только хемосорбция. Однако химическая связь между марганцем и OH• значительно ослаблена (заселенность связей Mn-O: 0,06), хотя HMnO 4 не диссоциирует, что указывает на то, что OH• имеет тенденцию отделяться от молекулы. Поэтому, как показано на рисунке 4D, некоторые сильно локализованные энергетические уровни, вносимые 2p-орбиталью атома кислорода, появляются как в MnO 3 •, так и в OH• в диапазоне −10~−5 эВ.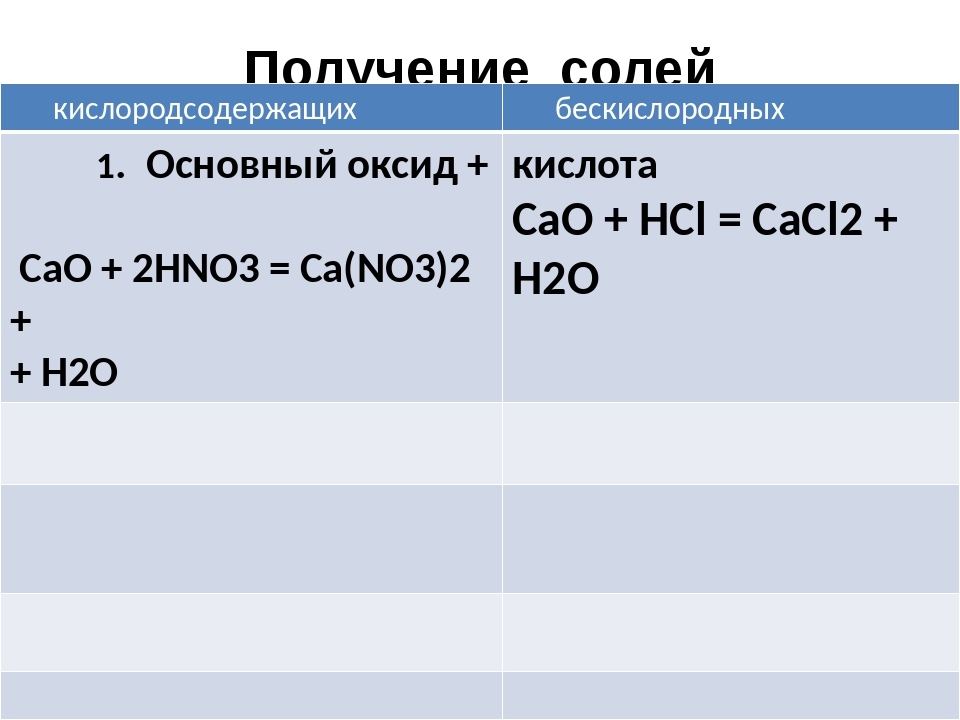 Значения энергии, соответствующие этим энергетическим уровням, совпадают, указывая на то, что между MnO 3 • и OH• все еще существует сильная связь. Напротив, HMnO 4 диссоциирует на графене с дефектом Стоуна-Уэйлса с образованием MnO 3 • и OH•. Но MnO 3 • и OH• не объединились вместе с образованием нейтральной группы за счет сильного кулоновского взаимодействия, как в случае диссоциации HMnO 4 на бездефектном графене. Эти две части относительно независимы.Следовательно, существует очень мало энергетических уровней с близкими значениями энергии вблизи уровня Ферми между MnO 3 • и OH•, как видно на рисунке 5D. Кроме того, OH• в обоих случаях становится диффузным справа от уровня Ферми из-за заряда, полученного от графена, как показано на рисунке 4D и рисунке 5D. Это явление указывает на то, что вода способствует образованию кислородсодержащих функциональных групп, как показали предыдущие исследования (Chen et al.
Значения энергии, соответствующие этим энергетическим уровням, совпадают, указывая на то, что между MnO 3 • и OH• все еще существует сильная связь. Напротив, HMnO 4 диссоциирует на графене с дефектом Стоуна-Уэйлса с образованием MnO 3 • и OH•. Но MnO 3 • и OH• не объединились вместе с образованием нейтральной группы за счет сильного кулоновского взаимодействия, как в случае диссоциации HMnO 4 на бездефектном графене. Эти две части относительно независимы.Следовательно, существует очень мало энергетических уровней с близкими значениями энергии вблизи уровня Ферми между MnO 3 • и OH•, как видно на рисунке 5D. Кроме того, OH• в обоих случаях становится диффузным справа от уровня Ферми из-за заряда, полученного от графена, как показано на рисунке 4D и рисунке 5D. Это явление указывает на то, что вода способствует образованию кислородсодержащих функциональных групп, как показали предыдущие исследования (Chen et al.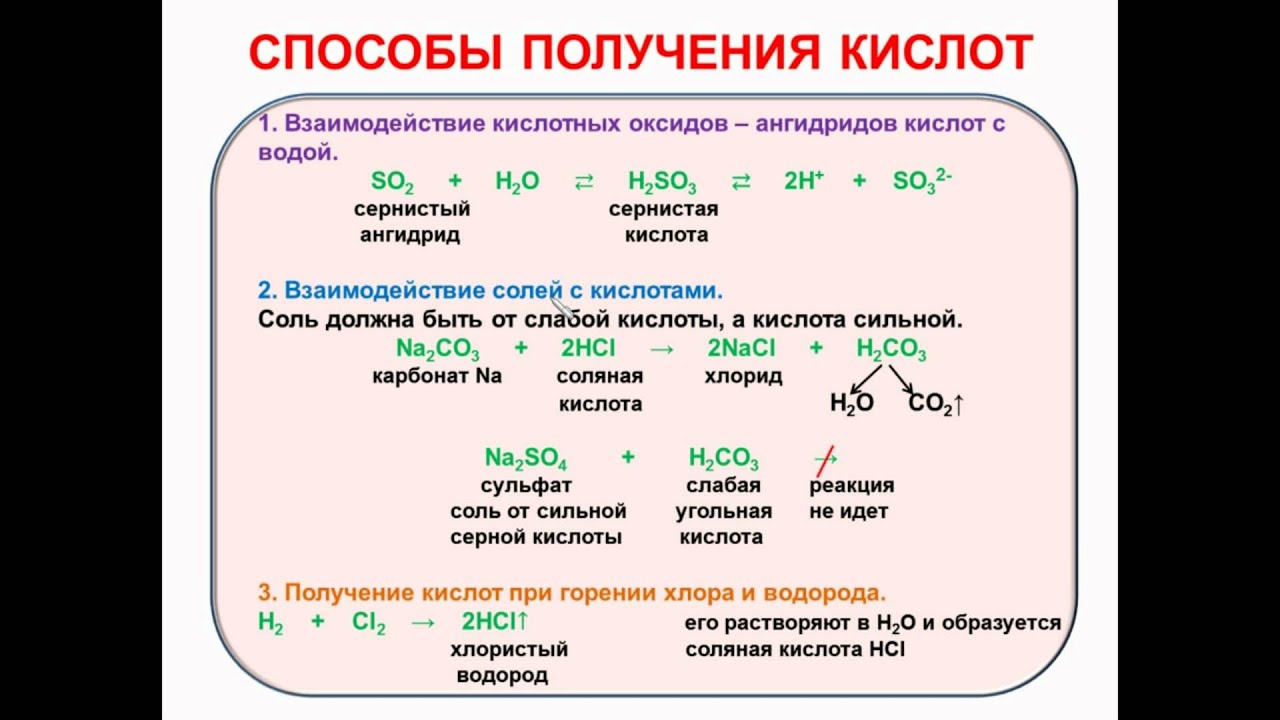 , 2016). Другими словами, сольватационный эффект способствует образованию функциональных групп.Это сильнее, чем у топологических дефектов, хотя дефекты Стоуна-Уэйлса обладают селективностью по функциональным группам.
, 2016). Другими словами, сольватационный эффект способствует образованию функциональных групп.Это сильнее, чем у топологических дефектов, хотя дефекты Стоуна-Уэйлса обладают селективностью по функциональным группам.
Реакция смешанных компонентов с графеном
При получении ГО обычно используют смесь растворителей, а не однокомпонентный реагент. Поэтому на основе Реакции одного компонента с графеном в этом разделе дополнительно изучалась реакция между молекулами смешанной кислоты и графеном. В этом разделе в основном рассчитаны реакции между H 2 SO 4 , HMnO 4 и HClO 3 и графеном с учетом типов реагентов, необходимых для приготовления GO.При расчете были созданы две контрастные группы для реакции с недефектным графеном и графеном с дефектом Стоуна-Уэйлса. Каждая из вышеперечисленных категорий включала следующие три группы: H 2 , HMNO 4 и HMNO 4 и HMNO 4 , H 4 , H 2 SO 4 и HNO 3 и HMNO 4 .
DOS из них показаны на рисунке 7. Расчетные данные показаны на рисунке 8, таблица 3.
РИСУНОК 7 .DOS молекул смешанных кислот в отсутствие воды. (a) , (b) и (c) и (c) и (c) и DOS HMNO 4 в случае HMNO 2 SO 4 и HMNO 4 , HMNO 3 и HMNO 4 и H 2 SO 4 и HNO 3 и HMnO 4 на бездефектном графене соответственно. (D) , (e) и (f) и (f) и (f) и 4 в случае hmno 4 SO 4 и HMNO 4 , HMNO 3 и HMNO 4 и H 2 SO 4 и HNO 3 и HMnO 4 на дефекте Стоуна-Уэйлса соответственно.На каждой диаграмме верхняя часть представляет TDOS, середина представляет LDOS pf MnO 3 • и нижняя часть представляет LDOS OH•.
РИСУНОК 8 . Загрузка HMnO 4 в смесь-компонент в отсутствие воды. Тень указывает, что это значение отрицательное.
ТАБЛИЦА 3 . Реакция смешанных компонентов на поверхности графена без воды.
Как и в случае отдельных компонентов, существует лишь слабая физическая адсорбция между молекулами серной и азотной кислот и графеном в смешанном состоянии, независимо от того, является ли графен идеальным или с дефектами Стоуна-Уэйлса.Молекулы H 2 SO 4 и HNO 3 не будут диссоциировать с образованием OH•, но их присутствие приведет к возникновению сольватационного эффекта. Он может способствовать диссоциации HMnO 4 с образованием MnO 3 • и OH•, как показано на рисунках 7A, B, D–F. Уникальной в этих случаях является реакция между смесью трех кислот и недефектным графеном, в которой HMnO 4 не диссоциирует. Эти явления еще раз доказывают, что эффект сольватации сильнее, чем эффект топологических дефектов, хотя последний обладает селективностью по функциональным группам.
Для того, чтобы быть ближе к экспериментальному составу препарата ГО, в приведенную выше модель были добавлены молекулы воды для дальнейшего подтверждения сделанных выше выводов. DOS для них показаны на рисунке 9. Расчетные данные показаны на рисунке 10, таблица 4.
РИСУНОК 9 . DOS молекул смешанных кислот в водном состоянии. (a) , (b) и (c) и (c) и (c) и DOS HMNO 4 в случае HMNO 2 SO 4 и HMNO 4 , HMNO 3 и HMNO 4 и H 2 SO 4 и HNO 3 и HMnO 4 на бездефектном графене соответственно. (D) , (e) и (f) и (f) и (f) и 4 в случае hmno 4 SO 4 и HMNO 4 , HMNO 3 и HMNO 4 и H 2 SO 4 и HNO 3 и HMnO 4 на дефекте Стоуна-Уэйлса соответственно. На каждой диаграмме верхняя часть представляет TDOS, середина представляет LDOS pf MnO 3 • и нижняя часть представляет LDOS OH•.
На каждой диаграмме верхняя часть представляет TDOS, середина представляет LDOS pf MnO 3 • и нижняя часть представляет LDOS OH•.
РИСУНОК 10 .Загрузка HMnO 4 в смесь-компонент в водном состоянии. Тень указывает, что это значение отрицательное.
ТАБЛИЦА 4 . Реакция смешанных компонентов на поверхности графена с водой.
В соответствии с предыдущими результатами наблюдается лишь слабая физическая адсорбция из-за сил Ван-дер-Ваальса между молекулами H 2 SO 4 и HNO 3 и графеном в условиях смешанной кислоты, независимо от идеального или Стоунового — Уэльс дефектный графен.Количество переноса заряда между этими молекулами и графеном очень мало, как видно на рисунке 10. Присутствие воды, молекул H 2 SO 4 и HNO 3 приводит к эффекту сольватации, который диссоциирует HMnO 4 на форма ОН•. Между тем, этот эффект усиливается за счет присутствия нескольких компонентов. Во всех моделях HMnO 4 диссоциирует с образованием OH•. Эти ОН• могут прикрепляться к поверхности графена и становиться источником гидроксильных групп в ОГ.Они также могут реагировать с кислородом, присутствующим в растворе или воздухе, с образованием карбоксильных групп. Они способны реагировать с другими компонентами, вызывая дальнейшую диссоциацию, а также становятся источником эпоксидных функциональных групп. Эти явления убедительно доказывают, что эффект сольватации сильнее, чем эффект топологических дефектов, хотя дефекты Стоуна-Уэйлса обладают селективностью в отношении функциональных групп. Поэтому, исходя из изложенной выше ситуации, можно считать, что источником кислородсодержащих функциональных групп на ОГ могут стать молекулы HMnO 4 , мгновенно генерируемые за счет флуктуаций энергии в среде раствора.
Во всех моделях HMnO 4 диссоциирует с образованием OH•. Эти ОН• могут прикрепляться к поверхности графена и становиться источником гидроксильных групп в ОГ.Они также могут реагировать с кислородом, присутствующим в растворе или воздухе, с образованием карбоксильных групп. Они способны реагировать с другими компонентами, вызывая дальнейшую диссоциацию, а также становятся источником эпоксидных функциональных групп. Эти явления убедительно доказывают, что эффект сольватации сильнее, чем эффект топологических дефектов, хотя дефекты Стоуна-Уэйлса обладают селективностью в отношении функциональных групп. Поэтому, исходя из изложенной выше ситуации, можно считать, что источником кислородсодержащих функциональных групп на ОГ могут стать молекулы HMnO 4 , мгновенно генерируемые за счет флуктуаций энергии в среде раствора.
Заключение
Таким образом, в среде раствора, где готовится ГО, молекулы HMnO 4 , существующие мгновенно из-за флуктуаций энергии, могут диссоциировать с образованием ОН•, а ОН• может быть источником гидроксильных групп в ГО. Они также могут реагировать с кислородом, присутствующим в растворе или воздухе, с образованием карбоксильных групп. Они способны реагировать с другими компонентами, вызывая дальнейшую диссоциацию, а также становятся источником эпоксидных функциональных групп. В этом процессе определенную роль в образовании функциональных групп играет дефект Стоуна-Уэйлса, но эта роль значительно меньше, чем роль сольватационного эффекта.В среде сложного раствора многие частицы будут взаимодействовать и влиять друг на друга. Среди них не связанные с перманганатом компоненты из графена и раствора могут постоянно передавать заряд перманганату. Смешанные компоненты могут заставить реакцию протекать в направлении диссоциации, чтобы способствовать диссоциации перманганата с образованием OH•. Эта работа представляет собой руководство для изучения источника кислородсодержащих функциональных групп на GO.
Они также могут реагировать с кислородом, присутствующим в растворе или воздухе, с образованием карбоксильных групп. Они способны реагировать с другими компонентами, вызывая дальнейшую диссоциацию, а также становятся источником эпоксидных функциональных групп. В этом процессе определенную роль в образовании функциональных групп играет дефект Стоуна-Уэйлса, но эта роль значительно меньше, чем роль сольватационного эффекта.В среде сложного раствора многие частицы будут взаимодействовать и влиять друг на друга. Среди них не связанные с перманганатом компоненты из графена и раствора могут постоянно передавать заряд перманганату. Смешанные компоненты могут заставить реакцию протекать в направлении диссоциации, чтобы способствовать диссоциации перманганата с образованием OH•. Эта работа представляет собой руководство для изучения источника кислородсодержащих функциональных групп на GO.
Заявление о доступности данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал, дальнейшие запросы можно направлять соответствующим авторам.
Вклад авторов
XZ, YX и ZL внесли вклад в разработку концепции и дизайна исследования. XZ написал первый черновик рукописи. ZL предоставила компьютерное программное обеспечение. ZL и QX обеспечили финансирование исследований. Все авторы внесли свой вклад в доработку рукописи, прочитали и одобрили представленную версию.
Финансирование
Работа выполнена при поддержке Национального фонда естественных наук Китая (№ 11972344).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций, издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Ссылки
Амбрози, А., и Пумера, М. (2016). Электрохимически расслоенный графен и оксид графена для хранения энергии и электрохимии. Хим. Евро. J. 22 (1), 153–159. doi:10.1002/chem.201503110
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бетанкур А. Ф., Орнелас-Сото Н., Гарай-Тапия А. М., Перес Ф. Р., Салазар А. и Гарсия А. Г. (2018). Общая стратегия прямого синтеза восстановленного оксида графена путем химического расслоения графита. Матер. хим. физ. 218, 51–61. doi:10.1016/j.matchemphys.2018.07.019
CrossRef Полный текст | Google Scholar
Бракамонте, М.В., Лаккони Г.И., Уррета С.Е. и Фоа Торрес Л.Е.Ф. (2014). О природе дефектов в жидкофазном расслаивающемся графене. J. Phys. хим. С 118 (28), 15455–15459. doi:10.1021/jp501930a
Полный текст CrossRef | Google Scholar
Brisebois, P.P., Kuss, C., Schougaard, S.B., Izquierdo, R., and Siaj, M. (2016). Новое понимание реакции Дильса-Альдера оксида графена. Хим. Евро. J. 22 (17), 5849–5852. doi:10.1002/chem.201504984
Хим. Евро. J. 22 (17), 5849–5852. doi:10.1002/chem.201504984
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бризбуа, П.П. и Сиаж, М. (2020). Сбор оксида графена — с 1859 по 2019 год: обзор его структуры, синтеза, свойств и расслоения. Дж. Матер. хим. С 8 (5), 1517–1547. doi:10.1039/c9tc03251g
Полный текст перекрестной ссылки | Google Scholar
Броди, Британская Колумбия (1860 г.). Sur le poids атомный графит. Энн. Чим. физ. 59, 466–472.
Google Scholar
Chen, J., Zhang, Y., Zhang, M., Yao, B., Li, Y., Huang, L., et al. (2016). Усиленное водой окисление графита до оксида графена с контролируемыми видами оксигенированных групп. Хим. науч. 7 (3), 1874–1881. doi:10.1039/c5sc03828f
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Clark, S.J., Segall, MD, Pickard, C.J., Hasnip, P.J., Probert, M.I.J., Refson, K., et al. (2005). Методы первых принципов с использованием CASTEP. Z. für Kristallographie — Кристаллическая материя. 220, 567–570. doi:10.1524/zkri.220.5.567.65075
Z. für Kristallographie — Кристаллическая материя. 220, 567–570. doi:10.1524/zkri.220.5.567.65075
CrossRef Full Text | Google Scholar
Коллинз В. Р., Левандовски В., Шмойс Э., Валиш, Дж., и Свагер, Т.М. (2011). Клайзеновская перегруппировка оксида графита: путь к ковалентно функционализированным графенам. Анжю. хим. Междунар. Эд. 50 (38), 8848–8852. doi:10.1002/anie.201101371
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дас С., Сингх С., Сингх В., Юнг Д., Даудинг Дж. М., Рейд Д. и др. (2013). Плотность насыщенных кислородом функциональных групп на оксиде графена: ее влияние на клеточную токсичность. Деталь. Часть. Сист. Характеристика 30 (2), 148–157.doi:10.1002/ppsc.201200066
Полный текст перекрестной ссылки | Google Scholar
Димиев А., Косынкин Д. В., Алемани Л. Б., Чагин П. и Тур Дж. М. (2012). Чистый оксид графита. Дж. Ам. хим. соц. 134 (5), 2815–2822. doi:10.1021/ja211531y
CrossRef Полный текст | Google Scholar
Эйглер С.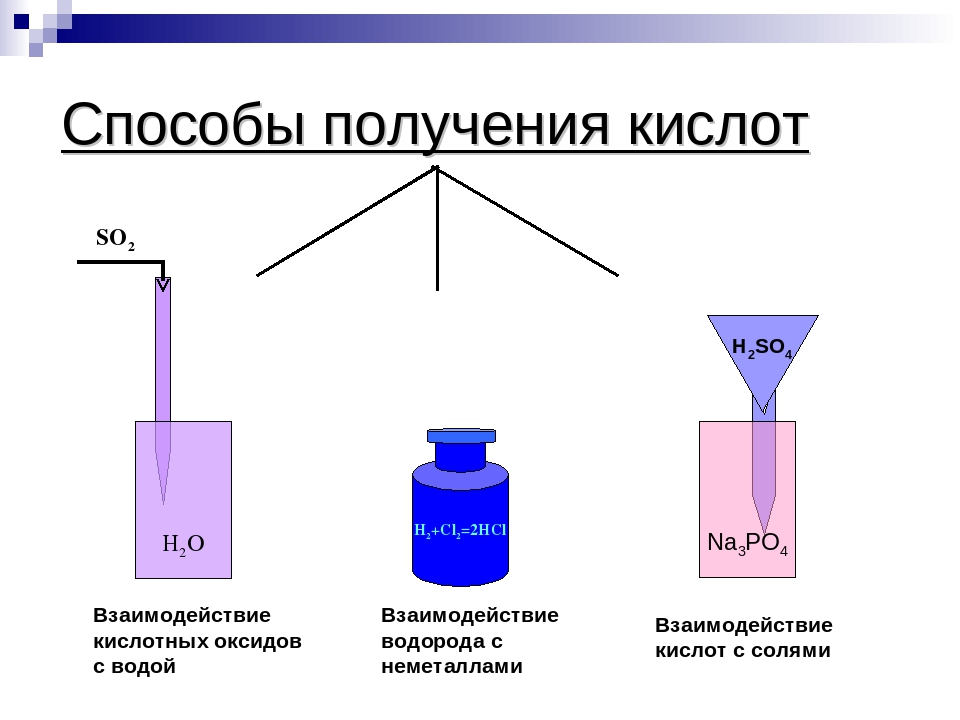 , Дотцер К., Хоф Ф., Бауэр В. и Хирш А. (2013). Формы серы в оксиде графена. Хим. Евро. J. 19 (29), 9490–9496. doi:10.1002/chem.201300387
, Дотцер К., Хоф Ф., Бауэр В. и Хирш А. (2013). Формы серы в оксиде графена. Хим. Евро. J. 19 (29), 9490–9496. doi:10.1002/chem.201300387
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
англ, А.Ю. С., Амброси А., Чуа С. К., Шанек Ф., Софер З. и Пумера М. (2013). Необычная внутренняя электрохимия оксидов графена, полученных с использованием перманганатных оксидантов. Хим. Евро. J. 19 (38), 12673–12683. doi:10.1002/chem.201301889
Полный текст CrossRef | Google Scholar
Эриксон К., Эрни Р., Ли З., Алем Н., Ганнетт В. и Зеттл А. (2010). Определение локальной химической структуры оксида графена и восстановленного оксида графена. Доп. Матер. 22 (40), 4467–4472.doi:10.1002/adma.201000732
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Госвами С., Банерджи П., Датта С., Мухопадхай А. и Дас П. (2017). Нанопластинки оксида графена, синтезированные с карбонизированной биомассой агроотходов в качестве зеленого предшественника, и его применение для очистки сточных вод, богатых красителями. Безопасность процесса. Окружающая среда. прот. 106, 163–172. doi:10.1016/j.psep.2017.01.003
Безопасность процесса. Окружающая среда. прот. 106, 163–172. doi:10.1016/j.psep.2017.01.003
Полный текст CrossRef | Google Scholar
Гримм, С.(2011). Теория функционала плотности с лондонскими дисперсионными поправками. Провода Вычисл. Мол. науч. 1 (2), 211–228. doi:10.1002/wcms.30
CrossRef Full Text | Google Scholar
Хе Х., Клиновски Дж., Форстер М. и Лерф А. (1998). Новая структурная модель оксида графита. Хим. физ. лат. 287 (1), 53–56. doi:10.1016/s0009-2614(98)00144-4
Полный текст CrossRef | Google Scholar
Хе Х., Ридл Т., Лерф А. и Клиновски Дж. (1996).Исследование структуры оксида графита методом ЯМР твердого тела. J. Phys. хим. 100 (51), 19954–19958 гг. doi:10.1021/jp961563t
Полный текст CrossRef | Google Scholar
Хиршфельд, Ф.Л. (1977). Фрагменты связанных атомов для описания плотностей молекулярных зарядов. Теор. Чим. Acta 44 (2), 129–138. doi:10.1007/bf00549096
Полный текст CrossRef | Google Scholar
Хофманн У. и Кениг Э. (1937). Untersuchungen über Graphitoxyd. З. Анорг.Allg. хим. 234 (4), 311–336. doi:10.1002/zaac.19372340405
и Кениг Э. (1937). Untersuchungen über Graphitoxyd. З. Анорг.Allg. хим. 234 (4), 311–336. doi:10.1002/zaac.19372340405
Полный текст CrossRef | Google Scholar
Хохенберг П. и Кон В. (1964). Неоднородный электронный газ. Физ. Ред. 136 (3B), B864–B871. doi:10.1103/physrev.136.b864
Полный текст CrossRef | Google Scholar
Huang, J., Larisika, M., Fam, W. H. D., He, Q., Nimmo, M. A., Nowak, C., et al. (2013). Расширенный рост хлопьев оксида графена с использованием этанола CVD. Наномасштаб 5 (7), 2945–2951.doi:10.1039/c3nr33704a
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хаммерс В.С. и Оффеман Р.Е. (1958). Получение оксида графита. Дж. Ам. хим. соц. 80 (6), 1339. doi:10.1021/ja01539a017
CrossRef Full Text | Google Scholar
Jin, M., Jeong, H.-K., Yu, WJ, Bae, D.J., Kang, B.R., and Lee, Y.H. (2009). Тонкопленочные полевые транзисторы на основе оксида графена без редукции. J. Phys. Д: заявл. физ. 42 (13), 135109.doi:10.1088/0022-3727/42/13/135109
J. Phys. Д: заявл. физ. 42 (13), 135109.doi:10.1088/0022-3727/42/13/135109
CrossRef Full Text | Google Scholar
Кон, В., и Шам, Л.Дж. (1965). Самосогласованные уравнения, включающие эффекты обмена и корреляции. Физ. Ред. 140 (4A), A1133–A1138. doi:10.1103/physrev.140.a1133
CrossRef Full Text | Google Scholar
Лерф А., Хе Х., Форстер М. и Клиновски Дж. (1998). Новый взгляд на структуру оксида графита. J. Phys. хим. В 102 (23), 4477–4482. doi:10.1021/jp9731821
Полный текст CrossRef | Google Scholar
Лерф А., He, H., Riedl, T., Forster, M., и Klinowski, J. (1997). 13C и 1H MAS ЯМР исследования оксида графита и его химически модифицированных производных. Ионика твердого тела 101-103, 857–862. doi:10.1016/s0167-2738(97)00319-6
Полный текст CrossRef | Google Scholar
Лян М., Луо Б. и Чжи Л. (2009). Применение графена и материалов на основе графена в устройствах, связанных с экологически чистой энергией. Междунар. Дж. Энерг. Рез. 33 (13), 1161–1170. doi:10.1002/er.1598
Междунар. Дж. Энерг. Рез. 33 (13), 1161–1170. doi:10.1002/er.1598
Полный текст CrossRef | Google Scholar
Лю, Л., Zhu, C., Fan, M., Chen, C., Huang, Y., Hao, Q., et al. (2015). Окисление и разложение графитовых материалов бактериями, разлагающими нафталин. Наноразмерный 7 (32), 13619–13628. doi:10.1039/c5nr02502h
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лопес В., Сундарам Р. С., Гомес-Наварро К., Олеа Д., Бургхард М., Гомес-Эрреро Дж. и др. (2009). Восстановление оксида графена химическим осаждением из паровой фазы: путь к высокопроводящим монослоям графена. Доп. Матер. 21 (46), 4683–4686. doi:10.1002/adma.200
2
Полный текст CrossRef | Google Scholar
Луо З., Лу Ю., Сомерс Л. А. и Джонсон А. Т. С. (2009). Высокопроизводительная подготовка макроскопических мембран из оксида графена. Дж. Ам. хим. соц. 131 (3), 898–899. doi:10.1021/ja807934n
CrossRef Полный текст | Google Scholar
Ма, Х. , Шен, З., и Бен, С. (2018). Понимание расслоения и дисперсии нанолистов MoS2 в чистой воде. J. Colloid Interf. науч. 517, 204–212. doi:10.1016/j.jcis.2017.11.013
, Шен, З., и Бен, С. (2018). Понимание расслоения и дисперсии нанолистов MoS2 в чистой воде. J. Colloid Interf. науч. 517, 204–212. doi:10.1016/j.jcis.2017.11.013
Полный текст CrossRef | Google Scholar
Маркано Д. К., Косынкин Д. В., Берлин Дж. М., Синицкий А., Сун З., Слесарев А. и др. (2010). Улучшенный синтез оксида графена. ACS Nano 4 (8), 4806–4814. doi:10.1021/nn1006368
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Марзари, Н., Вандербильт, Д., и Пейн, М. К. (1997). Ансамблевая теория функционала плотности для начальной молекулярной динамики металлов и диэлектриков с конечной температурой. Физ. Преподобный Летт. 79 (7), 1337–1340. doi:10.1103/physrevlett.79.1337
Полный текст CrossRef | Google Scholar
Малликен, Р. С. (1955). Электронный анализ населенностей на молекулярных волновых функциях LCAO-MO. II. Перекрывающиеся популяции, порядки облигаций и энергии ковалентных связей. J. Chem. физ. 23 (10), 1841–1846. doi:10.1063/1.1740589
Chem. физ. 23 (10), 1841–1846. doi:10.1063/1.1740589
Полный текст CrossRef | Google Scholar
Нойгебауэр, Дж., и Шеффлер, М. (1992). Адсорбат-подложка и адсорбат-адсорбатные взаимодействия адслоев Na и K на Al(111). Физ. Ред. B 46 (24), 16067–16080. doi:10.1103/physrevb.46.16067
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нурбахш А., Канторо М., Вош Т., Пуртуа Г., Клементе Ф., ван дер Вин М. Х. и др. (2010). Открытие запрещенной зоны в графене, обработанном кислородной плазмой. Нанотехнологии 21 (43), 435203. doi:10.1088/0957-4484/21/43/435203
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пей, С., Вэй, К., Хуанг, К., Ченг, Х.-М., и Рен, В. (2018). Зеленый синтез оксида графена путем электролитического окисления воды в масштабе секунд. Нац. коммун. 9 (1), 145. doi:10.1038/s41467-017-02479-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Приас-Барраган Дж. Дж., Гросс К., Ариса-Кальдерон Х. и Прието П. (2016). Синтез и вибрационный отклик пластинок оксида графита из бамбука для электронных приложений. Физ. Status Solidi A. 213 (1), 85–90.doi:10.1002/pssa.201532433
Дж., Гросс К., Ариса-Кальдерон Х. и Прието П. (2016). Синтез и вибрационный отклик пластинок оксида графита из бамбука для электронных приложений. Физ. Status Solidi A. 213 (1), 85–90.doi:10.1002/pssa.201532433
Полный текст CrossRef | Google Scholar
Qi, X., Zhou, T., Deng, S., Zong, G., Yao, X. и Fu, Q. (2014). Листы оксида графена заданного размера: подготовка и характеристика с помощью ультразвука. Дж. Матер. науч. 49 (4), 1785–1793. doi:10.1007/s10853-013-7866-8
Полный текст CrossRef | Google Scholar
Ридберг Х., Дион М., Якобсон Н., Шредер Э., Хильдгаард П., Саймак С. И. и др. (2003). Функционал плотности Ван-дер-Ваальса для слоистых структур. Физ. Преподобный Летт. 91 (12), 126402. doi:10.1103/physrevlett.91.126402
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Скалцас Т., Ке X., Биттенкур К. и Тагматархис Н. (2013). Ультразвук индуцирует насыщенные кислородом частицы и дефекты на расслоенном графене. J. Phys. хим. С 117 (44), 23272–23278. doi:10.1021/jp4057048
J. Phys. хим. С 117 (44), 23272–23278. doi:10.1021/jp4057048
Полный текст CrossRef | Google Scholar
Штауденмайер, Л. (1898 г.). Verfahren zur Darstellung der Graphitsäure. Бер. Дтч. хим. Гэс. 31 (2), 1481–1487. doi:10.1002/cber.18980310237
Полный текст CrossRef | Google Scholar
Сабо Т., Беркези О. и Декани И. (2005). Исследование DRIFT оксида графита, замещенного дейтерием. Углерод 43 (15), 3186–3189. doi:10.1016/j.carbon.2005.07.013
CrossRef Полный текст | Google Scholar
Сабо Т., Беркеси О., Форго П., Йозеповиц К., Санакис Ю., Петридис Д. и др. (2006). Эволюция поверхностных функциональных групп в ряду прогрессивно окисленных оксидов графита. Хим. Матер. 18 (11), 2740–2749. doi:10.1021/cm060258+
Полный текст CrossRef | Google Scholar
Тан Х., Лю Д., Чжао Ю., Ян X., Лу Дж. и Цуй Ф. (2015). Молекулярно-динамическое исследование процесса агрегации оксида графена в воде. J. Phys. хим. С 119 (47), 26712–26718. doi:10.1021/acs.jpcc.5b07345
Phys. хим. С 119 (47), 26712–26718. doi:10.1021/acs.jpcc.5b07345
Полный текст CrossRef | Google Scholar
Тан Л., Ли Х., Цзи Р., Тенг К. С., Тай Г., Йе Дж. и др. (2012). Восходящий синтез крупномасштабных нанолистов оксида графена. Дж. Матер. хим. 22 (12), 5676–5683. doi:10.1039/c2jm15944a
Полный текст CrossRef | Google Scholar
Тода К., Фуруэ Р. и Хаями С. (2015). Недавний прогресс в применении оксида графена для обнаружения газов: обзор. Аналитика хим. Acta 878, 43–53. doi:10.1016/j.aca.2015.02.002
Полный текст CrossRef | Google Scholar
Ян Л., Чжан Р., Лю Б., Ван Дж., Ван С., Хань М.-Ю. и др. (2014). π-сопряженные углеродные радикалы на оксиде графена для инициирования сверхсильной хемилюминесценции. Анжю. хим. Междунар. Эд. 53 (38), 10109–10113. doi:10.1002/anie.201405295
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжан Л., Лян Дж., Хуанг Ю., Ма Ю., Ван Ю. и Чен Ю. (2009). Синтез листов оксида графена с контролируемым размером в больших масштабах с использованием химического отшелушивания. Углерод 47 (14), 3365–3368. doi:10.1016/j.carbon.2009.07.045
и Чен Ю. (2009). Синтез листов оксида графена с контролируемым размером в больших масштабах с использованием химического отшелушивания. Углерод 47 (14), 3365–3368. doi:10.1016/j.carbon.2009.07.045
CrossRef Полный текст | Google Scholar
Чжан М., Окадзаки Т., Иидзуми Ю., Miyako, E., Yuge, R., Bandow, S., et al. (2016). Получение листов оксида графена малого размера и их биологическое применение. Дж. Матер. хим. Б 4 (1), 121–127. doi:10.1039/c5tb01800e
Полный текст CrossRef | Google Scholar
Чжэн, К., Ли, З., Ян, Дж., и Ким, Дж.-К. (2014). Прозрачные проводящие пленки на основе оксида графена. Прог. Матер. науч. 64, 200–247. doi:10.1016/j.pmatsci.2014.03.004
Полный текст CrossRef | Google Scholar
Чжу, К., Хао, К., Хуанг, Ю., Ян, Дж., и Сунь, Д. (2013). Микробное окисление дисперсного графита нитрифицирующими бактериями 2011.2. Наношкала 5 (19), 8982–8985. doi:10.1039/c3nr02069j
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhu, C. , Liu, L., Fan, M., Liu, L., Dai, B., Yang, J., et al. (2014). Микробное окисление графита Acidithiobacillus Ferrooxidans CFMI-1. RSC Adv. 4 (98), 55044–55047. doi:10.1039/c4ra09827g
, Liu, L., Fan, M., Liu, L., Dai, B., Yang, J., et al. (2014). Микробное окисление графита Acidithiobacillus Ferrooxidans CFMI-1. RSC Adv. 4 (98), 55044–55047. doi:10.1039/c4ra09827g
Полный текст CrossRef | Google Scholar
Чжу Ю., Murali, S., Cai, W., Li, X., Suk, J.W., Potts, J.R., et al. (2010). Графен и оксид графена: синтез, свойства и применение. Доп. Матер. 22 (35), 3906–3924. doi:10.1002/adma.201001068
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Факты и информация о кислотных дождях
Кислотными дождями называется любая форма осадков, содержащих большое количество азотной и серной кислот. Это также может происходить в виде снега, тумана и крошечных кусочков сухого материала, которые оседают на Землю.Обычный дождь слегка кислый, с pH 5,6, в то время как кислотный дождь обычно имеет pH от 4,2 до 4,4.
Причины кислотных дождей Гниющая растительность и извергающиеся вулканы выделяют некоторые химические вещества, которые могут вызывать кислотные дожди, но большая часть кислотных дождей является результатом деятельности человека. Крупнейшими источниками являются угольные электростанции, фабрики и автомобили.
Крупнейшими источниками являются угольные электростанции, фабрики и автомобили.
Когда люди сжигают ископаемое топливо, в атмосферу выбрасываются диоксид серы (SO 2 ) и оксиды азота (NO x ).Эти загрязнители воздуха реагируют с водой, кислородом и другими веществами с образованием переносимой по воздуху серной и азотной кислоты. Ветры могут распространять эти кислотные соединения по атмосфере на сотни миль. Когда кислотные дожди достигают Земли, они стекают по поверхности со стоковыми водами, попадают в водные системы и оседают в почве.
Виртуальное кладбище ели обыкновенной в Польше покрыто следами кислотных дождей. Кислотные дожди, вызванные тем, что капли дождя поглощают загрязнения воздуха, такие как оксиды серы и азота, ослабляют деревья, растворяя питательные вещества в почве до того, как растения смогут их использовать.
Фотография Дэвида Вудфолла/Getty Images Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Двуокись серы и оксиды азота не являются основными парниковыми газами, которые способствуют глобальному потеплению, одному из основных последствий изменения климата; на самом деле диоксид серы оказывает охлаждающее действие на атмосферу. Но оксиды азота способствуют образованию приземного озона, основного загрязнителя, который может быть вредным для людей.Оба газа вызывают проблемы с окружающей средой и здоровьем, потому что они могут легко распространяться через загрязнение воздуха и кислотные дожди.
Кислотные дожди имеют множество экологических последствий, особенно для озер, ручьев, болот и других водных сред. Кислотные дожди делают такие воды более кислыми, что приводит к большему поглощению алюминия из почвы, который переносится в озера и ручьи. Эта комбинация делает воду токсичной для раков, моллюсков, рыб и других водных животных. (Узнайте больше о последствиях загрязнения воды.)
Некоторые виды лучше переносят кислую воду, чем другие. Однако во взаимосвязанной экосистеме то, что влияет на некоторые виды, в конечном итоге влияет на многие другие виды по всей пищевой цепи, включая неводные виды, такие как птицы.
Однако во взаимосвязанной экосистеме то, что влияет на некоторые виды, в конечном итоге влияет на многие другие виды по всей пищевой цепи, включая неводные виды, такие как птицы.
Кислотные дожди и туман также наносят ущерб лесам, особенно высокогорным. Кислотные отложения лишают почву необходимых питательных веществ, таких как кальций, и вызывают выброс алюминия в почву, из-за чего деревьям трудно поглощать воду. Листья и хвоя деревьев также повреждаются кислотами.
Последствия кислотных дождей в сочетании с другими факторами стресса окружающей среды делают деревья и растения менее здоровыми, более уязвимыми к низким температурам, насекомым и болезням. Загрязняющие вещества могут также подавлять способность деревьев к размножению. Некоторые почвы способны лучше нейтрализовать кислоты, чем другие. Но в районах, где «буферная способность» почвы низка, например, в некоторых частях северо-востока США, вредное воздействие кислотных дождей гораздо сильнее.
Что такое загрязнение воздуха? Узнайте, как парниковые газы, смог и токсичные загрязнители влияют на изменение климата, а также на здоровье человека.
Кислотные отложения повреждают физические конструкции, такие как здания из известняка и автомобили. А когда они принимают форму вдыхаемого тумана, кислотные осадки могут вызвать проблемы со здоровьем, включая раздражение глаз и астму.
Что можно сделать?Единственный способ борьбы с кислотными дождями — ограничение выбросов загрязняющих веществ, которые их вызывают. Это означает сжигание меньшего количества ископаемого топлива и установление стандартов качества воздуха.
В США Закон о чистом воздухе 1990 года был нацелен на кислотные дожди, установив ограничения на загрязнение, которые помогли сократить выбросы двуокиси серы на 88 процентов в период с 1990 по 2017 год.Стандарты качества воздуха также привели к снижению выбросов диоксида азота в США на 50 процентов за тот же период времени. Эти тенденции помогли, например, лесам из красной ели в Новой Англии и некоторым популяциям рыб восстановиться после повреждений, нанесенных кислотными дождями. Но восстановление требует времени, и почвы на северо-востоке США и востоке Канады лишь недавно продемонстрировали признаки стабилизации питательных веществ.
Но восстановление требует времени, и почвы на северо-востоке США и востоке Канады лишь недавно продемонстрировали признаки стабилизации питательных веществ.
Проблема кислотных дождей будет сохраняться до тех пор, пока будет использоваться ископаемое топливо, и такие страны, как Китай, которые в значительной степени зависят от угля для производства электроэнергии и стали, борются с этими последствиями.Одно исследование показало, что кислотные дожди в Китае, возможно, даже способствовали смертельному оползню 2009 года. Китай осуществляет контроль за выбросами двуокиси серы, которые с 2007 года сократились на 75 процентов, а в Индии они увеличились вдвое.
Вопрос № 9720b | Socratic
Оксид свинца(II, IV) , #»Pb»_3″O»_4#, обычно называемый суриком , на самом деле представляет собой смесь двух оксидов свинца, оксид свинца(II) , #» PbO»# и оксид свинца(IV) , #»PbO»_2#.
Это означает, что в химических реакциях можно обращаться с суриком как со смесью этих двух оксидов. Точнее у вас
Точнее у вас
#»Pb»_3″O»_4 <=> 2″PbO» * «PbO»_2#
Теперь самое интересное. Оба этих оксида реагируют с концентрированной соляной кислотой с образованием водного раствора хлорида свинца(II) , #»PbCl»_2# и воды.
Однако разница между двумя оксидами свинца заключается в том, что оксид свинца (IV) также окисляет соляную кислоту до газообразного хлора #»Cl»_2#.
Таким образом, можно сказать, что
#2stackrel(цвет(синий)(+2))(«Pb»)»O»_text((s]) + 4″H»stackrel(цвет(синий)(-1))(«Cl»)_text( (aq]) -> 2stackrel(цвет(синий)(+2))(«Pb»)stackrel(цвет(синий)(-1))(«Cl»)_text(2(aq]) + 2″H» _2″O»_text((l])#
Это не а окислительно-восстановительная реакция .Здесь вы начинаете со свинца в степени окисления #color(blue)(+2)# и хлора в степени окисления #color(blue)(-1)# и заканчиваете теми же степенями окисления для обоих элементов.
Вторая реакция будет окислительно-восстановительной.
#stackrel(цвет(синий)(+4))(«Pb»)»O»_text(2(s]) + 4″H»stackrel(цвет(синий)(-1))(«Cl»)_text ((aq]) -> stackrel(color(blue)(+2))(«Pb»)»Cl»_text(2(aq]) + 2″H»_2″O»_text((l]) + stackrel (цвет(синий)(0))(«Cl»)_text(2(g])##uarr#
Катионы свинца(IV) восстанавливаются до катионов свинца(II), а соляная кислота окисляется до газообразного хлора.(цвет(синий)(«Pb»_3″O»_4)) + 8″HCl»_text((водный раствор]) -> 3″PbCl»_text(2(водный раствор]) + 4″H»_2″O»_text ((l]) + «Cl»_text(2(g])##uarr#
Теперь, когда сурик реагирует с азотной кислотой , #»HNO»_3#, вы не получаете две отдельные реакции, потому что оксид свинца (IV) будет реагировать с кислотой , а не .
В этом случае только оксид свинца(II) будет реагировать с азотной кислотой с образованием водного нитрата свинца(II) , #»Pb»(«NO»_3)_2#. Оксид свинца (IV0) останется непрореагировавшим , поэтому вы найдете его на стороне продуктов этой реакции
Оксид свинца (IV0) останется непрореагировавшим , поэтому вы найдете его на стороне продуктов этой реакции
На самом деле здесь происходит
#2″PbO»_text((s]) + 4″HNO»_text(3(водн.]) -> 2″Pb»(«NO»_3)_text(2(водн.]) + 2″H»_2» O»_text((l])#
Это классическая реакция двойного замещения , в которой катионы водорода меняются местами с катионами свинца(II).(цвет(красный)(«из Pb»_3″O»_4)) + 2″H»_2″O»_text((l])#
Пикосульфат натрия, оксид магния и безводная лимонная кислота: информация о препаратах MedlinePlus (Clenpiq
® ) принимать внутрь. Обычно его принимают в виде двух доз при подготовке к колоноскопии. Первую дозу обычно принимают за ночь до колоноскопии, а вторую — утром перед процедурой.Лекарство также можно принимать в виде двух доз за день до колоноскопии, причем первую дозу принимают во второй половине дня или ранним вечером перед колоноскопией, а вторую дозу принимают через 6 часов. Ваш врач скажет вам, когда именно вам следует принимать лекарство. Внимательно следуйте указаниям на этикетке с рецептом и попросите своего врача или фармацевта объяснить любую часть, которую вы не понимаете. Принимайте комбинацию пикосульфата натрия, оксида магния и безводной лимонной кислоты точно по назначению.Не принимайте больше или меньше и не принимайте чаще, чем предписано врачом.
Ваш врач скажет вам, когда именно вам следует принимать лекарство. Внимательно следуйте указаниям на этикетке с рецептом и попросите своего врача или фармацевта объяснить любую часть, которую вы не понимаете. Принимайте комбинацию пикосульфата натрия, оксида магния и безводной лимонной кислоты точно по назначению.Не принимайте больше или меньше и не принимайте чаще, чем предписано врачом.Во время подготовки к колоноскопии запрещается есть твердую пищу и пить молоко за день до процедуры. В это время у вас должны быть только прозрачные жидкости. Примерами прозрачных жидкостей являются вода, фруктовый сок светлого цвета без мякоти, прозрачный бульон, кофе или чай без молока, ароматизированный желатин, фруктовое мороженое и безалкогольные напитки. Не пейте алкогольные напитки или любую жидкость красного или фиолетового цвета.Спросите своего врача, если у вас есть какие-либо вопросы о том, какие жидкости вы можете пить перед колоноскопией.
Если вы принимаете порошок (Препопик ® ), вам нужно смешать лекарственный порошок с холодной водой непосредственно перед приемом. Если вы проглотите порошок, не смешивая его с водой, больше шансов, что вы испытаете неприятные или опасные побочные эффекты. Чтобы приготовить каждую дозу лекарства, наполните мерный стаканчик, в который было вложено лекарство, холодной водой до нижней отметки (5 унций, 150 мл), отмеченной на стаканчике.Влейте содержимое одного пакета пикосульфата натрия, оксида магния и порошка безводной лимонной кислоты и перемешайте в течение 2–3 минут, чтобы порошок растворился. Смесь может стать слегка теплой по мере растворения порошка. Выпейте всю смесь сразу. Смешивайте лекарство с водой только тогда, когда вы готовы его принять; не готовьте смесь заранее.
Если вы проглотите порошок, не смешивая его с водой, больше шансов, что вы испытаете неприятные или опасные побочные эффекты. Чтобы приготовить каждую дозу лекарства, наполните мерный стаканчик, в который было вложено лекарство, холодной водой до нижней отметки (5 унций, 150 мл), отмеченной на стаканчике.Влейте содержимое одного пакета пикосульфата натрия, оксида магния и порошка безводной лимонной кислоты и перемешайте в течение 2–3 минут, чтобы порошок растворился. Смесь может стать слегка теплой по мере растворения порошка. Выпейте всю смесь сразу. Смешивайте лекарство с водой только тогда, когда вы готовы его принять; не готовьте смесь заранее.
Если вы принимаете раствор (Clenpiq ® ), выпейте все содержимое одной бутылки раствора пикосульфата натрия, оксида магния и безводной лимонной кислоты непосредственно из бутылки для каждой дозы, которую вы должны принять.Пикосульфат натрия, оксид магния и раствор безводной лимонной кислоты готовы к употреблению и не должны смешиваться с жидкостью перед использованием.
Если вы принимаете лекарство накануне вечером и утром перед колоноскопией, вы должны принять первую дозу между 17:00 и 21:00. в ночь перед колоноскопией. После того, как вы примете эту дозу, вам нужно будет выпить пять порций 8 унций (240 мл) прозрачной жидкости в течение следующих 5 часов перед сном. Вы примете вторую дозу на следующее утро, примерно за 5 часов до запланированной колоноскопии.После того, как вы примете вторую дозу, вам нужно будет выпить три порции прозрачной жидкости по 8 унций в течение следующих 5 часов, но вы должны выпить все напитки по крайней мере за 2 часа до колоноскопии.
Если вы принимаете обе дозы препарата за день до колоноскопии, первую дозу вы примете между 16:00 и 18:00. вечером перед колоноскопией. После того, как вы примете эту дозу, вам нужно будет выпить пять порций 8 унций прозрачной жидкости в течение 5 часов. Вы примете следующую дозу через 6 часов, между 22:00.м. до 00:00. После того, как вы примете вторую дозу, вам нужно будет выпить три порции прозрачной жидкости по 8 унций в течение 5 часов.
Очень важно, чтобы во время лечения вы выпивали необходимое количество прозрачной жидкости, чтобы восполнить потерю жидкости при опорожнении толстой кишки. Вы можете использовать мерный стаканчик, прилагаемый к вашему лекарству, для измерения порции жидкости объемом 8 унций, наполнив стаканчик до верхней отметки. Возможно, вам будет легче выпить все количество жидкости, если вы выберете различные прозрачные жидкие напитки.
Во время лечения комбинацией пикосульфата натрия, оксида магния и безводной лимонной кислоты у вас будет частое опорожнение кишечника. Обязательно оставайтесь рядом с туалетом с момента приема первой дозы лекарства до момента назначения колоноскопии. Спросите своего врача о других вещах, которые вы можете сделать, чтобы чувствовать себя комфортно в это время.
Если вы испытываете сильное вздутие живота или боль в животе после приема первой дозы этого лекарства, подождите, пока эти симптомы не исчезнут, прежде чем принимать вторую дозу.
Ваш врач или фармацевт предоставит вам информационный лист производителя (Руководство по лекарствам), когда вы начнете лечение пикосульфатом натрия, оксидом магния и безводной лимонной кислотой.
 H2SO4) реагируют с металлами по-другому.
H2SO4) реагируют с металлами по-другому. При этом анион Cl— окисляется до свободного хлора:
При этом анион Cl— окисляется до свободного хлора:
 Важен диаметр воронки фильтра — слишком большая воронка делает фильтрующую установку нестабильной.
Важен диаметр воронки фильтра — слишком большая воронка делает фильтрующую установку нестабильной.
 карточку опасности CLEAPSS HC027c.
карточку опасности CLEAPSS HC027c. Может быть целесообразно проверить (используя рН или лакмусовую бумагу), чтобы не осталось кислоты. Если кислота была недостаточно горячей, избыток кислоты может сосуществовать с оксидом меди. (Кипячение воды с образованием сульфата меди, который затем разлагается при чрезмерном нагревании, небезопасно. Газообразный диоксид серы ядовит и может вызвать затруднение дыхания.)
Может быть целесообразно проверить (используя рН или лакмусовую бумагу), чтобы не осталось кислоты. Если кислота была недостаточно горячей, избыток кислоты может сосуществовать с оксидом меди. (Кипячение воды с образованием сульфата меди, который затем разлагается при чрезмерном нагревании, небезопасно. Газообразный диоксид серы ядовит и может вызвать затруднение дыхания.) Если раствор не прозрачен и в нем остался черный порошок, фильтрацию нужно будет повторить.
Если раствор не прозрачен и в нем остался черный порошок, фильтрацию нужно будет повторить.
 «Национальная луковая ассоциация призывает луковую промышленность Соединенных Штатов добровольно приложить все разумные усилия для обеспечения потребителей самым высококачественным, питательным и безопасным луком; и, кроме того, уделять должное внимание вопросам продовольственной безопасности, управление пестицидами и рациональное использование окружающей среды».
«Национальная луковая ассоциация призывает луковую промышленность Соединенных Штатов добровольно приложить все разумные усилия для обеспечения потребителей самым высококачественным, питательным и безопасным луком; и, кроме того, уделять должное внимание вопросам продовольственной безопасности, управление пестицидами и рациональное использование окружающей среды».
