Метод электронного баланса
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась — составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Применение метода электронного баланса по шагам. Пример «а»
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.Ag0 + H+1N+5O-23 → Ag+1N+5O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют)
Ag0 — 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Пример «б»
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 — 2e = Ca+2 (коэффициент 4)
S+6 + 8e = S-2
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример «в»
Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. вышеДля Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 — 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
profmeter.com.ua
Метод электронного баланса — это… Что такое Метод электронного баланса?
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР.Для правильного уравнивания следует придерживаться определённой последовательности действий:
- Найти окислитель и восстановитель.
- Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
- Уравнять число отданных и принятых электронов в полуреакциях.
- Просуммировать порознь левые и правые части полуреакций.
- Расставить коэффициенты в уравнении окислительно восстановительной реакции.
Теперь рассмотрим конкретный пример
Дана реакция: Li + N2 = Li3N
1. Находим окислитель и восстановитель:
Li0 + N20 = Li3+1N−3
N присоединяет электроны, он-окислитель
Li отдаёт электроны, он-восстановитель
2. Составляем полуреакции:
Li0 — 1e = Li+1
N20 + 6e = 2N −3
3. Теперь уравняем число отданных и принятых электронов в полуреакции:
6* |Li0 — 1e = Li+1
1* |N20 + 6e = 2N−3
Получаем:
6Li0 — 6e = 6Li+1
N20 + 6e = 2N−3
4. Просуммируем порознь левые и правые части полуреакций:
6Li + N2 = 6Li+1 + 2N−3
5. Расставим коэффициенты в окислительно-восстановительной реакции:
6Li + N2 = 2Li3N
Рассмотрим более сложный пример
Дана реакция: FeS + O2 = Fe2O3 + SO2
В результате реакции происходит окисление атомов железа, окисление атомов серы и восстановление атомов кислорода.
1. Записываем полуреакции для серы и железа:
Fe+2 — 1e = Fe+3
S−2 — 6e = S+4
Суммарно для обоих процессов можно записать так:
Fe+2 + S−2 — 7e = Fe+3 + S+4
Записываем полуреакцию для кислорода:
O2 +4e = 2O−2
2. Уравниваем число отданных и принятых электронов в двух полуреакциях:
4*| Fe+2 + s−2 — 7e = Fe+3 + S+4
7*| O2 + 4e = 2O−2
3. Просуммируем обе полуреакции:
4Fe+2 + 4S−2 + 7O2 = 4Fe+3 + 4S+4 + 14O−2
4. Расставим коэффициенты в окислительно-восстановительной реакции:
4FeS + 7O2 = 2Fe2O3 + 4SO2
dic.academic.ru
Метод электронного баланса
Этот метод основан на сравнении степеней окисления атомов, вхо-дящих в состав исходных и конечных веществ. Метод, в основном, при-меняется для составления уравнений реакций, идущих вне растворов.
Например:
Составляем схему реакции :
Fe S2 + O2 Fe2 O3 + S O2 .
Определяем элементы, изменяющие степени окисления.
3. Составляем схему электронного баланса :
2 2 Fe +2 2 e = 2 Fe +3
4 S-1 — 20 e = 4S+4
11 O2 — 4e = 2 О-2
4. В уравнении записываем коэффициенты у окислителя и восстано-вителя.
4 Fe S2 + 11O2 = 2 Fe2 O3
Недостатком метода является то, что баланс не отражает изменений, происходящих с атомами и молекулами в ходе реакции, а также трудности, возникающие при определении продуктов достаточно сложных реакции.
Электронно-ионный метод
Этот метод основан на составлении электронно-ионных уравнений для процессов и окисления и восстановления с последующим суммированием их в общее ионное уравнение.
При составлении уравнений реакций соблюдается следующая последо-вательность:
Записывается схема полуреакций, при этом сильные электролиты пишутся в виде ионов, а слабые — в виде молекул. Продукты реак-ции определяются на основании опыта или исходя из знания химии элементов, т.е. устойчивых степеней окисления.
Если исходное вещество содержит больше кислорода, чем продукт реакции, то избыточный кислород связывается в кислой среде ио-нами Н+, а в нейтральных и щелочных средах — молекулами воды.
Если исходное вещество содержит меньше кислорода, чем продукт реакции, то недостаток кислорода восполняется в кислой и нейт-ральной средах за счет молекул воды, а в щелочных средах — (за счет ионов гидроксила.
Следует помнить, что суммарные числа и знак зарядов ионов справа и слева от знака равенства должны быть равны.
Правильность составления реакции проверяем по кислороду.
В качестве примера рассмотрим следующую реакцию :
+7 +4
KМnO4 + Na2SO3 + H2 SO4
KМnO4 — является окислителем, так как центральный атом ( Mn) нахо-дится в высшей степени окисления, Na2SO3содержит центральный атом ( S) в степени окисления +4, это средняя степень , поэтому ион SO32 — мо-жет проявлять как окислительные, так и восстановительные свойства, одна-ко, в данной реакции окислитель KМnO4 , следовательно, Na2SO3 – восстано-витель.
Восстановление иона МnO4¯ в кислой среде идет до Мn2+ , окисление ио-на SO32 — — до SO42 —.
Учитывая сказанное, можно записать схему полуреакций : МnO4¯ Мn2+
SO32 — SO42 —
Следующий этап – составление уравнений полуреакций. Уравнивание в кислой среде производится с использованием ионов Н+ и молекул Н2О.
2 МnO4¯ + 8Н+ + 7е Мn2+ + 4Н2 О
5 SO32 — + Н2 О – 2е SO42 — + 2Н+
2МnO4¯ + 16Н+ +5SO32 — + 5Н2 О 2Мn2+ + 8Н2О + 5SO42 — + 10Н+
6 3
Записываем итоговое уравнение полуреакции, проставляя множители ( как и в методе электронного баланса). После этого складываем левые и правые части уравнений полуреакций, умножая их предварительно на соот-ветствующие множители, и получаем общее ионное уравнение реакции. Если в левой и правой части уравнения есть одинаковые молекулы или ионы, их требуется сократить с учетом коэффициентов ( помните , что ионы Н+ и ОН¯при сложении Н2 О).
Для получения молекулярного уравнения реакции ко всем ионам добавляем ионы противоположного знака
2KМnO4 + 5Na2SO3 + 3Н2 SO4 2MnSO4 + 5Na2SO4 + К2 SO4 +3Н2 О
Рассмотрим ход этой реакции в щелочной среде.
В щелочной среде , ион МnO4¯ будет восстанавливаться до МnO4 2- ,
в отличие от кислой среды в щелочной среде при составлении электронно-ионных уравнений используются ионы OН¯ и молекулы Н2О.
+7 +4 + 6 +6
2KМnO4 + Na2SO3 + 2КОН К2MnO4 + Na2SO4 + Н2 О
Производим все описанные выше действия и получаем ионное уравне-ние :
2 МnO4¯ +е МnO4 2-
1 SO32 — + 2ОН¯ – 2е SO42 — + Н2 О
2МnO4¯ +5SO32 — + 2ОН¯ 2 МnO42- + SO42 — + Н2О
В нейтральной среде , ион МnO4¯ будет восстанавливаться до МnO2, уравнивание кислорода производится только молекулами Н2 О.
+7 +4 +4 +6
2KМnO4 + 3Na2SO3 + Н2O 2MnO2 + 3Na2SO4 + К2 SO4 +2КОН
2 МnO4¯ + 2 Н2О + 3е MnO2 + 4ОН¯
3 SO32 — + Н2 О – 2е SO42 — + 2Н+
2МnO4¯ + 4Н2 О + 3 SO32 — + 3Н2 О 2MnO2 + 8ОН¯ + 3 SO42 — + 6 Н+
2 6 Н2О
Окислительно-восстановительные реакции можно разделять на следующие типы:
1. Межмолекулярные – степени окисления меняют разные элементы,входящие в состав разных веществ.
Н2 + С12 = 2НС1
1 | +1 H2 – 2 ē = 2H |
1 | —1 Cl2 + 2 ē = 2Cl |
2. Внутримолекулярные – степень окисления меняют разные элементы, входящие в состав одного вещества.
+5 -2 -1 0
2KClO3 = 2KCl+ 3O2
2 | +5 -1 Cl + 6 ē = Cl |
3 | -2 0 2O — 4 ē = O2 |
3. Реакции диспропорционирования (самоокисления – самовосстанов-ления), в таких реакциях одинаковые частицы являются окислителем и восстановителем:
0 -1 +1
С12 +Н2О = НСl + НСlО
1
0 -1
Cl + 1 ē = Cl
1
0 +1
Cl — 1 ē + Н2О = ClО— + Н+
studfile.net
Метод электронного баланса ℹ️ определение, правила и сущность, алгоритм составления и уравнивания окислительно-восстановительных реакций, примеры
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.

Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями. Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:

- В уравнении определяют сложные и простые степени окисления.
- Реакцию переписывают с расстановкой степени окисления. При этом вещества, в которых изменяется степень во всех связях, выделяют любым способом, например, подчёркиванием.
- Находят окислитель, восстановитель, и в случае присутствия, нейтральный элемент.
- Составляют уравнение баланса с выделением внутренних коэффициентов.
- Определяют наименьшее общее кратное.
- Подставляют вычисленные коэффициенты в уравнение.
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Например, ионное соединение NaCl = Na1+ + Cl1-. Атом натрия имеет один электрон, который в ионном соединении полностью переходит к более отрицательному атому. То есть, электрон натрия отдаётся полностью атому хлора. При этом атом, утратив один ион, приобретает заряд равный один плюс. Хлор же, получая дополнительный электрон, меняет заряд на один минус.
В химии принято заряды обозначать сначала цифрой, а после ставить знак, а степень окисления наоборот. Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na+1 Cl-1.
Для ковалентной полярной связи, например, молекулы HCl, общая электронная пара лишь смещается в сторону хлора. На атомах возникают частичные дельта-плюс и минус заряды. Но при расстановке значений на это внимания не обращают. Атом водорода полностью отдаёт свой электрон атому хлора. Соответственно, степень будет выглядеть как H+1Cl-1.
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:

- Первую — щелочные металлы и фтор.
- Вторую — металлы II группы, главной подгруппы и кислород.
- Третью — алюминий.
Остальные же вещества характеризуются переменной валентностью. При описании реакции характерно выделение и гидроксильной группы. Для соединения ОН значение ионов указывается единым. Например, Na+1(OH)-1. Проверку правильности расстановки зарядов можно выполнить по правилу электронейтральности, согласно которому сумма положительных электронов должна быть равна сумме отрицательных.
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + Nh4 = Cu + N2 +h3O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
Опираясь на таблицу Менделеева можно утверждать, что правильная степень окисления будет выглядеть для рассматриваемого выражения следующим образом: Cu+2 O-2 + N-3H+1 3 = Cu0 + N02 +H+12O-2. Теперь нужно отметить те элементы, которые поменяли свою валентность. Это медь, была +2, а стала 0, и азот, изменивший своё значение с -3 до 0.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
- Cu+2 — Cu0. Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.
- 2N-3 — N02. Тут следует обратить внимание на то, что при составлении полуреакций для молекул простых веществ обязательно следует указывать индексы. В рассматриваемом случае это двойка. Соответственно, такие выражения следует тоже уравнять. Поэтому в левой части ставится коэффициент два. Анализируя полуреакцию, можно прийти к выводу, что было -6 атомов, а стало ноль. То есть азот отдал шесть электронов. Записывается это как -6 e.
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
В рассматриваемом примере получается, что два электрона были приняты, а шесть отданы. Так не бывает, поэтому нужно найти, где же потерялась разница. Для полученных чисел ищется наименьший общий знаменатель. Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu+2O-2 + 2N-3H+13 = 3Cu0 + N02 +H+12O-2.
Опираясь на полученные значения, проводят стандартную процедуру уравнивания: 3Cu+2O-2 +2N-3H+13 = 3Cu0 + N02 + 3H+12O-2. Задача считается выполненной. Пожалуй, ещё можно указать, что медь в уравнении является окислителем, а азот — восстановителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + h3SO4 → MnSO4 + Br2 + K2SO4 + h3O.
Согласно правилу, нужно расставить ионны для каждого элемента: K+1Br+1 + K+1Mn+7O-24 + H+12S+6O-24 → Mn+2S+6O-2 4 + Br02 + K+1 2 S+6O-2 4 + H+12O-2. В уравнении только два элемента изменили степень. Это марганец, который был +7, а стал +2, и бром, поменявший свою валентность с -1 до нуля.

Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Вторая полуреакция состоит из брома. Был он в степени -1, а стал в нулевой. При этом индекс у него стал два. Значит, первоначально в реакцию должны были вступить два атома брома. Следовательно, в исходном состоянии было 2*(-1) = -2 электрона, а после стало ноль. То есть бром отдал два электрона: — 2e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
Mn+7 — Mn+2|+5e |5.
2Br-1 — Br02 |-2e |2.
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + h3SO4 → 5 Br2 + 2MnSO4+ K2SO4 + h3O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
В итоге полным правильным уравнением будет следующая химическая формула: 2KBr + 10KMnO4 + 8h3SO4 → 5 Br2 + 2MnSO4+ 6K2SO4 + 8h3O. Полученное выражение дальше править уже не нужно. Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Использование онлайн-калькулятора

В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
nauka.club
Электронный баланс химия как делать
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом : число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1 . Составление уравнения реакции меди с раствором нитрата палладия ( II ). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь — восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия ( II ) -окислитель. Эти изменения можно выразить электронными уравнениями
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd 2+ + 2NO3 — = Cu 2+ + 2NO3 — + Р d
И после сокращения одинаковых ионов получим
Cu + Pd 2+ = Cu 2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца ( IV ) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl — восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль Mn О2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н + + 4С l — + МnО2 = С l 2 + Мn 2 + + 2С l — + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н + + 2Cl — + Mn O 2 = С l 2 + Mn 2+ + 2Н2О
Пример 3 . Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции — формулы исходных и полученных веществ:
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2 S — восстановитель, КМ n О4 — окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2 S и 2 моль КМ n О4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2 S О4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2 . 4 + 3 . 4 = 20 и в правой части 2 . 4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2 MnO 4 — + 6 H + = 5 S + 2Мn 2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Разделы: Химия
Умение составлять электронный баланс при изучении окислительно-восстановительных реакций является одним из важнейших при изучении химии. Однако, несмотря на то, что учителя уделяют много времени и внимания формированию этого умения, учащиеся испытывают затруднения и допускают многочисленные ошибки.
К типичным ошибкам в традиционных способах приводят: неясность того, нужно ли учитывать индекс элемента и с какой части уравнения начинать расстановку коэффициентов. Излагаемый ниже способ этих недостатков лишен, достаточно лишь запомнить некоторые весьма несложные правила составления баланса.
С основами этого способа я познакомилась в студенчестве на лекциях и занятиях кандидата химических наук, преподавателя методики изучения химии Андриенко Антонины Леонтьевны в Астраханском педагогическом институте им. С.М.Кирова (ныне Астраханский государственный университет).
Применяя этот метод в течение многих лет в своей работе, мне удалось дополнить и расширить его, постепенно сложились «Правила составления баланса». Метод применяется преподавателями в ряде школ г. Астрахани и Астраханской государственной медицинской академии, апробирован многолетней практикой, которая свидетельствует, что учащиеся усваивают его легче обычного и допускают меньше ошибок.
Суть метода: электронный баланс составляется под уравнением, при этом учитываются индексы элементов, затем находится наименьшее общее кратное для чисел отданных и принятых электронов (НОК), делением НОК на эти числа получаем коэффициенты для восстановителя и окислителя.
Например, для уравнения Al 0 + Сl2 0 ––> Al + 3Cl3 –1 рассуждение ведется на один атом элемента: до реакции атом алюминия имел степень окисления ноль, после реакции приобрел степень окисления +3, следовательно, атом Al отдает три электрона. В той части уравнения, где составляется баланс, индекс Al равен единице, поэтому число три остается без изменений и подписывается под алюминием:
Хлор до реакции имел степень окисления ноль, после реакции имеет степень окисления –1, т.е. один атом хлора принимает один электрон, однако, в той части уравнения, где составляется баланс у хлора индекс два и, умножая число электронов на индекс, получаем цифру два для хлора
Находим НОК для числа отданных и принятых электронов
Делением НОК на число отданных электронов, получаем коэффициент для Al (6 : 3 = 2)
Делением НОК на число принятых электронов, получаем коэффициент для хлора (6 : 2 = 3)
В другой части уравнения коэффициенты расставляются методом подбора.
Дано задание: «По данным схемам составьте схемы электронного баланса». Как его выполнить? Что для этого потребуется? Попробуем разобраться вместе.
Для начала остановимся на том, что представляет собой данный метод. Если схема электронного баланса составлена правильно, можно поставить в предложенной реакции все стереохимические коэффициенты.
Суть данной методики заключается в определении степеней окисления отдельных элементов, которые участвовали во реакции. Если в левой и правой частях уравнения у элемента сохраняется постоянная степень окисления, то схема электронного баланса составляется без него.
У элементов, которые поменяли свою степень окисления в процессе взаимодействия, полученные значения учитываются при вычислениях наименьшего общего кратного.
Для начала вам придется поставить у каждого элемента его степени окисления, пользуясь определенными правилами. Если во взаимодействие вступало простое вещество, то оно не принимает, а также не отдает другому элементу электроны, следовательно, его степень окисления равна нулю. Примерами соединений с нулевой степенью окисления являются молекулы галогенов, металлы.
В бинарном соединении у второго элемента степень окисления имеет отрицательное, а у первого — положительное значение. В сумме (с учетом числа атомов) должен получиться ноль. В оксиде кальция, например, у первого элемента степень окисления +2, а у второго (кислорода) -2. Суммарное их значение равно нулю, так как молекула нейтральна.
Если необходимо расставить степени окисления в более сложном веществе, то сначала определяют показатели у первого и последнего элементов. Затем, пользуясь математическими вычислениями, определяют степень окисления у центрального элемента. Сумма всех показателей должна быть равна нулю.
Как же составляется схема электронного баланса? В левой ее части записывают вместе со степенями окисления элементы, которые участвовали в окислительно-восстановительном процессе.
Далее знаками «плюс» и «минус» указывается количество принятых и отданных электронов в ходе химического взаимодействия. Между числом электронов определяется наименьшее общее кратное. Напомним, что под ним подразумевается положительное число, которое будет без остатка делиться на обе цифры, касающиеся электронов.
Схема электронного баланса считается полной в том случае, когда в ней определены и коэффициенты. Как их найти? Наименьшее общее кратное необходимо разделить на принятые и отданные в процессе электроны. Полученные цифры и будут стереохимическими коэффициентами.
Важно также определить восстановитель и окислитель, а также протекающие при взаимодействии процессы (окисление и восстановление). Полученная схема электронного баланса окислительно-восстановительного процесса позволит вам расставить недостающие коэффициенты в реакции.
Задания на ОВР в итоговой аттестации
На основании данного метода выпускникам предлагается выполнение задания из уровня «С». Успешность зависит от уровня практических навыков ученика, степени владения теоретическими основами.
Например, в задании сказано: по данным схемам составьте схемы электронного баланса. Кроме того, часть реагирующих веществ, а также некоторые продукты взаимодействия могут быть упущены. Данный вопрос считается заданием повышенной сложности, поэтому предполагает определенную последовательность рассуждений.
Для начала у всех элементов в известных веществах определяют степени окисления, затем записывают вещества, которых не хватает в обеих частях реакции.
Далее составляется баланс. По полученной схеме реакции расставьте коэффициенты методом электронного баланса, как было описано выше. Последним действием будет указание всех протекающих процессов.
В тестах ЕГЭ по химии предполагается отдельная запись веществ, непосредственно участвующих в уравнении, с последующим указанием окислителя и восстановителя.
Такой метод является далеко не единственным способом расстановки коэффициентов в уравнении. Можно воспользоваться и методом полуреакций, который позволяет уравнивать сразу все вещества, записанные в уравнении.
Загрузка…wearethepeople.ru
Что такое схема электронного баланса?
Дано задание: «По данным схемам составьте схемы электронного баланса». Как его выполнить? Что для этого потребуется? Попробуем разобраться вместе.

Суть метода
Для начала остановимся на том, что представляет собой данный метод. Если схема электронного баланса составлена правильно, можно поставить в предложенной реакции все стереохимические коэффициенты.
Суть данной методики заключается в определении степеней окисления отдельных элементов, которые участвовали во реакции. Если в левой и правой частях уравнения у элемента сохраняется постоянная степень окисления, то схема электронного баланса составляется без него.
У элементов, которые поменяли свою степень окисления в процессе взаимодействия, полученные значения учитываются при вычислениях наименьшего общего кратного.

Как составить баланс
Для начала вам придется поставить у каждого элемента его степени окисления, пользуясь определенными правилами. Если во взаимодействие вступало простое вещество, то оно не принимает, а также не отдает другому элементу электроны, следовательно, его степень окисления равна нулю. Примерами соединений с нулевой степенью окисления являются молекулы галогенов, металлы.
В бинарном соединении у второго элемента степень окисления имеет отрицательное, а у первого — положительное значение. В сумме (с учетом числа атомов) должен получиться ноль. В оксиде кальция, например, у первого элемента степень окисления +2, а у второго (кислорода) -2. Суммарное их значение равно нулю, так как молекула нейтральна.
Если необходимо расставить степени окисления в более сложном веществе, то сначала определяют показатели у первого и последнего элементов. Затем, пользуясь математическими вычислениями, определяют степень окисления у центрального элемента. Сумма всех показателей должна быть равна нулю.

Алгоритм действий
Как же составляется схема электронного баланса? В левой ее части записывают вместе со степенями окисления элементы, которые участвовали в окислительно-восстановительном процессе.
Далее знаками «плюс» и «минус» указывается количество принятых и отданных электронов в ходе химического взаимодействия. Между числом электронов определяется наименьшее общее кратное. Напомним, что под ним подразумевается положительное число, которое будет без остатка делиться на обе цифры, касающиеся электронов.
Схема электронного баланса считается полной в том случае, когда в ней определены и коэффициенты. Как их найти? Наименьшее общее кратное необходимо разделить на принятые и отданные в процессе электроны. Полученные цифры и будут стереохимическими коэффициентами.
Важно также определить восстановитель и окислитель, а также протекающие при взаимодействии процессы (окисление и восстановление). Полученная схема электронного баланса окислительно-восстановительного процесса позволит вам расставить недостающие коэффициенты в реакции.
Задания на ОВР в итоговой аттестации
На основании данного метода выпускникам предлагается выполнение задания из уровня «С». Успешность зависит от уровня практических навыков ученика, степени владения теоретическими основами.
Например, в задании сказано: по данным схемам составьте схемы электронного баланса. Кроме того, часть реагирующих веществ, а также некоторые продукты взаимодействия могут быть упущены. Данный вопрос считается заданием повышенной сложности, поэтому предполагает определенную последовательность рассуждений.
Для начала у всех элементов в известных веществах определяют степени окисления, затем записывают вещества, которых не хватает в обеих частях реакции.
Далее составляется баланс. По полученной схеме реакции расставьте коэффициенты методом электронного баланса, как было описано выше. Последним действием будет указание всех протекающих процессов.
В тестах ЕГЭ по химии предполагается отдельная запись веществ, непосредственно участвующих в уравнении, с последующим указанием окислителя и восстановителя.
Заключение
Такой метод является далеко не единственным способом расстановки коэффициентов в уравнении. Можно воспользоваться и методом полуреакций, который позволяет уравнивать сразу все вещества, записанные в уравнении.
fb.ru
Конспект «Метод электронного баланса» — УчительPRO
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
- Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:

- Составим схемы, отражающие процессы перехода электронов:

- Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:

- Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:

- Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:

Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl– участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
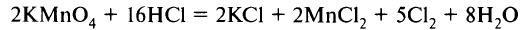
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).

Вы смотрели конспект урока по химии «Метод электронного баланса».
Следующая тема: «Окислители и восстановители».
uchitel.pro