Влияние давления на скорость реакции — Мегаобучалка
При записи кинетического уравнения реакции для газообразных систем вместо концентрации (С) пишут давление (Р) реагентов, так как изменение давления в системе аналогично изменению концентрации. Увеличение давления в системе вызывает уменьшение объема системы во столько же раз, при этом концентрация реагентов в единице объема увеличивается так же. При уменьшении давления происходит увеличение объема системы, при этом концентрации в единице объема уменьшится соответственно.
Примеры и решения задач.
Пример 1.
Скорость какой реакции больше, если за единицу времени в единице объема образовалось в результате первой реакции 9г водяного пара, в результате второй реакции – 3,65г хлористого водорода?
Скорость реакции измеряется количеством молей вещества, которое образуется в единице объема за единицу времени. Молярная масса воды молярная масса хлористого водорода тогда скорость первой реакции,
а скорость второй реакции
будет моль/л.
Скорость образования водяных паров больше, так как число молей образования водяного пара больше, чем число молей образования хлористого водорода.
Пример 2.
Реакция между веществами А и В выражается уравнением: А+2В®С. Начальная концентрация вещества А равна 0,3 моль/л, а вещества В–0,5 моль/л. Константа скорости равна 0,4. Определить скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшается на 0,1 моль/л.
Концентрация вещества А уменьшилась на 0,1 моль/л. Следовательно, исходя из уравнения реакции, концентрация вещества В уменьшилась на 0,2 моль/л, так как перед веществом В стоит коэффициент 2. Тогда концентрация вещества А через некоторое время станет равной 0,3-0,1=0,2 моль/л, а концентрация В – 0,5-0,2=0,3 моль/л.
Определяем скорость реакции:
моль/л×с
Пример 3.
Как изменится скорость реакции: если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции:
.
При увеличении концентрации NO в 3 раза скорость реакции будет:
Скорость реакции увеличится в 9 раз.
Пример 4.
Определите, как изменится скорость реакции, если увеличить давление в системе в 2 раза.
Увеличение давления в системе в 2 раза вызовет уменьшение объема системы в 2 раза, при этом концентрации реагирующих веществ возрастут в 2 раза.
Согласно закону действующих масс запишем начальную скорость реакции и при увеличении давления в 2 раза:
Тогда
, .
Скорость реакции увеличится в 8 раз.
Пример 5.
Рассчитайте исходные концентрации веществ А и В в системе А+3В=2С, если равновесные концентрации веществ А равна 0,1 моль/л, веществ В равна 0,2 моль/л, вещества С–0,7 моль/л.
Находим концентрацию вещества А, израсходованную на реакцию, составляя пропорцию по уравнению реакции:
2 моль/л С получено из 1 моль/л А,
0,7 моль/л С ®х моль /л × А.
моль/л А.
Следовательно, исходная концентрация вещества А равна:
= 0,1 + 0,35 = 0,45 моль/л.
Находим концентрацию вещества В, израсходованную на реакцию.
Составляем пропорцию по уравнению реакции:
2 моль/л С получено из 3 моль/л В
0,7 моль/л С ® х моль/л В
х= моль/л А.
Тогда исходная концентрация вещества В равна:
моль/л.
Пример 6.
При температуре 400 С образовалось 0,5 моль/л вещества А. Сколько моль/л А образуется, если повысить температуру до 800 С? Температурный коэффициент реакции равен 2.
По правилу Вант-Гоффа запишем выражение скорости реакции при 800 С:
.
Подставив в уравнение данные задачи, получим:
При 800 С образуется 8 моль/л вещества А.
Пример 7.
Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Запишем уравнение Аррениуса для условия задачи:
где R – универсальная газовая постоянная, равная 8,32 Дж/к(К×моль).
откуда изменение константы скорости будет:
.
Контрольные задания
61. Скорость химической реакции
2NO(г) + O2(г) = 2NO2(г)
при концентрациях реагирующих веществ [NO]=0,3 моль/л и [O2]=0,15 моль/л составила 1,2·10-3 моль/(л·с). Найдите значение константы скорости реакции.
62. На сколько градусов следует повысить температуру системы, чтобы скорость протекания в ней реакции возросла в 30 раз (=2,5)?
63.Во сколько раз следует увеличить концентрацию оксида углерода в системе
2СО = СО2+ С,
чтобы скорость реакции увеличилась в 4 раза?
64.Во сколько раз следует увеличить давление, чтобы скорость реакции образования NО2по реакции
2NO + O2= 2NO2
возросла в 1000 раз?
65. Реакция идет согласно уравнению
2NO(г) + Cl2(г) = 2NOCl(г).
Концентрации исходных веществ до начала реакции составляли: [NO]=0,4 моль/л; [Cl2]=0,3 моль/л. Во сколько раз изменится скорость реакции по сравнению с первоначальной в тот момент, когда успеет прореагировать половина оксида азота?
66.Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40, если =3,2?
67.Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению
А+2В=АВ2
и определите, во сколько раз увеличится скорость этой реакции, если :
а) концентрация А уменьшится в 2 раза;б) концентрация А увеличится в 2 раза;
в) концентрация В увеличится в 2 раза;
г) концентрация обоих веществ увеличится в 2 раза.
68.Во сколько раз следует увеличить концентрацию водорода в системе
N2 + 3h3= 2NН3,
чтобы скорость реакции возросла в 100 раз?
69.Вычислите температурный коэффициент скорости реакции, если константа скорости ее при 100 С составляет 0,0006, а при 150 С 0,072.
70.Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO + Cl2= 2NOCl.
Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в 2 раза;
б) концентрации хлора в 2 раза;
в) концентрации обоих веществ в 2 раза?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Примеры решения задач
Химическим равновесием называется такое состояние системы, при котором скорости прямой и обратной химических реакций равны, и концентрации реагирующих веществ не изменяются с течением времени.
Количественной характеристикой химического равновесия является константа равновесия. Константа равновесия при постоянной температуре равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов, и является величиной постоянной.
В общем случае для гомогенной реакции mA+ nB« pC+qD
константа равновесия равна:
.
Это уравнение выражаем законом действующих масс для обратимой реакции.
При изменении внешних условий происходит смещение химического равновесия, выражающееся в изменении равновесных концентраций исходных веществ и продуктов реакции. Направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Химическое равновесие можно сместить влиянием изменения концентрации реагирующих веществ, температуры, давления.
При увеличении концентрации исходных веществ равновесие сместится в соответствии с принципом Ле-Шателье в сторону продуктов реакции, а при увеличении концентраций продуктов – в сторону исходных веществ.
При изменении температуры (ее увеличении) равновесие смещается в сторону эндотермической реакции (D H > 0), идущей с поглощением тепла, т.е. увеличивается скорость прямой реакции, и равновесие смещается в сторону продуктов реакции. В случае экзотермической реакции (D H > 0), при увеличении температуры увеличится скорость обратной реакции, которая будет обеспечивать поглощение тепла, и равновесие сместится в сторону исходных веществ.
Если в реакции участвуют вещества в газообразном состоянии, то химическое равновесие можно сместить изменением давления. Увеличение давления равносильно увеличено концентрации реагирующих веществ. При увеличении давления равновесие смещается в сторону реакции с меньшим числом молей газообразных веществ, а при уменьшении давления – в сторону реакции с большим числом молей газообразных веществ.
Пример 1.
Рассчитайте исходные концентрации вещества А и В в гомогенной системе А+3В«2С, если равновесные концентрации А=0,1 моль/л, В=0,2 моль/л, С= 0,7 моль/л.
Известно, что исходная концентрация вещества равна сумме равновесной и концентрации, ушедшей на реакцию, т.е. прореагировавшей:
Чтобы найти надо знать, сколько вещества А прореагировало.
Рассчитываем , составляя пропорцию по уравнению реакций:
2моль/л С получено из 1 моль/л А
0,7 моль/л С ––––––––х моль/л А,
х= (0,7×1)/2= 0,35 моль/л
Тогда:
Рассчитываем исходную концентрацию вещества В:
Для нахождения составим пропорцию:
2 моль/л С получено из 3моль/л В
0,7 моль/л С –––––––––––––х моль/л В
х = (0,7×3)/2 = 1,05 моль/л
Тогда исходная концентрация В равна:
Пример 2.
Рассчитайте равновесные концентрации веществ в системе А+В «С+Д при условии, что исходные концентрации веществ: А=1 моль/л, В= 5 моль/л. Константа равновесия равна 1.
Предположим, что к моменту равновесия вещества А прореагировало х молей. Исходя из уравнения реакции, равновесные концентрации будут:
;
; ; ,
так как по уравнению реакции вещества В ушло на реакции столько же, сколько прореагировало вещества А.
Подставляем значения равновесных концентраций в константу равновесия и находим х.
Тогда:
Пример 3.
В системе установилось равновесие: 2АВ+В2 «2АВ; D H > 0.
В каком направлении сместится равновесие при уменьшении температуры?
Данная прямая реакция является эндотермической, т.е. идет с поглощением тепла, поэтому при уменьшении температуры в системе, равновесие в соответствии с принципом Ле-Шателье сместится влево, в сторону обратной реакции, которая является экзотермической.
Пример 4.
Равновесие системы А + В « АВ установилось при следующих концентрациях веществ: С(А)=С(В)=C(АВ)=0,01моль/л. Рассчитайте константу равновесия и исходные концентрации веществ.
Константа равновесия равна:
.
Рассчитываем исходные концентрации веществ:
.
По уравнению реакции:
= 0,01 моль/л,
= 0,01моль/л.
Тогда:
0,02 моль/л
0,02 моль/л.
Контрольные задания
71. Константа равновесия гомогенной системы
N2+ 3h3 2Nh4
при температуре 400 С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 моль/л и 0,08 моль/л. Вычислите равновесную и начальную концентрации азота.
72. Исходные концентрации оксида азота (II) и хлора в системе
2NO + Cl2 2NOCl
составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 оксида азота (II).
73.При некоторой температуре равновесные концентрации реагентов обратимой химической реакции
2А(г)+В(г) 2С(г)
составили [А]=0,04 моль/л, [В]=0,06 моль/л, [C]=0,02 моль/л. Вычислите константу равновесия и исходные концентрации веществ А и В .
74.При некоторой температуре равновесные концентрации в системе
2SO2+ O2 2SO3
составляли соответственно: [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л,
[SO3]=0,02 моль/л. Вычислите константу равновесия и исходные кон-
центрации оксида серы (IV) и кислорода.
75.При состоянии равновесия системы
N2+ 3h3 2Nh4,
концентрации участвующих веществ были: [N2] = 0,3 моль/л; [h3] = =0,9 моль/л; [Nh4] = 0,4 моль/л. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличится в 5 раз. В каком направлении сместится равновесие?
76. Вычислите константу равновесия обратимой реакции
2SO2(г) + O2(г) 2SO3(г),
если равновесная концентрация [SO3]=0,04 моль/л, а исходные концен-трации веществ [SO2]=1 моль/л, [O2]=0,8 моль/л.
77.Равновесие системы
CO + Cl2 COCl2,
установилось при следующих концентрациях реагирующих веществ: [СО] = =[Сl2] = [COCl2] = 0,001 моль/л. Определите константу равновесия и исходные концентрации окиси углерода и хлора.
78. Исходные концентрации оксида углерода (II) и паров воды равны и составляют 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2в системе
CO + h3O CO2+ h3,
если равновесная концентрация СО2оказалась равной 0,01 моль/л. Вычислите константу равновесия.
79.Определите равновесную концентрацию водорода в системе
2HJ h3+ J2,
если исходная концентрация HJ составляла 0,05 моль/л, а константа равновесия К=0,02.
80.Константа равновесия системы
СО + Н2О СО2+ Н2
при некоторой температуре равна 1. Вычислите процентный состав смеси в состоянии равновесия, если начальные концентрации СО и Н2О составляют по 1 моль/л.
Давление, влияние на скорость реакции в растворе
Экспериментальные данные свидетельствуют о том, что кинетика реакций Арбузова, проведенных в различных растворителях, хорошо описывается уравнением для бимолекулярной реакции. Таким образом, с точки зрения теории переходного состояния можно ожидать ускорения реакций Арбузова при проведении их под высоким давлением. Изучение влияния давления на скорость изомеризации триэтилфосфита при 80 °С в растворе толуола в присутствии этилиодида привело к следующим результатам (табл. 23). [c.192]Изучалось влияние давления водорода на ход реакции. Как видно нз рис. 14, константа скорости реакции первого порядка прямо пропорциональна парциальному давлению водорода Ян,. Поскольку в исследованном диапазоне давлений водорода его растворимость в большинстве водных растворов подчиняется закону Генри, то константа скорости первого порядка должна [c.198]
Влияние давления. Зависимость скорости реакции от давления изучалась ири температурах 130, 140, 150 и 165° в интервале давлений 150—260 ат и графически представлена на рис. V. 35. Наблюдается прямая пропорциональность скорости реакции от давления ири всех изученных температурах. Пересечения прямых с осью абсцисс дают отрезки, численные значения которых соответствуют минимальному давлению (для эквимолекулярной смеси окиси углерода с водородом), ниже которого при данной температуре реакция практически протекать не может. По-видимому, отрезки, отсекаемые прямыми на оси абсцисс, отвечают общим давлениям, обеспечивающим парциальное давление окиси углерода, необходимое для удержания в растворе какого-то минимального количества карбонильного комплекса. [c.341]
Влияние давления на скорость реакции в растворе [24] [c.240]
Анализ данных о влиянии давления на скорость реакций в разбавленных растворах показывает различное ускорение нормальных и медленных бимолекулярных реакций скорость последних растет с повышением давления гораздо быстрее. Проведенные расчеты на основе применения метода переходного состояния подтверждают приложимость количественных выводов теории этого метода о зависимости скорости реакций от давления к реакции пиридина с иодистым этилом и димеризации циклопентадиена нри давлениях порядка сотен и тысяч атмосфер. Как и следовало ожидать, мономолекулярные реакции распада в жидкой фазе несколько тормозятся давлением. [c.137]
И, наконец, последний пример. Известно, что на скорость химических реакций в растворах оказывает весьма сильное влияние химическая природа растворителя одна и та же реакция может протекать в разных растворителях со скоростями, различающимися в десятки тысяч раз. Исследование скорости таких реакций при высоких давлениях проливает свет на механизм участия растворителя в них, так как позволяет установить, как изменяется объем реагирующих молекул в момент реакции. Оказалось, что в разных растворителях ето изменение объема различно. Подробное рассмотрение ползгченных данных о влиянии давления на скорость реакций в растворах подтвердило предположение о том, что в ряде случаев молекулы растворителя в момент реакции тесно связываются с молекулами реагирующих веществ, тем самым облегчая протекание реакции. [c.28]
Скорость реакции зависит от мно] их причин. На нее влияют природа и концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, степень измельчения (в реакциях с участием твердых веществ), среда (для реакций в растворах), форма сосуда (в цепных реакциях ), интенсивность света (в фотохимических реакциях), потенциал электродов (в электрохимических реакциях), мощность дозы излучения (в радиационнохимических процессах). Таким образом, лишь некоторые из факторов, действующих на скорость реакции, одновременно оказывают влияние на химическое равновесие. В связи с этим надо отметить огромную трудность учета действия различных факторов на скорость реакции и, тем более, количественной их оценки. [c.102]
Механизмы метаболических процессов очень напоминают механизмы реакций, проводимых в лабораторных условиях, с тем отличием, что если в лаборатории часто работают прн повышенных температурах и давлении, с безводными (часто ядовитыми) растворителями, с сильными кислотами и основаниями и с нетипичными для природы реагентами, то метаболические процессы протекают при весьма умеренных условиях в разбавленных водных растворах в интервале температур от 20 до 40 °С при pH от 6 до 8 и с участием чрезвычайно эффективных катализаторов — ферментов. Можно сказать, что каждая ступень метаболического процесса катализируется специфическим ферментом. Ферменты представляют собой вещества белковой природы их каталитическое действие оказывает влияние не на положение равновесия реакции, а на ее скорость, которая очень сильно увеличивается — часто на несколько порядков по сравнению со скоростью реакции, проводимой в лабораторных условиях. В состав некоторых ферментов входят коферменты, имеющие небелковый характер. Подвергающийся превращению субстрат сначала связывается с активным центром фермента, поблизости от которого расположен кофер-мент. При этом реагирующая группа субстрата и кофермент так сориентированы в пространстве, что реакция между ними протекает практически мгновенно. Затем прореагировавший субстрат отделяется от активного центра фермента, а измененный кофермент регенерируется под действием другого субстрата. Если в ферменте нет кофермента, то два субстрата непосредственно взаимодействуют в активном центре. [c.180]
Гидролиз [131, 140, 141, 143, 158] в промышленном масштабе применяется для получения глицерина и жирных кислог, идущ,их на производство мыла. В первом этапе процесса идет химическая реакция между глицеридом и водой, во втором—экстрагирование образующихся молекул глицерина из масляной фазы в водную [134, 138]. Химическая реакция сначала идет медленно, благодаря слабой растворимости воды и масла, и носит гетерогенный характер. По мере накопления в масляной фазе продуктов реакции (кислот и глицерина) растворимость в воде увеличивается, растет скорость реакции, приобретающей гомогенный характер. Образующиеся молекулы глицерина сейчас же растворяются в водной фазе, что благоприятно влияет на скорость реакции в масляной фазе. Таким образом, количество воды, введенной в процесс, имеет большое влияние на его ход. Для ускорения реакции пользуются катализаторами, например окисью цинка или алкиларилсульфоновой кислотой. Процесс проводится под атмосферным давлением при 100 С в присутствии кислого катализатора или при —230 С и соответственно под повышенным давлением (не менее 30 ат, т. е. —3-10 н/м ) без катализатора. Верхним пределом является температура 290—340 С (в зависимости от рода масла), при которой достигается полная взаимная растворимость воды и масел. Выгоднее проводить процесс про
Скорость химических реакций влияние давления
Влияние различных факторов. На скорость химической реакции могут влиять различные факторы. В гомогенных системах такими факторами являются температура, давление и состав в гетерогенных системах проблема усложняется. Реагирующее вещество может 22 [c.22]На скорость химической реакции оказывает влияние и давление. С изменением давления может меняться константа скорости реакции. Переменными могут оказаться и концентрации. Пусть, например, при изменении давления сохраняется соотношение между компонентами, т. е. сохраняются относительные молярные концентрации /г = = р Р, где Р1— парциальное давление, Р — общее давление. Тогда действующие концентрации компонент С,- = рр РЯТ) будут меняться прямо пропорционально общему давлению, соответственно будет меняться число соударений и скорость реакции. [c.101]
Кинетика химических реакций при высоких давлениях является весьма молодой отраслью физической химии, ибо лишь в течение последних нескольких десятков лет были поставлены серьезные исследования. В отличие от проблемы химического равновесия вопрос о влиянии давления на скорость химических реакций никак не может считаться в принципе решенным, [c.172]
Пределы распространения пламени по давлению. Влияние давления на скорость горения связано в основном с зависимостью скорости химической реакции от давления. Для реакции п-то порядка скорость химического превращения в реакционной зоне зависит от давления приблизительно как (ср. с формулой (1.8)) [c.265]
На скорость химических реакций влияет много факторов природа реагирующих веществ, их концентрация, температура, давление, наличие катализаторов и др. В предложенных задачах необходимо учитывать влияние на скорость реакций только двух факторов — концентрации реагирующих веществ и температуры. Кратко охарактеризуем величины, которыми следует оперировать в процессе решения задач, а также закономерности, определяющие зависимости между этими величинами. [c.53]
Рассмотрим зависимость скорости сложных реакций от давления. О влиянии давления на константы скорости различных стадий сложных химических превращений можно высказать лишь некоторые общие соображения. [c.184]
На первом уровне рассматриваются процессы, протекающие в единичном структурном элементе — поре — с учетом ее реальных геометрических характеристик и их влияния на процессы переноса. Элемент характеризуется коэффициентами переноса, константами скорости химических реакций, адсорбции, энергиями активации, условиями возникновения межфазных границ и т. д., для него должны быть определены внешние условия — температура, давление, концентрации исходных веществ и продуктов и др. В средах с неоднородной пористой структурой, характеризующейся распределением пор по размерам, учитывается также влияние неравномерности распределения размеров пор на характер протекающих в них процессов. [c.141]
Измерения в таком же сосуде, но с диспергированием газа в жидкости также показали, что при высокой интенсивности перемешивания скорость абсорбции пропорциональна давлению кислорода. Скорость абсорбции оставалась неизменной при использовании кобальта вместо меди (с той же концентрацией). Это свидетельствовало о независимости скорости абсорбции от скорости химической реакции и о влиянии на нее лишь скорости переноса от поверхности в массу жидкости. По данным Филлипса и Джонсона, значения киа при 600 и 4500 оборотах ъ I мин составляли около 0,044 и 0,88 eк соответственно. [c.256]
При протекании реакций в жидких средах влияние давления на скорость взаимодействия оказывается весьма неоднозначным. Естественно, что скорость химической реакции под давлением будет зависеть от многих факторов стерических особенностей реагентов, вязкости реакционной среды, изменения каталитического действия и т. д. В настоящее время еще не удается построить теорию химической кинетики при высоких давлениях с учетом всех действующих на процесс факторов. Поэтому кинетические закономерности в средах под высоким давлением приходится выводить с помощью ряда приближений. Сейчас в кинетике химических реакций используются два метода метод активных соударений и метод переходного состояния. [c.172]
В результате упорных исследований Беккерелю удалось показать, что радиоактивные лучи испускаются различными соединениями урана, но наиболее интенсивно — самим металлическим ураном. Лучи эти появлялись не в результате химической реакции обычные условия, которые влияют на скорость химических реакций,— температура, давление, состояние химического соединения — были абсолютно неэффективны и не оказывали никакого-влияния на интенсивность радиоактивного излучения. [c.454]
Из выражений (8) и (3) следует, что для интенсификации процесса в газожидкостном реакторе необходимо вначале определить лимитирующую стадию процесса. Если лимитирующей стадией является массоперенос, то в целях интенсификации необходимо обратиться к соответствующим РТ- и АК-методам. Для интенсификации собственно реакционного процесса в жидкой фазе следует использовать те РТ-методы, которые оказывают влияние на скорость химической реакции (увеличение давления и температуры, применение катализаторов, совмещение химических реакций и др.). [c.16]
Рассмотрим закономерности химической технологии применительно к гомогенным процессам, т. е. влияние концентраций реагирующих веществ, температуры, давления и перемешивания на скорость процессов в газовой и жидких средах. Гомогенные процессы, как правило, идут в кинетической области, т. е. общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и к процессам, идущим в газовой или жидкой среде. [c.139]
Влияние температуры на скорость химической реакции во много раз значительнее, чем на ряд других процессов, таких, как, например, скорость диффузии, изменение вязкости среды, поверхностное натяжение, осмотическое давление и т. д. [c.135]
На скорость химической реакции влияют многие факторы концентрация реагирующих веществ, их природа, температура, природа растворителя (если реакция протекает в растворе), присутствие катализаторов, в случае газовых реакций оказывает влияние на скорость и давление. [c.112]
Раздел физической химии, в котором изучается скорость химических реакций и механизм химическо
Скорость реакции — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Скоростью химической реакции называется изменение концентрации вещества в единицу времени, , где концентрация С выражена в моль/л. В ЕГЭ не требуется применение этой формулы, необходимо лишь уметь сравнивать скорости различных реакций и определять, как на них влияют изменения внешних условий.
Скорость реакции зависит от нескольких факторов:
- — Природы взаимодействующих веществ
- — Температуры
- — Концентрации реагирующих веществ
- — Присутствия в реакционной смеси катализатора или ингибитора
- — Площади поверхности соприкосновения реагентов (для гетерогенных процессов).
Рассмотрим каждый пункт отдельно:
1) Природа реагентов
Очевидно, что разные реакции при одних и тех же условиях протекают с различными скоростями. Нейтрализация щелочи кислотой протекает почти моментально, растворение цинка в соляной кислоте — быстро, ржавление железа под действием воды и кислорода – намного дольше. Общее правило очевидно: чем активнее реагирующие вещества, тем быстрее они взаимодействуют друг с другом.
Самые быстрые реакции – гомогенные, протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме смеси реагентов.
Гетерогенные реакции – взаимодействие не смешивающихся друг с другом веществ – протекают на границе раздела фаз. Эти процессы медленнее, и скорость определяется площадью поверхности соприкосновения.
2) Температура
При увеличении температуры молекулы начинают двигаться быстрее, следовательно, чаще сталкиваются друг с другом. Таким образом, скорость реакции всегда возрастает при повышении температуры и уменьшается – при понижении. Мы активно пользуемся этим в быту: например, для замедления процессов гниения (сложных химических реакций) храним продукты в холодильнике, а для ускорения реакции Майяра (взаимодействие белков с сахарами) готовим пищу при высокой температуре.
Зависимость скорости реакции от температуры определяется уравнением Вант-Гоффа: , где v2 и v1 – скорости реакции при температурах Т2 и Т1 соответственно, γ – температурный коэффициент, принимающий значения от 2 до 4. Например, если γ=3, при повышении температуры на 20 градусов скорость реакции возрастет в раз.
3) Концентрация реагентов
Очевидно, что чем выше концентрации реагирующих веществ, тем чаще их молекулы будут сталкиваться друг с другом, следовательно, тем быстрее будет протекать взаимодействие. Зависимость скорости от концентрации реагентов выражается законом действующих масс.
Например, для реакции aA + bB = cC + dD скорость . На самом деле часто зависимость скорости от концентраций реагентов носит более сложный характер, так как многие процессы протекают через образование промежуточных продуктов, но мы оставим эти случаи университетскому курсу.
Пожалуйста, не путайте: скорость реакции зависит от концентраций реагентов и не зависит от концентраций продуктов!
Здесь же рассмотрим влияние давления на скорость реакции. Жидкости и твердые тела практически несжимаемы и давление не влияет на их концентрации. Для газов увеличение давления вызывает возрастание концентрации, следовательно, ускоряет реакцию.
4) Катализаторы и ингибиторы
Катализатор – вещество, увеличивающее скорость реакции, но не расходующееся в ней, ингибитор – это «катализатор наоборот», он замедляет реакцию.
5) Площадь границы раздела фаз
Для примера рассмотрим реакцию цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2.
Кусочек цинка будет постепенно растворяться в кислоте: сначала прореагирует верхний слой молекул, потом следующий, — и так далее. «Внутренние» атомы смогут прореагировать только после того, как перейдут в раствор «внешние».
Если же этот кусочек измельчить (то есть увеличить площадь его поверхности) реакция пойдет заметно быстрее, т.к. возрастет количество «доступных для кислоты» частиц.
Таким образом, чем сильнее измельчено твердое вещество, тем выше скорость реакции. Количество твердого вещества на скорость влияет намного слабее, чем степень его измельченности и концентрация жидких или газообразных реагентов.
Потренируемся. Ниже приведены вопросы из ЕГЭ разных лет:
| А) Скорость химической реакции 2С(тв) + СО2(г) = 2СО(г) не зависит от | 1) температуры 2) концентрации СО 3) степени измельченности угля 4) давления |
| Б) С наибольшей скоростью при комнатной температуре протекает реакция меду водородом и | 1) серой 2) иодом 3) фтором 4) бромом |
| В) Для увеличения скорости химической реакции Mg(тв) + 2HCl(р-р) = MgCl2(р-р) + h3(г) необходимо | 1) увеличить давление 2) уменьшить температуру 3) увеличить концентрацию HCl 4) увеличить количество магния. |
| Г) Повышение давления приведет к увеличению скорости реакции | 1) 2P(тв) + 3S(тв) = P2S3(тв) 2) Br2(ж) + 2Na(тв) = 2NaBr 3) h3O(ж) + 2Na(тв) = 2NaOH + h3(г) 4) N2(г) + 3h3(г) = 2Nh4(г) |
| Ответы:
| |
Давление, влияние на скорость реакции
Влияние давления на скорость реакции окисления парафина [c.452] Влияние давления на скорость реакции сказывается также через изменение концентрации. Так как изменение давления существенно влияет только на концентрацию веществ, находящихся в газовой фазе, то давление оказывает влияние только на скорость реакций, в которых участвуют газообразные вещества. [c.57]
Используя при вычислении числа Рейнольдса средние по слою величины, мы получим при этом линейную зависимость Р от 2. Если влияние давления на скорость реакции незначительно, можно вообще не принимать уравнения (IX.14) во внимание и использовать при расчете среднее по слою давление. В дальнейшем, при исследовании поведения трубчатых реакторов, мы так и будем поступать, не внося существенных искажений в общую картину процесса. [c.260]
Неоднократно устанавливалось влияние высоких давлений на скорость реакций в конденсированных системах. Это влияние наблюдалось в случае реакций в жидкой фазе, например полимеризации этилена, стирола и т. д. Для некоторых реакций в жидкостях можно предвидеть влияние давления на константу скорости реакции, основываясь на теории переходного состояния [c.235]
Для выяснения влияния фактора давления на скорость реакций гидрирования А. В. Фрост [120] исследовал кинетику гидрирования бензола и толуола на Pd-катализаторе в интервале давлений [c.435]
Выведите кинетическое уравнение реакции и предскажите влияние давления на скорость реакции. [c.160]
Используем для процессов такого типа изложенные закономерности по влиянию давления на скорость реакций с применением метода переходного состояния [см. уравнение (64)]. Знак изменения логарифма отношения констант скорости реакций в зависимости от давления будет определяться разностью изменений объемов при образовании активированного комплекса при реакциях (1) и (2) АУ, -ДКГ. [c.185]
Влияние давления на скорость реакции будет рассмотрено в на примерах реакций с участием газов. [c.80] Влияние давления. Зависимость скорости реакции от давления изучалась ири температурах 130, 140, 150 и 165° в интервале давлений 150—260 ат и графически представлена на рис. V. 35. Наблюдается прямая пропорциональность скорости реакции от давления ири всех изученных температурах. Пересечения прямых с осью абсцисс дают отрезки, численные значения которых соответствуют минимальному давлению (для эквимолекулярной смеси окиси углерода с водородом), ниже которого при данной температуре реакция практически протекать не может. По-видимому, отрезки, отсекаемые прямыми на оси абсцисс, отвечают общим давлениям, обеспечивающим парциальное давление окиси углерода, необходимое для удержания в растворе какого-то минимального количества карбонильного комплекса. [c.341]Влияние внешнего давления на скорость (реакций рассматривается в разд. 5.5.11. Активационный объем реакции обычно оценивают путем измерения внешнего давления. [c.277]
ВЛИЯНИЕ ДАВЛЕНИЯ НА СКОРОСТЬ реакции [c.169]
Зависимость скорости химической реакции от температуры — Студопедия
Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму реакций взаимодействия, протекающих в газах или в разбавленных растворах.
Для гомогенных реакций:
1. aA(Ж) + bB(Ж) ↔ cC(Ж) + dD(Ж) ;  (T=const)
(T=const)
2. 3H2(Г) + N2(Г) ↔ 2NH3(Г); 
Для гетерогенных реакций:
1. aA(т) + bB(Г) = cC(Г) + dD(Г); 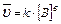 2. С (т)+О2(Г)=СО2(Г);
2. С (т)+О2(Г)=СО2(Г); 
В законе действия масс не учитываются концентрации веществ, находящихся в твердой фазе. Чем больше площадь поверхности твердой фазы, тем выше скорость химической реакции.
k – константа скорости химической реакции определяется природой реагирующих веществ и зависит от температуры, от присутствия в системе катализатора, но не зависит от концентрации реагирующих веществ. Константа скорости представляет собой скорость химической реакции (
 ), если концентрации реагирующих веществ
), если концентрации реагирующих веществ  .
.
3. Зависимость скорости химической реакции от давления. Для газообразных систем увеличение давления или уменьшение объема, равноценно увеличению концентрации и наоборот.
Задача: Как изменится скорость химической реакции 2SO2(г) + O2(г)  2SO3(г), если давление в системе увеличить в 4 раза?
2SO3(г), если давление в системе увеличить в 4 раза?
В соответствие с законом действия масс для прямой реакции, записываем выражение:
 , пусть [SO2] = a моль/л, [O2] = b моль/л, тогда по закону действия масс
, пусть [SO2] = a моль/л, [O2] = b моль/л, тогда по закону действия масс 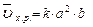
Уменьшение объема в 4 раза соответствует увеличению концентрации в системе в 4 раза, тогда:
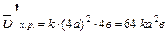 ;
;
 .
.
Влияние температуры на скорость химической реакции приближенно определяется правилом Вант-Гоффа. При повышении температуры на 100С скорость химической реакции возрастает в 2-4раза.
Математическая запись правила Вант-Гоффа: γ — температурный коэффициент скорости реакции или коэффициент Вант-Гоффа 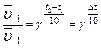 для большинства реакций лежит в пределах 2-4.
для большинства реакций лежит в пределах 2-4.
Задача. Во сколько раз изменится скорость химической реакции, протекающей в газовой фазе, если температура изменилась от 80 0С до 120 0С (γ = 3)?
В соответствии с правилом Вант-Гоффа записываем:

Увеличение скорости химической реакции при повышении температуры объясняется не только увеличением кинетической энергии взаимодействующих молекул. Например, число столкновений молекул растет пропорционально корню квадратному из абсолютной температуры . При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза
. При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза , а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
, а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
Энергия активации (EА) – это тот избыток энергии по сравнению со средним запасом, которым должны обладать молекулы для осуществления химической реакции. Если ЕА< 40 кДж/моль – реакции протекают быстро, если ЕА > 120 кДж/моль – реакции не идут, если ЕА = 40-120 кДж/моль – реакции протекают в обычных условиях. Повышение температуры снижает энергию активации, делает вещества более реакционно-способными, скорость взаимодействия при этом увеличивается.
Более точную зависимость скорости химической реакции от температуры установил C. Аррениус: константа скорости реакции пропорциональна основанию натурального логарифма, возведенного в степень ( –ЕА/RT).  ,
,
А – предэкспоненциальный множитель, определяет число активных соударений;
е – экспонента (основание натурального логарифма).
Логарифмируя выражение  , получим уравнение:
, получим уравнение:
 . Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
. Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
ВЛИЯНИЕ ДАВЛЕНИЯ НА СКОРОСТЬ РЕАКЦИИ На этой странице описывается и объясняется, как изменение давления газа изменяет скорость реакции. Факты Что происходит? Увеличение давления в реакции с участием реагирующих газов увеличивает скорость реакции. Изменение давления в реакции, в которой участвуют только твердые вещества или жидкости, не влияет на скорость. Пример При производстве аммиака по процессу Габера скорость реакции между водородом и азотом увеличивается за счет использования очень высокого давления. Фактически, основной причиной использования высоких давлений является повышение процентного содержания аммиака в равновесной смеси, но это также оказывает полезное влияние на скорость реакции. | ||
Примечание: Если вы хотите изучить равновесие, вы найдете эту тему в отдельном разделе сайта. | ||
Объяснение Связь между давлением и концентрацией Повышение давления газа — это то же самое, что повышение его концентрации. Если у вас есть заданная масса газа, вы можете увеличить его давление, чтобы сжать его до меньшего объема. Если у вас такая же масса в меньшем объеме, то его концентрация выше. Вы также можете показать это соотношение математически, если столкнулись с уравнением идеального газа : Перестановка дает: Поскольку «RT» постоянна, пока температура остается постоянной, это показывает, что давление прямо пропорционально концентрации.Если вы удвоите одно, вы также удвоите и другое. | ||
Примечание: Если у вас есть возможность выполнять вычисления с использованием уравнения идеального газа, но они вас не устраивают, возможно, вас заинтересует моя книга расчетов по химии. | ||
Влияние увеличения давления на скорость реакции Столкновения двух частиц Тот же аргумент применим независимо от того, включает ли реакция столкновение двух разных частиц или двух одинаковых частиц. Чтобы произошла какая-либо реакция, частицы должны сначала столкнуться. Это верно независимо от того, находятся ли обе частицы в газовом состоянии или одна является газом, а другая твердым телом. Если давление выше, вероятность столкновения выше. Реакции с участием только одной частицы Сложнее объяснить, если у вас есть реакции, в которых что-то происходит с одной частицей, а не в результате столкновения двух частиц.Связь между давлением и скоростью намного сложнее и варьируется от реакции к реакции. Это выше уровня А. | ||
Примечание: До мая 2017 года у меня здесь было упрощенное объяснение с точки зрения столкновений частиц, а затем, спустя 15 лет, когда страница находилась в сети, кто-то указал, что это нелогично! Прошу прощения за это. Существуют теории, которые показывают, что даже для мономолекулярных реакций (реакций с участием только одной молекулы) столкновения необходимы для того, чтобы молекулы приобрели энергию активации.Если вы хотите узнать об этом больше, вам придется заниматься химией на более высоком уровне. Вы можете погуглить, но вы найдете объяснения на высоком уровне и довольно математические. | ||
В меню ставок реакции. , , В меню «Физическая химия». , , В главное меню. , ,  © Джим Кларк, 2002 г. (последнее изменение — май 2017 г.) | ||
Скорость реакции
Скорость реакцииСкорость реакции
Скорость реакции
Для завершения химических реакций требуется разное время, в зависимости от характеристик реагентов и продуктов, а также условий, в которых протекает реакция. Химическая кинетика — это исследование скорости реакции, того, как скорость реакции изменяется в различных условиях и по какому механизму протекает реакция.
Какие факторы влияют на скорость реакции?
- Концентрация реагентов. Чем больше концентрация, тем быстрее скорость (обратите внимание, что в некоторых случаях на скорость может не влиять концентрация конкретного реагента, при условии, что он присутствует в минимальной концентрации). Помните, что для газов увеличение давления просто увеличивает концентрацию, так что это то же самое.
- Температура.Обычно реакции ускоряются с повышением температуры («повышение температуры на 100 ° C удваивает скорость»).
- Физическое состояние реагентов. Порошки реагируют быстрее, чем блоки — большая площадь поверхности, и, поскольку реакция происходит на поверхности, мы получаем более высокую скорость.
- Наличие (и концентрация / физическая форма) катализатора (или ингибитора). Катализатор ускоряет реакцию, ингибитор ее замедляет. Проверьте свои классные заметки — там должна быть диаграмма, показывающая влияние различных катализаторов на разложение перекиси водорода; нарисуйте его ниже.
- Свет. Свет определенной длины волны также может ускорить реакцию
Как температура влияет на скорость химической реакции? Когда два химических вещества вступают в реакцию, их молекулы должны сталкиваться друг с другом с достаточной энергией, чтобы реакция могла произойти. Это теория столкновений. Две молекулы будут реагировать только в том случае, если у них будет достаточно энергии. Нагревая смесь, вы повысите уровень энергии молекул, участвующих в реакции.Повышение температуры означает, что молекулы движутся быстрее. Это кинетическая теория. Если ваша реакция протекает между атомами, а не молекулами, вы просто заменяете слово «молекула» в своем объяснении.
Как катализаторы влияют на скорость реакции? Катализаторы ускоряют химические реакции. Требуются лишь очень незначительные количества катализатора для резкого изменения скорости реакции. Это действительно потому, что реакция протекает по другому пути, когда присутствует катализатор.Добавление дополнительного катализатора не имеет абсолютно никакого значения. На этом сайте есть целая страница, посвященная катализаторам.
Как концентрация влияет на скорость реакции? Увеличение концентрации реагентов увеличивает частоту столкновений между двумя реагентами. Итак, это снова теория столкновений. Когда происходят столкновения, они не всегда приводят к реакции. Если две сталкивающиеся молекулы обладают достаточной энергией, они вступят в реакцию. Если происходит реакция между веществом в растворе и твердым веществом, вы просто меняете концентрацию раствора.Эксперимент прост. Если реакция идет между двумя решениями, у вас небольшая проблема. Вы меняете концентрацию одного из реагентов или меняете концентрацию обоих? Вы можете обнаружить, что скорость реакции ограничена концентрацией более слабого раствора, и увеличение концентрации другого не имеет значения. Что вам нужно сделать, так это зафиксировать избыточную концентрацию одного из реагентов. Теперь вы можете увеличить концентрацию другого раствора, чтобы увеличить скорость реакции.
Как площадь поверхности влияет на химическую реакцию? Если один из реагентов является твердым веществом, площадь поверхности твердого вещества будет влиять на скорость реакции. Это связано с тем, что два типа молекул могут сталкиваться друг с другом только на границе раздела жидкое твердое тело, то есть на поверхности твердого тела. Таким образом, чем больше площадь поверхности твердого тела, тем быстрее будет реакция. Более мелкие частицы имеют большую площадь поверхности, чем более крупные частицы при той же массе твердого тела. Есть простой способ визуализировать это.Возьмите буханку хлеба и нарежьте ее ломтиками. Каждый раз, когда вы разрезаете новый ломтик, вы получаете дополнительную поверхность, на которую можно намазывать масло и джем. Чем тоньше вы нарежете ломтиками, тем больше у вас получится и тем больше масла и джема вы сможете на них положить. Это «Теория хлеба и масла». Вы должны были встретить эту идею на уроках биологии. Пережевывая пищу, вы увеличиваете площадь поверхности, что ускоряет пищеварение.
Как давление влияет на реакцию между двумя газами? Вы уже должны знать, что атомы или молекулы в газе очень разнесены.Чтобы два химических вещества вступили в реакцию, между их молекулами должны быть столкновения. Увеличивая давление, вы сжимаете молекулы вместе, так что вы увеличиваете частоту столкновений между ними. Это снова теория столкновений. В дизельном двигателе сжатие газовой смеси воздуха и дизельного топлива также увеличивает температуру, достаточную для сгорания. Повышение давления также приводит к повышению температуры. В бензиновом двигателе недостаточно для сгорания топлива, поэтому для бензиновых двигателей нужна свеча зажигания.После сжатия воздушно-бензиновой смеси искра свечи зажигает смесь. В обоих случаях реакция (горение) происходит очень быстро. Это потому, что как только реакция началась, выделяется тепло, и это заставит ее идти еще быстрее.
,Chem4Kids.com: Реакции: Скорость реакции
Скорость реакции — это скорость, с которой происходит химическая реакция. Если реакция имеет низкую скорость, это означает, что молекулы объединяются с меньшей скоростью, чем реакция с высокой скоростью. Некоторые реакции занимают сотни, может быть, даже тысячи лет, тогда как другие могут происходить менее чем за одну секунду. Если вы хотите думать об очень медленной реакции, подумайте о том, сколько времени требуется растениям и древним рыбам, чтобы превратиться в окаменелости (карбонизация).Скорость реакции также зависит от типа соединяющихся молекул. При низких концентрациях существенного элемента или соединения реакция будет медленнее.
Есть еще одна важная идея для скоростей реакции, называемая теория столкновений . Теория столкновений гласит, что чем больше столкновений в системе, тем больше будет на комбинаций молекул, отскакивающих друг от друга. Если у вас есть больше возможных комбинаций, вероятность того, что молекулы завершат реакцию, выше.Реакция будет происходить быстрее, что означает, что скорость этой реакции увеличится.
Подумайте о том, как медленно движутся молекулы в меде по сравнению с вашей газировкой, даже если они обе жидкости. В меде меньше столкновений из-за более сильных межмолекулярных сил (сил между молекулами). Большие силы означают, что мед имеет более высокую вязкость, чем газированная вода.
Реакции случаются — несмотря ни на что. Химические вещества всегда соединяются или распадаются.Реакции происходят снова и снова, но не всегда с одинаковой скоростью. Несколько вещей влияют на общую скорость реакции и количество возможных столкновений.Температура: Когда вы повышаете температуру системы, молекулы отскакивают намного сильнее. У них больше энергии . Чем больше они подпрыгивают, тем выше вероятность столкновения. Этот факт означает, что они также с большей вероятностью объединятся. Когда вы понижаете температуру, молекулы становятся медленнее и меньше сталкиваются.Это падение температуры снижает скорость реакции. В химическую лабораторию! Иногда вы будете смешивать растворы со льдом, чтобы температура системы оставалась низкой, а скорость реакции замедлялась.
Концентрация: Если в системе больше вещества, существует большая вероятность того, что молекулы столкнутся и увеличат скорость реакции. Если чего-то будет меньше, будет меньше столкновений и реакция, вероятно, будет происходить с меньшей скоростью.Иногда, когда вы находитесь в химической лаборатории, вы добавляете один раствор к другому. Если вы хотите, чтобы скорость реакции была ниже, вы добавляете только несколько капель за раз вместо всего стакана.
Давление: Давление: Давление влияет на скорость реакции, особенно когда вы смотрите на газы. Когда вы увеличиваете давление, у молекул становится меньше пространства, в котором они могут двигаться. Эта большая плотность молекул увеличивает количество столкновений. Когда вы уменьшаете давление, молекулы не так часто сталкиваются друг с другом, и скорость реакции снижается.
Давление также связано с концентрацией и объемом. Уменьшая объем, доступный молекулам газа, вы увеличиваете концентрацию молекул в определенном пространстве. Вы также должны помнить, что изменение давления в системе хорошо работает только для газов. Как правило, повышение давления не влияет на скорость реакции твердых и жидких веществ.
Как работает NIF (Лаборатория Лоуренса Ливермора)
,
Скорость реакций и теория столкновений Учебное пособие по химии
Измерение скорости реакции
Способ измерения скорости реакции зависит от природы реагентов и продуктов.
Вот некоторые измеримые количества:
- объем газа, выделяемого в единицу времени
- масса твердого вещества, образовавшегося в единицу времени
- интенсивности цвета в единицу времени
- изменение pH в единицу времени
- изменение температуры в единицу времени
Представьте себе эксперимент, в котором мы можем измерить количество продукта, образующегося в закрытом сосуде. 2
В начале эксперимента присутствуют только реагенты, продуктов еще нет, поэтому количество продукта равно нулю.
Но после этого производятся измеримые количества продукта, и мы записываем количество произведенного продукта каждую минуту (например).
Затем представьте, что мы повторяем эксперимент, сохраняя все переменные одинаковыми, ЗА ИСКЛЮЧЕНИЕМ нагрева всей системы.
Когда мы строим точки количества произведенного продукта в зависимости от времени для одной и той же реакции при двух разных температурах, мы получаем график, подобный приведенному ниже:
 | ____ высокотемпературный ____ низкотемпературный |
Начальный наклон графика показывает начальную скорость реакции.
У быстрой реакции будет более крутой наклон, чем у более медленной.
На приведенном выше графике красная линия представляет более быструю начальную скорость реакции, чем синяя линия , потому что наклон красной линии больше, чем наклон синей линии на ранних (начальных) стадиях. реакции.
Скорость реакции снижается по мере приближения реакции к равновесию.
По мере образования продуктов становится меньше реагирующих частиц, которые могут реагировать, что означает, что будет меньше успешных столкновений, поэтому скорость реакции снижается.
В состоянии равновесия концентрация реагента или концентрация продукта не меняется со временем.
В состоянии равновесия каждая линия на графике выше будет прямой горизонтальной линией.
Рабочий пример: скорость реакции цинка и соляной кислоты
Рассмотрим эксперимент, в котором мы добавляем соляную кислоту HCl (водн.) к чистому куску металлического цинка Zn (s) в открытом стакане.
Продуктами этой реакции будут водорастворимый хлорид цинка ZnCl 2 (водн.) и газообразный водород H 2 (г) .
Поскольку это «открытая система», в которой газообразный водород может улетучиваться, мы будем использовать одностороннюю стрелку →, чтобы показать, что реакция идет до завершения в одном направлении, как показано на сбалансированной химической реакции ниже:
Zn (т.) + 2HCl (водн.) → ZnCl 2 (водн.) + H 2 (г)
Для определения скорости реакции мы могли:
- Измерьте скорость исчезновения реагента:
Например, мы могли бы вынимать кусок цинка из стакана каждую минуту и взвешивать его отдельно, записывая его массу, прежде чем поместить его обратно в стакан и снова запустить таймер.
Со временем масса цинка уменьшится. - Измерьте скорость появления товара:
Например, мы могли бы использовать метод «вытеснения воды» для сбора газообразного водорода и измерения его объема каждую минуту.
Со временем объем газа увеличится.
Затем мы могли бы исследовать факторы, влияющие на скорость реакции, изменяя одну переменную за раз и повторяя эксперимент.
Например, мы могли бы изучить влияние изменения концентрации кислоты на реакцию по скорости, повторив эксперимент несколько раз, используя один и тот же объем кислоты, НО каждый раз используя другую концентрацию кислоты, сохраняя при этом все остальные переменные постоянными, то есть,
- одинаковый объем соляной кислоты во всех экспериментах
- одинаковая температура для всех экспериментов
- одинаковое атмосферное давление для всех экспериментов
- один и тот же чистый сухой стакан для всех экспериментов
- одинаковая масса цинка для всех экспериментов
- одинаковых размеров (ширина, высота и ширина) для куска цинка
(см. Учебное пособие по экспериментальному проектированию для получения дополнительных сведений о том, как разрабатывать собственные эксперименты.)
Если бы нам пришлось провести серию экспериментов для проверки каждой из переменных, которые, по нашему мнению, будут влиять на скорость реакции металлического цинка с соляной кислотой, мы бы получили результаты, подобные тем, которые приведены в таблице ниже:
| Переменная | Влияет на рейтинг | Пояснение |
|---|---|---|
| Концентрация | Увеличение концентрации HCl (водн.) увеличит скорость реакции. | Больше частиц HCl 3 означает, что будет больше столкновений между HCl (вод.) и Zn (s) . |
| Температура | Повышение температуры увеличивает скорость реакции. | частицы HCl получат больше кинетической энергии, увеличивая количество столкновений с атомами Zn. Больше частиц Zn (s) и HCl (водн.) будет обладать достаточной энергией для реакции, что приведет к более успешным столкновениям. |
| Размер частиц | Уменьшение размера частиц Zn (s) увеличит скорость реакции. | Уменьшение размера частиц Zn (s) увеличивает площадь поверхности, доступную для реакции с молекулами HCl (водный) , что приводит к большему количеству столкновений. |
| Скорость перемешивания | Увеличение скорости перемешивания этой смеси увеличивает скорость реакции. | Перемешивание будет удерживать мелкие частицы Zn (s) в суспензии, увеличивая площадь поверхности, доступную для столкновений, что приводит к увеличению скорости реакции. |