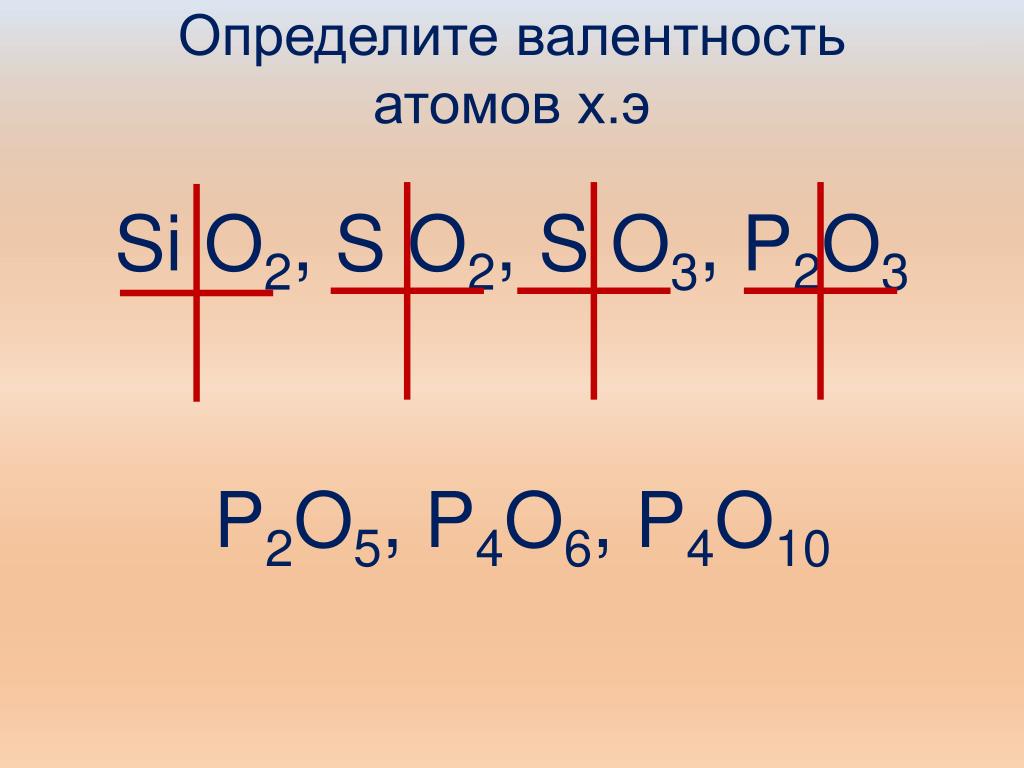
Валентность селена (Se), формулы и примеры
Общие сведения о валентности селена
В свободном состоянии селен образует несколько аллотропных видоизменений, из которых наиболее устойчивым является аморфный селен, представляющий собой красно-бурый порошок, и серый селен, образующий хрупкие кристаллы с металлическим блеском. Селен полупроводник.
Валентность селена в соединениях
Селен–тридцать четвертый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIA группе. В ядре атома селена содержится 34 протона и 45 нейтронов (массовое число равно 79). В атоме селена есть четыре энергетических уровня, на которых находятся 34 электрона (рис. 1).
Рис. 1. Строение атома селена.
Электронная формула атома селена в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что селен способен проявлять валентность II (низшая валентность) в своих соединениях (H2Se).
Для атома селена характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что селен проявляет в своих соединениях валентности IV (SeO2) и VI (H2SeO4) (высшая валентность).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Селен валентность — Справочник химика 21
Селен 5е, теллур Те и полоний Ро — р-элементы с конфигурацией валентных электронов [c. 336]
336] Это сходство с металлами указывает, что валентные электроны в германии не связаны с атомами столь прочно, как можно было бы ожидать для настоящего ковалентного каркасного кристалла. Мыщьяк, сурьма и селен существуют в одних модификациях в виде молекулярных кристаллов, а в других модификациях — в виде металлических кристаллов, хотя атомы в их металлических структурах имеют относительно низкие координационные числа. Известно, что теллур кристаллизуется в металлическую структуру, но довольно вероятно, что он может также существовать в виде молекулярного кристалла. Положение астата в периодической таблице заставляет предположить наличие у него промежуточных свойств, однако этот элемент еще не исследован подробно.
Селен 5е, теллур Те и полоний Ро — р-элементы с конфигурацией валентных электронов Некоторые сведения об этих элементах, а также кислороде и сере, приведены ниже [c.
 363]
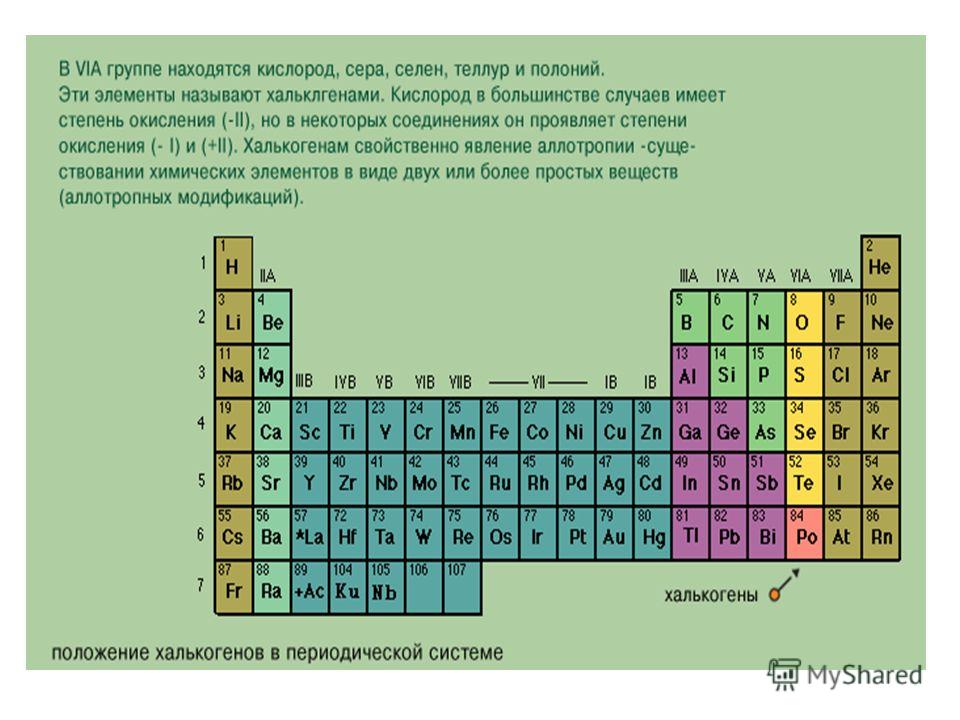
363]VI группа, главная подгруппа кислород, сера, селен, теллур, полоний. На внешнем уровне атомов этих элементов по шесть электронов П5 Первые четыре элемента имеют ярко выраженные неметаллические свойства. Их называют халькогенами ( образующими руды ), полоний — редкий, малоизученный элемент. Во внешнем уровне атома кислорода нет -подуровня, как и у атомов других элементов 11 периода периодической системы, поэтому кислород проявляет валентность, равную 2, остальные халькогены — 2, 4, 6. Валентность 2 соответствует невозбужденному состоянию атома, 4 —состоянию -возбуждения, 6 — состоянию 5 -возбуждения электронных облаков атома. [c.233]
Главную подгруппу шестой группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы имеют электронные конфигурации внешнего валентного слоя типа ns np (гг=2, 3, 4 и 5 соответственно у кислорода, серы, селена и теллура (см. табл.. 1), что обусловливает прежде всего окислительные свойства этих элементов, хотя при переходе от кислорода к теллуру и полонию окислительная способность элементов резко ослабляется. [c.288]
[c.288]
При сопоставлении свойств серы и элементов обеих следующих за ней подгрупп наблюдается соответствие основных данных опыта учению об электронных аналогах в производных высшей валентности аналогия серы с элементами подгруппы хрома выражена сильнее, чем с селеном и теллуром напротив, в соединениях низших валентностей имеет место аналогия по ряду 5—5е—Те, тогда как члены подгруппы хрома теряют сходство с серой.
Во внешнем электронном уровне атомов этих элементов по. шесть электронов вследствие чего они имеют сильно выраженный неметаллический характер (кроме полония, химия которого мало изучена). Электроотрицательность их выше, чем у элементов подгруппы азота. В соединениях с водородом и металлами кислород, сера, селен и теллур проявляют нормальную валентность, равную двум окислительное число —2. [c.306]
Такнм образом, атом кислорода с двумя валентными р-электронами образует изогнутую (угловую) молекулу воды.
При переходе в возбужденное состояние (что имеет место при поглощении энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 35-электроны (показано стрелками). Число неспаренных электронов, а следовательно, и валентность в первом случае будут равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, б будут иметь и аналоги серы —селен, теллур и полоний, а их степени окисления будут равны —2, +2, +4 и 4-6- [c.240]
Таким образом, атом кислорода с двумя неспаренными (валентными) р-электронами образует с водородом молекулу воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовать с водородом аналоги кислорода—сера, селен, теллур.

Это правило действует, когда между атомами образуются прочные химические связи. Например, атомы галогенов имеют 7 валентных электронов. Они образуют молекулы р2, СЦ, Вгг и Ь. Следовательно, координационное число г этих атомов (т. е. число ближайших соседних атомов) равно единице. Это справедливо не только для твердых и жидких, но и газообразных галогенов до тех пор, пока под влиянием высокой температуры молекулы не распадаются на атомы. Атомы кислорода, серы, селена и теллура имеют 6 валентных электронов. Согласно правилу 8—N эти вещества должны иметь структуру с координационным числом 2. И, действительно, сера, селен и теллур образуют цепочечные или кольцевые молекулы, в которых каждый атом имеет два соседа, г =2. [c.171]
Какую валентность могут проявлять сера, селен и теллур [c.360]
Сопротивление скольжению определяется прежде всего характером сил связи между его структурными элементами. Так, например, валентная связь, обладающая строгой направленностью, резко ослабевает уже при незначительных смещениях атомов относительно друг друга. При сдвиге эта связь разрушается раньше, чем атомы успевают устанавливать ее с другими своими соседями. Поэтому кристаллы валентного типа (кремний, германий, мышьяк, селен, сурьма и др.) не проявляют заметной способности к пластической деформации. По исчерпании упругой деформации они хрупко разрушаются. Напротив, металлическая связь, не имеющая направленного характера, меняется очень слабо при тангенциальных смещениях атомов относительно друг друга. Поэтому возможны большие смещения одних частей решетки относительно других, что и определяет высокую степень пластичности (и даже сверхпластичность металлов [131).
При сдвиге эта связь разрушается раньше, чем атомы успевают устанавливать ее с другими своими соседями. Поэтому кристаллы валентного типа (кремний, германий, мышьяк, селен, сурьма и др.) не проявляют заметной способности к пластической деформации. По исчерпании упругой деформации они хрупко разрушаются. Напротив, металлическая связь, не имеющая направленного характера, меняется очень слабо при тангенциальных смещениях атомов относительно друг друга. Поэтому возможны большие смещения одних частей решетки относительно других, что и определяет высокую степень пластичности (и даже сверхпластичность металлов [131).
По химическим свойствам селен и теллур сходны с серой, однако для селена и теллура характерны более слабые окислительные и более сильные восстановительные свойства. Это обусловлено большим удалением валентных электронов от ядра в атомах 5е и Те, что облегчает отдачу электронов. Например, теллур может выступать восстановителем в реакции с водой [c. 142]
142]
В патентной и технической литературе указывается на множество попыток ускорить процесс окисления сырья и придать определенные свойства окисленному битуму, применяя окислители, катализаторы и инициаторы. Так, в качестве окислителей предложено применять кислород, озон, серу, хлор, бром, иод, селен, теллур, азотную и серную кислоты, марганцовокислый калий и др. В качестве катализаторов окислительно-восстановительных реакций — соли соляной кислоты и металлов переменной валентности (железа, меди, олова, титана и др.) в качестве катализаторов алкилирования, дегидратации, крекинга (переносчика протонов) предложены хлориды алюминия, железа, олова, пятиокиси фосфора и т. п. в качестве инициаторов окисления — перекиси и др. Большинство из них инициирует реакции уплотнения молекул сырья в асфальтены, не обогащая битумы кислородом. [c.157]
Теллур как элементарное вещество в обычных условиях представлен только одной формой. На рис. 3.2 показана форма, по структуре аналогичная серому селену межатомное расстояние Те—Те 2,835 А, валентный угол 103,2°, вещество является полупроводником, однако по сравнению с селеном обладает гораздо меньшей величиной электрического сопротивления. При нагревании под давлением свыше 70 кбар образуется аллотропная модификация, соответствующая металлическому состоянию р-формы полония и принадлежащая к ромбоэдрической структурной системе. В газовой фазе устойчивыми являются формы Тег и Те, обладающие парамагнитными свойствами.
При нагревании под давлением свыше 70 кбар образуется аллотропная модификация, соответствующая металлическому состоянию р-формы полония и принадлежащая к ромбоэдрической структурной системе. В газовой фазе устойчивыми являются формы Тег и Те, обладающие парамагнитными свойствами.
В хлорной воде присоединение хлора идет достаточно медленно для того, чтобы почти количественно образовывался этиленхлоргидрин (см. стр. 370). Реакции олефинов с хлором и бромом в жидкой фазе идут обычно исключительно быстро 130], и применение растворителя, как правило, сказывается благоприятно. Этилен легко хлорируется при низких температурах в дихлорэтаповом растворе, как это применяется в промышленности. Хлориды элементов, образующих с хлором соединения высшей и низшей валентностей, как сурьма, железо, селен, являются эффективными катализаторами присоединения хлора к этилену. Присутствие полярных веществ можот катализировать присоединение галоидов например, реакция брома с этиленом в гааовой фазе сильно ускоряется, если стенки реактора покрыты стеариновой кислотой, но скорость реакции приближается к нулю, если стенки покрыты парафином [64]. Степень замещения хлором при реакции олефинов с хлором, как показано в табл. 3, поразительно велика [80]. Реакция замещения часто сопровождается перемещением двойной связи. [c.364]
Степень замещения хлором при реакции олефинов с хлором, как показано в табл. 3, поразительно велика [80]. Реакция замещения часто сопровождается перемещением двойной связи. [c.364]
В этих схемах полной стрелкой показано положение координационной связи. Фигурирующие здесь донорные элементы (сера, -мышьяк и азот), а также селен, фосфор и другие не образуют соединений, обладающих свойства.ми каталитических ядов, если они находятся в состоянии наивысшей валентности, поскольку в этом случае молекулы не обладают парами свободных электронов. То же справедливо для ионов этих элементов. Например, сульфит-ион является ядом, в то время как сульфат-ион им не является [c.50]
Сера, селен и теллур образуют по два окисла обш,ей формулы ЭОз (SO2, SeOa) и ЭО3 (SO3, ТеОз), соответствующие валентностям +4 и +6. [c.72]
Очень важно обратить внимание на следующее. Если в малых периодах с увеличением заряда ядер атомов все химические свойства элементов изменяются последовательно, то в больших периодах некоторые свойства элементов повторяются внутри самого периода. Например, в четвертом периоде молвыделить пары элементов, которые при одинаковой валентности образуют сходные по форме и по некоторым свойствам соедпнения. К таким элементам относятся марганец и бром, хром и селен, ванадий и мышьяк и другие (НМпО и НВГО4 Н2СГО4 и Н25е04). [c.57]
Например, в четвертом периоде молвыделить пары элементов, которые при одинаковой валентности образуют сходные по форме и по некоторым свойствам соедпнения. К таким элементам относятся марганец и бром, хром и селен, ванадий и мышьяк и другие (НМпО и НВГО4 Н2СГО4 и Н25е04). [c.57]
Например, хлор находится в VH группе. Его высшая положительная валентность равна +7 отрицательная валентность равна —1 (8 —7 = 1). Фосфор находится в V группе, его валентности +5 и —3 селен находится в VI группе, его валентности +6 и —2 и т. д. Имеются исключения. Например, бор —элемент И1 группы—дает соединения состава В2О3 и ВНд, в которых этот элемент формально может рассматриваться как +3- и —3-валентный. [c.88]
Химические свойства. Железо является металлом со средней восстановительной активностью. При окислении его слабыми окислителями получаются производные двухвалентного железа сильные окислители переводят его в трехвалентное состояние. Эти два валентных состояния являются наиболее устойчивыми, хотя известны соединения железа с валентностью 1, 4 и 6. Являясь аналогом рутения и осмия (аналогия по подгруппе), железо имеет также много сходного с кобальтом и никелем (аналогия по периоду). При определенных условиях оно вступает в реакции почти со всеми неметаллами. При невысоких температурах (до 200° С) железо в атмосфере сухого воздуха покрывается тончайшей оксидной пленкой, предохраняющей металл от дальнейшего окисления. При высокой температуре оно сгорает в атмосфере кислорода с образованием Fe Oi. Во влажном воздухе и кислороде окисление идет с получением ржавчины 2Fe20a HgO. Галогены активно окисляют железо с образованием галидов FeHlgj или FeHlgg (иодид железа (III) не образуется). При нагревании железо соединяется с серой и селеном, образуя сульфиды и селениды. В реакциях с азотом и фосфором получаются нитриды и фосфиды в случае малых концентраций азота образуются твердые растворы внедрения. Нагревание с достаточным количеством [c.348]
Являясь аналогом рутения и осмия (аналогия по подгруппе), железо имеет также много сходного с кобальтом и никелем (аналогия по периоду). При определенных условиях оно вступает в реакции почти со всеми неметаллами. При невысоких температурах (до 200° С) железо в атмосфере сухого воздуха покрывается тончайшей оксидной пленкой, предохраняющей металл от дальнейшего окисления. При высокой температуре оно сгорает в атмосфере кислорода с образованием Fe Oi. Во влажном воздухе и кислороде окисление идет с получением ржавчины 2Fe20a HgO. Галогены активно окисляют железо с образованием галидов FeHlgj или FeHlgg (иодид железа (III) не образуется). При нагревании железо соединяется с серой и селеном, образуя сульфиды и селениды. В реакциях с азотом и фосфором получаются нитриды и фосфиды в случае малых концентраций азота образуются твердые растворы внедрения. Нагревание с достаточным количеством [c.348]
Селен — металл черного цвета с атомной массой 79, валентностью 2 4 тотностью 4,8 г/см , температурой плавления 217 С, удельным эчек-тросонрогнвлеинем 0,12 Qm-mu при 0 С Твердость селеновых покрытий 3—3 5 ГПа [c. 156]
156]
Селен 8е, теллур Те и полоний Ро — имеют конфигурацию валентных электронов б2р4 [c.366]
В этот же период зародилось учение о валентности (Ф. Кекуле, Ш. Вюрц и др.), стали известными иовые хим. элементы (бор, литий, кадмий, селен, кремний, бром, алюминий, иод, торий, ванадий, лантан, эрбий, тербий, диспрозий, рутеш й, ниобий), с помощью введенного в практику спектр, анализа было доказано существование цезия, рубидия, таллия и индия. Было проведено определение и уточнение атомных масс мн. хим. элементов. [c.211]
Одно из самых наглядных достоинств периодической системы заключается в возможности предсказания с ее помощью наиболее вероятной валентности элемента. Элементы групп I — III, как правило, характеризуются степенью окисления 1, 2 и 3 соответственно. Степень окисления почти всех остальных элементов соответствует номеру их группы, однако возможны отклонения, особенно для элементов центральной части периодической таблицы. Например, элементы Ti, V, Сг, Мп, относящиеся к группам IVE, VB, VIE и VIIE, обнаруживают соответствующие этим группам степени окисления, хотя это не всегда наиболее типичные или устойчивые состояния для указанных металлов. Далее, все лантаноиды (редкоземельные металлы) относятся к III группе, и несмотря на то, что они характеризуются различными степенями окисления, для всех них наиболее типична степень окисления -t-3. У неметаллов, например галогенов, относящихся к VII группе, проявляются степени окисления 7 и — 1, у элементов VI группы, таких, как кислород, сера, селен и теллур, наиболее распространена степень окисления —2. Вместе с тем элементы IV группы — углерод, кремний и германий—почти всегда четырехвалентны. Таким образом, имеется возможность довольно надежно предсказывать наиболее вероятную степень окисления элемента по его положению в периодической таблице тем не менее следует пользоваться периодической таблицей лишь как полезным ориентиром, не считая ее непогрешимым источником сведений о степенях окисления элементов.
Например, элементы Ti, V, Сг, Мп, относящиеся к группам IVE, VB, VIE и VIIE, обнаруживают соответствующие этим группам степени окисления, хотя это не всегда наиболее типичные или устойчивые состояния для указанных металлов. Далее, все лантаноиды (редкоземельные металлы) относятся к III группе, и несмотря на то, что они характеризуются различными степенями окисления, для всех них наиболее типична степень окисления -t-3. У неметаллов, например галогенов, относящихся к VII группе, проявляются степени окисления 7 и — 1, у элементов VI группы, таких, как кислород, сера, селен и теллур, наиболее распространена степень окисления —2. Вместе с тем элементы IV группы — углерод, кремний и германий—почти всегда четырехвалентны. Таким образом, имеется возможность довольно надежно предсказывать наиболее вероятную степень окисления элемента по его положению в периодической таблице тем не менее следует пользоваться периодической таблицей лишь как полезным ориентиром, не считая ее непогрешимым источником сведений о степенях окисления элементов. [c.105]
[c.105]
Наивысший известный фторид кислорода — ОРг, а сера, селен и теллур образуют гексафториды. Действием электрического разряда на смеси Ог—Рг при низких температурах получен 04р2 наряду с ОаРа, но единственные фториды, содержащие связи 5—5, 5е—5е или Те—Те, — это ЗгРг, ЗгРю и ТегРю- Как н во многих других случаях, эти три элемента проявляют свою высшую валентность в соединениях с фтором, и фтор — это единственный элемент, с которым сера образует шесть связей. [c.193]
Элементы кислород О, сера 8, селен 8е, теллур Те и полоний Ро составляют У1А-группу Периодической системы Д.И. Менделеева. Групповое название этих элементов — халькогены, хотя кислород часто рассматривают отдельно. Валентный уровень атомов отвечает электронной формуле ир . Кислород — второй по электроотрицательности неметалл (после наиболее электроотрицательного фтора). Его устойчивая степень окисления —П положительная степень окисления у кислорода проявляется только в его соединениях с фтором. Остальные элементы У1А-группы проявляют в соединениях степени окисления -П, IV и -нУ , причём для серы устойчива степень окисления +У1, а для остальных элементов -1-1У. Судя по значениям электроотриц 1тельности, О и 8 — неметаллы, 8е, Те и Ро — амфотерные элементы с преобладанием неметаллических (8е, Те) или металлических свойств(Ро). [c.139]
Остальные элементы У1А-группы проявляют в соединениях степени окисления -П, IV и -нУ , причём для серы устойчива степень окисления +У1, а для остальных элементов -1-1У. Судя по значениям электроотриц 1тельности, О и 8 — неметаллы, 8е, Те и Ро — амфотерные элементы с преобладанием неметаллических (8е, Те) или металлических свойств(Ро). [c.139]
Селен, теллур, полоний. Селен устойчив в виде аллотропном модификации серого цвета, расстояние Se—Se 2,37 А, валентный угол 103°, в целом структура представляет собой агрегат из компактно сложенных спиралеобразных цепей (рис. 3.2). Сточки зрения электрического сопротивления это вещество является полупроводником с ззмечательны.ми свойствами (разд. 7 настоящей главы). При облучении светом его электропроводность возрастает, поэтому селен используют в фотоэлементах и солнечных батареях. Помимо этой формы известна модификация, напоминающая ромбическую серу и имеющая в основе циклическую структуру Ses (расстояние Se—Se 2,34 А, валентный угол 105°), существующую в двух аллотропных разновидностях а- и 3-формы. Обе они красного цвета, относятся к моноклинной сингонии и во всех отношениях проявляют свойства неметаллов, причем, будучи нагреты до 75 °С, превращаются в стабильную форму. Пары селена парамагнитны и состоят из молекул Se2 и Se. [c.107]
Обе они красного цвета, относятся к моноклинной сингонии и во всех отношениях проявляют свойства неметаллов, причем, будучи нагреты до 75 °С, превращаются в стабильную форму. Пары селена парамагнитны и состоят из молекул Se2 и Se. [c.107]
По своим химическим свойствам сера занимает п-ро межуточное Me to между кислородом и селеном все три элемента 1При адлежат к шестой группе периодической системы. В своей низшей валентности сера находится в сернистом водороде —2) и в высшей — в верной кислоте (+6). [c.393]
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.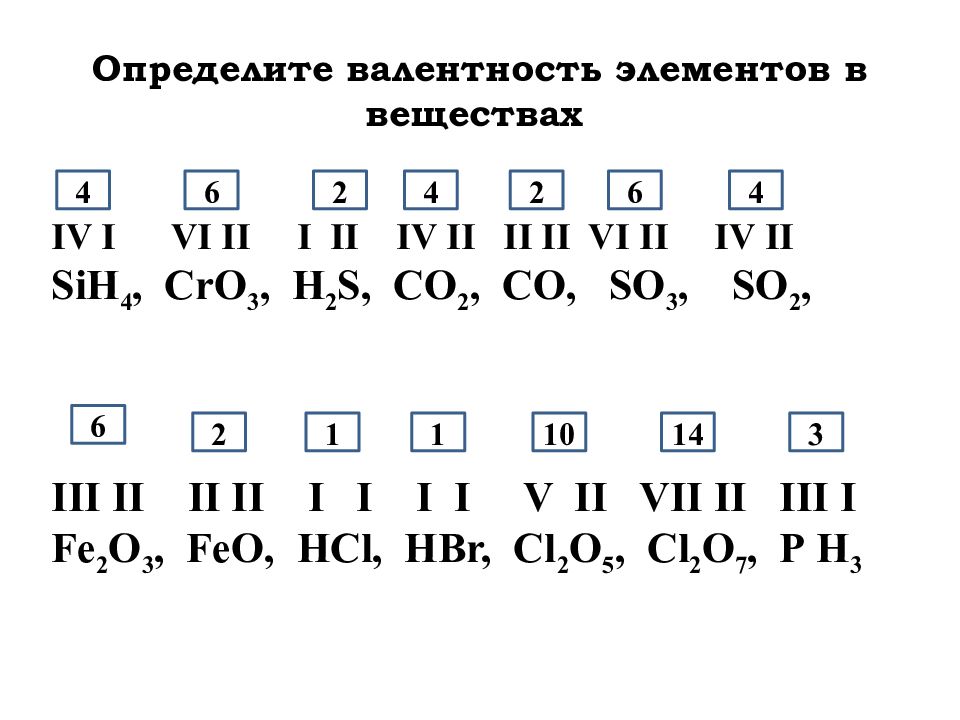
youtube.com/embed/WzNbdAhBPak» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/qEFVz-qrPmc» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных [Решение №18548]
Напишите мне в whatsapp, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
Закажите у меня новую работу, просто написав мне в whatsapp! |
Описание заказа и 38% решения ( + фото):
Для платины и селена: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных электронов, в) укажите количество неспаренных электронов, г) укажите валентные возможности атома, д) охарактеризуйте валентные электроны с помощью квантовых чисел, е) укажите суммарный спин системы.
Ответ:
Платина является элементом периода группы Периодической системы, имеет порядковый номер . Поэтому атом платины содержит электронов, которые находятся на энергетических уровнях. а) В атоме платины наблюдается проскок электрона с подуровень. Полная электронная формула: б) Валентные электроны: в) Графическая формула валентных электронов: в) В основном состоянии количество неспаренных электронов равно . г) Валентные возможности определяются количеством неспаренных электронов, поэтому валентность платины равна . д) Квантовые числа валентных электронов: е) Суммарный спин системы равен: Селен является элементом периода группы Периодической системы, имеет порядковый номер . Поэтому атом селена содержит электрона, которые находятся на энергетических уровнях. а) Полная электронная формула: б) Валентные электроны: в) Графическая формула валентных электронов: в) В основном состоянии количество неспаренных электронов равно . г) Валентные возможности определяются количеством неспаренных электронов, поэтому валентность селена в основном состоянии равна . При сообщении атому селена дополнительной энергии он переходит в возбужденное состояние с переходом электронов с -подуровень: В этом состоянии имеется неспаренных электрона, валентность селена равна . Также возможно следующее возбужденное состояние: Имеется неспаренных электронов, валентность селена равна . д) Квантовые числа валентных электронов селена в основном состоянии: е) Суммарный спин системы равен:
При сообщении атому селена дополнительной энергии он переходит в возбужденное состояние с переходом электронов с -подуровень: В этом состоянии имеется неспаренных электрона, валентность селена равна . Также возможно следующее возбужденное состояние: Имеется неспаренных электронов, валентность селена равна . д) Квантовые числа валентных электронов селена в основном состоянии: е) Суммарный спин системы равен:
Похожие готовые решения по химии:
- Как определить положение элемента в периодической системе по его электронной формуле? Электронная формула валентных электронов атома некоторого
- Какие свойства характерны для соединений с молекулярной кристаллической решеткой. Определите тип кристаллической решетки для каждого вещества: Mg; NO2; KI; SiO2; O2
- Различают геометрические формы молекул правильные, искаженные и незавершенные. Объясните, от каких факторов зависит та или иная форма молекулы
- Постройте диаграмму МО гетероатомной молекулы ВN.
 Определите порядок связи и магнитные свойства. Что легче ионизовать: молекулу или атомы, из которых
Определите порядок связи и магнитные свойства. Что легче ионизовать: молекулу или атомы, из которых - Рассчитайте массовую долю кислоты аскорбиновой в «Solutio Acidi ascorbinicipro injectionibus», если на 5 мл раствора пошло 5,9 мл 0,5 н раствора йодата калия. Плотность
- Для молибдена и селена: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных
- На примере оксидов элементов третьего периода покажите закономерность изменения основных свойств. Приведите уравнения реакций
- Для бария и ртути: а) запишите полную электронную формулу, б) запишите формулу валентных электронов, в) изобразите графическую формулу валентных
химический элемент Селен Selenium — «Химическая продукция»
Что такое
Селен, selenium, характеристики, свойстваСелен — это химический элемент Se химический элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам.
Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам.
Селен класс химических элементов
Элемент Se — относится к группе, классу хим элементов (…) химический элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам.
Элемент Se свойство химического элемента Селен Selenium
Основные характеристики и свойства элемента Se…, его параметры.
Применение Селен Selenium Элемент Se
Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с высоким усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве источника гамма-излучения для дефектоскопии.
- Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл).
- Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия и кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод самовосстанавливается при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным.
 К недостаткам селеновых выпрямителей относятся их значительные габариты.
К недостаткам селеновых выпрямителей относятся их значительные габариты. - Соединения селена применяются для окрашивания стекла в красный и розовый цвет. Обычно используют металлический селен и селенистокислый натрий Na2SeO3. Красные стекла, окрашенные селеном, называют селеновым рубином. Селен применялся при производстве стекла рубиновых звёзд Кремля
Применение селена в медицине
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Из-за его влияния на репарацию ДНК, апоптоз, эндокринную и иммунную системы, а также другие механизмы, включая его антиоксидантные свойства, селен может играть роль в профилактике рака. Согласно исследованиям, прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки на 58 %, опухолями простаты — на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе.
Токсичность
Общий характер воздействия селена и его соединений
Селен и его соединения ядовиты , по характеру действия несколько напоминает мышьяк ; обладает политропным действием с преимущественным поражением печени, почек и ЦНС . Металлический селен менее ядовит. Из неорганических соединений селена наиболее токсичными являются селеноводород, диоксид селена (ЛД 50 = 1,5 мг/кг, крысы, интратрахеально) и селениты натрия (ЛД 50 = 2,25 мг/кг, кролик, перорально) и лития (ЛД 50 = 8,7 мг/кг, крысы, перорально). Особенно токсичен селеноводород, однако, ввиду его отвратительного запаха, ощущаемого даже в ничтожных концентрациях (0,005 мг/л), удаётся избежать отравлений. Органические соединения селена, такие как алкил- или арил-производные (например, диметилселен , метилэтилселен или дифенилселен ), являются сильнейшими нервными ядами, с очень отвратительными запахами; так, порог восприятия для диэтилселена составляет 0,0064 мкг/л.
Органические соединения селена, такие как алкил- или арил-производные (например, диметилселен , метилэтилселен или дифенилселен ), являются сильнейшими нервными ядами, с очень отвратительными запахами; так, порог восприятия для диэтилселена составляет 0,0064 мкг/л.
Отравление
При попадании металлического порошкового селена в количестве 1 грамма перорально вызывает боль в животе в течение двух суток и учащённый стул, со временем симптомы проходят.
Действие на кожу
Соли селена при непосредственном соприкосновении с кожей вызывают ожоги и дерматиты. Диоксид селена при контакте с кожей способен вызывать резкую боль и онемение. При попадании на слизистые оболочки соединения селена могут вызывать раздражение и покраснение, при попадании в глаза резкую боль, слезотечение и конъюктивит .
формула химического элемента Селен Selenium
Химическая формула Селена:
Атомы Селен Selenium химических элементов
Атомы Selenium хим. элемента
Selenium Селен ядро строение
Строение ядра химического элемента Selenium — Se,
История открытия Селен Selenium
Открытие элемента Selenium — Элемент открыт Й. Я. Берцелиусом в 1817.
Я. Берцелиусом в 1817.
Сохранился рассказ самого Берцелиуса о том, как произошло это открытие:
Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме.
Обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура.
Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию.
Масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.
В 1873 году Уиллоуби Смит обнаружил, что электрическое сопротивление серого селена зависит от освещённости. Это свойство стало основой для чувствительных к свету ячеек. Первый коммерческий продукт на основе селена был представлен на рынке в середине 1870-х годов Вернером фон Сименсом. Селеновая ячейка использовалась в фотофоне, созданном Александром Беллом в 1879 году.
Электрический ток, проходящий через селен, пропорционален количеству света, падающему на его поверхность, — это свойство использовано в различных измерителях освещённости (экспонометрах). Полупроводниковые свойства селена нашли применение в других областях электроники. В 1930-е годы началось развитие селеновых выпрямителей, которые пришли на смену медно-закисным выпрямителям благодаря высокой эффективности Селеновые выпрямители использовались до 1970-х годов, когда им на смену пришли кремниевые выпрямители.
В более позднее время была обнаружена токсичность селена. Были зарегистрированы случаи отравления людей, работавших на селеновых производствах, а также животных, поедавших богатые селеном растения. В 1954 году были обнаружены первые признаки биологического значения селена для микроорганизмов. В 1957 году была установлена важная роль селена в биологии млекопитающих. В 1970-е годы было показано наличие селена в двух независимых группах энзимов, а затем обнаружен селеноцистеин в белках. В 1980-е годы было установлено, что селеноцистеин кодируется кодоном UGA. Механизм кодирования был установлен сначала для бактерий, а затем для млекопитающих (SECIS-элемент).
Селен Selenium происхождение названия
Откуда произошло название Selenium …
Распространённость Селен Selenium
Как любой хим. элемент имеет свою распространенность в природе, Se …
Получение Селен Selenium
Selenium — получение элемента
Физические свойства Селен Selenium
Основные свойства Selenium
Изотопы Selenium Селен
Наличие и определение изотопов Selenium
Изотопы
Селен в природе состоит из 6 изотопов: 74Se (0,87 %), 76Se (9,02 %), 77Se (7,58 %), 78Se (23,52 %), 80Se (49,82 %), 82Se (9,19 %). Из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7⋅1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94. Из искусственных изотопов применение нашел 75Se как источник гамма-излучения для неразрушающего контроля сварных швов и целостности конструкций.
Из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7⋅1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94. Из искусственных изотопов применение нашел 75Se как источник гамма-излучения для неразрушающего контроля сварных швов и целостности конструкций.
Периоды полураспада некоторых радиоактивных изотопов селена:
| Изотоп | Распространённость в природе, % | Период полураспада |
|---|---|---|
| 73Se | — | 7,1 час. |
| 74Se | 0,87 | — |
| 75Se | — | 120,4 сут. |
| 76Se | 9,02 | — |
| 77Se | 7,58 | — |
| 77mSe | — | 17,5 сек. |
| 78Se | 23,52 | — |
| 79Se | — | 6,5⋅104 лет |
| 79mSe | — | 3,91 мин. |
| 80Se | 49,82 | — |
| 81Se | — | 18,6 мин. |
| 81mSe | — | 62 мин. |
| 82Se | 9,19 | 9,7⋅1019 лет |
| 83mSe | — | 69 сек. |
| 83Se | — | 25 мин. |
Se свойства изотопов Селен Selenium
…
Химические свойства Селен Selenium
Определение химических свойств Selenium
Меры предосторожности Селен Selenium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Selenium
Стоимость Селен Selenium
Рыночная стоимость Se, цена Селен Selenium
Происхождение названия
Название происходит от греч. σελήνη — Луна . Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Нахождение в природе
Натуральный селен
Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы.
Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы.
37 минералов селена
Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены
- ашавалит FeSe,
- клаусталит PbSe,
- тиманнит HgSe,
- гуанахуатит Bi 2 (Se, S) 3 ,
- хастит CoSe 2 ,
- платинит PbBi 2 (S, Se) 3 ,
- ассоциирующие с различными сульфидами,
- а иногда также с касситеритом .
Изредка встречается самородный селен . Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 0,4 мкг/л. На территории Кавказских Минеральных Вод есть источник с содержанием биогенного Se более 50 мкг/л .
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра . Применяют несколько способов получения: окислительный обжиг с возгонкой SeO 2 ; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO 2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементного селена действием SO 2 .
Применяют несколько способов получения: окислительный обжиг с возгонкой SeO 2 ; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO 2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементного селена действием SO 2 .
Физические свойства
Монокристаллический селен (99,9999 %)
Аллотропных модификаций селена
Твёрдый селен имеет несколько аллотропных модификаций :
- Серый селен (γ-Se, «металлический селен») — наиболее устойчивая модификация с гексагональной кристаллической решёткой;
- Красный кристаллический селен — три моноклинные модификации: оранжево-красный α-Se, тёмно-красный β-Se, красный γ-Se;
- Красный аморфный селен;
- Чёрный стекловидный селен.
При нагревании серого селена он даёт серый же расплав, а при дальнейшем нагревании испаряется с образованием коричневых паров. При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
Химические свойства
Селен — аналог серы и проявляет степени окисления −2 (H 2 Se), +4 (SeO 2 ) и +6 (H 2 SeO 4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (−2) — гораздо более сильные восстановители, чем соответствующие соединения серы.
Простое вещество селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно. Окислить селен удаётся только при дополнительном нагревании, при котором он медленно горит синим пламенем, превращаясь в двуокись SeO 2 . Со щелочными металлами селен реагирует (весьма бурно), только будучи расплавленным.
В отличие от SO 2 , SeO 2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO 2 + H2 O → H2 SeO 3 ) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO 3 ), получают селеновую кислоту H2 SeO 4 , более сильную, чем серная.
А действуя на неё сильным окислителем (например, HClO 3 ), получают селеновую кислоту H2 SeO 4 , более сильную, чем серная.
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина . Является необходимым для жизни микроэлементом , но большинство соединений достаточно токсичны (селеноводород , селеновая и селенистая кислота ) даже в средних концентрациях.
Роль селена в организме человека
В организме человека содержится 10—14 мг селена, бо́льшая его часть сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин. Селен присутствует в ядре клетки.
Суточная потребность человека в селене составляет 70-100 мкг. Повышенное содержание селена в организме может приводить к депрессии, тошноте, рвоте, диарее, поражению ЦНС и др.
Согласно данным эпидемиологических исследований 1990-х годов, более чем у 80 % россиян наблюдается дефицит селена
Селен в организме взаимодействует с витаминами, ферментами и биологическими мембранами, участвует в регуляции обмена веществ, в обмене жиров, белков и углеводов, а также в окислительно-восстановительных процессах. Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. Селен входит в активный центр ферментов системы антиоксидантно-антирадикальной защиты организма, метаболизма нуклеиновых кислот, липидов, гормонов (глутатионпероксидазы, йодотиронин-дейододиназы, тиоредоксинредуктазы, фосфоселенфосфатазы, фосфолипид-гидропероксид-глутатионпероксидазы, специфических протеинов Р и W и др.).
Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. Селен входит в активный центр ферментов системы антиоксидантно-антирадикальной защиты организма, метаболизма нуклеиновых кислот, липидов, гормонов (глутатионпероксидазы, йодотиронин-дейододиназы, тиоредоксинредуктазы, фосфоселенфосфатазы, фосфолипид-гидропероксид-глутатионпероксидазы, специфических протеинов Р и W и др.).
Селен входит в состав белков мышечной ткани, белков миокарда. Также селен способствует образованию трийодтиронина (гормонов щитовидной железы).
Селен является синергистом витамина E и иода . При дефиците селена иод плохо усваивается организмом. Согласно исследованиям, селен необходим для нормального функционирования иммунной системы. Он задействован в механизмах противодействия вирусным инфекциям, включая ВИЧ. Было доказано, что у пациентов, уже заразившихся ВИЧ, он замедляет переход заболевания в СПИД.
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Se
элемент Se
Селекор
Категория препарата: Микроэлементные корректоры
Состав:
Селен в 2-х валентной форме — 70мкг
Вы можете купить Селекор-Макси в нашем интернет-магазине, либо офисе
Биологичекая эффективность:
Первичный селенодефицит связан с практическим исчезновением из продуктов питания этого микроэлемента вследствие обеднения почв и значительным ухудшением экологической обстановки во всем мире. Вторичный селенодефицит является следствием ускорения ритма жизни человека, сопровождающимся повышенным напряжением, стрессом, отравлением организма в условиях нарастающего загрязнения окружающей среды.
В настоящее время большинство населения подвержено тяжелейшим заболеваниям (болезни XX века) вследствие селенодефицита.
Эпидемиологические исследования показали, что недостаток селена в диете увеличивает риск возникновения и развития заболеваний сердечно-сосудистой системы. Дефицит селена (ниже 45 мкг/л в сыворотке крови) является фактором риска развития коронарных заболеваний. Была установлена зависимость, что среди лиц, употребляющих бедную селеном питьевую воду, распространенность артериальной гипертонии в два раза выше, чем при употреблении воды с адекватным содержанием элемента. Исследователями сделан вывод, что дефицит селена может усугублять риск развития и тяжесть гипотиреоза, возникающего на фоне йодной недостаточности.
Дефицит селена (ниже 45 мкг/л в сыворотке крови) является фактором риска развития коронарных заболеваний. Была установлена зависимость, что среди лиц, употребляющих бедную селеном питьевую воду, распространенность артериальной гипертонии в два раза выше, чем при употреблении воды с адекватным содержанием элемента. Исследователями сделан вывод, что дефицит селена может усугублять риск развития и тяжесть гипотиреоза, возникающего на фоне йодной недостаточности.
Механизм действия:
- Дефицитзамещающее. Селекор восполняет дефицит жизненнонеобходимого микроэлемента селена.
- Антиоксидантное. Селен регулирует ферменты 2- ой фазы биохимической адаптации и по антиокислительной активности близок к токоферолу.
-
Антистрессовое: Селенопротеин Р, который синтезируется и особенно больших количествах на поверхности эндотелия головного мозга играет антиишемическую и антистрессорную роль и нейропротекторных механизмах.
 Недостаточный уровень селена и мозге потенцирует нарушения функции и структуры нейронов, индуцируемые эндогенными и патогенными воздействиями, приводящими к гибели нейронов.
Недостаточный уровень селена и мозге потенцирует нарушения функции и структуры нейронов, индуцируемые эндогенными и патогенными воздействиями, приводящими к гибели нейронов. - Снижение йодонедостаточности. Нормально функционирующая щитовидная железа необходима человеку, так как с ее помощью обеспечиваются жизненно важные функции организма. Ее гормоны необходимы для нормальной деятельности большинства, если не всех его органов и тканей. Тироксин и трийодтиронин увеличивают теплопродукцию, ускоряют метаболизм углеводов, белков, липидов (жиров).При недостатке гормонов щитовидной железы уменьшается кровоснабжение и потребление кислорода мозгом, замедляется рост и формирование нервной ткани, а также окостенение скелета.
Впервые, в 1990-1991 г.г. было доказано, что один из важных ферментов, ответственных за конверсию тироксина в 3,5,3′ трийодтиронин — 5′- йодтиронин дейодиназа щитовидной железы типа 1 (Д1), является селеноэнзимом. Полученные данные объяснили, почему в эксперименте с селеновой недостаточностью снижалась конверсия Т4 в ТЗ, т. е. была идентифицирована роль селена в действии тиреоидных гормонов.
Полученные данные объяснили, почему в эксперименте с селеновой недостаточностью снижалась конверсия Т4 в ТЗ, т. е. была идентифицирована роль селена в действии тиреоидных гормонов.
- Репродуктивное. В митохондриях сперматозоидов содержится до ЗОмкг/г селена. Селен входит в состав 17 кД белка спермы. При дефиците селена снижается число сперматозоидов и их оплодотворяющая способность.
Функции селена можно назвать одним словам: Защита. Он защищает организм от отравлений свинцом, кадмием, ртутью, спиртом, сигаретным дымом и угарным газом.
Он эффективен при профилактике онкозаболеваний, сердечно-сосудистых заболеваний, аллергии и диабете.
Применение в профилактических и оздоровительных целях:
- для восполнения дефицита по микроэлементной недостаточности по селену;
- для улучшения работы центральной нервной системы;
- при сердечно-сосудистых заболеваниях; диабете;
- для повышения иммунитета; профилактики простудных заболеваний;
- при повышенных физических и психоэмоциональных нагрузках, алкоголизме, курении;
- при бронхолегочных заболеваниях;
- в качестве радиопротекторного средства;
- при опухолевых заболеваниях;
-
при бесплодии.

Селекор — селеносодержащее органическое соединение третьего поколения, где микроэлемент приобретает валентность 2+, самое безопасное соединение селена в отличие от 4-х и 6-ти валентного селена при попадании в организм восстанавливается до химического элемента без образования селенистого водорода (Н28е), чрезвычайно токсичного вещества для любой клетки организма,практически полностью усваивается организмом, его биоусвояемость достигает 95% (в отличие от других соединений селена, не превышающих порога в 60%).
Элементы — Общая и неорганическая химия
p-Элементы III группы
К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные — металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.

Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор — достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4.
 Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C — Si — Ge — Pb.
Углерод и кремний — типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние.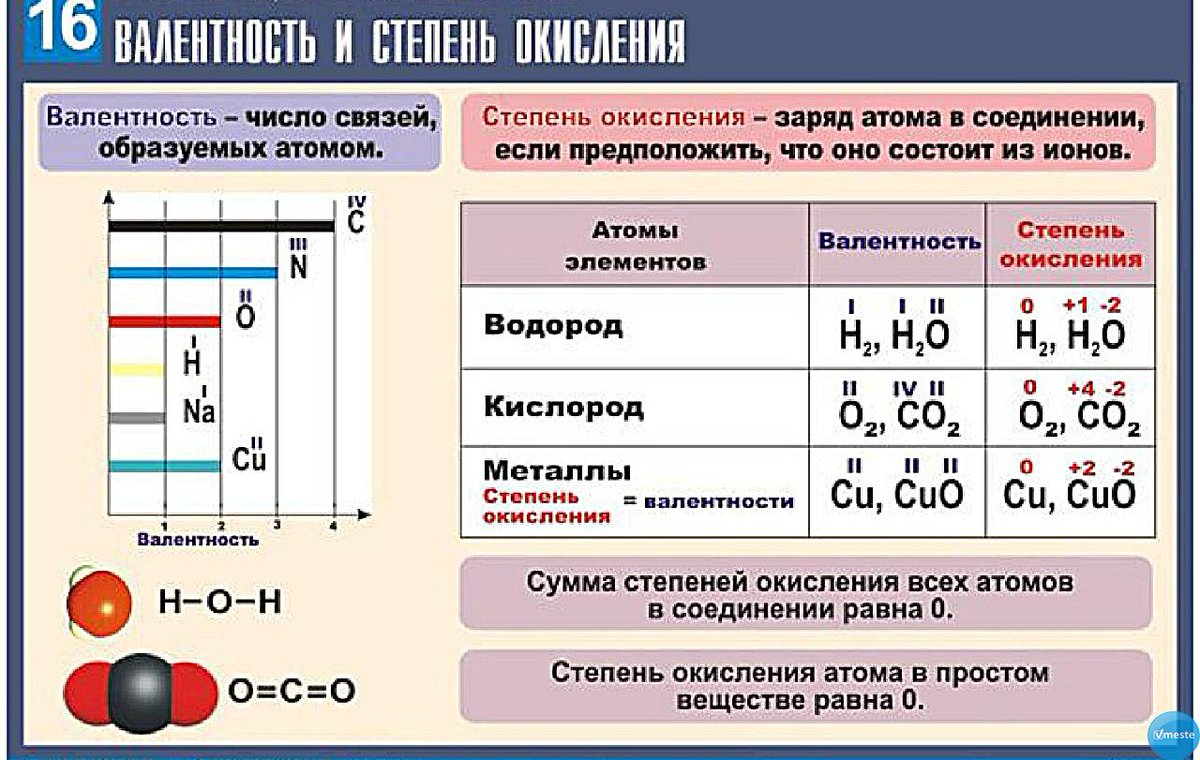 Свинец — металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
Свинец — металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, — также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4+ и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
Примером может служить ион аммония NH4+ и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N — P — As — Sb — Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns2np4.
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O+, в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O — S — Se — Te — Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы — галогены
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At.
 Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F — Cl — Br — I — At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы
К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s2 (Не) и ns2np6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s2), неона (2s22p6) и аргона (3s23p6) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s24p6), ксенон (5s25p6) и радон (6s26p6) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
электронов валентности селена | Валентность селена (Se) с точечной диаграммой
Электроны валентности селена исследование доступно здесь, чтобы лучше понять элемент. Также вы можете дополнительно изучить другие важные характеристики этого элемента. В химической отрасли науки селен признан химическим элементом. Он имеет символ Se и атомный номер 34.
.Сколько валентных электронов имеет
Селен ?Селен не имеет свободной формы в природе, в отличие от других элементов.В земной коре нет или очень мало селена. Селен на самом деле является побочным продуктом сульфидных руд, где он встречается в своей истинной форме. Он зарождается при переработке сульфидных руд, а затем и на этапе добычи.
Кроме того, Selenium также используется во многих коммерческих и промышленных целях. Например, он используется в качестве основного компонента в промышленном производстве стекол и пигментов. Кроме того, селен также можно использовать в качестве полупроводника в различных электронных устройствах.Удобрения, сплавы, солнечные батареи и другие продукты, в процессе производства которых используется селен. Проверьте здесь диаграммы периодической таблицы.
Кроме того, селен также можно использовать в качестве полупроводника в различных электронных устройствах.Удобрения, сплавы, солнечные батареи и другие продукты, в процессе производства которых используется селен. Проверьте здесь диаграммы периодической таблицы.
Ну, мы понимаем, насколько важно понимать электронную валентность любого химического элемента. Химическая связь в основном осуществляется взаимодействием валентных электронов. Таким образом, вы можете понять валентные электроны с нашей точечной диаграммой. На диаграмме точками обведен символ селена.
Количество нарисованных точек равно количеству валентных электронов. Вы можете использовать точечную диаграмму как эффективный инструмент изучения валентных электронов атома.
Валентность селена Селен может иметь несколько валентностей в разных случаях в зависимости от его соединения. Обычно он может иметь валентность -2,4 и 6.
Обычно он может иметь валентность -2,4 и 6.
Электронная конфигурация этого химического элемента 2-8-18-6. У него явно есть 6 электронов на внешней оболочке, которые имеют переменную валентность.
Сколько валентных электронов у селена? — Ответы на все
Сколько валентных электронов у селена?
шесть электронов
Селен имеет электронную конфигурацию 2-8-18-6. Шесть электронов на внешней оболочке позволяют селену иметь различные числа валентности. Были обнаружены соединения селена с валентностью -2, 4 и 6. Говоря о числе шесть, было обнаружено, что селен имеет шесть встречающихся в природе изотопов.
Какова валентность селена?
0
Валентность элементарного селена явно равна 0.
В какой группе периодической таблицы находится селен?
Группа 6
4.2 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Селен является неметаллическим элементом с атомным номером 34 и атомной массой 78,96 (Lide 2000). Селен принадлежит к группе 6 (группа VIA) таблицы Менделеева, расположенной между серой и теллуром, и напоминает серу как в различных ее формах, так и в ее соединениях.
Имеет ли ксенон 18 валентных электронов?
Ксенон имеет восемь валентных электронов, которые являются электронами на его внешней оболочке.
Что такое селен в Python?
Selenium — это мощный инструмент для управления веб-браузерами с помощью программ и выполнения автоматизации браузера. Он функционален для всех браузеров, работает на всех основных ОС, а его скрипты написаны на разных языках, например Python, Java, C# и т. д. Мы будем работать с Python.
Как рассчитать валентность?
Вычтите число электронов на самой внешней оболочке атома на восемь, чтобы получить число валентных электронов.Например, если самая внешняя оболочка калия содержит только один электрон, число валентных электронов равно семи (8 – 1 = 7).
Как узнать, сколько валентных электронов?
Если вы посмотрите на периодическую таблицу и на числа периодов, это число валентных электронов. Если число больше 10, вычтите 10, чтобы получить два валентных электрона. Пример: Кислород находится в 16-м периоде. Если из 16 вычесть 10, получится 6; следовательно, кислород имеет шесть валентных электронов.
Пример: Кислород находится в 16-м периоде. Если из 16 вычесть 10, получится 6; следовательно, кислород имеет шесть валентных электронов.
Сколько протонов и нейтронов у селена?
Атомный номер Se равен 34. На каждый атом селена приходится 34 протона, 45 нейтронов, 34 электрона.
Какой элемент имеет 2 валентных электрона?
Элементыгруппы -2 имеют 2 валентных электрона в своей валентной оболочке. Эти элементы группы обычно называют щелочноземельными металлами. Некоторые примеры: бериллий, кальций, стронций, барий, магний и т. Д.
Стенограмма: Химия в ее стихии: селен(Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец акции) Крис Смит Привет, на этой неделе шелушащиеся скальпы, скунсы, мертвые пони-поло и элемент, который заставляет вас вонять чесноком. Ням! Но это не все плохие новости. Берни Булкин Мы знаем, что селен присутствует в таблице Менделеева прямо под серой, но ему не уделяется много внимания. Учебники по неорганической химии, которые я изучал, много говорят о сере и, где это уместно, говорят такие вещи, как «селен также образует подобные кислоты» или «селен также имеет много аллотропных форм».Как пренебрегают этим важным элементом! Когда мне было немного за 20, у меня несколько лет страдала от сухости кожи головы, вероятно, в результате беспокойства по поводу грантов на исследования, которые я пыталась получить. Лечением этого был шампунь, содержащий сульфид селена, что меня удивило, потому что я думал, что селен очень токсичен. На самом деле небольшое расследование показало мне, что в небольших количествах это совершенно безопасно. Селен — один из тех слишком распространенных элементов, который необходим для жизни в небольших количествах и очень токсичен в больших количествах.400 мкг в день считается безопасным верхним уровнем потребления для человека. Но он необходим нам в составе различных ферментов, таких как глутатионпероксидаза, а также в щитовидной железе. Он широко распространен и накапливается в различных продуктах питания, таких как орехи, тунец и омары, поэтому у людей редко бывает дефицит селена. Но для лошадей с их более ограниченным рационом дефицит селена является обычным явлением и часто корректируется с помощью пищевых добавок. Опять же, это требует большой осторожности. Недавно во Флориде от передозировки селеном умерла 21 лошадь для игры в поло в результате того, что ветеринарный фармацевт переборщил с смешиванием препаратов. Берцелиус в 1817 году открыл селен в виде примеси в серной кислоте. Теллур уже был открыт и назван в честь греческого слова «земля», поэтому он назвал селен, используя греческое слово «луна», selene . В то время как некоторые из аллотропных форм селена напоминают те, которые мы хорошо знаем из изучения серы, есть и другие, отличающиеся от них. Самое главное, так называемый серый селен состоит из длинных цепочек атомов, образующих вытянутые спиральные структуры. Но разнообразие применений селена не ограничивается шампунями, кормовыми добавками для лошадей и фотоэлектрическими элементами. Селен добавляют в синтетический каучук для повышения устойчивости к истиранию, его добавляют в латунь вместе с висмутом для замены свинца в трубах, и он используется в виде селената натрия в качестве инсектицида для предотвращения нападения на цветущие растения, такие как хризантемы. и гвоздики.Селен в его аллотропной красной форме добавляют к стеклу, чтобы придать ему алый цвет, но его также можно использовать для удаления зеленоватого оттенка, иногда обнаруживаемого в стекле из-за соединений железа. Было проведено множество исследований, ни одно из которых не было убедительным, о возможной роли селена в профилактике рака и повышении эффективности химиотерапии. Большинство из них, по-видимому, указывают на то, что если он вообще эффективен, то каким-то образом работает в сочетании с витамином Е, который, как и селен, играет антиоксидантную роль в организме.Меня также заинтриговало недавнее исследование, показывающее, что почвы с дефицитом селена могут играть роль в восприимчивости к ВИЧ/СПИДу в Африке. Обоснование заключается в том, что низкий уровень селена связан с ослаблением иммунной системы, поскольку при недостатке антиоксидантной способности возникает стресс для иммунной системы. Но лучшее из встречающихся в природе селена я приберегу напоследок. Бутилселеномеркаптан является основным компонентом запаха скунса и, безусловно, является претендентом на звание самого неприятно пахнущего соединения.Однажды понюхав его, вы никогда его не забудете и не будете недооценивать воздействие, которое может оказать этот интересный элемент. Крис Смит Таким образом, он может убрать зуд кожи головы, но при этом может вызвать вонь. Это был Берни Балкин из Кембриджского университета с историей Selenium. На следующей неделе мы посетим элемент, который прославил Супермен. Ангелос Михаэлидис Криптон — вымышленная планета во вселенной DC Comics и родной мир супергероев Супермена, Супергёрл и Крипто, «суперсобаки».Криптон постоянно изображается как разрушенный сразу после полета Супермена с планеты, причем точные детали его разрушения зависят от периода времени, писателей и франшизы. Вот вам и попытка найти в «википедии» этот «скрытый» элемент! Крис Смит И вы можете узнать факты о Криптоне, а не вымысел с Англеосом Михаэлидесом на следующей неделе Химия в ее стихии. Я Крис Смит, спасибо за внимание и до свидания. (Акция) (Конец акции) |
Se Информация об элементе селена: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История селена
Элемент селен был открыт Йонсом Якобом Берцелиусом в год
1817 г. в Швеции
.Селен
получил свое название от греческого селена, что означает «луна».
в Швеции
.Селен
получил свое название от греческого селена, что означает «луна».
Присутствие селена: изобилие в природе и вокруг нас
В таблице ниже показано содержание селена во Вселенной, на Солнце, в метеоритах, Земная кора, океаны и тело человека.
Кристаллическая структура селена
Твердотельная структура Selenium представляет собой Simple Monoclinic.
Кристаллическую структуру можно описать с точки зрения ее элементарной ячейки. Единичные клетки повторяются в три объемное пространство для формирования конструкции.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | в |
|---|---|---|
905. 4 4 | 908,3 | 1160,1 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | 1,58493 | №/2 |
Положения атомов внутри элементарной ячейки описываются набором положений атомов ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются понятием пространственных групп. Все возможное
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются различными.
Атомные и орбитальные свойства селена
атома селена имеют 34 электрона и структура электронной оболочки [2, 8, 18, 6] с атомарным символом (квантовыми числами) 3 P 2 .
Оболочечная структура селена — количество электронов на единицу энергии уровень
| нет | с | р | д | ф | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | М | 2 | 6 | 10 | |
| 4 | Н | 2 | 4 |
Электронная конфигурация селена в основном состоянии — нейтральная Атом селена
Электронная конфигурация нейтрального атома селена в основном состоянии
[Ар] 3d10 4s2 4p4. Часть конфигурации селена, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации селена, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального селена
Полная электронная конфигурация атома селена в основном состоянии, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Атомная структура селена
Атомный радиусселена составляет 103 пм, а его ковалентный радиус — 116 пм.
Атомный спектр селена
Химические свойства селена: Энергии ионизации селена и сродство к электрону
Сродство к электрону селена составляет 195 кДж/моль.
Энергия ионизации селена
Энергии ионизации селена
см. в таблице ниже.| Номер энергии ионизации | Энтальпия — кДж/моль |
|---|---|
| 1 | 941 |
| 2 | 2045 |
| 3 | 2973.7 |
| 4 | 4144 |
| 5 | 6590 |
| 6 | 7880 |
| 7 | 14990 |
Физические свойства селена
Физические свойства селена см. в таблице ниже.
| Плотность | 4. 819 г/см3 819 г/см3 |
| Молярный объем | 16,3851421457 см3 |
Упругие свойства
Твердость селена. Испытания для измерения твердости элемента
Электрические свойства селена
Селен не относится к электричеству. Ссылаться на Таблица ниже для электрических свойств селена
Свойства теплопроводности и теплопроводности селена
Магнитные свойства селена
Оптические свойства селена
Акустические свойства селена
Тепловые свойства селена – энтальпии и термодинамика
См. таблицу ниже для тепловых свойств Selenium
.энтальпии селена
Изотопы селена — ядерные свойства селена
Изотопы родия. Встречающийся в природе селен имеет
5 стабильный изотоп —
74Se, 76Se, 77Se, 78Se, 80Se.
Встречающийся в природе селен имеет
5 стабильный изотоп —
74Se, 76Se, 77Se, 78Se, 80Se.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим затухания |
|---|---|---|---|---|
| 65Se | ||||
| 66Se | ||||
| 67Se | ||||
| 68Se | ||||
| 69Se | ||||
| 70Se | ||||
| 71Se | ||||
| 72Se | ||||
| 73Se | ||||
| 74Se | 0. 89% 89% | Стабильный | Н/Д | |
| 75Se | ||||
| 76Se | 9. 37% 37% | Стабильный | Н/Д | |
| 77Se | 7. 63% 63% | Стабильный | Н/Д | |
| 78Se | 23. 77% 77% | Стабильный | Н/Д | |
| 79Se | ||||
| 80Se | 49. 61% 61% | Стабильный | Н/Д | |
| 81Se | ||||
| 82Se | 8. 73% 73% | |||
| 83Se | ||||
| 84Se | ||||
| 85Se | ||||
| 86Se | ||||
| 87Se | ||||
| 88Se | ||||
| 89Se | ||||
| 90Se | ||||
| 91Se | ||||
| 92Se | ||||
| 93Se | ||||
| 94Se |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | КАС7782-49-2 |
| Номер РТЕКС | {Н/Д, RTECSVS7700000, Н/Д} |
| Класс опасности DOT | {Н/Д, 6. 1, н/д} 1, н/д} |
| Номера точек | «Н/Д», {2658}, «Н/Д» |
| Номер ЕС | {Н/Д, Н/Д, Н/Д} |
| Рейтинг огнестойкости NFPA | {Н/Д, 0, Н/Д} |
| Опасности NFPA | Н/Д, Н/Д, Н/Д |
| Рейтинг здоровья NFPA | {Н/Д, 2, Н/Д} |
| Рейтинг реактивности NFPA | {Н/Д, 0, Н/Д} |
Поиск по базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химических реестров
Изучите нашу интерактивную периодическую таблицу
Сравнение элементов периодической таблицы
Какой валентный электрон у селена? – Легче с практикой.
 ком
комЧто такое валентный электрон селена?
[Ар] 3d10 4s2 4p4
Как найти валентные электроны в селене?
Для нейтральных атомов число валентных электронов равно номеру главной группы атома. Номер основной группы элемента можно найти в его столбце периодической таблицы. Например, углерод находится в группе 4 и имеет 4 валентных электрона. Кислород находится в группе 6 и имеет 6 валентных электронов.
Сколько валентных электронов присутствует в атоме?
У углерода четыре валентных электрона, а здесь валентность четыре.Каждый атом водорода имеет один валентный электрон и является одновалентным… Количество валентных электронов.
| Блок периодической таблицы | Группа периодической таблицы | Валентные электроны |
|---|---|---|
| р | Группа 16 (VI) (халькогены или кислородная группа) | 6 |
| Группа 17 (VII) (галогены) | 7 |
Сколько валентных электронов имеет s 32?
6 валентных электронов
Может ли у вас быть 9 валентных электронов?
Некоторые молекулы могут вместить более 8 валентных электронов, потому что они имеют расширенные валентные оболочки. Эти молекулы относятся к периоду 3 или выше, потому что, начиная с n = 3, атомы имеют d-орбитали, на которых может разместиться более 9 валентных электронов.
Эти молекулы относятся к периоду 3 или выше, потому что, начиная с n = 3, атомы имеют d-орбитали, на которых может разместиться более 9 валентных электронов.
Почему у серы только 6 валентных электронов?
Здесь атом серы имеет шесть электронных пар в своей валентной оболочке. Говорят, что атом, подобный фосфору или сере, имеющий более октета, расширил свою валентную оболочку. Это может произойти только тогда, когда на валентной оболочке достаточно орбиталей для размещения дополнительных электронов.
Почему атом серы имеет 6 валентных электронов?
Пояснение: Сера имеет шесть валентных электронов.Валентные электроны — это самые внешние электроны, которые, следовательно, расположены на самых высоких энергетических уровнях. Следовательно, это электроны, доступные для химической связи.
Какова валентность серы?
2
Какой символ обозначает серу?
символ S
Имеет ли сера 6 валентных электронов?
Верхние индексы, связанные с этими орбиталями, в сумме дают 6. Следовательно, сера имеет 6 валентных электронов.
Следовательно, сера имеет 6 валентных электронов.
Как узнать валентность серы?
Атом серы имеет 6 электронов на внешней оболочке, и его валентность может быть равна 6.Но сере легче получить два электрона, чем потерять шесть электронов. Следовательно, его валентность определяется вычитанием шести электронов из октета, и это дает валентность серы, равную двум.
Почему у серы 16 электронов?
Атом серы содержит 16 протонов, потому что его атомный номер равен 16, и 16 электронов, чтобы быть нейтральным.
Какова конфигурация валентного электрона S +?
[Ne] 3s² 3p⁴
Сколько валентных электронов в литии?
один валентный электрон
Какова атомная масса гелия?
4.002602 и
Кто нашел гелий?
Уильям Рамзи
Кто первым вдохнул гелий?
Анри Муассан из Франции: отравлен несколько раз, успех, но сокращение жизни». Я заставил свою 11-летнюю дочь уронить книгу, мой 5-летний сын закричал, а моя жена посмотрела на меня с выражением лица «WTF?
Можно ли вдыхать гелий?
Чем больше чистого гелия вы вдохнете, тем дольше ваше тело будет без необходимого кислорода. Вдыхание чистого гелия может привести к смерти от удушья всего за несколько минут.Вдыхание гелия из баллона под давлением также может вызвать газовую или воздушную эмболию, когда пузырь попадает в кровеносный сосуд, блокируя его.
Вдыхание чистого гелия может привести к смерти от удушья всего за несколько минут.Вдыхание гелия из баллона под давлением также может вызвать газовую или воздушную эмболию, когда пузырь попадает в кровеносный сосуд, блокируя его.
Действительно ли гелий убивает клетки мозга?
Однако с этим «высоким» газом связаны некоторые опасности. Вдыхание гелия может привести к повреждению головного мозга из-за недостатка кислорода в кровотоке. Тело нуждается в кислороде, чтобы функционировать должным образом, поэтому, когда его не хватает, клетки начинают отмирать, что приводит к отказу органов и, в конечном итоге, к смерти.
Делает ли гелий вас легче?
То же самое, если вы человек, вдыхающий гелий. Но влияние воздуха, которым вы дышите, на ваш вес зависит от среды, в которой вы находитесь, и вы станете легче только в том случае, если воздух будет более плотным, чем гелий.
Где берут гелий?
Почти весь наш гелий извлекается из природного газа, побочного продукта радиоактивного распада урана и тория. Большая часть добычи в Соединенных Штатах и во всем мире приходится на подземные газовые месторождения между Амарилло, штат Техас, и Хьюготоном, штат Канзас, где можно обнаружить очень высокую концентрацию, до 2%.
Большая часть добычи в Соединенных Штатах и во всем мире приходится на подземные газовые месторождения между Амарилло, штат Техас, и Хьюготоном, штат Канзас, где можно обнаружить очень высокую концентрацию, до 2%.
Почему не хватает гелия?
Хотя гелий, который мы используем в повседневной жизни, чрезвычайно распространен в космосе, его можно найти в нескольких гораздо более земных и ограниченных источниках. Гелия гораздо больше в космосе, потому что он легче других газов в атмосфере, а это означает, что ничто не останавливает его, когда он путешествует в космосе.
Имеет ли s 2 8 валентных электронов?
Сера относится к группе 16. Она имеет 6 валентных электронов. Заряд 2- означает, что атом получил 2 электрона.Это делает общее число валентных электронов равным 8,
.Какой тип связи образует no2?
ковалентный
Что означает цифра 2 в слове NO2?
Двуокись азота
Почему NO2 не может иметь две двойные связи?
NO2 не может быть получен с двумя двойными связями и одной неподеленной парой на центральном атоме N, поскольку это нарушает правило октета. N не может превышать правило октета, потому что у него нет пустых d-орбиталей, в отличие от многих элементов третьего периода, которые используют свои пустые d-орбитали для размещения большего количества электронов.
N не может превышать правило октета, потому что у него нет пустых d-орбиталей, в отличие от многих элементов третьего периода, которые используют свои пустые d-орбитали для размещения большего количества электронов.
Является ли NO2 щелочным или кислым?
Двуокись азота является кислым газом. NO2 очень хорошо растворяется в воде, реагируя с водой с образованием азотистой и азотной кислот.
Является ли СА кислотным или щелочным?
Кальций, стронций, барий и радий всегда считались щелочноземельными металлами; также часто включают более легкие бериллий и магний, также находящиеся во 2-й группе периодической таблицы.
Каков pH NO2?
7
Является ли p2o5 кислотным или основным?
Пентоксид фосфора представляет собой кислый оксид и используется в качестве осушителя и обезвоживающего агента, поскольку представляет собой ангидрид фосфорной кислоты.
Является ли CaCl2 щелочным или кислым?
CaCl2 представляет собой соль сильной кислоты HCl и сильного основания Ca(OH)2. Таким образом, он образует нейтральный раствор при растворении в воде.
Таким образом, он образует нейтральный раствор при растворении в воде.
k2o это основание или кислота?
Оксид калия (K2O) представляет собой ионное соединение калия и кислорода. Это база. Это бледно-желтое твердое вещество, простейший оксид калия, является редко встречающимся высокореактивным соединением.
Какие основания самые сильные?
Прочные основания Аррениуса
- Гидроксид натрия (NaOH)
- Гидроксид бария (Ba(OH)2)
- Гидроксид цезия (CsOH)
- Гидроксид натрия (NaOH)
- Гидроксид стронция (Sr(OH)2)
- Гидроксид кальция (Ca(OH)2)
- Гидроксид лития (LiOH)
- Гидроксид рубидия (RbOH)
Соляная кислота и кислота или основание?
Если кислота не указана здесь, это слабая кислота.Он может быть ионизирован на 1% или на 99%, но все же классифицируется как слабая кислота. Любая кислота, диссоциирующая на 100% на ионы, называется сильной кислотой. Если он не диссоциирует на 100%, это слабая кислота… Сильные и слабые кислоты.
| Кислоты | Основания |
|---|---|
| HCl | LiOH |
| HBr | NaOH |
| Привет | КОН |
| HNO3 | РбОН |
Является ли h3SO4 H+ или OH?
Несмотря на то, что h3SO4 обеспечивает два (кислотных) иона H+ на молекулу по сравнению с одним (основным) ионом OH- на молекулу NaOH, расчеты N учитывают эти различия и помещают все это в эквивалентную шкалу.
Является ли азотистая кислота сильной кислотой?
Азотистая кислота (HNO2), слабая кислота, очень нестабильна и существует только в водной среде…
Какие 7 сильных кислот?
Существует 7 сильных кислот: хлорная кислота, бромистоводородная кислота, соляная кислота, йодистоводородная кислота, азотная кислота, хлорная кислота и серная кислота.
Какая кислота самая сильная?
Фторсурьмяная кислота является самой сильной суперкислотой на основании измеренного значения ее функции кислотности Гаммета (H0), которая была определена для различных соотношений HF:SbF5.
Какая кислота самая страшная?
Плавиковая кислота (HF): слабая кислота, то есть она не полностью диссоциирует на свои ионы в воде, но это, вероятно, самая опасная кислота в этом списке, потому что именно с ней вы, скорее всего, столкнетесь.
Какая кислота самая смертоносная?
Самая сильная суперкислота в мире — фторсурьмяная кислота, HSbF6. Он образуется при смешивании фтористого водорода (HF) и пентафторида сурьмы (SbF5). Различные смеси производят суперкислоту, но смешивание двух кислот в равных пропорциях дает самую сильную суперкислоту, известную человеку.
Атомный номер, электронная конфигурация, свойства, использование и недостатки
Селен — это химический элемент, который находится в 16-й группе и 4-м периоде периодической таблицы. Символ элемента селена — Se. Это неметаллический элемент с атомным номером 34. Он проявляет такие же свойства, как сера, теллур и мышьяк. Сера находится выше селена, а теллур ниже селена в 16-й группе периодической таблицы.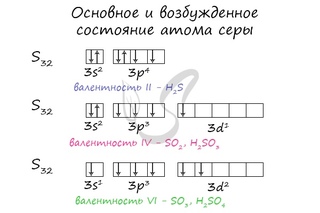 Мышьяк находится слева от селена в 4-м периоде и 15-й группе.Поскольку он находится в 16-й группе, значит, это p-блочный элемент. Из-за его различных свойств иногда его также считают металлоидом.
Мышьяк находится слева от селена в 4-м периоде и 15-й группе.Поскольку он находится в 16-й группе, значит, это p-блочный элемент. Из-за его различных свойств иногда его также считают металлоидом.
Селен был открыт и выделен шведскими химиками Йонсом Якобом Берцелиусом и Иоганном Готлибом Ганом в 1817 году. Слово селен происходит от греческого слова «селена», что означает луна. Он редко встречается в виде чистой руды или в чистом виде. Обычно встречается в сульфидных рудах металлов. Для коммерческого использования селен в основном производится как побочный продукт переработки сульфидных руд металлов.
Селен встречается в виде красных, серых и черных аллотропов. Его 7 изотопов доступны в природе. Помимо этого, у него также есть много синтетических изотопов, хотя все его синтетические изотопы нестабильны по своей природе. Из семи встречающихся в природе изотопов пять стабильны, а два нестабильны.
Атомный номер селена и электронная конфигурация
Атомный номер селена равен 34. Его электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 или может быть записана как [Ar] 3d10 4s2 4p4.Он имеет 2 электрона на K-оболочке, 8 электронов на L-оболочке, 18 электронов на M-оболочке и 6 электронов на внешней оболочке N.
Его электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 или может быть записана как [Ar] 3d10 4s2 4p4.Он имеет 2 электрона на K-оболочке, 8 электронов на L-оболочке, 18 электронов на M-оболочке и 6 электронов на внешней оболочке N.
Свойства селена
Изображение будет добавлено в ближайшее время
Физические и химические свойства селена перечислены ниже
Он находится в твердом состоянии при температуре 20 ℃.
Относительный атомный вес селена 78,96.
Температура плавления 221 ℃.
Температура кипения селена 685 ℃.
Имеет гексагональную кристаллическую структуру.
Плотность 4,809 г см-3.

Образует сильнокислотный оксид.
По шкале Полинга его электроотрицательность составляет 2,55
Его кристаллическая структура гексагональная.
Имеет много изотопов. Его 5 изотопов стабильны: 74Se, 76Se, 77Se, 78Se, 80Se.хотя его ключевой изотоп — 80Se.
Образует несколько изотопов.
Оптические свойства. Селен проводит некоторое количество электричества. Таким образом, это полупроводник. Селен также является фотопроводником. Он может преобразовать энергию света в электрическую энергию. В исследованиях было обнаружено, что его проводимость увеличивается в присутствии света, что означает, что его фотопроводимость увеличивается с увеличением интенсивности света.
Использование селена
Селен используется в различных областях, в основном благодаря его свойствам, таким как фотопроводимость, полупроводник электричества и т. д.Ниже перечислены некоторые из его применений –
д.Ниже перечислены некоторые из его применений –
Он широко используется в производстве стекла и пигментации. Это основные виды коммерческого использования селена в современном мире.
Используется в фотоэлементах, так как является фотопроводником.
В прошлом селен доминировал на рынке электроники, поскольку он является полупроводником, но в настоящее время кремний почти заменил селен.
Используется в флуоресцентных квантовых точках и устройствах защиты от перенапряжения.
Небольшое количество солей селена необходимо для правильного функционирования клеток многих организмов.
Входит в состав детских смесей.
Он является компонентом многих ферментов, таких как ферменты тиоредоксинредуктазы, дейодиназы.

Диоксид селена используется в электролизе марганца.
Используется для изготовления сплавов. Например, в латуни селен используется вместо свинца, который более токсичен, чем селен.Он также используется в медных сплавах.
Используется в батареях Li-Se.
Используется в тонкопленочных солнечных элементах из селенида меди индия галлия.
Используется в плоскопанельных рентгеновских детекторах.
Селенорганические соединения применяются при вулканизации каучука.
Используется в фотокопировальных машинах.
Селенид цинка используется в синих светодиодах.

Селен-75 используется в промышленной радиологии в качестве источника гамма-излучения.
В настоящее время соединение селена (сульфид селена) широко используется для лечения перхоти. Он работает как противогрибковое средство.
Недостатки селена
Селен является важным микроэлементом, но его высокие концентрации вредны для окружающей среды. Селен является токсичным элементом, и его высокие концентрации вредны не только для окружающей среды, но и для здоровья человека. Это влияет и на нашу экосистему. Высокая концентрация селена в рыбе может вызвать отек жабр и нарушение кровотока в жабрах.Селен может вызвать катаракту, повреждение тканей печени, проблемы с дыханием и т. д.
Чрезмерное воздействие селена может вызвать бронхит, астму, рвоту, дисфункцию легких, диарею, боль в животе, одышку и в тяжелых случаях смерть.
Обычно необходимое или необходимое количество селена потребляется животными и людьми с пищей, но большее количество селена потребляется ими за счет его накопления в окружающей среде. Селен попадает в окружающую среду в виде диоксида селена при сжигании угля и нефти.
Высокие концентрации селена могут вызывать нарушения репродуктивной функции, дефекты у младенцев. Хотя его дефицит также может вызвать множество неблагоприятных последствий для здоровья. Дефицит селена может вызвать болезнь Кашина-Бека, стресс, снижение функции головного мозга, поражение белых мышц у жвачных животных, дисфункцию щитовидной железы и т. д. Хотя после исследований было сказано, что все эти последствия дефицита селена, как правило, сопровождаются дефицитом других витаминов. или другие заболевания.
Селен: Сводка в табличной форме
SE 99 | Обнаружено | JONS JACOB BERZELIUS Готлиб Ган | |||||||||||||||||||||||
Атомный номер | 34 | ||||||||||||||||||||||||
Относительный атомный вес 110847
На этом наш обзор темы «Селен» заканчивается. Селен в периодической таблице | Сетевые поясненияСелен Селен занимает промежуточное положение между серой и теллуром.Это место в семействе халькогенов .Редко встречается в земной коре. В нашем организме требуется 14 миллиграмм селена. Селен токсичен по своей природе. В избыточном количестве опасен для здоровья, канцерогенен. Селен является фотогальваническим (преобразует свет в электричество), а также является проводником Открытие: селен открыт в 1817 году ученым Джоном Джейкобом Берзелиумом Происхождение названия :. Физические свойства: Атомный символ: селен обозначается символом Se Атомный номер : атомный номер селена 34 В селене присутствует 34 протона и 34 электрона Атомный вес/масса: атомный вес селена 78,9 а.е.м. В селене присутствует 34 протона и 45 нейтронов. Позиция: селен присутствует в периодической таблице в 4 периоде (строка) и 16 столбце (группа) Блок : находится в блоке P Цвет: селен серебристо-серый цвет элемент Природа:. Присутствует в твердом состоянии Запах : селен показать запах гнилого хрена Температура кипения: температура кипения селена 685 0 C Температура плавления: температура плавления селена 220 0 C Изотопы: Селен-шоу 6 стабильный изотоп 74 Se: атомный вес этого изотопа равен 73. В этом изотопе присутствует 34 протона,34 электрона 40 нейтрона В природе присутствует 0,8% 76 Se: атомный вес этого изотопа 75,9 а.е.м. В этом изотопе присутствует 34 протона, 34 электрона и 42 нейтрона. В природе присутствует в количестве 9,3% 77 Se: атомный вес этого изотопа 76,9 а.е.м. В этом изотопе присутствует 34 протона, 34 электрона и 43 нейтрона Присутствует 7.6% в природе 78 Se: атомный вес этого изотопа 77,9 а.е.м. В этом изотопе присутствует 34 протона, 34 электрона и 44 нейтрона В природе присутствует 23,7% 80 Se: атомный вес этого изотопа 79,9 а.е.м. В этом изотопе присутствует 34 протона, 34 электрона, 46 нейтрона В природе присутствует на 49,6% 82 Se: атомный вес этого изотопа 82,9 а.е.м. В этом изотопе присутствует 34 протона, 34 электрона и 48 нейтронов Присутствует 8. Химические свойства: Электронная конфигурация Электронная конфигурация селена [Ar] 3d 10 4S 2 4P 4 Электронная конфигурация в корпусе 2,8,18,6 Электронная структура Валентность : валентность селена равна 2 В селене 2 электрона необходимы для завершения их октата Атомный радиус: атомный радиус селена составляет 103 пм Реактивность :. Селен менее реактивный элемент. Но это реакция с кислотой. Использование: Селен используется в шампуне против перхоти Также используется для изготовления нержавеющей стали Селен используется в фотоэлементах и солнечных батареях. Используется для производства стекла красного цвета. Также используется для обесцвечивания стекла. | |||||||||||||||||||||||||
 Определите порядок связи и магнитные свойства. Что легче ионизовать: молекулу или атомы, из которых
Определите порядок связи и магнитные свойства. Что легче ионизовать: молекулу или атомы, из которых К недостаткам селеновых выпрямителей относятся их значительные габариты.
К недостаткам селеновых выпрямителей относятся их значительные габариты. Недостаточный уровень селена и мозге потенцирует нарушения функции и структуры нейронов, индуцируемые эндогенными и патогенными воздействиями, приводящими к гибели нейронов.
Недостаточный уровень селена и мозге потенцирует нарушения функции и структуры нейронов, индуцируемые эндогенными и патогенными воздействиями, приводящими к гибели нейронов.

 Хотя селен не является металлическим элементом, серый селен является хорошим фотопроводником и использовался в первых фотоэлементах. Впоследствии селен и различные соединения селена использовались в различных фотопроводниках и фотоэлектрических устройствах.Действительно, новейшим и наиболее многообещающим классом солнечных элементов массового производства являются селенид меди, индия, галлия. Когда-то практически все копировальные машины использовали селен; теперь они в значительной степени заменены органическими фотопроводниками.
Хотя селен не является металлическим элементом, серый селен является хорошим фотопроводником и использовался в первых фотоэлементах. Впоследствии селен и различные соединения селена использовались в различных фотопроводниках и фотоэлектрических устройствах.Действительно, новейшим и наиболее многообещающим классом солнечных элементов массового производства являются селенид меди, индия, галлия. Когда-то практически все копировальные машины использовали селен; теперь они в значительной степени заменены органическими фотопроводниками.



 Мы надеемся, что вам понравилось обучение, и вы смогли понять концепции. Мы надеемся, что после прочтения этой статьи вы сможете решить задачи, основанные на теме. Если вы ищете решения проблем учебника NCERT, основанные на этой теме, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому.
Мы надеемся, что вам понравилось обучение, и вы смогли понять концепции. Мы надеемся, что после прочтения этой статьи вы сможете решить задачи, основанные на теме. Если вы ищете решения проблем учебника NCERT, основанные на этой теме, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому. Название происходит от компьютерного слова «селена», что означает луна
Название происходит от компьютерного слова «селена», что означает луна 9 Аму
9 Аму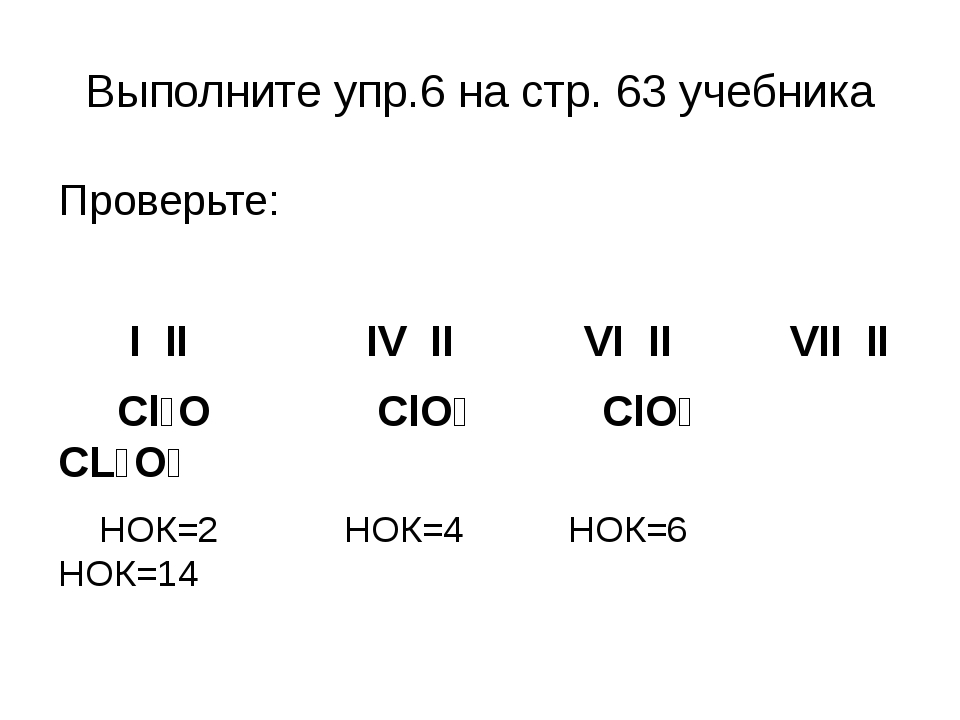 7% в природе
7% в природе