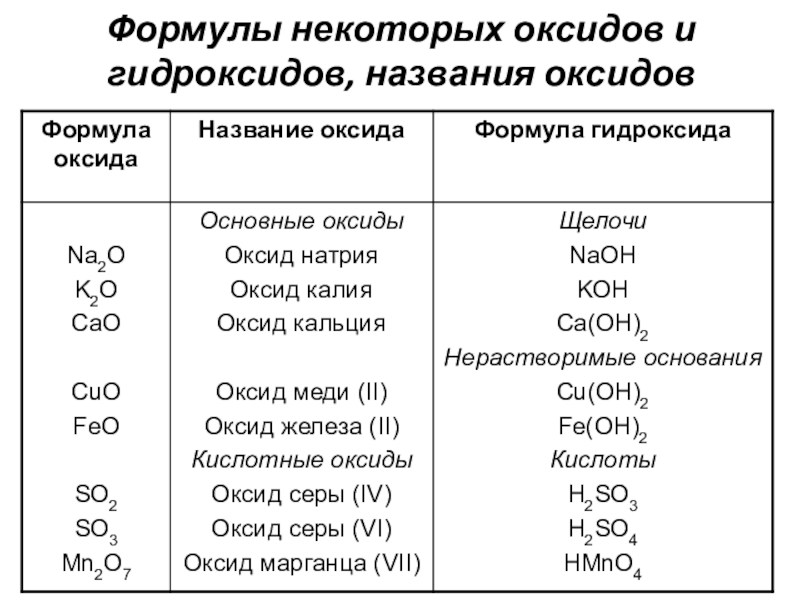
Марганец гидроксид — Справочник химика 21
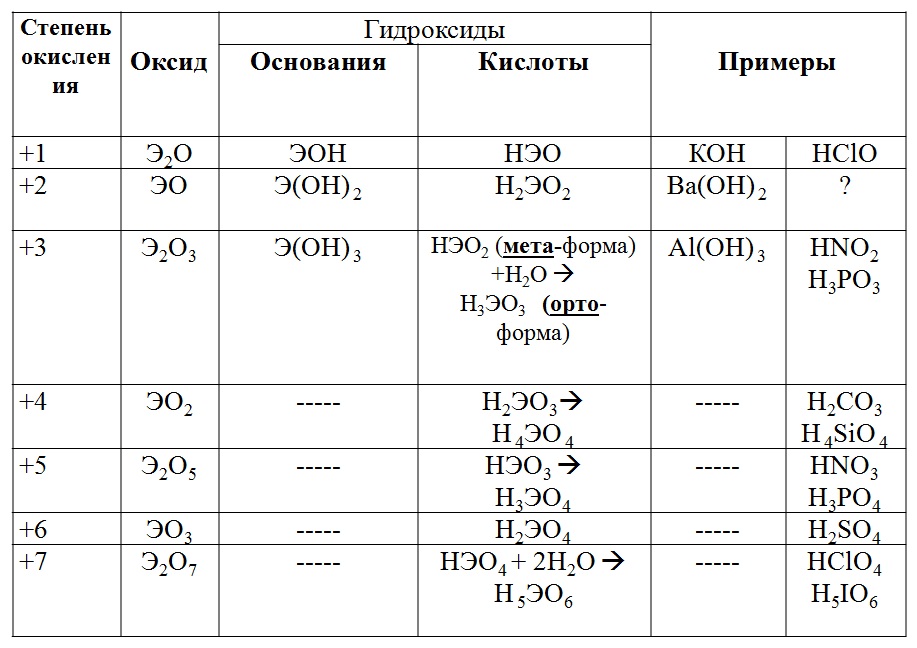
Характеристические соединения. Марганец в определенном смысле может служить модельным элементом для иллюстрации зависимости кислотно-основных свойств оксидов и гидроксидов от степени окисления, в то же время на примере этого элемента в рядах его производных, отвечающих различным степеням окисления, удобно проследить изменение окислительно-восстановительных свойств и влияние реакции среды на стабильность различных степеней окис- [c.375]Определение железа и алюминия. При анализе силикатов, известняков, некоторых руд и других горных пород эти элементы часто определяют гравимеФрическим методом в смеси с титаном, марганцем и фосфатом как сумму так называемых полуторных оксидов. Обычно после отделения кремниевой кислоты в кислом растворе приводят осаждение сульфидов (меди и других элементов) и в. фильтрате после удаления сероводорода осаждают сумму полуторных оксидов аммиаком в аммиачном буферном растворе.

В соответствии с возможными валентными состояниями марганец образует несколько оксидов МпО, МП3О4, МпгОз, МпОг, МпОз, МпгО . Наиболее устойчив к воздействию атмосферы диоксид марганца МпОг, так как на воздухе оксид МпО окисляется кислородом до МпОг, а МпОа устойчив к действию О2 и не превращается в МпОз или МпгО .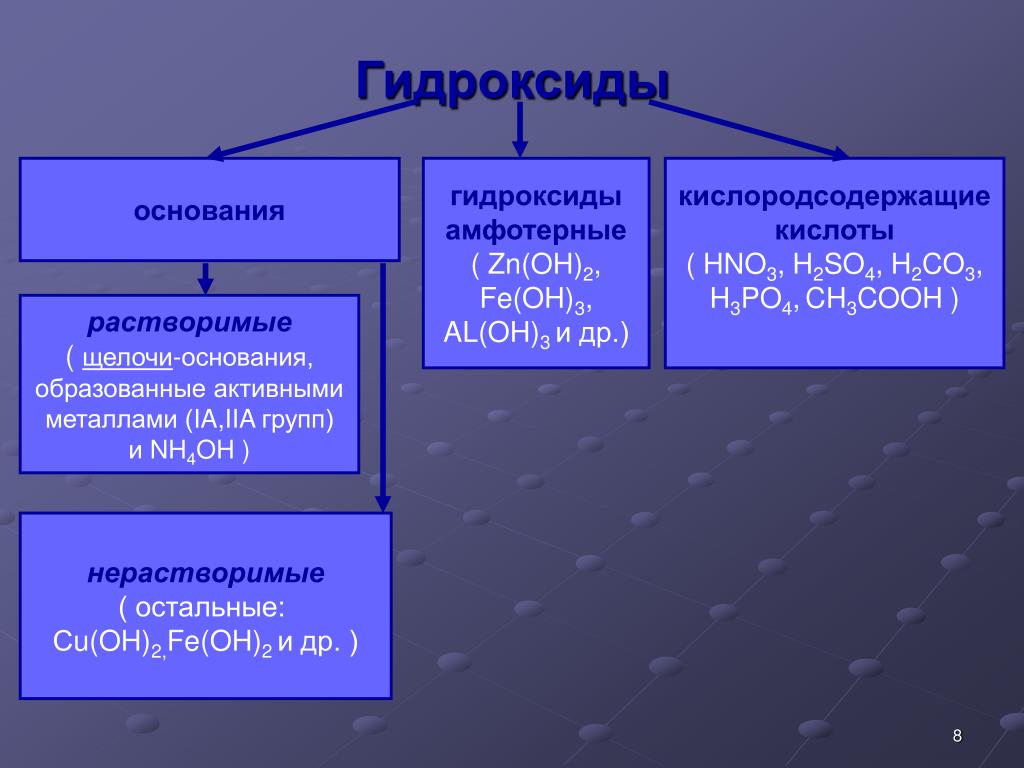
В соединениях марганец проявляет степени окисления + 2, -ЬЗ, 4-4, -)-6, 4-7. С повышением степени окисления усиливается кислотный характер соединений оксидов и гидроксидов Мп(0Н)2 — основание, Мп(0Н)4 — амфотерен с очень слабо выраженными основными и кис- [c.99]
III). Гидроксиды железа (II) и (III). Их свойства. Комплексные соединения железа. Химические реакции, лежащие в основе получения чугуна и стали. Роль железа и его сплавов в технике. Хром, электронная формула, степени окисления. Получение, физические и химические свойства хрома. Оксиды хрома (II) и (III). Гидроксиды хрома (II) и (III). Их свойства. Оксид хрома (VI). Хромовая и дихромовая кислоты. Дихромат калия как окислитель. Марганец, злектронная формула, степени окисления. Получение, физические и химические свойства марганца. Кислотно-основные и окислительно-восстановительные свойства соединений марганца.
Химические сво йства. Марганец очень медленно реагирует с холодной водой, быстрее при нагревании. Он легко растворяется в воде в присутствии хлорида аммония, который препятствует осаждению гидроксида марганца [c.476]
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента—металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элементанеметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца (II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Мп (HjO) ] , тогда как у оксида и гидроксида марганца (Vil) доминируют кислотные свойства, а сам марганец входит в состав анионов типа МПО4.
У d-элементоБ в определении кислотно-основцых свойств первую роль играет форма соединения ЗОН — редкая форма для -элементов она наблюдается только у элементов дополнительной подгруппы I группы. ЭОН, Э(ОН), — этим формам гидроксидов соответствуют основные свойства [исключение Zn(OH)a, u(0H).2 — амфотерны . 3(0H)i, Э(ОН)., — гидроксиды, обладающие амфотерными свойствами. Большого числа гидроксильных групп элемент не удерживает, так как действуют силы отталкивания, поэтому происходит отщепление воды и форма меняется. Образовапшейся форме уже присущи кислотные свойства. Так, марганец образует гидроксиды следующих форм и свойств [c.110]
Марганец. Оксиды марганца (II) и (IV). Гидроксид и соли марганца (II). Манганат и перманганат калия 17.1. Общая характеристика ЙВ I I М [c.318]
Марганец в степени окисления (+11) образует основные оксид МпО и гидроксид Мп(ОН)2, под действием кислот они переходят в раствор в виде аквакатиона марганца(II).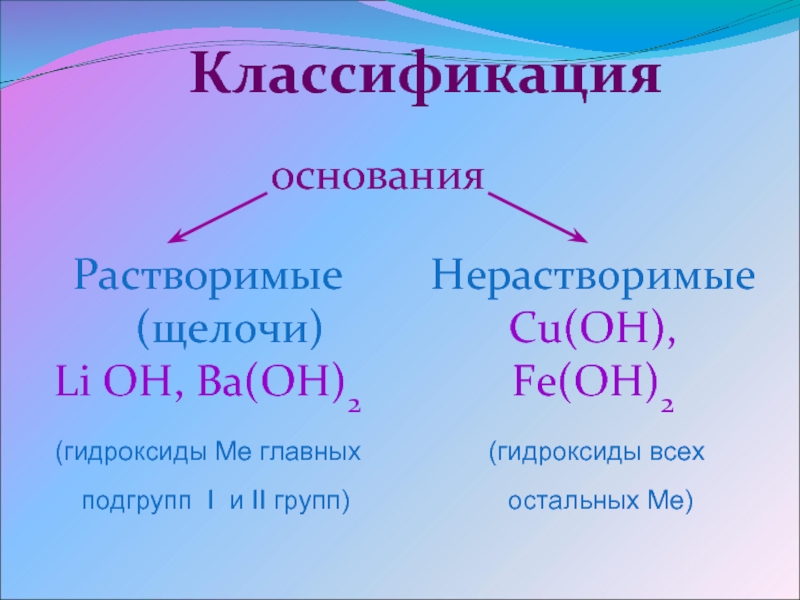
Марганец образует несколько оксидов (в наиболее характерных степенях окисления). Оксид марганца (IV) МпОг и соответствующий ему гидроксид Мп (0Н) — амфотерные соединения. Например, МпО реагирует с серной кислотой и с щелочами при сплавлении [c.138]
Однако в зависимости от содержания различных компонентов в схеме должно предусматриваться влияние этих компонентов и их поведение в процессе анализа по такой схеме. Так, если в силикате присутствуют бор, фтор и марганец, то без изменения эта схема не может быть принята, потому что могут быть следующие отклонения 1) при выпаривании с хлороводородной кислотой будут заметны потери кремния и бора 2) бор частично будет осаждаться вместе с кремневой кислотой, а затем улетучится при обработке осадка кремневой кислоты фтороводородной кислотой 3) часть фтора может остаться в растворе и будет препятствовать осаждению алюминия и железа при действии водного раствора аммиака 4) некоторая часть бора осядет вместе с полуторными гидроксидами 5) без прибавления окислителя не весь марганец выпадает вместе с полуторными гидроксидами при осаждении водным раствором аммиака, затем он частично осаждается в виде оксалата совместно с оксалатом кальция 6) при осаждении магния фосфатом осядет также и фосфат марганца.
Рассмотрим, например, шкалу характерных степеней окисления марганца Мп (рис. 19). Марганец в степени окисления (+ II) образует основные оксид МпО и гидроксид Мп(ОН)2, под действием кислот они переходят в раствор в виде солей Мп». Щелочи не действуют на МпО и Мп (ОН)2-Марганец в степени окисления ( + Ш) начинает прояв- [c.183]
Натрия гидроксид Калия гидроксид Аммония гидроксид Натрий углекислый Калий углекислый Калий углекислый Натрий сернокислый Натрий сернокислый Натрий сернокислый Натрий сернисто-кислый Натрий хлористый Барий хлористый Кальций хлористый Магний хлористый Марганец хлористый Железо хлорное Железа сульфид Железа сульфид Натрия сульфид Сероводород Сера Сера Сера [c.115]
При высоком pH электролита и, особенно, в приэлектродном слое, основное количество водорода образуется путем восстановления ионов КН4+ и частично разложения воды. В результате первой реакции получается аммиак, с которым марганец образует растворимые комплексы типа [Мп(ЫНз) ]504.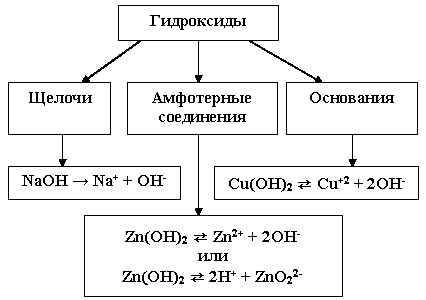 Аммонийные соли и аммиак затрудняют образование твердой фазы гидроксида. [c.396]
Аммонийные соли и аммиак затрудняют образование твердой фазы гидроксида. [c.396]
Оксиды, гидроксиды и их производные. Марганец образует с кислородом соединения одноокись МпО, полутораокись МпаОз, двуокись МпОг, трехокись МпОз (не выделен в свободном состоянии) и полусемиокись МпаО , причем наиболее устойчивыми являются JHn02, МпаОз, МП3О4, встречающиеся в природе.
Оставшийся раствор, содержащий катионы магния Mg , марган-ца(П), железа(Ш) и висмут(1П), обрабатывают смесью растворов щелочи NaOH (6 моль/л) и 3%-го пероксида водорода и кипятят для удаления избытка пероксида водорода. Получают осадок гидроксидов Mg(0H)2, Bi(OH)3, MnO(OH)2 и Ре(ОН)з, который отделяют и обрабатывают раствором 2 моль/л азотной кислоты. В раствор переходят катионы Fe , Mg и висмут(1П), а в осадке остается МпО(ОН)2. Последний отделяют центрифугированием, растворяют в смеси азотной кислоты с пероксидом водорода при нагревании и в полученном растворе открывают марганец реакцией с диоксидом свинца РЬ()2 — раствор окрашивается в малиновый цвет вследствие образования перманганат-ионов MnO .
Из гидроксоманганатов (И) выделены в свободном состоянии К41Мп(ОН)б], BajiMn (0Н)б1 (красного цвета) и некоторые другие. Все они в водных растворах полностью разрушаются. По этой же причине ни металлический марганец, ни его оксид и гидроксид в, обычных условиях со щелочами не взаимодействуют. [c.574]
Это можно обьяснить тем, что с возрастанием степени окисления положительный заряд атома марганца увеличивается, а его радиус — уменьшается. В результате этого напряженность положительного электрического поля вблизи атома марганца возрастает, что приводит к усилению связи марганец—кислород и к более сильному отталкиванию протонов гидроксидов. [c.262]
Марганец относится к активным металлам. На воздухе он окисляется и покрывается видимой пленкой оксидов, вначале красноватой, затем почти черной. С водой на холоду марганец взаимодействует очень медленно при повышении температуры скорость реакции окисления марганца водой увеличивается.
В высоких степенях окисления (-t-VI) и ( + VII) марганец уже находится только в аниона) солей, а именно Мп О и Мп «04. Оксид и гидроксид марганца(УП)-Мп207 и НМПО4 являются кислотными. [c.184]
Активаторами для ОНЭ являются кобальт, литий, барий, марганец, ртуть. Ионы Li+ (из LiOH, присутствующего в составе электролитов, см. табл. 1.4), адсорбируясь на зернах гидроксида никеля (И), препятствуют их укрупнению, т. е.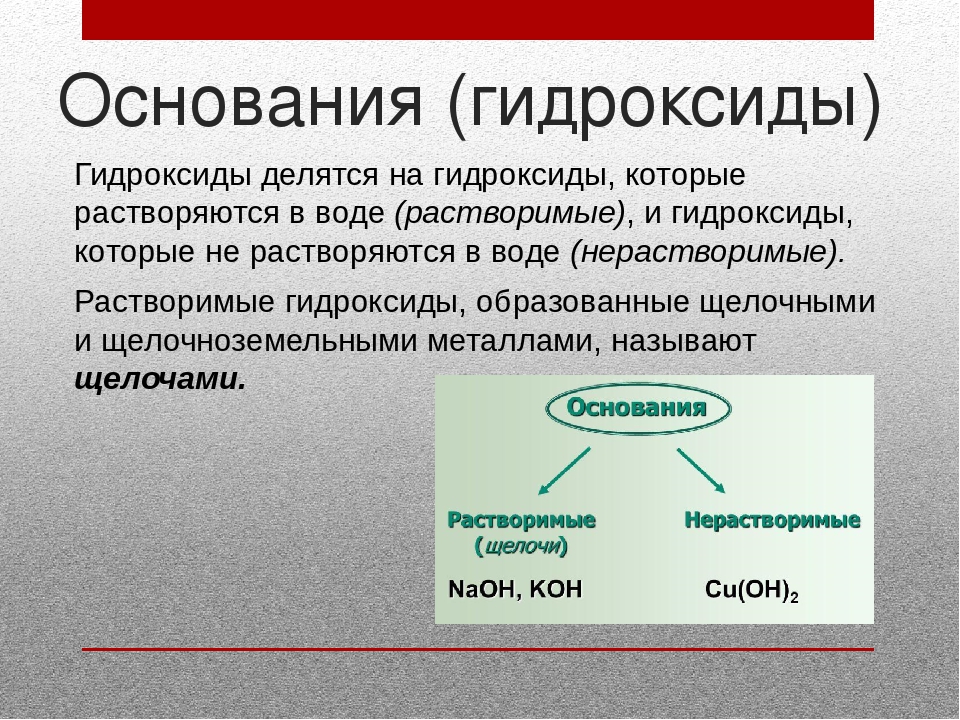 сохраняют массу в высокодисперсном состоянии. Аналогично действует и барий в качестве активирующей добавки. Избыточное количество Li+ ухудщает работоспособность электрода вследствие внедрения этого иона в решетку активной массы с образованием электрохимически инертного соединения LiNiOj. [c.102]
сохраняют массу в высокодисперсном состоянии. Аналогично действует и барий в качестве активирующей добавки. Избыточное количество Li+ ухудщает работоспособность электрода вследствие внедрения этого иона в решетку активной массы с образованием электрохимически инертного соединения LiNiOj. [c.102]
Марганец растворяется в разбавленных соляной, серной и азотной кислотах с образованием солей двузарядного катиона Мп +. Концентрированная серная кислота уже на холоду восстанавливается марганцем (медленно) с выделением оксида серы (IV). Оксид марганца (II) растворим в кислотах с образованием солей розового цвета. При pH 8,7 из таких растворов выпадает белый гидроксид Мп(ОН)г, очень быстро окисляющийся на воздухе с образованием Мп(0Н)0, МпМпОз и НгМпОз, и приобретающий вследствие этого коричневый цвет. [c.212]
Подобно хрому, марганец с низкими степенями окислення образует соединения основного характера, с высшими степенями окислення — кислотного, с промежуточными степенями окисления — ам-фотерного.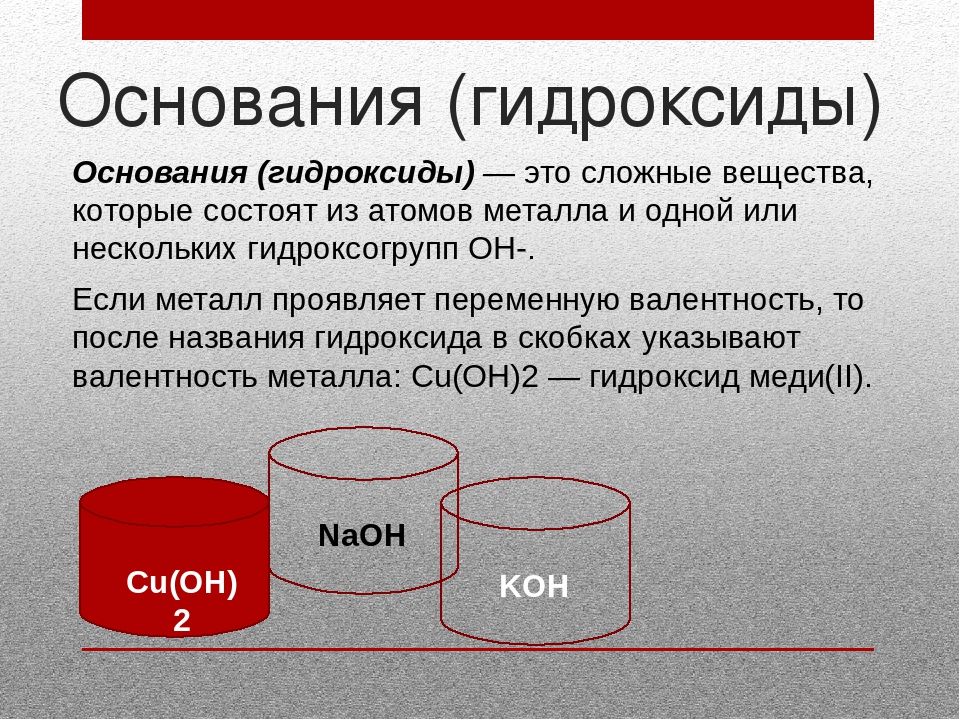 Так, МпО обладает основными свойствами, Мп Оз и Л 1п02 — амфотерными (первый с преобладанием основных свойств, второй — кислотных), МП.2О7—кислотными. Оксидам соответствуют гидроксиды с теми же свойствами. [c.203]
Так, МпО обладает основными свойствами, Мп Оз и Л 1п02 — амфотерными (первый с преобладанием основных свойств, второй — кислотных), МП.2О7—кислотными. Оксидам соответствуют гидроксиды с теми же свойствами. [c.203]
Марганец — важнейший элемент УИБ группы. Основными соединениями марганца являются производные Мп (II), Мп (IV), Мп (VII). Из других соединений следует отметить оксид и гидроксид Мп (П1), смешанный оксид МП3О4 и МпОз, а также марганцевую кислоту Н2МПО4 и ее соли — манганаты. Основным исходным продуктом получения соединений марганца служит пиролюзит МпОг. [c.535]
Марганец может служить модельным элементом для иллюстрации зависимости кислотно-основньтх свойств оксидов и гидроксидов от степени окисления. [c.46]
При действии некоторых сильных окислителей (СЬ и т. п.) на взболтанный в концентрированном растворе NaOH или КОН гидроксид висмута образуются нерастворимые производные пятивалентного висмута, окрашенные в цвета от фиолетового до желтого.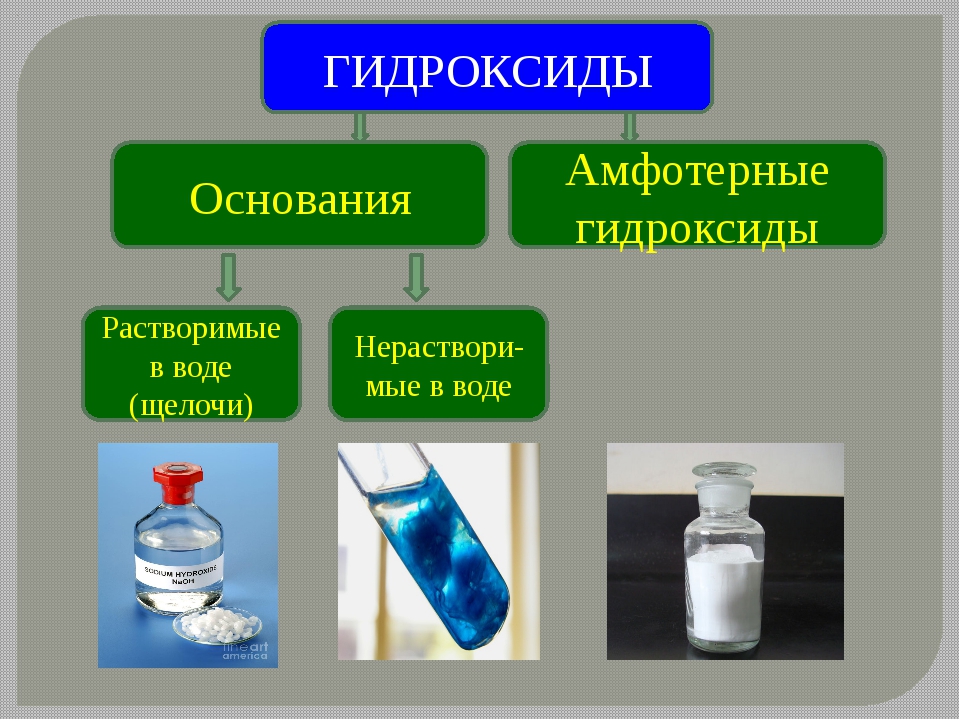 Состав их более или менее близок к формулам МаВЮз и КВ1О3. Эти висмутаты являются чрезвычайно сильными окислителями. Так, в кислой среде двухвалентный марганец легко окисляется ими до семивалентного, например, по реакции [c.284]
Состав их более или менее близок к формулам МаВЮз и КВ1О3. Эти висмутаты являются чрезвычайно сильными окислителями. Так, в кислой среде двухвалентный марганец легко окисляется ими до семивалентного, например, по реакции [c.284]
Титрование обычно ведут, не отфильтровывая осадка гидроксида железа. Если титруют марганец в отсутствие солей железа, а также в отсутствие свободных кислот, то в раствор можно ввoд iTь лишь очень мало оксида цинка (или даже вовсе не вводить его), так как титрование ведется в очень разбавленных растворах, но необходимо прибавить растворимую соль цинка, например ZnS04 или Zn U- [c.409]
Одновременно с этими протекает также реакция 2Н+-Ь2е—> — -Нг. Выделение металла с практически приемлемым выходом по току в данном случае возможно при условии, что разряд ионов водорода будет искусственно затруднен (тем более, что перенапряжение водорода на хроме мало). Это достигается путем максимального повышения pH. Однако уже при рН = =3 образуются гидроксид Сг(ОН)з и основные соли, сильно загрязняющие металл. Выделение водорода ведет к повышению pH приэлектродного слоя. Поэтому так же, как и марганец, хром получают из сильно буфферированного аммонийными солями комплексного электролита. Таким путем удается получать плотные толстые осадки хрома как из сульфатных, так и из хлоридных электролитов, причем выход по току приближается к 50%. Процесс проводят при обязательном разделении католита и анолита диафрагмой, с свинцово-серебряными анодами. Состав электролита (в г/л) 15 СгЗ+ и 15 Сг +, 200—270 (Nh5)2S04, 250—280 свободной серной кислоты в анолите, что соответствует извлечению из 1 л питающего раствора около 100 г хрома. Процесс ведут при катодной плотности тока до [c.401]
Выделение водорода ведет к повышению pH приэлектродного слоя. Поэтому так же, как и марганец, хром получают из сильно буфферированного аммонийными солями комплексного электролита. Таким путем удается получать плотные толстые осадки хрома как из сульфатных, так и из хлоридных электролитов, причем выход по току приближается к 50%. Процесс проводят при обязательном разделении католита и анолита диафрагмой, с свинцово-серебряными анодами. Состав электролита (в г/л) 15 СгЗ+ и 15 Сг +, 200—270 (Nh5)2S04, 250—280 свободной серной кислоты в анолите, что соответствует извлечению из 1 л питающего раствора около 100 г хрома. Процесс ведут при катодной плотности тока до [c.401]
Раствор должен быть очищен от более электроположительных примесей. Для очистки от железа последнее переводят сначала из FeS04 в Рез(804)з путем окисления его диоксидом марганца. После нейтрализации кислоты Рег (804)3 и АЬ (804)3 осаждаются в виде гидроксидов, которые, осаждаясь, адсорбируют соединения мышьяка и сурьмы. Электроположительные ионы выделяют из раствора цементацией цинковой пылью. Марганец, перешедший в раствор лри окислении железа, не являясь вредной примесью, окисляется на аноде до. диоксида марганца, который опять используется для -окисления железа. Очищенный от примесей раствор сульфата цинка подкисляют для увеличения электропроводности и направляют на электролиз. [c.310]
Электроположительные ионы выделяют из раствора цементацией цинковой пылью. Марганец, перешедший в раствор лри окислении железа, не являясь вредной примесью, окисляется на аноде до. диоксида марганца, который опять используется для -окисления железа. Очищенный от примесей раствор сульфата цинка подкисляют для увеличения электропроводности и направляют на электролиз. [c.310]
Безводную соль получают из кристаллогидрата путем нагревания его до 170°С. Для получения кристаллогидрата в раствор 100 мл концентрированной азотной кислоты в 30 мл воды вносят порощок карбоната кальция СаСОз (или мел) до прекращения выделения СО2. Добавляют гидроксид кальция Са(0Н)2 до сильно щелочной реакции и осаждают примесь марганца, добавляя по каплям 30 7о-ный пероксид водорода Н2О2. Марганец осаждается в виде МпО(ОН)2. [c.48]
Металлический марганец (1681). Оксид марганца(И) (1682). Гидроксид марганца(И) (1682). Оксид марганца(1И) (1684). Оксид марганца(1У) (1684). Оксид марганца( /И) (1685). Манганат(У) натрия (1686). Манганат(У1) калия (1687). Манганат(УИ) бария (1687). Манганат(УИ) серебра (1688). Смешанные кристаллы Ва804 и КМИО4 (1688). Хлорид калия-марганца(И1) (1689). Гексахлороманганат(1 /) калия (1689). Сульфид марганца(П) (1689). Сульфат марганца(1П) (1691). Сульфат цезия-марганиа(1И) (1691). Нитрид марганца (1692). [c.1861]
Оксид марганца( /И) (1685). Манганат(У) натрия (1686). Манганат(У1) калия (1687). Манганат(УИ) бария (1687). Манганат(УИ) серебра (1688). Смешанные кристаллы Ва804 и КМИО4 (1688). Хлорид калия-марганца(И1) (1689). Гексахлороманганат(1 /) калия (1689). Сульфид марганца(П) (1689). Сульфат марганца(1П) (1691). Сульфат цезия-марганиа(1И) (1691). Нитрид марганца (1692). [c.1861]
Кислотно-основные свойства гидроксидов (11 класс)
Урок по теме «Кислотно-основные свойства гидроксидов»
Цель урока.
Образовательная: используя проблемно-интегративный подход к обучению направить поисковую деятельность учащихся на установление закономерности в изменении свойств гидроксидов.
Развивающая: развивать познавательную активность, интеллектуальные способности и логическое мышление учащихся.
Воспитательная: формировать научное мировоззрение, творческое мышление, радость познания.
Оборудование: таблицы «Периодическая система химических элементов Д.И. Менделеева», « Растворимость кислот, оснований, солей в воде», «Относительная электроотрицательность элементов», компьютер, мультимедийный проектор.
Ход урока
I. Актуализация опорных знаний
— Какой процесс называют электролитической диссоциацией?
— На какие группы можно разделить вещества по способности проводить электрический ток в водном растворе или расплаве?
— Какие вещества называются электролитами?
— Неэлектролитами?
— Какие связи имеются в электролитах?
— В неэлектролитах?
— Какие бывают электролиты по способности распадаться на ионы?
— Как идет диссоциация сильных электролитов?
— Слабых электролитов?
_ какая величина характеризует степень распада слабых электролитов на ионы?
— как ее выражают?
— От каких условий зависит степень диссоциации?
— Какая величина характеризует способность электролита диссоциировать на ионы?
— О чем мы можем судить по константе диссоциации?
— способны ли к диссоциации молекулы воды?
— какая величина характеризует ее диссоциацию?
— Что она показывает?
— как оно изменяется с повышением температуры?
— Что позволяет определить ионное произведение воды?
— что называют водородным показателем?
А теперь выполним задание
Задание 1 Соотнесите:
[H⁺] [ОHˉ] pH Среда
I) 10ˉ¹² А)10ˉ¹¹ 1) 3 а) кислотная
II) 10ˉ³ Б)10ˉ⁹ 2) 7 б) нейтральная
III) 10ˉ⁵ В)10ˉ⁷ 3) 12 в) щелочная
IV) 10ˉ⁷ Г) 10ˉ² 4) 5
Решение
I
II
III
IV
Г
А
Б
В
3
1
4
2
в
а
а
б
Выполним второе задание.
Задание 2 Составьте уравнения диссоциации гидроксидов, формулы которых: NaOH, H₂SO₄.
Решение.
NaOH = Na⁺ + OHˉ
I) H₂SO₄ = H⁺ + HSO₄ ˉ
II) HSO₄ ˉ = H⁺ + SO₄ ²ˉ
— На какие ионы распадаются основания?
— На какие ионы распадаются кислоты?
— Следовательно, по каким направлениям протекает диссоциация гидроксидов?
Э – О – Н
(разрыв связи Э – О)
Э – О – Н
(разрыв связи О – Н)
Постановка проблемы
— Когда диссоциация идет по кислотному типу, когда – по основному?
-Что определяет характер ЭД?
(Цель и тему выводят дети)
Постановка цели: определить зависимость кислотно-основных свойств гидроксидов от положения элементов, образующих данные вещества, в Периодической системе химических элементов и типа химической связи.
II
Тема урока: Кислотно-основные свойства гидроксидов
— Вспомним основные закономерности изменения свойств атомов в периоде.
— Как происходить изменение заряда ядра?
— Как его увеличение влияет на радиусы атомов?
— Как изменяется относительная электроотрицательность?
— как изменяются высшие степени окисления центральных атомов в гидроксидах?
— Определим теперь, как изменяется полярность связи Э – О в гидроксидах в периоде слева направо.
Рассмотрим изменение полярности связей Э-О и О-Н в гидроксидах. Для этого определим разности электроотрицательностей и место диссоциации в молекуле.
Диссоциация будет происходить по месту более полярной связи.
— Как изменяется полярность связи Э-О в гидроксидах?
Вывод: полярность связи Э_О слева направо уменьшается, относительная полярность связи О-Н по сравнению со связью Э_О возрастает → возрастает способность гидроксидов к диссоциации по кислотному типу.
— Подумайте, почему я не предложила рассмотреть гидроксиды алюминия и кремний?
Задание 3 Приведенные формулы гидроксидов расположите в порядке увеличения кислотных свойств веществ:
H₂CO₃, H₃BO₃, HNO₃, LiOH, Be(OH)₂
Ответ:
LiOH Be(OH)₂ H₃BO₃ H₂CO₃ HNO₃
— Выясним, как полярность связей Э-О и О-Н зависит от взаимного влияния атомов в молекуле.
Посмотрите на структурную формулу серной кислоты. В молекуле 2 атома кислорода, связанные с атомом серы двойными связями, оттягивают на себя электроны связей. Это приводит к более сильному смещению электронов от атомов водорода в гидроксогруппах к атомам кислорода. В результате полярность связей О_Н в молекуле увеличивается.
В результате полярность связей О_Н в молекуле увеличивается.
— Что происходит в молекуле хлорной кислоты? (Три атома кислорода, связанные с атомом хлора двойными связями, оттягивают на себя электроны связей)
— К чему это приводит? (Еще большее смещение электронов от водорода к атому хлора)
В результате полярность связей О-Н в молекуле хлорной кислоты увеличивается в еще большей степени.
— Какая кислота сильнее, серная или хлорная?
Отметим еще одну закономерность изменения свойств гидроксидов.
Вывод: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, а кислотные усиливаются.
Задание 4 Расположите формулы в порядке увеличения силы кислот: HClO₃, HClO₂, HClO₄, HClO.
Ответ: HClO, HClO₂, HClO₃, HClO₄
Теперь рассмотрим закономерности изменения свойств гидроксидов элементов главных подгрупп.
— Как изменяются радиусы атомов сверху вниз?
— электроотрицательность?
— Степень окисления атомов в соединениях ЭОН?
-Как изменяется разность электроотрицательностей атомов кислорода и элемента
(Э-О)? (возрастает.)
В результате возрастает способность гидроксидов к диссоциации по основному типу.
III Закрепление
1. Полярность связи Э — О слева направо уменьшается, относительная полярность связи О-Н по сравнению со связью Э-О возрастает → возрастает способность гидроксидов к диссоциации по кислотному типу.
2. С увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, а кислотные усиливаются.
Итоги урока
Домашнее задание
Важнейшие классы и номенклатура неорганических соединений (реферат)
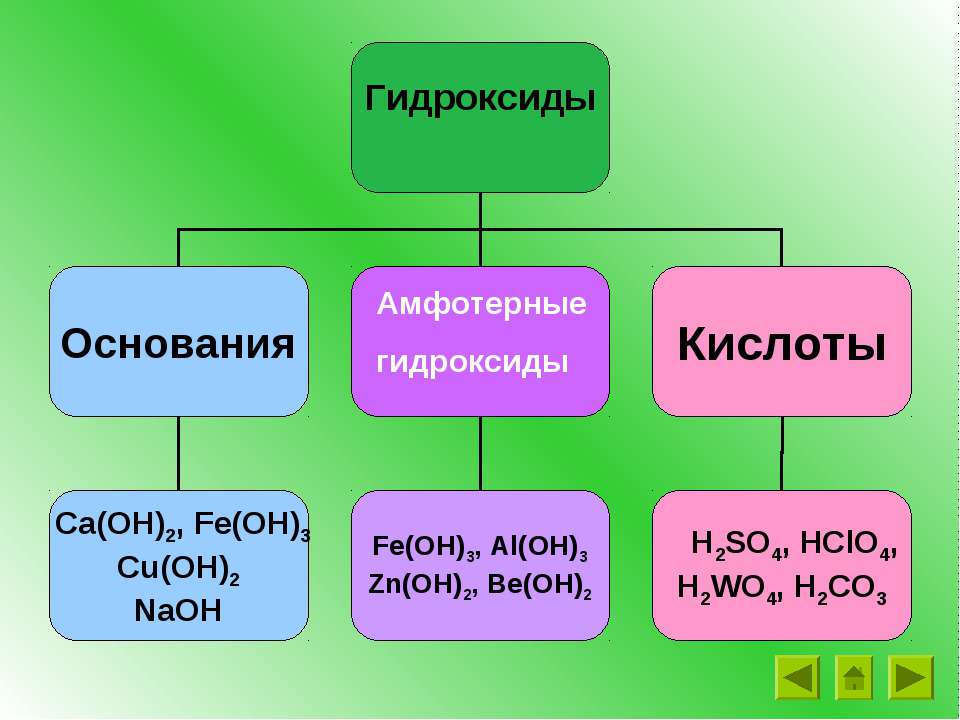
Неорганические соединения делят на следующие классы: оксиды, гидроксиды (кислоты и основания), амфотерные гидроксиды, соли.
. Оксиды
По международной номенклатуре соединения элементов с кислородом называют оксидами; при обозначении этих соединений рядом с формулой или названием указывают в скобках степень окисления элемента, например FeO-оксид железа (II), Fе2О3 — оксид железа (III). Оксиды разделяют на солеобразующие и несолеобраэующие. Солеобразующие, в свою очередь делят на кислотные, основные и амфотерные.
Кислотными (SO2, CO2 и др.) называют такие оксиды, которые образуют соли с основаниями или основными оксидами, например:
2 + 2NaOH = Na2SO3 + Н2О
Основными (CuO, FeO и др.) называют такие оксиды, которые образуют соли с кислотами или кислотными оксидами, например:
+ h3SO4 = CuSO4 + Н2О
Амфотерными называют оксиды металлов, образующие соли при взаимодействии как с кислотами (кислотными оксидами), так и с основаниями (основными оксидами), например:
+ 2НС1 = ZnCI2 + Н2О
ZnO + 2NaOH = Na2ZnO2 + Н2О
Основные оксиды реагируют с кислотами и кислотными оксидами:
+ h3SO4 = FeSO4 + Н2О; MgO + SO3 = MgSO4
Оксиды щелочных и щелочноземельных металлов вступают во взаимодействие с водой:
СаО + Н2O = Са(ОН)2
Кислотные оксиды реагируют с гидроксидами, основными оксидами и (многие) с водой:
+ 2NaOH = Na2SO3 + h3O; Р2О5 + ЗСаО = Cа3(РO4)2;+ h3O = h3SO4
Способы получения оксидов:
взаимодействие веществ с кислородом
Mg + О2 = 2MgO: S + О2 = SO2
разложение гидроксидов, кислот
Сu(ОН2) = СuО + Н2О; 2Н3ВО3 = В2О3 + 3h3O
разложение солей
СаСО3 = СаО + СО2
разложение оксидов
СгО3 = 2Сг2О3 + ЗО2
взаимодействие кислот, обладающих окислительными свойствами, с металлами и неметаллами
С + 2h3SO4 (конц. ) = СО2 + 2SO2 + 2Н2О
) = СО2 + 2SO2 + 2Н2О
. Кислоты
Число атомов водорода, способных замещаться металлами с образованием солей, определяет основность кислоты. Различают кислоты одноосновные (например НС1, НNO3), двухосновные (h3SO4, Н2S), трехосновные (Н3РO4).
По химическому составу кислоты делят на бескислородные (HF, НС1 и др.) и кислородсодержащие (Н2SО4, HNO3 и др.).
Большинство кислотных оксидов образует кислоты путем непосредственного присоединения воды. Кислотные оксиды называют ангидридами кислот. Молекулы некоторых ангидридов могут присоединять разные количества молекул воды. При этом образуются метакислоты, содержащие наименьшее количество воды, и ортокислоты, содержащие наибольшее количество воды.
Например:
Р2О5 + h3O = 2НРО3 — метафосфорная кислота
Р2О5 + 2Н2О = Н4Р2O7 — пирофосфорная кислота
Р2О5 + 3Н2О = 2Н3РO4 — ортофосфорная кислота
Название киcлот, в которых степень окисления центрального атома соответствует номеру группы в 1 таблице Д. И. Менделеева, образуется от русского (названия элемента с суффиксом «н» или «ов», например: HNO3 — азотная кислота, h3WO4 — вольфрамовая кислота.
И. Менделеева, образуется от русского (названия элемента с суффиксом «н» или «ов», например: HNO3 — азотная кислота, h3WO4 — вольфрамовая кислота.
Если элемент имеет разные степени окисления и образует не одну кислоту, то в название кислоты с низшей степенью окисления элемента вводится суффикс «ист», например: Н2SО3 — сернистая кислота; HNO2 — азотистая кислота.
Кислоты взаимодействуют с гидроксидами, основными оксидами, солями, металлами:
НС1 + NaOH = NaCI + Н2О; h3SO4 + CuO = CuSO4 + Н2О
h3SO4 + 2NaCl = Na2SO4 + 2HC1; 2HC1 + Zn = ZnCI2 + h3↑
Некоторые кислоты разлагаются:
Н2СО3 = CO2↑ + Н2О
Определяют кислоты с помощью индикаторов: лакмуса, метилового оранжевого и др.
Способы получения кислот:
взаимодействие ангидридов, с водой
2O5 + Н2О = 2НNО3
взаимодействие солей с кислотами
+ h3SO4 = NaHSO4 + НС1
окисление простых веществ
3P + 5HNO3 + 2h3O = 3h4PO4 + 5NO
соединение неметалла с водородом с последующим растворением полученного соединения в воде (получение бескислородных кислот)
Н2 + Сl2 = НС1
. Основания. Амфотерные гидроксиды
Основания. Амфотерные гидроксиды
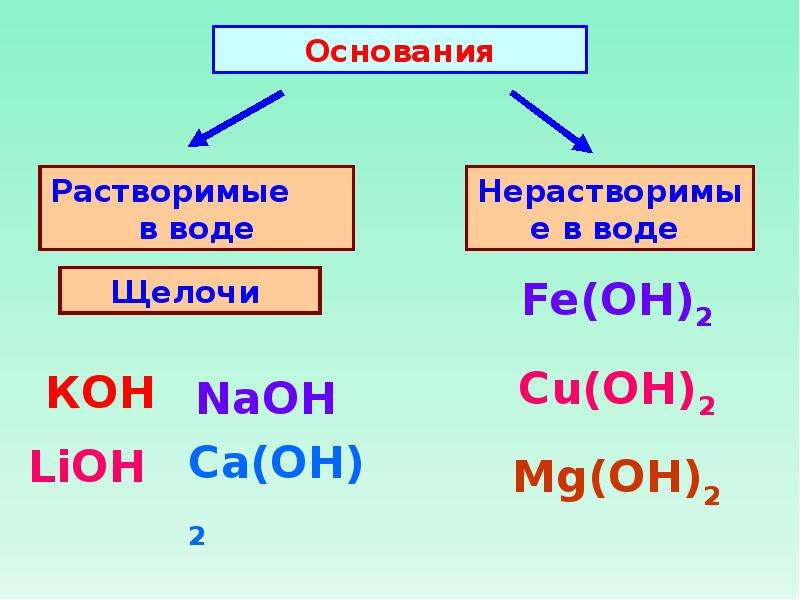
В зависимости от числа гидроксильных групп основания бывают однокислотные (КОН, NaOH и др.) и многокислотные [Са(ОН)2, Ва(ОН)2 и др.]. Основания, растворимые в воде, называют щелочами. К ним относят основания, образованные щелочными и щелочноземельными металлами, и гидроксид аммония.
По международной номенклатуре основания называют гидроксидами. Например, Fe(OH)2 — гидроксид железа (II), Fе(ОН)3 — гидроксид железа (III).
Амфотерные гидроксиды. Гидраты амфотерных оксидов, как и. сами оксиды, обладают амфотерными свойствами. С кислотами они взаимодействуют как основания
(OH)2 + h3SO4 = ZnSO4 + 2h3O
Основаниями — как кислоты:
2ZnO2 + 2NaOH = Na2ZnO2 + 2h3O
Гидроксиды реагируют с кислотными оксидами, с кислотами, с солями, некоторые при нагревании разлагаются:
Са(ОН)2 + СО2 = СаСО3↓ + h3O; NaOH + НС1 = NaCI + Н2О 2КОН + CuSO4 == Cu(OH)2↓ + K2SO4;
Fе(ОН)3 = Fе2О3 + ЗН2О
Растворимые гидроксиды — щелочи определяют с помощью индикаторов: лакмуса, фенолфталеина, метилового оранжевого и др.
Гидроксиды получают взаимодействием:
щелочных и щелочноземельных металлов с водой
Na + 2Н2О = 2NaOH + h3↑
оксидов щелочных и щелочноземельных металлов с водой
ВаО + Н2О = Ва(ОН)2
солей со щелочами (способ получения нерастворимых гидроксидов)
+ 2NaOH = Na2SO4 + Fe(OH)2↓
Щелочи также получают электролизом растворов солей калия, натрия.
. Соли
Соли делят на средние (например, Na2SO4, Nа2СО3), кислые (NaHSO4, NaHC03) и основные (NiOHNO3,A1OHSO4).
По международной номенклатуре название средних и кислых солей производят от названия кислот и металлов, их образовавших. Так: CuSO4 — сульфат меди, К2SO3 — сульфит калия, NaHSO3 — гидросульфит натрия, Nа3РO4 — фосфат натрия, NaHPO4 — гидрофосфат натрия, Nah3PO4 — дигидрофосфат натрия.
Основные соли называют гидроксосоляма, например: NiOHNO3 — нитрат гидроксоникеля, A1OHSO4 — сульфат гидроксоалюминия.
Соли реагируют с солями, кислотами, щелочами, водой, некоторые разлагаются при нагревании:
+ AgNO3 = NaNO3 + AgCl↓;
СаСО3 + 2HC1 = CaCI2 + CO2↑ + Н2О+ 2NaOH == Na2SO4 + Ni(OH)2↓;+ 5h3O = CuSO4 • 5Н2О= MgO + CO2↑
Средние соли получают взаимодействием:
металла с кислотой
+ h3SO4 (разб. ) = ZnSO4 + h3↑;
) = ZnSO4 + h3↑;
Сu + 2Н2SO4(конц.) = CuSO4 + SO2↑ + 2Н2О
основного оксида с кислотой
СаО + 2HC1 = CaCI2 + Н2О
гидроксида с кислотой
NaOH + h3SO4 = Na2SO4 + 2Н2О
соли с кислотой
СаСО3 + 2НNО3 = Сa(NО3)2 + CO2↑ + Н2О
основного оксида с кислотным
СаO + SiO2 = CaSiO3
гидроксида с кислотным оксидом
КОН + N2O5 = 2КNО3 + Н2О
соли со щелочью
(NO3)3 + 3NaOH == 3NaNO3 + Fe(OH)3↓
соли с солью
Ва(NО3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
металла с солью
+ CuSO4 = FeSO4 + Cu↓
металла с неметаллом
+ S = FeS
металла со щелочью
оксид соль кислота основание
Zn + 2NaOH = Na2ZnO2 + h3↑
неметалла со щелочью
Сl2 + 2КОН = КС1 + КС1O + Н20
неметалла с солью
Сl2 + 2KI = 2КС1 + I2
Средние соли можно получить также разложением кислородных солей при нагревании:
КС1O3 = 2КC1 + 3O2↑
Способы получения кислых солей:
неполная нейтрализация кислоты или кислотного оксида гидроксидом
SO4 + NaOH = NaHSO4 + Н2О; CO2 + NaOH == NaHCO3
действие кислоты или кислотного оксида на нормальную соль той же кислоты:
а2SO4 + h3SO4 = 2NaHSO4;
СаСО2 + Н2О = Са(НСО3)2
Основные соли чаще всего получают неполной нейтрализацией гидроксида кислотой:
(OH)2 + НС1 = MgOHCl + h3O
Кислые соли можно перевести в средние прибавлением щелочи, а основные в средние-добавлением кислоты:
+ NaOH = Na2CO3 + h3O;(OH)2Cl + 2НС1 = FeCI3 + 2Н2O
Литература
Аналитическая химия. Физические и физико-химические методы анализа./ Под ред. О.М.Петрухина. — М., 2005
Физические и физико-химические методы анализа./ Под ред. О.М.Петрухина. — М., 2005
Артеменко А.И. Органическая химия.- М., 2006
Ахметов Н.С. Общая и неорганическая химия.- М., 2003
Биологическая химия./Под ред. Ю.Б. Филипповича, Н.И. Ковалевская, Г.А. Севастьяновой . — М., 2005
Биохимия./Под редакцией В.Г.Щербакова. — СПб., 2003
Скачать архив (4.5 Kb)
Схожие материалы:
Оксиды и гидроксиды в природе составляют около 17% от массы земной коры.
Основу структур большинства оксидов составляют плотнейшие или приближающиеся к плотнейшим кубические и гексагональные упаковки атомов кислорода, октаэдрические и тетраэдрические пустоты которых заполнены катионами. Поэтому большая часть оксидов имеет высокие твердость, плотность и несовершенную спайность.
Для оксидов кремния, алюминия, магния часто характерны ионно-ковалентные связи, в остальных оксидах (меди, железа, хрома и т. д.) обнаруживается также некоторая доля металлических связей. Поэтому оксиды кремния, алюминия, магния обладают повышенной твердостью (7-9 — кварц, шпинель, корунд, хризоберилл), у остальных оксидов твердость более низкая (5-6).
д.) обнаруживается также некоторая доля металлических связей. Поэтому оксиды кремния, алюминия, магния обладают повышенной твердостью (7-9 — кварц, шпинель, корунд, хризоберилл), у остальных оксидов твердость более низкая (5-6).
Большинство оксидов черного, темно-бурого цвета.
Блеск — от металлического до алмазного.
Оксиды Si, Al, Mg, как правило, сами по себе бесцветны, но часто бывают окрашены благодаря примесям элементов-хромофоров (рубин), электронно-дырочными центрами (морион) или механическими вростками окрашенных минералов (авантюрин).
Плотность оксидов колеблется от 2,5 (кварц) до 10,5 г/см3 (уранинит) и зависит в основном от атомных масс входящих в них элементов. Необычно низкая для этого класса минералов плотность кварца объясняется его ”рыхлой” каркасной структурой.
Оксиды часто встречаются в виде хорошо ограненных кристаллов, форма которых используется при их диагностике. Оксиды с координационными структурами кристаллизуются в кубической сингонии и имеют, как правило, изометрический облик кристаллов (шпинель, пирохлор и др. ). Цепочечные мотивы в структуре минералов приводят к появлению у таких минералов спайности и удлиненно-уплощенного облика кристаллов (рутил, брукит, касситерита и др.).
). Цепочечные мотивы в структуре минералов приводят к появлению у таких минералов спайности и удлиненно-уплощенного облика кристаллов (рутил, брукит, касситерита и др.).
Оксиды, содержащие в своем составе уран и торий, радиоактивны, что приводит к их метамиктному распаду и появлению вокруг кристаллов бурых ореолов (плеохроический дворик), а сами минералы приобретают характерный смоляной блеск; понижается их твердость и плотность.
Структуры многих гидроксидов составляет плотнейшую упаковку как атомов кислорода, так и групп ОН.
В гидроксидах связь ионно-ковалентная связей с существенным влиянием водородных связей.
Гидроксиды со слоистыми структурами (брусит, гиббсит) легко узнаются по уплощенно-таблитчатым кристаллам, листовато-чешуйчатым агрегатам, низкой твердости (2,5-3,5) и плотности (2,3-2,4 г/см3). Для них характерны весьма совершенная спайность и перламутровый отлив на плоскостях спайности.
В гидроксидах ленточной структуры, где проявляются достаточно прочные водородные связи, повышаются твердость (5-6) и плотность (3,3-4,4 г/см3) (диаспор, гетит).
Гидроксиды редко встречаются в природе в виде хорошо ограненных кристаллов. Обычно они образуют сплошные, рыхлые, землистые, порошковатые, натечные агрегаты и оолиты.
Гидроксиды Fe, Mn имеют бурую, черную окраску, Al, Mg — бесцветны, но могут быть окрашены механическими вростками оксидов и гидроксидов железа.
Урок химии по теме: «Гидроксиды металлов»
Тема урока: «Гидроксиды металлов».
Цели урока:
Обобщающие: Обобщить и систематизировать материал о важнейших гидроксидах металлов (предметный результат).
Развивающие: Выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
Воспитательные: Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат).
Ход урока
Актуализация субъективного опыта (10 мин)
Опрос домашнего задания. Ответы на вопросы.
Что такое оксиды? (Оксиды – сложные вещества, которые состоят из двух элементов, одним из которых является кислород).
Как классифицируются оксиды? (Оксиды металлов бывают: основные (CaO, Na2O), кислотные (Mn2O7), амфотерные (ZnO, Al2O3).
Основные оксиды – оксиды, при взаимодействии которых с водой образуются основания.
Кислотные оксиды – оксиды, при взаимодействии которых с водой образуются кислоты. Неметаллы и металлы с валентностью больше 4. (Хром, марганец).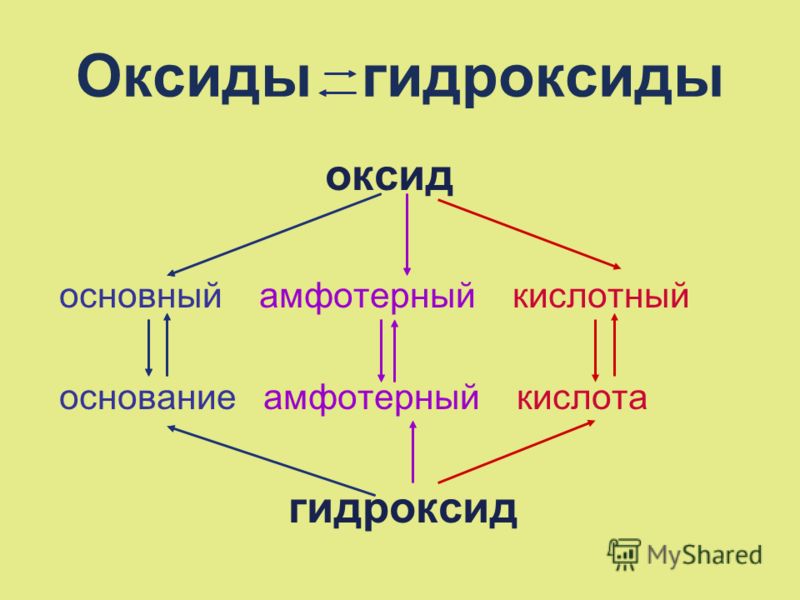
Физические свойства оксидов?(твердые CaO, жидкие SO3, газы CO2).
Химические свойства основных оксидов?(работа с карточками)
Взаимодействие с кислотами (образуется соль и вода):
CuO + H2SO4 = CuSO4 + H2O
Взаимодействие с водой (образуется основание):
Li2O + H2O = 2LiOH
Взаимодействие с кислотными оксидами:
CaO + CO2 = CaCO3
Объяснение нового материала.
Гидроксиды. Основания.
Гидроксиды – это сложные вещества, в состав которых входит группа –OH.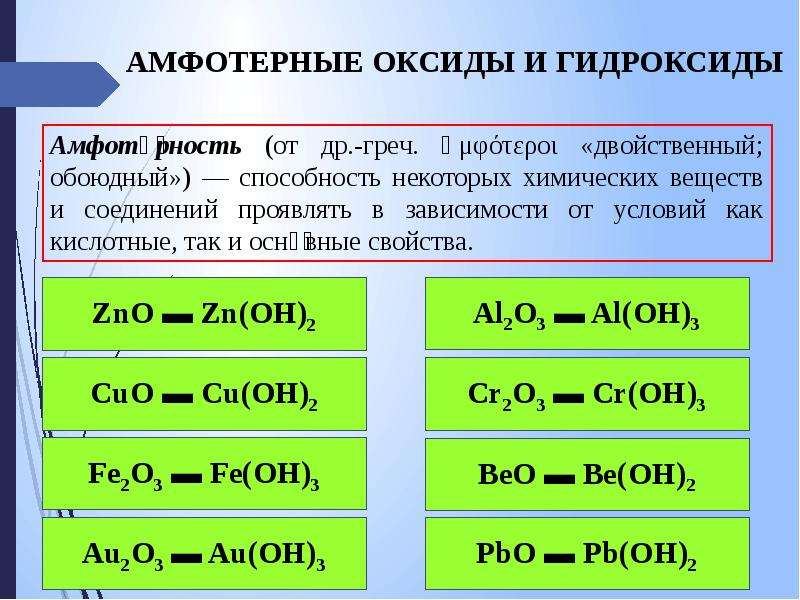
Гидроксиды
Основные (ОСНОВАНИЯ) | Амфотерные | Кислотные (КИСЛОТЫ) |
Все гидроксиды одновалентных металлов и большинства двухвалентных металлов. | Большинство гидроксидов металлов с валентностью III и IV. | Гидроксиды неметаллов и гидроксиды металлов с валентностью V, VI и VII. |
NaOH, KOH, Ba(OH)2, Fe(OH)2, Mg(OH)2, Cu(OH)2, Ca(OH)2 | Be(OH)2, Al2(OH)3, Cr2(OH)3, Zn(OH)2, Fe(OH)3 | H2CO3, H2SO4, HMnO4, K2CrO4 |
Растворимые (ЩЕЛОЧИ) | Нерастворимые |
NaOH, KOH, Ba(OH)2, Ca(OH)2 | Mg(OH)2, Cu(OH)2, Fe(OH)2 |
ОСНОВАНИЯ
Основания – это сложные вещества, в молекуле которых атомы металла связаны с одной или несколькими гидроксидными группами –OH (Ме ОН).
Щелочи – это растворимые в воде основания. Некоторые растворимые в воде основания называют едкими щелочами: NaOH – едкий натр, KOH – едкий кали.
Все основания – твёрдые вещества (кроме гидроксида аммония NH4OH), имеющие разные цвета: Cu(OH)2 – голубой, Fe(OH)2 – бледно-зелёный, Ca(OH)2 – белый, Co(OH)2 – розовый.
Графические формулы.
Показывают порядок связей и их количество (по валентности). В гидроксидах атомы кислорода связаны только с атомами других элементов и не связаны между собой.
Ca(OH)2 | HO – Ca – OH |
NaOH | Na – O – H |
Получение оснований
Растворимых оснований:
Взаимодействием щелочных и щелочноземельных металлов с водой
2Na + 2HOH 2NaOH + H2↑
Ca + 2HOH Ca(OH)2 + H2↑
Взаимодействием оксидов щелочных и щелочноземельных металлов с водой
Na2O + H2O à 2NaOH (Na2O·H2O)
BaO + H2O Ba(OH)2 (BaO·H2O)
Нерастворимых оснований:
Взаимодействием щелочей с растворимыми солями металлов
2NaOH + CuSO4 Cu(OH)2↓ + Na2SO4
2KOH + ZnCl2 Zn(OH)2↓ + 2KCl
Химические свойства
Общие свойства оснований объясняются наличием в их растворах анионов OH-, которые образуются в результате электролитической диссоциации молекул оснований:
Me(OH)y ↔ Mey+ + yOH—
Водные растворы щелочей изменяют окраску индикаторов
Индикатор | Цвет индикатора в среде | ||
Щелочной (pH 7) | Нейтральной (pH = 7) | Кислой (pH ) | |
Универсальная индикаторная бумага | Синий | Желтый | Красный |
Лакмус | Синий | Фиолетовый | Красный |
Фенолфталеин | Малиновый | Бесцветный | Бесцветный |
Метиловый оранжевый | Желтый | Оранжевый | Розовый |
Взаимодействуют с кислотами с образованием соли и воды
NaOH + HCl NaCl + HOH
Cu(OH)2 + H2SO4 CuSO4 + 2HOH
Взаимодействуют с кислотными оксидами с образованием соли и воды
2NaOH + SO2 Na2SO3 + H2O
Ca(OH)2 + CO2 CaCO3 + H2O
Растворы щелочей взаимодействуют с растворами солей при образовании нерастворимого основания или нерастворимой соли
2NaOH + CuSO4 Cu(OH)2↓ + H2O
Ba(OH)2 + Na2SO4 BaSO4↓ + 2NaOH
Нерастворимые основания при нагревании разлагаются на основной оксид и воду
to
Cu(OH)2 CuO + H2O
Растворы щелочей взаимодействуют металлами, которые образуют амфотерные оксиды и гидроксиды:
Zn + 2NaOH Na2ZnO2 + H2↑
цинкат натрия
2Al + 2KOH + 6H2O 2K[Al(OH)4] + 3H2↑
тетрагидроксоалюминат калия
Растворы щелочей взаимодействуют амфотерными оксидами:
ZnO + 2NaOH Na2ZnO2 + H2O
цинкат натрия
Al2O3 + 2KOH 2KAlO2 + H2O
алюминат калия
Щелочи взаимодействуют амфотерными гидроксидами:
в расплаве
Al(OH)3 + KOH à KAlO2 + 2H2O
алюминат калия
в растворе
Al(OH)3 + KOH à K[Al(OH)4]
Щелочи взаимодействуют с неметаллами:
2NaOH + Cl20 NaCl-1 + NaCl+1O + H2O
ОСНОВАНИЕ | НЕМЕТАЛЛ | НЕМЕТАЛЛ |
ТИПИЧНЫЙ МЕТАЛЛ «АМФОТЕРНЫЙ» МЕТАЛЛ» | МЕТАЛЛ | |
ОСНОВНОЙ ОКСИД АМФОТЕРНЫЙ ОКСИД КИСЛОТНЫЙ ОКСИД | ОКСИД | |
ОСНОВНОЙ (ОСНОВАНИЕ) АМФОТЕРНЫЙ ГИДРОКСИД КИСЛОТНЫЙ (КИСЛОТА) | ГИДРОКСИД | |
СОЛЬ | СОЛЬ |
Подведение итогов учебного занятия, рефлексия (5 мин)
Домашнее задание.
Получение и свойства амфотерных гидроксидов. Амфотерные гидроксиды
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH) 2 . Однако существуют исключения. Так, гидроксиды Zn(OH) 2 , Be(OH) 2 , Pb(OH) 2 , Sn(OH) 2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH) 2 , Be(OH) 2 , Pb(OH) 2 , Sn(OH) 2 . Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH) 2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P 2 O 5 , SO 3 , N 2 O 5 , с образованием средних соле1:
Нерастворимые основания вида Me(OH) 2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Например:
Cu(OH) 2 + CO 2 = (CuOH) 2 CO 3 + H 2 O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na образуется соль Na 3 :
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH) 2 , устойчивы к нагреванию и плавятся без разложения.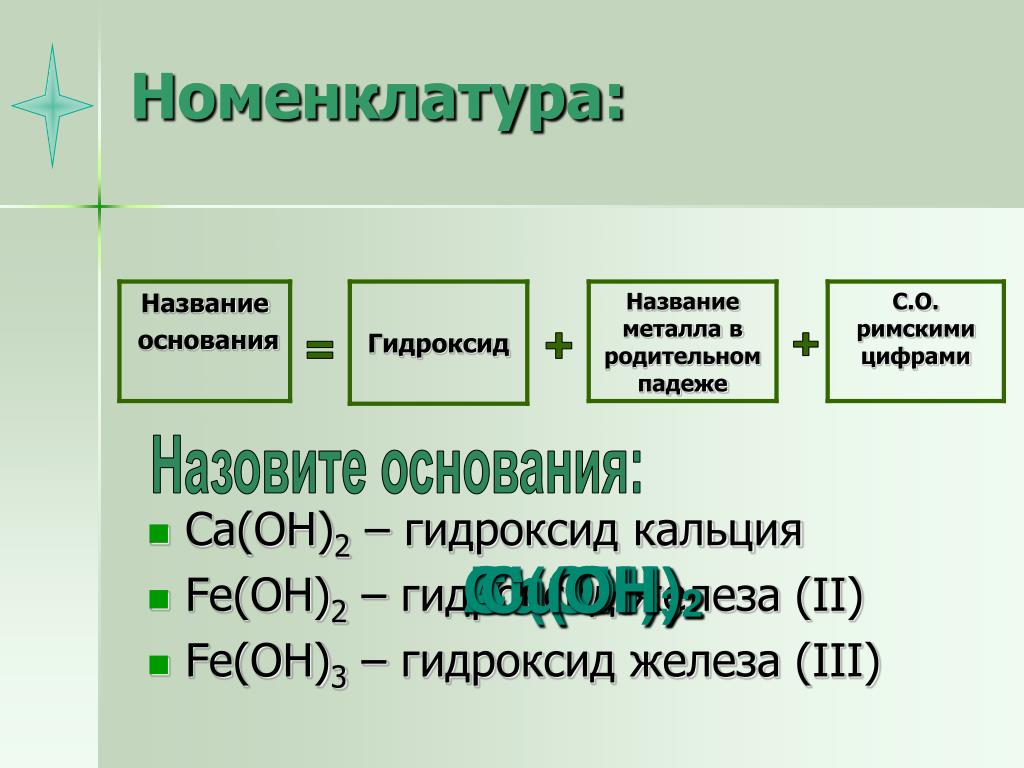
Все нерастворимые основания, а также малорастворимый Ca(OH) 2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с сильными кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH) 3, не реагируют с такими кислотами, как H 2 S, H 2 SO 3 и H 2 СO 3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO 3 , P 2 O 5 , N 2 O 5):
Амфотерные гидроксиды металлов в степени окисления +3, т. е. вида Me(OH) 3 , не реагируют с кислотными оксидами SO 2 и СO 2 .
е. вида Me(OH) 3 , не реагируют с кислотными оксидами SO 2 и СO 2 .
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду.
Существует три основных класса неорганических химических соединений: оксиды, гидроксиды и соли. Первые делятся на две группы: несолеобразующие (к ним относятся угарный газ, закись азота, монооксид азота и т. д.) и солеобразующие, которые, в свою очередь, бывают основными, кислотными и амфотерными. Гидроксиды делятся на кислоты, основания и амфотерные. Соли существуют основные, кислые, средние и двойные. Ниже будут более подробно описаны амфотерные оксиды и гидроксиды.
Гидроксиды делятся на кислоты, основания и амфотерные. Соли существуют основные, кислые, средние и двойные. Ниже будут более подробно описаны амфотерные оксиды и гидроксиды.
Что такое амфотерность?
Это способность неорганического химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции. К веществам, которые обладают такого рода особенностью, могут относиться оксиды и гидроксиды. Среди первых можно назвать оксид и диоксид олова, бериллия, марганца, цинка, железа (ІІ), (ІІІ). Амфотерные гидроксиды представлены такими веществами: гидроксид бериллия, алюминия, железа (ІІ), метагидроксид железа, алюминия, дигидроксид-оксид титана. Самыми распространенными и часто используемыми из перечисленных выше соединений являются оксид железа и алюминия, а также гидроксиды этих металлов.
Химические свойства амфотерных оксидов
Амфотерные оксиды имеют одновременно как свойства кислотных, так и основных соединений. Как кислотные, они могут взаимодействовать со щелочами. При такого типа реакциях образуются соль и вода. Также они вступают в химическую реакцию с основными оксидами. Проявляя свои основные свойства, они вступают во взаимодействиескислотами, вследствие чего образуются соль и вода, а также с кислотными оксидами, благодаря чему можно получить соль.
При такого типа реакциях образуются соль и вода. Также они вступают в химическую реакцию с основными оксидами. Проявляя свои основные свойства, они вступают во взаимодействиескислотами, вследствие чего образуются соль и вода, а также с кислотными оксидами, благодаря чему можно получить соль.
Примеры уравнений реакций, в которых участвуют амфотерные оксиды
АІ 2 О 3 + 2КОН = 2КАІО 2 + Н 2 О — данная реакция показывает кислотные свойства амфотерных оксидов. 2АІ 2 О 3 + 6НСІ = 4АІСІ 3 + 3Н 2 О; АІ 2 О 3 + 3СО 2 = АІ2(СО 3) 3 — эти уравнения служат примером основных химических свойств таких оксидов.
Химические свойства амфотерных гидроксидов
Они способны вступать в химическое взаимодействие как с сильными кислотами, так и со щелочами, а некоторые из них реагируют также со слабыми кислотами. Все они при воздействии высоких температур распадаются на оксид и воду. При реакции амфотерного гидроксида с кислотой образуются соль и вода. Все такие гидроксиды нерастворимы в воде, поэтому могут реагировать только с растворами определенных соединений, но не с сухими веществами.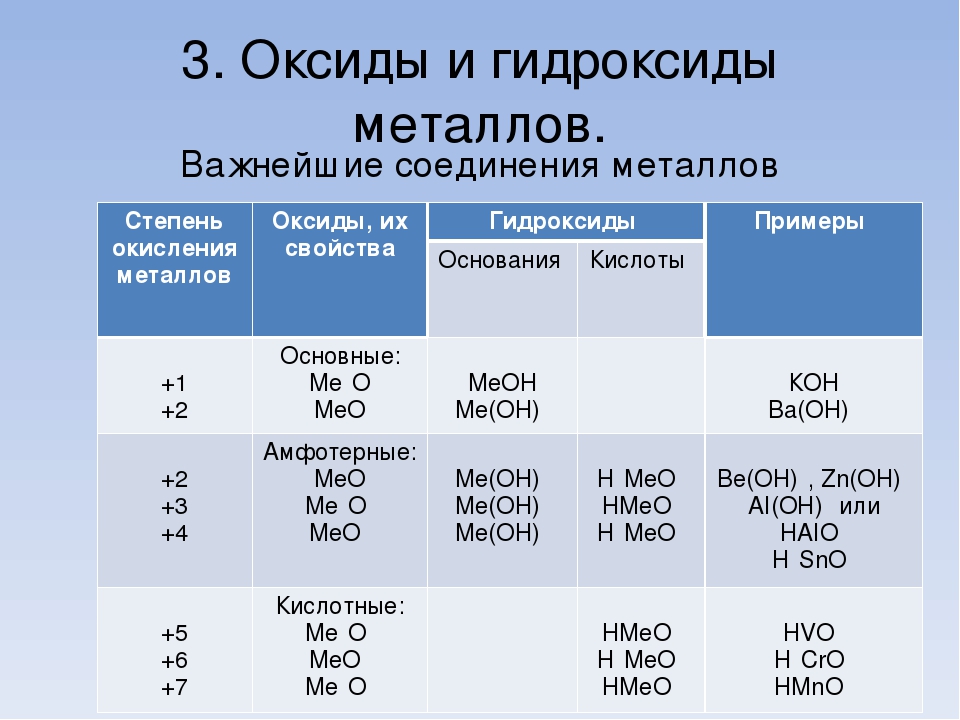
Физические свойства амфотерных оксидов, способы их получения и применение
Оксид ферума (ІІ) — пожалуй, самый распространенный амфотерный оксид. Способов его получения существует довольно много. Он широко используется в промышленности. Другие амфотерные оксиды также применяются во многих отраслях: от металлургии до пищевой промышленности.
Внешний вид, получение и использование ферум (ІІ) оксида
Он представляет собой твердое вещество черного цвета. Его кристаллическая решетка схожа с решеткой пищевой соли. В природе его можно найти в виде минерала вюстита.
Данное химическое соединение получают четырьмя различными способами. Первый — восстановление оксида железа (ІІІ) с использованием угарного газа. При этом, смешав одинаковое количество этих двух веществ, можно получить две части оксида железа (ІІ) и одну — углекислого газа. Второй метод получения — взаимодействие железа с его оксидами, к примеру, ферум (ІІІ) оксидом, при этом не образуется никаких побочных продуктов.
Однако для такой реакции необходимо создать условия в виде высокой температуры — 900-1000 градусов по Цельсию. Третий способ — реакция между железом и кислородом, в этом случае образуется только оксид железа (ІІ). Для осуществления данного процесса также понадобится нагревание исходных веществ. Четвертым методом получения является оксалата двухвалентного железа. Для такой реакции необходима высокая температура, а также вакуум. В результате образуются ферум (ІІ) оксид, углекислый и угарный газ в соотношении 1:1:1. Из написанного выше можно сделать вывод, что самым простым и не требующим специальных условий является первый способ получения данного вещества. Применяют оксид железа (ІІ) для выплавки чугуна, также он является одной из составляющих некоторых красителей, используется в процессе чернения стали.
Оксид железа (ІІІ)
Это не менее распространенный амфотерный оксид, чем описанный выше. При нормальных условиях он представляет собой твердое вещество, имеющее красно-коричневый цвет.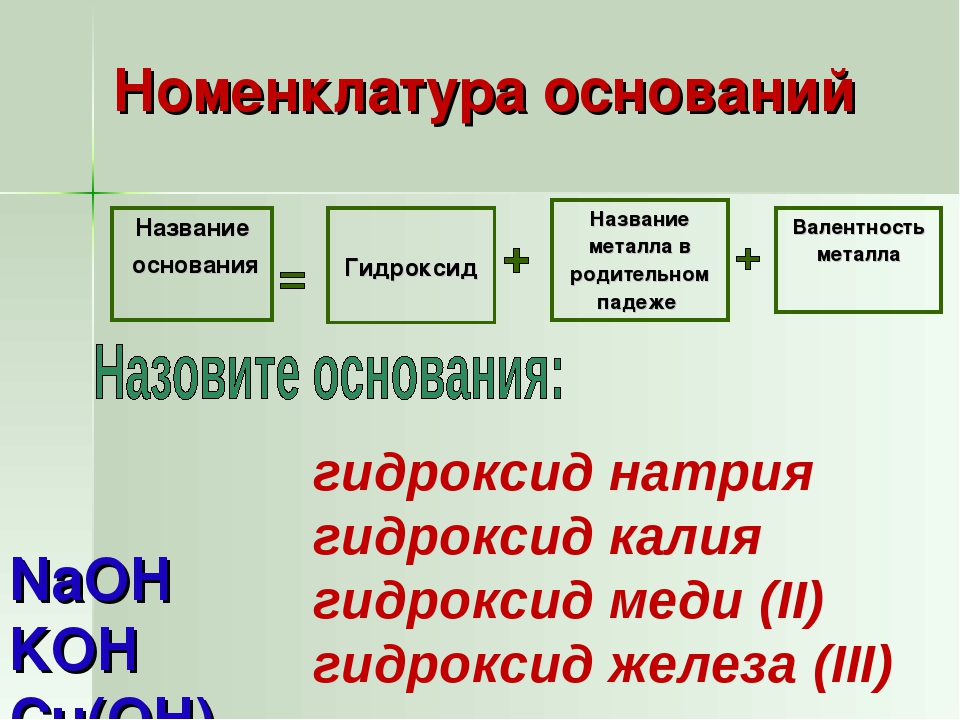 В природе может встретиться в виде минерала гематита, который используется в изготовлении украшений. В промышленности данное вещество получило широкое применение: его используют для окрашивания некоторых строительных материалов, таких как кирпич, тротуарная плитка и т. д., в изготовлении красок, в том числе полиграфических, и эмалей. Также рассматриваемое вещество служит пищевым красителем под названием Е172. В химической отрасли его применяют при производстве аммиака в качестве катализатора.
В природе может встретиться в виде минерала гематита, который используется в изготовлении украшений. В промышленности данное вещество получило широкое применение: его используют для окрашивания некоторых строительных материалов, таких как кирпич, тротуарная плитка и т. д., в изготовлении красок, в том числе полиграфических, и эмалей. Также рассматриваемое вещество служит пищевым красителем под названием Е172. В химической отрасли его применяют при производстве аммиака в качестве катализатора.
Оксид алюминия
Амфотерные оксиды также включают в свой список и оксид алюминия. Данное вещество при нормальных условиях имеет твердое состояние. Цвет этого оксида белый. В природе его часть можно встретить в виде глинозема, а также сапфира и рубина. Используется в основном в химической промышленности в качестве катализатора. Но также его применяют и в изготовлении керамики.
Оксид цинка
Это химическое соединение также обладает амфотерностью. Это твердое вещество, не имеющее цвета, в воде не растворяется. Получают его в основном посредством разложения различных соединений цинка. К примеру, его нитрата. При этом выделяется оксид цинка, диоксид азота и кислород. Также можно добыть данное вещество посредством разложения карбоната цинка. При такой реакции, кроме нужного соединения, выделяется еще и углекислый газ. Также возможен распад гидроксида цинка на его оксид и воду. Для того чтобы осуществить все три выше перечисленных процесса, требуется воздействие высокой температуры. Применяют оксид цинка в различных отраслях промышленности, например, в химической (в качестве катализатора) для изготовления стекла, в медицине для лечения кожных дефектов.
Получают его в основном посредством разложения различных соединений цинка. К примеру, его нитрата. При этом выделяется оксид цинка, диоксид азота и кислород. Также можно добыть данное вещество посредством разложения карбоната цинка. При такой реакции, кроме нужного соединения, выделяется еще и углекислый газ. Также возможен распад гидроксида цинка на его оксид и воду. Для того чтобы осуществить все три выше перечисленных процесса, требуется воздействие высокой температуры. Применяют оксид цинка в различных отраслях промышленности, например, в химической (в качестве катализатора) для изготовления стекла, в медицине для лечения кожных дефектов.
Оксид бериллия
Получают его в основном путем термического разложения гидроксида данного элемента. При этом также образуется вода. Он имеет вид твердого бесцветного вещества. Применение свое данный оксид находит в различных отраслях промышленности в качестве термостойкого материала.
Оксид олова
Имеет темный цвет, обладает твердым состоянием при нормальных условиях. Получить его возможно, как и многие другие амфотерные оксиды, посредством разложения его гидроксида. В результате образуется рассматриваемое вещество и вода. Для этого также нужно воздействие высокой температуры. Используется данное соединение в химической промышленности в качестве восстановителя в окислительно-восстановительных реакциях, реже применяется как катализатор.
Получить его возможно, как и многие другие амфотерные оксиды, посредством разложения его гидроксида. В результате образуется рассматриваемое вещество и вода. Для этого также нужно воздействие высокой температуры. Используется данное соединение в химической промышленности в качестве восстановителя в окислительно-восстановительных реакциях, реже применяется как катализатор.
Свойства, получение и применение амфотерных гидроксидов
Амфотерные гидроксиды используются не менее широко, нежели оксиды. Благодаря своему разностороннему химическому поведению, они в основном применяются для получения всевозможных соединений. Кроме того, гидроксид железа (бесцветное твердое вещество) используется в изготовлении аккумуляторов; гидроксид алюминия — для очистки воды; гидроксид бериллия — для получения оксида.
Амфотерными
являются следующие оксиды элементов главных подгрупп:
BeO,
A1 2 O 3 ,
Ga 2 O 3 ,
GeO 2 ,
SnO,
SnO 2 ,
PbO,
Sb 2 O 3 ,
РоO 2 .
Амфотерными гидроксидами являются
следующие гидроксиды элементов главных подгрупп:
Ве(ОН) 2 ,
А1(ОН) 3 ,
Sc(OH) 3 ,
Ga(OH) 3 ,
In(OH) 3 ,
Sn(OH) 2 ,
SnО 2 ·nH 2 О,
Pb(OH) 2 ,
PbО 2 ·nH 2 О.
Основный характер оксидов и гидроксидов элементов одной подгруппы усиливается с возрастанием порядкового номера элемента (при сравнении оксидов и гидроксидов элементов в одной и той же степени окисления). Например, N 2 O 3 , Р 2 O 3 , As 2 O 3 – кислотные оксиды, Sb 2 O 3 – амфотерный оксид, Bi 2 O 3 – основный оксид.
Рассмотрим амфотерные свойства гидроксидов на примере соединений бериллия и алюминия.
Гидроксид алюминия проявляет амфотерные свойства, реагирует как с основаниями, так и с кислотами и образует два ряда солей:
1) в которых элемент А1 находится в форме катиона;
2А1(ОН) 3 + 6НС1 = 2А1С1 3 + 6Н 2 O А1(ОН) 3 + 3Н + = А1 3+ + 3Н 2 O
В этой реакции А1(ОН) 3 выполняет функцию основания, образуя соль, в которой алюминий является катионом А1 3+ ;
2) в которых элемент А1 входит в состав аниона (алюминаты).
А1(ОН) 3 + NaOH = NaA1O 2 + 2Н 2 O.
В
этой реакции А1(ОН) 3
выполняет функцию кислоты, образуя
соль, в которой алюминий входит в состав
аниона AlO 2 – .
Формулы растворенных алюминатов записывают упрощенно, имея ввиду продукт, образующийся при обезвоживании соли.
В химической литературе можно встретить разные формулы соединений, образующихся при растворении гидроксида алюминия в щёлочи: NaA1О 2 (метаалюминат натрия), Na тетрагидроксоалюминат натрия. Эти формулы не противоречат друг другу, так как их различие связано с разной степенью гидратации этих соединений: NaA1О 2 ·2Н 2 О – это иная запись Na. При растворении А1(ОН) 3 в избытке щелочи образуется тетрагидроксоалюминат натрия:
А1(ОН) 3 + NaOH = Na.
При спекании реагентов – образуется метаалюминат натрия:
А1(ОН) 3 + NaOH ==== NaA1О 2 + 2Н 2 О.
Таким образом, можно говорить, что в водных растворах присутствуют одновременно такие ионы, как [А1(ОН) 4 ] – или [А1(ОН) 4 (Н 2 О) 2 ] – (для случая, когда составляется уравнение реакции с учетом гидратной оболочки), а запись A1О 2 – является упрощенной.
Из-за способности реагировать со щелочами гидроксид алюминия, как правило, не получают действием щелочи на растворы солей алюминия, а используют раствор аммиака:
A1 2 (SО 4) 3
+ 6 NH 3 ·Н 2 О
= 2А1(ОН) 3 + 3(NH 4) 2 SО 4 .
Среди гидроксидов элементов второго периода амфотерные свойства проявляют гидроксид бериллия (сам бериллий проявляет диагональное сходство с алюминием).
С кислотами:
Ве(ОН) 2 + 2НС1 = ВеС1 2 + 2Н 2 О.
С основаниями:
Ве(ОН) 2 + 2NaOH = Na 2 (тетрагидроксобериллат натрия).
В упрощенном виде (если представить Ве(ОН) 2 как кислоту Н 2 ВеО 2)
Ве(ОН) 2 + 2NaOH(конц.горяч.) = Na 2 BeО 2 + 2H 2 О.
бериллат Na
Гидроксиды элементов побочных подгрупп, соответствующие высшим степеням окисления, чаще всего имеют кислотные свойства: например, Мn 2 О 7 – НМnО 4 ; CrО 3 – H 2 CrО 4 . Для низших оксидов и гидроксидов характерно преобладание основных свойств: СrО – Сr(ОН) 2 ; МnО – Mn(OH) 2 ; FeO – Fe(OH) 2 . Промежуточные соединения, соответствующие степеням окисления +3 и +4, часто проявляют амфотерные свойства: Сr 2 О 3 – Cr(OH) 3 ; Fe 2 О 3 – Fe(OH) 3 . Проиллюстрируем эту закономерность на примере соединений хрома (таблица 9).
Таблица 9 – Зависимость характера оксидов и соответствующих им гидроксидов от степени окисления элемента
Взаимодействие с кислотами приводит к образованию соли, в которой элемент хром находится в форме катиона:
2Cr(OH) 3
+ 3H 2 SO 4
= Cr 2 (SO 4) 3
+ 6H 2 O.
сульфат Cr(III)
Взаимодействие с основаниями приводит к образованию соли, в которой элемент хром входит в состав аниона:
Cr(OH) 3 + 3NaOH = Na 3 + 3H 2 О.
гексагидроксохромат (III) Na
Оксид и гидроксид цинка ZnO, Zn(OH) 2 – типично амфотерные соединения, Zn(OH) 2 легко растворяется в растворах кислот и щелочей.
Взаимодействие с кислотами приводит к образованию соли, в которой элемент цинк находится в форме катиона:
Zn(OH) 2 + 2HC1 = ZnCl 2 + 2H 2 O.
Взаимодействие с основаниями приводит к образованию соли, в которой элемент цинк находится в составе аниона. При взаимодействии со щелочами в растворах образуются тетрагидроксоцинкаты, при сплавлении – цинкаты:
Zn(OH) 2 + 2NaOH = Na 2 .
Или при сплавлении:
Zn(OH) 2 + 2NaOH = Na 2 ZnO 2 + 2Н 2 O.
Получают гидроксид цинка аналогично гидроксиду алюминия.
Ступень обучения: III (X класс).
Характер ориентации: средний уровень.
Ведущий принцип: деятельностный, коммуникативный.
Метод–доминанта: проблемно-поисковый.
Триединая цель урока:
1) Образовательный аспект
- Актуализировать и обобщить ранее полученные учащимися знания об основных классах неорганических соединений.
- Закрепить умения учащихся составлять уравнения химических реакций с участием амфотерных гидроксидов.
- Продолжить формирование у учащихся понятия «амфотерности».
2) Развивающий аспект
- Показать возможность применения своих знаний при решении качественных задач и выполнении упражнений.
- Продолжить формирование навыков познавательной деятельности, путем объяснения поставленного перед учащимися проблемного опыта.
- Продолжить формирование умения сравнивать, анализировать и сопоставлять результаты проведенных опытов;
- Формирование умения проводить аналогии между различными объектами;
- Развитие внимания и памяти.

- Развитие экспериментальных навыков.
3) Воспитывающий аспект
- Формирование научного мировоззрения.
- Формирование культуры учебного труда.
- Обратить внимание на эстетику учебной и трудовой деятельности при выполнении опытов.
- Воспитание культуры общения, умения взаимодействовать в паре;
- Формирование у учащихся культуры умственного труда, аккуратности в выполнении заданий и написании формул.
- Воспитание человека как части природы и общества, подчиняющегося их законам.
Оборудование и реактивы: растворы хлорида цинка, гидроксида натрия, аммиака, хлорида алюминия, соляной кислоты, хлорида магния, хлорида натрия; пробирки.
Ход урока
1. Организационный момент
2. Повторение пройденного материала
Индивидуальный опрос у доски:
Первый ученик – « Химические свойства кислот»
— второй ученик – « Химические свойства оснований».
В это время класс выполняет задание: с какими из перечисленных веществ будет реагировать гидроксид натрия, а с какими соляная кислота?
Написать возможные уравнения реакций.
Вещества: HNO 3 , CaO , CO 2 , СuSO 4 , Cu(OH) 2 , P 2 O 5 , ZnO, AgNO 3 .
Затем один ученик выполняет это задание на доске, а остальные проверяют.
На доске:
| 1. | NaOH + HNO 3 = NaNO 3 + H 2 O 2 NaOH + ZnO Na 2 ZnO 2 + H 2 O |
| 2. | 2HCl + CaO = CaCl 2 + H 2 O 2HCl + Cu(OH) 2 = CuCl 2 + 2H 2 O 2HCl + ZnO = ZnCl 2 + H 2 O HCl + AgNO 3 = AgCl + HNO 3 |
3. Изучение нового материала
Тема урока: «Амфотерные гидроксиды».
Девиз урока: «Химия – наука полутонов».

Э.Е. Нифантьев.
Актуализация знаний
Учитель: Тема нашего урока «Амфотерные гидроксиды». Наша задача знать, какие соединения называют амфотерными гидроксидами и каковы их химические свойства; понять, в чем причина амфотерности; уметь писать уравнения реакций, отражающих химические свойства амфотерных гидроксидов.
Итак, давайте вспомним, что вы уже знаете об «амфотерности».
Ученик: Амфотерные соединения проявляют одновременно и основные, и кислотные свойства.
Учитель: Мы уже познакомились с амфотерными оксидами. Скажите, пожалуйста, какие элементы образуют эти соединения?
Ученик: Металлы в степени окисления +3 и +4,а также металлы, металлические свойства которых выражены неярко (в периодической системе элементов они находятся между металлами и неметаллами, вдоль диагонали). Например: Be, Zn, Ge и др.
Физические свойства амфотерных гидроксидов
Учитель: Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого цвета.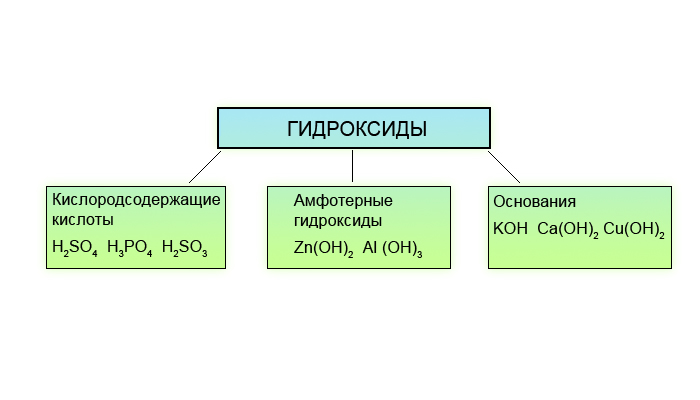
Получение
Учитель: Предположите способ получения амфотерных гидроксидов, помня, что они не растворимы в воде.
Ученик: Реакцией обмена между растворимой солью соответствующего металла и щелочью. (Демонстрационный эксперимент)
ZnCl 2 + 2NaOH = Zn(OH) 2 + 2NaCl
Zn 2+ + 2OH — = Zn (OH) 2
Учитель: Но! Избыток щелочи может растворить образовавшийся осадок, поэтому берут слабое основание – NH 3 * H 2 O (гидроксид аммония или гидрат аммиака).
Химические свойства
Учитель: Известная мудрость гласит: «Опыт- путь к познанию». Поэтому химические свойства амфотерных гидроксидов вы определите, выполняя лабораторный опыт в парах.
Задание : получить гидроксид алюминия и определить его химические свойства. Для этого у Вас на столах есть растворы хлорида алюминия, аммиака, соляной кислоты и гидроксида натрия. Помните о соблюдении правил техники безопасности.Запишите уравнения химических реакций.
Ученики выполняют опыт, записывают в тетрадях уравнения реакций.
Один ученик выходит к доске и записывает все уравнения и объясняет наблюдаемые явления.
AlCl 3 + 3NH 3 * H 2 O = Al(OH) 3 + 3NH 4 Cl
Вывод : гидроксид алюминия взаимодействует и с кислотами, и с основаниями, т.е. проявляет амфотерные свойства.
Учитель: В чем же причина амфотерности этих соединений?
Для того чтобы ответить на этот вопрос, рассмотрим их диссоциацию.
В водных растворах амфотерные гидроксиды практически не диссоциируют, но в растворах кислот и щелочей могут диссоциировать двумя способами.
Учитель. Нужно отметить, что соли анионного типа, образующиеся при взаимодействии амфотерного гидроксида со щелочью, устойчивы в щелочной среде, но разрушаются при подкислении растворов.
Na + 4HCl = NaCl + AlCl 3 + 4H 2 O
Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются:
2Al(OH) 3 Al2O 3 + 3H 2 O
4. Закрепление
Закрепление
Экспериментальная задача. Даны три пробирки с растворами хлоридов натрия, магния и алюминия. Как определить, в какой пробирке какое вещество?
Один участник выходит к демонстрационному столу и выполняет опыт.
5. Подведение итогов урока
Учитель: Итак, подводя итоги нашего урока, я хотела бы сказать, что амфотерность — категория не только химическая, но и философская: с греческого языка слово «amphoteros» переводится как « тот и другой », то есть это понятие означает единство противоположностей.
А это уже один из основных законов природы – закон единства и борьбы противоположностей, который проявляется практически в каждой химической реакции: кислота и основание, окислитель и восстановитель, донор и акцептор и так далее.
Этот закон объективен, его нельзя отменить, можно только воспользоваться им для объяснения явлений.
Мы часто в жизни сталкиваемся с проявлениями этого закона: в технике – противоположно заряженные частицы притягиваются; в человеческих отношениях – часто очень разные люди сближаются, они как будто дополняют друг друга. В жизни всегда борются добро и зло, в каждом человеке обязательно присутствуют плохие и хорошие черты. Поэтому не бывает человека идеального, только хорошего, а в самом падшем, плохом человеке всегда можно найти что-то доброе, светлое. Об этом надо всегда помнить и относиться к окружающим нас людям с пониманием, терпимостью к чужим недостаткам.
В жизни всегда борются добро и зло, в каждом человеке обязательно присутствуют плохие и хорошие черты. Поэтому не бывает человека идеального, только хорошего, а в самом падшем, плохом человеке всегда можно найти что-то доброе, светлое. Об этом надо всегда помнить и относиться к окружающим нас людям с пониманием, терпимостью к чужим недостаткам.
Тема нашего сегодняшнего урока является еще одним подтверждением связи химии с нашей жизнью. И теперь давайте вернемся к девизу этого урока: « Химия – это наука полутонов ». Как вы можете объяснить это выражение?
Ученик: Это значит, что нельзя провести четкую границу между простыми веществами металлами и неметаллами, разными классами соединений, органическими и неорганическими веществами. Все подчиняется единству материального мира.
6. Домашнее задание
Параграф 28.3, задания: 1,2,3 (учебник «Химия 10 класс» авторы: И.И.Новошинский, Н.С.Новошинская)
Дополнительное задание к уроку (если останется время)
Осуществить превращения:
Al- 1 — Al 2 O 3 — 2 — NaAlO 2 — 3 — Al (OH) 3 — 4 — Al 2 O 3 |
1. 4Al + 3O 2 = 2Al 2 O 3
4Al + 3O 2 = 2Al 2 O 3
2. Al 2 O 3 + Na 2 O 2NaAlO 2
3. NaAlO 2 + HCl + H 2 O = NaCl + Al(OH) 3
4. 2Al(OH) 3 Al 2 O 3 +3H 2 O
AlCl 3 — 1 — Al(OH) 3 — 2 — Na — 3 — AlCl 3 |
1. AlCl 3 + 3NaOH = 3NaCl + Al(OH) 3 |
2. Al(OH) 3 + NaOH = Na[ Al(OH) 4 ]
3. Na[ Al(OH) 4 ]+ 4HCl = NaCl + AlCl 3 + 4H 2 O
1) В реакциях с кислотами эти соединения проявляют основные свойства, как обычные основания:
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O; Zn(OH) 2 + H 2 SO 4 → ZnSO 4 + 2H 2 O.
2) В реакциях с основаниями амфотерные гидроксиды проявляют кислотные свойства и образуют соли. В этом случае амфотерный металл входит в состав аниона кислоты. Амфотерные металлы могут образовывать разные кислотные остатки в зависимости от условий проведения реакции:
В водном растворе:
Al(OH) 3 + 3NaOH → Na 3 ; Zn(OH) 2 + 2NaOH →Na 2 ,
При сплавлении твёрдых веществ:
Al(OH) 3 + NaOH → NaAlO 2 + 2H 2 O; Zn(OH) 2 + 2NaOH →Na 2 ZnO 2 + 2H 2 O
Оксиды
Оксиды – это вещества, состоящие из двух элементов, один из которых кислород, который находится в степени окисления -2. Они делятся по своим свойствам на основные, амфотерные и кислотные.
Они делятся по своим свойствам на основные, амфотерные и кислотные.
Основные оксиды – это оксиды металлов с основными свойствами. К ним относятся большинство оксидов металлов со степенью окисления +1 и +2.
Амфотерные оксиды – в зависимости от условий могут проявлять основные или кислотные свойства. К ним относятся оксиды большинства металлов со степенью окисления +3 и +4, а также некоторые оксиды металлов со степенью окисления +2, например Al 2 O 3 , Cr 2 O 3 , ZnO, BeO.
Кислотные оксиды – это оксиды неметаллов и оксиды металлов, в которых степень окисления металла +5 и выше. Эти оксиды обладают кислотными свойствами и образуют кислоты.
Свойства основных оксидов
1) Основные оксиды реагируют с водой, если образуется растворимый гидроксид:
CaO + H 2 O → Ca(OH) 2 ; Na 2 O + H 2 O → 2NaOH.
2) Основные оксиды могут реагировать с кислотными оксидами:
CaO + SO 3 → CaSO 4 ; Na 2 O + CO 2 → Na 2 CO 3 .
3) Основные оксиды реагируют с кислотами:
MgO + 2HCl → MgCl 2 + H 2 O; Na 2 O + 2HNO 3 → 2NaNO 3 + H 2 O.
Свойства амфотерных оксидов
1) С кислотами они реагируют, как обычные основные оксиды:
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O; ZnO + H 2 SO 4 → ZnSO 4 + 2H 2 O.
2) В реакциях с основаниями они проявляют кислотные свойства и образуют такие же кислотные анионы, как и амфотерные гидроксиды:
Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 ;
ZnO + 2NaOH + H 2 O → Na 2 .
При сплавлении твёрдых веществ:
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O; ZnO + 2NaOH →Na 2 ZnO 2 + H 2 O.
Свойства кислотных оксидов
1) Реагируют с водой, если получается растворимая кислота:
SO 3 + H 2 O → H 2 SO 4 ; P 2 O 5 + 3H 2 O → 2H 3 PO 4 .
2) Кислотные оксиды могут реагировать с основными оксидами:
SO 3 + MgO → CaSO 4 ; CO 2 + CaO → CaCO 3 .
3) Кислотные оксиды реагируют с основаниями:
SO 3 + NaOН→ Na 2 SO 4 + H 2 O; CO 2 + Ca(OН) 2 → CaCO 3 + H 2 O.
Соли
Соли – это вещества, при первичной диссоциации которых не образуются ни ионы Н + , ни ионы ОН — . Это продукты взаимодействия кислот и оснований.
Это продукты взаимодействия кислот и оснований.
Например: NaCl=Na + +Cl — ;
Ca(HCO 3) 2 =Ca 2+ +2HCO 3 — ;
AlOH(NO 3) 2 =AlOH 2+ +2NO 3 —
Средние соли состоят из анионов и катионов, которые не содержат Н + и ОН — , например: Na 2 SO 4 – сульфат натрия, CaCO 3 – карбонат кальция. Кислые соли содержат катион водорода Н + , например: NaHCO 3 – гидрокарбонат натрия. Основные соли содержат анион ОН — , например (CaOH) 2 CO 3 – гидроксокарбонат кальция.
Для химических свойств всех солей характерны реакции обмена.
1) Соли могут реагировать с кислотами:
а) Сильная кислота вытесняет слабую кислоту из её соли.
Na 2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓.
б) Многоосновная кислота может реагировать со своей средней солью с образованием кислых солей.
Na 2 CO 3 + H 2 CO 3 → 2NaHCO 3 ; CuSO 4 + H 2 SO 4 → Cu(HSO 4) 2 .
2) Растворимые соли могут реагировать с растворимыми основаниями, если в результате реакции получится нерастворимое вещество:
2NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 ;
Ba(OH) 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaOH.
3) Две растворимые соли могут реагировать друг с другом, если в результате реакции получится нерастворимое вещество:
NaCl + AgNO 3 → NaNO 3 + AgCl↓.
4) Соли могут реагировать с металлами. В этих реакциях активный металл вытесняет менее активный из его соли.
гидроксид: определение и формула | Study.com
Где электроны?
Периодическая таблица элементов может дать нам массу информации об атомах, и мы будем использовать ее, чтобы понять химическую формулу гидроксида. Согласно периодической таблице, водород имеет 1 протон и 1 электрон, как показано на диаграмме. Кроме того, кислород имеет 8 электронов и 8 протонов.Два электрона кислорода находятся на его внутренней орбите, а остальные 6 — на его внешней орбите.
Орбиты вокруг ядра атома подобны кольцам вокруг Юпитера или Сатурна. Поэтому химики часто используют кольца для обозначения орбиталей. Первое кольцо вокруг атома представляет собой первый энергетический уровень, второе — второй энергетический уровень и так далее.Исходя из этого, мы видим, что внутренняя оболочка кислорода является первым энергетическим уровнем, а его внешняя оболочка — вторым энергетическим уровнем.
Поэтому химики часто используют кольца для обозначения орбиталей. Первое кольцо вокруг атома представляет собой первый энергетический уровень, второе — второй энергетический уровень и так далее.Исходя из этого, мы видим, что внутренняя оболочка кислорода является первым энергетическим уровнем, а его внешняя оболочка — вторым энергетическим уровнем.
Кроме того, химики могут представлять атомы или молекулы структурами Льюиса. В структурах Льюиса маленькими точками отмечены только электроны внешней оболочки. Здесь мы видим кислород с 6 точками, обозначающими его 6 электронов внешней оболочки, и водород с одной точкой, обозначающей его единственный электрон.
До сих пор мы учли 9 из 9 протонов и 9 из 10 электронов. А последний электрон? Ну, этот электрон на кислороде — но почему?
А последний электрон? Ну, этот электрон на кислороде — но почему?
Почему гидроксид заряжен отрицательно?
Помимо отображения количества протонов и электронов в атоме, периодическая таблица может дать представление о свойствах атомов по периоду или по группе.В тенденции периодической таблицы включено сродство к электрону, которое описывает количество энергии, высвобождаемой при присоединении электрона к атому или молекуле. Чем больше энергии высвобождается, тем легче присоединить электрон. По мере того, как мы перемещаемся по периодической таблице, сродство к электрону увеличивается. Исходя из этого представления, кислород (группа 17) имеет большее сродство к электрону, чем водород (группа 1). Следовательно, последний электрон находится на кислороде, что делает его отрицательно заряженным и дает ему в общей сложности 9 электронов и 8 протонов.
Ковалентные связи
Когда два атома объединяются в молекулу, они создают связь. В гидроксиде кислород и водород делят два электрона посредством ковалентной связи. В ковалентной связи два атома имеют общие электроны. Это похоже на держание за руки: каждая рука — это электрон, и когда два атома соединяют свои руки (электроны) вместе, они образуют прочную ковалентную связь.
В гидроксиде кислород и водород делят два электрона посредством ковалентной связи. В ковалентной связи два атома имеют общие электроны. Это похоже на держание за руки: каждая рука — это электрон, и когда два атома соединяют свои руки (электроны) вместе, они образуют прочную ковалентную связь.
На следующей диаграмме связь обозначена двумя электронами, расположенными на перекрывающихся кольцах. В обозначении структуры Льюиса ковалентная связь представлена прямой линией, соединяющей O и H.
Окончательное изображение
Это подводит нас к окончательному изображению гидроксида, в котором водород ковалентно связан с кислородом, а вокруг гидроксида заключены скобки со знаком минус в нижнем индексе.Это условное обозначение информирует химиков о заряде -1 гидроксида.
Итоги урока
На этом уроке мы узнали, что гидроксид представляет собой отрицательно заряженную двухатомную молекулу. В гидроксиде кислород ковалентно связан с водородом, и имеется 9 протонов и 10 электронов.
В гидроксиде кислород ковалентно связан с водородом, и имеется 9 протонов и 10 электронов.
Гидроксид — New World Encyclopedia
В химии гидроксид — наиболее распространенное название двухатомного аниона ОН — , состоящего из атомов кислорода и водорода.Это один из простейших известных двухатомных ионов. Термин «гидроксид» также относится к классу соединений, которые содержат ион гидроксида. Типичными примерами являются гидроксид натрия, гидроксид калия и гидроксид аммония.
Гранулы гидроксида натрия.Гидроксидные соединения и ионы относительно распространены в природе. Некоторые минеральные руды, такие как бокситы и лимониты, являются гидроксидами. Кроме того, гидроксиды широко используются в деятельности человека. Например, гидроксид натрия (щелок) используется в качестве сильного основания в промышленности, а гидроксид калия используется в сельском хозяйстве.
Гидроксид в качестве основы
Большинство соединений, содержащих гидроксид-ион, являются химическими основаниями. Таким образом, гидроксид-ионы участвуют в многочисленных кислотно-щелочных реакциях, включая реакцию, известную как нейтрализация.
Таким образом, гидроксид-ионы участвуют в многочисленных кислотно-щелочных реакциях, включая реакцию, известную как нейтрализация.
Вещество, образующее гидроксид-ионы при растворении в водном растворе, называется основанием Аррениуса. Одним из примеров является аммиак (NH 3 ):
- NH 3 (г) + H 2 O(ж) ⇌ NH 4 + (водн.) + OH − (водн.)
Соли, называемые гидроксидами.Основные соли диссоциируют в воде на катион и один или несколько ионов гидроксида, делая раствор щелочным. Основные соли будут подвергаться реакциям нейтрализации с кислотами. В общем, кислотно-щелочные реакции можно упростить до
- OH − (водн.) + H + (водн.) → H 2 O(l)
Ионы, не участвующие в этой реакции, называются ионами-спектаторами и здесь не показаны.
Растворимость
Большинство неорганических гидроксидных солей нерастворимы в воде.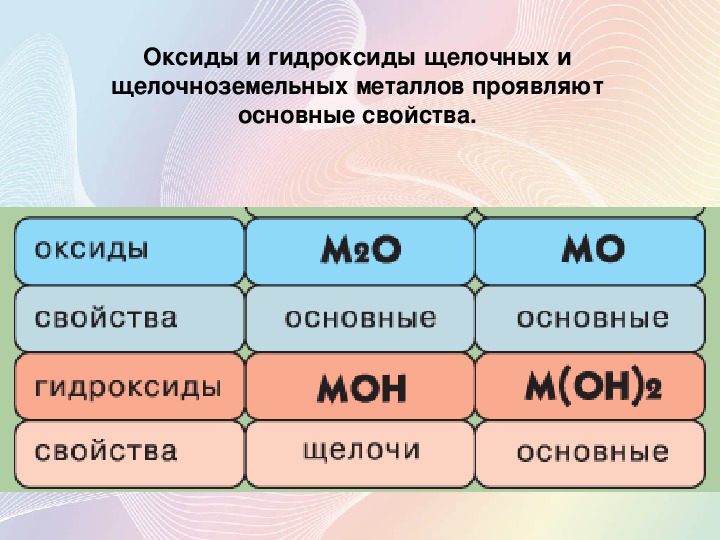 Важными исключениями являются соли, в которых катионами являются ионы щелочных металлов и ионы NH 4 + , Ba 2+ , Sr 2+ , Ca 2+ или Tl + ионы.
Важными исключениями являются соли, в которых катионами являются ионы щелочных металлов и ионы NH 4 + , Ba 2+ , Sr 2+ , Ca 2+ или Tl + ионы.
Поведение в качестве лиганда
Ион гидроксида является типом лиганда. Каждый атом кислорода в ионе ОН — имеет «неподеленную пару» (неподеленные пары) электронов на самой внешней оболочке, и он образует связи, отдавая эту пару электронов соответствующему принимающему атому. Таким образом, гидроксид-ион ведет себя как основание Льюиса.Примеры включают ион алюмината [Al(OH) 4 ] — и ион аурата [Au(OH) 4 ] — .
Использование гидроксида
Гидроксиды и гидроксид-ионы встречаются относительно часто. Многие полезные химикаты и химические процессы включают гидроксиды или гидроксид-ионы. Гидроксид натрия (щелок) используется в промышленности в качестве сильного основания, гидроксид калия используется в сельском хозяйстве, а минералы гидроксида железа, такие как гетит и лимонит, используются в качестве низкопробной бурой железной руды.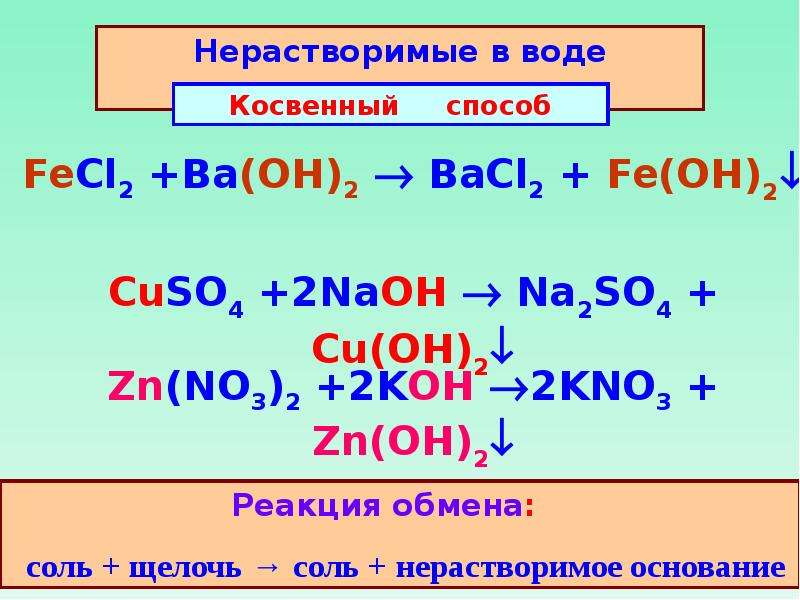 Бокситы алюминиевой руды состоят в основном из гидроксидов алюминия.
Бокситы алюминиевой руды состоят в основном из гидроксидов алюминия.
См. также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. 2006. Химия . 9-е изд. Нью-Йорк: McGraw-Hill Science/Engineering/Math. ISBN 0073221031 и ISBN 978-0073221038.
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Высшая неорганическая химия . 4-е изд. Нью-Йорк: Уайли. ISBN 0471027758.
- Макмерри, Дж.и Р.К. Фэй. 2004. Химия . 4-е изд. Река Аппер-Сэдл, Нью-Джерси: Прентис-холл. ISBN 0131402080.
Кредиты
New World Encyclopedia авторов и редакторов переписали и дополнили статью в Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Гидроксиды | AMERICAN ELEMENTS ®
Энергозатраты на «обогащение окислительно-восстановительным потенциалом» в псевдоемкостном накопителе энергии с использованием двойных гидроксидных материалов со слоистым никелем и алюминием., Чжан, Сянхуэй, Кокрехам Коди Б., Йылмаз Эсра, Ли Геннань, Ли Нан, Ха Су, Фу Лянцзе, Ци Цзяньци, Сюй Хунву и У Ди , J Phys Chem Lett, 7 мая 2020 г., том 11, выпуск 9, стр. 3745-3753, (2020)
Оптически активные микрококоны мезопористого кремнезема с функционализированной поверхностью гидроксида неодима для биомедицинских применений., Ансари, Анис А. , Хан Аслам, Алам Манаввер, Сиддики Максуд А., Ахмад Наушад и Алхедхайри Абдулазиз А.
, Colloids Surf B Biointerfaces, май 2020 г., том 189, стр. 110877, (2020)
, Хан Аслам, Алам Манаввер, Сиддики Максуд А., Ахмад Наушад и Алхедхайри Абдулазиз А.
, Colloids Surf B Biointerfaces, май 2020 г., том 189, стр. 110877, (2020)
Влияние добавления гидроксида натрия на характеристики и риск для окружающей среды тяжелых металлов в биоугле, полученном из свиного навоза., Сюй, Юнган, Бай Тянься, Ян Юбо и Ма Куйжун , Waste Manag, 3 марта 2020 г., том 105, стр. 511-519, (2020)
Новый синтез покрытого гелем гидроксида алюминия нано нульвалентного железа и исследования его активности в усиленном флокуляцией удалении тетрациклина., Ван , Сянюй, Чжан Биньбинь, Ма Цзюнь и Нин Пин , J Environ Sci (Китай), март 2020 г., том 89, стр. 194-205, (2020)
Влияние гидроксида натрия на поглощение Al гидратами силиката кальция (CSH)., Барзгар, Соня, Лотенбах Барбара, Тарик Мохамед, Ди Джакомо Алессио и Людвиг Кристиан , J Colloid Interface Sci, 15 июля 2020 г., том 572, с.246-256, (2020)
Влияние остатков гидроксида кальция после использования различных ирригантов на точность двух электронных апекслокаторов: исследование.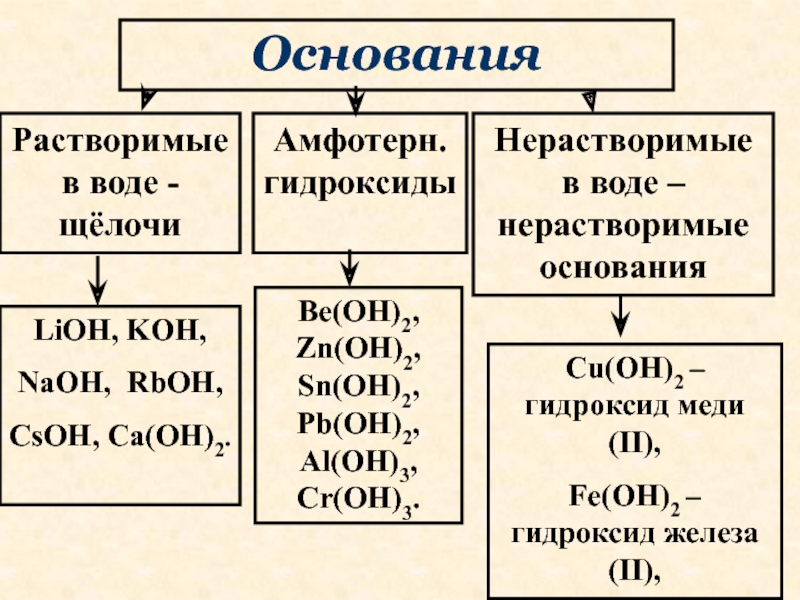 , Шоджаи, Нушин Садат, Заэри Захра, Шокоухи Мохаммад Мехди, Собхнамаян Ферештех и Адл Алиреза.
, Dent Res J (Исфахан), 2020 г., январь-февраль, том 17, выпуск 1, стр. 48-53, (2020)
, Шоджаи, Нушин Садат, Заэри Захра, Шокоухи Мохаммад Мехди, Собхнамаян Ферештех и Адл Алиреза.
, Dent Res J (Исфахан), 2020 г., январь-февраль, том 17, выпуск 1, стр. 48-53, (2020)
Фолат- и глюкуронат-функционализация слоистых двойных гидроксидов, содержащих диспрозий и гадолиний, и влияние на окислительный стресс в митохондриях печени крысы., Хуменес, Сесилия Санчес, Моисес Фермин Поль Паче, Кано М. Э., Андраде Карина Нава, Торрес Ана Лаура Брио и Арисага Грегорио Гуадалупе , Heliyon, январь 2020 г., том 6, выпуск 1, p.e03111, (2020)
Важность фазы ZnTiO3 в фотокатализаторах ZnTi-смешанных оксидов металлов, полученных из слоистого двойного гидроксида., Chuaicham, Chitiphon, Karthikeyan Sekar, Song Jun Tae, Исихара Тацуми, Отани Бунсё и Сасаки Кейко , ACS Appl Mater Interfaces, 26 февраля 2020 г., том 12, выпуск 8, стр. 9169-9180, (2020)
Люминесцентный эфир целлюлозы с регенерированной кристаллической формой, полученный в гидроксиде тетра(н-бутил)аммония/диметилсульфоксиде. , Цай, Сюй-Мин, Чен Сяо, Чен Синфэй, Ли Юй и Ван Фэй
, Carbohydr Polym, 15 февраля 2020 г., том 230, стр. 115649, (2020)
, Цай, Сюй-Мин, Чен Сяо, Чен Синфэй, Ли Юй и Ван Фэй
, Carbohydr Polym, 15 февраля 2020 г., том 230, стр. 115649, (2020)
Легкий синтез двойных гидроксидных нанолистов со слоями никеля и кобальта, интеркалированных сульфатным анионом, для высокопроизводительного суперконденсатора., Фэн, Яньян, Ли Яньцзе, Ян Вэнь, и Хуан Хунбинь , J Nanosci Nanotechnol, 2020 Feb 01, Volume 20, Issue 2, p.1260-1268, (2020)
Нанохлопья оксигидроксида кобальта с активностью, имитирующей оксидазу, индуцировали хемилюминесценцию люминола для обнаружения глутатиона., Ян, Си Цзюй, Ли Ронг Шэн, Ли Чун Мэй, Ли Юань Фан и Хуан Чэн Чжи , Talanta, 01 августа 2020 г., том 215, стр. 120928, (2020)
Адъювант на основе гидроксида алюминия защищает антигены от деградации. О’Хаган Дерек Т. , Вакцина, 23 апреля 2020 г., том 38, выпуск 19, стр. 3600-3609, (2020)
Гидроксид — обзор | ScienceDirect Topics
Кристаллохимия и рабочие характеристики Ni(OH)
2 Гидроксид никеля имеет три кристаллические модификации, каждая из которых имеет форму решетки с чередующимися слоями ионов никеля и ионов гидроксида. Они образуют межламеллярные каналы для миграции протонов, воды, гидроксида и посторонних ионов. Изоморфы различаются по стехиометрии. Считается, что α -форма является исходным материалом для превращения щелочного электрода. При электрохимическом получении нитрата никеля (Ni(NO 3 ) 2 ) образуется продукт α -3Ni(OH) 2 ·2H 2 O, в котором вода гидратации является неотъемлемой частью часть кристаллической структуры.Прослойка воды увеличивает расстояние в решетке между слоями гидроксида в α -гидроксиде. При окислении это соединение превращается в β -NiOOH, которое обычно встречается в пластинах аккумулятора, подвергавшихся многократному циклированию. Превращение сопровождается изменением плотности от 2,50 до 3,85 г см -3 . В концентрированном гидроксиде калия получается γ -модификация и ионы калия включаются в структуру решетки, для которой указан состав Ni 4 O 4 (OH) 4 O 1.
Они образуют межламеллярные каналы для миграции протонов, воды, гидроксида и посторонних ионов. Изоморфы различаются по стехиометрии. Считается, что α -форма является исходным материалом для превращения щелочного электрода. При электрохимическом получении нитрата никеля (Ni(NO 3 ) 2 ) образуется продукт α -3Ni(OH) 2 ·2H 2 O, в котором вода гидратации является неотъемлемой частью часть кристаллической структуры.Прослойка воды увеличивает расстояние в решетке между слоями гидроксида в α -гидроксиде. При окислении это соединение превращается в β -NiOOH, которое обычно встречается в пластинах аккумулятора, подвергавшихся многократному циклированию. Превращение сопровождается изменением плотности от 2,50 до 3,85 г см -3 . В концентрированном гидроксиде калия получается γ -модификация и ионы калия включаются в структуру решетки, для которой указан состав Ni 4 O 4 (OH) 4 O 1. 5 (OH) 0,5 K. Ионы K + в решетке препятствуют полному восстановлению γ -NiOOH до гидроксида никеля.
5 (OH) 0,5 K. Ионы K + в решетке препятствуют полному восстановлению γ -NiOOH до гидроксида никеля.
Объемная емкость была значительно улучшена за счет разработки сферического гидроксида никеля с высокой плотностью утряски. Однако долговременная стабильность и обратимость сферического гидроксида никеля в щелочном электролите по-прежнему вызывают беспокойство. Это особенно актуально для герметичных элементов, в которых вздутие никелевого электрода после многократного перезаряда приводит к высушиванию электролита из сепаратора.Последнее явление связано с внедрением молекул воды в никелевый электрод и в основном отвечает за ухудшение характеристик как Ni-Cd, так и Ni-MH аккумуляторов. Недавно стабилизированный α -Ni(OH) 2 привлек большое внимание как активный материал для положительной пластины в батареях на основе никеля. Частичное замещение катионов никеля трехвалентными катионами, такими как алюминий, кобальт или железо (>20 мас. %), стабилизирует α -форму двухслойного гидроксида никеля.Стабилизированный α -Ni(OH) 2 получают электрохимической пропиткой в ванне смешанного нитрата металлов. Предпочтительным материалом является стабилизированный алюминием сплав α -Ni(OH) 2 , поскольку он не только обладает более высокой удельной электрохимической емкостью, но и испытывает незначительное изменение объема электрода при циклировании между α — и γ -бланки. Последнее явление связано с низким поглощением молекул воды во время езды на велосипеде.Сообщается, что для фазового превращения α — в γ средняя степень окисления никеля в γ -NiOOH составляет 3,67. Это соответствует теоретической удельной емкости 482 мА·ч·г -1 , что на 66 % выше наблюдаемой для превращения β (III)-NiOOH в β (II)-Ni(OH) 2 . , а именно 289 мА·ч·г −1 . Теоретическая удельная емкость формы β практически достигается в практических батареях, и это оставляет место только для незначительных улучшений.
%), стабилизирует α -форму двухслойного гидроксида никеля.Стабилизированный α -Ni(OH) 2 получают электрохимической пропиткой в ванне смешанного нитрата металлов. Предпочтительным материалом является стабилизированный алюминием сплав α -Ni(OH) 2 , поскольку он не только обладает более высокой удельной электрохимической емкостью, но и испытывает незначительное изменение объема электрода при циклировании между α — и γ -бланки. Последнее явление связано с низким поглощением молекул воды во время езды на велосипеде.Сообщается, что для фазового превращения α — в γ средняя степень окисления никеля в γ -NiOOH составляет 3,67. Это соответствует теоретической удельной емкости 482 мА·ч·г -1 , что на 66 % выше наблюдаемой для превращения β (III)-NiOOH в β (II)-Ni(OH) 2 . , а именно 289 мА·ч·г −1 . Теоретическая удельная емкость формы β практически достигается в практических батареях, и это оставляет место только для незначительных улучшений.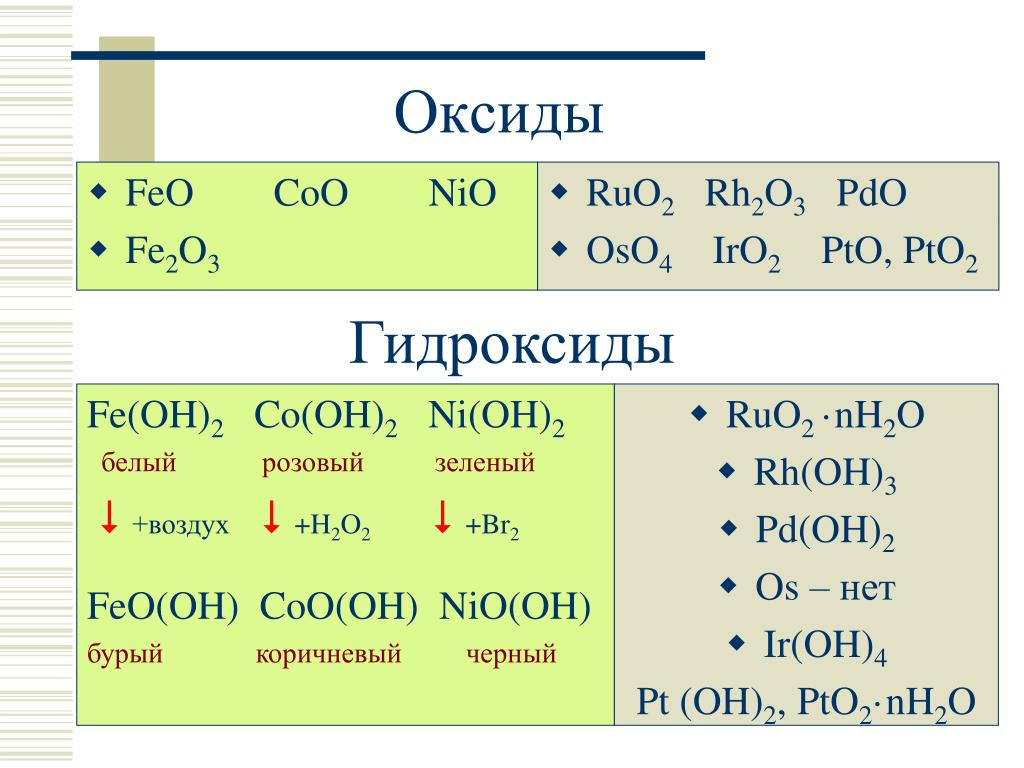 Если бы теоретическая емкость фазы α могла быть использована более полно, это компенсировало бы ее более низкую плотность отводов.
Если бы теоретическая емкость фазы α могла быть использована более полно, это компенсировало бы ее более низкую плотность отводов.
Известно, что тонкие пленки гидроксида никеля обмениваются 1,67 электронами на атом никеля. Сообщается, что гидроксид никеля, легированный кобальтом, обеспечивает удельную емкость от 345 до 375 мА·ч·г 90 105 -1 90 106 , что соответствует переносу 1,2–1,3 электрона на атом металла (никеля, кобальта). Недавно была оценена новая технология гидротермального синтеза для получения стабилизированного алюминием сплава α -Ni(OH) 2 с чрезвычайно мелким размером зерна, но хорошей кристалличностью.Результаты показывают, что наноразмерный α -Ni(OH) 2 с хорошо закристаллизованными частицами не только обладает высокой удельной емкостью до ~400 мА·ч·г -1 , но также обеспечивает превосходную способность к высокоскоростному разряду. с длительной стабильностью как при электрохимическом циклировании с перезарядом до 100%, так и при длительном плавающем заряде. Напротив, β -Ni(OH) 2 имеет более низкую удельную емкость и более низкую стабильность при циклировании при аналогичном циклировании перезарядки.Несмотря на более низкую плотность энергии, чем у β -фазы (~500 мА·ч см -3 ), другие характеристики делают стабилизированный алюминием α -Ni(OH) 2 превосходным материалом для аккумуляторов. Существует возможность увеличить плотность энергии фазы α за счет улучшения ее плотности отводов.
Напротив, β -Ni(OH) 2 имеет более низкую удельную емкость и более низкую стабильность при циклировании при аналогичном циклировании перезарядки.Несмотря на более низкую плотность энергии, чем у β -фазы (~500 мА·ч см -3 ), другие характеристики делают стабилизированный алюминием α -Ni(OH) 2 превосходным материалом для аккумуляторов. Существует возможность увеличить плотность энергии фазы α за счет улучшения ее плотности отводов.
Продукт низкой растворимости ( K sp =10 −35 ) гидроксида никеля делает его очень стабильным в щелочной среде. Хотя растворимость активного материала гидроксида никеля в концентрированных растворах гидроксида калия значительно низка, ее нельзя игнорировать.Недавно было показано, что зарядная эффективность никелевого электрода, хранящегося в разряженном состоянии, может быть значительно снижена за счет освальдовского созревания β -Ni(OH) 2 за счет реакции растворения-осаждения. Этот процесс является обратимым, и материал может вернуться к своей первоначальной кристаллической форме посредством повторяющихся циклов заряда-разряда.
Этот процесс является обратимым, и материал может вернуться к своей первоначальной кристаллической форме посредством повторяющихся циклов заряда-разряда.
Что такое гидроксиды | Характеристики, классификация…
Гидроксиды
Область химии достаточно обширна, и в ней мы можем найти большое количество важных определений.Возможно, в основе этой науки лежат химических соединения , вещества, которые образуются при союзе двух или более химических элементов . Среди этих элементов мы можем найти гидроксида .
Что такое гидроксиды?
гидроксиды представляют собой разновидность химического соединения , которое образуется из соединения элемента типа металлического или катионного с элементом, принадлежащим к группе гидроксидов 4 или ионов .
- Классификация
- Характеристики гидроксидов
- Недвижимость
- Как образуются гидроксиды
- Использование и применение
- Структура
- Состав
- Номенклатура
- Важность
- Примеры гидроксидов
Классификация
Гидроксиды подразделяются на три большие группы:
- Основы : этот тип гидроксида образуется в результате реакции, происходящей между оксидом металла при контакте с водой.

- Кислоты : они образуются благодаря реакции, происходящей между оксидом, принадлежащим неметаллу, то есть ангидридом, с водой.
- Амфотерный : этот тип гидроксида отвечает за действие в качестве основания по отношению к различным кислотам, а также действует как кислота по отношению к основаниям.
Характеристики гидроксидов
Среди наиболее примечательных характеристик гидроксидов можно выделить следующие:
- Характеризуются как неорганические соединения тройные , содержащие в своей молекуле водород, молекулу кислорода и элемент металлического типа.
- Они могут диссоциировать при растворении в воде.
- Они имеют довольно сильный основной характер, потому что гидроксильная группа способна присоединять протоны.
- Они могут изменить цвет лакмусовой бумаги с оттенка красного на синий.
- Они способны реагировать с кислотами и, таким образом, образовывать соль и воду.

- Когда вы выполняете какую-то реакцию, вы можете высвободить энергии .
Свойства
Среди физических и химических свойств, которыми обладают гидроксиды, мы находим следующие:
- При комнатной температуре и стабильном давлении гидроксиды металлов твердые и большинство из них белые .
- Они имеют значения очень высокие температуру плавления , которые в основном расположены в группе IA периодической таблицы.
- В зависимости от типа растворимости , присутствующей в воде, гидроксиды можно разделить на растворимые и нерастворимые .
- Некоторые из них, находясь в жидком или расплавленном состоянии, могут пропускать электрический ток.
- У них есть скрытый ионный характер , хотя он также может быть очень основным.

Как образуются гидроксиды
Гидроксиды образуются из комбинации оксида металла и воды . Для этого необходимо кислород , водород и металл , входящий в состав соединения.Чтобы добиться образования гидроксида, также необходимо, чтобы действовали катион и элемент гидроксидной группы, который будет действовать как анион.
Использование и применение
Гидроксиды могут иметь несколько применений и применений, и на самом деле многие из них используются в повседневной жизни . Некоторые используются для выделения труб, другие также используются в качестве пищеварительных и желудочных лекарств , таких как гидроксид магния.
Некоторые из них могут быть использованы в области строительства при создании керамики.Они очень хорошо работают в чистящей промышленности , в текстильной промышленности и используются в производстве бумаги и цветных карандашей.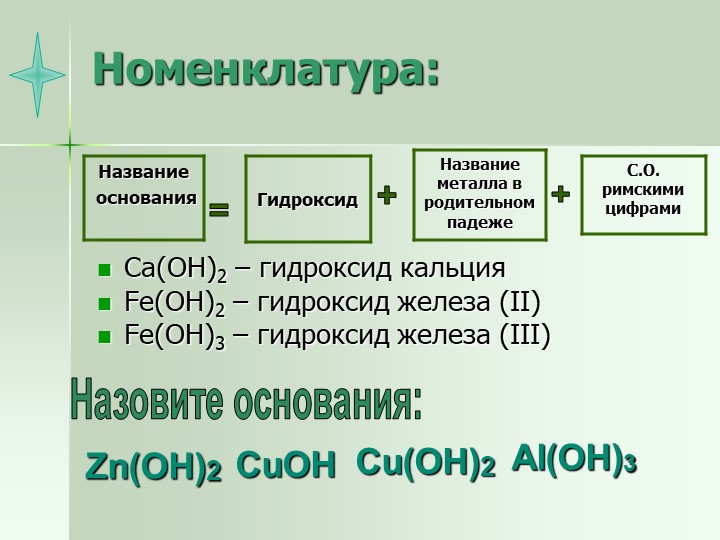 Некоторые из них играют важную роль в металлургической промышленности и химических лабораториях .
Некоторые из них играют важную роль в металлургической промышленности и химических лабораториях .
Структура
Структура гидроксидов характеризуется кристаллической структурой , очень похожей на соли или оксиды. Они также могут иметь очень простую структуру и в других случаях сложную. В гидроксидах, которые имеют восстановление в их ионном характере , может присутствовать металлический центр , который соединен посредством кислородных мостиков.
Состав
Чтобы написать молекулярную формулу гидроксида, важно иметь в виду, что число гидроксида должно быть помещено в качестве нижнего индекса , а также должно совпадать с числом окисления металла. Чтобы написать его формулу, вы должны написать металл , а затем функциональную группу ОН или гидроксильную группу . Эта гидроксильная группа должна быть подписана , если валентность больше числа 1, и должна быть заключена в круглые скобки.Например:
Эта гидроксильная группа должна быть подписана , если валентность больше числа 1, и должна быть заключена в круглые скобки.Например:
PbO2 + h3O → Pb(OH) 4
Номенклатура
Номенклатура гидроксидов выполняется путем наименования слов « гидроксид из …». Затем следует указать название металла , который его образует, а затем число степени окисления , которое должно быть помещено в круглых скобках , и, если это число больше единицы, оно должно быть записано латинскими буквами цифры .
Вы также можете использовать функциональную номенклатуру , чтобы назвать их, и для этого суффикс используется в названии металла , чтобы таким образом он мог подразумевать, какова степень окисления молекулы.При использовании этого типа номенклатуры окончание « несет » будет соответствовать состоянию с наименьшим окислением , или также используется валентность , окончание которого « ico » указывает на наивысшее окисление .
Важность
гидроксиды являются очень важными соединениями для человека и частью повседневной жизни практически всех людей, поскольку они идеально подходят для нейтрализации кислот , которые присутствуют во многих продуктах, которые используются в повседневной жизни.Многие из этих соединений используются в виде лекарств, а некоторые даже используются в клинических лабораториях, что придает им еще большую актуальность.
Примеры гидроксидов
Вот некоторые примеры гидроксидов:
- Бария гидроксид, Ba (OH) 2
- Гидроксид алюминия, Al (OH) 3
- Гидроксид железа, Fe(OH) 2
- Гидроксид кальция, Ca (OH) 2
- Гидроксид марганца, Mn (OH) 3
- Гидроксид магния, Mg (OH) 2
— Отдел безопасности исследований
Общие сведения и обзор опасностей
Растворы гидроксидов (OH — ) в воде образуют сильные основания с высоким pH. Они сильно разъедают кожу и глаза. Сильные основания коварны тем, что даже концентрированный раствор часто не вызывает боли до тех пор, пока коррозионное повреждение не станет серьезным.
Они сильно разъедают кожу и глаза. Сильные основания коварны тем, что даже концентрированный раствор часто не вызывает боли до тех пор, пока коррозионное повреждение не станет серьезным.
Концентрированные растворы гидроксида выделяют тепло при смешивании с водой или кислотами, что может вызвать кипение и разбрызгивание.
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов (Li, Na, K) и кальция в чистом виде являются водорастворимыми, гигроскопичными твердыми веществами. Растворение твердых гидроксидов в воде является сильно экзотермическим процессом, при котором выделяется избыточное тепло.Гидроксиды натрия и калия являются сильными основаниями и чрезвычайно разрушительны для кожи и глаз.
Концентрированные растворы гидроксида растворяют алюминий, что приводит к выделению легковоспламеняющегося газообразного водорода. Гидроксиды медленно атакуют стекло, образуя растворимые силикаты. Эта реакция приводит к «замерзанию» стеклянных соединений и запорных кранов.
Растворы гидроксидов быстро реагируют с диоксидом углерода на воздухе, образуя бикарбонаты (HCO 3 — ) для гидроксидов щелочных металлов или карбонаты (CO 3 2-) для гидроксида кальция, соответственно, и снижая рН раствора при хранении на открытом воздухе.
Гидроксид аммония (NH
4 OH)Гидроксид аммония представляет собой раствор аммиака (NH 3 ) в воде. Только небольшая часть фактически выходит в виде ионных NH 4 + и OH — . Концентрированный гидроксид аммония содержит примерно 29% аммиака и имеет резкий запах. С повышением температуры испаряется больше аммиака. Газообразный аммиак легко воспламеняется и имеет узкий диапазон взрывоопасности в воздухе 15–25%. Пары водных растворов аммиака раздражающе и ядовиты.
Гидроксид тетраметиламмония (TMAH)
Пентагидрат гидроксида тетраметиламмония представляет собой твердое вещество, которое очень токсично при проглатывании и токсично при контакте с кожей. Водный раствор ТМАГ обладает высокой острой пероральной и кожной токсичностью. Попадание на кожу раствора >1% ТМАГ на небольшой участок поверхности тела или проглатывание может привести к летальному исходу.
Водный раствор ТМАГ обладает высокой острой пероральной и кожной токсичностью. Попадание на кожу раствора >1% ТМАГ на небольшой участок поверхности тела или проглатывание может привести к летальному исходу.
Безопасное обращение
- При работе с твердыми основаниями надевайте как минимум стандартную лабораторную одежду: туфли с закрытыми носками, длинные брюки, лабораторный халат, защитные очки с боковыми щитками или защитные очки от брызг и перчатки.
- При работе с большими объемами (> 500 мл) или при вероятности разбрызгивания надевайте дополнительные средства защиты для предотвращения контакта с кожей, особенно при использовании TMAH: лицевой щиток поверх защитных очков, прочные перчатки с длинными манжетами и непромокаемый фартук или халат.
- При приготовлении растворов из твердых гидроксидов емкость необходимо охлаждать льдом или под холодной водой. Контейнер следует постоянно вращать до тех пор, пока гранулы не растворятся, чтобы предотвратить их прилипание ко дну, где они могут выделять избыточное тепло, что может привести к разрыву контейнера.

- Всегда разбавляйте растворы основания, добавляя основание в воду, а не воду в основание. Добавление воды к концентрированным основаниям может вызвать бурное кипение раствора и разбрызгивание.
- С гидроксидом аммония следует обращаться в вытяжном шкафу, чтобы избежать вдыхания газообразного аммиака.
Экстренные процедуры
Случайное воздействие
Контакт с кожей
Снимите загрязненную одежду и немедленно промойте пораженную кожу большим количеством воды в течение 15 минут или до тех пор, пока боль не уменьшится.Обратитесь за медицинской помощью, если кожа раздражена или ощущается боль.
Если вы подверглись воздействию TMAH, ВСЕГДА обращайтесь за медицинской помощью после оказания первой помощи, даже если вы не чувствуете боли.
При попадании в глаза
Используйте жидкость для промывания глаз, чтобы тщательно промыть глаза в течение не менее 15 минут, время от времени поднимая верхние и нижние веки и закатывая глазные яблоки. Обратитесь за медицинской помощью.
Обратитесь за медицинской помощью.
Вдыхание
Немедленно выйти на свежий воздух. Обратитесь за медицинской помощью.
Проглатывание
Не вызывать рвоту. Прополощите рот водой. Обратитесь за медицинской помощью.
Предоставить медицинской бригаде Паспорт безопасности для базы.
Разливы
Немедленно убирайте разливы. Прежде чем работать с концентрированными основами, подготовьте комплект для разлива. Мы рекомендуем твердую лимонную кислоту, винную кислоту или бисульфат натрия для нейтрализации разливов. Также доступны коммерческие комплекты для разливов.
Сначала нейтрализуйте пролитое вещество, покрыв его нейтрализатором, затем соберите нейтрализованный материал впитывающей салфеткой или веником.
В случае крупного разлива концентрированной базы за пределами колпака или если разлив не может быть локализован, немедленно эвакуируйте место, предупредив окружающих. Закройте дверь и не пускайте людей. Немедленно звоните 911.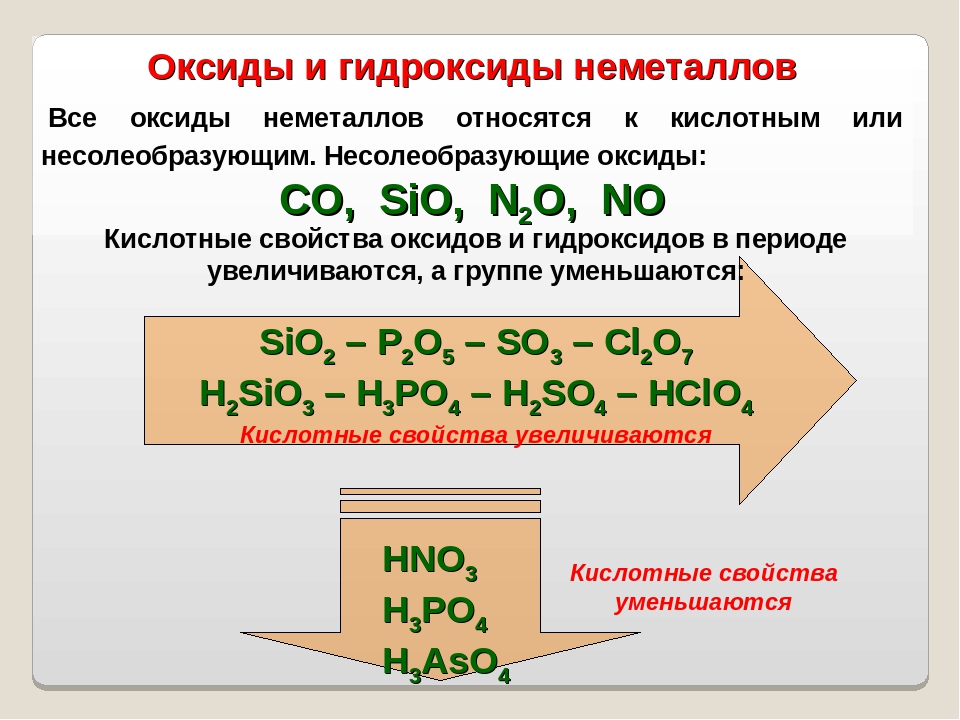
Хранение
Храните щелочи отдельно от кислот и маркируйте шкаф «коррозионно-активные щелочи». Используйте вторичную защитную оболочку для растворов водных оснований и других сильных жидких оснований. Гидроксиды должны быть отделены от окислителей.
НИКОГДА не храните растворы гидроксида в металлических контейнерах из-за возможности выделения газообразного водорода, утечки контейнера и разрыва.
Утилизация отходов
Храните основные отходы отдельно от других потоков отходов и используйте вторичную защитную оболочку для контейнера для отходов. Утилизируйте отходы в рамках программы химических отходов DRS.
Если отработанный раствор НЕ содержит никаких опасных металлов, рассмотрите возможность элементарной нейтрализации гидроксидов щелочных металлов, гидроксида кальция и гидроксида аммония:
Нейтрализовать 1 н. соляной кислотой. Этот раствор можно приготовить, смешав концентрированную соляную кислоту (37% = 12M) в соотношении 1:12 с водой. Для приготовления 1 л 1 н. HCl добавьте в воду 82 мл концентрированной HCl.
Для приготовления 1 л 1 н. HCl добавьте в воду 82 мл концентрированной HCl.
Процедура нейтрализации оснований
Используйте достаточно большую емкость для разбавления основания и добавления нейтрализующего агента. Он должен быть как минимум в четыре раза больше объема разбавленной основы, чтобы обеспечить безопасное перемешивание. Для обработки больших объемов можно использовать полиэтиленовое ведро.
- Разбавьте основу до концентрации 10% (по весу) или менее. Для концентрированных основ просто разбавьте их водой 1:10 или вылейте раствор основы на лед.
- Медленно добавляйте нейтрализующий агент при перемешивании раствора.
- Отслеживайте изменения рН с помощью рН-метра или индикаторной бумаги.
- Продолжайте добавлять нейтрализующий реагент, пока не будет достигнуто значение pH от 6 до 10.
Нейтрализованный раствор можно выливать в канализацию, если он НЕ содержит тяжелых металлов, легковоспламеняющихся или других соединений, опасных для человека или окружающей среды . Дополнительную информацию см. в разделе «Утилизация жидких неопасных химикатов».
Дополнительную информацию см. в разделе «Утилизация жидких неопасных химикатов».
Ссылки
Безопасность в академических химических лабораториях. 7-е издание, 2003 г. Американское химическое общество
Lin, C-C, et al. Отравление гидроксидом тетраметиламмония Clinical Toxicology (2010) 48, 213–217. DOI: 10.3109/15563651003627777
Правила растворимости
Правила растворимости
Правила растворимости
Спасибо профессору Кеннету В. Бушу, с веб-страницы которого были взяты эти данные.
извлечено.
1.Соли, содержащие элементы I группы, растворимы (Li + , Na + ,
К + , Cs + , Rb + ). Исключения из этого правила редки. соли
содержащий аммоний
ион (NH 4 + ) также растворимы.
2. Соли, содержащие нитрат-ион (NO 3 — ), обычно растворимы.
3. Соли, содержащие Cl — , Br — , I — , обычно растворимы. Важными исключениями из этого правила являются галогениды.
соли Ag + , Pb 2+ и (Hg 2 ) 2+ . Таким образом,
AgCl,
PbBr 2 и Hg 2 Cl 2 нерастворимы.
Важными исключениями из этого правила являются галогениды.
соли Ag + , Pb 2+ и (Hg 2 ) 2+ . Таким образом,
AgCl,
PbBr 2 и Hg 2 Cl 2 нерастворимы.
4. Большинство солей серебра нерастворимы. AgNO 3 и
Ag(C 2 H 3 O 2 ) — обычные растворимые соли серебра; практически
все остальное неразрешимо.
5. Большинство сульфатных солей растворимы.Важные исключения из этого правила включают BaSO 4 ,
PbSO 4 , Ag 2 SO 4 и SrSO 4 .
6. Большинство гидроксидных солей мало растворимы. Гидроксидные соли элементов I группы растворимы.
Гидроксидные соли элементов II группы (Ca,
Sr и Ba) малорастворимы. Гидроксидные соли переходных металлов и Al 3+ являются
нерастворимый. Так, Fe(OH) 3 , Al(OH) 3 , Co(OH) 2 не являются
растворимый.
7. Большинство сульфидов переходных металлов малорастворимы. Таким образом, CdS, FeS, ZnS,
Ag 2 S нерастворимы. Мышьяк, сурьма, висмут и свинец
сульфиды также нерастворимы.
8. Карбонаты часто нерастворимы. Карбонаты группы II (Ca, Sr, Ba) нерастворимы. Немного
другие нерастворимые карбонаты включают FeCO 3 и
PbCO 3 .
9. Хроматы часто нерастворимы. Примеры: PbCrO 4 , BaCrO 4
10.Фосфаты часто нерастворимы. Примеры:
Ca 3 (PO 4 ) 2 , Ag 3 PO 4
11. Фториды часто нерастворимы. Примеры: BaF 2 , MgF 2 ПбФ 2 .
Это предложение правил растворимости является общественным достоянием и может быть скопировано без ограничений. То
пользователь
рекомендуется загрузить его для частного использования и публичного распространения в любой форме,
в том числе сделать его доступным на других веб-серверах.