Предельные углеводороды — это… Что такое Предельные углеводороды?
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Номенклатура
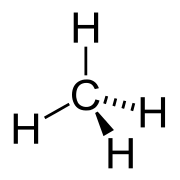
Химическая структура метана, простейшего алкана
Рациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
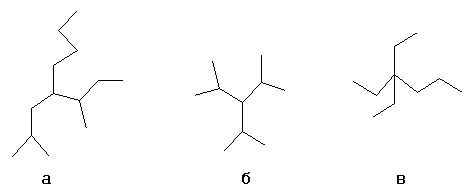
- а- н-бутил-втор-бутил-изобутилметан
- б- триизопропилметан
- в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
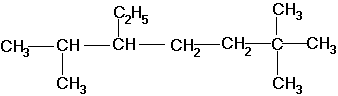
2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
| Физические свойства нормальных алканов | |||||
|---|---|---|---|---|---|
| n | Название | Ткип | Тпл | Плотность | Показатель преломления |
| 1 | Метан | −164 | −182,48 | 0,466 (-452324) | — |
| 2 | Этан | −88,63 | −183,3 | 0,546 | — |
| 3 | Пропан | −42,1 | −189,7 | 0,5853 (-45) | — |
| 4 | Бутан | −0,5 | −138,35 | 0,5788 | 1,3326 |
| 4а | Изобутан | −11,73 | −159,60 | 0,5510 | 1,3508 |
| 5 | Пентан | 36,1 | −130 | 0,626 | 1,3575 |
| 6 | Гексан | 68,7 | −95 | 0,659 | 1,3749 |
| 7 | Гептан | 98,4 | −91 | 0,684 | 1,3876 |
| 8 | Октан | 125,7 | −57 | 0,703 | 1,3974 |
| 9 | Нонан | 150,8 | −54 | 0,718 | 1,4054 |
| 10 | Декан | 174,1 | −30 | 0,730 | 1,4119 |
| 11 | Ундекан | 195,9 | −25,6 | ||
| 12 | Додекан | 216,3 | −9,7 | ||
| 13 | Тридекан | 235,5 | −6,0 | ||
| 14 | Тетрадекан | 253,6 | 5,5 | ||
| 15 | Пентадекан | 270,7 | 10 | ||
| 16 | Гексадекан | 287,1 | 18,1 | ||
| 17 | Гептадекан | 302,6 | 22 | ||
| 18 | Октадекан | 317,4 | 28 | ||
| 19 | Нонадекан | 331,6 | 32 | ||
| 20 | Эйкозан | 345,1 | 36,4 | ||
| 21 | Генэйкозан | 215 (15 мм рт ст) | 40,4 | ||
| 22 | Докозан | 224,5 (15 мм рт ст) | 44,4 | ||
| 23 | Трикозан | 234 (15 мм рт ст) | 47,4 | ||
| 24 | Тетракозан | 243 (15 мм рт ст) | 51,1 | ||
| 25 | Пентакозан | 259 (15 мм рт ст) | 53,3 | ||
| 26 | Гексакозан | 262 (15 мм рт ст) | 57 | ||
| 27 | Гептакозан | 270 (15 мм рт ст) | 60 | ||
| 28 | Октакозан | 280 (15 мм рт ст) | 61,1 | ||
| 29 | Нонакозан | 286 (15 мм рт ст) | 64 | ||
| 30 | Триаконтан | 304 (15 мм рт ст) | 66 | ||
| 40 | Тетраконтан | — | 81,4 | ||
| 50 | Пентаконтан | 421 | 92,1 | ||
| 60 | Гексаконтан | — | 98,9 | ||
| 70 | Гептаконтан | — | 105,3 | ||
| 100 | Гектан | — | 115,2 | ||
Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
CnH2n+H2→CnH2n+2
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO— перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO— — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)
Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Wikimedia Foundation. 2010.
Непредельные углеводороды — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 января 2017; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 января 2017; проверки требуют 7 правок.Непредельные углеводороды — углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи.
К непредельным углеводородам принадлежит несколько гомологических рядов: этилена (алкены), ацетилена (алкины), диены, диены.
- Ряд этилена (алкены[1]) общая формула СnН2n . Число связей: одна двойная связь.
- Диеновые углеводороды (алкадиены[2]) общая формула СnН2n-2 . Число связей: две двойные связи.
- Ряд ацетилена (алкины[3]) общая формула СnH2n-2 . Число связей: одна тройная связь.
- Диеновые углеводороды (алкадиены) общая формула Cnh3(n-3). Число связей: две тройные связи.
Как и для предельных углеводородов, для непредельных характерна структурная изомерия. Существует межклассовая изомерия между алкенами и циклоалканами, между алкинами и алкадиенами.
Низшие представители являются газами, более сложные — жидкости, а затем — твёрдые вещества с возрастающими температурами плавления и кипения. Для большинства характерен сильный запах.
В отличие от предельных углеводородов, очень реакционноспособны, вступают в реакции присоединения по двойным и тройным связям в открытой цепи. Они, например, присоединяют бром, легко окисляются раствором перманганата калия. Для многих непредельных углеводородов характерны реакции полимеризации.
Могут быть получены из предельных путём каталитического отщепления водорода (реакция дегидрирования, или дегидрогенизации). Например, из этана, содержащегося в попутном нефтяном газе, получают этилен, из бутана — бутадиен; изопрен может быть получен дегидрированием изопентана. Непредельные углеводороды образуются из предельных при крекинге нефтяных продуктов.
НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ — это… Что такое НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ?
- НЕПРАВИЛЬНАЯ ДРОБЬ
- НЕПРЕДИКАТИВНОЕ ОПРЕДЕЛЕНИЕ
Смотреть что такое «НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ» в других словарях:
непредельные соединения — то же, что ненасыщенные соединения. * * * НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ, то же, что ненасыщенные соединения (см. НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ) … Энциклопедический словарь
НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ — то же, что ненасыщенные соединения … Большой энциклопедический политехнический словарь
НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ — то же, что ненасыщенные соединения … Естествознание. Энциклопедический словарь
СОЕДИНЕНИЯ АЛИФАТИЧЕСКИЕ (ЖИРНЫЕ) — хим. соединения, для структуры которых характерна открытая цепь углеродных атомов (ациклическая структура). В случае прямой, неразветвленной, цепи С. а. называются нормальными (напр., углеводород н бутан СН3 СН2 СН2 СН3), в случае разветвленной… … Геологическая энциклопедия
НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ — непредельные соединения, органич. соединения, в к рых все или нек рые атомы углерода, образующие скелет молекулы, соединены между собой кратными связями С=С или (и) С=С в открытые цепи (ациклич., или алифатич., Н. с., например этилен, бутадиен,… … Большой энциклопедический политехнический словарь
ненасыщенные соединения — (непредельные соединения), органические соединения, в молекулах которых атомы соединены между собой кратными (двойными, например С=С; тройными, например С≡С) связями в «открытые» цепи (алифатические ненасыщенные соединения) или циклы… … Энциклопедический словарь
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — химические соединения, в которых углеродные атомы или органические группы связаны непосредственно с атомами металлов. Металлоорганические соединения играют важную роль в химии, во первых, поскольку удобны для синтеза других соединений, во вторых … Энциклопедия Кольера
НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (непредельные соединения) органические соединения, в молекулах которых атомы соединены между собой кратными (двойными, напр. С=С; тройными, напр. С?С) связями в открытые цепи (алифатические ненасыщенные соединения) или циклы (алициклические… … Большой Энциклопедический словарь
ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ — содержат группировку из связанных между собой двух атомов О. Различают собственно пероксиды ROOR (R и R орг. радикалы), гидропероксиды ROOH и озониды, напр. соед. ф лы I. В пероксидных соед. (II.) один или оба радикала м. б. присоединены к группе … Химическая энциклопедия
НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ — (непредельные соед.), органич. соед., в молекулах к рых атомы соединены между собой кратными (двойными, напр. С=С; тройными, напр. С=С) связями в открытые цепи (алифатич. Н.с.) или циклы (алициклич. Н.с. и ароматич.). К Н.с. относятся, напр.,… … Естествознание. Энциклопедический словарь
что такое предельность и непредельность в химии?
предельные и непредельные соединения — понятие из органической химии. Непредельными называются соединения, у которых имеются двойные (например, этилен) или тройные например, ацетилен) связи между атомами углерода и эти атомы при разрыве двойной (тройной) связи могут присоединять другие атомы или группы атомов, т. е. вступать в реакции присоединения.. . в отличии от них предельные соединения в такие реакции (по углероду) вступать не могут — там будут реакции замещения или разложения…
Для предельных соединения связи углерод-углерод в молекуле — одинарные. Все остальные связи — с атомами водорода или ещё какими-то группами. В непредельных (ненасыщщеных) соединениях некоторые пары атомов углерод-углерод связаны двойными или даже тройными связами.
У предельных замещены четыре связи, у непредельных ОДНА и ДВЕ НЕГИБРИДИЗОВАННЫЕ орбитали углерода. Непредельные еще диены и арены
§7. Получение, свойства и применение алканов (Страница 28)
Главная › 10-11 класс › Химия › Учебник по химии Рудзитис Фельдман 10 класс1. Как расположены электроны по энергетическим уровням и подуровням в атоме углерода? Почему в атоме углерода возможно распаривание 2s-электронов и какова у них форма электронных облаков?
Строение электронной оболочки атома углерода 1s22s22р2. У атома углерода 4 валентных электрона, из них только 2 неспаренных электрона на 2р-орбиталях.

На второй электронной оболочке есть еще свободная 2р-орбиталь, на которую может перейти один из электронов с 2s-орбитали. При этом у атома углерода становится четыре неспаренных электрона:

Так, атом углерода может образовывать 4 ковалентные связи, причем происходит гибридизация орбиталей: образуются 4 одинаковые орбитали, каждая из которых имеет форму вытянутой восьмерки, направленной к вершинам тетраэдра.
2. Изобразите электронные формулы метана и этана. Поясните, как образуются химические связи в молекулах этих веществ при перекрывании соответствующих электронных облаков.
Электронные формулы метана и этана:
Метан

Этан

В молекуле метана образуется четыре химические связи при перекрывании четырех гибридных sр3-орбиталей атома углерода с 1 s-орбиталями четырех атомов водорода.
В молекуле этана связь между атомами углерода образуется при перекрывании гибридных sр3-орбиталей двух атомов углерода. У каждого атома остается еще по три гибридных орбитали, и при перекрывании этих орбиталей с 1 s-орбиталями шести атомов водорода образуется шесть связей С-Н.
3. Опытным путем доказано, что у метана тетраэдрическая форма строения молекул. Как этот экспериментальный факт объясняет учение о формах электронных облаков и их гибридизации?
При гибридизации электронных облаков в атоме углерода из одной s-орбитали и трех р-орбиталей образуются четыре одинаковые гибридные sp3-орбитали. Гибридные орбитали направлены к вершинам тетраэдра, и при образовании ковалентных связей эти связи также оказываются направлены к вершинам тетраэдра. Поэтому молекула метана имеет тетраэдрическую форму.
4. Какие соединения называются предельными углеводородами? Приведите примеры.
Предельными называются углеводороды с общей формулой с2н2n+2. примеры: метан сн4, этан С2Н6, гексан С6Н14.
5. Алкан, молекула которого содержит семь атомов углерода, имеет формулу:
А. С7Н16
6. Формулы только алканов записаны в ряду:
2) С2Н6, С3Н8, С4Н10
7. Какие вещества называются гомологами? Приведите примеры
Гомологи – это органические соединения, отличающиеся друг от друга на одну или несколько групп-СН2. Гомологами являются алканы: метан, этан, пропан и т.д.
8. Напишите формулы и названия радикалов, которые можно вывести из первых шести предельных углеводородов.
Метил

Этил

Пропил

Бутил

Пентил

Гексил

9. Составьте сокращенные структурные формулы и подпишите названия всех возможных изомеров гексана.
Гексан

2-метилпентан

3-метилпентан

2,3-диметилбутан

2,2-диметилбутан

10. Приведите названия предельных углеводородов, которые имеют следующие формулы:

а) бутан
б) 2,3-диметилбутан
в) 3,5-диметил-4-этилгептан
г) з-метил-5-этилгептан
11. Изобразите структурную формулу 2,2,4-триметилпентана

12. Где и в каком виде предельные углеводороды встречаются в природе?
Метан – основная часть природного газа, также образуется при разложении растительных остатков. Др. алканы также входят в состав природного газа, углеводороды с большим числом атомов углерода входят в состав нефти.
13. При нагревании ацетата натрия с гидроксидом натрия образуется:
2) метан
14. При взаимодействии хлорметана с натрием образуется:
2) этан
15. Для алканов характерны реакции:
2) замещения
16. Как опытным путем можно отличить метан от водорода?
При горении метана образуется кроме воды СО2:

Если пропустить образующийся при сгорании метана газ через известковую воду, выпадает осадок:

17. При каких условиях происходит дегидрирование этана? Напишите уравнение реакции:
Дегидрирование этана происходит при нагревании в присутствии катализатора, при этом образуется этилен:

18. На примере хлорэтана на основе современных представлений раскройте сущность взаимного влияния атомов в молекуле.

В молекуле хлорэтана электронная плотность смещена к хлору. За счет неравномерного распределения электронной плотности идет разность потенциалов, что влияет на физико-химические свойства молекулы. Она становится полярной. Например, хлорэтан, в отличие от этана, растворим в спиртах и эфирах.
19. Как в промышленности из угля и метана получают так называемый синтез-газ? Составьте уравнения соответствующих химических реакций.



20. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:

1.

2. На свету образуется хлорметан:

3.

4. На свету

(прим. Вместо = ставим →)
21. Составьте конспект ответа, характеризующего метан и этан, заполнив таблицу.



Задачи — стр. 29§3. Электронная природа химических связей в органических соединениях — стр. 13
Сохраните или поделитесь с одноклассниками:
Систематическая номенклатура алканов — Википедия
Материал из Википедии — свободной энциклопедии
По номенклатуре ИЮПАК названия предельных углеводородов (алканов) характеризуются суффиксом -ан. Первые четыре углеводорода носят исторически сложившиеся названия; начиная с пятого, в основе названия углеводорода лежит греческое название соответствующего числа углеродных атомов. Углеводороды, в которых все атомы углерода расположены в одну цепь, называются нормальными. Углеводороды с нормальной цепью углеродных атомов имеют следующие названия:
- Метан — СH4
- Этан — CH3—CH3
- Пропан — CH3—CH2—CH3
- Бутан — CH3—(CH2)2—CH3
- Пентан — CH3—(CH2)3—CH3
- Гексан — CH3—(CH2)4—CH3
- Гептан — CH3—(CH2)5—CH3
- Октан — CH3—(CH2)6—CH3
- Нонан — CH3—(CH2)7—CH3
- Декан — CH3—(CH2)8—CH3
- Ундекан — CH3—(CH2)9—CH3
- Додекан — CH3—(CH2)10—CH3
- Тридекан — CH3—(CH2)11—CH3
- Тетрадекан — CH3—(CH2)12—CH3
- Пентадекан — CH3—(CH2)13—CH3
- Гексадекан — CH3—(CH2)14—CH3
- Гептадекан — CH3—(CH2)15—CH3
- Октадекан — CH3—(CH2)16—CH3
- Нонадекан — CH3—(CH2)17—CH3
- Эйкозан — CH3—(CH2)18—CH3
Названия углеводородов с разветвленными цепями[править | править код]
1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной цепи:
- главной цепью углеродных атомов считают самую длинную;
- если в углеводороде можно выделить две или несколько одинаково длинных цепей, то за главную выбирают ту из них, которая имеет наибольшее число разветвлений.
2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца цепи, к которому ближе примыкает любой из алкилов. Если разные алкилы находятся на равном удалении от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т. д.).
Если же одинаковые радикалы, определяющие начало нумерации, находятся на равном удалении от обоих концов цепи, но с одной стороны их имеется большее число, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше.
Называя соединение, сначала перечисляют заместители в алфавитном порядке (числительные не принимают во внимание), причём перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород, соответствующий главной цепи углеродных атомов, отделяя слово от цифр дефисом.
Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д.) и ставят перед названием этих радикалов, а их положение указывают, как обычно, цифрами, причём цифры разделяют запятыми, располагая в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. Для простейших углеводородов изостроения сохраняются их несистематические названия (изобутан, изопентан, неопентан, изогексан).
Радикалы называют, заменяя суффикс -ан в названии углеводорода на -ил:
- метил CH3—
- этил CH3—CH2—
- пропил CH3—CH2—CH2—
- бутил CH3—CH2—CH2—CH2—
- пентил (ранее — амил) CH3—CH2—CH2—CH2—CH2—
При построении названия сложных радикалов нумерацию их атомов начинают от углеродного атома со свободной валентностью.
Двухвалентные радикалы называют, добавляя к названию углеводорода суффикс -илен (кроме «метилен»).