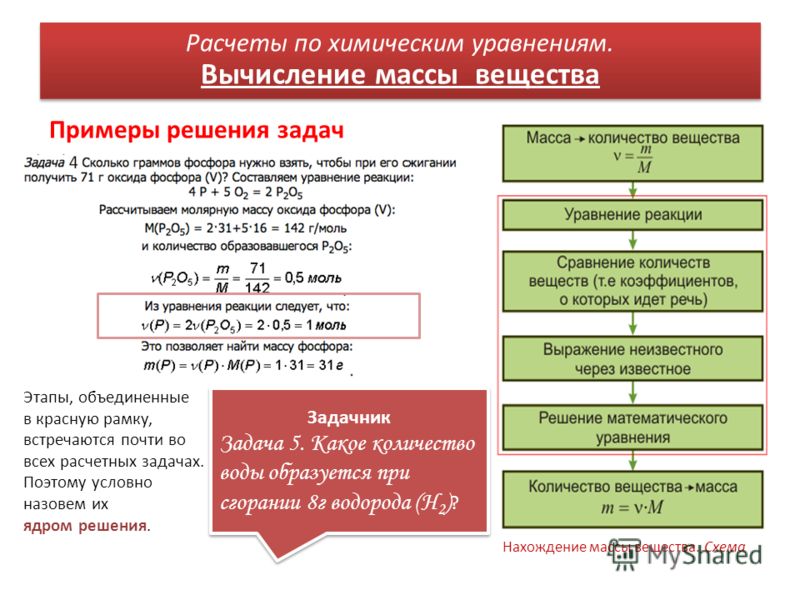
Уравнение Аррениуса: онлайн калькулятор, формула, примеры
Уравнение Аррениуса — научный закон, который определяет функцию константы скорости реакции от температуры. Благодаря закону легко вычислить динамику стремительности реакции в зависимости от температуры, что пригодится не только на производстве или школьной лаборатории, но и на кухне.
Химические реакции
Реакция — это процесс трансформации нескольких реагентов в другие вещества, во время которой совершается реконфигурация электронов ядер. Химические реакции протекают в самых разных условиях: спонтанно при физическом контакте исходных веществ, при действии температуры, света или электрического тока, при механическом воздействии или влиянии радиации.
К наиболее распространенным «бытовым» химическим реакциям относятся процессы, протекающие при динамике температуры. Чем больше температура тела, тем быстрее движутся атомы, что приводит к разрушению кристаллической решетки и хаотичному движению молекул. Понятно, что такие реакции происходят при столкновении элементарных частиц. Однако количество молекул огромно, и если бы каждая встреча частиц провоцировала реакцию, то все термические процессы завершались бы, не успев начаться.
Понятно, что такие реакции происходят при столкновении элементарных частиц. Однако количество молекул огромно, и если бы каждая встреча частиц провоцировала реакцию, то все термические процессы завершались бы, не успев начаться.
Шведский химик Сванте Аррениус, тот самый ученый, который открыл существование ионов, понял, что для начала реакции молекулы должны иметь в запасе энергию. При неизменной температуре спонтанные реакции возможны только при взаимодействии молекул, которые имеют эту энергию. Аррениус назвал эту излишнюю силу энергией активации, а сами частицы — активированными.
Энергия активации
Согласно постулату Аррениуса, энергия активации — это минимальное количество силы, которой должны обладать структурные частицы, чтобы их взаимодействие провоцировало реакцию и обмен электронами. Из курса химии известно, что взаимодействие частиц связано с разрушением старых химических связей и установлением новых, в результате чего каждая структурная единица вещества проходит через создание промежуточного соединения — активированного комплекса. Именно образование переменчивого активированного комплекса требует резервов энергии активации, которые тратятся на одоление сил отталкивания электронных оболочек и перестройку конфигурации атомов.
Именно образование переменчивого активированного комплекса требует резервов энергии активации, которые тратятся на одоление сил отталкивания электронных оболочек и перестройку конфигурации атомов.
Таким образом, чем больше молекул вещества обладают энергией активации, тем быстрее будут протекать реакции с участием этого реагента. На быстроту реакции также влияет и температура, в которой совершается химическое взаимодействие: чем выше температура, тем быстрее движутся молекулы и тем чаще происходят столкновения. Аррениус связал эти постулаты в единое целое.
Уравнение Аррениуса
Химическое уравнение Аррениуса позволяет связать скорость протекания реакции с частотой столкновений молекулярных частиц в зависимости от температуры окружающей среды. Математически уравнение Аррениуса записывается как:
K = Z × e (−Ea / (R × T)),
где K — константа скорости химической реакции, Z — частота соударений реагирующих молекул, Ea — энергия активации, T — температура в Кельвинах, R — универсальная газовая постоянная.
Если внимательно посмотреть на формулу, то можно заметить, что физический смысл константы скорости реакции состоит в том, что она количественно равна скорости реакции при концентрации каждого из реагентов, равной 1 моль/л.
Наш онлайн-инструмент позволяет вычислить скорость протекания реакций, если известны частота соударения молекул, их энергия активации и температура. Для использования калькулятора константы скорости достаточно ввести числа в соответствующие поля и нажать кнопку «Рассчитать».
Пример использования калькулятора
Рассмотрим приближенный пример. Всем известно, что из-за изменения давления скорость химических реакций также изменяется. Уменьшение атмосферного давления высоко в горах не дает альпинистам лакомиться варенной пищей: в разряженной атмосфере температура закипания воды снижается всего на 7 градусов, что замедляет химические реакции приблизительно в 11 раз. Скороварки наоборот повышают давление, увеличивая температуру кипения и ускоряя реакции.
И если мы знаем температуру проведения реакции, а энергию активации можем найти в справочнике, то частоту соударений молекул, к примеру, при варке яиц, мы определить не в состоянии. Известно, что при фиксированной температуре T = 300 K, частота соударения молекул для реакций с молекулярностью n = 1 составляет 1013 − 1014 c-1. Возьмем это число для нашего примера и рассчитаем постоянную скорости реакции для приготовления пищи с энергией активации на уровне 150 кДж/моль. Значение универсальной газовой постоянной известно и уже вшито в код калькулятора. Введем эти данные в калькулятор и получим, что постоянная скорости в этом случае равна 0,0000000000764154 1/с.
Заключение
Уравнение Аррениуса крайне важно для расчетов химической промышленности. Во время протекания реакций при неизменной температуре выделяется тепловая энергия, которая нагревает исходные вещества и может привести к неконтролируемому ускорению реакции. Грамотный расчет уравнений Аррениуса для промышленных процессов позволяет полностью контролировать выделение тепловой энергии и избежать взрыва.
Калькулятор химических реакций для Андроид
Балансировщик химических уравнений для удобного измерения химических формул. Это дает вам лучший опыт решения проблем и химических реакций с помощью химического калькулятора.Это приложение для балансировки химических уравнений представляет собой умный инструмент, который точно работает как химический балансир. Учащиеся любого уровня и любого класса могут использовать это приложение-решатель химии , потому что мы разработали его с простым в использовании интерфейсом для балансировки химических уравнений. Это приложение содержит все уравнения химии, поэтому вы можете легко измерить и сбалансировать уравнение химии с помощью этого калькулятора балансировки химических уравнений.
В этом приложении с уравнениями химии хорошо то, что оно также содержит периодическую таблицу. Таким образом, вы сможете быстро найти химические формулы и химические уравнения , используя этот балансировщик химических уравнений и химический калькулятор. Мы уверены, что это будет ваше следующее любимое приложение в качестве химического балансира .
Мы уверены, что это будет ваше следующее любимое приложение в качестве химического балансира .
Как пользоваться химическим калькулятором
Это приложение для баланса химических уравнений позволяет решать уравнения всего за несколько секунд. Вам нужно только написать желаемое уравнение и нажать кнопку баланса. Затем этот решатель химических уравнений обрабатывает ваш запрос, решает уравнения и реакции , чтобы мгновенно получить точные результаты. Вы также можете копировать и вставлять уравнения или результаты своей практики сбалансированных уравнений, решая химические уравнения и формулы с помощью этого калькулятора.
Особенности балансировщика химических уравнений
— Химический калькулятор небольшого размера.
— Гладкое приложение химического балансира.
— Очень проста в использовании.
— Все химические формулы.
— Периодическая таблица.
— Калькулятор балансировочных химикатов для всех.
— Полезное приложение для студентов-химиков.
— Простая балансировка химического уравнения.
— Простой инструмент химии.
— Одна секунда для уравновешивания химической реакции.
— Быстрые результаты химического балансира.
Помните, что приложение баланс химического уравнения не содержит только средства балансировки уравнений. Он также включает в себя все химические формулы и уравнения, которые необходимо решить и дать вам правильный ответ путем измерения задач уравнения. Это также полная программа для решения химических уравнений .
Цель создания этого балансирующего химического калькулятора — предоставить вам удобный и простой в использовании интерфейс и опыт работы с приложением для балансировки химических уравнений . Нет необходимости искать здесь и там разные формулы, когда у вас есть все это в одном обучающем приложении, которое содержит все химические формулы и уравнения. Просто вставьте уравнение в поле и посмотрите точный результат сбалансированного уравнения с помощью этого простого и идеального рабочего балансировщика уравнений .
Для вашего удобства мы добавили полную формулу и уравнения химии. Просто выберите любое уравнение из них, и после решения уравнений с помощью этого калькулятора вы получите решение желаемого химического уравнения .
Если вы ищете простой в использовании и хороший балансировщик химических уравнений ? Это приложение для балансировки химического уравнения создано для вас. Теперь вы не забудете формулы уравнений с помощью периодической таблицы этого химического балансира . Потому что наша цель — позволить вам легко выучить и понять химические формулы и уравнения баланса.
Это очень полезный балансировщик химических уравнений. Используйте этот простой химический инструмент для уравновешивания химических уравнений и мгновенно измеряйте реакции формул. Мы надеемся, что вам понравится этот калькулятор химии и поделитесь с нами своими взглядами и ценными словами об этом приложении, чтобы облегчить решение уравнений для вас.
хімія онлайн калькулятор
Вычислить массу реагентов и продуктов. Уравнять реакцию, расставить коэффициенты. Рассчитать массу чистого вещества по массовой доле. Определить избыток и недостаток. Найти количество вещества. Балансировка химического уравнения — онлайн балансировкa. Введите химические уравнения, чтобы их сбалансировать: Инструкция по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Уравнять». Ответ на этот вопрос появится ниже. Всегда используйте верхний регистр для первого символа в названии химического элемента и нижнем регистре для второго символа. Например: Fe, Au, Co, C, O, N, F. Сравните: Co — кобальт и CO — угарный газ. Калькулятор химических реакций. База данных 10000 химических реакций — инструменты химии — информация о веществах. Быстрый поиск. Реклама. Основные определения в химии. Что такое химическое уравнение? Химическое уравнение — это форма описания химической реакции, в которой название каждого химического вещества будет заменено его химическим символом. Калькуляторы по химии. Химия онлайн на нашем сайте в виде справочников и калькуляторов расчета для решения задач и уравнений.
Уравнять реакцию, расставить коэффициенты. Рассчитать массу чистого вещества по массовой доле. Определить избыток и недостаток. Найти количество вещества. Балансировка химического уравнения — онлайн балансировкa. Введите химические уравнения, чтобы их сбалансировать: Инструкция по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Уравнять». Ответ на этот вопрос появится ниже. Всегда используйте верхний регистр для первого символа в названии химического элемента и нижнем регистре для второго символа. Например: Fe, Au, Co, C, O, N, F. Сравните: Co — кобальт и CO — угарный газ. Калькулятор химических реакций. База данных 10000 химических реакций — инструменты химии — информация о веществах. Быстрый поиск. Реклама. Основные определения в химии. Что такое химическое уравнение? Химическое уравнение — это форма описания химической реакции, в которой название каждого химического вещества будет заменено его химическим символом. Калькуляторы по химии. Химия онлайн на нашем сайте в виде справочников и калькуляторов расчета для решения задач и уравнений.
 Наш же сборник онлайн-калькуляторов поможет решить или проверить решение наиболее популярных задач из курса школьной химии. Юрий Дудь: «Путин — красавчик?» {$ item.name $}. number:1 $%. {$ item.name $}. number $ {$ vote_pluralize(total) $}. О проекте. На нашем сайте вы можете найти химические уравнения онлайн, реакции различных химических веществ и продукты этой реакции. Советы по поиску химический реакций онлайн. Если вам нужно найти уравнение, в котором присутствуют вещества, например HCl напишите в поле выше. Если вам нужно найти вещества которые вступают в реакцию, напишите Ag3PO4 + HCl =. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Іонні рівняння реакцій. Як користуватись. Уроки хімії. Блог. Контакти. Головна. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Редактор химических уравнений позволяет уравнять как простейшие химические реакции, так и ОВР онлайн. Также поможет рассчитать массу реагентов или продуктов реакции В любом случае, система дает подсказки, поэтому, ориентируясь на них, записать химическое уравнение неправильно практически нереально.
Наш же сборник онлайн-калькуляторов поможет решить или проверить решение наиболее популярных задач из курса школьной химии. Юрий Дудь: «Путин — красавчик?» {$ item.name $}. number:1 $%. {$ item.name $}. number $ {$ vote_pluralize(total) $}. О проекте. На нашем сайте вы можете найти химические уравнения онлайн, реакции различных химических веществ и продукты этой реакции. Советы по поиску химический реакций онлайн. Если вам нужно найти уравнение, в котором присутствуют вещества, например HCl напишите в поле выше. Если вам нужно найти вещества которые вступают в реакцию, напишите Ag3PO4 + HCl =. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Іонні рівняння реакцій. Як користуватись. Уроки хімії. Блог. Контакти. Головна. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Редактор химических уравнений позволяет уравнять как простейшие химические реакции, так и ОВР онлайн. Также поможет рассчитать массу реагентов или продуктов реакции В любом случае, система дает подсказки, поэтому, ориентируясь на них, записать химическое уравнение неправильно практически нереально.
 1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять». 2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Онлайн калькуляторы. Calculatorium.ru — это бесплатные онлайн калькуляторы для самых разнообразных целей: математические калькуляторы, калькуляторы даты и времени, здоровья, финансов. Инструменты для работы с текстом. Конвертеры. Удобное решение различных задач — в учебе, работе, быту. Актуальная информация. Помимо онлайн.
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять». 2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Онлайн калькуляторы. Calculatorium.ru — это бесплатные онлайн калькуляторы для самых разнообразных целей: математические калькуляторы, калькуляторы даты и времени, здоровья, финансов. Инструменты для работы с текстом. Конвертеры. Удобное решение различных задач — в учебе, работе, быту. Актуальная информация. Помимо онлайн.хімія онлайн калькулятор
15 приложений для учёбы
AdMe отобрал самые лучшие приложения для школьников и студентов.
PhotoMath
PhotoMath — это калькулятор, использующий камеру смартфона — просто наведите камеру на математическую задачу, и PhotoMath сразу же выдаст ответ, с поэтапным решением задачи.
Android | iOS
MalMath
Программа для решения математических задач с пошаговым описанием и графическим изображением.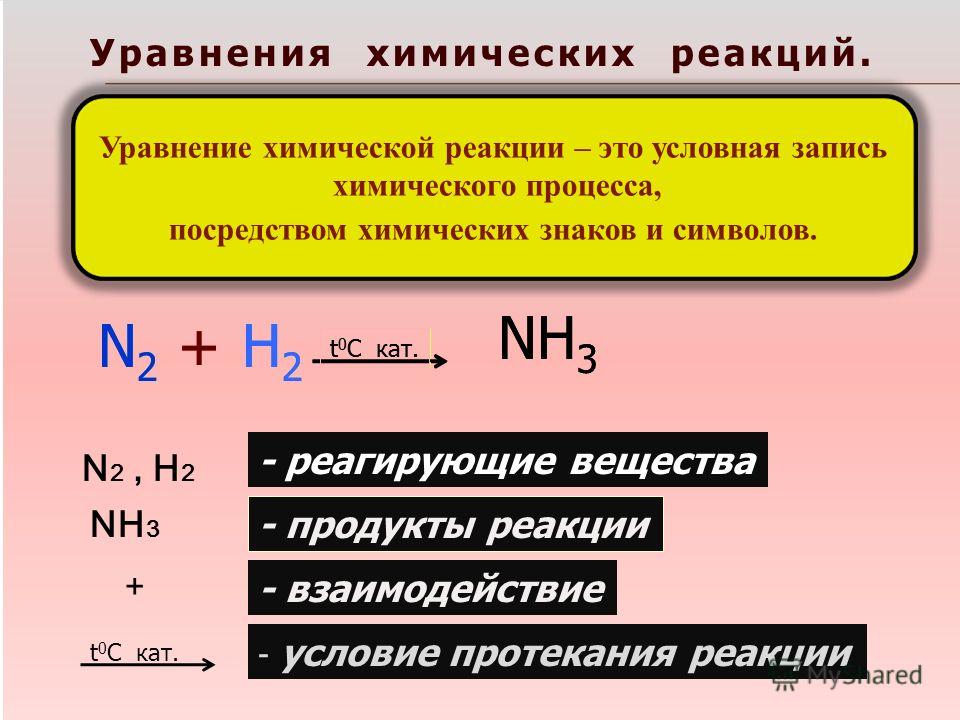 Генерирует случайные математические задачи в нескольких категориях и уровнях сложности. Работает автономно. Можно сохранить или поделиться решениями и графиками.
Генерирует случайные математические задачи в нескольких категориях и уровнях сложности. Работает автономно. Можно сохранить или поделиться решениями и графиками.
Android
Решение уравнений по шагам
Калькулятор может решить все типы уравнений (кроме дифференциальных), исправляет ошибки в выражениях и предлагает для ввода свои варианты. Показывает подробное решение квадратных, простейших тригонометрических уравнений.
Android
Физика
Это сборник всех формул физики, которые сортированы по разделам. Есть возможность поделится любой формулой со своими друзьями или одноклассниками простым свайпом влево и быстро искать формулы по их названию.
iOS
Химия
Приложение решает химические уравнения реакций, поможет с органической и неорганической химией. Есть интерактивная таблица Менделеева и таблица растворимости веществ. Реакции отображены в обычном и ионном виде. И даже нарисованы формулы органической химии.
Android | iOS
Химия X10
Химия X10 — это универсальный помощник по химии — решает задачи, содержит шпаргалки, расстанавливает коэффиценты в уравнениях. Здесь есть встроенный калькулятор молярных масс.
Здесь есть встроенный калькулятор молярных масс.
Android | iOS
Duolingo
Одно из лучших, полностью бесплатных приложений для изучения английского. Обучение проходит в игровой форме, незаметно и увлекательно. В случае неправильных ответов теряются жизни, а при усвоении небольших уроков вы продвигаетесь вперёд. Яркие трофеи отмечают этапы вашего прогресса.
Android | iOS
English Grammar Test
Приложение для проверки знаний английского языка. Здесь 60 тестов по 20 заданий. Каждый вопрос посвящен одной грамматической теме. Таким образом, пройдя один тест, вы сможете проверить свои знания сразу в 26 разделах английской грамматики.
Android
Орфография русского языка
«Орфография» — это и тест, и игра, и викторина. Слова, в которых вы делаете ошибки, будут появляться в последующих тестах для того, чтобы вы наверняка их запомнили. Проверка орфографии поможет с пользой провести время и улучшить правописание и грамотность. По нему можно готовиться к ЕГЭ по русскому языку.
По нему можно готовиться к ЕГЭ по русскому языку.
Android
Грамматика русского языка
Приложение составлено в виде таблиц и схем и имеет, в основном, практическую направленность. Здесь в краткой и доступной форме систематически изложены основные правила грамматики русского языка в объеме средней школы. Работает в оффлайне.
Android
Краткие содержания
30 произведений литературы с 9 по 11 класс в сокращенном виде. Работает без интернет-соединения.
Android
Слово дня – толковый словарь
Каждый день приложение будет показывать новые актуальные слова и термины русского языка, значение которых многие не знают. Команда филологов изучает их определения в толковых словарях Даля и Ожегова и других авторитетных источниках. А потом адаптирует эту информацию в краткие определения для простоты понимания.
Android | iOS
Фоксфорд Учебник
Это интерактивный справочник по школьной программе за 4–11 классы.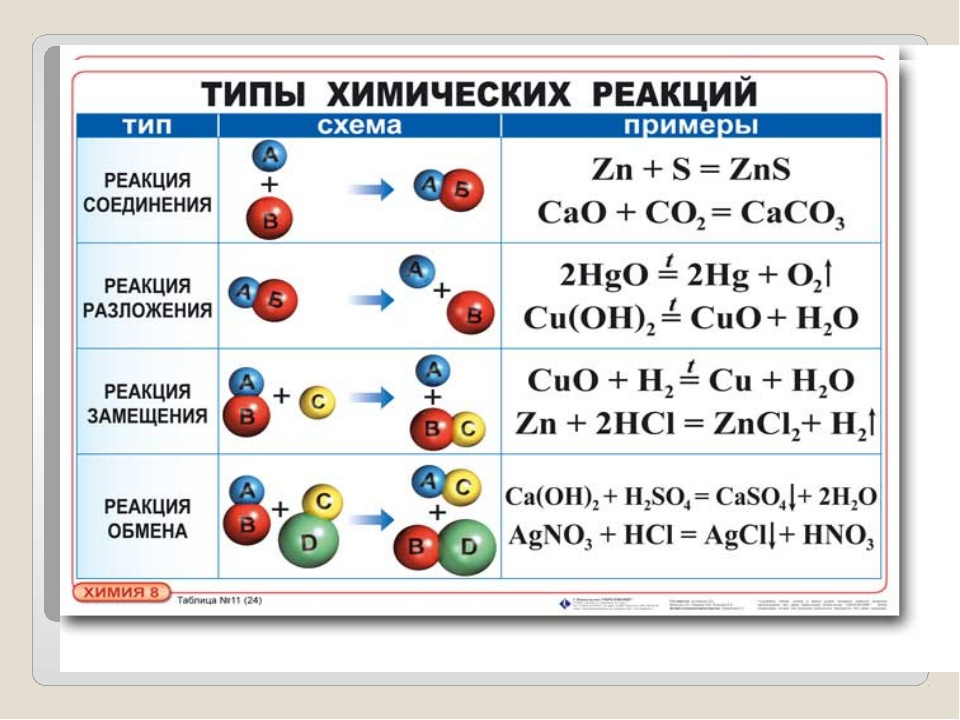 В учебнике вы найдете теорию, отличные примеры и просто шпаргалки по разным предметам. Бонус — более 500 подробных видеоуроков с лучшими преподавателями страны.
В учебнике вы найдете теорию, отличные примеры и просто шпаргалки по разным предметам. Бонус — более 500 подробных видеоуроков с лучшими преподавателями страны.
Android | iOS
Универсариум
Математика, химия, экономика, а, может быть, еще история искусства — изучайте столько предметов, сколько хотите и можете. Вы сами создаете свою программу. Основная часть обучения — это видеолекции. В конце каждого модуля следует проверочный тест.
Android | iOS
Знания
Если не справляетесь с заданием, или нужна подсказка — задайте вопрос и в течение нескольких минут можете получить решение от пользователей.
Android
Решаем уравнения первой степени с тремя неизвестными онлайн калькулятором
Помните наш калькулятор для решения системы уравнений с 2-мя неизвестными?
Мы пошли дальше, и сейчас уже перед вами еще один калькулятор, который может решить систему трех уравнений первой степени с 3-мя неизвестными.
Представим уравнения, в котором 3-и неизвестных:
Из-за того, что формулы очень большие принято писать в следующем варианте:
Тогда само решение уравнений будет выглядеть так:
The field is not filled.
‘%1’ is not a valid e-mail address.
Please fill in this field.
The field must contain at least% 1 characters.
The value must not be longer than% 1 characters.
Field value does not coincide with the field ‘%1’
An invalid character. Valid characters:’%1′.
Expected number.
It is expected a positive number.
Expected integer.
It is expected a positive integer.
The value should be in the range of [%1 .. %2]
The ‘% 1’ is already present in the set of valid characters.
The field must be less than 1%.
The first character must be a letter of the Latin alphabet.
Su
Mo
Tu
We
Th
Fr
Sa
January
February
March
May
June
July
August
September
October
November
December
century
B. C.
C.
%1 century
An error occurred while importing data on line% 1. Value: ‘%2’. Error: %3
Unable to determine the field separator. To separate fields, you can use the following characters: Tab, semicolon (;) or comma (,).
%3.%2.%1%4
%3.%2.%1%4 %6:%7
s.sh.
u.sh.
v.d.
z.d.
yes
no
Wrong file format. Only the following formats: %1
Please leave your phone number and / or email.
Бесплатный онлайн Калькуляторы для инженеров
| TRANSLATE: |
Добро пожаловать
Calculatoredge. com ! com ! |
| Благодарим Вас за посещение нашег о сайта, это на сайте есть несколько онл айн калькулятор Ср |
| едства для инженер ов и Студенты широк о используется во всем мире, мо жно решать слож ные |
| проблемы, ур авнения и форму лы на клик от кнопки. На нашем сайте пользователи инж енеров в обл |
| асти ф изики, химической, электрической, эле ктроника, Строительство и гражданских, оптики и |
лазерн
ой, механической,
финансов, нефти и
газа, структурных
и т. д.… д.…
|
| Даже несколько средних школ исп ользует наш сайт в свои учебные пр ограммы и препод авать в |
| своем кла ссе в школе. Наша цель сост оит в том, чтобы добавить новые онлайновые каль куляторы |
| каждый месяц. Если у Вас есть каки е-либо конкретные, н аши инструменты по могает студентам у |
читься быстрее и пр
оверить
их вручную
результаты
расчетов. Наш сайт имеет
раздел книги,
где вы
Наш сайт имеет
раздел книги,
где вы |
| можете выбрать книгу Ваших интересов. |
Калькулятор онлайн
На этой странице вы найдете отличный интерактивный калькулятор: простой в усвоении и удобный для обширной аудитории пользователей интернета. Онлайн-калькулятор для вычисления математических функций: тригонометрических, матриц, логарифмов, уравнений, и построения графиков. Есть все необходимые функции, быстро загружается, не требует установки на ПК.. Он по праву считается на сегодняшний момент одним из лучших среди сервисов интерактивных математических калькуляторов. Основное преимущество этого онлайн сервиса — это использование инженерного калькулятора с любого компьютера или мобильного устройства в любой удобный для вас момент. Использовать его можно круглосуточно, главное чтобы был выход в интернет. Также ещё одним хорошим подспорьем является то, что сервис предоставляет этот калькулятор абсолютно бесплатно и не требуется никакая регистрация для пользователей.
Использовать его можно круглосуточно, главное чтобы был выход в интернет. Также ещё одним хорошим подспорьем является то, что сервис предоставляет этот калькулятор абсолютно бесплатно и не требуется никакая регистрация для пользователей.
Интерактивный калькулятор умеет выполнять как простые, так и сложные математические вычисления: извлечения корней, логарифмы, тригонометрические функции, проценты, вычисление матриц, факториалов, интегралов, дробей, векторов и комплексных чисел, решения сложных математических формул, простых уравнений и сложных систем уравнений, так дифференциальных уравнений и их систем, и еще множество других вычислений
Также возможно построение различных графиков, что чрезвычайно удобно для быстрого и наглядного решения сложных математических задач для инженеров, студентов и школьников.
Кнопки и команды онлайн-калькулятора
В списке ниже указаны все клавиши и команды калькулятора и выполняемые ими операции.
| Клавиша | Символ | Операция |
|---|---|---|
| pi | pi | Постоянная pi |
| е | е | Число Эйлера |
| % | % | Процент |
| ( ) | ( ) | Открыть/Закрыть скобки |
| , | , | Запятая |
| sin | sin(α) | Синус угла |
| cos | cos(β) | Косинус |
| tan | tan(y) | Тангенс |
| sinh | sinh() | Гиперболический синус |
| cosh | cosh() | Гиперболический косинус |
| tanh | tanh() | Гиперболический тангенс |
| sin-1 | asin() | Обратный синус |
| cos-1 | acos() | Обратный косинус |
| tan-1 | atan() | Обратный тангенс |
| sinh-1 | asinh() | Обратный гиперболический синус |
| x2 | ^2 | Возведение в квадрат |
| xy | ^ | Возведение в степень |
| 10x | 10^() | Возведение в степень по основанию 10 |
| ex | exp() | Возведение в степень числа Эйлера |
| √x | sqrt(x) | Квадратный корень |
| y√x | sqrt(x,y) | Извлечение корня |
| log | log(x) | Десятичный логарифм |
| ln | ln(x) | Натуральный логарифм |
| logyx | log(x,y) | Логарифм |
| mod | mod | Деление с остатком |
| ! | ! | Факториал |
| i / j | i / j | Мнимая единица(комплексное число) |
| Re | Re() | Выделение целой действительной части |
| Im | Im() | Исключение действительной части |
| |x| | abs() | Модуль числа |
| /x | arg() | Аргумент функции |
| ()3 | () | Вектор с 3 параметрами |
| ()4 | () | Вектор с 4 параметрами |
| Deg | Градусы | |
| Rad | Радианы | |
| Дополнительные функции (набираются только вручную на клавиатуре) | ||
| ncr() | Биноминальный коэффициент | |
| gcd() | НОД | |
| lcm() | НОК | |
| sum() | Суммарное значение всех решений | |
| factorize() | Разложение на простые множители | |
| diff() | Дифференцирование | |
| Matrix() | Матрицы | |
| Solve() | Уравнения и системы уравнений | |
| Plot() | Построение графиков | |
Балансировщик уравнений | Лучший калькулятор химических уравнений
В химии мы имеем дело с химическими уравнениями, потому что химические уравнения помогают нам определить идентичность веществ, которые вступают в реакцию (реагенты), а также вещества, которые образуются в результате их реакций (продукты).
Удивительно, что мы можем предсказать продукт следующей реакции, только видя левую сторону уравнения. Для этого мы должны помнить некоторые ключевые моменты.Балансировщик химических уравнений поможет вам завершить процесс в цифровом виде.
Связанный: Как написать чистые ионные уравнения шаг за шагом?
Как предсказать продукт следующей реакции?
Чтобы предсказать природу вещества во время химической реакции, нам необходимо изучить природу реагирующих частиц и типы химических реакций.
Родственный: Полная демонстрация реакции замещения металла в водной среде.
Химическая реакция между металлом и галогенами приводит к образованию соли. Примером является образование NaCl, такого как
.2Na(металл) + Cl 2 (галоген) → 2NaCl(соль)
Химическая реакция между кислотой и основанием приводит к образованию соли и воды.
 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типаHCl + NaOH → NaCL + H 2 O
В реакциях синтеза конечным продуктом является комбинация реагентов, вовлеченных в химическую реакцию, например:
Также узнайте, что такое синтез в химии, чтобы полностью понять синтез.
2Al + 3Cl 2 → 2AlCl 3
В простых реакциях замещения одна часть соединения заменяется другой частью, как показано ниже
PbCl 4 + 2F 2 → PbF 4 + 2Cl 2
Для прогнозирования продукта реакции балансировщик уравнений доступен в Интернете.Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным вычислениям.
Также узнайте, как определить теплоту сгорания и как рассчитать процентный выход химической реакции вручную, или вы можете использовать калькулятор процентного выхода для расчета процентного выхода химической реакции с помощью онлайн-инструмента.
Уравнение химической идентификации веществ и определение количества (числа атомов каждого элемента) каждого вещества, участвующего в реакции.Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Для правильного определения количества химические уравнения должны быть полностью сбалансированы. Калькулятор уравнений балансировки позволяет это сделать без ошибок. Прежде чем мы перейдем к методам уравновешивания химических уравнений, давайте вспомним определения уравновешенных и неуравновешенных химических уравнений.
Связанный: Узнайте, что такое газовые законы и сколько существует газовых законов.
Что такое несбалансированное уравнение?
В несбалансированном химическом уравнении число атомов в обеих частях уравнения неодинаково.Рассмотрим общую реакцию для иллюстрации уравнения балансировки
2А + 2В → АВ
Приведенное выше уравнение в реакционной смеси имеет два атома A и два атома B. Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
Согласно закону сохранения массы это невозможно, поэтому данное уравнение не сбалансировано. Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Na 2 +Cl 2 → NaCl(несбалансированное уравнение)
Пример имеет два атома натрия и два атома хлора в L.H.S. Атомы натрия и один атом хлора находятся справа, что делает уравнение несбалансированным. Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Используйте калькулятор атомной массы для точного расчета количества, атома, молярной массы, промежуточной массы и атомной массы.
Пока мы изучаем химические реакции в химии, существуют несбалансированные химические уравнения, которые необходимо сбалансировать. Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Что такое балансировка химических уравнений?
Сбалансированное химическое уравнение имеет одинаковое количество атомов в обеих частях уравнения.Например,
2А + 2В → 2АВ
Видно, что есть два атома А и два атома В, которые при взаимодействии друг с другом превращаются в две молекулы АВ (2АВ:2А 1 =2•1=2 атома, 2В 1 =2•1=2) Теперь давайте рассмотрим химическое уравнение, чтобы развеять опасения
Na 2 + Cl 2 → 2NaCl
Как и общее уравнение, есть два атома натрия (1 Na 2 = 1•2 = 2) и два атома хлора (1 Cl 2 = 1•2 = 2) , который реагирует с друг друга с образованием 2 молекул NaCl (2 NaCl:2Na = 2•1 = 2, 2 C 1 = 2•1=2)
На примерах доказано, что процесс уравновешивания химических уравнений требует уравновешивания равного числа атомов реагентов и продуктов. Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Связанный: Узнайте, что происходит, когда натрий реагирует с хлором, из нашего блога.
Как сбалансировать химические уравнения?
Балансировка сложных уравнений имеет много способов, но каждый метод специфичен для определенного типа реакции. Метод проверки обычно используется для балансировки химических уравнений.В этом методе вы должны подсчитать количество атомов каждого элемента в обеих частях уравнения.
Связанный: Также узнайте, как подробно сбалансировать сложные уравнения.
Этот метод используется для уравновешивания количества атомов с каждой стороны уравнения, а другой метод включает использование балансировщика химических уравнений.
Мы можем определить количество атомов, умножив значение нижнего индекса каждого элемента, присутствующего в соединении, на значение коэффициента, например
AB 4 + 2C 2 → AC + BC (несбалансированный)
Нам нужно определить количество атомов, участвующих в реакции, чтобы сбалансировать это уравнение.
1А 1 = 1•1 = один атом А
1B 4 = 1•4 = четыре атома B
2C 2 = 2•2 = четыре атома C
- Поскольку имеется только один атом A в левой верхней части, нет необходимости добавлять какой-либо коэффициент или значение нижнего индекса с A в правой верхней части.
- Поскольку имеется четыре атома B и четыре атома C , произведение BC будет преобразовано в 2B 2 C .Мы не можем записать произведение как 2B 2 C 2 , потому что это покажет четыре атома B и пять атомов C, поскольку в продукте AC (2B 2 C 2) присутствует еще один атом C. +AC=4+1=5 несбалансированный) . Найдите этот блог полезным для получения дополнительной информации о том, что такое коэффициент преобразования в химии.
- Чтобы сбалансировать значение C, измените значение нижнего индекса C в AC на AC 2
Таким образом, окончательное уравнение будет таким, как
AB 4 + 2C 2 → AC 2 + 2B 2 C (сбалансированный)
Чтобы сбалансировать количество атомов по обе стороны от атомов, балансировщик химических уравнений также доступен в Интернете.
Связанный: Калькулятор процентного состава поможет вам рассчитать процентное содержание каждого элемента в соединении.
Вам просто нужно написать несбалансированные уравнения, и через несколько секунд он сбалансирует их за вас. Калькулятор уравнений балансировки обычно делает вашу работу безошибочной.
Мы не должны полностью зависеть от балансировщика уравнений, потому что мы не можем использовать этот инструмент в экзаменационном зале.
Калькулятор произведения химического уравнения и калькулятор предельных реагентов, широко используемый многими людьми.Метод этих калькуляторов уравнений баланса почти одинаков, однако итоговое уравнение показано с точным значением коэффициента и индекса.
Таким образом, вы можете легко предсказать предельный реагент, глядя на уравнение. По этой причине исследователи предпочитают такой калькулятор уравнения химического баланса.
Проверьте свои навыки с балансировкой химических уравнений онлайн бесплатно.
Как сбалансировать уравнение?
HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 +H 2 O
Прежде всего сравните общее число атомов каждого элемента, принимающего участие в химической реакции.
Поскольку на стороне продукта два атома азота, умножьте HNO3 на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O(несбалансированный)
Поскольку сторона реагента содержит четыре атома водорода, сбалансируйте количество атомов на стороне продукта, умножив h3O на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O(несбалансированный)
Так как обе стороны теперь содержат одинаковое количество атомов, то данное уравнение уравновешено.
Можете ли вы сбалансировать уравнение с дробью?
При балансировке количества атомов в несбалансированном химическом уравнении вы можете столкнуться со случаями, когда вам придется использовать дробный коэффициент, отличный от целочисленного коэффициента.
Это делается в тех случаях, когда нет возможности полностью сбалансировать химические уравнения, так как это также работает на функциональности балансировщика уравнений. Более того, это дробное значение используется временно и никогда не упоминается в окончательном уравнении.
Для пояснения рассмотрим пример
C 4 H 10 → H 2 O + CO 2 (несбалансированный)
Во-первых, мы должны сбалансировать количество атомов с обеих сторон, начиная с атома водорода.
Поскольку в LHS десять атомов водорода, будет пять молекул h3O. Более того, поскольку в LHS четыре атома углерода, будет четыре молекулы CO 2
.Окончательное уравнение будет записано как
C 4 H 10 + O 2 → 5H 2 O + 4CO 2 (несбалансированный)
Так как в R всего 13 атомов кислорода.HS, не существует целочисленного коэффициента, который можно было бы умножить на нижний индекс 2, чтобы получить 13, поэтому мы записали коэффициент в дроби 13/2 следующим образом:
C 4 H 10 + 13/2 O 2 → 5H 2 O + 4CO 2 (сбалансированный)
Как правило, окончательное уравнение не может быть записано в виде дробного коэффициента, поэтому, чтобы решить эту дробную величину, мы умножаем все уравнение на 2, чтобы преобразовать дробь в целое число, что приводит к окончательному уравнению, такому как
2C 4 H 10 + 13O 2 → 10H 2 O + 8CO 2 (несбалансированный)
Поскольку добавление дробной величины в уравнение является промежуточным шагом, всякий раз, когда вы будете использовать онлайн-решатель уравнений, этот промежуточный шаг не будет там показан. Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Также найдите калькулятор титрования для расчета молярности кислоты и объема кислоты.
Как сбалансировать уравнение методом степени окисления?
Этот метод в основном используется для балансировки окислительно-восстановительных реакций в кислоте на основе степеней окисления. Метод следующий
Напишите полное уравнение и степени окисления каждого элемента реагентов и продукта
Изучите полный метод определения степеней окисления, чтобы лучше понять.
+1*2 К 2 +6*2 Cr 2 -2*7 О 7 + -1 Н 1 -1 8 90 →
+3 Cr -1*3 Cl 3 + -1 K -1 Cl + +1*2 H 2- O -2
Теперь рассмотрим атомы, степени окисления которых не претерпевают никаких изменений.
 Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.Однако в +1K-1Cl степень окисления Cl снова упоминается как -1. Он предсказывает, что в смеси реагентов присутствуют два типа молекул хлора: одни претерпевают изменения в степени окисления, а другие не претерпевают изменения в своей степени окисления.
Таким образом, мы можем написать уравнение вида
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 9 + CL 1 -1 90 90 →
+3 CR -1 * 3 CL 3 + 0 CL 2 + -1 + -1 к -1 кл + + 1 * 2 H 2 -2 ОТак как на стороне реагента находятся два атома Cr со степенью окисления +6 (+1×2K 2 +6×2 Cr 2 -2×7 O 7 ).
 После реакции степень окисления Cr изменяется на +3 в +3 Cr -1×3 Cl 3 .
После реакции степень окисления Cr изменяется на +3 в +3 Cr -1×3 Cl 3 .Таким образом, чтобы сбалансировать уравнение, умножьте CrCl3 на 2, что приведет к следующему уравнению
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 9 + CL 1 -1 90 90 →
2 +3 CR -1 * 3 CL 3 + 0 CL 2 + -1- 2 K -1 CL + + 1 * 2 H 2 -2 О
Приведенное выше уравнение предсказывает, что на L должно быть 6 атомов HCl.H.S, которые изменяют степень окисления, теряя шесть электронов, и получают нулевую степень окисления в 0Cl2. Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например,
.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 3 0 CL -1 →
2 +3 CR -1 * 3 CL 3 + 0 CL 2 + -1- 2 K -1 CL + + 1 * 2 H 2 -2 О
Так как на стороне реагента два атома калия +1×2 K 2 +6×2 Cr 2 -2×7 O 7 , несколько KCl с 2 для баланса числа K в обеих частях уравнения, например
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 3 0 CL -1 →
2 +3 CR -1 * 3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1 * 2 H 2 -2 ОЧтобы подсчитать общее количество окисленных атомов Cl на стороне реагента, суммируйте общее количество Cl в 2KCl и 2CrCl3, которое равно восьми.
 Таким образом, поместите эту цифру в уравнение, такое как
Таким образом, поместите эту цифру в уравнение, такое как+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H H CL -1 →
2 +3 CR -1 * 3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1 * 2 H 2 -2 ОПоскольку сторона реагента содержит семь атомов кислорода, умножьте h3O на семь.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H H CL -1 →
2 +3 CR -1 * 3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + 7 + 1 * 2 H 2 — 2 ОНаконец, упростите уравнение, удалив степени окисления и просуммировав общее количество неокисленных и окисленных молекул Cl, таких как
K 2 Cr 2 O 7 + 12HCl
→
2CrCl 3 + C l2 +2KCl + 7H 2 O
Калькулятор химических уравнений балансировки становится лучшим вариантом, который обеспечивает правильность окончательного уравнения.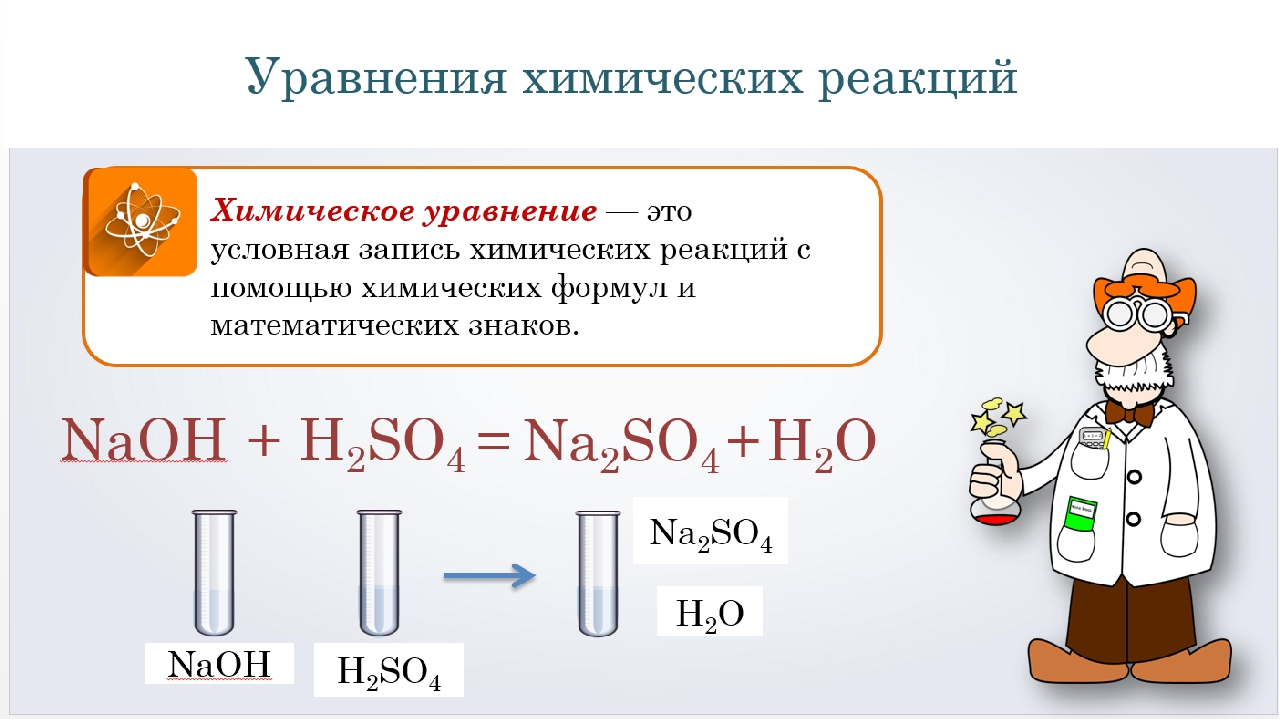 Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Как сбалансировать химическое уравнение ионно-электронным методом
Этот метод также используется для балансировки окислительно-восстановительных уравнений, которые содержат ионы и водную среду. Основной принцип заключается в удалении тех ионов, которые не изменяют степени окисления, отдавая или приобретая валентные электроны. Балансировщик химических уравнений также включает эту функцию.
Мы рассматриваем только те, которые показывают изменение степеней окисления либо отдачей, либо присоединением электронов на валентной оболочке. Поэтому метод получил название ионно-электронного метода. Чтобы понять метод, давайте обсудим окислительно-восстановительную реакцию между HCl и KMnO4, в которой Cl и MnO4 изменяют степень окисления, такую как
.Cl — + MnO 4 — → Cl 2 0 + Mn 2+
В этой реакции Cl окисляется, теряя электроны, а MnO4 восстанавливается, приобретая эти электроны.
 Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).Окисляющая часть:
Класс — → Класс 2 0
Переходник:
MnO 4 — → Mn 2+
Поскольку на стороне продукта два атома хлора, уравнение окисления примет вид
.2Cl — → Cl 2 0
Так как реакция протекает в кислой среде, добавьте H + при L.H.S и сбалансировать эти ионы H + , добавив H 2 O в RHS, например,
8H + + MnO 4 — → Mn 2+ + 4H 2 O
Добавьте количество потерянных и полученных электронов каждой частью, например
.2Cl — → Cl 2 0 + -2e
8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O
Чтобы сбалансировать количество потерянных и полученных электронов в обеих частях, умножьте обе части на определенный коэффициент, чтобы получить окончательное уравнение.
 Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.(2Cl — → Cl 2 0 + -2e)*5
(8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O) * 2
Окончательное уравнение получается суммированием обеих частей.
10Cl — + 16H + 2MnO 4 — → 5Cl 2 + 2Mn 2+ + 8H 2 O
Родственный:
Калькулятор теоретического выхода может помочь вам определить выход химической реакции.
Тот же метод используется для реакции, протекающей в основных средах. Однако вы должны добавить ионы OH, чтобы сбалансировать обе стороны, кроме ионов H+. Для дальнейшего удобства также полезен онлайн-способ сделать это с помощью калькулятора химических уравнений.
Родственный: Какое общее химическое уравнение для эндотермической реакции?.
Как сбалансировать уравнение в основной среде?
Рассмотрим окислительно-восстановительную реакцию, протекающую в щелочной среде, например:
H 2
6 O + MNO 4 -1
С
MnO 4 -1
и
С 2 О 4 -2
показывают изменения в степени окисления, мы будем рассматривать только их.
С
С 2 О 4 -2
окисляется, отдавая электроны, это будет часть окисления. Более того, с
г.MnO 4 -1
восстанавливается, приобретая электроны, это будет восстановительная часть.

Мы изменим часть окисления, чтобы сбалансировать количество атомов C с обеих сторон
C 2 O 4 -2 → 2CO 2
Чтобы сбалансировать восстановительную часть, добавьте две молекулы H 2 O на стороне реагента и сбалансируйте ее на стороне продукта, добавив четыре иона OH, например,
MnO 4 -1 + 2H 2 O → MnO + 4OH —
Сложите количество полученных и потерянных электронов в обеих частях, например
.C 2 O -2 4 → 2CO 2 + -2e
MnO 4 -1 + 2H 2 O + 3e → MnO + 4OH —
Сбалансируйте количество электронов с обеих сторон, умножив часть восстановления на 2 и часть окисления на 3.
. Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как2MNO 4
- 1 -1 -1
- 1 -1
- 2 + 3C 2 O 4 -2 -2 -2
- 2 + 4H 2 o → 2mno + 6Co 2 + 8OH —
Связанный: Узнайте все о трех законах термодинамики, чтобы улучшить свое понимание.
Чтобы получить точные и быстрые результаты, вы можете использовать усовершенствованный калькулятор химических уравнений балансировки для балансировки химических уравнений.Вы можете использовать калькулятор окислительно-восстановительных реакций на этом веб-сайте для балансировки окислительно-восстановительных уравнений и реакций.
Как использовать Equation Balancer?
Этот калькулятор уравнений химических балансов помогает быстро сбалансировать химические уравнения. Если вы используете калькулятор химических уравнений балансировки с шагами, вы знаете, как легко с ним работать.
В этом калькуляторе баланса химических уравнений есть много примеров уравнений, так что вы можете попрактиковаться и сбалансировать уравнения. Также есть периодическая таблица химии под калькулятором балансировки химических уравнений, так что вы можете добавлять значения оттуда.Вы также можете узнать все об уравнениях периодической таблицы, чтобы лучше понять.
Как только вы введете свое уравнение в поле, калькулятор уравнений балансировки немедленно сбалансирует ваше уравнение. Поделитесь этим со своими одноклассниками и другими людьми, чтобы они тоже могли извлечь из этого пользу.
Chemical Equation Balancer — Калькулятор химического баланса
Chemical Equation Balancer
Многим людям трудно справиться с задачами по химии, особенно с балансировкой химических уравнений в неорганической химии.Балансировка уравнения может быть сложной задачей, потому что она связана со сложностью работы с атомами и молекулами. Студенты, как правило, плохо учатся в этой области химии, но вам не о чем беспокоиться, потому что мы предлагаем вам бесплатный балансировщик химических уравнений в вашем распоряжении.
Калькулятор балансирующих химических уравнений сэкономит вам много сил и времени при подготовке к экзаменам. Его можно использовать в качестве решателя химических уравнений для балансировки уравнений. Уравнения баланса не более сложны, потому что калькулятор уравнений баланса делает все сам.Вам нужно всего лишь поместить уравнения химического баланса в коробку, и она сделает волшебство.
В этом содержании мы объясним, как сбалансировать химические уравнения, как калькулятор уравнений баланса работает, и как вы можете использовать этот калькулятор уравнений баланса химических для вашей академической работы.
Как пользоваться калькулятором сбалансированных уравнений?
Калькулятор уравнений баланса разработан, чтобы облегчить бремя студентов-химиков, которые сталкиваются с трудностями при балансировании химических уравнений в школе или колледже. Кроме того, требуется время, чтобы преобразовать несбалансированное уравнение в сбалансированное, что не способствует производительности. Этот инструмент является продуктивным образовательным инструментом для студентов, которые с нетерпением ждут техники решения для обучения.
Кроме того, требуется время, чтобы преобразовать несбалансированное уравнение в сбалансированное, что не способствует производительности. Этот инструмент является продуктивным образовательным инструментом для студентов, которые с нетерпением ждут техники решения для обучения.
Чтобы сделать этот инструмент более интерактивным, мы разместили периодическую таблицу. Эту таблицу можно использовать для ввода данных, щелкая элементы периодической таблицы. Существует также числовая вкладка для использования чисел для указания количества атомов или молекул в элементе. Это означает, что вам не нужно писать уравнение вручную, но вы можете написать его, если хотите.
Чтобы использовать калькулятор химического баланса , , выполните следующие действия:
- Составьте химическое уравнение, нажимая на элементы периодической таблицы.
- Используйте числовую вкладку для ввода количества атомов.
- Используйте знаки + и = , чтобы составить полное уравнение.

- Вы также можете скопировать и вставить уравнение в данное поле ввода.
- Нажмите кнопку Calculate , чтобы получить уравнение баланса.
- Используйте кнопку Сброс для следующей операции.
Выделяет только что добавленные атомы элемента синим цветом. Используя этот калькулятор, вы можете узнать, как сбалансировать химические уравнения, потренировавшись на этом инструменте. В химии очень важно число Авогадро. Вы можете в любое время воспользоваться нашим числовым калькулятором Авогадро, если он вам понадобится.
Как сбалансировать химические уравнения?
Как упоминалось выше, химические уравнения нелегко сбалансировать вручную.Чтобы овладеть этим навыком, требуется много практики. Существуют различные способы сбалансировать химическое уравнение, но мы объясним эту тему самым простым. Вы можете легко понять основную концепцию и метод балансировки химических уравнений, изучив эту технику.
Начнем с простейшего уравнения водорода и серы. Вот неуравновешенное сбалансированное уравнение.
Вот неуравновешенное сбалансированное уравнение.
Пример – простое химическое уравнение
H + S 3 = H S 2
Итак, как мы можем сбалансировать это уравнение?
Как видите, в левой части уравнения три атома серы, а в левой только два атома серы.Атомы водорода уже уравновешены с обеих сторон, по одному атому с каждой стороны.
Решение:
- Для повышения атомов серы в этом уравнении мы должны умножить правую сторону на 3.
H + S 3 = 3 HS 2
H + 2 S 3 = 3 HS 2
- Сера уравновешена с обеих сторон с 6 атомами с каждой стороны, но, как вы можете видеть, водород с левой стороны представляет собой только один атом, а с правой стороны , у него 3 атома.Умножьте количество водорода в правой части на 3.
3 H + 2 S 3 = 3 HS 2
- Проверьте уравнение для каждого элемента и посчитайте количество атомов каждого элемента с обеих сторон.
 уравнения.
уравнения.
H = 3 и S = 6
Обе стороны имеют одинаковое количество атомов для каждого элемента.
Теперь уравнение сбалансировано. С обеих сторон 3 атома водорода и 6 атомов серы.Вы можете использовать наш калькулятор уравнения балансировки выше, чтобы сделать это за несколько секунд.
Давайте сбалансируем сложное химическое уравнение на примере.
Пример – комплексное химическое уравнение
C 2 H 5 OH + O 2 = CO + H 2 O
Это комплексное уравнение с углеродом, кислородом и водородом. Как видите, атомы каждого элемента в этом уравнении различаются.
- В правой части уравнения 2 атома углерода, 6 атомов водорода и 3 атома кислорода.
- С левой стороны 1 атом углерода, 2 атома водорода и 2 атома кислорода.
Итак, мы должны сбалансировать каждый элемент в отдельности.
Решение:
- В правой части уравнения поместите коэффициент 2 с CO , чтобы сбалансировать кислород с обеих сторон.

C 2 H 5 OH + O 2 oh + O 2 = 2 2 CO + H 2 O
o o- Теперь балансируйте водород, размещая коэффициент 3 с H 2 O в правой части уравнения.
C 2 H 5 OH + O 2 = 2 = 2 C O + 3 H 2 o
o- Водород и углерод сбалансированы в уравнении. Сбалансируйте атомы кислорода, умножив O 2 на 2 в левой части уравнения.
C 2 H 5 H 5 OH + 2 O 2 O 2 = 2 CO + 3 H 2 O
- Проверьте уравнение для каждого элемента и подсчитайте количество атомов каждого элемента в обеих частях уравнения.

C = 2, H = 6, O = 5
Обе стороны имеют одинаковое количество атомов для каждого элемента.
Теперь, когда вы знаете, как сбалансировать химические уравнения, вы можете использовать наш химический балансировщик , описанный выше, чтобы сэкономить много времени. Вы также можете рассчитать вес кислоты с помощью нашего калькулятора веса кислоты.
Часто задаваемые вопросы
Как сбалансировать химическое уравнение?
Химическое уравнение можно сбалансировать, используя следующий метод:
- Подсчитайте количество атомов реагентов и продуктов в обеих частях уравнения.
- Выровняйте количество атомов для каждого элемента, расставив коэффициенты с реагентами и соединениями.
- Повторяйте предыдущий шаг, пока каждый элемент с обеих сторон не будет иметь одинаковое количество атомов.
2 H 2 + O 2 → 2 H 2 O
0 Какие химические уравнения бывают?Четыре типа химических уравнений:
- Реакция соединения
- Реакция осаждения
- Реакция разложения
- Реакция горения
Что является примером химического уравнения?
H 2 + O 2 è 2 H 2 O является примером химического уравнения.
В этом химическом уравнении молекулы водорода и кислорода объединяются, образуя воду. Элементы в левой части уравнений называются реагентами. Они объединяются знаком плюс (+). В то время как соединение в правой части уравнения называется продуктом , который представлен знаком стрелки ( ®).
Почему важно, чтобы химическое уравнение было сбалансированным?
Химические уравнения используются для создания различных соединений и химических продуктов.Использование этих химических уравнений со сбалансированными атомами приводит к химическим реакциям, которые дают требуемый продукт.
Если химические уравнения не сбалансированы, невозможно будет получить требуемые химические продукты. Продукты, произведенные с несбалансированными химическими уравнениями, являются дефектными и являются отходами химических веществ и элементов.
Химические балансы: Химия: TI Science Nspired
| Категория | Описание | Разрешить |
|---|---|---|
| Аналитические и эксплуатационные файлы cookie | Эти файлы cookie, в том числе файлы cookie из Google Analytics, позволяют нам распознавать и подсчитывать количество посетителей на сайтах TI, а также отслеживать, как посетители перемещаются по нашим сайтам. Это помогает нам улучшить работу сайтов TI (например, упрощая поиск информации на сайте). Это помогает нам улучшить работу сайтов TI (например, упрощая поиск информации на сайте). | |
| Рекламные и маркетинговые файлы cookie | Эти файлы cookie позволяют размещать рекламу на основе интересов на сайтах TI и сторонних веб-сайтах с использованием информации, которую вы предоставляете нам при взаимодействии с нашими сайтами.Объявления на основе интересов отображаются для вас на основе файлов cookie, связанных с вашими действиями в Интернете, такими как просмотр продуктов на наших сайтах. Мы также можем передавать эту информацию третьим лицам для этих целей. Эти файлы cookie помогают нам адаптировать рекламные объявления, чтобы они лучше соответствовали вашим интересам, управлять частотой, с которой вы видите рекламу, и понимать эффективность нашей рекламы. | |
| Функциональные файлы cookie | Эти файлы cookie помогают определить, кто вы, и сохраняют информацию о вашей деятельности и учетной записи, чтобы обеспечить расширенные функциональные возможности, включая более персонализированный и актуальный опыт на наших сайтах. Если вы не разрешите эти файлы cookie, некоторые или все функции и службы сайта могут работать неправильно. | |
| Файлы cookie социальных сетей | Эти файлы cookie позволяют идентифицировать пользователей и контент, связанный с онлайн-социальными сетями, такими как Facebook, Twitter и другие платформы социальных сетей, и помогают TI улучшить охват социальных сетей. | |
| Строго необходимо | Эти файлы cookie необходимы для работы сайтов TI или для выполнения ваших запросов (например, для отслеживания того, какие товары вы положили в свою корзину на TI.com, для доступа к безопасным областям сайта TI или для управления настроенными настройки файлов cookie). | Всегда включен |
Калькулятор химических уравнений и калькулятор — Бесплатный онлайн-калькулятор
Химия – одна из важнейших отраслей естествознания. Хотя это часто считается сложной и монотонной дисциплиной, на самом деле все обстоит иначе. Химия очень практична, логична и так или иначе ценна во всех аспектах нашей жизни. Законы химии диктуют многие природные явления, происходящие вокруг нас, будь то пылающее солнце над головой, облака, извержения вулканов, фотосинтез и даже наши собственные тела. В нашей повседневной жизни химия играет жизненно важную роль в таких областях, как уборка, приготовление пищи и медицина. Сегодня это стало еще более актуальным из-за спроса на экологически чистые продукты и процедуры.
Хотя это часто считается сложной и монотонной дисциплиной, на самом деле все обстоит иначе. Химия очень практична, логична и так или иначе ценна во всех аспектах нашей жизни. Законы химии диктуют многие природные явления, происходящие вокруг нас, будь то пылающее солнце над головой, облака, извержения вулканов, фотосинтез и даже наши собственные тела. В нашей повседневной жизни химия играет жизненно важную роль в таких областях, как уборка, приготовление пищи и медицина. Сегодня это стало еще более актуальным из-за спроса на экологически чистые продукты и процедуры.
Разве не увлекательно думать, что в нашем теле происходят миллионы химических реакций, когда мы бежим, сидим, едим или даже просто дышим? Таким образом, знание химии необходимо для студентов, стремящихся стать врачами, фармацевтами, физиками, диетологами, геологами или агрономами. Основы химии основаны на математике и логике. Таким образом, нужно быть сильным в этих областях, чтобы понимать химические реакции и свойства. Например, химические уравнения используются для представления того, как происходит химическая реакция.Эти уравнения должны быть сбалансированы, чтобы подчиняться законам сохранения массы и энергии.
Например, химические уравнения используются для представления того, как происходит химическая реакция.Эти уравнения должны быть сбалансированы, чтобы подчиняться законам сохранения массы и энергии.
Сбалансировать химическое уравнение иногда может быть довольно сложной и трудоемкой задачей. Если вы столкнулись с трудностями с тем же самым или просто не хватает времени, вы можете попробовать использовать калькулятор химических уравнений для балансировки уравнения. Вы можете положиться на него, чтобы получить быстрые и точные результаты. Давайте подробнее рассмотрим особенности этого уникального балансировщика и калькулятора химических уравнений.
Что такое химическое уравнение?
Прежде чем мы прочитаем о калькуляторе химических уравнений, давайте сначала поймем, что такое химическое уравнение. В химии уравнение — это в основном символическое представление химической реакции. По закону сохранения массы атомы не образуются и не разрушаются в ходе химической реакции. Во время химической реакции происходит перегруппировка атомов. В химическом уравнении реагенты и продукты условно показаны слева и справа от стрелки соответственно.
Во время химической реакции происходит перегруппировка атомов. В химическом уравнении реагенты и продукты условно показаны слева и справа от стрелки соответственно.
Согласно законам сохранения массы и заряда, как количество атомов каждого типа, так и общий заряд должны быть одинаковыми в обеих частях сбалансированного химического уравнения. Единственная разница в каждой части уравнения заключается в расположении атомов для образования ионов или молекул. Это связано с тем, что в реакции обычно связи реагентов разрываются, и новые связи должны давать продукты. Если количество атомов каждого вида в двух частях уравнения различно, то реакция неуравновешенная.В результате он не может правильно представить, что происходит во время реакции.
Например, рассмотрим приведенный ниже пример:
CH 4 + Cl 2 → CCl 4 + HCl
Сбалансированное химическое уравнение для приведенной выше реакции:
CH 4 + 4Cl 2 → CCl 4 + 4HCl
Используя химическое уравнение, мы также можем определить константу равновесия реакции (K eq ). Он определяется как значение коэффициента реакции в состоянии химического равновесия. K eq реакции формулируется как количество продуктов, деленное на количество реагентов. Здесь каждое количество выражено либо концентрацией, либо парциальным давлением, возведенным в степень его коэффициента в сбалансированном химическом уравнении.
Он определяется как значение коэффициента реакции в состоянии химического равновесия. K eq реакции формулируется как количество продуктов, деленное на количество реагентов. Здесь каждое количество выражено либо концентрацией, либо парциальным давлением, возведенным в степень его коэффициента в сбалансированном химическом уравнении.
Есть много способов вручную сбалансировать химическое уравнение. Однако эти методы, как правило, требуют много времени, а иногда и сложны.Калькулятор химических уравнений очень полезен для студентов, преподавателей и ученых, которым необходимо точно и быстро сбалансировать химическое уравнение.
Что такое калькулятор химических уравнений?
Калькулятор химических уравнений — это полезный онлайн-инструмент, который может точно сбалансировать данное химическое уравнение за считанные секунды. Помимо этого, он также способен отображать химическую структуру и свойства данного вещества, а также его химическое название и формулу. Он может даже отображать константу равновесия (K eq ) реакции для вас. Этот полезный инструмент можно использовать совершенно бесплатно, и к нему можно получить доступ из любой точки мира, если у вас есть работающее подключение к Интернету.
Он может даже отображать константу равновесия (K eq ) реакции для вас. Этот полезный инструмент можно использовать совершенно бесплатно, и к нему можно получить доступ из любой точки мира, если у вас есть работающее подключение к Интернету.
Как пользоваться калькулятором химических уравнений?
Вы можете использовать калькулятор химических уравнений, выполнив простые действия, указанные ниже:
- Откройте калькулятор и введите требуемое химическое уравнение в поле ввода.
- Нажмите кнопку Баланс.
В течение нескольких секунд калькулятор отобразит сбалансированное химическое уравнение в новом окне вместе с константой равновесия, химическими структурами и формулами участвующих элементов и соединений.
Калькулятор химических уравнений был запрограммирован с использованием современного алгоритма, обеспечивающего получение точных результатов за короткое время. Настоятельно рекомендуется как новичкам, так и профессионалам.
3.6: Количественная информация из сбалансированных уравнений
Сбалансированное химическое уравнение дает идентичность реагентов и продуктов, а также точное количество молекул или молей каждого из них, которые потребляются или производятся. Стехиометрия — это собирательный термин для количественных соотношений между массами, числом молей и числом частиц (атомов, молекул и ионов) реагентов и продуктов в сбалансированном химическом уравнении. Стехиометрическая величина — это количество продукта или реагента, определяемое коэффициентами в сбалансированном химическом уравнении.В этом разделе описывается, как использовать стехиометрию реакции для ответа на следующие вопросы: Сколько кислорода необходимо для обеспечения полного сгорания данного количества изооктана? (Эта информация имеет решающее значение для разработки экологически чистых и эффективных автомобильных двигателей.) Сколько граммов чистого золота можно получить из тонны низкосортной золотой руды? (От ответа зависит, стоит ли разрабатывать месторождение руды. ) Если промышленный завод должен производить определенное количество тонн серной кислоты в неделю, сколько элементарной серы должно еженедельно доставляться по железной дороге?
) Если промышленный завод должен производить определенное количество тонн серной кислоты в неделю, сколько элементарной серы должно еженедельно доставляться по железной дороге?
На все эти вопросы можно ответить, используя понятия молярной, молярной и формульной масс, концентрации раствора, а также коэффициенты в соответствующем сбалансированном химическом уравнении.
Проблемы стехиометрии
При проведении реакции в промышленных условиях или в лаборатории легче работать с массами веществ, чем с количеством молекул или молей. Общий метод преобразования массы любого реагента или продукта в массу любого другого реагента или продукта с использованием сбалансированного химического уравнения изложен и описан в следующем тексте.
Этапы преобразования массы реагента в массу продукта
- Преобразуйте массу одного вещества (вещества А) в соответствующее количество молей, используя его молярную массу.
- Из сбалансированного химического уравнения получить число молей другого вещества (В) из числа молей вещества А, используя соответствующее молярное отношение (отношение их коэффициентов).

- Переведите количество молей вещества В в массу, используя его молярную массу. Важно помнить, что некоторые виды присутствуют в избытке в силу условий реакции. Например, если вещество реагирует с кислородом воздуха, то кислорода явно (но не указано) в избытке.
Преобразование количеств веществ в моли — и наоборот — является ключом ко всем проблемам стехиометрии, независимо от того, даны ли количества в единицах массы (граммы или килограммы), веса (фунты или тонны) или объема (литры или галлоны). .
Рисунок \(\PageIndex{1}\): блок-схема стехиометрических расчетов с участием чистых веществ. Молярные массы реагентов и продуктов используются в качестве коэффициентов пересчета, чтобы можно было рассчитать массу продукта по массе реагента. и наоборот.Чтобы проиллюстрировать эту процедуру, рассмотрим сжигание глюкозы. Глюкоза реагирует с кислородом с образованием углекислого газа и воды:
\[ C_6H_{12}O_6 (т) + 6 O_2 (г) \rightarrow 6 CO_2 (г) + 6 H_2O (л) \label{3. 6.1}\]
6.1}\]
Предположим, что перед экзаменом по химии друг напоминает вам, что глюкоза является основным топливом, используемым человеческим мозгом. Поэтому вы решаете съесть шоколадный батончик, чтобы убедиться, что ваш мозг не исчерпает энергию во время экзамена (хотя нет прямых доказательств того, что употребление шоколадных батончиков улучшает результаты на экзаменах по химии).Если обычный батончик весом 2 унции содержит эквивалент 45,3 г глюкозы, и глюкоза полностью превращается в углекислый газ во время экзамена, сколько граммов углекислого газа вы выделите и выдыхаете в кабинете для осмотра?
Первым шагом в решении задачи такого типа является написание сбалансированного химического уравнения реакции. Проверка показывает, что он сбалансирован, как написано, поэтому изложенную выше стратегию можно адаптировать следующим образом:
1. Используйте молярную массу глюкозы (с точностью до одного десятичного знака, 180.2 г/моль) для определения количества молей глюкозы в шоколадном батончике:
\[моль\, глюкоза = 45,3\, г\, глюкоза \×{1\, моль\, глюкоза \свыше 180,2\, г\, глюкоза} = 0,251\, моль\, глюкоза\]
2. Согласно сбалансированному химическому уравнению, на моль глюкозы образуется 6 моль CO 2 ; поэтому молярное отношение CO 2 к глюкозе составляет 6:1. Таким образом, количество произведенных молей CO 2 равно
Согласно сбалансированному химическому уравнению, на моль глюкозы образуется 6 моль CO 2 ; поэтому молярное отношение CO 2 к глюкозе составляет 6:1. Таким образом, количество произведенных молей CO 2 равно
\[ моль \, CO_2 = моль \, глюкоза \ умножить на {6 \, моль \, CO_2 \над 1 \, моль \, глюкоза } \]
\[ = 0.251 \, моль \, глюкоза \ раз {6 \, моль \, СО_2 \свыше 1 \, моль \, глюкоза} \]
\[ = 1,51 \, моль \, СО_2 \]
3. Используйте молярную массу CO 2 (44,010 г/моль) для расчета массы CO 2 , соответствующей 1,51 моль CO 2 :
.\[масса\, д\, СО_2 = 1,51 \, моль \, СО_2 \раз {44,010 \, г \, СО_2 \над 1 \, моль \, СО_2} = 66,5 \, г \, СО_2 \]
Эти операции можно резюмировать следующим образом:
\[45,3\, г\, глюкоза \раз{1\, моль\, глюкоза\свыше 180.2 \, г \, глюкоза} \times {6 \, моль \, CO_2 \ над 1 \, моль \, глюкоза} \times {44,010 \, г \, CO_2 \ над 1 \, моль \, CO_2} = 66,4 \,г\,СО_2\]
Расхождения между двумя значениями связаны с ошибками округления, возникающими в результате использования пошаговых вычислений на шагах 1–3. (Помните, что во избежание этого во время многошагового расчета обычно нужно доводить лишние значащие цифры до конца!) Это количество газообразного диоксида углерода занимает огромный объем — более 33 л. Подобные методы можно использовать для расчета количества потребленного кислорода. или количество произведенной воды.
(Помните, что во избежание этого во время многошагового расчета обычно нужно доводить лишние значащие цифры до конца!) Это количество газообразного диоксида углерода занимает огромный объем — более 33 л. Подобные методы можно использовать для расчета количества потребленного кислорода. или количество произведенной воды.
Сбалансированное химическое уравнение использовалось для расчета массы продукта, который образуется из определенного количества реагента. Его также можно использовать для определения масс реагентов, необходимых для образования определенного количества продукта, или, как показано в примере \(\PageIndex{1}\), массы одного реагента, необходимой для потребления данной массы. другого реагента.
Пример \(\PageIndex{1}\): Американский космический корабль
Сгорание водорода с кислородом с образованием газообразной воды происходит чрезвычайно энергично, что приводит к одному из самых горячих известных пламени.Поскольку при заданной массе водорода или кислорода выделяется так много энергии, эта реакция использовалась для питания космических челноков НАСА (Национальное управление по аэронавтике и исследованию космического пространства), которые недавно были выведены из эксплуатации. Инженеры НАСА рассчитали точное количество каждого реагента, необходимого для полета, чтобы убедиться, что шаттлы не унесут на орбиту лишнее топливо. Вычислите, сколько тонн водорода должен нести космический шаттл на каждую 1,00 тонну кислорода (1 тонна = 2000 фунтов).
Инженеры НАСА рассчитали точное количество каждого реагента, необходимого для полета, чтобы убедиться, что шаттлы не унесут на орбиту лишнее топливо. Вычислите, сколько тонн водорода должен нести космический шаттл на каждую 1,00 тонну кислорода (1 тонна = 2000 фунтов).
Американский космический корабль «Дискавери» во время старта .Большой цилиндр в середине содержит кислород и водород, питающие главный двигатель шаттла .
Дано : реагенты, продукты и масса одного реагента
Запрашиваемый : масса другого реагента
Стратегия :
- Напишите сбалансированное химическое уравнение реакции.
- Перевести массу кислорода в моли. По соотношению молей в сбалансированном химическом уравнении определите необходимое количество молей водорода.Затем переведите моли водорода в эквивалентную массу в тоннах.
Решение :
Мы используем ту же общую стратегию для решения стехиометрических расчетов, что и в предыдущем примере. Однако, поскольку количество кислорода указывается в тоннах, а не в граммах, нам также необходимо преобразовать тонны в единицы массы в граммах. В конце необходимо еще одно преобразование, чтобы сообщить окончательный ответ в тоннах.
Однако, поскольку количество кислорода указывается в тоннах, а не в граммах, нам также необходимо преобразовать тонны в единицы массы в граммах. В конце необходимо еще одно преобразование, чтобы сообщить окончательный ответ в тоннах.
A Сначала мы используем полученную информацию, чтобы написать сбалансированное химическое уравнение.Поскольку мы знаем идентичность как реагентов, так и продукта, мы можем записать реакцию следующим образом:
\[ H_2(г) + O_2(г) \rightarrow H_2O(г) \]
Это уравнение не сбалансировано, потому что в левой части два атома кислорода, а в правой только один. Присвоение коэффициента 2 как H 2 O, так и H 2 дает сбалансированное химическое уравнение:
\[ 2 H_2 (г) + O_2 (г) \rightarrow 2 H_2O (г) \]
Таким образом, 2 моля H 2 реагируют с 1 молем O 2 с образованием 2 молей H 2 O.5 \, г \, Н_2 \ раз {1 \, фунт \ более 453,6 \, г} \ раз {1 \, тн \ более 2000 \, фунт} = 0,126 \, тн \, Н_2 \]
Космический шаттл должен был быть рассчитан на перевозку 0,126 тонны H 2 на каждую 1,00 тонну O 2 . Хотя для реакции с каждым молем O 2 требуется 2 моля H 2 , молярная масса H 2 настолько меньше, чем у O 2 , что только относительно небольшая масса H 2 по сравнению с массой O 2 .
Хотя для реакции с каждым молем O 2 требуется 2 моля H 2 , молярная масса H 2 настолько меньше, чем у O 2 , что только относительно небольшая масса H 2 по сравнению с массой O 2 .
Упражнение \(\PageIndex{1}\): Обжаривание киновари
Киноварь (или киноварит) \(HgS\) является обычной рудой ртути. Из-за содержания ртути киноварь может быть токсична для человека; однако из-за своего красного цвета он также использовался с древних времен в качестве пигмента.
Киноварь руды. из ВикипедииАлхимики произвели элементарную ртуть, обжигая киноварную руду на воздухе:
\[ HgS (т) + O_2 (г) \rightarrow Hg (л) + SO_2 (г) \]
Летучесть и токсичность ртути делают эту процедуру опасной, что, вероятно, сократило продолжительность жизни многих алхимиков.Учитывая 100 г киновари, сколько элементарной ртути можно получить в результате этой реакции?
- Ответить
86,2 г
Стехиометрия
ДОМ Главы курса Основы калькулятора Обзор математики Базовые понятия Расширенные понятияТесты разделов Предварительное испытание Пост-тест Полезные материалы Глоссарий Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Кинетика Аррениуса Калькулятор Калькулятор термодинамики Калькулятор ядерного распада Линейная регрессия методом наименьших квадратов Решатель уравнений методом Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки на дополнительную информацию Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Кредиты Связаться с веб-мастером | Стехиометрия — это просто математика, стоящая за химией.  Имея достаточно информации, можно использовать стехиометрию для расчета масс, молей и процентов в химическом уравнении. Имея достаточно информации, можно использовать стехиометрию для расчета масс, молей и процентов в химическом уравнении. В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от прочного знакомства с этими основными символами. Например, символ «С» представляет собой атом углерода, а «Н» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет собой натрий, а «Cl» представляет собой хлор.В этом случае мы называем хлор «хлоридом» из-за его связи с натрием. Вы должны были просмотреть схемы именования или номенклатуру в предыдущих чтениях. Химическое уравнение – это выражение химического процесса. Например: AgNO 3 (водн.) + NaCl (водн.) —> AgCl(т) + NaNO 3 (водн.) В этом уравнении AgNO 3 смешивается с NaCl. Уравнение показывает, что реагенты (AgNO 3 и NaCl) реагируют через некоторый процесс (—>) с образованием продуктов (AgCl и NaNO 3 ). Часто записывают химические уравнения, показывающие состояние, в котором находится каждое вещество. Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительное количество каждого присутствующего вещества.Это количество может представлять либо относительное количество молекул, либо относительное количество молей (описано ниже). Если коэффициент не указан, предполагается единица (1). В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, такая как значение температуры, показывает, какие условия должны присутствовать для протекания реакции. Например, на графике ниже обозначения над и под стрелками показывают, что для протекания этой реакции нам нужен химикат Fe 2 O 3 , температура 1000°C и давление 500 атмосфер. Рисунок ниже иллюстрирует большинство концепций, описанных выше: Учитывая приведенное выше уравнение, мы можем определить количество молей реагентов и продуктов. Моль просто представляет число Авогадро (6,022 x 10 23 ) молекул. Родинка похожа на такой термин, как дюжина. Если у вас есть дюжина морковок, у вас их двенадцать. Точно так же, если у вас есть моль моркови, у вас есть 6,022 x 10 23 моркови. В приведенном выше уравнении перед членами нет чисел, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей AgNO 3 , NaCl, AgCl, NaNO 3 . Преобразование между молями и граммами вещества часто важно.
Это преобразование можно легко осуществить, когда атомарные и/или молекулярные
масса вещества (веществ) известна. Учитывая атомарное или молекулярное
масса вещества, эта масса в граммах составляет моль вещества.
Например, кальций имеет атомную массу 40 атомных единиц массы. + Fe Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 O 4 реагируют с образованием одного (1) моля Al 2 О 3 .Если бы это было так, реакция была бы весьма эффектной: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из закона сохранения массы (в котором говорится, что материя не может быть ни создана, ни уничтожена), что это просто не может произойти. Мы должны убедиться, что число атомов каждого конкретного элемента в реагентах равно числу атомов того же элемента в продуктах. Уравновешивание простого химического уравнения в основном делается методом проб и ошибок. Для этого существует множество различных способов и систем, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий термин. 2Fe 3 О 4Этот термин выражает две (2) молекулы Fe 3 O 4 . В каждой молекуле этого вещества есть три (3) атома Fe. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe.Точно так же в одной (1) молекуле вещества содержится четыре (4) атома кислорода, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: . Al + Fe 3 O 4 —> Al 2 O 3 + Fe Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
Пример: у химика есть только 6,0 грамм C 2 H 2 и неограниченный запас кислорода, и он хочет произвести как можно больше CO 2 . Если она использует приведенное ниже уравнение, сколько кислорода она должна добавить в реакцию? 2C 2 H 2 (ж) + 5O 2 (ж) —> 4CO 2 (ж) + 2 H 2 O(ж) Для решения этой задачи необходимо определить, сколько кислорода должно
добавлять, если все реагенты были израсходованы (это способ получения максимального количества CO 2 ).
Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить результат на 5/2, чтобы получить общее количество молекул кислорода. Затем переведем в граммы, чтобы найти количество кислорода, которое необходимо добавить:
В задачах процентного состава существует множество возможных решений. Всегда можно удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но это разные соединения. Стандартно давать соединения в их простейшей форме, где соотношение между элементами настолько уменьшено, насколько это возможно, — это называется эмпирической формулой. При расчете эмпирической формулы из процентного состава можно перевести проценты в граммы. Пример: если соединение состоит из 47,3 % C (углерода), 10,6 % H (водорода) и 42,0 % S (серы), какова его эмпирическая формула? Теперь мы пытаемся получить равномерное соотношение между элементами, поэтому мы делим на количество молей серы, потому что это наименьшее число:
Итак имеем: C 3 H 8 S Пример: Рассчитайте процентное содержание гидросульфата по массе, H 2 SO 4 . Теперь мы можем проверить, что проценты в сумме составляют 100% По сути, это 100, поэтому мы знаем, что все сработало, и, вероятно, мы не допустили ошибок по невнимательности. Таким образом, ответ состоит в том, что H 2 SO 4 состоит из 2,06 % H, 32,7 % S и 65,2 % O по массе. Хотя эмпирическая формула является простейшей формой соединения, молекулярная формула — это форма термина, которая могла бы появиться в химическом уравнение.  Эмпирическая формула и молекулярная формула могут быть
то же самое, или молекулярная формула может быть любым положительным целым числом, кратным эмпирическому
формула.
Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 . Примеры молекулярных формул: P 2 , C 2 o 4 , C 6 H 14 S 2 , H 2 , C 3 H 9 . Эмпирическая формула и молекулярная формула могут быть
то же самое, или молекулярная формула может быть любым положительным целым числом, кратным эмпирическому
формула.
Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 . Примеры молекулярных формул: P 2 , C 2 o 4 , C 6 H 14 S 2 , H 2 , C 3 H 9 .Можно рассчитать эмпирическую формулу по массе или процентному составу любого соединения.Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, — это, по сути, исключаем этап преобразования от процентов к массе. Пример. Рассчитайте эмпирическую формулу соединения, содержащего 43,7 г фосфора и 56,3 г кислорода. Сначала мы конвертируем в моли:
Затем мы делим родинки, чтобы попытаться получить равное соотношение.
Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножить на два (2).Ответ = Р 2 О 5 Рассчитать молекулярную формулу, когда у нас есть эмпирическая формула, несложно.
Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить
молекулярная масса соединения по массе эмпирической формулы.
Также можно сделать это с одним из элементов в формуле;
просто разделите массу этого элемента в одном моле соединения на массу
этого элемента в эмпирической формуле. Результат всегда должен быть
натуральное число. Пример: если мы знаем, что эмпирическая формула соединения — HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма. Разделив 2,016 на 1.008 мы видим, что количество необходимого водорода в два раза больше. Поэтому эмпирическую формулу необходимо увеличить в два раза (2). Ответ: Концентрация раствора — это «сила» раствора. Под раствором обычно понимается растворение некоторого твердого вещества в жидкости, например растворение соли в воде. Также часто необходимо выяснить, сколько воды нужно добавить в раствор, чтобы изменить его концентрацию до определенной. Концентрация раствора обычно указывается в молярности.
Молярность определяется как количество молей растворенного вещества (то, что фактически растворено в растворе), деленное на объем в литрах раствора (общий объем того, что растворено и в чем оно было растворено).
Молярность, вероятно, является наиболее часто используемым термином, потому что измерить объем жидкости довольно просто. Пример: если 5,00 г NaOH растворить в 5000 мл воды, какова молярность раствора?
Теперь мы просто используем определение молярности: моли/литры, чтобы получить ответ
Таким образом, молярность (М) раствора составляет 0,025 моль/л. Моляльность — еще одно распространенное измерение концентрации.
Моляльность иногда используется вместо молярности при экстремальных температурах, потому что объем может сокращаться или увеличиваться. Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, равна 1,5, а масса воды равна 11,7 кг, определите, сколько C 2 H 5 OH должно быть добавлено. в граммах к раствору.
Теперь мы просто используем определение молярности: моли/литры, чтобы получить ответ Можно преобразовать между молярностью и моляльностью. Пример: Если молярность раствора равна 0,30 М, рассчитайте моляльность
раствора, зная, что плотность составляет 3,25 г/мл.
Также можно рассчитать коллигативные свойства, такие как понижение температуры кипения, используя моляльность. Уравнение понижения или расширения температуры: ΔT= K f × mГде: ΔT – депрессия температуры (для точки замерзания) или температурное расширение (для точки кипения) (°C) Пример: если точка замерзания соленой воды, нанесенной на дороги, равна -5. ΔT = K f * m Практические задачи1. Если доступны только 0,25 моль NaOH и вода, сколько NaOH нужно добавить, чтобы получить 10 литров 0.2 М раствор NaOH?Проверьте свою работу 2. Если 2,0 моль сахарозы массой 684 г поместить в 1000 г воды и затем растворить, какова будет моляльность раствора? Проверьте свою работу. 3. Если у вас есть 0,25 М раствор бензола с плотностью 15 г/л, рассчитайте моляльность раствора. Проверьте свою работу 4. Если плотность ртути 13,534 г/см 3 и у вас есть 62,5 см 3 ртути, сколько граммов, молей и атомов ртути у вас есть? (Меркурий имеет массу 200.6 г/моль. [Основной указатель]
[Химическая номенклатура]
[Атомная структура]
[Периодическая таблица] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Калькулятор химических уравнений
| Входное уравнение | Сбалансированное уравнение |
|---|---|
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag+HNO3= NO+ h3O+ AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al2O3 + CO=Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + Fe2O3= Fe+ Al2O3 | 2Al + Fe2O3 = 2Fe + Al2O3 |
| Al + Fe2O= Fe+ Al2O3 | 2Al + 3Fe2O = 6Fe + Al2O3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AgNO 3 + Cl 2 = AgCl + N 2 O 5 + O 2 | 4AgNO3 + 2Cl2 = 4AgCl + 2N2O5 + O2 |
| AL + HNO3 = AL(NO3) + h3 | 2AL + 2HNO3 = 2AL(NO3) + h3 |
| AL + HNO3 = AL(NO3) + h3 | 2AL + 2HNO3 = 2AL(NO3) + h3 |
| Ag+HNO3= NO+ h3O+ AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AL2O3+CO2=AL2(CO3)3 | AL2O3 + 3CO2 = AL2(CO3)3 |
| Ag + Na2SO4 = AgNa2SO4 | Ag + Na2SO4 = AgNa2SO4 |
| Al2O3+h3S=Al2S3+h3O | Al2O3 + 3h3S = Al2S3 + 3h3O |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al(OH)3(s) + h3SO4(aq) = Al2(SO4)3(aq) + h3O(l) | 2Al(OH)3(s) + 3h3SO4(aq) = Al2(SO4) 3(водн. ) + 6h3O(л) ) + 6h3O(л) |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + Cl2 = AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| AI(NO3)3(водн.)+Na3PO4(водн.)=AIPO4(т.)+NaNO3(водн.) | AI(NO3)3(водн.) + Na3PO4(водн.) = AIPO4(тв.) + 3NaNO3(водн. ) |
| AI(NO3)3(водн.)+Na3PO4(водн.)=AIPO4(т.)+NaNO3(водн.) | AI(NO3)3(водн.) + Na3PO4(водн.) = AIPO4(тв.) + 3NaNO3(водн. ) |
| Al+Fe3N2=AlN+Fe | 2Al + Fe3N2 = 2AlN + 3Fe |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2O = Ag + O2 | 2Ag2O = 4Ag + O2 |
| Al(OH)3 = Al2O3 + h3O | 2Al(OH)3 = Al2O3 + 3h3O |
| Ag2O = Ag + O2 | 2Ag2O = 4Ag + O2 |
| As(OH)6 + CO2 = As2O3 + HCO3 + h3O | 2As(OH)6 + 6CO2 = As2O3 + 6HCO3 + 3h3O |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+Cl2=AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Au+h3SeO4=Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al4C3 + h3O = Al(OH)3 + Ch5 | Al4C3 + 12h3O = 4Al(OH)3 + 3Ch5 |
| AlCl3 + O2 = Al2O3 + Cl2 | 4AlCl3 + 3O2 = 2Al2O3 + 6Cl2 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+HCl=AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+HCl=AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
Au (т) + h3SeO4 (водн. )=Au2(SeO4)3 (водн.) + h3SeO3 (водн.) + h3O (ж) )=Au2(SeO4)3 (водн.) + h3SeO3 (водн.) + h3O (ж) | 2Au(тв) + 6h3SeO4 (водн.) = Au2(SeO4)3 (водн. ) + 3h3SeO3(водн.) + 3h3O(ж) |
| Au+h3SeO4 = Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| As2O3 + Cl2 + h3O = h4AsO4 + HCl | As2O3 + 2Cl2 + 5h3O = 2h4AsO4 + 4HCl |
| Al2O3+3h3SO4=Al2(SO4)3+3h3O | Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O |
| Al2O3+HNO3=Al(NO3)3+h3O | Al2O3 + 6HNO3 = 2Al(NO3)3 + 3h3O |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 =NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al(NO3)3 + NaOH = Al(OH)3 + 3 NaNO3 | Al(NO3)3 + 3NaOH = Al(OH)3 + 3NaNO3 |
| Al +BaCl=AlCl3 +Ba | Al + 3BaCl = AlCl3 + 3Ba |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Ag NO3 +Cu=Cu(NO3)2+Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| AlCl3 + K2CO3=Al2(CO3)3 + KCl | 2AlCl3 + 3K2CO3 = Al2(CO3)3 + 6KCl |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| AgNO3+K3PO4=Ag3PO4+KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al2O3 = Al + O2 | 2Al2O3 = 4Al + 3O2 |
| Al+CuO=Al2O3+Cu | 2Al + 3CuO = Al2O3 + 3Cu |
| Al+Fe2O3=Fe+Al3O3 | 3Al + Fe2O3 = 2Fe + Al3O3 |
| Al2 + HCl = AlCl3 + h3 | Al2 + 6HCl = 2AlCl3 + 3h3 |
| Ac(OH)3 = Ac2O3 + h3O | 2Ac(OH)3 = Ac2O3 + 3h3O |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al + 3HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + 3HCl = 2AlCl3 + 3h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al(CN)3+ Mg3(PO4)2= Mg(CN)2+ AlPO4 | 2Al(CN)3 + Mg3(PO4)2 = 3Mg(CN)2 + 2AlPO4 |
| Al(CN)3+ Mg3(PO4)2= Mg(CN)2+ AlPO4 | 2Al(CN)3 + Mg3(PO4)2 = 3Mg(CN)2 + 2AlPO4 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al2O2 + CO = Al + CO2 | Al2O2 + 2CO = 2Al + 2CO2 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Au+h3SeO4= Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AlBr3+K2SO4=KBr+Al2(SO4)3 | 2AlBr3 + 3K2SO4 = 6KBr + Al2(SO4)3 |
| Al4C3 + h3O = Ch5 + Al(OH)3 | Al4C3 + 12h3O = 3Ch5 + 4Al(OH)3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al+O2= Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag + HNO3 = NO+AgNO3+h3O | 3Ag + 4HNO3 = NO + 3AgNO3 + 2h3O |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| AlBr3 + 3Cu = Al + 3CuBr | AlBr3 + 3Cu = Al + 3CuBr |
| AuCl + Al = AlCl3 + Au | 3AuCl + Al = AlCl3 + 3Au |
| AuCl + Zn= ZnCl2 + Au | 2AuCl + Zn = ZnCl2 + 2Au |
| Al + h3CO3 = Al2(CO3)3 + h3 | 2Al + 3h3CO3 = Al2(CO3)3 + 3h3 |
| Al + h3S = Al2S3 + h3 | 2Al + 3h3S = Al2S3 + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+NaOH=h3+Na3AlO3 | 2Al + 6NaOH = 3h3 + 2Na3AlO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al2O3 + HCN = Al(CN)3 +h3O | Al2O3 + 6HCN = 2Al(CN)3 + 3h3O |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Au2S3 + 3h3 = 2Au + 3h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Au2S3 + 3h3 = 2Au + 3h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Ag2+SO4+NaCl=Na2SO4+AgCl | Ag2 + SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Au2S3+h3=Au+h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al(OH)3+C=h3O+Al+CO2 | 4Al(OH)3 + 3C = 6h3O + 4Al + 3CO2 |
| Al(OH)3+C=h3O+Al+CO2 | 4Al(OH)3 + 3C = 6h3O + 4Al + 3CO2 |
| Al(OH)3+3C=6h3O+4Al+3CO2 | 4Al(OH)3 + 3C = 6h3O + 4Al + 3CO2 |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al+ O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag+HNO3=NO2+h3O+AgNO3 | Ag + 2HNO3 = NO2 + h3O + AgNO3 |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Ag+HNO=NO2+h3O+AgNO3 | 3Ag — 2HNO = -5NO2 — h3O + 3AgNO3 |
| Al+ HCl= AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+ HNO3 = AlNO3 + h3 | 2Al + 2HNO3 = 2AlNO3 + h3 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al2O3 + HNO3 = Al(NO3)3+h3O | Al2O3 + 6HNO3 = 2Al(NO3)3 + 3h3O |
| AlCl3+h3SO4=Al2(SO4)3+HCl | 2AlCl3 + 3h3SO4 = Al2(SO4)3 + 6HCl |
| Al+F2=AlF3 | 2Al + 3F2 = 2AlF3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4 + NaC1 = Na2SO4 + AgC1 | Ag2SO4 + 2NaC1 = Na2SO4 + 2AgC1 |
| A12O3 + CO = A1 + CO2 | A12O3 + 3CO = 12A1 + 3CO2 |
| A1 + h3SO4 = A12(SO4)3 + h3 | 12A1 + 3h3SO4 = A12(SO4)3 + 3h3 |
| Al2O3+h3SO4=Al2(SO4)3+h3O | Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O |
| Al+ Br2 = AlBr3 | 2Al + 3Br2 = 2AlBr3 |
| Al +h3SO4= Al(SO4) + h3 | Al + h3SO4 = Al(SO4) + h3 |
| Au+h3SeO4= Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al(OH)3+ h3SO4= Al2(SO4)3+ h3O | 2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O |
| AlCl3 + K2CO3 = Al2(CO3)3 + KCl | 2AlCl3 + 3K2CO3 = Al2(CO3)3 + 6KCl |
| Au+h3SeO4= Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al2O3 = Al + O2 | 2Al2O3 = 4Al + 3O2 |
| Al+O2= Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al+O2= Al2O3 | 4Al + 3O2 = 2Al2O3 |
| As4O6 +H+ +MnO4- + h3O=Mn2+ +h4AsO4 | 13As4O6 + 24H+ + 16MnO4- + 66h3O = 8Mn2+ + 52h4AsO4 |
| Al + h3SO4 = Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al2(SO4)3 + Ca(OH)2 = Al(OH)3 + CaSO4 | Al2(SO4)3 + 3Ca(OH)2 = 2Al(OH)3 + 3CaSO4 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| AgNO3+Na3PO4=Ag3PO4+NaNO3 | 3AgNO3 + Na3PO4 = Ag3PO4 + 3NaNO3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| AgNO3 + AlCl3 = AgCl + Al(NO3)3 | 3AgNO3 + AlCl3 = 3AgCl + Al(NO3)3 |
| Al2O3 + 2N = 2NO + Al | Al2O3 + 3N = 3NO + 2Al |
| Al2O3 + 2N = 2NO + Al | Al2O3 + 3N = 3NO + 2Al |
| Al2O3 + 3N = 3NO + 2Al | Al2O3 + 3N = 3NO + 2Al |
| AgNO3 + AlPO4 = AlNO3 + AgPO4 | AgNO3 + AlPO4 = AlNO3 + AgPO4 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al2S3 + h3O = Al(OH)3 + h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| AlCl3=Al+Cl2 | 2AlCl3 = 2Al + 3Cl2 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al4C3 + h3O = Ch5 + Al2O3 | Al4C3 + 6h3O = 3Ch5 + 2Al2O3 |
| AgNO3 + Cl2 = AgCl + N2O5 + O2 | 4AgNO3 + 2Cl2 = 4AgCl + 2N2O5 + O2 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al+Cl2=AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al2O3 + h3O = Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| AgNO3 + Cl = AgCl + N2O5 + O2 | 4AgNO3 + 4Cl = 4AgCl + 2N2O5 + O2 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al + 3HCl = 2AlCl3 + 3h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + 3HCl = 2AlCl3 + 3h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al4C3+h3O=Ch5+Al(OH)3 | Al4C3 + 12h3O = 3Ch5 + 4Al(OH)3 |
| Al4C3+h3O=Ch5+Al(OH)3 | Al4C3 + 12h3O = 3Ch5 + 4Al(OH)3 |
| Al2O3 + Fe = Fe3O4 + Al | 4Al2O3 + 9Fe = 3Fe3O4 + 8Al |
| Au2 S3 + h3 = Au + h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Al2O3 = Al + O2 | 2Al2O3 = 4Al + 3O2 |
| AgNO3 + MgCl2 = AgCl + Mg(NO3)2 | 2AgNO3 + MgCl2 = 2AgCl + Mg(NO3)2 |
| Al + Pb(NO3)2 = Pb + Al(NO3)3 | 2Al + 3Pb(NO3)2 = 3Pb + 2Al(NO3)3 |
| Al2O3 * 3h3SO4 = Al2(SO4)3 + 3h3O | Al2O3*3h3SO4 = Al2(SO4)3 + 3h3O |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AL+O2=AL2+O3 | 0AL + 3O2 = 0AL2 + 2O3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+HCl= AlCl3+ h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al2O3=Al+O2 | 2Al2O3 = 4Al + 3O2 |
| AlCl3 + h3SO4 = Al2(SO4)3 + HCl | 2AlCl3 + 3h3SO4 = Al2(SO4)3 + 6HCl |
| AgNO3+ K3PO4= Ag3PO4 +KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| AlI3 + HgCl2 = AlCl3 + HgI2 | 2AlI3 + 3HgCl2 = 2AlCl3 + 3HgI2 |
| AgNO3 + K3PO4= Ag3PO4 +KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| AlBr3 + Cl2 = AlCl3 + Br2 | 2AlBr3 + 3Cl2 = 2AlCl3 + 3Br2 |
| Al + Br2 = AlBr3 | 2Al + 3Br2 = 2AlBr3 |
| Ag + S8 = Ag2S | 16Ag + S8 = 8Ag2S |
| Al2(SO4)3 + Ca(OH)2= Al(OH)3 + CaSO4 | Al2(SO4)3 + 3Ca(OH)2 = 2Al(OH)3 + 3CaSO4 |
| Al(т) + O2(г) = Al2O3(т) | 4Al(т) + 3O2(г) = 2Al2O3(т) |
| Ag+O2=Ag2O | 4Ag + O2 = 2Ag2O |
Al (т) + HCl (водн. ) = AlCl3 (водн.) + h3 (г) ) = AlCl3 (водн.) + h3 (г) | 2Al(тв) + 6HCl (водн.) = 2AlCl3 (водн.) + 3h3 (г) |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al(ж) + BaO(т) =Al2O3(т) + Ba(ж) | 2Al(ж) + 3BaO(т) = Al2O3(т) + 3Ba(ж) |
| Al +Pb(NO3)2=Al(NO3)3 +Pb | 2Al + 3Pb(NO3)2 = 2Al(NO3)3 + 3Pb |
| Al(OH)3 = Al2O3 + h3O | 2Al(OH)3 = Al2O3 + 3h3O |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| AlPO4 + Mg = Mg3(PO4)2 + Al | 2AlPO4 + 3Mg = Mg3(PO4)2 + 2Al |
| AgNO3+ Cu = Cu(NO3)2 + Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Al + h3SO4 = Al2(SO4)3 + H | 2Al + 3h3SO4 = Al2(SO4)3 + 6H |
| Al(OH)3+h3SO4=Al2(SO4)3+h3O | 2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O |
| As + O2 = As2O5 | 4As + 5O2 = 2As2O5 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| AgNO3 + h3SO4 = NO2 + h3O + SO2 + AgSO4 | AgNO3 + h3SO4 = NO2 + h3O + 0SO2 + AgSO4 |
| Ag + HNO3 = NO2 + AgNO3 +h3O | Ag + 2HNO3 = NO2 + AgNO3 + h3O |
| As+KBrO+KOH= K3AsO4+ KBr+ h3O | 2As + 5KBrO + 6KOH = 2K3AsO4 + 5KBr + 3h3O |
| Al(OH)3 = Al2O3 + h3O | 2Al(OH)3 = Al2O3 + 3h3O |
| AlPO4 + Mg = Mg3(PO4)2 + Al | 2AlPO4 + 3Mg = Mg3(PO4)2 + 2Al |
| AgNO3 + Cu = Cu(NO3)2 + Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al(NO3)3 + Ag = AgNO3 + Al | Al(NO3)3 + 3Ag = 3AgNO3 + Al |
| Al(NO3)3 + Ag = AgNO3 + Al | Al(NO3)3 + 3Ag = 3AgNO3 + Al |
| Al2O3+CO=Al+CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Ag + h3SO4 = AgSO4+SO+h3O | 2Ag + 3h3SO4 = 2AgSO4 + SO + 3h3O |
| Al + I2 = Al+++ + I- | 2Al + 3I2 = 2Al+++ + 6I- |
| Al2O3 + Nh5OH = (Nh5)2O + Al(OH)3 | Al2O3 + 6Nh5OH = 3(Nh5)2O + 2Al(OH)3 |
| Al + h3SO4 =h3+ Al2(SO4)3 | 2Al + 3h3SO4 = 3h3 + Al2(SO4)3 |
| Al + I2 = Al+++ + I- | 2Al + 3I2 = 2Al+++ + 6I- |
| Al(NO3)3 + MgSO3 = Mg(NO3)2 + Al2(SO3)3 | 2Al(NO3)3 + 3MgSO3 = 3Mg(NO3)2 + Al2(SO3)3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + Cl2 = AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| AlBr3+K2SO4=KBr+Al2(SO4)3 | 2AlBr3 + 3K2SO4 = 6KBr + Al2(SO4)3 |
| AgNO3+Cu=Cu(NO3)2+Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Ag + O2 = Ag2O | 4Ag + O2 = 2Ag2O |
| Al2 + Au4Po3 = Al4Po3 + Au | 2Al2 + Au4Po3 = Al4Po3 + 4Au |
| Ag3N + MgS = Mg3N2 + Ag2S | 2Ag3N + 3MgS = Mg3N2 + 3Ag2S |
| Ag2O=Ag+O2 | 2Ag2O = 4Ag + O2 |
| Al2O3 + h3O = Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| Ag + HNO3 = AgNO3+ NO2 + h3O | Ag + 2HNO3 = AgNO3 + NO2 + h3O |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al2O3+CO=Al+CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al2O3+CO=Al+CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al2O3+CO=Al+CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al + 3O2 = 2Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + 3Cl2 = 2AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al+B2=2AlB | 2Al + B2 = 2AlB |
| Al+ h3SO4= Al2(SO4)3+ h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Au+h3SeO4=Au(SeO4)3+h3SeO3+h3O | Au + 6h3SeO4 = Au(SeO4)3 + 3h3SeO3 + 3h3O |
| Au+h3SeO4=Au(SeO4)+h3SeO3+h3O | Au + 2h3SeO4 = Au(SeO4) + h3SeO3 + h3O |
| Al(s) + 3S(s) = Al2S3(s) | 2Al(s) + 3S(s) = Al2S3(s) |
| As2O3 + Ca(OH)2 = Ca3 + (AsO4)2 + h3O | 3As2O3 + 15Ca(OH)2 = 5Ca3 + 3(AsO4)2 + 15h3O |
| Al + HSO4 = Al2(SO4)3 + h3 | 4Al + 6HSO4 = 2Al2(SO4)3 + 3h3 |
| Al(OH)3 + h3SO4 = Al2(SO4)3 + h3O | 2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O |
| AgNO3 + Cl2 = AgCl + N2O5 + O2 | 4AgNO3 + 2Cl2 = 4AgCl + 2N2O5 + O2 |
| Au+h3SeO4=Au2(SeO4)3+h3SeO3+h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| AgNo3+CaSo4=Ca(No3)2+Ag2So4 | 2AgNo3 + CaSo4 = Ca(No3)2 + Ag2So4 |
| AgNo3+CaSo4=Ca(No3)2+Ag2So4 | 2AgNo3 + CaSo4 = Ca(No3)2 + Ag2So4 |
| Al(OH)3 + h3SO4 = Al2(SO4)3 + h3O | 2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O |
| Al(NO3)3 + Na2S = Al2S3 + NaNO3 | 2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + h3S+ O2 = Ag2S+ h3O | 4Ag + 2h3S + O2 = 2Ag2S + 2h3O |
| Ag + h3S+ O2 = Ag2S+ h3O | 4Ag + 2h3S + O2 = 2Ag2S + 2h3O |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Ag2+SO4+NaCl=Na2SO4+AgCl | Ag2 + SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + HCl= AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + HNO3 = NO2 + AgNO3 + h3O | Ag + 2HNO3 = NO2 + AgNO3 + h3O |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag +HNO3 =NO2+AgNO3+h3O | Ag + 2HNO3 = NO2 + AgNO3 + h3O |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + P4 = AlP4 | Al + P4 = AlP4 |
| Au+ + Fe = Au + Fe+++ | 3Au+ + Fe = 3Au + Fe+++ |
| Ag+ HNO3 =NO+ h3O+ AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al4C3 + h3O= Al(OH)3 + Ch5 | Al4C3 + 12h3O = 4Al(OH)3 + 3Ch5 |
| Al + 3O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al + HCl = AlCl3 +h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + h3SO4 = h3 + Al2(SO4)3 | 2Al + 3h3SO4 = 3h3 + Al2(SO4)3 |
| Al + h3SO4 = h3 + Al2(SO4)3 | 2Al + 3h3SO4 = 3h3 + Al2(SO4)3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al2O3+h3O=Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| Al4C3 + h3O = Al(OH)3 + Ch5 | Al4C3 + 12h3O = 4Al(OH)3 + 3Ch5 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al + FeO = Fe + Al2O3 | 2Al + 3FeO = 3Fe + Al2O3 |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al2O3+C=Al+CO | Al2O3 + 3C = 2Al + 3CO |
| Al4C3 + h3O = Ch5 + Al(OH)3 | Al4C3 + 12h3O = 3Ch5 + 4Al(OH)3 |
| Au2S3 + h3 = Au + h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Au2S3 + h3 = Au + h3S | Au2S3 + 3h3 = 2Au + 3h3S |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| AgNO3 + Na2CrO4 = Ag2CrO4 + NaNO3 | 2AgNO3 + Na2CrO4 = Ag2CrO4 + 2NaNO3 |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al2O3 + HCl = AlCl3 + h3O | Al2O3 + 6HCl = 2AlCl3 + 3h3O |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| As2O3 + NaOH = h3O + Na3AsO3 | As2O3 + 6NaOH = 3h3O + 2Na3AsO3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| AgCl2+h3O=AgO+2HCl | AgCl2 + h3O = AgO + 2HCl |
| Au + HCl = AuCl3 + h3 | 2Au + 6HCl = 2AuCl3 + 3h3 |
| Al + I2 = Al+++ + I- | 2Al + 3I2 = 2Al+++ + 6I- |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AgNO3 + h4AsO4 = Ag3AsO4 + HNO3 | 3AgNO3 + h4AsO4 = Ag3AsO4 + 3HNO3 |
| Ag2SO4+NaCl= Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| AgBr + AlPO4 = Ag3PO4 + AlBr3 | 3AgBr + AlPO4 = Ag3PO4 + AlBr3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al +KOH +h3O= KAl(OH)4+h3 | 2Al + 2KOH + 6h3O = 2KAl(OH)4 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + Cl2 = AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Ag2O= Ag + O2 | 2Ag2O = 4Ag + O2 |
| Ag2O= Ag + O2 | 2Ag2O = 4Ag + O2 |
| AsCl3 + h3O = HCl + As(OH)3 | AsCl3 + 3h3O = 3HCl + As(OH)3 |
| Al2O3 +3h3 = 2Al + 3h3O | Al2O3 + 3h3 = 2Al + 3h3O |
| Al + h3O = Al(OH)3 + h3 | 2Al + 6h3O = 2Al(OH)3 + 3h3 |
| Al+ 3I =I3Al | Al + 3I = I3Al |
| Al+ 2I =I3Al | Al + 3I = I3Al |
| AlCl3 + NaOH = Al(OH)3 + NaCl | AlCl3 + 3NaOH = Al(OH)3 + 3NaCl |
| Al2(SO4)3 + KOH = Al(OH)3 + K2SO4 | Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4 |
| Al2(SO4)3 + Ca (OH)2 = Al(OH)3 + CaSO4 | Al2(SO4)3 + 3Ca(OH)2 = 2Al(OH)3 + 3CaSO4 |
| Al2(SO4)3 + Ca (OH)2 = Al(OH)3 + CaSO4 | Al2(SO4)3 + 3Ca(OH)2 = 2Al(OH)3 + 3CaSO4 |
| Ag+ HNO3= NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al2O3+ CO= Al+ CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al2O3 + CO = Al +CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al2(SO4)3 + Ca(OH)2 = CaSO4 + Al(OH)3 | Al2(SO4)3 + 3Ca(OH)2 = 3CaSO4 + 2Al(OH)3 |
| Ag + Cl 2 = AgCl | 2Ag + Cl2 = 2AgCl |
| AgNO 3 + K 3 PO 4 = Ag 3 PO 4 + KNO 3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al(OH)3=Al2O3+h3O | 2Al(OH)3 = Al2O3 + 3h3O |
| Ag2O=Ag+O2 | 2Ag2O = 4Ag + O2 |
| Al2O3 + HCl = AlCl3 + h3O | Al2O3 + 6HCl = 2AlCl3 + 3h3O |
| AgNO3 + Cu = Cu (NO3)2 + Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Al2 + O2 = Al2O3 | 2Al2 + 3O2 = 2Al2O3 |
| Ag(Nh4)2OH + R-CHO= R-COONh5 + Ag + Nh4 + h3O | 2Ag(Nh4)2OH + R-CHO = R-COONh5 + 2Ag + 3Nh4 + h3O |
| Ag(Nh4)2OH + R-CHO= R-COONh5 + Ag + Nh4 + h3O | 2Ag(Nh4)2OH + R-CHO = R-COONh5 + 2Ag + 3Nh4 + h3O |
| AgNO3 + Nh5NO3 + NaOH = Ag(Nh4)2OH + NaNO3 + h3O | AgNO3 + 2Nh5NO3 + 3NaOH = Ag(Nh4)2OH + 3NaNO3 + 2h3O |
| Ag2O(s) = Ag(s) + O2(g) | 2Ag2O(s) = 4Ag(s) + O2(g) |
| Al(s) + h3SO4(aq) =Al2(SO4)3(aq) + h3(g) | 2Al(s) + 3h3SO4(aq) = Al2(SO4)3(aq) + 3h3(g) |
| Al+HCl=AlCl3+H | Al + 3HCl = AlCl3 + 3H |
| Al+HCl=AlCl+H | Al + HCl = AlCl + H |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al+h3SO4=Al(SO4)3+h3 | Al + 3h3SO4 = Al(SO4)3 + 3h3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + Cl2 = AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al + KOH + h3O = Al(OH)6 + K+ +h3 | Al + 0KOH + 6h3O = Al(OH)6 + 0K+ + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al2O3 + C=Al + CO | Al2O3 + 3C = 2Al + 3CO |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al+HCl= AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al+HCl= AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + HCl=AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 = h3 + AgNO3 | 2Ag + 2HNO3 = h3 + 2AgNO3 |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Ag + HNO2 = NO +h3O +Ag NO3 | Ag + 4HNO2 = 3NO + 2h3O + AgNO3 |
| As2O3+HNO3+h3O=h4AsO4+NO2 | As2O3 + 4HNO3 + h3O = 2h4AsO4 + 4NO2 |
| As+NaClO+h3O=NaCl+h4AsO4 | 2As + 5NaClO + 3h3O = 5NaCl + 2h4AsO4 |
| Al+HCl=AlCl3 +h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al2(SO4)3 + BaCl2 = BaSO4 + AlCl3 | Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| AgNO3 = Ag + NO2 + O2 | 2AgNO3 = 2Ag + 2NO2 + O2 |
| Al + h4O+ = h3 + h3O + Al3+ | 6Al + 2h4O+ = h3 + 2h3O + 2Al3+ |
| AgNO3 + K3PO4 = Ag3PO4 + KNO3 | 3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3 |
| Al + h3O = Al(OH)3 + h3 | 2Al + 6h3O = 2Al(OH)3 + 3h3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2O = Ag +O2 | 2Ag2O = 4Ag + O2 |
| AlBr3 + Cl2 = Al2Cl3 +Br2 | 4AlBr3 + 3Cl2 = 2Al2Cl3 + 6Br2 |
| Al+HBr=AlBr3+h3 | 2Al + 6HBr = 2AlBr3 + 3h3 |
| Al2O3 + h3O = Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| As2O3 + HNO3 + h3O = h4AsO4 + NO2 | As2O3 + 4HNO3 + h3O = 2h4AsO4 + 4NO2 |
| As2O3 + NaClO + h3O = NaCl + h4AsO4 | As2O3 + 2NaClO + 3h3O = 2NaCl + 2h4AsO4 |
| Al2O3 = Al + O2 | 2Al2O3 = 4Al + 3O2 |
| Al2O3 + CO2 = Al + CO2 | 0Al2O3 + CO2 = 0Al + CO2 |
| Al (NO3)3 + h3SO4 = HNO3 + Al2(SO4)3 | 2Al(NO3)3 + 3h3SO4 = 6HNO3 + Al2(SO4)3 |
| Al2O3+3h3O = 2 Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| Ag2O= Ag + O2 | 2Ag2O = 4Ag + O2 |
| Ag2O= Ag + O | Ag2O = 2Ag + O |
| AlBr3+ K2SO4 =KBr + Al2(SO4)3 | 2AlBr3 + 3K2SO4 = 6KBr + Al2(SO4)3 |
| AgNO3 + MgCl2 = AgCl + Mg(NO3)2 | 2AgNO3 + MgCl2 = 2AgCl + Mg(NO3)2 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| AgNO3+Cu=Cu(NO3)2+Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Al(OH)3 + HCl = AlCl3 + h3O | Al(OH)3 + 3HCl = AlCl3 + 3h3O |
| Al+S8=Al2S3 | 16Al + 3S8 = 8Al2S3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag + h3S = AgS + H | Ag + h3S = AgS + 2H |
| Al+Nh5ClO4= Al2O3+AlCl3+NO+h3O | 3Al + 3Nh5ClO4 = Al2O3 + AlCl3 + 3NO + 6h3O |
| Al(OH)3 + HCl = AlCl3 + h3O | Al(OH)3 + 3HCl = AlCl3 + 3h3O |
| Al2(SO4)3 + BaCl2 = BaSO4 + AlCl3 | Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al2O3 = Al + O2 | 2Al2O3 = 4Al + 3O2 |
| Au(NO3)4 (aq) + Ag2(SO4)3 (aq) = Au(SO4)2 (s) + Ag(NO3)3 (aq) | 3Au(NO3)4(aq) + 2Ag2(SO4)3(aq) = 3Au(SO4)2(s) + 4Ag(NO3)3(aq) |
| Au(NO3)4 (aq) + Ag2(SO4)3 (aq) = Au(SO4)2 (s) + Ag(NO3)3 (aq) | 3Au(NO3)4(aq) + 2Ag2(SO4)3(aq) = 3Au(SO4)2(s) + 4Ag(NO3)3(aq) |
| Al + Cl2 = AlCl3 | 2Al + 3Cl2 = 2AlCl3 |
| Al + O3 = Al2O3 | 2Al + O3 = Al2O3 |
| Al+h3O=Al2O3+h3 | 2Al + 3h3O = Al2O3 + 3h3 |
| Al+h3O=Al2O+h3 | 2Al + h3O = Al2O + h3 |
| AgNO3 + NaCl = AgCl + NaNO3 | AgNO3 + NaCl = AgCl + NaNO3 |
| Al+h3O=Al(OH)3+h3 | 2Al + 6h3O = 2Al(OH)3 + 3h3 |
| Al+O2=AlO3 | 2Al + 3O2 = 2AlO3 |
| Al2S3 = Al + S | Al2S3 = 2Al + 3S |
| Al2O3+HCl=AlCl3+h3O | Al2O3 + 6HCl = 2AlCl3 + 3h3O |
| Au(OH)3 + h3SO3 = Au2(SO3)3 + h3O | 2Au(OH)3 + 3h3SO3 = Au2(SO3)3 + 6h3O |
| Al+HCl=AlCl3+h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al2O3 + C + Cl2= AlCl3 + CO | Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO |
| AlI3+Na2CrO4=NaI+Al2(CrO4)3 | 2AlI3 + 3Na2CrO4 = 6NaI + Al2(CrO4)3 |
| Al + I2 = Al+++ + I- | 2Al + 3I2 = 2Al+++ + 6I- |
| Al+S+O = AlSO | Al + S + O = AlSO |
| Al+S+O = AlSO | Al + S + O = AlSO |
| Al + KClO3 + h3SO4 = Al2(SO4)3 + KCl + h3O | 2Al + KClO3 + 3h3SO4 = Al2(SO4)3 + KCl + 3h3O |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Ag + Li2O = Ag2O + Li | 2Ag + Li2O = Ag2O + 2Li |
| Al2O3 + h3O = Al(OH)3 | Al2O3 + 3h3O = 2Al(OH)3 |
| Au(s) + h3SeO4 (aq) = Au2(SeO4)3 (aq) + h3SeO3 (aq) + h3O(l) | 2Au(s) + 6h3SeO4(aq) = Au2(SeO4)3(aq) + 3h3SeO3(aq) + 3h3O(l) |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al+h3SO4=Al2(SO4)3+h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| Al2O3+CO = AlC+CO2 | Al2O3 + 7CO = 2AlC + 5CO2 |
| Al3 + Cl2 = AlCl3 | 2Al3 + 9Cl2 = 6AlCl3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al(NO3)3+Na2S=Al2S3+NaNO3 | 2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 |
| Al(NO3)3+Na2S=Al2S3+NaNO3 | 2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 |
| Al+O2=Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO3 = NO + h3O + AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Al(OH)3 + HCl = AlCl3 +h3O | Al(OH)3 + 3HCl = AlCl3 + 3h3O |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h3O | 2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O |
| Al+HCl=AlCl3+H | Al + 3HCl = AlCl3 + 3H |
| Al+CuO=Al2O3+Cu | 2Al + 3CuO = Al2O3 + 3Cu |
| Ag2O=Ag+O2 | 2Ag2O = 4Ag + O2 |
| AlBr3 + Cu = Al + CuBr | AlBr3 + 3Cu = Al + 3CuBr |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| AlBr3 + Cu = Al + CuBr | AlBr3 + 3Cu = Al + 3CuBr |
| AlBr3 + F2 = AlF3 + Br2 | 2AlBr3 + 3F2 = 2AlF3 + 3Br2 |
| AlF3 + Li2S = Al2S3 + LiF | 2AlF3 + 3Li2S = Al2S3 + 6LiF |
| AgNO3 + NaBr = AgBr + NaNO3 | AgNO3 + NaBr = AgBr + NaNO3 |
| Al2S3 + 6h3O = 2Al(OH)3 + 2h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + 6h3O = 2Al(OH)3 + 2h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + 6h3O = 2Al(OH)3 + 2h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + 6h3O = 2Al(OH)3 + 2h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + 6h3O = 2Al(OH)3 + 2h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + h3O = 2Al(OH)3 + h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + h3O = 2Al(OH)3 + h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2S3 + h3O = Al(OH)3 + h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| As2S5 + HNO3 = h4AsO4 + h3SO4 + NO2 + h3O | As2S5 + 40HNO3 = 2h4AsO4 + 5h3SO4 + 40NO2 + 12h3O |
| AgNO3+Cu=Cu(NO3)2+Ag | 2AgNO3 + Cu = Cu(NO3)2 + 2Ag |
| Ag+HNO3 = NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| Au + h3SeO4 = Au2(SeO4)3 + h3SeO3 + h30 | 20Au + 30h3SeO4 = 10Au2(SeO4)3 + 0h3SeO3 + 3h30 |
| AgOH = Ag2O + h3O | 2AgOH = Ag2O + h3O |
| AgOH = Ag2O + h3O | 2AgOH = Ag2O + h3O |
| Al+NaSO4= Al(SO4)3 +Na | Al + 3NaSO4 = Al(SO4)3 + 3Na |
| Al2O3 + HCl = AlCl3 + h3O | Al2O3 + 6HCl = 2AlCl3 + 3h3O |
| Ag2S=Ag + S8 | 8Ag2S = 16Ag + S8 |
| Ag+HNO3=NO+h3O+AgNO3 | 3Ag + 4HNO3 = NO + 2h3O + 3AgNO3 |
| A1+HC1=A1C13+h3 | 2A1 + 26HC1 = 2A1C13 + 13h3 |
| Ag2SO4+NaCl=Na2SO4+AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| Al + HBr = AlBr3 + h3 | 2Al + 6HBr = 2AlBr3 + 3h3 |
| Al2S3 + h3O = Al(OH)3 + h3S | Al2S3 + 6h3O = 2Al(OH)3 + 3h3S |
| Al2(SO4)3(aq) + KOH(aq) = Al(OH)3(aq) + K2SO4(aq) | Al2(SO4)3(aq) + 6KOH(aq) = 2Al(OH)3(aq) + 3K2SO4(aq) |
| Al2O3 + CO = Al + CO2 | Al2O3 + 3CO = 2Al + 3CO2 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Al + h3SO4 = Al2(SO4)3 + h3 | 2Al + 3h3SO4 = Al2(SO4)3 + 3h3 |
| AgNO3+Na2S=Ag2S+NaNO3 | 2AgNO3 + Na2S = Ag2S + 2NaNO3 |
| Al + HCl = AlCl3 + h3 | 2Al + 6HCl = 2AlCl3 + 3h3 |
| Ag + HNO = NO + h3O + AgNO3 | Ag — 4HNO = -5NO — 2h3O + AgNO3 |
| Ag2SO4 + NaCl = Na2SO4 + AgCl | Ag2SO4 + 2NaCl = Na2SO4 + 2AgCl |
| AgNO3 + LiOH = AgOH + LiNO3 | AgNO3 + LiOH = AgOH + LiNO3 |
| Ag + O2 = Ag2 O | 4Ag + O2 = 2Ag2O |
| Al(OH)3 + HCl = AlCl3 + h3O | Al(OH)3 + 3HCl = AlCl3 + 3h3O |
| Al(OH)3 + h3(SO4) = Al2(SO4)3 + H(OH) | 2Al(OH)3 + 3h3(SO4) = Al2(SO4)3 + 6H(OH) |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al + O2 = Al2O3 | 4Al + 3O2 = 2Al2O3 |
| Al(OH)3 + HCl = AlCl3 + h3O | Al(OH)3 + 3HCl = AlCl3 + 3h3O |

 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типа Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2. После реакции степень окисления Cr изменяется на +3 в +3 Cr -1×3 Cl 3 .
После реакции степень окисления Cr изменяется на +3 в +3 Cr -1×3 Cl 3 .
 Таким образом, поместите эту цифру в уравнение, такое как
Таким образом, поместите эту цифру в уравнение, такое как Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть). Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.
 Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как
 уравнения.
уравнения.

 Если вы не разрешите использование этих файлов cookie, некоторые или все функции и службы сайта могут работать неправильно.
Если вы не разрешите использование этих файлов cookie, некоторые или все функции и службы сайта могут работать неправильно.
 Поскольку они подвергаются химическому процессу, они коренным образом изменяются.
Поскольку они подвергаются химическому процессу, они коренным образом изменяются.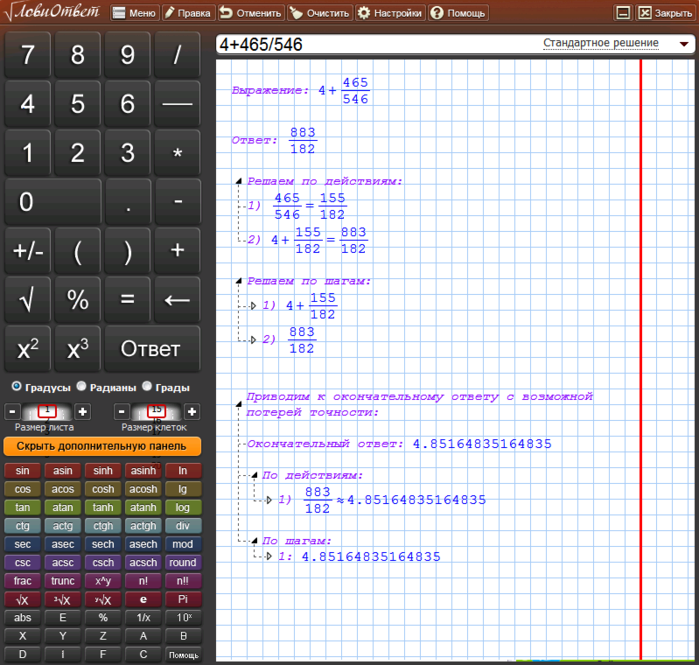
 Итак, 40
грамм кальция составляет один моль, 80 граммов — два моля и т. д.
Итак, 40
грамм кальция составляет один моль, 80 граммов — два моля и т. д. К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина.
К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина.
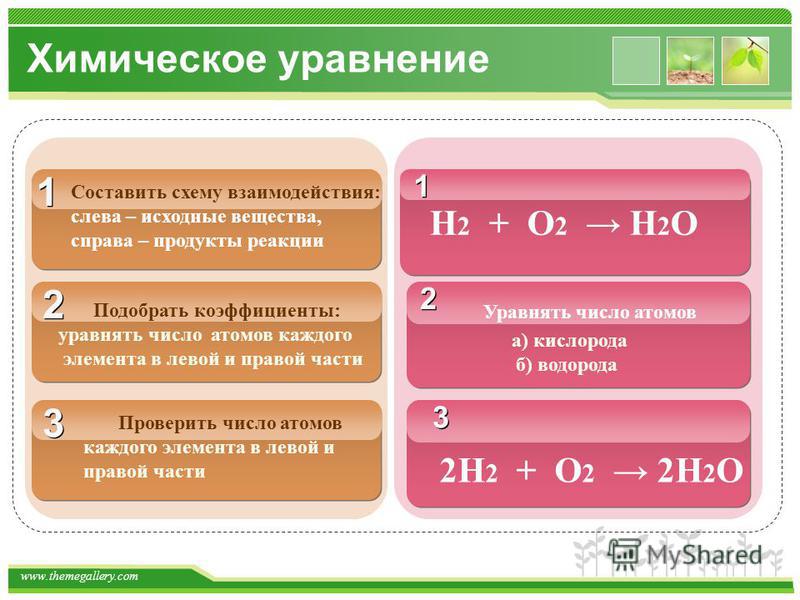 Теперь у нас есть: Al +3 Fe 3 O 4 —> 4Al 2 O 3 + 9Fe
Теперь у нас есть: Al +3 Fe 3 O 4 —> 4Al 2 O 3 + 9Fe
 0 г О 2
0 г О 2  Например, проще всего предположить, что у вас 100 г, поэтому 54.3% станут 54,3 г. Затем мы можем преобразовать массы в моли; это дает нам молярные отношения. Необходимо привести к целым числам. Хороший метод — разделить все члены на наименьшее число молей. Затем соотношение молей можно перевести в эмпирическую формулу.
Например, проще всего предположить, что у вас 100 г, поэтому 54.3% станут 54,3 г. Затем мы можем преобразовать массы в моли; это дает нам молярные отношения. Необходимо привести к целым числам. Хороший метод — разделить все члены на наименьшее число молей. Затем соотношение молей можно перевести в эмпирическую формулу. 310
310  3 грамма O
3 грамма O 

 Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода).
Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода). Единственная необходимая информация — это плотность.
Единственная необходимая информация — это плотность.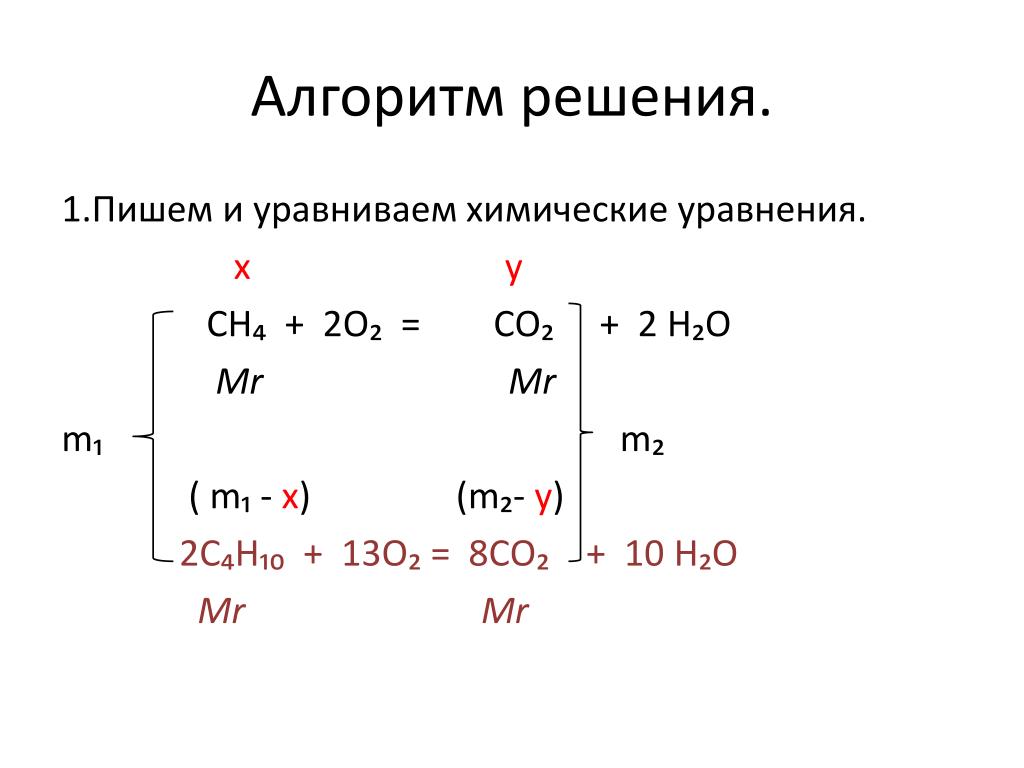 2°С, какова моляльность раствора? (K f для воды составляет 1,86 °C/м.)
2°С, какова моляльность раствора? (K f для воды составляет 1,86 °C/м.)  )
Проверьте свою работу
)
Проверьте свою работу