%d1%81%d1%82%d1%80%d0%be%d0%b5%d0%bd%d0%b8%d0%b5 %d0%b0%d1%82%d0%be%d0%bc%d0%b0 PNG рисунок, картинки и пнг прозрачный для бесплатной загрузки
Мемфис дизайн геометрические фигуры узоры мода 80 90 х годов
4167*4167
поп арт 80 х патч стикер
3508*2480
green environmental protection pattern garbage can be recycled green clean
2000*2000
80 основных форм силуэта
5000*5000
Мемфис шаблон 80 х 90 х годов стилей фона векторные иллюстрации
4167*4167
схема бд электронный компонент технологии принципиальная схема технологическая линия
2000*2000
поп арт 80 х патч стикер
2292*2293
поп арт 80 х патч стикер
2292*2293
80 е брызги краски дизайн текста
1200*1200
скейтборд в неоновых цветах 80 х
1200*1200
be careful to slip fall warning sign carefully
2500*2775
поп арт 80 х патч стикер
3508*2480
Мемфис шаблон 80 х 90 х годов на белом фоне векторная иллюстрация
4167*4167
поп арт 80 х патч стикер
3508*2480
blue series frame color can be changed text box streamer
1024*1369
поп арт 80 х патч стикер
3508*2480
поп арт 80 х патч стикер
3508*2480
поп арт 80 х патч стикер
3508*2480
поп арт 80 х патч стикер
3508*2480
поп арт 80 х патч стикер
3508*2480
Элементы рок н ролла 80 х
1200*1200
поп арт 80 х патч стикер
2292*2293
мемфис образца 80 s 90 стилей на белом фоневектор иллюстрация
4167*4167
в первоначальном письме векторный дизайн логотипа шаблон
1200*1200
pop be surprised female character
2000*2000
Диско вечеринка в стиле ретро 80 х art word design
1200*1200
плавный руки нарисованная мемфис модный хипстер 80 х 90 х годов творческих детей рисовать
5000*5000
Ретро мода неоновый эффект 80 х тема художественное слово
1200*1200
80 летие векторный дизайн шаблона иллюстрация
4167*4167
80 летний юбилей дизайн шаблона векторные иллюстрации
4083*4083
диско дизайн в стиле ретро 80 х неон
5556*5556
номер 80 золотой шрифт
1200*1200
black key that can be hung on the body car key key
2000*2000
black and white train icon daquan free download can be used separately can be used as decoration free of charge
2000*2000
prohibited use mobile phone illustration can not be used
2048*2048
Модель буквы м в стиле 80 х
1200*1200
в первоначальном письме bd логотипа
1200*1200
logo design can be used for beauty cosmetics logo fashion
1024*1369
Ностальгическая ретро лента 80 х клипарт
1200*1200
be careful of electric shock icons warning icons cartoon illustrations warnings
2500*2000
дизайн логотипа bc значок буквы b
8333*8333
80 летия золотой шар векторный дизайн шаблона иллюстрация
4083*4083
поп арт 80 х патч стикер
3508*2480
Мода стерео ретро эффект 80 х годов тема искусства слово
1200*1200
в эти выходные только мега продажи баннер скидки до 80 с
10418*10418
скачать букву т серебро 80 х
1200*1200
Флаер музыкального мероприятия 80 х годов
1200*1200
Ретро мода 80 х градиент цвета художественного слова
1200*1200
Неоновый эффект 80 х годов Ретро вечеринка арт дизайн
1200*1200
Ретро стиль 80 х годов вечеринка арт дизайн
1200*1200
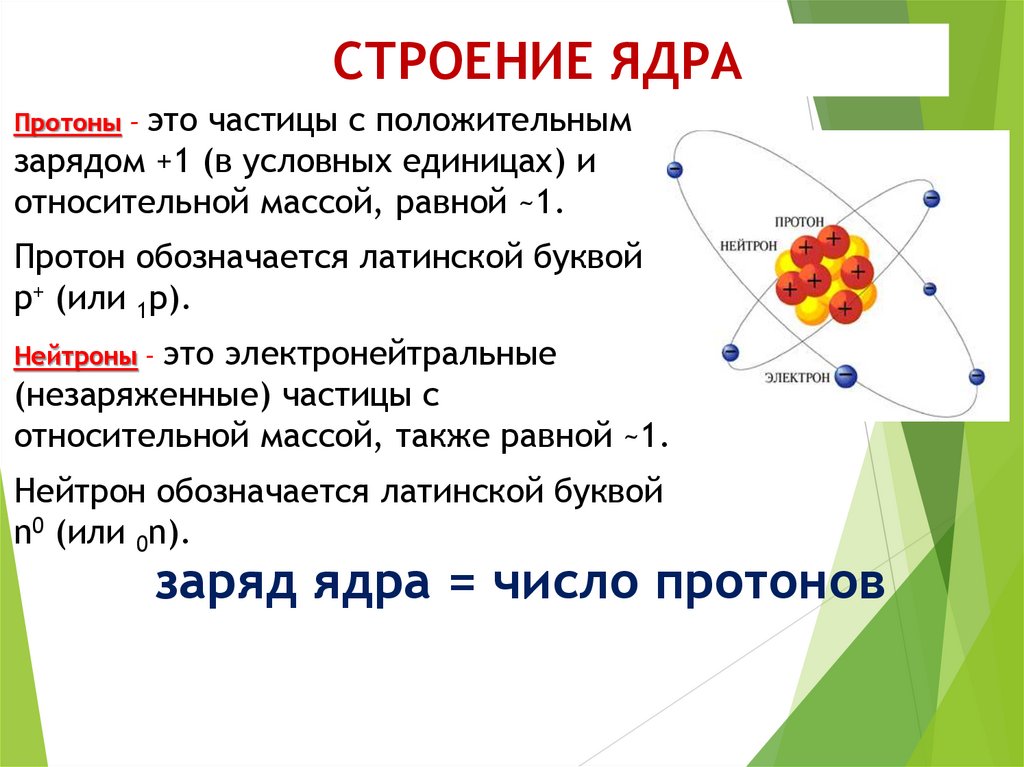
Можно ли сфотографировать строение атома?
Чтобы понять, можно ли сфотографировать структуру атома, нужно выяснить, что этот самый атом из себя представляет.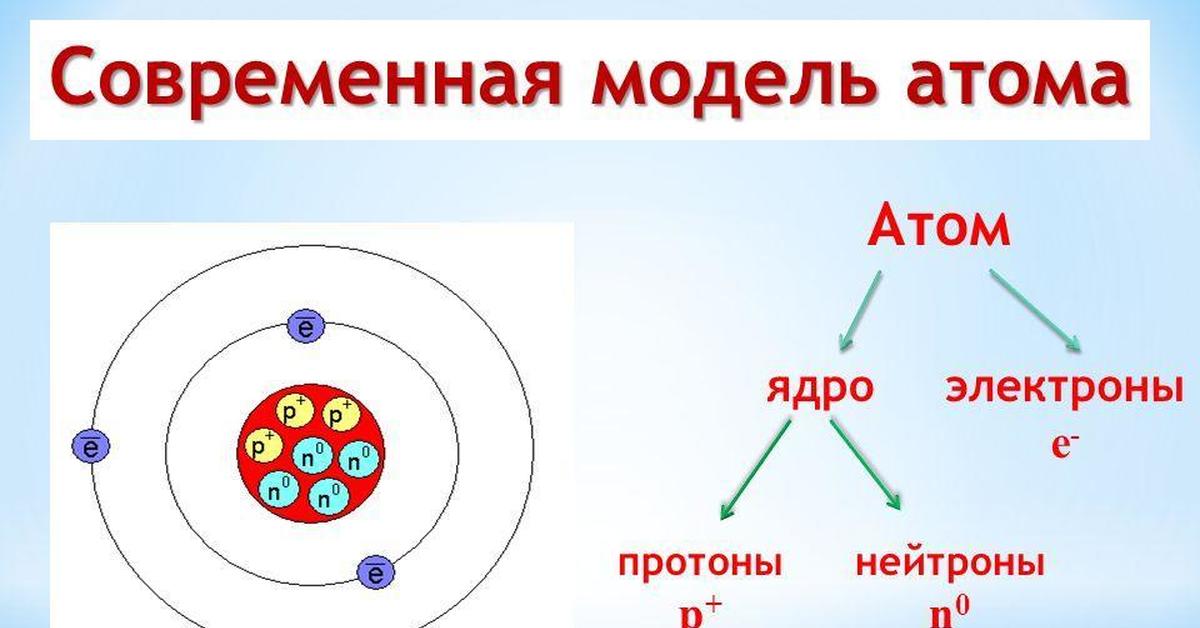 Каждый хотя бы раз видел картинку, которой обычно изображают строение атома.
Каждый хотя бы раз видел картинку, которой обычно изображают строение атома.
В его центре находится ядро (так называемый нуклон – протоны и нейтроны, соединенные сильным взаимодействием между собой), а вокруг ядра по орбиталям крутятся электроны. Но такая схема часто вводит в заблуждение: орбитали показаны на ней как тонкие линии, а электроны выступают в качестве частиц. Все это напоминает движение космических тел по орбитам. Но на самом деле, эта схема передает лишь общие черты строения атома.
Давайте представим, что мы смогли сфотографировать атом водорода, у которого есть только один электрон, в определенный момент времени.
Желтая точка – это ядро, а синяя – электрон. Запомним его местоположение и сфотографируем атом в другой момент времени.
Электрон поменял свое местоположение, что логично. А что будет, если сделать несколько десятков таким снимков и наложить их друг на друга? Давайте посмотрим.
Ничего себе! Получается, электрон может находиться практически в любой точке атома? Верно, но если присмотреться, можно обнаружить, что вероятность его обнаружения в определенной окружности (выделена серым цветом) выше, чем в других местах. Именно эта область и называется «орбиталь», а вся область, в которой может находиться электрон, будет называться «электронным облаком».
Именно эта область и называется «орбиталь», а вся область, в которой может находиться электрон, будет называться «электронным облаком».
Вы сказали вероятность? Почему нельзя точно вычислить местоположение электрона в атоме? Здесь следует вспомнить, что электрон – это элементарная частица, и в определенной ситуации может вести себя как частица, а в другой ситуации – как волна. То есть его местоположение в атоме задается распределением вероятности.
Когда атом не подвергается воздействию, электрон ведет себя как волна, но достаточно лишь посмотреть на него, как он становится частицей и предстает перед нами в точке, в которой совсем не должен находиться. То есть, при любой попытке сфотографировать строение атома, вся система рушится, и мы не можем увидеть электрон в его действительном состоянии.
Получается, сфотографировать реальное состояние атома невозможно? Решение задачи существует и оно похоже на то, что мы делали выше на схеме. То есть фиксировали положение электрона вокруг ядра в различные моменты времени, а затем накладывали фотографии друг на друга.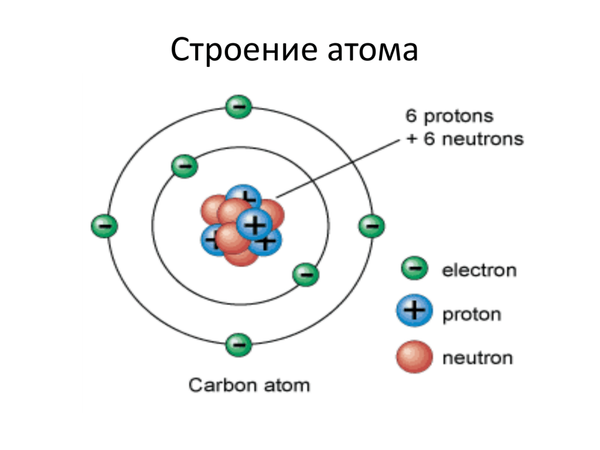 Получается, электрон как бы находится везде в электронном облаке, но в то же время его нет ни в какой определенной точке.
Получается, электрон как бы находится везде в электронном облаке, но в то же время его нет ни в какой определенной точке.
Конечно же, не существует такого фотоаппарата, который мог бы сфотографировать структуру атома в определенный момент времени, поэтому ученым и центра исследований элементарных частиц, пришлось действовать другими методами.
Чтобы упростить эксперимент, был выбран атом водорода, так как он содержит только один электрон. Далее атом поместили в герметичную камеру между двух лазеров, которые, ионизируя атом, заставляли электрон срываться с орбитали. Электромагнитное поле внутри камеры направляло электрон в сторону пластины-детектора, где он отмечался в виде точки. При этом его положение на пластине совпадает с тем положением, которое он занимал в атоме в момент обстрела. Повторив эксперимент около двух тысяч раз, физики получили картину, которую можно считать изображением структуры атома водорода. Чем краснее точка, тем больше вероятность нахождения в ней электрона.
Иллюстрация: depositphotos | ezumeimages
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
comments powered by HyperCommentsНаука: Наука и техника: Lenta.ru
Группа ученых из Германии, Греции, Нидерландов, США и Франции получила снимки атома водорода. На этих изображениях, полученных при помощи фотоионизационного микроскопа, видно распределение электронной плотности, которое полностью совпадает с результатами теоретических расчетов. Работа международной группы представлена на страницах Physical Review Letters.
Суть фотоионизационного метода заключается в последовательной ионизации атомов водорода, то есть в отрывании от них электрона за счет электромагнитного облучения. Отделившиеся электроны направляются на чувствительную матрицу через положительно заряженное кольцо, причем положение электрона в момент столкновения с матрицей отражает положение электрона в момент ионизации атома. Заряженное кольцо, отклоняющее электроны в сторону, играет роль линзы и с его помощью изображение увеличивается в миллионы раз.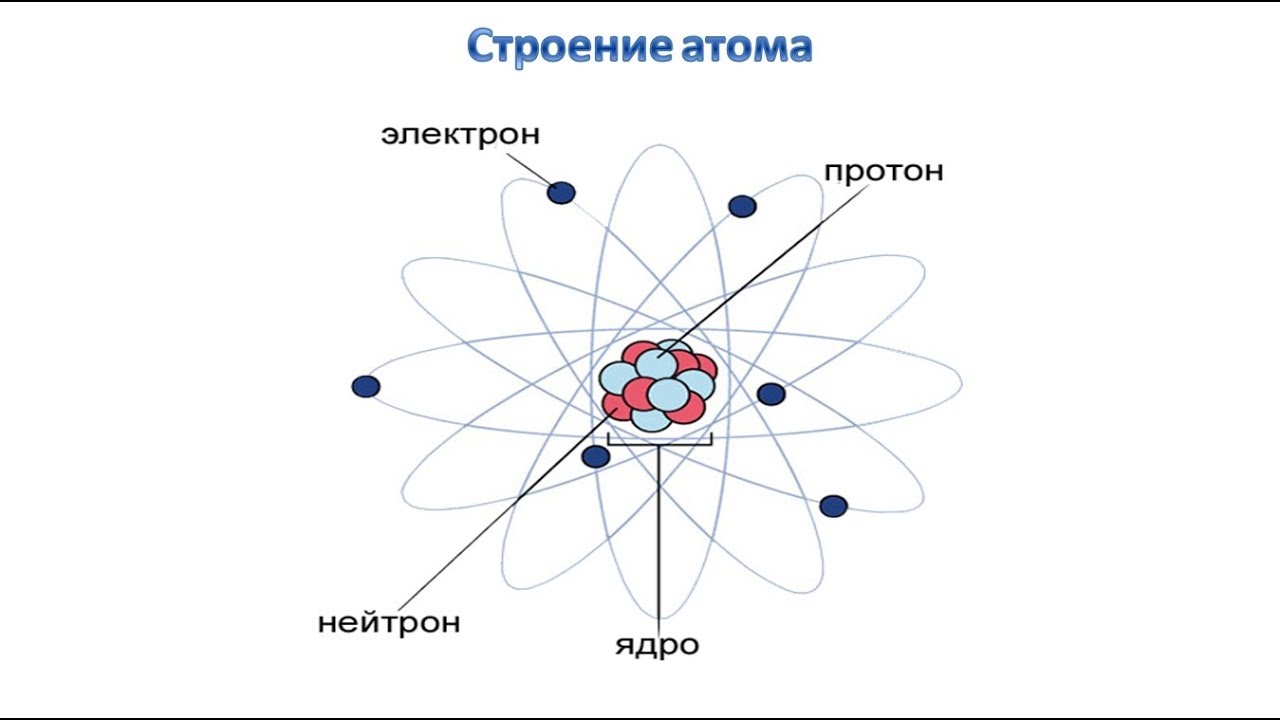
Этот метод, описанный в 2004 году, уже применялся для получения «фотографий» отдельных молекул, однако физики пошли дальше и использовали фотоионизационный микроскоп для исследования атомов водорода. Так как попадание одного электрона дает всего одну точку, исследователи накопили около 20 тысяч отдельных электронов от разных атомов и составили усредненное изображение электронных оболочек.
В соответствии с законами квантовой механики, электрон в атоме не имеет какого-то определенного положения сам по себе. Лишь при взаимодействии атома с внешней средой электрон с той или иной вероятностью проявляется в некоторой окрестности ядра атома: область, в которой вероятность обнаружения электрона максимальна, называется электронной оболочкой. На новых изображениях видны различия между атомами разных энергетических состояний; ученые смогли наглядно продемонстрировать форму предсказанных квантовой механикой электронных оболочек.
При помощи других приборов, сканирующих туннельных микроскопов, отдельные атомы можно не только увидеть, но и переместить в нужное место. Эта техника около месяца назад позволила инженерам компании IBM нарисовать мультфильм, каждый кадр которого сложен из атомов: подобные художественные эксперименты не имеют какого-то практического эффекта, но демонстрируют принципиальную возможность манипуляций с атомами. В прикладных целях используется уже не поатомная сборка, а химические процессы с самоорганизацией наноструктур или самоограничением роста одноатомных слоев на подложке.
Эта техника около месяца назад позволила инженерам компании IBM нарисовать мультфильм, каждый кадр которого сложен из атомов: подобные художественные эксперименты не имеют какого-то практического эффекта, но демонстрируют принципиальную возможность манипуляций с атомами. В прикладных целях используется уже не поатомная сборка, а химические процессы с самоорганизацией наноструктур или самоограничением роста одноатомных слоев на подложке.
Из чего состоит атом? Инфографика | Инфографика
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. За основу он взял планетарную модель атома, разработанную физиком Резерфордом. В ней атом уподоблялся объектам макромира — планетарной системе, где планеты двигаются по орбитам вокруг большой звезды. Аналогично в планетарной модели атома электроны движутся по орбитам вокруг расположенного в центре тяжёлого ядра.Бор ввёл в теорию атома идею квантования. Согласно ей, электроны могут двигаться только по фиксированным орбитам, соответствующим определённым энергетическим уровням. Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Что находится внутри атома?
Атомы состоят из электронов, протонов и нейтронов. Нейтроны были открыты после того, как физиками была разработана планетарная модель атома. Лишь в 1932 году, проводя серию опытов, Джеймс Чедвик обнаружил частицы, не имеющие никакого заряда. Отсутствие заряда подтверждалось тем, что эти частицы никак не реагировали на электромагнитное поле.
Само ядро атома образуют тяжёлые частицы — протоны и нейтроны: каждая из этих частиц почти в две тысячи раз тяжелее электрона. Протоны и нейтроны также имеют схожие размеры, но протоны обладают положительным зарядом, а нейтроны не имеют заряда вообще.
В свою очередь, протоны и нейтроны состоят из элементарных частиц, называемых кварками. В современной физике кварки являются самой маленькой, основной частицей материи.
Размеры самого атома во много раз превышают размеры ядра. Если увеличить атом до размеров футбольного поля, то размеры его ядра могут быть сопоставимы с теннисным мячиком в центре такого поля.
В природе существует множество атомов, различающихся размерами, массой и другими характеристиками. Совокупность атомов одного вида называется химическим элементом. На сегодняшний день известно более ста химических элементов. Их атомы различаются размерами, массой, а также строением.
Электроны внутри атома
Отрицательно заряженные электроны двигаются вокруг ядра атома, образуя своего рода облако. Массивное ядро притягивает электроны, но энергия самих электронов позволяет им «убегать» дальше от ядра. Таким образом, чем больше энергия электрона, тем дальше от ядра он находится.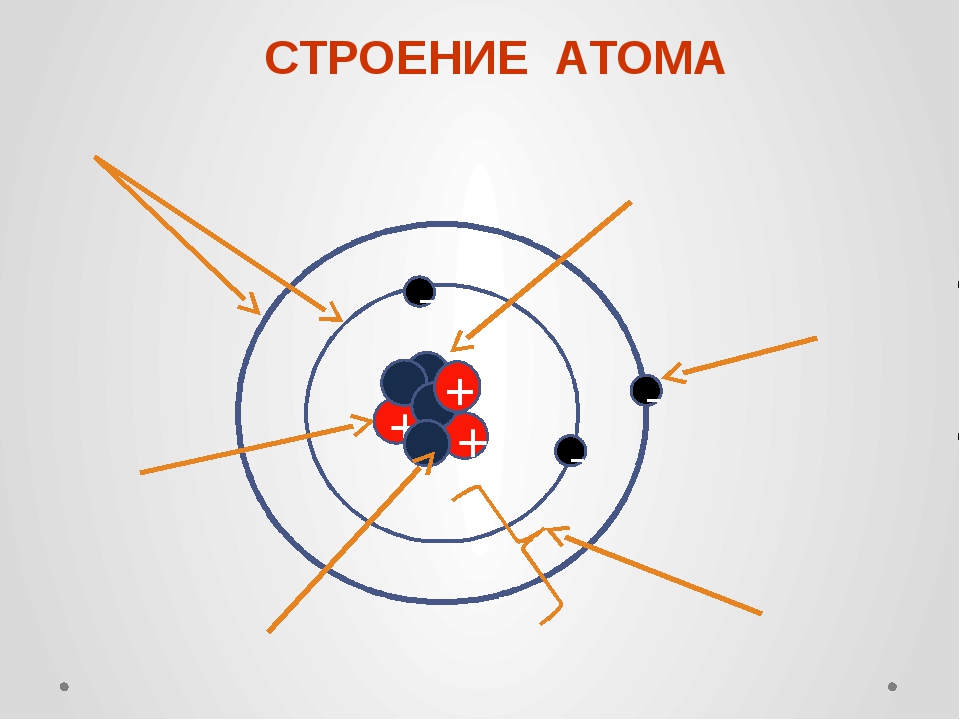
Значение энергии электронов не может быть произвольным, оно соответствует чётко определенному набору энергетических уровней в атоме. То есть энергия электрона изменяется скачкообразно от одного уровня к другому. Соответственно, и двигаться электрон может только в рамках ограниченной электронной оболочки, соответствующей тому или иному энергетическому уровню — в этом смысл постулатов Бора.
Получив больше энергии, электрон «перескакивает» в более высокий от ядра слой, потеряв энергию — наоборот, в более низкий слой. Таким образом, облако электронов вокруг ядра упорядочено в виде нескольких «нарезанных» слоев.
История представлений об атоме
Само слово «атом» происходит от греческого «неделимый» и восходит к идеям древнегреческих философов о наименьшей неделимой части материи. В средние века химики убедились в том, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы. Такие наименьшие частицы вещества и получили название атомов.
В конце XIX — начале XX века физиками были открыты субатомные частицы и стало ясно, что атом в действительности не является неделимым. Сразу же были выдвинуты теории о внутреннем строении атома, одной из первых среди которых стала модель Томсона или модель «пудинга с изюмом». Согласно этой модели, маленькие электроны находились внутри массивного положительно заряженного тела — как изюм внутри пудинга. Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Развитие планетарной модели Бором наряду с открытием в 1932 году нейтронов сформировало основу для современной теории о строении атома. Следующие этапы в развитии знаний об атоме уже связаны с физикой элементарных частиц: кварков, лептонов, нейтринов, фотонов, бозонов и других.
Смотрите также:
«Вещество на 99% состоит из пустоты» / Хабр
 99…% состоит из пустоты, с разными версиями количества девяток. Как мы сейчас увидим, это утверждение имеет весьма шаткие основания, а попытки оценить долю пустоты в веществе могут с одинаковым успехом дать любое число от 0 до 100%. Последовательное же рассмотрение вопроса в рамках квантовой механики показывает, что от пустоты вещество отличается довольно сильно.
99…% состоит из пустоты, с разными версиями количества девяток. Как мы сейчас увидим, это утверждение имеет весьма шаткие основания, а попытки оценить долю пустоты в веществе могут с одинаковым успехом дать любое число от 0 до 100%. Последовательное же рассмотрение вопроса в рамках квантовой механики показывает, что от пустоты вещество отличается довольно сильно.Традиционная линия рассуждений
(*)выглядит так: в атоме, имеющем размер около одного ангстрема (10
–10метра), электроны вращаются вокруг ядра, размер которого в 100 000 раз меньше (около 10
–15метра). Размер самого электрона равен нулю, это точечная частица
(**), поэтому атом оказывается практически пустым: в нем «непустое» лишь ядро. Чтобы получить долю объема атома, занимаемого ядром, нужно возвести в куб отношение их размеров. Получаем, что ядро занимает 10
–15 объема атома, остальную долю объема — это 99.99…% с 13 девятками после запятой — занимает пустота.
Если атом растянуть до размеров футбольного поля, то ядро будет величиной с маковое зернышко.
Что не так в этих рассуждениях? Давайте продолжим ту же логику, рассматривая уже не атом, а его ядро. Мы считали атомное ядро непустым, но ведь оно состоит из протонов и нейтронов, которые, в свою очередь, состоят из фундаментальных частиц — кварков и глюонов(***). По современным представлениям, кварки и глюоны тоже являются точечными частицами, как и электрон. Следуя такой же линии рассуждений, как и в случае атома, получим, что ядро — тоже пустота, в которой летают частицы нулевых размеров. Итог: вещество ровно на 100% состоит из пустоты. Эта линия рассуждений завела нас в никуда.
Квантовая механика говорит нам, что электрон в атоме является не маленьким шариком, летающим по орбите вокруг ядра, а размазан по пространству в виде вероятностного облака, называемого орбиталью. Плотность этого облака, или просто электронная плотность
, зависит от координаты
. Эта зависимость своя для каждой орбитали, тем не менее, есть общая закономерность:
Эта зависимость своя для каждой орбитали, тем не менее, есть общая закономерность:
заметно отлична от нуля в области пространства размерами порядка ангстрема, а на больших расстояниях от ядра экспоненциально убывает.
Типичное поведение электронной плотности в атоме для разных электронных орбиталей. Источник.
Отсюда берется характерный размер атома в один ангстрем, использованный выше при сравнении размеров атома и ядра. Какой же количественный ответ на вопрос о доле пустоты в веществе может дать нам квантовая механика? Для этого нужно оценить суммарный объем, занимаемый электронными орбиталями всех атомов. А для этого, в свою очередь, следует провести четкую границу между атомом и окружающей его пустотой. Но как это сделать? Формально электронная плотность , хоть и стремится к нулю при удалении от ядра, никогда в ноль не обращается, поэтому каждая атомная орбиталь заполняет если не всю Вселенную, то, как минимум, весь объем рассматриваемого куска вещества. В этом случае получается, что пустоты в веществе нет — в любой точке есть отличная от нуля вероятность найти электрон.
Можно определить границу атома как место, где электронная плотность достигает 1/2 от максимальной. Или 1/15 — такая граница будет отстоять дальше от ядра. Или как поверхность, внутри которой содержится 1/2 всей суммарной электронной плотности. Можно ухватить и больше объема, проведя поверхность, внутрь которой попадает, например, 9/10 всей плотности.
Плотность электронного облака для орбитали в атоме водорода (показана белым цветом) и разные варианты проведения условной границы атома.
Как видим, по-разному проводя условные границы атомов, можно получать разные величины занимаемого ими объема. Поэтому и для доли пустоты в веществе можно получить любой ответ от 0 до 100%. Например, в этом видео доля пустоты оценивается как 90%. Почему именно 90, а не 80 или 95? Видимо, автор взял какой-то «стандартный» размер атома в районе одного ангстрема.
Хотя для точного определения границ атома поверхности равной электронной плотности и не годятся, они удобны, когда нужно наглядно изобразить структуру вещества на микроуровне. По форме этих поверхностей можно судить о структуре молекулярных орбиталей и химических связей.
По форме этих поверхностей можно судить о структуре молекулярных орбиталей и химических связей.
Пример поверхности (она зеленая и полупрозрачная), на которой электронная плотность в кристалле принимает постоянное значение. Источник.
А так выглядят поверхности постоянной плотности в некоторых белках. Источник.
Даже если вещество от пустоты нельзя четко отделить, можно ли хотя бы ответить на вопрос, чем вообще, с точки зрения квантовой теории, вещество отличается от пустого пространства? Для ответа обратимся к квантовой теории поля, изучающей системы многих частиц и вакуум. В этой теории любое состояние системы (точнее, квантованного поля), в которой может находиться 0, 1, 2 и т.д. частиц, характеризуется вектором, длина которого равна единице.
ПодробнееКаждый вектор
можно задать его проекциями
на координатные оси, число которых равно размерности пространства
:
. Квантовые системы описываются векторами в бесконечномерном пространстве, то есть такими векторами, число проекций которого бесконечно:
. Сами же проекции
Сами же проекции
в квантовой механике являются комплексными числами, это обстоятельство важно при описании явлений интерференции.
Если в системе нет ни одной частицы (пустота), ее состояние называют вакуумом, и соответствующий вектор принято обозначать как
. Атом с одним электроном на любой орбитали — это состояние системы с одной частицей, вектор которого можно обозначить как
. Насколько отличаются эти два состояния друг от друга? Существуют разные способы описания «расстояния» между векторами, наиболее простой и часто используемый
(****)— посчитать длину разности векторов
. Можно показать, что векторы
и
взаимно перпендикулярны, это обычная ситуация для существенно отличающихся друг от друга квантовых состояний. Выходит, что, с точки зрения квантовой теории поля, «расстояние» между пустотой и электроном, находящимся на атомной орбитали, равно
.
Два взаимно перпендикулярных вектора состояния — вакуум и один электрон на атомной орбитали, — и расстояние между ними.
Получаемый ответ — что вещество всегда радикально отличается от пустоты, даже если содержит одну частицу на кубический километр, — не очень удовлетворителен, потому что из него начисто выпадает распределение вещества в пространстве. Можно ли ввести меру отличия вещества от пустоты, показывающую, насколько сильно они отличаются не в целом, а локально, в каждой точке ? Да, такую меру найти можно, и ей является не что иное как электронная плотность . Там, где электронная плотность спадает до предельно малых значений, отличие вещества от пустоты также становится несущественным.
Пара формулЭто можно понять, если учесть, что квадрат расстояния
представляется в виде:
где
— волновая функция многоэлектронной системы,
— число электронов. Как видим, квадрат расстояния складывается из двух частей: одна из них равна единице, другая набегает за счет интеграла от электронной плотности по пространству.
Линии равных электронных плотностей в кристалле Na2GeS3.
 Чем дальше от атомных ядер, тем ниже плотность, и тем ближе пустота. Источник.
Чем дальше от атомных ядер, тем ниже плотность, и тем ближе пустота. Источник.Итак, мы видим, что:
- Если рассуждать в духе «в атоме непустым является лишь ядро», то придется признать, что вещество — ровно на 100% пустота, потому что ядро — это такой же пустой «атом», только состоящий из других частиц.
- В квантовой механике электронные оболочки атомов размазаны в пространстве, и невозможно точно сказать, где кончается атом и начинается окружающее его пустое пространство. Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%.
- С точки зрения квантовой теории поля, вещество даже с одним электроном существенно отличается от вакуума — эти два квантовых состояния представляются взаимно перпендикулярными векторами, расстояние между которыми равно .
- Однако можно, в каком-то смысле, ввести меру отличия вещества от вакуума не в целом, а локально, в каждой точке пространства.
 Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.
Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.
(*)Вот примеры такого рода рассуждений, в которых, впрочем, соотношение размеров атома и ядра иногда преувеличивают в миллионы раз:
• www.popmech.ru/science/10566-zhizn-v-pustote-kvantovoe-osoznanie
• www.yaplakal.com/forum7/topic1503279.html
• pikabu.ru/story/tyi_nichto_561687
• thequestion.ru/questions/10102/atom-sostoit-iz-pustoty-vsyo-materialnoe-sostoit-iz-atomov-kak-materialnoe-mozhet-sostoyat-iz-pustoty
(**)По крайней мере, эксперименты на Большом электрон-позитронном коллайдере показали, что размер электрона не превышает 10–19 м. Более поздние сверхточные измерения магнитного момента электрона дали верхнюю оценку размера электрона, равную 10–20 м. Эти оценки показывают, что электрон, как минимум, в десятки тысяч раз меньше ядра.
Более поздние сверхточные измерения магнитного момента электрона дали верхнюю оценку размера электрона, равную 10–20 м. Эти оценки показывают, что электрон, как минимум, в десятки тысяч раз меньше ядра.
(***)Интересный факт: три кварка, из которых состоит протон, дают лишь менее 2% его массы. Остальная часть массы — это виртуальные частицы (кварки и глюоны), возникающие в результате взаимодействия трех исходных кварков. Этих частиц так много, что они образуют целое «море», и поэтому называются «морскими» кварками и глюонами.
(****)В случае двух чистых квантовых состояний и такие меры расстояния между ними, как метрика Гильберта-Шмидта и метрика Фубини-Штуди, сводятся именно к длине вектора .
строительные блоки молекул / Хабр
Если молекулы –
основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H
Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H
O содержит два атома водорода и один кислорода. Молекула столового сахара C
12H
22O
11содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
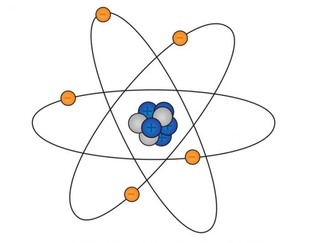
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Ядро – это скопление протонов (красные) и нейтронов (белые).
Рис. 1
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.
Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.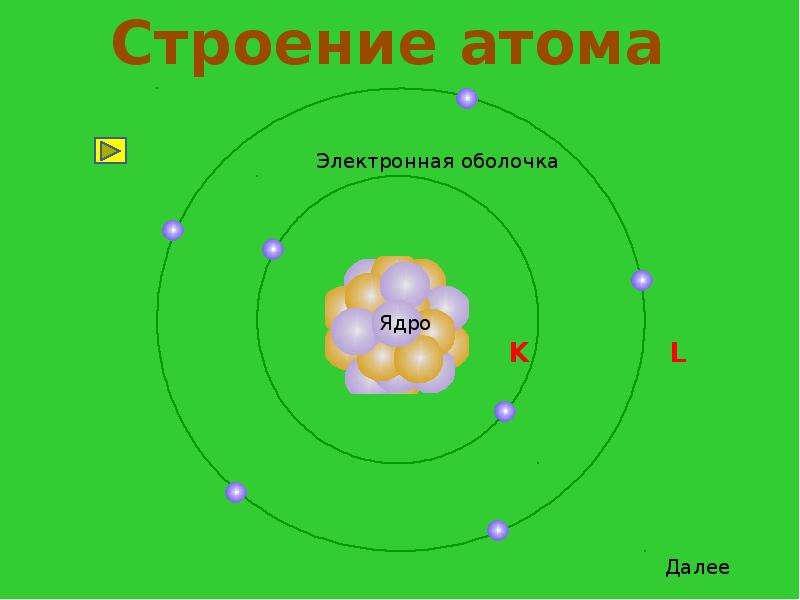
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Тема 7 Электронное строение сложных атомов
%PDF-1.5
%
1 0 obj
>
/Metadata 2 0 R
/Outlines 3 0 R
/PageLayout /OneColumn
/Pages 4 0 R
/StructTreeRoot 5 0 R
/Type /Catalog
>>
endobj
6 0 obj /Comments ()
/Company ()
/CreationDate (D:20151006103331+03’00’)
/Creator
/Keywords ()
/ModDate (D:20151006103338+03’00’)
/Producer (Adobe PDF Library 10.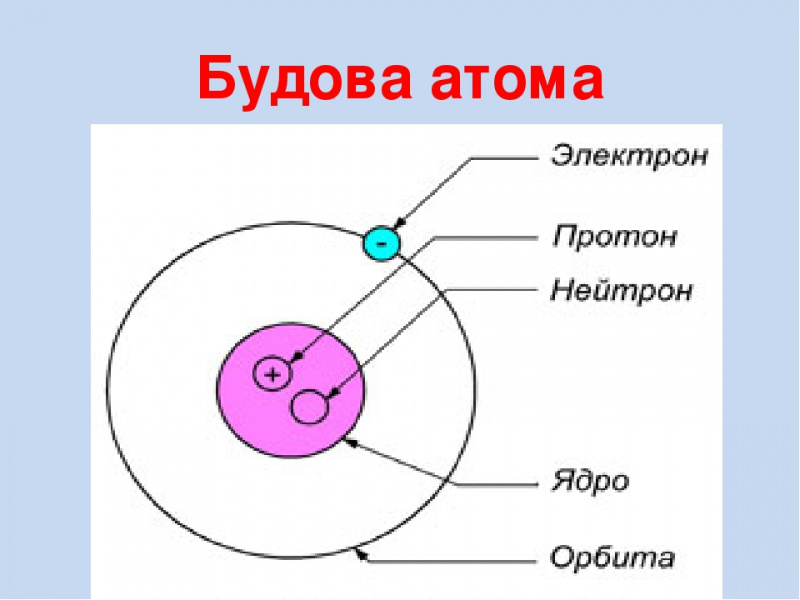 0)
/SourceModified (D:20151006073324)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2015-10-06T10:33:38+03:002015-10-06T10:33:31+03:002015-10-06T10:33:38+03:00Acrobat PDFMaker 10.1 для Worduuid:4350221a-2d21-4d56-afcf-2257e9808a0auuid:e5e6745a-0d7f-431e-88eb-05d7f6b1170b
0)
/SourceModified (D:20151006073324)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2015-10-06T10:33:38+03:002015-10-06T10:33:31+03:002015-10-06T10:33:38+03:00Acrobat PDFMaker 10.1 для Worduuid:4350221a-2d21-4d56-afcf-2257e9808a0auuid:e5e6745a-0d7f-431e-88eb-05d7f6b1170b
`vfǘܲKdwmcSǚ!k08lۺk@3,lΨn7?،tOX2?㖘 gɈB_A{wyIBFsWn;1[
Chem4Kids.
 com: Атомы: Структура
com: Атомы: Структура Атомы являются основой химии. Они являются основой всего во Вселенной. Как известно, материя состоит из атомов. Твердые тела состоят из плотно упакованных атомов, в то время как газы имеют разбросанные атомы. Мы рассмотрим основы, такие как атомная структура и связи между атомами. Когда вы узнаете больше, вы можете перейти к страницам реакций и биохимии и посмотреть, как атомы образуют соединения, которые помогают биологическому миру выжить.
Существуют ли частицы материи, которые меньше атомов? Конечно есть. Сверхмалые частицы можно найти внутри кусочков атомов. Эти субатомные частицы включают нуклона и кварка . Химики-ядерщики и физики работают вместе на ускорителях частиц , чтобы обнаружить присутствие этих крошечных, крошечных, крошечных частиц материи. Однако наука основана на атоме, потому что это мельчайшая отдельная единица материи.
Несмотря на то, что существует множество сверхмалых атомных частиц, вам нужно запомнить только три основные части атома: электроны, протоны и нейтроны. Что такое электроны, протоны и нейтроны? Электроны — самые маленькие из трех частиц, из которых состоят атомы. Электроны находятся в оболочках или орбиталях, окружающих ядро атома. Протоны и нейтроны находятся в ядре . Они группируются в центре атома. Это все, что вам нужно помнить. Три легких произведения!
Что такое электроны, протоны и нейтроны? Электроны — самые маленькие из трех частиц, из которых состоят атомы. Электроны находятся в оболочках или орбиталях, окружающих ядро атома. Протоны и нейтроны находятся в ядре . Они группируются в центре атома. Это все, что вам нужно помнить. Три легких произведения!В периодической таблице насчитывается почти 120 известных элементов. (117, пока мы это пишем) Химики и физики каждый день пытаются создавать новые в своих лабораториях.Атомы разных элементов имеют разное количество электронов, протонов и нейтронов. Каждый элемент уникален и имеет атомный номер. Это число говорит вам о количестве протонов в каждом атоме элемента. Атомный номер также называют числом протона.
Вы можете видеть, что каждая часть атома помечена знаком «+», «-» или «0». Эти символы относятся к заряду частицы. Вы когда-нибудь слышали о том, что вас может ударить током от розетки, статического электричества или молнии? Все это связано с электрическими зарядами. Заряды также обнаруживаются в мельчайших частицах материи.
Заряды также обнаруживаются в мельчайших частицах материи.Электрон всегда имеет «-» или отрицательный заряд. Протон всегда имеет «+» или положительный заряд. Если заряд всего атома равен «0» или нейтральному, количество положительных и отрицательных зарядов равно. Нейтральные атомы имеют одинаковое количество электронов и протонов. Третья частица – нейтрон. Он имеет нейтральный заряд, также известный как нулевой заряд.
Поскольку количество протонов в атоме не меняется, меньшее количество или дополнительные электроны могут создать особый атом, называемый ионом. Катионы имеют меньше электронов и имеют положительный заряд. Анионы имеют дополнительные электроны, которые создают отрицательный заряд.
Самое маленькое письмо в мире (видео Стэнфордского университета)
Первые подробные фотографии атомов
Атомы готовы к своему первому портрету крупным планом.
ВАШИНГТОН — Впервые физики сфотографировали структуру атома вплоть до его электронов.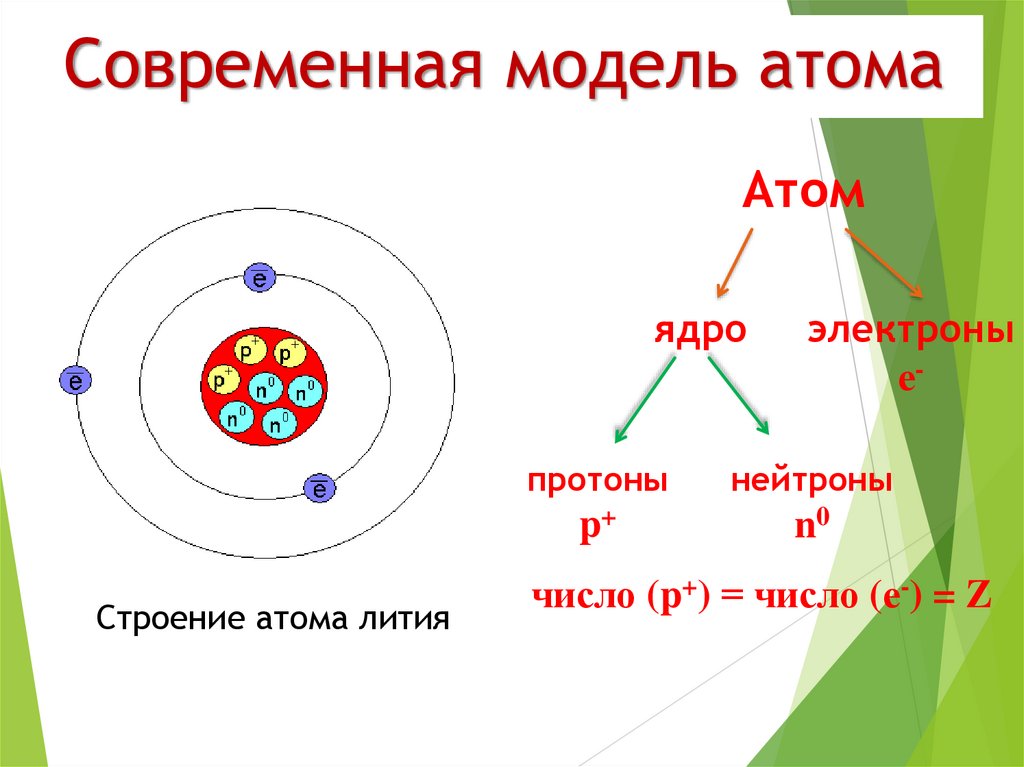
Фотографии, которые вскоре будут опубликованы в журнале Physical Review B, показывают подробные изображения электронного облака одиночного атома углерода, сделанные украинскими исследователями из Харьковского физико-технического института в Харькове, Украина.
Это первый раз, когда ученые смогли непосредственно увидеть внутреннюю структуру атома. С начала 1980-х годов исследователи смогли наметить атомную структуру материала в математическом смысле, используя методы визуализации.
Квантовая механика утверждает, что электрон не существует как отдельная точка, а распространяется вокруг ядра в облаке, известном как орбиталь. Мягкие голубые сферы и разделенные облака, видимые на изображениях, показывают два расположения электронов на их орбиталях в атоме углерода. Структуры подтверждают иллюстрации, которые можно увидеть в тысячах книг по химии, потому что они соответствуют установленным квантово-механическим предсказаниям.
Дэвид Голдхабер-Гордон, профессор физики Стэнфордского университета в Калифорнии, назвал исследование выдающимся.
«Одним из преимуществ [этой техники] является то, что она висцеральная», — сказал он. «Как люди, мы привыкли смотреть на изображения в реальном пространстве, такие как фотографии, и мы можем легче и быстрее усваивать вещи в реальном пространстве, особенно люди, которые менее глубоко разбираются в физике».
Для создания этих изображений исследователи использовали автоэмиссионный электронный микроскоп или FEEM. Они поместили жесткую цепочку атомов углерода длиной всего в несколько десятков атомов в вакуумную камеру и пропустили через образец напряжение 425 вольт.Атом на конце цепи испускал электроны на окружающий люминофорный экран, создавая изображение электронного облака вокруг ядра.
Электронные микроскопы с автоэлектронным излучением были основным инструментом ученых, исследующих очень маленькие объекты с 1930-х годов. До этого момента микроскопы могли выявить только расположение атомов в образце.
Чем острее заостренный кончик образца внутри вакуумной камеры, тем выше разрешение конечного изображения на экране, сказал Игорь Михайловский, один из авторов статьи.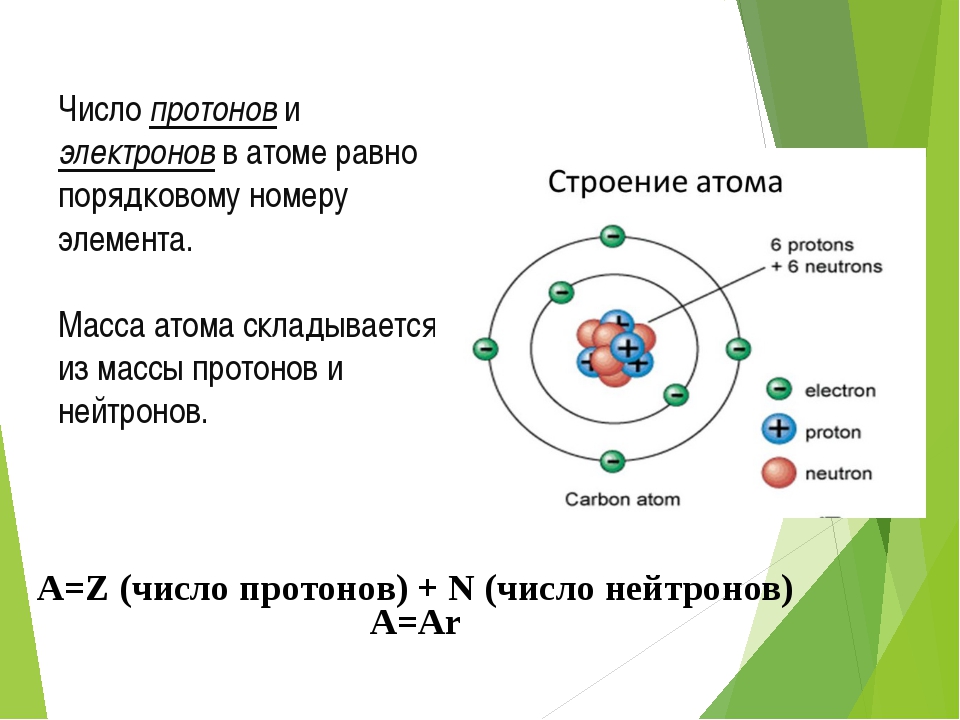 В прошлом году физики научились превращать атомы углерода в цепочки. Теперь, когда ширина кончика образца составляла всего один атом, микроскоп смог разрешить орбитали электрона. Харьковские исследователи первыми получили реальные изображения электронов отдельного атома, сделав видимыми предсказания квантовой механики.
В прошлом году физики научились превращать атомы углерода в цепочки. Теперь, когда ширина кончика образца составляла всего один атом, микроскоп смог разрешить орбитали электрона. Харьковские исследователи первыми получили реальные изображения электронов отдельного атома, сделав видимыми предсказания квантовой механики.
В то время как такие инструменты, как сканирующий туннельный микроскоп, уже отображают структуру электронов в образце из многих атомов, «всегда хорошо иметь дополнительные подходы», — сказал Голдхабер-Гордон.«Иногда что-то загадочное с одной точки зрения становится кристально ясным с другой точки зрения. Каждое из них приближает вас на шаг к полному пониманию».
Голдхабер-Гордон также указал, что этот метод не может быть широко применим, поскольку высокое разрешение обусловлено специфической структурой образца.
«В настоящее время более важно напрямую отображать квантовую механику, чем узнавать что-то новое о материалах», — сказал он. «Но это может измениться, если [украинская команда] разработает новые возможности.
«Но это может измениться, если [украинская команда] разработает новые возможности.
Посмотрите на это изображение одного атома
Дэвид Надлингер — Оксфордский университет
- Атомы настолько малы, что их практически невозможно увидеть без микроскопа.
- Но теперь на отмеченной наградами фотографии показан один атом в электрическом поле — и вы можете увидеть его невооруженным глазом, если хорошенько присмотритесь.
- Это атом стронция, который имеет 38 протонов. Диаметр атома стронция составляет несколько миллионных долей миллиметра.
Атомы очень маленькие. На самом деле настолько мал, что его невозможно увидеть невооруженным глазом даже в самый мощный микроскоп. По крайней мере, раньше это было правдой. Теперь у нас есть фотография, на которой виден одиночный атом, плавающий в электрическом поле, и она достаточно большая, чтобы ее можно было увидеть без какого-либо микроскопа.
🔬Наука на нашей стороне. Мы поможем вам понять это.
Мы поможем вам понять это. Фотография (в начале статьи), сделанная Дэвидом Надлингером и озаглавленная «Один атом в ионной ловушке», стала победителем конкурса научной фотографии Совета по исследованиям в области технических и физических наук.На фотографии изображен одиночный атом стронция, помещенный в сильное электрическое поле, облучаемый лазерами, которые заставляют его излучать свет.
Несмотря на то, что атом виден, его все же не так просто увидеть. Если вы внимательно посмотрите в центр фотографии, вы увидите тусклую голубую точку. Это атом стронция, освещенный сине-фиолетовым лазером.
В данном аппарате используется стронций из-за его размера: стронций имеет 38 протонов, а диаметр одного из этих атомов составляет несколько миллионных долей миллиметра.Обычно это было бы слишком мало, чтобы увидеть, но в этой установке используется хитрый трюк, чтобы сделать атом намного ярче.
Лучшие микроскопы
SE306R-PZ-LED Передний бинокулярный стереомикроскоп
AmScope amazon. com
com212,99 долларов США
Профессиональный бинокулярный стереомикроскоп SE400-Z
AmScope Амазонка.ком235,95 долларов США
Andonstar AD407 3D HDMI паяльный цифровой микроскоп
Андонстар amazon.com $319.00$243,99 (скидка 24%)
На атом стронция на фотографии воздействует мощный лазер, в результате чего электроны, вращающиеся вокруг атома стронция, становятся более возбужденными.Иногда эти заряженные электроны испускают свет. При достаточном количестве возбужденных электронов, испускающих достаточно света, обычная камера может запечатлеть атом.
Тем не менее, это не значит, что вы сможете увидеть атом своими глазами. Это изображение снято с длинной выдержкой, что означает, что даже со всем этим лазерным светом оно все еще слишком слабое, чтобы его можно было снять без оборудования. Но, учитывая, насколько невероятно малы атомы, глядя на эту фотографию, вы, вероятно, приблизитесь к ней.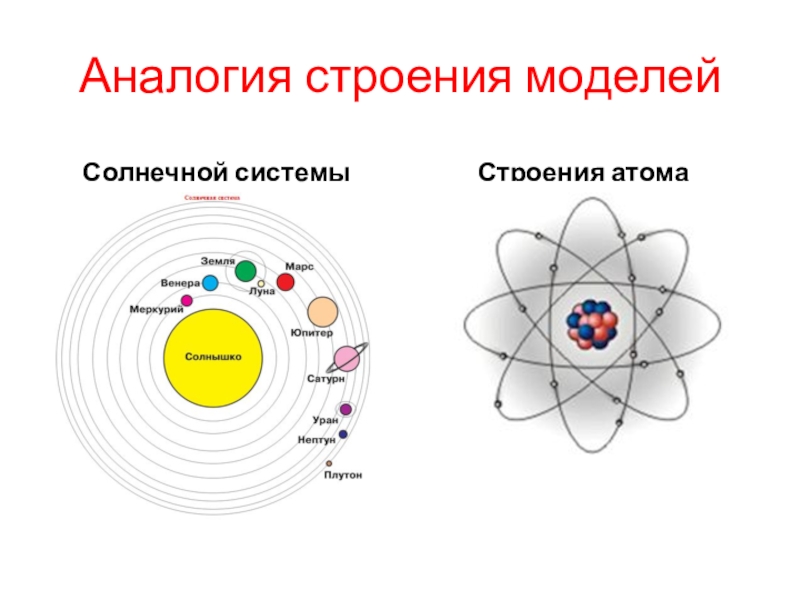
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти дополнительную информацию об этом и подобном контенте на сайте piano.io.
первых фотографий одиночного атома | БиоНаука
Получить помощь с доступом
Институциональный доступ
Доступ к контенту с ограниченным доступом в Oxford Academic часто предоставляется посредством институциональных подписок и покупок.Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту следующими способами:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически,
и невозможно выйти из учетной записи с проверкой подлинности IP.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения.
Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Вход с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Многие общества предлагают своим членам доступ к своим журналам с помощью единого входа между веб-сайтом общества и Oxford Academic. Из журнала Oxford Academic:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Некоторые общества используют личные аккаунты Oxford Academic для своих членов.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.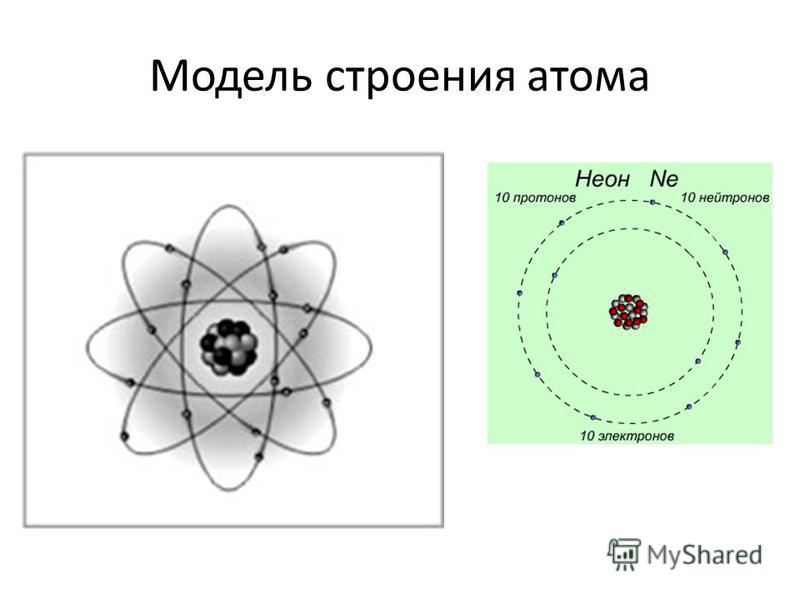
Некоторые общества используют личные учетные записи Oxford Academic для предоставления доступа своим членам.
Институциональная администрация
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
Просмотр ваших зарегистрированных учетных записей
Вы можете одновременно войти в свою личную учетную запись и учетную запись своего учреждения.Щелкните значок учетной записи в левом верхнем углу, чтобы просмотреть учетные записи, в которые вы вошли, и получить доступ к функциям управления учетной записью.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ.
Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ.
Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Атомная структура
Атомная структураАтомная структура
Вся материя состоит из основных строительных блоков, называемых атомами .
Атомы состоят из еще более мелких частиц, называемых протонов , электронов и нейтронов . Протоны и нейтроны
живут в ядре атома и почти одинаковы по массе. Однако,
протоны имеют положительный заряд, тогда как нейтроны не имеют заряда. Электроны
имеют отрицательный заряд и вращаются вокруг ядра в оболочках или электронов
орбитали и намного менее массивны, чем другие частицы.С
Электроны в 1836 раз менее массивны, чем протоны или нейтроны.
масса атома находится в ядре, которое составляет всего 1/100 000 размера ядра
весь атом(!).
Организация атома водорода показана ниже:
Атом водорода
Красная точка — это протон в ядре. Он имеет положительный заряд +1 ед. Синяя точка — это электрон. Он имеет отрицательный заряд -1 ед. Для любого нормального атома число электронов и протоны равны, что означает, что электрический заряд уравновешен.Там только одна орбиталь для водорода. Давайте посмотрим на более крупный атом, углерод.
Атом углерода
Теперь в ядре есть новая частица, нейтрон
(обозначены белыми точками). В ядре также 6 протонов,
всего 12 частиц. Кроме того, теперь есть 6 электронов
вращается вокруг ядра по двум орбиталям. Причина, по которой атом углерода нуждается в
вторые орбитали сложны и выходят за рамки этого геологического класса.
Но правила, управляющие атомами, гласят, что первая орбиталь может иметь только два
электронов, на второй орбитали разрешено восемь электронов, на третьей орбитали только
восемь электронов и т. д. (см. стр. 27 вашего текста к номерам
электронов на каждой орбитали для первых 20 элементов.)
д. (см. стр. 27 вашего текста к номерам
электронов на каждой орбитали для первых 20 элементов.)
В природе встречается 91 элемент. Атомы — это мельчайшие частицы элементов, и на самом деле слово «атом» происходит от греческого слова «томос», что означает «не разрезая» — то есть вы не можете разрезать его меньше, чем это.Мы обычно представляют элементы их атомным символом. Водород представлен буквой «Н»; углерод буквой «С».
Для атомов изменение количества протонов изменяет вид элемент . Итак, если бы я бросил дополнительный протон в ядра атома углерода, показанного выше, у меня больше не было бы углерода — я будет азот. Точно так же, если я уберу протон из углерода атом, у меня был бы другой элемент, бор. Количество протонов в ядро атома такое же, как атомный номер этого атом.Если сложить количество протонов и нейтронов, получится атомных атомов. массовое число этого конкретного атома.
Быстрый тест : Какой атомный номер изображенного атома водорода над? Какова его атомная масса? Что такое атомный номер и атомное массовое число атома углерода, показанного выше?
Ответы : Атомный номер водорода 1 (сосчитайте
протоны). Атомное массовое число водорода также на (есть
нейтронов нет!).Для углерода атомный номер равен 6 , а атомный
массовое число 12 (6 протонов плюс 6 нейтронов).
Атомное массовое число водорода также на (есть
нейтронов нет!).Для углерода атомный номер равен 6 , а атомный
массовое число 12 (6 протонов плюс 6 нейтронов).
Посмотрите еще раз на рисунок атома углерода. Что, если мы добавим нейтрон вместо протона? Будет ли у нас один и тот же элемент? да. Но атом был бы другим. А нумерация или вычитание нейтронов из ядра атома создает изотопы этого атома . Например, давайте добавим два нейтрона к атому углерода, обозначенному зеленым цветом. точки ниже:
Изотоп углерода
Добавление двух нейтронов меняет наш атом.Однако, поскольку
количество протонов то же, это все еще углерод, но теперь это изотоп
углерода. Мы представляем изотопы, используя химический символ
(«C» для углерода) и число. Первый атом углерода всего с 6
нейтроны будут называться 12 C или Углерод-12. Новый с 8
нейтроны будут 14 C или Углерод-14.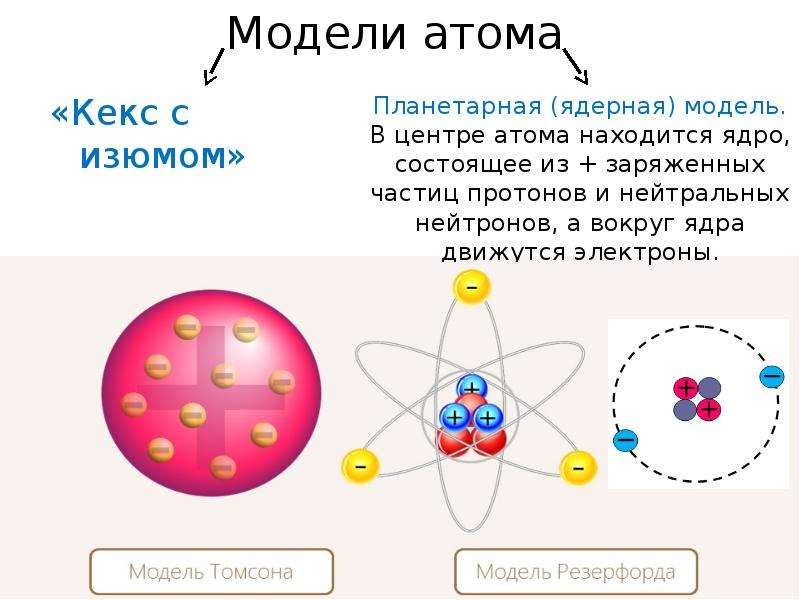 Обратите внимание, что число
«14» также является атомным массовым числом этого изотопа.
Обратите внимание, что число
«14» также является атомным массовым числом этого изотопа.
Химики работали над организацией элементов особым образом, называемым Периодическая таблица.Он упорядочен таким образом, что элементы в каждом столбце имеют некоторые общие химические и физические свойства. Ниже приведено изображение Периодическая таблица:
*Изображение с http://www.chemtutor.com/perich.htm
Каждый элемент имеет атомарный символ и атомарный количество.
Быстрый тест: Вспомните, что атомный номер — это количество протонов в ядре. Каково число протонов в Атом натрия (Na)? Атом кислорода (O)? Атом урана (U)?
Ответы: Натрий имеет 11 протонов, Кислород 8 протонов, а уран 92 протонов.
Продолжить и узнать об ионах.
Вернуться в главное меню.
Вернуться на страницу вводного курса по геонаукам.
(Для получения дополнительной информации об основах химии и атомной структуре, посетите http://www.chemtutor.com/.)
Это самый подробный взгляд на отдельные атомы из когда-либо снятых
Криста Чарльз
Крупный план атомов в кристалле, побивший мировой рекорд
Cornell
На сегодняшний день получено изображение атомов с самым высоким разрешением, побив рекорд, установленный в 2018 году.
Дэвид Мюллер из Корнельского университета в Итаке, штат Нью-Йорк, и его коллеги сделали это изображение, используя кристалл ортоскандата празеодима. Они использовали метод, называемый птихографией, в котором они использовали электронный микроскоп для анализа кристалла, вычисляя углы рассеяния электронов, чтобы определить форму рассеивающих их атомов.
Это изображение в два раза превышает разрешение увеличенного изображения атомов, сделанного в 2018 году Мюллером и его командой, что само по себе в три раза превышает разрешение других изображений, сделанных в то время с помощью других методов.
В 2018 году Мюллер и его команда использовали двумерный материал, чтобы ограничить количество рассеяния электронов, которое происходит в более толстом материале, и затрудняет определение того, откуда рассеялись электроны.
«Ключевым прорывом, которого мы добились в этом году, стало то, что мы нашли способ расшифровать это многократное рассеяние, а это проблема 80-летней давности», — говорит Мюллер. «В течение 80 лет у нас не было общего решения, и теперь с помощью некоторых очень умных алгоритмов, разработанных нашими коллегами [которые работают с рентгеновскими лучами], а затем модифицированных для рассеяния электронов, мы смогли распутать это многократное рассеяние.
Это позволило команде изучить более толстые образцы и добиться лучшего разрешения. Размытие на текущем изображении происходит из-за движения самих атомов (на фото выше).
«Мы можем сделать немного лучше, охладив образец, потому что при охлаждении образца атомы не трясутся так сильно», — говорит Мюллер.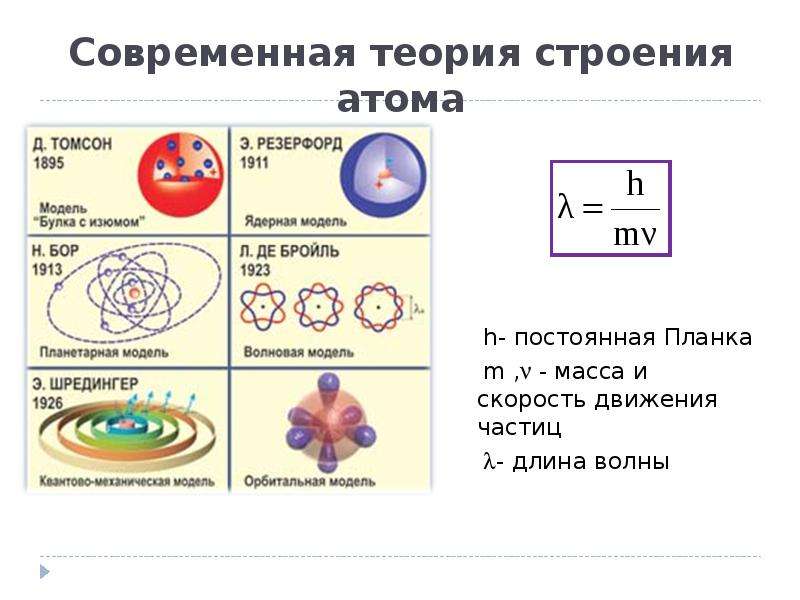
Ссылка на журнал: Science , DOI: 10.1126/science.abg2533
Статья изменена на 4 июня 2021 г.Мы скорректировали источник света, используемый в эксперименте
Дополнительная информация по этим темам:
| |
 Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.
Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.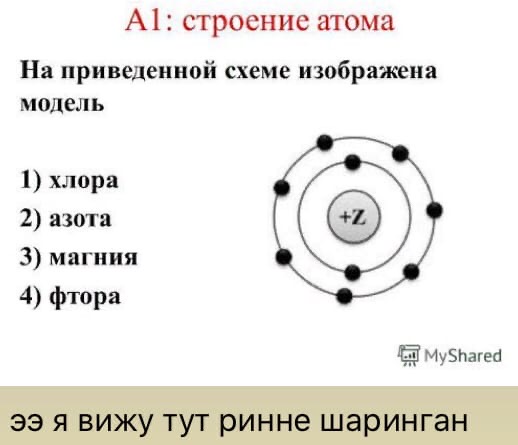 (В биологии слово ядро имеет и другие значения, поэтому мы будем называть эту область атомным центром ). В этой центральной области находятся протоны и нейтроны.
(В биологии слово ядро имеет и другие значения, поэтому мы будем называть эту область атомным центром ). В этой центральной области находятся протоны и нейтроны.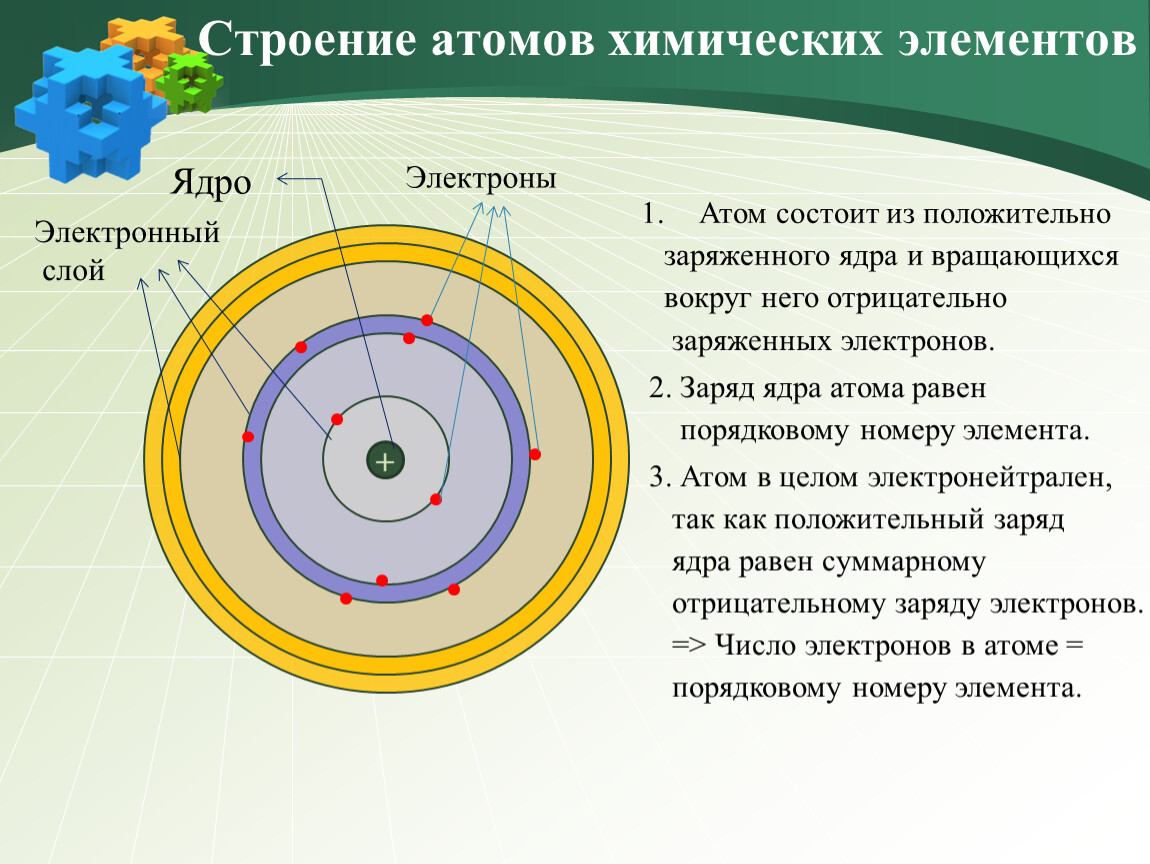 Самая известная из этих моделей была усовершенствованием модели Резерфорда и теперь известна как …
Самая известная из этих моделей была усовершенствованием модели Резерфорда и теперь известна как …


 Атомы трития имеют один протон, один электрон и два нейтрона. Масса каждого протона и нейтрона приблизительно равна 1 а.е.м. (атомная единица массы), поэтому масса водорода равна единице, массе дейтерия — две единицы, а массе трития — три единицы.Массу атомного центра (электроны в массе не учитывают, они слишком малы) называют атомным массовым числом или чаще атомной массой .
Атомы трития имеют один протон, один электрон и два нейтрона. Масса каждого протона и нейтрона приблизительно равна 1 а.е.м. (атомная единица массы), поэтому масса водорода равна единице, массе дейтерия — две единицы, а массе трития — три единицы.Массу атомного центра (электроны в массе не учитывают, они слишком малы) называют атомным массовым числом или чаще атомной массой .