Кислоты, их классификация и свойства. Химия. 8 класс. Разработка урока
УМК по химии для 8 класса О. С. Габриеляна.
Тип урока: изучение нового материала.
Форма урока: урок-исследование.
Цель урока: рассмотреть свойства кислот в свете теории электролитической диссоциации.
Задачи урока:
- Образовательные: на основе повторения и обобщения ранее изученного материала и в ходе знакомства с новым материалом углубить знания учащихся о свойствах кислот, отработать умение составления ионных уравнений реакций.
- Воспитательные: формировать мировоззренческие понятия о познаваемости природы, воспитывать чувство патриотизма и уважения к своей Родине, чувство коллективизма при работе в группах, уверенность в своих силах.
- Развивающие: развивать познавательный интерес к предмету, память, мышление, наблюдательность в ходе эксперимента; продолжить развитие навыков работы с химическими веществами и лабораторным оборудованием в процессе выполнения лабораторного опыта.
Оборудование и материалы: таблица растворимости, плакат “Химические свойства кислот”, карты-исследований, карточки-инструктажи, карточки с домашним заданием;
ТСО: проектор, видеофильм “Взаимодействие оксида меди с серной кислотой”.
Ход урока
I. Организационный момент
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой учащихся. Создание спокойной, деловой обстановки.
II. Повторение изученного материала
Я хочу начать наш урок с эпиграфа: “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”. Это изречение принадлежит великому русскому учёному М. В. Ломоносову. Из этих слов становится ясно, какую значимость придавал он опыту. Именно поэтому Михаил Васильевич в течение 7 лет настойчиво добивался организации химической лаборатории. “Профессор химии без лаборатории никакой пользы учинить не может, точно так же, как профессор астрономии без обсерватории”.
В итоге первая химическая лаборатория была учреждена в России в 1748 г. В ней было выполнено большое количество исследований, было сделано много открытий.
Не случайно наш урок начался со слов этого великого учёного. Сегодня мы с вами будем работать в рамках химической лаборатории, в которой, как и М.В.Ломоносов, будем проводить исследования. В нашей лаборатории мы будем изучать кислоты с точки зрения теории электролитической диссоциации. Сегодня на уроке мы рассмотрим химические свойства кислот в свете теории электролитической диссоциации. Это цель нашего урока. Тема нашего урока: “Кислоты, их классификация и свойства” (Запись даты и темы урока в тетради).
Вспомним основные понятия электролитической диссоциации:
– На какие группы делятся вещества по отношению к электрическому току? (Электролиты и неэлектролиты.)
– Дайте определение понятию “электролит”? (Это вещество, водный раствор или расплав, которого проводит электрический ток.)
– Приведите примеры электролитов? (Растворы и расплавы солей и щелочей, растворы кислот.)
– Дайте определение понятию “неэлектролит”? (Это вещество, водный раствор и расплав которого не проводит электрический ток.)
– Приведите примеры неэлектролитов? (Нерастворимые соли и основания, оксиды, простые вещества, органические вещества.)
– Дайте определение понятию “электролитическая диссоциация”? (Это распад электролита на ионы при расплавлении или растворении в воде.)
– Дайте определение кислоте из курса? (Это сложное вещество, состоящее из атомов водорода и кислотного остатка.)
Существует несколько классификаций кислот. Откройте учебник на странице 157, таблица № 10.
– Как могут классифицироваться кислоты?
Если кислоты электролиты, то они тоже могут диссоциировать. Сейчас я вам предлагаю написать диссоциацию серной и соляной кислот.
H2SO2 → 2H+ + SO42–
HСl → H+ + Cl–
– Дайте определение кислоте с точки зрения теории электролитической диссоциации? (Это электролит, диссоциирующий в водном растворе на катион водорода и анион кислотного остатка.)
Мы повторили основные понятия, необходимые для дальнейшего изучения химических свойств кислот.
III. Изучение нового материала
Переходим к изучению химических свойств кислот.
Все химические свойства кислот представлены на плакате.
На доске прикрепляю карточки (зачитываю химические свойства)
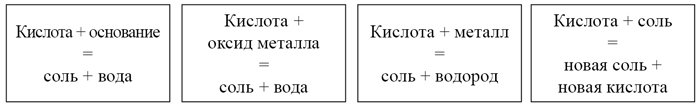
Приложение 1
Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты, поэтому постоянный контроль опытом необходим”. Поэтому опытным путем докажем химические свойства кислот, соблюдая технику безопасности.
Инструкция “Меры безопасности при работе с кислотами”, инструкция проведения опыта), учащиеся разделены на 4 группы. Перед выполнением лабораторного опыта, учащиеся читают инструкцию (приложение 2).
Лабораторный опыт “Взаимодействие кислот с щелочами (основаниями)”
Порядок выполнения работы:
- В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1–2 капли фенолфталеина. Что вы наблюдаете?
- К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете?
- Составьте молекулярное и ионные уравнения проделанной реакции.
Лабораторный опыт “ Взаимодействие кислот с солями”
Порядок выполнения работы:
- В пробирку налейте 2 мл серной кислоты и прибавьте несколько капель хлорида бария. Что вы наблюдаете?
- Напишите молекулярное и ионные уравнения проделанной реакции
Лабораторный опыт “Взаимодействие кислот с металлами”
Порядок выполнения работы:
- В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию.
- Что вы наблюдаете?
- Напишите молекулярное уравнение проделанной реакции.
Лабораторный опыт “Взаимодействие кислот с основными оксидами” (видеофрагмент)
После выполнения работы 4 учащихся от каждой группы выходят к доске и пишут уравнения реакции под соответствующими карточками. В это время 4 других учащихся представляют отчет о проделанной работе.
Затем зачитываю применение кислот в быту. Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты.
IV. Закрепление
Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д. И. Менделеева.
|
1) SiО2 2) LiОН 3) ВаNО3 4) НСI 5) К2О 6) К2SiО3 7) НNО3 8) Fе(ОН)3 |
А К А С Л И О Й |
III. Подведение итогов урока
Подведем итоги урока. Сегодня в рамках химической лаборатории мы исследовали кислоты с точки зрения теории электролитической диссоциации. Давайте ещё раз обратимся к эпиграфу, с которого мы начали наш урок: “Один опыт я ставлю выше, чем тысячу мнений рождённых только воображением”. Этим мудрым высказыванием М. В. Ломоносова давайте завершим наш урок.
IV. Домашнее задание
Учащиеся получают необычное домашнее задание разного уровня сложности “Кем вы считаете себя в химии?”: кандидатом наук, профессором или академиком. Ученые степени расположены в порядке возрастания от кандидата наук до академика. Самая высшая учёная степень – академик. Дома ученики выбирают посильный для себя вариант работы с той учёной степенью, на которую они претендуют. Каждый вариант работы включает 2 задания, одно из них носит творческий характер. К следующему уроку выполняется первое задание, на выполнение второго задания даётся одна неделя.
Приложение 3.
Состав и общие свойства кислот. Видеоурок. Химия 8 Класс
Тема: Обобщение пройденного материала
Урок: Состав и общие свойства кислот
Существуют разные способы классификации кислот. По наличию атомов кислорода кислоты делятся на кислородсодержащие (например, азотная и серная кислоты) и бескислородные (например, соляная и сероводородная).
По количеству атомов водорода в молекуле или по валентности кислотного остатка кислоты можно разделить на одноосновные (например, HCl), двухосновные (например, H 2SO4) и трехосновные (например, Н3РО4).
На наших уроках пока мы используем только формулы неорганических (минеральных кислот), но ведь есть и органические кислоты. Это уксусная, щавелевая, стеариновая, лимонная и другие.
В состав кислот обязательно входят атомы водорода, которые можно заместить на металл. Поэтому кислотами называют сложные вещества, в состав которых входят атомы водорода, способные замещаться на металл, и кислотные остатки.
Состав кислот отражен в их названии. Например, у бескислородных кислот название всегда включает название элемента и слово «водородная»:
HCl – хлороводородная, H2S – сероводородная.
Названия кислородсодержащих кислот тоже подчиняются определенным правилам. К названию химического элемента прибавляется суффикс н или ов(ев) и окончание –ая, если число атомов кислорода в молекуле кислоты наибольшее:
H2SO4 — серная
HNO3 – азотная
H2SiO3 — кремниевая
Если в молекуле кислоты число атомов кислорода меньше максимального, то часто в названии используют суффикс ист:
H2SO3 – сернистая
HNO2 – азотистая
Вспомним, какие же химические свойства характерны для кислот. Растворимые в воде кислоты изменяют окраску индикаторов. Например, в кислой среде лакмус и метилоранж становятся красными, а фенолфталеин остается бесцветным.
Кислоты (кроме азотной и концентрированной серной) вступают в реакции замещения с металлами, стоящими в ряду активности левее водорода. При этом образуется соль и выделяется водород. Например, железо медленно взаимодействует с соляной кислотой, при этом образуются хлорид железа(II) и водород:
Fe + 2HCl = FeCl2 + H2
Алюминий вступает в реакцию замещения с соляной кислотой быстрее, чем железо, т.к. в ряду активности он стоит левее железа. При этом образуется хлорид алюминия и выделяется водород:
2Al + 6HCl = 2AlCl3 + 3H2
Магний очень энергично взаимодействует с соляной кислотой, образуя хлорид магния и водород:
Mg + 2HCl = MgCl2 + H2
Для кислот характерна реакция с основными и амфотерными оксидами. В результате этого взаимодействия образуются соль и вода. При взаимодействии оксида кальция с соляной кислотой образуются хлорид кальция и вода. В реакции оксида железа(III) с соляной кислотой образуются хлорид железа(III) и вода.
CaO + 2HCl = CaCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Кислоты вступают во взаимодействие с основаниями. Эта реакция относится к типу обмена и получила название реакции нейтрализации. Реакция нейтрализации может протекать между серной кислотой и гидроксидом натрия. В результате этого взаимодействия образуется сульфат натрия и вода:
H2SO4+ 2NaOH = Na2SO4 + 2H2O
Роль кислот в нашей жизни трудно не заметить. Во-первых, в желудочном соке человека и животных содержится слабый раствор соляной кислоты. Муравьиная кислота, которая относится к группе органических кислот, содержится в жидкости, выделяемой муравьями, и ожог от крапивы обусловлен действием на кожу именно этой кислоты.


Рис. 1. Кислоты в природе (в лимонном соке содержится лимонная кислота; в жидкости, выделяемой муравьями – муравьиная кислота)
На этикетке многих газированных фруктовых напитков написано, что в их состав входит фосфорная кислота. Азотная кислота используется в производстве минеральных удобрений и взрывчатых веществ. Серную кислоту применяют в производстве аккумуляторных батарей.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.120-123)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.126-128)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (§36)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§45)
5. Химия: неорг. химия: учеб.для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§32)
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. (Источник).
2. Химическая информационная сеть (Источник).
3. Химия и жизнь (Источник).
Домашнее задание
с. 127 №№ 3,4 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Конспект урока по химии на тему «Кислоты» (8 класс)
Методическая разработка урока по химии в рамках ФГОС для 8 класса
на тему: «Кислоты».
Автор: Зайцева Наталья Станиславовна
МБОУ « Пудостьская средняя общеобразовательная школа»
.п. Пудость Ленинградская область.
Пояснительная записка.
Автор: Зайцева Наталья Станиславовна п.Пудость Ленинградской обл.
Учитель: химии
Предмет: химия
Класс: 8
Тема урока: «Кислоты»
Тип урок: изложение нового материала.
Автор учебника: О.С.Габриелян. Учебник для общеобразовательных учреждений. «Химия 8». 2011г. М.: Дрофа.
Раздел учебника: соединения химических элементов.
Учебная нагрузка: 68 часов в год, 2 раза в неделю.
Актуальность: данный урок является четвертым в изучении раздела химии. Использования средств ИКТ. Визуализация химических опытов, привить интерес к изучению предмета в соответствии с образовательными стандартами.
Технологии и методики применяемые на уроке: ИКТ- презентация в формате Power Point служит для визуализации учебного материала и рассчитана на сопровождение изучения нового материала. С ее помощью осуществляется демонстрация и объяснение нового материала, проверка знаний и самопроверка. Лабораторный опыт позволяет повысить познавательный интерес к предмету. С помощью беседы успешно решается задача формирования теоретических и фактических знаний, а их применение способствует развитию логического мышления, речевых умений и эмоциональной сферы личности. Здоровьесберегающие технологии. В ходе урока спланированы организационно-технические, санитарно-гигиенические условия здоровьясбережения, учитывающие возрастные особенности детей.
Понятийный аппарат усвоения: . кислота; органические и неорганические; состав кислоты: водород и кислотный остаток; одноосновная, двухосновная, трехосновная кислоты; кислородсодержащие и бескислородные кислоты. Структура урока:
1.Организационный момент.
2.Актуализация знаний.
3.Изучение нового материала.
4.Закрепление изученного материала.
5.Домашнее задание.
6.Подведение итогов;
7.Рефлексия
Анализ результатов урока:
Урок способствует развитию межпредметных знаний.
Упражнения направлены на активизацию деятельности учащихся;
Лабораторный опыт дает возможность для развития познавательного интереса к предмету;
Рефлексия позволяет осуществить каждому ребенку самоанализ своей деятельности на уроке.
Перспективы использования данного материала: разработка данного урока будет размещена в методической копилке школьного сайта и в социальной сети работников образования.
Теория Кислоты
К классу кислот относят соединения, состоящие из двух и трех химических элементов. Как правило, третьим элементом, входящим в состав кислоты, является кислород. Поэтому такие кислоты называют кислородсодержащими, в отличие от НС1 и H2S, которые называют бескислородными. Перечислим некоторые кислородсодержащие кислоты.
А зотная кислота — HN03.
зотная кислота — HN03.
Азотистая кислота — HN02.
Серная кислота — H2S04.
Сернистая кислота — H2S03.
Угольная кислота — Н2С03.
Кремниевая кислота — H2Si03.
Фосфорная кислота — Н3Р04.
Обратите внимание, что все кислоты (и кислородсодержащие, и бескислородные) обязательно содержат водород, который в формуле записывают на первом месте. Всю остальную часть формулы называют кислотным остатком. Например, у НС1 кислотным остатком является С1, а у Н3Р04 кислотный остаток Р04.
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Как правило, кислотные остатки образуют элементы-неметаллы .
Все многообразие кислот делится на органические и неорганические кислоты.
Познакомимся с некоторыми из кислот.
В природе встречается много кислот: лимонная кислота в лимонах, яблочная кислота в яблоках, щавелевая кислота в листьях щавеля ( Муравьи защищаются от врагов, разбрызгивая едкие капельки, содержащие муравьиную кислоту. Она же содержится в пчелином яде и в жгучих волосках крапивы.
При скисании виноградного сока получается уксусная кислота, а при скисании молока — молочная кислота Та же самая молочная кислота образуется при квашении капусты и при силосовании кормов для скота. Нам хорошо известны часто применяемые в быту лимонная и уксусная кислоты. Употребляемый в пищу уксус и представляет собой раствор уксусной кислоты.Многие кислоты нужны в народном хозяйстве в огромных количествах, производство этих веществ называют много тоннажным. К их числу относят серную и соляную кислоты.
Серная кислота H2S04 — бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения.
П ри смешивании серной кислоты с водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего. Чтобы этого не случилось, при растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать (рис. 61).
ри смешивании серной кислоты с водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего. Чтобы этого не случилось, при растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать (рис. 61).
Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с серной кислотой опустить лучинку, то происходит химическая реакция — лучинка обугливается. Теперь понятно, как опасно попадание брызг серной кислоты на кожу человека и одежду.
Угольная и сернистая кислоты — Н2С03 и h3SO3 — в свободном виде не существуют, так как они разлагаются на воду и соответствующий оксид (газ):
Н2С03-> С02| + Н20,
H2S03 —> S02t + Н20.
Растворы всех кислот кислые, но распознавать концентрированные кислоты на вкус не решится ни один химик — это опасно. Есть более эффективные и безопасные способы обнаружения кислот. Их так же, как и щелочи, распознают с помощью индикаторов. Добавим к растворам кислот по нескольку капель раствора лакмуса фиолетового цвета. Лакмус окрасится в красный цвет. Метиловый оранжевый при действии кислот изменяет оранжевый цвет на красно-розовый А вот кремниевую кислоту H2Si03, поскольку она нерастворима в воде, так распознавать нельзя.
Технологическая карта урока по химии «Кислоты»
Учитель: Зайцева Н.С. МБОУ Пудостьская СОШ
УМК: О.С.Габриелян 8класс
Предметная область: химия
Тема урока — «Кислоты».
Цель: формирование образовательных компетенций (информационных, коммуникативных, рефлексивных) учащихся 8 класса в предметной области «Химия» по теме « Кислоты».
Тип урока – изучение нового материала.
Оборудование урока: комплекс “Компьютер + проектор” для демонстрации компьютерной презентации к уроку, раздаточный материал для лабораторного опыта в парах.
Используемые на уроке технологии:
Технологии системно-деятельного подхода
Технология проблемного обучения
3.Информационно-коммуникационная технология
«Все познается в сравнении»
п/п
Этап урока
Деятельность учителя
Деятельность обучающего
Формируемые УУД
1
Мотивация к учебной деятельности
Цель: проверка готовности учащихся, их настроя на работу
Приветствует учащихся,
определяет готовность к уроку.
Приветствуют учителя,
проверяют свои рабочие места.
Коммуникативные
Планируют учебное сотрудничество с учителем и одноклассниками.
2.
Актуализация знаний и постановка учебной проблемы
Цель: подведение детей к формулированию темы и постановке задач на уроке.
1.Вспомните, ребята, с какими неорганическими соединениями мы с вами познакомились на предыдущих уроках?
2.Какие соединения называют оксидами?
3.какие соединения называют
основаниями?
4 Кто запишет и назовет на доске оксид и основание?
5.записала формулу кислоты на доске
H2SO4
К каким соединениям мы можем отнести это вещество?
6.Почему? не оксид и не основание?
7.Давайте попробуем определить, к какому классу неорганических соединений относится это вещество.
1.Оксидами, водородными соединениями, основаниями.
2.Это сложные бинарные соединения, один из которых кислород со степенью окисления -2
3.это сложные соединения, состоящие из атомов металла и гидроксогруппы.
4.обучающийся приводит пример оксида и основания на доске.
5.это не оксид и не основание.
6.соединение состоит из трех химических элементов, поэтому не оксид, нет гидроксогруппы , поэтому не основание.
Познавательные
Самостоятельно выделяют и формулируют познавательную цель
Коммуникативные
Оформляют свои мысли в устной форме, взаимодействуют друг с другом.
Регулятивные
Определяют цель деятельности на уроке и планируют свою работу.
Личностные
Проявляют учебно-познавательный интерес к новому учебному материалу .
3.
Совместное открытие новых знаний
Цель: выявление обучающимися новых знаний, развитие умения находить ответы на проблемные вопросы
Задачи:
подведение детей к формулированию темы и постановке задач на уроке; составить представления учащихся о кислотах как классе неорганических веществ, познакомить с классификациями кислот.
Проводит беседу: В нашей повседневной жизни мы часто употребляем такие слова как «кислота» и «кислый»( в виде табличек демонстрация слов детям).
1.Подумайте,что общего между ними.
2.Вспомним примеры продуктов питания с кислым вкусом.
3. Как вы, думаете какие вещества придают этим продуктам кислый вкус?
4.Ребята, подумайте, как можно сформулировать тему сегодняшнего урока.
«Кислоты»
5.Давайте попытаемся вместе определить цель сегодняшнего урока.
Совсем недавно мы с вами начали путешествие по классам неорганических соединений
.И сегодня мы сделаем остановку на станции «Кислоты».(слайд 2)
Ключевой вопрос нашего урока: “Как кислоты распознать среди других веществ”(слайд3)
6.Все, существующие кислоты, делятся на: органические и неорганические (слайд № 4)

 Кислоты
Кислоты
Органические неорганические
7.Сегодня на нашем уроке присутствуют две экспертные группы: по органическим кислотам и неорганическим кислотам.
Давайте предоставим слово экспертам
С какими органическими кислотами нам приходится сталкиваться чаще всего?
8.Какие неорганические кислоты, находят применение в нашей жизни? (слайд №5)
формулы кислот
HCl
H2CO3
HNO3
9.Теперь нам известно, что каждая кислота имеет свою формулу. Давайте вспомним, что показывает химическая формула вещества?
10. Проанализируем состав кислот и сформулируем определение.( слайд№6)
Дополняю: и кислотный остаток.

 Состав кислоты
Состав кислоты
водород кислотный остаток
H NO3
11.Кислоты по числу атомов водорода классифицируют на (слайд №7)
Кислоты
одноосновные HNO3 двухосновные H2SO4
трехосновные H3PO4
по наличию кислорода
кислоты
кислородсодержащие HNO3 бескислородные HCl
(слайд№8)
12..Как можно отличить кислоты от других веществ? (слайд 9)
Предлагаю провести лабораторный опыт.
На столах обучающихся, находится инструктивная карта для выполнения практической работы.
Однако, согласно правилам поведения в химическом кабинете
Много говорить не буду,
Но хочу предостеречь:
При работе с кислотою
Нужно глазоньки беречь.
Если попадет на кожу,
Ты быстрей смывай водой!
Даю пояснение, что фенолфталеин является индикатором на щелочи, т.к. только в щелочной среде изменяет окраску, а в кислой среде остается бесцветным.
1.В этих словах один корень
2.яблоко, лимон, щавель…
3.Кислоты!
4.Кислоты!
5.познакомиться с многообразием кислот и изучить их свойства.
Записывают тему урока в рабочих тетрадях.
6.Схему записывают в тетрадь.
7.Эксперты в составе 4-х выходят с иллюстративным материалом к доске и рассказывают о некоторых органических кислотах . По окончанию своего выступления, каждый обучающийся крепит свой материал на стенд.
 8.Эксперт по неорганическим кислотам сообщает ребятам о применение неорганических кислот.
8.Эксперт по неорганическим кислотам сообщает ребятам о применение неорганических кислот.
В желудочном соке соляная кислота.
В лимонаде
В производстве удобрений
9.кислоты показывают количественный и качественный состав.
10.В состав молекул кислот входят атомы водорода .
Записывают в тетрадь.
11.Записывают в тетрадь.
12 Вспоминают ТБ.
Выполняют л\о
оранжевого метилового – на красный; фиолетового лакмуса – на красный; бесцветный фенолфталеин – остается бесцветным.
Личностные
Демонстрируют ответственное отношение к обучению
Предметные умения определения понятий: кислота и кислотная среда;
должны уметь: определять формулы кислот, среди других веществ, составлять их , исследовать среды раствора с помощью индикатора, оформлять отчет с описанием лабораторного опыта, его результатов и выводов.
Метапредметные умения
Познавательные
Обще учебные- организовывать свою учебную деятельность, участвовать в групповой работе, соблюдать правила поведения и работы с лабораторным оборудованием в кабинете химии, осваивать приемы исследовательской деятельности.
Физкультминутка
Физкультминутка поставили руки на локотки,
ладошки смотрят друг на друга. Каждый палец руки должен по очереди совершить mах нажатие на большой палец со словами:
Здравствуй мальчик,
Здравствуй пальчик,
С добрым утром,
С ясным днем.
Упражнение повторить 2-3 раза. .

Данное упражнение помогает активизировать все процессы головного мозга , так как на кончиках пальцев располагаются многочисленные нервные окончания
4.
Закрепление изученного материала
Цель: освоение способа действия с полученными знаниями в практической деятельности
Лабораторный опыт «Действие
кислот на индикаторы ».
После выполнения л/о ребята отвечают на вопрос как с помощью индикаторов определить кислоты.
2.Упражнение в применении знаний:
«Разделить формулы соединений на кислоты, основания ,оксиды из перечня предложенных веществ»
3.Теперь вернемся к ключевому вопросу урока:
“Как кислоты распознать среди других веществ”
Молодцы, ребята! Отлично справились с поставленной проблемой.
Выполняют записи в тетради
3 .1). по формуле
2).экспериментально: с помощью индикатора
Коммуникативные
формируем умение слушать и понимать других, работать в парах учитывая позицию собеседника
Познавательные
формируем умение работать с новой информацией по теме (отбирать, выделять, обобщать)
5.
Домашнее задание
Планирование работы на следующий урок.
Предлагает домашнее задание на следующий урок
§ 20, упр.1,подготовить на выбор презентацию или оформленный доклад на тему: «Значение кислот в природе и для человека».
Записывают задание
6.
Рефлексия
Создаёт условия для заключительной рефлексии:
-Сегодня на уроке я научилась(ся)…
-Сегодня на уроке я узнал(а)…
-Что ещё я хотел(а) бы узнать о кислотах …
-Неожиданностью для меня явилось то, что….
-Сегодня на уроке я понял(а), что..
-Особенно интересным было…
Инструктивная карточка
Лабораторная работа
Действие кислот на индикаторы.
Цель работы: исследовать окраску индикаторов в кислотах.
Оборудование и реактивы: 1,2,3 пробирки с растворами кислот: (1) соляной, (2) азотной, (3) серной кислот. индикаторы, стеклянная химическая палочка.
Ход работы:
В пробирках 1.2.3 находятся растворы (1) соляной, (2)азотной,
(3) серной кислот.
1.С помощью химической стеклянной палочки смочите лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу
2. С помощью химической стеклянной палочки смочите фенолфталеиновую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
3. С помощью химической стеклянной палочки смочите метилоранженвый индикатор. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
Взаимодействие кислот с индикаторами.
Лакмусфиолетовый
Фенолфталеин
бесцветный
Метиловый оранжевый
оранжевый
4.Сделайте вывод: Как можно определить раствор кислоты среди других веществ?
Информационные ресурсы
1. Воронцов А.Б. и др. Проектная деятельность в основной и старшей школе. – М.: Просвещение, 2010. – 176с.
2. О.С.Габриелян. Учебник для общеобразовательных учреждений. «Химия 8». 2011г. М.: Дрофа.
3 .О.С.Габриелян, Н.П.Воскобойникова, А.В.Яшукова. «Химия. Настольная книга учителя. 8 класс: методическое пособие». 2007г. М.: Дрофа.
4.О.С.Габриелян, П.Н.Берёзкин. Контрольные и проверочные работы к учебнику «Химия. 8 класс». 2008г. М.: Дрофа.
Презентация к уроку по химии (8 класс) по теме: Кислоты. 8 класс. (презентация)
Слайд 1
Учреждение образования СШ№13 г. Гродно Урок по теме: «Кислоты» Урок подготовила учитель химии Шегидевич Наталья ПетровнаСлайд 2
«Считай несчастным тот день или тот час, в который ты не усвоил ничего нового и ничего не прибавил к своему образованию» Я. А. Коменский
Слайд 3
Взаимопроверка домашнего задания. Упражнение 1, с. 161. 2Cu + O 2 = 2CuO ( р. соединения ) Cu(OH) 2 = CuO + H 2 O ( р. разложения ) или CuCO 3 = CuO + CO 2 ( р.разложения ) Упражнение 2, с. 161. ВаСО 3 = ВаО + СО 2 Карбонат бария оксид бария оксид углерода ( IV )
Слайд 4
Упражнение 8, с. 162. SiO 2 – оксид кремния ( IV ), песок, кремнезем не растворяется в воде. Ему соответствует кремниевая кислота — H 2 SiO 3 .
Слайд 5
Что нас объединяет?
Слайд 6
Кислый вкус лимону придает лимонная кислота , яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Слайд 7
План изучения темы: Состав, названия и определение кислот. Классификация кислот. Физические свойства кислот. Химические свойства кислот.
Слайд 8
Кислоты.
Слайд 9
Страна Кислот раздел Воспоминаний (состав, названия и определение кислот)
Слайд 10
Антуан Лавуазье Юстус Либих (1743-1794 ) (1803-1873)
Слайд 11
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. HCl – хлороводородная H 2 SO 4 – серная H 3 PO 4 — фосфорная
Слайд 12
Страна Кислот раздел Классификаций
Слайд 13
Классификация кислот Уксусная Лимонная Яблочная Муравьиная HCl H 2 SO 4 H 3 PO 4 H 2 CO 3 H 2 SiO 3 Неорганические Органические
Слайд 14
По какому признаку кислоты разделены на группы? HCl HF HBr H 2 S HI Design Inc. HNO 3 H 2 SO 4 H 2 CO 3 H 2 SiO 3 H 3 PO 4 Contents 1 Contents 2
Слайд 15
Классификация кислот по наличию в их составе кислорода Кислород- содержащие Бескислородные Кислоты
Слайд 16
По какому признаку кислоты разделены на группы? HF HCl HBr HI HNO 3 HClO 4 H 2 S H 2 SO 4 H 2 SO 3 H 2 CO 3 H 2 SiO 3 H 3 PO 4 H 3 BO 3 ? ? ?
Слайд 17
Одноосновные HCl, HNO 3 Двухосновные H 2 SO 4 ,H 2 SiO 3 Трехосновные H 3 PO 4 Классификация кислот по числу атомов водорода. Кислоты
Слайд 18
Работаем с тестом
Слайд 19
Страна Кислот раздел Физический (свойства)
Слайд 20
Физические свойства кислот По агрегатному состоянию: Газообразные ( HCl , H 2 S ) Жидкие ( HNO 3 , H 2 SO 4 ) Твердые ( H 3 PO 4 , H 2 SiO 3 ) Цвет кислот – ? Запах – ? Вкус – ?
Слайд 21
Кремниевая кислота H 2 SiO 3 Единственная нерастворимая кислота Она соответ-ствует кислот- ному оксиду — SiO 2
Слайд 22
Физкультминутка Л. Бетховен — К Элизе ( Fur Elise ) (1 часть).mp4
Слайд 23
Страна Кислот раздел Химический (свойства)
Слайд 24
ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Слайд 25
Химические свойства кислот. Кислоты… 1 ). Изменяют окраску индикатора; Взаимодействуют: 2). с металлами; 3). с основными оксидами; 4). с основаниями; 5). с солями.
Слайд 26
Взаимодействие с индикаторами Индикатор Нейтраль-ная среда Кислая среда Лакмус Фиолетовый Красный Фенол-фталеин Бесцветный Бесцветный Метиловый оранжевый Оранжевый Красный Помни! Нерастворимые кислоты не меняют окраску индикаторов.
Слайд 27
Взаимодействие с солями Взаимодействие кислот с солями.wmv
Слайд 28
Взаимодествие с солями
Слайд 29
Кислоты реагируют с солями, если образуется осадок или газ.
Слайд 30
2004 2005 2006 2007 Ме х О у Ме(ОН)х Ме
Слайд 31
Д/З § 37, у. 1, 3б, 4б, 5бг, 7 с. 165
Слайд 32
Спасибо за урок!
Открытый урок по химии 8 класс «Кислоты»
Изучение нового материала
В третью группу вы поместили пока что незнакомые вам вещества, которые относятся к классу кислот. Именно с веществами этого класса мы и будем знакомиться сегодня. Итак, тема нашего урока «Кислоты: состав, классификация и значение». Запишите тему урока в рабочую тетрадь. (Слайд 4).
? Что же нам необходимо знать о кислотах? (Состав, формулы, названия, классификации, значение, правила техники безопасности).
Многообразие кислот (Слайд 5).
План изучения кислот (Слайд 6).
Состав.
Классификация.
Номенклатура и соответствующие оксиды
Значение и применение.
Правила техники безопасности при работе с кислотами.
Состав кислот (Слайд 7).
Вы видите формулы трех кислот: хлороводородной НСl, серной Н2SО4 и фосфорной кислот Н3РО4. Что общего в их составе?
Да, это присутствие в их составе атомов водорода, с которого начинаются все три формулы. Остальная часть называется кислотным остатком.
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Классификация кислот
А) по наличию кислорода. (Слайд 8)
? Обратите внимание на отличия в кислотных остатках двух групп кислот на доске. В чем заключается это отличие?
Правильно, кислотные остатки серной, азотной, фосфорной и хлорной кислот содержат кислород, а кислотные остатки хлороводородной, бромоводородной, сероводородной и фтороводородной кислот кислорода не содержат.
Наличие кислорода или его отсутствие – один из признаков классификации кислот. По этому признаку кислоты подразделяют на две группы: бескислородные и кислородсодержащие. Приведите примеры бескислородных и кислородсодеражщих кислот из таблицы.
Б) Классификация кислот по основности. (Слайд 9).
? Посмотрите на формулы кислот на доске. Они распределены на три группы по определенному признаку. Как вы думаете, что это за признак?
Основность – число атомов водорода в кислоте.
Приведите примеры одноосновных, двухосновных и трехосновных кислот из таблицы.
По числу атомов водорода можно определить общий заряд кислотного остатка, который при растворении в воде образует отрицательно заряженный ион.
Водород при растворении образует положительно заряженный ион, заряд которого равен +1. Обозначение заряда иона имеет свои особенности.
В) Классификация кислот по растворимости в воде (Слайд 10).
Кстати, способности растворяться в воде – ещё один признак классификации кислот. По этому признаку все кислоты подразделяют на две группы: растворимые и нерастворимые. Давайте приведем примеры, используя таблицу растворимости.
Степень окисления элементов в кислотах и соответствующие кислотам оксиды. (Слайд 11).
+1 −1 +1 − 2 +1 х − 2 +5 − 2
НСl Н2S Н3РО4 → Р2О5 — фосфорная кислота
(+1) · 3 + х + (−2) · 4 = 0
х − 5 = 0
х = + 5
+1 + 3 − 2 +3 − 2
Н3РО3 → Р2О3 — фосфористая кислота
Определите оксиды, соответствующие кислотам. (Слайд 12).
Н2SО4 → SО3 НNО3 → N2О5
Н2SО3 → SО2 НNО2 → N2О3
Номенклатура кислот
Бескислородные кислоты:
К названию кислотообразующего элемента добавляют гласную «о»
и слова «водородная кислота»
HCl – хлороводородная кислота Н2S – сероводородная кислота
Кислородсодержащие кислоты:
К русскому названию кислотообразующего элемента добавляют суффикс:
Если элемент проявляет высшую СО (равную № группы)
+6
– «-н» и окончание «-ая»: H2SO4
серная кислота
Если СО элемента ниже высшей +4
– «-ист» и окончание «-ая»: H2SO3
сернистая кислота
Значение кислот в природе и жизни человека (Слайд 13-14).
Кислоты в природе
Кислоты в жизни человека
В организме человека
В кулинарии продуктах питания
В медицине
В народном хозяйстве
Кислотные дожди
Правила техники безопасности при работе с кислотами (Слайд 15-16).
В ХIХ веке в Германии жил и работал ученый Юстус Либих. Он был экспериментатором от Бога, с ранних лет с увлечением помогал отцу готовить лаки, краски и лекарства. Однажды на уроке греческого языка у Либиха взорвался ранец с гремучей ртутью. Отец, убедившись, что мальчик не создан для гимназии, отдал его в ученики аптекарю. Через несколько месяцев тринадцатилетний химик лучше учителя знал, как составлять лекарства. После очередного взрыва его выгнали, но занятий химией он не оставил и в возрасте 23 лет он стал профессором Гиссенского университета. Вот как описывает Карл Фогт – химик, работавший вместе с Либихом один случай. «Входит Либих, у него в руках склянка с притёртой пробкой. «Ну-ка, обнажите руку», — говорит он Фогту и влажной пробкой прикасается к руке. «Не правда, ли, жжёт? – невозмутимо спрашивает Либих. – Я только что добыл безводную муравьиную кислоту». Как вы думаете, правильно ли обращался Либих с кислотами?
(Нет. При работе с химическими веществами надо быть аккуратными: убрать волосы, закатать рукава одежды, наливать не более 1-2 мл растворов, держа банку этикеткой вверх.)
? Каким образом, не прибегая к экстремальным методам, можно определить кислоту?
Закрепление знаний
Лабораторный опыт
ИНСТРУКТИВНАЯ КАРТА:
Форма работы: парная.
Время работы – 8-10 минут.
Задание:
Исследовать окраску индикаторов в кислотных средах.
Оборудование и реактивы:
3 пробирки с соляной и 3 пробирки с лимонной кислотами, жидкие индикаторы: лакмус, фенолфталеин и метилоранж, стеклянные палочки.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1 группа: В пробирку с соляной кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Во 2-ю пробирку с соляной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
В 3-ю пробирку с соляной кислотой добавьте каплю лакмуса. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
2 группа: В пробирку с лимонной кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Во 2-ю пробирку с лимонной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
В 3-ю пробирку с лимонной кислотой добавьте каплю лакмуса. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Действие кислот на индикаторы
Обсуждение результатов и формулирование выводов:
? Какие индикаторы изменили свой цвет в кислотах? (Лакмус и метилоранж).
? Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах? (Да).
? Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной кислотах?
(Лакмус стал красным, а метилоранж — розовым).
На основании проведенных опытов сделаем выводы:
независимо от вида кислоты (органической или неорганической) индикаторы изменяют свой цвет одинаково; а это означает, что все кислоты обладают сходными свойствами.
? С чем же это связано? (С наличием атомов водорода).
При наличии времени. Задание на слайде 18
Подведение итогов. Рефлексия.
Подведение итогов урока. Выставление оценок.
Продолжите фразу
Сегодня на уроке я узнала…
Я научилась…
Мне было непонятно…
Для меня этот урок…
Интерес вызвало, то …
Затруднения возникли когда…
Домашнее задание. §20, с. 102-107, выучить формулы и названия кислот, задание 6 ( «Рабочий лист»), задание 1, с.107 (учебник).
План-конспект урока по химии (8 класс) на тему: Конспект урока химии в 8 классе по теме «Состав и классификация кислот»
ГУ «Средняя школа № 42»
Разработка открытого урока
по химии в 8 классе
«Кислоты. Состав и классификация»
учитель химии 1 категории
Кривошеева Наталья Александровна
г. Петропавловск, 2012 г.
Тема: Кислоты. Состав и классификация кислот.
Цель: ознакомление учащихся с новым классом неорганических соединений – кислотами.
Задачи: сформировать у учащихся понятие о кислотах, как о классе неорганических соединений; изучить состав, номенклатуру и классификацию кислот; закрепить умение составлять формулы кислот и давать им название; рассмотреть основные способы получения кислот.
Тип урока: Урок усвоения новых знаний.
Оборудование: интерактивное оборудование, презентация «Кислоты», тесты, карточки для самостоятельной работы, инструкции для лабораторной работы.
Оборудование и реактивы для учащихся: по три пробирки с растворами азотной, соляной, серной кислот; индикаторы: метилоранж, фенолфталеин, универсальный индикатор и сок краснокочанной капусты; пипетки, штатив, стакан с водой.
Ход урока:
1. Организационный момент.
Проверка посещаемости, готовности к уроку.
2. Подготовка учащихся к усвоению новых знаний.
Посмотрите на иллюстрации, представленные на экране. Как видите, здесь есть представители растений, животных и даже лекарственных средств. А что же между ними общего? Как вы думаете?
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку– яблочная кислота, скисшему молоку–молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Итак, предмет нашего изучения сегодня это … – Кислоты
Что вы знаете о кислотах? (учащиеся отвечают, опираясь на свой жизненный опыт)
Что бы вы хотели узнать о кислотах? – Состав, строение, свойства, названия, их представителей…
Откройте тетради, запишите тему урока: “Кислоты, состав и классификация кислот».
Что мы сегодня на уроке должны сделать?
Итак, цель нашего урока:
- Изучение нового класса неорганических соединений-кислот.
Задачи:
- Изучить состав кислот, классификацию и способы получения;
- Совершенствовать навыки экспериментальной работы.
Новые понятия: кислота, кислотный остаток, индикатор.
3. Изучение нового материала.
1. Определение кислот.
Итак, водород входит в состав многих химических веществ, в том числе и органических. Сегодня мы познакомимся с классом неорганических соединений, в состав которых также входит водород. Это кислоты. Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего, необходимо знать их состав, строение и свойства.
Кислоты – это сложные соединения, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
При химических реакциях кислотный остаток обычно сохраняется и переходит из одних веществ в другие без изменения. На предыдущих уроке, при изучении способов получения водорода мы знакомились с реакциями взаимодействия соляной кислоты с металлами.
? Составьте уравнение взаимодействия соляной кислоты с алюминием.
2Al + 6HCl → 2AlCl3 +3h3
Кроме соляной кислоты существует еще несколько кислот, с которыми мы сегодня познакомимся.
Учитель демонстрирует на столе кислоты,
Соляная, серная, ортофосфорная, азотная, уксусная. Большинство кислот – растворимы, но есть и исключения – кремниевая кислота. Эти кислоты получены искусственным путем. Их получают в результате различных реакций на химических заводах и в лабораториях. Их получают в концентрированном виде, но для эксперимента чаще требуются растворы кислот. Какое правило нужно знать и соблюдать при разбавлении кислот?
Чтобы не было беды, в кислоту не лей воды!
В природе также встречается много кислот. Муравей при укусе впрыскивает в ранку яд, содержащий муравьиную кислоту. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты. Органические кислоты входят в состав различных фруктов.
Назовите кислоты, которые вам известны и где вы их применяли? Яблочная, уксусная, лимонная, щавелевая, муравьиная, угольная, ацетилсалициловая, аскорбиновая и многие другие. (элементы ЛОО)
2. Индикаторы.
Все кислоты имеют общий признак. Какой? (кислый)
Однако в лаборатории мы не можем вещества пробовать на вкус, а для того чтобы определить кислоты можно использовать специальные вещества – индикаторы.
Индикаторы – это вещества, изменяющие свой цвет в растворах кислот и щелочей.
Рассмотрим некоторые из них:
Индикатор | Нейтральная среда | Кислая среда |
Лакмус | Фиолетовый | Красный |
Фенолфталеин | Бесцветный | Бесцветный |
Метиловый оранжевый | Оранжевый | Красный |
Универсальный индикатор | Желто-зеленый | Красный |
Кроме того в природе существуют и натуральные индикаторы и один из них мы будем использовать в лабораторном опыте – сок краснокочанной капусты. Им мы заменим индикатор лакмус.
Перед проведением лабораторного опыта познакомимся с правилами ТБ при работе с кислотами.
- Кислота – едкое вещество! Разрушает и раздражает кожу, слизистые оболочки.
- Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Лабораторный опыт
Действие индикатора на кислоты
Цель опыта: выявить на практике результат действия индикаторов на кислоты.
Ход опыта:
В трех пробирках дан раствор соляной кислоты (серной или азотной – для других групп).
С помощью пипетки нанесите 1 каплю раствора кислоты на универсальный индикатор. Затем, промыв пипетку, внесите в первую пробирку каплю сока капусты; во вторую – каплю фенолфталеина; в третью – каплю метилоранжа. Что произошло?
Задание: Сделайте вывод: с помощью каких индикаторов можно определить кислоту? Запишите вывод в тетрадь.
3. Классификация кислот.
Задание: По какому признаку кислоты разделены на группы?
HF — фтороводородная
HCl — хлороводородная
HBr — бромоводородная
HI — йодоводородная
h3S — сероводородная
HNO3 — азотная
h3SO4 — серная
h3CO3 — угольная
h3SiO3- кремниевая
h4PO4 — фосфорная
Действительно, все кислоты можно разделить на бескислородные и кислородсодержащие.
Какое отличие в следующих группах вы можете увидеть? …разное число атомов водорода.
HF — фтороводородная
HCl — хлороводородная
HBr — бромоводородная
HNO3 — азотная
h3S — сероводородная
h3SO4 — серная
h3CO3 — угольная
h3SiO3 — кремниевая
h4PO4 — фосфорная
h4BO3 — борная
Число атомов водорода определяет основность кислоты. Таким образом, по числу атомов водорода (основности) различают одноосновные, двухосновные, трехосновные кислоты. По количеству атомов водорода можно определеить валентность кислотного остатка. Знание валентности кислотного остатка нам пригодится при составлении молекул солей.
Записывают классификацию кислот, приводят примеры, пользуясь таблицей в учебнике на стр. 90.
Кислоты | |
Бескислородные | Кислородсодержащие |
Одноосновные-HCl, HBr, HI. Двухосновная — h3S | Одноосновная – HNO3, Двухосновная — h3SO4, Трехосновные — h4PO4. |
4. Номенклатура кислот.
Названия кислот образуются их сочетания двух слов: названия элемента, образующего кислотный остаток и водород; или от названия элемента (в кислородсодержащих кислотах).
5. Получение кислот.
Кислоты можно получить различными способами, в зависимости от состава и силы кислоты:
Кислоты
бескислородные кислородсодержащие
водород + неметалл вода + оксид неметалла
h3 + Cl2 → 2HCl h3O + SO2 → h3SO3
соль + сильная кислота
NaCl + h3SO4→ NaHSO4 + HCl↑
Объяснение материала сопровождается показом видеоматериала (ссылки рядом с уравнениями реакций).
5. Проверка понимания изученного материала.
Итак, подведем итоги и проверим, что вы усвоили.
Дополните выражение:
Кислоты – это _______ вещества, состоящие из атомов __________ , способных замещаться на атомы _________ и _________ ___________.
Валентность кислотного остатка равна количеству атомов ____________.
Вещества, изменяющие свою окраску в кислотах и щелочах, называются __________.
В кислой среде метиловый оранжевый, лакмус и универсальный индикатор окрашиваются в __________ цвет.
6. Закрепление.
1. Найдите «лишнее» вещество в каждом ряду. Поясните.
1. HNO3, HCl, h4PO4,
2 h3SiO3, HBr, HI,
3 h3SO4, h3S, h4BO3,.
2. Приведенные на рисунке формулы кислот распределите в следующем порядке:
- Кислородсодержащие;
- Бескислородные;
- Одноосновные;
- Двухосновные;
- Трехосновные.
Самостоятельная работа на 5 минут (дифференцированные задания).
Уровень «А»
- Дан текст, в котором «спрятаны» формулы кислот. Выпишите их и дайте им название.
h3OSOHBrNa2SО3MgBah3CO3SO4KOH
HClBaSHKSHh3Na2Oh3SКNaClh3SO4
Уровень «В»
2. Назовите кислоты и дайте им характеристику по плану:
- Название
- Наличие кислорода
- Основность
- Растворимость
1 вариант — h3SО4 2 вариант – HNO3
Уровень «С»
3. Составьте уравнение получения кислот, укажите тип реакции и назовите вещества. В формуле кислоты укажите валентность кислотного остатка, определите ее основность.
1 вариант – соляная; 2 вариант – сероводородная.
Если позволит время, проводится проверка выполненной работы после сдачи листков.
7. Домашнее задание и инструктаж по его выполнению.
§33, № 1-5 (устно), № 8 (письменно). Выучить состав, названия всех кислот, валентности кислотных остатков.
Рефлексия. (элементы ЛОО)
- Что нового узнали на уроке?
- Что было особенно интересно?
- В чем возникали трудности?
- Где вам могут пригодиться знания, полученные сегодня на уроке?
- С каким настроением вы заканчиваете урок? Выбрать смайлики:
хорошее безразличное грустное
объясните тему кислоты, 8 класс химия
Слова «кислота» и«кислый» не зря имеют общий корень. Растворы всех кислот на вкус кислые.
Это не означает, что раствор любой кислоты можно пробовать на язык –
среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как
уксусная (содержится в столовом уксусе) , яблочная, лимонная,
аскорбиновая (витамин С) , щавелевая и некоторые другие (эти кислоты
содержатся в растениях) знакомы вам именно своим кислым вкусом.
Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение: Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
h3SO4 серная кислота
h3SO3 сернистая кислота
HNO3 азотная кислота
h4PO4 фосфорная кислота
h3CO3 угольная кислота
h3SiO3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота)
HBr бромоводородная кислота
HI иодоводородная кислота
h3S сероводородная кислота
Классификация кислот по числу атомов водорода
Одноосновные HNO3 азотная
Двухосновные h3SO4 серная
Трехосновные h4PO4 фосфорная
Классификация кислот по составу.
Не содержат кислород
HF фтороводородная
h3S сероводородная
HCl хлороводородная
HBr бромоводородная
HI иодоводородная
Кислородсодержащие
h3SO4 серная
h3SO3 сернистая
h3S сероводородная
h3CO3 угольная
h3SiO3 кремниевая
h4PO4 фосфорная
Термин
«одноосновная кислота» возник потому, что для нейтрализации одной
молекулы такой кислоты требуется «одно основание», т. е. одна молекула
какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + h3O
HCl + KOH = KCl + h3O
Двухосновная кислота требует для своей нейтрализации уже «два основания», а трехосновная – «три основания»:
h3SO4 + 2 NaOH = Na2SO4 + 2 h3O
h4PO4 + 3 NaOH = Na3PO4 + 3 h3O
Свойства кислот определяются тем, что они способны заменять в своих молекулах