Классификация органических веществ
Существует несколько критериев классификации органических соединений.
Классификация по составу. Согласно этой классификации все органические вещества делятся на: углеводороды, которые состоят только из атомов углерода и водорода, кислородсодержащие соединения, которые состоят не только из атомов углерода и водорода, но и ещё и из кислорода. Азотсодержащие соединения содержат кроме углерода и водорода ещё и атом азота.
Однако эта классификация является не точной, потому что в одну группу могут попадать вещества, имеющие совершенно разные свойства. Например, диметиловый эфир, как и этанол, является кислородсодержащим соединением, но диметиловый эфир является простым эфиром и представляет собой газ, а этанол относится к классу спиртов и представляет собой жидкость.
Поэтому более совершенной классификацией является классификация по
строению.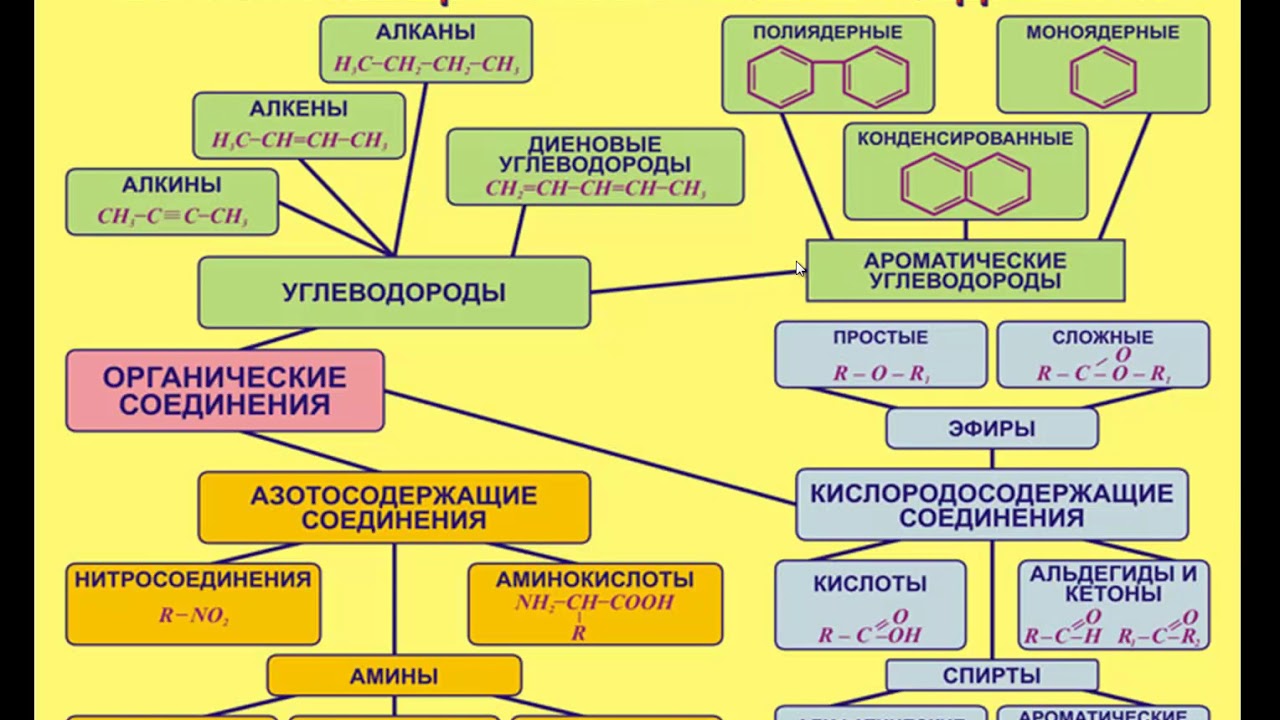
В состав молекул, кроме атомов углерода и водорода, могут входить атомы O, S, N. Поэтому по наличию или отсутствию гетероатомов различают скелет молекулы углеродный и гетероатомный. Так в молекуле этанола скелет считается углеродным, потому что атом кислорода не включён в скелет молекулы, а в молекуле диметилового эфира атом кислорода включён в скелет молекулы, поэтому его скелет считается гетероатомным.
Скелет молекулы может быть неразветвлённым, когда все атомы углерода соеденены последовательно, как в молекуле бутана, а также разветвлённым, как в молекуле изобутана.
Цепь из атомов углерода может быть замкнутой, тогда эту систему называют циклом,
или цепь может быть незамкнутой, тогда такую молекулу называют ациклической
(алифатической).
Циклические соединения бывают карбоциклическими и гетероциклическими. Карбоциклические соединения делят на алициклические (например циклогексан) и ароматические (бензол). Гетероциклические соединения в цикле вместо атомов углерода содержат атом или несколько атомов других элементов. К таким соединениям относят пиридин, пиримидин, фуран.
В углеродном скелете различают первичный, вторичный, третичный и четвертичный атомы углерода. Первичным называют атом углерода, который связан только с одним другим атомом углерода, вторичный атом углерода всегда связан с двумя другими атомами углерода, третичный – с тремя другими атомами углерода, а четвертичный – с четырьмя другими атомами углерода.
Ещё одним признаком классификации является наличие (или отсутствие) в
молекуле кратных связей и бензольных колец.
Алифатические соединения не содержат бензольных
колец, их иногда ещё называют соединениями жирного ряда. Но от того содержат
они кратные связи или нет их подразделяют на предельные, или насыщенные,
и на непредельные, или ненасыщенные. Предельные, или насыщенные
соединения содержат только простые (одинарные) связи, а непредельные, или
ненасыщенные содержат кроме простых ещё и кратные связи – двойные или тройные.
Ароматические соединения содержат бензольное кольцо.
К насыщенным углеводородам относят алканы и циклоалканы. К углеводородам, имеющим кратные связи,
относят алкены, алкины и
диены.
Но от того содержат
они кратные связи или нет их подразделяют на предельные, или насыщенные,
и на непредельные, или ненасыщенные. Предельные, или насыщенные
соединения содержат только простые (одинарные) связи, а непредельные, или
ненасыщенные содержат кроме простых ещё и кратные связи – двойные или тройные.
Ароматические соединения содержат бензольное кольцо.
К насыщенным углеводородам относят алканы и циклоалканы. К углеводородам, имеющим кратные связи,
относят алкены, алкины и
диены.
Есть ещё и классификация соединений по наличию (или отсутствию)
функциональных групп. Есть вещества, которые не содержат функциональных групп,
а есть вещества, которые содержат одну или несколько функциональных групп. Если
в составе молекулы одна функциональная группа, то это соединение относится к
монофункциональным соединениям. Например, этанол – это монофункциональное
соединение, потому что содержит только одну группу ОН. Полифункциональные
соединения содержат несколько одинаковых групп, например
глицерин – трёхатомный спирт, является полифункциональным соединением, потому
что содержит три одинаковые группы – ОН. Гетерофукциональные
соединения содержат разные функциональные группы. Например, аминоуксусная
кислота содержит две различные функциональные группы – аминогруппу и
карбоксильную группу.
Полифункциональные
соединения содержат несколько одинаковых групп, например
глицерин – трёхатомный спирт, является полифункциональным соединением, потому
что содержит три одинаковые группы – ОН. Гетерофукциональные
соединения содержат разные функциональные группы. Например, аминоуксусная
кислота содержит две различные функциональные группы – аминогруппу и
карбоксильную группу.
Рассмотрим соединения, имеющие функциональные группы. Спирты содержат гидроксильную группу, как и фенолы, альдегиды – альдегидную, карбоновые кислоты — карбоксильную, амины содержат аминогруппу, а аминокислоты – амино- и карбоксильную группы.
Классификация органических соединений(10 класс УМК Рудзитис)
Танатаров А.Т.
Светлинский район Оренбургская область
Название предмета: «Химия».
Класс: 10
УМК: Химия. 10 класс: учеб. для общеобразоват. организаций: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 2-е издание – М.: Просвещение, 2016. – 224 с.:ил. – ISBN 978-5-09-041198-1.
10 класс: учеб. для общеобразоват. организаций: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 2-е издание – М.: Просвещение, 2016. – 224 с.:ил. – ISBN 978-5-09-041198-1.
Уровень обучения: базовый.
Тема урока: Классификация органических соединений
Общее количество часов, отведённое на изучение темы: 4
Место урока в системе уроков по теме: данный урок является завершающим в теме теоретические основы органической химии. На данном уроке обучающиеся узнают два способа классификации органических веществ. Учатся решать задачи на вывод формул по массовым долям элемента.
Цель урока: Сформировать общие представления о классификации органических соединений, рассмотреть основные признаки их классификации.
Задачи урока:
Образовательные: изучить способы классификации органических веществ. Научиться решать задачи на вывод формулы по массовым долям элемента.
Научиться решать задачи на вывод формулы по массовым долям элемента.
Развивающие: закрепить навыки определения класса органических веществ. Продолжать формировать умения наблюдать, сравнивать, делать выводы на основе полученных знаний. Развивать абстрактное мышление.
Воспитательные: способствовать развитию навыков самостоятельного поиска знаний, формированию активной познавательной позиции; воспитание патриотизма и любви к Родине. Знакомство с жизнью и деятельностью ученых с целью интернационального воспитания.
Планируемые результаты:
Знать принципы классификации органических веществ, определение функциональной группы;
Уметь по структурным формулам органических веществ определять принадлежность вещества к конкретному классу органических соединений.
Техническое обеспечение урока: набор щаростержневых моделей атомов, информационная таблица «Классификация органических соединений по структуре углеродного скелета», информационная таблица «Функциональные группы и соответствующие им классы органических соединений».
Содержание урока
I. Организационный этап
II. Проверка и оценка знаний. Актуализация знаний.
Визуальная проверка наличия выполненного письменного домашнего занятия.
Вопросы для контроля:
1) Записать на доске электронно-графические формулы атома углерода в обычном и возбужденном состоянии.
2) Определить число σ и π связей в молекуле
3) Рассказать о способах перекрывания ЭО
4) Что такое σ и π связь
5) Рассказать о видах гибридизации по таблице у доски
6) Собрать шаростержневые модели молекул, в которых атомы углерода находятся в состоянии sp3, sp2 и sp-гибридизации.
III. Постановка целей и задач урока.
Учитель сообщает тему урока и вместе с учениками формулирует цель и задачи на урок. После чего переходит к объяснению нового материала.
После чего переходит к объяснению нового материала.
IV. Изучение нового материала
В природе существуют несколько миллионов органических соединений. Каждый год создаются все новые и новые органические вещества. Чтобы разобраться в огромном количестве органических соединений, необходимо их классифицировать. Существуют разные способы классификации органических соединений. Мы будем рассматривать два способа классификации: первый — по характеру углеродной цепи, второй – по функциональной группе (работа с учебником схема 1 и схема 2 с 23-24).
Последовательность химически связанных атомов углерода в молекуле составляет ее углеродный скелет. Это основа органического соединения. Поэтому первым признаком классификации органического соединения служит классификация по строению углеродного скелета (схема 1 с 23, учитель демонстрирует по таблице возле доски).
По характеру углеродного скелета органического соединения вещества можно разделить на открытые или ациклические (приставка а- обозначает отрицание, т. е. это незамкнутые цепи) и циклические в них углеродная цепь замкнута в цикл.
е. это незамкнутые цепи) и циклические в них углеродная цепь замкнута в цикл.
Органические соединения можно подразделять также по кратности связи. Соединения, содержащие только одинарные связи С-С, называются насыщенными или предельными. Соединения со связями С=С или С≡С называются ненасыщенными или непредельными (схема 1, учитель демонстрирует по таблице возле доски).
Циклические соединения – это соединения, в которых углеродные атомы образуют цикл или замкнутую цепь. Циклические соединения делятся на две большие группы: карбоциклические и гетероциклические. Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов (греч. heteros — другой) – O, S, N.
Закрепляем новый материал выполнением следующего задания: используя схему классификации, определить к какому классу относятся представленные соединения.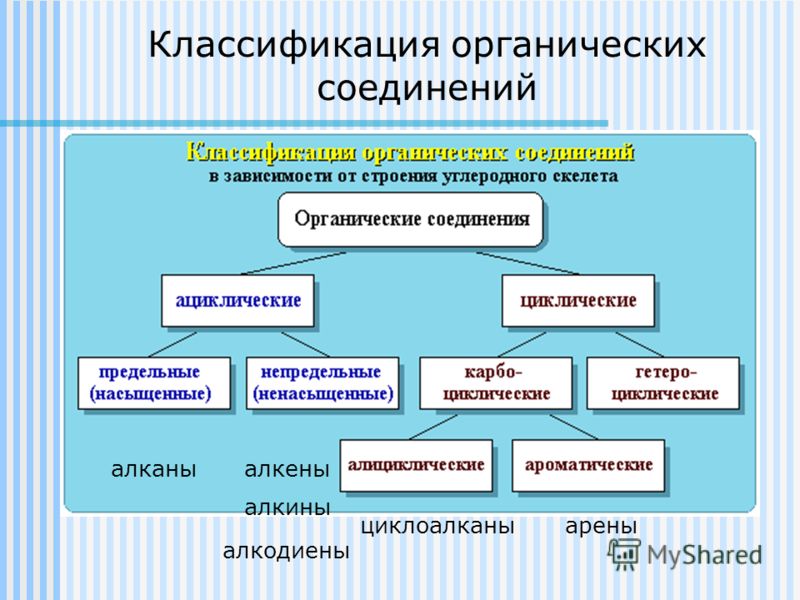 Учитель записывает на доске.
Учитель записывает на доске.
CH2=CH–CH3CH3–CH3CH2= CH–CH=CH2
Рассматриваем второй способ классификации органических соединений, по наличию функциональных групп. Формулируем определение функциональной группы, как группы атомов, определяющей химические свойства соединения и принадлежность его к определенному классу органических соединений. Функциональная группа является основным признаком, по которому органические соединения относят к определенному классу (схема 2 с. 24, учитель рассказывает по таблице возле доски).
К ациклическим соединениям кроме углеводородов, относятся вещества содержащие разнообразные функциональные группы. Главный критерий, по которому вещества относят к ациклическим соединениям – это наличие незамкнутой цепи углеродных атомов. Рассматриваем более подробно классы кислородосодержащих органических соединений.
Решение задач по массовым долям элемента.
Решение таких задач состоит из двух частей:
1) сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава соотношение количеств веществ и соответствует соотношению числа их атомов в молекуле:
2) затем, используя молярную массу вещества, определяют его истинную формулу.
Пример 1.
Определить формулу вещества, если оно содержит и и имеет относительную плотность по воздуху, равную .
Решение примера 1.
Пусть масса вещества равна 100 г. Тогда масса будет равна 84,21 г, а масса Н 15,79 г.
Найдём количество вещества каждого атома:
моль,
моль.
Определяем мольное соотношение атомов и :
(сократим оба числа на меньшее) (домножим на )
Таким образом, простейшая формула .
По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле г/моль, это в раза меньше истинно молярной массы.
Значит, истинная формула .
V. Закрепление материала
Ученик решает задачу 1 из Задачника с «помощником» 10-11 класс.
Ответ: С4Н10.
VI. Домашнее задание
§ 6, в 1-5 (в 5 письменно), задачи из Задачника с «помощником» 10-11 класс № 2, 7
Рефлексия
Что узнали нового?
Что понравилось на уроке?
Какое настроение?
Разработка урока «Классификация и номенклатура органических соединений» (10 класс)
Шудраков Николай Николаевич
Методическая разработка урока
Химия 10 класс
Тема: «Классификация и номенклатура органических соединений»
Цель урока: познакомить учащихся с общей классификацией органических соединений. Рассмотреть классификацию органических веществ по характеру углеродного скелета и классификацию по функциональной группе. Познакомить с номенклатурой органических веществ.
Рассмотреть классификацию органических веществ по характеру углеродного скелета и классификацию по функциональной группе. Познакомить с номенклатурой органических веществ.
Оборудование: компьютер, мультимедийный проектор, презентация.
Тип урока: комбинированный
Ход урока
I. Организационный момент.
II. Классификация органических соединений.
В природе существуют несколько миллионов органических соединений. Каждый год создаются все новые и новые органические вещества. Чтобы разобраться в огромном количестве органических соединений, необходимо их классифицировать. Существуют разные способы классификации органических соединений. Мы будем рассматривать два способа классификации: первый — по характеру углеродной цепи, второй – по функциональной группе. (Слайд 2)
Последовательность химически связанных атомов углерода в молекуле составляет ее углеродный скелет. Это основа органического соединения. Поэтому первым признаком классификации органического соединения служит классификация по строению углеродного скелета. (Слайд 3)
Это основа органического соединения. Поэтому первым признаком классификации органического соединения служит классификация по строению углеродного скелета. (Слайд 3)
По характеру углеродного скелета органического соединения вещества можно разделить на открытые или ациклические (приставка а- обозначает отрицание, т.е. это незамкнутые цепи) и циклические в них углеродная цепь замкнута в цикл. (Слайд 4)
Углеродный скелет может быть также неразветвленным или разветвленным. (Слайд 5)
Органические соединения можно подразделять также по кратности связи. Соединения, содержащие только одинарные связи С-С, называются насыщенными или предельными. Соединения со связями С=С или СС называются ненасыщенными или непредельными. (Слайд 6)
Циклические соединения – это соединения, в которых углеродные атомы образуют цикл или замкнутую цепь. Циклические соединения делятся на две большие группы: карбоциклические и гетероциклические. Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов ( греч. heteros — другой) – O, S, N. (Слайд 7)
Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов ( греч. heteros — другой) – O, S, N. (Слайд 7)
Закрепляем новый материал выполнением следующего задания №1: используя схему классификации, определить к какому классу относятся представленные соединения. (Слайд 8)
Рассматриваем второй способ классификации органических соединений, по наличию функциональных групп. Формулируем определение функциональной группы, как группы атомов, определяющей химические свойства соединения и принадлежность его к определенному классу органических соединений. Функциональная группа является основным признаком, по которому органические соединения относят к определенному классу. (Слайд 9,10)
Ставим перед учениками задачу: рассмотреть основные классы органических соединений с точки зрения наличия кратных связей. Рассматриваем более подробно классы органических соединений, относящихся к группе ациклических соединений это классы алканов, алкенов, алкинов и алкадиенов. (Слайд 11)
Рассматриваем более подробно классы органических соединений, относящихся к группе ациклических соединений это классы алканов, алкенов, алкинов и алкадиенов. (Слайд 11)
К ациклическим соединениям кроме углеводородов, относятся вещества содержащие разнообразные функциональные группы. Главный критерий, по которому вещества относят к ациклическим соединениям – это наличие незамкнутой цепи углеродных атомов. Рассматриваем более подробно классы кислородосодержащих органических соединений.Слайд 12
Закрепляем изученный материал. Определить к какому классу относятся соединения? (Слайд 13)
Что обозначает термин «номенклатура»? (Слайд 14) Переходя от простого к сложному, мы будем рассматривать принципы составления названий органических соединений важнейших классов, включая ациклические и циклические углеводороды, гетероциклические соединения.
Первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие. Это тривиальная (историческая) номенклатура.
Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие. Это тривиальная (историческая) номенклатура.
Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
В настоящее время для точного обозначения состава и строения органических соединений используют рациональную и систематическую номенклатуры.
Мы рассмотрим с вами основные принципы систематической номенклатуры. Международный союз теоретической и прикладной химии (ИЮПАК) (IUPAC) рекомендовал для использования номенклатуру, получившую название номенклатура ИЮПАК. Следует отметить, что эти правила крайне сложны даже для специалиста. Номенклатура ещё не «устоялась» и в неё постоянно вносятся изменения.
Номенклатура ещё не «устоялась» и в неё постоянно вносятся изменения.
Номенклатура ИЮПАК составлена по заместительному принципу. Представляется, что структурная формула состоит из основной цепи и заместителей.
При этом название состоит из следующих блоков (слайд 15):
Ключевым моментом в составлении названия является выбор основной цепи.
Алгоритм выбора основной цепи (слайд 16):
1) В основную цепь должна входить старшая характеристическая группа,
2) В нее должны максимально быть включены кратные связи,
3) Основная цепь должна быть максимально длинной,
4) Выбирают самую разветвленную цепь.
4) Цепь нумеруется так, чтобы сумма номеров заместителей была наименьшей.
Правило с меньшим номером имеет приоритет над правилом с большим номером.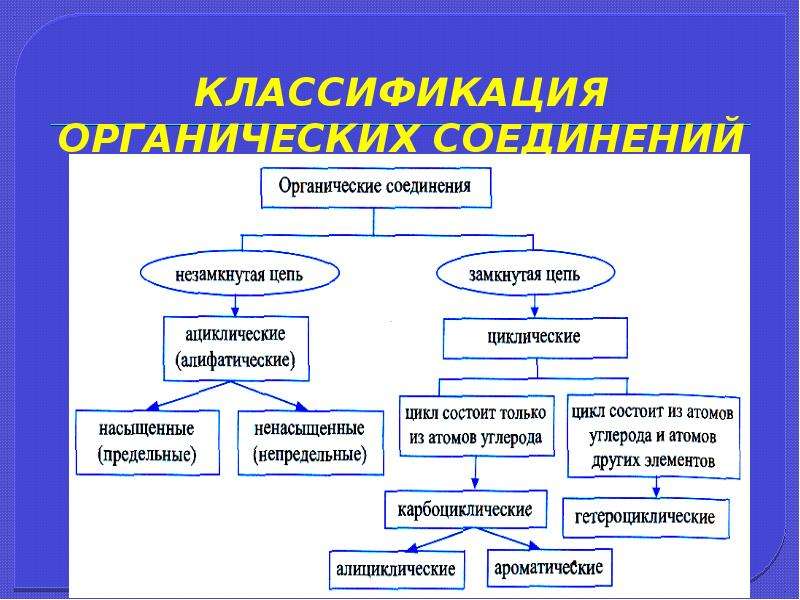
Чтобы уметь пользоваться этой номенклатурой, нужно хорошо знать названия первых представителей гомологического ряда алканов и несколько простейших радикалов. (Слайд 17)
Органические соединения рассматривают как продукты замещения части атомов водорода в главной углеродной цепи (родоночальная структура) на различные характеристические группы.
Названия неразветвленных алканов
Значение n в формуле
Cnh3n+2 Название вещества Молекулярная формула
1 Метан СН4
2 Этан С2Н6
3 Пропан С3Н8
4 Бутан С4Н10
5 Пентан С5Н12
6 Гексан С6Н14
7 Гептан С7Н16
8 Октан С8Н18
9 Нонан С9Н20
10 Декан С10Н22
К данной структуре названия можно обращаться каждый раз при изучении номенклатуры конкретного класса веществ, а для начала, принципы номенклатуры разбирают на примере названий предельных углеводородов.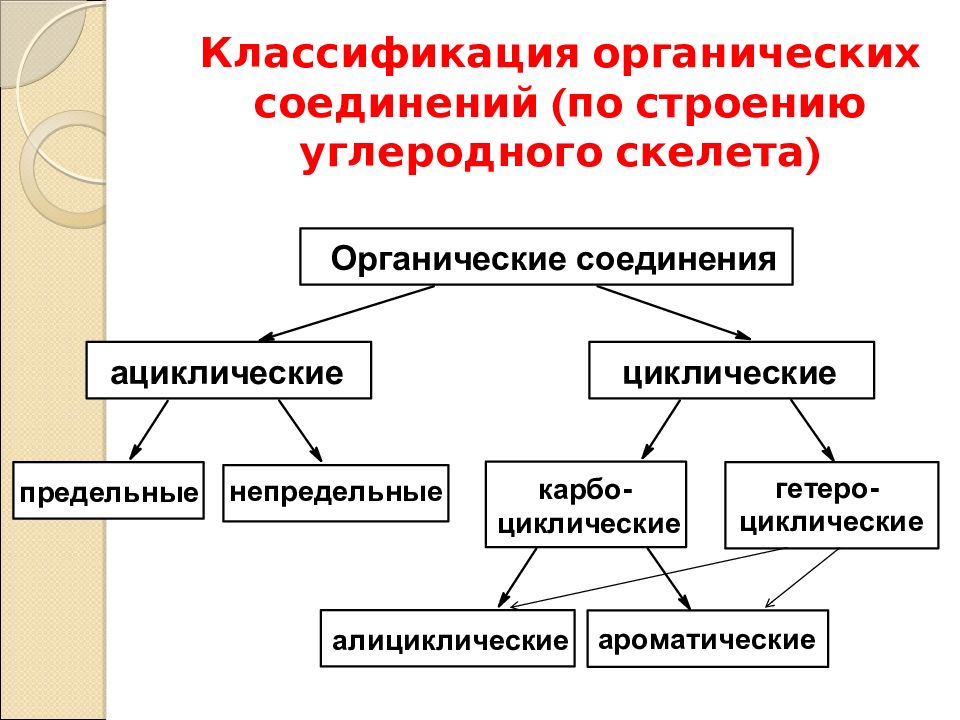
Для предельных углеводородов можно предложить следующий алгоритм составления названий:
1. В структурной формуле выбирают основную цепь. Для алканов такая цепь содержит максимально возможное число атомов углерода. Если существует несколько цепей максимальной длины, то выбирают самую разветвленную из них.
2. Основную цепь нумеруют так, чтобы углеводородные заместители (боковые цепи) получили наименьшие номера.
3. Перечисляют заместители с их номерами в алфавитном порядке, затем записывают корень названия, отвечающий числу атомов углерода в основной цепи и добавляют суффикс -ан.
4. Если в молекуле несколько одинаковых боковых цепей, то употребляют приставку, обозначающую их число ( ди -, три- , тетра-, пента-, гекса — и т.д.). Числа в названиях отделяют дефисами, между числами ставятся запятые. (Слайд 18, 19)
Закрепление новых знаний через самостоятельную работу по определению названий органических веществ и составлению формул. (Слайд 20)
(Слайд 20)
III. Рефлексия.
Список использованной литературы:
Учебник Химия 10 класс О.С. Габриелян
Поурочные разработки по химии М.Ю. Горковенко
festival.1september.ru/articles/586588/
www.xumuk.ru/rhf/
festival.1september.ru/articles/630735
Классификация органических соединений — ХИМИЯ. Просто.Доступно.Наглядно.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ В ЗАВИСИМОСТИ ОТ СТРОЕНИЯ УГЛЕРОДНОЙ ЦЕПИ
Огромное разнообразие существующих сегодня органических веществ, а также потребность в синтезе новых соединений с заданными свойствами приводит к необходимости постоянного совершенствования и расширения системы классификации (систематизации). Органические вещества можно рассматривать как некий «пазл», в котором составные части должны идеально подходить друг к другу и к основе. Основой органического вещества является углеродный скелет, а составные части — это функциональные группы, гетероатомы, кратные связи. Классификация также необходима для того, чтобы правильно называть соединения, причем называть так, чтобы все химики понимали, о каком веществе идет речь. Поэтому классификация лежит в основе Международной номенклатуры органических соединений.
Основой органического вещества является углеродный скелет, а составные части — это функциональные группы, гетероатомы, кратные связи. Классификация также необходима для того, чтобы правильно называть соединения, причем называть так, чтобы все химики понимали, о каком веществе идет речь. Поэтому классификация лежит в основе Международной номенклатуры органических соединений.
В основе классификации органических веществ можно выделить несколько основных подходов:
- Строение углеводородной цепи: замкнутые (циклические) и разомкнутые; линейные и разветвленные УВ.
- Наличие кратных связей: насыщенные или предельные (только одинарные связи) и ненасыщенные или непредельные (двойные и тройные связи) УВ.
- Наличие функциональных групп и замещающих атомов: кислородсодержащие, азотсодержащие, галлоидзамещенные УВ.
- Наличие гетероатома (N, O, S в структуре цикла): гетероциклические УВ.
- Биологическое (природное) происхождение: белки, жиры, углеводы, нуклеиновые кислоты, гормоны, витамины.

- Наличие в структуре соединений помимо C, H, N, O и S, других химических элементов, в том числе металлов: элементорганические (металлорганические) соединения.
Схема классификации в зависимости от строения углеродной цепи приведена на рисунке.
Некоторые соединения могут быть одновременно отнесены к нескольким классам. Например, 2-амино-1-гидрокси-4-нитробензол содержит сразу три функциональные группы, позволяющие отнести его к карбоциклическим (в основе лежит бензол), азотсодержащим (амино- и нитрогруппы) и кислородсодержащим (гидроксильная группа) соединениям.
ПОНЯТИЕ О ФУНКЦИОНАЛЬНОЙ ГРУППЕ
ОПРЕДЕЛЕНИЕ
Функциональная группа — это совокупность атомов, определяющая характерные химические свойства целого класса веществ.
Иногда к понятию функциональной группы относят также понятие радикал (метил, этил, пропил и т. д.). Однако хотя это и близкие понятия, но отличительным свойством функциональной группы является наличие одинаковых химических свойств, характерных для всего класса веществ, имеющих такую группу в своей структуре. С этой точки зрения алкильные радикалы такими свойствами не обладают.
С этой точки зрения алкильные радикалы такими свойствами не обладают.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ ПО ТИПУ ФУНКЦИОНАЛЬНОЙ ГРУППЫ
По типу функциональных групп органические соединения делят на следующие классы (R-предельный углеводородный радикал):
Материал для проведения 1 урока по теме «Классификация органических соединений (углеводороды)»
Классификация органических соединений. Номенклатура
Задание №1. В чем уникальность атома углерода? Почему органических соединений так много на планете?
Задание №2. Что такое углеводородный скелет молекулы органического соединения?
Заполните таблицу:
Классификация органических соединений по строению углеводородного скелета
Алифатические соединения | Циклические соединения | Гетероциклические соединения |
ПРИМЕРЫ СОЕДИНЕНИЙ: | ||
Дополните схему:
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Ароматические
Предельные
Циклические
Задание №3. Что такое брутто-формула вещества?
Что такое брутто-формула вещества?
Чем структурная формула отличается от брутто-формулы?
Чем отличается подробная структурная формула вещества от сокращенной?
Задание №4. Какие вещества называются гомологами? Что такое гомологическая разность? Как её вычислить?
Задание №5. Какие вещества называются изомерами? Какие типы изомерии Вы знаете?
Задание №6. Заполните пропуски в таблице?
Классификация органических соединений. Углеводороды
Наименование класса | Общая формула | Суффикс и префикс | Существенное отличие | Пример. Название |
АЛКАНЫ | Все связи одинарные | |||
ЕН | C5h20 Пентен | |||
Циклическая структура | С6Н12 Циклогексан | |||
Одна тройная связь | ||||
АЛКАДИЕНЫ | ||||
— | Ароматическое кольцо | С6Н5-СН3 Толуол |
Задание №7. Изобразите в пространстве следующие вещества? (в рабочей тетради). Назовите приведенные вещества.
Изобразите в пространстве следующие вещества? (в рабочей тетради). Назовите приведенные вещества.
Задание №8. Что такое номенклатура ИЮПАК? Какие еще номенклатуры существуют? Назовите следующие соединения по международной номенклатуре?
Формула соединения | Наименование соединения |
Задание №9. По названиям соединений напишите их структурные формулы:
Наименование соединения | Формула соединения |
2,3-диметилпентен-1 |
Классификация органических реакций.
 Классификация органических соединений
Классификация органических соединенийДанный урок познакомит вас с темой «Классификация органических реакций и соединений». Будут систематизированы знания учащихся об органических веществах, определены критерии классификации органических соединений и реакций. Вы узнаете о составлении схемы классификации органических веществ, что такое скелет молекул, как классифицируют вещества по классам и функциональным группам.
I. Классификация органических реакций
1. Классификация по механизму реакции
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции.
1. Гомолитические (радикальные) реакции
Например, галогенирование алканов (реакция цепная)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.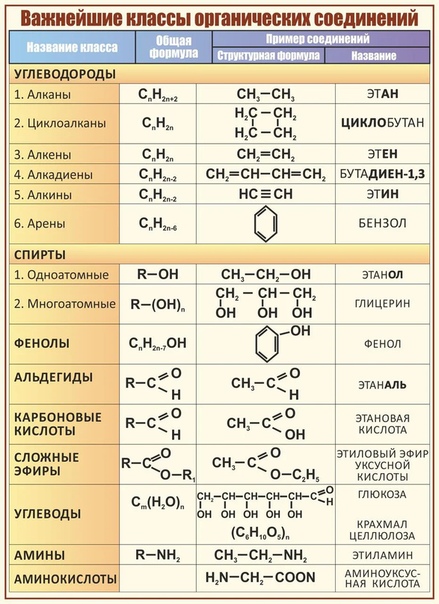
2. Гетеролитические (ионные)
Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
а)
б) H2O → H+ + OH—
Образовавшиеся ионы вступают в дальнейшие превращения, например:
CH3+ + OH— → CH3OH
электрофил нуклеофил
Ионные реакции делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Примеры частиц – электрофилов: H3O+, H+, HCl, HNO3, NO2+, AlCl3 и др.
Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH—, Cl—, S2-, NH3, H2O, R—OH, CH3O— и др.
Нуклеофильные реакции – это реакции органических веществ с нуклеофилами, т.е. анионами или молекулами, которые предоставляют электронную пару на образование новой связи:
СH3Br(субстрат) + NaOH(реагент-нуклеофил) → CH3OH + NaBr
Электрофильные реакции – реакции органических соединений с электрофильными реагентами, т. е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи
е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи
C6H6 (субстрат) + HO:— NO2+(реагент –электрофил) → C6H5–NO2 + H – OH
2. Классификация по направлению и конечному результату химического превращения
Это реакции замещения, присоединения, отщепления (элиминирования), перегруппировки, окисления и восстановления.
Реакции замещения — замена атомов водорода или группы атомов на другой атом или группу атомов.
Реакции присоединения — введение атома или группы атомов в молекулу непредельного соединения, что сопровождается разрывом в этом соединении π – связей.
Реакции отщепления (элиминирование) — реакции, в ходе которых происходит отщепление атомов или групп атомов от молекулы органического соединения с образование кратной связи.
Реакции изомеризации (перегруппировка) — реакции с изменением строения вещества, но с сохранением химического состава.
Реакции изомеризации
Типы химических реакций в органической химии
II. Классификация органических соединений
Углерод соединяется друг с другом одинарными и кратными связями (двойными и тройными), образуя прямые, разветвлённые и замкнутые цепи.
а) Прямая (неразветвлённая) цепь:
CH3 – CH2 – CH2 – CH3
СH2 = CH – CH2 – CH3
CH ≡ C – CH2 – CH3
CH2 = CH – CH = CH2
б) Разветвлённая цепь:
Классификация ациклических органических соединений
в) Замкнутая цепь:
К циклическим соединениям относятся карбоциклические
и гетероциклические соединения – содержащие в цикле кроме атомов углерода атомы других элементов – кислорода, азота и др.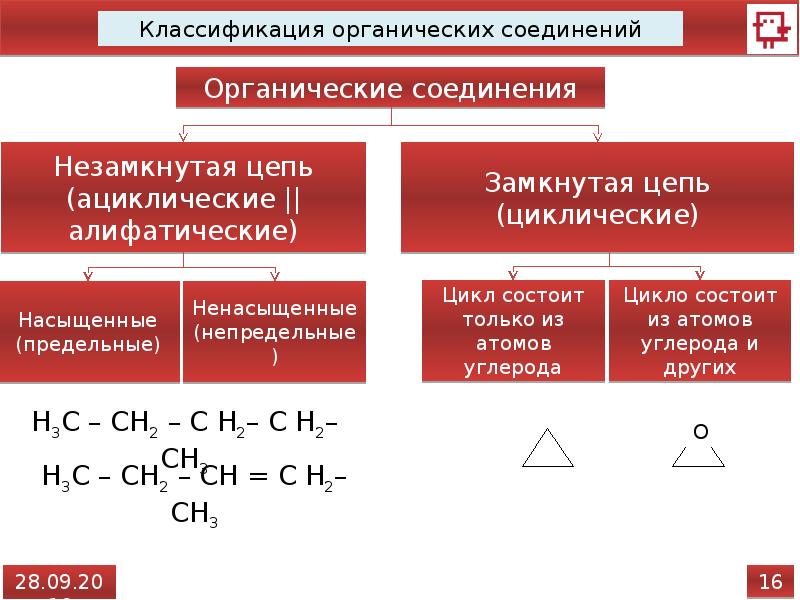
Функциональные производные углеводородов
( —R или -СnH2n+1) — это углеводородный радикал, частица, образующаяся при отрыве атома водорода от молекулы предельного углеводорода (алкана)
Например,
-СН3 метил; -С2Н5 этил.
Классификация циклических органических соединений
III. Тренажеры
Тренажер №1. “Реакции замещения”
Тренажер №2. “Реакции отщепления (элиминирования)”
Тренажер №3. “Реакции присоединения”
Тренажер №4. “Основы номенклатуры органических соединений”
Углеводороды Классификация органических соединений — Справочник химика 21
Химический состав битумов чрезвычайно разнообразен. Фактически это смесь метановых, нафтеновых, ароматических углеводородов и кислородных, сернистых и азотистых органических соединений. Классификация нефтяных бит мов производится, исходя из их элементарного состава (табл. 36). [c.114]
Фактически это смесь метановых, нафтеновых, ароматических углеводородов и кислородных, сернистых и азотистых органических соединений. Классификация нефтяных бит мов производится, исходя из их элементарного состава (табл. 36). [c.114]Можно предложить три вида классификации химических реакций в полимерах. Во-первых, их можно классифицировать по аналогии с реакциями в низкомолекулярных системах, т. е. применить принятую в органической химии классификацию реакции замещения, присоединения, по функциональным группам производных углеводородов и т. д. Здесь нет необходимости приводить ее полностью, так как она принципиально не отличается от известной классификации химических реакций углеводородов, их производных и других органических соединений с теми же функциональными группами, что и в полимерах. [c.218]
УГЛЕВОДОРОДЫ КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ [c.50]
Таким образом, классификация органических соединений основывается на сходстве и различии их строения, отображаемого структурными формулами она является генетической, т. е. показывает развитие (генезис) данного сложного соединения из простейшего углеводорода. [c.44]
е. показывает развитие (генезис) данного сложного соединения из простейшего углеводорода. [c.44]
Исследование природных органических продуктов, которое всегда было одной из главных целей органической химии, представляет и в настоящее время величайший интерес как теоретический, так и практический. Огромное число известных природных нродуктов и непрерывное открытие новых соединений в природе, непредвиденное разнообразие структур этих соединений доказывают практически неограниченную способность живых организмов, главным образом растительных, к синтезу веществ. В настоящей книге главные групны таких природных продуктов, как жиры, углеводы, а-аминокислоты, природные красящие вещества, различные витамины, коферменты, гормоны и т.д., рассматривались в разделе, соответствующем их строению, согласно систематической классификации органических соединений. Имеются, однако, две большие группы природных нродуктов растительного происхождения — соединения с полиизопреновым скелетом и алкалоиды (причем первая включает углеводороды, спирты, альдегиды и кетоны, а вторая — азотсодержащие соединения, главным образом гетероциклические), включение которых в общую классификацию нарушило бы единство изложения.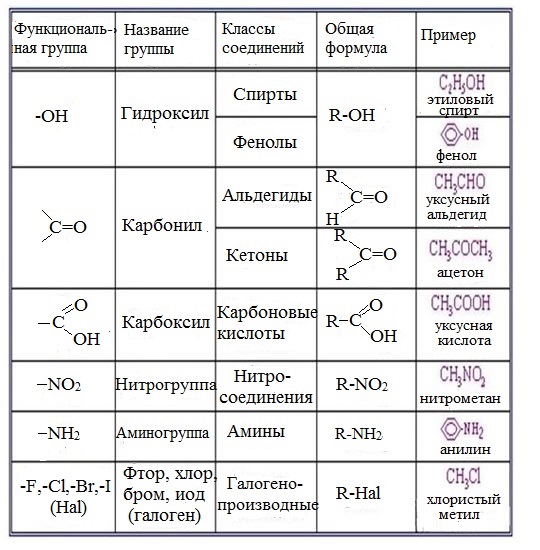 Этим двум классам соединений посвящена последняя, шестая часть книги. [c.811]
Этим двум классам соединений посвящена последняя, шестая часть книги. [c.811]
Поэтому всю систему органической химии надо было строить в таком же последовательном порядке, в каком шло усложнение получаемых из углеводородов производных. В более ясной форме необходимость положить в основу органической химии именно простейшие углеводороды обнаружилась на примере классификации органических соединений по гомологическим рядам. [c.243]
Оригинальные высказывания автора по многим вопросам являются дискуссионными. Это касается как вопросов о рекомендуемых путях исследования высших фракций нефти, так и самого определения природы высокомолекулярных соединений нефти. В частности, мы не склонны рассматривать углеводородные компоненты масел, даже остаточных, как высокомолекулярные соединения. Мы не считаем удачным выделение всех групп углеводородов, кроме парафиновых и циклических без заместителей, в особую группу гибридных соединений. Классификация органических соединений, например углеводородов, по гомологическим рядам представляется более правильной. Дополняя эту классификацию общеизвестными положениями об изологических и функциональных рядах, мы не видим необходимости в объединении весьма разнообразных соединений в [c.7]
Дополняя эту классификацию общеизвестными положениями об изологических и функциональных рядах, мы не видим необходимости в объединении весьма разнообразных соединений в [c.7]
Порядок расположения разделяемых систем соответствует приведенной классификации органических соединений. Соединения одного класса перечисляются в порядке увеличения числа атомов углерода в молекуле. Если в названии системы указываются только классы соединений, то такие системы помещаются в конце соответствующего класса. Например, система парафины — олефины помещается после систем, содержащих конкретные парафиновые углеводороды. [c.341]
Многообразие органических соединений объясняется. особенностями строения углеродного атома. Изучение строения и свойств органических молекул становится возможным благодаря стройной системе классификации. Наиболее простыми представителями соединений алифатического, алициклического и ароматического рядов являются углеводороды. Замещая атомы водорода в углеводородах на другие атомы или группы атомов (функциональные группы), можно перейти к различным классам органических соединений данного ряда. Соединения, содержащие одну и ту же функциональную группу, образуют гомологический ряд, представляющий собой ряд веществ, отличающихся друг 01 друга на любое число —СН2-групп. Детальное описание химической реакции называют механизмом реакции. Механизм протекания данной реакции зависит от многих факторов, важнейшими из которых являются природа реагирующих частиц, а также тип разрыва ковалентной связи. Различают гомолитическое и гетеролитическое расщепление связи. [c.316]
Замещая атомы водорода в углеводородах на другие атомы или группы атомов (функциональные группы), можно перейти к различным классам органических соединений данного ряда. Соединения, содержащие одну и ту же функциональную группу, образуют гомологический ряд, представляющий собой ряд веществ, отличающихся друг 01 друга на любое число —СН2-групп. Детальное описание химической реакции называют механизмом реакции. Механизм протекания данной реакции зависит от многих факторов, важнейшими из которых являются природа реагирующих частиц, а также тип разрыва ковалентной связи. Различают гомолитическое и гетеролитическое расщепление связи. [c.316]
В основу построения книги положена классификация органических соединений по функциональным группам, без традиционного подразделения на жирный и ароматический ряд. Таким образом, сначала рассматриваются углеводороды разных типов, включая ароматические, затем все галоидпроизводные, гидроксильные производные и т. д. Такое построение отражает тот существенный для современной органической химии факт, что углеводороды разных типов ныне со ставляют одну большую семью, связанную многочисленными взаимными переходами, осуществляемыми не только в лаборатории, но и в промышленном масштабе. Выбранный порядок изложения позволяет также уменьшить объем книги,, яснее выделить значение функциональной группы как главного фактора, определяющего свойства органических веществ. [c.10]
Выбранный порядок изложения позволяет также уменьшить объем книги,, яснее выделить значение функциональной группы как главного фактора, определяющего свойства органических веществ. [c.10]
Классификация углеводородов или органических соединений. [c.446]
В основу построения книги положена классификация органических соединений по функциональным группам, определяющим химическое поведение органических веществ. Сначала рассматриваются углеводороды разных типов, которые составляют одну большую семью, связанную многочисленными взаимными переходами, затем все галогенпроизводные, гидроксильные производные и т. д. [c.9]
Из всего сказанного вытекают наиболее рациональная классификация органических соединений и последовательность в их изучении,. которые с наибольшей легкостью могут дать возможность овладеть тем громадным материалом, который входит в область органической химии. Все соединения классифицируются по составу, простейшими будут углеводороды, рядом с ними следует поставить их галоидопроизводные, так как одноатомные галоиды, входя в частицу на место водорода, не могут усложнять частицы. Более сложными будут соединения, содержащие кислород, еще сложнее — содержащие азот, и, наконец, наиболее сложными будут те, которые будут содержать все четыре органогена углерод, водород, кислород и азот. Затем мы видим, что все органические соединения существуют в виде гомологических рядов, и в каждом ряде при некоторой степени сложности гомологов мы будем иметь изомеры, отличающиеся друг от друга по строению. [c.21]
Более сложными будут соединения, содержащие кислород, еще сложнее — содержащие азот, и, наконец, наиболее сложными будут те, которые будут содержать все четыре органогена углерод, водород, кислород и азот. Затем мы видим, что все органические соединения существуют в виде гомологических рядов, и в каждом ряде при некоторой степени сложности гомологов мы будем иметь изомеры, отличающиеся друг от друга по строению. [c.21]
О. Лоран предложил классификацию органических соединений, исходными членами которой были генетические типовые углеводороды разработал теорию ядер — теорию строения органических соединений, согласно которой органические соединения — производные углеводородов как основных ядер . [c.549]
Новая классификация изобретений Великобритании предусматривает деление объектов на 8 разделов, 40 классов и более 400 подклассов. Раздел обозначается прописной латинской буквой, класс — арабской цифрой, подкласс — также прописной латинской буквой дальнейшее деление обозначается поочередно арабскими цифрами н прописными латинскими буквами. Нефтехимическая тематика в основном относится к классу В1 — Физические и химические процессы и аппараты , подклассам С2С — Органические соединения и С5Е — Деструктивный пиролиз, газ, углеводороды и т. д. . [c.572]
Нефтехимическая тематика в основном относится к классу В1 — Физические и химические процессы и аппараты , подклассам С2С — Органические соединения и С5Е — Деструктивный пиролиз, газ, углеводороды и т. д. . [c.572]
Органических соединений много, но среди них имеются соединения с общими, сходными свойствами. Поэтому все они по общим признакам классифицированы, объединены в отдельные классы и группы. В основе классификации лежат углеводороды, т. е. соединения, состоящие только из атомов углерода и водорода. [c.290]
Для осуществления групповой классификации на основе зависимостей типа индекс — индекс можно воспользоваться также эффектом заметного изменения параметров удерживания представителей различных классов органических соединений при существенном изменении содержания неподвижной фазы на твердом носителе. Согласно [50, 53] такой прием, основанный на перераспределении вкладов адсорбции и абсорбции в общую величину удерживания, особенно эффективен при разделении геометрических изомеров непредельных углеводородов на капиллярных колонках.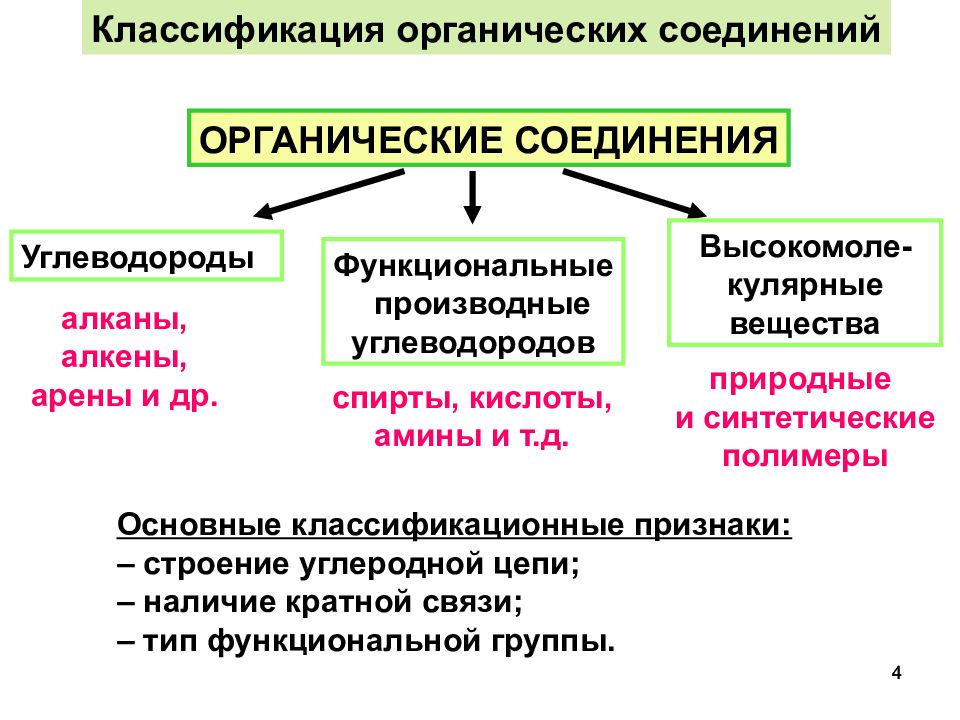 [c.182]
[c.182]
Классификация углеводородов и других органических соединений. За основу классификации всех органических соединений принимается классификация углеводородов, так как все остальные [c.444]
Классификация углеводородов и других органических соединений. [c.460]
Последующая классификация указанных выше типов органических соединений может быть проведена на основе состава их молекул. Органические соединения, молекулы которых состоят только из атомов углерода и водорода, называются углеводородами. К углеводородам относятся, например, этан, этилен, бензол. [c.299]
Обычные неводные органические растворители относятся к молекулярным жидкостям и в зависимости от их химического строения принадлежат к одному из следующих классов органических соединений алифатические и ароматические углеводороды и их галоген- и нитропроизводные, спирты, карбоновые кислоты, сложные эфиры карбоновых кислот, простые эфиры, кетоны, альдегиды, амины, нитрилы, незамещенные и замещенные амиды, сульфоксиды и сульфоны (см. приложение, табл. АЛ). Классификация растворителей в соответствии с их химическим строением позволяет сделать некоторые выводы качественного характера, в общем случае сводящиеся к старому правилу подобное растворяется в подобном . Обычно соединение легко растворяется в растворителе, имеющем такие же или [c.87]
приложение, табл. АЛ). Классификация растворителей в соответствии с их химическим строением позволяет сделать некоторые выводы качественного характера, в общем случае сводящиеся к старому правилу подобное растворяется в подобном . Обычно соединение легко растворяется в растворителе, имеющем такие же или [c.87]
Органические соединения — углеводороды и их производные, в состав которых могут входить атомы (органогены — Hal, О, N, S). Классификация и номенклатура создает систему для подразделения органических соединений и наименования их при этом должно соблюдаться соответствие между системой номенклатуры и существующей классификацией. [c.361]
Последовательность изложения материала в этой книге отличается от обычно принятой в учебниках. Автор отказался от традиционного деления на алифатические и ароматические соединения. В основу построения учебника положена классификация углеводородов и их производных по характеристическим группам. В начале учебника изложен материал по углеводородам как основе построения любого органического соединения. Затем следуют функциональ- [c.7]
Затем следуют функциональ- [c.7]
Фтор умеренно растворим в обычных органических растворителях, что подтверждено рядом качественных данных. Во всех описанных реакциях так называемого жидкофазного фторирования фтор или смесь фтора с инертным газом барботируют через углеводород, растворенный в инертном растворителе, либо в отсутствие растворителя. Несомненно, что в этих процессах реакция протекает в газовой фазе (в пузырьках) или на поверхности раздела газ — жидкость, так что заглавие раздела Жидкофазное фторирование не совсем соответствует действительности. Однако на практике фторирование указан ным методом резко отличается от фторирования, при котором фтор подвергают взаимодействию с парами органических соединений, в связи с чем принятая классификация достаточно обоснована. [c.391]
Понятие гомологии играет важнейшую роль в систематизации и классификаций материала органической химии, позволяя свести рассмотрение огромного числа отдельных органических соединений к рассмотрению целых гомологических рядов, все члены которых обладают сходным химическим строением, а следовательно, и сходными химическими свойствами (гомологический р. яд углеводородов, ряд спиртов, ряд кислот и т. д.). Подробнее о гомологии см. в книге Ю. А. Жданова Очерки методологии органической химии , Изд. Высшая школа , М., 1960. [c.69]
яд углеводородов, ряд спиртов, ряд кислот и т. д.). Подробнее о гомологии см. в книге Ю. А. Жданова Очерки методологии органической химии , Изд. Высшая школа , М., 1960. [c.69]
Современная классификация органических веществ основана на теории химического строения. Классом органических соединений, положенным в основу классификации, принято считать углеводороды все остальные соединения рассматриваются как производные углеводородов, т. е. как вещества, происшедшие в результате замещений в углеводородах одного или нескольких атомов водорода на различные другие атомы или радикалы. [c.147]
Классификация производных углеводородов. Замещая в молекулах углеводородов атомы водорода (один и более) на атомы других элементов, или группы атомов, получают различные классы органических соединений. По существу все разнообразные классы этих соединений являются производными тех или иных углеводородов. Замещающие водород атомы или группы атомов называют функциональными группами.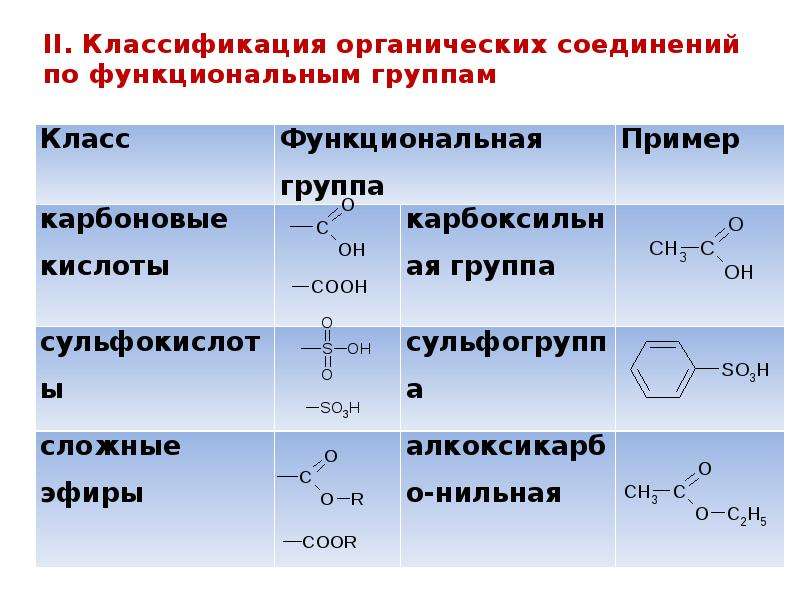 Они придают соединению специфический химический характер и определяют класс данных соединений. Отметим здесь только следующие основные классы. [c.295]
Они придают соединению специфический химический характер и определяют класс данных соединений. Отметим здесь только следующие основные классы. [c.295]
Первый выпуск целиком посвяш ен теоретическим вопросам и состоит из разделов Общие понятия , Очерк развития теоретических воззрений , Классификация органических соединений , Отношения между физическими и химическими свойствами веществ . Во втором и т1ретьем выпусках, больших по объему, отводится по главе углеводородам с их цроизводными одновалентных элементов и групп, соединениям кислорода и серы, азотсодержащим соединением и, наконец, металлоорганическим соединениям. Третий выпуск заключает теоретический раздел Очерк химического значения элементарных паев в частицах углеродистых соединений , о котором было упомянуто раньше, когда речь шла о взаимном влиянии атомов. [c.97]
Когда Ш. Жерар, на основе теории типов построил первую научную классификацию органических соединений по принципу гомологических рядов (середина XIX в. ), возникла возможность создания более рациональной номенклатуры. За основу этой номенклатуры был взят гомологический ряд, а название всех членов ряда выводилось как производное родоначальника — простейшего члена ряда. Так, гомологи предельных углеводородов рассматривались как ряд производных метана, т. е. как продукты замещения в метане атомов водорода на радикалы например, пропан — как двухзамещенный метан (диметилметан). [c.50]
), возникла возможность создания более рациональной номенклатуры. За основу этой номенклатуры был взят гомологический ряд, а название всех членов ряда выводилось как производное родоначальника — простейшего члена ряда. Так, гомологи предельных углеводородов рассматривались как ряд производных метана, т. е. как продукты замещения в метане атомов водорода на радикалы например, пропан — как двухзамещенный метан (диметилметан). [c.50]
За основу классификации всех ор1ганических соединений принимается классификация углеводородов, так как все остальные органические соединения являются их производными и образуются путем замещения атомов водорода в их молекулах другими атомами или группами агомов, вносящими свои специфические свойства. Поэтому, классифицируя углеводороды по характерным признакам строения их мол( кул, мы одновременно классифицируем и все остальные органические соединения. [c.460]
Наиболее законченной можно считать сейчас геохимическую классификацию по A.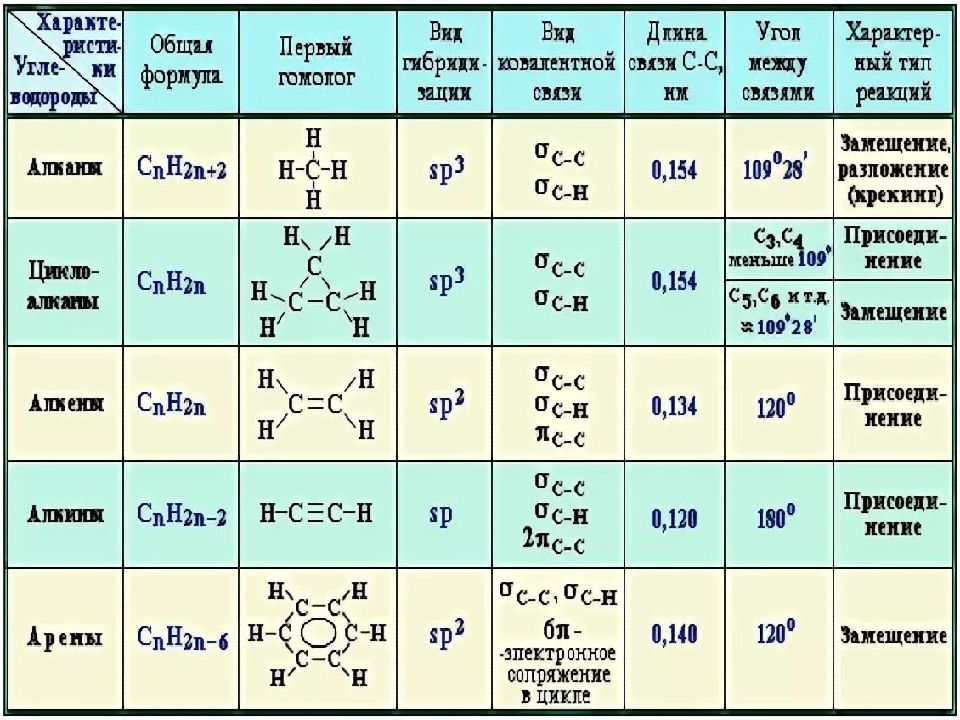 A. Петрову. В ней исходными позициями является содержание в нефти реликтовых углеводородов, т. е. соединений, общих по своему химическому строению с органическим нефтематеринским веществом. Они считаются в этом случае как бы биологическими метками нефти. В частности, в качестве таких реликтовых углеводородов приняты изопреноидные алканы от С14Н30 до С25Н52, а деление нефтей по группам ведется на основе их соотношений с алканами нормального строения. [c.229]
A. Петрову. В ней исходными позициями является содержание в нефти реликтовых углеводородов, т. е. соединений, общих по своему химическому строению с органическим нефтематеринским веществом. Они считаются в этом случае как бы биологическими метками нефти. В частности, в качестве таких реликтовых углеводородов приняты изопреноидные алканы от С14Н30 до С25Н52, а деление нефтей по группам ведется на основе их соотношений с алканами нормального строения. [c.229]
Формирование понятий о свойствах органических веществ базируется на представлениях об их составе и строении. Блок классификации веществ пополняется новым принципом деления веществ по составу на неорганические и органические (соединения углерода), тем самым подчеркивается особенность состава органических веществ. В дальнейшем классификация веществ по составу детализируется при делении органических веществ на углеводороды, кислородсодержащие и азотсодержащие органические вещества. Однако в органической химии характеристика веществ по составу является, как известно, совершенно недостаточной, и поэтому далее классификация органических веществ осуществляется по признаку сходства и различия в их строении. Последовательность иззгчения этих групп веществ определяется усложнением их строения. [c.264]
Последовательность иззгчения этих групп веществ определяется усложнением их строения. [c.264]
Рациональная номенклатура— номенклатура, возникшая с момента создания классификации и унитарной теории строения органических соединений. Как правило, имеет национальный характер. Органические соединения получают названия по соответствующему типу органических соединений (предельные углеводороды, этилены, ацетилены, спирты, альдегиды, кетоны, кислоты и т.д.). Эти названия содержат название основного типа и названия заместителей. В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении. Например сим-диметилэтилен, метилацетилен, метиловый спирт, триме-тилкарбипол, триметилуксуспый альдегид, диметижетон, хлоруксусная кислота, метиламин, триметиламин. [c.362]
Молекулы углеводородов состоят только из углерода и водорода. Углеводороды наиболее многочисленны среди других классов органических соединений.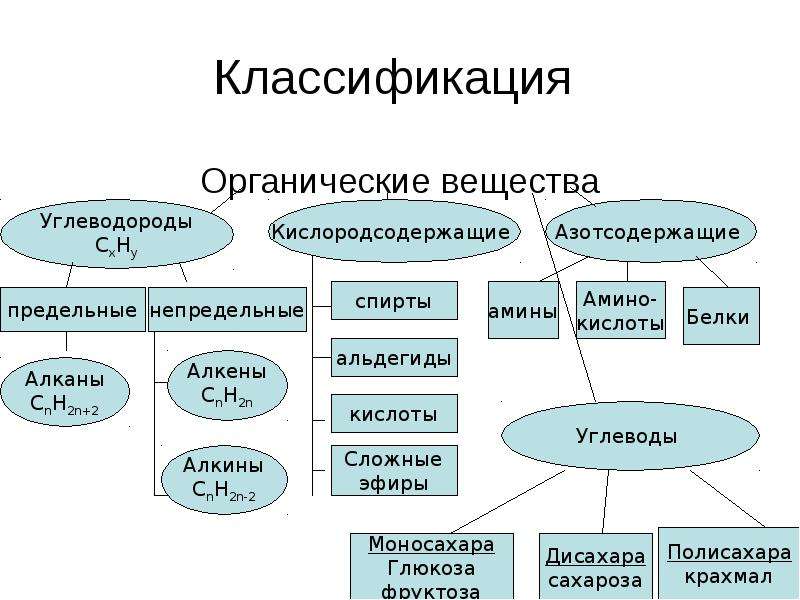 Их подразделяют на алифатические и ароматические углеводороды. Эта классификация сложилась в XIX в., когда органические соединения получали преимущественно из природных источников. Часть из них выделяли из жиров и масел такие соединения называли жирными, или алифатическими (от греческого слова а1ИрНаг — жир). Другие соединения отличались особым запахом, их назвали ароматическими. В зависимости от принадлежности к ряду (ациклические — циклические) и наличия кратных связей углеводороды классифицируют по группам. Наиболее важные группы перечислены в табл. 2.1. [c.133]
Их подразделяют на алифатические и ароматические углеводороды. Эта классификация сложилась в XIX в., когда органические соединения получали преимущественно из природных источников. Часть из них выделяли из жиров и масел такие соединения называли жирными, или алифатическими (от греческого слова а1ИрНаг — жир). Другие соединения отличались особым запахом, их назвали ароматическими. В зависимости от принадлежности к ряду (ациклические — циклические) и наличия кратных связей углеводороды классифицируют по группам. Наиболее важные группы перечислены в табл. 2.1. [c.133]
Неприменимость простых аддитивных схем для вычисления термодинамических свойств различных классов органических соединений обусловила поиски классификации типов связи. В методе Кла-геса [765] вклады за счет связей суммируются по тинам связей в молекуле. Этот метод был использован для оценки энергии резонансных колебаний. Уиланд ([1602], стр. 86) для этих целей предложил несколько улучшенный вариант метода расчета по аддитивной схеме.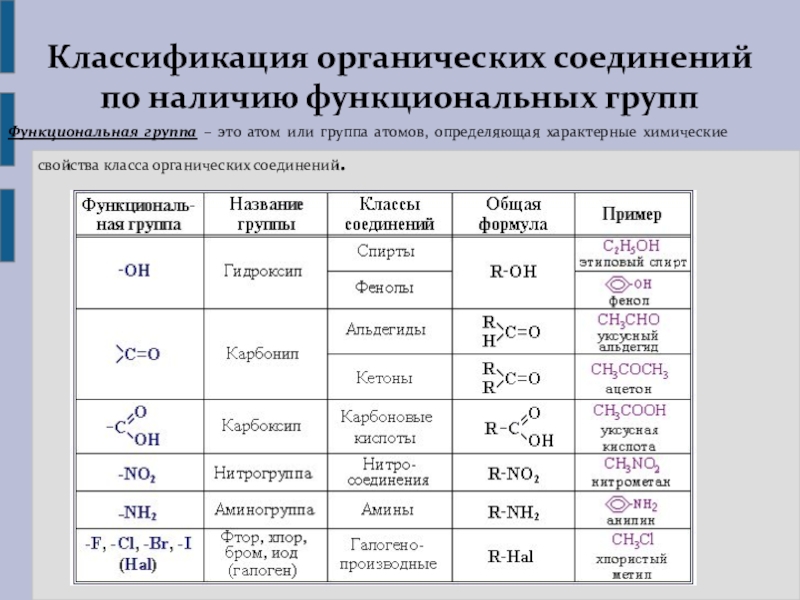 Лейдлер [838] пытался объяснить энергии связи в парафиновых углеводородах на основе трех типов связи С — Ни одного тина связи С — С. Татевский, Бендерский и Яровой [1468] в своих расчетах использовали три типа связи С — Н и 10 типов связи С — С. Глоклер [494—496], Фейлченфилд [414], Дьюар и Шмейсинг [326], [c.162]
Лейдлер [838] пытался объяснить энергии связи в парафиновых углеводородах на основе трех типов связи С — Ни одного тина связи С — С. Татевский, Бендерский и Яровой [1468] в своих расчетах использовали три типа связи С — Н и 10 типов связи С — С. Глоклер [494—496], Фейлченфилд [414], Дьюар и Шмейсинг [326], [c.162]
Предложенная классификация позволяет разделить сточные воды на сравнительно ограниченное число типов, для каждого из которых может быть выбрана наиболее рациональная технологическая схема огневого обезвреживания. В качестве примера рассмотрим определение типа сточной воды для щелочного стока производства капролактама со следующим составом примесей натриевые соли низших дикарбоновых кислот (в основном адипинат натрия) — 20—21,9% циклогексанон — 0,1—0,7% циклогексанол — 1,8—2,5% едкий натр — до 1% циклогексан — до 0,5%> Рассматриваемая сточная вода содержит углеводород (циклогексан), окисленные углеводороды (циклогексанон, циклогексанол), органические соединения натрия и минеральное вещество (едкий натр), т.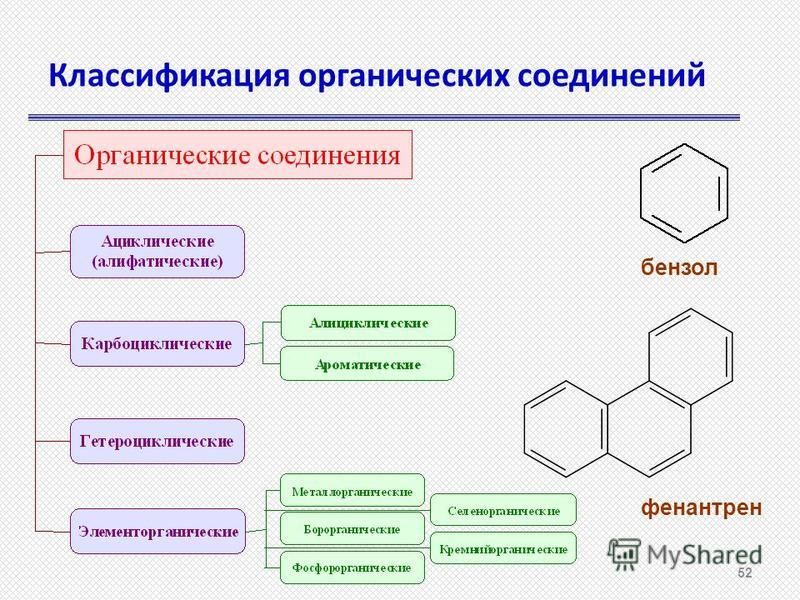 е. относится к классу II. В ней содержатся как легколетучие (циклогексан), так и высококипящие органические вещества (натриевые соли органических кислот), т. е. по наличию легколетучих веществ эта сточная вода должна быть отнесена к группе Б. Экспериментальное исследование огневого обезвреживания показало, что температура отходящих газов, равная 980— 1000° С, является рабочей. При этом натриевые соли органических кислот превращаются в карбонат натрия, а едкий натр подвергается карбонизации, т. е. конечным минеральным продуктом процесса обезвреживания является карбонат натрия, имеющий температуру плавления 850° С, близкую к рабочей температуре процесса. В связи с этим сточная вода входит в подгруппу 1. Известно, что при температуре 980—1000°С карбонат натрия частично возгоняется, поэтому рассматриваемую сточную воду следует отнести к подгруппе в. Таким образом, в соответствии с предложенной классификацией щелочной сток производства капролактама представляет сточные воды типа ПБ1в. Предложенная классификация сточных вод распространяется и на жидкие горючие отходы, в составе которых могут быть минеральные вещества и органические соединения некоторых металлов.
е. относится к классу II. В ней содержатся как легколетучие (циклогексан), так и высококипящие органические вещества (натриевые соли органических кислот), т. е. по наличию легколетучих веществ эта сточная вода должна быть отнесена к группе Б. Экспериментальное исследование огневого обезвреживания показало, что температура отходящих газов, равная 980— 1000° С, является рабочей. При этом натриевые соли органических кислот превращаются в карбонат натрия, а едкий натр подвергается карбонизации, т. е. конечным минеральным продуктом процесса обезвреживания является карбонат натрия, имеющий температуру плавления 850° С, близкую к рабочей температуре процесса. В связи с этим сточная вода входит в подгруппу 1. Известно, что при температуре 980—1000°С карбонат натрия частично возгоняется, поэтому рассматриваемую сточную воду следует отнести к подгруппе в. Таким образом, в соответствии с предложенной классификацией щелочной сток производства капролактама представляет сточные воды типа ПБ1в. Предложенная классификация сточных вод распространяется и на жидкие горючие отходы, в составе которых могут быть минеральные вещества и органические соединения некоторых металлов. [c.123]
[c.123]
За последние два десятилетия представление о сопряжении связей приобрело еще большую общность. Беккер и Натан [4—6] в 1936 г. предположили существование своеобразного типа сопряжения простой и кратнохх связи (сверхсопряжение или геперконъюгация). К этому типу принадлежит один из первых примеров взаимного влияния атомов, открытый В. В. Мар-ковниковым и выраженный в правиле присоединения галоидо-водорода к этиленовому углеводороду (правило Марковникова). Широкое обобщение понятия о сопряжении связей было положено А. Н. Несмеяновым [7] в основу объяснения двойственной реакционной способности многих органических соединений. А. Н. Несмеянов предложил классификацию систем со-прял ения. Сопряжение между связями, в которых участвуют я-электроны или я-электронные ароматические системы, обозначается как я,я-сонряжение. Сопряжение между кратной связью и простой (т. е. образованной только а-электронами) названо я,о-сопряжением. Это понятие эквивалентно понятию [c. 109]
109]
Качественный анализ органических соединений.
Качественный анализ органических соединений.Качественный анализ органических соединений.
Анализ и идентификация неизвестных органических соединений составляет очень важный аспект экспериментальной органической химия.Нет определенной установленной процедуры, которую можно было бы применяется к органическому качественному анализу. В разных книгах есть различные подходы, но системный подход, основанный на схема, приведенная ниже, даст хорошие результаты.
Тем не менее, учащимся следует ознакомиться с лабораторным руководством и Учебник практической органической химии, А.И. Фогель (4-й Версия).
Практические советы
Прежде чем изложить общую схему, отметим один-два пункта следует отметить практическую важность. (а) Количество вещества для испытаний. Для большинства тестов о
0,1 г твердого вещества или 0,1–0,2 мл (2–3 капли) жидкого материала (НЕ
БОЛЬШЕ) следует использовать.
(b) Реагенты, которые могут быть обнаружены в ходе органического анализа, включены полки с реагентами.Учащимся предлагается разработать общий знание физических свойств обычных органических соединения. Если вы сомневаетесь в ожидаемом результате теста между определенным соединением и реагентом провести пробный тест с известным соединением и сравнить с неизвестным.
(c) Количество производных веществ. Студенты потратили впустую много времени и материала в прошлом, взяв слишком большое количество вещества для получения производного.В общем 0,5 — 1 г (или 0,5 — 1 мл) вещества дает наиболее удовлетворительное Результаты.
Если практическая книга предписывает использовать большее количество (3 — 4 г или более), количество должно быть уменьшено до 1 г или 1 мл неизвестного вещества и соответствующие количества следует использовать реагенты.
Общая схема анализа
А. Предварительные тесты (a) Обратите внимание на физические характеристики — твердое, жидкое, цвет и
запах.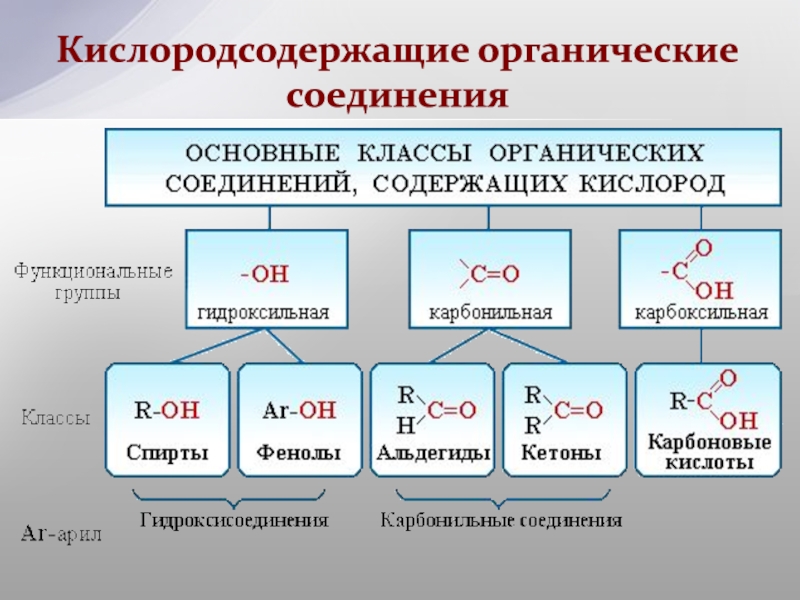
(b) Проведите испытание на воспламенение (небольшое количество тепла на металлическом шпатель), чтобы определить, является ли соединение алифатическим или ароматические (т.е. светящееся пламя — алифатические; копотистое пламя — ароматный).
B. Физические константы
Определите температуру кипения или плавления. Дистилляция рекомендуется для жидкостей (см. Приложение 3). Это служит двойная цель определения б.п., а также очистки жидкости для последующих испытаний.
C. Анализ на присутствие элементов
На уровне С10 вам расскажут о присутствующих элементах, но почитайте метод.
D. Испытания на растворимость
Растворимость неизвестного вещества в следующих реагентах дает очень полезную информацию. В целом около 3 мл. растворителя используют с 0,1 г или 0,2 мл (2-3 капли) вещество. Класс соединения может быть указан из следующая таблица:
ТАБЛИЦА РАСТВОРИМОСТИ
| РЕАГЕНТ И ТЕСТ | КЛАСС | ГРУППА СОЕДИНЕНИЙ |
Растворим в холоде или
горячая вода. (Если неизвестно
растворимый НЕ
выполнить тесты на растворимость ниже) (Если неизвестно
растворимый НЕ
выполнить тесты на растворимость ниже) | Нейтральная, кислая или базовый. (Тест с лакмусовая или универсальная индикаторная бумага) | Нижние члены серии. Нейтральный, т.е. спирты; Кислотный, напр. кислоты, фенолы; Базовый, например. амины | Растворим в разб. HCl | Базовый | Большинство аминов (кроме III амины с только ароматическими группами |
| Растворим в разл.NaOH | Кислотный | Большинство кислот, большинство фенолов. |
| Растворим в NaHCO 3 | Сильнокислотный | Большинство карбоновых кислот. |
| Не растворим в воде, кислота и щелочь | Нейтральный | Углеводороды, нитроуглеводороды, алкил или арил галогениды, сложные и простые эфиры. Спирты, альдегиды и кетоны с более высокой молекулярной массой |
Э.
 Групповые классификационные тесты
Групповые классификационные тестыИз предыдущих тестов часто можно вывести функциональные группы, присутствующие в неизвестном соединении. Проконсультируйтесь с и.р. спектры при их наличии.
Затем проводятся отдельные тесты для выявления и подтверждения присутствующие функциональные группы.
ПРИМЕЧАНИЕ:
1. Студентам настоятельно не рекомендуется выполнять ненужные тестов, поскольку они не только являются пустой тратой времени, но и увеличивают возможность ошибки.Таким образом, бессмысленно сначала тестировать спирт или кетон в основном соединении, содержащем азот! Вместо этого на таком соединении следует провести тесты на амины и т. д.2. Нельзя переоценивать системный подход в группе классификационные тесты, чтобы избежать путаницы и ошибок.
F. Литературная консультация
После определения функциональной группы ссылка
составлены в виде таблиц в книге по органическому анализу, для оценки
возможности и для приготовления подходящего твердого
производные.
Следует отметить, что хотя два вещества с одинаковым функциональная группа может иногда иметь очень похожие п.н. или м.п., твердые производные обычно можно выбирать из литературы, при этом т.пл. различия около 10 (или более), которые различают две возможности.
Пример:
СОЕДИНЕНИЕ Б.П. ПРОИЗВОДНЫЕ (MP)
2,4-ДНФХ ПОЛУКАРБАЗОН
Диэтилкетон 102 156 139
Метил-н-пропилкетон 102 144 112
Г.Получение производныхОкончательную характеристику неизвестного дает получение подходящих твердых производных. Производная должна быть тщательно отобранным и его т.п. желательно между 90 — 150 для облегчения кристаллизации и т.пл. определение.
Следует попытаться приготовить одно производное. То производное очищают перекристаллизацией, сушат и т.пл. определенный. Производные должны быть представлены правильно помечены для оценки вместе с записью.
Запись результатов
Результаты должны быть систематизированы. Результаты
должны быть записаны в практической книге в то время (не написано
вверх потом).
Результаты
должны быть записаны в практической книге в то время (не написано
вверх потом).
Должна быть сделана запись о каждом проведенном испытании, независимо от ПОЛУЧЕН ЛИ ОТРИЦАТЕЛЬНЫЙ РЕЗУЛЬТАТ .
Должны быть даны тесты, наблюдения и выводы.
По завершении анализа краткое изложение результатов должны быть включены, давая имя, b.п. или т.пл., и формула анализируемое соединение.
Качественный анализ элементов (только для справки)
В органических соединениях элементы, обычно встречающиеся вдоль с углеродом и водородом, кислород, азот, сера, хлор, бром и йод. Обнаружение этих элементов зависит от превращения их в водорастворимые ионные соединения и Применение специальных тестов.
Натриевый сплав Лассена
C, H, O, N, S, X NaX
NaCN
-> Na2S
NaCNS
ПРОЦЕДУРА Поместите кусок чистого металлического натрия размером с горошину. в термоядерную трубку.Добавьте немного соединения (50 мг или 2-3
капель).* Сначала осторожно нагрейте пробирку, позволяя дистилляту
формируется, чтобы упасть обратно на расплавленный натрий. Когда начинается обугливание,
нагревайте дно пробирки до тусклого покраснения в течение примерно трех
минут и, наконец, погрузите пробирку, пока она еще горячая, в
чистая посуда с холодной дистиллированной водой (6 мл) и крышка
немедленно чистой проволочной сеткой.**
в термоядерную трубку.Добавьте немного соединения (50 мг или 2-3
капель).* Сначала осторожно нагрейте пробирку, позволяя дистилляту
формируется, чтобы упасть обратно на расплавленный натрий. Когда начинается обугливание,
нагревайте дно пробирки до тусклого покраснения в течение примерно трех
минут и, наконец, погрузите пробирку, пока она еще горячая, в
чистая посуда с холодной дистиллированной водой (6 мл) и крышка
немедленно чистой проволочной сеткой.**
*Для жидкостей лучше сначала расплавить натрий, добавить жидкость по каплям.
**ВНИМАНИЕ! Трубка разбивается, и остатки металлического натрия реагирует с водой. Перемешать, кипятить 1-2 минуты на штатив и горячий фильтр через гофрированную бумагу.
Фильтрат «плавления», который должен быть прозрачным и бесцветным, используется для СПЕЦИАЛЬНЫХ ИСПЫТАНИЙ, ОПИСАННЫХ НИЖЕ:
1. К порции (2 мл) фильтрата «плавления» добавить 0,2 г
порошкообразные кристаллы железного купороса. Смесь кипятить полтора
минуту, охладить и подкислить, добавив разбавленную серную кислоту. по каплям.Образование голубовато-зеленого осадка (берлинская лазурь)
или синий раствор указывает на то, что исходное вещество содержит
азот. Если осадка не появилось, дать постоять 15
минут, отфильтруйте и осмотрите фильтровальную бумагу.
по каплям.Образование голубовато-зеленого осадка (берлинская лазурь)
или синий раствор указывает на то, что исходное вещество содержит
азот. Если осадка не появилось, дать постоять 15
минут, отфильтруйте и осмотрите фильтровальную бумагу.
2. СЕРА (СУЛЬФИДНАЯ)
К холодному фильтрату «фьюжн» (1 мл) добавить несколько капель холодного,
свежеприготовленного разбавленного раствора нитропруссида натрия. То
последний может быть приготовлен добавлением небольшого кристалла твердого вещества к
2 мл воды.Образование насыщенного пурпурного цвета свидетельствует о том, что
исходное вещество содержит серу. Этот тест очень
чувствительный. Значимы только сильные положительные результаты.
3. ГАЛОГЕНЫ (ГАЛОГЕНИДЫ)
Подкислить часть (1 мл) фильтрата «плавления» 2N азотной кислотой.
кислоты, а если присутствуют азот и/или сера, кипятить в течение 1-2
минут.* Охладить и добавить водный раствор нитрата серебра (1 мл), сравнить
с пустым. Образование тяжелого белого или желтого осадка
галогенида серебра указывает на галоген. Если положительный результат
получено: оставшуюся часть фильтрата «плавления» подкислить
разбавленной серной кислотой, кипятят и охлаждают. Добавить углерод
тетрахлорида (1 мл) и несколько капель свежеприготовленного хлора
вода. Встряхните смесь.
Если положительный результат
получено: оставшуюся часть фильтрата «плавления» подкислить
разбавленной серной кислотой, кипятят и охлаждают. Добавить углерод
тетрахлорида (1 мл) и несколько капель свежеприготовленного хлора
вода. Встряхните смесь.
а) Если слой четыреххлористого углерода остается бесцветным — указывает на хлор.
(b) Если слой четыреххлористого углерода коричневый — указывает бром.
(c) Если слой четыреххлористого углерода фиолетовый — указывает йод.
*Если также присутствуют азот и/или сера, добавление нитрат серебра в подкисленный «плавильный» раствор будет осаждать цианид серебра и/или сульфид серебра в дополнение к галогениды серебра. Удаление цианистого водорода и/или сероводород получают кипячением «плавильного» раствора. ГРУППОВЫЕ КЛАССИФИКАЦИОННЫЕ ИСПЫТАНИЯ
Ниже перечислены некоторые функциональные групповые тесты. Студенты должны
обратитесь к практическому учебнику за подробностями и далее
информация, т.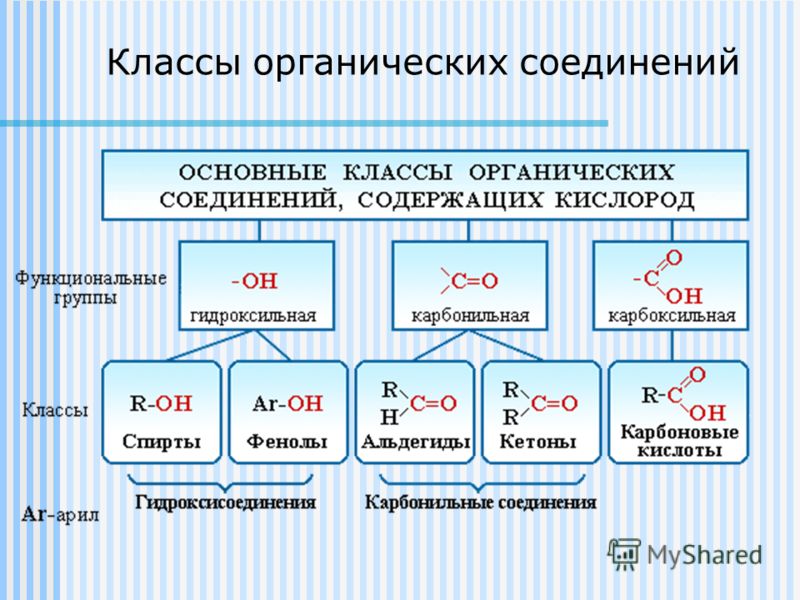 г. Фогель.
г. Фогель.
Тесты на ненасыщенность
1. Холодный разбавленный раствор перманганата калия.
2. Раствор брома в четыреххлористом углероде.
Испытания соединений, содержащих азот
1. Амины
а) Азотистая кислота.
(b) Подтверждающие тесты.
2. Соединения, дающие амины или аммиак в кислотной или щелочной среде.
гидролиз:
Амиды, замещенные амиды, анилиды, нитрилы.
3.Соединения, дающие амины при восстановлении:
Нитро, нитрозо, азо, гидразо, нитрилы.
Испытания соединений, содержащих C, H и, возможно, кислород
1. Карбоновые кислоты
Растворы Na2CO3 или NaHCO3 выделяют углекислый газ.
2. Фенолы
(а) Раствор гидроксида натрия (растворимый). Нерастворим в и не содержит CO2
из NaHCO3 (за исключением случаев, когда присутствуют группы, притягивающие электроны, напр.
2,4-динитрофенол).
(b) Раствор хлорида железа.
в) бромная вода.
3. Альдегиды и кетоны
(а) 2,4-динитрофенилгидразин (в качестве реактива Брейди) для
С=О.
(b) Йодоформный тест на Ch4CO-.
4. Только альдегиды (восстановительные свойства)
а) раствор Фелинга.
(б) реактив Толлена (аммиачный раствор AgNO3).
(в) реактив Джонса.
5. Спирты
(а) Реактив Лукаса для различения спиртов I, II и III.
(б) реактив Джонса.
(c) Металлический натрий (используйте сухую жидкость и сухую трубку).
6. Сахар
а) тест Молиша.
7. Эфиры
(а) Тест с гидроксамовой кислотой.
(б) Гидролиз.
Запишите идентификацию неизвестного органического соединения
Дата......................................
Соединение, содержащее C, H (N, Hal, S)
Физические характеристики ....................... (твердое, жидкое, газообразное, цвет, запах и т. д.)
Испытание на воспламенение . ...............................(ароматическое или алифатическое)
Физическая константа ................................(температура кипения или плавления)
Испытания на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Тестовое наблюдение
Судя по приведенным выше тестам и наблюдениям, данное соединение, вероятно, является
.................................(кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
(а)
(б)
(с)
Получение производного (способ получения)
Наблюдаемые т.пл. производной
лит. т.пл. производной
Результат
Соединение № ................................ это ..................... ......
(дайте формулу)
...............................(ароматическое или алифатическое)
Физическая константа ................................(температура кипения или плавления)
Испытания на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Тестовое наблюдение
Судя по приведенным выше тестам и наблюдениям, данное соединение, вероятно, является
.................................(кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
(а)
(б)
(с)
Получение производного (способ получения)
Наблюдаемые т.пл. производной
лит. т.пл. производной
Результат
Соединение № ................................ это ..................... ......
(дайте формулу)
ИСПЫТАНИЯ ДЛЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
Я.НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ Двумя распространенными типами ненасыщенных соединений являются алкены и
алкины, характеризующиеся двойным и тройным углерод-углеродным
связи соответственно в качестве функциональной группы. Два общих
Качественными тестами на ненасыщенность являются реакции
соединения с (а) бромом в четыреххлористом углероде и (б)
перманганат калия.
Два общих
Качественными тестами на ненасыщенность являются реакции
соединения с (а) бромом в четыреххлористом углероде и (б)
перманганат калия.
(a) 2% Бром в четыреххлористом углероде
Растворяют 0,2 г (или 0,2 мл) соединения в 2 мл угля.
тетрахлорид или другой подходящий растворитель и добавить раствор
по каплям к 2 мл 2% раствора брома в четыреххлористом углероде
и встряхнуть.
напр.
Быстрое исчезновение бромного окрашивания с образованием бесцветного раствор является положительным тестом на ненасыщенность.
ПРИМЕЧАНИЕ. Реагент потенциально опасен. Оставь это
с кожи и одежды; берегите глаза и нос. (b) 2% водный перманганат калия
Растворить 0,2 г (или 0,2 мл) вещества в 2 мл воды.
(ацетон также может быть использован в качестве растворителя). Добавьте калий
раствора марганцовки по каплям и наблюдайте за результатом.
напр.
Для холостого определения подсчитайте количество капель, добавленных к
2 мл ацетона до сохранения окраски. Значительный
разница в количестве капель, необходимых в двух случаях, составляет
положительный тест на ненасыщенность.
Значительный
разница в количестве капель, необходимых в двух случаях, составляет
положительный тест на ненасыщенность.
II. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ АЗОТ
1. Амины
а) Реакция с азотистой кислотой. Растворяют амин (0,5 мл) в
концентрированную кислоту (2,0 мл) и воду (3 мл) и охлаждают раствор.
до 0-5°С на ледяной бане в течение 5 мин.Добавьте холодный раствор
(ледяная баня) нитрита натрия (0,5 г) в воде (2,0 мл) из
капельницу, вращая пробирку, сохраняя при этом
смесь на ледяной бане.
АМИНОВАЯ РЕАКЦИЯ
Я выделил алифатический N2.
RNh3 + HNO2 -> ROH + N2 + h3O
_________________________________________________________________________
Образуется I ароматическая соль диазония.ArNh3 + HNO2 -> ArN=N+
Добавьте холодный раствор диазония и, взбалтывая
к холодному раствору 2-нафтола (0,2 г) в 5% NaOH
раствор (2 мл). Образуется оранжево-красный азокраситель. _________________________________________________________________________
Обычно образуются алифатические и желтые маслянистые нитрозамины.II ароматический R2NH + HNO2 -> R2N-NO
_________________________________________________________________________
III алифатический Нет видимой реакции.
_________________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если п-положение незамещено).
_________________________________________________________________________
_________________________________________________________________________
Обычно образуются алифатические и желтые маслянистые нитрозамины.II ароматический R2NH + HNO2 -> R2N-NO
_________________________________________________________________________
III алифатический Нет видимой реакции.
_________________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если п-положение незамещено).
_________________________________________________________________________
(b) Реакция с бензолсульфонилхлоридом
Бензолсульфонилхлорид реагирует с первичными и вторичными, но не с третичными аминами для получения замещенных сульфонамидов.
например (а) C6H5SO2Cl + H-NHR + NaOH -> C6H5SO2NHR + NaCl + h3O (б) C6H5SO2Cl + H-NR2 + NaOH -> C6H5SO2NR2 + NaCl + h3OЗамещенный сульфонамид, образованный из первичного амина растворяется в щелочной среде, в то время как полученный из вторичный амин нерастворим в щелочи.
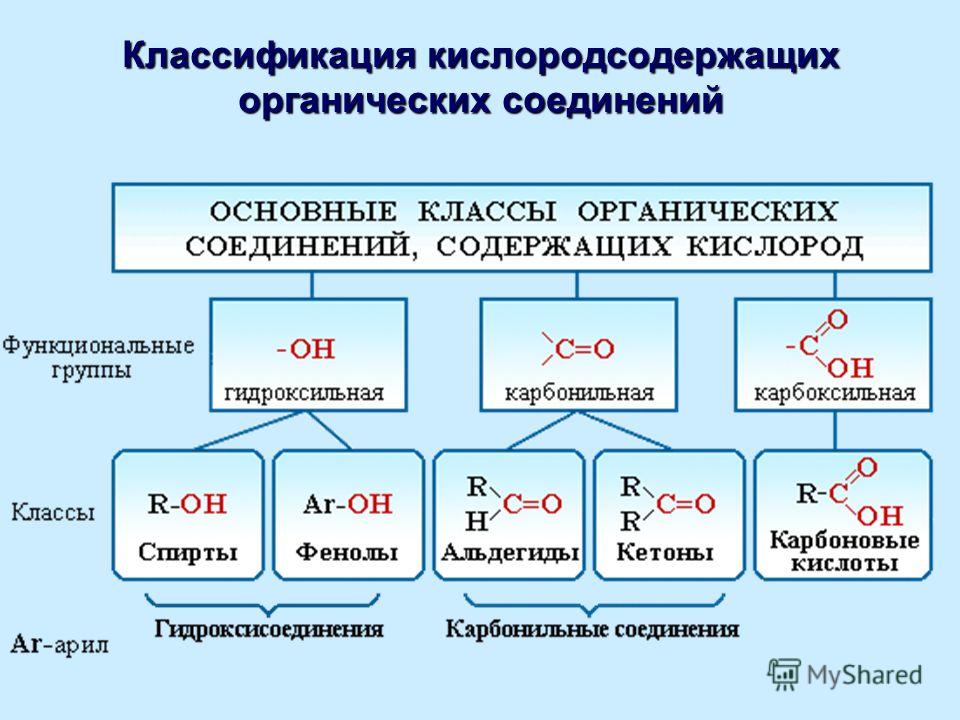
Поместите 0,5 мл (или 0,5 г) соединения, 15–10 мл 5% NaOH и 1 мл бензолсульфонилхлорида в пробирку, закрывают пробкой. пробирку и встряхивают, пока не исчезнет запах сульфонилхлорида. исчезнувший.Раствор должен быть щелочным (если нет реакции произошло, вещество, вероятно, является третичным амином).
Если в щелочном растворе появляется осадок, разбавить около 10 мл воды и взболтать; если осадка нет растворяются, указывается вторичный амин.
Если осадка нет, осторожно подкислить до конго красного с концентрированной соляной кислотой (добавляется по каплям): а осадок свидетельствует о первичном амине.
2. Амиды R-CO-Nh3
Простые первичные амиды можно разложить при кипячении со щелочью.
и тем самым выделяя аммиак.
например Ch4-CO-Nh3 + NaOH -> Ch4-CO2- Na+ + Nh4
Кипятят 0,5 г соединения с 5 мл 10% гидроксида натрия.
раствора и наблюдайте, выделяется ли аммиак.
III. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ C, H И ВОЗМОЖНО КИСЛОРОД
1.Карбоновые кислоты — тест с 5% водн. NaHCO3
R-CO2H + NaHCO3 -> R-CO2- Na+ + CO2 + h3OГидрокарбонат натрия реагирует с карбоновыми кислотами с образованием натриевой соли кислоты и выделяет углекислый газ. Если кислота нерастворима в воде и реакция растворения идет вяло кислоты в метаноле и осторожно добавить к насыщенному раствором гидрокарбоната, когда появится сильное шипение. наблюдаться.
2. Фенолы [растворимы в NaOH и не образуют CO2 из
NaHCO3]
(а) Бромная вода
Фенолы, как правило, очень активны по отношению к электрофильным
реагенты и легко бромируются бромной водой. например
Растворить или суспендировать около 0,05 г соединения в 2 мл
разбавляют соляную кислоту и добавляют по каплям бромную воду до
остается бромная окраска. Белый осадок бромфенола
может образоваться.Твердые производные бромфенола могут быть использованы для
подтверждение строения фенола (см. получение
производные).
получение
производные).
(b) Тест на хлорид железа
Большинство фенолов реагируют с хлоридом железа (III) с образованием окрашенных
комплексы. Цвета разные — красный, фиолетовый, синий или зеленый —
в зависимости от различных факторов, т.е. используемое фенольное соединение,
растворитель, концентрация. Поскольку некоторые фенолы не дают
цвета, отрицательный тест не должен считаться значимым без
Вспомогательная информация.
Растворяют 0,05 г соединения в 2 мл воды (или смеси воды и этанола, если соединение не растворяется в воде) и добавить водный раствор хлорного железа по каплям. Соблюдайте любые изменения цвета, которые могут произойти.
3. Альдегиды и кетоны
(а) 2,4-динитрофенилгидразин (в качестве реактива Брейди) Тест на
карбонильная группа (C=O) в альдегидах и кетонах.
2,4-динитрофенилгидразин дает малорастворимый желтый или красный
2,4-динитрофенилгидразоны с альдегидами и кетонами.
Добавьте 3 мл реагента к 2 каплям соединения в тесте
пробирку и встряхнуть. Если сразу не образуется осадок, подогрейте и
дать постоять 5-10 минут. Кристаллический осадок
указывает на присутствие карбонильного соединения.
Если сразу не образуется осадок, подогрейте и
дать постоять 5-10 минут. Кристаллический осадок
указывает на присутствие карбонильного соединения.
Лабораторный реагент очень разбавлен и предназначен для
только качественные тесты и не должны использоваться в подготовке
дериватива в целях идентификации. (b) Йодоформный тест
для Ч4СО-
Растворить 0.1 г (или 5 капель) соединения на 2 мл воды; если
он нерастворим в воде, добавьте достаточное количество диоксана, чтобы получить
однородный раствор. Добавьте 2 мл 5% раствора NaOH и затем
ввести йодистый калий — йодный реактив по каплям с
взбалтывают до тех пор, пока не сохранится определенная темная окраска йода. Разрешить
выдержать 2 – 3 минуты; если в помещении не выделяется йодоформ
температуры, подогрейте пробирку в стакане с водой до 60°С. Добавлять
еще несколько капель йодного реактива, если слабая окраска йода
исчезает.Продолжайте добавлять реагент до тех пор, пока не потемнеет.
цвет не сбрасывается после 2-х минутного прогрева при 60 . Удалять
избыток йода добавлением нескольких капель разбавленного
раствора гидроксида натрия при встряхивании, разбавляют равным
объема воды и дайте постоять 10 минут. Тест
положительный, если выпадает желтый осадок йодоформа. Фильтр
отделить желтый осадок, высушить на кусках фильтровальной бумаги и
определить т.пл. Йодоформ плавится при 120 (может быть
перекристаллизованный из смеси метанол-вода).
Удалять
избыток йода добавлением нескольких капель разбавленного
раствора гидроксида натрия при встряхивании, разбавляют равным
объема воды и дайте постоять 10 минут. Тест
положительный, если выпадает желтый осадок йодоформа. Фильтр
отделить желтый осадок, высушить на кусках фильтровальной бумаги и
определить т.пл. Йодоформ плавится при 120 (может быть
перекристаллизованный из смеси метанол-вода).
Реакцию дают ацетальдегид и простой метил кетоны. Спирты, содержащие группу Ch4CHROH, окисляются. в условиях реакции и также дают положительный тест.
4. Только альдегиды (восстановительные свойства).
(а) Раствор Фелинга
Альдегиды восстанавливают раствор Фелинга до желтой или красной меди (I).
окись.
Приготовление реактива: смешать равные объемы раствор раствора I (водный щелочной виннокислый калий) и Раствор Фелинга II (раствор медного купороса).
Добавить 2 капли (или 0,05 г) соединения и 2–3 капли
реактива и нагревают на кипящей водяной бане 3—4 мин.
Тест положительный на алифатические альдегиды, но часто нерешителен для ароматических альдегидов, где часто используется реактив Джонса. полезно (см. 5).
(b) Реактив Толлена (раствор аммиачного азотнокислого серебра)
Альдегиды легко окисляются до карбоновых кислот и
уменьшить реагент Толлена, чтобы получить серебряное зеркало внутри
из чистой пробирки.
СНАЧАЛА промойте пробирку небольшим количеством горячей азотной кислоты (дым шкаф) и промойте дистиллированной водой.
Приготовление реактива: К 1 мл раствора азотнокислого серебра добавить несколько капель гидроксида натрия. Затем добавьте разбавленный аммоний. гидроксида по каплям, пока не растворится осадок.
Добавьте 2–3 капли соединения в метаноле к 2–3 мл Раствор Толлена содержится в очень чистой пробирке. Если нет реакция протекает на холоде, мягко в теплой воде ванна.
ОСТОРОЖНО: После теста вылейте содержимое
пробирку в раковину и промойте пробирку разбавленным
азотная кислота. Присутствует любое гремучее серебро, которое очень
взрывоопасен, когда высохнет, будет уничтожен.
Присутствует любое гремучее серебро, которое очень
взрывоопасен, когда высохнет, будет уничтожен.
(c) Реагент Джонса (см. раздел «Спирты»).
5. Спирты
Тесты на гидроксильную группу не только выявляют наличие
группе, но может также указывать, является ли она первичной, вторичной
или третичный.
(a) Реагент Джонса (CrO 3 -H 2 SO 4 в Н 2 О)
Этот реактив отличает первичные и вторичные спирты от
третичные спирты; тест основан на гораздо большем
стойкость к окислению третичных спиртов по сравнению с
два других типа. Альдегиды также дают положительный тест.
Поместите 1 мл ацетона в пробирку и растворите одну каплю
жидкость или около 10 мг твердого спирта или альдегида в ней.Добавлять
одну каплю реактива в раствор ацетона и встряхнуть
трубка для смешивания содержимого. Первичный и вторичный спирты реагируют
в течение двух секунд, о чем свидетельствует исчезновение
оранжевый цвет реагента и образование зеленого или
сине-зеленый осадок или эмульсия.
Третичные спирты не реагируют даже через 3 минуты.
(I) RCh3OH -> RCHO -> RCO2H (II) R2CHOH -> R2C=O (III) R3COH -> нет видимой реакции.
(b) Реагент Лукаса [ZnCl 2 — конц. HCl]
Этот реагент превращает спирты в соответствующие алкильные
хлориды. Хлорид цинка (кислота Льюиса) увеличивает реакционную способность
спиртов в сторону кислоты. Тест зависит от скорости
взаимодействие первичных, вторичных и третичных спиртов с
реагент при комнатной температуре.
(I) RCh3OH -> нет реакции при комнатной температуре. (II) R2CHOH -> R2CHCl + h3O (1 час или больше) (III) R3COH -> R3CCl + h3O (немедленно)К 1 мл спирта в небольшой пробирке добавить 6 мл раствора Лукаса. реагент при комнатной температуре.Закрыть пробирку пробкой, встряхнуть и дать постоять.
(i) Первичные спирты — водная фаза остается прозрачной (кроме аллиловый спирт — капли через 7 минут).
(ii) Вторичные спирты – очень медленная реакция (~ 1 час или
может быть дольше), когда можно увидеть капли хлористого алкила.
(iii) Третичные спирты — очень быстрая реакция и капли алкилхлорид образуется почти сразу.
6.Сахара, Углеводы
Тест Молиша
Это общий тест на углеводы. Растворить 20-30 мг
соединения в 2 мл воды и добавить 0,5 мл реагента (20%
раствор 2-нафтола в этаноле). Налейте 2 мл концентрированного
серная кислота из пипетки осторожно вниз по стенке пробирки
так что кислота образует слой под водным раствором
не смешиваясь с ним. Красное окрашивание, переходящее в темное
фиолетовые формы на интерфейсе.Проведите второй тест на бланке.
решение.
7. Эфиры
Тест на гидроксамовую кислоту
R-CO-OR' + h3N-OH -> R-CO-NH-OH + R'-OH
Реакция сложных эфиров с гидроксиламином в присутствии натрия
гидроксид с образованием натриевой соли соответствующего гидроксамового
кислота. При подкислении и добавлении хлорного железа
окрашенный в пурпурный цвет комплекс железа (III) гидроксамовой кислоты
сформировался.
Всегда рекомендуется убедиться, что неизвестное соединение не давать окраску хлоридом железа (III) перед проведением тест с гидроксамовой кислотой.
Процедура испытания гидроксамовой кислотой
(a) Испытание на хлорид железа
Каплю или несколько мелких кристаллов соединения растворить в 1 мл.
95% этанола (ректификованного спирта) и добавить 1 мл М соляной
кислота. Обратите внимание на цвет, полученный при добавлении 1 капли 5% железа (III).
к раствору добавляют хлор.Если ярко выраженный фиолетовый, синий,
окрашивание в красный или оранжевый цвет, тест с гидроксамовой кислотой
описанное ниже, НЕ ПРИМЕНЯЕТСЯ.
(b) Тест на гидроксамовую кислоту
Смешайте 1 каплю или несколько мелких кристаллов (около 0,05 г) соединения
с 1 мл 0,5 М гидрохлорида гидроксиламина в 95% этаноле и
добавить 0,2 мл 6 М водного раствора гидроксида натрия. Нагрейте смесь до
кипячения и после того, как раствор немного остынет, добавить 2 мл М
соляная кислота.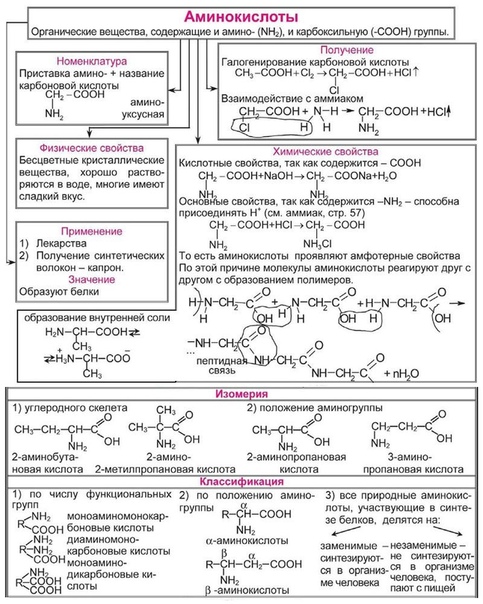 Если раствор мутный, добавьте 2 мл 95%
этиловый спирт.Обратите внимание на цвет, полученный при добавлении 1 капли 5% железа (III).
добавляют раствор хлора. Если полученный цвет не
сохраняется, продолжайте добавлять реагент по каплям до наблюдаемого
цвет пронизывает все решение. Обычно достаточно 1 капли
необходим раствор хлорида железа (III). Сравните цвет
с полученным в тесте (а). Положительный тест будет
отчетливый бордовый или пурпурный цвет по сравнению с желтым
цвет, наблюдаемый при тестировании исходного соединения с железом
(III) раствор хлорида в присутствии кислоты.Это часто
целесообразно параллельно провести пробу, скажем, с этиловым
ацетат, чтобы убедиться, что условия для этого теста
правильный.
Если раствор мутный, добавьте 2 мл 95%
этиловый спирт.Обратите внимание на цвет, полученный при добавлении 1 капли 5% железа (III).
добавляют раствор хлора. Если полученный цвет не
сохраняется, продолжайте добавлять реагент по каплям до наблюдаемого
цвет пронизывает все решение. Обычно достаточно 1 капли
необходим раствор хлорида железа (III). Сравните цвет
с полученным в тесте (а). Положительный тест будет
отчетливый бордовый или пурпурный цвет по сравнению с желтым
цвет, наблюдаемый при тестировании исходного соединения с железом
(III) раствор хлорида в присутствии кислоты.Это часто
целесообразно параллельно провести пробу, скажем, с этиловым
ацетат, чтобы убедиться, что условия для этого теста
правильный.
ПОЛУЧЕНИЕ ПРОИЗВОДНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Предварительный экзамен и групповые классификационные испытания указать конкретный класс (функциональную группу), к которому может принадлежать неизвестное органическое соединение. Дальнейшая характеристика и идентификация зависит от выбора и подготовки подходящее твердое производное и точное определение его температура плавления (лучше всего от 90 до 150°С).
В следующей таблице перечислены некоторые классы органических соединения и ряд производных, которые могут быть получены для охарактеризовать их. Сверьтесь с таблицами температур плавления в Vogel, какие производные наиболее подходят для характеристика вашего конкретного соединения.
| КЛАСС СОЕДИНЕНИЯ | ПРОИЗВОДНЫЕ |
| 1. СПИРТЫ | 3,5-динитробензоат |
| 2.ФЕНОЛЫ | бензоат, ацетат, бромпроизводное |
| 3. АЛЬДЕГИДЫ И КЕТОНЫ | семикарбазон, 2,4-динитрофенилгидразон, оксим |
| 4. КИСЛОТЫ | анилид, амид, п-толуидид. |
| 5. АМИНЫ | производные бензоила, ацетила и сульфамида |
СПИРТЫ
(и) 3,5-динитробензоаты
3,5-Динитробензоилхлорид обычно частично гидролизуется и
следует готовить в чистом виде путем осторожного нагревания смеси
3,5-динитробензойной кислоты (1 г) и пентахлорида фосфора
(1. 5 г) в сухую пробирку до разжижения (5 мин).*
жидкость выливают на сухое часовое стекло и дают затвердеть.
Фосфорилхлориды удаляют прессованием твердого вещества с помощью
шпателя на комке фильтровальной бумаги. Остаточный хлорангидрид
подходит для немедленного использования при приготовлении
производные.
5 г) в сухую пробирку до разжижения (5 мин).*
жидкость выливают на сухое часовое стекло и дают затвердеть.
Фосфорилхлориды удаляют прессованием твердого вещества с помощью
шпателя на комке фильтровальной бумаги. Остаточный хлорангидрид
подходит для немедленного использования при приготовлении
производные.
*Работа под вытяжным шкафом. Испарения раздражают глаза и нос.
3,5-динитробензоилхлорид смешивают со спиртом (0.5 — 1 мл) в неплотно закупоренную сухую пробирку и подогретую на пару ванну около 10 мин. Вторичные и третичные спирты требуют до до 30 мин. При охлаждении добавить 10 мл гидрокарбоната натрия. раствора, перемешивают до кристаллизации сложного эфира и фильтруют при насос. Промойте небольшим количеством раствора карбоната, полейте водой и отсосите. сухой. Перекристаллизовать из минимально горячего этанола или легкого нефть. Охладите медленно, чтобы избежать образования маслянистых капель твой эфир.
ФЕНОЛЫ
(i) Бензоаты (метод Шттена-Баумана).
К фенолу (0,5 г) добавляют 5% гидроксид натрия (10 мл) в
хорошо закупоренная кипятильная трубка или небольшая коническая колба. Бензоил
хлорид (2 мл) добавляют небольшими порциями за один раз и
смесь энергично встряхивают с периодическим охлаждением под краном
или в ледяной воде. Через 15 мин выделяется твердый бензоат:
раствор должен быть щелочным в конце реакции; если
не щелочной, или если продукт маслянистый, добавьте твердую таблетку
гидроксида натрия и снова встряхнуть.Собрать бензоат, промыть
тщательно холодной водой и перекристаллизовать из спирта или
светлая нефть.
(ii) Ацетаты
Ацетаты многих простых фенолов — жидкости; однако это
подходящее производное для многоатомных и замещенных фенолов. То
фенола (0,5 г) растворяют в 10% растворе едкого натра и
добавляют равное количество дробленого льда, а затем уксусную
ангидрид (2 мл). Смесь энергично встряхивают в закрытой
пробирку до тех пор, пока ацетат не отделится.Продукт фильтруется
и перекристаллизовывают из спирта.
(iii) Бромпроизводные
Фенол (0,3 г) суспендируют в разбавленном соляном растворе (10 мл).
и добавляли по каплям бромную воду до прекращения обесцвечивания
имеет место. Выпавшее в осадок бромпроизводное отфильтровывают.
отключают и перекристаллизовывают из спирта.
АЛЬДЕГИДЫ И КЕТОНЫ
(i) Семикарбазоны
Растворяют гидрохлорид семикарбазида (1 г) и ацетат натрия.
(1.5 г) в воде (8-10 мл), добавить альдегид или кетон (0,3 мл)
и встряхнуть. Встряхните смесь в течение нескольких минут, а затем остудите.
вода со льдом. Отфильтруйте кристаллы, промойте небольшим количеством холодной воды.
и перекристаллизовывают из метанола или этанола.
(ii) 2,4-динитрофенилгидразоны
Растворить 0,25 г 2,4-динитрофенилгидразина в 5 мл метанола.
и осторожно добавить 0,5 мл концентрированной серной кислоты. Фильтр
теплый раствор и добавить раствор 0.2 г карбонила
соединения в 1 мл метанола. Перекристаллизовать производное из
метанол, этанол или этилацетат.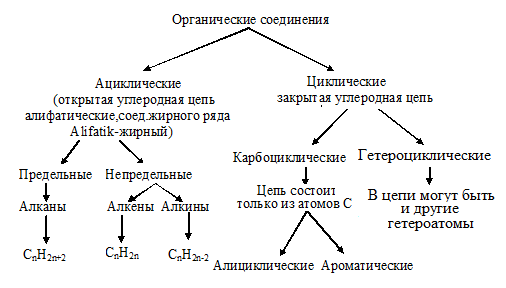
(iii) Оксимы
Гидроксиламина гидрохлорид (0,5 г) растворяют в воде (2
мл). 10% гидроксид натрия (2 мл) и карбонильное соединение (0,2-
0,3 г) растворяют в спирте (1-2 мл), смесь
нагревают на паровой бане в течение 10 мин, а затем охлаждают во льду.
Кристаллизацию индуцируют, царапая края теста.
трубка со стеклянной палочкой.Оксимы могут быть кристаллизованы из
алкоголь.
КИСЛОТЫ
(i) Амиды, анилиды и п-толуидиды
Кислоту (0,5 г) кипятят с тионилхлоридом (2–3 мл) в
вытяжной шкаф примерно на 30 мин.*
заглушка из ваты в верхней части дефлегматора, чтобы исключить
влага. Конденсатор удаляют и избыток тионила
хлорид отгоняют (т.кип. 78). Таким образом, хлорангидрид
производится обработка концентрированным раствором аммиака (5 мл) или
анилин (0.5 — 1 мл) или п-толуидин (0,5 — 1 г), когда твердое
производная выделяется. Его собирают и перекристаллизовывают из
спирт с добавлением обесцвечивающего угля, если это необходимо.
*В качестве альтернативы используйте PCl 5 для образования хлорангидрида.
АМИНЫ
(i) Производные ацетила (ацетамиды)
Осторожно кипятите с обратным холодильником в небольшой сухой колбе под сухим холодильником.
амина (1 г) с уксусным ангидридом (3 мл) в течение 15 мин. Охладить
реакционную смесь и выливают в 20 мл холодной воды.Варить до
разложить избыток уксусного ангидрида. Охладить и отфильтровать всасыванием
нерастворимое производное. Перекристаллизовать из этанола.
(ii) Производные бензоила (бензамиды)
Суспендировать 1 г амина в 20 мл 5% водного раствора гидроксида натрия.
в хорошо закупоренную колбу и добавить 2 мл бензоилхлорида (дым.
капот!), около 0,5 мл за один раз, при постоянном встряхивании. встряхнуть
энергично в течение 5-10 мин до появления запаха бензоилхлорида.
исчез.Убедитесь, что смесь остается щелочной. Фильтр
от твердого производного, промойте небольшим количеством холодной воды и
перекристаллизовать из этанола.
(iii) Бензолсульфонамиды
К 1 г амина в 20 мл 5% раствора едкого натра в
в хорошо закупоренную колбу добавить 1 мл бензолсульфонилхлорида (выпарить
капот!). Встряхивайте смесь до тех пор, пока не появится запах сульфонила.
хлорид исчезает. Убедитесь, что раствор является щелочным. подкислить
при необходимости получить осажденное производное.Концентрированный
следует использовать соляную кислоту, добавляемую по каплям. Отфильтровать
продукт, промойте небольшим количеством холодной воды и высушите.
Перекристаллизовать из этанола.
Встряхивайте смесь до тех пор, пока не появится запах сульфонила.
хлорид исчезает. Убедитесь, что раствор является щелочным. подкислить
при необходимости получить осажденное производное.Концентрированный
следует использовать соляную кислоту, добавляемую по каплям. Отфильтровать
продукт, промойте небольшим количеством холодной воды и высушите.
Перекристаллизовать из этанола.
Вернуться к химии, UWI-Мона, Домашняя страница
Copyright © 2005 Роберт Джон Ланкашир, все права защищены.
Создан и поддерживается профессором Робертом Дж. Ланкашир,Кафедра химии Вест-Индского университета,
. Кампус Моны, Кингстон 7, Ямайка. Создано в марте 1997 года. Ссылки проверены и/или последние. изменено 11 декабря 2005 г.
URL http://wwwchem.uwimona.edu.jm/lab_manuals/c10expt25.html
4.3 Именование и формулы IUPAC | Органические молекулы
Соедините соединения в столбце А с правильным
функциональная группа в столбце B. Например
метан является алканом: A1 , Б1 .
Например
метан является алканом: A1 , Б1 .
A1 (метан) , B1 (алкан)
A2 (пропановая кислота) , B4 (карбоновая кислота)
A3 (2-хлорэтан) , B7 (галогеналкан)
A4 (1-октановый) , B5 (альдегид)
А5 (3-гептин) , В2 (алкин)
А6 (бутанон) , В3 (кетон)
А7 (3-гексен) , В8 (алкен)
A8 (1-гексанол) , B9 (алкоголь)
A9 (метилпентаноат) , B6 (эфир)
Соедините соединения в столбце А с правильным
число атомов углерода в столбце C. Например
метан имеет один атом углерода в самом длинном
цепь: A1 , C1 .
Например
метан имеет один атом углерода в самом длинном
цепь: A1 , C1 .
A1 (метан) , C1 (1)
A2 (пропановая кислота) , C8 (3)
A3 (2-хлорэтан) , C5 (2)
A4 (1-октановый) , C2 (8)
А5 (3-гептин) , С9 (7)
А6 (бутанон) , С3 (4)
А7 (3-гексен) , С4 или С6 (6)
А8 (1-гексанол) , С4 или С6 (6)
A9 (метилпентаноат) , C7 (1 и 5)
Происхождение и классификация органического вещества в обломочных системах на JSTOR
Абстрактный Классификация органических частиц, основанная на степени их разложения и биологическом происхождении, предназначена для использования в палинологическом анализе. Классификация использовалась в различных формах с 1969 года и оказалась полезной при анализе органического вещества из обломочных пород в диапазоне от девона до современности. Органические частицы называются мацералами и делятся на фитокласты (растительного происхождения), зоокласты (животного происхождения), протистокласты (протистанового происхождения) и склератокласты (грибкового происхождения). Кроме того, термин рецепторкласты используется для обозначения осажденного органического вещества. Фитокласты подразделяются на следующие категории в зависимости от степени их разложения: хорошо сохранившиеся, без признаков биодеградации; плохая сохранность, незначительная биодеградация; зараженные, сильно разрушенные клеточные стенки; аморфная структура, только остаточная клеточная структура; аморфная неструктурированная, глыбистая масса.Помимо аморфных неструктурированных фитокластов встречаются аморфные неструктурированные протистокласты (пушистые массы) и аморфные инвазированные индетерминантные мацералы (массы с включениями).
Классификация использовалась в различных формах с 1969 года и оказалась полезной при анализе органического вещества из обломочных пород в диапазоне от девона до современности. Органические частицы называются мацералами и делятся на фитокласты (растительного происхождения), зоокласты (животного происхождения), протистокласты (протистанового происхождения) и склератокласты (грибкового происхождения). Кроме того, термин рецепторкласты используется для обозначения осажденного органического вещества. Фитокласты подразделяются на следующие категории в зависимости от степени их разложения: хорошо сохранившиеся, без признаков биодеградации; плохая сохранность, незначительная биодеградация; зараженные, сильно разрушенные клеточные стенки; аморфная структура, только остаточная клеточная структура; аморфная неструктурированная, глыбистая масса.Помимо аморфных неструктурированных фитокластов встречаются аморфные неструктурированные протистокласты (пушистые массы) и аморфные инвазированные индетерминантные мацералы (массы с включениями).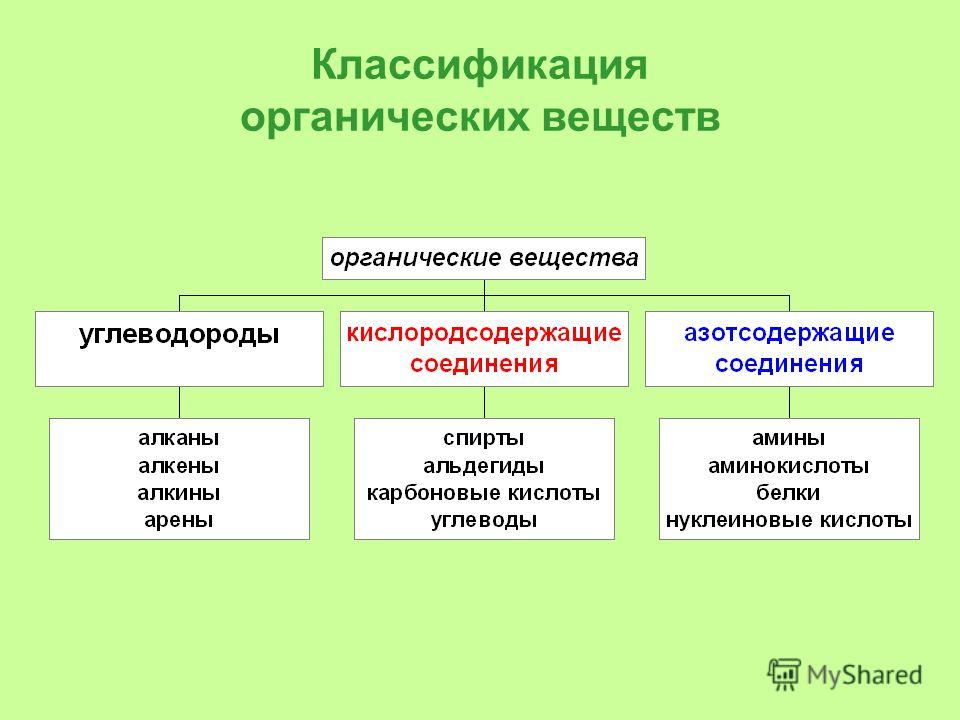 Другие методы классификации мацералов, такие как отражательная способность и УФ-флуоресценция, могут быть интегрированы в эту классификацию. Время пребывания органической частицы в поверхностной среде влияет на степень ее деградации. Длительное пребывание в аэробном биоценозе особенно увеличивает скорость разложения всего органического вещества.Среди фрагментов растений доля разложившегося вещества используется для определения «индекса разложения». Индекс деградации древних отложений сравним с углеродно-азотным индексом современных отложений, поскольку он измеряет уровень деградации, имевшей место во время отложений. Поскольку органическое вещество из разных сред показывает разные индексы разложения, а также различное биологическое происхождение захороненных органических частиц, можно использовать совокупность органических частиц в качестве показателя среды отложения.Анализ мацеральных фаций явно вносит свой вклад в палеоэкологический анализ. Используя двойной подход биологического происхождения и уровня деградации, комплексы мацералов дают ключ к пониманию условий осадконакопления, а также нефтегенерирующего потенциала (виды и количество углеводородов) конкретной материнской породы.
Другие методы классификации мацералов, такие как отражательная способность и УФ-флуоресценция, могут быть интегрированы в эту классификацию. Время пребывания органической частицы в поверхностной среде влияет на степень ее деградации. Длительное пребывание в аэробном биоценозе особенно увеличивает скорость разложения всего органического вещества.Среди фрагментов растений доля разложившегося вещества используется для определения «индекса разложения». Индекс деградации древних отложений сравним с углеродно-азотным индексом современных отложений, поскольку он измеряет уровень деградации, имевшей место во время отложений. Поскольку органическое вещество из разных сред показывает разные индексы разложения, а также различное биологическое происхождение захороненных органических частиц, можно использовать совокупность органических частиц в качестве показателя среды отложения.Анализ мацеральных фаций явно вносит свой вклад в палеоэкологический анализ. Используя двойной подход биологического происхождения и уровня деградации, комплексы мацералов дают ключ к пониманию условий осадконакопления, а также нефтегенерирующего потенциала (виды и количество углеводородов) конкретной материнской породы. Изменения свойств мацералов, связанные с термическим созреванием, обычно известны для обломочных сред. Важные изменения происходят в отражательной способности витринита, флуоресценции и цвете и используются в качестве меры уровня термического созревания.Объемные изменения в мацералах связаны с термическим созреванием в результате катагенеза и могут вызывать микродавление по мере образования углеводородов.
Изменения свойств мацералов, связанные с термическим созреванием, обычно известны для обломочных сред. Важные изменения происходят в отражательной способности витринита, флуоресценции и цвете и используются в качестве меры уровня термического созревания.Объемные изменения в мацералах связаны с термическим созреванием в результате катагенеза и могут вызывать микродавление по мере образования углеводородов.
Журнал «Палинология» является основным изданием Американской ассоциации стратиграфов-палинологов (AASP) и принимает подходящие рукописи по всем аспектам палинологии. Палинология — один из лучших журналов в своем жанре, и весь иллюстративный материал воспроизводится на высочайшем уровне.Он публикуется ежегодно с 1977 года, и с 1968 по 1974 год ему предшествовали выпуски журнала AASP «Науки о Земле и человеке». Помимо рецензируемых статей, «Палинология» включает цитаты из наград AASP, биографические очерки авторов, выдержки из презентаций, представленных на ежегодных собраниях AASP. , групповые фотографии участников годового собрания и инструкции авторам.
, групповые фотографии участников годового собрания и инструкции авторам.
Основываясь на двухсотлетнем опыте, Taylor & Francis за последние два десятилетия быстро выросла и стала ведущим международным научным издательством.Группа издает более 800 журналов и более 1800 новых книг каждый год, охватывающих широкий спектр предметных областей и включающих оттиски журналов Routledge, Carfax, Spon Press, Psychology Press, Martin Dunitz и Taylor & Francis. Taylor & Francis полностью предана своему делу. публикации и распространению научной информации самого высокого качества, и сегодня это остается первоочередной задачей.
Что такое почвенный органический углерод?
Чем органический углерод почвы отличается от органического вещества почвы?
Почвенный органический углерод (SOC) относится только к углеродному компоненту органических соединений.Органическое вещество почвы (SOM) трудно измерить напрямую, поэтому лаборатории, как правило, измеряют и сообщают SOC.
Почвенный органический углерод и секвестрация углерода
Связывание углерода в SOC рассматривается как один из способов смягчения последствий изменения климата за счет сокращения содержания углекислого газа в атмосфере. Аргумент состоит в том, что небольшое увеличение SOC на очень больших площадях сельскохозяйственных и пастбищных угодий значительно уменьшит содержание углекислого газа в атмосфере. Чтобы восстановление было продолжительным, органическое вещество должно быть в более стабильных или устойчивых фракциях (таблица 1).Для получения дополнительной информации см. Органический углерод почвы и депонирование углерода.
Что такое органическое вещество почвы?
SOM состоит в основном из углерода, водорода и кислорода и содержит небольшие количества других элементов, таких как азот, фосфор, сера, калий, кальций и магний, содержащиеся в органических остатках. Он делится на «живые» и «мертвые» компоненты и может варьироваться от совсем недавних материалов, таких как стерня, до в значительной степени разложившихся материалов, которым тысячи лет. Около 10% подземного органического вещества, такого как корни, фауна и микроорганизмы, являются «живыми» (рис. 1).
Около 10% подземного органического вещества, такого как корни, фауна и микроорганизмы, являются «живыми» (рис. 1).
SOM существует в виде 4 отдельных фракций, которые сильно различаются по размеру, времени оборота и составу в почве (таблица 1):
- растворенное органическое вещество
- органическое вещество в виде твердых частиц
- гумус
- устойчивое органическое вещество.
| фракция | размер микрометров | размер микрометров (мкМ) и миллиметры (мм) | Время оборота | состав |
|---|---|---|---|---|
| Растворенное органическое вещество | <45 мкм (в растворе) | От минут до дней | Растворимые корневые экссудаты, простые сахара и побочные продукты разложения. Обычно он составляет менее 5% от общего органического вещества почвы. Обычно он составляет менее 5% от общего органического вещества почвы. | |
| Твердое органическое вещество | 53 мкм–2 мм | 2–50 лет | Свежий или разлагающийся растительный и животный материал с идентифицируемой клеточной структурой. Составляет 2–25 % общего органического вещества почвы. | |
| Гумус | <53 мкм | Десятилетие (от 10 до 100 лет) | Старые разложившиеся органические соединения, устойчивые к разложению.Может составлять более 50% всего органического вещества почвы. | |
| Устойчивое органическое вещество | <53 мкм–2 мм | От 100 до 1000 лет | Относительно инертный материал, такой как химически стойкие материалы или органические остатки (например, древесный уголь). Может составлять до 10% органического вещества почвы. |
Вернуться к началу
Сколько почвенного органического углерода содержится в почвах Западной Австралии?
Большинство почв Западной Австралии имеют низкое содержание ПОУ (Viscarra Rossel et al. 2014). Малое количество осадков, теплые условия в течение большей части года и песчаные почвы ограничивают накопление стабильного SOC.
2014). Малое количество осадков, теплые условия в течение большей части года и песчаные почвы ограничивают накопление стабильного SOC.
Как правило, содержание органического углерода в сельскохозяйственных почвах засушливых районов Западной Австралии составляет от 0,7% до 4% (рис. 2), хотя SOC может составлять от 0,3% для пустынных почв и до 14% для интенсивных молочных почв. Большая часть органического вещества находится вблизи поверхности почвы. На юго-западе Западной Австралии около 60% органического вещества в верхних 30 см почвы находится в верхних 10 см.
Оценка запасов органического вещества почвы по органическому углероду почвы
1 Начните с измеренного общего органического углерода %
Около 58% массы органического вещества существует в виде углерода.Мы можем оценить процент SOM от SOC%, используя коэффициент преобразования 1,72 (полученный из 100/58).
Органическое вещество (%) = общий органический углерод (%) x 1,72
Этот коэффициент преобразования может варьироваться в разных почвах, но 1,72 обеспечивает разумную оценку ПОВ для большинства целей.
2 Преобразование % в вес для данной глубины и площади
Запас SOC в тоннах углерода на гектар (тС/га) = (% органического углерода в почве) x (масса почвы в данном объеме)
Для Например, почва с SOC 1.3% (0,013) и объемной плотностью 1,2 грамма на кубический сантиметр (эквивалентно 1,2 тонны на кубический метр) будет иметь SOC на глубине 10 см (0,1 м) на гектар (10 000 м 2 ) из:
(0,013) x (1,2 x 0,1 x 10 000) = 15,6 тС/га.
Используя коэффициент преобразования 1,72, количество ПОВ будет составлять: 15,6 x 1,72 = 26,8 тонн органического вещества.
Вернуться к началу
Круговорот органического вещества в почве
Тип почвы, климат и управление влияют на поступление органического вещества в почву и его оборот или разложение.Осадки являются основным фактором роста растений (биомассы) и биологической активности, что приводит к разложению органического вещества, попадающего в почву. Различные фракции ПОВ (растворенные, взвешенные, гумусовые и устойчивые) переворачиваются с совершенно разной скоростью (рис. 3). Кроме того, SOM непрерывно переключается между живыми, разлагающимися и стабильными фракциями в почве (рис. 4).
3). Кроме того, SOM непрерывно переключается между живыми, разлагающимися и стабильными фракциями в почве (рис. 4).
- Входы: растения и животные становятся частью SOM по мере того, как они умирают или создают побочные продукты.
- Трансформация: почвенные организмы разлагают и потребляют органические вещества, создавая различные формы органических остатков.Например, свежие растительные остатки разбиваются на более мелкие кусочки (<2 мм) и становятся частью фракции твердых частиц органического вещества. Этот материал далее разлагается, и в гумусовый бассейн поступает меньшее количество более биологически устойчивого материала.
- Высвобождение питательных веществ: питательные вещества и другие соединения, не требуемые микроорганизмами, высвобождаются и становятся доступными для растений.
- Стабилизация органических веществ: по мере разложения органических остатков они становятся более устойчивыми к дальнейшим изменениям.
Вернуться к началу
Сколько почвенного органического углерода, попадающего в почву, остается там?
Микроорганизмы переваривают до 90% органического углерода, поступающего в почву в составе органических остатков. При этом они выдыхают углерод обратно в атмосферу в виде углекислого газа. В то время как до 30% органических материалов могут в конечном итоге быть преобразованы в гумус, в зависимости от типа почвы и климата, в австралийских сельскохозяйственных почвах это значение часто значительно меньше. Существует 3 основных фактора, влияющих на способность данного типа почвы удерживать SOC (рис. 5).Почвы с более высоким содержанием глины обычно удерживают больше органического вещества и, следовательно, могут удерживать больше органического углерода, чем песчаные почвы.
При этом они выдыхают углерод обратно в атмосферу в виде углекислого газа. В то время как до 30% органических материалов могут в конечном итоге быть преобразованы в гумус, в зависимости от типа почвы и климата, в австралийских сельскохозяйственных почвах это значение часто значительно меньше. Существует 3 основных фактора, влияющих на способность данного типа почвы удерживать SOC (рис. 5).Почвы с более высоким содержанием глины обычно удерживают больше органического вещества и, следовательно, могут удерживать больше органического углерода, чем песчаные почвы.
SOM в основном является результатом поступления за вычетом потерь, и на него могут влиять тип почвы, климат и управление (таблица 2). SOM увеличивается, когда затраты превышают потери, и наоборот. Входы в значительной степени зависят от производства растительной биомассы, хотя они также могут быть результатом внесения в почву поправок или побочных продуктов животноводства. Потери происходят при разложении органического вещества и, в некоторых случаях, при эрозии почвы.
| Тип почвы |
|
|---|---|
| Климат |
|
| Управление земельными и почвенными ресурсами |
|
Вернуться к началу
Как измерить или интерпретировать результаты по органическому углероду в почве?
Изменения стабильного ПОУ обычно происходят очень медленно (в течение десятилетий), и зачастую трудно измерить небольшие изменения на относительно большом фоне почвенного углерода.Изменения SOC в значительной степени определяются тем, сколько биомассы выращивается и сохраняется над и под землей.
Около 45 % органического вещества представляет собой углерод, а более легкие по текстуре почвы удерживают менее 30 % этого количества. Например, в почвах Западной Австралии содержится от 20 до 160 тС/га. Типичная австралийская система производства зерна, производящая 2 т/га пшеницы, вероятно, ежегодно сохраняет в почве 0,1–0,5 т органического вещества на гектар. Это соответствует изменению SOC во многих случаях менее чем на 1 % от общего запаса.
Прежде чем с какой-либо степенью уверенности можно будет измерить значительное изменение, требуется более значительное изменение общего запаса органического углерода, для которого может потребоваться несколько лет или больше.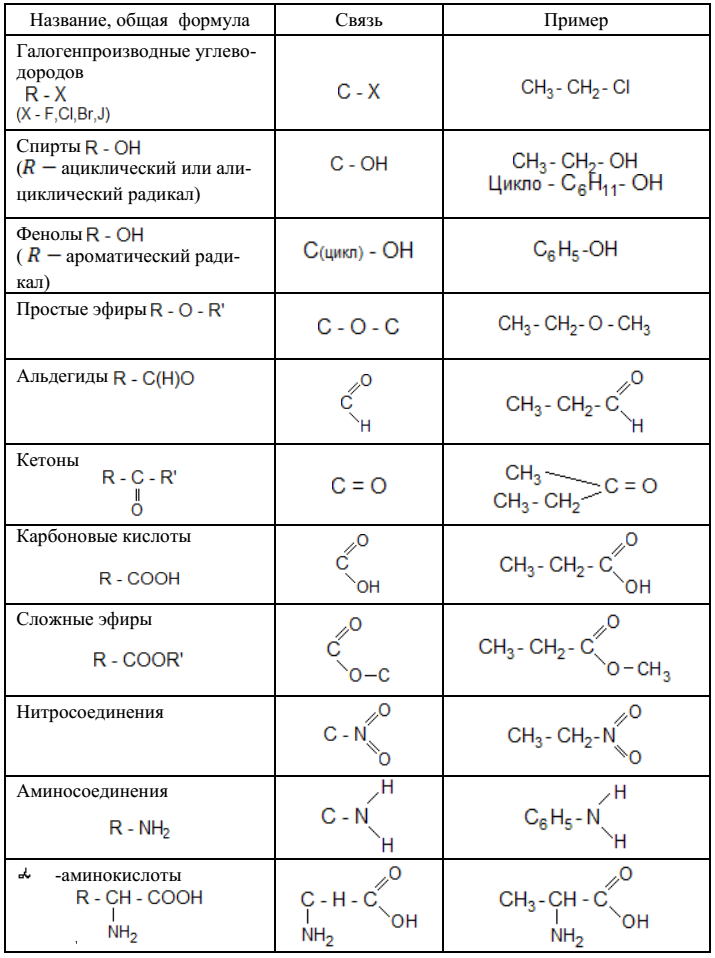 Учитывая, что годовой ввод органических остатков, вероятно, будет менее 0,2 тС/га в типичной системе возделывания зерновых, время, необходимое для обнаружения значительного изменения SOC, обычно составляет более 10 лет.
Учитывая, что годовой ввод органических остатков, вероятно, будет менее 0,2 тС/га в типичной системе возделывания зерновых, время, необходимое для обнаружения значительного изменения SOC, обычно составляет более 10 лет.
Отслеживая SOC с течением времени, можно оценить изменения, вызванные управлением (рис. 6).Однако свежие остатки (рис. 1) могут сильно различаться в зависимости от сельскохозяйственных культур или пастбищ, выращиваемых каждый год.
Для точного измерения изменений SOC требуется:
- стратегия отбора проб почвы, фиксирующая естественные колебания содержания углерода в почве
- мера концентрации SOC заданные интервалы глубины.
Изменения SOC чаще всего наблюдаются в верхнем слое почвы 0–10 см.
При анализе почвы на органический углерод обычно указывается процентное содержание общего ПОУ. Используя меру объемной плотности, можно рассчитать количество углерода на гектар на заданную глубину почвы, как показано ранее. 16 ноябрь 2016 г. , https://www.agric.wa.gov.au/sites/gateway/files/2.4%20Soil%20organic%20carbon.pdf
, https://www.agric.wa.gov.au/sites/gateway/files/2.4%20Soil%20organic%20carbon.pdf
Hoyle, FC 2013, Управление органическим веществом почвы: практическое руководство , Корпорация исследований и разработок зерна, Кингстон, просмотрено 15 октября 2018 г., https://grdc.com.au/resources-and-publications/all-publications/publications/2013/07/grdc-guide-managingsoilorganicmatter.
Hoyle, FC, Murphy, DV & Fillery, IRP 2006, «Температура и уход за стерней влияют на микробную эволюцию CO 2 -C и общую скорость трансформации N», Soil Biology and Biochemistry , vol.38, стр. 71–80.
Ingram, JSI, Fernandes, ECM 2001, «Управление секвестрацией углерода в почве: понятия и терминология», Journal of Agriculture, Ecosystems and Environment , vol. 87, стр. 111–117, просмотрено 15 октября 2018 г., https://www.sciencedirect.com/science/article/pii/S0167880
1451 Viscarra Rosssel, RA, Webster, R, Bui, EN & Baldock, JA 2014, «Базовая карта органического углерода в австралийской почве для поддержки национального учета и мониторинга углерода в условиях изменения климата», Global Change Biology , vol. 20, стр. 2953–2970, doi:10.1111/gcb.12569
20, стр. 2953–2970, doi:10.1111/gcb.12569
II—Формирование, модификация и сохранение органических соединений в Солнечной системе, 2 Межзвездная химия | Изучение органической среды в Солнечной системе
7. Е.Л. Гибб, D.C.B. Уитет, A.C.A. Бугерт и A.G.G.M. Тиленс, «Межзвездный лед: Наследие инфракрасной космической обсерватории», Astrophysical Journal Supplement Series 151: 35G, 2004.
8. Т.Дж. Миллар, Э. Хербст и С.Б. Чарнли, «Формирование кислородсодержащих органических молекул в Компактном хребте Ориона», Astrophysical Journal 369: 147, 1991.
9. А.Г.Г.М. Тиленс и С.Б. Чарнли, «Околозвездный и межзвездный синтез органических молекул», Origins of Life and Evolution of the Biosphere 27: 23-51, 1997.
10. Р.Дж.А. Грим, Ф. Баас, Т.Р. Гебалле, Дж. М. Гринберг и В. Шутте, «Обнаружение твердого метанола в направлении W33A», Astronomy и Astrophysics 243: 473, 1997.
11. В.К. Агарвал, В. Шутте, Дж. М. Гринберг, Дж. П. Феррис, Р. Бриггс, С. Коннер, C.P.E.M. Ван де Бульт и Ф. Басс, «Фотохимические реакции в межзвездных зернах, фотолиз СО, NH 3 и H 2 O», Origins of Life 16: 21-40, 1985.
12. Р. Бриггс, Г. Эртем, Дж. П. Феррис, Дж. М. Гринберг, П. Дж. Маккейн, С.Х. Мендоза-Гомез и В. Шютте, «Комета Галлея как совокупность межзвездной пыли и дополнительные доказательства фотохимического образования органических веществ в межзвездной среде», Origins of Life и Evolution of the Biosphere 22: 287-307 , 1992.
13. М.П. Бернштейн, Дж.П. Дворкин, С.А. Сэндфорд, Г.В. Купер и Л. Дж. Алламандола, «Рацемические аминокислоты в результате ультрафиолетового фотолиза аналогов межзвездного льда», Nature 416: 401-403, 2002.
14. Г.М. Муньос Каро, Ю.Дж. Мейерхенрих, В.А. Шутте, Б. Барбье, А. Арконес Сеговия, Х. Розенбауэр, В.Х.П. Тиманн, А. Брак и Дж. М. Гринберг, «Аминокислоты в результате ультрафиолетового облучения аналогов межзвездного льда», Nature 416: 403-406, 2002.
15. Г.М. Муньос Каро, Ю.Дж. Мейерхенрих, В.А. Шутте, Б. Барбье, А. Арконес Сеговия, Х. Розенбауэр, В.Х.П. Тиманн, А. Брак и Дж. М. Гринберг, «Аминокислоты в результате ультрафиолетового облучения аналогов межзвездного льда», Nature 416: 403-406, 2002.
16. М.П. Бернштейн, Дж.П. Дворкин, С.А. Сэндфорд, Г.В. Купер и Л. Дж. Алламандола, «Рацемические аминокислоты в результате ультрафиолетового фотолиза аналогов межзвездного льда», Nature 416: 401-403, 2002.
17. Для обзора см. Пендлтон И. Дж. и Алламандола Л. Дж., «Органический огнеупорный материал в диффузной межзвездной среде: средние инфракрасные спектроскопические ограничения», Astrophysical Journal Supplement Series 138: 75-98, 2002.
18. В. Мэннингс, А. П. Босс и С. С. Рассел, ред., Protostars and Planets IV, University of Arizona Press, Тусон, Аризона, 2002.
19. Айкава Ю., Хербст Э. Химические модели околозвездных дисков.425-434 в Astrochemistry: From Molecular Clouds to Planetary Systems (YC Minh and EF van Dishoeck, eds. ), IAU Symposium 197, Astronomical Society of the Pacific, Сан-Франциско, Калифорния, 2000.
), IAU Symposium 197, Astronomical Society of the Pacific, Сан-Франциско, Калифорния, 2000.
20. Недавний обзор см., например, в P.M. Хоппе и Э. Зиннер, «Досолнечные пылинки метеоритов и их звездные источники», Journal of Geophysical Research 105: 10371-10386, 2000.
21. Д.Э. Браунли, «Космическая пыль: сбор и исследование», Annual Review of Earth and Planetary Science 13: 147-173, 1985.
22. Л.П.Келлер, К.Л. Томас и Д.С. Маккей, «Частица межпланетной пыли со связями с хондритами CI», Geochimica et Cosmochimica Acta 56: 1409-1412, 1992.
23. К.Л. Томас, Л.П. Келлер, Г.Е. Бланфорд и Д.С. Маккей, «Количественный анализ углерода в безводных и гидратированных частицах межпланетной пыли», стр. 165-172 в Analysis of Interplanetary Dust (ME Zolensky, TL Wilson, FJM Rietmeijer, and GJ Flynn, eds.), Материалы конференции AIP 310, Американский институт физики, Вудбери, Н.Ю., 1994.
24. Г.Дж. Флинн, Л.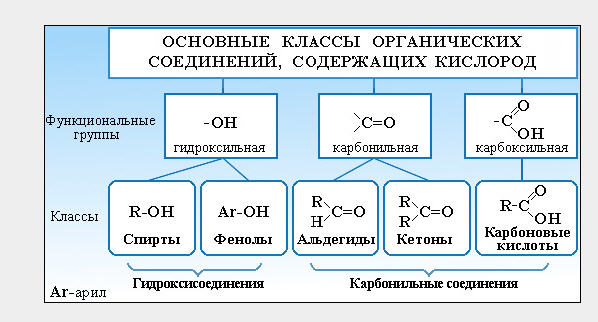 П. Келлер, К. Якобсен, С. Вирик и М.А. Миллер, «Органический углерод в частицах межпланетной пыли», стр. 191-194 в A New Era in Bioastronomy , ASP Conference Series, Vol. 213, Астрономическое общество Тихоокеанской прессы, Сан-Франциско, Калифорния, 2000.
П. Келлер, К. Якобсен, С. Вирик и М.А. Миллер, «Органический углерод в частицах межпланетной пыли», стр. 191-194 в A New Era in Bioastronomy , ASP Conference Series, Vol. 213, Астрономическое общество Тихоокеанской прессы, Сан-Франциско, Калифорния, 2000.
25. Л. П. Келлер, С. Мессенджер, Г.Дж. Флинн, С. Клеметт, С. Вирик и К. Якобсен, «Природа молекулярного облачного материала в межпланетной пыли», Geochimica et Cosmochimica Acta 68(11): 2577-2589, 2004.
26. Г.Дж. Флинн, Л.П. Келлер, М. Фезер, С. Вирик и К. Якобсен, «Происхождение органического вещества в Солнечной системе: данные о частицах межпланетной пыли», Geochimica et Cosmochimica Acta 67(24): 4791- 4806, 2003.
27. Дж. Алеон, Ф. Роберт, М. Чаусидон и Б. Марти, «Изотопный состав азота макромолекулярного органического вещества в частицах межпланетной пыли», Geochimica et Cosmochimica Acta 67: 3773-3783, 2003.
28.Л. П. Келлер, С. Мессенджер, Г.Дж. Флинн, С. Клеметт, С. Вирик и К. Якобсен, «Природа молекулярного облачного материала в межпланетной пыли», Geochimica et Cosmochimica Acta 68(11): 2577-2589, 2004.
Мессенджер, Г.Дж. Флинн, С. Клеметт, С. Вирик и К. Якобсен, «Природа молекулярного облачного материала в межпланетной пыли», Geochimica et Cosmochimica Acta 68(11): 2577-2589, 2004.
29. Л. П. Келлер, С. Мессенджер, Г.Дж. Флинн, С. Клеметт, С. Вирик и К. Якобсен, «Природа молекулярного облачного материала в межпланетной пыли», Geochimica et Cosmochimica Acta 68(11): 2577-2589, 2004.
30. Ж. Алеон, К. Энгранд, Ф. Роберт и М.Чауссидон, «Подсказки к происхождению частиц межпланетной пыли из изотопного исследования их водородсодержащих фаз», Geochimica et Cosmochimica Acta 65: 4399-4412, 2001.
31. Дж. Алеон, Ф. Роберт, М. Чаусидон и Б. Марти, «Изотопный состав азота макромолекулярного органического вещества в частицах межпланетной пыли», Geochimica et Cosmochimica Acta 67: 3773-3783, 2003.
32. Г.Дж. Флинн, Л. П. Келлер, М. Фезер, С. Уирик и К.Якобсен, «Происхождение органического вещества в Солнечной системе: данные по частицам межпланетной пыли», с. 275 в Биоастрономия 2002: Жизнь среди звезд , Симпозиум 213 МАС (Р. Норрис и Ф. Стоотман, ред.), Тихоокеанское астрономическое общество, Сан-Франциско, Калифорния, 2003.
275 в Биоастрономия 2002: Жизнь среди звезд , Симпозиум 213 МАС (Р. Норрис и Ф. Стоотман, ред.), Тихоокеанское астрономическое общество, Сан-Франциско, Калифорния, 2003.
33. Л. П. Келлер, С. Мессенджер, Г.Дж. Флинн, С. Клеметт, С. Вирик и К. Якобсен, «Природа молекулярного облачного материала в межпланетной пыли», Geochimica et Cosmochimica Acta 68(11): 2577-2589, 2004.
34. Г.Дж. Флинн, Л.П. Келлер, М. Фезер, С. Вирик и К. Якобсен, «Происхождение органического вещества в Солнечной системе: данные о частицах межпланетной пыли», Geochimica et Cosmochimica Acta 67(24): 4791- 4806, 2003.
35. J. Aleon, C. Engrand, F. Robert и M. Chaussidon, «Clues to the Origin of Interplanetary Dust Particles from the изотопное исследование их водородосодержащих фаз», Geochimica et Cosmochimica Acta 65: 4399- 4412, 2001.
Включение СОЗ в Стокгольмскую конвенцию
Профиль риска Ar, Ch, En, Fr, Ru, Sp (PDF)
Оценка управления рисками Ar, Ch, En, Fr, Ru, Sp (PDF)
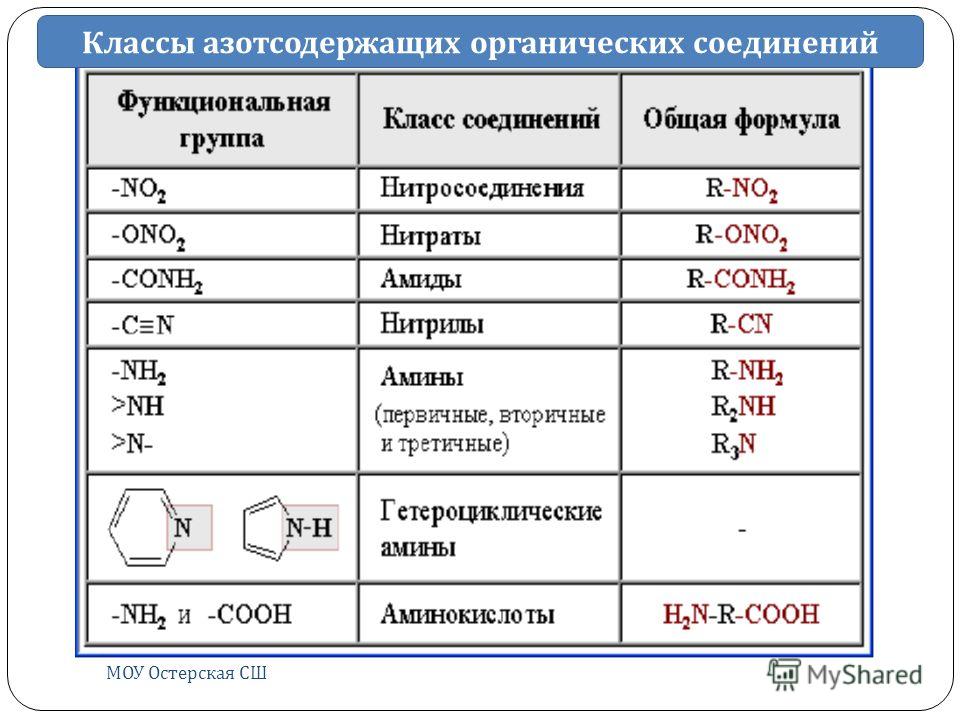 Оба они биологически активны. Эндосульфан технический (№ CAS: 115-29-7) представляет собой смесь двух изомеров с небольшим количеством примесей.
Оба они биологически активны. Эндосульфан технический (№ CAS: 115-29-7) представляет собой смесь двух изомеров с небольшим количеством примесей. | |
альфа-эндосульфан |
| |
бета-эндосульфан |
Согласно оценке управления рисками эндосульфана, принятой КРСОЗ, эндосульфан является инсектицидом, который используется с 1950-х годов для борьбы с сельскохозяйственными вредителями, мухой цеце и эктопаразитами крупного рогатого скота, а также в качестве консерванта древесины. В качестве инсектицида широкого спектра действия эндосульфан в настоящее время используется для борьбы с широким спектром вредителей на различных культурах, включая кофе, хлопок, рис, сорго и сою.
В качестве инсектицида широкого спектра действия эндосульфан в настоящее время используется для борьбы с широким спектром вредителей на различных культурах, включая кофе, хлопок, рис, сорго и сою.
Ежегодно в Бразилии, Китае, Индии, Израиле и Южной Корее производится от 18 000 до 20 000 тонн эндосульфана. Колумбия, Соединенные Штаты Америки и несколько стран Европы, которые раньше производили эндосульфан, прекратили его производство.
Крупнейшие потребители эндосульфана (Аргентина, Австралия, Бразилия, Китай, Индия, Мексика, Пакистан и США) ежегодно используют в общей сложности около 15 000 тонн эндосульфана.Еще 21 страна сообщает об использовании эндосульфана. Использование эндосульфана запрещено или будет постепенно прекращено в 60 странах, на долю которых в совокупности приходится 45 процентов текущего глобального использования.
Характеристики СОЗ эндосульфана Согласно характеристике риска эндосульфана, принятой КРСОЗ, эндосульфан устойчив в атмосфере, отложениях и воде. Эндосульфан биоаккумулируется и может переноситься на большие расстояния. Он был обнаружен в воздухе, отложениях, воде и в живых организмах в отдаленных районах, таких как Арктика, которые удалены от районов интенсивного использования.
Эндосульфан биоаккумулируется и может переноситься на большие расстояния. Он был обнаружен в воздухе, отложениях, воде и в живых организмах в отдаленных районах, таких как Арктика, которые удалены от районов интенсивного использования.
Эндосульфан токсичен для человека, и было показано, что он оказывает неблагоприятное воздействие на широкий круг водных и наземных организмов. Воздействие эндосульфана связано с врожденными физическими расстройствами, умственной отсталостью и смертностью среди сельскохозяйственных рабочих и сельских жителей в развивающихся странах Африки, Азии и Латинской Америки. Сульфат эндосульфана проявляет токсичность, подобную токсичности эндосульфана.
Замена эндосульфана
Химические и нехимические альтернативы эндосульфану доступны во многих географических условиях как в развитых, так и в развивающихся странах.Некоторые из этих альтернатив применяются в странах, где эндосульфан запрещен или постепенно выводится из употребления. Однако в некоторых странах может быть сложно и/или дорого заменить эндосульфан для конкретных комплексов сельскохозяйственных культур и вредителей. Некоторые страны также предпочитают использовать эндосульфан для борьбы с опылителями, борьбы с устойчивостью к инсектицидам, комплексных систем борьбы с вредителями, а также потому, что он эффективен против широкого круга вредителей. Некоторые страны хотят продолжать использовать эндосульфан, чтобы дать время для поэтапного внедрения альтернатив.
Однако в некоторых странах может быть сложно и/или дорого заменить эндосульфан для конкретных комплексов сельскохозяйственных культур и вредителей. Некоторые страны также предпочитают использовать эндосульфан для борьбы с опылителями, борьбы с устойчивостью к инсектицидам, комплексных систем борьбы с вредителями, а также потому, что он эффективен против широкого круга вредителей. Некоторые страны хотят продолжать использовать эндосульфан, чтобы дать время для поэтапного внедрения альтернатив.
Для получения дополнительной информации см. страницу технического эндосульфана.
Гармонизированная тарифная сетка в формате PDF
Версия: Предварительное издание 2022 г.Полный документ
Эта страница содержит поглавный список Гармонизированных Тарифная сетка и общие примечания. Ссылки ниже соответствуют к различным разделам Оглавления Гармонизированного Тарифная сетка. При нажатии на ссылку загрузится соответствующий Adobe .pdf
(Примечание.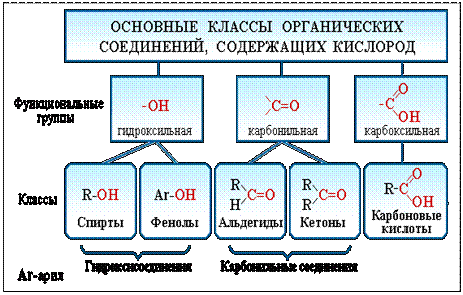 Примечания к разделам, если таковые имеются,
прилагается к первой главе каждого раздела. «Листать вниз»
для просмотра главы после выбора.)
Примечания к разделам, если таковые имеются,
прилагается к первой главе каждого раздела. «Листать вниз»
для просмотра главы после выбора.)
Обложка
Изменять Записывать (Запись правовых и статистических изменений в этом издании Гармонизированная тарифная сетка)
Предисловие
Общие замечания; Общие правила интерпретация; Общие статистические примечания
Уведомление для экспортеров
Раздел I: Живой Животные; Животные продукты
| Глава 1 | Живые животные |
| Глава 2 | Мясо и пищевые мясные субпродукты |
| Глава 3 | Рыба и ракообразные, моллюски и прочие водные беспозвоночные |
| Глава 4 | Молочные продукты; яйца птиц; натуральный мед; съедобные продукты животного происхождения, в другом месте не поименованные или не включенные |
| Глава 5 | Продукты животного происхождения, в другом месте не поименованные или
в комплекте |
| Глава 6 | Живые деревья и другие растения; луковицы, корни и тому подобное; срезанные цветы и декоративная зелень |
| Глава 7 | Съедобные овощи и некоторые корнеплоды и клубнеплоды |
| Глава 8 | Съедобные фрукты и орехи; кожура цитрусовых или дыни |
| Глава 9 | Кофе, чай, мате и специи |
| Глава 10 | Зерновые |
| Глава 11 | Продукция мукомольной промышленности; солод; крахмалы; инулин; пшеничный глютен |
| Глава 12 | Масличные семена и масличные плоды; разные зерна, семена и плоды; технические или лекарственные растения; солома и корм |
| Глава 13 | лак; камеди, смолы и прочие растительные соки и экстракты |
| Глава 14 | Материалы для плетения овощей; растительные продукты не
в другом месте не указано или не включено |
| Глава 15 | Жиры и масла животного или растительного происхождения и их расщепление продукты приготовленные пищевые жиры; воски животного или растительного происхождения |
| Глава 16 | Готовые продукты из мяса, рыбы или ракообразных, моллюсков или другие водные беспозвоночные |
| Глава 17 | Сахар и кондитерские изделия из сахара |
| Глава 18 | Какао и продукты из какао |
| Глава 19 | Продукты из злаков, муки, крахмала или молока; пекари товары |
| Глава 20 | Готовые продукты из овощей, фруктов, орехов или других частей растения |
| Глава 21 | Разные пищевые продукты |
| Глава 22 | Напитки, спиртные напитки и уксус |
| Глава 23 | Остатки и отходы пищевой промышленности; готовый корм для животных |
| Глава 24 | Табак и промышленные заменители табака |
| Глава 25 | Соль; сера; земли и камня; штукатурные материалы, известь и цемент |
| Глава 26 | Руды, шлак и зола |
| Глава 27 | Минеральные топлива, нефтепродукты и продукты их дистилляция; битумные вещества; минеральные воски |
| Глава 28 | Неорганические химикаты; органические или неорганические соединения драгоценных металлов, редкоземельных металлов, радиоактивных элементов или изотопов |
| Глава 29 | Органические химикаты |
| Глава 30 | Фармацевтическая продукция |
| Глава 31 | Удобрения |
| Глава 32 | Экстракты дубильные или красильные; красители, пигменты, краски,
лаки, замазки и мастики |
| Глава 33 | Эфирные масла и резиноиды; парфюмерные, косметические или туалетные принадлежности |
| Глава 34 | Мыло, органические поверхностно-активные вещества, моющие средства, смазочные препараты, искусственные воски, готовые воски, средства для полировки или чистки, свечи и аналогичные изделия, пасты для лепки, «зубоврачебный воск» и стоматологические препараты с основа из гипса |
| Глава 35 | Альбуминоидные вещества; модифицированные крахмалы; клеи; ферменты |
| Глава 36 | Взрывчатые вещества; пиротехнические изделия; Спички; пирофорный сплавы; некоторые горючие препараты |
| Глава 37 | Фото- или кинотовары |
| Глава 38 | Прочие химические продукты |
| Глава 41 | Необработанные шкуры (кроме натурального меха) и кожа |
| Глава 42 | Изделия из кожи; шорно-седельные изделия и упряжь; товары для путешествий, сумки и аналогичные контейнеры; изделия из кишок животных (прочие чем кишечник тутового шелкопряда) |
| Глава 43 | Натуральный и искусственный мех; их изделия |
| Глава 44 | Древесина и изделия из дерева; древесный уголь |
| Глава 45 | Пробка и изделия из пробки |
| Глава 46 | Изделия из соломы, альфы или прочих материалов для плетения материалы; корзиночные и плетеные изделия |
| Глава 47 | Масса древесная или из другого волокнистого целлюлозного материала; отходы и обрезки бумаги или картона |
| Глава 48 | Бумага и картон; изделия из бумажной массы, бумаги или из картона |
| Глава 49 | Печатные книги, газеты, картины и другие изделия полиграфическая промышленность; рукописи, машинописные тексты и планы |
| Глава 50 | Шелк |
| Глава 51 | Шерсть, тонкий или грубый волос животных; пряжа из конского волоса и ткань ткань |
| Глава 52 | Хлопок |
| Глава 53 | Прочие растительные текстильные волокна; бумажная пряжа и ткань ткань из бумажной пряжи |
| Глава 54 | Искусственные нити |
| Глава 55 | Искусственные штапельные волокна |
| Глава 56 | Вата, войлок и нетканые материалы; специальные нити, шпагат, снасти, канаты и тросы и изделия из них |
| Глава 57 | Ковры и прочие текстильные напольные покрытия |
| Глава 58 | Специальные ткани; стеганые текстильные ткани; кружево, гобелены; отделка; вышивка |
| Глава 59 | Текстильные материалы с пропиткой, покрытием, покрытием или ламинированием; текстильные изделия, пригодные для промышленного использования |
| Глава 60 | Трикотажные или вязаные ткани |
| Глава 61 | Предметы одежды и аксессуары к одежде, трикотажные или вязаный крючком |
| Глава 62 | Предметы одежды и принадлежности к одежде, нетрикотажные или крючком |
| Глава 63 | Прочие готовые текстильные изделия; наборы; изношенная одежда и бывшие в употреблении текстильные изделия; тряпки |
| Глава 64 | и тому подобное; части таких изделий |
| Глава 65 | из них |
| Глава 66 | Зонты солнечные зонты, трости, трости-сиденья, хлысты, хлысты и их части |
| Глава 67 | Готовые перья и пух и изделия из перьев или пуха; искусственный цветы; изделия из человеческого волоса |
| Глава 71 | Жемчуг природный или культивированный, драгоценный или полудрагоценные камни, драгоценные металлы, металлы, плакированные драгоценными металл и изделия из него; бижутерия; монета |
| Глава 84 | Реакторы ядерные, котлы, машины и механические приспособления; их части |
| Глава 85 | Электрические машины, оборудование и детали из них; звукозаписывающие и воспроизводящие устройства, телевизионное изображение и звукозаписывающие и воспроизводящие устройства, а также их части и принадлежности статьи |
| Глава 86 | Железнодорожные или трамвайные локомотивы, подвижной состав и их части из них; приспособления и детали для железнодорожных или трамвайных путей из них; механическое (в том числе электромеханическое) движение сигнальное оборудование всех видов |
| Глава 87 | Транспортные средства, кроме железнодорожного или трамвайного подвижного состава, и их части и принадлежности |
| Глава 88 | Самолеты, космические аппараты и их части |
| Глава 89 | Корабли, лодки и плавучие сооружения |
| Глава 90 | Оптический, фотографические, кинематографические, измерительные, проверочные, точные, медицинские или хирургические инструменты и аппараты; части и принадлежности к ним |
| Глава 91 | и их части |
| Глава 92 | Музыкальные инструменты; части и принадлежности таких изделий |
| Глава 93 | Оружие и боеприпасы; их части и принадлежности |
| Глава 94 | Мебель; постельные принадлежности, матрасы, опоры для матрасов, подушки и аналогичные набивные обстановка; лампы и осветительные приборы, в другом месте не поименованные или включены; световой знак светящиеся таблички и как; сборные здания |
| Глава 95 | |
| Глава 96 | Разное готовые изделия |
| Глава 97 | Произведения искусства, предметы коллекционирования и антиквариат |
| Глава 98 | Специальные положения классификации |
| Глава 99 | Временное законодательство; объявлены временные модификации в соответствии с законодательством о торговых соглашениях; дополнительный импорт ограничения, провозглашенные в соответствии со статьей 22 Закона о сельском хозяйстве Закон об урегулировании с поправками |
Химическая Приложение к Тарифному плану
Фармацевтическое приложение к Тарифу Расписание
Средний Химия для красителей Приложение к Тарифной таблице
Статистический Приложения
Приложение А — Приложение С,
Классификация обозначений стран и территорий для U.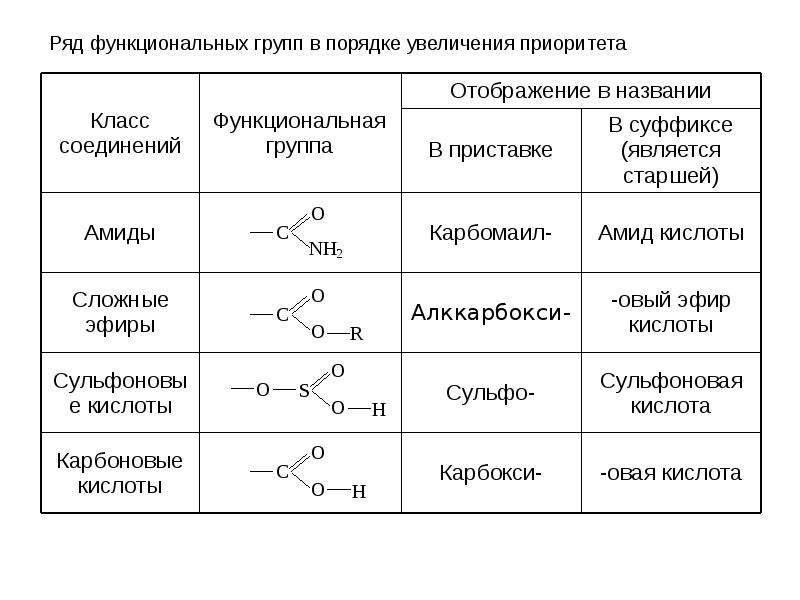

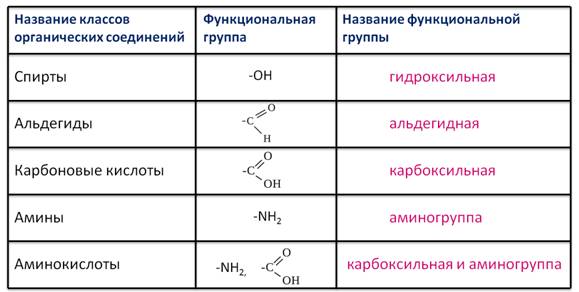 ...............................(ароматическое или алифатическое)
Физическая константа ................................(температура кипения или плавления)
Испытания на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Тестовое наблюдение
Судя по приведенным выше тестам и наблюдениям, данное соединение, вероятно, является
.................................(кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
(а)
(б)
(с)
Получение производного (способ получения)
Наблюдаемые т.пл. производной
лит. т.пл. производной
Результат
Соединение № ................................ это ..................... ......
(дайте формулу)
...............................(ароматическое или алифатическое)
Физическая константа ................................(температура кипения или плавления)
Испытания на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Тестовое наблюдение
Судя по приведенным выше тестам и наблюдениям, данное соединение, вероятно, является
.................................(кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
(а)
(б)
(с)
Получение производного (способ получения)
Наблюдаемые т.пл. производной
лит. т.пл. производной
Результат
Соединение № ................................ это ..................... ......
(дайте формулу)
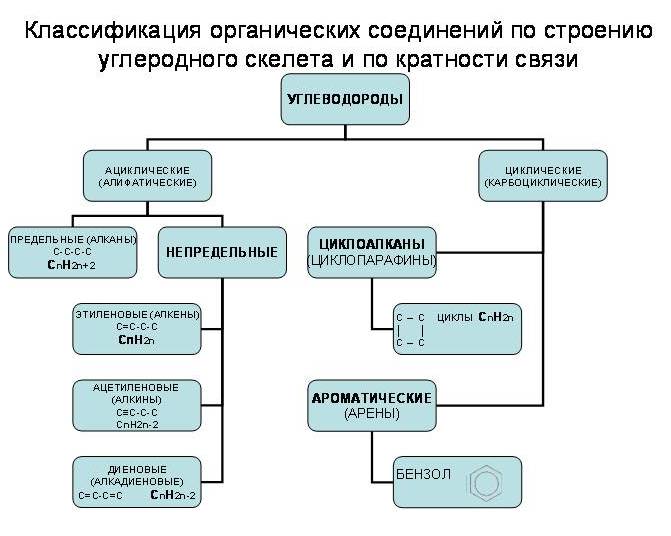 _________________________________________________________________________
Обычно образуются алифатические и желтые маслянистые нитрозамины.II ароматический R2NH + HNO2 -> R2N-NO
_________________________________________________________________________
III алифатический Нет видимой реакции.
_________________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если п-положение незамещено).
_________________________________________________________________________
_________________________________________________________________________
Обычно образуются алифатические и желтые маслянистые нитрозамины.II ароматический R2NH + HNO2 -> R2N-NO
_________________________________________________________________________
III алифатический Нет видимой реакции.
_________________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если п-положение незамещено).
_________________________________________________________________________
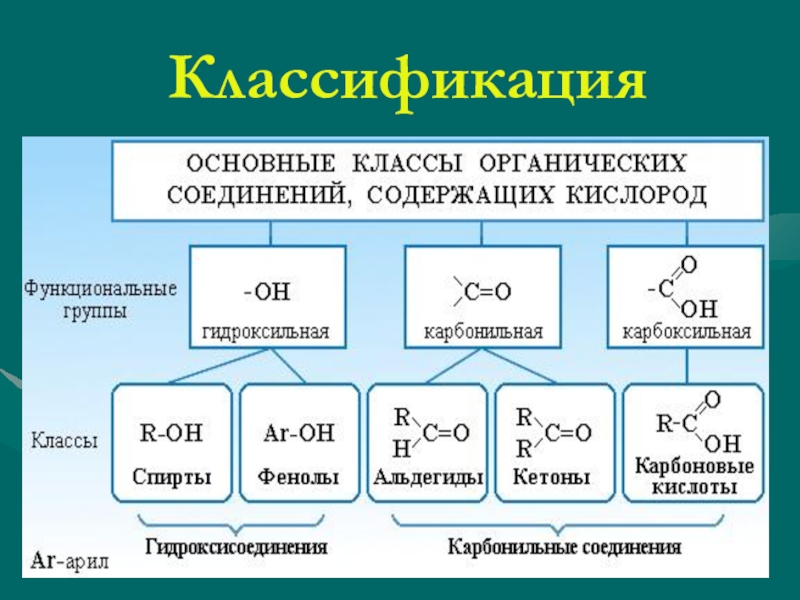 Это связано с тем, что увеличение количества осадков способствует более активному росту растений, что приводит к накоплению большего количества органических веществ в почве.
Это связано с тем, что увеличение количества осадков способствует более активному росту растений, что приводит к накоплению большего количества органических веществ в почве.
