Измерение количества теплоты — урок. Физика, 8 класс.
При расчёте задач в современной физике единицей измерения энергии и теплоты является джоуль. Эта единица измерения введена в \(1889\) году.
Калорию как единицу измерения тепла предложил Йохан Карл Вильке (\(1732\)-\(1796\)) — шведский физик-экспериментатор. Он измерил удельную теплоёмкость твёрдых тел в \(1772\) году. Более века калория являлась единственной признанной наукой единицей измерения количества тепловой энергии.
Калория — это количество теплоты, которое необходимо для нагревания \(1\) г воды на \(1\)°С.
\(1\) кал \(= 4,19\) Дж \(≈ 4,2\) Дж.
Термин «калория» (от латинского «calor» — тепло) ввёл в научный оборот французский химик (рис. 1) Николя Клеман-Дезорм (\(1779—1842\)).
Рис. 1. Николя Клеман-Дезорм
Его определение калории как единицы измерения тепла было впервые опубликовано в \(1824\) году в журнале «Le Producteur», а во французских словарях оно появилось в \(1842\) году.
Однако задолго до появления этого термина были сконструированы первые калориметры — приборы для измерения теплоты.
Первый калориметр изобрёл английский химик (рис. 2) Джозеф Блэк и в \(1759—1763\) годах с его помощью определил теплоёмкости разных веществ, скрытую теплоту плавления льда и испарения воды.
Рис. 2. Джозеф Блэк
Изобретением Д. Блэка воспользовались знаменитые французские учёные (рис. 3, 4) Антуан Лоран Лавуазье (\(1743—1794\)) и Пьер Симон Лаплас (\(1749—1827\)).
Рис. 3. Антуан Лоран Лавуазье
Рис. 4. Пьер Симон Лаплас
В \(1780\) году они начали серию калориметрических экспериментов, которые позволили измерить тепловую энергию.
Это понятие встречается ещё в \(XVIII\) веке в трудах шведского физика (рис. 5) Иоганна Карла Вильке (\(1732—1796\)), который занимался исследованием электрических, магнитных и тепловых явлений и задумывался об эквивалентах, в которых можно измерять тепловую энергию.
Рис. 5. Иоганн Карл Вильке
Устройство, которое впоследствии начали называть калориметром, Лавуазье и Лаплас использовали, чтобы измерять количество теплоты, выделяющееся в различных физических, химических и биологических процессах. Тогда ещё не было точных термометров, поэтому для измерения теплоты приходилось идти на ухищрения.
Рис. 6. Изображение первого калориметра
Первый калориметр был ледяным (рис. 6). Внутренняя полая камера, куда помещали объект, излучающий тепло (например, мышку), была окружена рубашкой, заполненной льдом или снегом. А ледяная рубашка, в свою очередь, была окружена воздушной, чтобы лёд не плавился под действием внешнего нагрева. Тепло от объекта внутри калориметра нагревало и плавило лёд. Взвешивая талую воду, стекавшую из рубашки в специальный сосуд, исследователи определяли теплоту, выделенную объектом.
Этот прибор позволил Лавуазье и Лапласу измерить теплоту многих химических реакций: сгорания угля, водорода, фосфора, чёрного пороха. Своими работами они заложили основы термохимии и сформулировали её основной принцип:
Своими работами они заложили основы термохимии и сформулировали её основной принцип:
Всякие тепловые изменения, которые испытывает какая-нибудь материальная система, переменяя своё состояние, происходят в обратном порядке, когда система вновь возвращается в своё первоначальное состояние.
Иными словами, чтобы разложить воду на водород и кислород, надо затратить столько же энергии, сколько выделяется при реакции водорода с кислородом с образованием воды.
В том же \(1780\) году Лавуазье поместил в калориметр морскую свинку. Тепло от её дыхания растапливало снег в рубашке. Потом последовали и другие эксперименты, которые имели огромное значение для физиологии.
Тогда-то Лавуазье высказал мысль, что дыхание животного подобно горению свечи, за счёт которого в организме поддерживается необходимый запас тепла. Он также впервые связал три важнейшие функции живого организма: дыхание, питание и транспирацию (испарение воды). Видимо, с тех пор и заговорили о том, что пища сгорает в нашем организме.
В \(XIX\) веке благодаря стараниям знаменитого французского химика (рис. 7) Марселена Бертло (\(1827—1907\)), который опубликовал более 200 работ по термохимии, точность калориметрических методов сильно повысилась и появились более совершенные приборы — водяной калориметр и герметичная калориметрическая бомба (рис. 8).
Рис. 7. Марселен Бертло
Последний прибор нам особенно интересен, потому что в нём можно измерять теплоту, выделяемую при очень быстрых реакциях — горении и взрыве.
Рис. 8. Изображение калориметрической бомбы
Навеску сухого исследуемого вещества насыпают в тигель, помещают внутри бомбы и герметично закрывают этот сосуд. Затем вещество поджигают электрической искрой. Оно сгорает, отдавая тепло воде в окружающей его водяной рубашке. Термометры позволяют точно фиксировать изменение температуры воды.
В похожем калориметре в тридцатых годах \(XIX\) века проводил первые опыты с пищей знаменитый немецкий химик (рис. 9) Юстус фон Либих (\(1803—1873\)), который разделял идеи Лавуазье о том, что пища — это топливо для организма, как дрова для печки.
9) Юстус фон Либих (\(1803—1873\)), который разделял идеи Лавуазье о том, что пища — это топливо для организма, как дрова для печки.
Рис. 9. Юстус фон Либих
Рис. 10. Юлиус фон Майер
Либих назвал эти дрова: белки, жиры и углеводы. Он сжигал навески пищи в калориметре и измерял выделившееся тепло. На основании результатов этих опытов Либих вместе со своим коллегой Юлиусом фон Майером (рис. 10) составил первые в мире таблицы калорийности продуктов питания и на их основе попытался рассчитать научно обоснованный рацион для прусских солдат.
Знаменитым последователем Юстуса фон Либиха стал американский агрохимик (рис. 11)Уилбур Олин Этуотер (\(1844—1907\)).
Рис. 11. Уилбур Олин Этуотер
Этуотер первым додумался измерять энергоёмкость компонентов пищи и придумал схему подсчёта калорийности любых продуктов питания. Ему не пришлось начинать с нуля. Три года (\(1869—1871\)) Этуотер провёл в Германии, где изучал опыт европейских коллег-агрохимиков. Здесь он не только вдохновился идеями физиологической калориметрии, посеянными Либихом, но и освоил некоторые методики эксперимента.
Здесь он не только вдохновился идеями физиологической калориметрии, посеянными Либихом, но и освоил некоторые методики эксперимента.
Сегодня Этуотера называют отцом диетологии. Значения калорийности углеводов (\(4\) ккал/г), белков (\(4\) ккал/г) и жиров (\(9\) ккал/г) впервые экспериментально получил Этуотер. Но и теперь, спустя сто двадцать лет, диетологи используют эти цифры при подсчёте энергетической ценности продуктов питания. Система Этуотера по сей день лежит в основе маркировки продуктов. И в этом смысле, как верно подметил кто-то из журналистов, Уилбур Этуотер — самый цитируемый учёный в мире.
Источники:
Рис. 6. Автор: A. Arsonval.Original uploader was Cumulus at nl.wikipedia — Lumiere electrique 18 oktover 1884, Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=8652828.
Рис. 8. By Mmmmm at Czech Wikipedia, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=63238360.
Количества теплоты, единицы измерения — Справочник химика 21
Количество теплоты, подводимой (или отводимой) к произвольной массе вещества, обозначают Qt, а удельное количество теплоты, отнесенное к единице массы вещества, — (/. Теплоту в системе СИ измеряют в джоулях (Дж), килоджоулях (кДж) допускаются и такие единицы измерения, как калория и килокалория (ккал). [c.25]
Теплоту в системе СИ измеряют в джоулях (Дж), килоджоулях (кДж) допускаются и такие единицы измерения, как калория и килокалория (ккал). [c.25]Теплоемкость. Для измерения количества теплоты, подводимой к га у (или отводимой от него), надо знать удельную теплоемкость газа. Удельной теплоемкостью (или просто теплоемкостью) называется количество теплоты, которое необходимо подвести к единице количества вещества (или отвести от него), чтобы повысить (или понизить) его температуру на один градус. [c.25]
Единицами измерения количества теплоты служат джоуль и калория (ГОСТ 8550—57). В практике расчетов необходимо различать малые калории (кал) и большие калории, или килокалории (ккал). Одна малая калория представляет собой количество тепла, которое необходимо для нагревания 1 г, а ккал — 1 кг воды на 1 (с 19,5 до 20,5° С) при нормальном атмосферном давлении.
Необходимо условиться относительно единицы измерения количества теплоты. В настоящее время за единицу количества теплоты принят джоуль, который равен работе, производимой силой в 1 ньютон при перемещении точки ее приложения на 1 -метр по направлению этой силы. С другой стороны, джоуль можно охарактеризовать как работу, совершаемую электрическим током мощностью в 1 ватт в течение 1 с. Наконец, следует отметить, еще одно определение джоуля, связанное непосредственно с представлением о количестве теплоты. Джоуль — это такое количество теплоты, которое необходимо для нагревания 1/4,186 г воды на ГС в интервале температур от 14,65 до 15,65°С. Последнее определение иллюстрирует взаимосвязь джоуля с калорией, которая в настоящее время для определения количества теплоты не рекомендуется. Следовательно, единицей теплоемкости для принятой единицы количества вещества является Дж/К. [c.29]
В настоящее время за единицу количества теплоты принят джоуль, который равен работе, производимой силой в 1 ньютон при перемещении точки ее приложения на 1 -метр по направлению этой силы. С другой стороны, джоуль можно охарактеризовать как работу, совершаемую электрическим током мощностью в 1 ватт в течение 1 с. Наконец, следует отметить, еще одно определение джоуля, связанное непосредственно с представлением о количестве теплоты. Джоуль — это такое количество теплоты, которое необходимо для нагревания 1/4,186 г воды на ГС в интервале температур от 14,65 до 15,65°С. Последнее определение иллюстрирует взаимосвязь джоуля с калорией, которая в настоящее время для определения количества теплоты не рекомендуется. Следовательно, единицей теплоемкости для принятой единицы количества вещества является Дж/К. [c.29]
В данной книге в качестве единицы измерения теплоты используется только джоуль, однако следует знать и о калории, поскольку в старой литературе повсеместно используется именно калория. Калория приблизительно вчетверо больше джоуля 1 кал = 4,184 Дж. Теплоты реакций для молярных количеств веществ обычно имеют порядок килоджоулей (кДж) или килокалорий (ккал) 1 кДж = 1000 Дж и 1 ккал = 1000 кал. [c.89]
Калория приблизительно вчетверо больше джоуля 1 кал = 4,184 Дж. Теплоты реакций для молярных количеств веществ обычно имеют порядок килоджоулей (кДж) или килокалорий (ккал) 1 кДж = 1000 Дж и 1 ккал = 1000 кал. [c.89]
Теперь необходимо рассмотреть, какие виды подобия, кроме геометрического, встречаются в системах, используемых в химической технологии. В гл. 6 подробно рассматривались уравнения, описываюш ие элемент процесса, причем было получено три уравнения для потока компонента, теплоты (энтальпии) и импульса (количества движения). Каждое такое уравнение имело пять составляющих I — для конвективного потока II — для основного потока III — для переходящего потока IV — для источников V — для локальных изменений. В случае стационарных установившихся систем составляющая V равна нулю. В дальнейшем ограничимся рассмотрением только тех систем, в которых принимаются во внимание лишь четыре составляющие (с I по IV). Полученные в предыдущей главе уравнения (6-49) и (6-50) размерно однородны.
Джоуль является очень удобной единицей измерения теплоты, так как с его помощью легко понять связь между теплотой, работой-и энергией. До введения системы СИ в химии было принято пользоваться в качестве единицы измерения теплоты калорией. Одна калория (кал) определяется как количество теплоты, необходимое для повышения температуры 1 г чистой воды на 1″С (точнее от 14,5 до 15,5″»С). Это определение основано на измерениях теплоты и непосредственно не связано с работой. Дело в том, что калория была введена в XIX столетии, когда еще не было известно, что теплота и работа являются различными формами энергии.
 [c.88]
[c.88] Сравнение этих двух величин, измеренных в соответствующих единицах (с учетом ряда поправок), показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Поскольку одно и тоже изменение состояния (определяемое измерением таких свойств системы, как температура, давление и объем) можно получить, совершая над системой работу или сообщая ей теплоту, количество теплоты q может быть выражено в механических единицах. В опытах, подобных опыту Джоуля, найдено, что затрата 4,184 Дж работы производит такое же изменение состояния, как и 1 кал теплоты, полученная системой извне. [c.18]
Традиционной единицей измерения теплоты, работы и энергии является калория, которая вводится эмпирически как количество теплоты, необходимое для повышения температуры одного грамма воды на один градус Кельвина (в системе СИ просто на 1 кельвин). Хотя, согласно термодинамике, теплота, энергия и работа эквивалентные величины, единица их измерения-калория-не связана очевидным образом с массой и ускорением. Такой выбор единиц затрудняет понимание физической связи между ними. Джоуль как единица измерения теплоты гораздо удобнее в том отношении, что позволяет видеть связь между теплотой, работой и энергией уже по самому своему определению. Хотя большая часть термодинамической литературы основана на использовании калории, логическая простота определения джоуля должна в конце концов обеспечить его повсеместное использование, подобно тому как литр и метр вытеснили галлон и ярд в большинстве передовых стран мира. [c.443]
Хотя, согласно термодинамике, теплота, энергия и работа эквивалентные величины, единица их измерения-калория-не связана очевидным образом с массой и ускорением. Такой выбор единиц затрудняет понимание физической связи между ними. Джоуль как единица измерения теплоты гораздо удобнее в том отношении, что позволяет видеть связь между теплотой, работой и энергией уже по самому своему определению. Хотя большая часть термодинамической литературы основана на использовании калории, логическая простота определения джоуля должна в конце концов обеспечить его повсеместное использование, подобно тому как литр и метр вытеснили галлон и ярд в большинстве передовых стран мира. [c.443]
Единицей измерения количества теплоты, внутренней энергии, работы и других энергетических величин в системе СИ является Дж или Дж/моль. [c.19]
Иными словами, дифференциальной теплотой адсорбции называется тепло, выделившееся при дополнительной адсорбции малого количества адсорбтива и пересчитанное на 1 его моль.
Выясним физический смысл коэффициентов в выражении (П.36). Здесь 1т — количество теплоты, которое необходимо сообщить системе для поддержания ее при постоянной температуре ири увеличении объема на единицу измерения в отсутствие химических реакций. Таким образом, 1т является теплотой изотермического расширения системы (скрытая теплота расширения). [c.38]
Количество выделенной (или поглощенной) теплоты называют тепловым эффектом процесса . Чтобы этой величине придать полную определенность, надо условиться об ее знаке, выбрать единицы измерения, установить, к какому количеству вещества ее следует относить, и выбрать режим протекания процесса. Примем положительным тепловой эффект эндотермических процессов условимся выражать его в килокалориях (ккал). [c.9]
Следует отметить, что в системах тепловых единиц СИ, МКС °К МКС °С единицей измерения количества теплоты является джоуль, а не калория между этими единицами узаконено следующее соотношение 1 межд. кал=4,1868 дж 1 межд. кк гл= 1/859,845 абс. квт. ч. Аналогично и единицей измерения теплового потока служит ватт, вместо калории в секунду. [c.578]
кал=4,1868 дж 1 межд. кк гл= 1/859,845 абс. квт. ч. Аналогично и единицей измерения теплового потока служит ватт, вместо калории в секунду. [c.578]
В зависимости от используемой единицы измерения количества испаренного вещества теплота испарения может быть массовой, мольной и объемной. В расчетах нефтеперерабатывающей аппаратуры чаще применяют массовую и мольную теплоты иопарения. [c.70]
Для измерения тепловой энергии используется условная единица, называемая калорией. Калория представляет собой количество теплоты, необходимое для повышения температуры 1 г воды от 14,5 до 15,5 °С. Экспериментально установлено, что 4,184 Дж механической энергии могут быть превращены в 1 кал тепловой энергии, хотя следует отметить, что обратное превращение осуществляется далеко не так просто. Несмотря на это, механический эквивалент тепловой энергии установлен достаточно точно, Для измерения больших количеств тепловой энергии используется килокалория 1 ккал = 1000 кал.
В 1780 г. была предложена и единица измерения теплоты, широко применяемая, несмотря на то, что не входит в СИ, и в настоящее время, — калория. Калории соответствует количество тепла, необходимое для нагревания 1 г воды от 14,5 до 15,5 °С. [c.309]
Потери из-за теплопроводности при измерениях температуры в пламенах с помощью тонких термопар можно сделать незначительными, если расположить оба электрода термопары в плоскостях с одинаковой температурой. Потери тепла излучением можно определить, приравнивая этим потерям количество теплоты, передаваемой от газа к зонду [1, с. 139]. Для сферического зонда диаметра ё. находящегося при установившейся температуре Та и введенного в газ с коэффициентом теплопроводности % и температурой Тг (при Тг>Тз), количество тепла, передаваемого на единицу площади поверхности зонда, можно приближенно определить как (2Х/с1) (Гг—Та). Это справедливо для зонда, диаметр которого достаточно мал (число Рейнольдса много меньше единицы).
 Тепловые потери зонда излучением к стенкам при температуре стенок Гст характеризуются величиной еа(П—Т ст) (где е —степень черноты зонда, а — постоянная Стефана — Больцмана). Приравнивая выражения для этих двух тепловых потоков, можно найти погрешность в измерении температуры, возникающую вследствие излучения
Тепловые потери зонда излучением к стенкам при температуре стенок Гст характеризуются величиной еа(П—Т ст) (где е —степень черноты зонда, а — постоянная Стефана — Больцмана). Приравнивая выражения для этих двух тепловых потоков, можно найти погрешность в измерении температуры, возникающую вследствие излучения Поскольку количество теплоты, выделяющейся при погружении в жидкость обезгаженного порошка, пропорционально смачиваемой поверхности, измерение теплоты смачивания позволяет быстро оценить относительные поверхности любых образцов из одного и того же материала. Этот метод, однако, имеет серьезные ограничения, связанные с тем, что для каждого типа твердого тела необходимо с помощью сравнения с каким-либо методом определения абсолютной поверхности находить теплоту смачивания единицы поверхности. [c.365]
КАЛОРИЯ — единица измерения количества теплоты. Назва- [c.260]
Стандартной единицей измерения количества теплоты в системе СИ принят джоуль (дж). Эта единица в настоящее время и служит основной во всех технических расчетах. В связи с тем, что джоуль — величина незначительная (см. табл. 2, стр. 444), в расчетной практике часто пользуются укрупненными его значениями кдж, Мдж, Гдж и т. д. [c.23]
Эта единица в настоящее время и служит основной во всех технических расчетах. В связи с тем, что джоуль — величина незначительная (см. табл. 2, стр. 444), в расчетной практике часто пользуются укрупненными его значениями кдж, Мдж, Гдж и т. д. [c.23]
Примечание. В отдельных случаях ГОСТ 1550—61 временно допускается пользование и несистемной единицей измерения количества теплоты — калорией (кал) и кратным ее значением — килокалорией (ккал). За килокалорию принята величина, равная 1/840 квт-ч. Практически калория представляет собой количество тепла, необходимое для нагревания 1 г воды на 1° (с 19,5 до 20°,5 С) при нормальном атмосферном давлении. В переводе на систему СИ 1 л а- = 4,1868 дж, или 1 л л 0л=4,1868 кдж . [c.23]
В таблице приведены тепловые единицы измерения рекомендованной ГСК Том 8550-57 системы МКС К (МКС °С), отвечающие аналогичным единицам системы СИ. В систему включена дополнительная основная единица измерения — градус абсолютной термодинамической шкалы (градус стоградусной термодинамической шкалы). Для ее установления используется второе начало термодинамики (количество теплоты, переданное телом холодильнику, зависит только от абсолютных температур тела и холодильника) . [c.751]
Для ее установления используется второе начало термодинамики (количество теплоты, переданное телом холодильнику, зависит только от абсолютных температур тела и холодильника) . [c.751]
Калориметрические измерения теплот растворения полимеров весьма сложны, так как в единицу времени выделяется или поглощается очень малое количество тепла. Подобные измерения требуют точных приборов и искусства экспериментатора. Применять большие навески полимеров практически невозможно, так как, во-первых, значительно увеличивается вязкость образующихся растворов, что затрудняет их перемешивание, а, во-вторых, очень возрастает продолжительность тепловой реакции. Поэтому в большинстве исследований определяют интегральную теплоту образования растворов, в которых массовая доля полимера не превы шает 0,1. Их значения приведены в табл. 11.2. [c.316]
Согласно определению, удельная теплопроводность Я соединения равна количеству теплоты, которое протекает через плоскую пластину толщиной 1 см и площадью 1 см за 1 с при условии, что между поверхностями пластины поддерживается разность температур 1 К. Таким образом, единица измерения удельной теплопроводности — Вт/(м-К). Теплопроводность осуществляется в результате прямой передачи энергии между молекулами без учета влияния конвекции или излучения. Согласно законам кинетической теории газов, в области температур и давлений, применяемых в газовой хроматографии, теплопроводность не зависит от давления и для всех газов существенно увеличивается с ростом температуры. [c.379]
Таким образом, единица измерения удельной теплопроводности — Вт/(м-К). Теплопроводность осуществляется в результате прямой передачи энергии между молекулами без учета влияния конвекции или излучения. Согласно законам кинетической теории газов, в области температур и давлений, применяемых в газовой хроматографии, теплопроводность не зависит от давления и для всех газов существенно увеличивается с ростом температуры. [c.379]
Терм — единица измерения больших количеств теплоты по английской системе. 1 терм равен 1 млн. британских тепловых единиц (Вtu). [c.168]
Согласно системе СИ единицей измерения работы, энергии, количества теплоты является джоуль (дж). Применяется также кратная единица — килоджоуль (кдж) 1 кдж = ЮбО дж. Между килокалорией и килоджоулем существует соотношение 1 ккал = 4,1868 кдж. [c.25]
Когда хотят показать энергетический эффект химической реакции, то в правой части уравнения реакции записывают количество выделенной или поглощенной теплоты в тех или иных единицах измерения. Так как в уравнении реакции формула каждого вещества выражает его количество, равное одному молю, а коэффициент при формуле — число молей этого вещества, то и величину энергии, записанную в уравнении, относят к обозначенным в уравнении количествам исходных и полученных веществ. Выделенную энергию записывают обычно со знаком плюс, а поглощенную—со знаком минус. В первом случае реакцию называют экзотермической, во втором — эндотермической. Такие уравнения, выражающие законы сохранения массы и энергии в химических реакциях, называются термохимическими. Термохимия — раздел науки о взаимных превращениях химической и тепловой энергии. Термохимическим уравнениям присущи все свойства алгебраических равенств, поэтому с ними можно производить математические действия. [c.74]
Так как в уравнении реакции формула каждого вещества выражает его количество, равное одному молю, а коэффициент при формуле — число молей этого вещества, то и величину энергии, записанную в уравнении, относят к обозначенным в уравнении количествам исходных и полученных веществ. Выделенную энергию записывают обычно со знаком плюс, а поглощенную—со знаком минус. В первом случае реакцию называют экзотермической, во втором — эндотермической. Такие уравнения, выражающие законы сохранения массы и энергии в химических реакциях, называются термохимическими. Термохимия — раздел науки о взаимных превращениях химической и тепловой энергии. Термохимическим уравнениям присущи все свойства алгебраических равенств, поэтому с ними можно производить математические действия. [c.74]
Калория является внесистемной единицей. Она допускается к использованию лишь в виду большой трудности осуществления перехода к джоулю как единственной единице измерения количества теплоты. Определением калории в настоящее время является только соотношение ее с джоулем. Поэтому при названии и обозначении калории отсутствует указание на температуру. [c.183]
Поэтому при названии и обозначении калории отсутствует указание на температуру. [c.183]
О количестве сообщенной ледяному калориметру теплоты судят по изменению объема смеси вода — лед, находящейся при 0° С. Изменение объема измеряют по перемещению ртути в капилляре или по взвешиванию ртути, вытекающей из капилляра или втягиваемой в него. Поскольку удельный объем льда, воды и ртути и теплота плавления льда при 0° С точно известны, для ледяного калориметра можно заранее рассчитать, какое количество сообщенной калориметру теплоты вызовет определенное изменение объема или какое изменение объема будет наблюдаться при сообщении калориметру единицы количества теплоты. Эти константы не зависят от конструкции калориметра. Кроме того, изменение объема всегда будет строго пропорционально количеству теплоты. Эти соображения могут привести к мысли, что градуировка ледяного калориметра не является необходимой. Однако и для ледяного калориметра следует рекомендовать эмпирическую градуировку, так как выполнение ее позволяет, во-первых, учесть неравномерность сечения капилляра и, во-вторых, получить все отмеченные выше преимущества сравнительного метода измерений. [c.227]
[c.227]
Интегральная теплота растворения полимера может быть измерена калориметрическим методом. Это достигается смешением па-вески полимера с определенным количеством низкомолекулярного компонента, находящегося в калориметрическом сосуде. При соприкосновении с растворителем по-лил1ер набухает, а затем растворяется. Процесс в целом, даже при очень малых навесках полиме-а, Продолжается от 20 до шн. Основная трудность этого метода зак.лю-чается в том, что в единицу Времени выделяется Или поглощается очепь небольшое количество теплоты. Подобные измерения требуют точных приборов и искусства экспериментатора. Применять большие навески полимеров Практически невозможно, так как, во-первых, значительно увеличивается вязкость образующихся растворов, что затрудняет их перемешивание, а во-вторых, очень возрастает время тепловой реакции. Поэтому в большинстве исследований определяют интегральную теплоту образования растворов, в которых весовая доля полимера не превышает 0,1. [c.361]
[c.361]
ТЕПЛОТА СГОРАНИЯ (топлива) — количество теплоты, выделяющейся при полном сгорании топлива в кислороде (раньше эта величина наа. теплотворной способность ю). Т. с. определяют нри нсследованпи топлива, для к-рого эта величина является одним из вая нейших показателей его практич. ценности. Томи же методами, что и для топлив, Т. с. определяют и при исследовапии органич. веществ с целью получения данных об их структуре (см. Теплота образования). При полном сгорании в кислороде органич. вещества его Т. с. характеризуется суммой тепловых эффектов реакций превращения углерода в углекислый газ, водорода — в воду, серы — в серный ангидрид, выделения азота и галогенов в свободном виде. Т. с. измеряют в джоулях 1 Зж= = 1 ньютон-1 метр=(1и-1 м), или в калориях (1 кал= =4,1868 дж). Т. с., отнесенная к единице количества вещества, наз. удельной теплотой сгорания. В зависимости от выбранной для измерения единицы количества вещества удельную Т. с. обозначают для твердого и жидкого вещества — кдж1кг, кал г, ккал кг, для газообразного вещества — кдж/лА, шт ккал , с фиксацией условий (темп-ра, давление) замера объема газа. Обычно берется кубич. метр сухого газа, измеренный нри 20° и 760 мм рт. ст. (ГОСТ 2939—63). [c.39]
Обычно берется кубич. метр сухого газа, измеренный нри 20° и 760 мм рт. ст. (ГОСТ 2939—63). [c.39]
Теплоемкостью называется количество теплоты, необходимое для нагревания рабочего тела на 1 фадус. Удобно оперировать удельной теплоемкостью с, отнесенной к единице массы тела. В курсе ПАХТ чаще всего используют теплоемкость при постоянном давлении (с = Ср). Единица измерения теплоемкости Дж/ кгК). [c.54]
Понятие о теплоемкости с (с указанием ее размерности и единиц измерения) введено в разд. 1.2.3 как количество теплоты, необходимой для изменения на 1 фадус единичной массы рабочего тела (вещества). В основном при изучении теплопереноса используют теплоемкость при постоянном давлении , (в гл. 6 и 7 индекс р» опущен). Величина с в общем случае зависит от температуры, хотя и не всегда существенно. Заметим, что в практических расчетах теплоемкость выражают не только в Дж/ кг-К), но и в кДж/ кг К). [c.472]
Работа, количество теплоты, энергия измеряются в джоулях (Дж). в технике применяют следующие единиць измерения теплоты — калория — это количество тепла, необходимого для нагрева 1 г воды на 1 градус Цельсия, и килокалория, равная 4,1868 Дж. Количество электричества — киловатт-час, равный 3,6 10 Дж. [c.291]
в технике применяют следующие единиць измерения теплоты — калория — это количество тепла, необходимого для нагрева 1 г воды на 1 градус Цельсия, и килокалория, равная 4,1868 Дж. Количество электричества — киловатт-час, равный 3,6 10 Дж. [c.291]
Единицей измерения количества теплоты служит калория. В практике расчетов необходимо различать малые калории (кал) и большие калории, или килокалории ккал). Одна малая калория представляет соаой количество тепла, которое необходимо для нагревания 1 г воды на 1 (с 19,5 до 20,5 С) при нормальном атмосферном давлении. Таким образом, 1 кал по своей величине равна теплоемкости воды. Одна большая калория представляет собой количество тепла, необходимое для нагревания 1 кг воды на 1° (от 19,5 до 20,5 С). Отсюда ясно, что 1 ккал = 1 ООО кал. [c.32]
Q = Qв — К (У ккал кг (кдж/кг) где К — коэфф., равный, в зависимости от выбранной единицы измерения (калория или джоуль), соответственно 6 или 25 — содержание влаги в испытуемом топливе, вес. % Н — содержание водорода в испытуемом топливе, вес. %. Для определения низшей теплоты сгорания газа при его сжигании в проточном калориметре собирают воду, выделившуюся при горении газа, и, исходя из количества поды, вводят в поправку на скрытую теплоту образования пара. [c.40]
% Н — содержание водорода в испытуемом топливе, вес. %. Для определения низшей теплоты сгорания газа при его сжигании в проточном калориметре собирают воду, выделившуюся при горении газа, и, исходя из количества поды, вводят в поправку на скрытую теплоту образования пара. [c.40]
Большое разнообразие задач, ставящихся при калориметрич. измерениях, и условий проведения этих измерений обусловливает наличие большого числа различных типов калориметров. Устройство калориметров настолько разнообразно, что всеобъемлющая классификация их чрезвычайно затруднительна. Отдельные, наиболее распространенные типы калориметров описаны ниже. Большинство из них относится к калориметрам с переменной т емп-рой. Количество теплоты опыта, вычисляется по ф-ле = Я , где Я — тепловое значение калориметра, т. е. количество теплоты, необходимое для нагревания калориметра на 1°, а Дг — изменение его темп-ры в опыте. Это изменение обычно составляет величину 1—3° и в прецизионных работах должно измеряться с высокой точностью. Для измерения темп-ры калориметра обычно используются ртутные термометры, термометры сопротивления или термопары, а при высоких темп-рах — оптич. пирометры. Часто употребляются специальные калориметрич. термометры, обладающие высокой чувствительностью. Значение Н определяется или специальными опытами, в к-рых в калориметр вводится известное количество теплоты и измеряется Аг, или же расчетом, по теплоемкости всех тел, входяпщх в калориметр. Второй способ является менее точным и в последнее время применяется редко. Для определения Н нагревом (или охлаждением) калориметра известное количество теплоты Q вводится или с помощью нагревателя, питаемого электрич. током, или с помощью процесса, тепловой эффект к-рого хорошо известен (напр., теплота сгорания бензойной к-ты, теплота растворения хлористого калия и т. д,). Определение Я вводом известного количества теплоты может быть произведено с высокой точностью (до 0,01%, а иногда и выше). Очень существенно, что этот способ позволяет измерять темп-ру калориметра в условных единицах.
Для измерения темп-ры калориметра обычно используются ртутные термометры, термометры сопротивления или термопары, а при высоких темп-рах — оптич. пирометры. Часто употребляются специальные калориметрич. термометры, обладающие высокой чувствительностью. Значение Н определяется или специальными опытами, в к-рых в калориметр вводится известное количество теплоты и измеряется Аг, или же расчетом, по теплоемкости всех тел, входяпщх в калориметр. Второй способ является менее точным и в последнее время применяется редко. Для определения Н нагревом (или охлаждением) калориметра известное количество теплоты Q вводится или с помощью нагревателя, питаемого электрич. током, или с помощью процесса, тепловой эффект к-рого хорошо известен (напр., теплота сгорания бензойной к-ты, теплота растворения хлористого калия и т. д,). Определение Я вводом известного количества теплоты может быть произведено с высокой точностью (до 0,01%, а иногда и выше). Очень существенно, что этот способ позволяет измерять темп-ру калориметра в условных единицах. Наиболее благоприятным является случай, когда при определении неизвестного количества теплоты и при определении теплового значения калориметра Я в опытах совпадают начальные и конечные темп-ры в этом случае требуется лишь воспроизводимость показаний термометра и отпадает [c.182]
Наиболее благоприятным является случай, когда при определении неизвестного количества теплоты и при определении теплового значения калориметра Я в опытах совпадают начальные и конечные темп-ры в этом случае требуется лишь воспроизводимость показаний термометра и отпадает [c.182]
Международной системой единиц СИ для измерения количества теплоты и теплоемкости приняты единицы дж, или н м, дж1град или н м1град соответственно (1 кал=4,1868 дж и 1 кка г=4,1868 10 дж). Прим. перев. [c.79]
Некоторые из этих единиц были узаконены в различных странах (так, например, в СССР с 1934 по 1957 г. как обязательная единица для измерения теплоты была принята двадцатиградусная калория). В некоторых странах (особенно широко в работах технического профиля в Англии и США) до настоящего времени широко применяется для тепловых измерений так называемая единица BTU (British thermal unit). Эта единица определяется как количество теплоты, необходимое для нагревания 1 фунта воды на 1° по шкале Фаренгейта . Такая многочисленность единиц измерения теплоты создает значительные неудобства и затрудняет сопоставление величин, выраженных в различных единицах. Однако главный недостаток калории как единицы измерения (это относится и к BTU) связан с двумя другими обстоятельствами. [c.178]
Такая многочисленность единиц измерения теплоты создает значительные неудобства и затрудняет сопоставление величин, выраженных в различных единицах. Однако главный недостаток калории как единицы измерения (это относится и к BTU) связан с двумя другими обстоятельствами. [c.178]
Количество теплоты. Удельная теплоемкость вещества :: Класс!ная физика
КОЛИЧЕСТВО ТЕПЛОТЫ
При теплопередаче (теплообмене) внутренняя энергия одних тел уменьшается, а других – увеличивается, без изменения механической энергии тел и без совершения работы.
При этом уменьшается внутренняя энергия тела-нагревателя, а внутренняя энергия нагреваемого тела увеличивается .
Процесс теплопередачи характеризуется количеством теплоты.
Количеством теплоты (Q) называется изменение внутренней энергии тела, происходящее в результате теплопередачи.
Количество теплоты измеряется в системе СИ в джоулях.
[Q] = 1Дж.
Кроме того, для измерения количества теплоты (вне системы СИ) используется единица, называемая калорией (кал).
1 калория равна количеству теплоты, необходимому для нагревания 1 г воды на 1 градус С.
Опытным путем было установлено, что для нагревания 1 г воды на 1 градус требуется
совершить работу в 4,18 Дж, следовательно 1кал = 4,18Дж.
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ВЕЩЕСТВА
Удельная теплоемкость вещества показывает, какое количество теплоты необходимо, чтобы изменить температуру единицы массы данного вещества на 1°С.
Единица удельной теплоемкости в системе СИ :
[c] = 1Дж/кг·градусС.
Удельную теплоемкость данного вещества можно приближенно считать постоянной величиной.
У разных веществ удельная теплоемкость имеет разные значения.
Если одинаковым по массе телам из разных веществ передать одно и то же количество теплоты, то они нагреются до разной температуры. Вещество с меньшей теплоемкостью нагреется сильнее,
Вещество с меньшей теплоемкостью нагреется сильнее,
а вещество с большей теплоемкостью — слабее.
КНИЖНАЯ ПОЛКА
Глобальное потепление. Ведет ли оно к катастрофе?
ИНТЕРЕСНО
…что в пустынях днем очень жарко, а ночью температура падает ниже 0°С. Это происходит потому,
что песок обладает малой удельной теплоемкостью, поэтому быстро нагревается и охлаждается.
Устали? — Отдыхаем!
Количество теплоты — О’Пять пО физике!
Это энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях.
Количество
тепловой энергии в веществе нельзя определить, наблюдая за движением каждой его
молекулы по отдельности. Напротив, только изучая макроскопические свойства
вещества, можно найти усредненные за некий период времени характеристики
микроскопического движения многих молекул. Температура вещества – это средний
показатель интенсивности движения молекул, энергия которого и есть тепловая
энергия вещества.
Температура вещества – это средний
показатель интенсивности движения молекул, энергия которого и есть тепловая
энергия вещества.
Один из самых привычных, но и наименее точных способов оценки температуры – на ощупь. Трогая предмет, мы судим о том, горячий он или холодный, ориентируясь на свои ощущения. Конечно, эти ощущения зависят от температуры нашего тела, что подводит нас к понятию теплового равновесия – одному из важнейших при измерении температуры.
Тепловое равновесие. Очевидно, что если два тела A и B плотно прижать друг к другу, то, потрогав их спустя достаточно долгое время, мы заметим, что температура их одинакова. В этом случае говорят, что тела A и B находятся в тепловом равновесии друг с другом. Однако тела, вообще говоря, не обязательно должны соприкасаться, чтобы между ними существовало тепловое равновесие, – достаточно, чтобы их температуры были одинаковыми.
В этом можно убедиться с помощью третьего тела C, приведя его сначала в тепловое равновесие с телом A, а затем сравнив температуры тел C и B. Тело C здесь играет роль термометра. В строгой формулировке
этот принцип называется нулевым началом термодинамики: если тела A и B
находятся в тепловом равновесии с третьим телом C, то эти тела находятся также
в тепловом равновесии друг с другом. Этот закон лежит в основе всех
способов измерения температуры.
Тело C здесь играет роль термометра. В строгой формулировке
этот принцип называется нулевым началом термодинамики: если тела A и B
находятся в тепловом равновесии с третьим телом C, то эти тела находятся также
в тепловом равновесии друг с другом. Этот закон лежит в основе всех
способов измерения температуры.Нагревание и охлаждение
Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле
Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии.Плавление и кристаллизация
Плавление — переход вещества из твердого состояния в жидкое. Обратный переход называется кристаллизацией.
Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле
Парообразование (испарение или кипение) и конденсация
Парообразование
— это переход вещества из жидкого (твердого) состояния в газообразное. Обратный
процесс называется конденсацией.
Обратный
процесс называется конденсацией.
Горение
Количество теплоты, которое выделяется при сгорании вещества
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:
Q1+Q2+…+Qn=0
Тренажер 1 Тренажер 2 Тренажер 3 Тренажер 4 Тренажер 5
06-в. Количество теплоты и калориметр
§ 06-в. Количество теплоты и калориметр
В этом параграфе мы изучим несколько новых терминов. Определим их. Теплообмен – это явление перехода внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы. Количество теплоты – это энергия, перешедшая от одного тела к другому при теплообмене.
На рисунке показан калориметр – прибор для измерения количества теплоты. Простейший калориметр состоит из двух стаканов: внутреннего алюминиевого и внешнего пластмассового, которые разделены воздушным промежутком.
Простейший калориметр состоит из двух стаканов: внутреннего алюминиевого и внешнего пластмассового, которые разделены воздушным промежутком.
Рассмотрим пример. Во внутренний стакан нальём 100 г воды. Измерим её температуру: 20 °С. Погрузим в воду горячее тело – металлический цилиндрик. Внутри калориметра начнётся теплообмен, и некоторое количество теплоты перейдёт от цилиндрика к воде, в результате чего её температура повысится (см. рисунок). Вычислим изменение температуры воды:
Δt°воды = 60 °С – 20 °С = 40 °С .
Зная, что масса воды 100 г, инженер-теплотехник скажет: вода получила 100 г · 40 °С = 4000 калорий теплоты. В отличие от теплотехники, в физике количество теплоты выражают в джоулях (как и любую другую энергию). Для этого применяют специальную формулу:
Формула для подсчета количества теплоты, поглощаемого телом при нагревании или выделяющегося при его охлаждении. Формула читается так: «Ку равно цэ эм дэльта тэ».
| Q = c·m·Δt° | Q – количество теплоты, Дж |
Удельная теплоёмкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С.
Используя таблицу (см. далее), легко подсчитать, что вода внутри калориметра получила от цилиндрика 16,8 кДж теплоты:
Qводы = 4200 Дж/(кг°С) · 0,1 кг · 40 °С = 16800 Дж .
Формулу Q = cmΔt° применяют не только в том случае, когда вещество нагревается. Её также используют для подсчёта количества теплоты, которое отдают охлаждающиеся тела. Например, вода внутри отопительных батарей в квартире или классе.
Удельные теплоёмкости всех веществ измерены и занесены в специальные таблицы. Например, для воды в жидком состоянии с = 4200 Дж/(кг°С). Это значение показывает, что для нагревания 1 кг воды на 1 °С потребуется 4200 Дж теплоты. Можно сказать и иначе: каждый килограмм воды, остывая на 1 °С, отдаёт окружающим телам 4200 Дж тепловой энергии.
Например, для воды в жидком состоянии с = 4200 Дж/(кг°С). Это значение показывает, что для нагревания 1 кг воды на 1 °С потребуется 4200 Дж теплоты. Можно сказать и иначе: каждый килограмм воды, остывая на 1 °С, отдаёт окружающим телам 4200 Дж тепловой энергии.
Удельная теплоемкость показывает количество теплоты, которое необходимо для нагревания 1 кг вещества на 1 градус. Или, что то же самое, – количество теплоты, которое выделится при охлаждении 1 кг этого вещества на 1 градус.
| Удельные теплоёмкости некоторых веществ, Дж/(кг°С) | ||||
| Алюминий | 920 | Вода | 4200 | |
| Железо | 460 | Лёд | 2100 | |
| Латунь | 400 | Масло подсолн. | 1700 | |
Поясним, почему в определении теплообмена присутствуют слова «без совершения механической работы». Вспомним, что в § 5-е мы рассмотрели опыт с манометром и горячей гирей. Тогда внутренняя энергия гири уменьшалась. Часть этой энергии превращалась в механическую работу – удлинялся «столбик» жидкости в манометре. В опыте с калориметром внутренняя энергия цилиндрика также уменьшалась. Однако теперь она превращалась во внутреннюю энергию воды без совершения работы (см. рисунок; для наглядности цилиндрик изображён вне калориметра).
Тогда внутренняя энергия гири уменьшалась. Часть этой энергии превращалась в механическую работу – удлинялся «столбик» жидкости в манометре. В опыте с калориметром внутренняя энергия цилиндрика также уменьшалась. Однако теперь она превращалась во внутреннюю энергию воды без совершения работы (см. рисунок; для наглядности цилиндрик изображён вне калориметра).
Калориметрические измерения показывают, что теплообмен всегда протекает так, что убыль внутренней энергии одних тел сопровождается таким же приращением внутренней энергии других тел, участвующих в теплообмене. Это – одно из проявлений закона сохранения и превращения энергии.
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
Источник
Больше интересного в телеграм @calcsboxУрок по теме «Количество теплоты» к разделу «Тепловые явления». 8-й класс
Физика, как и всякая наука о природе, ставит
своей задачей познать окружающий мир, изучить
его законы и применить их для решения
практических задач. Поэтому в своей
педагогической деятельности я стараюсь больше
внимания уделять практическим работам
обучающихся.
Поэтому в своей
педагогической деятельности я стараюсь больше
внимания уделять практическим работам
обучающихся.
Мною разработан урок для 8 класса по теме “Количество теплоты. Единицы количества теплоты” к разделу “Тепловые явления”. Тип урока — комбинированный, который содержит изучение нового материала и практическую работу на определение калорий и килокалорий в пищевых продуктах. Он разработан с целью повышения интереса к предмету и активизации познавательной деятельности обучающихся.
Цель урока: Изучить что такое количество теплоты; как она обозначается и что она значит, в каких единицах она измеряется.
План урока:
1. Повторение пройденной темы.
2. Изучение нового материала.
3. Практическая работа.
4. Закрепление пройденной темы.
5. Анализ урока.
6. Домашнее задание.
I. Вопросы для повторения:
- Каким видом теплопередачи к нам поступает энергия от солнца?
- Что такое излучение?
- Какие тела в солнечную погоду лучше нагреваются (темные или светлые)?
- Почему весной снег в городе тает быстрее, а на полях медленнее?
- Все ли тела излучают энергию и почему?
II. Изучение нового материала:
Изучение нового материала:
1 Первая половина урока отводится на изучение нового материала . Для подведения обучающихся к главной цели – обозначение количества теплоты и единицы ее измерения ставятся проблемные вопросы :
- Какими способами можно изменить внутреннюю энергию тела? (После ответа учеников высветить слайд)
- Перечислите виды теплопередачи: (После ответа учеников высветить слайд)
Изменение внутренней энергии без совершения работы, т.е. путем теплопроводности называется-количеством теплоты
Обозначается :Q
Основная единица измерения : (Дж)
(Высвечивание слайда)
- Выясним, от чего зависит количество теплоты?
(С помощью слайдов рассмотрим примеры, от чего зависит количество теплоты)
Вывод: Количество теплоты которое необходимо
для нагревания тела (или выделяемое при
остывании), зависит от массы этого тела, от
изменения его температуры и от рода вещества.
III. Практическая работа:
Измерять количество теплоты ученые стали задолго до того, как в физике появилось понятие энергии. Тогда была установлена особая единица измерения количества теплоты – КАЛОРИЯ (кал) (Калория – от лат. слова калор – тепло, жар)
1 ккал – 100 кал
1 кал = 4,19 Дж 4,2 Дж
1 ккал = 4190 Дж 4200Дж4,2 кДж
Выполнение практической работы: Класс делится на 4 группы учеников или на 8 групп учеников.
Ответить на вопросы:
- Что такое количество теплоты?
- Как зависит количество теплоты от изменения температуры тела?
- Почему нельзя только по изменению температуры тела судить о полученном им количестве теплоты?
- Как зависит количество теплоты от массы тела?
- Какими единицами измеряют внутреннюю энергию и количество теплоты?
- Чему равен 1 ккал в Джоулях ?
IV. Домашнее задание:
Домашнее задание:
Прочитать параграф 7 страница 18
Найдите ответ на вопрос (в интернете, в справочниках или в другой литературе ) “Сколько килокалорий рекомендуется употреблять в сутки взрослому человеку и ребенку?” Переведите в кДж.
В чем измеряется теплота q. Количество теплоты, удельная теплоемкость
>>Физика: Количество теплоты
Изменить внутреннюю энергию газа в цилиндре можно, не только совершая работу, но и нагревая газ.
Если закрепить поршень (рис.13.5 ), то объем газа при нагревании не меняется и работа не совершается. Но температура газа, а следовательно, и его внутренняя энергия возрастают.
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом или теплопередачей.
Количественную меру изменения внутренней энергии при теплообмене называют количеством теплоты . Количеством теплоты называют также энергию, которую тело отдает в процессе теплообмена.
Молекулярная картина теплообмена
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии горячего тела передается холодному телу.
Количество теплоты и теплоемкость. Вам уже известно, что для нагревания тела массой m от температуры t 1 до температуры t 2 необходимо передать ему количество теплоты:
При остывании тела его конечная температура t 2 оказывается меньше начальной температуры t 1 и количество теплоты, отдаваемое телом, отрицательно.
Коэффициент c в формуле (13.5) называют удельной теплоемкостью вещества. Удельная теплоемкость — это величина, численно равная количеству теплоты, которое получает или отдает вещество массой 1 кг при изменении его температуры на 1 К.
Удельная теплоемкость зависит не только от свойств вещества, но и от того, при каком процессе осуществляется теплопередача. Если нагревать газ при постоянном давлении, то он будет расширяться и совершать работу. Для нагревания газа на 1°С при постоянном давлении ему нужно передать большее количество теплоты, чем для нагревания его при постоянном объеме, когда газ будет только нагреваться.
Для нагревания газа на 1°С при постоянном давлении ему нужно передать большее количество теплоты, чем для нагревания его при постоянном объеме, когда газ будет только нагреваться.
Жидкие и твердые тела расширяются при нагревании незначительно. Их удельные теплоемкости при постоянном объеме и постоянном давлении мало различаются.
Удельная теплота парообразования. Для превращения жидкости в пар в процессе кипения необходима передача ей определенного количества теплоты. Температура жидкости при кипении не меняется. Превращение жидкости в пар при постоянной температуре не ведет к увеличению кинетической энергии молекул, но сопровождается увеличением потенциальной энергии их взаимодействия. Ведь среднее расстояние между молекулами газа много больше, чем между молекулами жидкости.
Величину, численно равную количеству теплоты, необходимому для превращения при постоянной температуре жидкости массой 1 кг в пар, называют удельной теплотой парообразования . Эту величину обозначают буквой r и выражают в джоулях на килограмм (Дж/кг).
Очень велика удельная теплота парообразования воды: r h3O =2,256 10 6 Дж/кг при температуре 100°С. У других жидкостей, например у спирта , эфира, ртути, керосина, удельная теплота парообразования меньше в 3-10 раз, чем у воды.
Для превращения жидкости массой m в пар требуется количество теплоты, равное:
При конденсации пара происходит выделение такого же количества теплоты:
Величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг при температуре плавления в жидкость, называют удельной теплотой плавления .
При кристаллизации вещества массой 1 кг выделяется точно такое же количество теплоты, какое поглощается при плавлении.
Удельная теплота плавления льда довольно велика: 3,34 10 5 Дж/кг.
 «Если бы лед не обладал большой теплотой плавления, — писал Р. Б л эк еще в XVIII в., — то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота непрерывно передается льду из воздуха. Последствия этого были бы ужасны; ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда или снега».
«Если бы лед не обладал большой теплотой плавления, — писал Р. Б л эк еще в XVIII в., — то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота непрерывно передается льду из воздуха. Последствия этого были бы ужасны; ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда или снега».Для того чтобы расплавить кристаллическое тело массой m , необходимо количество теплоты, равное:
Количество теплоты, выделяемое при кристаллизации тела, равно:
Внутренняя энергия тела меняется при нагревании и охлаждении, при парообразовании и конденсации, при плавлении и кристаллизации. Во всех случаях телу передается или от него отнимается некоторое количество теплоты.
???
1. Что называют количеством теплоты ?
2. От чего зависит удельная теплоемкость вещества?
3. Что называют удельной теплотой парообразования?
4. Что называют удельной теплотой плавления?
5. В каких случаях количество теплоты положительная величина, а в каких случаях отрицательная?
В каких случаях количество теплоты положительная величина, а в каких случаях отрицательная?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиЕсли у вас есть исправления или предложения к данному уроку,
О единицах количества теплоты. Единицу количества теплоты — «малую» калорию — мы определили выше как количество теплоты, которое требуется для повышения температуры воды на 1 К при атмосферном давлении. Но так как теплоемкость воды при разных температурах различна, необходимо условиться о той температуре, при которой выбирается этот одноградусный интервал.
Единицу количества теплоты — «малую» калорию — мы определили выше как количество теплоты, которое требуется для повышения температуры воды на 1 К при атмосферном давлении. Но так как теплоемкость воды при разных температурах различна, необходимо условиться о той температуре, при которой выбирается этот одноградусный интервал.
В СССР принята так называемая двадцатиградусная калория, для которой принят интервал от 19,5 до 20,5°С. В некоторых странах применяется пятнадцатиградусная калория (интервал Первая из них равна Дж, вторая — Дж. Иногда применяется средняя калория, равная одной сотой количества тепла, необходимого для нагревания воды от до
Измерение количества теплоты. Для непосредственного измерения количества теплоты, отданного или полученного телом, служат специальные приборы — калориметры.
В наиболее простой своей форме калориметр представляет собой сосуд, заполненный веществом, теплоемкость которого хорошо известна, например водой (удельная теплоемкость
Измеряемое количество теплоты тем или иным путем передается калориметру, в результате чего изменяется его температура. Измерив это изменение температуры мы получим теплоту
Измерив это изменение температуры мы получим теплоту
где с — удельная теплоемкость вещества, заполняющего калориметр, его масса.
Необходимо учитывать, что теплота передается не только веществу калориметра, но и сосуду и различным устройствам, которые могут в нем помещаться. Поэтому перед измерением нужно определить так называемый тепловой эквивалент калориметра — количество теплоты, нагревающее «пустой» калориметр на один градус. Иногда эту поправку вводят добавлением к массе воды добавочной массы теплоемкость которой равна теплоемкости сосуда и других частей калориметра. Тогда можно считать, что тепло передается массе воды, равной Величина называется водяным эквивалентом калориметра.
Измерение теплоемкости. Калориметр служит также для измерения теплоемкости. В этом случае необходимо точно знать количество подведенного (или отведенного) тепла Если известно, то удельная теплоемкость вычисляется из равенства
где масса исследуемого тела, а изменение его температуры, вызванное теплотой
Тепло к телу подводится в калориметре, который должен быть устроен так, чтобы подводимое тепло передавалось только исследуемому телу (и, конечно, калориметру), но не терялось в окружающем пространстве. Между тем такие потери тепла в какой-то мере всегда происходят, и их учет является главной заботой при калориметрических измерениях.
Между тем такие потери тепла в какой-то мере всегда происходят, и их учет является главной заботой при калориметрических измерениях.
Измерение теплоемкости газов затруднено тем, что из-за малой их плотности теплоемкость той массы газа, которая может быть помещена в калориметр, мала. При обычных температурах она может оказаться сравнимой с теплоемкостью пустого калориметра, что неизбежно понижает точность измерений. Это особенно относится к измерению теплоемкости при постоянном объеме При определении эту трудность можно обойти, если исследуемый газ заставить протекать (при постоянном давлении) через калориметр (см. ниже).
Измерение Едва ли не единственным методом непосредственного измерения теплоемкости газа при постоянном объеме является метод, предложенный Жоли (1889 г.). Схема этого метода представлена на рис. 41.
Калориметр состоит из камеры К, в которой на концах коромысла точных весов подвешены два одинаковых полых медных шара снабженных тарелками снизу и отражателями сверху. Один из шаров откачивается, другой наполняется исследуемым газом. Для того чтобы газ имел заметную теплоемкость, его вводят под значительным давлением Массу введенного газа определяют с помощью весов, восстанавливая гирями нарушенное введением газа равновесие.
Один из шаров откачивается, другой наполняется исследуемым газом. Для того чтобы газ имел заметную теплоемкость, его вводят под значительным давлением Массу введенного газа определяют с помощью весов, восстанавливая гирями нарушенное введением газа равновесие.
После того как между шарами и камерой установится тепловое равновесие, в камеру впускают водяной пар (трубки для входа и выхода пара расположены на передней и задней стенках камеры и на рис. 41 не показаны). Пар конденсируется на обоих шарах, нагревая их, и стекает в тарелки. Но на сфере, заполненной газом, конденсируется больше жидкости, так как ее теплоемкость больше. Из-за избытка конденсата на одном из шаров равновесие шаров снова нарушится. Уравновесив весы, мы узнаем ту избыточную массу жидкости, которая сконденсировалась благодаря присутствию газа в шаре. Если эта избыточная масса воды равна то, умножив ее на теплоту конденсации воды найдем количество теплоты, которое пошло на нагревание газа от начальной температуры до температуры водяного пара Измерив эту разность термометром, получим:
где удельная теплоемкость — газа. Зная удельную теплоемкость мы найдем, что молярная теплоемкость
Зная удельную теплоемкость мы найдем, что молярная теплоемкость
Измерение Мы уже упоминали, что для измерения теплоемкости при постоянном давлении исследуемый газ заставляют протекать через калориметр. Только таким путем можно обеспечить постоянство давления газа, несмотря на подвод тепла и нагревание, без которого нельзя измерять теплоемкость. В качестве примера такого метода приведем здесь описание классического опыта Реньо ( Схема аппарата представлена на рис. 42.
Исследуемый газ из резервуара А через кран пропускают через змеевик, помещенный в сосуде с маслом В, нагреваемым каким-нибудь источником тепла. Давление газа регулируется краном а его постоянство контролируется манометром Проходя длинный путь в змеевике, газ принимает температуру масла, которая измеряется термометром
Нагретый в змеевике газ проходит затем через водяной калориметр, охлаждаясь в нем до некоторой температуры измеряемой термометром и выходит наружу. Измерив давление газа в резервуаре А в начале и в конце опыта (для этого служит манометр мы узнаем массу прошедшего через аппарат газа.
Количество теплоты отданное газом калориметру, равно произведению водяного эквивалента калориметра на изменение его температуры где начальная температура калориметра.
§ 1 Количество теплоты
Включим в холодном помещении электрообогреватель, и температура воздуха начинает повышаться. Или после зимней прогулки возвращаемся в теплый дом и ощущаем тепло. Названные примеры относят к теплообмену.
Теплообмен — это явление передачи внутренней энергии от одного тела к другому телу без совершения механической работы. В процессе теплообмена энергия или, как говорят, теплота поступает (нагревание комнаты электрообогревателем) или выделяется в окружающую среду (остывание горячей воды в чаше).
К примеру, чтобы согреть помещение или охладить устройство, защитить механизм от перегрева, необходимо выполнить расчеты, а значит, ввести параметр, с помощью которого удастся быстро и эффективно сосчитать количество поступающей или выделяющейся теплоты.
Количество теплоты- это энергия, передающаяся от одного тела к другому при теплообмене.
Вы видите калориметр — прибор для измерения количества теплоты. Простейший калориметр состоит из двух стаканов: внутреннего алюминиевого и внешнего пластмассового, которые разделены воздушным промежутком.
Как его применяют на практике? Во внутренний стакан нальём 200 г воды. Измерим её температуру: 20 °С. Погрузим в воду горячее тело — металлический цилиндрик.
Внутри калориметра начнётся теплообмен, и некоторое количество теплоты перейдёт от цилиндрика к воде, в результате чего её температура повысится и станет равной 60 °С. Можно вычислить изменение температуры, тем самым узнаем, на сколько градусов повысилась температура воды в калориметре:
Известно, что масса воды 200 г, инженер-теплотехник объяснит, что вода получила 200 г · 40 °С = 4000 калорий теплоты, но в физике количество теплоты измеряют джоулями. Формула выглядит следующим образом:
количество теплоты равно произведению удельной теплоемкости вещества на массу взятого вещества и на его изменение температуры, где
В этой формуле появилась физическая величина — удельная теплоемкость.
Удельная теплоёмкость вещества — физическая скалярная величина, показывающая, какое количество теплоты необходимо для изменения температуры 1(одного) кг этого вещества на 1 °С.
Эта величина является табличной.
Удельные теплоёмкости всех веществ измерены и занесены в специальные таблицы. Например, для воды в жидком состоянии с = 4200 Дж/(кг°С). Физический смысл показывает, что для нагревания 1 кг воды на 1 °С потребуется 4200 Дж теплоты. Иначе: каждый килограмм воды остывает на 1 °С, отдавая окружающим телам 4200 Дж тепловой энергии. Возвращаясь к нашему примеру, так как внутри калориметра находится вода, то воспользуемся данными таблицы и запишем ее значение: с = 4200 Дж/(кг°С)
Воспользуемся выше указанной формулой и сосчитаем количество теплоты, которое получила вода в джоулях:
§ 2 Единицы измерения количества теплоты
Для удобства и специфики работы используют внесистемные единицы количества теплоты — калории.
Калория — это количество тепла, необходимое для нагрева 1 г воды на 1 °С (от 19,5 до 20,5 °С).
Или используют:
1кДж = 1000Дж
1МДж = 1000000Дж
Данную формулу применяют не только в том случае, когда вещество нагревается, но и когда отдает тепло при охлаждении.
Калориметрические измерения показывают, что теплообмен всегда протекает так, что убывание внутренней энергии одних тел всегда сопровождается таким же поступлением внутренней энергии других тел, участвующих в теплообмене. Это одно из проявлений закона сохранения и превращения энергии.
Для расчета количества теплоты применяют формулу, связывающую удельную теплоемкость вещества, массу тела и изменение температуры, которую используют для расчета при нагревании и при охлаждении вещества. Единица измерения количества теплоты в системе СИ — джоуль. Также выяснили табличную величину для разных веществ — удельная теплоемкость
Список использованной литературы:
- Физика. 8 класс: Учебник для общеобразовательных учреждений/А.В. Перышкин. – М.: Дрофа, 2010.
- Физика 7-9 Учебник И.
 В. Кривченко.
В. Кривченко. - Физика Справочник. О.Ф. Кабардин. – М.: АСТ-ПРЕСС, 2010.
Использованные изображения:
Когда мы будем обсуждать способы отоплении дома, варианты снижения утечек тепла, мы должны понимать, что такое тепло, в каких единицах оно измеряется, как передается и как теряется. На этой странице будут приведены основные сведения из курса физики, необходимые для рассмотрения всех перечисленных вопросов.
Теплота — один из способов передачи энергии
Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой.
В строгом смысле теплота представляет собой один из способов передачи энергии, и физический смысл имеет лишь количество энергии, переданное системе, но слово «тепло-» входит в такие устоявшиеся научные понятия, как поток тепла, теплоёмкость, теплота фазового перехода, теплота химической реакции, теплопроводность и пр. Поэтому там, где такое словоупотребление не вводит в заблуждение, понятия «теплота» и «количество теплоты» синонимичны. Однако этими терминами можно пользоваться только при условии, что им дано точное определение, и ни в коем случае «количество теплоты» нельзя относить к числу первоначальных понятий, не требующих определения. Во избежание ошибок под понятием «теплота» следует понимать именно способ передачи энергии, а количество переданной этим способом энергии обозначают понятием «количество теплоты». Рекомендуется избегать такого термина, как «тепловая энергия».
Поэтому там, где такое словоупотребление не вводит в заблуждение, понятия «теплота» и «количество теплоты» синонимичны. Однако этими терминами можно пользоваться только при условии, что им дано точное определение, и ни в коем случае «количество теплоты» нельзя относить к числу первоначальных понятий, не требующих определения. Во избежание ошибок под понятием «теплота» следует понимать именно способ передачи энергии, а количество переданной этим способом энергии обозначают понятием «количество теплоты». Рекомендуется избегать такого термина, как «тепловая энергия».
Теплота — это кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит. Мерой интенсивности движения молекул является температура. Количество теплоты, которым обладает тело при данной температуре, зависит от его массы; например, при одной и той же температуре в большой чашке с водой заключается больше теплоты, чем в маленькой, а в ведре с холодной водой его может быть больше, чем в чашке с горячей водой (хотя температура воды в ведре и ниже).
Теплота представляет собой одну из форм энергии, а поэтому должна измеряться в единицах энергии. В международной системе СИ единицей энергии является джоуль (Дж). Допускается также применение внесистемной единицы количества теплоты — калории: международная калория равна 4,1868 Дж.
Теплообмен и теплопередача
Теплопередача — это процесс переноса теплоты внутри тела или от одного тела к другому, обусловленный разностью температур. Интенсивность переноса теплоты зависит от свойств вещества, разности температур и подчиняется экспериментально установленным законам природы. Чтобы создавать эффективно работающие системы нагрева или охлаждения, разнообразные двигатели, энергоустановки, системы теплоизоляции, нужно знать принципы теплопередачи. В одних случаях теплообмен нежелателен (теплоизоляция плавильных печей, космических кораблей и т.п.), а в других он должен быть как можно больше (паровые котлы, теплообменники, кухонная посуда). Существуют три основных вида теплопередачи: теплопроводность, конвекция и лучистый теплообмен. 2*К)
2*К)
Металлы
Алюминий ___________________205
Бронза _____________________105
Вольфрам ___________________159
Железо ______________________67
Медь _______________________389
Никель ______________________58
Свинец ______________________35
Цинк _______________________113
Другие материалы
Асбест _______________________0,08
Бетон ________________________0,59
Воздух _______________________0,024
Гагачий пух (неплотный) ______0,008
Дерево (орех) ________________0,209
Опилки _______________________0,059
Резина (губчатая) ____________0,038
Стекло _______________________0,75
Конвекция
Конвекция — это теплообмен за счет перемещения масс воздуха или жидкости. При подводе тепла к жидкости или газу увеличивается интенсивность движения молекул, а вследствие этого повышается давление. Если жидкость или газ не ограничены в объеме, то они расширяются; локальная плотность жидкости (газа) становится меньше, и благодаря выталкивающим (архимедовым) силам нагретая часть среды движется вверх (именно поэтому теплый воздух в комнате поднимается от батарей к потолку). В простых случаях течения жидкости по трубе или обтекания плоской поверхности коэффициент конвективного теплопереноса можно рассчитать теоретически. Однако найти аналитическое решение задачи о конвекции для турбулентного течения среды пока не удается.
В простых случаях течения жидкости по трубе или обтекания плоской поверхности коэффициент конвективного теплопереноса можно рассчитать теоретически. Однако найти аналитическое решение задачи о конвекции для турбулентного течения среды пока не удается.
Тепловое излучение
Третий вид теплопередачи — лучистый теплообмен — отличается от теплопроводности и конвекции тем, что теплота в этом случае может передаваться через вакуум. Сходство же его с другими способами передачи тепла в том, что он тоже обусловлен разностью температур. Тепловое излучение — это один из видов электромагнитного излучения.
Мощным излучателем тепловой энергии является Солнце; оно нагревает Землю даже на расстоянии 150 млн. км. Интенсивность солнечного излучения составляет примерно 1,37 Вт/м2.
Интенсивность теплопередачи путем теплопроводности и конвекции пропорциональна температуре, а лучистый тепловой поток пропорционален четвертой степени температуры.
Теплоёмкость
Различные вещества обладают разной способностью накапливать тепло; это зависит от их молекулярной структуры и плотности. Количество теплоты, необходимое для повышения температуры единицы массы вещества на один градус (1 °С или 1 К), называется его удельной теплоемкостью. Теплоемкость измеряется в Дж/(кг К).
Количество теплоты, необходимое для повышения температуры единицы массы вещества на один градус (1 °С или 1 К), называется его удельной теплоемкостью. Теплоемкость измеряется в Дж/(кг К).
Обычно различают теплоемкость при постоянном объёме (C V ) и теплоемкость при постоянном давлении (С P ), если в процессе нагревания поддерживаются постоянными соответственно объём тела или давление. Например, чтобы нагреть на 1 К один грамм воздуха в воздушном шаре, требуется больше теплоты, чем для такого же его нагрева в герметичном сосуде с жесткими стенками, поскольку часть энергии, сообщаемой воздушному шару, расходуется на расширение воздуха, а не на его нагревание. При нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть — на увеличение его внутренней энергии, тогда как при нагревании при постоянном объёме вся теплота расходуется на увеличение внутренней энергии; в связи с этим С Р всегда больше, чем C V . У жидкостей и твёрдых тел разница между С Р и C V сравнительно мала.
Тепловые машины
Тепловые машины — это устройства, преобразующие теплоту в полезную работу. Примерами таких машин могут служить компрессоры, турбины, паровые, бензиновые и реактивные двигатели. Одной из наиболее известных тепловых машин является паровая турбина, использующаяся на современных тепловых электростанциях. Упрощенная схема такой электростанции на рисунке 1.
Рис. 1. Упрощенная схема паротурбинной электростанции, работающей на ископаемом топливе.
Рабочую жидкость — воду — превращают в перегретый пар в паровом котле, нагреваемом за счет сжигания ископаемого топлива (угля, нефти или природного газа). Пар высокого давления вращает вал паровой турбины, которая приводит в действие генератор, вырабатывающий электроэнергию. Отработанный пар конденсируется при охлаждении проточной водой, которая поглощает часть теплоты. Далее вода подается в охлаждающую башню (градирню), откуда часть тепла уходит в атмосферу. Конденсат с помощью насоса возвращают в паровой котел, и весь цикл повторяется.
Другим примером тепловой машины может служить бытовой холодильник, схема которого представлена на рис. 2.
В холодильниках и бытовых кондиционерах энергия для его обеспечения подводится извне. Компрессор повышает температуру и давление рабочего вещества холодильника — фреона, аммиака или углекислого газа. Перегретый газ подается в конденсатор, где охлаждается и конденсируется, отдавая тепло окружающей среде. Жидкость, выходящая из патрубков конденсатора, проходит через дросселирующий клапан в испаритель, и часть ее испаряется, что сопровождается резким понижением температуры. Испаритель отбирает у камеры холодильника тепло, которое нагревает рабочую жидкость в патрубках; эта жидкость подается компрессором в конденсатор, и цикл снова повторяется.
Тепловая энергия — это система измерения теплоты, которая была изобретена и используется еще два столетия назад. Основным правилом работы с данной величиной было то, что тепловая энергия сохраняется и не может просто исчезнуть, но может перейти в другой вид энергии.
Существует несколько общепринятых единиц измерения тепловой энергии . В основном их используют в промышленных отраслях, таких как . Внизу описаны самые распространенные из них:
Любая единица измерения, входящая в систему СИ, имеет предназначение в определении суммарного количества того или иного вида энергии, такого как выделения тепла или электроэнергия. Время проведения измерения и количество не влияют на эти величины, почему можно их использовать как для потребляемой, так и для уже потребленной энергии. Кроме того, любая передача и прием, а также потери тоже исчисляются в таких величинах.
Где применяют единицы измерения тепловой энергии
Единицы измерения энергии, переведенные в тепловую
Для наглядного примера ниже приведены сравнения различных популярных показателей СИ с тепловой энергией:
- 1 ГДж равен 0,24 Гкал, что в электрическом эквиваленте равняется 3400 миллионов кВт на час. В эквиваленте тепловой энергии 1 ГДж = 0,44 тонны пара;
- В то же время 1 Гкал = 4,1868 ГДж = 16000 млн.
 кВт на час = 1,9 тонн пара;
кВт на час = 1,9 тонн пара; - 1 тонна пара равняется 2,3 ГДж = 0,6 Гкал = 8200 кВт на час.
В данном примере приводимая величина пара принята за испарение воды при достижении 100°С.
Чтобы провести расчеты количества тепла, используется следующий принцип: для получения данных о количестве тепла его используют в нагревании жидкости, после чего масса воды умножается на пророщенную температуру. Если в СИ масса жидкости измеряется килограммами, а температурные перепады в градусах Цельсия, то результатом таких расчетов будет количество теплоты в килокалориях.
Если есть необходимость в передаче тепловой энергии от одного физического тела другому, и вы хотите узнать возможные потери, то стоит массу получаемого тепла вещества умножить на температуру повышения, а после узнать произведение получаемого значения на «удельную теплоемкость» вещества.
Измерение тепла — видео по физике от Brightstorm
Измерение тепла производится в калориях. Одна калория — это количество энергии, необходимое для нагревания одного грамма воды на один градус Цельсия. Чтобы измерить тепло, вы делите изменение температуры образца воды на массу воды.
Одна калория — это количество энергии, необходимое для нагревания одного грамма воды на один градус Цельсия. Чтобы измерить тепло, вы делите изменение температуры образца воды на массу воды.
Измерение тепла, так как мы можем измерить тепло? Помните, что тепло — это поток энергии от горячего объекта к холодному или от чего-то более горячего к чему-то более холодному.Что ж, мы можем измерить это тепло с помощью чего-то, что называется калорией. Калория — это измерение количества тепла в веществе, и это, по сути, то количество энергии, которое требуется, чтобы поднять один грамм воды на один градус Цельсия, и мы можем использовать формулу, чтобы вычислить это изменение температуры по Цельсию, разделенное по массе воды, которая была нагрета при этом.
Давайте рассмотрим пример того, как можно рассчитать меру тепла, как рассчитать калории.Допустим, у нас есть образец пищи, и когда образец пищи сгорает, а тепло поднимает температуру 25 граммов воды с 10 градусов по Цельсию до 85 градусов по Цельсию, сколько калорий выделяется этой пищей? И давайте предположим, что мы получили всю энергию от этой пищи для нагрева воды, мы не много потеряли в окружающую среду и в другие места, что вся эта энергия была передана непосредственно в воду, хорошо, поэтому мы можем просто установить это вверх. У нас есть изменение температуры в порядке над нашей массой воды, хорошо, что, как вы знаете, мы собираемся использовать, а затем в граммах наши научные единицы, поэтому изменение температуры наша конечная температура была 85 градусов по Цельсию, наша начальная температура была, I извините, 10 градусов по Цельсию, а наша масса воды была 25 граммов, хорошо, поэтому, если мы разделим это, мы получим 75 градусов по Цельсию, это наше изменение температуры, деленное на 25 граммов воды, что будет равно 3 калориям, так что образец пищи произвел 3 Калории и 3 калории — это измерение тепла, которое было передано от этой пищи в воду, или переданное тепло — измерение тепла.
У нас есть изменение температуры в порядке над нашей массой воды, хорошо, что, как вы знаете, мы собираемся использовать, а затем в граммах наши научные единицы, поэтому изменение температуры наша конечная температура была 85 градусов по Цельсию, наша начальная температура была, I извините, 10 градусов по Цельсию, а наша масса воды была 25 граммов, хорошо, поэтому, если мы разделим это, мы получим 75 градусов по Цельсию, это наше изменение температуры, деленное на 25 граммов воды, что будет равно 3 калориям, так что образец пищи произвел 3 Калории и 3 калории — это измерение тепла, которое было передано от этой пищи в воду, или переданное тепло — измерение тепла.
тепла: Меры тепла | Infoplease
Температура является мерой средней поступательной кинетической энергии молекул системы. Тепло обычно выражается в одной из двух единиц: калории, старой метрической единице, и британской тепловой единице (БТЕ), английской единице, обычно используемой в Соединенных Штатах. Ученые выражают тепло в джоулях, единицах, используемых для всех форм энергии.
Ученые выражают тепло в джоулях, единицах, используемых для всех форм энергии.
При подводе тепла к веществу в твердом состоянии молекулы вещества приобретают кинетическую энергию, и температура вещества повышается.Количество теплоты, необходимое для нагревания единицы массы вещества на один градус температуры, называется удельной теплоемкостью вещества. Из-за того, как определяются калория и БТЕ, удельная теплоемкость любого вещества одинакова в любой системе измерения. Например, удельная теплоемкость воды составляет 1 калорию на грамм на градус Цельсия; т. е. для повышения температуры 1 грамма воды на 1 градус Цельсия необходима 1 калория тепла; это также 1 британская тепловая единица за фунт на градус Фаренгейта.
Когда твердое тело достигает определенной температуры, оно превращается в жидкость. Эта температура является особым свойством вещества и называется его температурой плавления. Пока происходит переход твердого тела в жидкое, температура не меняется. Все добавляемое тепло преобразуется во внутреннюю потенциальную энергию, связанную с жидким состоянием. Количество теплоты, необходимое для превращения одной единицы массы вещества из твердого состояния в жидкое, называется теплотой плавления или скрытой теплотой плавления вещества.Как и удельная теплоемкость, скрытая теплота также является свойством конкретного вещества. Скрытая теплота плавления при переходе льда в воду составляет 80 калорий на грамм.
Количество теплоты, необходимое для превращения одной единицы массы вещества из твердого состояния в жидкое, называется теплотой плавления или скрытой теплотой плавления вещества.Как и удельная теплоемкость, скрытая теплота также является свойством конкретного вещества. Скрытая теплота плавления при переходе льда в воду составляет 80 калорий на грамм.
После полного перехода вещества из твердого состояния в жидкое дальнейшее добавление тепла снова вызывает повышение температуры до точки кипения, определенной температуры, при которой данное вещество переходит из жидкого состояния в газообразное. При переходе жидкость-газ температура остается постоянной до завершения перехода.Теплота парообразования, или скрытая теплота парообразования, — это теплота, которую необходимо добавить для превращения одной единицы массы вещества из жидкости в газ.
Электронная энциклопедия Колумбии, , 6-е изд. Авторское право © 2012, издательство Колумбийского университета. Все права защищены.
См. больше статей энциклопедии на тему: Физика
Тепло
Тепло
Тепло
Тепло — это способ передачи энергии между системами и его окружение, которое часто, но не всегда, меняет температура системы.Тепло не сохраняется, его можно либо созданы, либо уничтожены. В метрической системе теплота измеряется в единицах калорий , которые определяются как количество теплоты, необходимое для нагревания одного грамма вода от 14,5 o С до 15,5 o С.
В системе СИ единицей тепла является джоуля .
Теплоемкость
Теплоемкость вещества есть количество теплоты
требуется для повышения температуры определенного количества чистого
веществ на один градус (по Цельсию или Кельвину).Калорийность была
определяли так, чтобы теплоемкость воды была равна единице.
Удельная теплоемкость
Удельная теплоемкость вещества – это число калорий, необходимых для повышения температуры на один грамм на 1 o °С. Поскольку один градус по шкале Цельсия равен одному Кельвину, удельная теплоемкость в метрической системе может быть выражена в единицах либо кал/г- или C, либо кал/г-K.Единицы удельной теплоемкости в системе СИ – Дж/г-К. Поскольку 4,184 Дж в калория, удельная теплоемкость воды 4,184 Дж/г-К.
Легкость, с которой вещество приобретает или
теряет тепло также может быть описано с точки зрения его молярной теплоты
емкость , то есть количество тепла, необходимое для повышения температуры. один моль вещества на 1 или C или 1
K. В метрической системе единицами молярных теплоемкостей являются
следовательно, либо кал/моль- или °С, либо кал/моль-К. В СИ
единицами молярной теплоемкости являются Дж/моль-К.
В СИ
единицами молярной теплоемкости являются Дж/моль-К.
Скрытая теплота
При нагреве льда тепло, первоначально поступающее в систему используется для растапливания льда. Когда лед тает, температура остается постоянна при 0, o C. Количество тепла, необходимое для плавления лед исторически назывался скрытой теплотой плавления . После того, как лед растает, температура воды медленно увеличивается от 0 o C до 100 o C.Но как только вода начинает кипеть, тепло, попадающее в образец, используется для преобразование жидкости в газ и температуру образца остается постоянной до тех пор, пока жидкость не испарится. Количество тепла для кипячения или испарения жидкость исторически была называется скрытой теплотой парообразования .
Более 200 лет назад Джозеф Блэк различал разумных
теплота и скрытая теплота . Тепло, которое поднимает
можно измерить температуру системы, но тепло, которое приводит к
изменение состояния системы из твердого в жидкое или
из жидкости в газ скрыто. Как скрытое изображение на
фотопленка, которая не была проявлена или со скрытыми отпечатками пальцев
невидимое невооруженным глазом, скрытое тепло тепло, поступающее в систему без изменения температуры
система.
Тепло, которое поднимает
можно измерить температуру системы, но тепло, которое приводит к
изменение состояния системы из твердого в жидкое или
из жидкости в газ скрыто. Как скрытое изображение на
фотопленка, которая не была проявлена или со скрытыми отпечатками пальцев
невидимое невооруженным глазом, скрытое тепло тепло, поступающее в систему без изменения температуры
система.
Тепло и кинетика Молекулярная теория
Система — это небольшая часть Вселенной в которые нас интересуют, например вода в стакане или газ в поршне и цилиндре, как показано на рисунках ниже. окружение это все остальное Другими словами, остальная часть Вселенной.
Система и ее окружение разделены границей . Тепло передается через границу между системой и ее
окрестности.
Тепло передается через границу между системой и ее
окрестности.
Одним из фундаментальных принципов кинетической теории является предположение, что средняя кинетическая энергия газового скопления частиц зависит от температуры газа и больше ни от чего.Газ становится теплее тогда и только тогда, когда средняя кинетическая энергия частиц газа увеличивается. Тепло, когда оно повышает температуру системы, приводит к увеличению скорости, с которой частицы системы движутся, как показано на рисунке ниже.
калорий | единица измерения
калория , единица энергии или тепла, определяемая по-разному. Первоначально калория определялась как количество тепла, необходимое при давлении в 1 стандартную атмосферу для повышения температуры 1 грамма воды на 1 градус Цельсия.С 1925 года эта калория определяется в джоулях, а определение с 1948 года гласит, что одна калория равна примерно 4,2 джоуля. Поскольку известно, что количество теплоты, представленное калорией, различается при различных температурах (на целых 1 процент), следовательно, необходимо определить температуру, при которой удельную теплоемкость воды следует принимать за 1 калорию. Таким образом, «15° калория» (также называемая грамм-калорией или малой калорией) была определена как количество тепла, которое повысит температуру 1 грамма воды с 14.от 5° до 15,5° C — равно 4,1855 Дж. Другими менее распространенными определениями в этой серии являются 20° калорий (4,18190 джоулей) от 19,5° до 20,5°C; и средняя калория (4,19002 Дж), определяемая как 1 / 100 тепла, необходимого для повышения температуры 1 грамма воды от 0° до 100°С.
Поскольку известно, что количество теплоты, представленное калорией, различается при различных температурах (на целых 1 процент), следовательно, необходимо определить температуру, при которой удельную теплоемкость воды следует принимать за 1 калорию. Таким образом, «15° калория» (также называемая грамм-калорией или малой калорией) была определена как количество тепла, которое повысит температуру 1 грамма воды с 14.от 5° до 15,5° C — равно 4,1855 Дж. Другими менее распространенными определениями в этой серии являются 20° калорий (4,18190 джоулей) от 19,5° до 20,5°C; и средняя калория (4,19002 Дж), определяемая как 1 / 100 тепла, необходимого для повышения температуры 1 грамма воды от 0° до 100°С.
Другая калория, единица тепловой энергии, есть Международная таблица калорий (IT калорий), первоначально определенная как 1 / 860 международных ватт-часов. Он равен 4.1868 Дж и используется в инженерных паровых столах.
Британская викторина
Забавные факты об измерениях и математике
Что измеряет барометр? В какой год люди растут быстрее всего? Соберитесь с мыслями и измерьте свои знания, пройдя этот тест.
Единицей тепловой энергии, используемой в термохимии, является термохимическая калория, равная 4.184 Дж. Он обычно используется в качестве единицы теплоемкости, скрытой теплоты и теплоты реакции.
В популярном использовании термина калория диетологи используют его для обозначения килокалории, иногда называемой килограммовой калорией, или большой калорией (равной 1000 калориям), при измерении калорийности, нагревании или метаболизме пищевых продуктов. Таким образом, «калории», учитываемые по диетическим соображениям, на самом деле являются килокалориями с опущенным префиксом «кило-»; в научных обозначениях используется калория с большой буквы.Другими словами, если персик указан как содержащий 40 калорий, это означает, что этот персик на самом деле содержит 40 000 калорий.
В области питания было предложено, чтобы килоджоуль заменил килокалорию в качестве предпочтительной единицы для обсуждения энергетической ценности пищевых продуктов. Такое изменение приблизило бы номенклатуру ученых-пищевиков к номенклатуре других ученых. Коэффициент пересчета килокалорий в килоджоули, рекомендованный Комитетом по номенклатуре Международного союза наук о питании, составляет 1 килокалория, равная 4.184 килоджоуля, исходя из килокалории, определенной при температуре от 14,5° до 15,5° C. Хотя в настоящее время в правительственных публикациях часто приводятся расчеты энергии в килоджоулях и килокалориях, калория по-прежнему является наиболее часто используемой единицей пищевой энергии во всем мире.
Такое изменение приблизило бы номенклатуру ученых-пищевиков к номенклатуре других ученых. Коэффициент пересчета килокалорий в килоджоули, рекомендованный Комитетом по номенклатуре Международного союза наук о питании, составляет 1 килокалория, равная 4.184 килоджоуля, исходя из килокалории, определенной при температуре от 14,5° до 15,5° C. Хотя в настоящее время в правительственных публикациях часто приводятся расчеты энергии в килоджоулях и килокалориях, калория по-прежнему является наиболее часто используемой единицей пищевой энергии во всем мире.
Удельная теплоемкость – обзор
2.31.2.2.1 Линейное сканирование
Наиболее распространенным режимом работы ДСК является нагрев или охлаждение с постоянной скоростью. Основным результатом такого эксперимента является график зависимости скорости теплового потока от времени.Если известна температура положения образца, то данные также могут быть представлены в виде зависимости скорости теплового потока от температуры. (Следует знать, что обычно измеряется температура вблизи образца, а не температура самого образца.) Типичный пример показан на рис. 2 .
(Следует знать, что обычно измеряется температура вблизи образца, а не температура самого образца.) Типичный пример показан на рис. 2 .
Рисунок 2. Температурный профиль и измеренная скорость теплового потока для (а) пустых кювет, (б) сапфирового калибровочного стандарта (31,3 мг) и (в) исходно аморфного ПЭЭК (29 мг). Скорость нагрева β = 20 К мин -1 .
Данные PerkinElmer Pyris Diamond DSC. Воспроизведено с разрешения Schick, C. Anal. Биоанал. хим. 2009 , 395 , 1589–1611. 35Из кривых теплового потока, показанных на рис. 2 , удельная теплоемкость c p (T) может быть получена следующим образом
[8]cp(T)=cp,sapphire(T) msapphireβmsampleβΦsample(T)−Φempty(T)Φsapphire(T)−Φempty(T)=K(T)Φsample(T)−Φempty(T)msampleβ
с
K(T)=cp,sapphire(T)msapphireβΦsapphire (T)−Φпусто(T)
, где K ( T ) — калибровочный коэффициент, зависящий от температуры, который можно сохранить для использования в будущем.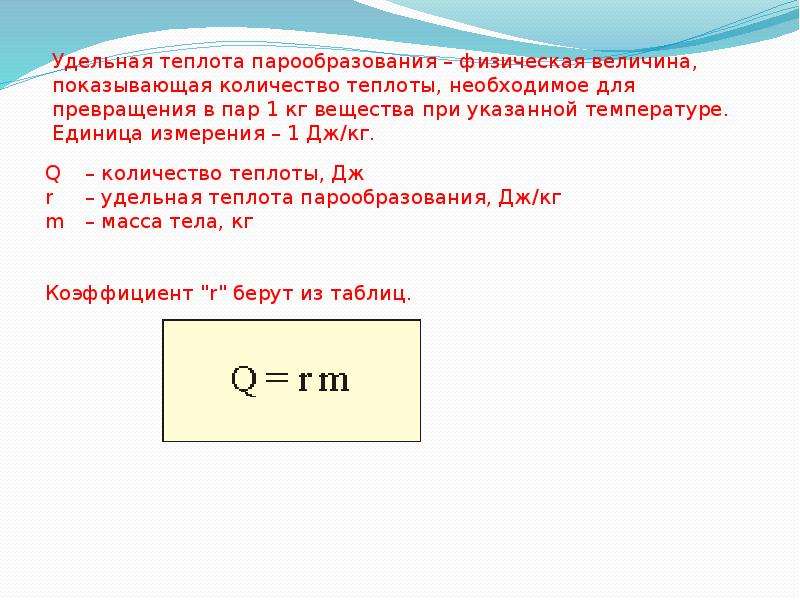 Здесь все измерения собираются с одинаковой скоростью сканирования. Изотермы в начале и в конце сканирования используются для поправки на небольшие изменения тепловых потерь между измерениями пустого стекла, сапфира и образца путем выравнивания этих частей кривых. Небольшие изменения потерь неизбежны, поскольку тепловые свойства, например теплопроводность, образцов различны. С другой стороны, проверка расхода тепла на изотермах позволяет проверить правильность размещения и термоконтактов всех частей измерительной системы, перемещаемых при смене образцов.Особенно высокотемпературная изотерма не должна сильно различаться между последовательными измерениями.
Здесь все измерения собираются с одинаковой скоростью сканирования. Изотермы в начале и в конце сканирования используются для поправки на небольшие изменения тепловых потерь между измерениями пустого стекла, сапфира и образца путем выравнивания этих частей кривых. Небольшие изменения потерь неизбежны, поскольку тепловые свойства, например теплопроводность, образцов различны. С другой стороны, проверка расхода тепла на изотермах позволяет проверить правильность размещения и термоконтактов всех частей измерительной системы, перемещаемых при смене образцов.Особенно высокотемпературная изотерма не должна сильно различаться между последовательными измерениями.
Удельная теплоемкость является наиболее полезной величиной, доступной с помощью ДСК, поскольку она напрямую связана со свойствами образца и, согласно уравнениям [1]–[5], напрямую связана со стабильностью и порядком. Тем не менее, часто представляется только скорость теплового потока, полученная при измерении одного образца. Есть несколько причин, по которым это не должно быть представлено:
- 1.

Каждый график теплового потока должен указывать эндотермическое или экзотермическое направление, поскольку направление графика не стандартизировано.
- 2.
Кривые, измеренные при разных скоростях сканирования, нелегко сравнивать.
- 3.
Если не разделить на массу образца, кривые для разных образцов нельзя сравнивать.
- 4.
Если измерения пустой чаши не вычитаются, кривые могут быть кривыми, и построение базовой линии для интегрирования пиков может быть затруднено.
- 5.
Если калибровочный коэффициент теплового потока K ( T ) зависит от температуры, полученная теплота плавления и другие подобные параметры могут быть ошибочными.
Выполнение поправок (3)–(5) дает удельную теплоемкость согласно уравнению [8]. Поскольку большинство программных пакетов ДСК включают определение удельной теплоемкости по уравнению [8], настоятельно рекомендуется определять удельную теплоемкость, а не представлять кривые теплового потока. Хотя предпочтительнее представлять данные об удельной теплоемкости, могут быть причины не делать этого. Нормализация кривой теплового потока по скорости сканирования и массе образца может привести к «псевдо измерениям c p », которые можно использовать для определения зависящей от температуры кристалличности и других величин, как показано в ссылке 8.Но есть еще один очень сильный аргумент в пользу представления удельной теплоемкости, а не «псевдо c p » или скорости теплового потока. Для более чем 200 полимеров данные об удельной теплоемкости от 0 до 1000 К доступны в банке данных ATHAS (ATHAS-DB). 36 Данные можно использовать для сравнения измеренных данных в стеклообразном или жидком состоянии с рекомендуемыми значениями. Это позволяет легко проверить качество измеренных данных, хотя следует иметь в виду, что точность рекомендуемых данных банка данных составляет всего около 6%. На рис. 3 показана удельная теплоемкость (согласно уравнению [8]), рассчитанная по данным, показанным на рис.
Хотя предпочтительнее представлять данные об удельной теплоемкости, могут быть причины не делать этого. Нормализация кривой теплового потока по скорости сканирования и массе образца может привести к «псевдо измерениям c p », которые можно использовать для определения зависящей от температуры кристалличности и других величин, как показано в ссылке 8.Но есть еще один очень сильный аргумент в пользу представления удельной теплоемкости, а не «псевдо c p » или скорости теплового потока. Для более чем 200 полимеров данные об удельной теплоемкости от 0 до 1000 К доступны в банке данных ATHAS (ATHAS-DB). 36 Данные можно использовать для сравнения измеренных данных в стеклообразном или жидком состоянии с рекомендуемыми значениями. Это позволяет легко проверить качество измеренных данных, хотя следует иметь в виду, что точность рекомендуемых данных банка данных составляет всего около 6%. На рис. 3 показана удельная теплоемкость (согласно уравнению [8]), рассчитанная по данным, показанным на рис. 2 .
2 .
Рис. 3. Зависимость удельной теплоемкости от температуры для исходно аморфного образца PEEK. Данные с Рисунок 2 . Справочные данные (прямые линии) для полностью аморфного (жидкого) и кристаллического (твердого) ПЭЭК доступны в базе данных ATHAS-DB. 36
Воспроизведено с разрешения Schick, C. Anal. Биоанал. хим. 2009 , 395 , 1589–1611. 35Более подробное обсуждение оценки кривых, показанных в Рис. 3 , дано в ссылке 35.
Помимо сканирующих измерений при нагреве, ДСК позволяет проводить охлаждение в широком диапазоне скоростей охлаждения. В зависимости от прибора и интересующего температурного диапазона может быть достигнута скорость охлаждения до 750 К мин -1 (HyperDSC™ PerkinElmer, США). 20,37–39 Но, как правило, диапазон температур для контролируемого охлаждения при самых высоких скоростях ограничен.Измерения, проводимые в широком диапазоне скоростей нагрева или охлаждения, требуют оптимизации условий эксперимента. Масса образца должна масштабироваться обратно пропорционально скорости сканирования. При низких скоростях, когда тепловая задержка не является проблемой, масса образца должна быть высокой, чтобы иметь хорошее отношение сигнал/шум. При высоких скоростях, когда сигналы велики, масса образца должна быть небольшой, чтобы свести к минимуму тепловой поток к образцу, который пропорционален скорости и вызывает тепловую задержку. Были тщательно изучены проблемы, связанные с тепловой задержкой, температурной калибровкой и воспроизводимостью в экспериментах по быстрому сканированию ДСК, и были даны адекватные рекомендации. 37,40,41 На рис. 4 показаны кривые охлаждения в диапазоне кристаллизации полиэтилена низкой плотности (ПЭ). При скоростях выше 200 К мин -1 управляемое охлаждение до 100 °C было невозможно из-за ограниченной охлаждающей способности используемого механического промежуточного охладителя. Если необходимы более высокие скорости охлаждения, необходимо использовать жидкий азот.
Масса образца должна масштабироваться обратно пропорционально скорости сканирования. При низких скоростях, когда тепловая задержка не является проблемой, масса образца должна быть высокой, чтобы иметь хорошее отношение сигнал/шум. При высоких скоростях, когда сигналы велики, масса образца должна быть небольшой, чтобы свести к минимуму тепловой поток к образцу, который пропорционален скорости и вызывает тепловую задержку. Были тщательно изучены проблемы, связанные с тепловой задержкой, температурной калибровкой и воспроизводимостью в экспериментах по быстрому сканированию ДСК, и были даны адекватные рекомендации. 37,40,41 На рис. 4 показаны кривые охлаждения в диапазоне кристаллизации полиэтилена низкой плотности (ПЭ). При скоростях выше 200 К мин -1 управляемое охлаждение до 100 °C было невозможно из-за ограниченной охлаждающей способности используемого механического промежуточного охладителя. Если необходимы более высокие скорости охлаждения, необходимо использовать жидкий азот. Для более низких скоростей сканирования, показанных в Рисунок 4 , масса образца должна быть достаточно большой, чтобы обеспечить хорошее отношение сигнал/шум.При более высоких скоростях большой образец (4 мг) вызывает некоторое термическое отставание, как обсуждалось в учебниках и ссылках 37, 40 и 42. Это также видно по уширению пика кристаллизации при 20 К мин –1 по сравнению с с образцом 0,4 мг при той же скорости охлаждения. Данные, показанные на Рис. 4 , предоставляют информацию о кинетике кристаллизации и могут быть проанализированы с использованием различных кинетических моделей. 43–48
Для более низких скоростей сканирования, показанных в Рисунок 4 , масса образца должна быть достаточно большой, чтобы обеспечить хорошее отношение сигнал/шум.При более высоких скоростях большой образец (4 мг) вызывает некоторое термическое отставание, как обсуждалось в учебниках и ссылках 37, 40 и 42. Это также видно по уширению пика кристаллизации при 20 К мин –1 по сравнению с с образцом 0,4 мг при той же скорости охлаждения. Данные, показанные на Рис. 4 , предоставляют информацию о кинетике кристаллизации и могут быть проанализированы с использованием различных кинетических моделей. 43–48
Рис. 4. Кривые охлаждения в области кристаллизации ПЭ низкой плотности.Образцы имеют массу 4 мг в алюминиевом противне на 25 мг для скоростей охлаждения до -20 K мин -1 и массой 0,4 мг в алюминиевой фольге на 2 мг для более высоких скоростей охлаждения. Теплоемкость отложена вниз.
Данные PerkinElmer Pyris 1 DSC. Воспроизведено с разрешения Schick, C. Anal. Биоанал. хим. 2009 , 395 , 1589–1611. 35
Воспроизведено с разрешения Schick, C. Anal. Биоанал. хим. 2009 , 395 , 1589–1611. 35 Как показано на Рис. 4 , DSC имеет широкий динамический диапазон, который может быть расширен как минимум на 1 порядок в сторону более низких скоростей; таким образом, он покрывает 3 порядка.Расширение на несколько порядков в сторону более высоких скоростей обсуждается в разделе 2.31.3.2. Возможность достаточно быстрого охлаждения образца позволяет изучать структурообразование в далеко неравновесных ситуациях, таких как «квази»-изотермическая кристаллизация при глубоком переохлаждении.
Тепловая энергия — Энергетика Образование
Тепловая энергия объекта представляет собой энергию, содержащуюся в движении и вибрации его молекул. Тепловая энергия измеряется через температуру.
Энергия, содержащаяся в небольших движениях молекул объекта, может быть разбита на комбинацию микроскопической кинетической энергии и потенциальной энергии. Полная энергия тела равна:
Полная энергия тела равна:
[математика]E_T = E_K + E_P[/математика]
- [math]E_T[/math] — полная энергия объекта.
- [math]E_K[/math] — кинетическая энергия объекта.
- [math]E_P[/math] — это потенциальная энергия объекта.
Температура — это прямое измерение тепловой энергии. Это означает, что чем горячее объект, тем больше у него тепловой энергии.Теплота является мерой того, сколько тепловой энергии передается между двумя системами.
Механическую энергию легко превратить в тепловую, например, с помощью трения. Также возможно превратить тепловую энергию в механическую с помощью тепловой машины, но при этом методе всегда будет отработанное тепло.
Удельная теплоемкость
Удельная теплоемкость вещества — это количество энергии, необходимое для повышения температуры одного килограмма этого вещества на один градус Кельвина (или Цельсия, если вы не в лаборатории).
Скрытая теплота (энтальпия)
Скрытая теплота вещества — это тепло, необходимое объекту для изменения состояния, также называемого фазовым переходом. Вообще говоря, значения скрытой теплоты намного выше, чем значения удельной теплоемкости. Это также называют энтальпией. [1]
Вообще говоря, значения скрытой теплоты намного выше, чем значения удельной теплоемкости. Это также называют энтальпией. [1]
Лед и вода обладают огромной скрытой теплотой, поэтому снег тает так долго, а вода используется для приготовления пищи. Это также важно для обеспечения комфортной жизни на нашей планете и обеспечения достаточной устойчивости к изменению климата.
PhET: трение увеличивает тепловую энергию
Университет Колорадо любезно разрешил нам использовать следующую симуляцию PhET. Изучите симуляцию ниже, чтобы получить физическое представление о том, как трение может увеличить тепловую энергию и превратить макроскопическое движение в микроскопическое.
Ссылки
- ↑ Рэндалл Найт, Физика для ученых и инженеров, 3-е изд. Нью-Йорк: Пирсон, 2013, гл. 17, с. 482.
Биологическая энергия
Измерение энергии
В четвертой главе рассказа «Знакомьтесь, брат Грегори» брат Мэтью изобретает новую единицу измерения тепла; horko , что в переводе с чешского означает «тепло». Он опоздал. У англичан уже была единица, которую они называли «британской термальной единицей», или BTU , основанная на их собственных единицах измерения «фут-фунт». Но в Европе, во всех странах, захваченных французским императором Наполеоном Бонапартом, утверждалась новая система измерений, особенно в науке. Это была «метрическая» система, основанная на единице измерения в одну сорокмиллионную часть земной окружности.
Он опоздал. У англичан уже была единица, которую они называли «британской термальной единицей», или BTU , основанная на их собственных единицах измерения «фут-фунт». Но в Европе, во всех странах, захваченных французским императором Наполеоном Бонапартом, утверждалась новая система измерений, особенно в науке. Это была «метрическая» система, основанная на единице измерения в одну сорокмиллионную часть земной окружности.
Метрическая система, в которой есть стандарты для измерения расстояния, объема, тепла и температуры, но, что любопытно, не времени, построена в единицах по десять.Латинские префиксы используются для дробей, а греческие префиксы используются для кратных десяти, так что десять метров становятся одним дека метров (греческий префикс), тогда как десятая часть метра составляет деци метров (латинский префикс).
Для измерения теплопередачи физикам-метрикам требовалась метрическая единица измерения. Они выбрали единицу, исходя из количества тепла (или энергии), необходимого для повышения температуры одного грамма воды с 14,5 до 15,5 градусов по Цельсию. Технически этот стандарт должен называться грамм-калорий , но большинство людей называют его просто калорией , слово, происходящее от латинского слова «тепло».
Технически этот стандарт должен называться грамм-калорий , но большинство людей называют его просто калорией , слово, происходящее от латинского слова «тепло».
Помимо очевидного использования метрических единиц (грамм и градус Цельсия), это определение стандартной «калории» содержит две другие части, требующие объяснения; почему вода и почему 14,5-15,5 градусов?
Опыт и эксперименты быстро показали, что всем веществам требуется разное количество тепла, чтобы поднять их температуру на один градус Цельсия. Встаньте рядом с кузнецом, когда он или она стучит по раскаленному железному бруску, и полетят искры. Эти осколки металла очень, очень горячие (их температура высока).Но если один из них попадет вам на голую кожу, кроме шока, маловероятно, что вы обожжетесь. С другой стороны, если на вашу кожу упадет капля горячей воды, температура которой намного ниже температуры горячего утюга, вы, вероятно, ошпаритесь. Несмотря на разницу температур, вода держит гораздо больше тепла, чем утюг.
Требуется одна калория тепла, чтобы поднять температуру одного грамма воды на один градус, но та же самая калория тепла повысит температуру одного грамма алюминия 4.5 градусов, один грамм железа на 9 градусов, один грамм меди на 11 градусов, один грамм серебра на 18 градусов и один грамм свинца на 33 градуса. Это ясно показывает различие между теплом и температурой.
Поэтому при установлении «стандарта калорий» важно определить вещество, к которому добавляется тепло. Это также дает нам другое свойство веществ, называемое удельной теплоемкостью , то есть количество тепла (или энергии), необходимое для повышения температуры одного грамма этого вещества на один градус Цельсия.
Даже вода не постоянна в этом отношении. Количество тепла (или энергии), необходимое для повышения температуры воды на один градус, зависит от того, с какой точки шкалы Цельсия вы начинаете. Одному грамму воды при температуре 1 градус Цельсия требуется больше энергии, чтобы поднять ее температуру до 2 градусов Цельсия, чем требуется для повышения температуры одного грамма воды при 92 градусах Цельсия до 93 градусов Цельсия.
 В. Кривченко.
В. Кривченко. кВт на час = 1,9 тонн пара;
кВт на час = 1,9 тонн пара;