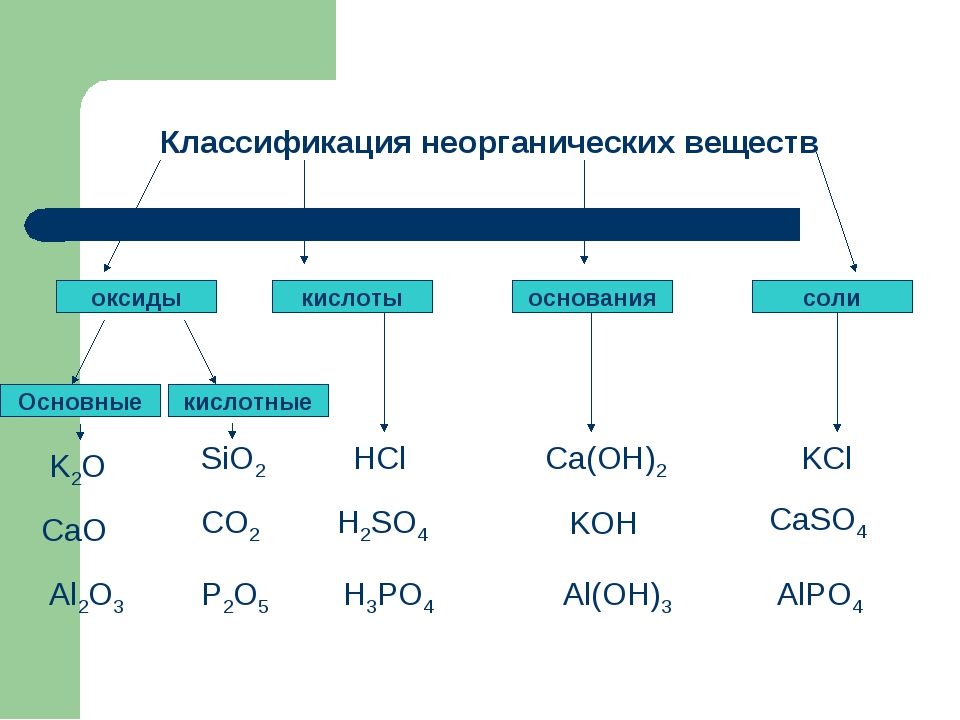
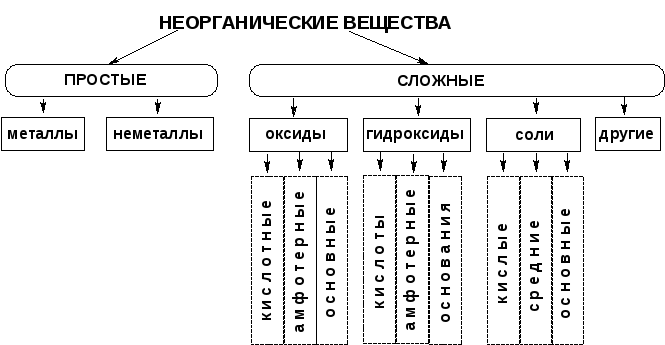
Неорганические вещества, определение — Справочник химика 21
ОБЪЕМНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ [c.315]Органические соединения, получаемые при реакциях синтеза с участием неорганических веществ (определение NHi, NO , NOi). [c.298]
Двуокись и окись углерода, а также все другие неорганические вещества определению не мешают. [c.59]
В связи с высокими температурами плавления неорганических веществ, определение обычными методами с капиллярами, погружаемыми в нагретые до определенной температуры бани, в большинстве случаев не удается. Определение температуры плавления неорганических веществ выполняют большей частью так называемым тигельным методом, наблюдая скорость охлаждения расплава при помощи погруженной в него термопары. [c.385]
В настоящее время газохроматографический метод начинает все шире применяться для анализов при высоких температурах [211].
Предлагаемая работа представляет собой сборник по методическим исследованиям, проведенным автором в области применения в аналитической химии неорганических веществ определенного класса органических соединений,— органических оснований. [c.3]
[c.3]
Лиофобные коллоиды являются гетерогенными высокодисперсными коллоидными системами. К ним принадлежат большей частью системы из неорганических веществ в водной дисперсионной среде, которые и представляют наибольший интерес для нашего курса. Типично лиофобные коллоиды при выделении дисперсной фазы образуют осадки, порошкообразные по структуре и не содержащие значительных количеств дисперсионной среды. Впрочем, наряду с типично лиофобными коллоидами существуют и такие лиофобные в общем коллоиды, которые обладают уже некоторой, и иногда довольно значительной, лиофильностью. К ним принадлежат, например, гидрозоли кремнезема (точнее — кремневых кислот), гидроокиси алюминия и др. В таких коллоидах частицы дисперсной фазы связывают большие количества воды и могут в известных условиях удерживать значительную часть ее ири выделении из раствора, образуя при этом студнеобразные продукты. В определенных условиях такие золи способны даже застудневать (желатинироваться), не выделяя воды, т.
Раздел СОСТОИТ из двух таблиц Рабочие (титрованные) растворы и Методы определения неорганических веществ . Таблицы охватывают важнейшие неорганические вещества (иопы), определяемые методами объемного анализа, и рабочие растворы, имеющие наибольшее применение. [c.303]
Раздел состоит из двух таблиц в первой таблице указаны рабочие (титрованные) растворы, с помощью которых возможно определять методом потенциометрического титрования различные неорганические вещества (ионы) во второй — даны условия потенциометрического определения важнейших неорганических веществ. В основном выбраны методы прямого титрования. [c.481]
Атомарные теплзты образования уже давно привлекали внимание еще и потому, что они должны равняться сумме энергии связи между атомами в молекуле. Определение же энергий связи представляет большой и разносторонний интерес для химии. Еще в 20-х годах Фаянс произвел такие расчеты для некоторых органических соединений в газообразном состоянии и получил интересные результаты в отношении энергий связи. В 30-х годах Б. Ф. Ормонт -2 рассматривал энергию атомизации неорганических веществ в кристаллическом состоянии. Но все эти работы не получили в то время дальнейшего развития вследствие отсутствия достаточно надежных значений вспомогательных величин, необходимых для таких расчетов.
Еще в 20-х годах Фаянс произвел такие расчеты для некоторых органических соединений в газообразном состоянии и получил интересные результаты в отношении энергий связи. В 30-х годах Б. Ф. Ормонт -2 рассматривал энергию атомизации неорганических веществ в кристаллическом состоянии. Но все эти работы не получили в то время дальнейшего развития вследствие отсутствия достаточно надежных значений вспомогательных величин, необходимых для таких расчетов.
Структура ИрНИТУ
02.00.01 Неорганическая химия
Формула специальности:
Неорганическая химия – раздел науки, изучающий строение, реакционную способность и свойства химических элементов и их соединений, за исключением органических соединений. Объектами исследований являются химические элементы и их соединения, включая координационные соединения с неорганическими, органическими и био лигандами и материалы на их основе. Теоретической основой неорганической химии является Периодический закон Д. И.Менделеева. Методы неорганической химии включают синтез неорганических соединений различными способами, изучение их строения, химических превращений и свойств физическими и физико-химическими методами.
И.Менделеева. Методы неорганической химии включают синтез неорганических соединений различными способами, изучение их строения, химических превращений и свойств физическими и физико-химическими методами.
Области исследований:
1. Фундаментальные основы получения объектов исследования неорганической химии и материалов на их основе.
2. Дизайн и синтез новых неорганических соединений и особо чистых веществ с заданными свойствами.
3. Химическая связь и строение неорганических соединений.
4. Реакционная способность неорганических соединений в различных агрегатных состояниях и экстремальных условиях
5. Взаимосвязь между составом, строением и свойствами неорганических соединений. Неорганические наноструктурированные материалы.
6. Определение надмолекулярного строения синтетических и природных неорганических соединений, включая координационные.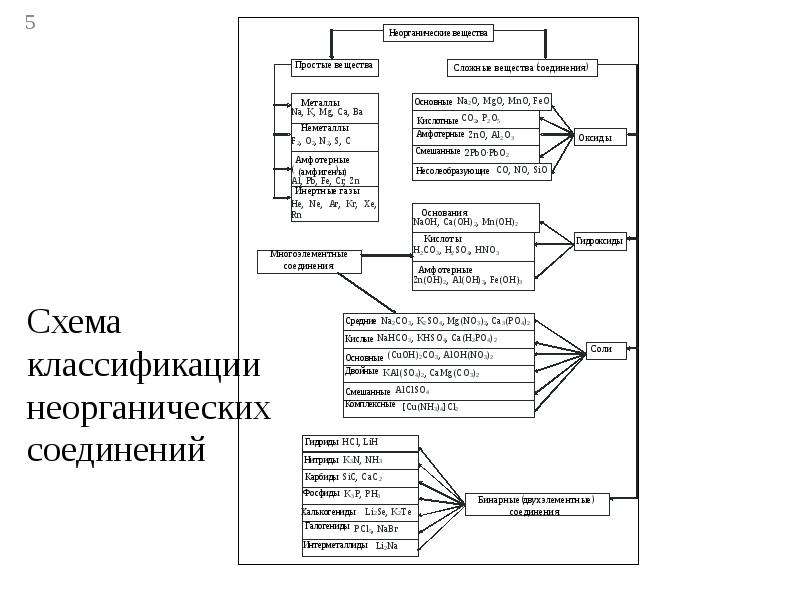
7. Процессы комплексообразования и реакционная способность координационных соединений, Реакции координированных лигандов.
8. Моделирование процессов, протекающих в окружающей среде, растениях и живых организмах, с участием объектов исследования неорганической химии.
02.00.04 Физическая химия
Формула специальности:
Физическая химия – раздел химической науки об общих законах, определяющих строение веществ, направление и скорость химических превращений при различных внешних условиях; о количественных взаимодействиях между химическим составом, структурой вещества и его свойствами. Теоретической основой физической химии являются общие законы физической науки. Она включает учение о строении молекул вещества, химическую термодинамику и химическую кинетику.
Области исследований:
1. Экспериментальное определение и расчет параметров строения молекул и пространственной структуры веществ.
2. Экспериментальное определение термодинамических свойств веществ, расчет термодинамических функций простых и сложных систем, в том числе на основе методов статистической термодинамики, изучение термодинамики фазовых превращений и фазовых переходов.
3. Определение термодинамических характеристик процессов на поверхности, установление закономерностей адсорбции на границе раздела фаз и формирования активных центров на таких поверхностях.
4. Теория растворов, межмолекулярные и межчастичные взаимодействия.
5. Изучение физико-химических свойств систем при воздействии внешних полей, а также в экстремальных условиях высоких температур и давлений.
6. Неравновесные процессы, потоки массы, энергии и энтропии пространственных и временных структур в неравновесных системах.
7. Макрокинетика, механизмы сложных химических процессов, физико- химическая гидродинамика, растворение и кристаллизация.
 Динамика элементарного акта при химических превращениях.
Динамика элементарного акта при химических превращениях. 9. Элементарные реакции с участием активных частиц.
10. Связь реакционной способности реагентов с их строением и условиями осуществления химической реакции.
11. Физико-химические основы процессов химической технологии.
03.02.08 Экология (по отраслям)
Формула специальности:
Экология – наука, которая исследует структуру и функционирование живых систем (популяции, сообщества, экосистемы) в пространстве и времени в естественных и измененных человеком условиях. Предмет экологии: совокупность живых организмов (включая человека), образующих на видовом уровне популяции, на межпопуляционном уровне – сообщество (биоценоз), и в единстве со средой обитания – экосистему (биогеоценоз).
Области исследований:
Факториальная экология – исследование влияния абиотических факторов на живые организмы в природных и лабораторных условиях с целью установления пределов толерантности и оценки устойчивости организмов к внешним воздействиям.
Популяционная экология – изучение закономерностей, управляющих динамикой численности популяций, их пространственной и демографической структурой. Установление механизмов, лежащих в основе регуляции численности видов и обеспечивающих устойчивость популяции в изменяющихся биотических и абиотических условиях.
Экология сообществ – изучение разнообразных типов межпопуляционных отношений (конкуренция, мутуализм, паразитизм и т.п.), обеспечивающие образование сообществ, как систем с относительно стабильным видовым составом. Одна из основных задач в этой области – выяснение конкретных механизмов, ответственных, с одной стороны, за поддержание динамического равновесия в сообществе, а с другой стороны, обуславливающих закономерные изменения сообществ в ходе сукцессий. Исследование временных и пространственных аспектов сукцессий. Системная экология – изучение взаимодействия сообществ с абиотической средой обитания и закономерности превращений вещества и энергии в процессах биотического круговорота.
Экология человека – изучение общих законов взаимодействия человека и биосферы, исследование влияния условий среды обитания на людей (на уровне индивидуума и популяции). Разработка принципов и механизмов, обеспечивающих устойчивое развитие человеческого общества при сохранении биоразнообразия и стабильного состояния природной среды.
1. В нефтегазовой отрасли:
В нефтегазовой отрасли:
1.1. Исследования влияния абиотических факторов технологических процессов и продукции нефтегазовой отрасли на живые организмы в природных и лабораторных условиях с целью установления пределов толерантности и устойчивости организмов к техногенному воздействию.
1.2. Комплексная оценка влияния промышленных объектов нефтегазовой отрасли на природные и искусственные экосистемы. Принципы и механизмы системного экологического мониторинга.
1.3. Научное обоснование, разработка и совершенствование методов проектирования технико-технологических систем и нормирования проектной и изыскательской деятельности, обеспечивающих минимизацию антропогенного воздействия на живую природу нефтегазовой отрасли
1.4. Инженерная защита экосистем. Прогнозирование, предупреждение и ликвидация последствий загрязнения окружающей среды от техногенных аварий и катастроф в нефтегазовой промышленности.
1. 5. Разработка экологически безопасных технологий и материалов, процессов подготовки и повышения качества продукции, утилизации промышленных отходов при разработке и эксплуатации нефтегазовых месторождений.
5. Разработка экологически безопасных технологий и материалов, процессов подготовки и повышения качества продукции, утилизации промышленных отходов при разработке и эксплуатации нефтегазовых месторождений.
1.6. Эколого-методические основы системы охраны прибрежных зон природных (моря, озера, реки) и искусственных (водохранилища) водоемов от загрязнения нефтью и нефтепродуктами.
2. В строительстве и ЖКХ:
2.1. Факториальная экология – исследование влияния абиотических факторов на живые организмы в природных и лабораторных условиях с целью установления пределов толерантности и оценки устойчивости организмов к внешним воздействиям, возникающим в результате строительной хозяйственной деятельности и эксплуатации ЖКХ.
2.2. Системная экология – изучение взаимодействия сообществ с абиотической средой обитания, в том числе созданной и измененной в результате строительной и хозяйственной деятельности и установление закономерностей превращений вещества и энергии в процессах биотического круговорота.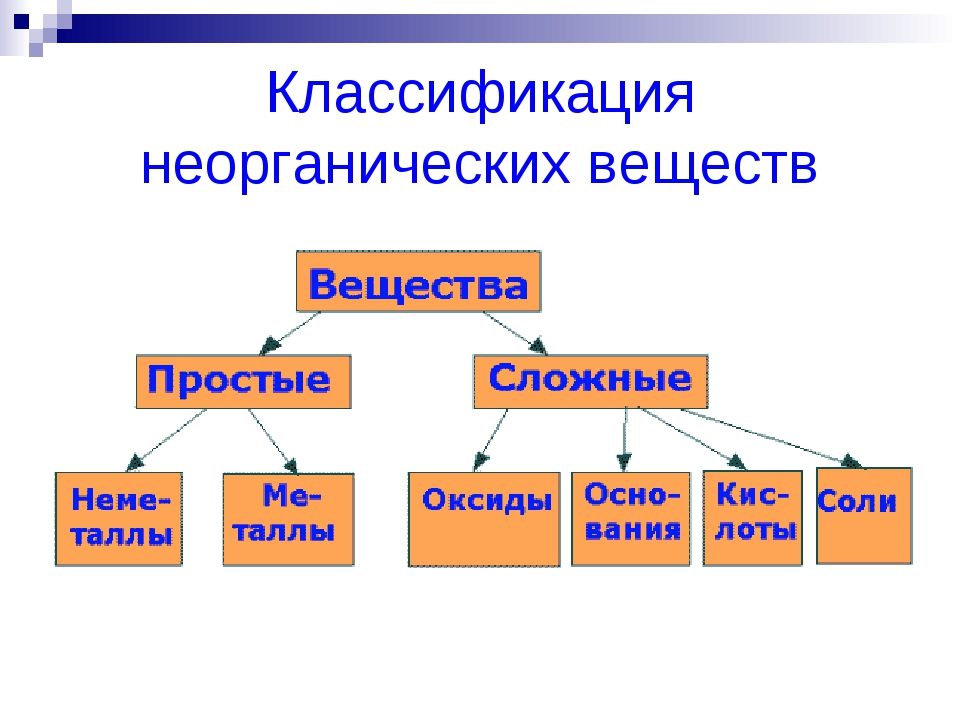
2.3. Прикладная экология – разработка принципов и практических мер, направленных на охрану живой природы, как на видовом, так и экосистемном уровне; разработка принципов создания искусственных экосистем (строительные системы, урбосистемы, агроэкосистемы, объекты аквакультуры, ЖКХ и т.п.) и управления их функционированием. Исследование влияния антропогенных факторов на экосистемы различных уровней с целью разработки экологически обоснованных норм воздействия строительной, хозяйственной деятельности человека и эксплуатации ЖКХ на живую природу.
2.4. Экология человека – изучение общих законов взаимодействия человека и биосферы, исследование влияния условий среды обитания (в том числе созданной в результате строительной, хозяйственной деятельности и эксплуатации ЖКХ) на человека.
2.5. Разработка принципов и механизмов, обеспечивающих устойчивое развитие человеческого общества при сохранении биоразнообразия и стабильного состояния природной среды при создании безопасной и комфортной среды жизнедеятельности.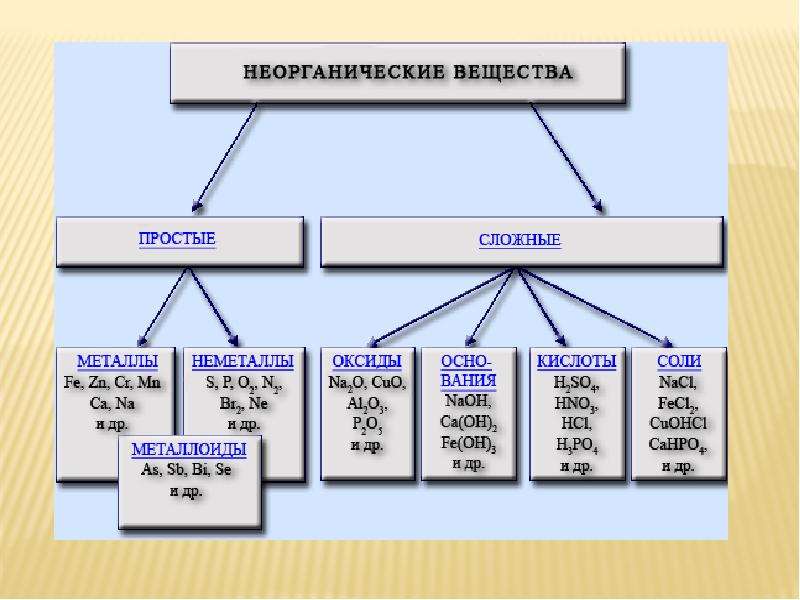
3. В транспорте:
3.1. Комплексная оценка воздействия объектов транспорта и транспортных систем (включая этап строительства) на экосистемы различных уровней.
3.2. Исследование загрязнения компонентов природной среды транспортными объектами и техническими средствами обеспечения перевозок, с целью разработки экологически обоснованных норм воздействия транспортной деятельности человека на природную среду.
3.3. Научные исследования в области разработки и совершенствования методов проектирования природоохранной техники для железнодорожного, водного, автомобильного и авиационного транспорта.
3.4. Разработка научных основ рационального использования и охраны водных, воздушных, земельных, рекреационных и энергетических ресурсов, санации и рекультивации земель.
3.5. Научное обоснование безопасного размещения, хранения, транспортировки и захоронения токсичных и других отходов, образующихся от деятельности транспорта.
3.6. Научное обоснование, разработка и совершенствование транспортных средств, объектов и транспортных систем, методов нормирования проектной и изыскательской деятельности, обеспечивающих предотвращение и минимизацию негативного воздействия на природную среду.
3.7. Научные исследования в области создания экологически чистых транспортных средств, малоотходных, энерго- и ресурсосберегающих технологий.
3.8. Разработка и совершенствование системы экологического мониторинга и контроля на транспорте.
3.9. Научные основы управления антропогенным воздействием объектов транспорта на основе информационных систем.
3.10. Научное обоснование принципов и разработка методов прогнозирования, предупреждения и ликвидации последствий загрязнения природной среды при техногенных авариях и катастрофах на объектах транспорта.
4. В легкой, текстильной промышленности, химии и нефтехимии:
4. 1. Исследования влияния абиотических факторов технологических процессов и продукции легкой, текстильной, химических и нефтехимических отраслей промышленности на окружающую среду в естественных и искусственных условиях с целью установления пределов устойчивости компонентов биосферы к техногенному воздействию.
1. Исследования влияния абиотических факторов технологических процессов и продукции легкой, текстильной, химических и нефтехимических отраслей промышленности на окружающую среду в естественных и искусственных условиях с целью установления пределов устойчивости компонентов биосферы к техногенному воздействию.
4.2. Исследования в области экологической безопасности производственных объектов легкой, текстильной, химических и нефтехимических отраслей промышленности
4.3. Принципы и механизмы системного экологического мониторинга, аналитического контроля в легкой, текстильной, химических и нефтехимических отраслях промышленности.
4.4. Научное обоснование, разработка и совершенствование методов проектирования технологических систем и нормирования проектной и изыскательской деятельности, обеспечивающих минимизацию антропогенного воздействия объектов легкой, текстильной, химических и нефтехимических отраслей промышленности на окружающую среду.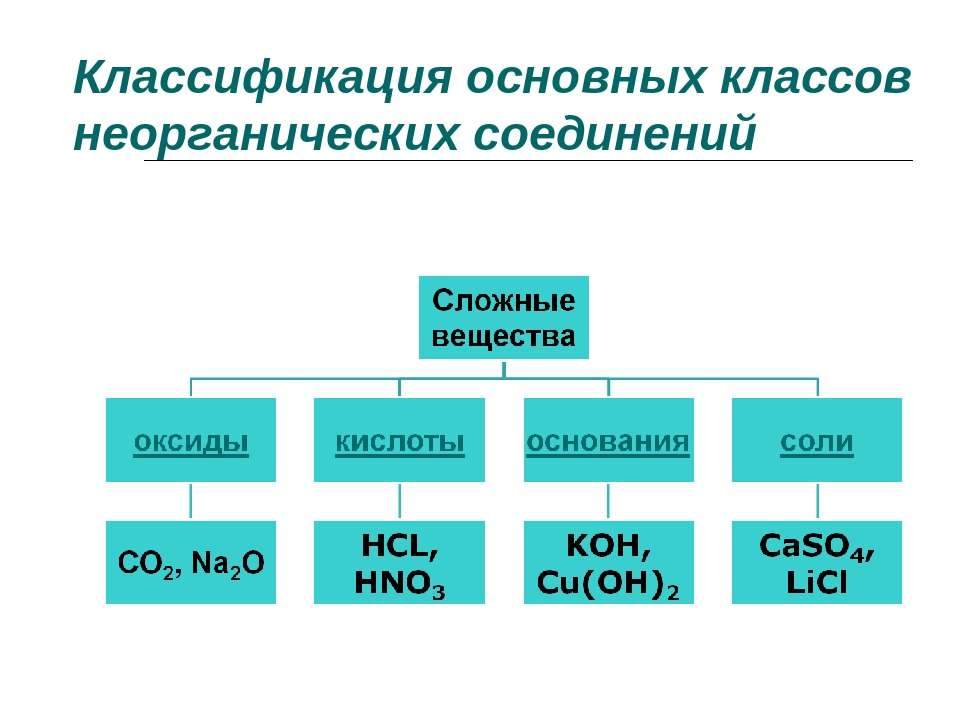
4.5. Научное обоснование принципов и разработка методов инженерной защиты территорий естественных и искусственных экосистем от воздействия предприятий легкой, текстильной, химических и нефтехимических отраслей промышленности.
4.6. Научное обоснование принципов и разработка методов прогнозирования, предупреждения и ликвидации последствий загрязнения окружающей среды при техногенных авариях и катастрофах на объектах легкой, текстильной, химических и нефтехимических отраслей промышленности.
4.7. Эколого-экономический анализ деятельности предприятий легкой, текстильной, химических и нефтехимических отраслей промышленности.
4.8. Информационные технологии, как инструмент достижения экологической и экономической эффективности работы предприятий отрасли.
4.9. Разработка систем управления отходами производства и потребления предприятий легкой, текстильной, химических и нефтехимических отраслей промышленности.
5. В энергетике:
5.1. Разработка научных методов расчета, выбора и оптимизации параметров, совершенствование методов проектирования энергетических установок и систем и нормирования проектной и изыскательской деятельности, обеспечивающих предотвращение и минимизацию вредного воздействия энергетики на окружающую среду.
5.2. Исследование влияния абиотических факторов энергетической отрасли на живые организмы в природных и лабораторных условиях с целью установления пределов толерантности и устойчивости организмов к техногенному воздействию.
5.3. Комплексная оценка влияния объектов энергетики на природные и искусственные экосистемы, разработка методов и средств экологического мониторинга объектов энергетического комплекса, исследование и оценка воздействия энергетической отрасли на окружающую среду, в том числе на стадиях проектирования и строительства.
5.4. Разработка, исследование, совершенствование действующих и освоение новых технологий и устройств, позволяющих снизить негативное воздействие объектов энергетики на окружающую среду.
5.5. Прогнозирование, предотвращение и ликвидация последствий загрязнения окружающей среды от техногенных аварий и катастроф, повышение надежности оборудования и персонала объектов энергетики.
5.6. Разработка экологически безопасных технологий очистки, утилизации и хранения вредных промышленных отходов.
5.7. Разработка научных основ рационального и энергоэффективного использования энергетических ресурсов, принципов и механизмов, обеспечивающих безопасное и устойчивое развитие человеческого общества при сохранении стабильного состояния природной среды.
05.18.01 Технология обработки, хранения и переработки злаковых, бобовых культур, крупяных продуктов, плодоовощной продукции и виноградарства
Формула специальности:
Содержанием специальности «Технология обработки, хранения и переработки злаковых, бобовых культур, крупяных продуктов, плодоовощной продукции и виноградарства» является разработка технологий обработки, хранения, переработки злаковых, бобовых культур, крупяных продуктов, винограда, плодоовощной продукции, фруктов и ягод в рамках зерноперерабатывающей, комбикормовой, крупяной, хлебопекарной, макаронной, кондитерской, пивобезалкогольной, спиртовой, дрожжевой, ликероводочной, винодельческой, консервной, овоще- и фруктосушильной, пищеконцентратной отраслей, производства быстрозамороженной продукции, кваса.
Объектами данной специальности являются технологические параметры процессов обработки, хранения и переработки злаковых, бобовых культур, крупяных продуктов, винограда, плодоовощной продукции, фруктов и ягод, качественный и количественный состав сырья, готовой продукции, применяемое оборудование, системы управления технологическим процессом и качеством продукции, применяемые тара и тароупаковочные материалы при фасовании продуктов. Самостоятельным блоком этой специализации являются направления, способствующие повышению конкурентоспособности продукции, ее безопасности и обеспечению снижения вредного воздействия производства на окружающую среду.
Области исследований:
1. Разработка научных основ технологий для выращивания, приемки, транспортирования и хранения зерна, плодоовощной продукции, фруктов, ягод, обеспечивающих энергоресурсосбережение, экологическую безопасность, повышение технического и технологического уровня производства, сокращение потерь и сохранение качества растительного сырья.
2. Разработка научных основ технологий применения новых видов сырья, в том числе вторичного сырья зерноперерабатывающей и плодоовощной отрасли с целью рационального использования ресурсов и повышения пищевой биологической ценности.
3. Разработка новых (в том числе интенсивных) и совершенствование существующих технологий производства продуктов зерноперерабатывающей, комбикормовой, крупяной, хлебопекарной, макаронной, кондитерской, винодельческой, консервной, овоще- и фруктосушильной, пищеконцентратной отраслей, быстрозамороженной продукции.
4. Моделирование и оптимизация технологических процессов производства мучных, крупяных, кормовых, хлебобулочных, макаронных, кондитерских изделий, продуктов быстрого приготовления и длительного хранения, оптимизация параметров процессов, в том числе с использованием компьютерных технологий.
5. Разработка научных основ и технологий создания и оптимизации продуктов лечебного, профилактического назначения из растительного сырья для питания отдельных групп населения, использования в экологически неблагоприятных зонах, в том числе с использованием биологически активных добавок направленного действия.
6. Разработка нового ассортимента и технологий изделий с использованием нетрадиционных и новых сортов и видов сырья, поликомпозитных смесей и полуфабрикатов с регулированием содержания основных пищевых и биологически активных компонентов, измененным химическим составом для создания продуктов нового поколения повышенной пищевой ценности и высокой степени готовности к употреблению, в том числе компонентов детского и диетического питания.
7. Исследование и разработка научных и практических основ технологий и ассортимента изделий с использованием полного или частичного удаления влаги из растительного сырья, быстрого замораживания сырья, полуфабрикатов и готовой продукции с максимальным сохранением питательных веществ, вкусовых свойств и увеличения срока хранения с использованием экологически чистых технологических приемов.
8. Исследование процессов производства ферментированных продуктов, изучение биологической ценности готовой продукции и разработка способов переработки вторичных сырьевых ресурсов с использованием физических и биохимических приемов с целью извлечения ценных компонентов, в том числе ароматических, красящих и загущающих веществ.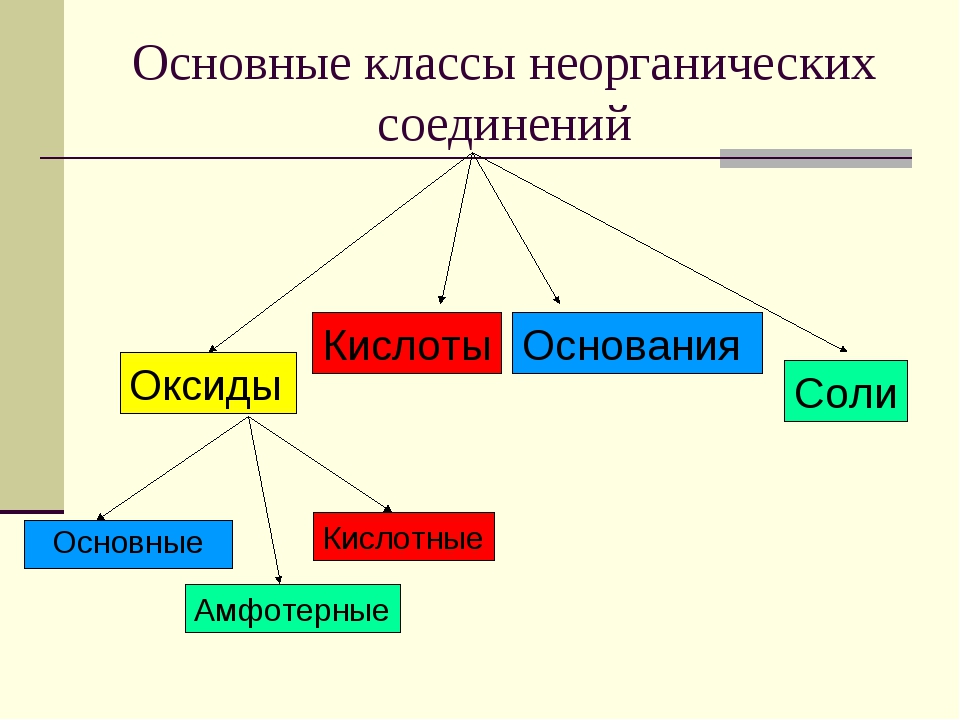
9. Создание технологии получения и применения полифункциональных пищевых и кормовых добавок и улучшителей, в том числе на основе вторичных продуктов перерабатывающих отраслей АПК.
10. Разработка научных и практических основ технологий и методов для увеличения срока сохранения свежести или срока годности изделий.
11. Разработка научных и практических основ технологии производства и использования упаковочных материалов и тары для мучных, крупяных, кормовых, хлебобулочных, макаронных, кондитерских изделий, продуктов быстрого приготовления и длительного хранения, пива, спирта, кваса, безалкогольных напитков, ликеро-водочных изделий.
12. Разработка теоретических и практических основ перспективных методов и систем контроля качества и безопасности сырья, полуфабрикатов и готовой продукции на различных этапах производственного процесса.
Разница между органическими и неорганическими соединениями — Разница Между
Органические и неорганические соединения — две широкие категории соединений в химии. Почти все теории, законы и гипотезы в химии сделаны на основе органических и неорганических соединений. Оба типа с
Почти все теории, законы и гипотезы в химии сделаны на основе органических и неорганических соединений. Оба типа с
Основное отличие — органические и неорганические соединения
Органические и неорганические соединения — две широкие категории соединений в химии. Почти все теории, законы и гипотезы в химии сделаны на основе органических и неорганических соединений. Оба типа состоят из вещества в любом физическом состоянии: твердое состояние, жидкое состояние или газообразное состояние. Основное различие между органическими и неорганическими соединениями заключается в том, что органические соединения по существу имеют один или несколько атомов углерода в своей структуре в то время как неорганические соединения могут иметь или не иметь атомы углерода.
Ключевые области покрыты
1. Какие органические соединения
— определение, структура, свойства
2. Какие неорганические соединения
— определение, структура, свойства
3. В чем разница между органическими и неорганическими соединениями
В чем разница между органическими и неорганическими соединениями
– Сравнение ключевых различий
Ключевые слова: органические, неорганические, химические, твердые, жидкие, газообразные, ковалентные, ионные, гидрофобность.
Какие органические соединения?
Органическое соединение представляет собой любое соединение, по существу имеющее один или несколько атомов углерода, ковалентно связанных с другими элементами. Чаще всего эти атомы углерода связаны с атомами водорода, кислорода и азота. Понятие органических соединений может вводить в заблуждение в некоторых моментах, таких как углекислый газ (СО2). Хотя СО2 имеет атом углерода, связанный с двумя атомами кислорода, он не считается органическим соединением по историческим причинам. Соединения, такие как карбонаты, цианиды, СО и СО2 были открыты до открытия органических соединений. В то время они считались неорганическими соединениями, и эта практика все еще продолжается.
Органическая химия является разделом химии, который объясняет структуру, свойства, реакции и другие важные факты об органических соединениях. Органическая химия — сложный предмет, и ученые используют его для создания ряда ценных продуктов. Поскольку почти все организмы состоят из органических молекул, органические соединения необходимы для жизни на Земле.
Поскольку существует ряд различных соединений, включенных в категорию органических соединений, эти соединения могут быть дополнительно классифицированы различными способами. Наиболее распространенным типом органических соединений являются углеводороды. Углеводороды также можно классифицировать различными способами, так как эти соединения имеют разную структуру, свойства и проявляют разные реакции.
Полимеры являются еще одним типом важных органических соединений. Хотя некоторые полимеры состоят из неорганических основных цепей, они также содержат органические группы и называются гибридными полимерами. Полимеры используются в различных областях и процессах, которые важны в повседневной жизни.
Полимеры используются в различных областях и процессах, которые важны в повседневной жизни.
Органические соединения, такие как углеводороды, могут быть классифицированы как алифатические и ароматические в зависимости от наличия или отсутствия ароматических кольцевых структур. Органические соединения находятся во всех трех физических состояниях при комнатной температуре. Например,
Твердая фаза — некоторые амиды
Жидкая фаза — спирты, такие как этанол
Газовая фаза — газы типа метана
Рисунок 1: алифатическое органическое соединение
Рисунок 2: Ароматическое органическое соединение
Что такое неорганические соединения?
Неорганическое соединение представляет собой любое соединение, которое не является органическим соединением. Другими словами, неорганические соединения по существу не состоят из атомов углерода. Могут присутствовать или отсутствовать атомы углерода.
Неорганическая химия — это раздел химии, который объясняет структуру, поведение, свойства и характеристики неорганических соединений. Неорганические соединения в основном встречаются в виде минералов, соединений металлов или металлоорганических соединений.
Неорганические соединения в основном встречаются в виде минералов, соединений металлов или металлоорганических соединений.
Поскольку многие неорганические соединения состоят из металла или ионов металлов, они способны проводить электричество. Некоторые неорганические соединения могут проводить электричество даже без металла, такого как графит. Большинство неорганических соединений содержат ионные и ковалентные связи. Многие неорганические соединения также очень красочны из-за присутствия элементов d-блока. Большинство неорганических соединений растворимы в воде благодаря их ионному связыванию. Они могут распасться на их ионы при добавлении в воду. Другим важным свойством является их способность образовывать кристаллы. Эта способность также вызвана их связующим характером.
Рисунок 3: Структура силана (слева) похожа на структуру метана (справа). Но силан — неорганическое соединение, а метан — органическое соединение.
Разница между органическими и неорганическими соединениями
Определение
Органические соединения: Органические соединения представляют собой соединения, по существу имеющие атомы углерода в структуре наряду с атомами, такими как водород, азот и кислород.
Неорганические соединения: Неорганические соединения представляют собой соединения, которые по существу не имеют атомов углерода в своей структуре.
Тип склеивания
Органические соединения:Органические соединения в основном проявляют ковалентную связь.
Неорганические соединения: Неорганические соединения показывают ионную связь наряду с ковалентной связью.
Настоящее атомы
Органические соединения:Органические соединения по существу имеют атомы водорода С и Н.
Неорганические соединения: Неорганические соединения могут иметь любой атом, кроме C и H, непосредственно связанных вместе.
Внешность
Органические соединения:Большинство органических соединений бесцветны.
Неорганические соединения: Большинство неорганических соединений являются красочными.
Растворимость в воде
Органические соединения:Большинство органических соединений не растворяются в воде из-за их гидрофобности.
Неорганические соединения: Большинство неорганических соединений могут растворяться в воде из-за наличия ионных связей.
Заключение
Основные области химии включают органическую химию, неорганическую химию, физическую химию и аналитическую химию. Среди них органическая химия объясняет структуру, свойства и реакции органических соединений. Неорганическая химия — это область, объясняющая структуру, свойства и реакции неорганических соединений. Таким образом, разница между органической и неорганической химией проистекает из разницы между органическими и неорганическими соединениями, которая, в свою очередь, зависит от наличия или отсутствия атомов углерода в их структуре.
Рекомендации:
1. Органические и неорганические соединения. ”SoftSchools.com. Н.п., н.д. Web.
Неорганические вещества клетки
Из неорганических веществ клетки вода составляет около 65% ее массы: в молодых быстрорастущих клетках до 95%, в старых — около 60%. Роль воды в клетках очень велика, она является средой и растворителем, участвует в большинстве химических реакций, перемещении веществ, терморегуляции, образовании клеточных структур, определяет объем и упругость клетки. Большинство веществ поступает в организм и выводится из него в водном растворе.
Роль воды в клетках очень велика, она является средой и растворителем, участвует в большинстве химических реакций, перемещении веществ, терморегуляции, образовании клеточных структур, определяет объем и упругость клетки. Большинство веществ поступает в организм и выводится из него в водном растворе.
Содержание минеральных веществ в клетках незначительно, но роль их велика: они поддерживают осмотическое равновесие, регулируют различные биохимические и физиологические процессы. Например, ионы Na и К нужны для образования нервных импульсов, ионы Са нужны для свертывания крови и др.
Органические вещества — составляют 20-30% состава клетки. Они могут быть простыми (аминокислоты, глюкоза, жирные кислоты) и сложными (белки, полисахариды, нуклеиновые кислоты, липиды). Наиболее важное значение имеют белки, жиры, углеводы, нуклеиновые кислоты.
- Белки
- — это основные и наиболее сложные вещества любой клетки. По размерам белковая молекула в сотни и тысячи раз превосходит молекулы неорганических соединений.
 Белковые молекулы образуются из простых соединений — аминокислот (в естественных белках содержится 20 аминокислот). Объединяясь в различной последовательности и количестве, они образуют большое разнообразие (до 1000) белков. Их роль в жизни клетки огромна: строительный материал организма, катализаторы (белки-ферменты ускоряют химические реакции), транспорт (гемоглобин крови доставляет клеткам кислород и питательные вещества и уносит углекислый газ и продукты распада). Белки выполняют защитную функцию, энергетическую.
Белковые молекулы образуются из простых соединений — аминокислот (в естественных белках содержится 20 аминокислот). Объединяясь в различной последовательности и количестве, они образуют большое разнообразие (до 1000) белков. Их роль в жизни клетки огромна: строительный материал организма, катализаторы (белки-ферменты ускоряют химические реакции), транспорт (гемоглобин крови доставляет клеткам кислород и питательные вещества и уносит углекислый газ и продукты распада). Белки выполняют защитную функцию, энергетическую. - Углеводы
- — органические вещества, состоящие из углерода, водорода и кислорода. Наиболее простые из них моносахариды — гексоза, фруктоза, глюкоза (содержатся в фруктах, меде), галактоза (в молоке) и полисахариды — состоящие из нескольких простых углеводов. Сюда относятся крахмал, гликоген. Углеводы — основной источник энергии для всех форм клеточной активности (движение, биосинтез, секреция и т. д.) и играют роль запасных веществ.
- Липиды
- — нерастворимые в воде жиры и жироподобные вещества.
 Они являются основным структурным компонентом биологических мембран. Липиды выполняют энергетическую функцию, в них содержатся жирорастворимые витамины.
Они являются основным структурным компонентом биологических мембран. Липиды выполняют энергетическую функцию, в них содержатся жирорастворимые витамины. - Нуклеиновые кислоты
- — (от латинского слова «нуклеус» — ядро) — образуются в ядре клетки. Они бывают двух типов: дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). Биологическая роль их очень велика. Они определяют синтез белков и передачу наследственной информации.
Ионнохроматографическая система ICS-5000, Dionex: Ионохроматографическая система ICS-5000 — революционный шаг в ионной хроматографии. Она отлично сочетает в себе увеличенную производительность, расширенные возможности проведения анализов и повышенную эффективность работы. В ионохроматографической системе ICS-5000 реализованы все современные технологии в области ионной хроматографии — безреагентная ионная хроматография (RFIC), в том числе с автоматическим предварительным концентрированием для определения следовых количеств ионов – фторид-, хлорид-, бромид-, йодид-, сульфат-, сульфит-, нитрат-, нитрит, фосфат-, ацетат-, формиат- анионов, а также катионов лития, калия, натрия, магния, кальция, аммония. Модульная конструкция ICS-5000 позволяет гибко конфигурировать систему для широкого спектра хроматографических задач, таких как анализ содержания катионов и анионов в питьевой и сточной водах (до 10-4), определение следовых количеств катионов и анионов в высокочистых кислотах и основаниях (до 10-6 % масс.) и для многих других задач. Аппаратно-программный комплекс для системного подхода к анализу состава и структуры неорганических веществ и особо-чистых химических реактивов, в состав которого входят: 1) Чистая зоны класса 5 ИСО, оснащенная ламинарными боксами, в сочетании с системами получения сверх чистой воды и установкой для перегонки кислот без кипения, позволяет осуществлять работу и пробоподготовку особо чистых химических реактивов без загрязнения примесями постоянно присутствующими в атмосферном воздухе. 2) Система микроволнового вскрытия Sineo MDS-10 позволяет переводить в растворимую форму различные труднорастворимые органические и неорганические соединения, минимизируя количество возможных источников загрязнения при анализе особо чистых реактивов. 3) Приборы для прецизионного анализа элементного состава и количественного определения примесей: атомно-эмиссионный спектрометр с индуктивно связанной плазмой iCAP 6300 duo и масс-спектрометр с индуктивно связанной плазмой Elan DRC Perken Elmer позволяют достоверно устанавливать элементный состав пробы, а также определять содержание следовых количеств примесей до 1*10-9 массовых процентов. 4) Система ретгенофлуоресцентого анализа ElvaX Light позволяет проводить неразрушающий элементный анализ образцов различной природы с содержанием элементов до 10-3 массовых процентов. 5) Порошковый рентгеновский дифрактометр EMMA позволяет проводить качественный и количественный анализ фазового состава органических и неорганических соединений, смесей и материалов. Данный приборный комплекс позволяет проводить комплексный качественный и количественный анализ неорганических веществ и реактивов высокой чистоты. Каждый элемент комплекса позволяет получать информацию об отдельных характеристиках веществ, реактивов и материалов, позволяя по совокупности данных получать исчерпывающую информацию об объектах анализа. Аппаратно-программный комплекс для системного подхода к анализу состава и структуры органических соединений, в том числе и олигомеров, в состав которого входят: 1) Чистая зоны класса 5 ИСО, оснащенная ламинарными боксами, в сочетании с системами получения сверх чистой воды и установкой для перегонки кислот без кипения, позволяет осуществлять работу и пробоподготовку особо чистых химических реактивов без загрязнения примесями постоянно присутствующими в атмосферном воздухе. 2) Газохроматографическая система ХроматекКристалл 5000.2 с капиллярными и насадочными колонками, с детекторами ПИД (пламенно-ионизационный детектор) и ДТП (детектор по теплопроводности) используется для качественного и количественного анализа сложны органических смесей, испаряющихся без разложения. 3) Хроматомасс-спектрометрическая система с масс-спектрометрическим детектором ISQ Thermo Scientific представляет собой комбинацию газового хроматографа и масс-спектрометра (источник ионизации – электронный удар). Предназначена для обнаружения и идентификации соединений, входящих в состав медицинской, пищевой, сельскохозяйственной и других видов продукции, лекарственных, психотропных и наркотических средств, биологических систем, контроля экологической обстановки. Область применения — химический и структурный анализ соединений в органической химии, медицине, судебно-медицинской экспертизе, криминалистике, токсикологии, при производстве и контроле качества различных видов пищевой, парфюмерной, фармацевтической, промышленной и сельскохозяйственной продукции, при наркотическом и экологическом контроле. 4) ИК Фурье спектрометра Vertex 70 с расширенным ИК диапазоном от 8000 до 50 см-1 и Раман Фурье модулем RAM2 применяется для проведения количественного и структурного анализа органических соединений. Спектрометр также оборудован приставкой диффузного отражения, что позволяет анализировать пробы, с трудом поддающиеся исследованию в проходящем свете (например, объемные образцы, порошки, волокнистые материалы — бумага, ткань, компактные куски трудно измельчаемых материалов). Спектрометр также оборудован приставкой нарушенного полного внутреннего отражения, которая может применяться для анализа жидкостей, гелей, паст, поверхностей образца, изучения превращений на поверхности. 5) Спектрометр ядерного магнитного резонанса Bruker Avance III Nanobay 300 МГц предназначен для подтверждения или установления строения органических веществ, определения чистоты органических веществ, контроля прохождения химических реакций, определения структуры полимеров и т. Конфигурация прибора позволяет регистрировать спектры органических и неорганических растворов большинства магнитных ядер. 6) Элементный CHNS анализатор Euro Vecktor Euro EA 3000 предназначен для одновременного определения массовой доли азота, углерода, водорода и серы в органических и неорганических соединениях. 7) Градиентная система гель-проникающей высоко-эффективной жидкостной хроматографии «Бриз» с UV- и RI- детекторами, Waters Corporation, которая позволяет проводить исследования молекулярномассового распределения оргенических и элементорганических олигомеров массой до 20 000 Дальтонов. Данный приборный комплекс позволяет проводить комплексный качественный и количественный анализ органических веществ и реактивов высокой чистоты, новых органических веществ в том числе олигомерного и полимерного строения. Аппаратно-программный комплекс для системного подхода к анализу физико-химических свойств, размеров частиц и структуры поверхности, в состав которого входят: 1) Лазерный дифракционный анализатор Malvern Mastersisez 2000Е с блоком диспергирования большого объема Hydro 2000G, позволяет проводить измерения распределения размеров частиц неорганических и органических веществ и порошковых материалов в диапазоне от 0,02 до 2000 мкм. Система позволяет также проводить анализ размеров частиц в суспензиях и эмульсиях 2) Спектрофлуориметр Флюорат-02-Панорама с приставкой «КРИО-1» и приставкой типа «Лягушка» для измерения спектров люминесценции и фосфоресценции твёрдых и сыпучих образцов, в том числе и вне кюветного отделения при температурах вплоть до -196 оС 3) Спектрофотометр Spekord 250 Plus, Analytik-Jena AG, позволяет проведить количественный и качественный фотометрический анализ в различных научных исследованиях, в том числе определение цветности, коэффициентов и спектров отражения пигментных красителей и веществ для производства керамики и волоконной оптики, при контроле качества веществ, участвующих в производственном процессе, в том числе сырья и конечных продуктов. 4) Малогабаритный сканирующий электронный микроскоп Hitachi SU1510 позволяет проводить анализ поверхности определять размеры структурных элементов в проводящих и непроводящих образцах различной природы, для проведения исследований микро- и нано-структуры поверхности различных образцов. Позволяет изучать морфологию поверхности образца, проводить измерения размеров, формы, ориентации и других параметров микро- и нано-объектов в диапазоне размеров от нескольких сантиметров до 10 нанометров. 5) Термический анализатор SDT Q 600 для одновременного ДСК/ТГА/ДТА анализа позволяет проводить исследования термохимических свойств индивидуальных веществ, соединений и материалов, в том числе в вакууме, инертной и реакционной атмосфере методами дифференциальной сканирующей калориметрии, термогравиметрического и дифференциального термического анализа. 6) Дифференциальный сканирующий калориметр DSC Q20P с ячейкой высокого давления позволяет проводить исследования химических процессов, изучать кинетику реакций и изменение активности катализаторов, в условиях от глубокого вакуума до при давлении до 7 атм и температуре от -196 оС до 540 оС с использованием инертных и реакционных газов в том числе и водорода. 7) Вискозиметр Брукфильда CAP 2000 серия L с системой «конус-плита» предназначен для исследования вязкости и реологических свойств ньютоновских и неньютоновских жидкостей в широком диапазоне температур и скоростей сдвига (от 10 с-1 до 13300 с-1). |
Неорганические вещества. Вода
Вы помните, что все вещества клетки делятся на неорганические и органические. Сегодня рассмотрим более подробно неорганические вещества. А конкретно – воду. Вдумайтесь в это древнегреческое изречение: «Самое лучшее – это вода: лучше, чем Олимпийские игры, лучше, чем золото».
Человек
может продержаться без воды несколько дней. Космические аппараты, которые всё
чаще направляют к другим планетам, преследуют главную цель – поиск воды. Потому
что наличие оксида водорода на планете – непременное условие существования
жизни. По крайней мере, той формы жизни, к которой принадлежим мы и все
окружающие нас живые организмы.
По крайней мере, той формы жизни, к которой принадлежим мы и все
окружающие нас живые организмы.
Именно
вода стала колыбелью зарождения первых живых организмов на Земле. И вот уже 4
миллиарда лет вода – основное вещество, из которого состоит живая природа. Так
почему именно вода? Ведь на Земле миллионы других химических соединений!
Вначале более подробно поговорим о содержании воды в живых организмах. В
среднем оно составляет 60–75 % их массы, но может значительно
колебаться. Рекордсмены здесь – медузы, которые ну просто одна
вода – 98 %. Не отстаёт и растительный мир – в листьях и сочных
плодах наших зелёных собратьев содержание воды также может достигать
фантастических 98 %.
У человека количество воды неодинаково в разных тканях и органах. В сером
веществе головного мозга её содержание составляет 85 %, в костях
– 22, а в эмали зуба всего 2–3 %. При
этом наибольшее содержание воды в организме наблюдается в эмбриональный
период, когда мы по водоносности практически не уступаем медузам – 95
%. Но с возрастом содержание воды в теле человека неуклонно уменьшается.
Задумайтесь, кстати, почему.
При
этом наибольшее содержание воды в организме наблюдается в эмбриональный
период, когда мы по водоносности практически не уступаем медузам – 95
%. Но с возрастом содержание воды в теле человека неуклонно уменьшается.
Задумайтесь, кстати, почему.
Вы помните из химии, что вода в природе находится в двух формах: свободной и связанной. В живых организмах свободная вода находится в межклеточных пространствах, сосудах, полостях органов, вакуолях. В основном она служит для переноса веществ из окружающей среды в клетку и наоборот. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Мы
уже сказали в начале, что вода выполняет уникальные функции в живой природе.
Это значит, что она обладает и уникальными свойствами. А функции и свойства
всегда зависят от строения. Вспомним строение молекулы воды.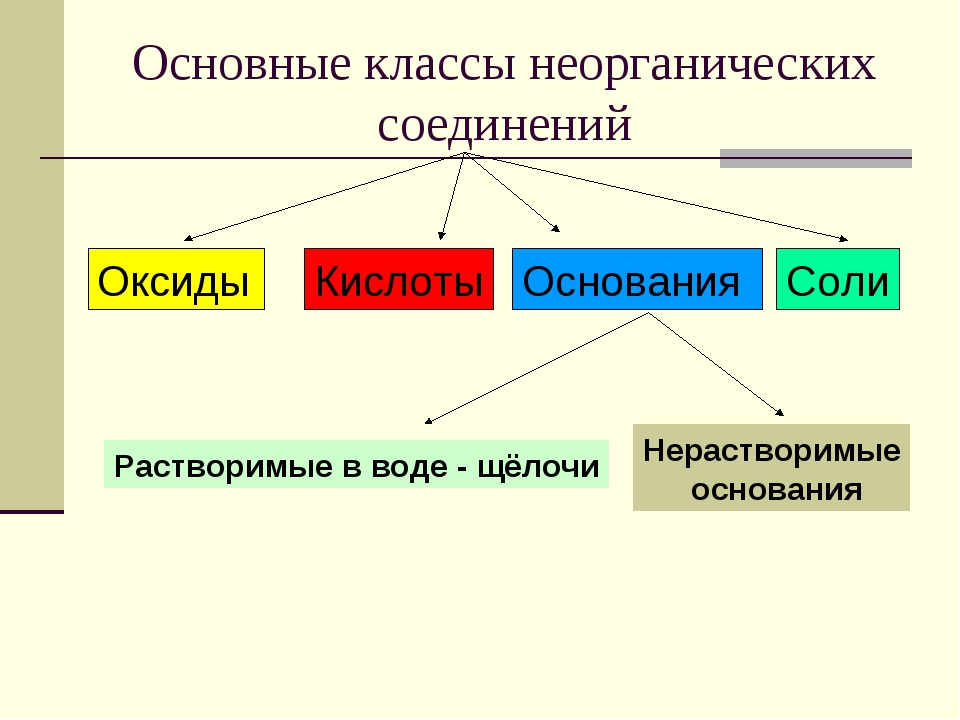
H2O. Эта формула известна любому
ребёнку. А вот как соединяются атомы водорода и кислорода между собой, вы могли
подзабыть. Связи Н-О-Н ковалентные полярные и располагаются под углом
104,5°. Как известно, кислород обладает более
высокой электроотрицательностью, чем водород, поэтому атом кислорода
притягивает к себе общие электронные пары и приобретает частично отрицательный
заряд. Ну а атомы водорода, от которых отодвинули их электроны, становятся
частично положительными.
Таким образом, молекула воды поляризована и является диполем. Этот факт – первая ступенька к раскрытию тайны воды.
Далее
обратим внимание на размеры молекулы воды. Приблизительно это 3·10-10 м.
То есть молекула оксида водорода очень мала. Она самая маленькая из всех
известных оксидов, что логично – в её состав входит два самых маленьких по
диаметру атома.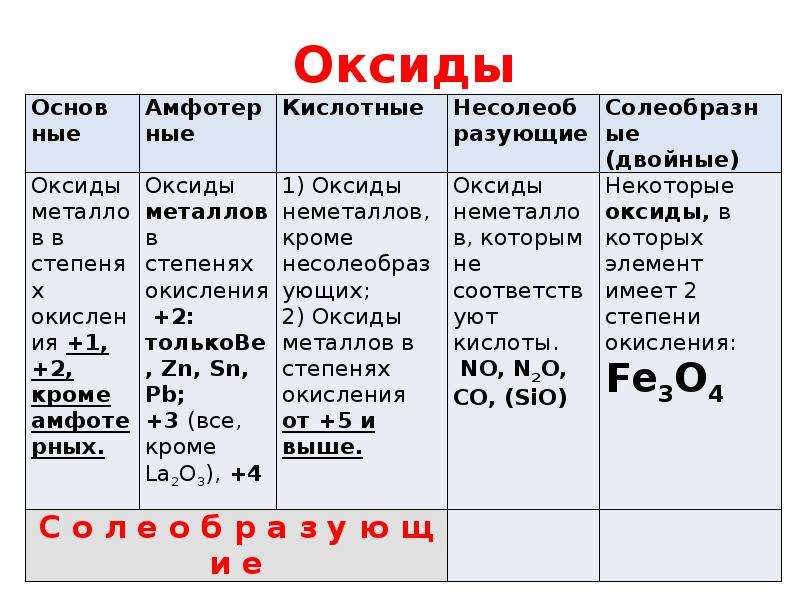 Например, другой ключевой оксид живых организмов – оксид
углерода четыре – образован молекулами диаметром уже 3,3·10 -10 м.
Например, другой ключевой оксид живых организмов – оксид
углерода четыре – образован молекулами диаметром уже 3,3·10 -10 м.
Итак, маленькие размеры молекулы – вторая составляющая уникальных
свойств воды. К ним и перейдём.
1. Вода – универсальный растворитель.
В
ней прекрасно растворяются ионные соединения (кислоты, основания, соли) и некоторые
неионные, но полярные соединения. То есть те, в молекуле которых присутствуют
заряженные (полярные) группы, например, сахара (вы сталкиваетесь с этим каждый
день, правда?), а также простые спирты, аминокислоты.
Почему же вода так хороша в этом отношении? А потому что её молекулы, как мы
говорили, тоже полярны. Между молекулами воды и растворяемого вещества
тут же возникает электростатическое притяжение, которое приводит к образованию
так называемых водородных связей. И вода просто разрывает растворяемое
вещество.
Вы
же помните, что молекулы находятся в постоянном движении. И чем больше
температура, тем выше скорость их движения, поэтому справиться с сахаром в
утренней чашке чая нам легче кипятком.
И чем больше
температура, тем выше скорость их движения, поэтому справиться с сахаром в
утренней чашке чая нам легче кипятком.
Вещества, хорошо растворимые в воде, называются гидрофильными (от
греческого hygros – «влажный» и philia –
«дружба», «склонность»).
Зачем же вещества вообще растворять и почему это так важно? Когда вещество
переходит в раствор, значительно увеличивается его площадь соприкосновения,
молекулы или ионы могут двигаться более свободно и, следовательно, реакционная
способность вещества резко возрастает. Вот почему вода является основной
средой, в которой протекает большинство химических реакций. А все реакции
гидролиза и многочисленные окислительно-восстановительные реакции идут при
непосредственном участии воды.
Но способности воды к растворению не безграничны. Нам не удаётся отмыть жирные
руки без мыла. Потому что жиры, а также нуклеиновые кислоты и некоторые белки,
а это неполярные вещества, в воде не растворяются и называются гидрофобными
(от греческого phobos – «страх»). Но наличие таких веществ
– это не недостаток и не минус воде. Гидрофобные вещества могут образовывать с
водой поверхности раздела, на которых протекают многие химические реакции.
Поэтому тот факт, что вода не растворяет неполярные вещества, для живых
организмов также очень важен.
Но наличие таких веществ
– это не недостаток и не минус воде. Гидрофобные вещества могут образовывать с
водой поверхности раздела, на которых протекают многие химические реакции.
Поэтому тот факт, что вода не растворяет неполярные вещества, для живых
организмов также очень важен.
Ещё физиологически важным свойством воды является её способность растворять
газы. Например, растворённым в воде кислородом дышит большинство водных
обитателей. Ну вы знаете.
Как растворитель, вода принимает участие в явлениях осмоса, играющих важнейшую
роль в жизнедеятельности клеток организма. Запомните, осмос – это
направленное движение молекул
воды через полупроницаемую мембрану из области с меньшей концентрацией
растворённых веществ в область с более высокой концентрацией этих веществ. То есть вода движется туда, где её меньше. Вот как это
происходит.
Полупроницаемая мембрана, например плазмалемма, способна пропускать маленькие
молекулы воды, а крупные молекулы, например сахаров, – задерживать. Если
разделить два раствора с разной концентрацией растворённых веществ, то через
некоторое время их концентрация выравняется. Но не за счёт перемещения молекул
растворённых веществ – они останутся на своих местах, а за счёт перемещения
молекул воды. Движение воды в сторону более высокой концентрации растворённых
веществ создаёт давление. Такое давление называется осмотическим. Чем
выше разность концентраций растворов, тем выше осмотическое давление.
Если
разделить два раствора с разной концентрацией растворённых веществ, то через
некоторое время их концентрация выравняется. Но не за счёт перемещения молекул
растворённых веществ – они останутся на своих местах, а за счёт перемещения
молекул воды. Движение воды в сторону более высокой концентрации растворённых
веществ создаёт давление. Такое давление называется осмотическим. Чем
выше разность концентраций растворов, тем выше осмотическое давление.
Растворы, осмотическое давление которых такое же, как в
клетках, называются изотоническими. Такие растворы, не вызывающие
изменение осмотического давления, относят к физиологическим. Вы, наверное,
встречались с водным раствором поваренной соли, в котором массовая доля NaCl составляет 0,9 %. Это и есть физиологический раствор,
который применяют в медицине.
Если концентрация раствора больше, чем у изотонического (то есть больше, чем
0,9 % NaCl), то такой раствор будет являться гипертоническим
(от греческого hyper – «сверх», «чрезмерно»).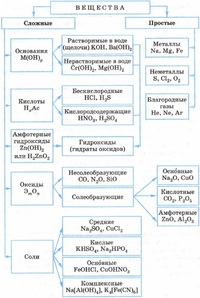 Соответственно, растворы с
более низкой концентрацией будут называться гипотоническими (от
греческого hypo – «под», что означает «ослабление»).
Соответственно, растворы с
более низкой концентрацией будут называться гипотоническими (от
греческого hypo – «под», что означает «ослабление»).
Почему в медицине применяют изотонические растворы? Как мы сказали, они не
изменяют осмотическое давление. Но что же произойдёт, если вместо
физиологического раствора применить раствор с другой концентрацией соли?
Давайте представим. Мы сделали инъекцию какого-либо препарата в кровь. Если мы
использовали при этом физиологический раствор, то концентрация соли в плазме не
изменится, и останется такой же, как в эритроцитах. Если же мы применим
гипертонический раствор, то повысим концентрацию соли в плазме, и вода начнёт выходить
из эритроцита, чтобы уравнять осмотическое давление.
Ну а введённый гипотонический раствор, наоборот, приведёт к поступлению воды в
эритроцит, что может привести к его разрыву. Эритроцит не выдержит давления
воды изнутри, так как этого не выдержит его клеточная мембрана.
А вот растительные клетки, покрытые толстой клеточной оболочкой, при увеличении
содержания воды остаются невредимыми, но становятся более упругими за счёт
осмотического давления воды на них изнутри. Если же воды перестаёт хватать –
растения увядают.
Давление цитоплазмы на клеточную стенку называется тургорным.
Второе
важнейшее свойство воды – высокая теплоёмкость.
Теплоёмкость – это отношение количества теплоты, полученного телом, к соответствующему
приращению его температуры. Количество тепла, необходимого для нагревания 1
г воды на 1°, достаточно, чтобы нагреть на 1° 9,25 г железа, 10,3
г меди. То есть вода обладает аномально высокой теплоёмкостью. В
чём секрет? В её строении. Мы с вами уже сказали, как происходит растворение в
воде полярных веществ: с образованием водородных связей между частично
положительными и частично отрицательными зарядами. Точно такие связи возникают
и между молекулами самой воды. Каждая из них стремится соединиться с четырьмя
соседними молекулами. Образуется сложная и прочная структура. Можно сказать –
монолитная, так как молекулы маленькие, связей очень много и держится всё это
очень прочно. Вот почему вода до последнего противится любому воздействию. В том
числе нагреванию. Ведь повышение температуры – это повышение скорости движения
молекул. А как её увеличишь, если все молекулы связаны по рукам и ногам
водородными связями.
Точно такие связи возникают
и между молекулами самой воды. Каждая из них стремится соединиться с четырьмя
соседними молекулами. Образуется сложная и прочная структура. Можно сказать –
монолитная, так как молекулы маленькие, связей очень много и держится всё это
очень прочно. Вот почему вода до последнего противится любому воздействию. В том
числе нагреванию. Ведь повышение температуры – это повышение скорости движения
молекул. А как её увеличишь, если все молекулы связаны по рукам и ногам
водородными связями.
Таким
образом вода, в большом количестве содержащаяся в живых организмах, помогает им
избегать резких перепадов температур в клетках и организме в целом, даже когда
колебания в окружающей среде достаточно велики. А как вы понимаете, это очень
важно для поддержания гомеостаза.
При испарении воды, когда между её молекулами также разрушаются водородные
связи, тратится много
теплоты – это позволяет регулировать температуру тела растениям при
транспирации, а животным при потоотделении.
3.
Высокая теплопроводность воды.
Благодаря этому свойству обеспечивается
равномерное распределение тепла по всему организму. Если бы в нашем организме
не было воды, то зимой нам нужно было бы надевать на руки не одни варежки, а
несколько.
4.
Высокое поверхностное натяжение воды.
Наверное, вы пробовали класть монетку на воду и добиваться того, чтобы она не
тонула. Это происходит из-за крепкого сцепления молекул воды водородными
связями с молекулами других веществ. В живых организмах благодаря высокому
поверхностному натяжению воды обеспечивается капиллярный кровоток, восходящий и
нисходящий токи в растениях.
На
этом всё. Секрет того, почему именно вода из миллионов других химических
соединений играет ключевую роль в живых организмах, раскрыт.
У оксида водорода маленькие и полярные молекулы, соединённые водородными
связями, – таково строение. Оксид водорода – универсальный растворитель,
у него высокая теплоёмкость, теплопроводность, теплота парообразования и
поверхностное натяжение – таковы свойства, основанные на его строении.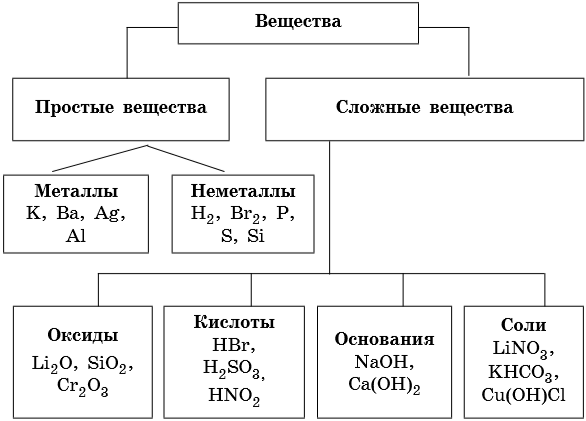 И благодаря этим свойствам
вода выполняет уникальные функции в живых организмах. А её процентное
содержание зависит от интенсивности обмена веществ. У человека с возрастом
обмен веществ замедляется, соответственно клеткам не нужно прежнее количество
воды.
И благодаря этим свойствам
вода выполняет уникальные функции в живых организмах. А её процентное
содержание зависит от интенсивности обмена веществ. У человека с возрастом
обмен веществ замедляется, соответственно клеткам не нужно прежнее количество
воды.
И закончим цитатой древнекитайского философа Лао Цзы: «Чтобы быть сильным, надо быть как вода. Нет препятствий – она течёт; плотина – она остановится; прорвётся плотина – она снова потечёт; в четырёхугольном сосуде она четырёхугольна; в круглом – кругла. Оттого, что она так уступчива, она нужнее всего и сильнее всего».
Амфотерные органические и неорганические соединения
К амфотерным неорганическим соединениям относят оксиды и гидроксиды следующих металлов – Al, Zn, Be, Cr (в
степени окисления +3) и Ti (в степени окисления +4). Амфотерными органическими соединениями являются аминокислоты – NH2–CH(R)-COOH.
Получение амфотерных соединений
Амфотерные оксиды получают путем реакции горения соответствующего металла в кислороде, например:
2Al + 3/2O2 = Al2O3
Амфотерные гидроксиды получают по реакции обмена между щелочью и солью, содержащий «амфотерный» металл:
ZnSO4 + NaOH = Zn(OH)2 + Na2SO4
Если щелочь присутствует в избытке, то есть вероятность получения комплексного соединения:
ZnSO4 + 4NaOHизб = Na2[Zn(OH)4] + Na2SO4
Органические амфотерные соединения – аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах. В общем виде уравнение реакции будет выглядеть так:
R-CH(Cl)-COOH + NH3 = R-CH(NH3+Cl—) = NH2–CH(R)-COOH
Химические амфотерных соединений
Главным химическим свойством амфотерных соединений является их способность реагировать с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + NaOH+ 3H2O= 2Na[Al(OH)4]
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + NaOH= Na2[Zn(OH)4]
NH2–CH2-COOH + HCl = Cl[NH3–CH2-COOH]
NH2–CH2-COOH + NaOH= NH2–CH2-COONa + H2O
Специфические свойства амфотерных органических соединений
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями:
NH2–CH2-COOH ↔ +H3N–CH2-COO—
Молекулу внутренней соли называют биполярным ионом.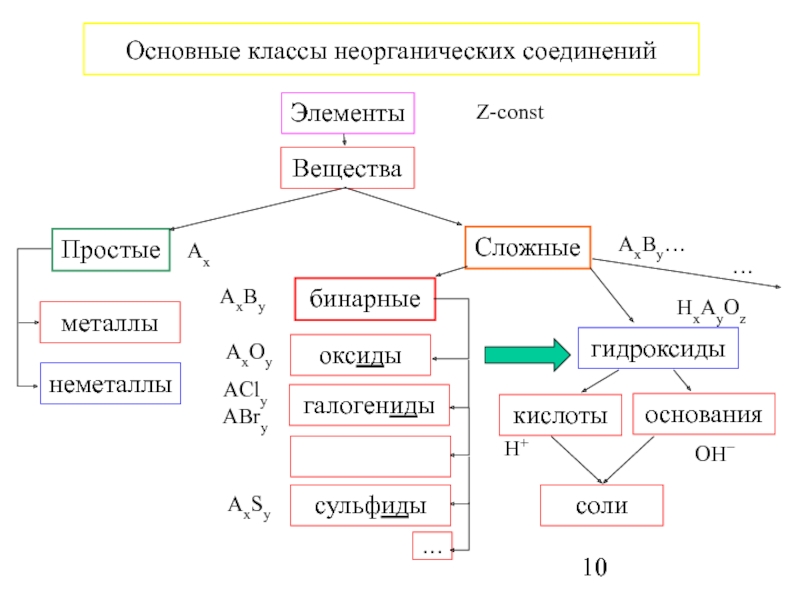
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:
Также для аминокислот характерны все химические свойства карбоновых кислот (по карбоксильной группе) и аминов (по аминогруппе).
Примеры решения задач
Что такое неорганические соединения? — Определение, характеристики и примеры — Видео и стенограмма урока
Характеристики
Поскольку многие неорганические соединения содержат металл определенного типа (щелочной, щелочной, переходный и т. д.), они обладают способностью проводить электричество. Например, в твердом состоянии неорганические соединения являются плохими проводниками электричества. Однако в жидкой фазе неорганические соединения обладают высокой проводимостью. В этой фазе электроны неорганических соединений могут двигаться очень свободно, и это движение электронов отмечается как электричество.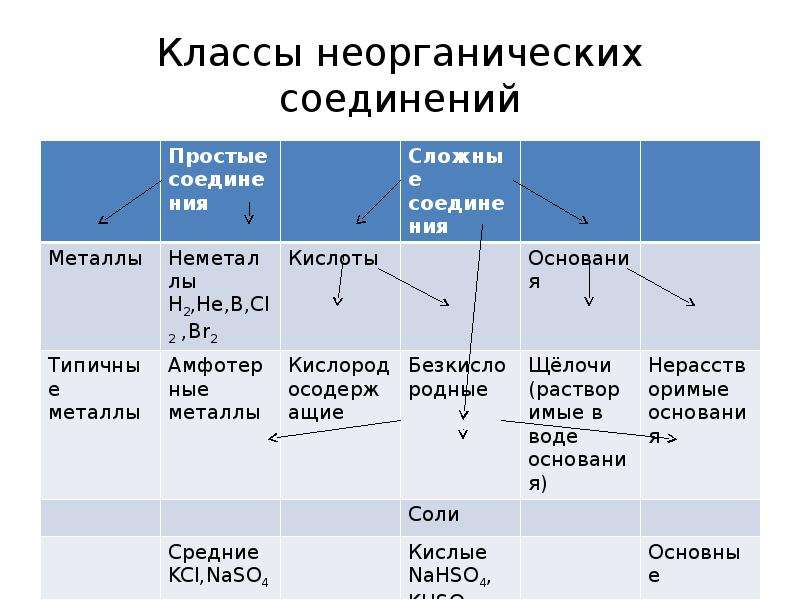
Благодаря ионной связи, обычно встречающейся в неорганических соединениях, они очень прочно удерживаются вместе и обладают чрезвычайно высокими температурами плавления и кипения. Еще одной характерной чертой неорганических соединений является их цвет. Неорганические соединения переходных металлов, даже находящиеся на рабочем столе, обычно сильно окрашены, и это, опять же, из-за конфигурации электронов «d-блока». Яркие и красивые цвета, которые можно увидеть, когда взрывается фейерверк, обусловлены неорганическим металлом (обычно щелочным или щелочным), присутствующим в соединении.Поскольку неорганические соединения проявляют уникальный цвет при сжигании, его можно использовать в качестве «маркера» для идентификации вовлеченного металла. Кроме того, неорганические соединения обычно хорошо растворимы в воде. То есть они могут «исчезнуть» при попадании в воду, так как просто растворятся. Еще одной показательной характеристикой неорганических соединений является их способность образовывать кристаллы. Природа связи, обнаруженная в неорганических соединениях, позволяет им выращивать кристаллы в насыщенных растворах.
Природа связи, обнаруженная в неорганических соединениях, позволяет им выращивать кристаллы в насыщенных растворах.
Применение и примеры
Подумайте теперь об одной из самых распространенных молекул во всем мире.Эта конкретная молекула занимает две трети планеты и составляет 70% человеческого тела. Угадайте, что это за молекула? Если вы угадали воду, то вы правы! Эта молекула является неорганическим соединением! Благодаря уникальности неорганических соединений они имеют множество применений и приложений в реальном мире. Большинство продуктов, которые мы потребляем ежедневно, были обработаны каким-либо пестицидом в процессе выращивания, и этот пестицид является еще одним примером неорганического соединения.
Возьмем, к примеру, все химические вещества, с которыми мы сталкиваемся в повседневной жизни, чтобы понять важность и изобилие неорганических соединений, которыми мы окружены.Например, соль и многие другие приправы, которые используются для придания вкуса нашим продуктам, являются неорганическими соединениями. Автомобили, на которых мы ездим, питаются от аккумуляторов, содержащих неорганические соединения, такие как серная кислота. Многие поверхности нашей одежды, обуви и автомобилей покрыты неорганическими соединениями, которые служат для защиты поверхности. С каждым вдохом в смеси появляются неорганические соединения. Каждый раз, когда мы выдыхаем, выбрасывается углекислый газ, и это тоже неорганическое соединение.Почему же углекислый газ (углеродсодержащее соединение) не считается органическим? Проще говоря, углекислый газ считается неорганическим, а не органическим, потому что он не содержит углерод-водородных связей. Как упоминалось ранее, для того, чтобы соединение считалось органическим, должна присутствовать связь C-H.
Автомобили, на которых мы ездим, питаются от аккумуляторов, содержащих неорганические соединения, такие как серная кислота. Многие поверхности нашей одежды, обуви и автомобилей покрыты неорганическими соединениями, которые служат для защиты поверхности. С каждым вдохом в смеси появляются неорганические соединения. Каждый раз, когда мы выдыхаем, выбрасывается углекислый газ, и это тоже неорганическое соединение.Почему же углекислый газ (углеродсодержащее соединение) не считается органическим? Проще говоря, углекислый газ считается неорганическим, а не органическим, потому что он не содержит углерод-водородных связей. Как упоминалось ранее, для того, чтобы соединение считалось органическим, должна присутствовать связь C-H.
Краткий обзор урока
Неорганические соединения замечательны сами по себе. Большую часть того, к чему мы прикасаемся или чем пользуемся ежедневно, так или иначе можно считать неорганическими соединениями.Эти соединения имеют множество цветов и ведут себя по-разному в зависимости от того, в какой фазе они находятся. Фундаментальное различие между органическими и неорганическими соединениями заключается в наличии связей углерод-водород или связей С-Н. Неорганические соединения, как правило, представляют собой соединения минерального или геологического происхождения, не содержащие углерод-водородных связей. Все вокруг нас и часть каждой вещи, которую мы используем ежедневно, представляют собой неорганические соединения. В воде, которую мы пьем, в воздухе, которым мы дышим, в продуктах, которые мы едим, и в одежде, которую мы носим, неорганические соединения повсюду!
Фундаментальное различие между органическими и неорганическими соединениями заключается в наличии связей углерод-водород или связей С-Н. Неорганические соединения, как правило, представляют собой соединения минерального или геологического происхождения, не содержащие углерод-водородных связей. Все вокруг нас и часть каждой вещи, которую мы используем ежедневно, представляют собой неорганические соединения. В воде, которую мы пьем, в воздухе, которым мы дышим, в продуктах, которые мы едим, и в одежде, которую мы носим, неорганические соединения повсюду!
Неорганические соединения – определение и примеры
- Неорганические соединения — соединения, которые используют минералы и/или металлы для создания продуктов
| Примеры природного и искусственного происхождения |
|---|
| Водопроводная вода |
| Воздух |
| Продукты питания |
| Одежда |
| Автомобильные аккумуляторы |
| Краска |
Результаты обучения
Изучая неорганические соединения с помощью этого урока, вы разовьете способность:
- Давать определения и характеризовать неорганические соединения
- Распознать их применение и привести примеры неорганических соединений вокруг нас
Примеры неорганических соединений
Неорганические соединения Неорганическое соединение — это любое соединение, в котором отсутствует атом углерода из-за отсутствия более глубокого определения.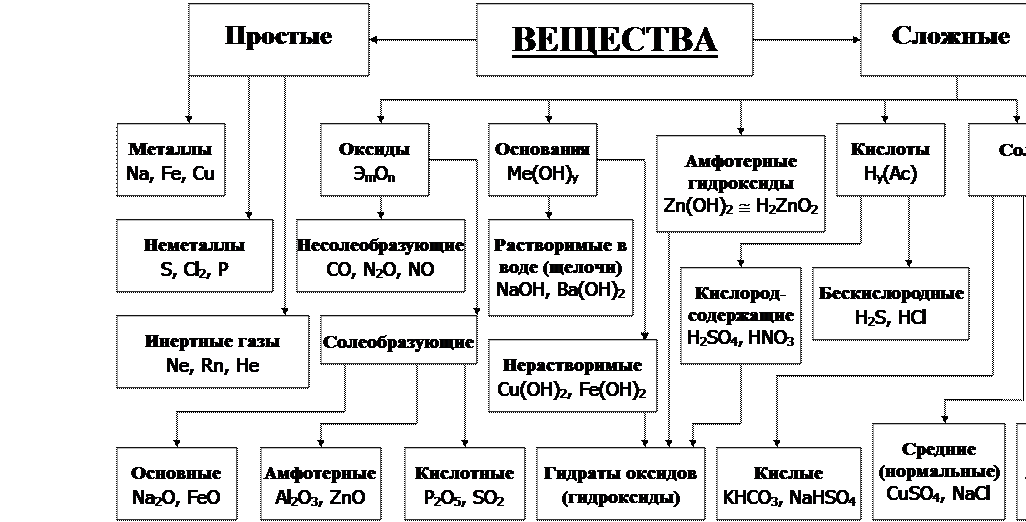 Те соединения с атомом углерода называются органическими соединениями из-за их корневой основы в атоме, который жизненно важен для жизни. Есть небольшое количество неорганических соединений, которые действительно содержат углерод, учитывая его склонность к образованию молекулярных связей; к ним относятся окись углерода и двуокись углерода, и это лишь некоторые из них.
Те соединения с атомом углерода называются органическими соединениями из-за их корневой основы в атоме, который жизненно важен для жизни. Есть небольшое количество неорганических соединений, которые действительно содержат углерод, учитывая его склонность к образованию молекулярных связей; к ним относятся окись углерода и двуокись углерода, и это лишь некоторые из них.
Неорганические соединения часто довольно просты, поскольку они не образуют сложных молекулярных связей, которые делает возможным углерод. Типичным примером простого неорганического соединения может быть хлорид натрия, более известный как бытовая соль.Это соединение содержит только два атома натрия (Na) и хлора (Cl).
Примеры неорганических соединений:
1. H 2 O — Вода представляет собой простое неорганическое соединение, несмотря на то, что она содержит водород, ключевой атом (наряду с углеродом) во многих органических соединениях. Атомы в молекуле воды образовали очень простые связи из-за отсутствия углерода.
2. HCl — Гидрохлорид, также известный как соляная кислота, когда он растворяется в воде, представляет собой бесцветную коррозионную кислоту с довольно сильным pH.Он содержится в желудочном соке многих животных, помогая пищеварению путем расщепления пищи.
3. CO 2 — Углекислый газ, несмотря на присутствие в формуле атома углерода, классифицируется как неорганическое соединение. Это вызвало споры в научном сообществе, и были подняты вопросы относительно достоверности наших нынешних методов классификации соединений. В настоящее время органические соединения содержат углерод или углеводород, который образует более прочную связь. Связь, образованная углеродом в CO 2 , не является прочной связью.
4. NO 2 — Газообразный диоксид азота имеет различные цвета при различных температурах. Он часто образуется при ядерных испытаниях в атмосфере и отвечает за характерный красноватый цвет грибовидных облаков. Он очень токсичен и образует довольно слабые связи между атомами азота и кислорода.
5. Fe 2 O 3 — Оксид железа (III) является одним из трех основных оксидов железа и представляет собой неорганическое соединение из-за отсутствия атома углерода или углеводорода.Оксид железа (III) встречается в природе в виде гематита и является источником большей части железа для сталелитейной промышленности. Он широко известен как ржавчина и имеет ряд общих характеристик со своим естественным аналогом.
Примеры неорганических соединений
Неорганические соединения – определение, химические вещества, соли и часто задаваемые вопросы
Знаете ли вы определение неорганических соединений?
Неорганическое соединение – это любое вещество, в котором два или более химических элемента (обычно кроме углерода) объединены в определенных пропорциях.Если углерод связан с бесцветным водородом, соединение называется органическим. Неорганические соединения углерода включают карбиды (такие как карбид кремния [SiC2]), карбонаты (такие как карбонат кальция [CaCO<3]), цианиды (такие как цианид натрия [NaCN]), графит, двуокись углерода и окись углерода.
В этой статье мы подробно изучим неорганические соединения, неорганические химические вещества и неорганический бензол (боразин).
Неорганические химические вещества
Ионные соединения состоят из катионов и анионов, связанных вместе ионными связями.Примерами солей (ионных соединений) являются хлорид магния MgCl2, содержащий катионы магния Mg2+ и хлорид-анионы Cl, и оксид натрия Na2O, содержащий катионы натрия Na+ и оксидные анионы O2. Пропорции ионов в любой соли таковы, что электрические заряды компенсируются, что приводит к электрически нейтральному объемному соединению. Потенциал ионизации исходных элементов (для катионов) или сродство к электрону (для анионов) можно использовать для определения степени окисления ионов, а также легкости их образования.
Простейшей неорганической реакцией является двойное замещение, которое происходит при смешивании двух солей и обмене ионами без изменения степени окисления. В окислительно-восстановительных реакциях один реагент, окислитель, снижает свою степень окисления, в то время как степень окисления другого реагента, восстановителя, увеличивается. Конечным продуктом является электронный обмен. Электронный обмен также может происходить косвенным образом, например, в батареях, и является центральным принципом электрохимии.
Конечным продуктом является электронный обмен. Электронный обмен также может происходить косвенным образом, например, в батареях, и является центральным принципом электрохимии.
Боразин
Боразин представляет собой полярное неорганическое соединение с формулой B 3 H 6 N 3 .В этом циклическом соединении чередуются три звена BH и три звена NH. Для бензола соединение изоэлектронно и структурно идентично. Из-за этого боразин часто называют «неорганическим бензолом». Боразин, как и бензол, представляет собой бесцветную жидкость. Боразин представляет собой прозрачную жидкость с хорошим запахом.
Неорганическая кислота
Неорганические кислоты, также известные как минеральные кислоты, представляют собой кислоты, полученные из одного или нескольких неорганических соединений и не содержащие углерода. Эти неорганические кислоты либо являются оксокислотами, либо не содержат кислорода.Они бывают одно-, двух- или трехосновными в зависимости от количества атомов водорода в них. Одноосновные кислоты, такие как соляная кислота и плавиковая кислота, а также двухосновные кислоты, такие как сероводород, являются примерами кислот без кислорода. Азотная кислота (одноосновная), серная кислота (двухосновная) и ортофосфорная кислота являются кислородсодержащими кислотами (трехосновная). При растворении неорганических кислот в воде образуются ионы водорода и ионы сопряженных оснований.
Одноосновные кислоты, такие как соляная кислота и плавиковая кислота, а также двухосновные кислоты, такие как сероводород, являются примерами кислот без кислорода. Азотная кислота (одноосновная), серная кислота (двухосновная) и ортофосфорная кислота являются кислородсодержащими кислотами (трехосновная). При растворении неорганических кислот в воде образуются ионы водорода и ионы сопряженных оснований.
Неорганический фосфат
Неорганический фосфат (PO43-) представляет собой металл-ионную соль фосфорной кислоты.В тетраэдрической структуре один центральный атом фосфора окружен четырьмя атомами кислорода. Неорганические фосфаты могут присутствовать в природе различными способами, и они часто смешиваются с другими элементами (например, такими металлами, как натрий, калий, кальций и алюминий). Неорганические фосфаты присутствуют во всех живых организмах и необходимы для их выживания. В водном растворе неорганический фосфат встречается в основном в виде h3PO4- или HPO42- и действует как буфер.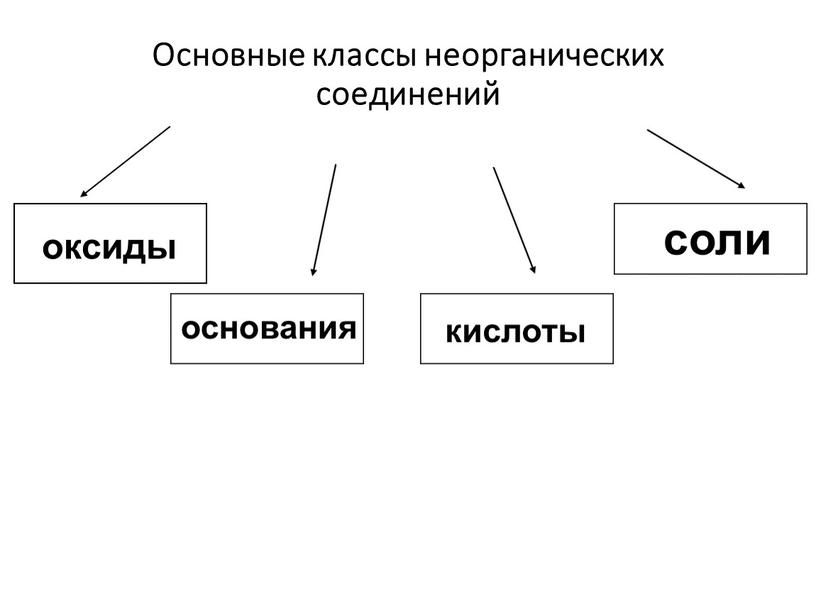
Гидрофосфат калия
Неорганическое соединение K2HPO4.(H 2 O) x (x = 0,3,6) представляет собой дикалийфосфат (K 2 HPO 4 ) (также дикалий гидроортофосфат; калия фосфат двухосновный). Он широко используется в качестве удобрения, пищевой добавки и буферного агента в сочетании с монокалийфосфатом (KH3PO4.(h3O)x. Растворяется в воде в виде белого или бесцветного твердого вещества.
Производится путем частичной нейтрализации фосфорной кислоты двумя эквивалентами калия. хлорида в коммерческой среде
Дикалийфосфат используется в имитациях молочных сливок, сухих порошковых напитков, минеральных добавок и заквасок в качестве пищевой добавки.Он действует как эмульгатор, стабилизатор и текстуризатор, а также как буферный и хелатирующий агент, особенно для кальция в молочных продуктах.
Неорганические соли
Соль представляет собой нейтральное ионное соединение, образованное химической реакцией кислоты и основания или нейтрализацией.
 Соли образуются, когда ионы связаны вместе ионной связью и диссоциируют на ионы (кроме H + или OH – ) при растворении в растворителе, таком как вода.
Соли образуются, когда ионы связаны вместе ионной связью и диссоциируют на ионы (кроме H + или OH – ) при растворении в растворителе, таком как вода.В отличие от органической соли, которая содержит связи C-H, неорганическая соль не содержит связей C-H.Хлорид натрия, химическое соединение, состоящее из ионов натрия и хлорида, является одной из самых известных солей.
Неорганические соли необходимы живым существам для выживания и роста. Хлорид натрия (NaCl), хлорид кальция (CaCl2), хлорид магния (MgCl2), бикарбонат натрия (NaHCO3), хлорид калия (KCl), сульфат натрия (Na2SO4), карбонат кальция (CaCO3) и фосфат кальция (Ca3P) являются некоторыми из наиболее распространенных неорганических солей у людей для различных функций организма (PO4)2.В жидкостях неорганические соли диссоциируют на ионы (или электролиты). Эти ионы необходимы для различных клеточных метаболических процессов.
 Например, хлорид натрия (NaCl) расщепляется на ионы натрия и хлорида.
Например, хлорид натрия (NaCl) расщепляется на ионы натрия и хлорида.Ионы натрия, в частности, необходимы для деполяризации нейронов и мышечных клеток и, таким образом, для передачи импульсов и сокращения мышц.
Знаете ли вы?
Боразин часто называют «неорганическим бензолом», потому что он изоэлектронен бензолу и имеет аналогичные связи.Из-за разницы в электроотрицательности бора и азота эта аналогия не совсем верна. Длины связей в боразиновом кольце равны 1,429, это свойство характерно для бензола, согласно данным рентгеноструктурного анализа. С другой стороны, боразиновое кольцо не образует идеального шестиугольника. Атомы бора имеют валентный угол 117,1°, а атомы азота имеют валентный угол 122,9°, что придает молекуле особую симметрию.
Разница между органическими и неорганическими соединениями
Основное отличие — органические и неорганические соединения
Органические и неорганические соединения — это две широкие категории соединений в химии. Почти все теории, законы и гипотезы в химии строятся на основе органических и неорганических соединений. Оба типа состоят из материи в любом физическом состоянии: твердом, жидком или газообразном. Основное различие между органическими и неорганическими соединениями заключается в том, что органических соединений по существу имеют один или несколько атомов углерода в своей структуре , тогда как неорганических соединений могут иметь или не иметь атомы углерода.
Почти все теории, законы и гипотезы в химии строятся на основе органических и неорганических соединений. Оба типа состоят из материи в любом физическом состоянии: твердом, жидком или газообразном. Основное различие между органическими и неорганическими соединениями заключается в том, что органических соединений по существу имеют один или несколько атомов углерода в своей структуре , тогда как неорганических соединений могут иметь или не иметь атомы углерода.
Ключевые сферы деятельности
1. Что такое органические соединения Ключевые слова: органические, неорганические, химические, твердые, жидкие, газообразные, ковалентные связи, ионные связи, гидрофобность Органическое соединение – это любое соединение, в основном имеющее один или несколько атомов углерода, ковалентно связанных с другими элементами. Органическая химия — это раздел химии, который объясняет структуру, свойства, реакции и другие важные факты об органических соединениях. Органическая химия — сложный предмет, и ученые используют ее для создания ряда ценных продуктов. Поскольку почти все организмы состоят из органических молекул, органические соединения необходимы для жизни на Земле. Поскольку существует ряд различных соединений, включенных в категорию органических соединений, эти соединения можно дополнительно классифицировать различными способами. Полимеры представляют собой еще один тип важных органических соединений. Хотя некоторые полимеры состоят из неорганических остовов, они также содержат органические группы и называются гибридными полимерами. Полимеры используются в различных приложениях и процессах, которые важны в повседневной жизни. Органические соединения, такие как углеводороды, могут быть классифицированы как алифатические и ароматические в соответствии с наличием или отсутствием ароматических кольцевых структур.Органические соединения находятся во всех трех физических состояниях при комнатной температуре. Например, Твердая фаза – некоторые амиды Жидкая фаза – спирты, такие как этанол Газовая фаза – газы, подобные метану Рисунок 1: Алифатическое органическое соединение Рисунок 2: Ароматическое органическое соединение Неорганическое соединение – это любое соединение, которое не является органическим соединением. Неорганическая химия — это раздел химии, который объясняет структуру, поведение, свойства и характеристики неорганических соединений. Неорганические соединения в основном встречаются в виде минералов, соединений, связанных с металлами, или металлоорганических соединений. Поскольку многие неорганические соединения состоят из металлов или ионов металлов, они способны проводить электричество. Некоторые неорганические соединения могут проводить электричество даже без такого металла, как графит.Большинство неорганических соединений содержат ионные связи и ковалентные связи. Многие неорганические соединения также очень красочны из-за присутствия элементов d-блока. Большинство неорганических соединений растворимы в воде благодаря ионной связи. Они могут расщепляться на свои ионы при добавлении в воду. Еще одним важным свойством является их способность образовывать кристаллы. Рисунок 3: Структура силана (слева) аналогична структуре метана (справа).Но силан — неорганическое соединение, а метан — органическое соединение. Органические соединения: Органические соединения — это соединения, в основном содержащие атомы углерода в структуре наряду с такими атомами, как водород, азот и кислород. Неорганические соединения: Неорганические соединения — это соединения, которые практически не содержат атомов углерода в своей структуре. Органические соединения: Органические соединения в основном имеют ковалентную связь. Неорганические соединения: Неорганические соединения демонстрируют ионную связь наряду с ковалентной связью. Органические соединения: Органические соединения в основном содержат атомы водорода C и H. Неорганические соединения: Неорганические соединения могут иметь любой атом, кроме C и H, непосредственно связанных друг с другом. Органические соединения: Большинство органических соединений бесцветны. Неорганические соединения: Большинство неорганических соединений окрашены. Органические соединения: Большинство органических соединений не растворяются в воде из-за их гидрофобности. Неорганические соединения: Большинство неорганических соединений могут растворяться в воде благодаря наличию ионных связей. Основные области химии включают органическую химию, неорганическую химию, физическую химию и аналитическую химию. Среди них органическая химия объясняет структуру, свойства и реакции органических соединений.Неорганическая химия — это область, объясняющая структуру, свойства и реакции неорганических соединений. 1. Органические и неорганические соединения». SoftSchools.com. н.п., н.д. Веб. Доступно здесь. 12 июня 2017 г. 1. «Octane-in-full» Автор (общественное достояние) через Commons Wikimedia Куда бы мы ни посмотрели, можно увидеть как неорганические, так и органические соединения. Ну, химическая разница не та, которую вы слышите в новостях, которая отличает «органические» овощи от «неорганических». Угадайте, что оба состоят из органических и неорганических соединений. Предположим, что определение «сельское хозяйство» не совпадает с определением химии. В химии есть большая разница, которая хорошо определена. Умение различать органические и неорганические соединения — одна из основных вещей, которые вам необходимо усвоить при изучении химии. Если вам интересно, узнайте больше о термодинамике и кинетике, еще двух из трех самых важных понятий в химии. В этой статье мы объясним это подробно, так что в конце вы сможете без труда различать оба типа химикатов. Мы постараемся развеять все ваши сомнения по поводу этого вечного вопроса химии! Вначале ученые разделяли органические и неорганические соединения на том основании, что первая группа рассматривалась как результат деятельности живых существ, тогда как вторая группа относилась к процессам, не связанным с каким-либо образом жизни. Около 200 лет назад, на переходе от алхимии к химии, химики разделили химические соединения на две основные группы. Простое и понятное определение органических соединений состоит в том, что это те соединения, которые получены из живых существ, таких как растения и животные, известные как органические соединения, такие как сахара, липиды, белки, нуклеиновые кислоты, и т.д. Строго говоря, мы считаем соединение органическим, если оно состоит из атомов углерода, которые участвуют в ковалентных связях. Обычно (но не всегда) органические соединения также имеют ковалентные связи C–H. Простое определение для стороннего наблюдателя состоит в том, что те соединения, которые получены из неживых существ или минеральных источников, известны как неорганические соединения, такие как NaCl (поваренная соль) и NaHCO 3 (пищевая сода) и т. д. Определение неорганических соединений довольно просто после определения органических соединений. Как правило, каждое химическое вещество, не подпадающее под категорию «органическое», считается неорганическим соединением. Давайте еще раз вернемся в прошлое, к самым ранним дням химии.Теория, известная как «теория жизненной силы», может показаться вам знакомой, если вы знакомы с историей химии. Эта теория была предложена шведским химиком Берцелиусом в 1815 году. Эта теория утверждает, что органические соединения не могут быть синтезированы в лаборатории. Ранние химики считали, что органические соединения можно получить только из живых организмов за счет «жизненных сил». В 1828 году немецкий химик Фридрих Велер синтезировал мочевину в лаборатории.Это объясняет первый химический полный синтез природного органического соединения! Это достижение показало, что можно синтезировать органическое соединение (мочевину) из неорганического соединения (цианата аммония) в лаборатории: при обработке цианата серебра хлоридом аммония было получено кристаллическое соединение, идентичное мочевина, выделенная из мочи. Это химическое превращение опровергло теорию жизненной силы, и вскоре после этого химики начали получать органические соединения в лаборатории. Отсюда в научный мир было введено современное определение органических соединений. Это также знаменует собой начало органической химии как дисциплины . Соединения, которые содержат атомы углерода в качестве основного компонента, связанные друг с другом ковалентными связями, называются органическими соединениями. В большинстве случаев все атомы различных элементов удерживаются вместе ковалентными связями. Некоторыми исключениями могут быть, например, органические карбоксилаты или соли аммония. Но вы можете возразить, что это «неорганические соли органических соединений». Некоторые соединения, которые могут показаться «чертовски неорганическими», такие как полимеры (причудливое название пластмасс), на самом деле являются органическими соединениями с длинной цепью.Примером является полистирол. Его основа в основном состоит из ковалентных связей C-C и C-H. Имейте в виду, что «органическое соединение» не означает «биохимическое соединение». С другой стороны, основу биохимии составляют в основном органические соединения (хотя металлы чрезвычайно важны в биологических системах, например, железо в гемоглобине). Удалить все органические соединения. У вас остаются неорганические соединения. Если он не подпадает под определение органического, он неорганический. В общем, соединения, которые не имеют ковалентных связей C–C или C–H, называются неорганическими соединениями. Есть много соединений, которые имеют только ковалентные связи, они имеют атомы углерода, , но не являются органическими соединениями. Примеры неорганических соединений этого типа включают монооксид углерода, диоксид углерода, неорганические карбонаты, карбиды и т. д. Примечательно, что аллотропы углерода, такие как графит, графен или алмаз, содержат только атомы углерода, но считаются неорганическими соединениями. Как видите, иногда определение не так хорошо установлено. На самом деле, я не мог найти четкого определения для обоих, предоставленного IUPAC. Это иллюстрирует тот факт, что определение границы между неорганическими и органическими химическими веществами. Некоторыми интересными примерами этой золотой середины являются металлоорганические соединения . Они состоят из органического компонента, обычно связанного с неорганическим компонентом через связь углерод-металл. Это действительно весело и является одной из наиболее широко изучаемых тем исследований в современной химии! Мы попытаемся обобщить в краткой сравнительной таблице основные различия между органическими и неорганическими соединениями. Однако имейте в виду, что в большинстве случаев это просто обобщения, которые не будут верны ни для одного сценария, и обязательно будут исключения. Время погрузиться в изучение органической химии! Это лишь некоторые природные и неприродные примеры органических соединений. Они широко известны как сахара. По функциональным группам это альдегиды или кетоны, имеющие дополнительные гидроксильные группы. Углеводы — это простой способ проиллюстрировать органические соединения, поскольку они представляют собой просто цепочки ковалентных связей С-С и С-Н в компании некоторых наиболее типичных органических функциональных групп (спиртов и карбонилов).Примерами углеводов являются глюкоза, фруктоза, сахароза и т. д. Белки состоят из цепочек аминокислот, соединенных вместе в пептиды. Белки на самом деле представляют собой полимеры, которые могут состоять из одной цепи многих аминокислот или из нескольких цепей, упакованных вместе за счет нековалентных взаимодействий. Поскольку они состоят из аминокислот, они содержат углерод, водород, кислород, а также атомы азота, все скрепленные ковалентными связями, а также нековалентными взаимодействиями. Органические растворители — это органические соединения, которые обычно используются для растворения химических веществ в лаборатории, в основном для проведения химических реакций. «Подобное растворяется в подобном», говорят они, поэтому эти растворители необходимы для проведения органических реакций. Обычно это простые органические соединения, состоящие из углерода, водорода, а также кислорода или азота, иногда серы. Обычно они представляют собой жидкости при комнатной температуре и имеют температуру кипения в диапазоне от 40 ºC до 200 ºC.Типичными примерами являются гексан, циклогексан (CyH), ацетон, тетрагидрофуран (THF), толуол (PhMe), этанол (EtOH), метанол (MeOH), бензол (PhH), диметилсульфоксид (DMSO) или диметилформамид (DMF). Единственным ограничением для органических соединений является воображение химика. Это то, что я только что создал менее чем за 1 минуту в ChemDraw, и это кажется вполне разумным органическим соединением. Готовитесь к изучению области неорганической химии? Это лишь некоторые распространенные примеры неорганических молекул. Соль, которую вы используете для приготовления пищи, в основном представляет собой хлорид натрия, NaCl, и это самый классический пример неорганического соединения.В частности, это ионное соединение, состоящее из равного количества катионов натрия (I) и анионов хлорида, образующих симметричную трехмерную сеть. Двуокись углерода является еще одним примером неорганического соединения с химической формулой CO 2 . Например, четыреххлористый углерод CCl4 считается органическим соединением, потому что вместо ковалентных связей C–H он имеет связи C–Cl, которые электронно эквивалентны. Модель связи в диоксиде углерода, монооксиде углерода и других небольших неорганических соединениях совершенно иная. Аллотропы углерода, такие как графит, графен или алмаз, классифицируются как неорганические соединения, даже если они содержат соединения, которые характеризуются наличием связи углерод-металл (которая во многих случаях является «гибридом» между ковалентной и ионной связью). Примером этого являются реактивы Гриньяра (такие как фенилмагнийбромид) или литийорганические соединения (такие как бутиллитий). Надеюсь, нам удалось ясно объяснить основные различия между органическими и неорганическими соединениями. Органические соединения всегда содержат атомы углерода и почти всегда атомы водорода, все они удерживаются вместе ковалентными силами. Неорганические соединения — это все остальное! Существует 5 подотраслей химии, но что такое неорганические соединения? Неорганическое соединение – это любое химическое соединение, не имеющее атома углерода.Неорганические соединения довольно просты, потому что они не образуют сложных молекулярных связей, как это делает углерод. Тогда каковы некоторые примеры неорганических соединений? Проще говоря, ответвлениями неорганического соединения является любое химическое вещество, состоящее из двух или более химических элементов, обычно отличных от углерода, которые смешаны и почти всегда в определенных пропорциях. Кроме того, эта статья предоставит вам несколько примеров неорганических соединений. Вот список примеров неорганических соединений: 1.Хлорид алюминия Каковы некоторые примеры неорганических соединений? Вот первые списки. Это химическое вещество обычно используется как кислота Льюиса и применяется в химической промышленности в качестве катализатора реакций Фриделя-Крафтса для производства моющих средств и этилбензола.Возможно, вы захотите узнать об использовании и свойствах алюминия 2. Гидроксид алюминия Гидроксид алюминия (Al(OH)3) также является одним из неорганических соединений. Это химическое вещество встречается в природе как гиббсит или гидраргиллит, которое произошло от греческого слова, обозначающего воду (гидра) и глину (аргайлы). Гидроксид алюминия в основном используется для производства других соединений алюминия, особенно кальцинированного алюмосульфата алюминия, полиалюминийхлорида, хлорида алюминия, цеолита алюмината натрия, активированного оксида алюминия и нитрата алюминия. 3. Нитрат алюминия Нитрат алюминия с формулой Al(NO3)3 представляет собой водорастворимую соль алюминия и азотной кислоты. Он окрашен в белый цвет и в основном существует в виде кристаллогидрата. Нитрат алюминия является сильным окислителем и часто используется для придания коже внешнего вида дубильных веществ, антиперспирантов, ингибиторов коррозии, экстракции нефтепереработки, урана, а также нитрирующего агента. Это химическое вещество также используется в лабораторных и аудиторных исследованиях, например, в следующей реакции: Al(NO3)3 + 3 NaOH → Al(OH)3 + 3 NaNO3 4.Бура Бура с формулой Na2B4O7•10h3O, также известная как борат натрия, тетрабират натрия или тетраборат натрия. Этот химикат является химическим компонентом для производства моющих средств, химикатов в косметике, а также эмалевых глазурей. Он также используется в качестве буферных растворов в приложениях биохимии, которые играют роль антипирена, противогрибкового соединения, флюса в металлургии и текстурирующего агента при выпечке. 5. Боран Боран (Bh4) является частью большой группы, состоящей из 13 гидридных соединений с общей формулой BxHy. Высокое сродство бора к электрону с кислородом, эти химические соединения не встречаются в природе, поэтому его называют неорганическим соединением. Большинство боранов окисляются при контакте с воздухом, зажигалка сильно взрывается. Существует три наиболее важных борана, а именно диборан (B2H6), пентаборан (B5H9) и декаборан (B10h24). 6.Кадия хлорид Хлорид кадмия (CdCl2) представляет собой белое кристаллическое химическое соединение, представляющее собой комбинацию кадмия и хлорида. Это химическое вещество хорошо растворяется в воде, но слабо растворяется в спирте. Кристаллический компонент этого химического вещества состоит из двухмерных слоев ионов. Кроме того, его формулы также известны как CdCl2•h3O и CdCl2•5h3O. Хлорид кадия используется для получения или получения сульфида кадия. В лаборатории из безводного CdCl2 получают кадмийорганические соединения типа R2Cd, используемые в синтезе кетонов из ацилхлоридов.Кроме того, это химическое соединение используется для фотокопирования, окрашивания, а также гальваники. 7. Фторид кадия Фторид кадмия с формулой CdF2 обычно является нерастворимым в воде источником кадмия. Это химическое вещество вместе с другими фторидными соединениями используется для (ограниченных) протоколов медицинского лечения. Это химическое соединение получают реакцией газообразного фтора (фтористого водорода) с металлическим камием (или также с его солями, а именно хлоридом, оксидом или сульфатом) 8.Иоид кадия Иодид кадмия с формулой CdI2 представляет собой неорганическое химическое соединение, представляющее собой комбинацию кадмия и йода. Он имеет кристаллическую структуру с сильными поляризационными эффектами. 9. Сульфат кадия Сульфат кадмия с формулой CdSO4 является одним из неорганических химических соединений, которые бесцветны и хорошо растворимы в воде.это химическое соединение используется для электроосаждения кадмия в электронной схеме. 10. Бикарбонат цезия Бикарбонат цезия с формулой CsHCO3 можно получить по реакции: Cs2CO3 + CO2 + h3O → 2 CsHCO3. он используется для синтеза солей цезия. 11. Дихлорид дихлорида Дихлорид дисульфура с формулой S2Cl2 является другим примером неорганического соединения, которое производится из серы и хлора. У него есть другое название – монохлорид серы.Это химическое вещество используется для введения связей C-S (хлорид и сера). Другими областями применения дихлорида серы являются синтетические каучуки, инсертициды, катализаторы полимеризации для любых видов растительных масел и для упрочнения мягкой древесины. 12. Силикагель Силикагель (SiO2•nh3O) представляет собой гранулированную, стекловидную и пористую форму диоксида кремния, полученную синтетическим путем из силиката натрия. Он содержит микроструктурированный нанопористый кремнезем. Обычное применение силикагеля сначала необходимо высушить.Это химическое соединение представляет собой природный минерал, который обрабатывается и очищается до гранулированной формы, обычно имеет средний размер пор 2,4 нанометра и обладает сильным сродством к молекулам воды. Силикагель используется для поддержания относительной влажности внутри спутниковой передачи как можно ниже, а также для предотвращения роста плесени и порчи, которые могут повредить другие элементы, например электронику. Это упаковано в проницаемый мешок. 13. Кремниевая кислота Кремниевая кислота с формулой [SiOx(OH)4-2x]n – это неорганическое химическое соединение, которое также является общим названием для соединений семейства химических, содержащих элементы кремния до оксида и гидроксила. 14. Азид натрия Азид натрия с формулой NaN3 представляет собой бесцветную соль в газовой форме, компонент, который можно найти во многих автомобильных подушках безопасности. Этот компонент используется для получения других азидных соединений, он также хорошо растворим в воде и опасно токсичен. Азид натрия можно использовать в сельскохозяйственных целях в качестве средства борьбы с вредителями, такими как Meloidogyne incognita, а также использовать для выращивания отдельных растений, например, риса, ячменя, а также овса. Бикарбонат натрия имеет различные названия, такие как пищевая сода, а также гидрокарбонат натрия.Это химическое соединение с формулой NaHCO3. Бикарбонат натрия представляет собой соль, которая состоит из ионов натрия, а также ионов бикарбоната. Бикарбонат натрия имеет различные применения в повседневной жизни, такие как средство от вредителей, средство для удаления краски и коррозии, средство для устранения запаха, медицинское применение, а также очиститель бытовой техники от столового серебра до пола. 16. Бисульфит натрия Бисульфит натрия с формулой NaHSO3 также является неорганическим химическим соединением, которое используется в качестве пищевой добавки с номером E E222.Он имеет различное использование, первое использование — это мягкий восстановитель в некоторых органических синтезах в процедурах очистки. Второе применение – удаление следов или избытка хлора, брома, йода, гипохлоритных солей, эфиров эсмата, триоксида хрома, а также перманганата калия. 17. Монооксид дихлора Монооксид дихлора с формулой Cl2O представляет собой неорганическое соединение, которое было впервые синтезировано в 1834 году. При комнатной температуре монооксид дихлора представляет собой коричневато-желтоватый газ и растворим в воде и органических растворителях.Это химическое вещество является сильным окислителем, а также хлорирующим агентом. 18. Диоксид дихлора Диоксид дихлора с формулой Cl2O2 представляет собой неорганическое химическое соединение, которое выглядит как желтовато-зеленый газ и может быть таким же ярким, как оранжевый кристалл при -59 °C. 19. Вода Вода с формулой h3O является еще одним примером простого неорганического соединения, хотя и содержит водород.Атомы в молекуле воды образовали очень простую связь из-за отсутствия углерода. 20. Углекислый газ Углекислый газ с формулой CO2 относится к неорганическим соединениям, так как не содержит атома. 21. Азот Азот с формулой NO2 может иметь разный цвет при разной температуре. это неорганическое соединение образуется при ядерных испытаниях в атмосфере и несет ответственность за появление красноватого цвета в грибовидных облаках.Это химическое вещество очень токсично и образует слабые связи между атомами азота и кислорода. 22. Оксид железа (III) Оксид железа (III) с формулой Fe2O3 является неорганическим соединением, поскольку в нем отсутствует атом углерода или углеводород. 1.Относитесь ко всем этим неорганическим соединениям, поскольку они являются опасными химическими компонентами. 2. Все бораны бесцветны, а также диамегнетики, что делает их известными как реактивные химические соединения, а некоторые из них пирофорны. Следовательно, он очень ядовит и требует особых мер предосторожности при обращении. 3. При концентрациях газовой фазы в воздухе более 30% по объему при СТП диоксид хлора может взрывоопасно распадаться на хлор и кислород. Соединение – это вещество, образованное путем химической связи двух или более различных элементов или атомов. Пример: хлорид натрия (ионное соединение), вода (ковалентное соединение). Обычно соединения бывают двух типов в зависимости от химического состава. Их Органическое соединение — это класс химических соединений, которые содержат углерод, водород и другие атомы 90 190 .Он также известен как углеводороды (соединения, содержащие углерод-водородную связь). На сегодняшний день известен миллион органических соединений. Эти органические соединения являются основными компонентами живых существ. В круговороте углерода и фотосинтезе происходит превращение неорганических соединений в органические соединения, такие как простой сахар. Большинство синтетически полученных органических соединений получают из нефтехимии, в основном углеводороды. Основные свойства углерода приводят к образованию большого количества органических соединений.эти свойства Неорганическое соединение также относится к классу химических соединений, которые в большинстве случаев не содержат углерод и которые не имеют углерод-водородной связи . Большинство неорганических соединений находится в земной коре. Некоторые простые углеродсодержащие соединения, такие как двуокись углерода, окись углерода, карбиды, цианиды и т. д., считаются неорганическими соединениями. Основное различие между органическими соединениями и неорганическими соединениями заключается в том, что органические соединения в основном состоят из углеводородов, а неорганические соединения не имеют углерод-водородных связей. Другие свойства, такие как проводимость, воспламеняемость, летучесть, растворимость и т. д., также будут различаться из-за разницы в химическом составе.
– Определение, структура, свойства
2. Что такое неорганические соединения? Что такое органические соединения?
 Чаще всего эти атомы углерода связаны с атомами водорода, кислорода и азота. Концепция органических соединений может в некоторых моментах сбивать с толку, например, в случае двуокиси углерода (CO 2 ). Хотя CO 2 имеет атом углерода, связанный с двумя атомами кислорода, по историческим причинам он не считается органическим соединением. Такие соединения, как карбонаты, цианиды, CO и CO 2 , были открыты до открытия органических соединений. В то время они считались неорганическими соединениями, и эта практика продолжается до сих пор.
Чаще всего эти атомы углерода связаны с атомами водорода, кислорода и азота. Концепция органических соединений может в некоторых моментах сбивать с толку, например, в случае двуокиси углерода (CO 2 ). Хотя CO 2 имеет атом углерода, связанный с двумя атомами кислорода, по историческим причинам он не считается органическим соединением. Такие соединения, как карбонаты, цианиды, CO и CO 2 , были открыты до открытия органических соединений. В то время они считались неорганическими соединениями, и эта практика продолжается до сих пор. Наиболее распространенным типом органических соединений являются углеводороды. Углеводороды также можно классифицировать по-разному, поскольку эти соединения имеют разную структуру, свойства и проявляют разные реакции.
Наиболее распространенным типом органических соединений являются углеводороды. Углеводороды также можно классифицировать по-разному, поскольку эти соединения имеют разную структуру, свойства и проявляют разные реакции. Что такое неорганические соединения?
 Другими словами, неорганические соединения не состоят в основном из атомов углерода.Атомы углерода могут как присутствовать, так и отсутствовать.
Другими словами, неорганические соединения не состоят в основном из атомов углерода.Атомы углерода могут как присутствовать, так и отсутствовать. Эта способность также вызвана их связующим характером.
Эта способность также вызвана их связующим характером. Разница между органическими и неорганическими соединениями
Определение
Тип соединения
Атомы присутствуют
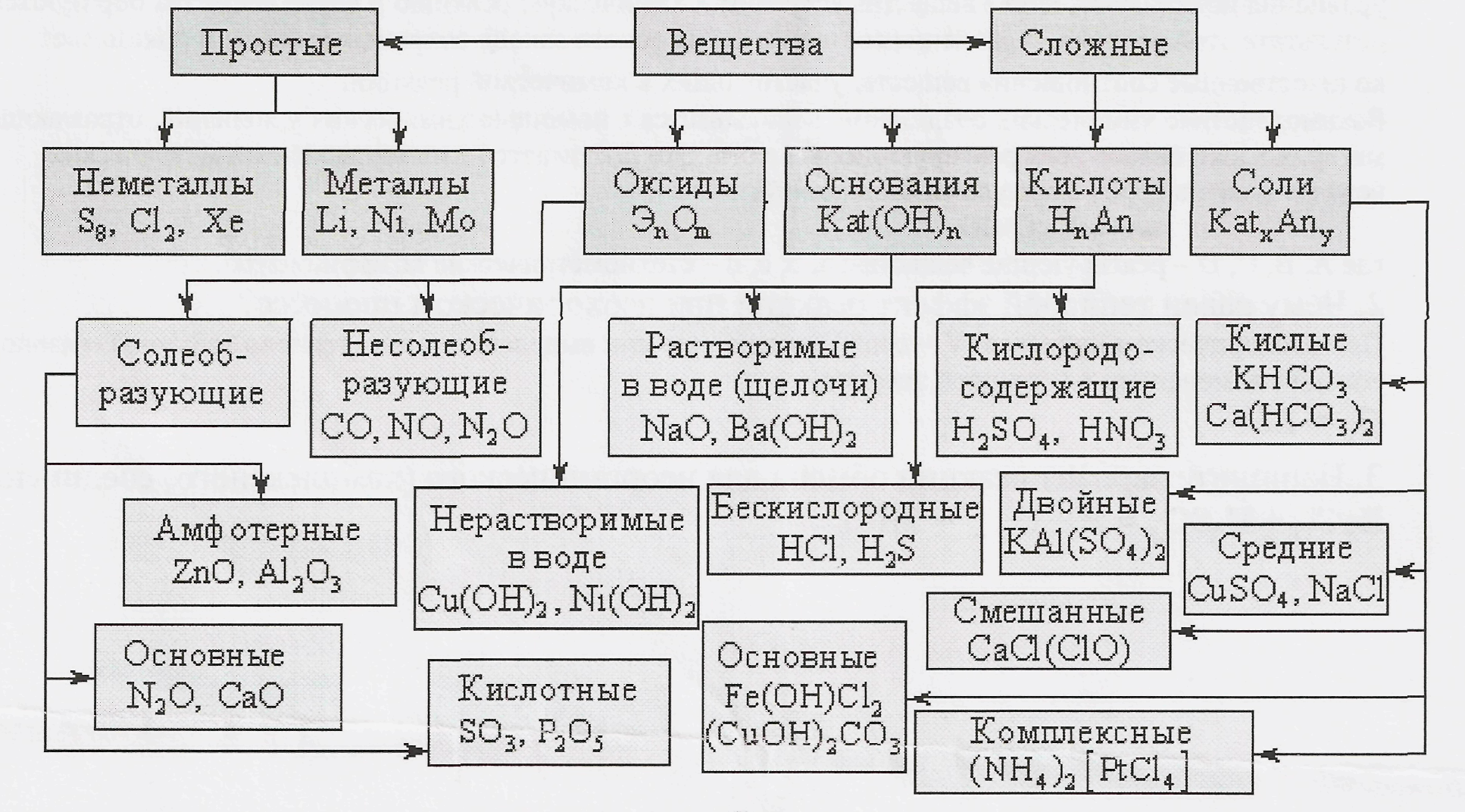
Внешний вид
Растворимость в воде
Заключение
 Таким образом, различие между органической и неорганической химией связано с различием между органическими и неорганическими соединениями, которое, в свою очередь, зависит от наличия или отсутствия в их структуре атомов углерода.
Таким образом, различие между органической и неорганической химией связано с различием между органическими и неорганическими соединениями, которое, в свою очередь, зависит от наличия или отсутствия в их структуре атомов углерода. Каталожные номера:
2. «Неорганическая химия». Американское химическое общество.н.п., н.д. Веб. Доступно здесь. 12 июня 2017 г. Изображение предоставлено:
2. «Olympicene» Yikrazuul (разговор) — собственная работа, Public Domain) через Commons Wikimedia
3. «Silane-Sih5-2D» Автор Бен Миллс — собственная работа (общественное достояние) через Commons Wikimedia
4. «Метан-2D-маленький» (общественное достояние) через Commons Wikimedia В чем разница между органическими и неорганическими соединениями?
 Когда мы идем в супермаркет, мы видим разные товары; некоторые из них органические, а другие неорганические. В чем разница между органическими и неорганическими соединениями?
Когда мы идем в супермаркет, мы видим разные товары; некоторые из них органические, а другие неорганические. В чем разница между органическими и неорганическими соединениями?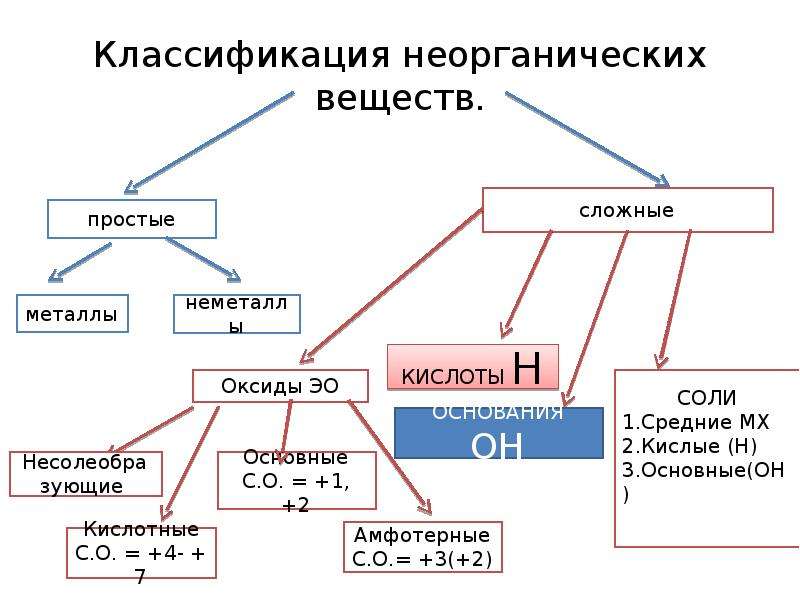 Теперь есть более четкие определения.
Теперь есть более четкие определения. Знаете ли вы?
Неорганическая и органическая химия являются двумя основными дисциплинами химии. Органика связана с (большинством) химией углерода, а неорганическая химия изучает в основном остальные химические соединения. Введение
1. Органические соединения
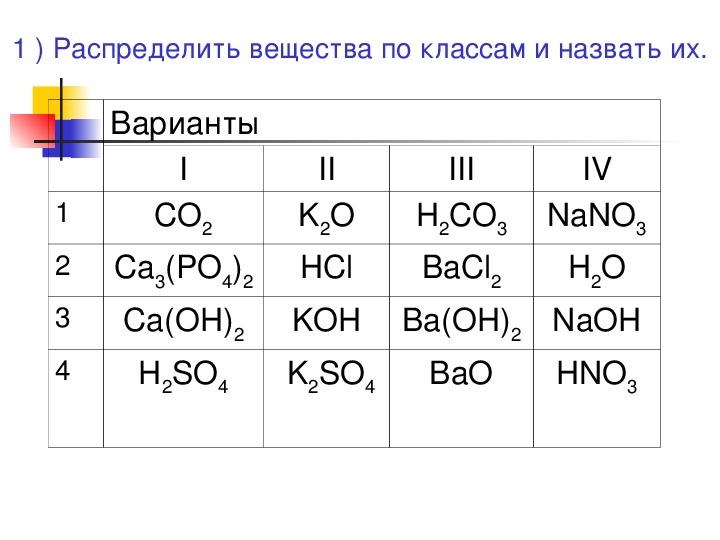
2.Неорганические соединения
Теория жизненной силы и первый полный химический синтез
 Именно поэтому эту теорию называют «теорией жизненной силы».
Именно поэтому эту теорию называют «теорией жизненной силы». The Modern Definitions
Органические соединения
 Большинство органических соединений также содержат водород. Другими распространенными элементами, присутствующими в органических соединениях, являются кислород, азот, сера, галогены или фосфор. Но это не единственные.
Большинство органических соединений также содержат водород. Другими распространенными элементами, присутствующими в органических соединениях, являются кислород, азот, сера, галогены или фосфор. Но это не единственные.
Неорганические соединения

Основные различия между органическими и неорганическими соединениями
0 А как вы, наверное, догадались, примеры для обоих типов можно продолжать бесконечно.9 9 Органные соединения Неорганические соединения 9 9 Неорганические соединения не имеют скелета, основанного на ковалентных связях С–С. 
Возникновение Живые организмы в основном состоят из органических соединений. Неорганические соединения обычно встречаются в неживых объектах, таких как минералы, воздух или космическое пространство. Состав Органические соединения в основном состоят из углерода и водорода, а также кислорода, азота, галогена, фосфора и других веществ. Неорганические соединения могут содержать огромное количество химических элементов.Для каждого элемента таблицы Менделеева существуют неорганические соединения. Химическая связь Органические соединения удерживаются вместе ковалентными связями. Неорганические соединения образуют ионные или металлические связи, хотя могут присутствовать и ковалентные связи. 
Растворимость В самых общих чертах органические соединения менее растворимы в воде. Обычно они растворимы в органических растворителях. В общих чертах неорганические соединения растворимы в воде и менее растворимы в органических растворителях. Температура плавления В самых общих чертах органические соединения имеют низкие температуры плавления и кипения. В общих чертах неорганические соединения имеют высокие температуры плавления и кипения. Примеры Углеводы, липиды, белки, нуклеиновые кислоты, органические растворители, метан… Хлорид натрия (поваренная соль), графит, металлическое железо, сталь, стекло, углекислый газ… 
Примеры органических соединений
Углеводы
Белки
 Классическим примером белков являются ферменты.
Классическим примером белков являются ферменты. Органические растворители
Создание любого органического соединения, которое только можно себе представить, в лаборатории органической химии
 Скорее всего, существует бесконечное количество комбинаций, в которых вы можете расположить атомы углерода и водорода, образуя органические соединения.Не говоря уже о других элементах.
Скорее всего, существует бесконечное количество комбинаций, в которых вы можете расположить атомы углерода и водорода, образуя органические соединения.Не говоря уже о других элементах. Примеры неорганических соединений
NaCl – хлорид натрия или поваренная соль
Двуокись углерода
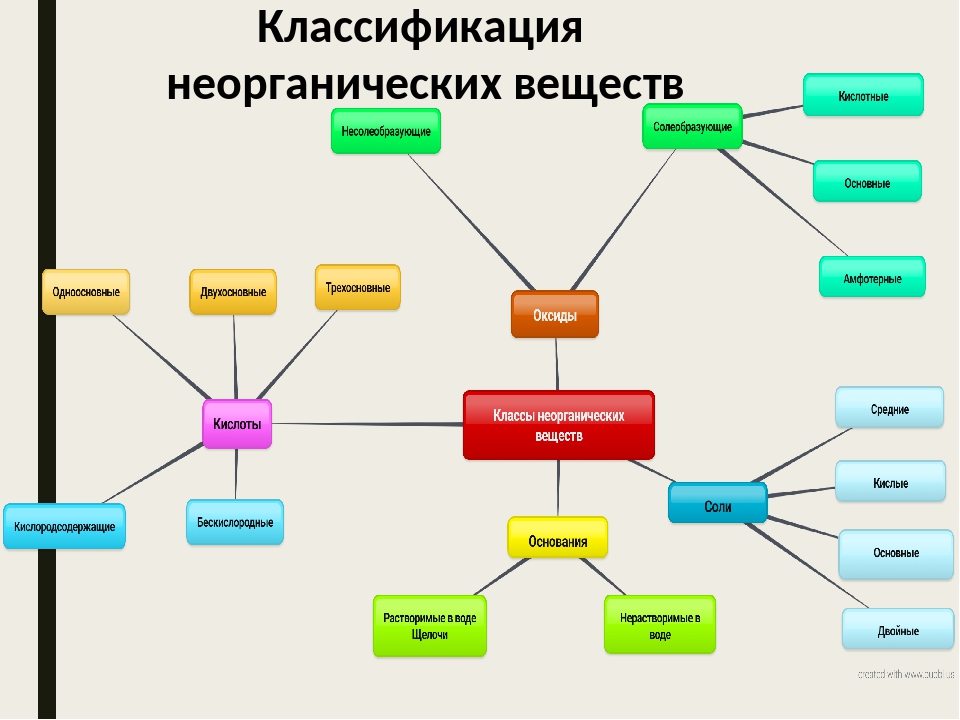 Несмотря на наличие атома углерода, CO 2 считается неорганическим соединением, поскольку наличие углеродных и ковалентных связей не делает соединение органическим. Вам нужна связь C–H или эквивалент.
Несмотря на наличие атома углерода, CO 2 считается неорганическим соединением, поскольку наличие углеродных и ковалентных связей не делает соединение органическим. Вам нужна связь C–H или эквивалент. Алмаз и графит
Подводя итоги
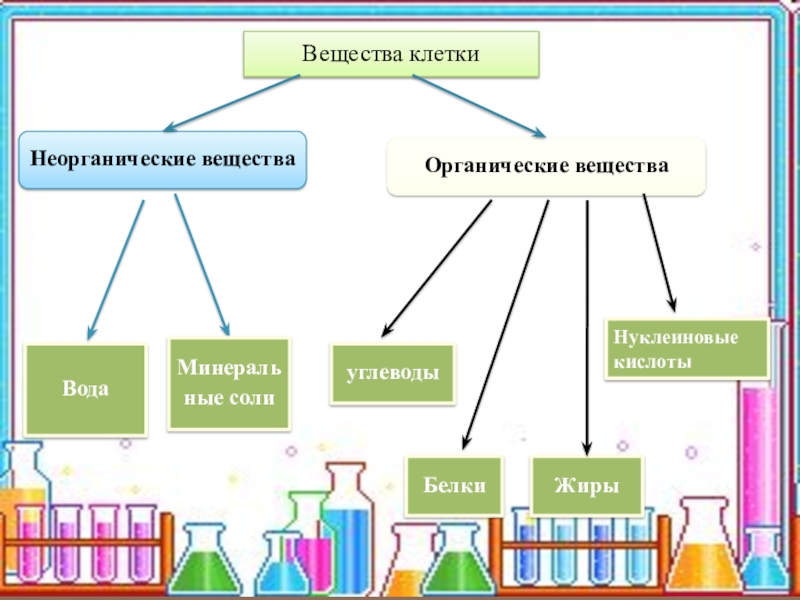
Какие примеры неорганических соединений?
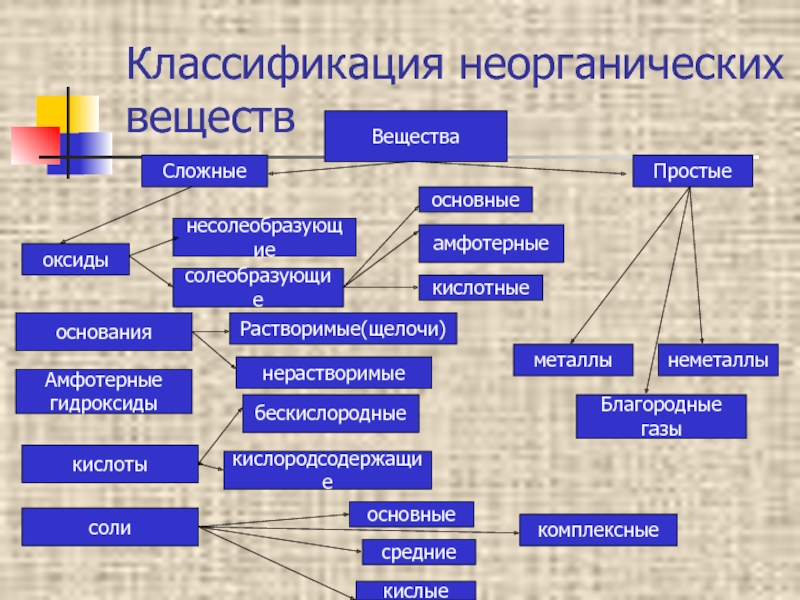 Хлорид алюминия (AlCl3) представляет собой химическое соединение алюминия и хлора. Его цвет белый, но иногда он загрязнен хлоридом железа (III) и делает его более желтым. Обычно хлорид алюминия расходуется при производстве металлического алюминия, но большое количество его используется в химической промышленности.
Хлорид алюминия (AlCl3) представляет собой химическое соединение алюминия и хлора. Его цвет белый, но иногда он загрязнен хлоридом железа (III) и делает его более желтым. Обычно хлорид алюминия расходуется при производстве металлического алюминия, но большое количество его используется в химической промышленности.
 В кустарной добыче золота он иногда используется в качестве токсичной ртути в процессе. добычи золота.
В кустарной добыче золота он иногда используется в качестве токсичной ртути в процессе. добычи золота.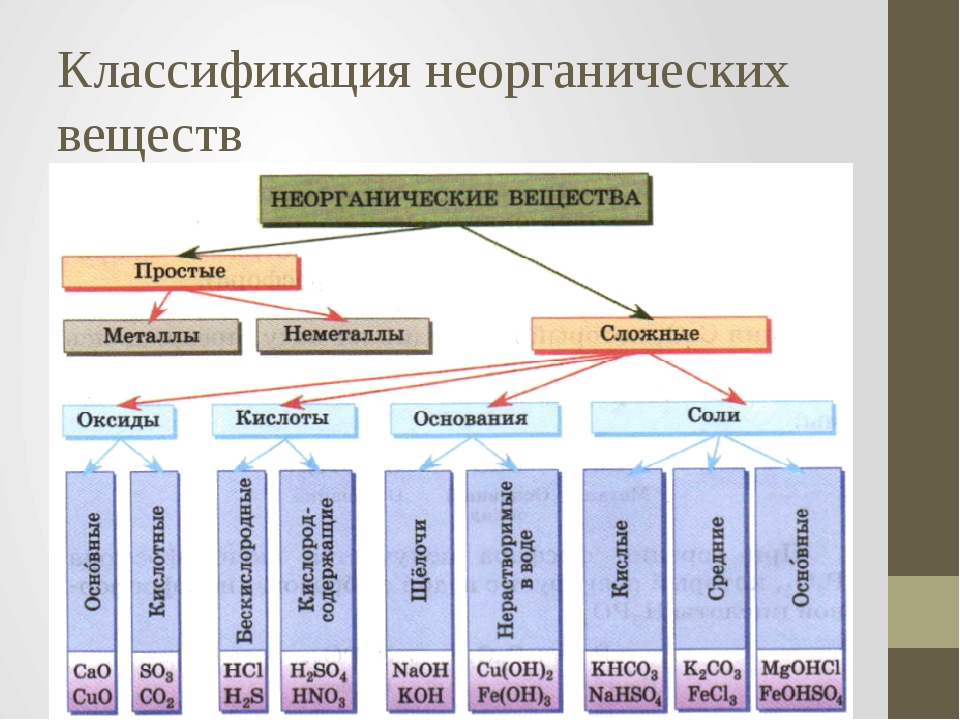
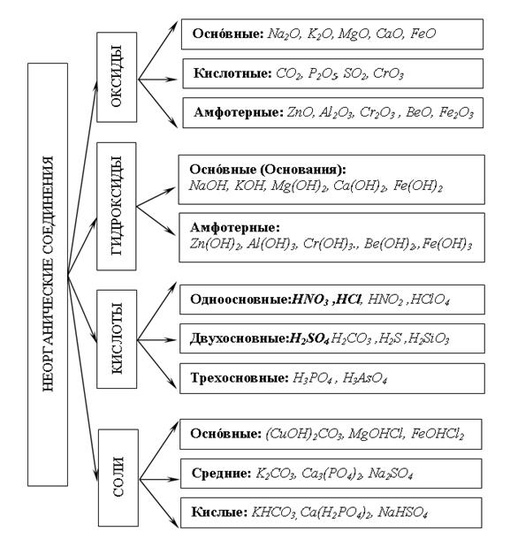 Это химическое соединение используется в литографии, фотографии, гальванике, а также в производстве люминофоров.
Это химическое соединение используется в литографии, фотографии, гальванике, а также в производстве люминофоров.


 Это включает в себя несколько оксидов хлора. Это полезно в качестве окислителя в воде и при отбеливании.
Это включает в себя несколько оксидов хлора. Это полезно в качестве окислителя в воде и при отбеливании. Это химическое вещество также входит в состав трех основных оксидов железа. Оксид железа (III) встречается в природе в виде гематита и обычно известен как ржавчина. Таким образом, теперь вы знаете, что представляют собой некоторые примеры неорганических соединений.
Это химическое вещество также входит в состав трех основных оксидов железа. Оксид железа (III) встречается в природе в виде гематита и обычно известен как ржавчина. Таким образом, теперь вы знаете, что представляют собой некоторые примеры неорганических соединений. Предостережения:
Разница между органическим и неорганическим соединением
Что такое соединение?  Связь может быть как ионного, так и ковалентного типа.
Связь может быть как ионного, так и ковалентного типа.
Что такое органическое соединение? 
Что такое неорганическое соединение?
Заключение Органическое соединение Неорганическое соединение Органическое соединение определяется как класс химических соединений, которые содержат углерод, водород и кислород. 
Неорганическое соединение определяется как класс химических соединений, не содержащих углерод-водородной связи. Органические соединения растворимы в органических растворителях и нерастворимы в воде. Неорганические соединения растворимы в воде и нерастворимы в органических растворителях. Органические соединения имеют низкие температуры плавления и кипения. Неорганические соединения имеют высокие температуры плавления и кипения. Благодаря наличию углерода проявляется катенация. Неорганические соединения не проявляют катетенации. Органические соединения проявляют изомерию. Неорганические соединения не проявляют изомерии. В органических соединениях наблюдается медленная скорость реакции. Высокая скорость реакции наблюдается в неорганических соединениях. Органические соединения легко воспламеняются и очень летучи. 
Неорганические соединения негорючие и нелетучие. Большинство органических соединений бесцветны. Большинство неорганических соединений окрашены. Органические соединения образуют ковалентные связи. Неорганические соединения образуют ионные связи. В водном растворе органические соединения действуют как плохие проводники тепла и электричества. В водном растворе неорганические соединения действуют как хорошие проводники тепла и электричества. Органические соединения являются биологическими и более сложными по своей природе. Неорганические соединения не являются сложными и представляют собой минералы, существующие в земной коре. Органические соединения не могут образовывать соли. Неорганические соединения могут образовывать соли. Факты, нуклеиновые кислоты, сахара, ферменты, белки и т. д. 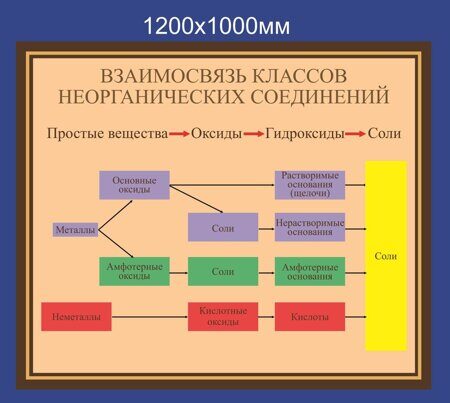
Неметаллы, соли, медали, кислоты, основания и т. д.
.
 Белковые молекулы образуются из простых соединений — аминокислот (в естественных белках содержится 20 аминокислот). Объединяясь в различной последовательности и количестве, они образуют большое разнообразие (до 1000) белков. Их роль в жизни клетки огромна: строительный материал организма, катализаторы (белки-ферменты ускоряют химические реакции), транспорт (гемоглобин крови доставляет клеткам кислород и питательные вещества и уносит углекислый газ и продукты распада). Белки выполняют защитную функцию, энергетическую.
Белковые молекулы образуются из простых соединений — аминокислот (в естественных белках содержится 20 аминокислот). Объединяясь в различной последовательности и количестве, они образуют большое разнообразие (до 1000) белков. Их роль в жизни клетки огромна: строительный материал организма, катализаторы (белки-ферменты ускоряют химические реакции), транспорт (гемоглобин крови доставляет клеткам кислород и питательные вещества и уносит углекислый газ и продукты распада). Белки выполняют защитную функцию, энергетическую. Они являются основным структурным компонентом биологических мембран. Липиды выполняют энергетическую функцию, в них содержатся жирорастворимые витамины.
Они являются основным структурным компонентом биологических мембран. Липиды выполняют энергетическую функцию, в них содержатся жирорастворимые витамины.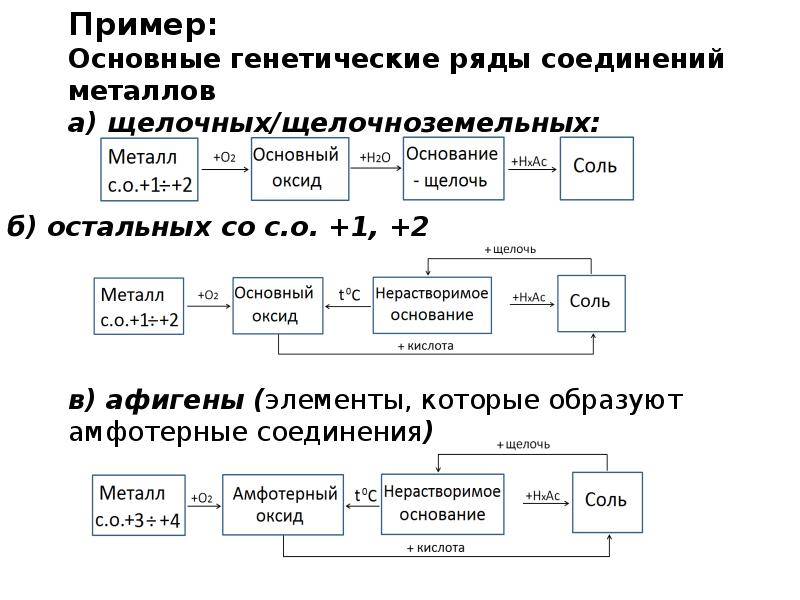



 Хромато-масс-спектрометр укомплектован библиотекой масс-спектров NIST, содержащей более 220 тысяч соединений со спектрами и 192 тысячи уникальных веществ.
Хромато-масс-спектрометр укомплектован библиотекой масс-спектров NIST, содержащей более 220 тысяч соединений со спектрами и 192 тысячи уникальных веществ. д.
д.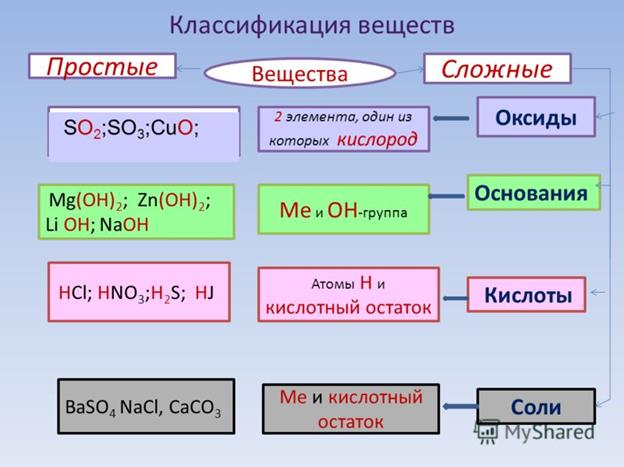 Каждый элемент комплекса позволяет получать информацию об отдельных характеристиках веществ, реактивов и материалов, позволяя по совокупности данных получать исчерпывающую информацию об объектах анализа.
Каждый элемент комплекса позволяет получать информацию об отдельных характеристиках веществ, реактивов и материалов, позволяя по совокупности данных получать исчерпывающую информацию об объектах анализа.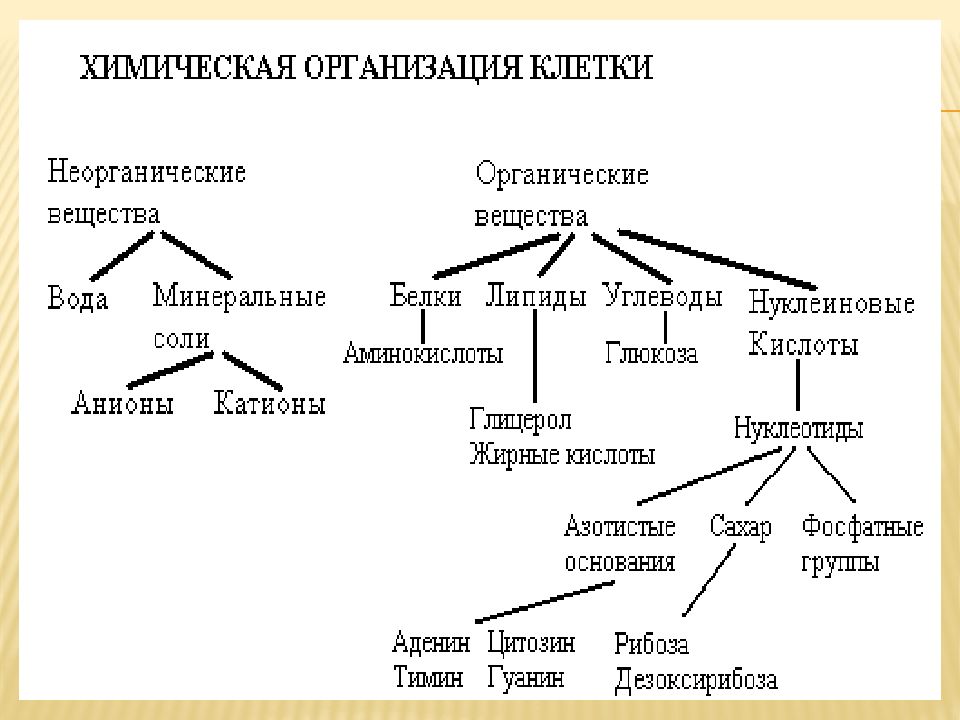

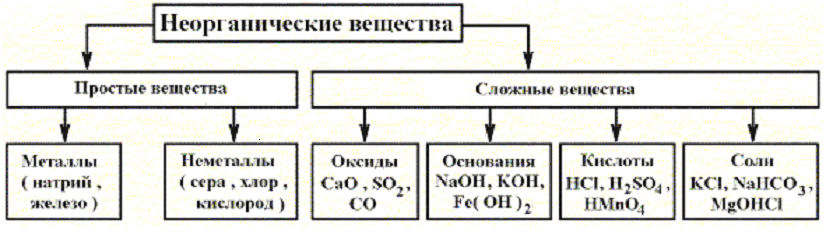 Соли образуются, когда ионы связаны вместе ионной связью и диссоциируют на ионы (кроме H + или OH – ) при растворении в растворителе, таком как вода.
Соли образуются, когда ионы связаны вместе ионной связью и диссоциируют на ионы (кроме H + или OH – ) при растворении в растворителе, таком как вода. Например, хлорид натрия (NaCl) расщепляется на ионы натрия и хлорида.
Например, хлорид натрия (NaCl) расщепляется на ионы натрия и хлорида.