Урок 8. Химическое количество вещества и моль – HIMI4KA
В уроке 8 «Химическое количество вещества и моль» из курса «Химия для чайников» выясним, что такое химическое количество вещества; рассмотрим моль в качестве единицы количества вещества, а также познакомимся с постоянной Авогадро. Напоминаю, что в прошлом уроке «Относительная молекулярная и относительная формульная массы» мы научились вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выяснили что такое массовая доля и привели формулу для ее вычисления.


Любое чистое вещество имеет свою химическую формулу, т. е. характеризуется определенным качественным и количественным составом.
Если необходима какая-то порция твердого вещества, то для этого следует взять нужную его массу, т. е. взвесить вещество (рис. 43). Нужный объем жидкого вещества обычно отмеряют с помощью мензурки или мерного цилиндра (рис. 44). Для отбора необходимой порции (объема) газообразных веществ применяют специальные емкости — газометры (рис. 45).




Следовательно, объем и масса — это величины, характеризующие данную порцию вещества.
Химическое количество вещества
В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. Когда вы говорите: «Я купил 2 кг груш», то здесь речь идет о массе груш. Но если вы говорите: «Я купил 10 груш», то в этом случае речь идет о количестве груш. Массу вещества измеряют в граммах, килограммах, тоннах, а количество — в штуках.
Груши можно пересчитать поштучно, а если это, например, зерна? Тут уже посчитать каждое зернышко даже в небольшой емкости сложно. Поэтому зерно обычно продают мешками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) — будет находиться практически одно и то же число зерен. Подобным образом продают многие товары. Например, яйца — десятками, спички — спичечными коробками, в каждом из которых находится по 45 спичек (рис. 46).

В химической практике, помимо массы или объема, необходимо знать число структурных единиц (атомов, молекул, формульных единиц), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии, как и в других естественных науках, используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется количеством вещества или, как следует называть ее при химических расчетах, — химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Международной системы единиц (СИ).
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
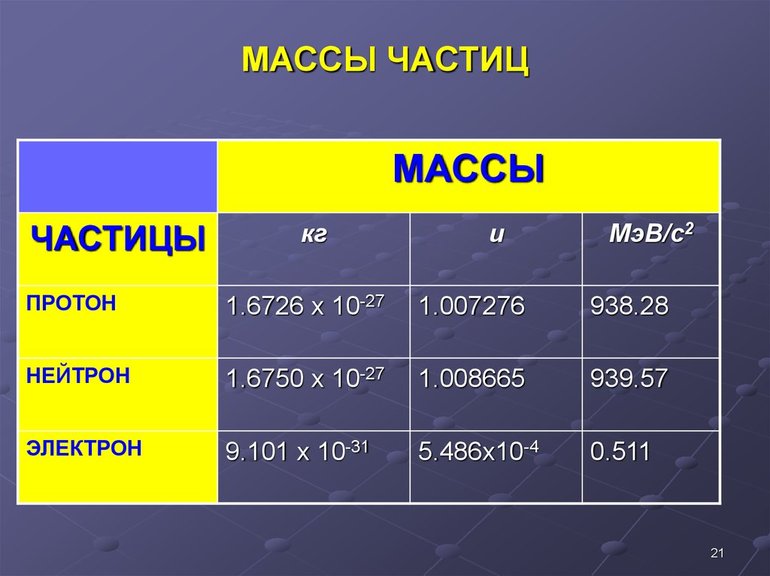
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):


Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
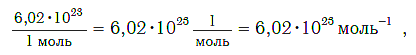
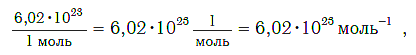
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:


Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023формульных единиц.
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N(Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул.
Отсюда:
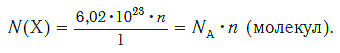
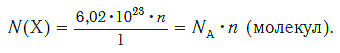
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
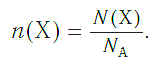
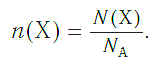
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Спойлер


[свернуть]
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·1023 формульных единиц (ФЕ).
Спойлер


[свернуть]
Краткие выводы урока:
- Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02·1023 структурных единиц.
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Число частиц, количество вещества, объём, плотность — урок. Химия, 8–9 класс.
Число частиц (атомов, молекул, протонов, электронов и т. д.) обозначается буквой N.
Пример:
N(O)= \(10000\) — число атомов кислорода равно \(10000\).
N(CO2)= 1025 — число молекул углекислого газа равно 1025.
N(n)= 2 ·1022 — число нейтронов равно 2 ·1022.
Химическое количество вещества — физическая величина, пропорциональная числу частиц, содержащихся в данной порции вещества. Обозначается буквой n. Единица измерения — моль.
\(1\) моль — количество вещества, в котором содержится 6,02⋅1023 частиц.
Величина, равная 6,02⋅1023 моль-1 или 6,02⋅1023 1/моль, называется постоянной Авогадро. Единица в числителе дроби (1/моль) заменяет название частицы вещества.
Пример:
Na(O)= 6,02⋅1023 моль-1 обозначает, что один моль содержит 6,02⋅1023 атомов кислорода.
Na(CO2)= 6,02⋅1023 моль
Na(n)= 6,02⋅1023 моль-1 обозначает, что один моль нейтронов содержит 6,02⋅1023 этих частиц.
Объём V измеряется в кубических дециметрах (дм³), кубических метрах (м³), кубических сантиметрах (см³). Применяются также единицы измерения литр (л) и миллилитр (мл).
Обрати внимание!
\(1\) дм³ \(=1\) л, \(1\) см³ \(=1\) мл, \(1\) м³ \(=1000\) дм³ \(=1000\) л, \( 1\) дм³ \(=1000\) см³ \(=1000\) мл.
Молярный объём Vm — это отношение объёма вещества к его химическому количеству. Численно равен объёму одного моля вещества. Единица измерения — дм³/моль.
Для всех газов при нормальных условиях молярный объём равен \(22,4\) дм³/моль.
Плотность обозначается буквой ρ. Измеряется в г/см³, г/мл (для твёрдых веществ и жидкостей), г/дм³ или г/л (для газов).
Часто в химических расчётах применяется плотность жидкой воды. При \(4\) °С она равна \(1\) г/см³ или \(1000\) г/дм³.
www.yaklass.ru
Молярная масса. Молярный объём. Решение задач. Видеоурок. Химия 8 Класс
В процессе химических реакций атомы (или молекулы) вещества друг с другом взаимодействуют, образуя новые молекулы. Но определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооруженным глазом. Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества (n – «эн»).
Единицей количества вещества является моль (от слова «молекула»).
1 моль любого вещества содержит 6,02·1023 частиц (например, молекул). Это число называют числом Авогадро.
Постоянная Авогадро: Nа = 6,02·1023 1/моль.
Используя постоянную Авогадро, можно находить количество вещества, если известно число молекул в нем, и наоборот. Количество вещества равно отношению общего числа его молекул к постоянной Авогадро.
В равных количествах веществ содержится равное число их структурных частиц (например, молекул).
Установлено, что масса одного моля вещества численно равна его относительной молекулярной массе. Такая величина называется молярной массой вещества, М. Молярная масса измеряется в г/моль. Например, молярная масса азота N2 равна 28 г/моль.
Количество вещества можно вычислить, разделив массу порции вещества на молярную массу этого вещества: n=m/М.
Условие. Какое количество оксида кальция содержится в 112 г этого вещества?
Дано:
m (СаО )=112г
Найти:
n (СаО) – ?
Решение.
Химическая формула оксида кальция – СаО.
n(CaO) = m(CaO)/М(СаО)
Mr(CaO) = 40 + 16 = 56
n(CaO) = 112 г/ (56г/моль) = 2 моль
Ответ: 2 моль СаО.
Условие. Вычислите массу порции воды, в которой содержится столько же молекул, сколько их в 22 г углекислого газа.
Дано:
m(CO2) = 22 г
n(CO2) = n(H2O)
Найти:
m(H2O) – ?
Алгоритм решения
Зная массу углекислого газа, рассчитывают его количество. Затем находят количество воды (оно будет равно количеству углекислого газа). А потом, зная количество воды, вычисляют ее массу:
m(CO2) → n(CO2) → n(H2O) → m(H2O)
Решение
1. n(CO2) = m(CO2)/М(СО2)
Mr(CO2) = 12 + 16·2 = 44
n(CO2) = 22 г/ 44 г/моль = 0,5 моль
2. n(H2O) = n(CO2) = 0,5 моль
3. m(H2O) = n(H2O)·M(H2O)
Mr(H2O) = 1·2+16 = 18
m(H2O) = 0,5 моль·18 г/моль = 9 г
Ответ: 9 г Н2О.
В 1811 году итальянский ученый Амедео Авогадро (рис. 1) сформулировал основной газовый закон, который назвали его именем. Закон Авогадро звучит так:
В равных объемах газов при одинаковых условиях содержится равное число молекул.
Следовательно, при одинаковых условиях равные количества различных газов занимают равные объемы.
При нормальных условиях (при температуре 0 °С и давлении 1 атм.) 1 моль любого газа занимает объем 22,4 л. Эта физическая постоянная – молярный объем газа при н. у.:
Vm = 22,4 л/моль при нормальных условиях.
Количество газообразного вещества равно отношению объема порции газа к молярному объему газа при данных условиях.

Рис. 1. Амедео Авогадро (1776–1856)
Условие. Вычислите массу метана СН4, объем которого при н. у. составляет 67,2 л.
Дано:
V(CН4) = 67,2 л
Найти:
m(CН4) – ?
Решение.
Алгоритм решения
V(CН4) → n(CН4) → m(CН4)
1) n(CН4) = V(CН4)/Vn = 67,2 л/ 22,4 (л/моль) = 3 моль
2) m(CН4) = n(CН4)·M(CН4)
Mr(CН4) = 12 + 1·4 =16
m(CН4) = 3 моль·16 г/моль = 48 г
Ответ: 48 г CН4.
Подведение итогов урока.
В ходе урока вы узнали, что такое молярная масса и молярный объем вещества и как использовать эти понятия при решении расчетных задач.
Список литературы
1. Оржековский П.А. Химия: 8 класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§15)
2. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17)
3. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.10)
4. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Интернет-сайт hemi.nsu.ru (Источник)
2. Интернет-сайт hemi.nsu.ru (Источник)
3. Интернет-сайт alhimikov.net (Источник)
4. Интернет-сайт cde.osu.ru (Источник)
Домашнее задание
1. с. 86 №№ 3–5 из учебника П.А. Оржековского «Химия: 8 класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
2. Какой объем при н. у. займут 5 моль кислорода О2?
3. Какая масса соответствует 3,36 л (н. у.) хлора Cl2?
interneturok.ru
Количество вещества — Википедия
Материал из Википедии — свободной энциклопедии
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы)[1]. Единица измерения количества вещества в Международной системе единиц (СИ) и в системе СГС — моль
Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул в единицах «штука», их измеряют в молях. Фактическое количество единиц «штука» в 1 моле вещества называется числом Авогадро (NA = 6,022140857(74)·1023 «штука»/моль[3]).
Количество вещества обозначается латинской n{\displaystyle n} (эн) и не рекомендуется обозначать греческой буквой ν{\displaystyle \nu } (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов[4]. Однако в школьном курсе широко используется именно греческая буква ν{\displaystyle \nu } (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: n=m/M{\displaystyle n=m/M}, где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества можно также определить на основании его объёма: n{\displaystyle n} = V / Vm, где V — объём газа при нормальных условиях, а Vm — молярный объём газа при тех же условиях, равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
- n=mM=NNA=VVm{\displaystyle n={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m}}}}
Примечания
- ↑ Количество вещества. Большой энциклопедический политехнический словарь (2004). Проверено 31 января 2014.
- ↑ Деньгуб В. М., Смирнов В. Г. Единицы величин. Словарь-справочник. — М.: Издательство стандартов, 1990. — С. 85. — 240 с. — ISBN 5-7050-0118-5.
- ↑ Avogadro constant (англ.). Physical Measurement Laboratory. National Institute of Standards and Technology. Проверено 7 февраля 2017.
- ↑ 5B+4,5h3 → B5H9, Δh398∘=+62,8 kJ{\displaystyle {\mathsf {5B+4{,}5H_{2}\ {\xrightarrow {}}\ B_{5}H_{9}}},~\Delta H_{298}^{\circ }=+62{,}8~\mathrm {kJ} }
Когда теплота реакции записывается так, как это сделано в данном уравнении, подразумевается, что она выражена в килоджоулях на стехиометрическую единицу («моль») реакции по записанному уравнению. В рассматриваемом случае теплота реакции равна 62,8 кДж на моль (+62,8 кДж · моль−1) B5H9 (газообразного), но составляет только 12,56 кДж на моль израсходованного бора (твёрдого кристаллического) или 62,8 кДж на каждые 4,5 моля газообразного водорода. Теплоты реакций всегда табулируются в расчете на моль образующегося соединения.
wikipedia.green
Количество вещества формула ℹ️ определение, обозначение, единицы измерения, расчет количества вещества по закону Авогадро, онлайн-калькулятор
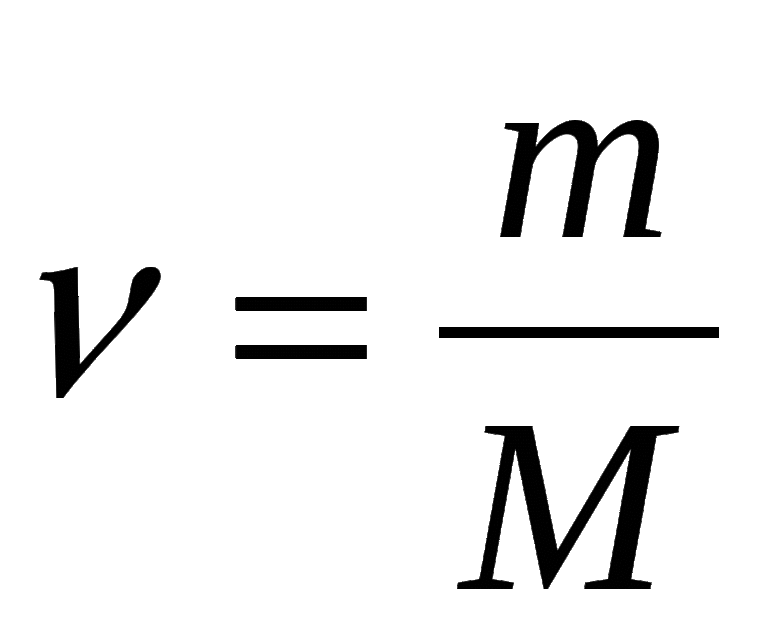
Общее понятие
Физическая величина применяется для вычисления количества конструкционных частиц в материальной субстанции. Понятие используется в случае, когда для численного определения количества вещества в химии требуется описание микроскопического строения формы материи.

Представление процессов в этом ключе нужно при проведении электролиза, получении азота и идеального газа, а также в других областях физики, которые рассматривают варианты превращения и передачи энергии.
Количество вещества является удобным понятием при характеристике различных химических процессов в отличие от массы. Это случается из-за того, что структурные электрические частицы реагируют независимо от их массы в объемах, которые являются кратными целым числам.
Примером служит процесс горения водорода, где число кислорода требуется в 2 раза меньше: О 2 + 2Н 2 = 2Н 2 О.
В этой реакции водородная масса меньше кислородной примерно в 8 раз из-за того, что атомная масса водорода меньше в 16 раз аналогичного показателя кислорода. Применение понятия количества элементов снижает неудобство при составлении уравнений. При этом взаимное соотношение между объемом веществ выражается уравнительным коэффициентом.
Формулы, которые применяются:

- Количество вещества закон Авогадро определяет на основании объема: n = V / V m, где V — объем порции газа в нормальном состоянии, а V m означает молярную величину объема субстанции в аналогичных условиях и равняется 22,4 л/моль.
- Другая формула показывает определение количества в зависимости от количества конструктивных элементов с применением постоянной Авогадро: n = N / N a, где N — число звеньев, а N a — постоянная константа Авогадро.
- В зависимости от массы и молярного веса расчет ведется по формуле: n = m / M, где m — масса субстанции, а М представляет его молярную массу.
Непосредственное число молекул не используется при расчете, т. к. это количество в реальности очень большое. Вместо обозначения молекул в штуках, применяется измерение в молях. Фактическое содержание единиц в 1 моле материи носит наименование числа Авогардо, при этом Na = 6,022141 х 1023 шт./моль.
Значение моля
Вес отдельных структурных элементов формы материи отличается, поэтому одинаковые объемы имеют различные массовые показатели. Моль — это количество материи, которое содержит число молекул, являющееся аналогичным количеству углеродных атомов в 12 г углекислого газа.
Массовый показатель не служит мерой количества субстанции, например:
- 1025 водородных молекул весят 33,5 г;
- 1025 кислородных частиц имеют массу 531,5 г.

Один моль составляет столько же нейтральных частиц, сколько их есть в 1 грамме водорода, такое положение принимается для удобства химических расчетов. При использовании наименования конструктивные элементы конкретизируются.
Понятия молекулы и моля взаимосвязаны между собой. Второе слово означает число, осязаемое множество и массу, а нейтральная частица рассматривается в качестве маленькой тяжести. Моль рассматривается в виде такого количества, которое можно отнести к понятию большой массы, состоящей из небольших весов отдельных элементов.
Молярная и молекулярная масса применяются не только к субстанциям, которые в основе конструкции имеют молекулы, но и к ионным и атомарным материальным формам.
Использование массы нейтральных частиц
В прошлом веке обнаружился научный факт, что если 2 газа содержатся в емкостях с одним и тем же объемом, то количество молекул остается одинаковым в этих субстанциях при соблюдении идентичного давления и нормальной температуры. Это значит, что важные характеристики тела определяются количеством структурных частиц, а не общим весом.
Количественное значение молярной массы M и показатели относительного молекулярного веса остаются равными, но первый предел измеряется в г/моль или моль, а вторая записывается в молях. Константа Авогадро обеспечивает пропорциональность и позиционирует переход к молярному соотношению.
Для расчета количества структурных элементов используется понятие молярной массы. Оно означает массу, которую составляет 1 моль вещества и получается от произведения молекулярной массы на количественный состав молекул в моле (число Авогардо). Молярная масса, для измерения которой используется единица грамм/ ммоль, является аналогичной по числу с относительным весом нейтральных частиц.
Примеры отмеривания равных молекулярных пропорций:
- 1 моль воды соответствует 6 х 1023 молекул Н 2 О.
- 1 моль хлора — 6 х 1023 атомов Fe.
- 1 моль ионов хлора — 6 х 1023 ионов Cl.
- 1 моль хлора — 6 х 1023 молекул Cl 2.
- 1 моль электронов е— — 6 х 1023 электронов е—.
Разница между молярной и молекулярной массой заключается в том, что они одинаковы в численном соотношении, но отличаются постоянной размерностью. Используется суммирование молярных масс составляющих элементов смеси для нахождения этой величины у многокомпонентных соединений. Для расчета молярной массы воды применяется калькулятор: М (Н 2 О) = М (О) + М (Н) = (16 + 2.1) = 18 моль.
Показатель относительного веса
Относительная молекулярная масса представляет собой вес молекулы, который выражается в атомных единицах. В расчетах используются не абсолютные веса, а относительные, т. к. масса молекулы очень мала. Например, молекула воды весит 3.10~26 кг, и частицы остальных веществ имеют значения подобного порядка. Нахождение показателя можно провести онлайн в соответствии с международными стандартами, которые сравнивают массы структурных элементов с 1/12 долей веса углеродного атома.

Успешное решение задачи связывается с тем, что углекислый газ является компонентом различных химических веществ. Принимается, что 1 атомная единица (1 а. е. м) соответствует весу водородного атома. Относительный атомный вес рассчитывается как масса неделимой частицы, выраженная в атомных единицах, при этом значение показателя берется из таблицы Д. И. Менделеева.
Относительные молекулярные массы сложных соединений находятся суммированием аналогичных показателей веса составляющих компонентов. Для подсчета требуется знание химической формулы и значение относительных атомных масс входящих элементов.
Например, молекулярный вес метана СН 4 равен 16 а. е. м (4+12), значит, при горении вещества применяется формула 2О + СН 4 = СО 2 + 2Н 2 О. Из 1 моля метана выходит 2 единицы воды, при этом 16 г газа служит для получения 36 г воды (пропорциональное соответствие).
Химические реакции
При реакции горения метана на каждую молекулу вещества требуется использовать 2 частицы кислорода. Но в условиях открытого воздуха содержание кислорода всегда является достаточным для прохождения реакции. В ограниченных условиях подводных или космических работ требуется точное определение количества вещества и молекул реагентов. Например, если в топку космического агрегата попадает больше кислорода, чем требуется, то снижается тяга и перерасходуется топливо.
Примеры использования относительного веса в реакциях:
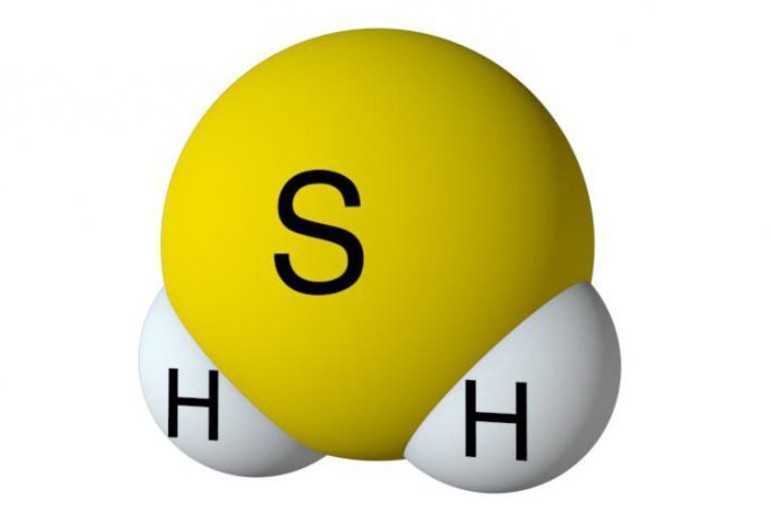
- Сероводород имеет формулу H 2 S. Молекулярная масса его частицы рассчитывается в виде суммы относительных масс атомов, являющихся компонентами M r (H 2 S) = A r (S) + 2· Ar (H). Для расчета молекулярной массы используется уравнение Mr (H 2 S) = 2х1+32 = 2+32 = 34.
- Гелий в нормальных обстоятельствах работает, как идеальный газ, поэтому значение молярной массы рассчитывается по формуле Клайперона — Менделеева pV = mRT /М, где p — давление газа, V — объем, M — масса субстанции, Т — значение абсолютной температуры, R — постоянная константа, составляет 8,3.
- Серная кислота применяется в виде двухосновной сильной кислоты H 2 SO 4. Она отвечает за степень серного окисления. В технических реакциях используется смесь с водой и ангидридом серы S О 3. Молярная масса составляет 98,08 ± 0,006 г/миллимоль.
Химики применяют такие пропорции взаимодействия, которые имеют в составе равное число молекул для удобства работы. Точность весов в лаборатории составляет 1 мг, поэтому получается, что 1 млн молекул не всегда удается взвесить. Значит, выбирается не миллион, а другая порция, в которой число n больше этого количества.
Подсчет количества элементов
Примером простой реакции, когда в результате взаимодействия двух продуктов образовывается третья субстанция, является формула А + Б = В. Остается решить весовое количество веществ А и Б, чтобы хватило для реагирования и не осталось исходных материалов, в ином случае продукт В будет загрязнен одним из начальных компонентов.
В качестве примера подходит реакция с участием кальция: Н 2 О + С а О = С а (ОН) 2. Если простейшие формы А и Б состоят из различных атомных наборов Н 2 О и С а О, которые отличаются по весу. Соответственно, в них содержится неодинаковое число частиц, при реакции часть из них не будет использована. Если берется пропорция С а О с содержанием N молекул и порция воды с N частиц, то после взаимодействия не останется никаких веществ и получится количество N молекул.

Отсчет невидимых молекул можно выполнить с помощью взвешивания вещества, для этого требуется вес одной частицы. На весы помещается определенное количество субстанции в граммах, чтобы отмерить требуемое число молекул. Для определения величины вещества в граммах требуется сложить вес составляющих атомов, показатели которых приводятся в периодической таблице.
Атомный вес кальция составляет 40 а. е. м, кислорода — 16 а. е. м, значит, молекулярный вес Са О будет 56 а. е. м. (40+16). Неудобно брать малые количества, например, по 10 молекул субстанции для проведения реакции, поэтому нужно взвесить по миллиону структурных частиц каждого компонента. Для этого высчитывается вес будущей порции, для удобства делается переход из килограммов в граммы, при этом вес 1 а. е. м составляет 1,67х10-24 г. Для подсчета веса умножается это число на 56, получается 56х (1,67-24г) = 93,5х10-24.
Чтобы получить вес, который должен быть на весах, полученный результат умножается на миллион молекул, возникает результат 93,5х10-18 г. При увеличении количества оксида кальция и воды в одинаковое число раз порции частиц возрастают пропорционально, например, 0,1 моль кальция прореагирует с 0,1 молем воды, увеличение кальция до 10 моль потребует повышения числа моль воды также до 10.
Константа Авогадро для газов
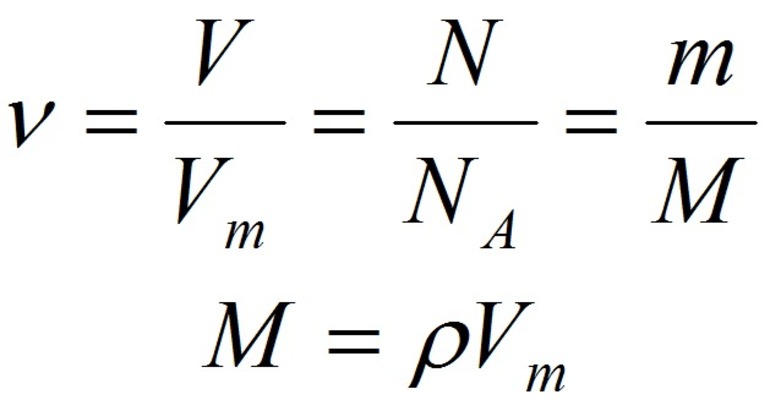
Закон Авогадро всегда точно выполняется как для газов в идеальном состоянии, так и для реальных газообразных смесей. Для последних субстанций понятие моля выражается в том, что любой объем газа всегда соответствует определенному количеству молекул. Примером служит реакция, где из аммиака и хлористого водорода выходит аммония хлорид в форме кристаллической твердой субстанции: NH 3 (газ) + HCL (газ) = NH 4 CL (крист.).
Для реагирования требуются одинаковые объемы газообразных веществ, т. к. после окончания реакции не должно оставаться избытка:
- В результате проведения опыта в замкнутом пространстве выяснилось, что при взрыве нужно 2 части водорода и одна порция кислорода, при этом получается 2 объема водяных паров в газовой консистенции О 2 + 2Н 2 = 2Н 2 О (все субстанции в виде газа).
- Одна порция водорода при реакции с 1 частью хлора преобразовывается в хлористый водород Cl 2 + H 2 = 2 HCL (все компоненты в газообразной форме).
Выводом из этого эксперимента следует то, что газы вступают в реакцию, и требуется объемные отношения с применением целочисленных показателей. Частицы в газе не связываются прочными контактами в отличие от атомов твердых субстанций. Занимаемый объем в похожих условиях зависит от количества молекул, но не от определенного типа газа. Исходя из этого положения, равные объемы газообразных субстанций всегда реагируют друг с другом без остатка.
nauka.club
Урок 5. Моль и молярная масса – HIMI4KA
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.


Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.


Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).


Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
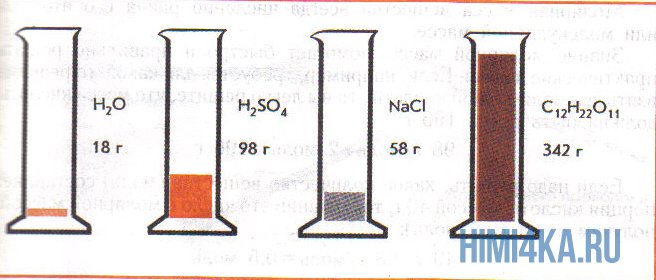
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.

Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:


Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
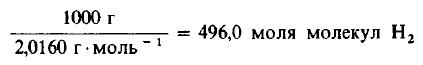
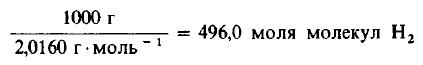
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
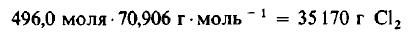
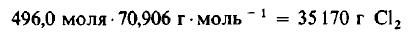
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Количество вещества в химии
Количество вещества в химии (моли):
Формулы в химии определяют, из чего состоит вещество. Сейчас мы научимся определять, в каких количествах эти вещества присутствуют в соединениях.
Количество вещества — это, по сути, количество наименьших частиц (или структурных единиц), из которых состоит вещество. Наименьшие частицы — это либо атомы (Fe) (в них только один элемент), либо молекулы (H2O) (из разных элементов).
Количество вещества в химии выражают через (это греческая буква «ню», которая похожа на английскую «v», только с закругленными вершинами).
Даже в крупице вещества молекул миллиарды, поэтому все их не считают, а используют специальные единицы измерения — моли.
1 моль — это количества вещества равное 6,02*1023 структурных единиц вещества. Именно столько (6,02*1023) молекул, например, в одном моле воды или сахара или чего-либо еще.
Как видите, это очень-очень много — миллиард, умноженный на миллиард, еще на 100 000 и на 6!!! Если взять такое количество однокопеечных монет и выложить ими всю поверхность Земли (а также все моря и океаны), то получится слой толщиной в 1 км!
Редактировать этот урок и/или добавить задание и получать деньги постоянно* Добавить свой урок и/или задания и получать деньги постоянноДобавить новость и получить деньги
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
uchilegko.info