Валентность мышьяка (As), формулы и примеры
Общие сведения о валентности мышьяка
Мышьяк существует в виде нескольких аллотропных модификаций. Наиболее устойчив при обычных условиях металлический (серый) мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность 5,72 г/см3. При нагревании под нормальным давлением серый мышьяк сублимируется. Обладает металлической электрической проводимостью.
При быстром охлаждении пара, состоящего из молекул As4, образуется неметаллическая модификация желтый мышьяк. Плотность 2,0 г/см3. При действии света или слабом нагревании переходит в серый мышьяк.
Валентность мышьяка в соединениях
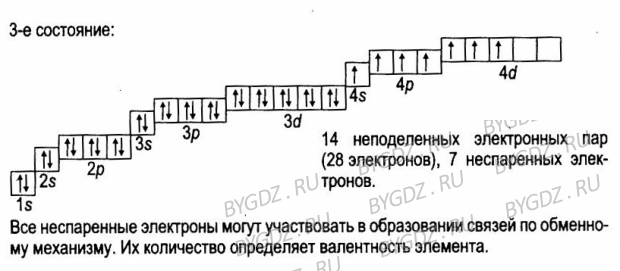
Мышьяк – тридцать третий по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VA группе. В ядре атома мышьяка содержится 33 протона и 42 нейтрона (массовое число равно 75). В атоме мышьяка есть четыре энергетических уровня, на которых находятся 33 электрона (рис.
Рис. 1. Строение атома мышьяка.
Электронная формула атома мышьяка в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
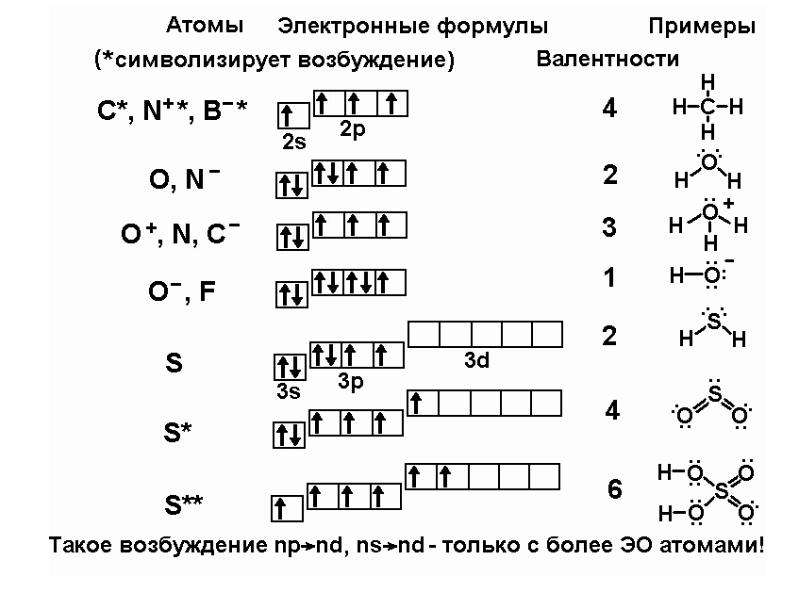
Наличие трех неспаренных электронов свидетельствует о том, что мышьяк способен проявлять валентность III (низшая валентность) в своих соединениях (As2O3, AsH3, HAsO2, H3AsO3).
Для атома мышьяка характерно наличие возбужденного состояния из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Электроны 4 s-подуровня распариваются и занимают свободную орбиталь 4p -подуровня:
Наличие пяти неспаренных электронов в возбужденном состоянии свидетельствует о том, что мышьяк также проявляет в своих соединениях валентность V (H3AsO4, As2O5) (высшая валентность).
Примеры решения задач
Сурьма валентность — Справочник химика 21
Фосфор, мышьяк или сурьма (имеющие электронное строение внешнего энергетического уровня s pЗ и проявляющие валентность 5), будучи введенными в кристаллические решетки германия или олова (электронное строение внешнего уровня 5 р валентность 4) ведут себя как донорные примеси, т. е. отдают электроны и создают проводимость п-типа. Если же в германий или кремний ввести бор, алюминий, галлий или индий (электронное строение внешнего уровня 5 р, валентность 3), то атомы примеси захватывают четвертый электрон и полупроводник обнаруживает проводимость р-типа.Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5.
 Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455] Аноды. Растворимые аноды (из металлического хрома) при хромировании применять нецелесообразно, так как хром растворяется на аноде с ббльшим выходом по току, чем осаждается на катоде, хром с анодов переходит в раствор в виде ионов различной валентности и из-за хрупкости хромовые аноды трудно поддаются механической обработке, а следовательно, им не всегда можно придать нужную форму. Вследствие этого применяют нерастворимые аноды преимущественно из свинца или сплава свинца с сурьмой ( 6%). Прй этом на аноде происходит выделение кислорода и окисление Сг +. [c.421]
[c.421]
К элементам подгруппы азота относятся азот, фосфор, мышьяк, сурьма и висмут. Во внешнем электронном слое атомов этих элементов имеется по 5 электронов они обладают восстановительными и окислительными свойствами. Они могут терять различное число электронов, проявляя в соединениях соответствующую положительную валентность от 1 до 5. В соединениях высшей валентности проявляются ковалентные связи.
Какие степени окисления наиболее характерны для элементов подгруппы мышьяка Как изменяется устойчивость валентных состояний в ряду мышьяк, сурьма, висмут [c.194]
Это сходство с металлами указывает, что валентные электроны в германии не связаны с атомами столь прочно, как можно было бы ожидать для настоящего ковалентного каркасного кристалла. Мыщьяк, сурьма и селен существуют в одних модификациях в виде молекулярных кристаллов, а в других модификациях — в виде металлических кристаллов, хотя атомы в их металлических структурах имеют относительно низкие координационные числа. Известно, что теллур кристаллизуется в металлическую структуру, но довольно вероятно, что он может также существовать в виде молекулярного кристалла. Положение астата в периодической таблице заставляет предположить наличие у него промежуточных свойств, однако этот элемент еще не исследован подробно. [c.607]
Известно, что теллур кристаллизуется в металлическую структуру, но довольно вероятно, что он может также существовать в виде молекулярного кристалла. Положение астата в периодической таблице заставляет предположить наличие у него промежуточных свойств, однако этот элемент еще не исследован подробно. [c.607]
В механизме проводимости полупроводников важную роль играют примеси, даже при очень малом их содержании. В зависимости от химической природы атомов примесей, их валентности и характера размещения в кристалле, в полупроводнике может возникнуть избыток свободных электронов или дырок и в соответствии с этим будет преобладать электронная или дырочная проводимость. Добавляя к кристаллу примесные атомы элементов пятой группы периодической системы (мышьяк, сурьму, фосфор), можно получить полупроводник с преобладающей электронной проводимостью. Рассмотрим, например, кристалл германия, в котором один из атомов замещен атомом фосфора.
Галоидирование. Катализаторы, наиболее часто применяющиеся для хлорирования металлическое железо, окись меди, бром, сера, иод, галоиды железа, сурьмы, олова, мышьяка, фосфора, алюминия и меди растительный и животный уголь, активированный боксит и другие глины. Большинство этих катализаторов является носителями галоидов. Так, Fe, Sb и Р в галоидных соединениях способны существовать в двух валентных состояниях в присутствии свободного хлора они поочередно присоединяют и отдают хлор в активной форме. Аналогично иод, бром и сера образуют с хлором неустойчивые соединения. Катализаторы броми-рования подобны катализаторам хлорирования. Для иодирования наилучшим ускорителем служит фосфор. Для проведения процесса фторирования катализатор не требуется. В присутствии кислорода галоидирование замедляется. [c.329]
Фосфор, мышьяк, сурьма и висмут образуют стехиометрические соединения, отвечающие формальной валентности, только с s-элементами и d-элементами подгруппы цинка.
Сколько электронов во внешних электронных оболочках сурьмы, фосфора и мышьяка, если валентность каждого из них равна V [c.43]
Больщинство известных химических элементов, находясь в виде простых веществ, представляют собой металлы. Некоторые элементы (германий, мышьяк, сурьма, алюминий) в одних условиях ведут себя как металлы, в других условиях — как неметаллы. Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
Каталитическое хлорирование основано на применении переносчика хлора, такого как йод [2], сера [3], фосфор, сурьма и другие, в виде соответствующих хлоридов, которые растворяются в хлорируемом углеводороде или прн хлорировании газообразных парафиновых углеводородов — в растворителе.
Введение в кристаллический кремний примесных атомов фосфора, имеющих по пять валентных электронов, также нарушает энергетическую однородность кристалла. В этих условиях каждый атом фосфора уже при сообщении ему энергии порядка 4,4 кДж/моль способен ионизироваться, перебрасывая один из своих электронов в зону проводимости и превращаясь в положительно заряженный ион. Аналогично ведут себя в кристаллах кремния и германия примесные атомы мышьяка, сурьмы и золота, обычно называемые донорными примесями. Для получения полупроводника с определенной концентрацией носителей (электронов или дырок) необходимо, чтобы количество собственных переносчиков тока в кристалле было примерно на два порядка ниже.
Бромноватокислый калий иногда применяется для титрования грех-валентного мышьяка или сурьмы, особенно когда они получаются в с льно [c.393]
Известно, что, чем больше валентных электронов приходится на атом металлического твердого вещества, тем выше температура его кипения. Исходя из этого, расположите в ряд по возрастающей температуре кипения калий, кальций, сурьму, хром. Проверьте ваш ряд по данным справочника. [c.110]
При возбуждении s-электронов внешнего слоя все три элемента могут проявлять валентность, равную пяти. Для возбуждения, однако, необходима затрата большого количества энергии. В силу этого пятивалентное состояние этих элементов неустойчиво. Поэтому мышьяк, сурьма и висмут в пятивалентном состоянии проявляют свойства окислителен. Особенно сильно выражены окислительные свойства у соединений пятивалентного висмута. [c.188]
Осаждение сульфидов 3- и 5-валентных сурьмы и особенно мышьяка необходимо вести в сильно кислой среде. Последняя необходима для с.мещения равновесий [c.191]
Последняя необходима для с.мещения равновесий [c.191]
Возможны случаи, когда зоны разрешенных энергий перекрываются лишь в малой степени. Благодаря такому перекрытию электроны переходят из зоны в зону, и их число в зоне проводимости, рсак и число свободных мест в валентной зоне, оказывается отличным от нуля (см. рис. 7.6, г). Такие вещества называются полуметаллами. Они обладают свойствами как металлов (при Т = Ь К они имеют отличную от нуля электронную проводимость), так и полупроводников (с ростом температуры (при низких температурах) их электропроводность возрастает). Примерами полуметаллов могут служить сурьма, висмут. [c.138]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ.
 Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157] Наряду с собственными большое распространение получили также полупроводники примесного типа. В них основное число переносчиков тока — электронов или дырок — поставляют введенные в собственный полупроводник специальные примеси, энергетические уровни которых располагаются между валентными зонами и зонами проводимости полупроводника. Так, при введении в кристалл германия так называемых донорных примесей, как, например, фосфора, мышьяка, сурьмы, электроны последних переходят в зону проводимости полупроводника, резко увеличивая в ней число электронов — переносчиков тока (п-про-водимость). При добавлении к германию акцепторных примесей типа бора, алюминия, индия электроны валентной зоны полупроводника переходят на свободные уровни зоны примесей, что увеличивает число дырок (р-проводимость) в валентной зоне. [c.77]
При добавлении к германию акцепторных примесей типа бора, алюминия, индия электроны валентной зоны полупроводника переходят на свободные уровни зоны примесей, что увеличивает число дырок (р-проводимость) в валентной зоне. [c.77]
Доноры. Предположим, что один из атомов германия замещен атомом элемента V группы, например сурьмой (рис. 28, а). Тогда в валентной зоне полупроводника должен появиться один лишний [c.125]
Соединения с кислородом. С кислородом мышьяк, сурьма и висмут образуют различные соединения. Наибольшее значение из них имеют соединения, в которых они проявляют валентности 5 и 3, т. е. соединения типа R Os и RoO [c.545]
Фосфор, мышьяк, сурьма и висмут составляют главную подгруппу V группы. Наружный энергии ческий уровень характеризуется электронной конфигурацией ns np , поэтому в невозбужденном состоянии элементы подгруппы азота имеют валентность 3. [c.212]
Таким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов и валентность их в этом состоянии равна 5. [c.215]
[c.215]
Атомы сурьмы и висмута образуют ромбоэдрическую решетку с координационным числом 3 + 3. Они обладают внешней электронной конфигурацией 5s 5p и 6s 6p соответственно. Перекрывание орбиталей р-электронов обусловливает ковалентные связи атомов сурьмы и висмута в твердом состоянии. При плавлении происходит отделение всех валентных электронов, вследствие чего эти элементы приобретают свойства металлов, а их структура становится более плотной. [c.183]
Детальный анализ химических свойств сурьмы тоже не дал возможности окончательно убрать ее из раздела ни то, ни се . Внешний, электронный слой атома сурьмы состоит из пяти валентных электронов Три из них (р-электроны) — неспаренные и два (я-электроны) — спаренные. Первые легче отрываются от атома и определяю т характерную для сурьмы валентность 3-[-. При проявле- [c.9]
Для атома теллура, имеющего шесть валентных электронов, координационное число шесть реализуется уже в октаэдрической молекуле ТеРб- Реализация этого же координационного числа у атома сурьмы (пять электронов) возможна лишь при объединении октаэдров в цепной полимер состава Sbp5. Для олова (четыре электрона) это возможно лишь при образовании слоистого полимера состава Snp4 (см. рис. 177). И наконец, для индия (три электрона) — при образовании трехмерного полимера состава InFg (см. рис. 71). [c.114]
Для олова (четыре электрона) это возможно лишь при образовании слоистого полимера состава Snp4 (см. рис. 177). И наконец, для индия (три электрона) — при образовании трехмерного полимера состава InFg (см. рис. 71). [c.114]
В хлорной воде присоединение хлора идет достаточно медленно для того, чтобы почти количественно образовывался этиленхлоргидрин (см. стр. 370). Реакции олефинов с хлором и бромом в жидкой фазе идут обычно исключительно быстро 130], и применение растворителя, как правило, сказывается благоприятно. Этилен легко хлорируется при низких температурах в дихлорэтаповом растворе, как это применяется в промышленности. Хлориды элементов, образующих с хлором соединения высшей и низшей валентностей, как сурьма, железо, селен, являются эффективными катализаторами присоединения хлора к этилену. Присутствие полярных веществ можот катализировать присоединение галоидов например, реакция брома с этиленом в гааовой фазе сильно ускоряется, если стенки реактора покрыты стеариновой кислотой, но скорость реакции приближается к нулю, если стенки покрыты парафином [64]. Степень замещения хлором при реакции олефинов с хлором, как показано в табл. 3, поразительно велика [80]. Реакция замещения часто сопровождается перемещением двойной связи. [c.364]
Степень замещения хлором при реакции олефинов с хлором, как показано в табл. 3, поразительно велика [80]. Реакция замещения часто сопровождается перемещением двойной связи. [c.364]
В большинстве случаев галоидирование ускоряется под действием светового облучения (длина волны 3000—5000 А) или высокой температуры (в присутствии катализатора или без него). В качестве катализаторов обычно применяют галоидные соединения металлов, имеющих два валентных состояния, способные отдавать атомы галоидов при переходе из одного валентного состояния в другое, — P I5, P I3, Fe lg. Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Числом электронов наружной оболочки определяются валентные состояния, свойственные данному элементу, а следовательно, типы его соединений — гидридов, окислов, гидроокисей, солей и т. д. Так, в наружных оболочках атомов фосфора, мышьяка, сурьмы и висмута находится одинаковое число (пять) электронов.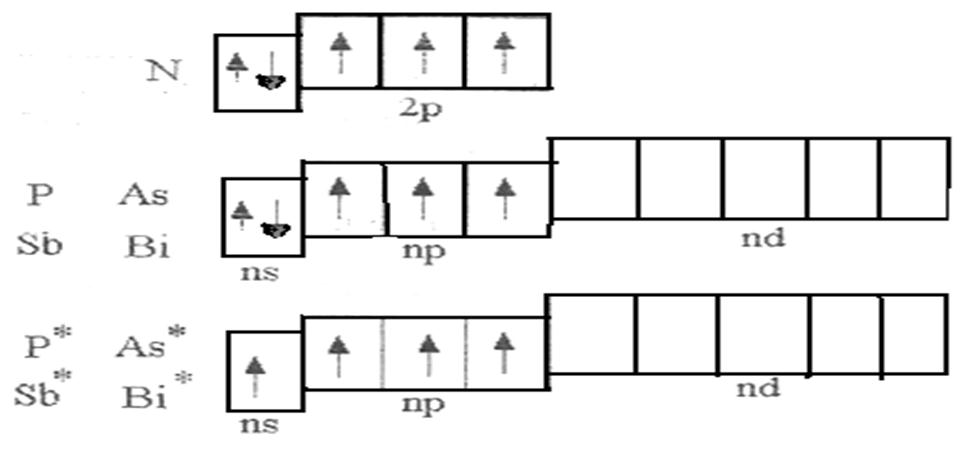 Этим определяется одинаковость их основных валентных состояний (—3, -fЗ, -Ь5), однотипность гидридов ЭНз, окислов Э2О3 и ЭаОб, гидроокисей и т. д. Данное обстоятельство в конечном счете и является причиной того, что указанные элементы располагаются в одной подгруппе периодической системы. [c.42]
Этим определяется одинаковость их основных валентных состояний (—3, -fЗ, -Ь5), однотипность гидридов ЭНз, окислов Э2О3 и ЭаОб, гидроокисей и т. д. Данное обстоятельство в конечном счете и является причиной того, что указанные элементы располагаются в одной подгруппе периодической системы. [c.42]
Катализаторы окисления и окислительного аммонолиза олефинов. Катализаторы процессов окисления и окислительного аммонолиза пропилена и изобу-тнлена представляют собой многокомпонентные смеси окислов элементов переменной валентности В , Мо, V, 5Ь, Ре, VV и др. [46, 70, 71 ]. Наиболее эффективны молибдаты и фосформолибдаты висмута, композиции олово—сурьма, железо— сурьма и др. [c.416]
Конденсированные арены образуют твердые комплексы и с хлоридом сурьмы(III) в среде хлороформа или четыреххлористого углерода [140], с трифторметансульфонатом одновалентной меди [141] или серебра [142]. Для выделения моноциклических аренов в виде твердых комплексов предложены соединения типа М(А1Х4)п, где М = Си, Ag, 5п, РЬ и другие металлы X = С1, Вг п — валентность металла [143]. [c.72]
[c.72]
Атомы элементов главной подгруппы V группы периодической системы имеют во внешних электронных оболочках 5 электронов. В соответствии с этим для азота и его аналогов должны быть характерны отрицательная валентность —3 и высшая положительная валентность 4-5. Однако если предположение о высшей положительной валентности, равной +5, в полной мере обосновано для аналогов азотафосфора, мышьяка — сурьмы и висмута, то для самого азота оно может быть принято лишь условно. В самом деле, свою высшую положительную валентность элементы проявляют обычно в соедине- [c.77]
Каково валентное состояние сурьмы в соли (Nh5)2Sb l6, если эта соль диамагнитна Какие ионы входят в состав кристаллической (и, возможно, жидкой соли) [c.67]
К УА-подгруппе элементов таблицы Д. И. Менделееза относятся типические элементы — азот N. фосфор Р и элементы подгруппы мь шьяка — мышьяк Аз, сурьма 5Ь, внсмут В1. Валентными у них являются з /р -электроны [c. 303]
303]
V группа, главная подгрупп а азот, фосфор, мышьяк, сурьма, висмут. Атомы этих элементов имеют на внешнем уровне по пять электронов из которых неспарены только три р-электрона. Такому состоянию соответствует степень окисления элементов —3, например в гидридах ЭНд. При возбуждении атомов происходит разъединение -электронов и один из них переходит на -подуровень (за исключением атомов азота, не имеющих внешних -подуровней). Валентных электронов становится пять, они находятся в состоянии 5 -возбуждения, которому соответствует степень окисления элементов в соединениях +5. [c.232]
Число электронов наружной оболочки и энергия связи их с ядром определяют химические свойства атомов. Так, три электрона лития неравноценны. Один из этих электронов связан с ядром атома слабее двух других, так как расположен дальше от ядра, чем первые два электрона. Этот электрон участвует в образовании химической связи поэтому называется валентным. Числом электронов наружной оболочки определяются валентные состояния, характерные для данного элемента, типы его соединений — гидридов, окислов, гидратов солей и т. д. Это можно проследить на любой группе элементов периодической системы. Известно, что в наружных оболочках атома азота, фосфора, мышьяка, сурьмы, висмута находится по пять электронов. Этим определяются их одинаковые, валентные состояния (—3, +3, +5), однотипность гидридов ЭНз,, окислов Э2О3 и ЭаОз и т. д. и, ггаконец, то, что все указанные эле-, менты находятся в одной группе периодической системы. [c.18]
д. Это можно проследить на любой группе элементов периодической системы. Известно, что в наружных оболочках атома азота, фосфора, мышьяка, сурьмы, висмута находится по пять электронов. Этим определяются их одинаковые, валентные состояния (—3, +3, +5), однотипность гидридов ЭНз,, окислов Э2О3 и ЭаОз и т. д. и, ггаконец, то, что все указанные эле-, менты находятся в одной группе периодической системы. [c.18]
Элементы азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi составляют VA группу Периодической системы. Валентный уровень атомон отвечает электронной форму.ме ns np . Азот—третий по электроотрицательности неметал.1 (ш)сле фтора и кислорода) судя по электроотрицательности, фосфор и мышьяк — неметаллы, сурьма — типичне>1Й амфотерный элемент, а у висмута иреобладгют металлические свойства. Элементы VA группы образуют соединения и степенях окисления от (-III) до (+V), характерные степени окисления ( П1) и ( + V). [c.206]
Сурьма и висмут образуют сплавы с большинством металлов.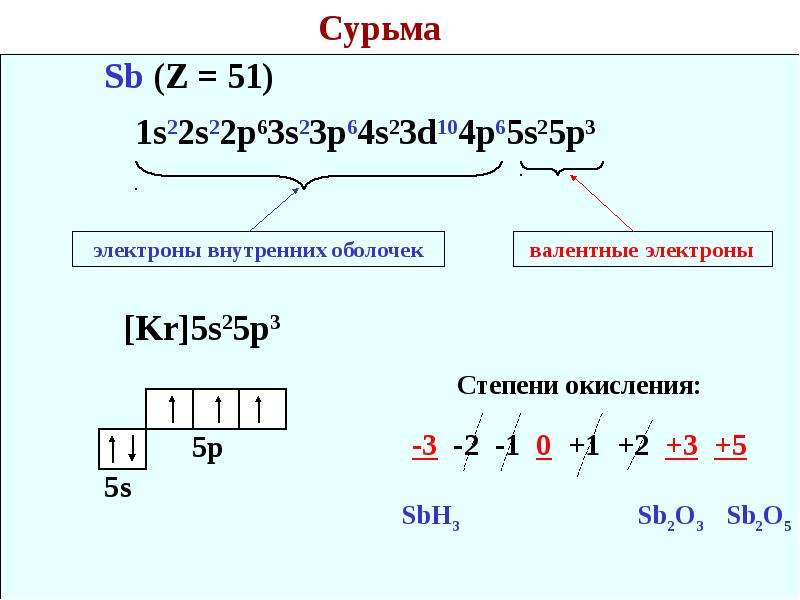 В сплавах сурьмы с активными металлами (шелочными, щелочноземельными) образуются соединения, состав которых соответствует определенным валентным отношениям. Эти соединения, называемые стиби-дами, например МазЗЬ, СэзЗЬг и т. п., по свойствам напоминают карбиды, силиды, фосфиды активных металлов. В частности, при действии кислот они разлагаются с образованием гидрида (стибина) [c.212]
В сплавах сурьмы с активными металлами (шелочными, щелочноземельными) образуются соединения, состав которых соответствует определенным валентным отношениям. Эти соединения, называемые стиби-дами, например МазЗЬ, СэзЗЬг и т. п., по свойствам напоминают карбиды, силиды, фосфиды активных металлов. В частности, при действии кислот они разлагаются с образованием гидрида (стибина) [c.212]
мониторинг обученности учащихся 11 класса (профильный уровень) по теме «Строение атома»
МОНИТОРИНГ ОБУЧЕННОСТИ УЧАЩИХСЯ 11 КЛАССА
(профильный уровень) по теме «Строение атома»
Работа проводится в конце изучения данной темы. Время выполнения работы – 40 минут.
Тесты составлены согласно информации об УМК (учебниках), программах и наполняемости классов общеобразовательного учреждения.
Учебник: Габриелян О.С. и др. – Химия 11 класс. Профильный уровень — М.: Дрофа, 2007
Основные темы, по которым проверяются знания учащихся:
Состав и строение атома.

Изотопы.
Электронные конфигурации атомов.
Валентность и валентные возможности атомов.
Степень окисления.
Периодический закон и периодическая система химических элементов Д.И.Менделеева.
Периодическая система и свойства элементов.
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
Вычисление объемных отношений газов.
10)Вычисление массы раствора в результате реакции.
11А и 11Б класс. Количество обучающихся – ____, 3 часа в неделю.
Правильный ответ на тест группы А оценивается в 1 балл, всего 10 заданий, группы В – 2 балла, всего 3 задания, группы С – С1 – 3 балла, С2 – 2 балла, С3 – 4 балла.
Оценка «удовлетворительно» — 8 – 15 баллов
«хорошо» — 16 — 21 баллов
«отлично» — 22 – 25 баллов
Литература:
1) Доронькин В. Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. – Тематические тесты для подготовки к ЕГЭ-2013. Базовый и повышенный уровень – изд: Легион, 2013
Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. – Тематические тесты для подготовки к ЕГЭ-2013. Базовый и повышенный уровень – изд: Легион, 2013
2) Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. – Тематические тесты для подготовки к ЕГЭ-2013. Задания высокого уровня сложности. – изд: Легион, 2013
3) Габриелян О.С., Остроумов И.Г., Введенская А.Г. – общая химия в тестах, задачах, упражнениях. 11 класс – учебное пособие для общеобразовательных учреждений. – М.: Дрофа, 2003
Номер задания
Тема
Уровень сложности
А1
Состав и строение атома
Базовый
А2
Изотопы
Базовый
А3
Электронные конфигурации атомов химических элементов
Базовый
А4
Периодическая система химических элементов
Базовый
А5
Изменение радиусов атомов в ПСХЭ
Базовый
А6
Изменение металлических и неметаллических свойств в ПСХЭ
Базовый
А7
Изменение окислительно-восстановительных свойств в ПСХЭ
Базовый
А8
Электроотрицательность
Базовый
А9
Степень окисления
Базовый
А10
Валентность и валентные возможности атомов
Базовый
В1
Степень окисления
Повышенный
В2
Валентность и степень окисления
Повышенный
В3
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
Повышенный
С1
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
повышенный
С2
Вычисление объемных отношений газов.
Повышенный
С3
Вычисление массы раствора в результате реакции.
Высокий
Вариант 1
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 65Zn равна:
30 2) 65 3) 35 4) 40
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
Ва 2) Mg 3) Ca 4) Sr
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов селена равны соответственно
4, 6 2) 3, 6 3) 4, 7 4) 3, 7
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
B, C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
У какого элемента наиболее выражены металлические свойства
Li 2) Fe 3) Na 4) Na
Наибольшей восстановительной активностью обладает
Са 2) К 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
N 2) S 3) Br 4) O
Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
Rb, Ca, Li 2) H, Si, F 3) Cl, I, Br 4) As, N, Te
Валентность III характерна для
Са 2) Р 3) О 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
При взаимодействии с концентрированной серной кислотой 128 г меди выделяется газ объемом _______л (н.у.). (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
К раствору массой 180 г с массовой долей уксусной кислоты 20% прибавили карбонат калия. Вычислите объем (н.у.) выделившегося газа.
Сколько литров воздуха (н.у.) требуется для сжигания 89,6л водорода?
Оксид натрия массой 43,4г растворили в 300 мл воды. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Вариант 2
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 31Р равна
15 2) 16 3) 46 4) 31
Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
3. Электронная формула 1s22s22p63s23p6 соответствует частице
Электронная формула 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4. Число энергетических слоев и число электронов во внешнем энергетическом слое атома хрома равны соответственно
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
5. Химические элементы расположены в порядке возрастания их атомных
радиусов в ряду
K, Rb, Cs 2) Rb, Sr, In 3) Al, Na, Mg 4) O, S, Cl
6. Металлические свойства элементов в ряду Ge – As – Se – Br:
1) усиливаются 3) ослабевают
2) не изменяются 4) изменяются периодически
7. Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4) Cl
8. Наименьшую электроотрицательность имеет элемент
1) N 2) S 3) Cl 4) O
9. Все элементы в каком ряду могут проявлять степень окисления + 5?
1) P, N, Cl 2) C, Se, F 3) O, B, I 4) Br, As, Sn
10. Верны ли следующие утверждения?
Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б. Высшая валентность элемента определяется номером периода.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
Запишите это число
в текст работы без указания единиц измерения.
40,5 г алюминия растворили в избытке водного раствора едкого натра. Объем (н.у.) выделившегося газа равен ________л. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
25 мл 34%-ной соляной кислоты плотностью 1,16 г/мл добавили к оксиду марганца (IV). Какой объем хлора (н.у.) выделится?
Рассчитайте объем воздуха (н.у.) необходимый для полного сжигания сероводорода объемом 8,96 л.
Железо растворили в растворе соляной кислоты объемом 400 мл (ρ=1,1 г/мл) с массовой долей хлороводорода 20%. Определите массовую долю образовавшейся соли в растворе.
Вариант 3
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 40К равна
40 2) 39 3) 20 4) 21
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
число электронов на внешнем энергетическом уровне атома фосфора в возбужденном состоянии равно
3 2) 5 3) 2 4) 4
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
Ga, Ce, As 2) Al, Ga, Ge 3) As, P, Ge 4) Se, As, Ge
В ряду Na – Mg – Al – Si неметаллические свойства:
Усиливаются 3) ослабевают
Не изменяются 4) изменяются периодически
Наименьшей восстановительной активностью обладает
Ca 2) K 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
Na 2) Li 3) Rb 4) K
Все элементы в каком ряду могут проявлять степени окисления – 3 и + 5?
Al, Ca, Li 2) B, Sb, Bi 3) Cl, I, Br 4) As, N, P
Валентность III характерна для
Be 2) F 3) Al 4) C
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой _______г.
 (Запишите число с точностью до целых).
(Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какой объем 15%-ного раствора хлороводорода плотностью 1,075 г/мл пойдет на нейтрализацию гидроксида кальция массой 59,2 г?
Рассчитайте объем воздуха (н.у.) необходимый для окисления 5 л оксида углерода (II).
Для полного осаждения ионов железа (III) в виде Fe(OH)3 из раствора массой 100 г с массовой долей хлорида железа (III) 20% необходим раствор гидроксида натрия массой 14,77 г. Определите массовую долю хлорида натрия в растворе.
Вариант 4
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 14С равна
14 2) 12 3) 13 4) 15
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Фосфид-иону соответствует электронная формула
1s22s22p63s23p6 3) 1s22s22p6
1s22s22p63s23p4 4) 1s22s22p63s23p2
У атома кальция число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
4, 20 2) 2, 20 3) 4, 40 4) 2, 40
У атома какого элемента радиус атома наибольший?
Кремния 2) германия 3) олова 4) свинца
У какого элемента наиболее выражены металлические свойства?
K 2) Rb 3) Cs 4) Sr
Наибольшей восстановительной активностью обладает
Br 2) As 3) Ga 4) Ge
Среди элементов IVА группы наиболее электроотрицательным является
Si 2) Ge 3) C 4) Sn
Все элементы в каком ряду могут проявлять степень окисления – 3?
Ga, Al, Be 2) C, Se, F 3) S, Br, In 4) P, N, Sb
Верны ли следующие утверждения?
А. высшая валентность элемента определяется числом неспаренных электронов в возбужденном состоянии и способностью элемента образовывать связь по донорно-акцепторному механизму.
высшая валентность элемента определяется числом неспаренных электронов в возбужденном состоянии и способностью элемента образовывать связь по донорно-акцепторному механизму.
Б. высшая валентность элемента определяется числом неспаренных электронов.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) HNO3 1) + 2
Б) N2O4 2) + 3
B) (NH4)2CO3 3) + 4
Г) KNO2 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
Запишите это число
в текст работы без указания единиц измерения.
Объем хлороводорода (н.у.), необходимый для получения 17,7 г хлоропрена при взаимодействии с винилацетиленом, равен _____л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Оксид меди (II) обработали 80 мл 5%-ного раствора серной кислоты (ρ=1,03 г/мл). определите массу полученной соли.
Какой объем воздуха необходим для окисления оксида серы (IV) объемом 6,72 л?
Для полного растворения оксида меди (II) количеством вещества 2,5 моль использован раствор серной кислоты массой 500 г. Определите массовую долю сульфата меди (II) в полученном растворе.
Вариант 5
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Число электронов в атоме аргона равно числу электронов в ионе
Р3- 2) Si4+ 3) Mg2+ 4) F—
Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
Химическому элементу соответствует оксид состава R2О3. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
какую электронную конфигурацию имеет атом наиболее активного металла?
…4s24p2 2) …4s1 3) …5s1 4) …5s25p2
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
Zn, Cd, Ca 2) Br, Cl, F 3) In, Sn, Sb 4) Br, Se, As
В ряду Mg → Si → P → S
Увеличивается число энергетических уровней в атомах
Усиливаются металлические свойства элементов
Уменьшается высшая степень окисления элементов
Ослабевают металлические свойства элементов
В ряду оксидов SiO2 – P2O5 – SO3 – Cl2O7 кислотные свойства
Возрастают 3) не изменяются
Убывают 4) сначала уменьшаются, потом увеличиваются
В ряду В – Al – As – Sr электроотрицательность
Возрастает 3) не изменяется
Уменьшается 4) изменяется периодически
Наибольшую степень окисления железо проявляет в соединении
K4[Fe(CN)6] 2) K3[Fe(CN)6] 3) FeO 4) Fe(OH)2
Валентность III характерна для
О 2) In 3) Mg 4) Se
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления
железа.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) Fe2O3 1) + 6
Б) NaFeO2 2) + 3
B) K2FeO4 3) + 4
Г) K4[Fe(CN)6] 4) + 2
5) 0
6) – 2
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Масса бромной воды, массовая доля брома в которой 2%, необходимая для взаимодействия с 1,12 л бутена, равна _____г.
 (Запишите число с точностью до целых).
(Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите объем метана (н.у.), который может быть получен из 18 г карбида алюминия, содержащего 20% примесей.
Рассчитайте объем воздуха (н.у.) необходимый для сжигания 15 л ацетилена.
Определите объем серного газа, который необходимо растворить в воде объемом 300 мл для получения раствора с массовой долей серной кислоты 20%.
Вариант 6
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 12С равна
14 2) 18 3) 6 4) 12
Электронные конфигурации двух изотопов:
Одинаковы
Различны
Могут быть одинаковы или различны в зависимости от элемента
Отличаются на определенное число электронов
Химический элемент, формула высшего оксида которого R2О7, имеет электронную конфигурацию атома:
1s22s22p63s1 3) 1s22s22p63s23p64s1
1s22s22p63s23p5 4) 1s22s22p3
Число энергетических слоев и число электронов во внешнем энергетическом слое атома мышьяка равны соответственно
4, 6 2) 2, 5 3) 3, 7 4) 4, 5
У какого из элементов радиус атома минимальный
Mg 2) Na 3) Si 4) Al
Наиболее ярко выражены металлические свойства у элемента:
Калия 2) кальция 3) магния 4) натрия
Наиболее сильно выражены окислительные свойства у элемента:
Германия 2) селена 3) брома 4) мышьяка
У атома какого элемента электроотрицательность наибольшая?
Кремния 2) олова 3) германия 4) свинца
Все элементы в каком ряду могут проявлять степени окисления – 2 и + 6?
Tl, Ca, Sn 2) S, Se, Te 3) Si, Sb, Te 4) C, O, P
Максимальная валентность атома серы в возбужденном состоянии равна:
2 2) 4 3) 5 4) 6
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Найдите массу осадка, выделяющегося при пропускании 448 л углекислого газа (н.у.) через избыток раствора известкового молока.
 Ответ____кг. (Запишите число с точностью до целых).
Ответ____кг. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите массу фенолята натрия, который образуется при взаимодействии избытка фенола с 50 г 12%-ного раствора гидроксида натрия.
Рассчитайте объем воздуха, необходимый для сжигания 30 л оксида азота (II).
В воде объемом 500 мл растворили металлический натрий массой 34,5 г. Определите массовую долю гидроксида натрия в растворе.
Вариант 7
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 24Mg равна
24 2) 12 3) 30 4) 17
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронная формула атома химического элемента 1s22s22p63s23p64s23d3.
 Этот элемент называется:
Этот элемент называется:
Ванадий 2) скандий 3) галлий 4) мышьяк
Из данных элементов минимальный радиус атома имеет:
Бор 2) углерод 3) кремний 4) азот
Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
Ba, Cd, Ra 2) In, Pb, Sb 3) Cs, Na, H 4) Br, Se, As
У какого элемента наиболее выражены металлические свойства
Бериллия 2) алюминия 3) кальция 4) стронция
В главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
Увеличении числа энергетических уровней
Увеличении числа протонов в ядре
Уменьшении радиуса атомов
Увеличении числа валентных электронов
Наибольшую электроотрицательность имеет элемент
Кальций 2) мышьяк 3) селен 4) бром
Верны ли следующие утверждения?
А. каждый химический элемент имеет единственную степень окисления, равную номеру группы.
каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. количество валентных состояний и степеней окисления элемента определяется его природой и положением в периодической системе.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
10. Валентность IV характерна для
1) Ca 2) P 3) O 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
Запишите это число
в текст работы без указания единиц измерения.
Кремний прокипятили в 200 г 40%-ного раствора едкого натра. Приведенный к нормальным условиям объем газообразного продукта реакции равен _____л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какая масса йода выделится при взаимодействии 350 г раствора с массовой долей 50% с необходимым количеством хлора?
Рассчитайте объем воздуха (н.у.), необходимый для горения 20л аммиака?
В воде объемом 400 мл растворили металлический кальций массой 6 г. Определите массовую долю гидроксида кальция в растворе.
Вариант 8
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Одинаковое число протонов и нейтронов содержится в атоме
Железа-56 2) йода-126 3) кобальта-58 4) углерода-12
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Заряд ядра атома элемента + 83. Электронная конфигурация валентных электронов:
…6s26p3 2) 6s25d3 3) 6s24f3 4) 6s26p1
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов цинка равны соответственно
2, 2 2) 4, 1 3) 3, 2 4) 4, 2
Химические элементы расположены в порядке увеличения их атомных радиусов в ряду
Zn, Ca, Cd 2) F, Cl, Br 3) In, Sn, Sb 4) As, Se, Br
Простые вещества расположены в порядке усиления металлических свойств в ряду
Ca, K, Al 2) Al, Ga, Sr 3) Ca, Sc, Ti 4) Cr, Mn, Fe
Основные свойства оксидов усиливаются в ряду
Na2o, MgO, Al2O3 3) Al2O3, MgO, Na2O
MgO, Al2O3, Na2O 4) Al2O3, Na2O, MgO
В каком ряду элементы расположены в порядке возрастания электроотрицательности?
C, Mg, Be 2) Ga, Al, Fe 3) Cl, Br, S 4) P, N, O
Все элементы в каком ряду могут проявлять степень окисления + 2?
Cl, S, Br 2) Ga, Al, Fe 3) C, Mg, Be 4) P, O, C
Чему равна максимальная валентность атома мышьяка?
1 2) 3 3) 5 4) 7
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Объем хлороводорода (н.у.), который потребуется для реакции с 186 г анилина, равен ______л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите массу 10%-ного раствора гидроксида натрия, который необходим для реакции с 42,3 г фенола.
Рассчитайте объем воздуха (н.у.), необходимый для каталитического окисления аммиака объемом 5 л.
Железо полностью растворили в растворе соляной кислоты объемом 400 мл (ρ= 1,1 г/мл), с массовой долей хлороводорода 15%. Определите массовую долю образовавшейся соли.
Вариант 9
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 65Zn равна:
30 2) 65 3) 35 4) 40
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
Ва 2) Mg 3) Ca 4) Sr
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов селена равны соответственно
4, 6 2) 3, 6 3) 4, 7 4) 3, 7
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
B, C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
У какого элемента наиболее выражены металлические свойства
1)Li 2) Fe 3) Na 4) Na
Наибольшей восстановительной активностью обладает
1)Са 2) К 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
1)N 2) S 3) Br 4) O
Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1)Rb, Ca, Li 2) H, Si, F 3) Cl, I, Br 4) As, N, Te
Валентность III характерна для
1)Са 2) Р 3) О 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
При взаимодействии с концентрированной серной кислотой 128 г меди выделяется газ объемом _______л (н.у.). (Запишите число с точностью до целых).

Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
К раствору массой 180 г с массовой долей уксусной кислоты 20% прибавили карбонат калия. Вычислите объем (н.у.) выделившегося газа.
Сколько литров воздуха (н.у.) требуется для сжигания 89,6л водорода?
Оксид натрия массой 43,4г растворили в 300 мл воды. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Вариант 10
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 31Р равна
2) 16 3) 46 4) 31
2. Изотопами являются:
Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
3. Электронная формула 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4. Число энергетических слоев и число электронов во внешнем энергетическом слое атома хрома равны соответственно
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
5. Химические элементы расположены в порядке возрастания их атомных
радиусов в ряду
K, Rb, Cs 2) Rb, Sr, In 3) Al, Na, Mg 4) O, S, Cl
6. Металлические свойства элементов в ряду Ge – As – Se – Br:
1) усиливаются 3) ослабевают
2) не изменяются 4) изменяются периодически
7. Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4) Cl
8. Наименьшую электроотрицательность имеет элемент
1) N 2) S 3) Cl 4) O
9. Все элементы в каком ряду могут проявлять степень окисления + 5?
Все элементы в каком ряду могут проявлять степень окисления + 5?
1) P, N, Cl 2) C, Se, F 3) O, B, I 4) Br, As, Sn
10. Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б. Высшая валентность элемента определяется номером периода.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
Запишите это число
в текст работы без указания единиц измерения.
40,5 г алюминия растворили в избытке водного раствора едкого натра. Объем (н.у.) выделившегося газа равен ________л. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
25 мл 34%-ной соляной кислоты плотностью 1,16 г/мл добавили к оксиду марганца (IV). Какой объем хлора (н.у.) выделится?
Рассчитайте объем воздуха (н.у.) необходимый для полного сжигания сероводорода объемом 8,96 л.
Железо растворили в растворе соляной кислоты объемом 400 мл (ρ=1,1 г/мл) с массовой долей хлороводорода 20%. Определите массовую долю образовавшейся соли в растворе.
Вариант 11
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 40К равна
40 2) 39 3) 20 4) 21
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
число электронов на внешнем энергетическом уровне атома фосфора в возбужденном состоянии равно
1)3 2) 5 3) 2 4) 4
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1)Ga, Ce, As 2) Al, Ga, Ge 3) As, P, Ge 4) Se, As, Ge
В ряду Na – Mg – Al – Si неметаллические свойства:
Усиливаются 3) ослабевают
Не изменяются 4) изменяются периодически
Наименьшей восстановительной активностью обладает
1)Ca 2) K 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
1)Na 2) Li 3) Rb 4) K
Все элементы в каком ряду могут проявлять степени окисления – 3 и + 5?
1)Al, Ca, Li 2) B, Sb, Bi 3) Cl, I, Br 4) As, N, P
Валентность III характерна для
1)Be 2) F 3) Al 4) C
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой _______г.
 (Запишите число с точностью до целых).
(Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какой объем 15%-ного раствора хлороводорода плотностью 1,075 г/мл пойдет на нейтрализацию гидроксида кальция массой 59,2 г?
Рассчитайте объем воздуха (н.у.) необходимый для окисления 5 л оксида углерода (II).
Для полного осаждения ионов железа (III) в виде Fe(OH)3 из раствора массой 100 г с массовой долей хлорида железа (III) 20% необходим раствор гидроксида натрия массой 14,77 г. Определите массовую долю хлорида натрия в растворе.
КЛЮЧИ
Часть А и В.
Номер задания
Вариант 1
Вариант 2
Вариант 3
Вариант 4
Вариант 5
Вариант 6
Вариант 7
Вариант 8
Вариант 9
Вариант 10
Вариант 11
А1
2
3
1
1
1
2
1
4
2
3
1
А2
2
4
1
2
4
1
2
1
2
4
1
А3
3
2
2
1
1
2
1
1
3
2
2
А4
1
2
2
2
3
4
4
4
1
2
2
А5
2
1
4
4
4
3
3
2
2
1
4
А6
3
3
1
2
4
1
4
2
3
3
1
А7
2
1
4
3
1
3
3
3
2
1
4
А8
4
2
2
3
2
1
4
4
4
2
2
А9
3
1
4
4
2
2
2
3
3
1
4
А10
2
1
3
1
2
4
4
3
2
1
3
В1
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
I3в
II2a
III1б
I3в
II2а
III1б
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
В2
5312
6314
5312
4362
2214
5312
6314
5312
5312
6314
5312
В3
45
50
1050
4,5
400
2
44,8
44,8
45
50
1050
Часть С.
Вариант 1.
С1. Дано: Решение:
m(p-pa CH3COOH)= 180 г 2СН3СООН + К2СО3 = 2СН3СООК + Н2О + СО2
w(CH3COOH) = 20% m(CH3COOH) = m(p-pa) * w = 180 г * 0,2 = 36 г
Найти: n(CH3COOH) = m/M = 36 г/60 г/моль = 0,6 моль
V(CO2) — ? по уравнению реакции n(CO2) = 1/2n(CH3COOH)
= 0,3 моль
V(CO2) = n*Vm = 0,3 моль * 22,4 л/моль = 6,72 л
Ответ: V(CO2) = 6,72 л
С2. Дано: Решение:
V(H2) = 89,6 л 2Н2 + О2 = 2Н2О
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(H2) = 44,8 л
Cодержание кислорода в воздухе φ(О2) = 21%
V(возд.) = V(O2) / φ(O2) = 44,8 л/0,21 = 213,3 л
Ответ: V(возд. ) = 213, 3 л
) = 213, 3 л
С3. Дано: Решение:
m(Na2O) = 43,4 г Na2O + H2O = 2NaOH
V(H2O) = 300 мл n(Na2O) = m/M = 43,4 г/62 г/моль = 0,7 моль
Найти: по уравнению реакции n(NaOH) = 2n(Na2O) =
w(NaOH) — ? = 1,4 моль
m(NaOH) = n*M = 1,4 моль * 40 г/моль = 56 г
m(p-pa) = m(Na2O) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 43,4 г = 343,4 г
w = m(в-ва)/m(p-pa) = 56 г/343,4 г = 0,163=16,3%
Ответ: w(NaOH) = 16,3%
Вариант 2.
С1. Дано: Решение:
V(p-pa HCl) = 25 мл 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
w(HCl) = 34% m(p-pa) = V*ρ = 25 мл * 1,16 г/мл = 29 г
ρ = 1,16 г/мл m(HCl) = m(p-pa) * w(HCl) = 29 г * 0,34 = 9,66 г
Найти: n(HCl) = m/M = 9,66 г/36,5 г/моль = 0,27 моль
V(Cl2) — ? по уравнению реакции n(Cl2) = 1/4n(HCl) =
= 0,675 моль
V(Cl2) = n * Vm = 0,675 моль * 22,4 л/моль =
= 1,51 л
Ответ: V(Cl2) = 1,51 л
С2. Дано: Решение:
Дано: Решение:
V(H2S) = 8,96 л 2H2S + 3O2 = 2SO2 + 2H2O
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/2V(H2S) = 13,44 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 13,44 л/0,21 = 64 л
Ответ: V(возд.) = 64 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
w(HCl) = 20% m(p-pa) = V * ρ = 400 мл * 1, 1 г/мл = 440 г
ρ = 1,1 г/мл m(HCl) = m(p-pa) * w(HCl) = 440 г * 0,2 = 88 г
Найти: n(HCl) = m/M = 88 г/36,5 г/моль = 2,41 моль
w(FeCl2) — ? по уравнению реакции n(FeCl2) = n(H2) =
n(Fe) = 1/2n(HCl) = 1,205 моль
m = n * M
m(Fe) = 1,205 моль * 56 г/моль = 67,48 г
m(FeCl2) = 1,205 моль * 127 г/моль = 153,035 г
m(H2) = 1,205 моль * 2 г/моль = 2,41 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 67,48 г + 440 г – 2,41 г = 505,07 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 153,035 г/505,07 г
= 0,303 = 30,3%
Ответ: w(FeCl2) = 30,3 %
Вариант 3.
С1. Дано: Решение:
w(HCl) = 15% 2HCl + Ca(OH)2 = CaCl2 + 2H2O
ρ = 1,075 г/мл n(Ca(OH)2) = m/M = 59,2 г/74 г/моль = 0,8 моль
m(Ca(OH)2) = 59,2 г по уравнению реакции n(HCl) = 2n(Ca(OH)2) =
Найти: = 1,6 моль
V(p-pa HCl) — ? m(HCl) = n * M = 1,6 моль * 36,5 г/моль =
= 58,4 г
m(p-pa) = m(HCl) / w(HCl) = 58,4 г/0,15 = 389,33 г
V(p-pa HCl) = m/ρ= 389,33 г/1,075 г/мл=362,17 мл
Ответ: V(p-pa HCl) = 362,17 мл
С2. Дано: Решение:
V(CO) = 5л 2СО + О2= 2CO2
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(CO) = 2,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 2,5 л/0,21 = 11,905 л
Ответ: V(возд.) = 11,905 л
С3. Дано: Решение:
m(p-pa FeCl3) = 100 г FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
w(FeCl3) = 20% m(FeCl3) = m(p-pa) * w = 100 г * 0,2 = 20 г
m(NaOH) = 14,77 г n(FeCl3) = m/M = 20 г/162,5 г/моль = 0,123 моль
Найти: по уравнению реакции n(Fe(OH)3) = n(FeCl3) =
w(NaCl) — ? = 0,123 моль
по уравнению реакции n(NaCl) = 3n(FeCl3) =
= 0,369 моль
m = n * M
m(Fe(OH)3) = 0,123 моль * 107 г/моль = 13,161 г
m(NaCl) = 0,369 моль * 58,5 г/моль = 21,59 г
m(p-pa) = m(p-pa FeCl3) + m(NaOH) – m(Fe(OH)3)
m(p-pa) = 100 г + 14,77 г – 13,161 г = 101,609 г
w(NaCl) = m(NaCl)/m(p-pa) = 21,59 г/101,609 г =
= 0,212 = 21,2%
Ответ: w(NaCl) = 21,2%
Вариант 4.
С1. Дано: Решение:
V(p-pa H2SO4) = 80 мл CuO + H2SO4 = CuSO4 + H2O
ρ = 1,03 г/мл m(p-pa) = V * ρ = 80 мл * 1,03 г/мл = 82,4 г
w(H2SO4) = 5% m(H2SO4) = m(p-pa) * w(H2SO4) =
Найти: = 82,4 г * 0,05 = 4,12 г
m(CuSO4) — ? n(H2SO4) = m/M = 4,12 г/98 г/моль = 0,042 моль
по уравнению реакции n(CuSO4) = n(H2SO4) =
= 0,042 моль
m(CuSO4) = n * M = 0,042 моль * 160 г/моль =
= 6,72 г
Ответ: m(CuSO4) = 6,72 г
С2. Дано: Решение:
V(SO2) = 6,72 л 2SO2 + O2 = 2SO3
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(SO2) = 3,36 л
Содержание кислорода в воздухе 21%
V(возд. ) = V(O2)/φ(O2) = 3,36 л/0,21 = 16 л
) = V(O2)/φ(O2) = 3,36 л/0,21 = 16 л
Ответ: V(возд.) = 16 л
С3. Дано: Решение:
n(CuO) = 2,5 моль CuO + H2SO4 = CuSO4 + H2O
m(p-pa H2SO4) = 500 г m(CuO) = n * M = 2,5 моль * 80 г/моль = 200 г
Найти: по уравнению реакции n(CuSO4) = n(CuO) =
w(CuSO4) — ? = 2,5 моль
m(CuSO4) = n * M = 2,5 моль * 160 г/моль =
= 400 г
m(p-pa) = m(CuO) + m(p-pa H2SO4) = 200 г + 500 г
= 700г
w(CuSO4) = m(CuSO4)/m(p-pa) = 400 г/700 г =
= 0,5714 = 57,14%
Ответ: w(CuSO4) = 57,14%
Вариант 5.
С1. Дано: Решение:
m(Al4C3 техн.) = 18 г Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
w(примесей) = 20% w(Al4C3) = 100 – 20 = 80%
Найти: m(Al4C3) = m(Al4C3техн. ) * w = 18 г * 0,8 = 14,4г
) * w = 18 г * 0,8 = 14,4г
V(CH4) — ? n(Al4C3) = m/M = 14,4 г/144 г/моль = 0,1 моль
По уравнению реакции n(CH4) = 3n(Al4C3) =
= 0,3 моль
V(CH4) = Vm * n = 22,4 л/моль * 0,3 моль = 6,72 л
Ответ: V(CH4) = 6,72 л
С2. Дано: Решение:
V(C2H2) = 15 л 2С2Н2 + 5О2 = 4CO2 + 2H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 5/2V(C2H2) = 37,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 37,5 л/0,21 = 178,57 л
Ответ: V(возд.) = 178,57 л
С3. Дано: Решение:
V(H2O) = 300 мл SO3 + H2O = H2SO4
w(H2SO4) = 20% пусть n(SO3) = x моль
Найти: по уравнению реакций n(H2SO4) = n(SO3) =
V(SO3) — ? = x моль
m = n * M
m(SO3) = 80x г; m(H2SO4) = 98x г
m(p-pa) = m(SO3) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 80х г
w(H2SO4) = m(H2SO4)/m(p-pa)
0,2 = 98x/300+80x
x = 0,7317 моль
V(SO3) = Vm * n = 22,4 л/моль * 0,7317 моль =
= 16,39 л
Ответ: V(SO3) = 16,39 л
Вариант 6.
С1. Дано: Решение:
m(p-pa NaOH) = 50 г C6H5OH + NaOH = C6H5ONa + H2O
w(NaOH) = 12% m(NaOH) = m(p-pa NaOH) * w(NaOH) =
Найти: = 50 г * 0,12 = 6 г
m(C6H5ONa) — ? n(NaOH) = m/M = 6 г /40 г/моль = 0,15 моль
по уравнению реакций n(C6H5ONa) = n(NaOH)=
= 0,15 моль
m(C6H5ONa) = n * M = 0,15 моль * 116 г/моль =
= 17,4 г
Ответ: m(C6H5ONa) = 17,4 г
С2. Дано: Решение:
V(NO) = 30 л 2NO + O2 = 2NO2
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(NO) = 15 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 15 л/0,21 = 71,43 л
Ответ: V(возд.) = 71,43 л
С3. Дано: Решение:
V(H2O) = 500 мл 2Na + 2H2O = 2NaOH + H2
m(Na) = 34,5 г n(Na) = m/M = 34,5 г/23 г/моль = 1,5 моль
Найти: по уравнению реакции n(NaOH) = n(Na) =
w(NaOH) — ? = 1,5 моль
n(H2) = 1/2n(Na) = 0,75 моль
m = n * M
m(NaOH) = 1,5 моль * 40 г/моль = 60 г
m(H2) = 0,75 моль * 2 г/моль = 1,5 г
w(NaOH) = m(NaOH)/m(p-pa)
m(p-pa) = m(Na) + m(H2O) – m(H2)
ρ(H2O) = 1 г/мл
m(H2O) = 500 г
m(p-pa) = 34,5 г + 500 г – 1,5 г = 533 г
w(NaOH) = 60 г/533 г = 0,1126 = 11,26%
Ответ: w(NaOH) = 11,26 %
Вариант 7.
С1. Дано: Решение:
m(p-pa KI) = 350 г 2KI + Cl2 = 2KCl + I2
w(KI) = 50% m(KI) = m(p-pa KI)*w(KI) = 350 г * 0,5 = 175 г
Найти: n(KI) = m/M = 175 г/166 г/моль = 1,054 моль
m(I2) — ? по уравнению реакции n(I2)=1/2n(KI)= 0,527 моль
m(I2) = n * M = 0,527 моль * 254 г/моль=133,858 г
Ответ: m(I2) = 133,858 г
С2. Дано: Решение:
V(NH3) = 20 л 4NH3 + 3O2 = 2N2 + 6H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/4V(NH3) = 15 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 15 л/0,21 = 71,43 л
Ответ: V(возд.) = 71,43 л
С3. Дано: Решение:
m(Ca) = 6 г Ca + 2H2O = Ca(OH)2 + H2
V(H2O) = 400 мл n(Ca) = m/M = 6 г/40 г/моль = 0,15 моль
Найти: по уравнению реакции n(Ca(OH)2) = n(Ca) =
w(Ca(OH)2) — ? = 0,15 моль
n(H2) = n(Ca) = 0,15 моль
m = n * M
m(Ca(OH)2) = 0,15 моль * 74 г/моль = 11,1 г
m(H2) = 0,15 моль * 2 г/моль = 0,3 г
ρ(Н2О) = 1 г/мл
m(H2O) = 400 г
m(p-pa) = m(Ca) + m(H2O) – m(H2) = 6г + 400 г –
— 0,3 г = 405,7 г
w(Ca(OH)2) = m(Ca(OH)2)/m(p-pa) =
= 11,1 г/405,7 г = 0,0274 = 2,74%
Ответ: w(Ca(OH)2) = 2,74%
Вариант 8.
С1. Дано: Решение:
m(C6H5OH) = 42,3 г С6Н5ОН + NaOH = C6H5ONa + H2O
w(NaOH) = 10% n(C6H5OH) = m/M = 42,3 г/94 г/моль = 0,45 моль
Найти: по уравнению реакции n(NaOH) = n(C6H5OH) =
m(p-pa NaOH) — ? = 0,45 моль
m(NaOH) = n * M = 0,45 моль * 40 г/моль =
= 18 г
m(p-pa) = m(NaOH)/w = 18 г/0,1 = 180 г
Ответ: m(p-pa) = 180 г
С2. Дано: Решение:
V(NH3) = 5 л 4NH3 + 5O2 = 4NO + 6H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 5/4V(NH3) = 6,25 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(H2O) = 6,25 л/0,21 = 29,762 л
Ответ: V(возд.) = 29,762 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
ρ(p-pa HCl) = 1,1 г/мл m(p-pa HCl) = V * ρ = 400мл * 1,1 г/мл = 440 г
w(HCl) = 15% m(HCl) = m(p-pa HCl) * w(HCl) = 440 г * 0,15 =
Найти: = 66 г
w(FeCl2) — ? n(HCl) = m/M = 66 г/36,5 г/моль = 1,808 моль
по уравнению реакции n(Fe) = n(FeCl2) =
= n(H2) = 1/2n(HCl) = 0,904 моль
m = n * M
m(Fe) = 0,904 моль * 56 г/моль = 50,624 г
m(FeCl2) = 0,904 моль * 127 г/моль = 114,808 г
m(H2) = 0,904 моль * 2 г/моль = 1,808 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 50,624 г + 440 г – 1,808 г = 488,816 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 114,808 г/488,816г
= 0,2349 = 23,49%
Ответ: w(FeCl2) = 23,49%
Вариант 9.
С1. Дано: Решение:
m(p-pa CH3COOH)= 180 г 2СН3СООН + К2СО3 = 2СН3СООК + Н2О + СО2
w(CH3COOH) = 20% m(CH3COOH) = m(p-pa) * w = 180 г * 0,2 = 36 г
Найти: n(CH3COOH) = m/M = 36 г/60 г/моль = 0,6 моль
V(CO2) — ? по уравнению реакции n(CO2) = 1/2n(CH3COOH)
= 0,3 моль
V(CO2) = n*Vm = 0,3 моль * 22,4 л/моль = 6,72 л
Ответ: V(CO2) = 6,72 л
С2. Дано: Решение:
V(H2) = 89,6 л 2Н2 + О2 = 2Н2О
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(H2) = 44,8 л
Cодержание кислорода в воздухе φ(О2) = 21%
V(возд.) = V(O2) / φ(O2) = 44,8 л/0,21 = 213,3 л
Ответ: V(возд. ) = 213, 3 л
) = 213, 3 л
С3. Дано: Решение:
m(Na2O) = 43,4 г Na2O + H2O = 2NaOH
V(H2O) = 300 мл n(Na2O) = m/M = 43,4 г/62 г/моль = 0,7 моль
Найти: по уравнению реакции n(NaOH) = 2n(Na2O) =
w(NaOH) — ? = 1,4 моль
m(NaOH) = n*M = 1,4 моль * 40 г/моль = 56 г
m(p-pa) = m(Na2O) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 43,4 г = 343,4 г
w = m(в-ва)/m(p-pa) = 56 г/343,4 г = 0,163=16,3%
Ответ: w(NaOH) = 16,3%
Вариант 10.
С1. Дано: Решение:
V(p-pa HCl) = 25 мл 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
w(HCl) = 34% m(p-pa) = V*ρ = 25 мл * 1,16 г/мл = 29 г
ρ = 1,16 г/мл m(HCl) = m(p-pa) * w(HCl) = 29 г * 0,34 = 9,66 г
Найти: n(HCl) = m/M = 9,66 г/36,5 г/моль = 0,27 моль
V(Cl2) — ? по уравнению реакции n(Cl2) = 1/4n(HCl) =
= 0,675 моль
V(Cl2) = n * Vm = 0,675 моль * 22,4 л/моль =
= 1,51 л
Ответ: V(Cl2) = 1,51 л
С2. Дано: Решение:
Дано: Решение:
V(H2S) = 8,96 л 2H2S + 3O2 = 2SO2 + 2H2O
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/2V(H2S) = 13,44 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 13,44 л/0,21 = 64 л
Ответ: V(возд.) = 64 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
w(HCl) = 20% m(p-pa) = V * ρ = 400 мл * 1, 1 г/мл = 440 г
ρ = 1,1 г/мл m(HCl) = m(p-pa) * w(HCl) = 440 г * 0,2 = 88 г
Найти: n(HCl) = m/M = 88 г/36,5 г/моль = 2,41 моль
w(FeCl2) — ? по уравнению реакции n(FeCl2) = n(H2) =
n(Fe) = 1/2n(HCl) = 1,205 моль
m = n * M
m(Fe) = 1,205 моль * 56 г/моль = 67,48 г
m(FeCl2) = 1,205 моль * 127 г/моль = 153,035 г
m(H2) = 1,205 моль * 2 г/моль = 2,41 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 67,48 г + 440 г – 2,41 г = 505,07 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 153,035 г/505,07 г
= 0,303 = 30,3%
Ответ: w(FeCl2) = 30,3 %
Вариант 11.
С1. Дано: Решение:
w(HCl) = 15% 2HCl + Ca(OH)2 = CaCl2 + 2H2O
ρ = 1,075 г/мл n(Ca(OH)2) = m/M = 59,2 г/74 г/моль = 0,8 моль
m(Ca(OH)2) = 59,2 г по уравнению реакции n(HCl) = 2n(Ca(OH)2) =
Найти: = 1,6 моль
V(p-pa HCl) — ? m(HCl) = n * M = 1,6 моль * 36,5 г/моль =
= 58,4 г
m(p-pa) = m(HCl) / w(HCl) = 58,4 г/0,15 = 389,33 г
V(p-pa HCl) = m/ρ= 389,33 г/1,075 г/мл=362,17 мл
Ответ: V(p-pa HCl) = 362,17 мл
С2. Дано: Решение:
V(CO) = 5л 2СО + О2 = 2CO2
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(CO) = 2,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 2,5 л/0,21 = 11,905 л
Ответ: V(возд.) = 11,905 л
С3. Дано: Решение:
m(p-pa FeCl3) = 100 г FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
w(FeCl3) = 20% m(FeCl3) = m(p-pa) * w = 100 г * 0,2 = 20 г
m(NaOH) = 14,77 г n(FeCl3) = m/M = 20 г/162,5 г/моль = 0,123 моль
Найти: по уравнению реакции n(Fe(OH)3) = n(FeCl3) =
w(NaCl) — ? = 0,123 моль
по уравнению реакции n(NaCl) = 3n(FeCl3) =
= 0,369 моль
m = n * M
m(Fe(OH)3) = 0,123 моль * 107 г/моль = 13,161 г
m(NaCl) = 0,369 моль * 58,5 г/моль = 21,59 г
m(p-pa) = m(p-pa FeCl3) + m(NaOH) – m(Fe(OH)3)
m(p-pa) = 100 г + 14,77 г – 13,161 г = 101,609 г
w(NaCl) = m(NaCl)/m(p-pa) = 21,59 г/101,609 г =
= 0,212 = 21,2%
Ответ: w(NaCl) = 21,2%
Что такое мышьяк? — Мышьяк
Что такое мышьяк?
Мышьяк (As) — это элемент, что означает, что это химическое вещество, которое нельзя разложить на более простые химические вещества (поэтому это не соединение или молекула, состоящая из других элементов).
- Элементы в одном и том же столбце обычно имеют схожие свойства, поэтому мышьяк имеет сходство с фосфором (P), который является частью молекул ДНК (см. клетки.Мышьяк может попасть в клеточную транспортную систему для P. .
- Мышьяк имеет атомный номер 33. Это означает, что у него 33 протона в ядре и 33 электрона, вращающихся вокруг ядра, когда оно не заряжено.
Молекулярная масса мышьяка равна 75, поэтому один моль атомов мышьяка имеет массу 75 грамм.
Мышьяк является металлоидом, что означает, что он имеет некоторые общие характеристики с металлами, а некоторые — с неметаллами.
- Металлы являются хорошими проводниками электричества, но проводимость падает с повышением температуры. Неметаллы не проводят электричество.
 Элементы, которые не очень хорошо проводят электричество, но все же могут это делать, и которые лучше проводят электричество при более высоких температурах, находятся между этими группами и называются металлоидами. Так как эти соединения плохо проводят электричество, их еще называют полупроводниками.Полупроводники широко используются в электронной промышленности.
Элементы, которые не очень хорошо проводят электричество, но все же могут это делать, и которые лучше проводят электричество при более высоких температурах, находятся между этими группами и называются металлоидами. Так как эти соединения плохо проводят электричество, их еще называют полупроводниками.Полупроводники широко используются в электронной промышленности. - Биологические молекулы состоят в основном из неметаллов, таких как углерод (C), водород (H), кислород (O), азот (N), сера (S) и фосфор (P), хотя металлы необходимы во многих меньшие суммы.
Нас в основном интересует мышьяк из-за его токсичности . Токсичные химические вещества предотвращают или влияют на процессы, необходимые для жизни. Они каким-то образом останавливают или изменяют функцию, необходимую для жизни животного, человека или растения.Мышьяк является очень сильным токсином.
- Мощный означает, что он оказывает сильное воздействие даже в очень малых количествах, поэтому небольшое количество мышьяка может нанести большой ущерб.

- Около 100 мг As достаточно, чтобы убить взрослого человека – это примерно 1/20 часть чайной ложки!
Мышьяк является природным соединением. Он содержится в земной коре (внешнем твердом слое, на котором мы живем) в концентрации около 2-5 частей на миллион. Это 20-й самый распространенный элемент на Земле.
- Таким образом, на каждый миллион граммов земной коры приходится от 2 до 5 граммов As.
- Иными словами, это как 2-5 гран соли на полстакана сахара или 2-5 капель лимонада на 13-галлонную бочку воды.
Мышьяк распределен неравномерно, поэтому в некоторых местах концентрация мышьяка намного выше, а в других ниже. Мышьяк часто связан с добываемыми минеральными рудами, такими как медь, золото и цинк. Концентрации мышьяка также высоки в горячих источниках и других геотермальных источниках.
- На картинке слева изображена шахта, а на картинке справа — возле выхода из горячего источника. Оранжевый цвет у кромки воды — это место, где образовался осадок с высоким содержанием мышьяка
Несмотря на свою токсичность, мышьяк используется во многих целях, в том числе в медицине (верьте или нет!), сельском хозяйстве, производстве стекла, в качестве консерванта для древесины и в электронной промышленности. Это обсуждается далее в разделе «Откуда берется мышьяк».
Это обсуждается далее в разделе «Откуда берется мышьяк».
Мышьяк может существовать в различных формах.Органические формы мышьяка связаны с органическим углеродом.
- Биологические молекулы, такие как белки, ДНК и липиды, составляющие ваше тело, основаны на углероде.
- Они называются органическими молекулами и включают все углеродсодержащие молекулы, кроме диоксида углерода (CO 2 ) или угольной кислоты (H 2 CO 3 ). Органический углерод показан зеленым цветом ниже.
Мышьяк может входить в состав органических соединений, таких как монометиларсоновая кислота (CH 3 AsO(OH) 2 ), арсенобетаин ((CH 3 ) 3 As + CH 2 2 ) (CH 3 ) 3 As + CH 2 CH 2 OH) и Paris Green (Cu(CH 4 COO) 2 .3Cu(AsO 2 ) 2 ).
Неорганические формы мышьяка включают многие твердые минералы, такие как аурипигмент (As 2 S 3 ) и арсенопирит (FeAsS). Существуют также растворимые неорганические формы, такие как мышьяковистая кислота (H 3 AsO 3 ) и мышьяковая кислота (H 3 AsO 4 ), которые представляют собой опасные соединения в питьевой воде. Мышьяковистая кислота имеет валентное состояние +3, что может быть записано как As(III), а мышьяковая кислота представляет собой As(V) с валентным состоянием +5.
Существуют также растворимые неорганические формы, такие как мышьяковистая кислота (H 3 AsO 3 ) и мышьяковая кислота (H 3 AsO 4 ), которые представляют собой опасные соединения в питьевой воде. Мышьяковистая кислота имеет валентное состояние +3, что может быть записано как As(III), а мышьяковая кислота представляет собой As(V) с валентным состоянием +5.
Состояние валентности:
- Валентное состояние описывает, сколько связей может образовать атом. Связи образуются между элементами, когда они обмениваются или обмениваются одним или несколькими электронами. Вы можете думать об общих валентных электронах в ковалентной связи как о клее, который скрепляет элементы в молекуле. Они показаны линиями на структурной диаграмме мышьяковистой кислоты. Предполагается наличие связей между атомами О и Н.
- Теперь вернемся к валентности: кислород имеет валентность -2 (за исключением молекулярного кислорода O 2 , где его валентность равна 0).
 Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1.
Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1. - Если вы добавите валентности каждого атома в молекулярной формуле мышьяковистой кислоты, H 3 AsO 3 , вы увидите, что незаряженная молекула имеет общее валентное состояние 0 (3x(+1) для атомов водорода; 1x(+3) для атома мышьяка(III); 3x(-2) для атомов кислорода = 3+3-6=0).Если вы посмотрите на структуру молекулы, то увидите, что As образует связь с каждым атомом кислорода, и каждый атом кислорода также связывается с атомом водорода своим другим валентным электроном.
- В мышьяковой кислоте мышьяк имеет валентность +5, поэтому в дополнение к трем связям, которые он образует с ОН-группами, он также образует двойную связь с оставшимся атомом кислорода в формуле.
 Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода.Если вы сложите валентные состояния всех атомов в молекуле, вы снова должны получить 0, .
Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода.Если вы сложите валентные состояния всех атомов в молекуле, вы снова должны получить 0, .
Мышьяковая кислота и мышьяковистая кислота являются формами, которые обычно встречаются в воде, хотя они могут терять часть своих атомов H + в зависимости от pH.
- pH — это шкала, которая измеряет кислотность раствора. Ионы водорода (H + ) представляют собой кислотные группы, а pH — это шкала, которая показывает, сколько H + содержится в растворе.
- Растворы с низким pH (менее 7, что является нейтральным) являются кислыми.Чем ниже опускаешься, тем кислее, тем выше концентрация ионов Н + в растворе.
- Растворы с высоким pH являются щелочными.
 Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .
Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – . - В воде, если умножить молярные концентрации H + и OH – , они всегда равны 1×10 -14 . Это означает, что при высокой концентрации H + концентрация OH – должна быть низкой, и наоборот.
Если мышьяковая кислота или любая другая кислота в этом отношении теряет протон (H + ), оставшаяся часть молекулы имеет отрицательный заряд. При близком к нейтральному рН, обычном для природных вод, мышьяковая кислота теряет один или два иона H + , придавая остальной части молекулы заряд –1 или –2 (H 2 AsO 4 – или HAsO 4 2-).
- Примечание: на этот раз, если вы сложите валентные состояния всех атомов, вы должны получить –1 для H 2 AsO 4 – и –2 для HAsO 4 2- .

Мышьяковистая кислота остается в основном незаряженной до тех пор, пока pH не поднимется примерно до 9. Выше этого pH она начнет терять ионы H + .
Разница в заряде при нормальном рН окружающей среды означает, что две формы ведут себя по-разному в окружающей среде.
Отрицательно заряженные молекулы притягиваются к положительно заряженным участкам на поверхности частиц почвы или камней. Многие горные породы имеют на своей поверхности положительно заряженные участки связывания железа, алюминия и марганца.Отрицательно заряженные молекулы могут ассоциироваться с положительно заряженными участками поверхности, потому что противоположные заряды притягиваются друг к другу. Это означает, что отрицательно заряженных молекулы «застревают» на поверхности и не двигаются с водой . Они будут оставаться в почве до тех пор, пока на поверхности почвы есть свободные участки связывания. Как только все сайты будут заполнены или «насыщены», As(V) также станет мобильным.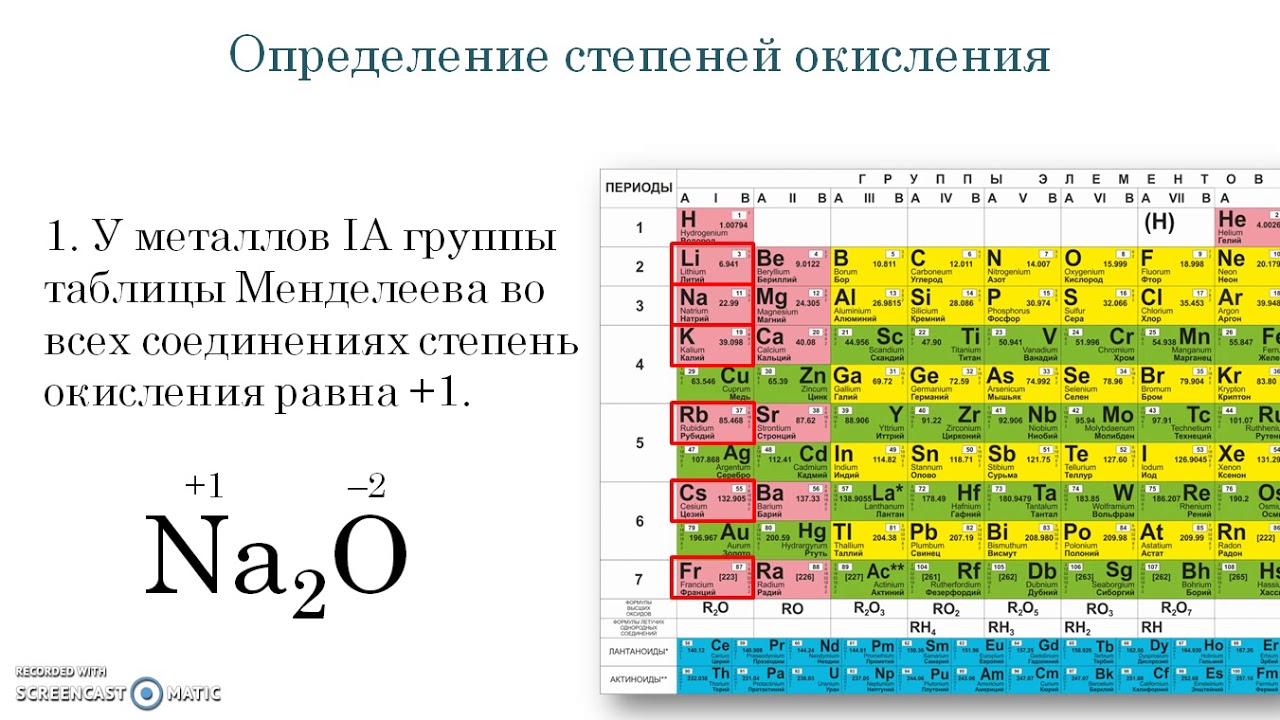 Незаряженные молекулы мышьяковистой кислоты свободно перемещаются в воде и более подвижны.Это означает, что незаряженная форма с большей вероятностью попадет в водопроводную воду.
Незаряженные молекулы мышьяковистой кислоты свободно перемещаются в воде и более подвижны.Это означает, что незаряженная форма с большей вероятностью попадет в водопроводную воду.
Обратите внимание, что на частицах почвы также есть много отрицательно заряженных участков связывания, но они не повлияют на виды мышьяка, которые мы здесь обсуждаем. Мышьяк также реагирует с поверхностными центрами способами, не связанными с зарядом, но это самый простой способ представить реакцию .
Химия поверхности почв действительно интересна и сложна. Это влияет на качество воды и движение всех видов загрязняющих веществ в окружающей среде, но это обсуждение выходит за рамки этой веб-страницы.
Итак, вы видите важность понимания различных форм мышьяка. Различные формы будут по-разному перемещаться в окружающей среде. Но то, что мы видели до сих пор, — это только часть истории. Еще одним важным фактором является то, что некоторые формы мышьяка более токсичны, чем другие. Мы обсудим токсичность далее в разделе о воздействии на здоровье.
Мы обсудим токсичность далее в разделе о воздействии на здоровье.
Мышьяк — обзор | ScienceDirect Topics
4.2 Вода
Мышьяк широко распространен в поверхностных, грунтовых и готовых питьевых водах.Морская вода обычно содержит 0,001–0,005 мг As/л (Ferguson, Gavis, 1972). Концентрации мышьяка в реках и озерах значительно различаются. Большинство уровней значительно ниже 0,01 мг/л, но в некоторых случаях они могут достигать 1 мг/л (Andreae, 1978; Durum et al., 1971; Sagner, 1973). Обследование 293 станций в двух общенациональных сетях отбора проб на крупных реках США показало, что средний уровень мышьяка составляет 1 мкг / л; уровень 75 го процентиля составлял 3 мкг/л (Smith et al., 1987).
Естественная концентрация общего мышьяка в подземных водах зависит от содержания мышьяка в коренных породах. Уровни мышьяка в подземных водах составляют в среднем около 1–2 мкг/л, за исключением некоторых западных штатов с месторождениями вулканических пород и сульфидных минералов с высоким содержанием мышьяка, где уровни мышьяка достигают 3,4 мг/л (Robertson, 1989; Welch et al. ., 1988). Приблизительно 13% проб подземных вод из 800 колодцев в районе Новой Шотландии, Канада, где содержание мышьяка в коренных породах высокое, имели концентрации, превышающие 0.05 мг As/л (Grantham and Jones, 1977). Мышьяк был обнаружен в 1298 из 3452 проб поверхностных вод, зарегистрированных в базе данных STORET за 2004 г., в концентрациях от 0,138 до 1700 мкг/л (EPA, 2005a). В Японии в воде горячих источников зарегистрированы концентрации до 1,7 мг As/л (Kawakami, 1967). В Кордове, Аргентина, сообщалось об уровнях подземных вод до 3,4 мг As/л (Arguello et al., 1938). На Тайване вода из артезианских скважин содержит до 1,8 мг/л (Kuo, 1968).
., 1988). Приблизительно 13% проб подземных вод из 800 колодцев в районе Новой Шотландии, Канада, где содержание мышьяка в коренных породах высокое, имели концентрации, превышающие 0.05 мг As/л (Grantham and Jones, 1977). Мышьяк был обнаружен в 1298 из 3452 проб поверхностных вод, зарегистрированных в базе данных STORET за 2004 г., в концентрациях от 0,138 до 1700 мкг/л (EPA, 2005a). В Японии в воде горячих источников зарегистрированы концентрации до 1,7 мг As/л (Kawakami, 1967). В Кордове, Аргентина, сообщалось об уровнях подземных вод до 3,4 мг As/л (Arguello et al., 1938). На Тайване вода из артезианских скважин содержит до 1,8 мг/л (Kuo, 1968).
Braman and Foreback (1973) и Crecelius (1974) отметили несколько различных форм мышьяка в природных водах: арсенат, арсенит, метиларсоновая кислота и диметиларсиновая кислота, при этом метилированные формы обычно находятся в более низких концентрациях, чем неорганические. Andreae (1978) сообщил, что арсенат обычно является преобладающей формой в морской воде. Клемент и Фауст (1973) обнаружили, что только приблизительно 8% общего количества мышьяка в хорошо аэрируемой речной воде находится в форме As(III), тогда как весь мышьяк в анаэробных водоемах, по-видимому, находится в форме As(III). ).Химическая форма мышьяка в различных подземных водах практически неизвестна. Клемент и Фауст (1973) обнаружили, что 25–50% общего мышьяка в нескольких пробах подземных вод находится в форме As(III).
Клемент и Фауст (1973) обнаружили, что только приблизительно 8% общего количества мышьяка в хорошо аэрируемой речной воде находится в форме As(III), тогда как весь мышьяк в анаэробных водоемах, по-видимому, находится в форме As(III). ).Химическая форма мышьяка в различных подземных водах практически неизвестна. Клемент и Фауст (1973) обнаружили, что 25–50% общего мышьяка в нескольких пробах подземных вод находится в форме As(III).
Среднесуточное потребление мышьяка с питьевой водой может сильно различаться в зависимости от источника воды. Маккейб и др. (1970) сообщалось, что менее 1% из более чем 18 000 коммунальных систем водоснабжения в Соединенных Штатах имели концентрации, превышающие 0,01 мг As/л. Энгель и Смит (1994) исследовали уровни мышьяка в питьевой воде на всей территории Соединенных Штатов в период с 1968 по 1984 год.Они обнаружили, что в 30 округах в 11 штатах средние уровни мышьяка превышали 5 мкг/л, в 15 округах — от 5 до 10 мкг/л; в 10 округах средние уровни составляли 10–20 мкг/л; и 5 округов имели уровни >20 мкг/л. Самые высокие уровни были обнаружены в округе Черчилль, штат Невада, где 89% населения подвергались воздействию мышьяка в средней концентрации 100 мкг/л, а 11% — в среднем 27 мкг/л. Совсем недавно исследователи Геологической службы США (Focazio et al., 2000) разработали обширную карту наличия мышьяка в подземных водах в Соединенных Штатах на основе 18 850 мест отбора проб; 2262 из них были идентифицированы как коммунальные системы водоснабжения.Результаты этих исследований указывают на ряд штатов в конкретных регионах (например, Новая Англия, Средний Запад, штаты Скалистых гор и Тихоокеанское побережье) с повышенными концентрациями (>10,0 мкг/л) в подземных водах, поэтому проблема повышенных концентраций мышьяка в подземных водах носит национальный характер. В январе 2001 г. EPA снизило ПДК для мышьяка с 50–10 мкг/л (EPA, 2001). При предполагаемом ежедневном потреблении 1,5 л питьевой воды концентрация 0,01 мг/л приведет к ежедневному приему внутрь 0.015 мг мышьяка.
Самые высокие уровни были обнаружены в округе Черчилль, штат Невада, где 89% населения подвергались воздействию мышьяка в средней концентрации 100 мкг/л, а 11% — в среднем 27 мкг/л. Совсем недавно исследователи Геологической службы США (Focazio et al., 2000) разработали обширную карту наличия мышьяка в подземных водах в Соединенных Штатах на основе 18 850 мест отбора проб; 2262 из них были идентифицированы как коммунальные системы водоснабжения.Результаты этих исследований указывают на ряд штатов в конкретных регионах (например, Новая Англия, Средний Запад, штаты Скалистых гор и Тихоокеанское побережье) с повышенными концентрациями (>10,0 мкг/л) в подземных водах, поэтому проблема повышенных концентраций мышьяка в подземных водах носит национальный характер. В январе 2001 г. EPA снизило ПДК для мышьяка с 50–10 мкг/л (EPA, 2001). При предполагаемом ежедневном потреблении 1,5 л питьевой воды концентрация 0,01 мг/л приведет к ежедневному приему внутрь 0.015 мг мышьяка.
В некоторых развивающихся странах, таких как Мексика, Бангладеш, Индия и Вьетнам, в некоторых регионах наблюдается сильно повышенный уровень мышьяка в питьевой воде (Bagla and Kaiser, 1996; Berg et al. . 2001; Tondel et al. , , 1999; Wyatt, и др., , 1998a; 1998b). По оценкам, в Бангладеш и Западной Бенгалии, Индия, более 1 миллиона человек пьют загрязненную мышьяком воду, и еще десятки миллионов могут подвергаться риску в районах, которые не были проверены на загрязнение.Анализ воды из 20 000 трубчатых колодцев показал, что в 62% из них уровни содержания мышьяка в питьевой воде превышают допустимый предел воздействия ВОЗ в 10 мкг/л, а в некоторых случаях достигают 3700 мкг/л (Bagla and Kaiser, 1996). Концентрация мышьяка в пробах воды из небольших частных колодцев в Ханое, Вьетнам, составляла в среднем 159 мкг/л в диапазоне от 1 до 3050 мкг/л (Berg et al., 2001).
. 2001; Tondel et al. , , 1999; Wyatt, и др., , 1998a; 1998b). По оценкам, в Бангладеш и Западной Бенгалии, Индия, более 1 миллиона человек пьют загрязненную мышьяком воду, и еще десятки миллионов могут подвергаться риску в районах, которые не были проверены на загрязнение.Анализ воды из 20 000 трубчатых колодцев показал, что в 62% из них уровни содержания мышьяка в питьевой воде превышают допустимый предел воздействия ВОЗ в 10 мкг/л, а в некоторых случаях достигают 3700 мкг/л (Bagla and Kaiser, 1996). Концентрация мышьяка в пробах воды из небольших частных колодцев в Ханое, Вьетнам, составляла в среднем 159 мкг/л в диапазоне от 1 до 3050 мкг/л (Berg et al., 2001).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Удаление мышьяка — Hungerford & Terry
Происхождение мышьяка
Мышьяк — это элемент, который встречается в земной коре.Соответственно, существуют естественные источники облучения. К ним относятся выветривание горных пород и эрозия, отложение мышьяка в водоемах и поглощение металла животными и растениями. Потребление пищи и воды являются основными источниками воздействия мышьяка для большинства населения. Люди также могут подвергаться воздействию из промышленных источников, поскольку мышьяк используется в производстве полупроводников, нефтепереработке, консервантах для древесины, кормовых добавках для животных и гербицидах.
Максимальный уровень загрязнения
Агентство по охране окружающей среды установило максимальный уровень загрязнения для мышьяка, 50 микрограммов на литр (50 мккв/л) или частей на миллиард (ppb) в 1976 году.В 2002 году MCL был снижен до 10 частей на миллиард.
Проблемы общественного здравоохранения
Мышьяк может соединяться с другими элементами с образованием неорганических и органических соединений мышьяка. В целом неорганические производные считаются более токсичными, чем органические формы. В то время как пища содержит как неорганические, так и органические соединения мышьяка, в воде присутствуют в основном неорганические формы. Воздействие мышьяка в больших количествах оказывает серьезное воздействие на здоровье, поскольку он является известным канцерогеном для человека. Кроме того, сообщалось, что он влияет на сосудистую систему человека и связан с развитием диабета.Мышьяк ядовит в дозах, значительно превышающих 65 мг (1 гран), причем отравление может возникнуть как от однократной большой дозы, так и от повторных малых доз, как, например, вдыхание мышьяковых газов или пыли.
В целом неорганические производные считаются более токсичными, чем органические формы. В то время как пища содержит как неорганические, так и органические соединения мышьяка, в воде присутствуют в основном неорганические формы. Воздействие мышьяка в больших количествах оказывает серьезное воздействие на здоровье, поскольку он является известным канцерогеном для человека. Кроме того, сообщалось, что он влияет на сосудистую систему человека и связан с развитием диабета.Мышьяк ядовит в дозах, значительно превышающих 65 мг (1 гран), причем отравление может возникнуть как от однократной большой дозы, так и от повторных малых доз, как, например, вдыхание мышьяковых газов или пыли.
Технология обработки
В воде наиболее распространенными валентными состояниями мышьяка являются As+5 (или арсенат), который более распространен в аэробных поверхностных водах, и As+3 (или арсенит), который чаще встречается в анаэробных грунтах воды. As+3 может быть преобразован путем предварительного окисления в As+5. В арсенатном состоянии мышьяк имеет тенденцию прилипать к гидроксиду железа, обычному осадку, образующемуся в процессе фильтрации CR Ferrosand.
В арсенатном состоянии мышьяк имеет тенденцию прилипать к гидроксиду железа, обычному осадку, образующемуся в процессе фильтрации CR Ferrosand.
Преимущества простой фильтрации по сравнению с другими технологиями
- Удаление до 95 % всего мышьяка за счет простого одноступенчатого процесса фильтрации
- Простые требования к управлению, может быть полностью автоматизирована для минимального вмешательства оператора
- Нет необходимости в дорогостоящих, и сложные мембранные системы
- Эффективная работа, минимальное количество отходов без необходимости нейтрализации
- Нет необходимости в дорогостоящих расходных ионообменных смолах или оборудовании для регенерации
- Нет необходимости в избыточных процессах предварительной обработки
- дополнительную информацию об этом процессе можно получить у американского или международного представителя Hungerford & Terry; или вы можете отправить электронное письмо или позвонить в штаб-квартиру Hungerford & Terry уже сегодня.

Мышьяк — CAREX Canada
Обзор воздействия на окружающую среду
Потребление мышьяка с пищей обычно считается основным путем воздействия на население в целом, хотя питьевая вода также может быть важным источником в районах, где мышьяк находится в коренных породах (таким образом загрязняя источники питьевой воды).[45] Области Канады с богатыми мышьяком геологическими отложениями включают Юкон, Северную Британскую Колумбию (Британская Колумбия), острова Нунавут, побережье Атлантического океана и несколько горячих точек в Южном Онтарио.[46] Экологические оценки CAREX Canada показывают, что уровни мышьяка в канадской питьевой воде приводят к более высокому риску развития рака на уровне населения (умеренное качество данных). Оценки пищевых продуктов и напитков показывают, что воздействие мышьяка также приводит к повышенному риску через этот путь (низкое качество данных).
Количественная оценка относительного вклада пищи и питьевой воды затруднена, потому что поглощение мышьяка варьируется в зависимости от формы (например, органической или неорганической) и валентного состояния мышьяка.
 [47] Основываясь на ограниченных доступных исследованиях,[48,49] потребление неорганического мышьяка, который считается более токсичным, оценивается в 25 % от общего потребления мышьяка. В Канаде источники мышьяка в продуктах питания включают моллюсков, мясо, птицу, зерно и молочные продукты.[50] Мышьяк был обнаружен в биодоступных формах (то есть легко усваиваемых) в канадских дикорастущих растениях и дичи, включая ягоды, грибы и зайцев.[51] По оценкам, в Онтарио 84% суточного поступления мышьяка поступает с пищей, 15% — с водой, менее 1% — с почвой/пылью и незначительное количество — с кожей.[50] Эта тенденция должна быть относительно одинаковой по всей Канаде. Мышьяк в пигментах и красках может попасть в организм через загрязненные руки, ногти, пищу, чашки или сигареты.[1]
[47] Основываясь на ограниченных доступных исследованиях,[48,49] потребление неорганического мышьяка, который считается более токсичным, оценивается в 25 % от общего потребления мышьяка. В Канаде источники мышьяка в продуктах питания включают моллюсков, мясо, птицу, зерно и молочные продукты.[50] Мышьяк был обнаружен в биодоступных формах (то есть легко усваиваемых) в канадских дикорастущих растениях и дичи, включая ягоды, грибы и зайцев.[51] По оценкам, в Онтарио 84% суточного поступления мышьяка поступает с пищей, 15% — с водой, менее 1% — с почвой/пылью и незначительное количество — с кожей.[50] Эта тенденция должна быть относительно одинаковой по всей Канаде. Мышьяк в пигментах и красках может попасть в организм через загрязненные руки, ногти, пищу, чашки или сигареты.[1]Средняя концентрация мышьяка в атмосферном воздухе в 11 канадских городах и одном сельском районе в 1990 г. составляла 0,001 мкг/м 3 . однако антропогенные источники вносят наибольший вклад.
 Примеры включают добычу неблагородных металлов и производство золота;[52] сжигание отходов и угля;[53] выщелачивание из опилок и древесины, обработанных мышьяком, или дыма из обработанной древесины;[1] и применение пестицидов на основе мышьяка.[54] Метанарсонат натрия (МСМА), мышьяксодержащий пестицид, использовался в Британской Колумбии. леса с 1995 по 2004 год в попытке замедлить заражение сосновым жуком. Когда наблюдалось накопление мышьяка и изменения в поведении дятлов и других видов, питающихся насекомыми, MSMA удаляли из B.C. рынки.[55]
Примеры включают добычу неблагородных металлов и производство золота;[52] сжигание отходов и угля;[53] выщелачивание из опилок и древесины, обработанных мышьяком, или дыма из обработанной древесины;[1] и применение пестицидов на основе мышьяка.[54] Метанарсонат натрия (МСМА), мышьяксодержащий пестицид, использовался в Британской Колумбии. леса с 1995 по 2004 год в попытке замедлить заражение сосновым жуком. Когда наблюдалось накопление мышьяка и изменения в поведении дятлов и других видов, питающихся насекомыми, MSMA удаляли из B.C. рынки.[55]Некоторые канадские объекты с высоким уровнем содержания мышьяка в остатках горнодобывающей/плавильной промышленности включают озеро Мойра, Онтарио, Йеллоунайф, Северная Каролина, Батерст, Северная Каролина, и Кроличье озеро, Южная Каролина.[54] Образцы, взятые недавно недалеко от Сиднея, штат Северная Каролина, показали, что 20% фоновых образцов почвы и 95% образцов почвы из смоляных прудов превышают канадские нормы содержания мышьяка в почве.
 [56]
[56]Поиски в Национальном кадастре выбросов загрязнителей Канады (NPRI) и в базе данных товаров для дома США дали следующие результаты о текущем потенциале воздействия мышьяка в Канаде:
База данных NPRI и товаров для дома
СШАNPRI 2015[57] Название вещества: «Мышьяк» Категория Количество Промышленность Выпущено в окружающую среду 152 т Литейное производство,
Производство цветных металлов (кроме алюминия)
Производство и обработка,
Добыча металлических руд (272 объекта)Ликвидировано 23 889 т Отправлено на переработку за пределами площадки 473 т Товары для дома США 2015[58] Критерий поиска Количество Тип продукта «Мышьяк» 6 Трансмиссионные и моторные масла (4), цементный краситель (1), лосьон для ухода за животными(1) т = тонна
Для получения дополнительной информации см.
 оценку воздействия мышьяка на окружающую среду.
оценку воздействия мышьяка на окружающую среду.Сколько валентных электронов имеет мышьяк(As)?
33-й элемент периодической таблицы — мышьяк. Элемент 15-й группы — мышьяк, а его символ — «As». Мышьяк образует связи через свои валентные электроны. В этой статье подробно рассматриваются валентных электронов мышьяка. Надеемся, что после прочтения этой статьи вы подробно узнаете о валентных электронах мышьяка(As).
Сколько электронов и протонов у мышьяка?
Ядро расположено в центре атома.Протоны и нейтроны находятся в ядре. Атомный номер мышьяка (As) — 33. Атомный номер — это число протонов.
То есть число протонов в мышьяке тридцать три. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом мышьяка имеет всего тридцать три электрона.
Каковы валентные электроны мышьяка(As)?
Общее количество электронов на последней оболочке после электронной конфигурации мышьяка называется валентными электронами мышьяка.
Атом мышьяка(As) Валентный электрон — это общее количество электронов на последней орбите (оболочке).
Валентный электрон — это общее количество электронов на последней орбите (оболочке).Валентные электроны определяют свойства элемента и участвуют в образовании связей. 33-й элемент периодической таблицы — мышьяк (As). То есть атом элемента мышьяка имеет всего тридцать три электрона.
Электронная конфигурация мышьяка показывает, что последняя оболочка мышьяка имеет в общей сложности пять электронов. То есть мы легко можем сказать, что валентных электронов мышьяка пять.На этом сайте есть статья с подробным описанием электронной конфигурации мышьяка, вы можете прочитать ее, если хотите.
Как рассчитать количество валентных электронов в атоме мышьяка?
Теперь мы будем знать, как легко определить валентные электроны мышьяка. Валентный электрон необходимо определить, выполнив несколько шагов. Электронная конфигурация является одной из них. Невозможно определить валентный электрон без электронной конфигурации.
Правильно зная электронную конфигурацию , очень легко определить валентные электроны всех элементов.
 На этом сайте опубликована статья с подробным описанием электронной конфигурации, вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация.
На этом сайте опубликована статья с подробным описанием электронной конфигурации, вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация.Ученый Нильс Бор первым дал представление об орбите (оболочке) атома. Он представил модель атома в 1913 году. Там дается полное представление об орбите. Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n.[ п знак равно 1,2 3 4 . . .]
K – название первой орбиты(оболочки), L – второй, M – третьей, N – название четвертой оболочки. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
Теперь
- n = 1 для K-орбиты.
Электронная удерживающая способность K-орбиты составляет 2n 2 = 2 × 1 2 = 2 электрона. - Для L-орбиты n = 2.
Электронная емкость L-орбиты составляет 2n 2 = 2 × 2 2 = 8 электронов.
- n=3 для М-орбиты.
Максимальная емкость для электронов на М-орбите составляет 2n 2 = 2 × 3 2 = 18 электронов. - n=4 для N-орбиты.
Максимальная емкость для электронов на N-орбите составляет 2n 2 = 2 × 4 2 = 32 электрона.
В дополнение к этому методу конфигурация электронов может быть выполнена с помощью суборбит. Немецкий физик Ауфбау впервые предложил идею конфигурации электронов через суборбиты. Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень.
Электронная конфигурацияЭти суборбитали обозначаются буквой «l». Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершают орбиталь с самой низкой энергией, а затем постепенно продолжают завершать орбиталь с более высокой энергией. Эти орбитали называются s, p, d, f. Электронная удерживающая способность этих орбиталей составляет s = 2, p = 6, d = 10 и f = 14.

Однако валентные электроны можно легко идентифицировать, располагая электроны в соответствии с принципом Бора. Теперь мы научимся определять валентный электрон мышьяка(As).
Шаг-1: Определение общего количества электронов в мышьяке (As)
1-й нам нужно знать общее количество электронов в атоме мышьяка. Чтобы узнать количество электронов, нужно знать количество протонов в мышьяке. А чтобы узнать количество протонов, нужно знать атомный номер элемента мышьяк.
Чтобы узнать атомный номер, нам нужно воспользоваться периодической таблицей. Необходимо знать атомный номер мышьяка (As) элементов периодической таблицы.Атомный номер — это количество протонов. А электроны, равные протонам, находятся вне ядра.
Положение мышьяка(As) в таблице МенделееваТо есть, можно окончательно сказать, что в атоме мышьяка есть электроны, равные атомному номеру. Из периодической таблицы мы видим, что атомный номер мышьяка (As) равен 33. То есть атом мышьяка имеет всего тридцать три электрона.

Этап 2: Необходимо определить электронную конфигурацию мышьяка
Этап 2 очень важен.На этом этапе необходимо организовать электроны мышьяка. Мы знаем, что атомы мышьяка (As) имеют в общей сложности тридцать три электрона. Электронная конфигурация мышьяка показывает, что есть два электрона на K-оболочке, восемь на L-оболочке, восемнадцать на M-оболочке и пять на N-оболочке (орбите).
Электронная конфигурация мышьякаТо есть первая оболочка мышьяка имеет два электрона, вторая оболочка имеет восемь электронов, 3-я оболочка имеет восемнадцать электронов и 4-я оболочка (последняя орбита) имеет пять электронов.Число электронов на оболочку мышьяка (As) равно 2, 8, 18, 5. Электронная конфигурация мышьяка на подорбите: 4с 2 3д 10 4п 3 .
Этап 3: Определение валентной оболочки и расчет общего количества электронов
Третий шаг — диагностика валентной оболочки. Последняя оболочка после электронной конфигурации называется валентной оболочкой (орбитой).
 Общее число электронов в валентной оболочке называется валентным электроном.Электронная конфигурация мышьяка (As) показывает, что последняя оболочка мышьяка имеет пять электронов. Следовательно, атомы мышьяка имеют 5 валентных электронов.
Общее число электронов в валентной оболочке называется валентным электроном.Электронная конфигурация мышьяка (As) показывает, что последняя оболочка мышьяка имеет пять электронов. Следовательно, атомы мышьяка имеют 5 валентных электронов.
Валентные электроны для мышьяка (As)Сколько валентных электронов имеет ион мышьяка (As
3-)?Элементы, имеющие 5, 6 или семь электронов на последней оболочке (орбите), получают электроны последней оболочки во время образования связи. Элементы, которые принимают электроны и образуют связи, называются анионами.То есть мышьяк(As) является анионным элементом.
As + 3e – → As 3-
При образовании мышьяковистой связи последняя оболочка принимает электроны и превращает их в ионы мышьяка (As 3- ).
 Электронная конфигурация мышьяка ионов (как 3- ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 .
Электронная конфигурация мышьяка ионов (как 3- ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 .Электронная конфигурация ионов мышьяка показывает, что ионы мышьяка (As 3-) имеют четыре оболочки, а последняя оболочка имеет восемь электронов (4s 2 4p 6 ).Электронная конфигурация показывает, что атом мышьяка приобрел электронную конфигурацию криптона. Поскольку последняя оболочка иона мышьяка имеет восемь электронов, валентных электронов ионов мышьяка (As 3-) восемь.
Какова валентность мышьяка?
Способность одного атома элемента присоединяться к другому атому при образовании молекулы называется валентностью (валентностью). Число неспаренных электронов на последней орбите элемента является валентностью этого элемента.В электронной конфигурации мышьяка (As) мы видим, что в последней оболочке мышьяка существует пять электронов.
Валентность и валентные электроны мышьяка(As) Следовательно, валентность мышьяка(As) равна 5.
Следовательно, валентность мышьяка(As) равна 5.Опять же, валентность определяется электронной конфигурацией элемента в возбужденном состоянии. Электронная конфигурация мышьяка в возбужденном состоянии является как * (33) = 1S 2 2S 2 2P 6 2P 2 3P 6 4S 2 3D 10 4P x 1 4p y 1 4p z 1 .Здесь электронная конфигурация мышьяка показывает, что в последней оболочке существуют три неспаренных электрона. В этом случае валентность атома мышьяка равна 3.
Степени окисления мышьяка зависят от образования связи. Степень окисления мышьяка +3. Степень окисления мышьяка +3 использовалась в арсениде галлия (GaAs). Валентность мышьяка в этом соединении равна 3.
5 валентных электронов
Атомный номер мышьяка (As) равен 33. Атомный номер — это число протонов.То есть число протонов в мышьяке равно тридцати трем.
 Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом мышьяка имеет в общей сложности тридцать три электрона
Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом мышьяка имеет в общей сложности тридцать три электронаОбщее количество электронов в последней оболочке после электронной конфигурации мышьяка называется валентными электронами мышьяка.
- Шаг-1: Определение общего числа электронов в мышьяке(As)
- Шаг-2: Необходимо определить электронную конфигурацию мышьяка
- Шаг-3: Определить валентную оболочку и рассчитать общее количество электронов Конфигурация мышьяка в возбужденном состоянии так как * (33) = 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P x 1 4P y 1 4p z 1 .Здесь электронная конфигурация мышьяка показывает, что в последней оболочке существуют три неспаренных электрона. В этом случае валентность атома мышьяка равна 3.
Электронная конфигурация ионов мышьяка показывает, что ионы мышьяка (As 3-) имеют четыре оболочки, а последняя оболочка имеет восемь электронов (4s 2 4p 6 ).
 Поскольку последняя оболочка иона мышьяка имеет восемь электронов, валентных электронов ионов мышьяка (As 3-) восемь.
Поскольку последняя оболочка иона мышьяка имеет восемь электронов, валентных электронов ионов мышьяка (As 3-) восемь.Группа 15: Общие свойства и реакции
Семейство азота включает следующие соединения: азот (N), фосфор (P), мышьяк (As), сурьма (Sb) и висмут (Bi).Все элементы группы 15 имеют электронную конфигурацию ns 2 np 3 в своей внешней оболочке, где n равно главному квантовому числу. Семейство азота расположено в р-блоке группы 15, как показано ниже.
Периодические тренды
Все элементы группы 15 имеют тенденцию следовать общим периодическим тенденциям:
- Электроотрицательность (способность атома притягивать электроны) уменьшается вниз по группе.
- Энергия ионизации (количество энергии, необходимое для отрыва электрона от атома в его газовой фазе) уменьшается вниз по группе.
- Атомные радиусы увеличиваются в размерах вниз по группе.
- Сродство к электрону (способность атома принимать электрон) уменьшается вниз по группе.

- Температура плавления (количество энергии, необходимое для разрыва связей для превращения твердофазного вещества в жидкофазное) увеличивается вниз по группе.
- Температура кипения (количество энергии, необходимое для разрыва связей, чтобы превратить вещество из жидкой фазы в газ) увеличивается вниз по группе.
- Металлический характер увеличивается вниз по группе.
Элемент/символ Атомный номер Масса Электронная конфигурация Ковалентный радиус (пм) Электроотрицательность Энергия первой ионизации (кДж/моль) Общие физические формы Свойства элементов группы 15 Азот (N) 7 14.  01
011с 2 2с 2 2п 3 75 3,0 1402 Бесцветный газ Фосфор (P) 15 30,97 [Ne]3s 2 3p 3 110 2.1 1012 Белый сплошной / красный сплошной Мышьяк (As) 33 74.92 [Ar] 3d 10 4s 2 4p 3 121 2,0 947 Желтый сплошной / Серый сплошной Сурьма (Sb) 51 121,76 [Кр] 4d 10 5s 2 5p 3 140 1,9 834 Желтый сплошной / серебристо-белый металлик сплошной Висмут (Би) 83 208.  98
98[Xe] 4f 14 5d 10 6s 2 6p 3 155 1,9 703 Розово-белый металлик однотонный Азот
Азот был открыт в 1770 году Шееле и Пристли. Этот неметаллический элемент не имеет цвета, вкуса и запаха и присутствует в природе в виде негорючего газа. По сравнению с остальной частью группы 15 азот имеет самую высокую электроотрицательность, что делает его самым неметаллическим элементом группы.Обычные степени окисления азота +5, +3 и -3. Азот составляет около 0,002 % земной коры; однако он составляет 78% земной атмосферы по объему. Азот также был обнаружен в атмосферах Венеры и Марса. Венера имеет 3,5% объема азота в своей атмосфере, а Марс имеет 2,7% объема азота в своей атмосфере. Азот естественным образом содержится в животных и растительных белках, а также в окаменелых остатках древней растительной жизни.
 Важными азотсодержащими минералами являются селитра, KNO 3 , и натриевая селитра, NaNO 3 , которые встречаются в пустынных районах и являются важными компонентами удобрений.До открытия процесса превращения азота в аммиак источники азота были ограничены. Один из процессов превращения азота в аммиак, процесс Габера-Боша, очень важен для производства азота. Азот очень плохо растворяется в жидкостях. N 2 не имеет аллотропов.
Важными азотсодержащими минералами являются селитра, KNO 3 , и натриевая селитра, NaNO 3 , которые встречаются в пустынных районах и являются важными компонентами удобрений.До открытия процесса превращения азота в аммиак источники азота были ограничены. Один из процессов превращения азота в аммиак, процесс Габера-Боша, очень важен для производства азота. Азот очень плохо растворяется в жидкостях. N 2 не имеет аллотропов.Необычайно стабильный газообразный азот N 2 (g) является источником, из которого в конечном итоге образуются все соединения азота. N 2 (g) стабилен благодаря своей электронной структуре: связь между двумя атомами азота N 2 представляет собой тройную ковалентную связь, прочную и трудно разрываемую.Изменение энтальпии, связанное с разрывом связей в N 2 , сильно эндотермическое: ΔH = +945,4 кДж. Газообразный азот используется в качестве хладагента, для обработки металлов и сжатого газа для добычи нефти.
 {-1}\]
{-1}\]Оксиды и оксикислоты азота включают закись азота (N 2 O), окись азота (NO) и двуокись азота (NO 2 ).Закись азота, также называемая «веселящим газом», используется в стоматологии, при родах и для увеличения скорости автомобилей. Оксид азота содержится в смоге и нейротрансмиттерах. Гидразин, N 2 H 4 , представляет собой ядовитую бесцветную жидкость, которая взрывается на воздухе. Гидразин является хорошим восстановителем, а метилгидразин обычно используется в качестве ракетного топлива.
Фосфор
Фосфор — неметаллический элемент. Наиболее распространенная степень окисления фосфора -3. Фосфор является одиннадцатым по распространенности элементом, составляющим 0.11% земной коры. Основным источником соединений фосфора являются фосфористые породы. Фосфор встречается не в чистом виде, а в виде апатитовых руд. К ним относятся такие соединения, как фторапатит (Ca 5 (PO 4 ) 3 F), который во фторированной воде используется для укрепления зубов, и гидроксиапатит (Ca 10 (OH) 2 (PO4) 6 ), основной компонент зубной эмали и костного материала.
 Фосфор проявляет аллотропные формы: наиболее распространенными формами при комнатной температуре являются белый фосфор и красный фосфор.Белый фосфор представляет собой белое воскообразное твердое вещество, которое можно резать ножом. Он образует тетраэдрическую молекулу P 4 . Белый фосфор токсичен, а красный фосфор нетоксичен. Красный фосфор образуется, когда белый фосфор нагревается до 573 Кельвинов и не подвергается воздействию воздуха. Красный фосфор менее активен, чем белый фосфор. Красный фосфор имеет цепочечную полимерную структуру и более стабилен. И белый, и красный фосфор являются зажигательными и использовались для изготовления спичечных наконечников, хотя использование белого фосфора в значительной степени прекращено из-за токсичности.Фосфор имеет множество применений: трихлорид фосфора (PCl 3 ) используется в мыле, моющих средствах, пластмассах, синтетическом каучуке, нейлоне, моторных маслах, инсектицидах и гербицидах; фосфорная кислота, H 3 PO 4 , используется в удобрениях; фосфор также широко распространен в пищевой промышленности, используется в разрыхлителях, хлопьях быстрого приготовления, сыре, вялении ветчины и в терпкости безалкогольных напитков.
Фосфор проявляет аллотропные формы: наиболее распространенными формами при комнатной температуре являются белый фосфор и красный фосфор.Белый фосфор представляет собой белое воскообразное твердое вещество, которое можно резать ножом. Он образует тетраэдрическую молекулу P 4 . Белый фосфор токсичен, а красный фосфор нетоксичен. Красный фосфор образуется, когда белый фосфор нагревается до 573 Кельвинов и не подвергается воздействию воздуха. Красный фосфор менее активен, чем белый фосфор. Красный фосфор имеет цепочечную полимерную структуру и более стабилен. И белый, и красный фосфор являются зажигательными и использовались для изготовления спичечных наконечников, хотя использование белого фосфора в значительной степени прекращено из-за токсичности.Фосфор имеет множество применений: трихлорид фосфора (PCl 3 ) используется в мыле, моющих средствах, пластмассах, синтетическом каучуке, нейлоне, моторных маслах, инсектицидах и гербицидах; фосфорная кислота, H 3 PO 4 , используется в удобрениях; фосфор также широко распространен в пищевой промышленности, используется в разрыхлителях, хлопьях быстрого приготовления, сыре, вялении ветчины и в терпкости безалкогольных напитков.
Мышьяк
Мышьяк — очень ядовитый металлоид. Поскольку мышьяк является металлоидом, он имеет высокую плотность, умеренную теплопроводность и ограниченную способность проводить электричество.Степени окисления мышьяка +5, +3, +2, +1 и -3. Три аллотропные формы мышьяка — желтая, черная и серая; серый аллотроп является наиболее распространенным. Соединения мышьяка используются в инсектицидах, гербицидах и сплавах. Оксид мышьяка амфотерный , что означает, что он может действовать как кислота, так и как основание. Мышьяк в основном получают нагреванием мышьяксодержащих сульфидов. Химическая формула этого процесса приведена ниже:
\[ FeAsS_{(s)} \rightarrow FeS_{(s)} + As_{(g)}\]
\(As_{(g)}\) откладывается в виде \(As_{(s)}\), который затем можно использовать для получения других соединений.Мышьяк также можно получить восстановлением оксида мышьяка (III) с помощью \(CO_{(g)}\).
Сурьма
Сурьма также является металлоидом.
 Степени окисления сурьмы +3, -3 и +5. Сурьма проявляет аллотропию; наиболее устойчивым аллотропом является металлическая форма, близкая по свойствам к мышьяку: высокая плотность, умеренная теплопроводность, ограниченная способность проводить электричество. Оксид сурьмы представляет собой оксид сурьмы (III), который является амфотерным, что означает, что он может действовать как кислота, так и как основание.Сурьму получают в основном из сульфидных руд, и она испаряется при низких температурах. Наряду с мышьяком в сплавах обычно используют сурьму. Мышьяк, сурьма и свинец образуют сплав с желаемыми свойствами для электродов в свинцово-кислотных батареях. Мышьяк и сурьма также используются для производства полупроводниковых материалов, таких как GaAs, GaSb и InSb, в электронных устройствах.
Степени окисления сурьмы +3, -3 и +5. Сурьма проявляет аллотропию; наиболее устойчивым аллотропом является металлическая форма, близкая по свойствам к мышьяку: высокая плотность, умеренная теплопроводность, ограниченная способность проводить электричество. Оксид сурьмы представляет собой оксид сурьмы (III), который является амфотерным, что означает, что он может действовать как кислота, так и как основание.Сурьму получают в основном из сульфидных руд, и она испаряется при низких температурах. Наряду с мышьяком в сплавах обычно используют сурьму. Мышьяк, сурьма и свинец образуют сплав с желаемыми свойствами для электродов в свинцово-кислотных батареях. Мышьяк и сурьма также используются для производства полупроводниковых материалов, таких как GaAs, GaSb и InSb, в электронных устройствах.Висмут
Висмут — металлический элемент. Степени окисления висмута +3 и +5. Висмут — плохой металл (со значительным ковалентным характером), похожий как на мышьяк, так и на сурьму.
 Висмут широко используется в косметических продуктах и медицине. Из этой группы висмут имеет самую низкую электроотрицательность и энергию ионизации, а это означает, что он с большей вероятностью потеряет электрон, чем остальные элементы группы 15. Вот почему висмут является самым металлическим из группы 15. Висмут также является плохим проводником электричества. Оксид висмута представляет собой оксид висмута (III); он действует как основание, как и положено для оксидов металлов. Висмут получают как побочный продукт рафинирования других металлов, что позволяет другим металлам перерабатывать свои побочные продукты в висмут.
Висмут широко используется в косметических продуктах и медицине. Из этой группы висмут имеет самую низкую электроотрицательность и энергию ионизации, а это означает, что он с большей вероятностью потеряет электрон, чем остальные элементы группы 15. Вот почему висмут является самым металлическим из группы 15. Висмут также является плохим проводником электричества. Оксид висмута представляет собой оксид висмута (III); он действует как основание, как и положено для оксидов металлов. Висмут получают как побочный продукт рафинирования других металлов, что позволяет другим металлам перерабатывать свои побочные продукты в висмут.Ссылки
- Петруччи, Ральф Х., Уильям С. Харвуд, Джефф Э. Херринг и Джеффри Д. Мадура. Общая химия: принципы и современные приложения. Река Аппер-Сэдл: Prentice Hall PTR, 2006.
- Коц, Джон К. и Пол Трейчел. Химия и химическая реактивность. 3-е изд. Нью-Йорк, Калифорния: Колледж Сондерс, 1996. .
- Коппола, Брайан Д.
 ; Ховик, Джеймс В.; Дэниелс, Дуглас С. «Я кричу, ты кричишь …: новый поворот в демонстрациях жидкого азота». J. Chem. Educ. 1994 , 71 , 1080.
; Ховик, Джеймс В.; Дэниелс, Дуглас С. «Я кричу, ты кричишь …: новый поворот в демонстрациях жидкого азота». J. Chem. Educ. 1994 , 71 , 1080.
Проблемы
- Какая часть земной коры состоит из азота?
- Какая часть земной коры не состоит из фосфора?
- Какая облигация у N 2 ?
- Как связаны между собой красный фосфор и белый фосфор?
- Какова электронная конфигурация мышьяка?
- Имеет ли висмут металлические свойства или неметаллические свойства?
- Верно или неверно: азот и фосфор — это металлы.
- Какой элемент группы 15 имеет наибольший атомный радиус?
- Какой элемент группы 15 является самым сильным восстановителем?
- Верно или неверно: висмут обладает наиболее металлическими свойствами.
- Какая физическая форма азота является наиболее распространенной?
- В каком процессе азот может превращаться в аммиак?
- Какой элемент имеет наибольшую энергию первой ионизации?
- Завершите и сбалансируйте следующую реакцию: _N 2 (г) + _H 2 (г) -> ____
- Какова общая степень окисления всех элементов группы 15?
Ответы
- 0.
 002% земной коры состоит из азота.
002% земной коры состоит из азота. - Земная кора состоит из 0,11% фосфора, поэтому 99,89% земной коры не состоит из фосфора.
- N 2 имеет прочную тройную ковалентную связь, которую трудно разорвать.
- Красный фосфор и белый фосфор являются аллотропами фосфора. Красный фосфор получается из белого фосфора при нагревании примерно до 573 Кельвинов.
- [Ar] 3d 10 4s 2 4p 3
- Висмут обладает металлическими свойствами.
- Ложь; и азот, и фосфор являются неметаллами.
- Согласно периодическим трендам наибольший атомный радиус имеет висмут.
- Согласно периодическим тенденциям, висмут является самым сильным восстановителем, так как он имеет значение электроотрицательности 1,9, такое же, как у сурьмы, но имеет более низкую энергию ионизации 703 кДж/моль, что означает, что он более склонен к окислению.
- Верно; висмут — единственный металлический элемент группы 15.

- Наиболее распространенной физической формой азота является бесцветный газ.
- Процесс превращения азота в аммиак известен как процесс Габера-Боша.
- Согласно периодическим тенденциям, азот должен иметь самую высокую энергию первой ионизации, что означает, что он больше всего не желает терять электрон.
- N 2 (г) + 3H 2 (г) -> 2NH 3 (г)
- Обычная степень окисления для всех элементов группы 15 равна -3.
Авторы и авторство
- Киренджот Гревал (UCD), Конни Су (UCD)

- n = 1 для K-орбиты.
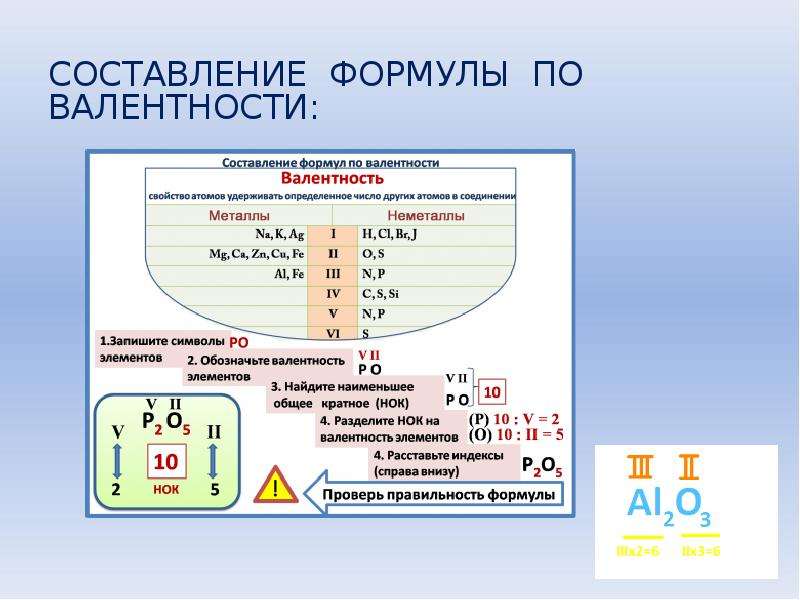
 (Запишите число с точностью до целых).
(Запишите число с точностью до целых). (Запишите число с точностью до целых).
(Запишите число с точностью до целых). Ответ____кг. (Запишите число с точностью до целых).
Ответ____кг. (Запишите число с точностью до целых). Этот элемент называется:
Этот элемент называется:
 (Запишите число с точностью до целых).
(Запишите число с точностью до целых). Элементы, которые не очень хорошо проводят электричество, но все же могут это делать, и которые лучше проводят электричество при более высоких температурах, находятся между этими группами и называются металлоидами. Так как эти соединения плохо проводят электричество, их еще называют полупроводниками.Полупроводники широко используются в электронной промышленности.
Элементы, которые не очень хорошо проводят электричество, но все же могут это делать, и которые лучше проводят электричество при более высоких температурах, находятся между этими группами и называются металлоидами. Так как эти соединения плохо проводят электричество, их еще называют полупроводниками.Полупроводники широко используются в электронной промышленности.
 Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1.
Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1. Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода.Если вы сложите валентные состояния всех атомов в молекуле, вы снова должны получить 0,
Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода.Если вы сложите валентные состояния всех атомов в молекуле, вы снова должны получить 0, Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .
Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .


 [47] Основываясь на ограниченных доступных исследованиях,[48,49] потребление неорганического мышьяка, который считается более токсичным, оценивается в 25 % от общего потребления мышьяка. В Канаде источники мышьяка в продуктах питания включают моллюсков, мясо, птицу, зерно и молочные продукты.[50] Мышьяк был обнаружен в биодоступных формах (то есть легко усваиваемых) в канадских дикорастущих растениях и дичи, включая ягоды, грибы и зайцев.[51] По оценкам, в Онтарио 84% суточного поступления мышьяка поступает с пищей, 15% — с водой, менее 1% — с почвой/пылью и незначительное количество — с кожей.[50] Эта тенденция должна быть относительно одинаковой по всей Канаде. Мышьяк в пигментах и красках может попасть в организм через загрязненные руки, ногти, пищу, чашки или сигареты.[1]
[47] Основываясь на ограниченных доступных исследованиях,[48,49] потребление неорганического мышьяка, который считается более токсичным, оценивается в 25 % от общего потребления мышьяка. В Канаде источники мышьяка в продуктах питания включают моллюсков, мясо, птицу, зерно и молочные продукты.[50] Мышьяк был обнаружен в биодоступных формах (то есть легко усваиваемых) в канадских дикорастущих растениях и дичи, включая ягоды, грибы и зайцев.[51] По оценкам, в Онтарио 84% суточного поступления мышьяка поступает с пищей, 15% — с водой, менее 1% — с почвой/пылью и незначительное количество — с кожей.[50] Эта тенденция должна быть относительно одинаковой по всей Канаде. Мышьяк в пигментах и красках может попасть в организм через загрязненные руки, ногти, пищу, чашки или сигареты.[1]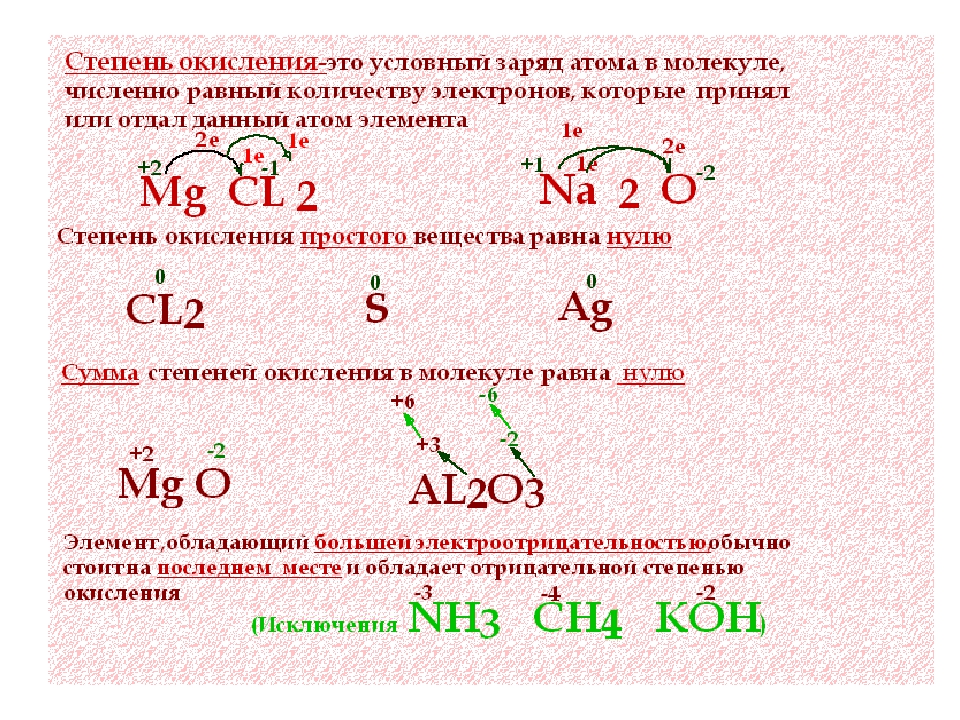 Примеры включают добычу неблагородных металлов и производство золота;[52] сжигание отходов и угля;[53] выщелачивание из опилок и древесины, обработанных мышьяком, или дыма из обработанной древесины;[1] и применение пестицидов на основе мышьяка.[54] Метанарсонат натрия (МСМА), мышьяксодержащий пестицид, использовался в Британской Колумбии. леса с 1995 по 2004 год в попытке замедлить заражение сосновым жуком. Когда наблюдалось накопление мышьяка и изменения в поведении дятлов и других видов, питающихся насекомыми, MSMA удаляли из B.C. рынки.[55]
Примеры включают добычу неблагородных металлов и производство золота;[52] сжигание отходов и угля;[53] выщелачивание из опилок и древесины, обработанных мышьяком, или дыма из обработанной древесины;[1] и применение пестицидов на основе мышьяка.[54] Метанарсонат натрия (МСМА), мышьяксодержащий пестицид, использовался в Британской Колумбии. леса с 1995 по 2004 год в попытке замедлить заражение сосновым жуком. Когда наблюдалось накопление мышьяка и изменения в поведении дятлов и других видов, питающихся насекомыми, MSMA удаляли из B.C. рынки.[55]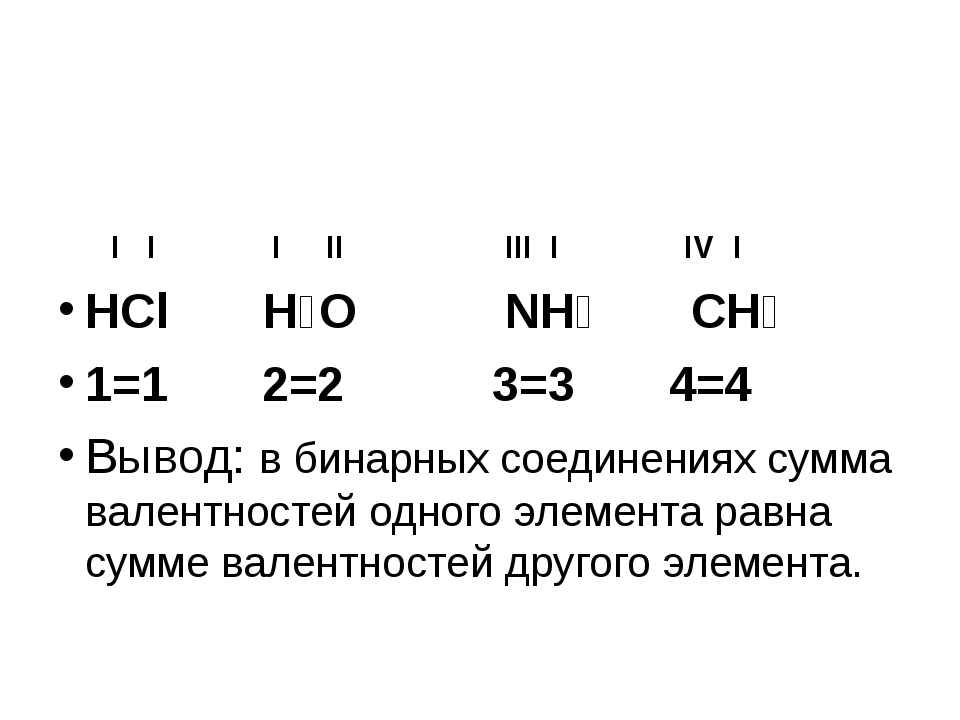 [56]
[56] оценку воздействия мышьяка на окружающую среду.
оценку воздействия мышьяка на окружающую среду. Валентный электрон — это общее количество электронов на последней орбите (оболочке).
Валентный электрон — это общее количество электронов на последней орбите (оболочке). На этом сайте опубликована статья с подробным описанием электронной конфигурации, вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация.
На этом сайте опубликована статья с подробным описанием электронной конфигурации, вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация.


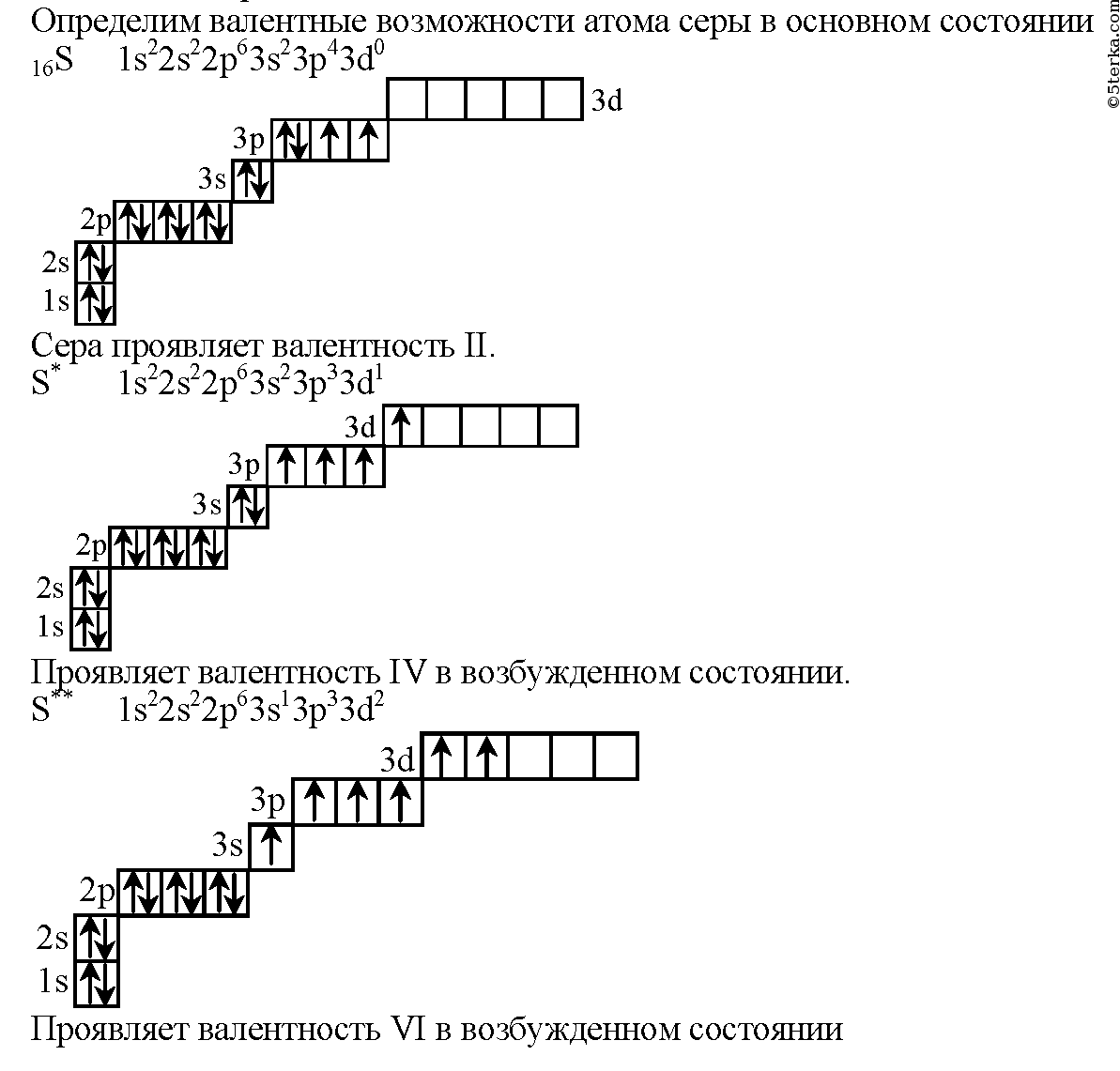 Общее число электронов в валентной оболочке называется валентным электроном.Электронная конфигурация мышьяка (As) показывает, что последняя оболочка мышьяка имеет пять электронов. Следовательно, атомы мышьяка имеют 5 валентных электронов.
Общее число электронов в валентной оболочке называется валентным электроном.Электронная конфигурация мышьяка (As) показывает, что последняя оболочка мышьяка имеет пять электронов. Следовательно, атомы мышьяка имеют 5 валентных электронов.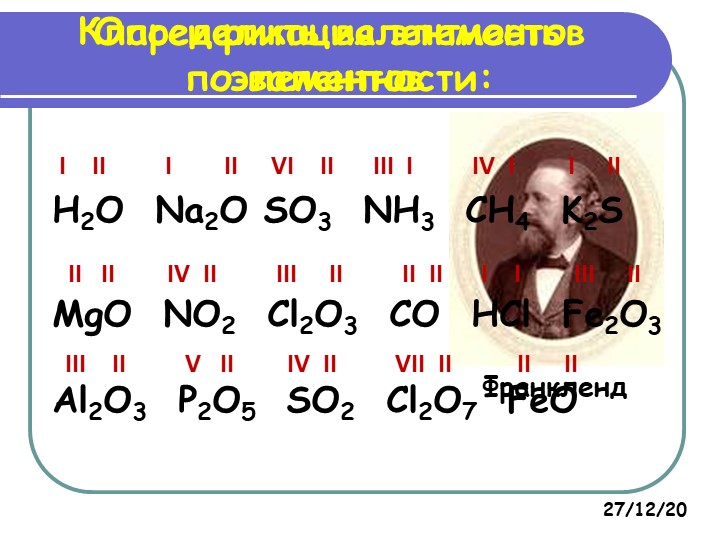 Электронная конфигурация мышьяка ионов (как 3- ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 .
Электронная конфигурация мышьяка ионов (как 3- ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 . Следовательно, валентность мышьяка(As) равна 5.
Следовательно, валентность мышьяка(As) равна 5. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом мышьяка имеет в общей сложности тридцать три электрона
Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом мышьяка имеет в общей сложности тридцать три электрона Поскольку последняя оболочка иона мышьяка имеет восемь электронов, валентных электронов ионов мышьяка (As 3-) восемь.
Поскольку последняя оболочка иона мышьяка имеет восемь электронов, валентных электронов ионов мышьяка (As 3-) восемь.
 01
01 98
98 Важными азотсодержащими минералами являются селитра, KNO 3 , и натриевая селитра, NaNO 3 , которые встречаются в пустынных районах и являются важными компонентами удобрений.До открытия процесса превращения азота в аммиак источники азота были ограничены. Один из процессов превращения азота в аммиак, процесс Габера-Боша, очень важен для производства азота. Азот очень плохо растворяется в жидкостях. N 2 не имеет аллотропов.
Важными азотсодержащими минералами являются селитра, KNO 3 , и натриевая селитра, NaNO 3 , которые встречаются в пустынных районах и являются важными компонентами удобрений.До открытия процесса превращения азота в аммиак источники азота были ограничены. Один из процессов превращения азота в аммиак, процесс Габера-Боша, очень важен для производства азота. Азот очень плохо растворяется в жидкостях. N 2 не имеет аллотропов.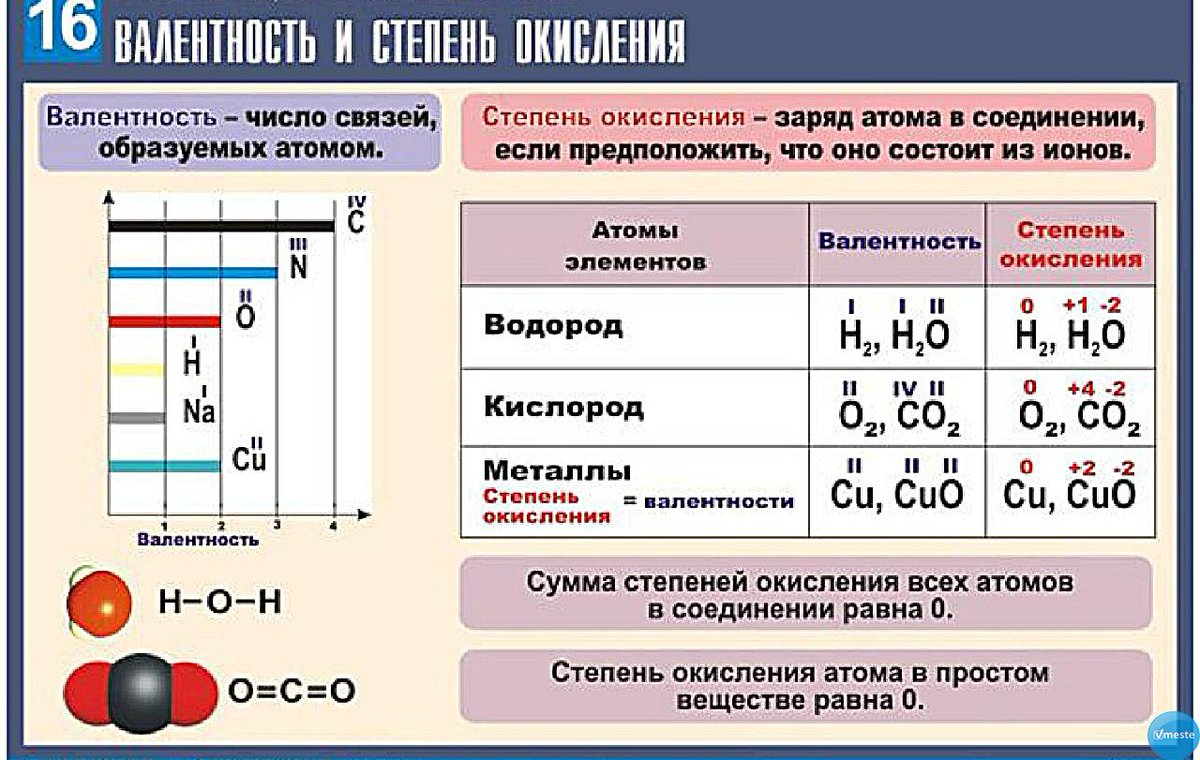 {-1}\]
{-1}\] Фосфор проявляет аллотропные формы: наиболее распространенными формами при комнатной температуре являются белый фосфор и красный фосфор.Белый фосфор представляет собой белое воскообразное твердое вещество, которое можно резать ножом. Он образует тетраэдрическую молекулу P 4 . Белый фосфор токсичен, а красный фосфор нетоксичен. Красный фосфор образуется, когда белый фосфор нагревается до 573 Кельвинов и не подвергается воздействию воздуха. Красный фосфор менее активен, чем белый фосфор. Красный фосфор имеет цепочечную полимерную структуру и более стабилен. И белый, и красный фосфор являются зажигательными и использовались для изготовления спичечных наконечников, хотя использование белого фосфора в значительной степени прекращено из-за токсичности.Фосфор имеет множество применений: трихлорид фосфора (PCl 3 ) используется в мыле, моющих средствах, пластмассах, синтетическом каучуке, нейлоне, моторных маслах, инсектицидах и гербицидах; фосфорная кислота, H 3 PO 4 , используется в удобрениях; фосфор также широко распространен в пищевой промышленности, используется в разрыхлителях, хлопьях быстрого приготовления, сыре, вялении ветчины и в терпкости безалкогольных напитков.
Фосфор проявляет аллотропные формы: наиболее распространенными формами при комнатной температуре являются белый фосфор и красный фосфор.Белый фосфор представляет собой белое воскообразное твердое вещество, которое можно резать ножом. Он образует тетраэдрическую молекулу P 4 . Белый фосфор токсичен, а красный фосфор нетоксичен. Красный фосфор образуется, когда белый фосфор нагревается до 573 Кельвинов и не подвергается воздействию воздуха. Красный фосфор менее активен, чем белый фосфор. Красный фосфор имеет цепочечную полимерную структуру и более стабилен. И белый, и красный фосфор являются зажигательными и использовались для изготовления спичечных наконечников, хотя использование белого фосфора в значительной степени прекращено из-за токсичности.Фосфор имеет множество применений: трихлорид фосфора (PCl 3 ) используется в мыле, моющих средствах, пластмассах, синтетическом каучуке, нейлоне, моторных маслах, инсектицидах и гербицидах; фосфорная кислота, H 3 PO 4 , используется в удобрениях; фосфор также широко распространен в пищевой промышленности, используется в разрыхлителях, хлопьях быстрого приготовления, сыре, вялении ветчины и в терпкости безалкогольных напитков.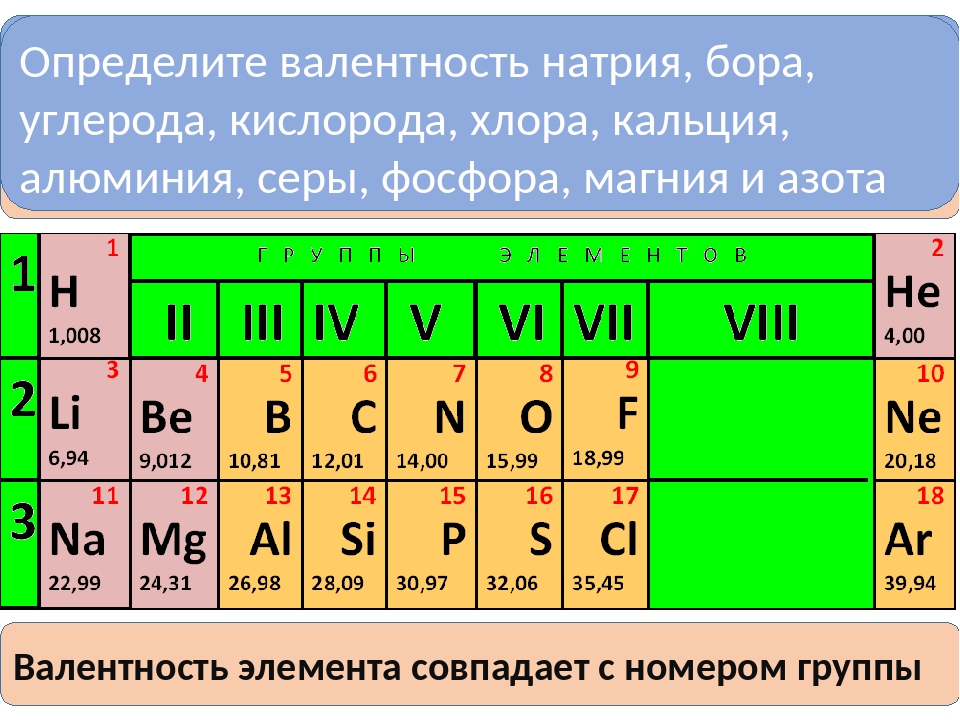
 Степени окисления сурьмы +3, -3 и +5. Сурьма проявляет аллотропию; наиболее устойчивым аллотропом является металлическая форма, близкая по свойствам к мышьяку: высокая плотность, умеренная теплопроводность, ограниченная способность проводить электричество. Оксид сурьмы представляет собой оксид сурьмы (III), который является амфотерным, что означает, что он может действовать как кислота, так и как основание.Сурьму получают в основном из сульфидных руд, и она испаряется при низких температурах. Наряду с мышьяком в сплавах обычно используют сурьму. Мышьяк, сурьма и свинец образуют сплав с желаемыми свойствами для электродов в свинцово-кислотных батареях. Мышьяк и сурьма также используются для производства полупроводниковых материалов, таких как GaAs, GaSb и InSb, в электронных устройствах.
Степени окисления сурьмы +3, -3 и +5. Сурьма проявляет аллотропию; наиболее устойчивым аллотропом является металлическая форма, близкая по свойствам к мышьяку: высокая плотность, умеренная теплопроводность, ограниченная способность проводить электричество. Оксид сурьмы представляет собой оксид сурьмы (III), который является амфотерным, что означает, что он может действовать как кислота, так и как основание.Сурьму получают в основном из сульфидных руд, и она испаряется при низких температурах. Наряду с мышьяком в сплавах обычно используют сурьму. Мышьяк, сурьма и свинец образуют сплав с желаемыми свойствами для электродов в свинцово-кислотных батареях. Мышьяк и сурьма также используются для производства полупроводниковых материалов, таких как GaAs, GaSb и InSb, в электронных устройствах. Висмут широко используется в косметических продуктах и медицине. Из этой группы висмут имеет самую низкую электроотрицательность и энергию ионизации, а это означает, что он с большей вероятностью потеряет электрон, чем остальные элементы группы 15. Вот почему висмут является самым металлическим из группы 15. Висмут также является плохим проводником электричества. Оксид висмута представляет собой оксид висмута (III); он действует как основание, как и положено для оксидов металлов. Висмут получают как побочный продукт рафинирования других металлов, что позволяет другим металлам перерабатывать свои побочные продукты в висмут.
Висмут широко используется в косметических продуктах и медицине. Из этой группы висмут имеет самую низкую электроотрицательность и энергию ионизации, а это означает, что он с большей вероятностью потеряет электрон, чем остальные элементы группы 15. Вот почему висмут является самым металлическим из группы 15. Висмут также является плохим проводником электричества. Оксид висмута представляет собой оксид висмута (III); он действует как основание, как и положено для оксидов металлов. Висмут получают как побочный продукт рафинирования других металлов, что позволяет другим металлам перерабатывать свои побочные продукты в висмут. ; Ховик, Джеймс В.; Дэниелс, Дуглас С. «Я кричу, ты кричишь …: новый поворот в демонстрациях жидкого азота». J. Chem. Educ. 1994 , 71 , 1080.
; Ховик, Джеймс В.; Дэниелс, Дуглас С. «Я кричу, ты кричишь …: новый поворот в демонстрациях жидкого азота». J. Chem. Educ. 1994 , 71 , 1080.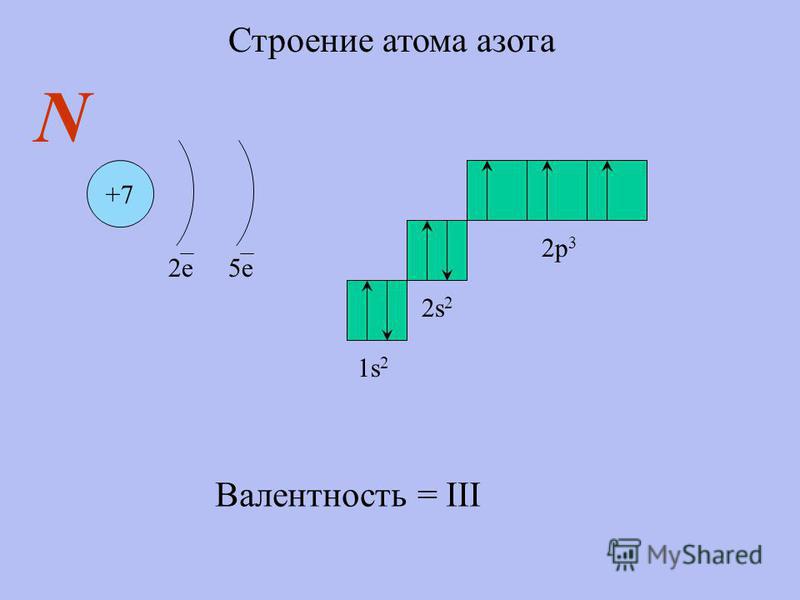 002% земной коры состоит из азота.
002% земной коры состоит из азота.