Валентность мышьяка (As), формулы и примеры
Общие сведения о валентности мышьяка
Мышьяк существует в виде нескольких аллотропных модификаций. Наиболее устойчив при обычных условиях металлический (серый) мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность 5,72 г/см3. При нагревании под нормальным давлением серый мышьяк сублимируется. Обладает металлической электрической проводимостью.
При быстром охлаждении пара, состоящего из молекул As4, образуется неметаллическая модификация желтый мышьяк. Плотность 2,0 г/см3. При действии света или слабом нагревании переходит в серый мышьяк.
Валентность мышьяка в соединениях
Мышьяк – тридцать третий по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VA группе. В ядре атома мышьяка содержится 33 протона и 42 нейтрона (массовое число равно 75). В атоме мышьяка есть четыре энергетических уровня, на которых находятся 33 электрона (рис. 1).
Рис. 1. Строение атома мышьяка.
Электронная формула атома мышьяка в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех неспаренных электронов свидетельствует о том, что мышьяк способен проявлять валентность III (низшая валентность) в своих соединениях (As2O3, AsH3, HAsO2, H3AsO3).
Для атома мышьяка характерно наличие возбужденного состояния из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Электроны 4s-подуровня распариваются и занимают свободную орбиталь 4 p -подуровня:
Наличие пяти неспаренных электронов в возбужденном состоянии свидетельствует о том, что мышьяк также проявляет в своих соединениях валентность V (H3AsO4, As2O5) (высшая валентность).
Примеры решения задач
ru.solverbook.com
Чему равна максимальная валентность атома мышьяка
СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
Вариант № ________
Число валентных электронов в атоме селена равно:
а) двум б) четырем в) шести г) семи
Число неспаренных электронов в атоме углерода в возбужденном состоянии равно:
а) одному б) двум в) трём г) четырём
Чему равна максимальная валентность атома мышьяка?
а) одному б) трём в) пяти г) семи
Валентность и степень окисления атома углерода в циановодороде HCN равны соответственно:
а) IV и +4 б) II и +2 в) IV и –4 г) IV и +2
Конфигурация валентных электронов 4s24p5 соответствует атому:
а) брома б) ванадия в) марганца г) мышьяка
Число неспаренных электронов в атоме хлора в невозбужденном состоянии равно:
а) одному б) трём в) пяти г) семи
Найдите пару элементов, наиболее схожих по строению атомов:
а) P и V б) К и Mg в) Sr и Ba г) Si и N
Какой из элементов имеет больший заряд ядра атома:
а) Co б) Ir в) Hg г) Cs
Число электронов на внешнем энергетическом уровне атома брома равно:
а) четырем б) шести в) семи г) восьми
Металлические свойства элементов в ряду Ge – As – Se – Br:
а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически
Неметаллические свойства элементов в главных подгруппах с увеличением порядкового номера:
а) ослабевают б) усиливаются в) не изменяются г) изменяются периодически
Радиус атома элементов в ряду Na – Mg – Al – Si:
а) увеличивается б) уменьшается в) не изменяется г) изменяется периодически
В группах с увеличением заряда атомного ядра металлические свойства элементов усиливаются, поскольку:
а) увеличивается радиус атома
б) увеличивается число валентных электронов
в) уменьшается число энергетических уровней
г) уменьшается радиус атома
Укажите элемент с наиболее ярко выраженными неметаллическими свойствами:
а) сурьма б) фосфор в) сера г) мышьяк
^
Вариант № ________
Число валентных электронов в атоме кремния равно:
а) двум б) четырем в) пяти г) семи
Число неспаренных электронов в атоме мышьяка в возбужденном состоянии равно:
а) одному б) трём в) пяти г) семи
Максимальная валентность теллура в соединении с кислородом равна:
а) шести б) пяти в) четырём г) двум
Валентность и степень окисления атома углерода в мочевине (NH2)2CO равны соответственно:
а) II и –2 б) II и +2 в) IV и –4 г) IV и +4
Распределение валентных электронов 5s24d3 соответствует атому:
а) сурьмы б) ниобия в) иттрия г) ванадия
Валентные возможности атома определяются:
а) числом неспаренных электронов
б) наличием вакантных орбиталей
в) наличием неподеленных электронных пар
г) все приведенные выше ответы верны
Найдите пару элементов, наиболее схожих по строению атомов:
а) Mg и B б) Sn и Pb в) As и Te г) S и Cl
Какой из элементов имеет больший заряд ядра атома:
а) Mo б) Ba в) W г) Pt
Число электронов на внешнем энергетическом уровне атома галлия равно:
а) одному б) трём в) пяти г) семи
Неметаллические свойства элементов в ряду P – S – O – F:
а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически
Высший оксид химического элемента с электронной формулой 1s22s22p63s23p64s2 растворили в воде. Раствор имеет реакцию среды:
а) кислотную б) нейтральную в) щелочную
Укажите самый активный металл из числа предложенных:
а) серебро б) цинк в) магний г) барий
Число электронов на внешнем энергетическом уровне элементов с № 3 по № 18:
а) увеличивается б) уменьшается в) не изменяется г) изменяется периодически
Свойства высших оксидов элементов третьего периода изменяются следующим образом:
а) от амфотерного через основные к кислотным
б) от основных через кислотные к амфотерным
в) от основных через амфотерные к кислотным
г) от кислотных через амфотерные к основным.
www.microbik.ru
Характеристика мешьяка
Характеристика мешьякаМышьяк (As) располагается во 4 периоде, в V группе, главной подгруппе, имеет порядковый номер 33.
Массовое число: A = 75
Число протонов: P = 33
Число электронов: ē = 33
Число нейтронов: N = A — Z = 75 — 33 = 42
 | 33As 1s2 2s2 2p6 3s2 3p6 |
Валентные электроны
| 33As | ↑↓ | ↑ | ↑ | ↑ | ||||||||
| 4s | 4p | 4d | ||||||||||
| 33As* | ↑ | ↑ | ↑ | ↑ | ↑ | |||||||
| 4s | 4p | 4d | ||||||||||
Мышьяк – p-элемент, неметалл.
Степени окисленияминимальная: -3
максимальная: +5
Высший оксид: As2O5 – оксид мышьяка (V).
Проявляет кислотные свойства:
As2O5 + 6NaOH ⟶ 2Na3AsO4 + 3H2O
Высший гидроксид: H3AsO4 – ортомышьяковая кислота.
Проявляет кислотные свойства:
H3AsO4 + 3NaOH ⟶ Na3AsO4 + 3H2O
Водородное соединение в низшей степени окисления: AsH3.
gomolog.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: Поделиться:
| |||||||||||
dpva.ru
Степени окисления мышьяка: химические свойства мышьяка
Прежде чем рассматривать степени окисления мышьяка, выявим его положение в таблице Менделеева и особенности строения. Кроме того, назовем основные физические и химические свойства данного химического элемента.

Положение в ПС
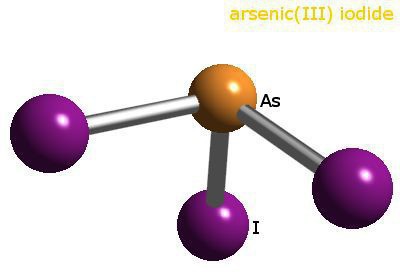
Основные степени окисления мышьяка, химические свойства, применение – все это можно узнать, взглянув на расположение элемента в периодической системе Менделеева. Мышьяк располагается в пятой группе, главной подгруппе, является представителем семейства азота. Он имеет относительную атомную массу 74,9216. Основные степени окисления мышьяка связаны именно с группой, в которой он находится в ПС. Данный элемент имеет 33 порядковый номер. Количество энергетических уровней соответствует номеру периода, в котором располагается элемент, оно равно четырем.
Рассмотрим расположение электронов на каждой атомной оболочке. На первом энергетическом уровне находится всего два спаренных электрона, вторую оболочку занимают восемь частиц: 2s и 6p. На третьем уровне, помимо них, располагается десять d-электронов, то есть всего 18 частиц. Внешний энергетический уровень представляет собой 2s-электрона, а также три неспаренных p-электрона. Именно количество валентных электронов определяет возможные степени окисления мышьяка.
Страницы истории
Именно мышьяк относят к пяти «алхимическим» элементам, известным со Средних веков. Интересным моментом является тот факт, что четыре из них находятся в пятой группе ПС. В те далекие времена никто не умел определять степени окисления мышьяка, но его соединения успешно применяли для изготовления лекарственных средств, создания красок.
После смены каменного века бронзовой эпохой люди научились изготавливать данный сплав со специальными характеристиками. Оказывается, в ее составе было до 7 процентов мышьяка и всего 3 процента олова. Ученые считают, что при первых выплавках бронзы вместо малахита, имеющего зеленый цвет, по ошибке брали зеленые сульфиды медно-мышьяковых минералов.
Удивительные эксплуатационные качества получаемого сплава сделали его популярным среди древних мастеров. Они специально искали в природе минералы, содержащие упомянутое вещество.
Степени окисления мышьяка в соединениях такого типа положительные, соответствуют его высшей валентности. Для идентификации сульфидов, содержащих мышьяк, минерал нагревают. Появление специфического чесночного запаха является подтверждением наличия в соединении мышьяка. Постепенно от выплавки мышьяковистой бронзы отказались. Среди причин прекращения производства ученые называют постоянные отравления мастеров во время работы.

Природные минералы
В виде минерала рассматриваемое нами вещество известно с давних времен. Например, степень окисления 3 мышьяк проявляет в соединении, известном в Древнем Китае в качестве «рудниковой пыли». Аристотель описывал минерал сандарак, представляющий собой сульфид мышьяка. В переводе с латинского языка его название звучит как «золотая краска». Применяли его в те далекие времена в качестве желтого красителя.
В одиннадцатом веке алхимиками выделялось три разных вида данного вещества. Степени окисления мышьяка в соединениях, представленных этими разновидностями, соответствуют номеру группы. Белым мышьяком называли его шестивалентный оксид, желтым именовали сульфид, а красным — As4S4 (тетрасульфид тетрамышьяка).
Белый вариант получали путем возгонки примесей в процессе обжига медных руд, в состав которых входил мышьяк. По мере конденсации из газообразного состояния происходит оседание оксида мышьяка в качестве белого налета. Он с древних времен применялся в качестве средства для уничтожения вредителей.
В тринадцатом веке Альбертом Великим было получено металлообразное вещество. Он нагревал с мылом желтый мышьяк. Вещество, получаемое в результате взаимодействия, не подтверждало «мистической связи» семи металлов с планетами. Возможно, именно из-за выявленного противоречия древними алхимиками мышьяк считался «незаконнорожденным» элементом. Именно в те далекие времена была выявлена его способность придавать меди белый цвет, благодаря чему его стали называть средством, «отбеливающим Венеру».
В качестве индивидуального вещества данный химический элемент был идентифицирован только в середине семнадцатого века. Немецкому аптекарю Иоганну Шредеру удалось выделить его, проведя химическое восстановление оксидов угля. Спустя некоторое время Николе Лемери удалось выделить металл, нагревая поташ, мыло, оксид мышьяка. В 18 веке это металл был известен в качестве необычного «полуметалла».
В конце 18 века шведским химиком К. В. Шееле была получена мышьяковая кислота, в которой проявляется высшая степень окисления мышьяка: +5. В девятнадцатом веке были определены органические вещества, которые содержат мышьяк.

Нахождение в природе
Высшая и низшая степень окисления мышьяка проявляются в его природных соединениях. В земной коре процентная концентрация данного элемента не превышает 5 граммов на тонну. Во многих минералах он содержится одновременно с никелем, кобальтом, медью, железом.
В настоящее время известно около двухсот различных природных минералов, в состав которых входит рассматриваемый нами химический элемент. Учитывая, что в них проявляется высшая и низшая степень окисления мышьяка, они имеют разное применение. Например, в соединении с сурьмой мышьяк проявляет отрицательную степень окисления. Учитывая тот факт, что у этого металла невысокая электроотрицательность, низшая степень окисления мышьяка составляет -3. Этот показатель характерен для арсенидов, а также для минерала аллемонтита.
Большая часть соединений с металлами мышьяка, учитывая специфику состава, представляет собой интерметаллические соединения, отличающиеся переменным составом этого химического элемента.
Характеристика арсенидов
Для арсенидов характерно содержание нескольких металлов, имеющих сходное строение кристаллических решеток. Данные минералы характеризуются металлическим блеском, они непрозрачные, имеют незначительную твердость.
В качестве примеров природных арсенидов можно рассмотреть следующие соединения:
- леллингит, аналогичный пириту;
- никелин, именуемый никелевым красным колчеданом;
- лангисит;
- орегонит;
- сперрилит.
Это, разумеется, далеко не полный перечень подобных минералов — на данный момент выделяют около двадцати пяти таких соединений. Среди максимально распространенных в природе можно упомянуть арсенопирит, именуемый мышьяковистым колчеданом. Он представляет собой продукт, получаемый при замещении атомов серы в пирите мышьяком. Соединения подобного плана, в которых не проявляется высшая степень окисления мышьяка, называют сульфосолями.
Их аналогами считают кобальтовый блеск, герсдорфит, энаргит, а также прустит. Последний является важной серебряной рудой, находящейся в верхнем слое драгоценных жил. В состав сульфосолей могут входить благородные металлы платиновой группы. Среди них интерес представляет ирарсит, а также орсит. В их составе есть редкие металлы, применяемые в качестве прекрасных катализаторов в органических и неорганических синтезах.
Максимальная степень окисления мышьяка проявляется в его природных сульфидах. Например, в оранжево-желтом диморфите, представляющем собой сульфид мышьяка (5). В тридцатые годы прошлого века были обнаружены природные залежи аурипигмента, включающего в свой состав сульфид трехвалентного мышьяка, на юге Верхоянского хребта. Размер обнаруженных кристаллов достигал 60 сантиметров в длину, а вес оценивался в 30 килограммов.

Характеристика арсенатов
Возможные степени окисления мышьяка можно рассмотреть на примере солей. Так, соединения мышьяковой кислоты, именуемые арсенатами, демонстрируют максимальный показатель для этого металла: +5. В качестве примера таких соединений приведем эритрин, имеющий яркий розовый цвет. Данную соль называют кобальтовым цветом, она имеет формулу Co3(AsO4)2*8H2O. Также можно отметить и гаспарит буро-красного оттенка в виде (Ce, La, Nd)ArO4.
В центре Швеции обнаружены лангбановские железо-марганцевые карьеры, где было найдено и охарактеризовано порядка пятидесяти различных арсенатов. Эти соединения образовались при взаимодействии мышьяковистой кислоты с гидроксидом марганца (2) при невысоких значениях температуры.
Какие в арсенатах проявляются степени окисления мышьяка? Характеристика этих солей подтверждает наличие в них серы. Несмотря на отсутствие промышленного применения, их эстетичный внешний вид позволяет использовать их для создания минералогических коллекций.
Интересную историю имеет купферникель, который соответствует минералу никелину. Средневековые немецкие горняки Никелем именовали горного злого духа, а «фальшивую медь» называли «купферникелем». Мастерами было выявлено внешнее сходство медно-красных кристаллов данного минерала с медными рудами. Применяли их в стекловарении для придания получаемому продукту зеленого оттенка. Только в середине восемнадцатого века минералогу Акселю Кронштедту удалось выделить из этого минерала никель.
Особенности размещения в природе
Мышьяк характеризуется высокой инертностью, поэтому его можно встретить и в самородном состоянии. Подобный металл в составе имеет от двух до шестнадцати процентов примесей, в основном ими будут серебро, железо, кобальт, никель. В нашей стране геологами был обнаружен самородный мышьяк в Амурской области, Забайкалье.
Его можно встретить и в горных породах, и в минералах, и в растениях, поэтому его по праву часто называют вездесущим элементом.
Какова максимальная и минимальная степень окисления мышьяка? Наибольшее значение соответствует номеру группы, в которой располагается данный элемент, и составляет +5. Это характерно для соединений, в которых он проявляет восстановительные свойства. Подробнее соединения данного уникального металла рассмотрим чуть позже.
По земному шару мышьяк распространен крайне неравномерно. Причина заключается в сформированности литосферы, а также в десорбционных и сорбционных процессах, происходящих в осадочных породах и почвах.
Благодаря отличной растворимости данного металла в воде он легко мигрирует. Например, при влажном климате происходит его вымывание из почвы с последующим движением вместе с грунтовыми водами, реками.
Физиологическое действие
В существенных количествах мышьяк содержится в минеральных водах. Существуют определенные нормативы по содержанию данного металла. При превышении допустимых показателей возникает серьезная угроза вреда для человеческого организма. В ходе химических исследований было обнаружено, что в природной воде мышьяк может содержаться в различных формах. Какие должны быть степени окисления мышьяка? Свойства соединений, обнаруженных в воде, подтверждают присутствие металла в виде раствора мышьяковистой кислоты.
Мышьяка в живом виде содержится около 6 мг на 1 килограмм. Часть морских водорослей может накапливать в себе упомянутое вещество в такой степени, что это может быть опасным для организма человека. Некоторые их виды, находящиеся в азиатских странах, способны размножаться в чистом растворе кислоты. Они применяются в качестве средства борьбы с крысами. В мозговой ткани человека, а также в его мышцах находится достаточное количество данного металла. Кроме того, он присутствует в ногтевых пластинах, скапливается в волосах.
Физические характеристики
Несмотря на то что мышьяк внешне напоминает металл, у него есть и неметаллические признаки. Например, он не способен образовывать солей с серной кислотой, выступая кислотообразующим элементом. Мышьяк способен существовать в различных аллотропных модификациях, напоминая фосфор. Самым устойчивым является серый мышьяк, который при нагревании возгоняется аналогично йоду.
По электрической проводимости эта модификация уступает меди, но превышает ртуть. При охлаждении паров мышьяка можно получить мягкое прозрачное вещество желтого оттенка, сходное с желтым фосфором. В процессе нагревания он превращается в иную аллотропную модификацию данного химического элемента.
При осаждении паров мышьяка на стекле можно наблюдать появление зеркальной пленки.
Соединения мышьяка
Степень окисления мышьяка в высшем оксиде составляет +5, то есть соответствует его высшей валентности. Но при возгонке паров данного металла во влажном воздухе образуется черная пленка его мышьяковистого ангидрида As2O3. Именно в такой форме в основном и существует окись этого элемента. Данный оксид проявляет амфотерные химические свойства.
В процессе окисления он превращается в высший оксид, где мышьяк демонстрирует значение степени окисления +5.
Чистый металл окисляется разбавленной азотной кислотой до ортомышьяковистой кислоты H3AsO3, в которой он имеет валентность 3. По своим химическим возможностям она считается кислотой средней силы, аналогичной борной кислоте. Солями считают арсениты, проявляющие яркие восстановительные свойства.
В хлориде металл имеет степень окисления +3, выступая в качестве типичного металлического элемента. Солеобразные арсениды, образующиеся при взаимодействии с активными металлами, подвергаются водному гидролизу. Например, арсин (AsH3) является ядовитым бесцветным газом, лишенным запаха.
Металлоорганические соединения
Мышьяк способен образовывать различные металлоорганические соединения. К примеру, в конце 18 века при перегонке с оксидом мышьяка (3) ацетата калия, была получена дымящаяся жидкость, имеющая неприятный запах. Полученный продукт был назван аларсином. В последующих исследованиях было выявлено, что в его составе присутствует мышьяк.
В конце девятнадцатого века были синтезированы ароматические арсины. Реакция была проведена при воздействии на смесь трихлорида мышьяка и арилгалогенида металлическим натрием. Некоторые из таких продуктов демонстрировали противомикробные свойства. На сегодняшний день осуществляется синтез десятка тысяч мышьякорганических веществ.
Применение мышьяка
Больше половины всего добываемого металла применяют в виде различных соединений. В чистом виде он практически не используется. В небольшом количестве его вводят в подшипниковые сплавы. Такие добавки положительно сказываются на твердости готового изделия, поэтому они востребованы в изготовлении электрических кабелей и аккумуляторов.
Минимальные дозы мышьяка способствуют повышению коррозионной стойкости, улучшают термические показатели латуни и меди. Если данный элемент не содержит дополнительных примесей, в таком случае он востребован в изготовлении полупроводниковых приборов. Для их создания мышьяк сплавляют с германием либо кремнием.
Кроме того, он является прекрасной легирующей добавкой при создании сталей. В качестве ценной насадки мышьяк необходим и в цветной металлургии. Даже при его незначительном содержании в сплаве можно существенно повысить прочность изготавливаемого изделия. Мышьяк повышает во время литья текучесть меди, облегчая процесс получения проволоки.
Есть и определенное отрицательное влияние этого переходного металла на производство. Его наличие в руде превращает процесс во вредное производство.
Среди разнообразных соединений мышьяка интерес представляет его трехвалентный оксид. Он и в настоящее время используется в стекловарении. Соли с показателем +5 востребованы в качестве антисептиков. Данный переходный элемент является одним из самых востребованных в современном химическом производстве, так как проявляет двойственные свойства в зависимости от среды протекания процесса.
fb.ru
Степень окисления мышьяка (As), формула и примеры
Общие сведения о степени окисления мышьяка
Мышьяк существует в виде нескольких аллотропных модификаций. Наиболее устойчив при обычных условиях металлический (серый) мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность 5,72 г/см3. При нагревании под нормальным давлением серый мышьяк сублимируется. Обладает металлической электрической проводимостью.
При быстром охлаждении пара, состоящего из молекул As4, образуется неметаллическая модификация желтый мышьяк. Плотность 2,0 г/см3. При действии света или слабом нагревании переходит в серый мышьяк.
Степень окисления мышьяка в соединениях
Мышьяк проявляет отрицательную степень окисления (-3) в солеподобных соединениях – арсенидах – бинарных соединениях с s-элементами I и II групп Периодической таблицы Д.И. Менделеева: K3As-3, Ca3As
Степень окисления (+3) мышьяк проявляет в галогенидах, оксидах, сульфидах и соответствующих им анионных комплексах: As+3Cl3, As+3Br3, As+32O3, As+3(OH)3, As+32S3, [As+3Cl4]—, [As+3O2]—, [As+3(OH)4]—, [As+3S2]—. Все эти вещества обладают амфотерными свойствами.
Наиболее характерная для мышьяка является степень окисления равна (+5): As+5Cl5, As+52O5, As+52S5.
Мышьяк также существует в виде элементарного соединения, где её степень окисления равна нулю.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Как узнать валентность по таблице Менделеева?
Для того, чтобы ответить на вопрос «как узнать валентность по таблице Менделеева» нужно точно знать определения этих двух понятий.
Валентность — это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. Мерой валентности служит число химических связей, образуемых атомом данного химического элемента с другими атомами, т.е., простыми словами, валентность – это способность образовывать химические связи с другими атомами.
Степень окисления же – это количественная оценка состояния атома химического элемента в соединении, основанная на его электроотрицательности. Степень окисления – это отрицательное или положительное число, которое присваивают элементу в соединении.
Высшая валентность хлора равна VII, а низшая – I. Эти значения валентности совпадают с максимальной положительной и максимальной отрицательной степенями окисления (+7 — , -1 — ) этого элемента.
Высшая валентность серы равна VI, а низшая – II. Эти значения валентности совпадают с максимальной положительной и максимальной отрицательной степенями окисления (+6 — , -2 — ) этого элемента.
Высшая валентность азота равна V, а низшая – III. Эти значения валентности совпадают с максимальной положительной и максимальной отрицательной степенями окисления (+5 — , -3 — ) этого элемента.
Валентность натрия равна I, а алюминия – III.
Высшая валентность мышьяка равна V, а низшая – III. Эти значения валентности совпадают с максимальной положительной и минимальной степенями окисления (+5 — , +3 — ) этого элемента.
ru.solverbook.com