Названия и формулы важнейших кислот и солей
Формула кислоты | Название кислоты | Название соли | Соответствующий оксид |
HCl | Соляная | Хлориды | —- |
HI | Йодоводородная | Иодиды | —- |
HBr | Бромиды | —- | |
HF | Плавиковая | Фториды | —- |
HNO3 | Азотная | Нитраты | N2O5 |
H2SO4 | Серная | Сульфаты | SO3 |
H2SO3 | Сернистая | Сульфиты | SO2 |
H2S | Сероводородная | Сульфиды | —- |
H2CO3 | Угольная | Карбонаты | CO2 |
H2SiO3 | Кремниевая | Силикаты | SiO2 |
HNO2 | Азотистая | Нитриты | N2O3 |
H3PO4 | Фосфорная | Фосфаты | P2O5 |
H3PO3 | Фосфористая | Фосфиты | P2O3 |
H2CrO4 | Хромовая | Хроматы | CrO3 |
H2Cr2O7 | Двухромовая | Бихроматы | CrO 3 |
HMnO4 | Марганцовая | Перманганаты | Mn2O7 |
HClO4 | Хлорная | Перхлораты | Cl2O7 |
Кислоты в лаборатории можно получить:
1) при растворении кислотных оксидов в воде:
N2O5 + H2O → 2HNO3;
CrO3 + H2O → H2CrO4;
2) при взаимодействии солей с сильными кислотами:
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl;
Pb(NO
Кислоты взаимодействуют с металлами, основаниями, основными и амфотерными оксидами, амфотерными гидроксидами и солями:
Zn + 2HCl → ZnCl2 + H2;
Cu + 4HNO3(концентр.) → Cu(NO3)2 + 2NO2 + 2H2O;
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O;
2HBr + MgO → MgBr2 + H2O;
6HI + Al2O3 → 2AlBr3 + 3H2O;
H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O;
AgNO3 + HCl → AgCl + HNO3.
Обычно кислоты взаимодействуют только с теми металлами, которые в электрохимическом ряду напряжения стоят до водорода, при этом выделяется свободный водород. С малоактивными металлами (в электрохимическом ряду напряжения стоят после водорода) такие кислоты не взаимодействуют. Кислоты, являющиеся сильными окислителями (азотная, концентрированная серная), реагируют со всеми металлами, за исключением благородных (золото, платина), но при этом выделяется не водород, а вода и оксид, например, SO
2 или NO2.Солью называют продукт замещения водорода в кислоте на металл.
Все соли делятся на:
средние – NaCl, K2CO3, KMnO4, Ca3(PO4)2 и др.;
кислые – NaHCO3, KH2PO4;
основные – CuOHCl, Fe(OH)2NO3.
Средней солью называется продукт полного замещения ионов водорода в молекуле кислоты атомами металла.
Кислые соли содержат атомы водорода, способные участвовать в химических обменных реакциях. В кислых солях произошло неполное замещение атомов водорода атомами металла.
Основные соли – это продукт неполного замещения гидроксо-групп оснований многовалентных металлов кислотными остатками. Основные соли всегда содержат гидроксогруппу.
Средние соли получают взаимодействием:
1) кислоты и основания:
NaOH + HCl → NaCl + H2O;
2) кислоты и основного оксида:
H2SO4 + CaO → CaSO4 + H2O;
3) кислотного оксида и основания:
SO2 + 2KOH → K2SO3 + H2O;
4) кислотного и основного оксидов:
MgO + CO2 → MgCO3;
5) металла с кислотой:
Fe + 6HNO3(концентр.) → Fe(NO3)3 + 3NO
2 + 3H2O;6) двух солей:
AgNO3 + KCl → AgCl + KNO3;
7) соли и кислоты:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3;
8) соли и щелочи:
CuSO4 + 2CsOH → Cu(OH)2 + Cs2SO4.
Кислые соли получают:
1) при нейтрализации многоосновных кислот щелочью в избытке кислоты:
H3PO4 + NaOH → NaH2PO4 + H2O;
2) при взаимодействии средних солей с кислотами:
СaCO3 + H2CO3 → Ca(HCO3)2;
3) при гидролизе солей, образованных слабой кислотой:
Na2S + H2O → NaHS + NaOH.
Основные соли получают:
1) при реакции между основанием многовалентного металла и кислотой в избытке основания:
Cu(OH)2 + HCl → CuOHCl + H2O;
2) при взаимодействии средних солей со щелочами:
СuCl2 + KOH → CuOHCl + KCl;
3) при гидролизе средних солей, образованных слабыми основаниями:
AlCl3 +H2O → AlOHCl2 + HCl.
Соли могут взаимодействовать с кислотами, щелочами, другими солями, с водой (реакция гидролиза):
2H3PO4 + 3Ca(NO3)2 → Ca3(PO4)2 + 6HNO3;
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl;
Na2S + NiCl2 → NiS + 2NaCl.
В любом случае реакция ионного обмена идет до конца только тогда, когда образуется малорастворимое, газообразное или слабо диссоциирующее соединение.
Кроме того, соли могут взаимодействовать с металлами при условии, что металл более активный (имеет более отрицательный электродный потенциал), чем металл, входящий в состав соли:
Fe + CuSO4 → FeSO4 + Cu.
Для солей также характерны реакции разложения:
BaCO3 → BaO + CO2;
2KClO3 → 2KCl + 3O2.
studfile.net
список кислот
Названия важнейших кислот и их солей
Формула кислоты | Название кислоты | Кислотный остаток | Название солей (кислотного остатка) |
HF | Фтороводородная | F— | Фториды |
NCl | Хлороводородная | Cl— | Хлориды |
HBr | Бромоводородная | Br— | Бромиды |
HI | Иодоводородная | I— | Иодиды |
HCN | Циановодородная | CN— | Цианиды |
H2S | Сероводородная | S2- | Сульфиды |
H2SO4 | Серная | SO42- | Сульфаты |
H2SO3 | Сернистая | SO32- | Сульфиты |
HNO3 | Азотная | NO3— | Нитраты |
HNO2 | Азотистая | NO2— | Нитриты |
H2CO3 | Угольная | CO32- | Карбонаты |
H3PO4 | Ортофосфорная | PO43- | Ортофосфаты |
HPO3 | Метафосфорная | PO3— | Метафосфаты |
H3PO3 | Фосфористая | HPO32- | Фосфиты |
H2CrO4 | Хромовая | CrO42- | Хроматы |
H2CrO7 | Дихромовая | Cr2O72- | Дихроматы |
H3CrO3 | Ортохромистая | CrO33- | Ортохромиты |
HMnO4 | Марганцовая | MnO4— | Перманганаты |
H2MnO4 | Марганцовистая | MnO42- | Манганаты |
H3BO3 | Ортоборная | BO33- | Ортобораты |
HBO2 | Метаборная | BO2— | Метабораты |
H2B4O7 | Тетраборная | B4O72- | Тетрабораты |
H3AlO3 | Ортоалюминиевая | AlO33- | Ортоалюминаты |
HalO2 | Метаалюминиевая | AlO2— | Метаалюминаты |
H2ZnO2 | Цинковая | ZnO22- | Цинкаты |
H4SiO4 | Ортокремниевая | SiO44- | Ортосиликаты |
H2SiO3 | Метакремниевая | SiO32- | Метасиликаты |
HСlO4 | Хлорная | ClO4— | Перхлораты |
HСlO3 | Хлорноватая | ClO3— | Хлораты |
HСlO2 | Хлористая | ClO2— | Хлориты |
HСlO | Хлорноватистая | ClO— | Гипохлориты |
studfile.net
Внеклассный урок — Таблица названий кислот и солей
Формула кислоты | Название кислоты | Название соответствующей соли |
HAlO2 | Метаалюминиевая | Метаалюминат |
HBO2 | Метаборная | Метаборат |
H3BO3 | Ортоборная | Ортоборат |
HBr | Бромоводородная | Бромид |
HCOOH | Муравьиная | Формиат |
HCN | Циановодородная | Цианид |
H2CO3 | Угольная | Карбонат |
H2C2O4 | Щавелевая | Оксолат |
H4C2O2 | Уксусная | Ацетат |
HCl | Хлороводородная | Хлорид |
HClO | Хлорноватистая | Гипохлорит |
HClO2 | Хлористая | Хлорит |
HClO3 | Хлорноватая | Хлорат |
HClO4 | Хлорная | Перхлорат |
HCrO2 | Метахромистая | Метахромит |
HCrO4 | Хромовая | Хромат |
HCr2O7 | Двухромовая | Дихромат |
HI | Иодоводородная | Иодид |
HMnO4 | Марганцевая | Перманганат |
H2MnO4 | Марганцовистая | Манганат |
H2MoO4 | Молибденовая | Молибдат |
HNO2 | Азотистая | Нитрит |
HNO3 | Азотная | Нитрат |
HPO3 | Метафосфорная | Метафосфат |
HPO4 | Ортофосфорная | Ортофосфат |
H4P2O7 | Двуфосфорная(Пирофосфорная) | Дифосфат(Пирофосфат) |
H3PO3 | Фосфористая | Фосфит |
H3PO2 | Фосфорноватистая | Гипофосфит |
H2S | Сероводородная | Сульфид |
H2SO3 | Сернистая | Сульфит |
H2SO4 | Серная | Сульфат |
H2S2O3 | Тиосерная | Тиосульфат |
H2Se | Селеноводородная | Селенид |
H2SiO3 | Кремниевая | Силикат |
HVO3 | Ванадиевая | Ванадат |
H2WO4 | Вольфрамовая | Вольфрамат |
raal100.narod.ru
8 сильнейших кислот, известных нам

Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа — это количественно выраженная сила кислоты в водном растворе. С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [h4O +] в растворе.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka
pKa = -log10Ka.
Чем сильнее кислота, тем ниже значения pKa.
 Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота. Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота
 Серная кислота (98%) на листе бумаги
Серная кислота (98%) на листе бумагиХимическая формула : H2SO4
pKa значение : -3
Ho значение : 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота

Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
 Трифторметансульфоновая кислота
Трифторметансульфоновая кислотаХимическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
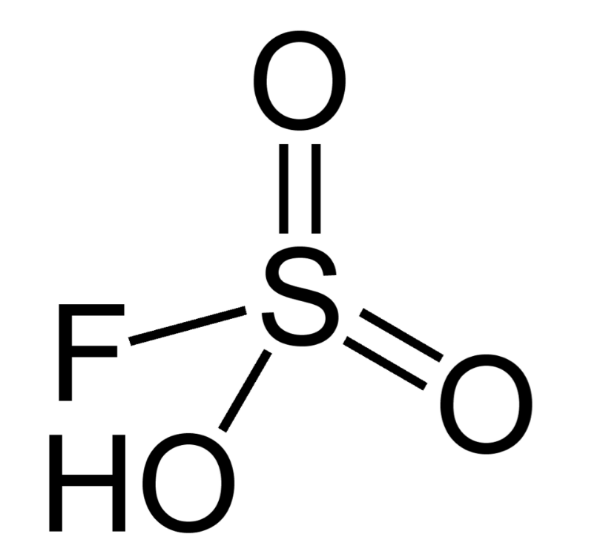
Химическая формула: HSO 3 F
H O значение : -15.1
pK A значение : -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота

Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
 Общая структура карбоновой кислоты
Общая структура карбоновой кислотыХимическая формула : H (CHB 11 F 11 )
H o значение: -18
pK a значение : -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота . Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом . В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота

Химическая формула : FSO 3 H · SbF 5
H o значение : -23
FSO 3 H · SbF 5 , наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
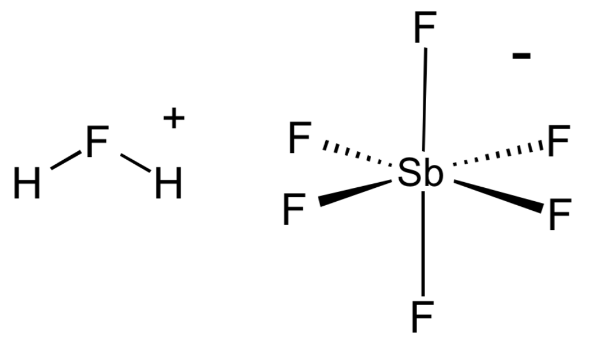
Химическая формула : H 2 FSbF 6
H o значение : -15 (в чистом виде), -28 (с> 50 мол.%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
new-science.ru