Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
2Na + 2H2O = 2NaOH + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Mg + 2H2O = Mg(OH)2↓ + H2↑
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 оС). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Zn + H2O = ZnO + H2↑
3Fe + 4H2O = Fe3O4 + 4H2 или
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
ОГЭ. Взаимодействие веществ с водой
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2.
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
Mg + 2H2O → Mg(OH)2 + H2.
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2.
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
Zn + H2O → ZnO + H2.
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
С + H2O → CO + H2
Si + 2H2O → SiO2 + 2H2.
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
M2O + H2O → 2MOH или MO + H2O → M(OH)2.
Например:
Na2O + H2O → 2NaOH или CaO + H2O → Ca(OH)2.
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
Примеры амфотерных оксидов: ZnO, BeO, Al2O3, Fe2O3, Cr2O3.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
Исключение: SiO2 + H2O → реакция не идет.
металлы с водой
3)Взаимодействие металлов с H2O(примеры). 1. щелочные и щелочноземельные металлы легко реагируют с водой при обычной температуре с выделением водорода и образованием гидроксида; 2. менее активные металлы взаимодействуют с водой только в раскаленном виде с выделением водорода и образованием оксида. !!!
Реакции
взаимодействия металлов с водой в общем
виде описываются
схемойMe+H2O→Me(OH)n+H2↑
Me -n(e)=Men+ (восстановитель) Е
-n(e)=Men+ (восстановитель) Е мет 2H ++2(e)=H2
мет 2H ++2(e)=H2 (окислитель) Е
(окислитель) Е 2Н/H2=-0,41
В
ΔE
2Н/H2=-0,41
В
ΔE =-0,41-
Е
=-0,41-
Е мет
мет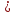 0
⟹
Е
0
⟹
Е мет
мет -0,41
В
-0,41
В
Реагировать с водой могут те металлы, потенциал которых менее -0,41 B. Практически в воде растворяются щелочные; Mg и щелочноземельные металлы, так как только их оксидные пленки растворимы в воде, а такие металлы, как алюминий, цинк, хром, титан, с водой не реагируют из-за явления пассивации.
Пример:
Растворение
(коррозия) Ca/CaO+H2O→
1.
CaO+H2O=Ca(OH)2 Ca+2H2O=Ca(OH)2+H2↑
2.
2Li +
2 H2O = 2 LiOH + H2 (протекает
реакция замещения) 3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
(протекает
реакция замещения) 3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.( Mn, Zn, Fe, Co, Ni, Sn, Pb)
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
Fe + H2O = FeO + H2 (протекает реакция замещения)
Ni + H2O = NiO + H2
Взаимодействие воды с металлами | moiurokihimii.ru
А разве такое возможно — спросите вы? Ведь можно же хранить воду, готовить пищу в металлической посуде, например, алюминиевой. И никаких признаков взаимодействия воды с оцинкованным ведром при мытье пола тоже никто не замечал.
И все же вода взаимодействует со многими металлами. Но реакции эти идут по-разному.
Если металл активный — литий, натрий, калий, кальций, барий, то получается так:
2Na + 2H2O → 2NaOH + H2
Кусочек натрия, попав в воду, быстро бегает по ее поверхности — его подталкивает выделяющийся водород. А в растворе образуется новое вещество — гидроксид натрия NaOH. Внимание: мы впервые встречаемся с веществом, молекула которого содержит группу атомов ОН. Эта группа ОН называется гидроксилом или гидроксогруппой. Вещества же, молекулы которых состоят из атомов металла и одной или нескольких гидроксогрупп, называются
Запомним: число групп ОН в молекуле основания всегда равно валентности металла в основании:
KOH NaOH LiOH Mg(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3
Литий и калий взаимодействуют с водой так же, как и натрий, но у лития эта реакция идет чуть медленнее, а у калия быстрее, чем у натрия. Значит, это металлы разной химической активности.
2Li + 2H2O → 2LiOH + H2
2K + 2H 2O → 2KOH + H2
А вот как взаимодействуют с водой двухвалентные активные металлы кальций и барий:
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Вот так взаимодействует с водой алюминий:
Если металл менее активен, то реакция его с водой идет медленнее, незаметнее, чаще при нагревании, и образуются при этом водород и оксид металла, а не гидроксид:
3Fe + 4H2 → Fe3O4 + 4H2
Если же металл находится в ряду активности правее водорода, то он с водой не реагирует: это медь серебро ртуть, золото, платина.
Еще на эту тему:
Урок 28. Химические свойства воды – HIMI4KA
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.


При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).


При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:


На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):


Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:


в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:


Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.


Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:


В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Взаимодействие воды с металлами, опыт эксперта

Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями. Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода. Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH+ → Men+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
NaH + H2O ® NaOH + H2
NaH + HCl ® NaCl + H2
 Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nh3O → 2Me(OH)n + nh3 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2h3O → Ca(OH)2 + h3↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nh3O Me2On + nh3 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде. Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Вконтакте
Google+