Опыт Резерфорда. Ядерная модель атома
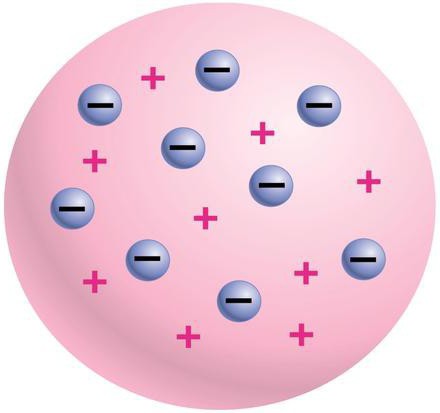
Первая попытка создания модели атома была предпринята Дж. Томпсоном. Он полагал, что атом – это электронейтральная система формы шара с радиусом 10-10 м. На рисунке 6.1.1. показано, как одинаково распределяется положительный заряд атома, причем отрицательные электроны располагаются внутри него. Чтобы получить объяснение линейчатых спектров атомов, Томпсон тщетно пытался определить расположение электронов в атоме, для расчета частоты их колебаний в положении равновесия. Спустя время Э. Резерфорд доказал, что заданная Томсоном модель была неверна.

Рисунок 6.1.1. Модель Дж. Томпсона.
Электроны в атоме. Опыты Резерфорда и Томпсона
Внутренняя структура атомов была исследована Э. Резарфордом, Э. Марсденом, Х. Гейгером еще в 1909-1911 годах. Было применено зондирование атома α-частицами, возникающими во время радиоактивного распада радия и других элементов. Их масса в 7300 раз больше массы электрона, а положительный заряд равняется удвоенному элементарному заряду.
В опытах Резерфорда были использованы α-частицы, имеющие кинетическую энергию 5 Мэв.
Определение 1Альфа-частицы – это ионизированные атомы гелия.
Когда было изучено явление радиоактивности, этими частицами Резерфорд уже «бомбардировал» атомы тяжелых металлов. Входящие в них электроны не могут заменить траектории α-частиц, так как имеют малый вес. Рассеяние может быть вызвано тяжелой положительно заряженной частью атома. На рисунке 6.1.2 подробно описан опыт Резерфорда.

Рисунок 6.1.2. Схема опыта Резерфорда по рассеянию α-час
Ядерная модель строения атома по Резерфорду
К началу XX века было достоверно установлено, что в состав каждого атома входят отрицательно заряженные электроны и положительно заряженные частицы. В целом атом электронейтрален.В 1911 г. английский физик Резерфорд предложил ядерную модель строения атома, сохранившую свое значение и до настоящего времени, хотя некоторые положения Резерфорда рассматриваются иначе с современной точки зрения. Согласно теории Резерфорда весь положительный заряд и почти вся масса атома (99,4%) сосредоточены в атомном ядре. Размер ядра ничтожно мал по сравнению с размером атома (10–13см и 10–8см). Вокруг ядра по замкнутым эллиптическим орбитам, которые в первом приближении можно считать круговыми, движутся электроны, образуя электронную оболочку атома. Заряд ядра равен по абсолютной величине суммарному заряду электронов. В 1919 году Резерфордом был открыт носитель положительного заряда–протон.
Согласно гипотезе, высказанной в 1923 году Д. Иваненко и являющейся теперь общепризнанной, в состав атомных ядер входят положительно заряженные протоны и электронейтральные нейтроны. Заряд протона по абсолютной величине равен заряду электрона. Масса протона почти равна массе нейтрона и в 1836 раз больше массы электрона. Число протонов в ядре равно порядковому номеру элемента в таблице Менделеева, а сумма протонов и нейтронов равна округленному до целого числа атомному весу.
Таким образом, атом в целом является совокупностью небольшого числа очень малых частиц–электронов, протонов и нейтронов, распределенных в сравнительно очень большом объеме.
Затруднения теории Резерфорда
Предложенная Резерфордом модель строения атома покоится на твердых экспериментальных данных и хорошо объясняет их. Но в то же время она не объясняет ни спектральных закономерностей, ни самого факта испускания атомом монохроматического излучения. В самом деле, движение электрона по орбите, как и всякое криволинейное движение, есть движение с ускорением. Согласно законам классической электродинамики криволинейное движение должно сопровождаться излучением света соответствующей частоты. В частности, при равномерном движении по кругу частота излучения равна частоте обращения по кругу. Следовательно, при движении электрона вокруг ядра атом должен излучать энергию. Но непрерывное уменьшение энергии приводит к непрерывному уменьшению радиуса орбиты электрона и электрон будет двигаться по спирали приближаясь к ядру. А так как скорость движения электрона остается неизменной, то увеличивается число оборотов в секунду, т.е. непрерывно должна увеличиваться частота излучении, спектр излучения должен быть непрерывным. Непрерывно приближаясь к ядру электрон через малую долю секунды должен упасть на ядро, т.е. атом должен являться неустойчивой системой.
Таким образом, применение классической электродинамики к модели атома Резерфорда приводит к полному противоречию с экспериментальными фактами. Согласно классической теории должно быть:
а) непрерывное приближение электрона к ядру, т.е. неустойчивость атома, но в действительности атом является весьма устойчивой системой;
б) спектр излучения должен быть только непрерывным, сплошным, в действительности же наблюдаются спектры линейчатые.
Для объяснения этих противоречий понадобилось новая физическая теория – квантовая теория.
Томпсона (1904), Резерфорда (1911), Бора (1913), Шрёдингера. ~ Проза (Мистика)
Модели атома: Томпсона (1904), Резерфорда (1911), Бора (1913), Шрёдингера.Томпсон Джон в 1904 г. предложил пудинговую модель атома (безядерную).
Томпсон Джон (1856-1940) открыл электроны в 1897 г. а в марте1904 г. опубликовал статью (28 стр.), в которой предложил пудинговую модель атома. «Что- то вроде пудинга с изюмом», как сказал Томсон.
Ядра атома у Томпсона не было!
«атомы элементов состоят из нескольких отрицательно заряженных корпускул,
заключённых в сферу (не шар), имеющую однородно распределённый положительный
электрический заряд…[2]
http://www.chemteam.info/Chem-History/Thomson-Stru…
Модель Томсона подобна модели сатурнианских
колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла).
Томсон предложил модель атома[5],
который состоит из положительно заряженной сферы, в которой электроны
находятся в стабильном статическом равновесии с их взаимным
отталкиванием и притяжением к положительно заряженной сфере, и смог
показать, что такая модель будет иметь периодические свойства, если
электроны собираются в последовательные кольца по мере увеличения их
числа. Модель Томсона дала, по существу, то же основание периодического закона, что и более продвинутые модели, основанные на ядре атома, которые были выведены Бором
из спектральных данных.

Резерфорд в 1911 г. предложил ядерную, планетарную модель атома.
Э. Резерфорд предложил планетарную модель атома, согласно которой ядро
находится в центре атома, а электроны вращаются вокруг ядра подобно
планетам, вращающимся вокруг Солнца. Заряды электронов уравновешиваются
положительным зарядом ядра, и атом в целом остается электронейтральным. Возникающая
вследствие вращения электронов центробежная сила уравновешивается
электростатическим притяжением электронов к противоположно заряженному
ядру. Опыты Резерфорда и его сотрудников привели к выводу, что в
центре атома находится плотное положительно заряженное ядро, диаметр
которого не превышает 10^-14–10^-15 м. Это ядро занимает только
десятую-двенадцатую часть полного объема атома, но содержит весь
положительный заряд и не менее 99,95 % его массы. Веществу,
составляющему ядро атома, следовало приписать колоссальную плотность
порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду
всех электронов, входящих в состав атома.
==================================================================================================
Боровская модель атома (Модель Бора) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать
энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы
преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в
том, что электроны в атоме могут двигаться только по определённым
(стационарным) орбитам, находясь на которых они не излучают энергию, а
излучение или поглощение происходит только в момент перехода с одной
орбиты на другую. Причём, стационарными являются лишь те орбиты, при
движении по которым момент количества движения электрона равен целому
числу постоянных Планка[1].
Недостатки теории Бора
- Не смогла объяснить интенсивность спектральных линий.
- Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других).
- Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
=====================================================================================================
Э. Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели Бора-Резерфорда. Согласно современной модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Модель Резерфорда
Физика > Модель Резерфорда
Как выглядит модель атома Резерфорда: спор с моделью Томпсона и эксперимент с золотой фольгой, опыты Резерфорда, новая модель строения атома, электроны и ядро.
Резерфорд подтвердил, что атом обладает концентрированным центром положительного заряда и относительно большой массой.
Задача обучения
- Рассмотреть эксперимент с золотой фольгой, осуществленный Гейгером и Марсденом.
Основные пункты
- В 1911 году Резерфорд опровергнул модель Томпсона в эксперименте с золотой фольгой.
- Резерфорд заметил, что большинство альфа-частиц отклоняются под небольшими углами, а другие отражаются к альфа-источнику.
- Ядром именуется высокоэнергетическая область с положительным зарядом.
Термин
- Альфа-частицы – положительно заряженное ядро атома гелия-4, выпущенное из-за радиоактивности.
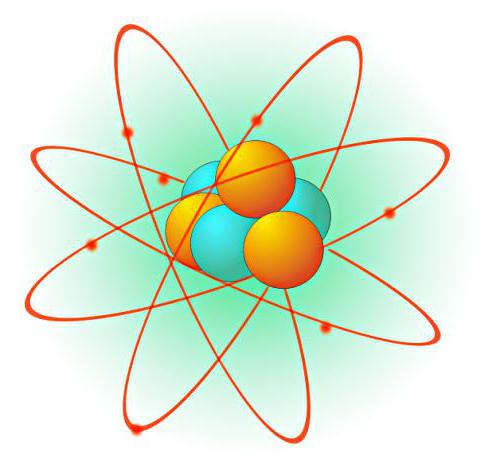
Моделью Резерфорда именуют модель строения атома, созданную Эрнстом Резерфордом. Он предположил, что модель Томпсона была ошибочной. Новая ядерная модель Резерфорда показывала удивительные особенности относительно высокого центрального заряда, сосредоточенного в крошечных объемах. Этот центральный участок также вмещал наибольшую часть массы и позже стал называться ядром. Ниже представлена схема модели строения атома Резерфорда.

Главная схема атомной планетарной модели: электроны – зеленые, а ядро – красное
Резерфорд планировал изучать атомную структуру, поэтому в 1911 году создал эксперимент на основе использования альфа-частиц, излучаемых радиоактивным элементом. Гейгер и Марсден расстреляли альфа-частички крупными кинетическими энергиями на тонкой золотой фольге. Полагали, что вычисление структуры рассеянных частиц даст сведения о позиции заряда внутри атома.
Если срабатывает модель «пудинга Томпсона», то альфа-частицы обязаны отклониться хотя бы на несколько градусов. Но реальные показатели всех удивили. Как и ожидалось многие альфа-частицы прошли сквозь, но у других наблюдалось отклонение под малым углом, а некоторые отразились обратно к источнику.

Сверху: Ожидаемые результаты – альфа-частицы проходят сквозь. Нижняя: Реальная картина – определенная часть отклонилась, что говорит о небольшом концентрированном положительном заряде
Помня о том, насколько далеко частицы с известными скоростными показателями могут проникнуть в центральный заряд – 100э, Резерфорд определил, что радиус центрального заряда золота обязан быть меньше 34 ⋅ 10-14 метров. И это странно, так как подразумевает мощный центральный заряд меньше диаметра атома.
Модели атома Томсона и Резерфорда кратко
Еще во времена Древней Греции философы догадывались о внутреннем строении вещества. А первые модели строения атомов появились уже в начале XX века. Гипотеза Дж. Томсона не была воспринята научным сообществом того времени критично – ведь до нее уже были выдвинуты различные теории о том, что же находится внутри мельчайших частиц материи.

«Пудинг с изюмом», или модель Томсона
Вплоть до XIX века ученые предполагали, что атом является неделимым. Однако все изменилось после того, как Джозеф Томсон в 1897 году открыл электрон – стало понятно, что ученые ошибались. Обе модели атома Томсона и Резерфорда были выдвинуты в начале прошлого столетия. Первой появилась модель У. Томсона, который высказывал предположение о том, что атом является сгустком материи, имеющей положительный электрический заряд. Внутри этого сгустка находятся равномерно распределенные электроны – именно поэтому данная модель была названа «кексовой». Ведь согласно ей электроны в материи располагаются подобно изюминкам в кексе. Другое неофициальное название модели – «Пудинг с изюмом».

Заслуги Дж. Томсона
Данная модель была разработана еще более детально Дж. Дж. Томсоном. В отличие от У. Томсона, он предполагал, что электроны в атоме располагаются строго на одной плоскости, представляющие собой концентрические кольца. Несмотря на одинаковую важность моделей атома Томсона и Резерфорда для науки того времени, стоит отметить, что Дж. Томсоном, помимо всего прочего, впервые был предложен способ определения количества электронов внутри атома. Его метод был основан на рассеивании рентгеновских лучей. Дж. Томсон предположил, что именно электроны являются теми частицами, которые должны быть в центре рассеивания лучей. Кроме того, именно Томсон был тем ученым, который открыл электроны. В современных школах именно с изучения его открытий начинается изучение курса квантовой механики.
Минусы теории Томсона
Однако по сравнению с моделью Резерфорда, модель атома Томсона имела один существенный недостаток. Она не могла объяснить дискретный характер излучения атома. Нельзя было с ее помощью и сказать что-либо о причинах устойчивости атома. Окончательно она была опровергнута, когда были произведены знаменитые опыты Резерфорда. Модель атома Томсона при этом имела не меньшую ценность для науки того времени, нежели другие гипотезы. Необходимо учитывать, что все эти модели, имевшиеся на тот момент, являлись сугубо гипотетическими.
Особенности опыта Резерфорда
В 1906-1909 годах Г. Гейгером, Э. Мардсеном и Э. Резерфордом были проведены опыты, в ходе которых альфа-частицы подвергались рассеиванию на поверхности золотой фольги. Кратко модели атома Томсона и Резерфорда описываются следующим образом. В модели Томсона электроны распределены в атоме неравномерно, а в теории Резерфорда – вращаются в концентрических плоскостях. Отличительным фактором в опыте Резерфорда было использование именно альфа-частиц вместо электронов. Альфа-частицы, в отличие от электронов, обладали гораздо большей массой, и не претерпевали значительных отклонений, когда сталкивались с электронами. Поэтому у ученых была возможность регистрировать только те столкновения, которые происходили с положительно заряженной частью атома.

Роль открытия Резерфорда
Этот опыт имел решающее значение для науки. С его помощью ученые смогли получить ответы на те вопросы, которые оставались загадкой для авторов различных моделей атома. Томсон, Резерфорд и Бор, хотя и обладали одинаковой базой, все же внесли несколько различный вклад в науку – и результаты опытов Резерфорда в данном случае были поразительными. Их результаты оказались прямо противоположными тому, что ожидали увидеть ученые.
Большая часть альфа-частиц проходило через лист фольги по прямым (или практически прямым) траекториям. Однако траектории некоторых альфа-частиц отклонялись на значительные углы. А это было свидетельством того, что в атоме находилось образование с очень большой плотностью, и имевшее положительный заряд. В 1911 году на основе экспериментальных данных была выдвинута модель строения атома Резерфорда. Томсон, теория которого до этого считалась господствующей, в это время продолжал работать в лаборатории Кавендишского университета. До конца своей жизни ученый продолжал верить в существование механического эфира, несмотря на все успехи в научных исследованиях того времени.

Планетарная модель Резерфорда
Обобщив результаты экспериментов, Эрнест Резерфорд выдвинул основные положения своей теории: согласно ей, атом состоит из тяжелого и плотного ядра очень малых размеров; вокруг этого ядра расположены электроны, находящиеся в непрерывном движении. Радиусы орбит этих электронов также малы: они составляют 10-9 м. Эта модель была названа «планетарной» за свое сходство с моделью Солнечной системы. В ней планеты движутся по эллиптическим орбитам вокруг огромного и массивного центра, обладающего притяжением – Солнца.
Электроны вращаются в атоме с такой гигантской скоростью, что образуют вокруг поверхности атома нечто вроде облака. Согласно теории Резерфорда, атомы располагаются друг от друга на некотором расстоянии, что позволяет им не слипаться друг с другом. Ведь вокруг каждого из них существует отрицательно заряженная электронная оболочка.
Модели атома Томсона и Резерфорда: основные отличия
Каковы же основные различия между двумя важнейшими теориями строения атома? Резерфорд предполагал, что в центре атома находится ядро, обладающее положительным электрическим зарядом, и объем которого, в сравнении с размерами атома, ничтожно мал. Томсон же предполагал, что весь атом представляет собой образование с большой плотностью. Вторым главным отличием было понимание положения электронов в атоме. Согласно Резерфорду, они вращаются вокруг ядра, и их число примерно равно ½ атомной массы химического элемента. В теории Томсона же электроны внутри атома распределены неравномерно.
Минусы теории Резерфорда
Однако, несмотря на все достоинства, на тот момент теория Резерфорда содержала в себе одно важное противоречие. По законам классической электродинамики, электрон, вращавшийся вокруг ядра, должен был постоянно испускать порции электрической энергии. Из-за этого радиус орбиты, по которой двигается электрон, должен был непрерывно испускать электромагнитное излучение. Согласно этим представлениям, время жизни атома должно быть ничтожно малым.
Чаще всего, когда говорят об открытии внутреннего строения атома, упоминают имена Томсона и Резерфорда. Опыты Резерфорда, модель атома которого сейчас известна каждому студенту физико-математических отделений в вузах, в настоящее время является частью истории науки. Когда Резерфорд сделал свое открытие, он воскликнул: «Теперь мне известно, как выглядит атом!» Однако в действительности он ошибался, ведь истинная картина стала известна ученым гораздо позднее. Хотя модель Резерфорда и была подвергнута с течением времени значительным коррективам, ее смысл остался неизменным.

Модель Бора
Однако, помимо моделей атома Томсона и Резерфорда, существовала еще одна теория, объяснявшее внутреннее строение этих мельчайших частиц материи. Она принадлежит Нильсу Бору – датскому физику, предложившему свое объяснение в 1913 году. Согласно его модели, электрон в атоме не подчиняется стандартным физическим законам. Именно Бор был тем ученым, который ввел в науку понятие о соотношении между радиусом орбиты электрона и его скоростью.
В процессе создания своей теории Бор взял за основу модель Резерфорда, однако подверг ее значительной доработке. Модели атомов Бора, Резерфорда и Томсона сейчас могут показаться несколько простыми, однако именно они легли в основу современных представлений о внутреннем строении атома. Сегодня общепринятой является квантовая модель атома. Несмотря на то что квантовая механика не может описывать движение планет Солнечной системы, понятие орбиты до сих пор осталось в теориях, описывающих внутренне строение атома.