Основные положения МКТ. Строение вещества. Молекула. Видеоурок. Физика 10 Класс
Данный видеоурок посвящен теме «Основные положения МКТ. Строение вещества. Молекула». Здесь вы узнаете, что изучает молекулярно-кинетическая теория (МКТ) в физике. Познакомитесь с тремя основными положениями, на которых базируется МКТ. Узнаете, чем определяются физические свойства вещества и что представляют собой атом и молекула.
Для начала давайте вспомним все предыдущие разделы физики, которые мы изучали, и поймём, что всё это время мы рассматривали процессы, происходящие с макроскопическими телами (или объектами макромира). Теперь же мы будем изучать их строение и процессы, протекающие внутри них.
Определение. Макроскопическое тело – тело, состоящее из большого числа частиц. Например: машина, человек, планета, бильярдный шар…
Микроскопическое тело – тело, состоящее из одной или нескольких частиц. Например: атом, молекула, электрон… (рис. 1)


Рис. 1. Примеры микро- и макрообъектов соответственно
Определив таким образом предмет изучения курса МКТ, следует теперь поговорить об основных целях, которые ставит перед собой курс МКТ, а именно:
- Изучение процессов, происходящих внутри макроскопического тела (движение и взаимодействие частиц)
- Свойства тел (плотность, масса, давление (для газов)…)
- Изучение тепловых явлений (нагревание-охлаждение, изменения агрегатных состояний тела)
Изучение этих вопросов, которое будет проходить на протяжении всей темы, начнётся сейчас с того, что мы сформулируем так называемые основные положения МКТ, то есть некоторые утверждения, истинность которых уже давно не подвергается сомнениям, и, отталкиваясь от которых, будет строиться весь дальнейший курс.
Разберём их по очереди:
Все вещества состоят из большого количества частиц – молекул и атомов.
Определение. Атом – мельчайшая частица химического элемента. Размеры атомов (их диаметр) имеет порядок  см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)
см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)

Рис. 2. Периодическая таблица химических элементов (по сути разновидностей атомов) Д. И. Менделеева
Молекула – структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее последних, а главное, они обладают огромным разнообразием.
Вещество, молекулы которого состоят из одного атома, называются атомарными, из большего количества – молекулярными. Например: кислород, вода, поваренная соль ( ) – молекулярные; гелий серебро (He, Ag) – атомарные.
) – молекулярные; гелий серебро (He, Ag) – атомарные.
Причём следует понимать, что свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.

Если в строении атомов вещество имеет какую-то определённую геометрию (кристаллическую решётку), или же, наоборот, не имеет, то этим телам будут присущи различные свойства. Например, аморфные тела не имеют строгой температуры плавления. Самый известный пример – это аморфный графит и кристаллический алмаз. Оба вещества состоят из атомов углерода.


Рис. 3. Графит и алмаз соответственно
Таким образом «из скольких, в каком взаимном расположении и каких атомов и молекул состоит вещество?» — первый вопрос, ответ на который приблизит нас к пониманию свойств тел.
Все упомянутые выше частицы находятся в непрерывном тепловом хаотическом движении.
Так же, как и в рассматриваемых выше примерах, важно понимание не только количественных аспектов этого движения, но и качественных для различных веществ.
Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения; жидких – также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом; частички газа, в свою очередь, практически не сталкиваясь, свободно перемещаются в пространстве.
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).

Здесь: d – расстояние между частицами; a – размеры частиц (диаметр).
Впервые понятие «атом» было введено древнегреческим философом и естествоведом Демокритом (рис. 4). В более поздний период активно задался вопросом о структуре микромира русский учёный Ломоносов (рис. 5).

Рис. 4. Демокрит

Рис. 5. Ломоносов
На следующем занятии мы введём методы качественного обоснования основным положениям МКТ.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. – М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. – М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. – М.: Дрофа, 2010.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Elementy.ru (Источник).
- Samlib.ru (Источник).
- Youtube (Источник).
Домашнее задание
- *Благодаря какой силе возможно сделать эксперимент по измерению размеров молекулы масла, показанный в видеоуроке?
- Почему молекулярно-кинетическая теория не рассматривает органические соединения?
- Почему даже очень маленькая песчинка песка является объектом макромира?
- Силы преимущественно какой природы действуют на частицы со стороны других частиц?
- Как определить, является ли некая химическая структура химическим элементом?
interneturok.ru
1.Основные положения молекулярно-кинетической теории строения вещества. Межмолекулярные силы. Агрегатные состояния вещества.
В основе молекулярно-кинетической теории строения вещества лежат следующие 3 положения:
Всякое тело в природе в каком бы состоянии оно не находилось – твердом, жидком или газообразном, не является сплошным, а состоит из весьма большого числа структурных частиц – молекул.
Молекулы любого вещества находятся в состоянии непрерывного движения, характерной особенностью которого является его полнейшая беспорядочность или хаотичность, означающая, что все направления в движении молекул являются равноправными, равновероятными, не существует какого-либо преимущественного направления для движения молекул.
Между молекулами в веществе действуют одновременно силы притяжения и силы отталкивания. И те и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания оказывается более быстрым, чем сил притяжения, в результате чего оказывается, что силы отталкивания преобладают на весьма малых расстояниях, а силы притяжения на более далеких расстояниях, однако и те и другие очень быстро убывают с расстоянием. Поэтому межмолекулярные силы являются коротко действующими силами. Они действуют на малых расстояниях между молекулами порядка 10-9м и менее.
Молекулы– это наименьшие частицы вещества, сохраняющие все его химические свойства. Они могут состоять из двух или большего числа одинаковых или различных атомов. Различных видов молекул известно огромное число, различных же атомов, соответствующих химическим элементам периодической системы Менделеева, совсем немного, причем в природе их встречается всего 88, а остальные получены искусственным путем.
Массы атомов и молекул чрезвычайно малы ( порядка 10-23– 10-24 г) и выражать их в граммах или килограммах неудобно. Поэтому в химии и физике введены специальные атомные единицы массы. Заатомную единицу массыпринимают 1/12 массы изотопа атома изотопа углерода С12. Массы атомов и молекул, выраженные в атомных единицах, называют соответственно относительными атомными и молекулярными массами.
Относительной атомной массойхимического элемента называют отношение массы атома этого элемента к 1/12 массы атома углерода С 12. Аналогично,относительной молекулярной массойвещества называют отношение массы молекулы этого вещества к 1/12 массы атома углерода С12. Молекулярная масса равна сумме атомных масс входящих в состав молекулы атомов. Она легко подсчитывается по химической формуле вещества. В случае химически простых веществ (т.е. веществ, состоящих из атомов) их относительная молекулярная масса совпадает с относительной атомной массой.
В химии и физике единицей количества вещества является моль (седьмая основная единица системы СИ).Молем веществаназывают такое количество вещества, которое содержит столько частиц, сколько атомов содержится в 0,012 кг изотопа углерода С12. Из определения следует, что моль любого вещества, независимо от того, в каком состоянии оно находится, содержит одинаковое число молекул. Число молекул, содержащихся в 1 моле любого вещества, является одной из важнейших физических констант и называется
Ввиду малых размеров молекул, их число в любом макроскопическом объеме тела огромно. В 1 см3газа при нормальных атмосферных условиях содержится 2,71019молекул (число Лошмидта), а в 1 см3воды – 3,31022молекул. При этом каждая молекула может состоять из нескольких атомов.
Сами атомы также являются сложными системами, состоящими из положительно заряженных ядер и электронных оболочек. Ядро атома имеет размеры порядка 10-13см и в нем сосредоточена почти вся масса атома (плотность ядра вещества чрезвычайно велика по сравнению с плотностью обычных веществ и составляет около 1014г/см3). Электрический заряд ядра положителен, по абсолютной величине равен сумме зарядов атомных электронов нейтрального атома иопределяется порядковым номером элемента в периодической таблице. Атом в целом нейтрален.
Из строения вещества следует, что между атомами и молекулами, входящими в состав вещества, должны существовать силы взаимодействия, которые по своей природе являются электрическими силами – силами взаимодействия между заряженными частицами, из которых состоят атомы, а следовательно, и молекулы. Так как в атоме имеются частицы с разными знаками электрических зарядов, то неизбежно должны существовать как силы притяжения, так и силы отталкивания. Действительно, электроны одной молекулы и ядра другой притягиваются друг к другу, а между электронами обеих молекул, так же как и между их ядрами, действуют силы отталкивания. Хотя в целом атом и молекула электронейтральны, но заряды в атоме, и следовательно, молекуле могут быть расположены не вполне симметрично, а как бы раздвинуты друг относительно друга на некоторое расстояние. Такая асимметрия в расположении зарядов в молекуле может появиться (индуцироваться) также из-за взаимодействия этих зарядов. Появление этой асимметрии приводит к тому, что между молекулами, даже нейтральными, возникают силы притяжения. На малых расстояниях эти силы притяжения компенсируются силами отталкивания, которые обусловлены главным образом электростатическим отталкиванием.
Количественно определить силы взаимодействия между молекулами трудно, их можно определить лишь весьма приближенно. Такие оценки в полном согласии с опытом показывают, что и силы притяжения, и силы отталкивания очень сильно зависят от расстояний между центрами молекул:
F~1/rn
(знак «+» относится к силам отталкивания, а «-« — к силам притяжения). В случае нейтральных молекул n7 для сил притяжения иn9 для сил отталкивания, т.е. силы отталкивания убывают быстрее, и поэтому они могут играть роль только при непосредственном соприкосновении молекул.
Силы межмолекулярных взаимодействий определяют структуру вещества и характер молекулярного движения в нем. Известно, что газообразные, жидкие и твердые вещества имеют разную структуру, и характер молекулярного движения в них оказывается различным.
В газах среднее расстояние между молекулами во много раз больше размеров самих молекул. Межмолекулярные силы на таких расстояниях незначительны (потенциальная энергия взаимодействия молекул пменьше их средней кинетической энергии движенияк, и молекулы движутся почти независимо друг от друга. В достаточно разреженном газе можно считать, что движение каждой молекулы происходит практически без действия сил, т.е. прямолинейно и равномерно. Прямолинейность движения молекул в таком газе нарушается лишь при столкновении его молекул между собой или со стенками сосуда. В момент столкновения молекула резко меняет направление своего движения и затем продолжает двигаться в новом направлении равномерно и прямолинейно вплоть до следующего столкновения и т.д. Таким образом,в газообразном состоянии вещества молекулы совершают хаотическое поступательное движение.Путь газовой молекулы представляет бесконечную ломаную линию, состоящую из множества неравных отрезков, следующих один за другим без всякого порядка. В газе отсутствует всякий порядок не только в направлении движения молекул, но нет также никакого порядка и в размещении их в пространстве для любого момента времени. Вещество в газообразном состоянии не сохраняет ни формы, ни объема.
Иначе обстоит дело в твердых кристаллических телах. В кристаллах расстояние между частицами много меньше, чем в газах, а межмолекулярные взаимодействия сильнее. Вещество в твердом состоянии сохраняет как форму, так и объем. Характер молекулярного движения в кристалле совсем иной. В кристалле частицы(молекулы, атомы или ионы – в зависимости от вещества) не могут разорвать свои связи с ближайшими соседями и переходят с места на место крайне редко. Большую часть времени ониколеблются около некоторых неподвижных положений равновесия,которые распределены в пространстве не хаотически, а тем или иным закономерным образом (в виде некоторой пространственной решетки, называемойкристаллической решеткой), который также определяется характером межмолекулярных взаимодействий.
Что же касается жидкостей, то в них сочетаются свойства, типичные для кристаллов, со свойствами, типичными для газов. Жидкое состояние характеризуется тем, что вещество стремится сохранить объем, но не сохраняет формы. Молекулы жидкости не так прочно связаны друг с другом, как молекулы кристаллов, но и не так свободны, как молекулы газов. Молекулы жидкости, как и молекулы кристаллов, колеблются, но положения равновесия, около которых совершаются эти колебания, не остаются неподвижными, как в кристаллах, а непрерывно меняются. По теории, развитой советским физиком Френкелем, каждая молекула жидкости колеблется около данного положения равновесия лишь в течение некоторого промежутка времени, после чего она меняет свое положение равновесия, перемещаясь на расстояние порядка диаметра самих молекул. Время, в течение которого молекулы в жидкости колеблются около определенных положений равновесия, Френкель назвалвременем оседлой жизни молекул.
При повышении Т жидкости время оседлой жизни молекулы быстро уменьшается, т.е. молекулы чаще перескакивают с одного места на другое, и жидкость по своим свойствам приближается к плотным газам: в жидкости колебательное движение частиц сочетается с поступательным перемещением (перескоком) их из одного положения равновесия в другое.
Следует отметить, что несмотря на различный характер движения молекул в газах, жидкостях и твердых телах, общим для всех этих случаев является то, что молекулярное движение всегда имеет беспорядочный характер, т.е. скорости молекул не имеют какого-либо преимущественного направления, а распределены хаотически по всем направлениям. Интенсивность этого хаотичного движения молекул, его энергия и определяют тепловое состояние тел. Поэтому хаотическое движение молекул в веществе обычно называют тепловым движением.
Иногда молекулы жидкости соединяются в агрегаты, состоящие из большого числа молекул, причем агрегатное расположение их определенным образом упорядочено. В этом случае жидкости обладают некоторыми свойствами, характерными для твердых кристаллических тел (жидкие кристаллы).
studfile.net
Основные понятия молекулярной теории строения вещества. Молекулярно-кинетическая теория
Последние:- Во сне увидеть обручальное золотое кольцо одинокой
- К чему снится обручальное кольцо?
- Сыровяленое мясо в домашних условиях: рецепт, особенности приготовления и отзывы
- Обручальное кольцо на мужчине во сне
- Сонник: к чему снится яблоко
fanatsporta.ru
Молекулярную теорию строения вещества создал авогадро. Молекулярно-кинетическая теория
В основе молекулярно-кинетической теории строения вещества лежат следующие 3 положения:
Всякое тело в природе в каком бы состоянии оно не находилось – твердом, жидком или газообразном, не является сплошным, а состоит из весьма большого числа структурных частиц – молекул.
Молекулы любого вещества находятся в состоянии непрерывного движения, характерной особенностью которого является его полнейшая беспорядочность или хаотичность, означающая, что все направления в движении молекул являются равноправными, равновероятными, не существует какого-либо преимущественного направления для движения молекул.
Между молекулами в веществе действуют одновременно силы притяжения и силы отталкивания. И те и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания оказывается более быстрым, чем сил притяжения, в результате чего оказывается, что силы отталкивания преобладают на весьма малых расстояниях, а силы притяжения на более далеких расстояниях, однако и те и другие очень быстро убывают с расстоянием. Поэтому межмолекулярные силы являются коротко действующими силами. Они действуют на малых расстояниях между молекулами порядка 10 -9 м и менее.
Всякое вещество состоит из молекул, состоящих из атомов.
Молекулы – это наименьшие частицы вещества, сохраняющие все его химические свойства. Они могут состоять из двух или большего числа одинаковых или различных атомов. Различных видов молекул известно огромное число, различных же атомов, соответствующих химическим элементам периодической системы Менделеева, совсем немного, причем в природе их встречается всего 88, а остальные получены искусственным путем.
Массы атомов и молекул чрезвычайно малы (порядка 10 -23 – 10 -24 г) и выражать их в граммах или килограммах неудобно. Поэтому в химии и физике введены специальные атомные единицы массы. Заатомную единицу массы принимают 1/12 массы изотопа атома изотопа углерода С 12 . Массы атомов и молекул, выраженные в атомных единицах, называют соответственно относительными атомными и молекулярными массами.
Относительной атомной массой химического элемента называют отношение массы атома этого элемента к 1/12 массы атома углерода С 12 . Аналогично,относительной молекулярной массой вещества называют отношение массы молекулы этого вещества к 1/12 массы атома углерода С 12 . Молекулярная масса равна сумме атомных масс входящих в состав молекулы атомов. Она легко подсчитывается по химической формуле вещества. В случае химически простых веществ (т.е. веществ, состоящих из атомов) их относительная молекулярная масса совпадает с относительной атомной массой.
В химии и физике единицей количества вещества является моль (седьмая основная единица системы СИ ).Молем вещества называют такое количество вещества, которое содержит столько частиц, сколько атомов содержится в 0,012 кг изотопа углерода С 12 . Из определения следует, что моль любого вещества, независимо от того, в каком состоянии оно находится, содержит одинаковое число молекул. Число молекул, содержащихся в 1 моле любого вещества, является одной из важнейших физических констант и называетсяпостоянной Авогадро N A = 6,0210 23 1/моль. Масса моля вещества численно равна его относительной молекулярной массе, выраженной в граммах, и обозначается тем же символом, что и относительная молекулярная масса.
Ввиду малых размеров молекул, их число в любом макроскопическом объеме тела огромно. В 1 см 3 газа при нормальных атмосферных условиях содержится 2,710 19 молекул (число Лошмидта), а в 1 см 3 воды – 3,310 22 молекул. При этом каждая молекула может состоять из нескольких атомов.
Сами атомы также являются сложными системами, состоящими из положительно заряженных ядер и электронных оболочек. Ядро атома имеет размеры порядка 10 -13 см и в нем сосредоточена почти вся масса атома (плотность ядра вещества чрезвычайно велика по сравнению с плотностью обычных веществ и составляет около 10 14 г/см 3). Электрический заряд ядра положителен, по абсолютной величине равен сумме зарядов атомных электронов нейтрального атома иопределяется порядковым номером элемента в периодической таблице. Атом в целом нейтрален.
Из строения вещества следует, что между атомами и молекулами, входящими в состав вещества, должны существовать силы взаимодействия , которые по своей природе являются электрическими силами – силами взаимодействия между заряженными частицами, из которых состоят атомы, а следовательно, и молекулы. Так как в атоме имеются частицы с разными знаками электрических зарядов, то неизбежно должны существовать как силы притяжения, так и силы отталкивания. Действительно, электроны одной молекулы и ядра другой притягиваются друг к другу, а между электронами обеих молекул, так же как и между их ядрами, действуют силы отталкивания. Хотя в целом атом и молекула электронейтральны, но заряды в атоме, и следовательно, молекуле могут быть расположены не вполне симметрично, а как бы раздвинуты друг относительно друга на некоторое расстояние. Такая асимметрия в расположе
trining.ru
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ | Энциклопедия Кругосвет
Содержание статьиМОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М.В.Ломоносов. Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики.
Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление, оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т.е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам – Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля». Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж.К.Максвелла и Л.Больцмана, которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов), состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Молекулярно-кинетическая теория газов.
Газовое состояние (см. ГАЗ) – одно из тех состояний вещества, описание которого на основе методов молекулярно-кинетической теории уже с самого начала ее развития дало наиболее полные и ощутимые результаты. В первую очередь это относится к так называемому идеальному газу, молекулы которого большую часть времени проводят в состоянии свободного хаотического движения, резко меняя свою скорость лишь в моменты кратковременных столкновений. Молекулярно-кинетическая теория успешно объясняет все известные экспериментальные законы идеального газа (закон Бойля – Мариотта, закон Гей-Люссака, закон Авогадро и формулируемое на их основе уравнение состояния Менделеева – Клапейрона). На базе этой теории получили свое полное объяснение процессы переноса в газах: диффузия, вязкость и теплопроводность.
Давление газа.
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа. Сначала определяется среднее число столкновений молекул, происходящих за единицу времени с поверхностью стенки сосуда. В газе выделяются три взаимно перпендикулярных оси, соответствующие декартовой системе координат. Если в сосуде содержится N молекул, то из-за огромного их числа логично предположить, что в любой момент времени вдоль каждого из направлений будут двигаться примерно N/3 молекул. Очевидно, что в направлении самой стенки сосуда перпендикулярно к ней будет в среднем двигаться 1/6 часть всех молекул.
Пусть есть плоский элемент поверхности на стенке сосуда DS. Предполагается, для простоты, что все молекулы движутся с одинаковой скоростью v. Тогда за время Dt до элемента стенки DS долетят все движущиеся по направлению к нему молекулы, которые заключены в объеме цилиндра с основанием DS и высотой v Dt (рис. 1).
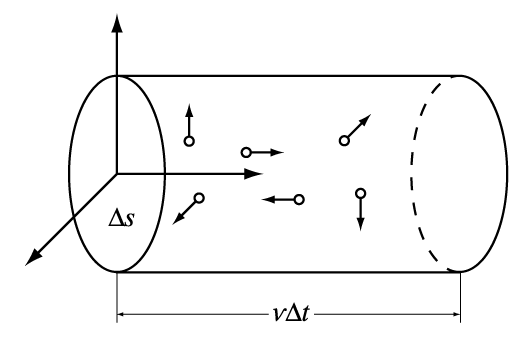
Если n = N/V – число молекул в единице объема, то число молекул, долетевших до стенки и ударившихся об нее, равно Dv = (n/6)vDSDt. Соответственно, число ударов молекул об единичную площадку в единицу времени оказывается равным
(1) 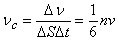
Каждая молекула, летящая к стенке, при столкновении с ней передает стенке свой импульс. Поскольку скорость молекулы при упругом столкновении со стенкой меняется от величины v до –v, величина передаваемого импульса равна 2mv. Сила, действующая на поверхность стенки DS за время Dt, определяется величиной полного импульса, передаваемого всеми молекулами достигнувшим стенки за этот промежуток времени, т.е. F = 2mv nc DS/Dt, где nc определено выражением (1). Для величины давления p = F/DS в этом случае находим: p = (1/3)nmv2.
Для получения окончательного результата можно отказаться от предположения об одинаковой скорости молекул, выделив независимые группы молекул, каждая из которых имеет свою приблизительно одинаковую скорость. Тогда средняя величина давления находится усреднением квадрата скорости по всем группам молекул или
(2) 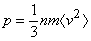
Это выражение можно представить также в виде
(3) 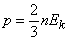
где 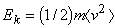 – средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
– средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
Тепловое равновесие, понятие температуры. Известно, что тепло всегда перетекает от горячего тела к холодному, т.е. температура соприкасающихся тел стремится выравняться. Это явление характеризуют как переход системы в состояние теплового равновесия. Понятие температуры является не столь очевидным, как многие привычные понятия механики: масса, сила, энергия и т.д. Температура связана с весьма неопределенным понятием теплоты и холода, которые располагаются в сознании человека где-то рядом с запахом и вкусом. Одно из главных достижений молекулярно-кинетической теории состоит в том, что теплота рассматривается просто как одна из форм энергии, а именно – кинетическая энергия атомов и молекул. Эта величина, усредненная по огромному числу беспорядочно движущихся частиц, и оказывается мерилом того, что называется температурой тела. Такое представление распространяется на все вещества – твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Если два тела, имеющие первоначально разные температуры, входят в соприкосновение друг с другом, движение частиц в одном из них замедляется, в другом наоборот ускоряется: средняя кинетическая энергия частиц становится везде одинаковой. Это и означает, что система в целом приходит в состояние полного теплового равновесия.
Поскольку понятие температуры тесно связано с усредненной кинетической энергией молекул, было бы естественным и в качестве единиц ее измерения использовать энергетические единицы (например, эрг или джоуль). Однако, энергия теплового движения частиц фактически очень мала по сравнению с эргом (не говоря уже о джоуле), поэтому использование этой величины оказывается неудобным. В молекулярной физике пользуются практически удобной условной единицей измерения температуры – градусом, который определяется таким образом, что интервал температур между точками кипения и замерзания воды при атмосферном давлении полагается равным 100 градусам.
Если температура T измеряется в градусах Кельвина (К), то связь ее со средней кинетической энергией молекул имеет вид
(4) Ek = (3/2)kT,
где k = 1,38·10–16 эрг/K – переводный коэффициент, определяющий, какая часть эрга содержится в градусе. Величина k называется постоянной Больцмана (она была введена Планком в 1899).
Уравнение состояния. Газовые законы.
Подстановка соотношений (4) в (3), приводит к известному уравнению состояния идеального газа
(5) p = nkT
Из соотношений (2) и (5) следует также выражение для средне-квадратичной скорости молекул
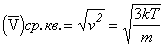 ,
,
Этой формуле удобно придать другой вид, умножив числитель и знаменатель под знаком квадратного корня на число Авогадро
Na = 6,023·1023.
Тогда
(7) 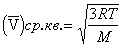
Здесь M = mNA – атомная или молекулярная масса, величина R = kNA = 8,318·107 эрг называется газовой постоянной.
Средняя скорость молекул в газе даже при умеренных температурах оказывается очень большой. Так, для молекул водорода (H2) при комнатной температуре (T = 293K) эта скорость равна около 1900 м/c , для молекул азота в воздухе – порядка 500 м/с. Скорость звука в воздухе при тех же условиях равна 340 м/с.
Учитывая, что n = N/V, где V – объем, занимаемый газом, N – полное число молекул в этом объеме, легко получить следствия из (5) в виде известных газовых законов. Для этого полное число молекул представляется в виде N = vNA, где v – число молей газа, и уравнение (5) принимает вид
(8) pV = vRT,
которое носит название уравнения Клапейрона – Менделеева.
При условии T = const давление газа меняется обратно пропорционально занимаемому им объему (закон Бойля – Мариотта).
В замкнутом сосуде фиксированного объема V = const давление меняется прямо пропорционально изменению абсолютной температуры газа Т. Если газ находится в условиях, когда постоянным сохраняется его давление p = const, но изменяется температура (такие условия можно осуществить, например, если поместить газ в цилиндр, закрытый подвижным поршнем), то объем, занимаемый газом, будет меняться пропорционально изменению его температуры (закон Гей-Люссака).
Пусть в сосуде есть смесь газов, т.е. имеются несколько разных сортов молекул. В этом случае величина импульса, передаваемого стенке молекулами каждого сорта, не зависит от наличия молекул других сортов. Отсюда следует, что давление смеси идеальных газов равно сумме парциальных давлений, которые создавал бы каждый газ в отдельности, если бы занимал весь объем. В этом состоит еще один из газовых законов – известный закон Дальтона.
Длина свободного пробега молекул. Одним из первых, кто еще в 1850-х дал разумные оценки величины средней тепловой скорости молекул различных газов, был австрийский физик Клаузиус. Полученные им непривычно большие значения этих скоростей сразу же вызвали возражения. Если скорости молекул действительно так велики, то запах любого пахучего вещества должен был бы практически мгновенно распространяться из одного конца замкнутого помещения в другой. На самом деле распространение запаха происходит очень медленно и осуществляется, как теперь известно, посредством процесса так называемой диффузии в газе. Клаузиус, а затем и другие исследователи, сумели дать убедительное объяснение этому и другим процессам переноса в газе (таким как теплопроводность и вязкость) с помощью понятия средней длины свободного пробега молекул, т.е. среднего расстояния, которое пролетает молекула от одного столкновения до другого.
Каждая молекула в газе испытывает очень большое число столкновений с другими молекулами. В промежутке между столкновениями молекулы движутся практически прямолинейно, испытывая резкие изменения скорости лишь в момент самого столкновения. Естественно, что длины прямолинейных участков на пути молекулы могут быть различными, поэтому имеет смысл говорить лишь о некоторой средней длине свободного пробега молекул.
За время Dt молекула проходит сложный зигзагообразный путь, равный vDt. Изломов траектории на этом пути столько, сколько произошло столкновений. Пусть Z означает число столкновений, которое испытывает молекула в единицу времени Средняя длина свободного пробега равна тогда отношению длины пути 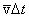 к полному числу столкновений ZDt, испытанных молекулой на этом пути,
к полному числу столкновений ZDt, испытанных молекулой на этом пути,
(9) 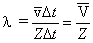
Для оценки величины Z принимается, что молекулы представляют собой твердые упругие шарики радиуса a, которые равномерно распределены в объеме газа с плотностью n. Сначала предполагается, что молекула движется в среде, где все остальные молекулы неподвижны. Можно видеть, что молекула пролетает мимо другой молекулы, не испытав столкновения с ней, если расстояние между центрами молекул превышает 2a. Следовательно, за время t, равное 1c, молекула взаимодействует только с теми партнерами по столкновению, центры которых расположены в объеме цилиндра длиной  и с площадью основания s = 4pa2 (рис.2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
и с площадью основания s = 4pa2 (рис.2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
Величину s называют эффективным поперечным сечением столкновений молекул. Число молекул в объеме цилиндра равно n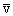 s. Таким же будет число столкновений, т.е. Z = n
s. Таким же будет число столкновений, т.е. Z = n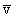 s. Используя (9), находим
s. Используя (9), находим
l = 1/ns
На самом деле, конечно, в газе одновременно находятся в движении все молекулы, поэтому в выражение для Z должна входить средняя скорость относительного движения молекул, так что Z = n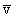 отн.s. Более точный расчет, проведенный впервые Максвеллом, показывает, что
отн.s. Более точный расчет, проведенный впервые Максвеллом, показывает, что 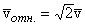 . В результате получается известная в элементарной кинетической теории формула
. В результате получается известная в элементарной кинетической теории формула
(10) 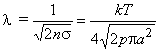
Характерный радиус молекул для различных газов можно оценить из экспериментальных данных по вязкости (внутреннему трению) в газе. Для молекул N2, например, a » 2,0·10–10 м. В таблице 1 приведены рассчитанные по формуле (10) значения l0 в мкм (1мкм = 10–6м) для некоторых газов при нормальных условиях (p = 1атм, T=273K). Эти значения оказываются примерно в 100–300 раз больше собственного диаметра молекул.
www.krugosvet.ru
Молекулярно-кинетическая теория — это… Что такое Молекулярно-кинетическая теория?
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
Основными доказательствами этих положений считались:
В современной (теоретической) физике термин молекулярно-кинетическая теория уже не используется, хотя он встречается в учебниках по курсу общей физики. В современной физике МКТ заменила кинетическая теория, в русскоязычной литературе — физическая кинетика, и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения.
История теории
Первым опровержением теории послужила теория М. В. Ломоносова[1][2]. Ломоносов опытным путём опроверг теории о теплороде и флогистоне, подготовив тем самым, молекулярно-кинетическую теорию XIX века Рудольфа Клаузиуса, Людвига Больцмана и Джеймса Максвелла.
Основное уравнение МКТ
 | Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. |
, где k является постоянной Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул ( в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T — абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Вывод основного уравнения МКТ
Пусть имеется кубический сосуд с ребром длиной и одна частица массой в нём.
Обозначим скорость движения , тогда перед столкновением со стенкой сосуда импульс частицы равен , а после — , поэтому стенке передается импульс . Время, через которое частица сталкивается с одной и той же стенкой, равно .
Отсюда следует:
Так как давление , следовательно сила
Подставив, получим:
Преобразовав:
Так как рассматривается кубический сосуд, то
Отсюда:
.
Соответственно, и .
Таким образом, для большого числа частиц верно следующее: , аналогично для осей y и z.
Поскольку , то . Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
Отсюда
или .
Пусть — среднее значение кинетической энергии всех молекул, тогда:
, откуда, используя то, что , а , имеем .
Уравнение среднеквадратичной скорости молекулы
Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
,
, где — молярная масса газа
Отсюда окончательно
См. также
Примечания
- ↑ Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX в. — М.: Наука, 1969
- ↑ Михаил Васильевич Ломоносов. Избранные произведения в 2-х томах. М.: Наука. 1986
Литература
dic.academic.ru
Опорный конспект по теме «Молекулярно-кинетическая теория»
Молекулярная физика.
Молекулярно-кинетическая теория
Молекулярная физика

Основные определения молекулярной физики
1. Молекулярно-кинетическая теория (МКТ) – раздел физики, учение, объясняющее свойства тел и происходящие с ними явления с точки зрения микроскопического строения этих тел.
2. Все вещества состоят из отдельных частиц (молекул, ионов и атомов), между которыми есть промежутки. Эти частицы не изменяются при изменении температуры или агрегатного состояния.
3. Частицы веществ постоянно и беспорядочно движутся. Средняя скорость движения частиц тем больше, чем выше температура тела. Соответственно частицы обладают кинетической энергией.
4. Частицы вещества взаимодействуют друг с другом: притягиваются и отталкиваются. Силы притяжения-отталкивания зависят от расстояния между частицами. Соответственно, частицы обладают потенциальной энергией.
5. Внутренняя энергия тела – сумма кинетических энергий движения и потенциальных энергий взаимодействия всех частиц тела между собой: молекул, атомов, ионов и других.
6. Кристаллическое тело – твёрдое тело, имеющее постоянную температуру плавления при постоянных внешних условиях. Большинство кристаллов являются поликристаллами. В расположении частиц монокристаллов существует дальний порядок.
7. Аморфное тело – твёрдое тело со слабо выраженной текучестью, плавно усиливающейся при нагревании. В расположении частиц аморфного тела обнаруживается лишь ближний порядок.
8. Жидкость – состояние вещества, при котором тело способно изменять форму под влиянием даже малых сил. Для изменения объёма вещества требуются большие силы. Расположение и движение частиц жидкости аналогичны наблюдаемым в аморфных телах.
9. Газ – состояние вещества, при котором тело способно изменять форму и объём под влиянием очень малых сил. При давлениях, близких к атмосферному, расстояния между частицами газа значительно больше их собственных размеров. Частицы газа постоянно и хаотично летают во всём доступном им пространстве; удары частиц о препятствия создают давление газа.
10. Насыщенным паром называют пар, находящийся в термодинамическом равновесии со своей жидкостью. Давление насыщенного пара не зависит ни от каких величин, кроме температуры жидкости и пара над её поверхностью.
11. Относительная влажность воздуха – физическая величина, равная отношению плотности водяного пара, содержащегося в воздухе, к плотности насыщенного водяного пара при той же температуре. Относительную влажность воздуха выражают в процентах и измеряют гигрометрами и психрометрами.
Основные положения МКТ


Конспект урока «Молекулярно-кинетическая теория».
uchitel.pro