Пероксид натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 декабря 2018; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 декабря 2018; проверки требуют 7 правок.Пероксид натрия (перекись натрия), Na2O2 — бинарное неорганическое химическое соединение натрия с кислородом, желтовато-белые кристаллы с ионной кристаллической решёткой. Является производным пероксида водорода.
Энергично реагирует с водой со значительным выделением тепла:
- 2Na2O2+2h3O→4NaOH+O2{\displaystyle {\mathsf {2Na_{2}O_{2}+2H_{2}O\to 4NaOH+O_{2}}}}
Для пероксида натрия характерно образование хорошо кристаллизующихся гидратов и аддуктов с пероксидом водорода. Так, быстрой кристаллизацией пероксида натрия из ледяной воды легко осаждается гидрат Na
Пероксид натрия является сильным окислителем. С восстановителями, такими, как сера, порошок алюминия, эфиры реагирует с образованием пламени. С монооксидом углерода реагирует менее активно, образуя карбонат:
- Na2O2+CO→Na2CO3{\displaystyle {\mathsf {Na_{2}O_{2}+CO\to Na_{2}CO_{3}}}}
Окисление аммиака пероксидом натрия приводит к образованию нитрата натрия:
- 4Na2O2+Nh4→NaNO3+3NaOH+2Na2O{\displaystyle {\mathsf {4Na_{2}O_{2}+NH_{3}\to NaNO_{3}+3NaOH+2Na_{2}O}}}
Образование пероксида водорода при действии на перекись натрия разбавленными кислотами:
- Na2O2+h3SO4→h3O2+Na2SO4{\displaystyle {\mathsf {Na_{2}O_{2}+H_{2}SO_{4}\to H_{2}O_{2}+Na_{2}SO_{4}}}}
Реагирует с сернистым газом, реакция ускоряется пероксидом водорода и серной кислотой:
- Na2O2+SO2→Na2SO4{\displaystyle {\mathsf {Na_{2}O_{2}+SO_{2}\to Na_{2}SO_{4}}}}
Пероксид натрия образуется при сгорании натрия в кислороде:
- 2Na+O2→Na2O2{\displaystyle {\mathsf {2Na+O_{2}\to Na_{2}O_{2}}}}
Применяют для отбеливания тканей, шерсти, шёлка, древесной и вискозной массы, соломы. Для получения кислорода, поглощения угарного и углекислого газа используется в регенерационных установках и изолирующих противогазах:
- 2CO2+2Na2O2→2Na2CO3+O2{\displaystyle {\mathsf {2CO_{2}+2Na_{2}O_{2}\to 2Na_{2}CO_{3}+O_{2}}}}
Физиологическое действие и токсикология[править | править код]
- Согласно ГОСТ 12.1.007-76 пероксид натрия относится к 3-му классу опасности (умеренно-опасные химические вещества).
- Предельно допустимая концентрация (в воздухе рабочей зоны) составляет 5 мг/м³.
- При попадании на кожу может вызвать раздражение.
- Аэрозоль пероксида натрия обладает разъедающим действием.
- Вещество опасно для окружающей среды.
- При работе с пероксидом натрия следует использовать респираторы, защитные очки и спецодежду.
- Хранить его следует в герметичной таре в сухом помещении. Гарантийный срок — 2 года со дня изготовления.
Оксид натрия — это… Что такое Оксид натрия?
Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу и относящееся к классу основных оксидов.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для изготовления гидроксида натрия и других веществ.[1]
См. также
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
Примечания
Оксид натрію — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
Окси́д на́трію — неорганічна бінарна сполука складу Na2O. Являє собою білі або безбарвні кристали, термічно стійка сполука. Проявляє сильні осно́вні властивості. Застосовується у виробництві гідроксиду натрію.
Оксид натрію зустрічається у мінералах, в основному, у вигляді домішок. Його масова частка є значною, зокрема, у природних карбонатах нагколіті, гейлюситі.
Оксид натрію являє собою білі або безбарвні кристали. Є термічно стійким і тугоплавким, розкладається за температури 1132 °C без плавлення.
Оксид натрію легко взаємодіє з водою та кислотами:
- Na2O+h3O→2NaOH{\displaystyle \mathrm {Na_{2}O+H_{2}O\rightarrow 2NaOH} }
- Na2O+2HCl→2NaCl+h3O{\displaystyle \mathrm {Na_{2}O+2HCl\rightarrow 2NaCl+H_{2}O} }
Проявляє осно́вні властивості, реагуючи з кислотними та амфотерними оксидами:
- Na2O+CO2→450−550oCNa2CO3{\displaystyle \mathrm {Na_{2}O+CO_{2}{\xrightarrow {450-550^{o}C}}Na_{2}CO_{3}} }
- Na2O+NO2+NO→250oC2NaNO2{\displaystyle \mathrm {Na_{2}O+NO_{2}+NO{\xrightarrow {250^{o}C}}2NaNO_{2}} }
- Na2O+Al2O3→1200oC2NaAlO2{\displaystyle \mathrm {Na_{2}O+Al_{2}O_{3}{\xrightarrow {1200^{o}C}}2NaAlO_{2}} }
Окрім кисню, взаємодіє також з деякими іншими неметалами:
- 2Na2O+O2→250−350oC,[p]2Na2O2{\displaystyle \mathrm {2Na_{2}O+O_{2}{\xrightarrow {250-350^{o}C,[p]}}2Na_{2}O_{2}} }
- 4Na2O+4S→t3Na2S+Na2SO4{\displaystyle \mathrm {4Na_{2}O+4S{\xrightarrow {t}}3Na_{2}S+Na_{2}SO_{4}} }
Реагує з рідким амоніаком:
- Na2O+Nh4→−50oCNaNh3+NaOH{\displaystyle \mathrm {Na_{2}O+NH_{3}{\xrightarrow {-50^{o}C}}NaNH_{2}+NaOH} }
Оксид натрію не можна отримати його взаємодією з киснем — в цьому випадку утворюється пероксид натрію. Необхідний результат досягається при подальшій взаємодії пероксиду з натрієм в атмосфері інертних газів:
- 2Na+O2→250−400oCNa2O2{\displaystyle \mathrm {2Na+O_{2}{\xrightarrow {250-400^{o}C}}Na_{2}O_{2}} }
- Na2O2+2Na→130−200oC,Ar2Na2O{\displaystyle \mathrm {Na_{2}O_{2}+2Na{\xrightarrow {130-200^{o}C,Ar}}2Na_{2}O} }
Також оксид можна синтезувати з гідроксиду натрію та з його солей: азиду, нітриту, нітрату:
- 2NaOH+2Na→600oC2Na2O+h3{\displaystyle \mathrm {2NaOH+2Na{\xrightarrow {600^{o}C}}2Na_{2}O+H_{2}} }
- 5NaN3+NaNO3→350−400oC,vacuum3Na2O+8N2{\displaystyle \mathrm {5NaN_{3}+NaNO_{3}{\xrightarrow {350-400^{o}C,vacuum}}3Na_{2}O+8N_{2}} }
- 6Na+2NaNO2→350−400oC4Na2O+N2{\displaystyle \mathrm {6Na+2NaNO_{2}{\xrightarrow {350-400^{o}C}}4Na_{2}O+N_{2}} }
Або отримати з пероксиду із використанням сторонніх відновників:
- Na2O2+C→Na2O+CO{\displaystyle \mathrm {Na_{2}O_{2}+C\rightarrow Na_{2}O+CO} }
- Na2O2+2Ag→Na2O+Ag2O{\displaystyle \mathrm {Na_{2}O_{2}+2Ag\rightarrow Na_{2}O+Ag_{2}O} }
Оксид натрію використовується у синтезі гідроксиду натрію.
- ↑ Sodium oxide
- ↑ а б За тиску 101,3 кПа
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
Гидрофосфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 2 правки.| Гидрофосфат натрия | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | Гидрофосфат натрия |
| Традиционные названия | Гидроортофосфат натрия, фосфорнокислый натрий, двузамещённый |
| Хим. формула | Na2HPO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 141,96 г/моль |
| Плотность | 2,066 г/см³ |
| Температура | |
| • плавления | гидр. 40 °C |
| Энтальпия | |
| • образования | -419,4 кДж/моль |
| Растворимость | |
| • в воде | 1,630; 7,6620; 92,480; 102,4100 г/100 мл |
| Рег. номер CAS | 7558-79-4 |
| PubChem | 24203 |
| Рег. номер EINECS | 231-448-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E339(ii) |
| RTECS | WC4500000 |
| ChEBI | 34683 |
| ChemSpider | 22625 |
| ЛД50 | 13 г/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Гидрофосфа́т на́трия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой Na2HPO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты.
- h4PO4+2NaOH → Na2HPO4+2h3O{\displaystyle {\mathsf {H_{3}PO_{4}+2NaOH\ {\xrightarrow {}}\ Na_{2}HPO_{4}+2H_{2}O}}}
- Nah3PO4+NaOH → Na2HPO4+h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}+NaOH\ {\xrightarrow {}}\ Na_{2}HPO_{4}+H_{2}O}}}
Гидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле. Водные растворы имеют слабощелочную реакцию из-за гидролиза по аниону.
Образует несколько кристаллогидратов Na2HPO4·n H2O, где n = 2, 7, 12, которые плавятся в кристаллизационной воде при 95, 48,1 и 35,1°С соответственно.
- Кристаллогидрат теряет воду при нагревании:
- Na2HPO4⋅12h3O →95−100oC Na2HPO4+12h3O{\displaystyle {\mathsf {Na_{2}HPO_{4}\cdot 12H_{2}O\ {\xrightarrow {95-100^{o}C}}\ Na_{2}HPO_{4}+12H_{2}O}}}
- 2Na2HPO4 →120−300oC Na4P2O7+h3O{\displaystyle {\mathsf {2Na_{2}HPO_{4}\ {\xrightarrow {120-300^{o}C}}\ Na_{4}P_{2}O_{7}+H_{2}O}}}
- Na2HPO4+h4PO4 → 2Nah3PO4{\displaystyle {\mathsf {Na_{2}HPO_{4}+H_{3}PO_{4}\ {\xrightarrow {}}\ 2NaH_{2}PO_{4}}}}
- Реагирует с щелочами:
- Na2HPO4+NaOH → Na3PO4+h3O{\displaystyle {\mathsf {Na_{2}HPO_{4}+NaOH\ {\xrightarrow {}}\ Na_{3}PO_{4}+H_{2}O}}}
- Вступает в обменные реакции:
- 4Na2HPO4+3CaCl2 → Ca3(PO4)2↓+6NaCl+2Nah3PO4{\displaystyle {\mathsf {4Na_{2}HPO_{4}+3CaCl_{2}\ {\xrightarrow {}}\ Ca_{3}(PO_{4})_{2}\downarrow +6NaCl+2NaH_{2}PO_{4}}}}
- Na2HPO4+CaCl2 → CaHPO4↓+2NaCl{\displaystyle {\mathsf {Na_{2}HPO_{4}+CaCl_{2}\ {\xrightarrow {}}\ CaHPO_{4}\downarrow +2NaCl}}}
- 2Na2HPO4+3AgNO3 → Ag3PO4↓+3NaNO3+Nah3PO4{\displaystyle {\mathsf {2Na_{2}HPO_{4}+3AgNO_{3}\ {\xrightarrow {}}\ Ag_{3}PO_{4}\downarrow +3NaNO_{3}+NaH_{2}PO_{4}}}}
- Гидрофосфат натрия используется в качестве многоцелевой добавки в пищевой промышленности E339, в качестве эмульгатора и буфера для производства плавленых сыров и в качестве добавки для предотвращения превращения молока в желе.[источник не указан 365 дней] Добавки гидрофосфата натрия в макароны ускоряют приготовления пищи.[источник не указан 365 дней]
- Фармакология.
- Гидрофосфат натрия двенадцативодный относится к многотоннажному химическому производству, цена ≈2$/кг.
- ГОСТ 31725-2012. Добавки пищевые. Натрия фосфаты Е339. Общие технические условия
Пиросульфит натрия — Википедия
Материал из Википедии — свободной энциклопедии
| Пиросульфит натрия | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | метабисульфит натрия |
| Сокращения | E 223 |
| Традиционные названия | пиросульфит натрия |
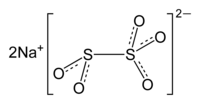
| Хим. формула | Na2(SO2SO3) |
| Состояние | твердое |
| Молярная масса | 190,11 г/моль |
| Плотность | 2,36 г/см³ |
| Температура | |
| • плавления | 150 °C |
| • разложения | 302 ± 1 °F[1] |
| Растворимость | |
| • в воде | 54,0 — 65,0 г/100 мл |
| Рег. номер CAS | 7681-57-4 |
| PubChem | 656671 |
| Рег. номер EINECS | 231-673-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E223 |
| RTECS | UX8225000 |
| ChEBI | 114786 |
| ChemSpider | 571015 |
| Пиктограммы ECB |  |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Пиросульфит натрия (Na2S2O5), или метабисульфит натрия, или натрий пиросернистокислый — соль пиросернистой кислоты, белый или желтоватый кристаллический порошок с резким запахом. Иногда называют также бисульфит натрия, натрий пиросульфит, натрий метабисульфит.
В воде легко происходит гидролиз с превращением в гидросульфит натрия:
- Na2S2O5+h3O⇌2NaHSO3{\displaystyle {\mathsf {Na_{2}S_{2}O_{5}+H_{2}O\rightleftharpoons 2NaHSO_{3}}}}
При нагревании соли происходит термическое разложение с выделением диоксида серы (SO2):
- Na2S2O5→TNa2SO3+SO2{\displaystyle {\mathsf {Na_{2}S_{2}O_{5}{\xrightarrow {T}}Na_{2}SO_{3}+SO_{2}}}}
- Пищевая промышленность: применяется как консервант, антиоксидант, отбеливатель и разрыхлитель, используется при производстве фруктовых соков, сладостей, вина и пива. Безопасная ежедневная норма до 0.7 мг на килограмм веса тела. В печени окисляется до безопасных сульфатов и выводится с мочой. Способен вызвать реакцию у аллергиков.
- Фармацевтическая промышленность: применяется в качестве наполнителя в некоторых таблетках, вспомогательного вещества в инъекционных лекарственных препаратах, системах фильтрации воды, для дезинфекции оборудования.
- Химическая промышленность.
- Сельское хозяйство: используется для удаления пней.
Пиросульфит натрия является трудногорючим и взрывобезопасным веществом, по степени воздействия на организм относится к веществам 3-го класса опасности. Опасности по ГН-98 отсутствуют.
Пиросульфит натрия вреден при попадании внутрь организма и в глаза. Работать с ним нужно в очках, маске и перчатках. При попадании в глаза их необходимо промыть большим количеством воды и обратиться к врачу.
При взаимодействии с водой и кислотами или нагревании выше температуры 65 °C выделяет токсичный газ — сернистый ангидрид SO2.
Пиросульфит натрия (метабисульфит натрия) получают взаимодействием сернистого ангидрида с содово-сульфитным раствором.
• Пиросульфит натрия технический. ГОСТ 11683-76[2]
Дигидропирофосфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 сентября 2016; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 сентября 2016; проверки требуют 3 правки.| Дигидропирофосфат натрия | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | Дигидродифосфат натрия |
| Традиционные названия | Фосфорнокислый (пиро) натрий, двузамещённый; пирофосфат натрия кислый |
| Хим. формула | Na2H2P2O7 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 221,94 г/моль |
| Плотность | 1,862 г/см³ |
| Температура | |
| • плавления | разл. 220 °C |
| Растворимость | |
| • в воде | 4,60; 23,540 г/100 мл |
| Рег. номер CAS | 7758-16-9 |
| PubChem | 9837369 |
| Рег. номер EINECS | 231-835-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E450(i) |
| ChemSpider | 8013090 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Дигидропирофосфат натрия — неорганическое соединение, кислая соль щелочного металла натрия и пирофосфорной кислоты с формулой Na2H2P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат.
- Nah3PO4 →160oC Na2h3P2O7+h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}\ {\xrightarrow {160^{o}C}}\ Na_{2}H_{2}P_{2}O_{7}+H_{2}O}}}
- h5P2O7+2NaOH → Na2h3P2O7+2h3O{\displaystyle {\mathsf {H_{4}P_{2}O_{7}+2NaOH\ {\xrightarrow {}}\ Na_{2}H_{2}P_{2}O_{7}+2H_{2}O}}}
- Na4P2O7+2Ch4COOH →0−10oC Na2h3P2O7+2Ch4COONa{\displaystyle {\mathsf {Na_{4}P_{2}O_{7}+2CH_{3}COOH\ {\xrightarrow {0-10^{o}C}}\ Na_{2}H_{2}P_{2}O_{7}+2CH_{3}COONa}}}
Дигидропирофосфат натрия — бесцветные кристаллы, умерено растворимые в холодной воде, разлагаются в горячей.
Образует кристаллогидрат вида Na2H2P2O7•6H2O.
- Кристаллогидрат при нагревании в вакууме теряет воду:
- Na2h3P2O7⋅6h3O →80oC Na2h3P2O7+6h3O{\displaystyle {\mathsf {Na_{2}H_{2}P_{2}O_{7}\cdot 6H_{2}O\ {\xrightarrow {80^{o}C}}\ Na_{2}H_{2}P_{2}O_{7}+6H_{2}O}}}
- При нагревании медленно теряет воду превращаясь в другие фосфаты:
- Na2h3P2O7 →220−250oC 2NaPO3+h3O{\displaystyle {\mathsf {Na_{2}H_{2}P_{2}O_{7}\ {\xrightarrow {220-250^{o}C}}\ 2NaPO_{3}+H_{2}O}}}
- 2Na2h3P2O7 →650oC Na4P2O9+h5P2O5{\displaystyle {\mathsf {2\,Na_{2}H_{2}P_{2}O_{7}\ {\xrightarrow {650^{o}C}}\ Na_{4}P_{2}O_{9}+H_{4}P_{2}O_{5}}}}
- Разлагается в горячей воде:
- Na2h3P2O7+h3O →100oC 2Nah3PO4{\displaystyle {\mathsf {Na_{2}H_{2}P_{2}O_{7}+H_{2}O\ {\xrightarrow {100^{o}C}}\ 2\,NaH_{2}PO_{4}}}}
- Реагирует с щелочами с образованием нормальной соли:
- Na2h3P2O7+2NaOH → Na4P2O7+2h3O{\displaystyle {\mathsf {Na_{2}H_{2}P_{2}O_{7}+2NaOH\ {\xrightarrow {}}\ Na_{4}P_{2}O_{7}+2\,H_{2}O}}}
Дигидропирофосфат натрия широко применяется в различных сферах промышленности[1]:
- в хлебобулочных изделиях в качестве источника кислоты для реакции с содой;
- в консервах из морепродуктов для сохранения цвета продуктов при стерилизации;
- в мясной промышленности для ускорения распада нитрита натрия и для удержания воды в готовом продукте;
- при производстве полуфабрикатов из картофеля для защиты от потемнения вследствие окисления.
- для удаления пятен при производстве кожи и меха;
- в молочной промышленности для очистки емкостей;
- в нефтяной промышленности;
- в косметической промышленности (краски для волос, зубные пасты и т.д.).
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ Пищевые добавки
Надпероксид натрия — Википедия
Материал из Википедии — свободной энциклопедии
Надперокси́д на́трия — бинарное соединение натрия и кислорода с формулой NaO2, оранжево-жёлтые кристаллы с ионной кристаллической решеткой.
- Пероксид натрия при высоких давлении (100 ат) и температуре взаимодействует с кислородом:
- Na2O2+O2 →450oC,p 2 NaO2{\displaystyle {\mathsf {Na_{2}O_{2}+O_{2}\ {\xrightarrow {450^{o}C,p}}\ 2\ NaO_{2}}}}
- Того же результата можно добиться сжиганием натрия в кислороде под давлением:
- Na+O2 →400oC,p NaO2{\displaystyle {\mathsf {Na+O_{2}\ {\xrightarrow {400^{o}C,p}}\ \ NaO_{2}}}}
Надпероксид натрия образует оранжево-жёлтые кристаллы. Имеет ионное строение (Na+)(O2—).
При температуре выше −50 °С устойчива фаза I — кубическая сингония, пространственная группа F m3m, параметры ячейки a = 0,549 нм, Z = 4.
При температуре в интервале от −77 °С до −50 °С существует фаза II — кубическая сингония, пространственная группа P a3, параметры ячейки a = 0,546 нм.
При температуре в интервале от −230 °С до −77 °С существует фаза III — ромбическая сингония, пространственная группа P nnm, параметры ячейки a = 0,426 нм, b = 0,554 нм, c = 0,334 нм.
При температуре ниже −230 °С существует фаза IV с плотностью 2,21 г/см³.
- При нагревании надпероксид натрия уже при 100°С начинает выделять кислород:
- 2 NaO2 → Na2O2+O2↑{\displaystyle {\mathsf {2\ NaO_{2}\ {\xrightarrow {\ }}\ Na_{2}O_{2}+O_{2}\uparrow }}}
- Надпероксид натрия растворяется в жидком аммиаке из которого при охлаждении до -32,5°С выпадает комплекс NaO2•2NH3.
- С водой надпероксид реагирует с выделением перекиси водорода и кислорода:
- 2 NaO2+2 h3O → 2 NaOH+h3O2+O2↑{\displaystyle {\mathsf {2\ NaO_{2}+2\ H_{2}O\ {\xrightarrow {\ }}\ 2\ NaOH+H_{2}O_{2}+O_{2}\uparrow }}}
- а в присутствии катализатора, например MnO2, реакция идёт по схеме:
- 4 NaO2+2 h3O →MnO2 4 NaOH+3 O2↑{\displaystyle {\mathsf {4\ NaO_{2}+2\ H_{2}O\ {\xrightarrow {MnO_{2}}}\ 4\ NaOH+3\ O_{2}\uparrow }}}
- аналогично идёт реакция и с кислотами:
- 4 NaO2+4 HCl → 4 NaCl+2 h3O+3 O2↑{\displaystyle {\mathsf {4\ NaO_{2}+4\ HCl\ {\xrightarrow {\ }}\ 4\ NaCl+2\ H_{2}O+3\ O_{2}\uparrow }}}
- 4 NaO2+2 CO2 → 2 Na2CO3+3 O2↑{\displaystyle {\mathsf {4\ NaO_{2}+2\ CO_{2}\ {\xrightarrow {\ }}\ 2\ Na_{2}CO_{3}+3\ O_{2}\uparrow }}}
- 2 NaO2+CO →100oC Na2CO3+O2↑{\displaystyle {\mathsf {2\ NaO_{2}+CO\ {\xrightarrow {100^{o}C}}\ Na_{2}CO_{3}+O_{2}\uparrow }}}
- Надпероксид натрия является сильным окислителем:
- 4 NaO2+3 C →100oC 2 Na2CO3+CO2↑{\displaystyle {\mathsf {4\ NaO_{2}+3\ C\ {\xrightarrow {100^{o}C}}\ 2\ Na_{2}CO_{3}+CO_{2}\uparrow }}}
- NaO2+Al →100oC NaAlO2{\displaystyle {\mathsf {NaO_{2}+Al\ {\xrightarrow {100^{o}C}}\ \ NaAlO_{2}}}}
Используется как компонент систем регенерации кислорода самостоятельно или в смеси с надпероксидом калия.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.