Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
Тема: Классификация реакций, термохимия, скорость
Урок: Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ  А+В; Обратная реакция.
А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В АВ
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2 (1)
(1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.

Рис. 1
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
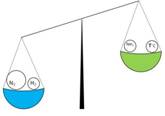
Рис. 2
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.

Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
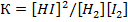
Если  , то в системе больше исходных веществ. Если
, то в системе больше исходных веществ. Если  , то в системе больше продуктов реакции.
, то в системе больше продуктов реакции.
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О2 =2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
· Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
· Добавление катализатора
· Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.

Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (Рис. 3)
относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2 (3)
(3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Подведение итога урока
На уроке была изучена тема «Химическое равновесие», рассмотрены условия смещения равновесия в случае обратимых реакций.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Электроотрицательность. Различие между полярной ковалентной и ионной связями (Источник).
2. Таблица Менделеева (Источник).
3. Электроотрицательность атомов по полингу (Источник).
Домашнее задание
1. №№7-9 (с. 63) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Какие факторы не влияют на смещение химического равновесия?
3. Назовите условия наступления химического равновесия.
interneturok.ru
Необратимые и обратимые реакции — HimHelp.ru
Примером/>/> такой/>/> реакции/>/> может/>/> служить/> разложение/>/> хлората/>/> калия/> (бертолетовой/>/> соли/>)/> при/> нагревании: />
2/>KClO 3/> = 2/>KCl + 3/>O 2/> ↑/>
Реакция/> прекратится/>/> тогда/>,/> когда/> весь/>/> хлорат/>/> калия/> превратится в хлорид/> калия/>/> и кислород/>./> Необратимых/> />реакций/>/> не так много. Большинство/>/> реакций/> являются/> обратимыми. />
Обратимыми/> называются/> такие/>/> реакции/>,/> которые одновременно протекают в/> двух/>/> взаимно противоположных/> направлениях/>./>
В/>/> уравнениях/>/> обратимых/> реакций/>/> между/> левой/>/> и/>/> правой/> частями ставят две/> стрелки,/> направленные/> />в/> />противоположные/>/> стороны./> Примером/> такой/> реакции/>/> может/> служить/> синтез/> аммиака/> из/> водорода/> и азота:/>
 ,
,
∆/>H = -46,2 />кДж/> //> моль/>
В/>/> технике/> обратимые/> реакции/>,/> как/> правило,/> невыгодны./> Поэтому различными/>/> методами/> (изменение/> />температуры,/> давления/> и/>/> др.) их делают практически/> необратимыми./>
Необратимыми/> называются/> такие/>/> реакции,/> при/> протекании/> />которых:/>
1) образующиеся/> />продукты/> />уходят/> />из/> />сферы реакции/> — выпадают/> в виде/> осадка,/> выделяются/> в виде/> />газа, например/>
ВаС/>l2 + />Н/> 2/>SО/> 4/> = />Ва/>SО4/>↓ + 2НС/>l
Na 2/>CO 3/> + 2/>HCl = 2/>NaCl + />CO2/> ↓/> + />H2/>O
2) образуется/> />малодиссоциированное соединение/>, например/> вода:/>
НС/>l + />NаОН/> =/> Н2О/> + />NаСl/>
3) реакция/>/> сопровождается/> большим/>/> выделением/> энергии,/> например/>/> горение/> магния/>
Mg/> + 1/2/> О/>2/> = />М/>gО, ∆/>H = -602,5 />кДж/> //> моль/>
В/> />уравнениях/> />необратимых реакций между/>/> левой/>/> и/> правой/>/> частями ставится/>/> знак/> равенства/> или/> стрелка. />
www.himhelp.ru
32 Химическое равновесие. Необратимые и обратимые процессы.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
 ,∆H =
-46,2 кДж / моль
,∆H =
-46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода: НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
33 Факторы определяющие направление протекания хим. Реакций
Направление протекания химического процесса определяется двумя факторами: изменением энтальпии и изменением энтропии. Возможность протекания процесса зависит от того, какой вклад составляющих — энтальпийной или энтропийной — в изобарный потенциал окажется больше. [2]
Одна из основных задач химической термодинамики состоит в предсказании возможного направления химической реакции, в расчете химических равновесий и определении возможных выходов продуктов реакции. В принципе эту задачу можно решить лишь на основании соотношения (У.225). Иными словами, мы хотим показать, что введение в термодинамику понятий изохорного и изобарного потенциалов не вносит в эту дисциплину ничего принципиально нового, а преследует цель практического удобства расчета. При промышленной реализации гетерогенно-каталитических процессов приходится регулировать скорости и направления химических реакций, механизм которых известен лишь в самых общих чертах, а катализаторами служат сложные твердые вещества, свойства которых до сих пор до конца не выяснены и в состав которых могут входить почти все элементы Периодической системы Менделеева.[c.9] В исследованиях Н. Н. Бекетова (1865) было показано, что направление химической реакции в ряде случаев зависит от давления газа и от концентрации раствора и при известных значениях этих величин реакция может прекратиться, не дойдя до конца. Он писал При некотором давлении Oj производит в растворе уксусной кислоты осадок углекислой соли, а растворение мрамора, который я постоянно употреблял в своих опытах, в свою очередь при некотором давлении прекращается, несмотря на избыток кислоты.. ..Итак, не было никакого сомнения, что при густоте углекислоты, соответствующей 17 атмосферам давления, действие ее и уксусной кислоты уравновешивается.. ..Химическое действие газов зависит от давления и, смотря по величине давления , может даже совершаться в обратном направлении . [c.261] В зависимости от условий эта реакция может протекать самопроизвольно как в прямом, так и обратном направлении. Химическая реакция протекает самопроизвольно до тех пор, пока не достигнуто химическое равновесие между реагирующими веществами. Условия химического равновесия , как и всякого равновесия, могут определяться термодинамическим или молекулярно-статистическим методом.[c.246] Если же реагирующие вещества не подчиняются законам идеальных газов, то в уравнение (Х1,5) вместо парциального давления следует подставить летучесть или активность. Уравнение (XI,5) позволяет установить влияние температуры, инертного газа и начальных концентраций иа направленность химической реакции.
studfile.net
4.1 Необратимые ионно-обменные реакции
Примеры необратимых ионно-обменных реакций:
1) Образование слабого электролита
NaF + HCl ® HF + NaCl – молекулярное уравнение,
Na+ + F– + H+ + Cl– ® HF + Na+ + Cl– – полное ионное уравнение,
F– + H+® HF – сокращенное ионное уравнение.
К данному случаю относятся реакции нейтрализации:
НСl + КОН ® КСl + Н2О,
Н+ + Сl– + К+ + ОН– → К+ + Сl– + Н2О,
Н+ + ОН– → Н2О.
2) Образование осадка
Pb(NO3)2 + K2CrO4 ® PbCrO4¯ + 2KNO3,
Pb2+ + 2NO3– + 2K+ + CrO42– ® PbCrO4¯ + 2K+ + 2NO3–,
Pb2+ + CrO42– ® PbCrO4¯.
3) Образование газообразного вещества
Na2S + 2HCl ® H2S + 2NaCl,
2Na+ + S2– + 2H+ + 2Cl– ® H2S + 2Na+ + 2Cl–,
S2– + 2H+ ® H2S.
4) Образование комплексного соединения
Теоретический материал по комплексным соединениям приведен в главе 18.
CuSO4 + 4NH3 ® [Cu(NH3)4]SO4,
Cu2+ + 4NH3 + SO42– ® [Cu(NH3)4]2+ + SO42–,
Cu2+ + 4NH3 ® [Cu(NH3)4]2+.
В приведенных примерах обратные реакции практически не протекают.
4.2 Обратимые ионно-обменные реакции
Если исходные вещества и продукты реакции содержат слабый электролит, осадок или комплексное соединение, то такие реакции являются обратимыми. В случае обратимых реакций исходные вещества отделяются от продуктов реакции знаком равновесия – ««».
Примеры обратимых ионно-обменных реакций:
1) Образование слабых электролитов
NaF + CH3COOH « HF + CH3COONa,
Na+ + F– + CH3COOH « HF + CH3COO– + Na+,
F– + CH3COOH « HF + CH3COO–.
Равновесие данной реакции будет смещено в сторону более слабого электролита, т.е. в сторону обратной реакции, так как Кд(HF) = 6,5·10–4 больше Кд(СH3СООН) = 1,75·10–5.
2) Образование газообразных веществ
2К2СО3 + Н2SО3 (SО2↑+ Н2О)↔ Н2СО3 (СО2↑+ Н2О) + К2SО3,
2К+ + СО32– + Н2SО3 ↔ Н2СО3 + 2К+ + SО32–,
СО32– + Н2SО3 ↔ Н2СО3 + SО32–.
В исходных веществах и продуктах реакции содержатся слабые термически нестойкие кислоты, при разложении которых образуются соответственно (СО2)и (SО2.) Равновесие будет смещаться в сторону прямой реакции, так как угольная кислота менее устойчива, чем сернистая кислота.
3) Образование осадков
KI + AgCl¯ ↔ KCl + AgI¯,
K+ + I– + AgCl¯ ↔ K+ + Cl– + AgI¯,
I– + AgCl¯ ↔ Cl– + AgI¯.
Для прогнозирования смещения равновесия в данной реакции необходимо сравнить произведения растворимостей, образующихся осадков. Из значений ПР(AgCl) = 1,8·10–10 и ПР(AgI) = 1,0·10–16 следует, что равновесие будет практически полностью смещено в сторону прямой реакции, т.е. в сторону образования значительно менее растворимого осадка.
4) Образование комплексных соединений
К4[Cо(СN)6] + 6NH3 « [Cо(NH3)6](СN)2 + 4КСN,
4К+ + [Cо(СN)6]4– + 6NH3 « [Cо(NH3)6]2+ + 6СN– + 4К+,
[Cо(СN)6]4– + 6NH3 « [Cо(NH3)6]2+ + 6СN– .
Из сравнения значений констант нестойкостей ионов Кн([Cо(СN)6]4– )
= 1,2·10–19 и Кн([Cо(NH3)6]2+) = 2,5·10–4 следует, что равновесие будет практически полностью смещено влево, так как цианидный комплекс кобальта значительно более прочный, чем аммиачный.
5 Гидролиз солей
Гидролиз – это обменная реакция взаимодействия вещества с водой. Гидролизу подвергаются вещества различных классов неорганических и органических соединений. Рассмотрим гидролиз водных растворов солей.
studfile.net
1.дайте определение обратимым и необратимым химическим реакциям.
<a rel=»nofollow» href=»http://vk.cc/56Bl6k» target=»_blank»>Этот сайт возможно поможет.</a>
Обратимые и необратимые химические реакции Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3h3 + N2 ⇆ 2Nh4 Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции. Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция N2O4 ⇆ 2NO2 складывается из элементарных реакций N2O4 ⇆ 2NO2 и 2NO2 ⇆ N2O4 Для обратимости сложной (многостадийной) реакции, необходимо, чтобы были обратимы все составляющие её стадии. Для обратимых реакцийуравнение принято записывать следующим образом А + В АВ. Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании 2КСlО3 > 2КСl + ЗО2, Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl Na 2CO 3+ 2HCl = 2NaCl + CO2↓ + h3O 2) образуется малодиссоциированное соединение, например вода: НСl + NаОН = Н2О + NаСl 3) реакция сопровождается большим выделением энергии, например горение магния Mg +1/2О2= МgО, ∆H = -602,5 кДж / моль
touch.otvet.mail.ru
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ • Большая российская энциклопедия
-

-

-

В книжной версии
Том 23. Москва, 2013, стр. 533
-

Скопировать библиографическую ссылку:
Авторы: Е. Т. Денисов
ОБРАТИ́МЫЕ И НЕОБРАТИ́МЫЕ РЕА́КЦИИ, типы реакций в химич. кинетике. Реакции, протекающие при заданных условиях одновременно как в прямом, так и обратном направлении, называют обратимыми. Обратимые реакции приводят систему в состояние химического равновесия, в котором скорости в двух противоположных направлениях равны. Если скоростью обратного процесса можно пренебречь по сравнению со скоростью прямого процесса, реакцию называют необратимой.
Простейшая обратимая реакция – превращение типа $A⇄Z$. Кинетич. характеристики этого процесса: константы скорости прямой $(k_1)$ и обратной ($k_{–1})$ реакции, энергии активации $(E_1$ и $E_{–1}$) и время релаксации $τ=(k_1+k_{-1})^{-1}$ – время, за которое система приближается к состоянию равновесия в $e$ раз $(e=2,718$ – основание натуральных логарифмов). Кинетика обратимой реакции описывается уравнениями: $[A]=[A]_∞+ ([A]_0- [A]_∞ )e^{–t/τ} \quadи\quad [Z]=[Z]_∞ (1-e^{-t/τ }). Если\quad t=0, [A]=[A]_0$, если же $t→∞ , [A]→ [A]_∞ и [Z]→ [Z]_∞$ , т. е. система стремится к равновесию. Константа равновесия K=k1/k-1= [Z]∞ /[A]∞ . Состояние равновесия характеризуется следующими термодинамич. величинами: энтальпией равновесия $ΔH$, энтропией равновесия $ΔS$ и энергией Гиббса $ΔG=ΔH-TΔS$. Константа равновесия $K$ связана с энергией Гиббса соотношением: $ΔG=–RTlnK$. Напр., реакция образования иодоводорода $H_2+I_2⇄2HI$ характеризуется следующими значениями: $ΔH=–9,4$ кДж/моль, $ΔS= 260,7$ Дж/(моль·К), $ΔG(298 К)=–64,3$ кДж/моль. К обратимым реакциям типа $A⇄Z $ относятся: цис-транс-изомеризация олефинов, напр. цис-$CH_3CH═CHCH_3$⇄ ⇄транс-$CH_3CH═ CHCH_3$; енолизация кетонов, напр. $CH_3C(O)CH_2COOC_2H_5⇄CH_3C(OH)═CHCOOC_2H_5$; изомеризация свободных радикалов, напр. $CH_3C^•H(CH_2)_3CH(CH_3)_2⇄ CH_3CH_2(CH_2)_3C^•(CH_3)_2$; изомеризация ионов, напр. $CH_3CHNH_2COOH⇄ CH_3CHN^+H_3COO^-$. Примерами обратимых реакций типа $A+B⇄Y+Z$ служат диссоциация карбоновых кислот $(C_2H_5COOH+ H_2O⇄ C_2H_5COO^–+H_3O^+)$ и катализируемая кислотами этерификация $(CH_3COOH+ C_2H_5OH⇄ CH_3COOC_2H_5+H_2O)$.
К необратимым относятся реакции, в результате которых образуются стабильные конечные продукты. Кинетика необратимой реакции $А→Z$ описывается уравнениями: $[A]=[A]_0e^{–kt}, [Z]=[A]_0(1-e^{–kt}).$ Если $t→∞, [A]→0$ (не к конечному значению, как для обратимой реакции) и $[Z]→ [A]_0$. Необратимые реакции со стабильным конечным продуктом можно рассматривать как обратимые с $K≫ 1 и ΔG< –200$ кДж/моль, поскольку $K⩾ exp(200000/RT)$. Следует иметь в виду, что $K$ зависит от темп-ры и может уменьшаться с её ростом. Напр., реакция образования бромоводорода $H_2+Br_2⇄2HBr$ характеризуется следующими значениями: $ΔH=-130,5$ кДж/моль и $ΔS=21,2$ Дж/(моль·К), $K=8·10^{16}$ при $300 К$ (реакция практически необратима) и $K=2·10^4$ при $1000 К$ (реакцию можно рассматривать как обратимую). Реакции, в которых продукты превращения вступают в последующие быстрые реакции, в силу чего равновесие становится невозможным, также относятся к необратимым.
bigenc.ru
8.4 Необратимая реакция второго порядка
Примером реакции второго порядка в растворе может служить омыление эфира щелочью:
СН3СООС2Н5 + NaOH CH3COONa + C2H5ОH .
В общем виде необратимая реакция второго порядка описывается стехиометрическим уравнением
А + В C + D .
Пусть в момент времени t = 0 имеется а моль вещества А и b моль вещества В. Пусть к моменту времени t прореагирует х моль вещества А. Из уравнения реакции ясно, что при этом прореагирует и х моль вещества В,
т.е. к моменту времени t останутся непрореагировавшими (а—x) моль вещества А и (b—х) моль вещества В. Если объем системы обозначить через V, то скорость реакции можно записать следующим образом:
—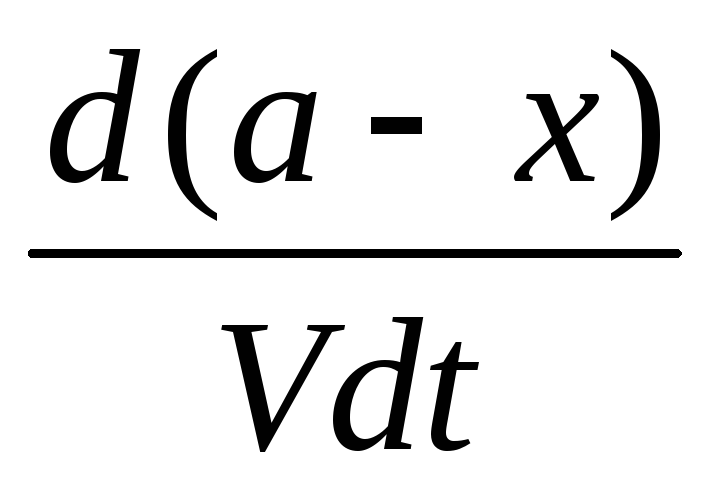 =k`
=k`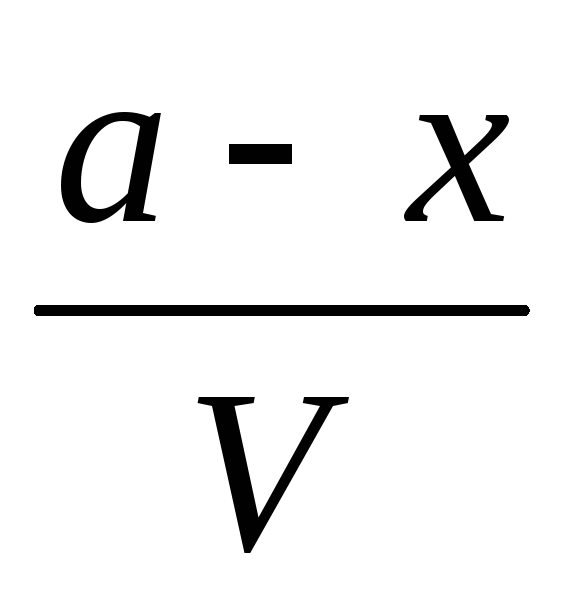
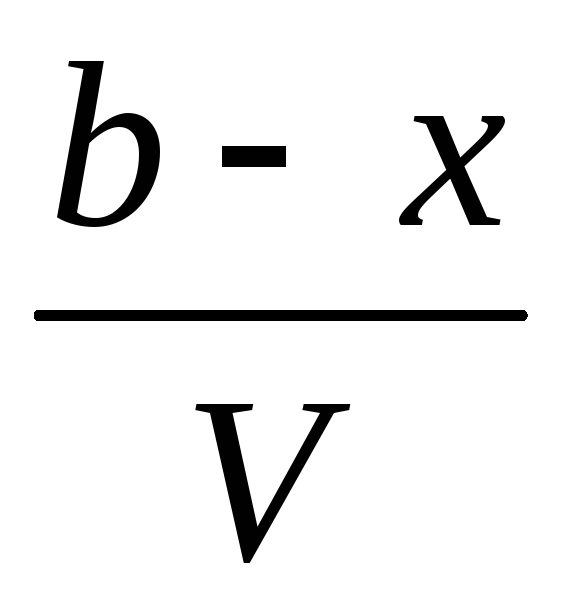 .
.
Сократив обе части уравнения на V и продифференцировав, получим
 =
=  (a-x)(b-x).
(a-x)(b-x).
Если объем V системы постоянен, то его можно ввести в константу, т. е.
 =
k.
=
k.
Тогда уравнение примет вид
 =
k
(а — x)
(b
— х).
=
k
(а — x)
(b
— х).
Уравнение и есть дифференциальное уравнение скорости необратимой реакции второго порядка. Интегрируя это уравнение c учетом начальных условий, получим
k
= 
 ln
ln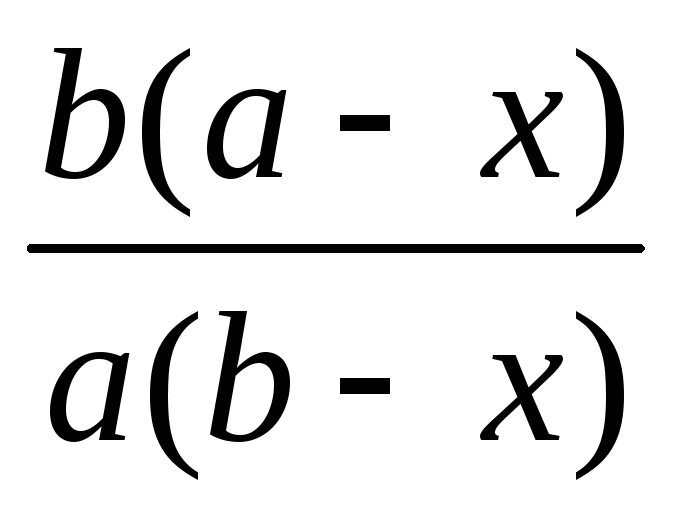 .
.
Если исходные количества веществ А и В будут равны, т.е. a = b , то дифференциальное уравнение скорости запишется так:
 =
k(a-x)2 .
=
k(a-x)2 .
Разделив
переменные и проинтегрировав в пределах
от 0 до t и
от 0 до х, получим
k
= 
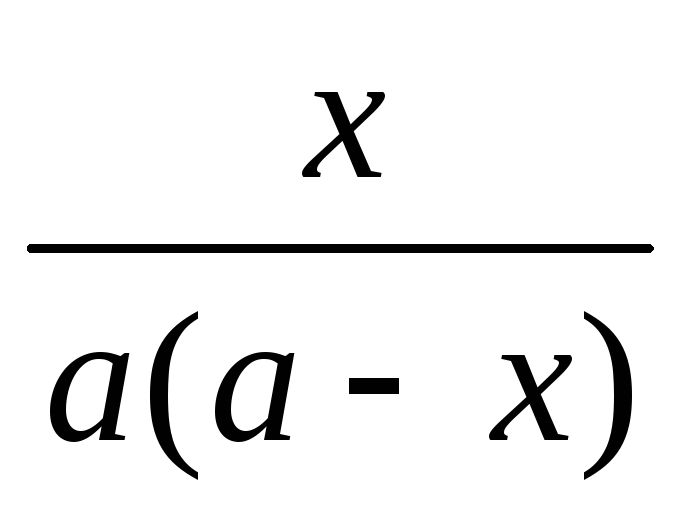 .
.
Когда количество прореагировавшего вещества будет равно половине исходного, т. е. когда х = а/2, значение t будет равно , т. е. времени полураспада. Подставив эти величины в уравнение , получим
= 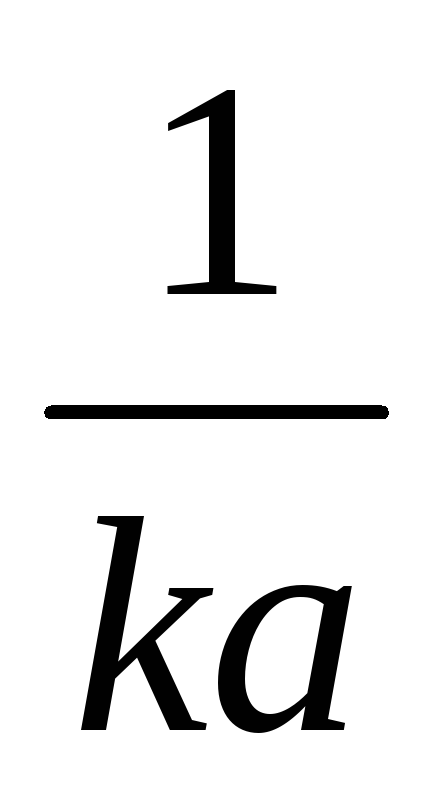 ,
,
т.е. время полураспада для реакции второго порядка обратно пропорционально количеству исходного вещества.
8.5 Обратимая реакция первого порядка
В общем случае стехиометрическое уравнение обратимой реакции первого порядка имеет вид
А в.
Реакция
одновременно протекает в двух
противоположных направлениях, поэтому
скорость такой реакции равна разности
скоростей прямой и обратной реакций,
каждая из которых является реакцией
первого порядка, т.е.
— = k1(a
— x) – k2(b
+ x),
= k1(a
— x) – k2(b
+ x),
где a и b — соответственно исходное количество вещества А и В, моль;x — количество вещества А, прореагировавшее к моменту времени t, моль.
Это следует из принципа независимости (принципа сосуществования) прямой и обратной реакций. Согласно этому принципу, если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна концентрациям реагирующих веществ. Конечное изменение концентрации данного вещества является результатом всех независимых изменений.
 =
k1(a
— x) – k2(b
+ x).
=
k1(a
— x) – k2(b
+ x).
После преобразования уравнения будем иметь
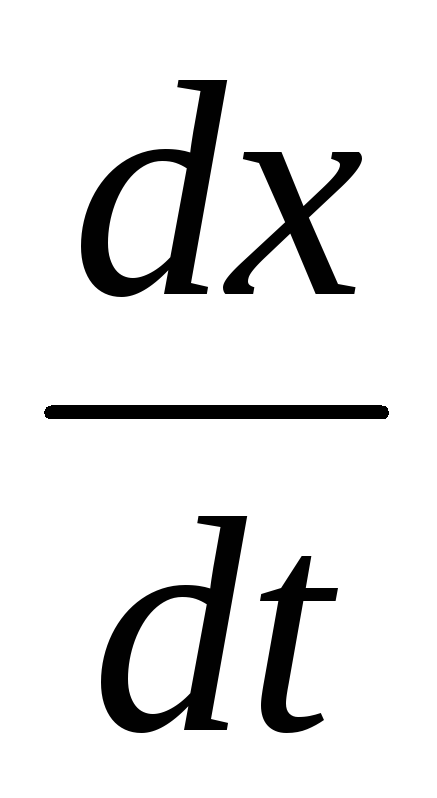 =
(k1 + k2)(
=
(k1 + k2)( — x).
— x).
Пусть
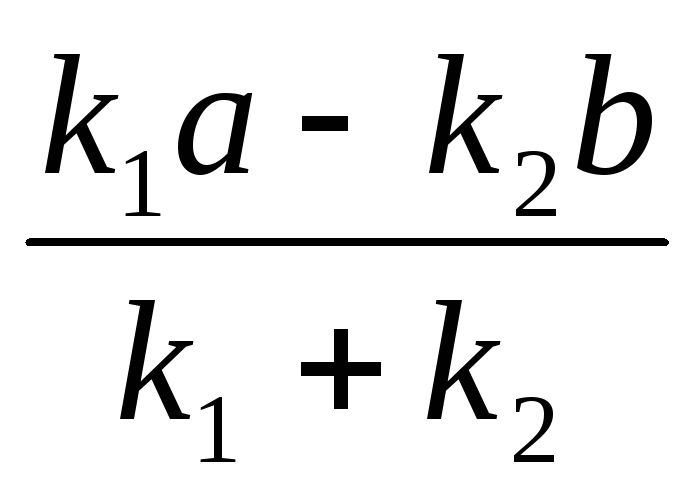 =
L
,
=
L
,
тогда выражение примет вид
 =
(k1 + k2)(L
– x).
=
(k1 + k2)(L
– x).
Разделив переменные, получим
 =
(k1 + k2)dt.
=
(k1 + k2)dt.
Проинтегрировав это выражение в пределах, соответственно от 0 до х и от 0 до t, и, решив его относительно k1 +k2, получим
k1 + k2 =  ln
ln .
.
Следовательно, для нахождения суммы констант скоростей прямой и обратной реакций надо знать величину L, которую можно найти, разделив числитель и знаменатель в уравнении на k2 и приняв во внимание, что
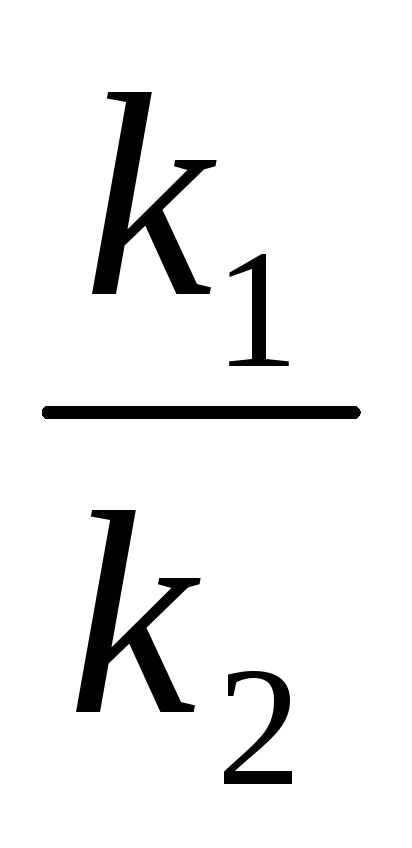 =
K
,
=
K
,
где K — константа равновесия . В результате получим
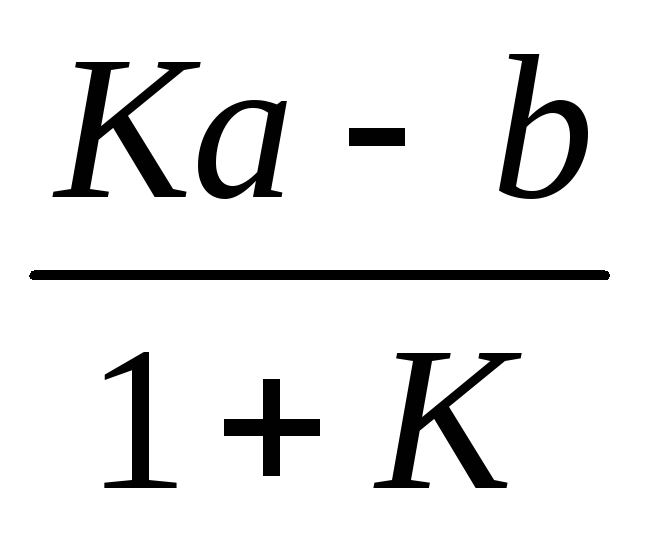 =
L.
=
L.
Следовательно, для нахождения величины L необходимо знать константу равновесия данной реакции. Скорости прямой и обратной реакций в момент равновесия одинаковы, поэтому
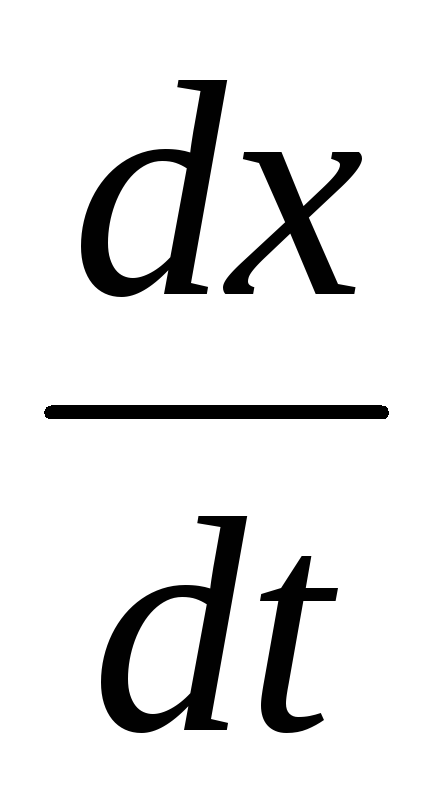 =
0.
=
0.
Oтметив количество вещества А, прореагировавшее к моменту равновесия, индексом , получим
k1(a — x) – k2(b + x) = 0.
Отсюда
K
=  =
=  .
.
Зная числовое значение L, можно рассчитать сумму констант скоростей k1 + k2 ,кроме того, зная числовое значение константы равновесия и учитывая, что она равна отношению констант скоростей прямой и обратной реакций, можно рассчитать каждую константу скорости в отдельности.
Иногда обратимую реакцию первого порядка формально удобно рассматривать как необратимую. Для этого можно считать, что к концу реакции прореагирует x исходного вещества. Тогда дифференциальное уравнение скорости реакции будет иметь вид
 =
k(x — x).
=
k(x — x).
Разделив переменные и проинтегрировав соответственно в пределах от 0 до х и от 0 до t, получим
k
=  ln
ln .
.
Как видно из уравнений,
L = x;
k = k1 + k2.
studfile.net