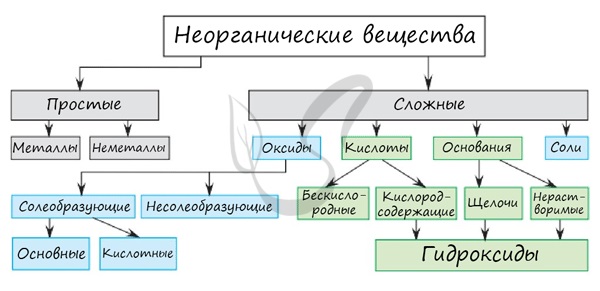
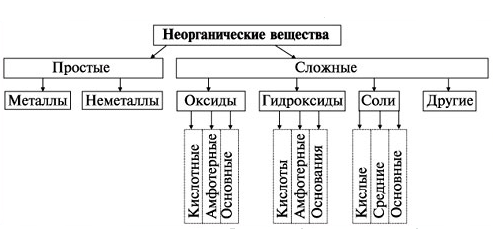
Классификация неорганических веществ, подготовка к ЕГЭ по химии
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
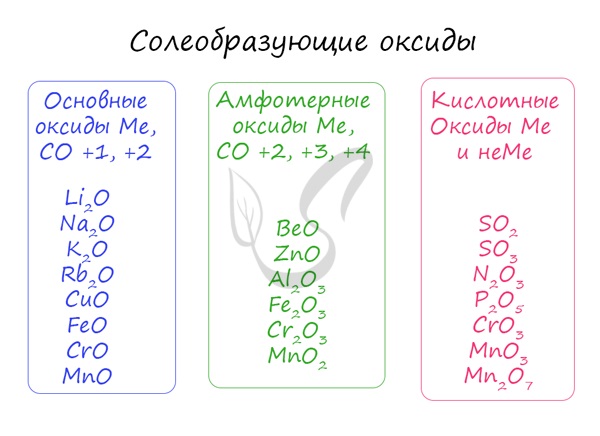
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO
- N2O5 — HNO3
- NO2 — HNO2, HNO3
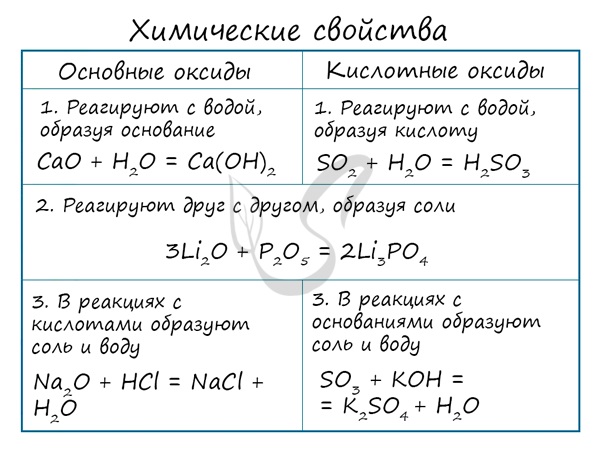
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H 2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
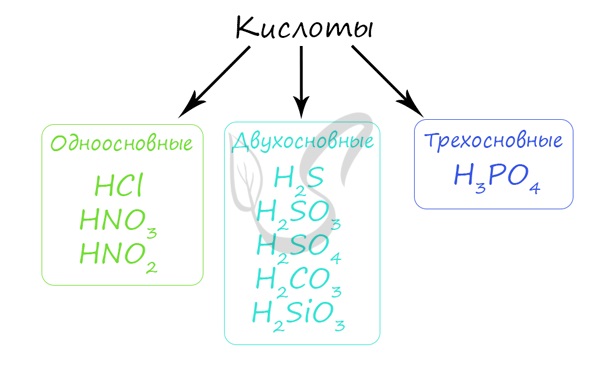
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь 🙂
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделятся газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Классификация неорганических веществВо-первых, все неорганические вещества делятся на простые и сложные. Простые вещества — это вещества, состоящие из атомов одного химического элемента. Иными словами, это форма существования элементов в свободном виде. Все остальные вещества являются сложными. Простые:1) Неметаллы: H2, O2, O3, N2, F2, He и др. Всего в периодической таблице химических элементов присутствуют 22 неметалла. В обычных условиях они могут быть в твердом состоянии (I2), жидком (Br2) или газообразном (H2, O2, F2, Cl2 и другие). Сложные:1) Оксиды — соединения, состоящие из двух элементов, один из которых кислород в степени окисления -2.
2) Пероксиды — сложные вещества, в которых атомы кислорода соединены друг с другом и находятся в степени окисления -1.
3) Гидроксиды
4) Соли — сложные вещества, состоящие из катиона(ов) металла (или катиона аммония NH4+) и аниона(нов) кислотного остатка.
5) Бинарные неорганические соединения
6) Водородные соединения (также являются бинарными соединениями)
|
chemrise.ru
Учебно-методический материал по химии (8, 9, 10, 11 класс) на тему: Таблица-памятка в цвете «Основные классы неорганических соединений (классификация и химические свойства)»
Оксиды
Основные (Ме) CuO | Кислотные (Неме) CO2 | Амфотерные ZnO/BeO AL2O3/Fe2O3/Cr2O3 | Несолеобразующие CO/NO/N2O |
Химические свойства
Основные | Кислотные |
С водой | |
Первые пять в ряду напряжений металлов | Все, кроме SiO2 (песок) |
Получаем щелочь Na2O+h3O=NaOH | Получаем кислоту CO2+h3O=h3CO3 |
С кислотными оксидами | С основными оксидами |
Получаем соль Na2O+CO2=Na2CO3 | |
С кислотами | С щелочами |
Получаем соль | |
Na2O+2HCL=2NaCL+h3O | NaOH+CO2=Na2CO3+ h3O |
Оксиды не вступают в реакции обмена, на ионы не диссоциируют!
Основания
Растворимые | Нерастворимые |
Щелочи |
Химические свойства
| NaOH+CL2= NaCL+NaCLO3+h3O | Три продукта |
| NaOH+CO2=Na2CO3+ h3O | Соль +вода |
| NaOH+HCL=NaCL+h3O | Соль +вода |
| 2NaOH+CuCL2=2NaCL+Cu(OH)2 | Соль+ гидроксид |
| Cu(OH)2=CuO+h3O | Оксид +вода |
Одноосновные | Двухосновные | Трехосновные |
HCL | h3SO4 | h4PO4 |
HNO3 | h3SO3 | |
HNO2 | h3S | |
HI | h3CO3 | |
HBr | h3SiO3 | |
HF |
Кислоты
Бескислородные | Кислородсодержащие |
HF | h3SiO3 |
HBr | h3CO3 |
HCL | h3SO3 |
HI | h3SO4 |
h3S | h4PO4 |
HNO3 | |
HNO2 |
Сильные | Слабые |
h3SO4 | HF |
HNO3 | h3SiO3 |
HBr | h3CO3=СО2+h3O |
HCL | h3SO3=SO2+h3O |
HI | h3S |
h4PO4 | |
HNO2 |
Химические свойства
С металлами | Стоящими до Н в ряду напряжений металлов | 2НCL+Zn=ZnCL2+h3 HCL+Cu= нельзя! | Металл растворяется, образуется соль и водород (шипение)! |
С оксидами металлов | Со всеми | 2НCL+ZnO=ZnCL2+h3O | Оксид растворяется, газ не выделяется! |
С гидроксидами металлов | Со всеми | 2НCL+Zn(OH)2=ZnCL2+2h3O | Реакция нейтрализации |
С солями | Более сильная кислота вытесняет менее сильную из ее соли | 2HCL+CaCO3=CaCL2+h3O+CO2 CaCL2+h3CO3= нельзя! |
Концентрированная серная кислота и азотная кислота любой концентрации образуют с металлами : соль, воду и третий продукт в зависимости от активности металла!!!
Соли
Средние (нормальные) | Кислые | Основные | Комплексные | Гидраты | Двойные |
Na2CO3 | NaHCO3 | (CuOH)2CO3 | Na[AL(OH)4] | CuSO4*5h3O | NaCL*KCL |
Химические свойства
Большинство реакций солей проходят в растворах!!
С кислотами | 2HCL+CaCO3=CaCL2+h3O+CO2 CaCL2+h3CO3= нельзя! | Более сильная кислота вытесняет менее сильную из ее соли! | ||
С щелочами | 2NaOH+CuCL2=2NaCL+Cu(OH)2 | С нерастворимыми гидроксидами реакция не идет! | ||
С металлами | Zn+CuSO4=ZnSO4+Cu Cu+ZnSO4= нельзя! | Более активный металл вытесняет менее активный из раствора ее соли! | ||
С неметаллами | ZnBr2+CL2=ZnCL2+Br2 | Более активный галоген вытесняет менее активный | ||
Разложение | ||||
Нитраты | Активных металлов= нитрит, кислород | Металлов средней активности (включая медь!)= оксид, NO2,кислород | Неактивных металлов= металл, NO2, кислород | |
Соли аммония | Разлагаются без твердого остатка | |||
Карбонаты | Разлагаются с выделением СО2 | |||
Амфотерные соединения
Растворяются и в кислотах, и в щелочах!
Металл | Оксиды и гидроксиды металлов | ||
В растворах (+Н2О) | |||
Al+NaOH=Na[AL(OH)4]+h3 Zn+NaOH=Na2[Zn(OH)4]+h3 | Водород выделяется | Al2O3+NaOH=Na[AL(OH)4] Zn(OH)2+NaOH=Na2[Zn(OH)4] | Водород не выделяется |
В расплавах (при температуре) | |||
Образуются соли | |||
Al+NaOH=NaALO2+h3 Zn+NaOH=Na2ZnO2+h3 | Al2O3+NaOH=NaALO2+h3O Zn(OH)2+NaOH=Na2ZnO2+h3O | ||
nsportal.ru
Тема 2 Основные классы неорганических веществ
Простые вещества – их молекулы состоят из одного вида атомов. Подразделяют на металлы (например: K, Mg, Ni, Fe, Zn, Al, Cr, Ag, Cu) и неметаллы (S, P, N2, O2, O3, Br2).
Сложные вещества – их молекулы состоят из атомов нескольких видов.
Оксиды – сложные вещества, их молекулы состоят из двух видов элементов, одним из которых кислород.
Основные оксиды – оксиды типичных металлов со степенями окисления +1 и +2, иногда +3, которым в качестве гидроксидов соответствуют основания:
+1: K2O, Li2O, Na2O, Rb2O, Cs2O, Cu2O, Ag2O, Tl2O;
+2: CaO, BaO, SrO, MnO, FeO, MgO, NiO, TiO;
+3: Bi2O3, La2O3, Ti2O3.
Взаимодействуют с водой с образованием щелочей: СаО+Н2О=Са(ОН)2;
с кислотами MgO + H2SO4 = MgSO4 + H2O;
с кислотными оксидами ВаО + СО2 = ВаСО3.
Кислотные оксиды – это оксиды неметаллов (например, P2O5, B2O3, Cl2O7) и некоторых металлов в высшей степени окисления (например, Nb2O5, MoO3, Mn2O7), которым в качестве гидроксидов соответствуют кислоты.
Взаимодействуют с водой с образованием кислот P2O5 + 3H2O = 2H3PO4;
со щелочами СО2 + Ва(ОН)2 = ВаСО3 + Н2О;
с основными оксидами СаО + СО2 = СаСО3.
Амфотерными оксиды, которым в качестве гидроксидов соответствуют амфотерные гидроксиды – это оксиды металлов со степенями окисления:
+2: BeO, ZnO, SnO, PbO, CuO, GeO;
+3: Al2O3, Sb2O3, Cr2O3, Fe2O3, Ga2O3;
+4: SnO2, PbO2, GeO2.
Реагируют с кислотными оксидами и кислотами, проявляя основные свойства PbO+2HNO3=Pb(NO3)2+H2O
ZnO+SiO2=ZnSiO3;
с основными оксидами и щелочами, проявляя кислотные свойства ZnO+CaO=CaZnO2
Al2O3+2NaOH=2NaAlO2+H2O,
в растворе Al2O3+2NaOH+3H2O=2Na[Al(OH)4].
Гидроксиды – соединения оксидов химических элементов с водой,
СаО + H2O = Са(ОН)2
SO3 + H2O = H2SO4
Основные гидроксиды (основания) – состоят из катиона металла или аммония NH4+ и гидроксильной группы ОН–.
Например: NaOH, Ni(OH)2, Mg(OH)2, Bi(OH)3, NH4OH.
Щелочи – сильные основания, как правило, хорошо растворимые в воде, гидроксиды щелочных и щелочноземельных металлов (металлов I и II главных групп).
Например: NaOH, КОН, Ва(ОН)2 раствор Са(ОН)2.
Взаимодействуют: с кислотами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 + NaOH = Na[Al(OH)4]
с кислотными оксидами СаO2+ СO= СаСO3
с амфотерными оксидами Al2O3+Ca(OН)2= Ca(AlO2)2 +H2O
Амфотерные гидроксиды (амфотерные основания) – гидроксиды, проявляющие в химических реакциях в зависимости от условий и основные и кислотные свойства, т.е. обладающие двойственной природой.
Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Ge(OH)2, Cu(OH)2;
Al(OH)3, Cr(OH)3, Sb(OH)3, Ga(OH)3, Au(OH)3, As(OH)3;
Sn(OH)4, Pb(OH)4, Ge(OH)4.
Амфотерные гидроксиды могут быть получены взаимодействием солей амфотерных металлов со щелочью. AlCl3+3NaOH=Al(OH)3+3NaCl
Следует помнить, что в избытке щелочи сразу образуются растворимые комлексные соли AlCl3 + 4NaOH= Na[Al(OH)4] + 3NaCl– тетрагидроксоалюминат натрия
AlCl3 + 6NaOH= Na3[Al(OH)6] + 3NaCl – гексагидроксоалюминат натрия
Амфотерные гидроксиды взаимодействуют с кислотами, проявляя основные свойства, формула гидроксида записана в виде основания:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Амфотерные гидроксиды взаимодействуют со щелочами, проявляя кислотные свойства, формула гидроксида записана в виде кислоты H3AlO3, амфотерный металл в составе аниона:
в расплаве: H3AlO3 + NaOH = NaAlO2 + 2H2O
в растворе: Al(OH)3 + NaOH = Na[Al(OH)4] или
Al(OH)3 + 3NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Zn(OH)3 + 2NaOH = Na2[Zn(OH)4]
Кислотные гидроксиды (кислородсодержащие кислоты) – гидроксиды, которые проявляют кислотные свойства, являются кислотами.
Кислоты – соединения, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков (анионов кислот). Основность кислоты – это число атомов водорода, способных замещаться на металл: одно- (HCl, HNO3), двух- (H2SO3, H2S), трех- (H3PO4) основные.
Кислоты подразделяются на безкислородные (например, HCl) и кислородсодержащие (кислотные гидроксиды, например, H2SO4).
По химической активности (силе) кислоты делят на сильные (HCl, H2SO4) и слабые (H2SO3, СH3СООН).
Таблица 1
Названия кислот и их анионов
Кислоты | Анионы кислот | ||
Бескислородные кислоты | |||
Хлороводородная | HCl | Cl | Хлорид |
Фтороводородная | HF | F | Фторид |
Бромоводородная | HBr | Br— | Бромид |
Иодоводородная | HI | I | Иодид |
Сероводородная | H2S | S2 | Сульфид |
HS | Гидросульфид | ||
Циановодородная | HCN | CN | Цианид |
Родановодородная | HCNS | CNS | Роданид |
Кислородсодержащие кислоты | |||
Азотная | HNO3 | NO3 | Нитрат |
Азотистая | HNO2 | NO2 | Нитрит |
Ортофосфорная | H3PO4 | H2PO4 | Дигидрофосфат |
HPO42 | Гидрофосфат | ||
PO43 | Фосфат | ||
Серная | H2SO4 | HSO4 | Гидросульфат |
SO42 | Сульфат | ||
Сернистая | H2SO3 | HSO3 | Гидросульфит |
SO32 | Сульфит | ||
Тиосерная | H2S2O3 | S2O32 | Тиосульфат |
Хлорная | HClO4 | ClO4 | Перхлорат |
Хлорноватая | HClO3 | ClO3 | Хлорат |
Хлористая | HClO2 | ClO2 | Хлорит |
Хлорноватистая | HСlO | СlO | Гипохлорит |
Угольная | H2CO3 | HCO3 | Гидрокарбонат |
CO32 | Карбонат | ||
Кремниевая | H2SiO3 | SiO32 | Силикат |
Марганцовистая | H2MnO4 | MnO42 | Манганат |
Марганцевая | HMnO4 | MnO4 | Перманганат |
Хромовая | H2CrO4 | CrO42 | Хромат |
Двухромовая | H2Cr2O7 | Cr2O72 | Бихромат |
Муравьиная | HCOOH* | HCOO | Формиат |
Уксусная | CH3COOH* | CH3COO | Ацетат |
Щавелевая | HOOCCOOH* | C2O42 | Оксалат |
*Муравьиная, уксусная и щавелевая кислоты являются органическими кислотами, поэтому вид их формул отличается от вида минеральных (неорганических) кислот. Водород, имеющий кислые свойства и способный замещаться на ион металла, занимает в минеральных кислотах первое место (H2SO4), в органических – последнее (HCOOH, CH3COOH, НООССООН).
Кислоты взаимодействуют
с основными гидроксидами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 +3HNO3 = Al(NO3)3 + 3H2O;
с основными оксидами MgO+2HCl=MgCl2+H2O;
амфотерными оксидами Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O;
с металлами, стоящими в ряду напряжений до водорода Fe+H2SO4=FeSO4+H2↑.
Не взаимодействуют с металлами, стоящими за водородом: Cu, Hg, Ag, Au;
При взаимодействии с металлами HNO3и H2SO4 (конц.) окислителями являются S+6 и N+5. Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O;
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
Соли – продукты полного или неполного замещения водорода кислоты на металл, или замещения гидроксигрупп основания кислотным остатком.
Средние соли (NaCl, Na2SO4, K3PO4),
Кислые соли (NaHCO3, MgHPO4, КH2PO4),
Основные соли (FeOHCl, Al(OH)2Cl, (CaOH)2CO3,
Двойные соли (KAl(SO4)2),
Комплексные соли (Ag[(NH3)2]Cl, K4[Fe(CN)6]).
Характерные реакции и генетическая связь неорганических соединений разных классов представлены в Таблицах, для реакций, протекающих в растворе, кроме молекулярных уравнений приведены полные и краткие ионные уравнения. Понятия растворимость и сила оснований и кислот, двойственная природа амфотерных гидроксидов рассмотрены в главе Диссоциация.
Таблица 2
Генетическая связь между соединениями разных классов
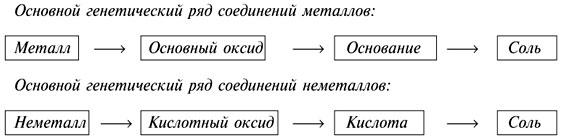
Таблица 3
studfile.net
Классификация неорганических веществВо-первых, все неорганические вещества делятся на простые и сложные. Простые вещества — это вещества, состоящие из атомов одного химического элемента. Иными словами, это форма существования элементов в свободном виде. Все остальные вещества являются сложными. Простые:1) Неметаллы: H2, O2, O3, N2, F2, He и др. Всего в периодической таблице химических элементов присутствуют 22 неметалла. В обычных условиях они могут быть в твердом состоянии (I2), жидком (Br2) или газообразном (H2, O2, F2, Cl2 и другие). Сложные:1) Оксиды — соединения, состоящие из двух элементов, один из которых кислород в степени окисления -2.
2) Пероксиды — сложные вещества, в которых атомы кислорода соединены друг с другом и находятся в степени окисления -1.
3) Гидроксиды
4) Соли — сложные вещества, состоящие из катиона(ов) металла (или катиона аммония NH4+) и аниона(нов) кислотного остатка.
5) Бинарные неорганические соединения
6) Водородные соединения (также являются бинарными соединениями)
|
chemrise.ru
| Химия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периодическая система химических элементов Д.И. Менделеева расширенная и доработанная (атомная масса, электронное строение, электро-отрицательность, температура плавления, температура кипения) |
Растворимость солей, кислот и оснований в воде |
Растворимость солей и оснований в воде | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сравнение понятий изомер и гомолог |
Химические свойства металлов | Окраска индикаторов в различных средах |
||||||||||||||||||||||||||||||||||||||||||||||||||||
Электрохимический ряд напряжений металлов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Плотность и температура плавления металлов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость солей и электрохимический ряд | Ряд электроотрицательности элементов | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрохимический ряд напряжений металлов Ряд электроотрицательности неметаллов (2 x 0.6 m) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость некоторых веществ в воде (при t=25°C) и их молекулярные или формульные массы |
Электрохимический ряд напряжений металлов |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обобщение сведений о группах углеводородов |
Относительные или молярные массы неорганических соединений |
Химические свойства кислот, солей и оснований |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие константы нестойкости некоторых комплексных ионов |
Константы диссоциации воды и некоторых cлабых кислот и оснований в водных растворах |
Стандартные термодинамические величины некоторых веществ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартные электродные потенциалы металлов |
Электродные потенциалы металлов в различных средах, В |
Правила безопасности на уроке химии |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Генетические связи органических веществ | Генетические связи неорганических веществ | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация органических соединений и их свойства (Комплект из трёх таблиц) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Углеводороды |
Кислородосодержащие органические соединения | Азотосодержащие органические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| < назад | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
www.ma-ko.ru
.металл | неметалл | вода | Кисл..оксид | Осн.оксид | Амф..оксид | кислота | Нерас.основание/ | Щелочь(основание) | Амф.гидроксид | соль | |
металл | ——— | 1.соль/Fe+Cl2-FeCl3/ 2.оксид;гидрид(только МЕ I;IIгрупп) карбид; нитрид , сульфид и др. Но!/щел.ме.первой группы обр-т пероксиды/Na2O2/кроме лития. | 1.акт.ме=щелочь+H2 2.ср.акт.ме=основ.окcид+H2)при нагр.)но помни2Al+6h3O=2Al(OH)3+3H2-если снять оксидную пленку.и Mg+HOH=Mg(OH)2+h3 | ————но очень редко CO2+Mg(Zn)=MgO+CO | —————- | ——————но алюминотермия/Al+Cr2O3=Al2O3+Cr/- | !!! =СОЛЬ+h3если .ме стоит до H2/(Fe+HCl=FeCl2+h3) 1/щел.ме. нельзя!/ 2/ но! HNO3 и к.h3SO4реагирует почти со всеми/кроме AU .Pt/ и h3 не выдел. | ——— | ————- | ———— | = СОЛЬ+МЕ/.если ме стоит впереди МЕ из состава соли (но щел.мет.нельзя брать) |
неметалл | +смотри↑ | 1.оксиды 2.водородные соед.(CH4/PH3/HCl/и другие | ————-ноCl2+h3O=HCl+HClO | ———но!CO2+C=2CO/ SiО2 + 2С → Si + 2СО. | ———-но 1.Осн.оксид ср.акт.ме или неакт.ме+h3=h3O+ME/при нагр./ 2.карботермияZnO+C=Zn+CO | ————— | ———но!-S+k.HNO3=h3SO4+6NO2+2h3O/ С + к.2H2SО4 → СО2 + 2SО2 + 2Н2О | ———— | Но!на холоде: Cl2 + 2NaOH = NaClO + NaCl + h3O, при нагревании: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3h3O; (Cl2—Br2 также как и хлор/—I2—P4(белый)—Si —S)см.внизу | ———— | ————но Более активные галогены вытесняют менее активные из их солей./Cl2+KBr=KCl+Br2/ |
Кислоксид | ————но очень редко CO2+Mg(Zn)=MgO+CO | —- но!CO2+C=2CO/ SiО2 + 2С → Si + 2СО. | =кислота/но! SiO2 не реагирует | ————— | =соль | =соль/но реагируют только с оксидами сильных и средних кислот/ | ——— | ———— | = соь +h3O или =кислая соль | =соль+h3O | —-но нелетучие оксиды вытесняют летучие из их солейSiO2+K2CO3=CO2+K2SiO3 |
металл | неметалл | вода | Кисл.окид | Осн.оксид | Амф.оксид | кислота | Нер.основание | Щелочь/основание/ | Амф.гидроксид | соль | |
Основ.оксид | —- | —— ————но 1.Осн.оксид ср.акт.ме или неакт.ме+h3=h3O+ME/при нагр./ 2.карботермияZnO+C=Zn+CO | =щелочь/но если оксид акт.Ме/+ | =соль | ————— | =двойная сольCaO+ZnO=CaZnO2; Li2O+Al2O3=2LiAlO2 | =соль +h3O | ——————- | =двойная соль +h3o (NaAlO2+H2O)если оксид акт.металла | — | |
кислота | + + | ———— но!-S+k.HNO3=h3SO4+6NO2+2h3O/ С + к.2H2SО4 → СО2 + 2SО2 + 2Н2О | ————- | ————— | =соль +h3O | =соль+H2O | ———- | = Соль +h3O | = Соль +h3O | = Соль +h3O | =Соль+кислота/если кислота сильная а соль образована слабой кислотой и соль выпадает в осадок |
Щелочь(основание) | — | ————— | ————— | = соь +h3O или =кислая соль | ————— | +h3o=Na2⌠Zn(OH)4⌡комплексная соль в растворе .а при сплавлении соль Na2znO2*но!(железо не обр-т). | =соль+h3O | ————— | ——————— | =компл.соль.Al(OH)3+NaOH=Na⌠Al(OH)4⌡в растворе а при сплавлении будетNaAlO2+2H2O | =нерастворимое основание+H2O/ если в составе соли металл неакт. Или сред.активный/ |
металл | неметалл | вода | Кисл.оксид | Осн.оксид | Амф.оксид | кислота | Нер.основание | щелочь | Амф.гидроксид | соль | |
соль | СОЛЬ+МЕ/.если ме стоит впереди МЕ из состава соли (но щел.мет.нельзя брать) | ——но но Более активные галогены вытесняют менее активные из их солей. | но иногда кристаллогидрат CuSO4.h3Oи гидролиз некоторых солей. | ————- | ———— | ————— | =Соль+кислота/если кислота сильная а соль образована слабой кислотой и соль выпадает в осадок | ————- | =нерастворимое основание+H2O/ если в составе соли металл неакт. Или сред.активный/ | ————- | =соль(нераст.)+соль/исходные соли должны быть растворимые/ |
.Нагревание разложение | — | —- | ток=h3+O2 | —— | —— | Угольная.сернистая. | =осн.оксид+вода | ——————но Nh5OH——Nh4+h3O | =осн.оксид+вода | Карбонаты.сульфиты.силикаты и др.нитраты по схеме:см.прим. |
infourok.ru