Ковалентная связь. Разбираем задачи, закрепляем тему
История
С момента открытия атомов и молекул исследователи долгое время задумывались над вопросом, какие силы объединяют микрочастицы в молекуле.
В 1897 году Джозеф Джон Томсон выдвинул теорию, что атомы удерживаются рядом благодаря переносу электронов от одного атома к другому и образованию электронных связей. И был прав. Вклад Томсона в науку был отмечен Нобелевской премией в 1906 году за «изучение прохождения электрического тока через газы».
Исследования продолжились, и в 1916 году американский физико-химик Гильберт Ньютон Льюис объяснил это явление, предложив теорию электронной химической связи. В своих опытах ученый заметил, что наиболее устойчивы при взаимодействии электронные оболочки атомов благородных газов. А атомы других веществ стремятся сделать свою энергетическую оболочку похожей на оболочку благородного газа, расположенного в том же периоде. И для этого присоединяют или отдают электроны. Познакомиться с биографией ученого можно в учебнике Химия 8 класс под редакцией В.В. Еремина на странице 218.
Исследователь предложил графическую модель структуры молекулы, в которой электроны обозначены точками, а связи черточками.
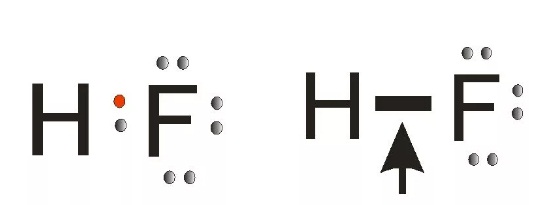
Правило октета
Льюис сформулировал принцип «октета». Согласно этому правилу, при создании молекулы атомы стараются достигнуть восьмиэлектронной валентной оболочки, попарно объединяя электроны, находящиеся на внешней орбитали. По важности это открытие сопоставимо с открытием периодического закона Д.И. Менделеевым.
Заглянем в Периодическую таблицу. В первом периоде находятся водород и гелий. Общее у этих двух газов — одна орбиталь. А вот количество электронов различно: у водорода один, у гелия два. Как мы помним, на первой орбитали у любого элемента могут поместиться всего лишь два электрона. И поскольку орбиталь гелия максимально заполнена — это инертный газ, который не вступает в химические реакции. А вот водород ищет себе пару и объединяется в двухатомные молекулы H 2 или образует соединения с другими элементами. В остальных периодах на внешней орбитали могут разместиться восемь электронов.

Химия. 8 класс. Задачник
Задачник включает как типовые расчетные задачи, так и нестандартные задачи повышенной сложности; задания и упражнения, развивающие учебные умения, творческие и аналитические способности учащихся. Задачи сгруппированы по темам, изучаемым в 8 классе основной школы, в порядке возрастания их сложности: от простых расчетных до поисковых олимпиадных.
КупитьМеханизмы образования связи
Взаимодействие, возникающее при образовании общих электронных пар, называется
Взаимодействие между атомами различных веществ может происходить двумя способами.
- В первом варианте два атома, у которых на внешнем энергетическом уровне находится по одному свободному электрону, образуют общую пару. Такой механизм взаимодействия называют обменным.
- В некоторых случаях у одного атома есть пара электронов, а у другого свободная орбиталь, которую он предоставляет для взаимодействия. Такой механизм называют донорно-акцепторным.
От электроотрицательности атомов и их способности притягивать электроны зависит, какая ковалентная связь
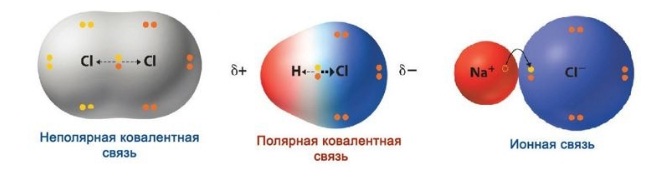
образуется в молекуле.В месте перекрывания электронных облаков создается зона повышенной электронной плотности. Если электроотрицательность элементов равна, электронное облако находится на одинаковом расстоянии от центров атомов, входящих в электронную пару, и образуется ковалентная неполярная связь.
Если электроотрицательность различна, происходит сдвиг электронного облака в сторону центра с большей электроотрицательностью, то есть образуются молекула с двумя полюсами (диполь). Самый простой пример диполя — молекула воды. Данный тип связи и есть ковалентная полярная связь.
Ионная связь — вариант крайне полярной ковалентной связи.
Помимо полярности,
- Длиной связи — чем меньше длина, тем прочнее связь.
- Энергией связи — чем больше выделяется энергии при образовании молекулы, тем стабильнее молекула.
- Кратностью связи — число общих электронных пар между атомами. Кратность связи такова, что обеспечивает заполнение внешней электронной оболочки до 8 электронов у обоих атомов. Чем больше кратность связи, тем прочнее ковалентная связь молекулы.
Что еще почитать?
Примеры и задачи
Чтобы закрепить тему, разберем задачу из учебника Химия 8 класс под редакцией В.В. Еремина.
Даны три электронные формулы:
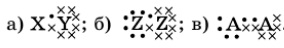 .
.
Какие из перечисленных ниже формул веществ соответствуют каждой из них: NH 3, HCl, O2, F2, N2, H2, HBr, Cl2?
Начнем с задания под буквой а.
Поскольку буквенные обозначения элементов разные, следовательно, и вещества в состав молекулы входят разные. Значит, можем вычеркнуть O2, F2, N2, H2 и Cl2.
В состав молекулы входят два атома различных веществ, соответственно, NH3, в молекулу которого входит 4 атома, также вычеркиваем.
У нас остаются HCl и HBr.
И Cl и Br являются элементами VII группы Периодической таблицы, и на внешнем энергетическом слое у них 7 электронов. Значит, оба вещества подходят.
С остальными двумя примерами попробуйте справиться сами.
#ADVERTISING_INSERT#ковалентная (полярная и неполярная), ионная, металлическая – HIMI4KA

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
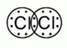
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
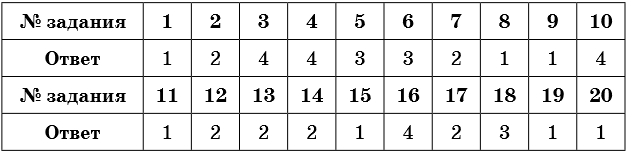
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
1) O2, H2, N2
2) Al, O3, H2SO4
3) Na, H2, NaBr
4) H2O, O3, Li2SO4
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
1) O2, H2SO4, N2
2) H2SO4, H2O, HNO3
3) NaBr, H3PO4, HCl
4) H2O, O3, Li2SO4
3. Только ионной связью образовано каждое из веществ, формулы которых
1) CaO, H2SO4, N2
2) BaSO4, BaCl2, BaNO3
3) NaBr, K3PO4, HCl
4) RbCl, Na2S, LiF
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
1) HCl и Na2S
2) Cr и Al(OH)3
3) NaBr и P2O5
4) P2O5 и CO2
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
1) HI – PH3 – HCl
2) PH3 – HCl – H2S
3) HI – HCl – H2S
4) HCl – H2S – PH3
11. Длина химической связи Э–Н уменьшается в ряду веществ
1) NH3 – H2O – HF
2) PH3 – HCl – H2S
3) HF – H2O – HCl
4) HCl – H2S – HBr
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
1) 4
2) 2
3) 6
4) 8
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
1) 4
2) 20
3) 6
4) 12
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
1) Mg
2) H2
3) NaCl
4) CaCl2
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
1) NaF, CaF2
2) NaNO3, N2
3) O2, SO3
4) Ca(NO3)2, AlCl3
Ответы

himi4ka.ru
Ковалентная связь
Ковалентная химическая связь возникает между атомами с близкими или равными значениями электроотрицательностей. Предположим, что хлор и водород стремятся отнять электроны и принять структуру ближайшего благородного газа, значит ни один из них не отдаст электрон другому. Каким же способом они все таки соединяются? Все просто – они поделятся друг с другом, образуется общая электронная пара.
ковалентная неполярная связьковалентная полярная химическая связь
Теперь рассмотрим отличительные черты ковалентной связи.
В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
Известно, что атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электронных облаков происходит в определенном направлении. Т.е. реализуется такое свойство ковалентной связи как направленность.
Если ковалентная связь в молекуле образована одинаковыми атомами или атомами с равной электроотрицательностью , то такая связь не имеет полярности , т.е электронная плотность распределяется симметрично. Называется она неполярной ковалентной связью (H2, Cl2, O2). Связи могут быть как одинарными, так и двойными, тройными.
Если электроотрицательности атомов различаются, то при их соединении электронная плотность распределяется между атомами неравномерно и образуется ковалентная полярная связь (HCl, H2O, CO), кратность которой также может быть различной. При образовании данного типа связи, более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд (δ- и δ+). Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:
Полярность соединения тем более выражена, чем больше дипольный момент. Молекулы будут иметь неполярный характер, если дипольный момент равен нулю.
В связи с вышеперечисленными особенностями, можно заключить, что ковалентные соединения летучи, имеют низкие температуры плавления и кипения. Электрический ток не может проходить через эти соединения, следовательно, они плохие проводники и хорошие изоляторы. При подводе тепла, многие соединения с ковалентной связью, загораются. В большей части это углеводороды, а также оксиды, сульфиды, галогениды неметаллов и переходных металлов.
zadachi-po-khimii.ru
Ковалентная неполярная и полярная связь. – nabi-ildar.ru
Ковалентная неполярная и полярная химическая связь.
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам.
Ковалентная связь – это химическая связь, возникающая между атомами неметаллов в результате образования общей электронной пары.
Входе образования ковалентной связи атомы объединяют свои электроны в общую пару образуя при этом общую молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Каждая новая электронная оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки. Так любой атом мы уже знаем стремиться получить завершенный электронный уровень как благородные газы.
Ковалентная неполярная связь.
Ковалентная неполярная связь-это связь, образованная между одинаковыми элементами неметаллами за счет образования общей электронной пары.
Вещества с данной связью имеют в твердом состоянии молекулярную либо атомную кристаллическую решетку.
Рассмотрим схему образования ковалентной неполярной связи для этого воспользуемся формулой Льюиса.
Американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками, которые необходимо располагать по сторонам света относительно символа элемента. Одна точка обозначает один электрон.
Возьмём на примере образования молекулы H2.

На рисунке мы видим атомы водорода с их атомными орбиталями, которые при образовании связи образуют молекулярную орбиталь. Чтобы показать схему Льюиса необходимо найти электроны внешнего электронного уровня и число неспаренных электронов.
Например, для азота 8-5 = 3, то есть 3 неспаренных электрона.
У атома водорода один электрон, то есть в молекуле между атомами может образоваться только одна связь. Схеме будет выглядеть так:

Для азота необходимо распределить электроны внешнего уровня одну пару и три неспаренных электрона относительно символа в схеме Льюиса.
При образовании связи каждый атом окружается электронами согласно числу электронов, на завершённом уровне, то есть два или восемь – правило дуплета или октета.
Схема будет такая:

Число связей между атомами зависит от количества общих электронных пар.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи, равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Ковалентная полярная связь.
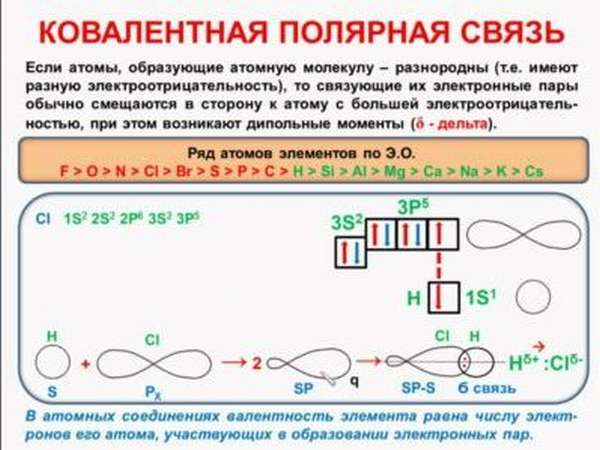
Ковалентная полярная связь-это связи образованная между разными элементами неметаллами, где более электроотрицательный элемент оттягивает ближе к себе электронную пару от менее электроотрицательного.
Характерна для сложных веществ образованных элементами неметаллами. Примеры: NH3, H2O, CO2 и т.д. вещества с данной в твёрдом состоянии имеют также молекулярную либо атомную кристаллическую решётку.
Электроотрицательность свойство атома притягивать к себе электроны от атомов других элементов.
Электроотрицательность -это мера неметалличности элементов. Высокая электроотрицательность характерна для неметаллов и низкая для металлов. Самый электроотрицательный элемент фтор. Электроотрицательность в периодической системе изменяется: в группе с верху вниз – уменьшается, в периоде с лева на право- возрастает. Можно запомнить так чем дальше отдаляемся от фтора, тем меньше становиться электроотрицательность элемента (так как фтор самый электроотрицательный).
Рассмотрим образование связи между водородом и хлором в молекуле хлороводорода.
У водорода один электрон на внешнем уровне, а у хлора семь из которых один неспаренный участвующий в образовании связи.
Так как хлор более электроотрицательный элемент, он оттягивает электронную пару к себе ближе при образовании молекулярной орбитали. При смещении на хлоре образуется частичный отрицательный заряд, а на водороде частичный положительный заряд, возникает полярность. При составлении формулы Льюиса общую электронную пару необходимо рисовать ближе к более электроотрицательному элементу.


Если рассмотреть аммиак, то в данной молекуле азот имеет три неспаренных электрона и образует три связи с тремя атомами водорода у которых по одному электрону. И все пары оттягивает азот ближе к себе.

nabi-ildar.ru
Ковалентная и ионная химическая связь. Видеоурок. Химия 11 Класс
Каждый атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Благодаря зарядам ядра и электронов между соседними атомами возникают электростатические силы: притяжения и отталкивания. Если сближение атомов приводит к понижению энергии образующейся частицы (по сравнению с энергиями отдельных атомов), то образуется химическая связь.
Химическая связь – это силы взаимодействия, удерживающие частицы друг около друга.
Ученые доказали, что главную роль в образовании связи играют электроны, которые меньше всего связаны с ядром, т. е. расположенные на внешней электронной оболочке. Такие электроны называют валентными.
В атомах элементов главных подгрупп все валентные электроны расположены на последнем (внешнем) электронном слое и их число равно номеру группы.
В атомах элементов побочных подгрупп валентные электроны расположены, как правило, на двух последних электронных слоях, но их число тоже равно номеру группы, к которой относится элемент.
Например, в атоме калия один валентный электрон, в атоме марганца – 7 валентных электронов (рис. 1).
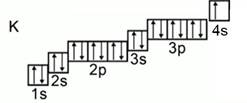
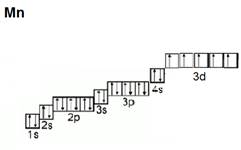
Рис. 1. Электронные конфигурации атомов калия и марганца
Согласно теории химической связи наиболее устойчивыми являются внешние оболочки из восьми электронов – октет (если в атоме только 1 электронный слой, то для него наиболее устойчиво двухэлектронное состояние – дуплет).
Образование устойчивой электронной оболочки может происходить несколькими способами, поэтому различают разные виды химической связи.
Ковалентная связь – химическая связь, образованная перекрыванием электронных облаков атомов. Электронные облака (электроны), обеспечивающие связь, называются общей электронной парой.
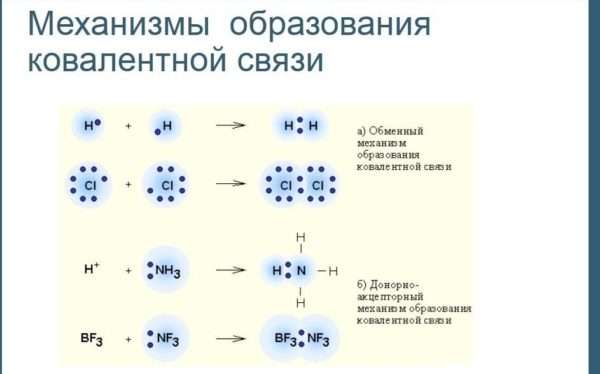
Различают два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме каждый атом предоставляет по одному электрону для образования общей пары:
А·+ В = А:В
При донорно-акцепторном механизме один атом предоставляет уже имеющуюся у него пару электронов (донор), а другой атом предоставляет свободную орбиталь для этой пары электронов (акцептор):
А: + □В = А:В
Связь, осуществляемая за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной.
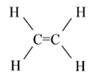
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковыми значениями относительной электроотрицательности, например в молекулах хлора, азота, между атомами углерода в этилене (табл. 1).
|
Молекулярные формулы |
Электронные формулы |
Графические формулы |
|
Cl2 |
|
|
|
N2 |
|
|
|
C2H4 |
|
|
Табл. 1. Примеры соединений, в которых присутствуют ковалентные неполярные связи
Число общих электронных пар зависит от того, сколько электронов не хватает каждому атому для октета. Хлор – элемент VII-А подгруппы, следовательно, на его внешнем электронном слое 7 электронов. До октета не хватает одного электрона, значит, будет образована одна общая пара электронов в Cl2. Между атомами азота в молекуле N2 образуются три общие электронные пары, т. е. тройная ковалентная связь. Между атомами углерода в этилене образуется двойная ковалентная связь.
Обратите внимание, что из каждого правила есть исключения и правило октета не всегда выполняется (пример – молекула сернистого газа SO2).
Ковалентная полярная связь осуществляется за счет образования общих электронных пар, которые смещаются к атому более электроотрицательного элемента. При этом на атомах образуются частичные заряды: δ+ и δ- (рис. 2).
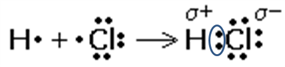
Рис. 2. Образование ковалентной связи в молекуле хлороводорода
Чем больше разность электроотрицательностей атомов элементов, тем больше полярность связи.
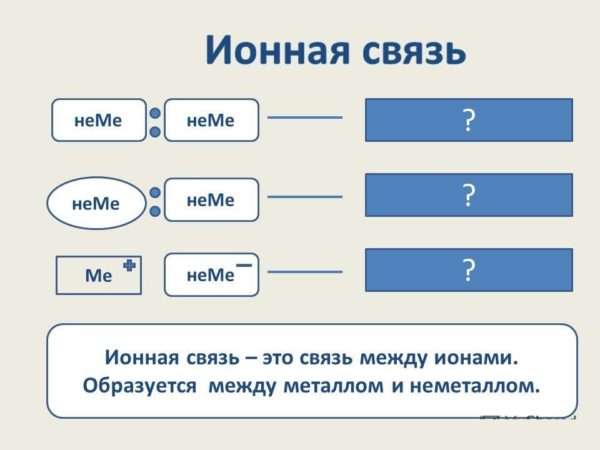
Ионная связь – предельный случай ковалентной полярной связи.
Ионная связь – это электростатическое притяжение между ионами, образованными путем практически полного смещения электронной пары к одному из атомов. Этот тип связи образуется, если разность значений относительной электроотрицательности атомов велика (как правило, больше 1,7 по шкале Полинга).
Ионная связь обычно образуется между типичным металлом и типичным неметаллом. Например, в хлориде натрия NaCl атом натрия свой 1 валентный электрон отдал атому хлора и превратился в катион, а атом хлора, приняв 1 электрон, превратился в анион. Катион с анионом притягиваются, и образуется ионная связь (рис. 3).

Рис. 3. Образование ионной связи в хлориде натрия
Соли, щелочи, основные оксиды, карбиды, нитриды относятся к ионным соединениям. Все эти вещества при обычных условиях твердые, с высокими температурами плавления (как правило, 700–1000 °С), их растворы и расплавы электропроводны.
Тугоплавкость ионных соединений объясняется тем, что ион может притягивать к себе противоположно заряженные ионы в любых направлениях и большом количестве. Следовательно, ионы прочно соединяются в кристаллическую решетку. Например, в кристаллической решетке поваренной соли один катион натрия окружен шестью анионами хлора, а каждый анион хлора окружен шестью катионами натрия (рис. 4). Таким образом, весь кристалл поваренной соли представляет собой как бы одну огромную макромолекулу, состоящую из огромного числа ионов. И химическая формула NaCl определяет только их соотношение в кристалле. При обычных условиях молекулы NaCl не существует.
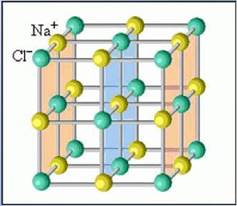
Рис. 4. Модель кристаллической решетки хлорида натрия
В одном веществе могут реализовываться сразу несколько типов химической связи. Например, в хлориде аммония присутствуют ковалентные связи, образованные по обменному и донорно-акцепторному механизму, а также ионная связь между катионом аммония и хлорид-ионом (рис. 5).

Рис. 5. Образование химических связей в хлориде аммония
Подведение итогов урока
Вы узнали, что такое химическая связь и почему она образуется, в чем разница между ковалентной и ионной связью, как изобразить схемы образования химической связи в различных веществах.
Список литературы
1. Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§§ 8, 14)
2. Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. Химия: 11 класс: Учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч.2. М.: Вентана-Граф, 2008. (§9)
3. Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011. (с. 88–95)
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 39–41)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Интернет-сайт «Алхимик» (Источник)
2. Интернет-сайт chem.msu.su (Источник)
3. Интернет-сайт chem.msu.su (Источник)
Домашнее задание
1.с. 39–40 №№ 7.3, 7.5, 7.7, 7.17из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
2.Предложен перечень веществ: H2S, CO, KOH, K2O, Na2SO4, CuCl2, HI, S, PCl3, N2O5. Выпишите из него формулы веществ: а) с ионной связью; б) с ковалентной связью.
3. Составьте электронную формулу молекулы SO2. Покажите смещение электронной плотности. Укажите тип химической связи.
interneturok.ru
Ковалентная связь – полярная и неполярная: что это такое и какова формула вещества
Вещества молекулярного строения образуются с помощью особого вида взаимосвязи. Ковалентная связь в молекуле, полярная и неполярная, также называется атомной. Это название происходит от латинского «co» «совместно» и «vales» «имеющий силу». При таком способе образования соединений пара электронов делится между двумя атомами.
Свойства
Что такое ковалентная полярная и неполярная связь? Если новое соединение образуется таким образом, то происходит обобществление электронных пар. Обычно такие вещества имеют молекулярное строение: Н2, О3, HCl, HF, Ch5.
Есть и немолекулярные вещества, в которых атомы связаны таким образом. Это так называемые атомные кристаллы: алмаз, диоксид кремния, карбид кремния. В них каждая частица связана с четырьмя другими, в результате получается очень прочный кристалл. Кристаллы с молекулярной структурой обычно не отличаются высокой прочностью.
Свойства такого способа образования соединений:
- кратность,
- направленность,
- степень полярности,
- поляризуемость,
- сопряжение.
Кратность — это количество поделенных электронных пар. Их может быть от одной до трех. У кислорода до заполнения оболочки двух электронов не хватает, поэтому она будет двойной. У азота в молекуле N2 она тройная.
Это интересно! Как самостоятельно определить валентность по таблице Менделеева
Поляризуемость — возможность образования ковалентной полярной связи и неполярной. При этом она может быть более или менее полярна, ближе к ионной или наоборот — в этом заключается свойство степени полярности.
Направленность означает, что атомы стремятся соединиться таким образом, чтобы между ними осталась как можно большая электронная плотность. О направленности имеет смысл говорить тогда, когда соединяются p или d-орбитали. S-орбитали сферически симметричны, для них все направления равноценны. У p-орбиталей неполярная или полярная ковалентная связь направлена вдоль их оси, так что две «восьмерки» перекрываются вершинами. Это σ-связь. Существуют и менее прочные π-связи. В случае p-орбиталей «восьмерки» перекрываются боковыми сторонами вне оси молекулы. В двойном или тройном случае p-орбитали образуют одну σ-связь, а остальные будут типа π.
Сопряжение — это чередование простых и кратных, делающее молекулу более стабильной. Такое свойство характерно для сложных органических соединений.
 Виды и способы образования химических связей
Виды и способы образования химических связей
Полярность
Важно! Как определить, вещества с неполярной ковалентной или полярной связью перед нами? Это очень просто: первая всегда возникает между одинаковыми атомами, а вторая — между разными, имеющими неодинаковую электроотрицательность.
Примеры ковалентной неполярной связи — простые вещества:
- водород Н2,
- азот N2,
- кислород О2,
- хлор Cl2.
Схема образования ковалентной неполярной связи показывает, что с помощью объединения электронной пары атомы стремятся дополнить внешнюю оболочку до 8 или 2 электронов. Например, фтору не хватает одного электрона до восьмиэлектронной оболочки. После образования поделенной электронной пары она заполнится. Распространенная формула вещества с ковалентной неполярной связью — двухатомная молекула.

Полярно обычно связываются только элементы-неметаллы:
 Но бывают и исключения, такие как AlCl3. Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других — как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.
Но бывают и исключения, такие как AlCl3. Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других — как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.
В этом случае молекулу образуют разные элементы, но разница в электроотрицательности не так велика, чтобы электрон полностью перешел от одного атома к другому, как в веществах ионного строения.
Схемы образования ковалентной структуры этого типа показывают, что электронная плотность смещается к более электроотрицательному атому, то есть поделенная электронная пара находится к одному из них ближе, чем ко второму. Части молекулы приобретают заряд, который обозначается греческой буквой дельта. В хлороводороде, например, хлор становится заряжен более отрицательно, а водород — более положительно. Заряд будет частичный, а не целый, как у ионов.
Важно! Не следует путать полярность связи и полярность молекулы. В метане СН4, например, атомы связаны полярно, а сама молекула неполярна.
Полезное видео: полярная и неполярная ковалентная связь
Механизм образования
Образование новых веществ может проходить по обменному или донорно-акцепторному механизму. При этом объединяются атомные орбитали. Возникает одна или несколько молекулярных орбиталей. Они отличаются тем, что охватывают оба атома. Как и на атомной, на ней может находиться не более двух электронов, причем их спины тоже должны быть разнонаправленными.
Как определить, какой механизм задействован? Это можно сделать по числу электронов на внешних орбиталях.
Это интересно! Что такое алканы: строение и химические свойства
Обменный
В этом случае электронная пара на молекулярной орбитали образуется из двух неспаренных электронов, каждый из которых принадлежит своему атому. Каждый из них стремится заполнить свою внешнюю электронную оболочку, сделать ее устойчивой восьми- или двухэлектронной. Так обычно образуются вещества с неполярной структурой.
Для примера рассмотрим соляную кислоту HCl. У водорода на внешнем уровне один электрон. У хлора — семь. Нарисовав схемы образования ковалентной структуры для него, увидим, что для заполнения внешней оболочки каждому из них не хватает по одному электрону. Поделив между собой электронную пару, они смогут завершить внешнюю оболочку. По такому же принципу образуются и двухатомные молекулы простых веществ, например, водорода, кислорода, хлора, азота и других неметаллов.
 Механизм образования
Механизм образования
Донорно-акцепторный
Во втором случае оба электрона представляют собой неподеленную пару и принадлежат одному атому (донору). У другого (акцептора) есть свободная орбиталь.
Формула вещества с ковалентной полярной связью, образованной таким образом, например, ион аммония Nh5+. Он образуется из иона водорода, в котором есть свободная орбиталь, и аммиака Nh4, содержащего один «лишний» электрон. Электронная пара из аммиака обобществляется.
Гибридизация
Когда электронная пара обобществляется между орбиталями различной формы, например, s и р, образуется гибридное электронное облако sp. Такие орбитали сильнее перекрываются, поэтому связываются прочнее.
Это интересно! Уроки химии: что это такое галогены
Так устроены молекулы метана и аммиака. В молекуле метана СН4 должны были образоваться три связи по p-орбиталям и одна по s. Вместо этого орбиталь гибридизируется с тремя р-орбиталями, получаются три гибридные sp3-орбитали в форме вытянутых капель. Это происходит потому, что электроны 2s и 2p имеют близкую энергию, они взаимодействуют друг с другом при соединении с другим атомом. Тогда можно образовать гибридную орбиталь. Получившаяся молекула имеет форму тетраэдра, водород располагается в его вершинах.
Другие примеры веществ с гибридизацией:
- ацетилен,
- бензол,
- алмаз,
- вода.
Для углерода характерна spЗ-гибридизация, поэтому она часто встречается в органических соединениях.
Полезное видео: ковалентная полярная связь
Вывод
Ковалентная связь, полярная или неполярная, характерна для веществ молекулярного строения. Неполярно связаны атомы одного элемента, а полярно — разных, но с ненамного отличающейся электроотрицательностью. Обычно таким образом соединяются элементы-неметаллы, но бывают и исключения, такие как алюминий.
tvercult.ru
Образование ковалентной связи — урок. Химия, 8–9 класс.
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Рассмотрим возникновение ковалентной связи в простых веществах.
1. Образование молекулы водорода.
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней, и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.

Ковалентная связь за счёт образования одной общей электронной пары называется одинарной.
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода — один неспаренный электрон. Для других элементов их число равно 8 – № группы.
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два.
У неметаллов VА группы (азот, фосфор) — три неспаренных электрона.
2. Образование молекулы фтора.
Атом фтора на внешнем уровне имеет семь электронов. Шесть из них образуют пары, а седьмой неспаренный.
При соединении атомов образуется одна общая электронная пара, то есть возникает одна ковалентная связь. Каждый атом получает завершённый восьмиэлектронный внешний слой. Связь в молекуле фтора тоже одинарная. Такие же одинарные связи существуют в молекулах хлора, брома и иода.

Если атомы имеют несколько неспаренных электронов, то образуются две или три общие пары.
3. Образование молекулы кислорода.
У атома кислорода на внешнем уровне — два неспаренных электрона.
При взаимодействии двух атомов кислорода возникают две общие электронные пары. Каждый атом заполняет свой внешний уровень до восьми электронов. Связь в молекуле кислорода двойная.

4. Образование молекулы азота.
Атом азота имеет три неспаренных электрона на внешнем уровне.
В молекуле образуются три общие электронные пары. Связь в молекуле азота тройная.
Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную:
H−H,F−F,Cl−Cl;
O=O,N≡N.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 66 с.
www.yaklass.ru