Определение массовой доли выхода продукта реакции от теоретически возможного
На практике масса продуктов реакции(mпракт.) почти всегда бывает меньше, чем масса тех же продуктов, которая рассчитана теоретически. Это может происходить из-за того, что исходные вещества полностью не вступают в реакцию, из-за потерь в ходе проведения реакции, из-за побочных процессов и т. д. Поэтому часто вычисляют долю выхода продукта реакции или просто выход продукта реакции (η ).
Массовую долю выхода рассчитывают по формуле:
Выход продукта реакции можно рассчитать, используя объем или количество вещества продукта, реально образовавшийся относительно теоретически вычисленного по уравнению химической реакции, по формулам:
Задачи для самостоятельного решения по темам
Галогены
1. Хлорид железа (ІІІ) используемый для травленния медных печатных плат, получают окислением хлорида железа (II) хлором.
Элементы VІ-А группы
2. Кисень, який отримали розкладанням 15,38 г бертолетової солі, використали для спалювання сірки. Об’єм одержаного сульфур(ІV) оксиду дорівнював 3,39 л (н.у.). Визначте: а) практичний вихід кисню при розкладанні бертолетової солі; б) кількість речовини сірки, яку спалили в одержаному кисні. (92 %, 0,17 моль)
3. Кислород, который получили разложением 15,38 г бертолетовой соли, использовали для сжигания серы. Объем полученного оксида серы(IV) равен 3,39 л (н.у.). Определите: а) практический выход кислорода при разложении бертолетовой соли; б) количество вещества серы, которую сожгли в полученном кислороде.(78,125 %)
Элементы V-А группы
4. Определите массовую долю выхода аммиака (в %) от теоретически возможного, если при прохождении через колонну синтеза азота массой 2,32∙10 3 кг получили аммиак массой 2,58∙103 кг. (91,6 %).
(91,6 %).
5. Из аммиака массой 1000 кг получили раствор азотной кислоты массой 4611,76 кг с массовой долей растворенного вещества 70 %. Чему равна массовая доля выхода азотной кислоты от теоретически возможного? (87,1 %)
6. Какую массу раствора ортофосфорной кислоты с массовой долей растворенного вещества 65 % можно получить из ортофосфата кальция массой 10 т, если массовая доля практического выхода составляет 92 %?(8,95 т)
7. Какая масса фосфорита необходима для производства 5 т фосфора, если массовая доля выхода продукта реакции составляет 96 % от теоретически возможного?(26 т)
8. Для производства сульфата аммония массой 1000 кг был использован раствор серной кислоты массой 980 кг с массовой долей кислоты 78 % и аммиак массой 270 кг. Определите массовую долю выхода продукта реакции от теоретически возможного (в %).(97,1 %)
9. Какую массу азотной кислоты можно получить из 20,2 г нитрата калия при воздействии на него избытком серной кислоты, если массовая доля практического выхода азотной кислоты составляет 0,98? (12,348 г)
10. Вычислите объем азота (н.у.), который можно получить разложением 6,4 г нитрита аммония, если объемная доля практического выхода азота составляет 89%. (2 л)
Вычислите объем азота (н.у.), который можно получить разложением 6,4 г нитрита аммония, если объемная доля практического выхода азота составляет 89%. (2 л)
11. Рассчитайте объем оксида азота(II), который можно получить при каталитическом окислении 5,6 л аммиака, если объемная доля практического выхода оксида азота(II) равна 90 %. (5,04 л)
12. Какую массу меди взяли для реакции с избытком концентрированной азотной кислоты, если получили 2,1 л (н.у.) оксида азота (IV). Объемная доля практического выхода оксида азота(IV) равна 94 %. (3,19 г)
Элементы IV-А группы
13. В результате действия 14 г соляной кислоты на 16,8 г карбоната магния добыли 4 л оксида углерода(IV). Определите объемную долю выхода продукта от теоретически возможного. (93,28 %)
Щелочноземельные элементы
14. При сильном нагревании гипса (СаSО4∙2Н2О) кальций сульфат, входящий в его состав, разлагается на оксид кальция и оксид серы(VI). Рассчитайте массу гипса, необходимого для получения оксида серы(VI) массой 16 т, если выход продукта реакции составляет 95 % от теоретически возможного. (36,32 т)
(36,32 т)
15.Барий получают восстановлением из его оксида алюминием. Рассчитайте массовую долю практического выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг этого металла.(92,46 %)
Алюминий
16. Какую массу алюминия можно получить из боксита массой 10 т, массовая доля оксида алюминия в котором равна 95%, если массовая доля выхода алюминия составляет 98 % от теоретически возможного.(4,93 т)
17. Хлорид алюминия, используемый в качестве катализатора, получают прямым действием хлора на алюминий. Какой объем хлора (н.у.) прореагирует с алюминием массой 5,4 кг и какая масса соли образуется, если массовая доля выхода продукта составляет 98% от теоретически возможного? (6,72 м
Железо
18. При восстановлении 9,84 г оксида железа(ІІІ) оксидом углерода(II) получили 5,73 г железа. Рассчитайте: а) практический выход железа б) объем полученного при этом углекислого газа (н.у.). (83 %, 4,13 л),
19. Из каждой тонны железной руды, содержащей 80 % магнитного железняка. выплавляют 570 кг чугуна, который содержит 95% железа. Определите массовую долю выхода железа (в%) от теоретически возможного.(93,47 %)
выплавляют 570 кг чугуна, который содержит 95% железа. Определите массовую долю выхода железа (в%) от теоретически возможного.(93,47 %)
Как обозначается объемная доля в химии. Неорганическая химия. Понятие массовой доли в растворе
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
m 1 — масса растворённого вещества, г;
m — общая масса раствора, г.
Массовое процентное содержание компонента, m%
m % =(m i /Σm i)*100
В
бинарных растворах часто существует
однозначная (функциональная)
зависимость между плотностью раствора
и его концентрацией (при данной
температуре). Это даёт возможность
определять на практике концентрации
важных растворов с
помощью денсиметра (спиртометра, сахариметра, лактометра).
Некоторые ареометры проградуированы
не в значениях плотности, а непосредственно
концентрации раствора (спирта, жира в
молоке, сахара). Следует учитывать, что
для некоторых веществ кривая плотности
раствора имеет максимум, в этом случае
проводят 2 измерения: непосредственное,
и при небольшом разбавлении раствора.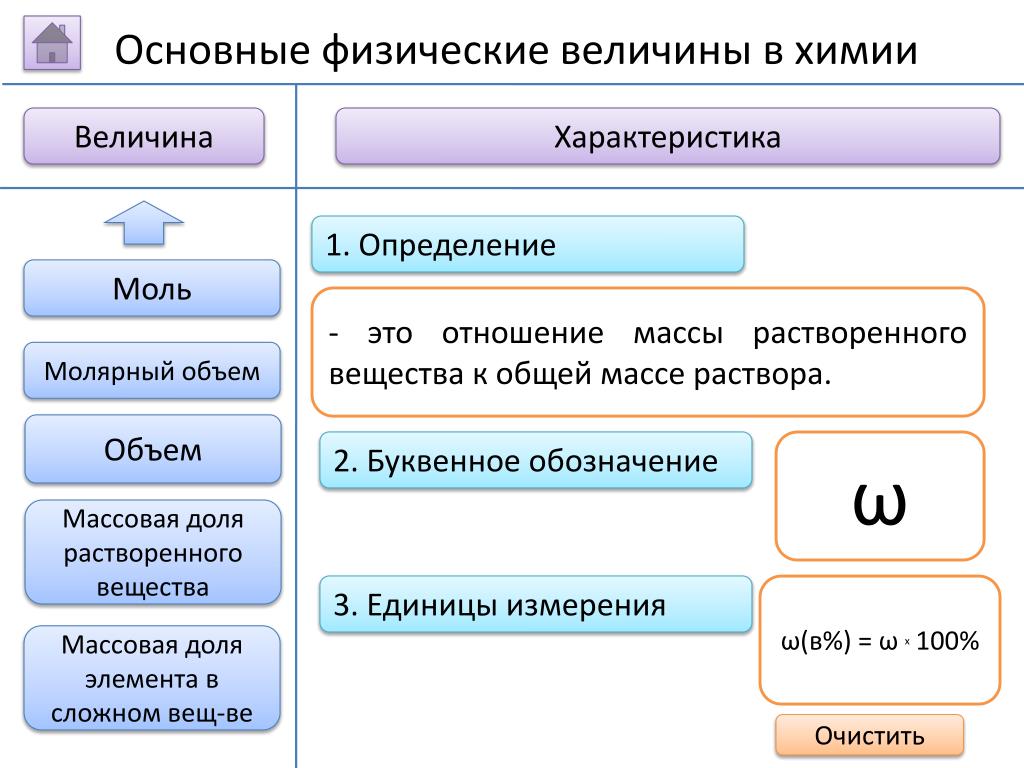
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры(денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
V 1 — объём растворённого вещества, л;
V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)
Молярная
концентрация — количество растворённого
вещества (число молей) в единице объёма
раствора. Молярная концентрация в системе
СИ измеряется
в моль/м³, однако на практике её гораздо
чаще выражают в моль/л или ммоль/л. Также
распространено выражение в «молярности».
Возможно другое обозначение молярной
концентрации C M ,
которое принято обозначать М. Так,
раствор с концентрацией 0,5 моль/л называют
0,5-молярным. Примечание: единица «моль»
не склоняется по падежам. После цифры
пишут «моль», подобно тому, как после
цифры пишут «см», «кг» и т. д.
Молярная концентрация в системе
СИ измеряется
в моль/м³, однако на практике её гораздо
чаще выражают в моль/л или ммоль/л. Также
распространено выражение в «молярности».
Возможно другое обозначение молярной
концентрации C M ,
которое принято обозначать М. Так,
раствор с концентрацией 0,5 моль/л называют
0,5-молярным. Примечание: единица «моль»
не склоняется по падежам. После цифры
пишут «моль», подобно тому, как после
цифры пишут «см», «кг» и т. д.
V — общий объём раствора, л.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н » или «N ». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н .
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число
эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H 2 SO 4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата KHSO 4 , и двухнормальным в реакции с образованием K 2 SO 4 .
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
(окончание)
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Объемную долю газа в смеси обозначают греческой буквой – «фи».
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси:
Что же показывает объемная доля газа в смеси
или, как говорят, какой физический смысл этой
величины? Объемная доля газа показывает, какую
часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рис. 62).
Рис. 62.Состав атмосферного воздуха |
Рассчитаем объемные доли этих газов в воздухе:
Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
(азота) + (кисл.) + (угл. газа) + (др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится
сталкиваться с обратной задачей: определять
объем газа в смеси по известной объемной доле.
Пример . Вычислите объем кислорода, содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси выразим объем кислорода:
V (кисл.) = V (возд.) (кисл.).
Подставим в уравнение числа и рассчитаем объем кислорода:
V (кисл.) = 500 (л) 0,21 = 105 л.
Кстати, для приближенных расчетов объемную долю кислорода в воздухе можно принять равной 0,2, или 20%.
При расчете объемных долей газов в смеси можно воспользоваться маленькой хитростью. Зная, что сумма объемных долей равна 100%, для «последнего» газа в смеси эту величину можно рассчитать по-другому.
Задача. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
V (смеси) = 50 мл,
V (угл. газа) = 48,5 мл,
V (азота) = 1,5 мл.
Найти:
(угл. газа),
газа),
Решение
Рассчитаем объемную долю углекислого газа в смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:
(угл. газа) + (азота) = 100%,
(азота) = 100% – (угл. газа) = 100% – 97% = 3%.
Ответ. (угл. газа) = 97%, (азота) = 3%.
С помощью какой величины измеряют содержание компонентов в смесях другого типа, например в растворах? Понятно, что в этом случае пользоваться объемной долей неудобно. На помощь приходит новая величина, о которой вы узнаете на следующем уроке.
1. Что такое объемная доля компонента в газовой смеси?
2. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
3. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
4. Объемная доля метана в природном газе составляет 92%.
Какой объем этой газовой смеси будет содержать 4,6 мл метана?
5. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее глазами химика. Вряд ли вам понравится такой «чай в гостях». Уж очень сладкий он будет из-за неумеренного содержания сахара! Содержание растворенного вещества в растворе химики называют концентрацией.
Концентрацию вещества можно выражать различными способами. Кстати, число ложечек на чашку воды – способ вполне приемлемый, но только для кухни. Трудно представить себе химика, приготавливающего раствор таким образом.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Массовой долей вещества в растворе называют отношение массы растворенного вещества к массе раствора:
Не правда ли, очень похоже на объемную долю? Так
оно и есть, ведь любая доля, как вы уже знаете, –
это отношение какой-то части к целому. Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е. верно выражение:
m (раствора) = m (растворителя) + m (растворенного вещества).
Предположим, массовая доля растворенного
вещества равна 0,1, или 10%. Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. В качестве иллюстрации к сказанному рассмотрим решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена томатов дезинфицируют (протравливают) 1%-м раствором марганцовки. Какую массу такого раствора можно приготовить из 0,25 г марганцовки?
(марганцовки) = 0,01 г,
m (марганцовки) = 0,25 г.
Найти:
m (раствора).
Решение
Зная массу растворенного вещества и его массовую долю в растворе, можно вычислить массу раствора:
Ответ . m (раствора) = 25 г.
Задача 2. В медицине широко применяют
так называемые физиологические растворы, в
частности раствор поваренной соли с массовой
долей соли 0,9%. Рассчитайте массы соли и воды,
необходимые для приготовления 1500 г
физиологического раствора.
(соли) = 0,009,
m (раствора) = 1500 г.
Найти:
m (соли),
m (воды).
Решение
Вычислим массу соли, необходимой для приготовления 1500 г физиологического раствора:
m (соли) = m (раствора) (соли) = 1500 (г) 0,009 = 13,5 г.
Определим массу воды, необходимой для приготовления раствора:
m (воды) = m (раствора) – m (соли) = 1500 – 13,5 = 1486,5 г.
Ответ . m (соли) = 13,5 г, m (воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к этому параграфу) вам будет нетрудно убедиться в том, что раствор замерзает при более низкой температуре, чем чистый растворитель. Например, морская вода начинает замерзать при температуре –1,9 °С, в то время как чистая вода кристаллизуется при 0 °С.
Что такое массовая доля растворенного вещества? Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
2. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки?
3. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе.
4. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе.
5. Найдите массу воды и лимонной кислоты, необходимую для приготовления 50 г 5%-го раствора.
6. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе.
7. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю вещества в полученном растворе.
8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
9. Пять чайных ложек поваренной соли (с горкой)
растворите в 450 г (450 мл) воды. Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой долей
растворенного вещества
Цель данной работы состоит в приготовлении раствора с заданной массовой долей путем растворения рассчитанной массы твердого вещества в определенном объеме воды.
Рассчитайте массу твердого вещества, необходимого для приготовления раствора в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твердого вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической работе № 3
Рассчитайте массу воды, необходимой
для приготовления раствора. Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы убедились, что присутствие посторонних соединений изменяет свойства вещества. В некоторых областях техники использование недостаточно «чистых» материалов недопустимо. Микросхему компьютера не сделать без особо чистого кристалла кремния, в атомной энергетике предъявляются повышенные требования к очистке ядерного топлива, световой сигнал «погаснет» в стекловолоконном кабеле, наткнувшись на посторонние вкрапления.
Если главное (основное) вещество содержит
посторонние загрязнения – это тоже смесь, только
в этом случае все ненужные, а порой и вредные ее
компоненты называют одним словом – примеси. Чем
меньше примесей, тем чище вещество.
Чем
меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют техническим образцом или просто образцом. Следовательно, любой такой образец включает основное вещество и примеси.
Степень чистоты вещества принято выражать массовой долей основного компонента или массовой долей примесей.
С массовыми долями разного типа вы уже знакомы. Попробуйте теперь сами сформулировать определение, что такое массовая доля примесей в веществе. Получилось? Сравните.
Массовой долей примесей называется отношение массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю основного вещества в образце. Тогда можно воспользоваться формулой:
Следует не забывать, что сумма массовых долей основного вещества и примесей всегда равна 1, или 100%:
(осн. в-ва) + (примесей) = 1, или 100%.
Также справедливо утверждение, что масса образца складывается из массы основного вещества и массы примесей:
m (образца) = m (осн. в-ва) + m (примесей).
в-ва) + m (примесей).
Разберем несколько задач с использованием понятия «массовая доля примесей».
Задача 1. Природная самородная сера содержит 8% примесей. Какая масса чистой серы содержится в 2 т природного образца?
(примесей) = 0,08,
m (образца) = 2 т.
Найти:
m (серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m (примесей) = m (образца) (примесей) = 2 (т) 0,08 = 0,16 т.
Рассчитаем массу чистой серы, содержащейся в природном образце:
m (серы) = m (образца) – m (примесей) = 2 (т) – 0,16 (т) = 1,84 т.
Ответ . m (серы) = 1,84 т.
Задача 2. В пищевой отрасли
промышленности можно использовать лимонную
кислоту, содержащую не более 1% посторонних
примесей. В аналитической лаборатории
установлено, что в 2,345 г продукта содержится 2,312 г
кислоты. Можно ли использовать продукт в пищевых
целях?
Можно ли использовать продукт в пищевых
целях?
m (образца) = 2,345 г,
m (кислоты) = 2,312 г.
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в образце:
Рассчитаем массовую долю примесей в образце:
(примесей) = 1 – (кислоты) = 1 – 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не может быть использован в пищевой отрасли промышленности.
1. Что называется массовой долей примесей? Что показывает эта величина?
2. В промышленности используются вещества с маркировкой «ч», что означает «чистое вещество». Содержание примесей в них может составлять, например, 0,01%. Найдите максимально допустимую массу примесей в 120 г образца сажи с маркировкой «ч».
3. Массовая доля примесей в известняке составляет 5%. Рассчитайте массу основного вещества (карбоната кальция), содержащегося в 300 кг природного известняка.
4. При очистке медного купороса получилось 150 мг примесей, что составило 2% от массы образца. Определите массу технического медного купороса, который подвергли очистке.
5. Для изготовления полупроводниковых батарей используется сверхчистый кремний. Массовая доля примесей в нем не должна превышать 0,000 000 0001%. Годится ли для данных целей кремний, в 30 кг которого содержится 0,03 мг примесей?
В статье рассматривается такое понятие, как массовая доля. Приводятся способы ее вычисления. Также описаны определения сходных по звучанию, но отличных по физическому смыслу величин. Это массовые доли для элемента и выхода.
Колыбель жизни — раствор
Вода — источник жизни на нашей прекрасной голубой планете. Это выражение можно встретить довольно часто. Однако мало кто, кроме специалистов, задумывается: на самом деле субстратом для развития первых биологических систем стал раствор веществ, а не химически чистая вода. Наверняка в популярной литературе или передаче читатель встречал выражение «первичный бульон».
Наверняка в популярной литературе или передаче читатель встречал выражение «первичный бульон».
Об источниках, давших толчок развитию жизни в виде сложных органических молекул, до сих пор спорят. Некоторые даже предполагают не просто естественное и весьма удачное стечение обстоятельств, а космическое вмешательство. Причем речь идет вовсе не о мифических пришельцах, а о специфических условиях для создания этих молекул, которые могут существовать только на поверхности малых космических тел, лишенных атмосферы, — кометах и астероидах. Таким образом, было бы правильнее говорить, что раствор органических молекул — колыбель всего живого.
Вода как химически чистое вещество
Несмотря на огромные соленые океаны и моря, пресные озера и реки, в химически чистом виде вода встречается крайне редко, в основном в специальных лабораториях. Напомним, в отечественной научной традиции химически чистое вещество — это субстанция, которая содержит не более десяти в минус шестой степени массовой доли примесей.
Получение абсолютно свободной от посторонних компонентов массы требует невероятных затрат и редко себя оправдывает. Применяется только в отдельных производствах, где даже один посторонний атом может испортить эксперимент. Отметим, что полупроводниковые элементы, которые составляют основу сегодняшней миниатюрной техники (в том числе смартфоны и планшеты), к примесям очень чувствительны. В их создании как раз и нужны совершенно незагрязненные растворители. Однако по сравнению со всей жидкостью планеты это ничтожно мало. Как же так получается, что распространенная, пронизывающая нашу планету насквозь вода так редко встречается в чистом виде? Объясним чуть ниже.
Идеальный растворитель
Ответ на поставленный в предыдущем разделе вопрос невероятно прост. Вода имеет полярные молекулы. Это значит, что в каждой мельчайше частице этой жидкости положительный и отрицательный полюсы не намного, но разнесены. При этом структуры, возникающие даже в жидкой воде, создают дополнительные (так называемые водородные) связи.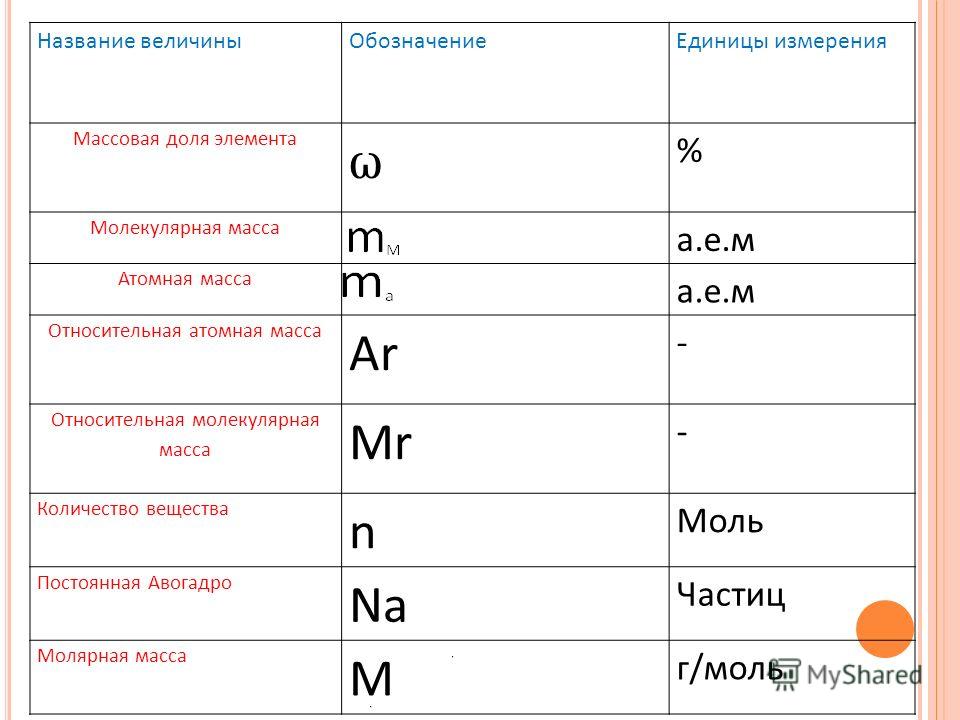 И в общей сложности это дает следующий результат. Попадающее в воду вещество (не важно, какой заряд оно имеет) растаскивается молекулами жидкости. Каждая частичка растворенной примеси обволакивается либо отрицательными, либо положительными сторонами молекул воды. Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
И в общей сложности это дает следующий результат. Попадающее в воду вещество (не важно, какой заряд оно имеет) растаскивается молекулами жидкости. Каждая частичка растворенной примеси обволакивается либо отрицательными, либо положительными сторонами молекул воды. Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
Понятие массовой доли в растворе
Получающийся раствор содержит некоторую часть примеси, имеющей название «массовая доля». Хотя такое выражение встречается не часто. Обычно используется другой термин — «концентрация». Массовая доля определяется конкретным соотношением. Формульное выражение приводить не будем, оно достаточно простое, объясним лучше физический смысл. Это соотношение двух масс — примеси к раствору. Массовая доля — величина безразмерная. Выражается по-разному в зависимости от конкретных задач. То есть в долях единицы, если в формуле есть только соотношение масс, и в процентах — если результат умножается на 100%.
Растворимость
Помимо Н 2 О применяются и другие растворители. Кроме того, есть вещества, которые принципиально не отдают свои молекулы воде. Зато с легкостью растворяются в бензине или горячей серной кислоте.
Существуют специальные таблицы, которые показывают, сколько того или иного материала останется в жидкости. Этот показатель называется растворимостью, и он зависит от температуры. Чем она выше, тем активнее двигаются атомы или молекулы растворителя, и тем больше примеси он способен поглотить.
Варианты определения доли растворенного вещества в растворе
Так как задачи у химиков и технологов, а также инженеров и физиков могут быть разными, часть растворенного вещества в воде определяется по-разному. Объемная доля вычисляется как объем примеси к общему объему раствора. Используется другой параметр, однако принцип остается тем же.
Объемная доля сохраняет безразмерность, выражаясь либо в долях единицы, либо в процентах. Молярность (по-другому еще называется «молярная объемная концентрация») — это число молей растворенного вещества в заданном объеме раствора. В этом определении участвуют уже два различных параметра одной системы, и размерность у данной величины другая. Она выражается в молях на литр. На всякий случай напомним, что моль — это количество вещества, содержащего примерно десять в двадцать третьей степени молекул или атомов.
В этом определении участвуют уже два различных параметра одной системы, и размерность у данной величины другая. Она выражается в молях на литр. На всякий случай напомним, что моль — это количество вещества, содержащего примерно десять в двадцать третьей степени молекул или атомов.
Понятие массовой доли элемента
Эта величина имеет лишь косвенное отношение к растворам. Массовая доля элемента отличается от рассмотренного выше понятия. Любое сложное химическое соединение состоит из двух или более элементов. Каждый обладает своей относительной массой. Эту величину можно найти в химической системе Менделеева. Там она указана в нецелых числах, но для приблизительных задач значение можно округлить. В состав сложного вещества входит определенное количество атомов каждого вида. Например, в воде (Н 2 О) два атома водорода и один кислорода. Соотношение между относительной массой всего вещества и данного элемента в процентах и будет составлять массовую долю элемента.
Для неискушенного читателя эти два понятия могут показаться близкими. И достаточно часто их путают между собой. Массовая доля выхода относится не к растворам, а к реакциям. Любой химический процесс всегда протекает с получением конкретных продуктов. Их выход рассчитывается по формулам в зависимости от реагирующих веществ и условий процесса. В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
И достаточно часто их путают между собой. Массовая доля выхода относится не к растворам, а к реакциям. Любой химический процесс всегда протекает с получением конкретных продуктов. Их выход рассчитывается по формулам в зависимости от реагирующих веществ и условий процесса. В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
Таким образом, всегда найдутся наиболее «холодные» частицы, которые не смогут вступить в реакцию и останутся в первоначальном состоянии. Физический смысл массовой доли выхода состоит в том, какой процент составляет реально полученное вещество от теоретически рассчитанного. Формула невероятно проста. Масса практически полученного продукта делится на массу практически рассчитанного, все выражение умножается на сто процентов. Массовая доля выхода определяется по количеству молей реагирующего вещества. Не стоит забывать об этом. Дело в том, что один моль вещества — определенное количество его атомов или молекул. По закону сохранения вещества из двадцати молекул воды не может получиться тридцать молекул серной кислоты, поэтому задачи вычисляются именно так. Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Массовая доля выхода определяется по количеству молей реагирующего вещества. Не стоит забывать об этом. Дело в том, что один моль вещества — определенное количество его атомов или молекул. По закону сохранения вещества из двадцати молекул воды не может получиться тридцать молекул серной кислоты, поэтому задачи вычисляются именно так. Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Объёмная доля (также объёмная часть , доля по объёму , объёмная концентрация ) — безразмерная величина, равная отношению объёма какого-то вещества в смеси к объёму всей смеси.
Обозначается греческой буквой φ .
Применяется в основном к газам и жидкостям.
Смысл величины
Объёмная доля вычисляется по формуле:
\phi=\frac{V_1}{V},
- V 1 — объём растворённого вещества в единицах объёма;
- V — общий объём раствора в тех же единицах.

Объёмная доля в химии
В химии величина используется в основном для газов, потому что объемная доля газовой смеси при н.у. равна его молярной концентрации.
Принято выражать объёмную долю в процентах.
См. также
Напишите отзыв о статье «Объёмная доля»
Ссылки
Отрывок, характеризующий Объёмная доля
Валуев конфиденциально рассказывал, что Уваров был прислан из Петербурга, для того чтобы узнать мнение москвичей об Аустерлице.В третьем кружке Нарышкин говорил о заседании австрийского военного совета, в котором Суворов закричал петухом в ответ на глупость австрийских генералов. Шиншин, стоявший тут же, хотел пошутить, сказав, что Кутузов, видно, и этому нетрудному искусству – кричать по петушиному – не мог выучиться у Суворова; но старички строго посмотрели на шутника, давая ему тем чувствовать, что здесь и в нынешний день так неприлично было говорить про Кутузова.
Граф Илья Андреич Ростов, озабоченно, торопливо похаживал в своих мягких сапогах из столовой в гостиную, поспешно и совершенно одинаково здороваясь с важными и неважными лицами, которых он всех знал, и изредка отыскивая глазами своего стройного молодца сына, радостно останавливал на нем свой взгляд и подмигивал ему.
 Молодой Ростов стоял у окна с Долоховым, с которым он недавно познакомился, и знакомством которого он дорожил. Старый граф подошел к ним и пожал руку Долохову.
Молодой Ростов стоял у окна с Долоховым, с которым он недавно познакомился, и знакомством которого он дорожил. Старый граф подошел к ним и пожал руку Долохову.В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Объемную долю газа в смеси обозначают греческой буквой – «фи».
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси:
Что же показывает объемная доля газа в смеси или, как говорят, какой физический смысл этой величины? Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рис.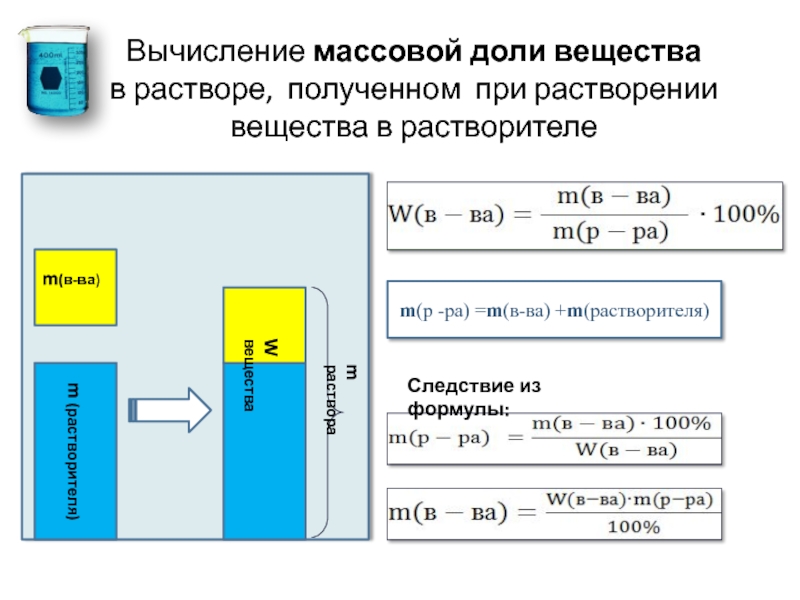 62).
62).
| Рис. 62. Состав атмосферного воздуха |
Рассчитаем объемные доли этих газов в воздухе:
Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
(азота) + (кисл.) + (угл. газа) + (др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Пример . Вычислите объем кислорода, содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси выразим объем кислорода:
V (кисл.) = V (возд.) (кисл.).
Подставим в уравнение числа и рассчитаем объем кислорода:
V (кисл. ) = 500 (л) 0,21 = 105 л.
) = 500 (л) 0,21 = 105 л.
Кстати, для приближенных расчетов объемную долю кислорода в воздухе можно принять равной 0,2, или 20%.
При расчете объемных долей газов в смеси можно воспользоваться маленькой хитростью. Зная, что сумма объемных долей равна 100%, для «последнего» газа в смеси эту величину можно рассчитать по-другому.
Задача. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
Дано:
V (смеси) = 50 мл,
V (угл. газа) = 48,5 мл,
V (азота) = 1,5 мл.
Найти:
(угл. газа),
Решение
Рассчитаем объемную долю углекислого газа в смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:
(угл. газа) + (азота) = 100%,
(азота) = 100% – (угл. газа) = 100% – 97% = 3%.
Ответ. (угл. газа) = 97%, (азота) = 3%.
С помощью какой величины измеряют содержание компонентов в смесях другого типа, например в растворах? Понятно, что в этом случае пользоваться объемной долей неудобно. На помощь приходит новая величина, о которой вы узнаете на следующем уроке.
1. Что такое объемная доля компонента в газовой смеси?
2. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
3. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
4. Объемная доля метана в природном газе составляет 92%. Какой объем этой газовой смеси будет содержать 4,6 мл метана?
5. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
Товары бытовой химии. Метод определения нерастворимого в воде остатка (абразива) – РТС-тендер
ГОСТ Р 51020-97
Группа У29
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОКС 71. 040.40*
040.40*
ОКСТУ 2309
_________________
* В указателе «Национальные стандарты» 2006 г.
ОКС 71.100.40. — Примечание «КОДЕКС».
Дата введения 1998-01-01
Предисловие
1 РАЗРАБОТАН И ВНЕСЕН Техническим комитетом ТК 354 «Бытовая химия»
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 января 1997 г. N 25
3 ВВЕДЕН ВПЕРВЫЕ
Настоящий стандарт распространяется на товары бытовой химии (чистящие средства) и устанавливает метод определения массовой доли нерастворимого в воде остатка (абразива) от 15,0 до 85,0% включительно.
Метод основан на термогравиметрическом определении нерастворимого в воде остатка (абразива), выделенного фильтрованием из водного раствора средства.
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 24104-88 Весы лабораторные общего назначения и образцовые. Общие технические условия*
________________
* На территории Российской Федерации действует ГОСТ 24104-2001, здесь и далее по тексту. — Примечание «КОДЕКС».
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27025-86 Реактивы. Общие указания по проведению испытаний
Общие указания по проведению испытаний
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
Весы лабораторные общего назначения 2-го класса точности по ГОСТ 24104 с наибольшим пределом взвешивания 200 г.
Термометр жидкостный стеклянный с диапазоном измерения температуры от 0 до 200 °С и ценой деления шкалы 2 °С по ГОСТ 28498.
Шкаф сушильный электрический, обеспечивающий поддержание температуры 100-105 °С.
Электроплитка по ГОСТ 14919.
Часы.
Цилиндр 1-250-2 по ГОСТ 1770.
Стаканчик СВ-34/12 по ГОСТ 25336.
Эксикатор 2-140 по ГОСТ 25336 с вставкой 2-128 по ГОСТ 9147.
Стакан Н-1-250 по ГОСТ 25336.
Воронка В-75-110 ТХС по ГОСТ 25336.
Воронка Бюхнера 2 по ГОСТ 9147.
Колба 1-500 по ГОСТ 25336.
Насос водоструйный по ГОСТ 25336.
Ступка 5 с пестиком 3 по ГОСТ 9147.
Кальций хлорид обезвоженный по нормативному документу [1] (приложение А), прокаленный при температуре 250-300 °С.
Спирт этиловый ректификованный технический по ГОСТ 18300 и его раствор в соотношении 1:1 (по объему).
Фенолфталеин (индикатор) по нормативному документу [2], спиртовой раствор с массовой долей 1%, приготовленный по ГОСТ 4919.1.
Фильтр обеззоленный по нормативному документу [3] (цвет ленты должен быть указан в нормативном документе на анализируемое средство).
Бумага универсальная индикаторная по нормативному документу [4].
Вода дистиллированная по ГОСТ 6709 или вода эквивалентной чистоты.
Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных.
Общие указания по проведению анализа — по ГОСТ 27025.
5.1 Отбор пробы
Отбор пробы — по нормативному документу на анализируемое средство.
Представительную пробу тщательно перемешивают.
5.2. Подготовка пробы к анализу
5.2.1 Для порошкообразных средств часть представительной пробы растирают в ступке до исчезновения гранул и комочков.
0,8000-1,3000 г средства взвешивают в стакане.
5.2.2 Средства, не содержащие мыло
К навеске приливают 70-80 см дистиллированной воды, нагретой до 70-80 °С, тщательно перемешивают и дают отстояться.
5.2.3 Средства, содержащие мыло
К навеске приливают 50 см раствора спирта, нагретого до 70 °С, тщательно перемешивают и дают отстояться.
Раствор средства, приготовленный по 5.2.2 или 5.2.3 настоящего стандарта, фильтруют на лабораторной воронке методом декантации через обеззоленный фильтр, предварительно доведенный до постоянной массы при температуре 100-105 °С.
Для средств, не содержащих мыло, осадок в стакане 3-4 раза промывают дистиллированной водой комнатной температуры порциями по 30-40 см и фильтруют.
Для средств, содержащих мыло, осадок промывают горячим раствором спирта объемом 25-30 см и фильтруют.
Затем осадок количественно переносят на фильтр и продолжают промывать дистиллированной водой до нейтральной реакции промывных вод по универсальной индикаторной бумаге (для средств, не содержащих мыло) или по фенолфталеину (для средств, содержащих мыло).
При использовании в средстве шлаков или шламов бората кальция промывание ведут до общего объема промывных вод 250 см.
При использовании в средстве плохо фильтрующихся мелких абразивов допускается проводить фильтрование под вакуумом, используя водоструйный насос, колбу с тубусом и воронку Бюхнера.
В этом случае промывание ведут до нейтральной реакции промывных вод по универсальной индикаторной бумаге.
Фильтр с осадком помещают в предварительно доведенный до постоянной массы при температуре 100-105 °С стаканчик и высушивают в сушильном шкафу при той же температуре до постоянной массы, охлаждают в эксикаторе над прокаленным хлоридом кальция и взвешивают. Первое взвешивание проводят через 2 ч, последующие — через 30 мин высушивания.
Массовую долю нерастворимого в воде остатка (абразива) , %, вычисляют по формуле
, (1)
где — масса остатка на фильтре, г;
— масса навески средства, г.
Результаты определений округляют до первого десятичного знака.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемые расхождения, указанные в таблице 1.
Таблица 1
В процентах
Массовая доля нерастворимого в воде остатка (абразива) | Допускаемая абсолютная суммарная погрешность результата анализа | Допускаемое абсолютное расхождение между результатами двух параллельных определений |
От 1,5 до 40,0 включ. | ±0,3 | 0,5 |
Св. 40,0 » 85,0 « | ±0,4 | 0,7 |
Допускаемая абсолютная суммарная погрешность результата анализа при доверительной вероятности =0,95 указана в таблице 1.
ПРИЛОЖЕНИЕ А
(информационное)
[1] ТУ 6-09-4711-81 Кальций хлорид обезвоженный (кальций хлористый) ч.
[2] ТУ 6-09-5360-88 Фенолфталеин, индикатор
[3] ТУ 6-09-1678-86 Фильтры обеззоленные (белая, красная, синяя лента)
[4] ТУ 6-09-1181-89 Бумага индикаторная универсальная для определения рН 1-10 и рН 7-14
Текст документа сверен по:
официальное издание
М. : ИПК Издательство стандартов, 1997
: ИПК Издательство стандартов, 1997
Вычисление молярной массы • Другие конвертеры • Компактный калькулятор • Онлайн-конвертеры единиц измерения
Конвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Можно ввести в него формулу уксусной кислоты и проверить что получится.
Автор статьи: Anatoly Zolotkov
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Урок 5. закон постоянства состава веществ. химические формулы. относительная атомная и молекулярная массы. массовая доля химического элемента в соединении — Химия — 8 класс
Закон постоянства состава. Относительная атомная и молекулярная массы. Массовая доля элемента
Атомы, как и молекулы обладают своей массой и размером. Массы атомов очень малы и определить ее путём точных измерений очень трудно, а в XVIII веке было невозможно. Большая заслуга в измерении атомных масс химических элементов принадлежит Джону Дальтону и Йенсу Якобу Берцелиусу, которые первыми попытались определить относительную атомную массу химических элементов.
В настоящее время для измерения массы атомов в качестве эталона принята масса одной двенадцатой части массы атома углерода. Массы атомов измеряют в атомных единицах массы. Такую массу называют относительной атомной массой, её условное обозначение взято от двух английских слов: A – atoms, r – relative (Ar). Значения относительных атомных масс можно узнать по периодической системе химических элементов: Ar (O) = 16. Эта запись означает, что относительная атомная масса кислорода равна 16. При вычислениях обычно используют округлённые значения. Относительную атомную массу хлора округлять до целого числа не принято: Ar (Cl) = 35,5.
Для того чтобы узнать массу молекулы необходимо знать ее состав. Вопрос определения качественного и количественного состава вещества являлся очень важным для дальнейшего развития химии как науки. На рубеже XVIII–XIX веков не было приборов, которые бы точно определяли атомы каких элементов входят в состав вещества, в каких соотношениях. Всё это можно было установить только косвенным путём. Французский химик Жозеф Луи Пруст сформулировал закон постоянства состава веществ: «каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав». Этот закон дал возможность описывать состав веществ при помощи уже известных символов – знаков химических элементов.
Французский химик Жозеф Луи Пруст сформулировал закон постоянства состава веществ: «каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав». Этот закон дал возможность описывать состав веществ при помощи уже известных символов – знаков химических элементов.
Известно, что в молекуле воды на два атома водорода приходится один атом кислорода: h3O. Химическая формула воды читается «аш-два-о». В серной кислоте на два атома водорода приходится один атом серы и четыре атома кислорода: h3SO4. Химическая формула серной кислоты читается «аш-два-эс-о-четыре». Условную запись состава вещества называют химической формулой. Знаки химических элементов указывают на качественный состав вещества, а индексы – на количественный состав вещества. Если нужно записать несколько молекул вещества, то используют коэффициенты. Тогда 3 молекулы воды можно записать так: 3h3O.
Зная состав вещества, легко определить и относительную массу молекулы. Она обозначается Mr и рассчитывается как сумма масс всех атомов в молекуле. Рассчитаем, чему равна относительная молекулярная масса водорода. Молекула водорода состоит из двух атомов, поэтому химическая формула водорода h3. Относительная молекулярная масса водорода нам известна, поэтому: Mr (h3) = 2 * Ar (H) = 2 * 1 = 2
Она обозначается Mr и рассчитывается как сумма масс всех атомов в молекуле. Рассчитаем, чему равна относительная молекулярная масса водорода. Молекула водорода состоит из двух атомов, поэтому химическая формула водорода h3. Относительная молекулярная масса водорода нам известна, поэтому: Mr (h3) = 2 * Ar (H) = 2 * 1 = 2
Так же можно рассчитать и относительную молекулярную массу любой молекулы. Например, молекулы сахара: Mr (C12h32O11) = 12 * Ar (C) + 22 * Ar (H) + 11 * Ar (O) = 12 * 12 + 22 * 1 + 11 * 16 = 342
Ещё одной важной количественной характеристикой вещества является массовая доля химического элемента, т.е. отношения массы всех атомов данного химического элемента к массе вещества. Обозначается массовая доля греческой буквой омега – ω, вычисляется по формуле:
Например, в молекуле сероводорода массовая доля водорода составляет 5,9 %, а серы 94,1 %. Как определить состав сероводорода?
По условию задачи в ста атомных единицах массы (аем) 5,9 атомных единиц массы водорода и 94,1 атомная единица массы серы. Для того чтобы определить соотношения количества атомов водорода и серы в 100 единицах аем сероводорода, разделим значение аем каждого химического элемента на величину его относительной атомной массы.
Для того чтобы определить соотношения количества атомов водорода и серы в 100 единицах аем сероводорода, разделим значение аем каждого химического элемента на величину его относительной атомной массы.
Получившиеся величины необходимо привести к целочисленным значениям. Сделаем это, разделив оба числа на меньшее из них.
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества.
x = 2; y = 1
Ответ: формула сероводорода h3S.
Справочный материал:
• Закон постоянства состава: «Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав» (в начале 20 века было установлено существование веществ с переменным составом)
• Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
• Индекс – в химической формуле показывает число атомов данного химического элемента в молекуле данного вещества.
• Химический знак (символ) – условное обозначение химического элемента. Первая буква (заглавная) его латинского названия. Иногда добавляется вторая буква – одна из последующих, обязательно строчная.
Первая буква (заглавная) его латинского названия. Иногда добавляется вторая буква – одна из последующих, обязательно строчная.
• Относительная атомная масса – это величина, которая показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Условное обозначение Ar.
• Относительная молекулярная масса – это величина, которая показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Условное обозначение Mr.
• Массовая доля химического элемента в веществе – это отношение массы атомов определённого химического элемента к массе вещества. Представляет собой количественную характеристику вещества. Обозначается ω [омега].
Вычисления по химическим формулам 8 класс Цели
Вычисления по химическим формулам. 8 класс.
Цели: 1. Образовательная: изучить понятие массовая доля атома химического элемента в соединении, закрепить знания об относительной молекулярной массе. 2. Развивающая: развить у учащихся умение применять основные физические величины в химии, на основе имеющихся знаний, при вычислении массовой доли атома химического элемента в соединении. Закрепить умение работать с Периодической системой. 3. Воспитывающая: активизировать познавательный интерес к предмету и творческую активность каждого школьника, умение сотрудничать с учителем и другими учащимися.
2. Развивающая: развить у учащихся умение применять основные физические величины в химии, на основе имеющихся знаний, при вычислении массовой доли атома химического элемента в соединении. Закрепить умение работать с Периодической системой. 3. Воспитывающая: активизировать познавательный интерес к предмету и творческую активность каждого школьника, умение сотрудничать с учителем и другими учащимися.
Основные физические величины в химии Величина Относительная молекулярная масса Характеристика 1. Определение -ЭТО ЧИСЛО, КОТОРОЕ ПОКАЗЫВАЕТ ВО СКОЛЬКО РАЗ МАССА МОЛЕКУЛЫ ДАННОГО ВЕЩЕСТВА БОЛЬШЕ 1/12 МАССЫ ИЗОТОПА УГЛЕРОДА-12. 2. Буквенное обозначение 3. Единицы измерения Mr Безмерная
Вычислить относительную молекулярную массу веществ Мr(Н 2 О)=Аr(Н)х2 Аr(О) =1 х2+16 =18 Мr(СО 2)= Аr(С)+ Аr(О) х2 = 12+ 16 х2 = 44 Мr(К 3 РО 4)= Аr(К)х3+ Аr(Р)+Аr(О) х4 = 39 х3+31+16 х4 =202 Самостоятельное решение в тетраде Са. СО 3, Сu. О, Na. NO 3, H 2 SO 4, Na. OH, Н 3 РО 4, К 2 О
OH, Н 3 РО 4, К 2 О
Основные физические величины в химии Величина Массовая доля атома химического элемента в веществе Формула ω(э)=Аr(э)хn Мr Характеристика 1. Определение — это отношение относительной атомной массы элемента, умноженная на индекс при знаке элемента в формуле, к относительной молекулярной массе вещества. 2. Буквенное обозначение 3. Единицы измерения ω ω(в%) = ω х 100%
Вычисление массовой доли элемента в веществе Вычислить массовую долю кислорода в молекуле воды. ω(О)=Аr(О)хn Мr(Н 2 О) = Аr(Н)х2+ Аr(О) =1 х2+16 =18 ω(О)= Аr(О)хn = 16 х100% =89 Мr(Н 2 О) 18
Вычисление массовой доли элемента в веществе Вычислить массовую долю элементов в молекуле углекислого газа(СО 2) ω(О)=Аr(О)х2 Мr(СО 2) = Аr( С) + Аr(О) х2 =12+16 х2 =44 ω(О)= Аr(О)х2 = 32 х100% = 72, 7% Мr(СО 2) 44 ω(С)= 100%- 72, 7%=27, 3%
Вычислить в молекуле какого вещества массовая доля кислорода больше. Н 2 О, СО 2, К 2 О, Са. О Мr(Н 2 О) = Аr(Н)х2+ Аr(О) =1 х2+16 =18 Мr(СО 2) = Аr(С)+Аr(О) х2 =12+16 х2 =44 Мr(К 2 О)= Аr(К) х2 + Аr(О) =39 х2+16 =94 Мr(Са. О) = Аr(Са) +Аr(О) =40+16 =56 ω(э)=Аr(э)хn Мr
Н 2 О, СО 2, К 2 О, Са. О Мr(Н 2 О) = Аr(Н)х2+ Аr(О) =1 х2+16 =18 Мr(СО 2) = Аr(С)+Аr(О) х2 =12+16 х2 =44 Мr(К 2 О)= Аr(К) х2 + Аr(О) =39 х2+16 =94 Мr(Са. О) = Аr(Са) +Аr(О) =40+16 =56 ω(э)=Аr(э)хn Мr
ω(О)= Аr(О)хn = 16 х100% =89% Мr(Н 2 О) 18 ω(О)= Аr(О)х2 = 32 х100% = 72, 7% Мr(СО 2) 44 ω(О)= Аr(О) = 16 х100% = 17% Мr(К 2 О) 94 ω(О)= Аr(О) = 16 х100% = 40% Мr(Са. О) 40 Вывод: в молекуле воды самая большая массовая доля кислорода
Вычисление массовой доли элемента в веществе. Самостоятельная работа в тетради. 1. Вычислить массовую долю элемента в веществах AI 2 O 3 N 2 O 5 Na 2 O 2. Не производя расчетов определить в каком веществе массовая доля кислорода больше: SO 2 или SO 3
СПАСИБО ЗА ВНИМАНИЕ
Номенклатура и нормы СИ
Номенклатура и нормы СИ
Следует использовать единицы СИ (Système International) . Только символы (не их нижние индексы, верхние индексы или описание в скобках) физических величин должны быть написаны курсивом . Все физические величины, приведенные в столбцах или строках таблицы или на осях рисунка, должны соответствовать алгебраическим правилам , т.е. . физическая величина/единица = числовое значение. Числовые значения и их единицы должны быть записаны через один пробел между ( например, . 1 см, 2 л, 3 г/л, 10 %, 20 °C).
Только символы (не их нижние индексы, верхние индексы или описание в скобках) физических величин должны быть написаны курсивом . Все физические величины, приведенные в столбцах или строках таблицы или на осях рисунка, должны соответствовать алгебраическим правилам , т.е. . физическая величина/единица = числовое значение. Числовые значения и их единицы должны быть записаны через один пробел между ( например, . 1 см, 2 л, 3 г/л, 10 %, 20 °C).
Для смесей А (растворенное вещество) и В (растворитель) содержание должно быть выражено одной из физических величин, приведенных в таблице ниже ( содержание само по себе не является физической величиной ).
| ОТНОШЕНИЕ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Имя | Символ | Определение блока | С.И. Отношение | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Масса | ζ | ζ (А, Б) = м (a) / м (b) / м (b) | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| объемное соотношение | Φ | Φ (A, B) = V (A) / V (б) | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Сумма (вещества) Соотношение | R | RR (A, B) = N (A) / N (B) | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент номера | R | R (A, B) = N (A) / N (B) | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| MASS на соотношение объема | м / В | M (A) / V (b) | кг / м | кг / м | ||||||||||||||||||||||||||||||||||||||||||||||||||
| фракций | |||
| массовая фракция | W | W ( А) = м (а) / [ м (a) + м (b)] (b)] | 1 |
| объемная фракция | Φ | Φ (A) = V (a) / [ v (a) + v (b)] (b)]1 | |
| сумма фракции | x | x (a) = n (a) / [ N (A) + N (b)] | (b)] (b)]1 |
| Номерная фракция | x | x (a) = n (a) / [ n ( A)+ N (B)] | 1 |
| СОДЕРЖАНИЕ Nations | |||
| Массовая концентрация | γ | γ (a) = м (a) / [ v (a) + v (b)] | кг / м 3 |
| Концентрация объема | Σ | Σ (A) = V (A) / [ V (A) + V (b)] | 1 |
| Концентрация суммы | C | C (A) = N (A) / [ V (A) + V (B)] | MOL / M 3 |
| Концентрация номера | C | C (A) = N (A) / [ V (a) + v (b)] | 1 / m 3 |
| Моляльность | b | b (A,B)= n (A)/ m (B) | моль/кг |
Рекомендуется использовать как можно меньше символов. Авторам следует использовать единицы с префиксом СИ вместо основной единицы СИ (следует использовать , например, вместо 1,2·10 –6 А, 1,2 мкА). Для объема в качестве специального названия для 1 дм 3 (1 л=1 дм 3 ) рекомендуется использовать единицу измерения литр ( 1 л ) или ее десятичные единицы. Следуя тому же принципу, хотя это и не рекомендуется ИЮПАК, можно использовать единицу 1 М (или ее десятичные единицы) для количественной концентрации (1 М = 1 моль/л). Символы w/w, v/v и w/v не должны использоваться . Правильный способ выражения дроби : % (по массе), % (по объему) или % ( m / V ). PPM и PPB также не должны использоваться, вместо этого написать 10 , 10 , 10 , и т. Д. Центробежная сила должна быть выражена как раз гравитация (× г ), а не об/мин.
Авторам следует использовать единицы с префиксом СИ вместо основной единицы СИ (следует использовать , например, вместо 1,2·10 –6 А, 1,2 мкА). Для объема в качестве специального названия для 1 дм 3 (1 л=1 дм 3 ) рекомендуется использовать единицу измерения литр ( 1 л ) или ее десятичные единицы. Следуя тому же принципу, хотя это и не рекомендуется ИЮПАК, можно использовать единицу 1 М (или ее десятичные единицы) для количественной концентрации (1 М = 1 моль/л). Символы w/w, v/v и w/v не должны использоваться . Правильный способ выражения дроби : % (по массе), % (по объему) или % ( m / V ). PPM и PPB также не должны использоваться, вместо этого написать 10 , 10 , 10 , и т. Д. Центробежная сила должна быть выражена как раз гравитация (× г ), а не об/мин.
Следует следовать рекомендациям IUPAC по химической номенклатуре (см. http://www.chem.qmul.ac.uk/iupac/index.html).
http://www.chem.qmul.ac.uk/iupac/index.html).
Для биохимической номенклатуры, включая аббревиатуры, следует использовать рекомендации Номенклатурного комитета IUBMB и IUPAC-IUBMB Объединенной комиссии по биохимической номенклатуре (http://www.chem.qmul.ac.uk/iubmb/). последовал.
Номенклатуру генов и символы см. в Базе данных номенклатуры генома человека (http://www.genenames.org/) и Entrez Gene (http://www.ncbi.nlm.nih.gov/sites/entrez). ?db=gene) следует проконсультироваться.
Помимо рекомендованной номенклатуры, допустимы обычные общие термины, а также использование обычных сокращений в тексте, особенно в случаях составных частей с очень длинными названиями.
«« | Рекомендации по таблицам и рисункам »»
единиц концентрации
единиц концентрацииЕдиницы концентрации
Всякий раз, когда мы начинаем обсуждать новый предмет, мы должны выучить язык, который его сопровождает. К счастью, для обсуждения решений в CHM1045 уже использована значительная часть языка. Проблемы, которые могут здесь возникнуть, связаны с тем, сколько из этого языка вы действительно помните и можете ли вы применить то, что вы помните, к новым задачам.
К счастью, для обсуждения решений в CHM1045 уже использована значительная часть языка. Проблемы, которые могут здесь возникнуть, связаны с тем, сколько из этого языка вы действительно помните и можете ли вы применить то, что вы помните, к новым задачам.
Обзор условий:
Существует пять основных способов описания концентрации растворов: 1) Молярность; 2) моляльность; 3) Весовой процент; 4) молярная доля; и 5) частей на миллион или миллиард. Вы должны знать значение каждого из этих терминов и, что более важно, как преобразовать их из одного в другой.Я добавил калькулятор преобразования в нижней части этой страницы, чтобы помочь вам проверить домашнюю работу и т. д. Но не слишком полагайтесь на него, так как он не будет доступен во время экзаменов.
Молярность: Молярность раствора рассчитывается путем деления молей растворенного вещества на литры раствора. Молярность обозначается заглавной «М».
Моляльность: Моляльность раствора рассчитывается путем деления количества молей растворенного вещества на килограммы растворителя. Моляльность обозначается строчной буквой «м».
Моляльность обозначается строчной буквой «м».
Весовой процент (или массовый процент): Весовой процент раствора рассчитывается путем деления массы одного растворенного вещества на общую массу раствора. Это могут быть граммы или килограммы, если единицы измерения обоих выражены одинаково. Затем коэффициент умножается на 100%. Весовой процент обозначается массовым %, а иногда и массовым %.
Мольная доля: Мольная доля одного растворенного вещества в растворе — это просто количество молей этого растворенного вещества, деленное на общее количество молей всех растворенных веществ/растворителей.Молярная доля растворенного вещества i записывается как X i .
Части на миллион (PPM) и Части на миллиард (PPB): «Части на» — это удобное обозначение, используемое для низких и очень низких концентраций. Вообще говоря, это очень похоже на весовые проценты — 1% по весу означает 1 грамм вещества на каждые 100 г образца и (хотя и очень редко) называется pph — части на сотню. Другие сокращения означают:
Другие сокращения означают:
| частей на миллион | частей на миллион (10 6 ) |
| частей на миллиард | частей на миллиард (10 9 ) |
| пп | частей на триллион (10 12 ) |
| ppq | частей на квадрилион (10 15 ) |
ppq — это скорее теоретическая конструкция, чем полезное измерение, скорее всего, вы никогда не увидите его в действии.Части на миллион также могут быть выражены в миллиграммах на литр (мг/л).
Практика, Практика, Практика:
Нужно больше практики? Попробуйте пройти любой из представленных здесь тестов: http://lrc-srvr.mps.ohio-state.edu/under/chemed/qbank/quiz/bank9.htm
Спешите или хотите проверить свои ответы? Используйте этот калькулятор преобразования:
4.
 {3}\ ).{o}\) представляет массовую плотность чистых видов \(A\). Массовая плотность вида \(A\) определяется как
{3}\ ).{o}\) представляет массовую плотность чистых видов \(A\). Массовая плотность вида \(A\) определяется как\[\left\{\begin{array}{c} \text{массовая плотность вида} \\ \text{видов} A \end{массив}\right\}=\left(\text{ масса видов }A\right) / \left(\begin{array}{c} \text{ объем, в котором содержится вид }A \\ \text{} \end{array}\right) \label{23}\]
, и это определение применимо к смесям, в которых присутствуют виды \(A\), а также к случаям чистых видов \(A\).{A = N}\rho_{A} \label{27}\]
Полная массовая плотность может быть определена экспериментально путем измерения массы \(m\) и объема \(V\) смеси. Для любой конкретной смеси трудно непосредственно измерить массовую плотность частиц; однако можно приготовить смесь, в которой можно определить массовую плотность видов, как мы предложили на рисунке \(\PageIndex{2}\). При работе с молярными формами нам часто нужна общая молярная концентрация, и она определяется как
.\[\left\{\begin{array}{c} \text{общая молярная} \\ \text{концентрация} \end{массив}\right\}=c=\sum_{A = 1}^{A = N}c_{A} \метка{28}\]
Массовая доля и молярная доля
Для твердых и жидких систем иногда удобно использовать массовую долю в качестве меры концентрации. {G = N}c_{G} } \label{31}\]
{G = N}c_{G} } \label{31}\]
Если кто-то хочет избежать номенклатуры смешанного режима в уравнениях \ref{30} и \ref{31}, необходимо выразить массовую долю как
\[\ omega_ {A} = \ frac {\ rho_ {A} }{\ rho } = \ frac {\ rho_ {A}} {\ rho_ {A} + \ rho_ {B} + \ rho_ {C} + \rho_{D} + …. + \rho_{N} } \label{32}\]
, а молярная доля принимает вид
\[y_{A} =\frac{c_{A}} }{c} =\frac{c_{A}} }{c_{A} + c_{B} + c_{C} + c_{D} + . … + c_{N} } \label{33}\]
Очень часто \(x_{A}\) используется для представления мольных долей в жидких смесях и \(y_{A}\) для представления мольных долей в паровых смесях , таким образом, уравнение \ref{33} представляет молярная доля в паровой смеси, а уравнение \ref{31} представляет мольную долю в жидкой смеси.
Пример \(\PageIndex{1}\): Преобразование мольных долей в массовые доли
Иногда нам могут дать состав смеси с точки зрения различных мольных долей и потребовать массовые доли различных компонентов. {G=N}MW_{G} x_{G } } \метка{5}\тег{5}\]
{G=N}MW_{G} x_{G } } \метка{5}\тег{5}\]
Баланс общей массы
Учитывая общую плотность, определяемую уравнением \ref{27}, мы готовы восстановить общий баланс массы для многокомпонентных реагирующих систем.{A = N}\omega_{A} \mathbf{v}_{A} \label{38}\]
Эта скорость известна как среднемассовая скорость и играет ключевую роль как в наших исследованиях макроскопических балансов масс, так и в последующих исследованиях гидромеханики, теплопереноса и массообмена. Использование этого определения для среднемассовой скорости позволяет нам выразить уравнение \ref{36} как
\[\frac{d}{dt} \int_{\mathscr{V}}\rho dV + \int_{\mathscr{A}}\rho \mathbf{v}\cdot \mathbf{n} dA=0 \метка{39}\]
По форме он идентичен массовому балансу для фиксированного контрольного объема, который был представлен в Главе 3; однако этот результат имеет на большее физическое содержание, чем наш предыдущий результат для однокомпонентных систем. В этом случае плотность представляет собой не плотность одного компонента, а сумму плотностей всех видов, как указано в уравнении \ref{27}, а скорость — это не скорость одного компонента, а среднемассовая скорость, определяемая уравнением \ссылка{38}.
В этом случае плотность представляет собой не плотность одного компонента, а сумму плотностей всех видов, как указано в уравнении \ref{27}, а скорость — это не скорость одного компонента, а среднемассовая скорость, определяемая уравнением \ссылка{38}.
Мольная доля – обзор
3 Имидазол, бензимидазол и их производные
В растворе и в твердом состоянии имидазол и его N2-незамещенные производные образуют крупные ассоциаты с водородными связями 13 (схема 8) [76AHC(S1) ), п.266; 84CHEC-I(5)345,84JPC5882; 96CHEC-II(3)77; 97JST(415)187].
Схема 8.
Благодаря совершенному линейному расположению водородных мостиков NH⋯N в 13 в растворе происходят чрезвычайно быстрые кооперативные переносы протонов, которые приводят к усреднению положений 4 и 5 в кольце по времени ЯМР масштаб. В отличие от пиразолов, для имидазола, бензимидазола и многих их производных к настоящему времени зарегистрированы только усредненные спектры ЯМР 1 H, 13 C и 15 N эффективной симметрии C 2v [75T1461, 82JOC5132, 96CHEC-II(3)77, 97MRC35]. Медленная прототропная кольцевая таутомерия 2-перфторалкилимидазолов была приписана реализующимся в этих соединениях внутримолекулярным связям N-H⋯F (82JOC2867; 95OPP33). Реакция протонного обмена подвержена общему и специфическому кислотному и основному катализу [76AHC(S1), p. 266; 87AHC(41)187],
Медленная прототропная кольцевая таутомерия 2-перфторалкилимидазолов была приписана реализующимся в этих соединениях внутримолекулярным связям N-H⋯F (82JOC2867; 95OPP33). Реакция протонного обмена подвержена общему и специфическому кислотному и основному катализу [76AHC(S1), p. 266; 87AHC(41)187],
Как и в случае пиразола, относительные энергии неароматических 2 H 14c и 4 (или 5) 14d,e (R 1 = R 8 2 = R 2 3 = H) изомеры имидазола слишком высоки, чтобы они могли способствовать таутомерному равновесию (схема 9).Согласно расчетам STO-3G (86BSF429) эти значения равны 60,4 и 67,7 кДж моль -1 соответственно относительно 14a,b (R 1 = R 2 = R 3 ).
Схема 9.
Большая часть имеющейся информации о положениях таутомерных равновесий 14a ⇌ 14b имидазолов связана с измерениями основности N-незамещенных имидазолов и N-метилированных производных таутомеров 14a и 14б. Данные, полученные ранее [76AHC(S1), с. 272] и более поздние исследования [96CHEC-II(3)77] собраны в Таблице III. Они, как правило, соответствуют данным, полученным при использовании 1 H и 13 C ЯМР [79JOC3864; 83Т3797; 86JHC921; 92JCS(P1)2779; 98JCS(P2)1665], 15 N ЯМР (79JOC3864; 83HCA1537) и УФ-спектральный (86ZC378) методы.
Данные, полученные ранее [76AHC(S1), с. 272] и более поздние исследования [96CHEC-II(3)77] собраны в Таблице III. Они, как правило, соответствуют данным, полученным при использовании 1 H и 13 C ЯМР [79JOC3864; 83Т3797; 86JHC921; 92JCS(P1)2779; 98JCS(P2)1665], 15 N ЯМР (79JOC3864; 83HCA1537) и УФ-спектральный (86ZC378) методы.
Таблица III. Константы равновесия ( k t = 14a / 14b ) для кольцевой таутомерии имидазола / 14 000 ° С. № по каталогу
 278
278Основной вывод о влиянии заместителей в имидазольном кольце на состояние таутомерных равновесий 14a ⇌ 14b состоит в том, что электроноакцепторные группы благоприятствуют 4-му положению, т.е. таутомерам 9000 с R 2 = Hal, NO 2 и т. д. являются энергетически предпочтительными видами.Применение уравнения Чартона K T = [4-R Im]/[5-R Im] = 3,2 σ m подробно обсуждалось [76AHC(S1); 96CHEC-II(3)77]. Уравнение оказалось в качественном согласии с экспериментальными данными, представленными в табл. III.
Теоретические исследования относительной устойчивости таутомеров 14а и 14б проводились в основном на полуэмпирическом уровне. Расчеты AM1 и PM3 [98JST(T)249] относительной стабильности для ряда 4(5)-замещенных имидазолов 14 (R 3 = H, R 2 = H, CH 3 , OH, F, NO 2 , Ph) в основном согласуются с выводом, основанным на уравнении Шартона.Из сравнения электронных спектров 4(5)-фенилимидазола 14 (R 2 = Ph, R 1 = R 3 = H) и 2,4(5)-дифенилимидазола 14 ( R 1 = R 2 = Ph, R 3 = H) в этаноле с рассчитанными по методу π -электронных ППС для каждой из таутомерных форм следует, что расчеты для таутомеров типа 14a лучше соответствуют экспериментально наблюдаемым спектрам (86ZC378).Расчеты AM1 [92JCS(P1)2779] энтальпий образования 4(5)-аминоимидазола 14 (R 2 = NH 2 , R 1 = R 3 (H ) и 4= 5. Оба предсказания не соответствуют ожиданиям, основанным на уравнении Чартона и данных, связанных с измерениями основности (таблица III).
Расчеты AM1 и PM3 [98JST(T)249] относительной стабильности для ряда 4(5)-замещенных имидазолов 14 (R 3 = H, R 2 = H, CH 3 , OH, F, NO 2 , Ph) в основном согласуются с выводом, основанным на уравнении Шартона.Из сравнения электронных спектров 4(5)-фенилимидазола 14 (R 2 = Ph, R 1 = R 3 = H) и 2,4(5)-дифенилимидазола 14 ( R 1 = R 2 = Ph, R 3 = H) в этаноле с рассчитанными по методу π -электронных ППС для каждой из таутомерных форм следует, что расчеты для таутомеров типа 14a лучше соответствуют экспериментально наблюдаемым спектрам (86ZC378).Расчеты AM1 [92JCS(P1)2779] энтальпий образования 4(5)-аминоимидазола 14 (R 2 = NH 2 , R 1 = R 3 (H ) и 4= 5. Оба предсказания не соответствуют ожиданиям, основанным на уравнении Чартона и данных, связанных с измерениями основности (таблица III). Эти несоответствия можно объяснить тем, что таутомеры 14b 4(5)-аминоимидазола и 14a 4(5)-нитроимидазола обладают более высокими значениями дипольных моментов по сравнению с их более стабильными газофазными таутомерами. Учет энергии сольватации должен преодолеть внутреннюю энергетическую щель.
Эти несоответствия можно объяснить тем, что таутомеры 14b 4(5)-аминоимидазола и 14a 4(5)-нитроимидазола обладают более высокими значениями дипольных моментов по сравнению с их более стабильными газофазными таутомерами. Учет энергии сольватации должен преодолеть внутреннюю энергетическую щель.
Утверждая, что метод MNDO более подходит, чем метод AM1, для прогнозирования теплот образования пятичленных азотсодержащих ароматических колец, Гарсия и Виларраса (88h2803) рассчитали, что 4-фторимидазол 14a (R 2 = F, R 1 = R 3 = H) равно 2.5 кДж Моль -1 Более стабильный, чем его Tautomer 14B , тогда как 2,4-дифторимидазол 14A (R 1 = R 2 = F, R 3 = H) составляет 2,1 кДж MOL −1 менее стабилен, чем 14b. Различия в энергиях очень малы и исчезают при учете поправочных членов, связанных с отталкиванием неподеленных пар между вицинальными пиридиноподобными атомами азота и фтористыми заместителями.
Теоретическое ab initio исследование газофазной основности метилдиазолов (90JA1303) включало обсуждение таутомерии 4(5)-метилимидазола.Расчеты RHF/4-31G позволили сделать вывод, что 4-метилтаутомерная форма 14a (R 2 = Me, R 1 = R 3 = H) на 5,2 кДж моль −1 9013 больше. стабильнее, чем его 5-метиловый аналог 14b. Было подчеркнуто, что этот результат следует рассматривать как зависящий от базового набора. Однако недавнее теоретическое исследование [94JST(T)45] показало, что, начиная с уровня RHF/6-31G*, все более точные приближения указывают на более высокую внутреннюю стабильность 4-метилтаутомера.На уровне MP2/6–31G* полная энергия 4-метилтаутомера на 0,7 кДж моль -1 ниже, чем у 5-метилтаутомера. Таким образом, учет эффектов сольватации может сильно повлиять на положение таутомерного равновесия 14а ⇌ 14б. Недавно было проведено систематическое теоретическое исследование, направленное на оценку молекулярных свойств и таутомерного равновесия 4- и 5-метилимидазолов [98JST(T)197]. Было обнаружено, что значение K T для газофазного равновесия весьма чувствительно как к базисному набору, так и к корреляционным эффектам.Для достижения хорошего согласования с экспериментальными данными требуется использование расширенных базисных наборов (6-31+G*, 6-311+G* и 6-31 ++G**) на уровнях MP2 и DFT.
Было обнаружено, что значение K T для газофазного равновесия весьма чувствительно как к базисному набору, так и к корреляционным эффектам.Для достижения хорошего согласования с экспериментальными данными требуется использование расширенных базисных наборов (6-31+G*, 6-311+G* и 6-31 ++G**) на уровнях MP2 и DFT.
В последние годы было добавлено немного информации к более ранним исследованиям таутомерных равновесий бензимидазолов, основанным на измерениях основности [76AHC(S1), p. 292], для 5(6)- и 4(7)-замещенных бензимидазолов и 2-метил-5(6)-замещенных бензимидазолов K T значения очень близки к 1, что указывает на близкую эквивалентность по стабильности Таутомеры N1(H) и N3(H).С использованием полуэмпирических методов MINDO/3 и INDO проанализированы таутомерные равновесия 2-замещенных (H, NH 2 , OMe, CN) 5-нитробензимидазолов и 4-нитробензимидазолов. Было предсказано, что электроноотдающие группы в положении 2 смещают равновесия в сторону таутомеров 6-NO 2 и 4-NO 2 соответственно.
Как уже упоминалось, частоты перескоков протонов, приводящие к установлению равновесия 14а ⇌ 14б в растворах имидазолов и бензимидазолов, слишком велики для наблюдения этих форм на шкале времени ЯМР с 13 С [ разность химических сдвигов для C4 и C5 в N -алкильных производных составляет около 10 м.д. (88MRC134)] и даже с 15 N ЯМР, где азотные резонансы пирролоподобного и пиридиноподобного атомов азота имеют разность химических сдвигов до 100 м.д. (97МРЦ35).Это указывает на то, что среднее время жизни отдельного таутомера до его прототропной перегруппировки составляет около 10 -4 -10 -5 с. Эта перегруппировка замораживается в твердом состоянии. Спектры ЯМР твердого тела 13 C с хорошим разрешением записаны для имидазола [81JA6011, 81JCS(CC)1207], 2-метилимидазола [87H(26)333], бензимидазола [83h2713; 96CHEC-II(3)77] и 2,2′-бис-1 H -имидазол [96CHEC-II(3)77]: сигналы C(4) и C(5) отнесены путем сравнения с спектры соответствующих N -метилпроизводных. Недавно было проведено спектроскопическое исследование ЯМР 1 H и 13 C 2,2′-бисбензимидазолила в растворе ДМСО в диапазоне температур от 293 до 383 К и энергии активации 67–69 кДж моль — 1 оценено для процесса переноса протона [98JPOC411]. Эта величина попадает в диапазон значений, характерных для таутомеризации других циклических оксаламидинов (89JA5946; 94JA1230), что предполагает возможность двухстадийного межмолекулярного механизма таутомерной перегруппировки .
Недавно было проведено спектроскопическое исследование ЯМР 1 H и 13 C 2,2′-бисбензимидазолила в растворе ДМСО в диапазоне температур от 293 до 383 К и энергии активации 67–69 кДж моль — 1 оценено для процесса переноса протона [98JPOC411]. Эта величина попадает в диапазон значений, характерных для таутомеризации других циклических оксаламидинов (89JA5946; 94JA1230), что предполагает возможность двухстадийного межмолекулярного механизма таутомерной перегруппировки .
Спектр ЯМР 15 N твердого имидазола показывает два отдельных сигнала для NH (–210 м.д.) и пиридиноподобного (–138 м.д.) азота, указывая на то, что протонный обмен замедлен в твердом состоянии (82JA1192). Принимая во внимание очень большую разницу между химическими сдвигами 15 N двух атомов азота в имидазольном кольце, спектроскопию ЯМР 15 N можно рассматривать как наиболее точный и надежный подход для определения K T значения для таутомерных равновесий 14a ⇌ 14b (82JA3945).
моль фракций таутомеров 14A ( x a ) и 14b ( x b ) могут быть рассчитаны с использованием уравнения
POBS = XAPA + XBPB,
где P obs — наблюдаемый усредненный химический сдвиг (или константа связи), а P a и P b — химические сдвиги (или константы связи) пирролоподобного и пиридиноподобного азота в 14 в условиях медленного протона обмен (т.г., в твердом состоянии) или в его производном NMe. Процедура не очень точна, потому что всегда существует неопределенность в отношении того, насколько хорошо значения модели соответствуют значениям отдельных таутомеров; однако обычно он считается (80JA2881; 82JA3945, 82JOC5132; 93JA6813) более точным, чем основанный на измерениях основности. Используя усредненные значения химических сдвигов 15 N атомов азота N1 и N3 гистамина 15 и ряда его аналогов со способностью образовывать циклическую водородную связь внутри определенного таутомера, Roberts et al. (82JA3945) рассчитаны значения K T для диапазона рН, соответствующего существованию соединений 15 – 21 в водном растворе в форме, подчиненной таутомерному равновесию N1(H) ⇌ N3(H). 1
(82JA3945) рассчитаны значения K T для диапазона рН, соответствующего существованию соединений 15 – 21 в водном растворе в форме, подчиненной таутомерному равновесию N1(H) ⇌ N3(H). 1
Как видно из значений K T , влияние циклических водородных связей в соединениях 15,17 и 18 недостаточно сильно для смещения таутомерных равновесий в сторону N3( Н) сторона.Этот факт связывали с неблагоприятным затенением метиленовых групп в боковой цепи и конкуренцией воды с боковой группой за образование водородной связи с группой NH. Устранение первого фактора в цис -урокановой кислоте 19 и 20 привело к заметной стабилизации таутомеров N(3)H, что подтверждается измерениями p K a [98JCS(P2)1665] .
Особое внимание было уделено изучению таутомерных равновесий в растворах гистидина 22 , поскольку признана ключевая функциональная роль таких равновесий в белках.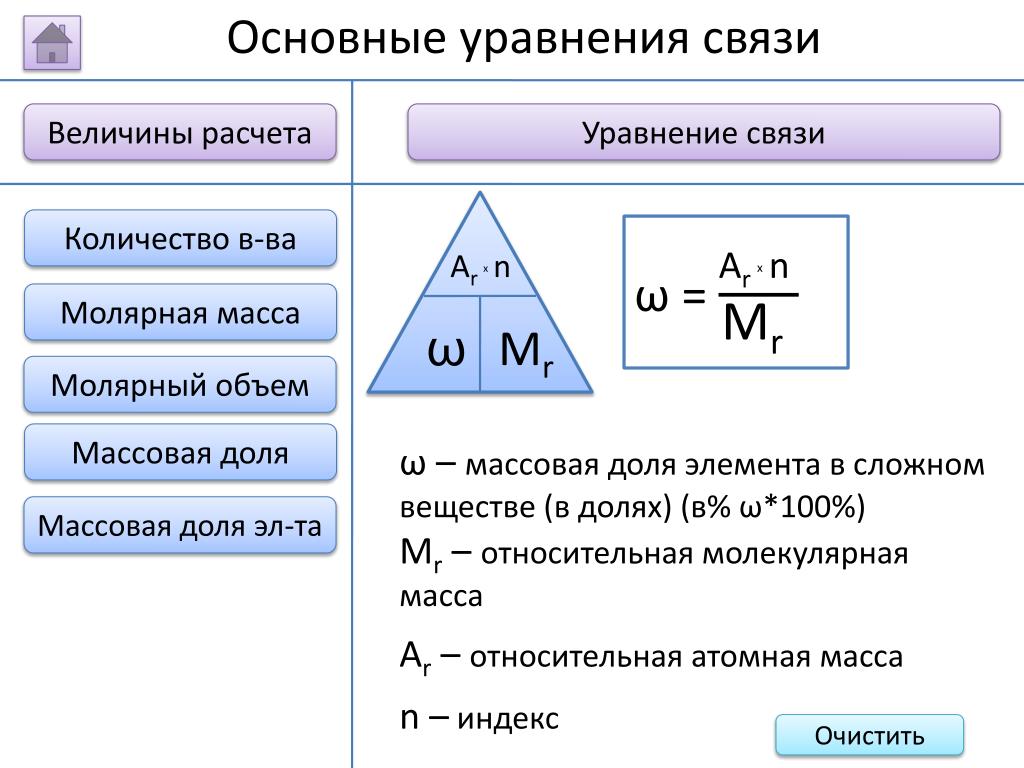 В водных растворах таутомеры гистидина быстро взаимопревращаются и наблюдается только один усредненный сигнал для каждого азота кольца (схема 10). Схема 10 твердое состояние, в котором таутомерный обмен происходит медленно (82JA1192). Использование 80% этанола/воды в качестве растворителя позволило Bachovchin et al. (93JA6813) для непосредственного наблюдения индивидуальных таутомерных форм гистидина в спектрах ЯМР 15 N при –55°C. Было обнаружено, что растворитель мало влияет на внутренние сдвиги 15 N индивидуальных таутомеров и таутомерные равновесия имидазольного кольца. В интервале рН, где имидазольный цикл нейтрален, в спектрах ЯМР 15 N при –55°С наблюдались три из четырех возможных форм гистидина. Только 22b напрямую не обнаружен.Примечательно, что в спектрах ЯМР твердого тела 15 N гистидина (82JA1192) наблюдались только формы 22a и 23a . Мольная доля таутомерной формы 22b , рассчитанная по химическим сдвигам 15 N в растворах при рН ~8,2, где преобладает цвиттер-ион 22 , равна 0,18.
В водных растворах таутомеры гистидина быстро взаимопревращаются и наблюдается только один усредненный сигнал для каждого азота кольца (схема 10). Схема 10 твердое состояние, в котором таутомерный обмен происходит медленно (82JA1192). Использование 80% этанола/воды в качестве растворителя позволило Bachovchin et al. (93JA6813) для непосредственного наблюдения индивидуальных таутомерных форм гистидина в спектрах ЯМР 15 N при –55°C. Было обнаружено, что растворитель мало влияет на внутренние сдвиги 15 N индивидуальных таутомеров и таутомерные равновесия имидазольного кольца. В интервале рН, где имидазольный цикл нейтрален, в спектрах ЯМР 15 N при –55°С наблюдались три из четырех возможных форм гистидина. Только 22b напрямую не обнаружен.Примечательно, что в спектрах ЯМР твердого тела 15 N гистидина (82JA1192) наблюдались только формы 22a и 23a . Мольная доля таутомерной формы 22b , рассчитанная по химическим сдвигам 15 N в растворах при рН ~8,2, где преобладает цвиттер-ион 22 , равна 0,18. Это значение хорошо согласуется с более ранними оценками (80JA2881), основанными на значениях констант связи 2 J NH . Стабилизация 22a над 22b , по-видимому, обусловлена образованием водородной связи с участием N3-центра.При рН выше 9.2, когда депротонирование α-аминогруппы не отдает водородную связь N3-центру, энергетически предпочтительной формой по-прежнему остается таутомер 23a . Мольная доля оценивалась равной 0,35 (93JA6813). Недавно был разработан эффективный метод определения протонированных и депротонированных форм и таутомерных состояний остатков гистидина даже в белках с большой молекулярной массой (до 30–40 кДа), основанный на измерении констант связывания между 90–137 15 N и 13 C в имидазольном кольце (98JA10998).Во всех гистидинсодержащих белках преобладают таутомерные формы типа -22а- и -23а-.
Это значение хорошо согласуется с более ранними оценками (80JA2881), основанными на значениях констант связи 2 J NH . Стабилизация 22a над 22b , по-видимому, обусловлена образованием водородной связи с участием N3-центра.При рН выше 9.2, когда депротонирование α-аминогруппы не отдает водородную связь N3-центру, энергетически предпочтительной формой по-прежнему остается таутомер 23a . Мольная доля оценивалась равной 0,35 (93JA6813). Недавно был разработан эффективный метод определения протонированных и депротонированных форм и таутомерных состояний остатков гистидина даже в белках с большой молекулярной массой (до 30–40 кДа), основанный на измерении констант связывания между 90–137 15 N и 13 C в имидазольном кольце (98JA10998).Во всех гистидинсодержащих белках преобладают таутомерные формы типа -22а- и -23а-.
Таутомерные равновесия между двумя вырожденными парами ( A ‘, A ″ ⇌ B ‘, B ″) наблюдались в низкоконцентрированных растворах DMSO-d 6 в обоих имидазольных кольцах [98H(48)113]. В этих равновесиях преобладают несимметричные таутомеры А ‘ и А ».
В этих равновесиях преобладают несимметричные таутомеры А ‘ и А ».
Сертификация массовой доли свинца в вине для сравнения 16 Международной программы оценки измерений
Сравнение 16 Международной программы оценки измерений (IMEP) было сосредоточено на оценке эффективности измерений для определения массовой доли свинца в коммерческом красном вине, что привело к продемонстрированной степени эквивалентности для лабораторий на международном уровне. Пробные образцы вина ИМЭП-16 были испытаны на однородность и устойчивость к колебаниям давления и температуры (изохронное сравнение).Концентрация свинца в среднем испытательном образце была сертифицирована с использованием комбинации прямого протокола разложения образца в микроволновой печи и квадрупольной масс-спектрометрии с индуктивно-связанным изотопным разбавлением плазмы, применяемой в качестве основного метода измерения. Сертификация прослеживаемых эталонных значений SI была достигнута при относительной расширенной неопределенности 1,2% ( k = 2). Почти половина неопределенности была связана с измеренным поправочным коэффициентом однородности образца (1 ± 0,4%).
затем следуют вклады поправок на инструментальный фон и эффекты мертвого времени (соответственно около 5% и 23% вычисленной комбинированной неопределенности) и вклады измерений, выполненных для поправки на эффекты дискриминации по массе (12.всего 3%). В ИМЭП-16 приняли участие 129 лабораторий из 33 стран. Результаты разбросаны по широкому диапазону значений (от <1 до >2900 мкг л -1 ), и одна треть лежит ниже -50% или выше +50% отклонения от сертифицированной концентрации Pb. Около 40% всех участников сообщили о точных результатах с погрешностью ±10%. Для подавляющего большинства неопределенность измерения была в значительной степени недооценена. Качество результатов, по-видимому, не коррелирует ни с заявленным опытом в этом типе измерений, ни с типом применяемого аналитического метода.
Сертификация прослеживаемых эталонных значений SI была достигнута при относительной расширенной неопределенности 1,2% ( k = 2). Почти половина неопределенности была связана с измеренным поправочным коэффициентом однородности образца (1 ± 0,4%).
затем следуют вклады поправок на инструментальный фон и эффекты мертвого времени (соответственно около 5% и 23% вычисленной комбинированной неопределенности) и вклады измерений, выполненных для поправки на эффекты дискриминации по массе (12.всего 3%). В ИМЭП-16 приняли участие 129 лабораторий из 33 стран. Результаты разбросаны по широкому диапазону значений (от <1 до >2900 мкг л -1 ), и одна треть лежит ниже -50% или выше +50% отклонения от сертифицированной концентрации Pb. Около 40% всех участников сообщили о точных результатах с погрешностью ±10%. Для подавляющего большинства неопределенность измерения была в значительной степени недооценена. Качество результатов, по-видимому, не коррелирует ни с заявленным опытом в этом типе измерений, ни с типом применяемого аналитического метода.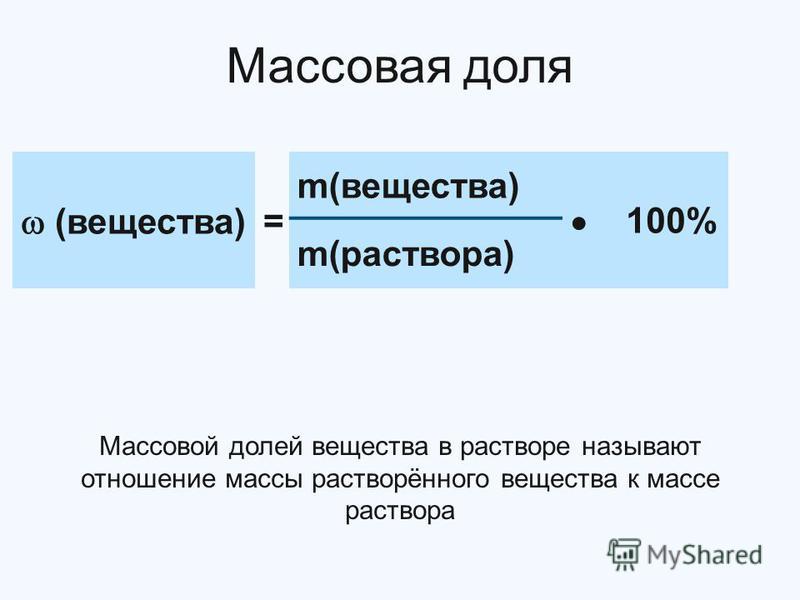 Идентичные образцы
были распространены среди 14 национальных измерительных институтов (из 12 стран и IRMM) в рамках пилотного исследования CCQM-P12. Все их результаты совпадали в пределах ±10% от сертифицированного значения IMEP-16, что резко отличалось от разброса результатов IMEP-16.
Идентичные образцы
были распространены среди 14 национальных измерительных институтов (из 12 стран и IRMM) в рамках пилотного исследования CCQM-P12. Все их результаты совпадали в пределах ±10% от сертифицированного значения IMEP-16, что резко отличалось от разброса результатов IMEP-16.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?Метео 532 Химия атмосферы
6. Атмосферные частицы
Атмосферные частицы
Как мы обсуждали в главе 2, атмосферные аэрозоли могут быть либо испускаются напрямую, либо образуются путем преобразования газа в частицы.В глобальном масштабе как прямые выбросы, так и преобразование газа в частицы имеют важное значение. На рисунке ниже показаны основные процессы, влияющие на атмосферное аэрозоли.
Полученные в результате этих процессов распределения размеров были дано на рисунке в главе 2, который повторяется ниже.
Особенно важны две особенности аэрозоля.
важно для понимания роли, которую аэрозоли играют в атмосфере
химия и радиационный баланс.Там
распределение по размерам и химический состав. Если мы хорошо знаем эти два свойства,
затем, проделав некоторую лабораторную работу, мы можем описать
химические, микрофизические и оптические свойства аэрозолей. Наша цель в этом
Глава посвящена описанию физических и химических процессов, которые создают
наблюдаемые распределения аэрозолей.
Наша цель в этом
Глава посвящена описанию физических и химических процессов, которые создают
наблюдаемые распределения аэрозолей.
Аэрозольные источники.
В следующей таблице представлены источники тропосферного аэрозоли.
- Антропогенный немного меньше естественного.
- Подробнее более половины серы антропогенного происхождения.
- Биогенный ЛОС в глобальном масштабе более важны, чем антропогенные ЛОС
В этой таблице приведены глобальные оценки, но распределения сильно изменчивы. Городские районы имеют примерно в 10 раз больше, чем в сельских районах, которые обычно имеют концентрации аэрозолей выше, чем в отдаленных районах.
У нас есть два типа смесей.
- Внешне смешанный. Частицы аэрозоля, имеющие различные химические составы находятся в одной и той же воздушной массе.
- Внутри смешанный. Каждый отдельный аэрозоль частица содержит смесь химических веществ.
Распределения по размерам.
Размеры аэрозолей различаются на несколько порядков, от от нескольких нм до 10 мкм. Номер аэрозоля концентрации (количество/объем) также меняются на порядки, от нескольких до 10 7 до 10 8 см -3 .Неудивительно, что городские районы обычно имеют гораздо более высокие концентрации аэрозолей, чем сельские или отдаленные районы.
Нас интересует распределение размеров этих аэрозолей, так как нас интересует химический состав как функция размера аэрозоля.
Давайте вернемся к фигуре, которую я показывал раньше, чтобы получить
приблизительное представление о распределении размеров.
1. хорошо частицы (диаметром < 2 мм).Эти обычно возникают в результате преобразования газа в частицы. Они состоят из режима зародышеобразования (диаметр <0,1 мм) и режим накопления (0,1 < диаметры < 2 мм).
2. курс частицы (диаметром > 2 мм). Эти обычно возникают в результате механических процессов, таких как морские брызги, переносимые ветром пыль, частицы от шин и разрывов и т.п.)
Некоторые определения. И диаметр, и радиус используются для определения размера аэрозоля.Сайнфелд и Пандис использовать диаметр, D p . Иногда мы будем использовать радиус, R p .
Аэрозоли часто измеряют приборами, которые разделяют аэрозолей по размеру, так как размер аэрозоля является важной величиной для знать, чтобы понять процессы, которые произвели аэрозоли и их вероятное воздействие на человека.
Для корзин любого размера с маркировкой i:
1. N и = количество аэрозольных частиц на см -3 воздуха в бункере такого размера
(единицы = см -3 ).
N и = количество аэрозольных частиц на см -3 воздуха в бункере такого размера
(единицы = см -3 ).
2. n i = количество аэрозольных частиц на см -3 воздуха на интервал единичного размера. (единицы = мм -1 см -3 ).
3. Таким образом, в любом заданном интервале размеров N i = n i ДД пи , где ДД пи это размер интервала.
4. Общее количество частиц происходит от сложения вместе всех частиц в различных размер ящиков:
N = S i N i = S I n i DD pi
Если бы размеры ячеек можно было сделать бесконечно малыми, то мы могли бы использовать интеграл:
Н Н (Д р )
d D p = количество частиц на см ‑3 воздуха диаметром от D p до
Д стр + ДД стр .
Н = 0 ∞ с с (Д р ) д Д р
или
Н Н (D p ) = dN / dD p .
Это полезная концепция по нескольким причинам.
1. Позволяет получить хорошее представление о фактическом распределении, даже когда приборы для измерения частиц не имеют одинаковых по размеру ящиков.
2. Мы можем интегрировать кривые непосредственно, чтобы получить общее количество частиц. Этот второй пункт особенно важен когда мы хотим получить быстрое представление об общем количестве, площади поверхности или объеме наблюдаемых аэрозолей.
Мы можем применить эту концепцию функции распределения размеров к
определить площадь поверхности, объем и общую массу частиц. Обычно мы предполагаем, что частицы
сферический. Мы действительно рассматриваем
плотности площади поверхности, объема и общей массы, т. е.е. количество каждого
количество на единицу объема воздуха.
е.е. количество каждого
количество на единицу объема воздуха.
Получаем следующие выражения:
Площадь поверхности. Поверхность площадь важна для гетерогенных реакций.
Площадь поверхности на единицу диаметра определяется как:
Общая поверхностная плотность может быть найдена путем интегрирования n s :
Объем.Громкость определяет общее количество химического вещества в аэрозоле.
Объем на единицу диаметра определяется как:
Общая объемная плотность может быть найдена интегрированием n V :
Масса (при условии однородной плотности).
, где единицами измерения r являются г см -3 .
Таким образом,
На самом деле массы аэрозолей обычно указываются как мг м -3 . Типичные массовые концентрации варьируются от менее 1 мг m -3 в чистых средах от 10 до, возможно, даже нескольких сотен мг m -3 в более загрязненной среде.
Поскольку распределения размеров охватывают такие диапазоны размеров, часто лучше всего смотреть не на распределение размеров в зависимости от диаметра, а вместо этого думать о них как о функции логарифма диаметра. Таким образом, мы получаем следующие функции для количество, площадь поверхности и объем распределения:
Пусть n N (log(D p )) d log(Dp) будет
количество частиц на см -3 воздуха с диаметрами в пределах
log(D p ) в log(Dp)
+ d log(D p ).
Тогда мы можем определить следующие отношения:
Чтобы получить общее число, мы просто делаем интеграцию:
Показаны распределения числа, поверхности и объема на рисунке ниже.Обратите внимание, что наибольшее количество аэрозольных частиц находится в наименьшем диапазоне, площадь поверхности находится в основном в промежуточном диапазоне, а громкость наибольшая в большом диапазон частиц.
Нас чаще всего интересует средний диаметр частиц и размер отклонения:
Логарифмически нормальное распределение. Наиболее часто используемое аналитическое выражение, которое используется для попытки
чтобы соответствовать наблюдаемым распределениям частиц по размерам, является суммой нескольких логарифмически нормальных
раздачи:
Наиболее часто используемое аналитическое выражение, которое используется для попытки
чтобы соответствовать наблюдаемым распределениям частиц по размерам, является суммой нескольких логарифмически нормальных
раздачи:
, где я представляет один журнал нормальное распределение. В каждом логе нормально распределения необходимо указать три параметра: N i , общее концентрация аэрозольного числа, D pi , диаметр при значении пиковая числовая концентрация, s i , геометрическая стандартное отклонение распределения.67% частиц имеют диаметры между D pi / s 1 и D pi x s i .
Часто для соответствия наблюдаемые распределения. Обратите внимание, что 3 параметры необходимы для соответствия каждому используемому логарифмически нормальному распределению.
Одной из приятных особенностей логарифмически нормального распределения является то, что поверхность
распределения площади и объема также являются логнормальными с теми же s и .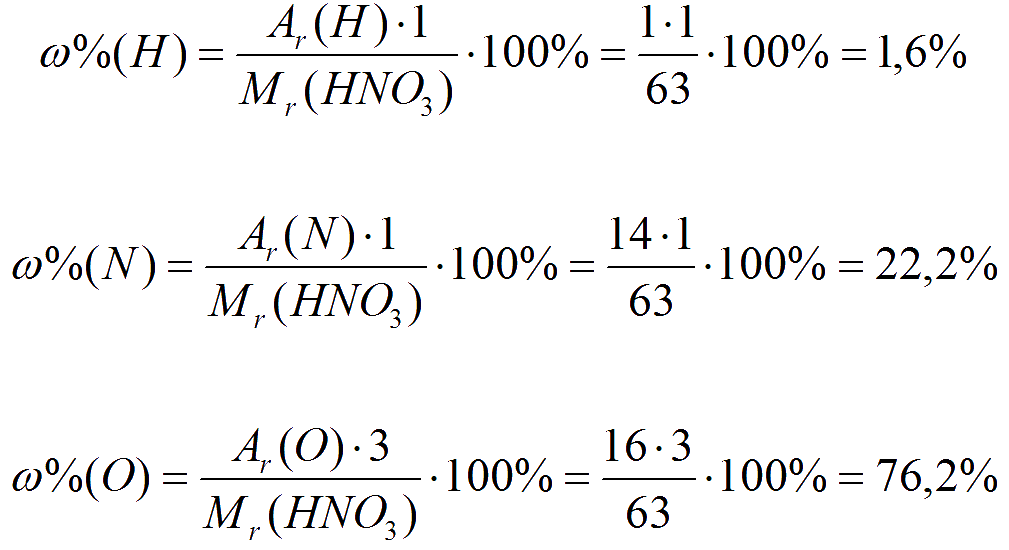
Атмосферные судьбы аэрозольных частиц.
Многое связано с физикой и микрофизикой. с удалением аэрозоля из атмосферы. Нам нужно обсудить аэрозоль аэродинамика, скорость падения, броуновское движение и коагуляция. Вместо этого мы просто укажем время весы для удаления аэрозолей по разным механизмам и разного размера Диапазоны диаметров аэрозолей.
Эффективно удаляются частицы размером более 2 мм. гравитационным осаждением, а частицы диаметром < 0,1 мм способны диффундировать по воздуху и, таким образом, попадать на поверхности, частицы с диаметры в диапазоне от 0,1 до 2 мм не удаляются эффективно ни одним из механизмов. Таким образом, они имеют тенденцию накапливаться в атмосфера.
Судьба аэрозолей представлена в следующей таблице.
Атмосферные источники аэрозольных частиц: газообразные частицы
преобразование.
Газы могут конденсироваться на существующих аэрозолях, называемых гетерогенными зародышеобразования или может конденсировать молекулу за молекулой с образованием аэрозоля, называемого гомогенное зародышеобразование.Если конденсирующей молекулой является вода, гомогенного зародышеобразования практически не происходит. Почти весь водяной пар конденсируется на ранее существовавшие аэрозоли другого химического состава. Эта ситуация неверна для важных химические вещества, такие как серная кислота или органические кислоты, которые могут образовывать аэрозоли путем гомогенного и гетерогенного зародышеобразования. Теперь мы рассмотрим эти два процесса.
Гомогенное зародышеобразование.
До сих пор все наши дискуссии о многофазных системах
предполагают, что поверхность раздела плоская.С молекулярной точки зрения это будет
справедливо для капель размером от 10 мм и более.
Однако для небольших капель, скажем в масштабе 10 нм, кривизна
падение довольно большое.
Рассмотрим образование капли из какого-либо вещества. Когда молекулы соединяются, они образуют электростатические связи и выделение энергии. В то же время они формируют поверхность, и требуется работа, чтобы расширять поверхность в присутствии межмолекулярных сил, которые пытаются минимизировать поверхность.Как молекулы собираются вместе, работа, необходимая для образования поверхности, больше, чем энергия, вырабатываемая конденсацией. это пока не соберется достаточное количество молекул, чтобы энергия, полученная от конденсации больше, чем работа, необходимая для создания поверхности. Критический радиус, для которого изменение максимальная свободная энергия определяется уравнением:
Р р * = 2 с V l / kT ln S
где s – поверхностное натяжение, В l – объем, занимаемый молекулой в жидкой фазе, а S = p A / p A o – степень насыщения. p А есть
давление пара над криволинейной поверхностью и p A o давление пара над плоской поверхностью.
p А есть
давление пара над криволинейной поверхностью и p A o давление пара над плоской поверхностью.
Это состояние равновесия, хотя равновесие является метастабильным, поскольку мы предполагаем, что равновесие предположение остается в силе, даже если частица может расти или сжиматься. Преобразование этого выражения:
, который может быть переписан другими терминами как:
, где М = молекулярная масса; ρ l = массовая плотность жидкости; и R = 8.314 Дж моль -1 К -1 . V л объем капли = 4/3 p R p 3
Так как Р р находится в
знаменателя экспоненты, мы можем ожидать, что чем меньше частица
радиус, тем больше давление пара. Таким образом, мелкие частицы имеют высокое равновесное давление паров и стремятся
испариться.
Таким образом, мелкие частицы имеют высокое равновесное давление паров и стремятся
испариться.
Физическое объяснение этого эффекта состоит в том, что чем меньше радиус, тем больше экспозиция любой молекулы на границе раздела с газовая фаза.Поскольку каждая молекула на интерфейс имеет меньший контакт с соседними молекулами и, следовательно, меньше связи, каждой молекуле на границе раздела легче уйти, чем из плоская поверхность.
Почему нас волнует, влияет ли на этот эффект Эффект Кельвина?
только очень мелкие частицы? Где делать
откуда берутся частицы? Если они происходят
от превращения газа в частицу они начинаются с отдельных молекул, которые
довольно маленький, менее 1 нм или около того.Буксировка
молекулы сталкиваются и слипаются за счет электростатической связи, образуя димер. Треть
сталкивается и слипается, образуя тример, и так далее. Однако на этих ранних стадиях радиус
аэрозоль очень мал, а равновесное давление пара очень велико. Испарение для достижения состояния равновесия, предсказанного теорией Кельвина, равно
быстрый. Это постоянная борьба между
зарождение аэрозоля и испарение аэрозоля.
Испарение для достижения состояния равновесия, предсказанного теорией Кельвина, равно
быстрый. Это постоянная борьба между
зарождение аэрозоля и испарение аэрозоля.
Для воды М = 0.018 кг/моль, r l = 1000 кг m -3 , и с . Предположим, что T = 298 К.
Таким образом,
р h3O ≡ e = e s exp(2.1×10 -3 /D p )
где e s – равновесное парциальное давление водяного пара для плоской поверхность чистой воды и Д р имеет единицы мм.
Коэффициент насыщения определяется как S = e/e s . Мы можем переписать приведенное выше выражение в терминах коэффициент насыщения:
S = ехр(2,1×10 -3 / Д р )
Пересыщение, с, определяется
как s = S-1 = exp(2,1×10 -3 / D p )
1.
На следующем рисунке показано перенасыщение в зависимости от диаметра аэрозоля:
Образование аэрозоля или падение облаков начинается при размере молекул около 0.001 мм. Мы видим, что пересыщение которое требуется для возникновения зародышеобразования, довольно велико, больше 5. Эта степень пересыщения практически никогда не попадает в атмосферу из-за присутствия ранее существовавшие аэрозоли. Таким образом, для чистого водяного пара гомогенное зародышеобразование имеет очень низкую вероятность возникновения в атмосфере, за исключением низких температур. Я должен сказать, что только потому, что требуемое пересыщение велика, частицы не могут образовываться.Просто это очень маловероятно.
А как насчет паров, кроме водяного пара? Давление паров над чистой серной кислотой при
296 К это 1,3 х 10 -8 атм. Однако обычно в нем присутствует водяной пар.
атмосфера, в которой существует сульфат. В
случай гомогенной нуклеации H 2 SO 4 , H 2 O
также участвует. Это называется гетеромолекулярной гомогенной нуклеацией. Требуемая концентрация H 2 SO 4 а относительная влажность дана на рисунке от Финлейсона-Питтса и
Питтс.В атмосфере H 2 SO 4 обычно меньше 0,001 pptv, потому что
легко осаждается на поверхностях и в уже существующих аэрозолях.
Однако обычно в нем присутствует водяной пар.
атмосфера, в которой существует сульфат. В
случай гомогенной нуклеации H 2 SO 4 , H 2 O
также участвует. Это называется гетеромолекулярной гомогенной нуклеацией. Требуемая концентрация H 2 SO 4 а относительная влажность дана на рисунке от Финлейсона-Питтса и
Питтс.В атмосфере H 2 SO 4 обычно меньше 0,001 pptv, потому что
легко осаждается на поверхностях и в уже существующих аэрозолях.
Следует отметить, что в чистых районах атмосферы
аэрозоли серной кислоты зарождаются со скоростью, намного большей, чем
предсказано бинарной теорией нуклеации.
Было высказано предположение, что в атмосфере содержится немного аммиака,
что значительно снижает давление паров H 2 SO 4 выше
аэрозоля, способствуя тем самым более быстрому зарождению и росту аэрозоля. можно увидеть на следующем рисунке.
можно увидеть на следующем рисунке.
Сайнфелд и Пандис обсуждают в некоторые детали термодинамики других распространенных систем, которые включают H 2 O, H 2 SO 4 , NH 3 и HNO 3 . NH 3 нейтрализует кислотность аэрозоля, в то время как HNO 3 и H 2 SO 4 конкурируют друг с другом (для низкого содержания аммиака сульфат имеет тенденцию превращать HNO 3 в газовая фаза.Помните, что H HNO3 * = H HNO3 K n1 / [H+].)
Недавняя улучшенная возможность измерения частиц в
режим зародышеобразования привел к ряду интересных наблюдений гомогенных
нуклеация в атмосфере. Некоторые из
наиболее интересны однородные зародыши в городских районах, например
Питтсбург, который можно увидеть на рисунке ниже. Только что прошел фронт с дождем
Питтсбург, очищая воздух от существовавшего ранее аэрозоля.Однако в воздухе содержались как SO 2 и ЛОС. Примечание
что чуть позже 9 появляется большое количество мелких зародышевых частиц и
затем растут путем слияния при столкновениях, а затем испаряются
осаждение на частицы, находящиеся в режиме накопления. Когда частицы сливаются,
количество капель на кубический сантиметр воздуха. Мы
однако можно было бы ожидать, что объем будет расти.
Только что прошел фронт с дождем
Питтсбург, очищая воздух от существовавшего ранее аэрозоля.Однако в воздухе содержались как SO 2 и ЛОС. Примечание
что чуть позже 9 появляется большое количество мелких зародышевых частиц и
затем растут путем слияния при столкновениях, а затем испаряются
осаждение на частицы, находящиеся в режиме накопления. Когда частицы сливаются,
количество капель на кубический сантиметр воздуха. Мы
однако можно было бы ожидать, что объем будет расти.
Гетерогенное зародышеобразование.
В этом случае пар конденсируется на существующем частица.
В присутствии водяного пара мы можем получить капли, которые состоят в основном из водяного пара.
Давление паров воды над каплей радиусом R p определяется двумя факторами:
1. Эффект Кельвина, повышающий давление пара.
р А = p A o exp{(2sM)/(RTr l R p )}
2.эффект Рауля, который снижает давление пара для воды пар, занимая места на границе раздела воздух-жидкость.
р А = р А 0 (1 х растворенное вещество )
где
х растворенное вещество = ([A(водн.)])/([H 2 O] + [A(водн.)])
Мы можем объединить эти два эффекта, сделать некоторые приближения, и приходим к выражению для давления пара над каплей, содержащей некоторые посторонние материалы:
, где w — активность воды, как определено в
Глава 3, р л есть плотность раствора (которую часто, но не всегда можно считать равной
плотность воды, М — масса раствора. Мы предположили, что вся сера
прореагировал и находится в форме сульфата, SO 4 2- .
Мы предположили, что вся сера
прореагировал и находится в форме сульфата, SO 4 2- .
Теория, объединяющая эффекты Кельвина и Рауля, называется теорией Келера. Теория Келера широко используется в облаке микрофизики для понимания процессов, происходящих в атмосфере, таких как зарождение облачных капель на ядрах облачной конденсации (CCN).
Результирующая кривая имеет вид:
Поведение растущей частицы можно разбить на два режима, которые встречаются на радиусе r c , радиус, который можно вывести из теории Келера для максимального насыщения соотношение.
Посмотрите условия, при которых S K меньше S C . Предположим, что мы начинаем с частицы в
равновесие (осаждение = испарение), так что S K = S амб , степень насыщения окружающей среды.
Для R < R C,
Если добавить несколько молекул, то S K станет больше, чем S и , и частица затем сжимается, чтобы вернуться в равновесие.
Если испаряется несколько молекул, то S K становится меньше, чем S амб и частица затем растет, чтобы вернуться в равновесие.
Дымка имеет довольно узкое распределение по размерам, т.е. определяется коэффициентом насыщения окружающей среды, S амб .
Для R > R C ,
Если добавить несколько молекул, то S K станет меньше, чем S и , и частица растет.
Если несколько молекул испаряются, S K становится
больше, чем S и , и частица сжимается до меньшего, чем R c .
до размера, соответствующего коэффициенту насыщения окружающей среды.
Частица либо вырастает до значительно большего размера, либо сжимается обратно в туман.
Если S и > S C , то частица будет расти при любых обстоятельствах.
Газы с низкой летучестью могут поглощаться существующим аэрозолем, а также вода. Многие из химических могут быть органическими соединениями с низким давлением паров, которые образуются при окислении процесс других органических соединений. Эти абсорбированные органические соединения могут влиять на физические и химические характеристики аэрозоля, в том числе их способность действовать как облако ядра конденсации. Эффекты Различные микропримеси атмосферы оказывают большое влияние на коэффициенты насыщения, необходимые для того, чтобы частица превратилась в облачный урожай.
За последнее десятилетие технологии и приборы
дошли до того, что теорию Келера можно проверить в атмосфере на
облачные ядра конденсации (ЯКК). Такой
исследования закрытия требуют измерения CCN, конденсируемых газовых примесей,
коэффициент насыщения и распределение аэрозолей по размерам. До сих пор эти исследования закрытия, кажется, показывают
что теория Келера работает довольно хорошо.
Тем не менее, необходимо больше, чтобы проверить теорию в широком диапазоне
Условия и химический состав.
Такой
исследования закрытия требуют измерения CCN, конденсируемых газовых примесей,
коэффициент насыщения и распределение аэрозолей по размерам. До сих пор эти исследования закрытия, кажется, показывают
что теория Келера работает довольно хорошо.
Тем не менее, необходимо больше, чтобы проверить теорию в широком диапазоне
Условия и химический состав.
Органические аэрозоли. (Это обсуждение следует за Seinfeld и Pandis)
Обычно они обозначаются следующим образом:
1. Элементарный углерод (ЭУ): нечистый графит, который выделяется непосредственно в атмосферу от сгорания;
2. органический углерод (ОС): углерод в большей степени смешанный с водородом, кислород и азот.
а. первичный органический углерод: выбрасывается непосредственно в атмосферу;
б. вторичный органический углерод:
получают из газов-предшественников в результате газофазных реакций.
Поскольку весь углерод имеет некоторые примеси, обозначение ЕС или OC зависит от метода, используемого для идентификации, и точного определение.
Элементарный углерод или сажа образуется при соотношении С/О при сгорании больше 0.5. Как топливо окисляется в пламени, оно распадается на более мелкие молекулы, включая ацетилен (C 2 H 2 ) и полициклические ароматические углеводороды (ПАУ). Образуются зародыши сажи, а затем газофазная полимеризация добавляет больше массы углерода к ядрам до тех пор, пока не образуются частицы сажи. Частицы сажи вырастают примерно до 10 нм, а затем коагулируют с образованием цепочечных агрегатов.
Образование сажи зависит от соотношения углерода и кислорода в процесс горения углеводородов.Если кислорода недостаточно для преобразования всего углерода в CO 2 из топлива C m H n , то стехиометрия:
С м Н с + а О 2 2 а CO + 0,5 н H 2 + (m-2a) C с
C s – образующаяся сажа и
отношение углерод/кислород, C/O, равно m/2a. Когда
m = 2a, C/O = 1 и весь углерод будет связан в виде CO и никакой сажи не будет.
сформировался.Если еще больше кислорода
доступны, то часть CO будет преобразована в CO 2 . Потому что некоторые CO и CO 2 всегда
образуется в процессах горения, сажа будет образовываться даже при С/О менее
1. Экспериментально установлено
что сажа может начать образовываться при C/O всего 0,5.
Когда
m = 2a, C/O = 1 и весь углерод будет связан в виде CO и никакой сажи не будет.
сформировался.Если еще больше кислорода
доступны, то часть CO будет преобразована в CO 2 . Потому что некоторые CO и CO 2 всегда
образуется в процессах горения, сажа будет образовываться даже при С/О менее
1. Экспериментально установлено
что сажа может начать образовываться при C/O всего 0,5.
Склонность к образованию сажи зависит от типа химического сложный. Многокольцевые соединения, такие как нафталин образует больше сажи, чем бензол, соединение с одним кольцом, которое образует больше сажи, чем алкены, алканы и алкины.Дизельные двигатели, печи, сжигающие жир, и камины являются основными источниками сажи.
Концентрация элементарного углерода колеблется от 0,2 до 2,0 мг·м -3 в сельской местности до 1,5-20 мг м -3 в городской местности. Размеры варьируются от 0,1 до 1 мм.
диаметр.
Размеры варьируются от 0,1 до 1 мм.
диаметр.
Органический углерод состоит из тысяч органических соединения. Как правило, органический углерод массы сообщаются только для массы углерода и не включают массу другие химические вещества, такие как водород, азот и кислород.Установлено, что органический углерод составляет 0,1-1 мг(С). m -3 в отдаленных районах до ~4 мг(С) m -3 в сельская местность до 5-20 мг(С) м -3 в городской местности.
Распределение по размерам обычно происходит в зародышах и режимы накопления от 0,1 до 1 мм в диаметре.
Первичный органический углерод. Первичный органический углерод, выброшенный в Лос-Анджелесе состоит из:
- мясо кулинария (21%)
- мощеный дорожная пыль (16%)
- камины (14%)
- без катализатора автомобили (12%)
- дизеля (6%)
- поверхность покрытия (5%)
- лес пожары (3%)
- с катализатором транспортные средства (3%)
- сигареты
(3%).

Химический состав первичных органических соединений обычно соединения С-10 и выше. То размер обычно составляет 0,1-1 мм в диаметре.
Вторичный органический углерод (SOC) или вторичный органический Аэрозоль (СОА).
Аэрозоли образуются, когда органические соединения окисляется, а некоторые продукты окисления имеют очень низкое давление паров.На следующем рисунке показан предлагаемый пути для циклогексена (C 6 H 10 ) окисление озоном. Обратите внимание на формирование некоторых кислот, а также альдегидов.
Газы-прекурсоры для образование вторичного аэрозоля.
Способность летучего органического соединения образовывать вторичные аэрозолей зависит от трех факторов:
- его атмосферное изобилие;
- его химическая реактивность;
- волатильность его продукции.

Во многих случаях летучие органические соединения соответствуют первому два критерия, но его продукты изменчивы. Примером является метан (CH 4 ). Его продукты CO, HCHO, CO 2 все летучие с высоким давления паров.
Вторичные органические аэрозоли обычно образуются из химические типы:
- алканы с числом атомов углерода более 6;
- алкена с более чем 6 атомами углерода;
- полициклические ароматические углеводороды (ПАУ).
Алканы низкомолекулярные, алкены, ароматические соединения (например, бензол) и карбонилы (например, ацетон), хлорированные химикаты и кислородсодержащие растворители не образуют вторичных органических аэрозолей.
Интересный класс ЛОС, который
могут образовывать вторичные органические аэрозоли, являются биогенными ЛОС. При окислении изопрена (C 5 H 8 )
не способствует образованию СОА, окислению некоторых монотерпенов
(C 10 H 16 ) и сесквитерпены (C 15 H 24 )
может. Относительно мало известно о
эти биогенные выбросы. Там есть
все больше доказательств того, что многие терпены того или иного типа обладают
не наблюдаются, но влияют на формирование СОА, разрушение O 3 ,
и производство ОХ.
Относительно мало известно о
эти биогенные выбросы. Там есть
все больше доказательств того, что многие терпены того или иного типа обладают
не наблюдаются, но влияют на формирование СОА, разрушение O 3 ,
и производство ОХ.
Типичные газообразные продукты с низким давлением паров, которые образуют вторичные органические аэрозоли включают высокомолекулярные кислоты и нитраты.
В Лос-Анджелесе вклад различных углеводородов классы для формирования SOA следующие:
ароматические соединения (~60%), биогенные углеводороды (~10-15%), алканы (15-20%) и алкены (5-10%).
Передача газы с низким давлением паров между газовой и аэрозольной фазами.
Мы будем количественно оценивать процесс с помощью нескольких различных показателей:
массовая концентрация, массовая доля в аэрозольной фазе и выход в
аэрозольная фаза.
Не взаимодействующий Вторичный Органические аэрозольные соединения.
Массопереход этих продуктов в аэрозоль происходит, если концентрация газовой фазы больше, чем равновесная газовая фаза концентрация:
Дж = с г — с экв
где с г — концентрация в газовой фазе и c eq представляет собой равновесную концентрацию в газовой фазе.
Если c g > c eq , тогда атмосфера будет перенасыщена органическими соединениями.Таким образом, чтобы найти органические соединения, которые, вероятно, чтобы сформировать SOA, нам нужно искать соединения с низким давлением паров по сравнению с их вероятное газофазное образование.
На следующем рисунке показано поведение адипиновой кислоты в зависимости от времени. Адипиновая кислота поступает
в результате окисления циклогексана. с экв. =
0,08 частей на миллиард. Если соотношение смешивания адипиновой кислоты превышает 0,08 частей на миллиард, то остальное пойдет на
аэрозоль.
Адипиновая кислота поступает
в результате окисления циклогексана. с экв. =
0,08 частей на миллиард. Если соотношение смешивания адипиновой кислоты превышает 0,08 частей на миллиард, то остальное пойдет на
аэрозоль.
Этот случай идеализирован.Химическое вещество не растворилось в аэрозоль, как это происходит с водной химией, которую мы ранее обсуждалось; он также не был адсорбирован, что требует химических взаимодействий с молекулы на поверхности аэрозолей. В этом простом идеализированном случае химически активный органический газ не взаимодействуют с молекулами на поверхности аэрозолей.
ROG = реактивный органический газ.
ROG S i a i P i , где a i – выход продукта P i из
РОГ.Например, реактивный
органический газ может реагировать с ОН и образующимся продуктом окисления
представляет собой органическую кислоту с низким давлением паров.
Общая массовая концентрация или массовая плотность продукта химический, P i , равен: c t,i = c g,i + c aer,i . Все они имеют единицы измерения мг м -3 воздуха.
В равновесии c г, i = c экв.i = p i o M i /RT, где мы используем закон идеального газа и M i – молекулярная масса молекулы, p i o — равновесное давление пара, если химические соединения i.
Для c t,i < c eq,i , затем c aer,i = 0 . В этом случае ни один из химических вид i находится в аэрозоле.
Для c t,i > c eq,i , c aer,i = с t,i с экв,i .Теперь равновесное значение массы
концентрация, которая, конечно, связана с давлением паров, была
превышено, и некоторые химические соединения i теперь
оседает на аэрозоле. По мере увеличения c t,i в аэрозоль попадает больше химических соединений i.
По мере увеличения c t,i в аэрозоль попадает больше химических соединений i.
Давайте свяжем эти концентрации с изменением концентрации реактивного органического газа, ДРОГ.
Суммарная концентрация = ДРОГ, в мг·м -3 .
с т, я = a i (M i / M ROG ) ДРОГ.
Средний член нормализует c t,i для разницы масс между ROG и продуктом окисления, потому что мы используем единицы, основанные на массе, а не на числовых единицах.
Следовательно, c aer,i = 0 если ДРОГ < DROG i * , что является пороговым значением для DROG.
с воздух, я = a i (M i / M ROG ) ДРОГ c eq,i , если DROG > DROG*.
Изменение порога ROG определяется уравнением:
ДРОГ i * = (p i o M ROG )/(a i RT)
с
с экв,i = p i o M i / RT = a i (M i /M ROG ) DROG*
Давайте добавим несколько новых определений. X p,i = массовая доля в аэрозольной фазе: X p,i = с aer,i / с t,i .
X p,i = массовая доля в аэрозольной фазе: X p,i = с aer,i / с t,i .
х р, я = 0, если ДРОГ < ДРОГ*
х р, я = 1 (p i o M ROG )/(a i RT DROG) = 1 (DROG*/DROG), если DROG > DROG*.
Нас интересует массовый выход аэрозоля для различных активных органических газов.Выход, Y i , определяется как:
Y i = c aer,i / ДРОГ
Y i = 0, если ДРОГ < ДРОГ*
В противном случае, если DROG > DROG*,
Y i = a i (M i / M ROG ) (p i М и )/(РТ ДРОГ) = (c aer,i a i M i RT)/(c aer,i RT + p i o M i )M ROG
Формирование бинарного идеального решения с уже существующими
Аэрозоль — Растворение.
В этом случае мы предполагаем, что химическое соединение разделены по закону Генри. Аэрозольный компонент вида i начинает расти, как только частица образуется, в отличие от предыдущего случая, когда Аэрозольная фаза возникала только тогда, когда парциальное давление газовой фазы превышало некоторое ценность.
Определить m o = масса ранее существовавшего аэрозоля (мг m -3 ) и M o = молекулярная масса ранее существовавшей молекулы аэрозоля.
Мольная доля химических соединений в аэрозоле фаза определяется как:
x i = (c воздух,i / M i ) / (c воздух,i / М и + М или / М или )
Для идеального раствора, который подчиняется закону Генри, пар давление p i равно мольной доле x i , умноженной на пар давление чистого раствора химических соединений i:
р я = х я р я или
В единицах массы (мг м -3 ),
в г ,я = (x i p i o M i ) / РТ
Объединение этих трех уравнений путем исключения x i и c g,i , получим выражение:
Но обычно c aer,i << м o.
Из этих уравнений мы также можем вывести массовую долю i в аэрозольной фазе:
и массовый выход аэрозоля ROG:
Адсорбция и разделение газов/частиц органических материалы.
Аэрозоли могут поглощать молекулы газа на своей поверхности. Поглощение включает в себя как микрофизику
и химия. По мере адсорбции происходит
частичное покрытие становится более полным монослоем. Как только новые молекулы газа могут быть адсорбированы только
на монослой одного и того же химического вещества с образованием многослойного химического
свойства и процесс адсорбции могут изменяться.
Изотерма поглощения зависимость количества газа адсорбированный при постоянной температуре, используется для характеристики адсорбция.Наиболее распространена изотерма Ленгмюра для равновесной адсорбции монослой, который имеет следующие допущения:
1. Все сайты поверхностной адсорбции эквивалентны.
2. Адсорбированный молекулы не действуют горизонтально.
3. Все молекулы имеют одинаковую теплоту адсорбции для любого центра.
Изотерма Ленгмюра имеет форма:
, где V — объем газа, адсорбированного при равновесии с газом. парциальное давление р, В м — объем газа который будет образовывать монослой, а b — константа, зависящая от поверхности свойства адсорбирующего материала.
Теория БЭТ расширяет теорию Ленгмюра. концепция изотермы для нескольких слоев. Это
использует предположения:
концепция изотермы для нескольких слоев. Это
использует предположения:
- Ан поглощенная молекула в одном слое может быть местом адсорбции в следующем слое.
- теплота адсорбции равна скрытой теплоте испарения для объема конденсированный газ для всех адсорбированных слоев, кроме первого слоя.
, где S = p/p o — коэффициент насыщения газовой фазы, как мы ввели ранее, p — адсорбирующий газ парциальное давление, p o – адсорбирующий газ давление насыщения, а c – константа, разная для разных поверхности.К сожалению, BET прогнозирует бесконечная адсорбция, если p = p o .
Возможно, лучшей изотермой является изотерма FHH, т.е. дается выражением:
, где А и В — константы адсорбционной поверхности. Поведение различных изотерм с
относительно S можно увидеть на рисунке ниже.Все три теории требуют экспериментальных данных для определения
константы для каждого типа поверхности и каждого адсорбирующего газа.
Поведение различных изотерм с
относительно S можно увидеть на рисунке ниже.Все три теории требуют экспериментальных данных для определения
константы для каждого типа поверхности и каждого адсорбирующего газа.
Типичное поведение различных изотерм приведено в рисунок ниже.
Адсорбция паров на частицах обычно определяется коэффициент разделения, который указывает на разделение химического вещества в газовой фазе и фазе частиц.Этот коэффициент разделения задается выражением:
, где K p — это
зависящий от температуры коэффициент разделения, м 3 мг -1 ,
M t теперь представляет собой общую массовую концентрацию атмосферного аэрозоля в мг m -3 ,
и c aer и c g являются аэрозольными
массовые концентрации газа в мг м -3 . Чем больше масса аэрозоля М t , тем больше газа,
могут быть адсорбированы частицей. А
больше K p означает, что больше
химические вещества будут адсорбироваться аэрозолем.
Чем больше масса аэрозоля М t , тем больше газа,
могут быть адсорбированы частицей. А
больше K p означает, что больше
химические вещества будут адсорбироваться аэрозолем.
Для чисто физической адсорбции коэффициент распределения K p можно найти по выражению:
где N s – поверхностная концентрация сорбции (сайты cm -3 ), a s – удельная площадь аэрозолей (m 2 g -1 ), Q l — энтальпия десорбции с поверхности (кДж·моль -1 ), Q v — энтальфия испарение химического вещества в виде жидкости (кДж моль -1 ), R — газ постоянная, T – температура (K), p o — давление паров химического вещества в виде жидкости (гПа).
Лабораторные исследователи попытались подобрать это выражение с уравнением вида:
, где m = -1 и b r = -7,8
для полициклических ароматических углеводородов (ПАУ) и b r = -8,5 для хлорорганических соединений.
Температурная зависимость K p задается выражением:
где A p — константа это зависит от хим.
Коэффициенты для выбранных ПАУ представлены в следующей таблице.
Химический состав: Резюме.
Типичный химический состав аэрозолей можно увидеть на следующую таблицу и рисунок.
Некоторые типичные фракции состава аэрозоля:
средний городской штраф (33 мг м -3 ) | средний удаленный штраф (5 мг м -3 ) | ||
видов | процентов | видов | процентов |
СО 4 | 28 | СО 4 | 22 |
№ 3 | 6 | № 3 | 3 |
НХ 4 | 8 | НХ 4 | 7 |
C-элемент | 9 | C-элемент | 0. |
С-органик | 31 | С-органик | 11 |
неизвестно | 18 | неизвестно | 57 |
Мы также можем видеть две наиболее важные характеристики распределения аэрозолей по размерам и химические композиция на следующем рисунке.
Мы видим, что существует широкий диапазон количества аэрозолей и
массовые концентрации, и совсем другое количество и размер объема
дистрибутивы. мы увидим
важность этих различий, когда мы обсуждаем атмосферную химию и
климат в главе 8.
мы увидим
важность этих различий, когда мы обсуждаем атмосферную химию и
климат в главе 8.
Стандартные методы испытаний для определения массовой доли углерода, азота и кислорода в порошке нитрида кремния
Лицензионное соглашение ASTM
ВАЖНО — ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ВХОДОМ В ЭТОТ ПРОДУКТ ASTM.
Приобретая подписку и нажимая на это соглашение, вы вступаете в
контракт, и подтверждаете, что прочитали настоящее Лицензионное соглашение, что вы понимаете
его и соглашаетесь соблюдать его условия. Если вы не согласны с условиями настоящего Лицензионного соглашения,
немедленно покиньте эту страницу, не входя в продукт ASTM.
1.Право собственности:
Этот Продукт защищен авторским правом, как
компиляции и в виде отдельных стандартов, статей и/или документов («Документы») ASTM
(«ASTM»), 100 Barr Harbour Drive, West Conshohocken, PA 19428-2959 USA, за исключением случаев, когда
прямо указано в тексте отдельных документов. Все права защищены. Ты
(Лицензиат) не имеет прав собственности или иных прав на Продукт ASTM или Документы.Это не продажа; все права, право собственности и интерес к продукту или документам ASTM
(как в электронном, так и в печатном виде) принадлежат ASTM. Вы не можете удалять или скрывать
уведомление об авторских правах или другое уведомление, содержащееся в Продукте или Документах ASTM.
Все права защищены. Ты
(Лицензиат) не имеет прав собственности или иных прав на Продукт ASTM или Документы.Это не продажа; все права, право собственности и интерес к продукту или документам ASTM
(как в электронном, так и в печатном виде) принадлежат ASTM. Вы не можете удалять или скрывать
уведомление об авторских правах или другое уведомление, содержащееся в Продукте или Документах ASTM.
2. Определения.
A. Типы лицензиатов:
(i) Индивидуальный пользователь:
один уникальный компьютер с индивидуальным IP-адресом;
(ii) Одноместный:
одно географическое местоположение или несколько
объекты в пределах одного города, входящие в состав единой организационной единицы, управляемой централизованно;
например, разные кампусы одного и того же университета в одном городе управляются централизованно.
(iii) Multi-Site:
организация или компания с
независимое управление несколькими точками в одном городе; или организация или
компания, расположенная более чем в одном городе, штате или стране, с центральным управлением для всех местоположений.
B. Авторизованные пользователи:
любое лицо, подписавшееся
к этому Продукту; если Site License также включает зарегистрированных студентов, преподавателей или сотрудников,
или сотрудник Лицензиата на Одном или Множественном Сайте.
3. Ограниченная лицензия.
ASTM предоставляет Лицензиату ограниченное,
отзывная, неисключительная, непередаваемая лицензия на доступ посредством одного или нескольких
авторизованные IP-адреса и в соответствии с условиями настоящего Соглашения использовать
разрешенных и описанных ниже, каждого Продукта ASTM, на который Лицензиат подписался.
А.Специальные лицензии:
(i) Индивидуальный пользователь:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов исключительно для собственного использования Лицензиатом.
То есть Лицензиат может получить доступ к электронному файлу Документа (или его части) и загрузить его.
Документа) для временного хранения на одном компьютере в целях просмотра и/или
печать одной копии документа для личного пользования.Ни электронный файл, ни
единственный печатный отпечаток может быть воспроизведен в любом случае. Кроме того, электронный
файл не может распространяться где-либо еще по компьютерным сетям или иным образом.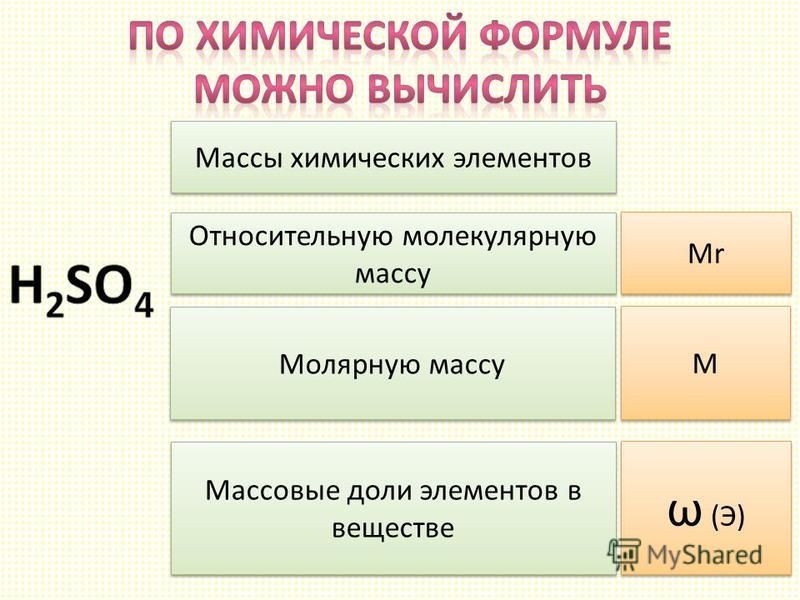 Это
электронный файл нельзя отправить по электронной почте, загрузить на диск, скопировать на другой жесткий диск или
в противном случае разделены. Одна печатная копия может быть распространена среди других только для их
внутреннее использование в вашей организации; его нельзя копировать.Индивидуальный загруженный документ
иным образом не может быть продана или перепродана, сдана в аренду, сдана в аренду, одолжена или сублицензирована.
Это
электронный файл нельзя отправить по электронной почте, загрузить на диск, скопировать на другой жесткий диск или
в противном случае разделены. Одна печатная копия может быть распространена среди других только для их
внутреннее использование в вашей организации; его нельзя копировать.Индивидуальный загруженный документ
иным образом не может быть продана или перепродана, сдана в аренду, сдана в аренду, одолжена или сублицензирована.
(ii) Односайтовые и многосайтовые лицензии:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов для личных целей Авторизованного пользователя. использовать и передавать такие копии другим Авторизованным пользователям Лицензиата в компьютерной сети Лицензиата;
использовать и передавать такие копии другим Авторизованным пользователям Лицензиата в компьютерной сети Лицензиата;
(c) если образовательное учреждение, Лицензиату разрешается предоставлять печатная копия отдельных Документов отдельным учащимся (Авторизованные пользователи) в классе по месту нахождения Лицензиата;
(d) право отображать, загружать и распространять печатные копии Документов для обучения Авторизованных пользователей или групп Авторизованных пользователей.
(e) Лицензиат проведет всю необходимую аутентификацию и процессы проверки, чтобы гарантировать, что только авторизованные пользователи могут получить доступ к продукту ASTM.
(f) Лицензиат предоставит ASTM список авторизованных
IP-адреса (числовые IP-адреса домена) и, если многосайтовый, список авторизованных сайтов.
Б.Запрещенное использование.
(i) Настоящая Лицензия описывает все разрешенные виды использования. Любой другой использование запрещено, является нарушением настоящего Соглашения и может привести к немедленному прекращению действия настоящей Лицензии.
(ii) Авторизованный пользователь не может производить этот Продукт, или Документы, доступные любому, кроме другого Авторизованного Пользователя, будь то по интернет-ссылке, или разрешив доступ через его или ее терминал или компьютер; или другими подобными или отличными средствами или договоренностями.
(iii) В частности, никто не имеет права передавать, копировать,
или распространять любой Документ любым способом и с любой целью, за исключением случаев, описанных в Разделе
3 настоящей Лицензии без предварительного письменного разрешения ASTM. Особенно,
за исключением случаев, описанных в Разделе 3, никто не может без предварительного письменного разрешения
ASTM: (a) распространять или пересылать копию (электронную или иную) любой статьи, файла,
или материал, полученный из любого продукта или документа ASTM; (b) воспроизводить или фотокопировать любые
стандарт, статья, файл или материал из любого продукта ASTM; в) изменять, видоизменять, приспосабливать,
или переводить любой стандарт, статью, файл или материал, полученный из любого продукта ASTM;
(d) включать любой стандарт, статью, файл или материал, полученный из любого продукта ASTM или
Документировать в других произведениях или иным образом создавать любые производные работы на основе любых материалов.
получено из любого продукта или документа ASTM; (e) взимать плату за копию (электронную или
иным образом) любого стандарта, статьи, файла или материала, полученного из любого продукта ASTM или
Документ, за исключением обычных расходов на печать/копирование, если такое воспроизведение разрешено
по разделу 3; или (f) систематически загружать, архивировать или централизованно хранить существенные
части стандартов, статей, файлов или материалов, полученных из любого продукта ASTM или
Документ.
Особенно,
за исключением случаев, описанных в Разделе 3, никто не может без предварительного письменного разрешения
ASTM: (a) распространять или пересылать копию (электронную или иную) любой статьи, файла,
или материал, полученный из любого продукта или документа ASTM; (b) воспроизводить или фотокопировать любые
стандарт, статья, файл или материал из любого продукта ASTM; в) изменять, видоизменять, приспосабливать,
или переводить любой стандарт, статью, файл или материал, полученный из любого продукта ASTM;
(d) включать любой стандарт, статью, файл или материал, полученный из любого продукта ASTM или
Документировать в других произведениях или иным образом создавать любые производные работы на основе любых материалов.
получено из любого продукта или документа ASTM; (e) взимать плату за копию (электронную или
иным образом) любого стандарта, статьи, файла или материала, полученного из любого продукта ASTM или
Документ, за исключением обычных расходов на печать/копирование, если такое воспроизведение разрешено
по разделу 3; или (f) систематически загружать, архивировать или централизованно хранить существенные
части стандартов, статей, файлов или материалов, полученных из любого продукта ASTM или
Документ.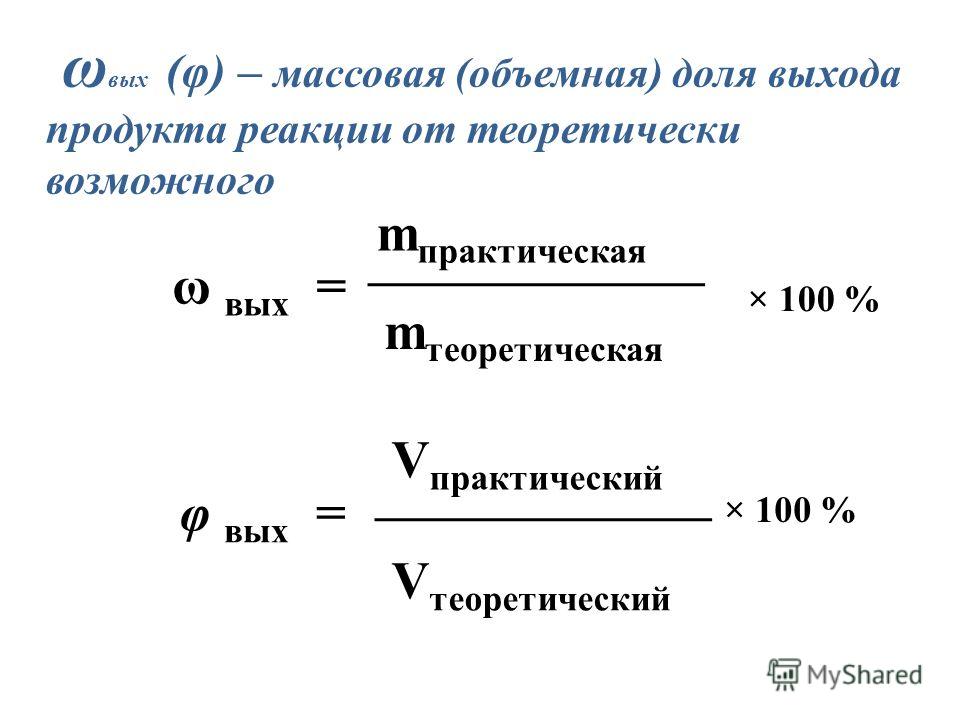 Включение печатных или электронных копий в пакеты курсов или электронные резервы,
или для использования в дистанционном обучении, не разрешено настоящей Лицензией и запрещено без
Предварительное письменное разрешение ASTM.
Включение печатных или электронных копий в пакеты курсов или электронные резервы,
или для использования в дистанционном обучении, не разрешено настоящей Лицензией и запрещено без
Предварительное письменное разрешение ASTM.
(iv) Лицензиат не может использовать Продукт или доступ к Продукт в коммерческих целях, включая, помимо прочего, продажу Документов, материалы, платное использование Продукта или массовое воспроизведение или распространение Документов в любой форме; а также Лицензиат не может взимать с Авторизованных пользователей специальные сборы за использование Продукт сверх разумных расходов на печать или административные расходы.
C. Уведомление об авторских правах . Все копии материала из ASTM
Продукт должен иметь надлежащее уведомление об авторских правах от имени ASTM, как показано на начальной странице. каждого стандарта, статьи, файла или материала. Сокрытие, удаление или изменение
уведомление об авторских правах не допускается.
каждого стандарта, статьи, файла или материала. Сокрытие, удаление или изменение
уведомление об авторских правах не допускается.
4. Обнаружение запрещенного использования.
A. Лицензиат несет ответственность за принятие разумных мер для предотвращения запрещенного использования и незамедлительного уведомления ASTM о любых нарушениях авторских прав или запрещенное использование, о котором Лицензиату стало известно. Лицензиат будет сотрудничать с ASTM при расследовании любого такого запрещенного использования и предпримет разумные шаги для обеспечения прекращение такой деятельности и предотвращение ее повторения.
B. Лицензиат должен прилагать все разумные усилия для защиты
Продукт от любого использования, не разрешенного настоящим Соглашением, и уведомляет
ASTM о любом использовании, о котором стало известно или о котором было сообщено.
5. Постоянный доступ к продукту.
ASTM резервирует
право прекратить действие настоящей Лицензии после письменного уведомления, если Лицензиат существенно нарушит
условия настоящего Соглашения.Если Лицензиат не оплачивает ASTM какую-либо лицензию или
абонентской платы в установленный срок, ASTM предоставит Лицензиату 30-дневный период в течение
что бы вылечить такое нарушение. Для существенных нарушений период устранения не предоставляется
связанные с нарушениями Раздела 3 или любыми другими нарушениями, которые могут привести к непоправимым последствиям ASTM.
вред. Если подписка Лицензиата на Продукт ASTM прекращается, дальнейший доступ к
онлайн-база данных будет отклонена.Если Лицензиат или Авторизованные пользователи существенно нарушают
настоящую Лицензию или запрещать использование материалов в любом продукте ASTM, ASTM оставляет за собой право
право отказать Лицензиату в любом доступе к Продукту ASTM по собственному усмотрению ASTM.
6. Форматы доставки и услуги.
A. Некоторые продукты ASTM используют стандартный интернет-формат HTML. ASTM оставляет за собой право изменить такой формат с уведомлением Лицензиата за три [3] месяца, хотя ASTM приложит разумные усилия для использования общедоступных форматов. Лицензиат и Авторизованные пользователи несут ответственность за получение за свой счет подходящие подключения к Интернету, веб-браузеры и лицензии на любое необходимое программное обеспечение для просмотра продуктов ASTM.
B. Продукты ASTM также доступны в Adobe Acrobat
(PDF) Лицензиату и его Авторизованным пользователям, которые несут единоличную ответственность за установку
и настройка соответствующего программного обеспечения Adobe Acrobat Reader.
C. ASTM приложит разумные усилия для обеспечения онлайн-доступа
доступны на постоянной основе. Доступность будет зависеть от периодического
перерывы и простои для обслуживания сервера, установки или тестирования программного обеспечения,
загрузка новых файлов и причины, не зависящие от ASTM. ASTM не гарантирует доступ,
и не несет ответственности за ущерб или возврат средств, если Продукт временно недоступен,
или если доступ становится медленным или неполным из-за процедур резервного копирования системы,
объем трафика, апгрейды, перегрузка запросов к серверам, общие сбои сети
или задержки, или любая другая причина, которая может время от времени делать продукт недоступным
для Лицензиата или Авторизованных пользователей Лицензиата.
7. Условия и сборы.
A. Срок действия настоящего Соглашения _____________ («Период подписки»). Доступ к Продукту предоставляется только на Период Подписки. Настоящее Соглашение останется в силе после этого для последовательных Периодов подписки при условии, что ежегодная абонентская плата, как таковая, может меняются время от времени, оплачиваются.Лицензиат и/или ASTM имеют право расторгнуть настоящее Соглашение. в конце Периода подписки путем письменного уведомления, направленного не менее чем за 30 дней.
B. Сборы:
8. Проверка.
ASTM имеет право проверять соответствие
с настоящим Соглашением, за свой счет и в любое время в ходе обычной деятельности
часы. Для этого ASTM привлечет независимого консультанта при соблюдении конфиденциальности.
соглашение, для проверки использования Лицензиатом Продукта и/или Документов ASTM. Лицензиат соглашается
разрешить доступ к своей информации и компьютерным системам для этой цели. Проверка
состоится после уведомления не менее чем за 15 дней, в обычные рабочие часы и в
таким образом, чтобы не создавать необоснованного вмешательства в деятельность Лицензиата.Если
проверка выявляет нелицензионное или запрещенное использование продуктов или документов ASTM,
Лицензиат соглашается возместить ASTM расходы, понесенные при проверке и возмещении
ASTM для любого нелицензированного/запрещенного использования. Применяя эту процедуру, ASTM не отказывается от
любое из своих прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности путем
любым другим способом, разрешенным законом.
Для этого ASTM привлечет независимого консультанта при соблюдении конфиденциальности.
соглашение, для проверки использования Лицензиатом Продукта и/или Документов ASTM. Лицензиат соглашается
разрешить доступ к своей информации и компьютерным системам для этой цели. Проверка
состоится после уведомления не менее чем за 15 дней, в обычные рабочие часы и в
таким образом, чтобы не создавать необоснованного вмешательства в деятельность Лицензиата.Если
проверка выявляет нелицензионное или запрещенное использование продуктов или документов ASTM,
Лицензиат соглашается возместить ASTM расходы, понесенные при проверке и возмещении
ASTM для любого нелицензированного/запрещенного использования. Применяя эту процедуру, ASTM не отказывается от
любое из своих прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности путем
любым другим способом, разрешенным законом. Лицензиат признает и соглашается с тем, что ASTM может внедрять
определенная идентифицирующая или отслеживающая информация в продуктах ASTM, доступных на Портале.
Лицензиат признает и соглашается с тем, что ASTM может внедрять
определенная идентифицирующая или отслеживающая информация в продуктах ASTM, доступных на Портале.
9. Пароли:
Лицензиат должен немедленно уведомить ASTM
о любом известном или предполагаемом несанкционированном использовании(ях) своего пароля(ей) или о любом известном или предполагаемом
нарушение безопасности, включая утерю, кражу, несанкционированное раскрытие такого пароля
или любой несанкционированный доступ или использование Продукта ASTM.Лицензиат несет исключительную ответственность
для сохранения конфиденциальности своего пароля (паролей) и для обеспечения авторизованного
доступ и использование Продукта ASTM. Личные учетные записи/пароли не могут быть переданы.
10. Отказ от гарантии:
Отказ от гарантии:
Если не указано иное в настоящем Соглашении,
все явные или подразумеваемые условия, заверения и гарантии, включая любые подразумеваемые
гарантия товарного состояния, пригодности для определенной цели или ненарушения прав
отказываются от ответственности, за исключением случаев, когда такие отказы признаются юридически недействительными.
11. Ограничение ответственности:
В пределах, не запрещенных законом,
ни при каких обстоятельствах ASTM не несет ответственности за любые потери, повреждения, потерю данных или за особые, косвенные,
косвенные или штрафные убытки, независимо от теории ответственности,
возникающие в результате или в связи с использованием продукта ASTM или загрузкой документов ASTM.
Ни при каких обстоятельствах ответственность ASTM не будет превышать сумму, уплаченную Лицензиатом по настоящему Лицензионному соглашению.
12. Общие.
A. Прекращение действия:
Настоящее Соглашение действует до
прекращено. Лицензиат может расторгнуть настоящее Соглашение в любое время, уничтожив все копии
(на бумажном, цифровом или любом носителе) Документов ASTM и прекращении любого доступа к Продукту ASTM.
B. Применимое право, место проведения и юрисдикция:
Это
Соглашение должно толковаться и толковаться в соответствии с законодательством
Содружество Пенсильвании.Лицензиат соглашается подчиняться юрисдикции и месту проведения
в суды штата и федеральные суды Пенсильвании по любому спору, который может возникнуть в соответствии с настоящим
Соглашение. Лицензиат также соглашается отказаться от любых претензий на неприкосновенность, которыми он может обладать.
C. Интеграция:
Настоящее Соглашение представляет собой полное соглашение
между Лицензиатом и ASTM в отношении его предмета. Он заменяет все предыдущие или
одновременные устные или письменные сообщения, предложения, заверения и гарантии
и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любой цитаты, заказа, подтверждения,
или другое сообщение между сторонами, относящееся к его предмету в течение срока действия
настоящего Соглашения.Никакие изменения настоящего Соглашения не будут иметь обязательной силы, если они не будут в письменной форме
и подписан уполномоченным представителем каждой стороны.
D. Переуступка:
Лицензиат не может уступать или передавать
свои права по настоящему Соглашению без предварительного письменного разрешения ASTM.
 Какой объем этой газовой смеси будет
содержать 4,6 мл метана?
Какой объем этой газовой смеси будет
содержать 4,6 мл метана?
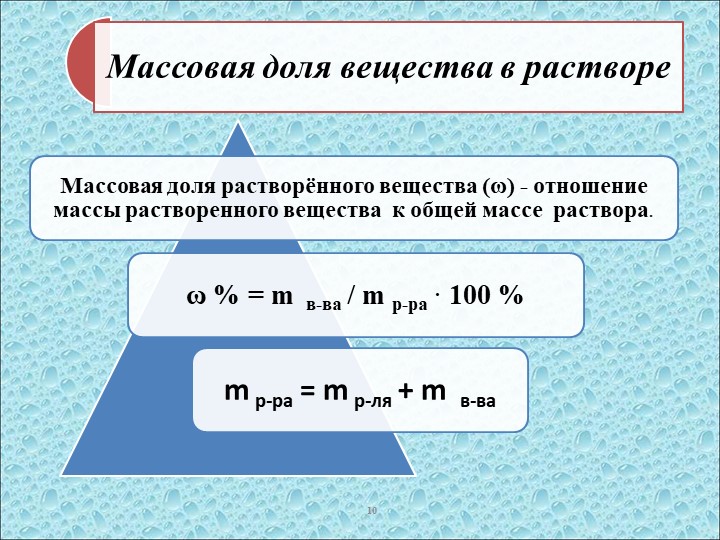



 3
3