Вопрос 34
Вопрос 34
Обратимые и необратимые химические реакции
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇆ 2NH3
Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇆ 2NO2
складывается из элементарных реакций
N2O4 ⇆ 2NO2 и 2NO2 ⇆ N2O4
Для обратимости сложной (многостадийной) реакции, необходимо, чтобы были обратимы все составляющие её стадии.
Для обратимых реакций уравнение принято записывать следующим образом А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании
2КСlО3 > 2КСl + ЗО2,
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
studfile.net
Обратимые и необратимые реакции
Очень часто химические реакции протекают так, что первичные реагирующие вещества полностью преобразуются в продукты реакции. К примеру, если в соляную кислоту положить гранулу цинка, то при определенном (достаточном) количестве кислоты реакция будет протекать до полного растворения цинка согласно уравнению: 2HCL + ZN = ZnCl
Если провести данную реакцию в обратном направлении, другими словами – пропустить водород через раствор хлорида цинка, то металлический цинкне образуется – данная реакция не может протекать в обратном направлении, поэтому она необратима.
Химическая реакция, в результате которой первичные вещества практически полностью преобразуются в конечные продукты, называется необратимой.
 К подобным реакциям имеют отношение как гетерогенные, так и гомогенные реакции. К примеру, реакции горения простых веществ – метана Ch5, сероуглерода CS2. Как мы уже знаем, реакции горения относятся к экзотермическим реакциям. В большинстве случаев к экзотермическим реакциям относятся реакции соединения, к примеру, реакция гашения извести: CaO + H 2O = Ca(OH)2 + Q (выделяется теплота).
К подобным реакциям имеют отношение как гетерогенные, так и гомогенные реакции. К примеру, реакции горения простых веществ – метана Ch5, сероуглерода CS2. Как мы уже знаем, реакции горения относятся к экзотермическим реакциям. В большинстве случаев к экзотермическим реакциям относятся реакции соединения, к примеру, реакция гашения извести: CaO + H 2O = Ca(OH)2 + Q (выделяется теплота).
Будет логично предполагать что, к эндотермическим реакциям принадлежат обратные реакции, т.е. реакция разложения. К примеру, реакция обжига известняка: CaCo3 = CaO + CO2 – Q (теплота поглощается).
Необходимо помнить, что число необратимых реакций является не таким уж и большим.
Гомогенные реакции (между растворами веществ) являются необратимыми, если проходят с образованием нерастворимого, газообразного продукта или воды. Данное правило получило название » правило Бертолле». Проведем опыт. Возьмем три пробирки и нальем в них по 2мл раствора соляной кислоты. В первый сосуд добавим 1 мл окрашенный фенолфталеином малиновый раствор щелочи, он потеряет цвет в следствие реакции: HCl + NaOH = NaCl + H2O.
Во вторую пробирку добавим 1 мл раствора карбоната натрия – мы увидим бурную реакцию кипения, которая обусловлена выделением углекислого газа: Na
В третью пробирку добавим немного капель нитрата серебра и увидим, как в ней образовался беловатый осадок хлорида серебра: HCl + AgNO3 = AgCl↓ + HNO3.
Большинство реакций являются обратимыми. Необратимых реакций не особенно много.
Химические реакции, которые могут проходить одновременно в двух противоположных направлениях – прямом и обратном, – называются обратимыми.
 Нальем в пробирку 3 мл воды и добавим несколько кусочков лакмуса, а потом начнем пропускать через нее с помощью газоотводной трубки выходящий из другого сосуда углекислый газ, который образуется из-за взаимодействия мрамора и соляной кислоты. Спустя некоторое время мы увидим, как фиолетовый лакмус станет красным, это свидетельствует о наличии кислоты. Мы получили непрочную угольную кислоту, которая образовалась путем связи углекислого газа и воды: CO 2 + H2O = H2CO3.
Нальем в пробирку 3 мл воды и добавим несколько кусочков лакмуса, а потом начнем пропускать через нее с помощью газоотводной трубки выходящий из другого сосуда углекислый газ, который образуется из-за взаимодействия мрамора и соляной кислоты. Спустя некоторое время мы увидим, как фиолетовый лакмус станет красным, это свидетельствует о наличии кислоты. Мы получили непрочную угольную кислоту, которая образовалась путем связи углекислого газа и воды: CO 2 + H2O = H2CO3.
Оставим данный раствор в штативе. Спустя некоторое время мы обратим внимание на то, что раствор опять стал фиолетовым. Кислота разложилась на исходные составляющие: H2CO3 = H2O + CO2.
Данный процесс будет происходить намного быстрее, если мы подогреем раствор угольной кислоты. Таким образом, мы выяснили, что реакция получения угольной кислоты может протекать как в прямом, так и в обратном направлении, а значит, она является обратимой. Обратимость реакции обозначается на письме двумя противоположно направленными стрелками: CO2 + H2O ↔ H2CO3.
Среди обратимых реакций, которые лежат в основе получения важныххимических продуктов, приведем в качестве примера реакцию синтеза оксида серы (VI) из оксида серы (IV) и кислорода: 2SO
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
10)Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье. Смещение равновесий, примеры.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3h3 + N2 ⇌ 2Nh4.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + h3SO4 → 2HClO2 + BaSO4↓
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
Принцип Ле Шателье — Брауна
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3h3↔2Nh4 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. N2 + 3h3 2Nh4 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования Nh4, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:давление, МПа 0,1 10 20 30 60 100
объемная доля Nh4, % 0,4 26 36 46 66 80
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина — скорость химической реакции.
Скорость реакции — это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,химические реакции при высоких температурах протекают быстрее, чем при низких температурах
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза.
Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа :

Правило Вант — Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние, оказываемое катализаторами на химические реакции, называется катализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:

Из кинетического уравнения уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
studfile.net
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов » HimEge.ru
Состояние равновесия характерно для обратимых химических реакций.
- Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
- Необратимой называется реакция, которая идет практически до конца в одном направлении. Условия необратимости реакции – образование осадка, газа или слабого электролита. Например:BaCl2 + H2SO4 = BaSO4 + 2HClK2S + 2HCl = 2KCl + H2SHCl + NaOH = NaCl + H2O.
- Химическое равновесие — состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются. Смещение равновесия в нужном направлении достигается изменением условий реакции.
Принцип Ле-Шателье — внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
- Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
- Повышение температуры смещает равновесие в сторону эндотермической реакции.
- Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в стoрону прямой реакции.
- Катализаторы не влияют на положение равновесия, а только ускоряет его достижение.
Задания А 21 ЕГЭ по химии тест онлайн
himege.ru
Обратимые и необратимые химические реакции
Реакция называется необратимой, если в результате образуются газ, осадок или слабодиссицирующие вещество, например, вода. Например, реакция: HСℓ + NaOH = NaСℓ + H2O.
Химическая реакция не всегда «доходит до конца», другими словами, исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания реакции в противоположенном направлении.
Химические
реакции, которые могут идти и в
противоположенных направлениях,
называются обратимыми.
Например, реакция получения аммиака:
N2(t)
+ 3H2(t)  2NH3
2NH3
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
Принцип Ле Шателье
Состояния химического равновесия при неизменных внешних условиях могут сохраняться бесконечно долго. В реальной действительности при изменении температуры, давления или концентрации реагентов «равновесие» может сместиться в ту или иную сторону.
Согласно принципу Ле Шателье внешнее воздействие на систему, находящуюся в равновесии, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется. Таким образом, внешнее воздействие на систему изменяет соотношение между скоростями прямого и обратного процесса, благопрепятствуя тому из них, который противодействует внешнему влиянию. Например, в реакции получения аммиака, чтобы увеличить выход продукта (аммиака) надо увеличить давление. При этом равновесие нарушается – увеличивается скорость прямой реакции.
Тепловой эффект реакции
Для каждого химического соединения теплота разложения равна теплоте его образования, но имеет противоположенный знак. Так при разложении 1 моля метана на углерод и водород поглощается 49 кДж теплоты:
CH4 C + 2H2 – 49 кДж;
C + 2H2 – 49 кДж;
А при соединении углерода и водорода выделяется 49 кДж теплоты:
C
+ 2H2 CH4 + 49 кДж.
CH4 + 49 кДж.
10.6. Методы качественного и количественного анализа
Определение характеристик атомных и молекулярных частиц (их структуры и состава) в аналитической химии называют качественным анализом, а измерение их относительного содержания – количественным анализом. Новые методы качественного и количественного анализа основываются на последних достижениях различных областей естествознания и в первую очередь физики. Методы аналитической химии широко применяются во многих отраслях: в химии, медицине, сельском хозяйстве, геологии, экологии и т. п.
Для анализа и идентификации структуры сложных молекул, объединяющих большое количество атомов с различными взаимными связями, широко применяются основанные на физических принципах экспериментальные методы ядерного, магнитного резонанса, оптической спектроскопии, масс-спектроскопии, рентгеноструктурного анализа, нейтронографии и др.
Метод ядерного магнитного резонанса основан на анализе резонансного поглощения электромагнитных волн. Данный метод – один из важнейших в различных областях естествознания и особенно в химии.
Оптическая спектроскопия позволяет анализировать спектр излучения вещества, находящегося в различных агрегатных состояниях: твердом, жидком и газообразном. Спектральный анализ – физический метод качественного и количественного определения состава вещества по его оптическому спектру излучения.
В масс-спектроскопии исследуемое вещество вначале превращается в газовую фазу, затем газ ионизируется и ионы ускоряются электрическим полем до заданной кинетической энергии. Масса частиц может быть определена двумя способами: измерением радиуса кривизны траектории иона и измерением времени пролета им заданного расстояния. Масс-спектроскопия широко применяется для анализа химических элементов, определения изотопного состава и строения молекул в таких областях, как производство интегральных схем, металлургия, ядерная, нефтяная и фармацевтическая промышленность. Сочетание хроматографа с масс-спектрометром – лучший аналитический прибор для работы со сложными смесями, позволяющий решать разнообразные задачи химии, экологии, криминалистики и других наук.
Современные электрохимические методы в сочетании с высокочувствительной аппаратурой открывают новые возможности для исследования структуры и функций живой клетки: с помощью электродов, площадь которых составляет всего лишь несколько микрометров, можно регистрировать процессы, происходящие внутри клетки.
Один из наиболее распространенных методов исследования молекулярных структур – рентгеноструктурный анализ, основанный на явлении дифракции. Рентгеноструктурный анализ дополняет нейтронография; для неё необходимы потоки нейтронов, которые формируются с применением радиоактивных изотопов, что несколько ограничивает применение данного метода. Отличительная особенность нейтронографии – высокая точность определения относительного расстояния между атомами. Она успешно применяется при определении структур сверхполупроводников, рибосом и других сложных молекулярных образований.
studfile.net
10. Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.

ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Принцип Ле-Шателье
«Всякая система, находящаяся в состоянии термодинамического равновесия, претерпевает в результате изменения одного из параметров термодинамического равновесия такие смещения других её параметров, которые, происходя сами по себе, вызвали бы изменение рассматриваемого параметра в противоположном направлении (то есть возникает некоторое сопротивление системы отклонению от равновесия)».
Влияние концентрации
Концентрация влияет на состояние равновесия следующим образом:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
В качестве иллюстрации рассмотрим реакцию угарного газа с водородом, с образованием метилового спирта:
CO + 2 H2 ↔ CH3OH
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. Для примера рассмотрим реакцию взаимодействия азота с водородом с образованием аммиака:
N2 + 3 H2 ↔ 2 NH3 + Q,
где Q = 92 кДж на 1 моль.
Прямая реакция — экзотермическая, идущая с выделением тепла а обратная реакция — эндотермическая, требующая поглощения тепла.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
При повышении температуры химическое равновесие смещается в направлении исходных веществ реакции;
При понижении температуры химическое равновесие смещается в направлении продуктов реакции.
Следовательно, в приведённой реакции по мере выделения тепла растёт температура, что снижает выход аммиака.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам реакции, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов реакции) с меньшим объемом;
При понижении давления равновесие сдвигается в направлении образования веществ с большим объемом;
При равенстве объёмов исходных веществ и продуктов реакции давление не влияет на равновесие реакции.
Рассмотрим снова реакцию азота с водородом:
N2 + 3 H2 ↔ 2 NH3
11.Химическая кинетка, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
Химическая кинетика — это наука о скоростях и механизмах химических превращений, о явлениях, сопровождающих эти превращения, и о факторах, влияющих на них.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
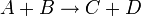
выражение для скорости будет выглядеть так:
 .
.
Средняя скорость реакции равна изменению концентрации реагирующих веществ в единицу времени (в пределах некоторого промежутка времени дельта t). V = — дельтаC / дельта t Это формула средней скорости по одному из исходных веществ — изменение концентрации этого вещества за промежуток времени дельта t. Знак минус поставлен, чтобы скорость не была отрицательной, поскольку дельтаС — отрицательная величина, концентрация исходного вещества убывает по ходу реакции. Если записывать скорость через концентрацию любого из продуктов реакции, то знак минус не нужен, потому что концентрация продукта реакции возрастает со временем. Таким образом, скорость реакции можно записать через изменение концентрации ЛЮБОГО из реагирующих веществ в единицу времени. Если вместо дельта С / дельта t записать производную (предел этого отношения при дельта t стремится к нулю), то будет не средняя, а мгновенная скорость реакции.
studfile.net
Обратимые и необратимые реакции.
Реакции обмена в водных растворах электролитов могут быть обратимыми и необратимыми.
● Обратимыми реакциями называются реакции, которые могут протекать в двух направлениях одновременно.
Например:
NaCl + KNO3 NaNO3 + KCl
(молекулярное уравнение)
NaNO3 + KCl
(молекулярное уравнение)
Na+ + Cl— + K+ + NO3— Na+ + NO3— + K+ + Cl— (полное ионное уравнение)
Na+ + NO3— + K+ + Cl— (полное ионное уравнение)
Данная реакция фактически не протекает.
● Необратимыми реакциями называются реакции, которые протекают только в одном направлении, т.е. «протекают до конца».
Например:
Na2CO3 + 2HCl 2NaCl + CO2 + H2O (молекулярное уравнение)
2Na+ + CO32- + 2H+ + 2Cl— 2Na+ + 2Cl— + CO2 + H2O (полное ионное уравнение)
CO32- + 2H+ CO2 + H2O (сокращённое ионное уравнение)
Условия необратимости реакций (условия протекания реакций до конца):
1. Образование осадка.
К2SО4 + BаСl2 BaSО4 + 2КСl
2К+ + SО42- + Bа2+ + 2Сl— BаSО4 + 2К+ + 2Сl—
SО42- + Bа2- BаSО4
2. Выделение газа.
Na2S + 2HCl 2NaCl + H2S
2Na+ + S2- + 2H+ + 2Cl— 2Na+ + 2Cl— + H2S
S2- + 2H+ H2S
3. Образование малодиссоциирующего соединения (слабого электролита или воды).
NaOH + HCl NaCl + H2O
Na+ + OH— + H+ + Cl— Na+ + Cl— + H2O
OH— + H+ H2O
4. Образование комплексного соединения.
NaOH + Al(OH)3 NaAl(OH)4
Na+ + OH— + Al(OH)3 Na+ + Al(OH)4—
OH— + Al(OH)3 Al(OH)4—
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе. В соответствии с законом действующих масс скорость реакции прямопропорциональна произведению концентрации реагирующих веществ. Следовательно, не возможность протекания обратной реакции в случае её необратимости объясняется тем, что концентрациях ионов в растворе уменьшается (ионы связываются в молекулы неэлектролитов), скорость обратной реакции стремится к нулю.
Вывод: реакции в растворах электролитов могут протекать лишь только в том случае, если участвующие во взаимодействии ионы полностью или частично уходят из сферы реакции (в виде газа, осадка, слабого электролита или комплексного соединения).
Лекция 9
Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
Представитель любого класса неорганических соединений имеет общие свойства, характерные для всего класса, а также специфические свойства, которые проявляются только у данного вещества. В данном случае мы рассматриваем только общие свойства, которые будут характерны для всего класса соединений (кислот, оснований и солей). Так как оксиды являются неэлектролитами, то их химические свойства не рассматриваются.
Химические свойства кислот в свете теории электролитической диссоциации.
1. Диссоциация. Изменение окраски индикаторов.
HCl  H+ + Cl—
H+ + Cl—
Так как при диссоциации образуются катионы водорода (протоны), то среда кислая. Следовательно, лакмус – красный, фенолфталеин – бесцветный.
2. Взаимодействие с металлами, стоящими в ряду активности металлов до водорода.
Ва + 2HCl ВаCl2 + H2
Ва + 2H+ + 2Cl— Ва2+ + 2Cl— + H2
Ва + 2H+ Ва2+ + H2
3. Взаимодействие с основными и амфотерными оксидами. Амфотерные оксиды (например, Al2O3, ZnO и др.) в данном случае проявляют свойства основных оксидов.
ВаO + 2HCl ВаCl2 + H2O
ВаO + 2H+ + 2Cl— Ва2+ + 2Cl— + H2O
ВаO + 2H+ Ва2+ + H2O
4. Взаимодействие с основаниями (реакция нейтрализации) и амфотерными гидроксидами. Амфотерные гидроксиды (например, Zn(OH)2, Al(OH)3 и др.) в данном случае проявляют основные свойства.
Ва(OН)2 + 2HCl ВаCl2 + 2H2O
Ва2+ + 2OН— + 2H+ + 2Cl— Ва2+ + 2Cl— + 2H2O
2OН— + 2H+ 2H2O
OН— + H+ H2O
5. Взаимодействие с солями более слабых или летучих кислот.
ВаСO3 + 2HCl ВаCl2 + СО2 + H2O
ВаСO3 + 2H+ + 2Cl— Ва2+ + 2Cl— + СО2 + H2O
ВаСO3 + 2H+ Ва2+ + СО2 + H2O
Все общие свойства кислот обусловлены наличием катионов водорода.
Химические свойства оснований в свете теории электролитической диссоциации.
1. Диссоциация. Изменение окраски индикаторов.
NaOH  Na+ + OH—
Na+ + OH—
Так как при диссоциации образуются гидроксид-ионы, то среда щелочная. Следовательно, лакмус – синий, фенолфталеин – малиновый.
2. Взаимодействие с кислотными и амфотерными оксидами. Амфотерные оксиды (например, Al2O3, ZnO и др.) в данном случае проявляют свойства кислотных оксидов.
SO3 + 2NaOH Na2SO4 + H2O
SO3 + 2Na+ + 2OH— 2Na+ + SO42- + H2O
SO3 + 2OH— SO42- + H2O
3. Взаимодействие с кислотами (реакция нейтрализации).
H2SO4 + 2NaOH Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH— 2Na+ + SO42- + 2H2O
2H+ + 2OH— 2H2O
H+ + OH— H2O
4. Взаимодействие с растворами солей.
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH— Cu(OH)2 + 2Na+ + SO42-
Cu2+ + 2OH— Cu(OH)2
Все общие свойства оснований обусловлены наличием гидроксид-ионов.
Химические свойства солей в свете теории электролитической диссоциации.
1. Диссоциация. Растворимые в воде соли диссоциируют на катион металла (ион аммония NH4+) и анион кислотного остатка.
СuSO4 Cu2+ + SO42-
Cu2+ + SO42-
Изменение окраски индикаторов в водных растворах солей индивидуально и зависит от гидролиза.
2. Взаимодействие растворов солей с более активными металлами.
Fe + CuSO4 Cu + FeSO4
Fe + Cu2+ + SO42- Cu + Fe2+ + SO42-
Fe + Cu2+ Cu + Fe2+
3. Взаимодействие с основаниями.
2NaOH + CuSO4 Cu(OH)2 + Na2SO4
2Na+ + 2OH— + Cu2+ + SO42- Cu(OH)2 + 2Na+ + SO42-
2OH— + Cu2+ Cu(OH)2
4. Взаимодействие с кислотами. При этом новая соль выпадает в осадок, либо образуется новая более слабая кислота.
2Н3РО4 + 3СuSO4 Cu3(PO4)2 + 3H2SO4
6Н+ + 2РО43- + 3Сu2+ + 3SO42- Cu3(PO4)2 + 6H+ + 3SO42-
2РО43- + 3Сu2+ Cu3(PO4)2
5. Взаимодействие с растворами солей.
BaCl2 + CuSO4 BaSO4 + CuCl2
Ba2+ + 2Cl— + Cu2+ + SO42- BaSO4 + Cu2+ + 2Cl—
Ba2+ + SO42- BaSO4
Все общие солей оснований обусловлены наличием катионов металла и анионами кислотного остатка.
Лекция 10
studfile.net