Реакции обратимые и необратимые — Справочник химика 21
Обратимые реакции становятся необратимыми и протекают до конца, если образующиеся вещества вы- [c.101]Все известные реакции делятся на химически необратимые и обратимые. Необратимые являются односторонними. К ним относятся взрывные процессы, разложение различных веществ (например, хлоратов и азидов), процессы перехода системы из состояния, [c.103]
Термодинамические потенциалы U, Н, F и G — функции состояния системы, свойства системы. Функцией состояния системы, свойством системы является и степень превращения е. Поэтому все производные в уравнении (VII.55) суть функции состояния и определяют свойства системы, независимо от того, каким путем протекала химическая реакция — обратимым или необратимым. [c.173]
Различают квазиобратимый, необратимый и обратимый электродные процессы.

Химические реакции можно разделить на обратимые и необратимые. Большинство химических реакций обратимо. Необратимые реакции характеризуются тем, что они протекают только в одном направлении. [c.47]
Если первую реакцию рассматривать как прямую, то вторая будет обратной. Разумеется, что такое деление является относительным. Химические реакции называются обратимыми, когда продукты реакции взаимодействуют друг с другом с образованием исходных веществ. Характерная особенность обратимых реакций — прямая и обратная реакции протекают одновременно. Это приводит к тому, что ни одно из реагирующих веществ полностью израсходовано быть не может, так как ни прямая, ни обратная реакция до конца не идут.
Необратимые и обратимые реакции. Химическое равновесие. Когда при химическом взаимодействии хотя бы одно из исходных веществ расходуется полностью, реакцию считают необратимой, протекающей до конца. Примером необратимой реакции может быть разложение бертолетовой соли [c.127]
По данным рис. 9.1 составьте уравнения кнслотно-основных реакций (обратимых, необратимых) между растворяемым веществом (указано первым) и растворителем [c.246]
Катализатор является веществом, которое влияет на скорость реакции. В течение процесса сам катализатор может изменяться или оставаться неизменным. Если катализатор действительно изменяется, его рассматривают как катализатор только в том случае, когда не существует никакого целочисленного стехио-метрического соотношения между его количеством и количеством прореагировавшего вещества.
Контуры постоянных значений скорости экзотермической обратимой реакции показаны па рис. IV.4. Если бы реакция была необратимой, то контуры были бы такими же, как и для необратимой [c.71]
Обратимость. Если скорость обратной реакции равна нулю или пренебрежимо мала, то реакция называется необратимой. Реакции редко бывают строго необратимыми (к = 0), но часто их можно считать необратимыми с достаточной степенью точности. Все остальные реакции являются обратимыми. [c.83]
Все остальные реакции являются обратимыми. [c.83]
Адиабатические реакторы. В адиабатическом процессе отсутствует теплообмен с внешней средой (д = 0). В случае, когда имеется только одна реакция (обратимая или необратимая), расчетные уравнения принимают вид [c.284]
Хотя теоретически необратимый процесс можно представить протекающим в определенных условиях обратимо, т. е. в принципе можно считать все реакции обратимыми, однако химику нередко приходится встречаться с процессами, в которых преобладает реакция, идущая в одном направлении. Это бывает в тех случаях, когда продукты взаимодействия удаляются из сферы реакции (выпадение осадка, выделение газа, образование — в случае ионных реакций — практически недиссоциированных продуктов), или же, когда за счет огромного избытка исходных веществ противоположный процесс практически подавляется. Таким образом, естественное или искусственное исключение возможности обратной реакции позволяет довести процесс практически до конца.
Выражение для движущей силы процесса АС зависит от обратимости химической реакции. Для необратимых гомогенных реакций [c.96]
Все химические реакции можно разбить на две группы необратимые и обратимые реакци и. Необратимые реакции протекают до конца — до полного израсходовании одного нз реагирующих веществ. Обратимые реакции протекают не до концш при обратимой реакции ни одно из реагирующих веществ не расха дуется полностью. Это различие связано с тем, что необратимая [c.184]
Т. е. В процессе взаимодействия кадмия с хлористым серебром энтропия уменьшается на 4,52 кал/моль-град (независимо от того, протекает ли реакция обратимо или необратимо). [c.66]
Строго говоря, обратимыми являются любые химические реакции. Практически же обратная реакция может быть настолько медленной по сравнению с прямой, что с любой разумной точностью обратимостью реакции можно пренебречь и рассматривать реакцию как необратимую, или одностороннюю. Так, при той же температуре невозможно зарегистрировать превращение НС1 в Hj и lj, т. е. образование [c.174]
Так, при той же температуре невозможно зарегистрировать превращение НС1 в Hj и lj, т. е. образование [c.174]
Реакция необратима. Далее дифенилбензидин окисляется до дифенилбензидина фиолетового эта реакция обратима
Все химические реакции обратимы в том смысле, что в зависимости от условий они могут протекать как в прямом, так и в обратном направлении. Например, смесь азота и водорода реагирует с образованием аммиака. Последний, в свою очередь, частично распадается на исходные вещества. Эта обратимость, однако, не эквивалентна термодинамической обратимости. Реакция, обратимая термодинамически, должна как в прямом, так и в обратном направлении проходить через непрерывную последовательность равновесных состояний. С этой точки зрения химические реакции в обычных условиях их протекания принадлежат к числу необратимых процессов они совершаются самопроизвольно лишь в одном направлении, пока не будет достигнуто состояние термодинамического равновесия, называемое, применительно к химическим процессам, химическим равновесием.
Если продукты гидролиза растворимы, то реакция имеет обратимый характер. Однако в результате гидролиза иногда могут получаться летучие или малорастворимые вещества. В этом случае реакция становится необратимой. [c.215]
Эта реакция является обратимой, так как, пропуская СО в раствор с осадком карбоната кальция, можно его растворить и снова получить кислую соль. При кипячении раствора СО улетучивается и реакция становится необратимой. [c.196]
Количественной мерой реакционной способности является константа скорости реакции (для необратимых процессов) или константы равновесий соответствующих реакций (для обратимых процессов) [c.52]
Циклобутены и 1,3-диены могут превращаться друг в друга при УФ-облучении или нагревании. Термическая реакция обычно необратима, хотя известны исключения [359], и многие циклобутены можно превращать в 1,3-диены нагреванием при температурах в интервале 100—200°С.
Если два исходных вещества полностью и необратимо переходят в конечный продукт, то такие реакции называются необратимыми. Реакций этого типа очень мало. Большинство реакций является обратимыми реакциями, т. е. такими, при которых образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные продукты. Обратимые реакции, следовательно, ограничены определенным пределом они не доходят до конца. [c.162]
Знать, обратима ли реакция или необратима, как зависит равновесный выход от определяющих его условий, это первый и необходимый шаг, но недостаточный. Необходимо еще, как вы знаете, иметь данные о скорости процесса. [c.188]
Необходимо еще, как вы знаете, иметь данные о скорости процесса. [c.188]
Какие реакции называются обратимыми п необратимыми Данте кинетическое толкование. В каких случаях хн-мические реакции являются необратимыми [c.89]
Какие из этих реакций обратимы Какие необратимы Почему [c.201]
Многие химические реакции являются, как известно, обратимыми, т.е. не протекают до конца , до полного превращения исходных веществ в продукты реакции. Если даже реакция является необратимой, то при ее практическом осуществлении, как правило, происходят потери веществ. В результате практически получаемое количество продукта реакции обычно представляет собой определенную долю (часть) от теоретически рассчитанной массы (целого).
Величина Кв (или о) характеризует степень обратимости реакции. Чем больще Кв, тем более обратима электрохимическая реакция. Если потенциал электрода отличается от равновесного на условно принятую величину 50 мВ, реакция считается необратимой. [c.26]
Если потенциал электрода отличается от равновесного на условно принятую величину 50 мВ, реакция считается необратимой. [c.26]
Различают обратимые и необратимые химические реакции. Обратимые реакции начинают идти в одном направлении, а затем в результате взаимодействия продуктов реакции протекает и обратный процесс. Следует отметить, что теоретически все реакции являются обратимыми, а необратимость связана со смещением равновесия, например, вследствие удаления из сферы реакции одного из продуктов. [c.43]
Односторонние и двусторонние реакции. По кинетической обратимости химические реакции классифицируют как односторонние и двусторонние. Односторонними называют реакции термодинамически необратимые (горение пороха) или обратимые, но при рассматриваемых условиях далекие от состояния химического равновесия (окисление водорода кислородом принципиально обратимо, но равновесие практически полностью смещено в направлении образования воды вплоть до температур порядка 1500— 2000 К). Двусторонними называют реакции, заканчивающиеся достижением химического равновесия, т. е. протекающие в условиях, когда скорости прямой и обратной реакций становятся сравнимыми. [c.171]
Двусторонними называют реакции, заканчивающиеся достижением химического равновесия, т. е. протекающие в условиях, когда скорости прямой и обратной реакций становятся сравнимыми. [c.171]
Все химические реакции можно разделить на необратимые и обратимые. Необратимыми реакциями называются такие реакции, которые протекают в одном направлении и идут до конца. К ним относятся реакции, сопровождающиеся выпадением осадка, выделением газа, образованием малодиссоциирующих веществ и т. п., а также процессы, сопровождающиеся большим выделением теплоты. [c.55]
Химические реакции отличаются степенью протекания. Одш идут практически до конца, другие же—лишь в незначительно степени. Поэтому химические ре акции делят на обратимьи и необратимые. Большинство химических реакций обратимо Необратимые реакции характеризуются тем, что они протекаюп только в одном направлении. [c.38]
Согласно классификации, прсдло кеииой Д. И. Орочко, которая приводится здесь только частично, химические реакции по своему механизму могут быть обратимыми, необратимыми, сло>кными и ав-токаталитическими, или цепными. [c.262]
[c.262]
Одна из важнейших химических особенностей сложных эфиров — нх способность к гидролизу. Если гидролиз катализуется кислотой то реакция обратима (см. образование сложных эфиров при реак ции этерификации). В щелочной среде гидролиз протекает необратимо. [c.303]
Определим изменение энтроп1ш при необратимой химической реакции, протекающей при постоянном давлении и температуре. Чтобы вычислить изменение энтропии, нужно мысленно провести эту реакцию обратимо. Учитывая уравнения (II, 3) и что [c.118]
Помимо контроля скорости реакции диффузионным процессом, характерного для обратимых реакций, существует контроль переносом заряженных частиц (электронов или ионов) через границу раздела электрод—раствор. В этом случае электродную реакцию называют необратимой. К необратимым процессам урапнепие Нернста неприменимо, поскольку на значительной части поляризационной кривой поляризация электрода при протекании тока не связана с изменением концентрации электродно-активного вещества в приэлектродной области, последнее просто отсутствует.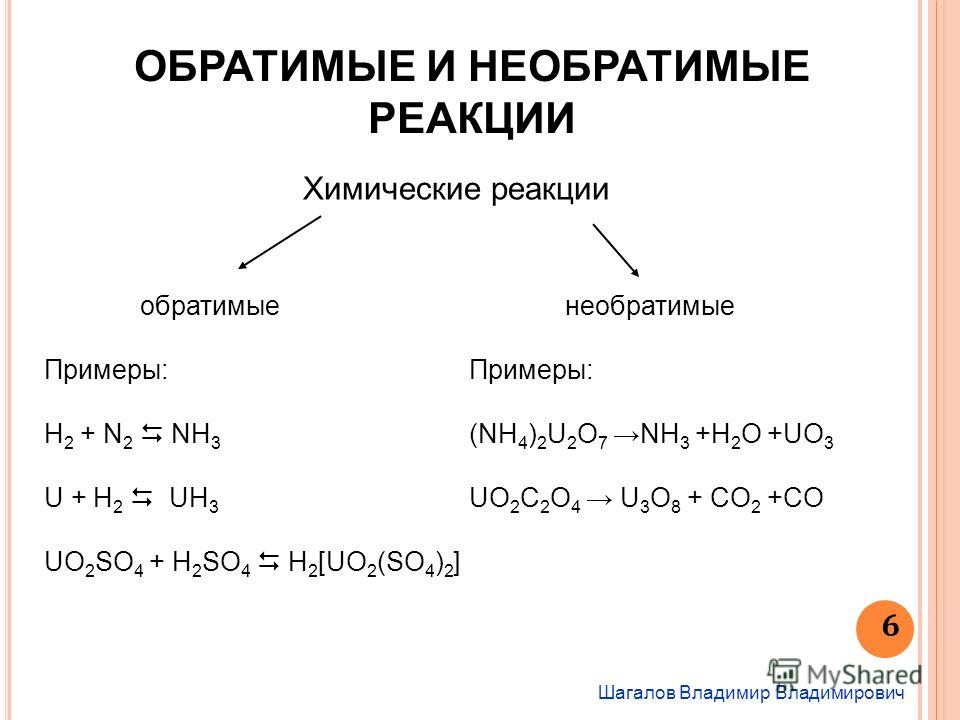 Рассмотрение теории замедленного разряда приводит к следующему выражению, связывающему потенциал электрода и силу поляризующего тока [c.277]
Рассмотрение теории замедленного разряда приводит к следующему выражению, связывающему потенциал электрода и силу поляризующего тока [c.277]
Поскольку сила тока обмена возрастает с концентрацией в соответствии с соотношением /обгде акувеличении концентрации электроактивного вещества достижимо состояние, когда /д. пр /об, так что обратимое протекание процесса для той же самой реакции сменяется необратимым. [c.277]
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией (например, в растворах или в газообразной среде). Все химические реакции делятся на необратимые и обратимые. Необратимые реакции протекают в одном направлении до конца. В этпх процессах, по крайней мере, одно ич веществ расходуется полностью. Обратимыми реакциями называются такие, у которых получающиеся в итоге реакции продукты вновь реагируют с образованием исходных веществ. Следовательно, обратимые реакции протекают при одних и тех же заданных условиях одновременно в двух противоположных направлениях А+В С-Ь +0. Обратимая реакция не доходит до конца, а протекает только до определенного момента, когда скорости обоих процессов — прямого и обратного — становятся одинаковыми, т. е. в системе настл-пает динамическое равновесие. После этого момента концентрацни всех участвующих в равновесии веществ остаются постоянными неограниченно долгое время. [c.38]
Обратимая реакция не доходит до конца, а протекает только до определенного момента, когда скорости обоих процессов — прямого и обратного — становятся одинаковыми, т. е. в системе настл-пает динамическое равновесие. После этого момента концентрацни всех участвующих в равновесии веществ остаются постоянными неограниченно долгое время. [c.38]
Строго говоря, обратимыми являются любые химические реакции. Практически же обратная реакция может быть настолько медленной по сравнению с прямой, что с любой разумной точностью обратимостью реакции можно пренебречь и рассматривать реакцию как необратимую, или одностороннюю. Так, при температуре 200°С невозможно зарегистрировать превращение НС1 в Н2 и I2, т. е. об разование хлороводорода нз водорода и хлора при этой температу ре можно рассматривать как практически необратимую реакцию Рассмотрим гомогенную реакцию, подчиняющуюся закону дей ствия масс, описываемую стехиометрическим уравнением (И.1) Скорость такой реакции по мере ее протекания «будет уменьшаться, поскольку уменьшаются концентрации реагентов. Одновременно с этим скорость обратной реакции будет возрастать, так как по мере протекания реакции концентрация продуктов реакции увеличивается. В конечном итоге наступит такое состояние, при тсотором скорость прямой реакции [c.200]
Одновременно с этим скорость обратной реакции будет возрастать, так как по мере протекания реакции концентрация продуктов реакции увеличивается. В конечном итоге наступит такое состояние, при тсотором скорость прямой реакции [c.200]
Составьте также уравнение подобной реакции для трикарбида тетраалюминия. Как называют такие реакции Обратимые они или необратимые [c.241]
Тепловой эффект химической реакции. Реакции экзотермические и эндпротекания химических реакций. Реакции обратимые и необратимые. [c.20]
Реакция сульфирования находит очень широкое применение, и в нее были введены многие типы ароматических углеводородов (включая конденсированные циклические системы), арилгалогениды, простые ароматические эфиры, карбоновые кислоты, ацилированные амины, кетоны, нитросоединения и сульфокислоты [139]. Фенолы также можно успешно сульфировать, но реакция может осложняться конкурентной атакой по кислороду. Для сульфирования часто применяют концентрированную серную кислоту, но можно использовать также дымящую серную кислоту, 50з, С18020Н и другие реагенты. Как и в случае нитрования (реакция 11-2), имеется широкий ассортимент реагентов различной реакционной способности для проведения реакции как с высокоактивными, так и с инертными субстратами. Поскольку эта реакция обратима (см. реакцию 11-44), то для доведения ее до конца может потребоваться внешнее воздействие. Однако при низких температурах обратная реакция идет очень медленно, поэтому прямое взаимодействие оказывается практически необратимым [140]. Серный ангидрид реагирует значительно быстрее, чем серная кислота,— с бензолом взаимодействие идет практически мгновенно. Побочно часто образуются сульфоны. При введении в реакцию сульфирования субстратов, содержащих в кольце четыре или пять алкильных заместителей или атомов галогена, обычно происходят перегруппировки (см. реакцию 11-42). [c.341]
Как и в случае нитрования (реакция 11-2), имеется широкий ассортимент реагентов различной реакционной способности для проведения реакции как с высокоактивными, так и с инертными субстратами. Поскольку эта реакция обратима (см. реакцию 11-44), то для доведения ее до конца может потребоваться внешнее воздействие. Однако при низких температурах обратная реакция идет очень медленно, поэтому прямое взаимодействие оказывается практически необратимым [140]. Серный ангидрид реагирует значительно быстрее, чем серная кислота,— с бензолом взаимодействие идет практически мгновенно. Побочно часто образуются сульфоны. При введении в реакцию сульфирования субстратов, содержащих в кольце четыре или пять алкильных заместителей или атомов галогена, обычно происходят перегруппировки (см. реакцию 11-42). [c.341]
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называют необратимыми. Реакции, идущие одновременно в двух противоположных направлениях (прямолл и обратном), называют обратимыми. [c.159]
[c.159]
Реакция химическая необратимые, обратимые — Справочник химика 21
Все известные реакции делятся на химически необратимые и обратимые. Необратимые являются односторонними. К ним относятся взрывные процессы, разложение различных веществ (например, хлоратов и азидов), процессы перехода системы из состояния, [c.103] Здесь ДЯ и AS — изменения энтальпии и энтропии, которые, согласно (52.2), соответствуют уравнению химической реакции. Таким образом измерением электродвижущей силы и ее температурной зависимости можно определить величины ДС, ДЯ и Д5 для реакции (52.2). Так как все три величины являются функциями состояния, то их значения ие зависят от того, протекает ли реакция (при постоянной температуре и постоянном давлении) необратимо (случай б».) или обратимо (случай в».). Напротив, теплота, принятая системой (которая зависит от пути в пространстве состояния), при необратимом протекании равна ДЯ, при обратимом процессе равна ГД5, в то время как в последнем случае, согласно (52. 31), ДЯ равна сумме подведенной теплоты и электрической работы, подведенной потенциометром к системе. Термодинамическое исследование гетерогенной реакции с помощью обратимых гальванических элементов играет также важную роль при экспериментальной проверке теплового закона Нернста ( 38). [c.270]
31), ДЯ равна сумме подведенной теплоты и электрической работы, подведенной потенциометром к системе. Термодинамическое исследование гетерогенной реакции с помощью обратимых гальванических элементов играет также важную роль при экспериментальной проверке теплового закона Нернста ( 38). [c.270]
Необратимые и обратимые реакции. Химическое равновесна [c.184]
Химическое равновесие. Химические реакции делятся на обратимые и необратимые. Необратимые реакции протекают только в одном направлении. Так, разложение нитрата аммония идет по реакции КН МОз -> ЗНзО + КаО [c.172]
Обратимые и необратимые реакции. Химическое равновесие 116 [c.381]
Необратимые и обратимые реакции. Химическое равновесие. Когда при химическом взаимодействии хотя бы одно из исходных веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.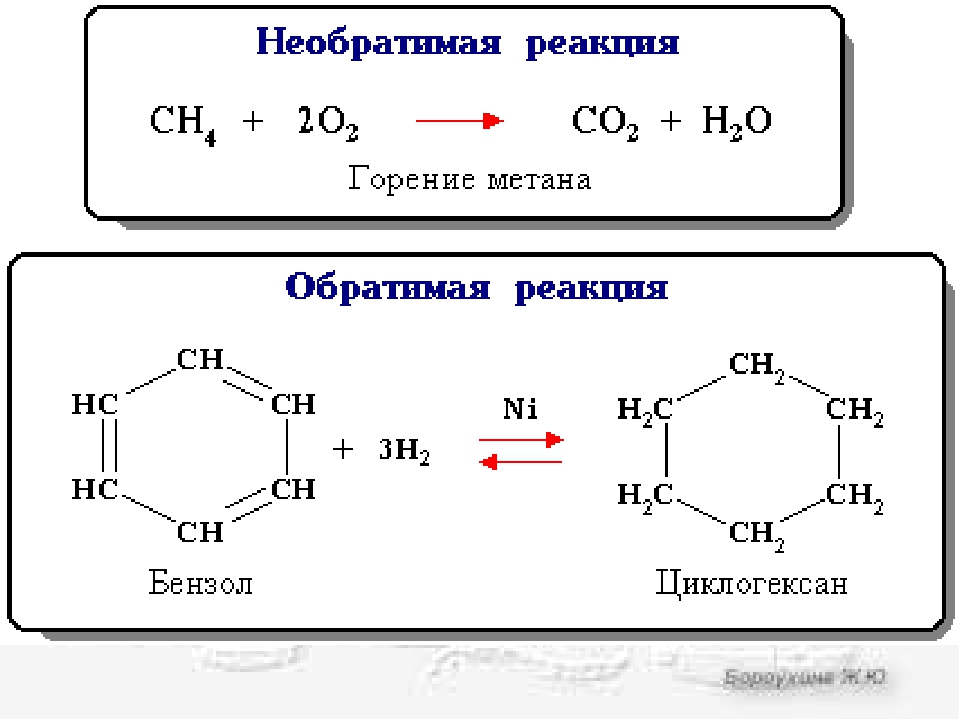 Примером необратимой реакции может быть разложение бертолетовой соли [c.127]
Примером необратимой реакции может быть разложение бертолетовой соли [c.127]
Многие реакции при соответствующих условиях протекают до фактического завершения, т. е. после реакции практически получаются только продукты реакции. Поэтому нередко употребляют выражения реакция химически мало обратима , трудно обратима или почти необратима . Однако даже в этих реакциях достигается состояние равновесия и обратные реакции имеют место, хотя и с весьма малой степенью превращения. [c.206]
Первые процессы — к ним относится подавляющее большинство реакций — принято называть химически обратимыми, вторые — их меньше — химически необратимыми. [c.31]
Химические процессы делятся на обратимые и необратимые. Необратимые процессы протекают лишь в одном направлении. Химические реакции, как правило, обратимы в том отношении, что в зависимости от условий они могут протекать как в прямом, так и в обратном направлениях. Однако в типичных производственных условиях многие химические реакции практически необратимы. Так, например, реакция [c.39]
Так, например, реакция [c.39]
Все химические реакции можно разбить на две группы необратимые и обратимые реакци и. Необратимые реакции протекают до конца — до полного израсходовании одного нз реагирующих веществ. Обратимые реакции протекают не до концш при обратимой реакции ни одно из реагирующих веществ не расха дуется полностью. Это различие связано с тем, что необратимая [c.184]
Изучение химических реакций приводит к следующему выводу наряду с процессами, которые, начиная протекать в одном направлении, затем идут в обоих направлениях (за счет взаимодействия продуктов реакции), т. е. являются двусторонними, встречаются и такие, которые протекают практически односторонне, до полного превращения исходных веществ. Первые процессы, к которым относится подавляющее большинство реакций, принято называть химически обратимыми, вторые — химически необратимыми. [c.174]
Выражение для движущей силы процесса АС зависит от обратимости химической реакции.
 Для необратимых гомогенных реакций [c.96]
Для необратимых гомогенных реакций [c.96]Если химическое равновесие обратимой реакции сильно смещается в одну сторону, то она при данных условиях представляется нам необратимой, т. е. протекающей в одном направлении. [c.26]
НЕОБРАТИМЫЕ И ОБРАТИМЫЕ РЕАКЦИИ ХИМИЧЕСКОЕ РАВНОВЕСИЕ [c.109]
Строго говоря, обратимыми являются любые химические реакции. Практически же обратная реакция может быть настолько медленной по сравнению с прямой, что с любой разумной точностью обратимостью реакции можно пренебречь и рассматривать реакцию как необратимую, или одностороннюю. Так, при той же температуре невозможно зарегистрировать превращение НС1 в Hj и lj, т. е. образование [c.174]
Термодинамическую обратимость процесса не следует смешивать с понятием обратимости или необратимости химических реакций, де термин обратимый часто применяется к любым реакциям, которые могут протекать как п прямом, так и обратном направлениях, если даже возвращение системы в исходное состояние было сопряжено с темн или иными изменениями в окружающей среде. [c.233]
[c.233]
Существуют обратимые и необратимые химические реакции. Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях с сопоставимыми скоростями, называют обратимыми, например [c.28]
Термин обратимость нередко применяют для характеристики как химической реакции, так и термодинамического процесса, что может привести к недоразумениям и ошибкам. При рассмотрении этого вопроса К. А. Путилов четко разграничивает понятия химической и термодинамической необратимости. Любая химическая реакция является химически обратимой, т. е. путем изменения условий ее проведения можно изменить направление реакции с прямого на обратное, Встречающиеся в литературе характеристики какой-либо реакции как трудно обратимой или почти необратимой относятся по сути дела к трудностям реализации условий, прн которых можно изменить направление реакции. [c.38]
Тепловые эффекты химических реакций 129 4.3. Скорость химических реакций. Катализ 136 4.4. Обратимые и необратимые реакции. Химическое равновесие 146 4.5. Классификация химических реакций 152 Тест № 5 по теме Химические реакции [c.723]
Скорость химических реакций. Катализ 136 4.4. Обратимые и необратимые реакции. Химическое равновесие 146 4.5. Классификация химических реакций 152 Тест № 5 по теме Химические реакции [c.723]
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми. [c.51]
Многие химические реакции являются, как известно, обратимыми, т.е. не протекают до конца , до полного превращения исходных веществ в продукты реакции. Если даже реакция является необратимой, то при ее практическом осуществлении, как правило, происходят потери веществ. В результате практически получаемое количество продукта реакции обычно представляет собой определенную долю (часть) от теоретически рассчитанной массы (целого). [c.55]
Односторонние и двусторонние реакции. По кинетической обратимости химические реакции классифицируют как односторонние и двусторонние. Односторонними называют реакции термодинамически необратимые (горение пороха) или обратимые, но при рассматриваемых условиях далекие от состояния химического равновесия (окисление водорода кислородом принципиально обратимо, но равновесие практически полностью смещено в направлении образования воды вплоть до температур порядка 1500— 2000 К). Двусторонними называют реакции, заканчивающиеся достижением химического равновесия, т. е. протекающие в условиях, когда скорости прямой и обратной реакций становятся сравнимыми. [c.171]
Односторонними называют реакции термодинамически необратимые (горение пороха) или обратимые, но при рассматриваемых условиях далекие от состояния химического равновесия (окисление водорода кислородом принципиально обратимо, но равновесие практически полностью смещено в направлении образования воды вплоть до температур порядка 1500— 2000 К). Двусторонними называют реакции, заканчивающиеся достижением химического равновесия, т. е. протекающие в условиях, когда скорости прямой и обратной реакций становятся сравнимыми. [c.171]
Существует классификация химических реакций по признаку их обратимости. Реакции, протекающие в одном направлении и приводящие к практически полному превращению исходных веществ в продукты, являются необратимыми. Обратимые реакции протекают в двух противоположных направлениях и не доходят до конца ни в одном из них. В уравнениях обратимых реакций часто вместо знака равенства ставят знак обратимости (5=). [c.20]
В литературе по физической химии обычно рассматривают случаи химических превращений (необратимые, обратимые, параллельные и последовательные реакции) применительно к гомогенным процессам, протекающим во времени, т. е. периодически. [c.23]
е. периодически. [c.23]
Реакции необратимые, реакции обратимые, реакции химические см. Необратимые реакции, Обратимые реакции, Химические реакции. [c.112]
Многие из перечисленных реакций являются необратимыми и к ним не применим классический термодинамический подход. Однако такие важнейшие типы химических реакций, как протонирование и депротонирование (кислотная ионизация), этерификация карбоновых кислот, гидролиз сложных эфиров, водородный обмен, сульфирование, кето-енольная таутомерия являются обратимыми. Рассмотрим основные типы обратимых реакций органических соединений. [c.134]
Химические реакции подразделяются на обратимые и необратимые. К обратимым относятся такие химические реакции, которые при изменении условий (давления, температуры, среды) могут протекать в прямом и обратном направлениях. Такие реакции протекают в соединениях со слабой связью [c.
 44]
44]Если система N3—Н2—ННз действительно находится в состоянии равновесия, для изменения относительных скоростей прямой и обратной реакций достаточно бесконечно малых изменений давления, температуры или кош1ентрации любого компонента системы. Подобно тому как самый легчайший груз способен изменить по.пожение весов при механическом равновесии, так и самое малое изменение условий влияет на систему, находящуюся в состоянии химического равновесия. Вот почему к подобным реакциям применимо определение обратимые. Щелчком пальца нельзя остановить скатывающийся с горы валун, и бесконечно малое изменение давления, температуры, концентрации или любого другого изменяемого параметра состояния системы не позволяет остановить взрыв смеси Н2 и С1з или менее наглядной реакции между N3 и Н2 прежде, чем будет достигнуто равновесие. Такие химические системы не находятся в состоянии равновесия, и процесс их протекания является необратимым. [c.52]
Физическая и химическая адсорбция различаются по следующим признакам. Физическая адсорбция вполне обратима и малоспецифична. Теплота физической адсорбции составляет обычно всего 2—8 ккал/моль и соизмерима с теплотой конденсации. Теплота химической адсорбции может достигать 200 ккал/моль, т. е, имеет порядок теплот химических реакций. Химическая адсорбция обычно необратима. [c.103]
Физическая адсорбция вполне обратима и малоспецифична. Теплота физической адсорбции составляет обычно всего 2—8 ккал/моль и соизмерима с теплотой конденсации. Теплота химической адсорбции может достигать 200 ккал/моль, т. е, имеет порядок теплот химических реакций. Химическая адсорбция обычно необратима. [c.103]
Строго говоря, обратимыми являются любые химические реакции. Практически же обратная реакция может быть настолько медленной по сравнению с прямой, что с любой разумной точностью обратимостью реакции можно пренебречь и рассматривать реакцию как необратимую, или одностороннюю. Так, при температуре 200°С невозможно зарегистрировать превращение НС1 в Н2 и I2, т. е. об разование хлороводорода нз водорода и хлора при этой температу ре можно рассматривать как практически необратимую реакцию Рассмотрим гомогенную реакцию, подчиняющуюся закону дей ствия масс, описываемую стехиометрическим уравнением (И.1) Скорость такой реакции по мере ее протекания «будет уменьшаться, поскольку уменьшаются концентрации реагентов. Одновременно с этим скорость обратной реакции будет возрастать, так как по мере протекания реакции концентрация продуктов реакции увеличивается. В конечном итоге наступит такое состояние, при тсотором скорость прямой реакции [c.200]
Одновременно с этим скорость обратной реакции будет возрастать, так как по мере протекания реакции концентрация продуктов реакции увеличивается. В конечном итоге наступит такое состояние, при тсотором скорость прямой реакции [c.200]
Химические реакции по признаку обратимости /,елят-ся на обратимые и необратимые [c.154]
Химически необратимые реакции при данных условит ях идут практически до конца, до полного расходования одного из реагирующих веществ. Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении [c.109]
Реакция (75) протекает обратимо в хроматографическом режиме только в случае, если Ка = Кв = Кс, в других случаях реакция становится необратимой. Таким образом, в условиях хроматографического режима возникает возможность необратимого проведения обратимых химических реакций. Широкие возможности появляются для устранения ингибиторного и ини-циаторного воздействия определенных веществ, для подавления положительного или отрицательного автокатализа продуктов реакции. При реакци- [c.470]
При реакци- [c.470]
Что такое электролитическая диссоциация 2) Какие реакции явли-» ются обратимыми, какие необратимыми 3) В каких случаях реакции» практичесгЬ идут до коица 4. Как выражается констаита равновесий химической реакции 5. Как производится сдвиг химического равио-« [c.11]
Обратимость химических реакций. Химическое равновесие
Все химические
реакции делятся на обратимые и необратимые. Необратимые
реакции – это реакции, которые идут только в одном направлении.
Необратимыми являются реакции горения (например, реакция горения метана),
большинство реакций тэрмического разложения сложных веществ (например, реакция
разложения перманганата калия), необратимыми являются большинство реакций, в
результате которых образуется газ (например, реакция карбоната калия с серной
кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом
серебра один), или если образуется малодиссоциирующее вещество (например, в
реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.
Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого
времени после начала реакции в газовой смеси можно обнаружить не только
йодоводород, но и исходные вещества – водород и йод. Если взять в качестве
исходного вещества йодоводород, то через некоторое время также наряду с
образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
Если взять в качестве
исходного вещества йодоводород, то через некоторое время также наряду с
образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же
обратной реакции увеличивается, потому что концентрация образующегося
йодоводорода увеличивается. Как только скорость прямой реакции окажется равной
скорости обратной реакции, наступит химическое равновесие. Это равновесие считается
динамическим, так как идут и прямая, и обратная реакции, скорости их
также равны, а значит и концентрации веществ не изменяются. То есть их
концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое
равновесие является подвижным. То есть изменения внешних условий
ведёт к смещению или сдвигу химического равновесия. Состояние же химического
равновесия при неизменных внешних условиях может сохраняться бесконечно долго.
Для многих химических производств состояние равновесия является нежелательным,
так как не приводит к нужному выходу продукции. И поэтому для таких химических
реакций нужно создавать условия, когда равновесие будет смещаться в нужную
сторону.
То есть изменения внешних условий
ведёт к смещению или сдвигу химического равновесия. Состояние же химического
равновесия при неизменных внешних условиях может сохраняться бесконечно долго.
Для многих химических производств состояние равновесия является нежелательным,
так как не приводит к нужному выходу продукции. И поэтому для таких химических
реакций нужно создавать условия, когда равновесие будет смещаться в нужную
сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.
А. Ле Шателье
(1850–1936)
Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим
влияние концентрации на смещение химического равновесия. Как правило, при увеличении
концентрации исходных веществ, равновесие смещается в сторону прямой
реакции, при увеличении концентрации продуктов реакции равновесие
смещается в сторону обратной реакции.
Как правило, при увеличении
концентрации исходных веществ, равновесие смещается в сторону прямой
реакции, при увеличении концентрации продуктов реакции равновесие
смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.
Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим
пример реакции взаимодействия хлорида железа три и роданида калия. В результате
реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой.
Если к хлориду железа три добавить роданид калия, то образуется раствор
кроваво-красного цвета.
В результате
реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой.
Если к хлориду железа три добавить роданид калия, то образуется раствор
кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
Рассмотрим, как
влияет изменение температуры на смещение химического равновесия. Для начала
большинства химических реакций необходимо нагреть исходные вещества, чтобы
частицы получили необходимую энергию. Однако скорость прямой и обратной реакции
зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
Однако скорость прямой и обратной реакции
зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
Как же влияет
давление на смещение химического равновесия? Давление газов в системе при
постоянной температуре определяется числом молекул газообразных веществ, или
химическим количеством этих веществ. Поэтому для оценки влияния изменения
давления необходимо подсчитать число молей газообразных веществ в левой и
правой частях уравнения. При увеличении давления увеличивается концентрация
газообразных веществ.
Поэтому для оценки влияния изменения
давления необходимо подсчитать число молей газообразных веществ в левой и
правой частях уравнения. При увеличении давления увеличивается концентрация
газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
Таким образом, при
увеличении давления равновесие смещается в сторону той реакции, при которой
объём образующихся газообразных веществ уменьшается, и, наоборот, при
уменьшении давления равновесие смещается в сторону той реакции, которая
приводит к увеличению объёма. То есть, при увеличении давления равновесие
смещается в сторону образования аммиака (вправо), а при уменьшении давления
равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.
Тест ЕГЭ по химии. Обратимые и необратимые химические реакции. Химическое равновесие. Ответы.
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
1. Химическое равновесие в системе
2NO(г) + O2 (г) = 2NO2 (г) + Q
смещается в сторону образования продукта реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) применении катализатора
2. Обратимая химическая реакция
Обратимая химическая реакция
1) гидролиз сложного эфира
2) горение дров
3) варка мяса
4) затвердевание цемента
3. Подвергается обратимому гидролизу
1) сульфид алюминия
2) карбид кальция
3) сульфид аммония
4) карбид алюминия
4. В реакции гидрирования этилена нередко в роли катализатора используют платиновую чернь (мелкодисперсный порошок платины). При изучении данной реакции было показано, что она является реакцией нулевого порядка. От какого фактора зависит скорость реакции гидрирования этилена?
1) парциального давления этилена
2) парциального давления водорода
3) парциального давления этана
4) площади поверхности катализатора
5. Состояние химического равновесия характеризуется
1) прекращением протекания прямой и обратной химической реакций
2) равенством скоростей прямой и обратной реакций
3) равенством суммарной массы продуктов суммарной массе реагентов
4) равенства суммарного количества вещества продуктов суммарному количеству вещества реагентов
6. Для увеличения выхода сложного эфира в химическом процессе
Для увеличения выхода сложного эфира в химическом процессе
C2H5OH + CH3COOH « CH3COOC2H5 +H2O-Q
необходимо
1) добавить воды
2) уменьшить концентрацию уксусной кислоты
3) увеличить концентрацию эфира
4) увеличить температуру
7. По приведенному ниже рисунку для реакции А+Б« В определите верное утверждение.
«Равновесие в реакции А+Б « В при повышении температуры смещается
1) вправо, так как это эндотермическая реакция
2) влево, так как это экзотермическая реакция
3) вправо, так как это экзотермическая реакция
4) влево, так как это эндотермическая реакция
8. При изменении давления химическое равновесие не смещается в реакции
1) СО(г) + Сl2 (г) « СОСl2 (г)
2) СО2(г) + С« 2СО(г)
3) 2СО(г) + О2(г) «2СО2(г)
4) С + О2 (г) «СО2(г)
9. При понижении давления химическое равновесие смещается в сторону
При понижении давления химическое равновесие смещается в сторону
1) эндотермической реакции
2) экзотермической реакции
3) уменьшения объема реакционной смеси
4) увеличения объема реакционной смеси
10. Введение катализатора в систему, находящуюся в состоянии динамического равновесия
1) увеличит скорость только прямой реакции
2) увеличит скорость только обратной реакции
3) увеличит скорость как прямой, так и обратной реакции
4) не оказывает влияние на скорость ни прямой, ни обратной реакции
11. Химическое равновесие сместится в одну сторону при повышении давления и понижении температуры в системе:
1) N2 + ЗН2 ?2NH3 + Q; 3) Н2 + Cl2? 2HC1 + Q;
2) N2 + О2? 2NO — Q; 4) С2H2(г)? 2С + Н2 — Q.
12. Давление не влияет на состояние химического равновесия следующей химической реакции
1) 2SO2 + O2 « 2SO3
2) 3Н2 + N2 « 2NH3
3) CO + Cl2 « COCl2
4) Н2 + Cl2 « 2HCl
13. При понижении давления химическое равновесие смещается в сторону исходных веществ в системе
При понижении давления химическое равновесие смещается в сторону исходных веществ в системе
1) 2CO(г) +O2(г) «2CO2(г) + Q
2) N2(г) + O2(г) «2NO(г) – Q
3) SO2Сl2(г) « SO2(г) + Cl2(г)- Q
4) H2(г) + Cl2(г) « 2HCl(г) + Q
14. Химическое равновесие в системе
2СО(г) « СО2 (г) + С(т)+ 173 кДж
можно сместить в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления,
4) использовании катализатора
15. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В СИСТЕМЕ
FeO (т) + Н2(г)«Fe(т) + Н2О (г) – Q
СМЕСТИТСЯ В СТОРОНУ ПРОДУКТА РЕАКЦИИ ПРИ
1) повышении давления
3) понижении давления
2) повышении температуры
4) использовании катализатора
16. В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
1) 2SO2(г) + O2(г) « 2SО3(г) + Q
2) N2(г) + О2(г) « 2NO(г) – Q
3) CO2(г) + 2C(тв. ) «2CO(г) – Q
) «2CO(г) – Q
4) 2NH3(г) « N2(г) + 3H2(г) – Q
17. При повышении давления равновесие смешается вправо в системе
1) 2СО2(г) « 2СО(г) + О2(г)
2) C2H4(г) « С2Н2(г) + Н2(г)
3) РС13(г) + С12(г) « РС15(г)
4) Н2(г) + С12(г) «2 НС1(г)
18. Изменение давления оказывает влияние на смешение равновесия в системе
1) 2SO2(г) + О2(г) « 2SO3 (г)
2) СО(г) + Н2О(г) « СО2(г)+ Н2(г)
2) 2НI(г) « Н2(г) + I2(г)
4) N2(г) + О2(г) «2NO(г)
19. Обратимой реакции соответствует уравнение
1) КОН + НС1 = KCI + Н2О
2) N2 + 3Н2 = 2NH3
3) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
4) Na2О + 2HCI = 2NaCl + H2О
20. При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
1) Н2(г) + S(тв) « H2S(г) + Q
2) 2NH3(г)« N2(г) + ЗН2(г) — Q
3) 2SО2(г) + О2(г) « 2SО3(г) + Q
4) 2HC1(г) «H2(г) + Cl2(г) — Q
21. Химическое равновесие в системе
С4Н10 (г) « С4Н8 (г) + Н2 (г) — Q
можно сместить в сторону продуктов реакции
1) повышением температуры и повышением давления
2) повышением температуры и понижением давления
3) понижением температуры и повышением давления
4) понижением температуры и понижением давления
22. На смешение химического равновесия в системе
N2 + ЗН2 « 2NH3 + Q
не оказывает влияния
1) понижение температуры
2) повышение давления
3) удаление аммиака из зоны реакции
4) применение катализатора
23. Химическое равновесие в системе
Химическое равновесие в системе
СО2 + С(тв) « 2СО (г) — Q
сместится вправо при
1) повышении давления
2) понижении температуры
3) повышении концентрации СО
4) повышении температуры
24. Давление не влияет на равновесие в реакции
I)N2(г) + 3H2 (г)« 2NH3(г)
2) N2(г) + О2(г) « 2NO(г)
3) С(тв) + СО(г)«2СО(г)
4) СО2(г) + Н2О(ж) « H2C03(p-p)
25. В реакции
С3Н6(г) + Н2(г) « С3Н8(г) + Q
увеличить выход С3Н8 можно
1) повысив температуру
2) применив катализатор
3) понизив концентрацию водорода
4) повысив давление
26. Оцените справедливость утверждений:
А. На химическое равновесие не влияет площадь поверхности реагирующих веществ.
Б. В состоянии химического равновесия концентрация исходных веществ равна концентрации продуктов реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. В равновесной системе
С(т) + Н2О (г) « Н2(г) + СО(г) — Q равновесие сместится в сторону исходных веществ при
1) повышении температуры и повышении давления
2) понижении температуры и повышении давления
3) повышении температуры и понижении давления
4) понижении температуры и понижении давления
28. Равновесие сместится в сторону продуктов реакции при повышении температуры и понижении давления в системе
1) Fe2О3(тв) + СО(г) « 3FeO(тв) + CО2(г) + Q
2) С(тв)+ СО2(г) « 2СО(г) — Q
3) 2SО2(г) + О2(г) «2SО3(г) + Q
4) H2(г)+I2(г)«2HI(г) — Q
29. В реакции
C3H6(г) + h3О(г) « C3H7OH(г) + Q увеличить выход пропанола можно,
1) повысив давление
2) повысив температуру
3) понизив концентрацию Н2О
4) применив катализатор
30. В системе
В системе
НСООН + С2Н5ОН « НСО-О-СН2-СН3 + Н2О
находящейся в водном растворе, смещение равновесия в сторону прямой реакции произойдёт при
1) добавлении катализатора
2) разбавлении реакционной смеси
3) повышении давления
4) отгонке сложного эфира
31. Смещению равновесия в сторону образования исходных веществ в системе
4NО2 (г) + 2Н2О(Ж) + О2(г) « 4HNО3(р-p) + Q
способствует
1) повышение температуры и повышение давления
2) понижение температуры и повышение давления
3) понижение температуры и понижение давления
4) повышение температуры и понижение давления
Ответы: 1-1, 2-1, 3-3, 4-4, 5-2, 6-4, 7-1, 8-4, 9-4, 10-3, 11-1, 12-4, 13-1, 14-1, 15-3, 16-2, 17-3, 18-1, 19-2, 20-3, 21-2, 22-4, 23-4, 24-2, 25-4, 26-4, 27-2, 28-2, 29-1, 30-4, 31-4
Обратимые и необратимые реакции
Очень часто химические реакции протекают так, что первичные реагирующие вещества полностью преобразуются в продукты реакции. К примеру, если в соляную кислоту положить гранулу цинка, то при определенном (достаточном) количестве кислоты реакция будет протекать до полного растворения цинка согласно уравнению: 2HCL + ZN = ZnCl2 + H2↑.
К примеру, если в соляную кислоту положить гранулу цинка, то при определенном (достаточном) количестве кислоты реакция будет протекать до полного растворения цинка согласно уравнению: 2HCL + ZN = ZnCl2 + H2↑.
Если провести данную реакцию в обратном направлении, другими словами – пропустить водород через раствор хлорида цинка, то металлический цинкне образуется – данная реакция не может протекать в обратном направлении, поэтому она необратима.
Химическая реакция, в результате которой первичные вещества практически полностью преобразуются в конечные продукты, называется необратимой.
К подобным реакциям имеют отношение как гетерогенные, так и гомогенные реакции. К примеру, реакции горения простых веществ – метана Ch5, сероуглерода CS2. Как мы уже знаем, реакции горения относятся к экзотермическим реакциям. В большинстве случаев к экзотермическим реакциям относятся реакции соединения, к примеру, реакция гашения извести: CaO + H2O = Ca(OH)2 + Q (выделяется теплота).
Будет логично предполагать что, к эндотермическим реакциям принадлежат обратные реакции, т.е. реакция разложения. К примеру, реакция обжига известняка: CaCo3 = CaO + CO2 – Q (теплота поглощается).
Необходимо помнить, что число необратимых реакций является не таким уж и большим.
Гомогенные реакции (между растворами веществ) являются необратимыми, если проходят с образованием нерастворимого, газообразного продукта или воды. Данное правило получило название » правило Бертолле». Проведем опыт. Возьмем три пробирки и нальем в них по 2мл раствора соляной кислоты. В первый сосуд добавим 1 мл окрашенный фенолфталеином малиновый раствор щелочи, он потеряет цвет в следствие реакции: HCl + NaOH = NaCl + H2O.
Во вторую пробирку добавим 1 мл раствора карбоната натрия – мы увидим бурную реакцию кипения, которая обусловлена выделением углекислого газа: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑.
В третью пробирку добавим немного капель нитрата серебра и увидим, как в ней образовался беловатый осадок хлорида серебра: HCl + AgNO3 = AgCl↓ + HNO3.
Большинство реакций являются обратимыми. Необратимых реакций не особенно много.
Химические реакции, которые могут проходить одновременно в двух противоположных направлениях – прямом и обратном, – называются обратимыми.
Нальем в пробирку 3 мл воды и добавим несколько кусочков лакмуса, а потом начнем пропускать через нее с помощью газоотводной трубки выходящий из другого сосуда углекислый газ, который образуется из-за взаимодействия мрамора и соляной кислоты. Спустя некоторое время мы увидим, как фиолетовый лакмус станет красным, это свидетельствует о наличии кислоты. Мы получили непрочную угольную кислоту, которая образовалась путем связи углекислого газа и воды: CO2 + H2O = H2CO3.
Оставим данный раствор в штативе. Спустя некоторое время мы обратим внимание на то, что раствор опять стал фиолетовым. Кислота разложилась на исходные составляющие: H2CO3 = H2O + CO2.
Данный процесс будет происходить намного быстрее, если мы подогреем раствор угольной кислоты. Таким образом, мы выяснили, что реакция получения угольной кислоты может протекать как в прямом, так и в обратном направлении, а значит, она является обратимой. Обратимость реакции обозначается на письме двумя противоположно направленными стрелками: CO2 + H2O ↔ H2CO3.
Таким образом, мы выяснили, что реакция получения угольной кислоты может протекать как в прямом, так и в обратном направлении, а значит, она является обратимой. Обратимость реакции обозначается на письме двумя противоположно направленными стрелками: CO2 + H2O ↔ H2CO3.
Среди обратимых реакций, которые лежат в основе получения важныххимических продуктов, приведем в качестве примера реакцию синтеза оксида серы (VI) из оксида серы (IV) и кислорода: 2SO2 + O2 ↔ 2SO3 + Q.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Применение обратимых и необратимых реакций в быту
1. Применение обратимых и необратимых реакций в быту
Обратимыми называются химические реакции, которыепротекают одновременно в двух противоположных
направлениях – прямом и обратном.

Среди обратимых реакций, лежащих в основе получения
важнейших химических продуктов, можно назвать реакцию
синтеза аммиака
Реакции, которые протекают только в одном направлении и
завершаются полным превращением исходных
реагирующих веществ в конечные вещества,
называются необратимыми.
В обратимых процессах скорость прямой реакции вначале
максимальна, а затем уменьшается из-за того, что уменьшаются
концентрации исходных веществ, расходуемых на образование
продуктов реакции. Наоборот, скорость обратной реакции,
минимальная вначале, увеличивается по мере увеличения
концентрации продуктов реакции. Наконец, наступает такой момент,
когда скорости прямой и обратной реакций становятся равными.
Состояние обратимого процесса, при котором скорость прямой
реакции равна скорости обратной реакции, называется химическим
равновесием.
Химическое равновесие является динамичным (подвижным), т.к.
при его наступлении реакция не прекращается, неизменными остаются
лишь концентрации компонентов, т.
 е. за единицу времени образуется
е. за единицу времени образуетсятакое же количество продуктов реакции, какое превращается в
исходные вещества. При постоянных температуре и давлении
равновесие обратимой реакции может сохраняться неопределенно
долгое время.
3. Примеры
Реакция № 2 – ПищеварениеТысячи химических реакций происходят в
процессе пищеварения. Как только Вы положили
еду в рот, фермент в слюне, амилаз, начинает
разрушать сахар и другие углеводороды в более
простые формы, чтобы Вы могли поглотить
пищу. Соляная кислота в желудке вступает в
реакцию с пищей, чтобы разбить ее, в то время как
ферменты расщепляют белки и жиры, чтобы те
могли пройти по крови через стенки кишечника.
4. Примеры в природе
Реакция № 2 – Анаэробное дыханиеВ отличие от аэробного клеточного дыхания, анаэробное
дыхание описывает набор химических реакций, которые
позволяют клеткам получать энергию от сложных молекул
без кислорода. Ваши клетки в мышцах выполняют
анаэробное дыхание, когда Вы исчерпаете кислород,
поставляемый им, например, во время интенсивных или
продолжительных физических упражнений.
 Анаэробное
Анаэробноедыхание дрожжей и бактерий используется для брожения,
производства этанола, диоксида углерода и других
химических веществ, которые производят сыр, вино, пиво,
хлеб и многие другие продукты питания.
Реакция № 3 – Аэробное клеточное дыхание
Аэробное клеточное дыхание — это
противоположный процесс фотосинтеза в том,
что энергия молекул в сочетании с кислородом,
которым мы дышим, с целью высвобождения
энергии, необходимым нашим клеткам, плюс
углекислый газ и вода. Энергия, используемая
клетками, является химической реакцией в
формате АТФ.
6. Примеры в быту
Растворение соли в водеЕсли говорить о том, растворяется ли
соль в воде, то для большинства солей
это справедливое утверждение.
Существует специальная таблица, в
соответствии с которой можно точно
определить величину растворимости.
Так как вода – универсальный
растворитель, она хорошо смешивается
с другими жидкостями, газами,
кислотами и солями.

молекулы воды и соли являются
полярными. Это означает, что их
электрические полюса
противоположны, что
обусловливает высокую
диэлектрическую проницаемость.
Молекулы воды окружают ионы
другого вещества, водеобразуется
жидкость, являющаяся однородной
по своей консистенции
Заваривание чая
Обратимые и необратимые реакции. Химическое равновесие
Тема урока. Обратимые и необратимые реакции. Химическое равновесие
Цели урока: формировать представление учащихся о химическое равновесие; ознакомить с классификацией реакций на обратимые и необратимые; показать необходимость смещения химического равновесия; формировать представление о факторах, влияющих на смещение химического равновесия.
Тип урока: изучение нового материала.
Формы работы: фронтальная опрос, самостоятельная работа учащихся, рассказ учителя.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, таблица растворимости, ряд активности металлов, реактивы и оборудование, необходимые для проведения демонстрационных экспериментов.
ПЛАН УРОКА
I. Организация класса (2 мин.)
II. Актуализация опорных знаний (7 мин.)
III. Изучение нового материала. Показ демонстрационного эксперимента (20 мин.)
IV. Первичное применение полученных знаний (10 мин.)
V. Домашнее задание
ХОД УРОКА
I. Организация класса
II. Актуализация опорных знаний.
Мотивация учебной деятельности
1. Решение кроссворда, основанного на теоретическом материале пройденных тем (приложение 1).
III. Изучение нового материала
Все химические реакции делятся на два типа: обратимые и необратимые.
Необратимые – реакции, которые протекают только в одном направлении, т.е. продукты этих реакций не взаимодействуют друг с другом с образованием исходных веществ.
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ.
Французский химик Клод Луи Бертолле установил важное условие необратимости химической реакции:
Правило Бертолле: Реакции являются необратимыми, если протекают с образованием нерастворимого, газообразного продукта или воды.
Рассмотрим примеры необратимых реакций:
CaO + h3O = Ca(OH)2 +Q (теплота выделяется) экзо
CaCO3 = CaO + CO2 – Q (теплота поглощается) эндо
2KMnO4 = K2MnO4 + MnO2 + O2
BaCl2 + h3SO4 = BaSO4 + 2HCl
ПРОДЕЛАЕМ ОПЫТ…
Однако необратимых реакций не так много. Большинство реакций обратимы.
Обратимые – реакции, которые одновременно протекают и в прямом и в обратном направлениях:
А + В = (прямая, обратная реакция) = С + D
В уравнениях обратимых реакций используется знак обратимости ↔ (?)
Примером обратимой реакции является синтез йодоводорода из водорода и йода:
Реакция при 350 градусах.***
Через некоторое время после начала этой реакции в газовой смеси можно обнаружить не только конечный продукт реакции, но и исходные вещества.
Другие примеры обратимых реакций:
2SO2 + O2 = 2SO3 + Q
3h3 + N2 = 2Nh4 + Q
N2 + O2 = 2NO — Q
ПРОДЕЛАЕМ ОПЫТ ….
Химическое равновесие
Химическое равновесие — это состояние системы, при котором скорость прямой реакции ([pic 1]1) равна скорости обратной реакции ([pic 2]2).
По химического равновесия концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при условии равновесия не прекращаются.
Обратимые и необратимые реакции — Химия LibreTexts
Обратимые и необратимые реакции широко распространены в природе и ответственны за такие реакции, как разложение аммиака.
Введение
Считалось, что все химические реакции являются необратимыми до 1803 года, когда французский химик Клод Луи Бертолле представил концепцию обратимых реакций. Сначала он заметил, что карбонат натрия и хлорид кальция реагируют с образованием карбоната кальция и хлорида натрия; однако, наблюдая за образованием карбоната натрия по краям соляных озер, он понял, что большое количество солей в испаряющейся воде реагирует с карбонатом кальция с образованием карбоната натрия, что указывает на то, что имеет место обратная реакция.
Химические реакции представлены химическими уравнениями. Эти уравнения обычно имеют однонаправленную стрелку (\ (\ rightarrow \)) для обозначения необратимых реакций. Другие химические уравнения могут иметь двунаправленные гарпуны (\ (\ rightleftharpoons \)), которые представляют обратимые реакции (не путать с двойными стрелками \ (\ leftrightarrow \), используемыми для обозначения резонансных структур). Чтобы ознакомиться с основами химических реакций, щелкните здесь: Химические реакции
Эти уравнения обычно имеют однонаправленную стрелку (\ (\ rightarrow \)) для обозначения необратимых реакций. Другие химические уравнения могут иметь двунаправленные гарпуны (\ (\ rightleftharpoons \)), которые представляют обратимые реакции (не путать с двойными стрелками \ (\ leftrightarrow \), используемыми для обозначения резонансных структур). Чтобы ознакомиться с основами химических реакций, щелкните здесь: Химические реакции
Необратимые реакции
Фундаментальная концепция химии состоит в том, что химические реакции происходят, когда реагенты взаимодействуют друг с другом с образованием продуктов.Эти однонаправленные реакции известны как необратимые реакции, реакции, в которых реагенты превращаются в продукты, а продукты не могут, превращаться обратно в реагенты. Эти реакции по сути похожи на выпечку. Ингредиенты, действующие как реагенты, смешиваются и выпекаются вместе, образуя лепешку, которая действует как продукт. Этот осадок нельзя превратить обратно в реагенты (яйца, муку и т. Д.), Так же как продукты необратимой реакции не могут снова превратиться в реагенты.
Д.), Так же как продукты необратимой реакции не могут снова превратиться в реагенты.
Пример необратимой реакции — горение. Горение включает сжигание органического соединения, такого как углеводород, и кислорода с образованием диоксида углерода и воды. Поскольку вода и диоксид углерода стабильны, они не вступают в реакцию друг с другом с образованием реагентов. Реакции горения имеют следующий вид:
\ [C_xH_y + O_2 \ rightarrow CO_2 + H_2O \]
Обратимые реакции
В обратимых реакциях реагенты и продукты никогда не расходуются полностью; каждый из них постоянно реагирует и производится.Обратимая реакция может иметь следующий обобщенный вид:
\ [A + B \ underset {k _ {- 1}} {\ overset {k_1} {\ rightleftharpoons}} C + D \]
Эту обратимую реакцию можно разделить на две реакции.
Реакция 1: \ [A + B \ xrightarrow {k_1} C + D \]
Реакция 2: \ [C + D \ xrightarrow {k _ {- 1}} A + B \]
Эти две реакции происходят одновременно , что означает, что реагенты реагируют с образованием продуктов, поскольку продукты реагируют с образованием реагентов. Столкновения реагирующих молекул вызывают химические реакции в замкнутой системе. После образования продуктов связи между этими продуктами разрываются, когда молекулы сталкиваются друг с другом, производя достаточную энергию, необходимую для разрыва связей продукта и молекул реагента.
Столкновения реагирующих молекул вызывают химические реакции в замкнутой системе. После образования продуктов связи между этими продуктами разрываются, когда молекулы сталкиваются друг с другом, производя достаточную энергию, необходимую для разрыва связей продукта и молекул реагента.
Ниже приведен пример обобщенной формы обратимой реакции и разрыва обратимой реакции N 2 O 4 ↔ 2NO 2
Реакция 1 и Реакция 2 происходят одновременно, потому что они находятся в закрытой системе.
Синий: Азот Красный: Кислород
Реакция 1 Реакция 2
Представьте себе бальный зал. Пусть реагентом A будет 10 девочек, а реагентом B — 10 мальчиков. Когда каждая девочка и мальчик выходят на танцпол, они объединяются в пары, чтобы стать продуктом. Когда пять девочек и пять мальчиков выходят на танцпол, одна из пяти пар распадается и уходит в сторону, снова становясь реагентами.Когда эта пара покидает танцпол, еще один мальчик и девочка в сторонке объединяются, чтобы снова сформировать продукт. Этот процесс продолжается снова и снова, представляя обратимую реакцию.
Этот процесс продолжается снова и снова, представляя обратимую реакцию.
В отличие от необратимых реакций, обратимые реакции приводят к равновесию: в обратимых реакциях реакция протекает в обоих направлениях, тогда как в необратимых реакциях реакция протекает только в одном направлении. Чтобы узнать больше об этом явлении, щелкните здесь: Химическое равновесие
Если реагенты образуются с той же скоростью, что и продукты, существует динамическое равновесие.Например, если резервуар для воды наполняется водой с той же скоростью, с какой вода покидает резервуар (через гипотетическое отверстие), количество воды, остающейся в резервуаре, остается постоянным.
Связь с биологией
Белок гемоглобина имеет четыре сайта связывания. Молекулы гемоглобина могут связываться с углекислым газом или кислородом. Когда кровь проходит через альвеолы легких, молекулы гемоглобина улавливают богатые кислородом молекулы и связываются с кислородом. По мере того, как гемоглобин перемещается по остальному телу, он отдает кислород в капиллярах, чтобы система органов использовала кислород. Удалив кислород, он улавливает углекислый газ. Поскольку этот процесс постоянно осуществляется в организме, всегда есть молекулы гемоглобина, улавливающие или вытесняющие кислород, и другие молекулы гемоглобина, которые улавливают или вытесняют углекислый газ. Следовательно, молекулы гемоглобина, кислород и углекислый газ являются реагентами, а молекулы гемоглобина со связанным с ними кислородом или углекислым газом являются продуктами. В этой замкнутой системе некоторые реагенты превращаются в продукты, поскольку некоторые продукты превращаются в реагенты, что делает это похожим на обратимую реакцию.
Удалив кислород, он улавливает углекислый газ. Поскольку этот процесс постоянно осуществляется в организме, всегда есть молекулы гемоглобина, улавливающие или вытесняющие кислород, и другие молекулы гемоглобина, которые улавливают или вытесняют углекислый газ. Следовательно, молекулы гемоглобина, кислород и углекислый газ являются реагентами, а молекулы гемоглобина со связанным с ними кислородом или углекислым газом являются продуктами. В этой замкнутой системе некоторые реагенты превращаются в продукты, поскольку некоторые продукты превращаются в реагенты, что делает это похожим на обратимую реакцию.
Авторы и авторство
- Хизер Йи (UCD), Мандип Сохал (UCD)
Объяснитель урока: Обратимые и необратимые реакции
В этом объяснении мы узнаем, как определять обратимость химических реакций и выявлять примеры обратимых и необратимых процессов.
Все мы знакомы с процессами в нашей повседневной жизни, которые являются обратимыми и необратимыми, например, замерзание воды с образованием льда и таяние льда с образованием жидкой воды, которые являются противоположными и обратимыми процессами:
Однако выпечка торта связана с необратимыми процессы. Процессы и реакции, происходящие между ингредиентами смеси для выпечки при выпекании в духовке, необратимы.
Процессы и реакции, происходящие между ингредиентами смеси для выпечки при выпекании в духовке, необратимы.
Давайте посмотрим на химические реакции, которые являются обратимыми или необратимыми. Химическая реакция — это процесс, при котором одно или несколько веществ (называемых реагентами) превращаются в одно или несколько различных веществ (называемых продуктами).
Определение: химическая реакция
Химическая реакция — это процесс, при котором одно или несколько веществ превращаются в одно или несколько различных веществ.
Мы склонны думать о реакции, прогрессирующей только в одном направлении: reactantsproducts⟶
Когда реакция идет только в одном направлении, мы говорим, что она необратима.
Определение: необратимая реакция
Необратимая реакция — это реакция, которая протекает только в одном направлении; продукты не вступают в реакцию вместе, чтобы преобразовать реагенты.
Примером этого является сжигание топлива в горелке Бунзена. Топливо часто представляет собой смесь пропана и бутана.Эти углеводороды вступают в реакцию с кислородом воздуха при воспламенении.
Топливо часто представляет собой смесь пропана и бутана.Эти углеводороды вступают в реакцию с кислородом воздуха при воспламенении.
Реакция горения пропана: CH () + 5O () 4HO () + 3CO () 38222gggg
Это необратимая реакция.
Реакция завершена, это означает, что все частицы реагента прореагировали и были преобразованы в продукт. Продукты, вода и углекислый газ стабильны, поэтому при нормальных условиях они не будут спонтанно реагировать с образованием пропана и кислорода. Реакция необратима.
Мы можем написать общее уравнение необратимой реакции: ABCD + ⟶ +
Пример 1: Идентификация необратимой реакции по данным наблюдений
Спирт воспламеняется и собирается смесь двух разных газов. Какой вывод можно сделать из этого наблюдения?
- Реакция необратима.
- В уравнении реакции будет использоваться символ.
- Реакция эндотермическая.
- Органический спирт содержит кристаллизационную воду.
- Реакция обратимая.

Ответ
Нам говорят, что исходным веществом в этой реакции является спирт, и что он воспламеняется. Когда вещество воспламеняется, мы предполагаем, что оно горит на воздухе. Другими словами, мы предполагаем, что он вступает в реакцию сгорания с кислородом воздуха. Нам говорят, что после возгорания спирта улавливаются два разных газа. Поскольку два газа отличаются друг от друга и отличаются от двух исходных веществ (спирта и кислорода), мы можем сделать вывод, что реакция действительно произошла.Поскольку исходное вещество, спирт, не было собрано в конце реакции, мы также можем предположить, что все реагенты превратились в продукты и что продукты не рекомбинируют с образованием спирта. Можно сделать вывод, что реакция необратима. Итак, правильный ответ — А, реакция необратима.
Однако в действительности многие реакции могут протекать и в обратном направлении. Продукты могут взаимодействовать, чтобы преобразовать реагенты, подвергаясь обратной реакции: продуктыреагенты⟶ или CDAB + ⟶ +
Итак, мы можем написать уравнение с двумя полустрелками, каждая из которых указывает в противоположном направлении. Эти стрелки показывают, что реакция может идти как в прямом, так и в обратном направлении: продукты или A + BC + D
Эти стрелки показывают, что реакция может идти как в прямом, так и в обратном направлении: продукты или A + BC + D
Мы называем это обратимой реакцией. В такой реакции одновременно протекают как прямая, так и обратная реакции. A и B реагируют с образованием C и D, в то время как C и D взаимодействуют вместе с образованием A и B.
Определение: обратимая реакция
Обратимая реакция — это реакция, которая протекает в обоих направлениях; реагенты реагируют с образованием продуктов, а продукты реагируют с преобразованием реагентов.
Однако важно отметить, что в принципе все реакции обратимы. Однако условия, необходимые для возникновения обратной реакции, зачастую очень трудно достичь. Например, для протекания обратной реакции горения пропана потребуются очень специфические условия. Эти условия не могут быть легко достижимы в стандартной лаборатории, и поэтому мы говорим, что при сгорании происходит только прямая реакция.
Пример 2: Определение утверждения, которое правильно описывает обратимую реакцию
Какое из следующих утверждений об обратимых реакциях верно?
- Обратимая реакция обозначается символом в химическом уравнении.

- Обратимая реакция эндотермична в обоих направлениях.
- В обратимой реакции всегда участвуют гидратированные и безводные соли.
- Обратимой реакцией часто является реакция горения.
- Обратимая реакция — это химическая реакция, которая может протекать в обоих направлениях.
Ответ
В обратимой реакции реагенты могут реагировать с образованием продуктов, а продукты могут реагировать с преобразованием реагентов. Это общее уравнение обратимой реакции: A + BC + D
Итак, A и B могут реагировать в прямой реакции с образованием C и D, и в то же время C и D могут реагировать в обратной реакции с образованием A и B.Правильный ответ — Е, обратимая реакция — это химическая реакция, которая может протекать в обоих направлениях.
Обратимые реакции более заметны для нас, когда они неполные, другими словами, когда не все реагенты превращаются в продукты.
Пример обратимой реакции — когда хлорид аммония, белое твердое вещество, нагревается и разлагается на два разных продукта: газообразный аммиак и газообразный хлористый водород. Эти два продукта могут легко реагировать друг с другом при охлаждении с образованием исходного реагента, хлорида аммония: NHCl () NH () + HCl () (обратимая реакция) 43sgg
Эти два продукта могут легко реагировать друг с другом при охлаждении с образованием исходного реагента, хлорида аммония: NHCl () NH () + HCl () (обратимая реакция) 43sgg
Иногда отверстие пробирки закупоривают ватой, чтобы предотвратить выход охлаждающих паров, но позволяя выходить более легким газам в воздухе.Таким образом, компоненты реакции удерживаются внутри пробирки, и газообразные продукты могут реагировать друг с другом.
Эта реакция показывает нам, что тепловая энергия (ввод или отвод) является одним из условий, которые могут влиять на направление обратимой реакции. Если прямая реакция является эндотермической, как в следующем случае, то подвод тепловой энергии (за счет нагрева химикатов) будет стимулировать прямую реакцию: NHCl () NH () + HCl () 43sgg
Обратная реакция NH () + HCl () NHCl () 34 г / г тогда экзотермический.Удаление тепловой энергии (путем охлаждения химикатов) вызовет обратную реакцию.
Однако важно помнить, что не все прямые реакции являются эндотермическими и не все обратные реакции являются экзотермическими.
Обратимая реакция 2NO () NO () 224ggexothermicendothermic
показывает, что прямая реакция является экзотермической, а обратная — эндотермической. Количество энергии, высвобождаемой при прямой реакции — другими словами, изменение энтальпии, Δ𝐻 — такое же, как количество энергии, поглощенной обратной реакцией.
Следующая диаграмма путей реакции показывает, что количество энергии, поглощаемой эндотермической реакцией обратимой реакции (Δ𝐻endo) или высвобождаемой экзотермической реакцией обратимой реакции (Δ𝐻exo), одинаково.
Пример 3: Понимание того, как прямая и обратная реакции связаны с точки зрения передачи энергии
В следующей химической реакции прямая реакция является эндотермической: CuSO · 5HO () CuSO () + 5HO () 4242ssl
Что должно быть правдой в отношении обратной реакции?
- Обратная реакция имеет меньшее общее изменение энергии.
- Обратная реакция имеет большее общее изменение энергии.
- Обратная реакция также эндотермическая.

- Обратная реакция экзотермическая.
- Обратная реакция поглощает тепло из окружающей среды.
Ответ
Нам говорят, что прямая реакция CuSO · 5HO () CuSO () + 5HO () 4242ssl эндотермический. Это означает, что эта реакция поглощает тепловую энергию из окружающей среды. Количество тепловой энергии, передаваемой из окружающей среды реагенту во время этого процесса дегидратации (прямая реакция), такое же, как количество энергии, переданное от продукта окружающей среде во время реакции гидратации безводного продукта CuSO () 4s.Реакция гидратации (обратная) имеет вид CuSO () + 5HO () CuSO · 5HO () 4242sls
Следовательно, эта обратная реакция является экзотермической, и поэтому правильный ответ — D, обратная реакция экзотермическая.
Разрыв связи обычно является эндотермическим процессом, поскольку для разрыва связей в реагентах требуется энергия. Затем атомы реагентов перегруппировываются с образованием продуктов. Образование связей — это обычно экзотермический процесс, при котором выделяется энергия. Мы называем общую реакцию эндотермической, если общее количество поглощенной энергии превышает общее количество выделенной энергии.И наоборот, при экзотермической реакции общее количество выделенной энергии больше, чем общее количество поглощенной энергии.
Мы называем общую реакцию эндотермической, если общее количество поглощенной энергии превышает общее количество выделенной энергии.И наоборот, при экзотермической реакции общее количество выделенной энергии больше, чем общее количество поглощенной энергии.
Рассмотрим еще несколько примеров обратимых реакций.
CuSO · 5HO () 42s, гидратированный сульфат меди (II), представляет собой голубое кристаллическое твердое вещество. Он содержит кристаллизационную воду, поэтому мы называем его гидратированной солью.
Определение: гидратированная соль
Гидратированная соль — это соль, содержащая кристаллизационную воду.
Если мы нагреем некоторые из этих кристаллов гидратированного сульфата меди, мы заметим, что выделяется белый пар, и кристаллы превращаются в белый порошок.Пар — это пар или газообразная вода. Оставшийся белый порошок представляет собой безводный или дегидратированный сульфат меди (II), CuSO () 4s.
Определение: безводная (дегидратированная) соль
Безводная или дегидратированная соль — это соль, не содержащая кристаллизационной воды.
Это реакция, которая происходит: CuSO · 5HO () CuSO () 5HO () Гидратированный сульфат меди (II) Безводный сульфат меди (II) BlueWhite4242ssg +
Мы можем наблюдать и обратную реакцию, добавив несколько капель воды в белый безводный порошок.Белый порошок снова станет синим, как показано на фотографии ниже. Безводный сульфат меди (II) снова становится синим по мере того, как он становится гидратированным, и из-за этих ярких различий в цвете мы можем использовать сульфат меди (II) для проверки наличия воды.
Прямая реакция эндотермическая и протекает при нагревании. И наоборот, когда добавляется вода, обратная реакция выделяет тепловую энергию, потому что она экзотермична. Это часто бывает с гидратированными солями.
Пример 4: Определение неверного утверждения из данного списка утверждений, описывающих обратимую реакцию
Выберите утверждение, которое не точно описывает следующую химическую реакцию: NaCO · 10HO () NaCO () + 10HO () 232232ssg
- Реакция обратима.

- Образуются синие кристаллы.
- Производится карбонат натрия безводный.
- Прямая реакция эндотермическая.
- HO () 2g образуется.
Ответ
В данной химической реакции есть две полустрелки, указывающие в противоположных направлениях, поэтому мы знаем, что реакция обратима. Реагент может распадаться с образованием продуктов, а продукты объединяться с образованием реагента. Утверждение А, реакция обратима , правильно описывает реакцию.
Реагент содержит кристаллизационную воду, поэтому это гидратированное соединение. При нагревании образуется продукт NaCO () 23s, не содержащий кристаллизационной воды. Продукт представляет собой безводный карбонат натрия, где «безводный» означает «без кристаллизационной воды». Заявление C, безводный карбонат натрия получается , правильно описывает реакцию.
Чтобы запустить прямую реакцию — другими словами, чтобы удалить кристаллизационную воду из гидратированного соединения — тепловая энергия должна поглощаться реагентом, NaCO · 10HO () 232s. Таким образом, прямая реакция эндотермична. Положение D, прямая реакция эндотермическая , точно описывает реакцию.
Таким образом, прямая реакция эндотермична. Положение D, прямая реакция эндотермическая , точно описывает реакцию.
Уравнение реакции показывает нам, что газообразная вода является одним из продуктов. Итак, утверждение E, HO () 2g образует , является точным утверждением для этой реакции.
До сих пор мы видели, что утверждения A, C, D и E являются правильными утверждениями. Путем исключения мы можем сделать вывод, что утверждение B, синих кристаллов образуются , не является точным описанием продукта NaCO () 23s.NaCO () 23s — белое вещество. (Общеизвестное кристаллическое вещество синего цвета — это CuSO · 5HO () 42s, хотя есть много других голубых кристаллических соединений.)
Если в замкнутой системе протекают как прямая, так и обратная реакции, то через некоторое время реакция достигнет равновесия. Например, это происходит со слабыми кислотами и основаниями в растворе. Слабые кислоты и слабые основания обратимо диссоциируют в воде. Примером этого является этановая кислота, CHCOOH () 3aq, которая не вся превращается в ионы в воде, но некоторые ионы повторно связываются с образованием CHCOOh4 одновременно с диссоциацией других молекул CHCOOh4.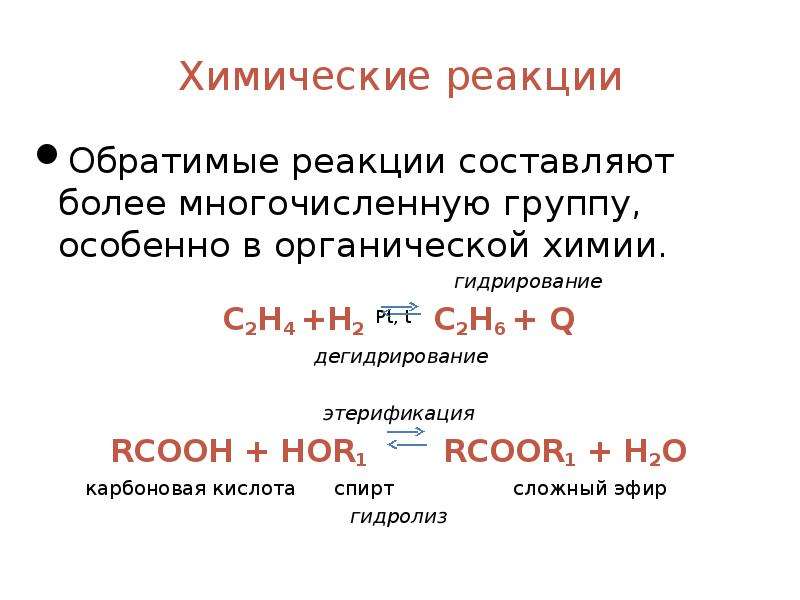 Возникающая обратимая реакция или процесс: CHCOOH () CHCOO () + H () 33– + aqaqaq
Возникающая обратимая реакция или процесс: CHCOOH () CHCOO () + H () 33– + aqaqaq
Как прямой, так и обратный процессы происходят одновременно и будут продолжаться одновременно, пока система не достигнет равновесия. В состоянии равновесия концентрации всех видов в системе останутся постоянными, но не обязательно одинаковыми. Концентрация CHCOOh4 в левой части уравнения и концентрации ионов в правой части уравнения зависят от условий, например температуры.Если условия изменятся, то равновесие «сместится» либо в левую, либо в правую часть уравнения, изменяя концентрацию каждого вида. Однако как прямая, так и обратная реакции будут продолжаться. Они будут происходить с одинаковой скоростью, и мы называем это динамическим равновесием.
Определение: динамическое равновесие
Динамическое равновесие — это равновесие между прямой и обратной реакциями, при котором обе реакции протекают с одинаковой ненулевой скоростью.
Существует еще один тип равновесия, называемый статическим равновесием. В статическом равновесии скорости прямой и обратной реакции равны нулю.
В статическом равновесии скорости прямой и обратной реакции равны нулю.
Определение: Статическое равновесие
Статическое равновесие — это равновесие, при котором скорости прямой и обратной реакции равны нулю.
Динамическое и статическое равновесие более подробно рассматриваются в другом объяснении.
Ключевые моменты
- Необратимая реакция идет только в одном направлении; продукты не вступают в реакцию вместе, чтобы преобразовать реагенты: реагентыпродуктыABCD⟶ + ⟶ +
- Обратимая реакция протекает в обоих направлениях; реагенты реагируют с образованием продуктов, а продукты реагируют с преобразованием реагентов: реагенты продукты ABCD ++
- Такие условия, как температура, влияют на реакции обратимой реакции.
- Если прямая реакция экзотермическая, то обратная реакция эндотермическая.
- Если прямая реакция эндотермическая, то обратная реакция экзотермическая.
- При обратимой реакции количество энергии, передаваемой между системой и окружающей средой, одинаково для прямой и обратной реакции.

- В динамическом равновесии скорость прямой реакции и скорость обратной реакции одинаковы и отличны от нуля.
- В статическом равновесии скорости прямой и обратной реакции равны нулю.
Видеоурок: Обратимые и необратимые реакции
Стенограмма видео
Обычно мы думаем о реакциях
происходящие в одном направлении, где реагенты объединяются с образованием продуктов. Но в этом видео мы увидим, как
некоторые реакции могут идти в обратном направлении, когда продукты могут реагировать с образованием
реагенты. В этом случае реакция
обратимый.В этом видео мы узнаем, как
определить обратимость химических реакций, выявить примеры обратимых и
необратимых процессов, и обсудить, как изменение условий реакции может
заставьте его двигаться в обратном направлении.
В начале 1800-х гг. Ученые думали, что реакция идет только в одном направлении, что кажется разумным. В конце концов, для многих процессов вы не можете заставить вещи реагировать в обратном направлении.Представьте, что вы пытаетесь разжечь реакция горения, например, когда метан горит в кислороде с образованием диоксида углерода и вода. Нам придется заставить углекислый газ и вода, чтобы снова вступить в реакцию с образованием метана и кислорода. Невозможно! Но был французский химик назвал Клода Луи Бертолле, который изучал реакцию, при которой карбонат натрия реагирует с хлоридом кальция с образованием карбоната кальция и хлорида натрия.
Он совершил поездку к соленому озеру, где
он сделал интересное наблюдение.Образуется карбонат натрия.
на берегу озера. В конце концов он понял, что
большое количество соли в соленом озере или хлорид натрия реагировал с
карбонат кальция, который содержится в панцирях морских организмов. Другими словами, реакция была
идет в обратном направлении от того, что он изучал в лаборатории. Как оказалось, есть много
реакции, которые не просто идут в прямом направлении, где реагенты объединяются, чтобы
формировать изделия.Есть много реакций, которые могут пойти
в обратном направлении, где продукты могут объединяться, чтобы сформировать
реагенты.
Другими словами, реакция была
идет в обратном направлении от того, что он изучал в лаборатории. Как оказалось, есть много
реакции, которые не просто идут в прямом направлении, где реагенты объединяются, чтобы
формировать изделия.Есть много реакций, которые могут пойти
в обратном направлении, где продукты могут объединяться, чтобы сформировать
реагенты.
Когда реакция может идти только в
прямое направление, подобное сгоранию метана, называется необратимым
реакция. Но когда реакция идет, оба в
прямое и обратное направление, мы называем это обратимым
реакция. Мы можем указать обратимый
реакция в нашем химическом уравнении с помощью двух односторонних стрелок.Так почему же реакции могут
иногда идут в прямом направлении, а иногда и в обратном
как Бертолле увидел его реакцию? Что ж, оказывается, что меняется
условия, в которых протекает реакция, могут иногда вызывать реакцию на
обеспечить регресс. Чтобы почувствовать это, давайте возьмем
взглянем на некоторые классические примеры обратимых реакций.
Чтобы почувствовать это, давайте возьмем
взглянем на некоторые классические примеры обратимых реакций.
Безводный сульфат меди (II) представляет собой белый порошок, но когда он подвергается воздействию воды, он образует гидратированную соль и превращается синий.Это делает его чрезвычайно полезным в качестве тест, чтобы определить, является ли это вещество водой. Когда вы нагреваете этот синий гидратированный сульфат меди (II), он вытесняет воду из соли, в результате чего реакция идет в обратном направлении, что дает нам белый порошок, безводную медь (II) сульфат, еще раз.
Nh5Cl или хлорид аммония
еще один белый порошок. Когда он нагревается, он разлагается,
образуя два бесцветных газа, аммиак и хлороводород.Если вы выполните эту реакцию в
закупорив пробирку, вы заметите, что по мере протекания реакции белый порошок будет
форма на холодном конце пробирки. Этот белый порошок, который образуется,
фактически хлорид аммония, то же самое вещество, с которого мы начали. Когда аммиак и водород
хлоридные газы достаточно остывают, они вступают в реакцию друг с другом, вызывая реакцию
пойти в обратном направлении и снова образовать хлорид аммония.
Этот белый порошок, который образуется,
фактически хлорид аммония, то же самое вещество, с которого мы начали. Когда аммиак и водород
хлоридные газы достаточно остывают, они вступают в реакцию друг с другом, вызывая реакцию
пойти в обратном направлении и снова образовать хлорид аммония.
Это не значит, что все
реакции идут в прямом или обратном направлении, потому что мы добавляем или убираем тепло. Есть много других
обратимые реакции, которые происходят из-за изменений в других условиях, таких как pH
индикаторы. Индикаторы pH чрезвычайно полезны в экспериментах с кислотно-щелочной реакцией.
вроде титрований. Можем добавить несколько капель индикатора
к нашему аналиту в нашем эксперименте по титрованию, чтобы мы могли приблизительно контролировать pH
решение.Когда мы впервые добавляем индикатор pH
в нашем решении это один цвет.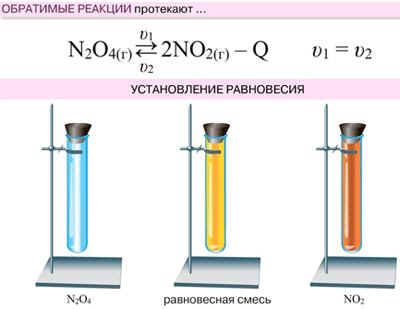 Но по мере того, как мы проводим титрование
Поэкспериментируйте, в этом случае добавление основания к кислоте изменит pH. В определенный момент, когда мы добавили
Достаточно нашей базы, индикатор pH внезапно изменит цвет.
Но по мере того, как мы проводим титрование
Поэкспериментируйте, в этом случае добавление основания к кислоте изменит pH. В определенный момент, когда мы добавили
Достаточно нашей базы, индикатор pH внезапно изменит цвет.
Как оказалось, эти pH индикаторы — большие органические молекулы, имеющие две формы. В одной форме индикатор имеет водород, и это один цвет.В другой форме индикатор потерял этот водород, и теперь он другого цвета. Цвет индикатора меняется в зависимости от концентрации ионов водорода в растворе. Когда больше ионов H + в раствор, означающий, что раствор кислый, индикатор — одноцветный. Но поскольку мы добавляем базу во время этого эксперимента, он будет реагировать с ионами H + в растворе, вызывая концентрация ионов H + уменьшится, что сделает раствор более щелочным, и индикатор изменит цвет.
Поскольку pH связан с
концентрация ионов водорода в растворе, мы можем использовать цвет pH
индикатор, чтобы дать нам приблизительную оценку pH раствора. Точный pH, при котором этот цвет меняет
бывает зависит от свойств индикатора. У нас много разных молекул
которые могут действовать как индикаторы, то есть у нас есть индикаторы, которые мы можем использовать для различных
значений pH.
Точный pH, при котором этот цвет меняет
бывает зависит от свойств индикатора. У нас много разных молекул
которые могут действовать как индикаторы, то есть у нас есть индикаторы, которые мы можем использовать для различных
значений pH.
Эти примеры не должны
предполагают, что для всех обратимых реакций у нас есть прямая реакция, происходящая в
в одних условиях и обратная реакция, протекающая в других условиях.Иногда и нападающий, и
при этом происходят обратные реакции. Это обычное дело в реакциях, которые
вовлекают слабые кислоты и слабые основания. Например, когда мы вводим
слабокислая фтористоводородная кислота в воду, она будет диссоциировать и образовывать ионы H + и F−
ионы. Но тогда ионы F− способны
реагирует с ионами H + с образованием плавиковой кислоты. Затем эти новообразованные молекулы
плавиковой кислоты может диссоциировать с образованием ионов H + и F−. Ну, некоторые из существующих ионов F−
снова будет реагировать с ионами водорода с образованием плавиковой кислоты.
Ну, некоторые из существующих ионов F−
снова будет реагировать с ионами водорода с образованием плавиковой кислоты.
Другими словами, нападающий и при этом происходят обратные реакции. Когда это происходит, нападающий и обратные реакции будут продолжаться до тех пор, пока система не достигнет равновесия. где концентрация плавиковой кислоты, ионов водорода и ионов F− не равна дольше меняется. Теперь это равновесие не статично. равновесие, при котором скорость прямой реакции равна нулю, а скорость обратная реакция равна нулю.Скорее, обе реакции все еще происходит. Их ставки просто равны каждому другое, поэтому чистых изменений в концентрациях наших химических веществ нет. Такое равновесие называется динамическое равновесие.
Осталась последняя тема для
обсудите, прежде чем практиковать то, что мы узнали, и это роль энергии в
обратимые реакции. Во время химического
реакции, некоторые или все связи между атомами в наших реагентах разрываются, так что
что атомы могут перегруппироваться, чтобы сформировать продукты.Процесс разрыва связей
требует энергии. Процесс, который должен поглощать энергию
эндотермический. И наоборот, процесс изготовления
облигации экзотермичны. Это высвобождает энергию. Когда реакция высвобождает больше
энергии, чем она поглощает, эта реакция экзотермична, что соответствует отрицательному
изменение энтальпии. Но когда реакция поглощает больше
энергии, чем выделяется, реакция эндотермическая, что соответствует
положительное изменение энтальпии.
Во время химического
реакции, некоторые или все связи между атомами в наших реагентах разрываются, так что
что атомы могут перегруппироваться, чтобы сформировать продукты.Процесс разрыва связей
требует энергии. Процесс, который должен поглощать энергию
эндотермический. И наоборот, процесс изготовления
облигации экзотермичны. Это высвобождает энергию. Когда реакция высвобождает больше
энергии, чем она поглощает, эта реакция экзотермична, что соответствует отрицательному
изменение энтальпии. Но когда реакция поглощает больше
энергии, чем выделяется, реакция эндотермическая, что соответствует
положительное изменение энтальпии.
Что это значит для
обратимые реакции? Что ж, скажем так, наш форвард
реакция эндотермическая, поэтому реакция будет иметь положительное изменение
энтальпия. Какая бы обратная реакция
быть? Когда мы смотрим на нашу диаграмму, мы можем
видим, что когда мы переходим от продуктов к реагентам, реакция эндотермична, потому что
у нас есть положительное изменение энтальпии. Но когда мы пойдем другим путем,
при образовании реагентов из продуктов изменение энтальпии отрицательное, что означает
что реакция будет экзотермической.Это всегда будет верно для
обратимые реакции. В одном направлении реакция будет
будет эндотермической, а в обратном направлении реакция будет экзотермической.
Но когда мы пойдем другим путем,
при образовании реагентов из продуктов изменение энтальпии отрицательное, что означает
что реакция будет экзотермической.Это всегда будет верно для
обратимые реакции. В одном направлении реакция будет
будет эндотермической, а в обратном направлении реакция будет экзотермической.
Однако, если мы посмотрим на общее изменение энтальпии реакции, это будет то же самое, только знак будет иначе. Другими словами, если в форварде направление изменения энтальпии составляет 100 джоулей, изменение энтальпии будет равно отрицательные 100 джоулей в обратном направлении.Итак, теперь мы обсудили все, что нам нужно чтобы узнать об обратимых и необратимых реакциях, так что давайте попробуем немного попрактиковаться проблемы.
Какое из следующих утверждений
про обратимые реакции верно? (A) Часто обратимая реакция
реакция горения. (B) Обратимая реакция
обозначается одинарной двунаправленной стрелкой в химическом уравнении. (C) Обратимая реакция — это
химическая реакция, которая может протекать в обоих направлениях.(D) Обратимая реакция всегда
включает гидратированные и безводные соли. (E) Обратимая реакция
эндотермический в обоих направлениях.
(B) Обратимая реакция
обозначается одинарной двунаправленной стрелкой в химическом уравнении. (C) Обратимая реакция — это
химическая реакция, которая может протекать в обоих направлениях.(D) Обратимая реакция всегда
включает гидратированные и безводные соли. (E) Обратимая реакция
эндотермический в обоих направлениях.
Обратимая реакция — это реакция
это не только идет в прямом направлении, где реагенты объединяются, чтобы сформировать
продукты, но также и обратное направление, где продукты объединяются, чтобы сформировать
реагенты. Мы можем указать это в нашем
химическое уравнение с помощью двух односторонних стрелок.С этой информацией ответьте
выбор (C) явно правильный ответ. Обратимая реакция — это химическая
реакция, которая может происходить в обоих направлениях, прямом и обратном
направление. Но давайте бегло рассмотрим
другие варианты ответов, чтобы понять, почему они ложны.
Вариант ответа (A) говорит, что Обратимая реакция часто является реакцией горения. Пример реакции горения это горение метана, при котором метан сгорает в кислороде с образованием углерода. диоксид и вода.Если бы эта реакция была обратимой, он должен пойти в обратном направлении, где углекислый газ вступает в реакцию с водой. с образованием метана и кислорода. Трудно представить себе этот процесс происходит. Поскольку реакции горения не обычно идут в обратном направлении, они не всегда обратимы. Вариант ответа (B) говорит, что обратимые реакции обозначены одинарной двунаправленной стрелкой. Но мы видели, насколько обратим реакции обозначены двумя односторонними стрелками в химическом уравнении.
Вариант ответа (D) говорит, что
В обратимой реакции всегда участвуют гидратированные и безводные соли. Есть несколько примеров
обратимые реакции с участием гидратированных и безводных солей. Например, безводная медь (II)
сульфат может реагировать с водой с образованием гидратированного сульфата меди (II). Эта реакция может быть обращена вспять, если
гидратированный сульфат меди (II) нагревают. Но есть масса примеров
обратимые реакции, в которых не участвуют эти гидратированные соли, например,
реакция любой слабой кислоты или основания с водой, такой как плавиковая кислота.Иногда обратимые реакции
включают гидратированные и безводные соли, но не всегда.
Например, безводная медь (II)
сульфат может реагировать с водой с образованием гидратированного сульфата меди (II). Эта реакция может быть обращена вспять, если
гидратированный сульфат меди (II) нагревают. Но есть масса примеров
обратимые реакции, в которых не участвуют эти гидратированные соли, например,
реакция любой слабой кислоты или основания с водой, такой как плавиковая кислота.Иногда обратимые реакции
включают гидратированные и безводные соли, но не всегда.
Наш окончательный вариант ответа гласит, что
обратимая реакция эндотермична в обоих направлениях. Напомним, эндотермический означает, что
изменение энтальпии реакции положительное. Это означает, что в целом
реакция забирает энергию. Глядя на набросок энергии
На диаграмме мы видим, что прямая реакция, когда A плюс B реагирует с образованием C плюс D
является эндотермическим, поскольку изменение энтальпии положительное. А как насчет обратного
направление, в котором C плюс D реагирует, образуя A плюс B? В этом случае мы получили бы
отрицательное изменение энтальпии, что означает, что обратная реакция экзотермическая, а не
эндотермический. Так обратимая реакция будет
эндотермический в одном направлении, но экзотермический в другом направлении.
А как насчет обратного
направление, в котором C плюс D реагирует, образуя A плюс B? В этом случае мы получили бы
отрицательное изменение энтальпии, что означает, что обратная реакция экзотермическая, а не
эндотермический. Так обратимая реакция будет
эндотермический в одном направлении, но экзотермический в другом направлении.
Итак, из утверждений, которые мы рассмотрели, единственное, что было правдой об обратимых реакциях, это то, что обратимая реакция может двигаться в обоих направлениях.
Какова обратная реакция на следующая обратимая реакция? CoCl2 плюс 6h3O в равновесии с CoCl2 6h3O.
Обратимая реакция — это реакция
которые могут идти в обоих направлениях. Значит, не только это
реакция идет в прямом направлении, где безводный хлорид кобальта (II) реагирует
с водой с образованием гидратированного хлорида кобальта (II), но реакция также может идти
в обратном направлении, о чем нас и спрашивает.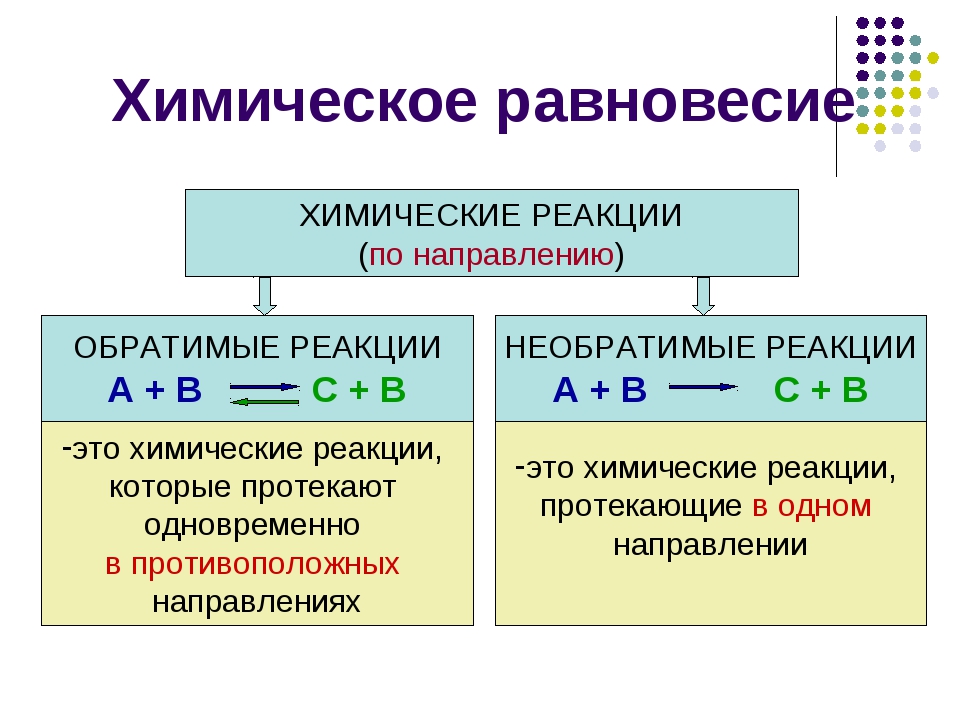 В прямом направлении вроде
мы только что видели, как реагенты образуют продукты. Но в обратной реакции
продукты образуют реагенты. Итак, обратная реакция на это
реакции будут наши продукты, CoCl2 6h3O, реагирующие с образованием наших реагентов,
безводный хлорид кобальта (II) и вода.
В прямом направлении вроде
мы только что видели, как реагенты образуют продукты. Но в обратной реакции
продукты образуют реагенты. Итак, обратная реакция на это
реакции будут наши продукты, CoCl2 6h3O, реагирующие с образованием наших реагентов,
безводный хлорид кобальта (II) и вода.
Теперь подведем итоги всего, что мы
выучил ключевые моменты этого урока. Когда реакция идет вперед
направлении, реагенты образуют продукты.И когда реакция идет в
в обратном направлении продукты образуют реагенты. Если реакция может идти как в
прямое и обратное направление, это обратимая реакция, которую мы обозначаем
две однонаправленные стрелки. Но если реакция может только войти
в прямом направлении, это необратимая реакция, которую мы можем указать в нашем
химическое уравнение с помощью одинарной двусторонней стрелки. Изменение условий, при которых
реакция может вызвать обратную реакцию. Обратимые реакции всегда
эндотермический в одном направлении и экзотермический в другом направлении.
Обратимые реакции всегда
эндотермический в одном направлении и экзотермический в другом направлении.
CHEM-GUIDE: Обратимые и необратимые реакции
Общеизвестно, что большинство реакций, проводимых в закрытых сосудах, не завершаются при заданном наборе условий температуры и давления. Фактически во всех таких случаях в исходном состоянии присутствуют только реагенты, но по мере протекания реакции концентрация реагентов уменьшается, а концентрация продуктов увеличивается.Наконец, достигается стадия, когда не наблюдается дальнейшего изменения концентрации реагентов и продуктов.Это состояние, при котором концентрация реагентов и продуктов не меняется со временем, называется состоянием химического равновесия.
Количество неиспользованных реагентов зависит от экспериментальных условий, таких как концентрация, температура, давление и характер реакции.Если смесь газообразного водорода и паров йода заставить реагировать при 717 К в закрытом сосуде в течение примерно 2 — 3 часов, газообразный йодистый водород образуется в соответствии со следующим уравнением:
Но вместе с газообразным йодистым водородом будет осталось некоторое количество непрореагировавшего газообразного водорода и газообразного йода.
Это означает, что продукты определенных реакций можно превратить обратно в реагенты. Эти типы реакций называются обратимыми.
Таким образом, в обратимых реакциях продукты могут реагировать друг с другом в подходящих условиях, возвращая реагенты.Другими словами, в обратимых реакциях реакция протекает как в прямом, так и в обратном направлении. Обратимая реакция может быть выражена как:
Эти обратимые реакции никогда не завершаются, если они проводятся в закрытом контейнере. Для обратимой химической реакции состояние равновесия достигается, когда скорость, с которой протекает химическая реакция в прямом направлении, равна скорости, с которой протекает обратная реакция.
Скорость прямой реакции = Скорость обратной реакции
Рассмотрим обратимую реакцию Когда эта реакция проводится при высоком давлении и температуре в закрытом контейнере, в состоянии равновесия,Скорость образования аммиака = Скорость разложения аммиак
Теперь возникает вопрос, все ли молекулы аммиака остаются нетронутыми и не разлагаются? Все молекулы азота и водорода становятся неактивными и не соединяются?Если это так, мы бы сказали, что статическое равновесие достигнуто.
Чтобы понять концепцию статического равновесия, давайте рассмотрим двух детей, сидящих на качелях. В точке равновесия (т. Е. В положении равновесия) движение детей на качелях не происходит. Статическое равновесиеОднако в случае обратимой реакции статическое равновесие не устанавливается.
В случае аммиака с использованием дейтерия, D (изотоп водорода), было доказано, что даже при равновесии разложение аммиака на водород и азот и соединение водорода и азота в аммиак продолжается. Это равновесие носит динамический характер и поэтому называется динамическим равновесием.
Это равновесие носит динамический характер и поэтому называется динамическим равновесием.Динамическое установившееся состояние можно сравнить с равновесием воды в резервуаре, который одновременно наполняется и сливается. Если скорость втекающей воды равна скорости истечения воды, количество воды в резервуаре останется неизменным, как и количество веществ в состоянии химического равновесия.
Динамическое равновесие
Скорость поступления воды = Скорость выхода водыСледовательно, уровень воды постоянен
Аналогично, некоторые другие обратимые реакции:С другой стороны, химическая реакция, в которой образуются продукты, не объединяются, чтобы дать реагенты, известны как необратимые реакции.
Например, хлорат калия разлагается при нагревании с образованием хлорида калия и кислорода. Однако продукты не могут объединяться с образованием хлората калия. В случае необратимых физико-химических процессов изменение происходит только в одном направлении и процессы идут до завершения. Однако обратимые процессы не завершаются и, кажется, останавливаются (достигают состояния химического равновесия), даже если некоторые исходные материалы остаются.
Однако обратимые процессы не завершаются и, кажется, останавливаются (достигают состояния химического равновесия), даже если некоторые исходные материалы остаются.Вот некоторые примеры необратимых реакций:
Можно отметить, что для обратимых реакций между реагентами и продуктами используется символ.Для необратимых реакций используется однонаправленная стрелка.Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Примечания об обратимых и необратимых реакциях и химическом равновесии
Химическая реакция может быть обратимой или необратимой. Необратимая химическая реакция:
При необратимой химической реакции реагенты объединяются с образованием продуктов, но эти продукты не могут производить реагенты в аналогичных условиях.
Все реагенты полностью реагируют с образованием продуктов.
Пример:
Обратимая химическая реакция
В обратимой химической реакции реагенты объединяются, образуя продукты, и эти продукты вступают в реакцию внутри самих себя, снова образуя реагенты.
Поскольку продукты и реагенты постоянно находятся в реакции, обратимые реакции никогда не доходят до состояния завершения.
Пример:
В обратимой реакции прямая реакция: превращение реагентов в продукты часто бывает неполной даже после того, как реакция протекает в течение длительного времени.
Рассмотрим обратимую реакцию с реагентами
Первоначально прямая реакция протекает с высокой скоростью, при этом реагенты превращаются в продукты.Как только продукт образуется, они снова начинают реагировать с образованием реагентов, тем самым начиная обратную реакцию. В этом случае обратная реакция происходит с высокой скоростью, а прямая реакция замедляется.
По прошествии длительного времени достигается стадия, когда и прямая, и обратная реакции происходят с одинаковой скоростью.
Равновесие бывает двух типов: физическое и химическое.
Когда между физическими формами химического вещества существует равновесие, оно называется физическим равновесием.
Пример: разжижение льда в воду
Когда в химической реакции существует равновесие, это называется химическим равновесием. Это динамическое равновесие, что означает, что в замкнутой системе протекает непрерывная реакция.
Пример:
Реакция хлорида железа с раствором тиоцианата аммония.
Условия химического равновесия:
Химическая реакция должна происходить в закрытом сосуде.
Химическая реакция должна быть обратимой.
Скорость прямой реакции и обратной реакции должны быть равны.
Такие факторы, как концентрация, давление и температура компонентов, которые влияют на химическое равновесие, должны оставаться постоянными.
Факторы, влияющие на химическое равновесие:
Химическое равновесие зависит от многих факторов, таких как концентрация, давление и температура. Все эти факторы объясняются на основе принципа Ле Шателье.
Согласно принципу Ле Шателье, если система в состоянии равновесия подвергается напряжению, то равновесие всегда будет двигаться таким образом, чтобы уменьшить напряжение.
В обратимой реакции увеличение концентрации реагентов способствует прямой реакции, тогда как увеличение концентрации продуктов способствует обратной реакции.
В обратимой реакции увеличение давления способствует реакции, в которой количество молей уменьшается. В реакции, в которой реагенты и продукты имеют равное количество молей, на равновесие не влияет какое-либо изменение давления.
Понижение температуры способствует эндотермической реакции, тогда как повышение температуры способствует экзотермической реакции.
Получение аммиака в процессе Габера — одно из применений принципа Ле Шателье. Здесь приведены условия, благоприятные для этой реакции.
Здесь приведены условия, благоприятные для этой реакции.
Равновесие и кинетика
Равновесие и кинетикаРеакция Тарифы и эквильбриум
Поскольку мы изучили химические реакции, у нас есть выучил
- как определить тип реакция
- как предсказать продукты реакция
- как определить сумму или концентрация произведенных продуктов с учетом количества или концентрации реагентов
По большей части мы также предполагали, что реакции протекают только в одном направлении, то есть от реагента к продукт.Однако мы упоминали, что в кислотно-основных реакциях и для окислительно-восстановительных реакций реакции гипотетически обратимы, но предпочитаю идти в направлении от сильной к слабой кислоте / основанию или окислитель / восстановитель. Теперь мы хотели бы расширить наше обсуждение реакций, чтобы рассмотреть реакции, которые легко обратимы. Мы хотел бы узнать о трех дополнительных функциях любого реакция:
- Степень протекания реакции в прямом направлении
- изменения энергии, происходящие в реакция
- скорость, с которой реакция выручка
Как мы увидим, первые два близко
Связанный. Энергетические изменения чрезвычайно важны для мира, в котором
большие потребности в энергии для стимулирования технологического
цивилизация.
Энергетические изменения чрезвычайно важны для мира, в котором
большие потребности в энергии для стимулирования технологического
цивилизация.
Обратимые / необратимые реакции, степень Реакции, равновесие : рассмотрим гипотетический обратимый реакция, в которой вы начинаете с некоторых реагентов, A и B, каждый с 1 Концентрация M (1 моль каждого / л раствора). но нет продуктов, P и Q. Для удобства предположим, что общий объем раствора составляет 1 л, так что мы начните с 1 моль каждого из A и B.. В момент времени t = 0 концентрация продуктов равно 0. Реакцию можно записать как:
А + В <--> П + Q . С течением времени суммы или
концентрации A и B уменьшаются по мере увеличения количества или концентрации
продуктов P и Q увеличиваются. В какой-то момент дальнейших изменений не происходит
в количестве или концентрациях оставшихся реагентов или продуктов.
В этот момент реакция находится в состоянии равновесия , используемый термин
часто в нашем общем словаре для обозначения системы, которая не
меняется. ).
).
Большинство реакций, которые мы будем изучать, происходят в растворе, поэтому мы будем иметь дело с концентрациями (в моль / л или ммоль / мл = M Рассмотрим, как концентрация реагентов и продуктов изменение как функция времени. В зависимости от степени до которой реакция обратима, можно представить 4 различных сценария:
Сценарий 1: Необратимая реакция, при которой обратная реакция происходит в незначительной степени.
В этой реакции происходит обратная реакция
в такой малой степени, что мы можем им пренебречь. Единственная реакция, которая
происходит превращение реагентов в продукт. Следовательно, все
реагенты превращаются в продукт. В состоянии равновесия [A] = 0.
Поскольку 1 моль A прореагировал, он должен образовать 1 моль P и 1 моль Q, т.е.
концентрация продуктов при равновесии составляет 1 М. При более раннем
время реакции (выберем время, когда [A] = 0,8 M),
только часть реагентов прореагировала (в данном случае 0. 2 м),
производство равного количества продуктов, P и Q. Графики [A]
и [P] как функция таймера показаны ниже. А уменьшается
нелинейным образом до 0 M, в то время как P возрастает обратным
мода до 1 М концентрации. Это показано на графике
ниже.
2 м),
производство равного количества продуктов, P и Q. Графики [A]
и [P] как функция таймера показаны ниже. А уменьшается
нелинейным образом до 0 M, в то время как P возрастает обратным
мода до 1 М концентрации. Это показано на графике
ниже.
Примеры необратимых реакций: реакции сильных кислот (например, азотной, серной, соляной) с основания, такие как OH — и вода, или реакции горения, такие как сжигание сахаров (например, деревьев) и углеводородов (например, октана) с образованием CO 2 и H 2 O.
Сценарий 2: Обратимая реакция, при которой предпочтительна прямая реакция.
Опять [A] убывает и [P]
увеличивается, но в этом случае остается некоторое A, так как реакция
обратимый. Когда A и B уменьшаются, P и Q увеличиваются, что увеличивает
вероятность того, что они столкнутся и образуют продукт. Поскольку P и Q могут
реагируют на реагенты, [A] в равновесии не равно нулю, поскольку
показано ниже.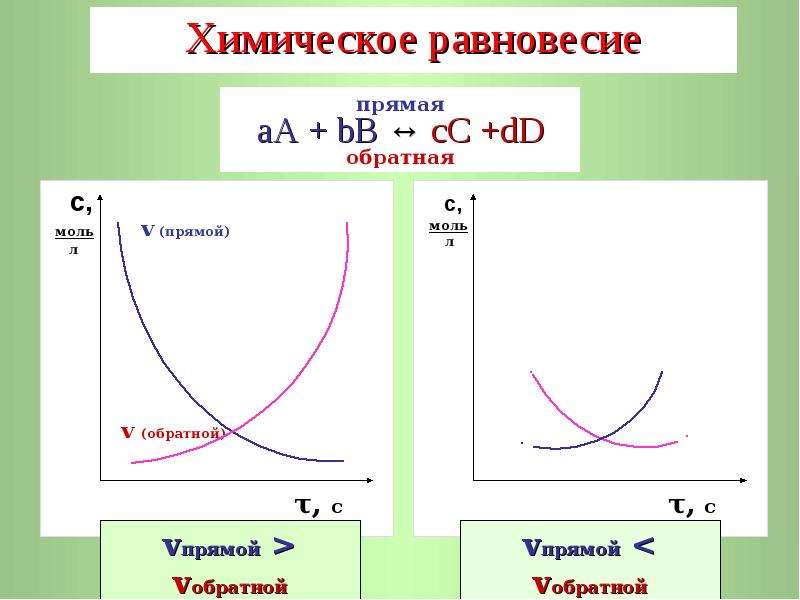
Сценарий 3: Обратимая реакция, при которой в равной степени предпочтительны прямые и обратные реакции.
Опять [A] убывает и [P] увеличивается, но в этом случае остается некоторое A, так как реакция обратимый. Когда A и B уменьшаются, P и Q увеличиваются, что увеличивает вероятность того, что они столкнутся и образуют продукт. Поскольку P и Q могут реагируют на реагенты, [A] в состоянии равновесия не равно нулю, поскольку показано ниже. Потому что реагенты и продукты одинаковы при условии, что их концентрация будет равной в состоянии равновесия.
Сценарий 4: Обратимая реакция, в которой обратная реакция приветствуется.
Опять [A] убывает и [P]
увеличивается, но в этом случае остается некоторое A, так как реакция
обратимый. Когда A и B уменьшаются, P и Q увеличиваются, что увеличивает
вероятность того, что они столкнутся и образуют продукт. Поскольку P и Q могут
реагируют на реагенты, [A] в состоянии равновесия не равно нулю, поскольку
показано ниже. Потому что реакция благоприятствует реагентам. их
концентрация будет выше в равновесии, чем у продуктов.
Потому что реакция благоприятствует реагентам. их
концентрация будет выше в равновесии, чем у продуктов.
Пример такой реакции, та, что благоприятствует реагентам, это реакция уксусной кислоты (слабая кислота) с вода.
CH 3 CO 2 H (водн.) + H 2 O (л) <==> + H 3 O + (водн.) + CH 3 CO 2 — (водн.)Константы равновесия :
Без большого опыта в химии это
сложно просто посмотреть на реагенты и продукты и определить
является ли реакция необратимой или обратимой, в пользу
реагенты или продукты (за исключением очевидных необратимых
реакции, описанные выше).Однако эти данные можно найти в таблице
из констант равновесия найдено в справочниках. смотреть на
сценарий 2 (продукт благоприятствовал обратимой реакции). Рассмотрим A <--> P, где при t = 0, A = 1M и P = 0M. В состоянии равновесия A может
= 0,2 M, что означает, что 0,8 моль / л A прореагировала с образованием 0,8 моль / л P. 80%
отреагировал. Если изначально A = 0,1 M, то в состоянии равновесия A = 0,02 M
и P = 0,08 М. И снова 80% A прореагировало. Константа равновесия,
K экв , для этой реакции: K экв =
[P] экв. / [A] экв. = 0.8 / 0,2 =
0,08 / 0,02 = 4. Константа равновесия, как следует из названия, равна
постоянная, не зависящая от концентрации реагентов и
продукты. K eq > 1 означает, что продукты
одобренный. K eq <1 означает, что предпочтение отдается реагентам.
Когда K eq = 1, и реагенты, и продукты равны
одобренный. Для более общей реакции:
80%
отреагировал. Если изначально A = 0,1 M, то в состоянии равновесия A = 0,02 M
и P = 0,08 М. И снова 80% A прореагировало. Константа равновесия,
K экв , для этой реакции: K экв =
[P] экв. / [A] экв. = 0.8 / 0,2 =
0,08 / 0,02 = 4. Константа равновесия, как следует из названия, равна
постоянная, не зависящая от концентрации реагентов и
продукты. K eq > 1 означает, что продукты
одобренный. K eq <1 означает, что предпочтение отдается реагентам.
Когда K eq = 1, и реагенты, и продукты равны
одобренный. Для более общей реакции:
aA + bB <==> pP + qQ, где a, b, c и d — стехиметрические коэффициенты, K eq = ([P] p [Q] q ) / ([A] a [B] b ).Для простой реакции, когда a, b, p и q равны 1, тогда К экв = ([P] [Q]) / ([A] [B]).
Для необратимой реакции, такой как
реакция 0,1 М HCl (водн. ) в воде, [HCl] экв. = 0,
поэтому вы не можете рассчитать K eq . Однако если предположить, что
реакция идет в обратном направлении до почти незаметной степени,
[HCl] экв. может равняться 10 -10 М. Следовательно
К экв >> 1.
) в воде, [HCl] экв. = 0,
поэтому вы не можете рассчитать K eq . Однако если предположить, что
реакция идет в обратном направлении до почти незаметной степени,
[HCl] экв. может равняться 10 -10 М. Следовательно
К экв >> 1.
Таким образом, степень реакции может варьироваться от полностью необратимого (отдавая предпочтение только продуктам) до реакции, которые благоприятствуют реагентам. Наша следующая цель — понять что контролирует степень реакции. Наш ответ будет энергия изменения. Мы увидим пример этих различных типов обратимых реакции позже.
ВИКТОРИНА WCB — Равновесие
Викторина WCB — Равновесие: ответы
Реакции и изменение энергии
Почему реакции полностью различаются по степени выраженности
необратимый в прямой реакции на обратимые реакции в пользу
реагенты? Это может помочь понять простую физическую реакцию
прежде чем мы попробуем более сложные химические реакции.
Бал на холме . Делает мяч наверху скатывания с холма спонтанно, или же происходит обратное? Никто никогда не видел, чтобы мяч самопроизвольно катился в гору, если только к мячу добавилась энергия. Эта физическая реакция кажется необратимый, и происходит потому, что мяч имеет более низкую потенциальную энергию внизу холма, чем наверху. Разрыв в потенциальная энергия связана с «степенью» и спонтанностью этого реакция.Как мы уже отмечали ранее, природа стремится к более низкому энергетическое состояние.
АНИМАЦИЯ: МЯЧ НА А HILL — ТО, ЧТО ВЫ ВСЕГДА ВИДЕТЕ!
АНИМАЦИЯ: МЯЧ НА А ХИЛЛ — ЧТО ВЫ НИКОГДА НЕ ВИДИЛИ!
H + H -> H 2 Происходит ли эта реакция спонтанно? Оно делает. Вам следует
помните, что отдельные атомы H нестабильны, так как они не имеют
завершенная внешняя оболочка электронов — в данном случае дуэт.Как они
подход, они могут стабильно взаимодействовать с образованием ковалентной связи и в
процесс высвобождает энергию. Связанное состояние — это состояние с более низкой энергией.
чем два разделенных атома водорода. Это должно быть ясно, поскольку энергия должна
быть добавленным к молекуле H 2 для разрыва связи.
Связанное состояние — это состояние с более низкой энергией.
чем два разделенных атома водорода. Это должно быть ясно, поскольку энергия должна
быть добавленным к молекуле H 2 для разрыва связи.
2C 8 H 18 (л) + 25O 2 (г) -> 16CO 2 (г) + 18H 2 O (г) . Для проведения этой реакции каждый C-C, C-H и связь O-O в реагентах должна быть разорвана (что требует ввода энергии), но при образовании C-O и Ковалентные связи Н-О в продуктах.Требуется больше энергии, чтобы сломаться связи в реагентах или больше энергии выделяется при образовании облигации в продукте? Ответ должен быть ясным. Продукты должны иметь более низкую энергию, чем реагенты, так как огромное количество тепла и световая энергия высвобождается при сгорании бензина и других углеводороды.
Эти реакции предполагают
эта энергия должна быть высвобождена для того, чтобы реакция продолжилась в какой-либо степени
в заданном направлении.
А теперь рассмотрим следующую реакцию которые я продемонстрировал в классе:
Ba (OH) 2 . 8H 2 O (т) + 2NH 4 SCN (с) -> 10H 2 O ( л ) + 2NH 3 ( г ) + Ba (SCN) 2 ( водн. + s)
Когда эти два твердых вещества смешиваются и перемешиваются,
реакция явно имеет место, о чем свидетельствует образование
жидкость (вода) и запах нашатырного спирта. Что удивительно, так это то, что
в этой реакции тепло не выделяется в окружающую среду. Скорее
тепло было поглощено из окружающей среды, в результате чего стакан стал таким холодным
что он замерз до куска дерева (с добавлением слоя воды
дерево), на котором он был размещен.Эта реакция, кажется, нарушает наши
идея, что реакция идет в направлении, в котором тепло
освобожден. Реакции с выделением тепла и повышением температуры
Окружающая среда называется экзотермическими реакциями. Реакции
которые поглощают тепло из окружающей среды и, следовательно, снижают
температура окружающей среды составляет эндотермических реакций.
Для экзотермических реакций реагенты имеют больше энергии, чем продукты, и тепловая энергия (измеряется в ккал) высвободившаяся разница между энергией продукты и реактивы.Когда тепловая энергия используется для измерения разность энергий, мы называем энергию энтальпией (H) и тепло, выделяющееся при изменении энтальпии ( D H ), как показано ниже.
Для экзотермических реакций, ΔH <0. Для эндотермических реакций ΔH > 0,
Ясно, что должно быть что-то еще, что решает, будет ли реакция в значительной степени, кроме того, если выделяется тепло.Еще один пример спонтанной естественной реакции испарение воды (физический, а не химический процесс).
H 2 O (л) -> H 2 O ( г ) Тепло поглощается из окружающей среды, чтобы сломаться
IMF (H-связи) между молекулами воды, позволяя жидкости
превратиться в газ. Если вокруг находится кожа, испарение
Вода в виде пота охлаждает тело. Что это
реакции спонтанные и по существу необратимые, даже если они
эндотермические? Обратите внимание, что в обеих этих эндотермических реакциях
продукты более неорганизованы (более неупорядочены), чем
продукты.Твердое тело более упорядочено, чем жидкость или газ, а жидкость
более заказный, чем газ. Весь наш опыт общения с природой от
поддержание чистоты в комнате или испарение воды показывает нам, что
природа, упорядоченные вещи со временем становятся все более беспорядочными. Энтропия (S) является мерой беспорядка системы.
У больше энтропия,
тем больше беспорядок . Вся природа
склонен к беспорядку. Для реакций, которые идут от порядка (низкий S) к
беспорядок (высокий S), измененный S, ΔS
= S Продукты — S реагенты > 0.Для реакции
которые переходят от низкого порядка к высокому, ΔS <0,
Что это
реакции спонтанные и по существу необратимые, даже если они
эндотермические? Обратите внимание, что в обеих этих эндотермических реакциях
продукты более неорганизованы (более неупорядочены), чем
продукты.Твердое тело более упорядочено, чем жидкость или газ, а жидкость
более заказный, чем газ. Весь наш опыт общения с природой от
поддержание чистоты в комнате или испарение воды показывает нам, что
природа, упорядоченные вещи со временем становятся все более беспорядочными. Энтропия (S) является мерой беспорядка системы.
У больше энтропия,
тем больше беспорядок . Вся природа
склонен к беспорядку. Для реакций, которые идут от порядка (низкий S) к
беспорядок (высокий S), измененный S, ΔS
= S Продукты — S реагенты > 0.Для реакции
которые переходят от низкого порядка к высокому, ΔS <0,
Являются ли реакции спонтанными в данном
направление зависит не только от экзотермической реакции (поскольку некоторые
реакции являются эндотермическими) или просто энтропийными (поскольку некоторые реакции, которые
порядок увеличения происходит спонтанно), но при некоторой комбинации того и другого,
как показано в таблице ниже.
реакция | Δэнтальпия (ΔH) | Δэнтропия (ΔS) | в благоприятном / неблагоприятном отношении |
сжигание топливо | экзотермический (<0) | положительный (> 0) | всегда в пользу |
различные | экзотермический (<0) | отрицательное (<0) | зависит от |
эндотермический (> 0) | положительный (> 0) | зависит от | |
синтез сахаров из CO 2 и H 2 O | эндотермический (> 0) | отрицательное (<0) | всегда в неблагоприятном свете |
ВИКТОРИНА WCB:
ΔG,
ΔH и
ΔS.
ВИКТОРИНА WCB: ΔG, ΔH и ΔS. Ответы
Вклады К экв и концентрация до D G
Мы только что видели, что ΔG является функцией энтальпии и энтропии, отражая двойственную вклады в общее изменение энергии тепла и изменения порядка в система. Есть два других фактора, более непосредственно связанных с актуальная химия системы, которая способствует ΔG — величина константа равновесия, K экв , и концентрации реактивы и продукты.Два примера — реакции соляной кислоты. кислота и уксусная кислота — проиллюстрируют это.
- HCl (водн.) + H 2 O (л) -> H 3 O + (водн.) + Cl — (водн.)
- CH 3 CO 2 H (водн.) + H 2 O (л) -> H 3 O + (водн.) + CH 3 CO 2 — (водн.)
Предположим, что при t = 0 каждая кислота помещается в
вода в концентрации 0. 1 М. При достижении равновесия возникает
практически не остается HCl в растворе, а 99% уксусной кислоты
останки. Почему они такие разные? Мы обосновали, что HCl (aq) — это
намного более сильная кислота, чем H 3 O + (водн.), которая сама по себе
является гораздо более сильной кислотой, чем CH 3 CO 2 H (водн.). Почему?
Все, что мы можем сказать, есть что-то в структуре этих
кислоты (и основания), которые делают HCl намного более естественным
нестабильный, гораздо более энергоемкий и, следовательно, гораздо более реактивный, чем
образуемая им кислота, H 3 O + (водн.).Так же,
H 3 O + (водн.) Гораздо более нестабилен по своей природе,
намного выше по энергии и, следовательно, более реактивен, чем
CH 3 CO 2 H (водн.). Это не имеет ничего общего с
концентрация , так как исходная концентрация как HCl (водн.)
и CH 3 CO 2 H (водн.
1 М. При достижении равновесия возникает
практически не остается HCl в растворе, а 99% уксусной кислоты
останки. Почему они такие разные? Мы обосновали, что HCl (aq) — это
намного более сильная кислота, чем H 3 O + (водн.), которая сама по себе
является гораздо более сильной кислотой, чем CH 3 CO 2 H (водн.). Почему?
Все, что мы можем сказать, есть что-то в структуре этих
кислоты (и основания), которые делают HCl намного более естественным
нестабильный, гораздо более энергоемкий и, следовательно, гораздо более реактивный, чем
образуемая им кислота, H 3 O + (водн.).Так же,
H 3 O + (водн.) Гораздо более нестабилен по своей природе,
намного выше по энергии и, следовательно, более реактивен, чем
CH 3 CO 2 H (водн.). Это не имеет ничего общего с
концентрация , так как исходная концентрация как HCl (водн.)
и CH 3 CO 2 H (водн. ) были идентичными. Этот
наблюдение отражено в K eq для этих кислот
(>> 1 для HCl и << 1 для уксусной кислоты). Эта разница в
внутренняя стабильность реагентов по сравнению с продуктами (что
независимо от концентрации) является одним из факторов, влияющих на
ΔG.
) были идентичными. Этот
наблюдение отражено в K eq для этих кислот
(>> 1 для HCl и << 1 для уксусной кислоты). Эта разница в
внутренняя стабильность реагентов по сравнению с продуктами (что
независимо от концентрации) является одним из факторов, влияющих на
ΔG.
Другой фактор — это концентрация, так как я
продемонстрировано в классе. 0,25 М (0,25 моль / л или 0,25 ммоль / мл) раствор
уксусной кислоты не проводит электричество, что означает, что очень немногие
ионы H 3 O + (водн.) +
CH 3 CO 2 — (водн.) Находятся в растворе.
Однако, когда я добавил более концентрированную уксусную кислоту, тусклый свет стал
очевидно. Добавление большего количества реагента, казалось, привело к реакции с образованием
больше продуктов, даже если обратная реакция предпочтительна, если один
учитывает только внутреннюю стабильность реагентов и продуктов.Перед добавлением концентрированной кислоты система находилась на
равновесие. Добавление концентрированной кислоты нарушило равновесие,
что привело к реакции с образованием дополнительных продуктов. Это
пример принципа Ле Шателье , который гласит, что если
реакция в равновесии нарушена, реакция будет
направление, которое снимет возмущение. Отсюда:
Добавление концентрированной кислоты нарушило равновесие,
что привело к реакции с образованием дополнительных продуктов. Это
пример принципа Ле Шателье , который гласит, что если
реакция в равновесии нарушена, реакция будет
направление, которое снимет возмущение. Отсюда:
- , если добавлено больше реагента, rx. сдвиги формировать больше продуктов
- , если добавлен еще продукт, rx.переходит на образуют больше реагентов
- , если продукты удаляются выборочно ( перегонка, кристаллизация или дальнейшая реакция для получения другой вид), rx. сдвиги, чтобы сформировать больше продукта.
- , если реагенты удалены (как указано выше), rx. сдвигается, чтобы сформировать больше реагентов.
- , если к экзотермической реакции добавляется тепло, RX. сдвигает, чтобы избавиться от лишнего тепла, переходя в форму больше реактивов.(напротив для эндотермического приемника).
Эти два фактора напрямую связаны с
химия реакции, собственная реакционная способность реагентов
по сравнению с продуктами (относящимися к K eq ) и
концентрации, влияют на ΔG. Так же, как связь между ΔG
можно выразить как сумму двух вкладов, показывающих
эффекты изменения тепла (изменение энтальпии) и энтропии
изменений:
Так же, как связь между ΔG
можно выразить как сумму двух вкладов, показывающих
эффекты изменения тепла (изменение энтальпии) и энтропии
изменений:
так может отношения между ΔG выразить как сумма двух вкладов, показывающих влияние внутренняя стабильность и концентрация:
Δ г = Δ G o стержень + Δ G конц где Δ G o stab отражает
вклад от относительной внутренней стабильности реагентов и
продуктов) и Δ G конц отражает
вклад относительных концентраций реагентов и
продукты (что не имеет ничего общего со стабильностью).Оба уравнения
истинный. Оба показывают, что всего D G можно выразить как сумму двух
вклады — либо изменения энтальпии и энтропии, либо относительные
стабильности и концентрации.
Значение Δ G
Помните, что ΔG
«движущая» сила реакции, аналогичная разнице в
потенциальная энергия мяча на холме.Вернитесь к этой аналогии. если
мяч начинается на вершине холма, он катится с холма? Из
курс. Он идет от энергии с высоким потенциалом к энергии с низким потенциалом.
Реакцию можно записать так: Ball top ->
Шар дно , для которого изменение потенциальной энергии,
ΔPE =
PE нижний -PE верхний <0. Если мяч начинается с
снизу, он пойдет наверх? Очевидно нет. Для этой реакции
Шар нижний -> Шар верхний , ΔPE
> 0.Если бы вершина холма была на одинаковой высоте внизу
холма (очевидно, абсурдная ситуация), мяч не двигался.
Фактически, это было бы равновесие, состояние без изменений. За
эта реакция, мяч сверху -> мяч снизу ,
ΔPE = 0. Поскольку
мяч начинает катиться с холма, его потенциальная энергия приближается
к потенциалу, который он имел бы внизу. Следовательно
ΔPE изменяется от
от отрицательного к все более и более положительному, пока не дойдет до дна в
в этом случае ΔPE
= 0 и движение прекращается.Если ΔPE
не 0, мяч будет двигаться до тех пор, пока ΔPE
= 0.
Следовательно
ΔPE изменяется от
от отрицательного к все более и более положительному, пока не дойдет до дна в
в этом случае ΔPE
= 0 и движение прекращается.Если ΔPE
не 0, мяч будет двигаться до тех пор, пока ΔPE
= 0.
Аналогично, для химической реакции, которая способствует продукты, ΔG <0. Система не находится в равновесии, и реакция пойдет в направление продуктов. По мере протекания реакции продукты накапливаются. вверх, и у реагентов меньше движущей силы продуктов (принцип ЛеШатильера), поэтому ΔG становится более положительным, пока ΔG = 0 и реакция находится в равновесии.Реакция, имеющая ΔG> 0 есть также не в состоянии равновесия, поэтому он пойдет в соответствующем направлении пока не будет достигнуто равновесие. Следовательно, для реакции A + B <==> P + Q,
- , если ΔG <0, реакция идет в сторону продуктов P и Q
- , если ΔG
= 0, реакция находится в равновесии, и дальнейших изменений в
концентрация реагентов и продуктов.

- , если ΔG > 0 реакция идет в сторону реагентов A и B.
Мы не можем легко измерить фактическую бесплатность энергия G реагентов или продуктов, но мы можем измерить ΔG легко. Эти точки показаны на графике ΔG от времени для гипотетической реакции A + B <==> P + Q. (Также обратите внимание на два графика вставки — синий и красный — которые показывают, в по аналогии с мячом на графиках холма значения ΔG на двух точки, в которых возмущение равновесия было сделано.)
Обратите внимание на ΔG
постоянно меняется, пока система не достигнет равновесия.Изначально
равновесие нарушается так, что система не находится в равновесии
(показаны синим цветом). Возмущение было таким, что продукты
одобренный. После достижения равновесия система снова возмущалась:
на этот раз в моде, чтобы поддержать обратную реакцию. Обратите внимание на это
случае ΔG для
реакция, как написано: A + B <==> P + Q положительна — т.е.
не находится в. Поэтому реакция (как написано) идет
назад к продуктам. Важно понимать, что отчет
ΔG для
реакция как написано.
Важно понимать, что отчет
ΔG для
реакция как написано.
Теперь применим Δ Г = Δ G o стержень + Δ G конц на две обсуждаемые нами реакции выше:
- HCl (водн.) + H 2 O (л) <==> H 3 O + (водн.) + Cl — (водн.)
- CH 3 CO 2 H (водн.) + H 2 O (л) <==> H 3 O + (водн.) + CH 3 CO 2 — (водн.)
Предположим, что в момент времени t = 0, 0.1 моль HCl и
CH 3 CO 2 H добавляли в два разных стакана. В
здесь предпочтение отдается прямой реакции, но очевидно, что
разной степени. Модель Δ G конц будет одинаковым для обеих кислот,
поскольку каждый реагент присутствует в концентрации 0,1 М, но продуктов пока нет.
Однако Δ G o stab гораздо более отрицательно для HCl, чем
уксусная кислота, поскольку HCl — сильная кислота. Следовательно, при t = 0 Δ G для HCl
реакция гораздо более отрицательная, чем на уксусную кислоту. Это
резюмировано в таблице ниже. Направление стрелки показывает, если
продукты (->) или реагенты (<---) являются предпочтительными. Размер
стрелка очень приблизительно показывает, насколько ΔG
срок благоприятен
Следовательно, при t = 0 Δ G для HCl
реакция гораздо более отрицательная, чем на уксусную кислоту. Это
резюмировано в таблице ниже. Направление стрелки показывает, если
продукты (->) или реагенты (<---) являются предпочтительными. Размер
стрелка очень приблизительно показывает, насколько ΔG
срок благоприятен
Реакция при t = 0 | Δ G o стержень | Δ G конц | Δ г |
HCl (водн.) + H 2 O (л) | —————> | —————> | ——————————> |
CH 3 CO 2 H (водн. | <------------- | —————> | -> |
Теперь, когда равновесие достигнуто, состояние не чистое изменение концентрации реагентов и продуктов, Δ G = 0.В случае HCl существует бесконечно малое количество HCl осталось, и 0,1 M каждого продукта, поэтому концентрация способствует его формирование. Однако относительная стабильность реагентов и продукты по-прежнему отдают предпочтение продуктам. В случае уксусной кислоты большая часть остается уксусная кислота (0,099 М) с небольшим количеством продукта (0,001 М), поэтому концентрация способствует продукту. Однако внутренний родственник стабильность реагентов и продуктов по-прежнему способствует реагенты. Это резюмировано в таблице ниже.
Реакция на equlib. | Δ G o стержень | Δ G конц | Δ г |
HCl (водн.) + H 2 O (л) | —————> | <--------------- | не одобряет, = 0 |
CH 3 CO 2 H (водн.) + H 2 O (л) | <------------- | —————> | не одобряет, = 0 |
Сравните две таблицы выше
(один в момент времени t = 0, а другой в момент равновесия). Уведомление:
Уведомление:
- Δ G o stab никогда не меняется, так как это не имеет ничего общего с концентрацией. Только
- Δ G конц в процессе реакция, пока не будет достигнуто равновесие.
Резюме: G определяет, идет ли реакция спонтанно в каком-либо направлении.
Если Δ G <0, реакция идет от реагентов к продуктам - к состоянию
когда продукты имеют меньшую энергию, чем реагенты - как мяч
катится с холма.На влияет множество факторов.
Δ G ,
в том числе ΔG конц , ΔG o стержень и ΔH. Это все энергия
условия и, следовательно, они будут способствовать образованию продукта, если они <0.
Другой термин, влияющий на Δ G есть ΔS.
Энтропия благоприятствует продукту, если ΔS
> 0. ΔS
не является энергетическим членом, но обратите внимание в приведенном выше уравнении, что член
содержащий вклад энтропии -TΔS
, где T — температура. Этот член <0 и благоприятствует
произведение, если ΔS
положительно (> 0).
Этот член <0 и благоприятствует
произведение, если ΔS
положительно (> 0).
WCB Тест: ΔG, ΔG o stab , и ΔG конц
WCB Тест: ΔG, ΔG o stab , и ΔG конц — Ответы
Ключ в Классную викторину на ΔG,
Скорость Реакция
Мы узнали много нового о химических реакциях, в том числе:
- как предсказать тип реакция
- как прогнозировать продукты
- как определить концентрацию реагенты и продукты в конце реакции
- , что некоторые реакции необратимы (K eq >> 1) и другие обратимые
- , что обе энтальпии И энтропии изменения определяют степень реакции в данном направление
- , что внутренняя относительная стабильность, энергия и реакционная способность реагентов по сравнению с продуктами И относительные концентрации реагентов и продуктов определить степень реакции в данном направление
- , эта реакция также переходит в равновесие
- , что реакция в равновесии может быть возмущены добавлением или удалением реагентов или продуктов
Одна вещь, которую мы не изучали, — это скорость (не степень) реакции.Они два очень разные концепции. Рассмотрим, например, простую реакцию октана с Oxgyen.
2C 8 H 18 (л) + 25O 2 (г) -> 16CO 2 (г) + 18H 2 O (г).Эта реакция явно экзотермическая. ( Δ H <0) и продолжается с увеличением в беспорядке ( Δ S > 0). Таким образом, он очень популярен в прямом направлении.Но вы все по опыту знаю, что если вы вылите бензин на стол в наличие воздуха, вроде ничего не происходит. Как такое может быть, если реакция настолько благоприятна, что по существу необратима? Взгляд на диаграмме ниже показано, как мы можем рационализировать такое поведение. Если вы думаете об этом, первое, что должно произойти в реакции выше сказано, что некоторые связи в продуктах должны быть разорваны. Это явно эндотермический процесс. Энергия (через столкновения) должна быть положить в реагенты для этого.Затем молекулы переходят в более высокий энергетическое состояние. В конце концов, несколько молекул начинают формировать стабильные облигаций, обнаруженных в продукте, и при этом они высвобождают много энергия в виде тепла. Это выделяемое тепло увеличивает температура контейнера, в результате чего молекулы увеличиваются кинетическая энергия, увеличивающая количество столкновений между реагентами молекулы, которые вызывают каскад разрыва и образования связей, что приводит к огромному высвобождению энергии.Вот почему нужна искра чтобы «вызвать реакцию», хотя это очень приветствуется.
АНИМАЦИЯ: АКТИВАЦИЯ ЭНЕРГИЯ И ШАР НА ГОРУ
.






 )
+ H 2 O (л)
)
+ H 2 O (л)