Обобщение темы «Окислительно-восстановительные реакции». Видеоурок. Химия 9 Класс
На уроке рассматриваются упражнения по теме «Окислительно-восстановительные реакции», которые помогут закрепить умения правильно определять степени окисления атомов химических элементов в соединениях, расставлять коэффициенты в схемах реакций методом электронного баланса.
Тема: Окислительно-восстановительные реакции
Урок: Обобщение темы «Окислительно-восстановительные реакции»
Окисление – это процесс отдачи электронов, а восстановление – процесс принятия электронов. Окислитель – в ходе реакции принимает электроны и сам при этом восстанавливается. Восстановитель отдает электроны, а сам при этом окисляется.
Атомы элемента, входящего в состав окислителя, понижают свою степень окисления в ходе ОВР, а атомы элемента, входящего в состав восстановителя, повышают свою степень окисления.
Окислительно-восстановительными реакциями называют реакции, в которых изменяются степени окисления химических элементов. Реакции ионного обмена не являются
Рассмотрим первый пример.
Пример 1. Определите степени окисления элементов в соединениях:
BaBr2, Na3PO4, KClO3.
Решение: При определении степеней окисления элементов пользуются правилом электронейтральности. Запишем постоянные значения степеней окисления химических элементов:
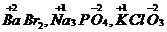
По правилу электронейтральности определим степени окисления остальных элементов. Сумма произведений степени окисления атома каждого элемента на число таких атомов в молекуле должна быть равна нулю:
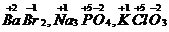
Пример 2. Определите число отданных или принятых электронов, окислитель и восстановитель, укажите процессы окисления и восстановления в следующих схемах:
Fe0 → Fe+2
C0 → C+4
N20 → 2N-3
S+6 → S-2
Решение: В первой схеме степень окисления железа изменилась с 0 до +2, т.е. повысилась. Значит, атом железа отдал 2 электрона. Процесс отдачи электронов называется окислением, а железо в данном случае является восстановителем:
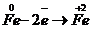 — восстановитель, окисляется
— восстановитель, окисляется
Аналогичны рассуждения и для остальных схем:
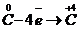
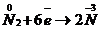 — окислитель, восстанавливается
— окислитель, восстанавливается
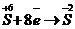 — окислитель, восстанавливается
— окислитель, восстанавливается
Пример 3. Расставьте коэффициенты в уравнении ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
KClO3 + S → KCl + SO2
Решение: Расставим степени окисления элементов и определим, какие элементы изменяют свои степени окисления:
+1+5 -2 0 +1 -1 +4 -2
KClO3 + S → KCl + SO2
Хлор и сера меняют степени окисления в ходе реакции. Определим число отданных и принятых электронов для хлора и серы:
Сl+5 + 6е→ Cl-1
S0 — 4е→ S+4
Хлор принимает электроны, значит, он окислитель, сера отдает электроны, она восстановитель.
Число отданных и принятых электронов должно быть одинаковым. Найдем НОК чисел 6 и 4. Оно равно 12. Разделим 12 на 6 и на 4, получим коэффициенты 2 и 3.

Умножим полуреакции окисления и восстановления на коэффициенты и перенесем коэффициенты в общее уравнение.
Получили уравнение реакции:
2KClO3 + 3S = 2KCl + 3SO2
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.68-71)
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§§20-22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Химия. 8-11 классы: тренинги и тесты с ответами по теме «Окислительно-восстановительные реакции» / авт.-сост. Т.М. Солдатова. – Волгоград: Учитель, 2007. (с.12-20)
5. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.54-57)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (интерактивные задачи по теме) (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
№№7.14, 7.16 из сборника задач и упражнений по химии (8-11 классы), автор — А.Д. Микитюк. – М.: Изд. «Экзамен», 2009.
interneturok.ru
Окисление и восстановление. Видеоурок. Химия 9 Класс
Данный урок посвящен изучению процессов окисления и восстановления. Вы познакомитесь с современными взглядами на эти процессы. Новые представления о процессах окисления и восстановления помогут объяснить противоречивые экспериментальные факты, рассмотренные на прошлом уроке.
Тема: Окислительно-восстановительные реакции
Урок: Окисление и восстановление
Если через раствор хлорида меди (II) пропускать электрический ток, то на катоде выделится медь, а на аноде образуется хлор.
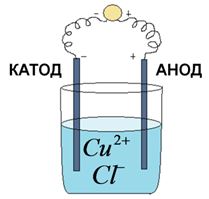
Рис. 1. Электролиз раствора хлорида меди(II)
Изобразим схемы протекающих на электродах процессов:
НА КАТОДЕ: Cu2+ → Cu
НА АНОДЕ: 2Cl— → Сl2
Чтобы катион меди Cu2+ превратился в электонейтральный атом меди, он должен принять от катода 2 электрона. Чтобы из двух анионов хлора Cl— образовалась молекула хлора, они должны отдать 2 электрона:
НА КАТОДЕ: Cu2+ + 2е → Cu (восстановление меди)
НА АНОДЕ: 2Cl— — 2е → Сl2 (окисление хлора)
Таким образом, можно сделать вывод:
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
Вещество, отдающее электроны, называется восстановителем. Вещество, принимающее электроны, называется окислителем.

Рис. 2. Переход электронов от восстановителя к окислителю
Окислитель, принимая электроны, сам при этом восстанавливается. Восстановитель, отдавая электроны, сам окисляется.
Процессы окисления и восстановления не могут протекать раздельно друг от друга, поэтому говорят об окислительно-восстановительной реакции.
В окислительно-восстановительной реакции число принятых электронов должно быть равно числу отданных электронов. В рассматриваемом процессе электронный баланс можно изобразить следующей схемой:
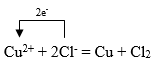
Если рассмотреть сущность еще одного окислительно-восстановительного процесса (между железом и сульфатом меди (II)), то мы увидим, что катионы меди в этой реакции выполняют роль окислителя. В результате происходит восстановление меди:
Fe + CuSO4 = FeSO4 + Cu
Cu2+ + 2e = Cu
Роль восстановителя играет простое вещество железо:
Fe – 2e = Fe2+
При этом железо окисляется до двухзарядного катиона.
Вы уже знаете, что окислительно-восстановительные реакции могут протекать под действием электрического тока. Такие реакции называют электролизом. Этот процесс был подробно изучен Майклом Фарадеем. Сегодня электролиз широко применяется в промышленности. С помощью него делают копии различных деталей, наносят на стальные детали автомобилей защитный слой другого металла.
Список рекомендованной литературы
1. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§20)
2. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§11)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
с. 81 №№ 4-6 из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
interneturok.ru
Урок на тему «Окислительно-восстановительные реакции», 9 класс
Разработка урока по теме : «Окислительно-восстановительные реакции»
Цель урока: организация продуктивной деятельности учащихся, направленной на достижение ими результатов:
1. Предметных:
— формировать умение составлять уравнения химических реакций.
— изучить применение окислительно-восстановительных реакций .
2. Метапредметных:
в познавательной деятельности
— использовать знаково-символические средства, в том числе схемы для решения уравнений;
в информационно-коммуникативной деятельности
— умение вступать в речевое общение, участвовать в диалоге (понимать точку зрения собеседника, признавать право на иное мнение).
— отражать в устной и письменной форме результаты своей деятельности.
— формирование умений воспринимать, перерабатывать и предъявлять информацию в словесной, образной, символической формах;
в рефлексивной деятельности
— постановка целей, планирование, самоконтроль и оценка результатов своей деятельности;
— формирование умений работать в группе, представлять и отстаивать свои взгляды и убеждения, вести дискуссию.
— поиск и устранение причин возникших трудностей.
3. Личностных:
— организовать свою учебу по выбранной теме: поставить достижимые цели, составить реальный план, выполнить его и оценить свои результаты;
— научиться аргументировано спорить, дискутировать в ходе изучения темы;
— научиться решать уравнения по теме.
Оборудование:
ПСХЭ Д.И.Менделеева, мультимедийный проектор, ноутбук, карточки с заданиями
Методы и методические приемы: рассказ, беседа, демонстрация средств наглядности, самостоятельная работа обучающихся.
Форма урока: урок-исследование с элементами проблемного обучения.
Ход урока:
I. Этап постановки целей и задач урока
Учитель:
В III в. до н.э. на острове Родос, был построен памятник в виде огромной статуи Гелиоса (у греков – бог Солнца). Грандиозный замысел и совершенство исполнения Колосса Родосского – одно из чудес света – поражали всех, кто его видел.
Мы не знаем точно, как выглядела эта статуя, но известно, что она была сделана из бронзы и достигла в высоту около 33 м. Скульптура была создана скульптором Харетом, на её строительство ушла 12 лет. Бронзовая оболочка крепилась к железному каркасу. Полую статую начали строить снизу и, по мере того, как она росла, заполняли камнями, чтобы сделать её устойчивее. Примерно, через 50 лет после завершения строительства, статуя рухнула. Во время землетрясения она переломилась на уровне колен.
Почему рухнула статуя?
Ответы учащихся : /примерные ответы /
-произошло разрушение металла.
Учитель: почему произошло разрушение?
Ответы учащихся : /примерные ответы /
Учитель:
Ребята, вокруг нас протекает множество химических реакций, без которых наша жизнь невозможна, некоторые из них приносят вред. . А как вы думаете, почему? Какие процессы лежат в основе разрушения металлов, в частности железа? Где в окружающем нас мире мы встречаемся с окислительно-восстановительными реакциями? Распространенных химических реакций и имеют огромное значение в теории и практике. С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, в процессе коррозии металла, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и другие ценные продукты. Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Именно с их помощью ракеты и самолеты поднимаются в космос.
Обучающиеся формулируют тему урока .Определение темы урока, постановки целей и задач.
II.Основной этап .Этап изучения новых знаний
Сегодня ребята вы будете себя оценивать на каждом этапе.
Этап урока | самооценка | Оценка учителя |
Постановка целей | ||
Этап изучения новых знаний | ||
Первичная проверка знаний | ||
Закрепления нового материала | ||
Итого | ||
учитель: в качестве примеров ОВР учащиеся проводят следующие лабораторные опыты:
1.Прилить к раствору сульфата меди +гидроксид натрия
CuSO4 +2NaOH=Na2SO4 +Cu(OH)2
2.Железный гвоздь опустить в раствор сульфата меди .
CuSO4 +Fe (железный гвоздь) = Fe SO4 +Cu (красивый красный гвоздь)
Записать уравнения, к какому типу реакций относятся.
А по какому признаку можно еще классифицировать. Сколько элементов меняют степень окисления. А можем ли мы в основу классификации положить признак: изменение степени окисления?
Ответы учащихся : формулируют определение ОВР(определение)
Учитель: даны уравнения химических реакций:
1)Углерод +кислород=оксид углерода(IV)
C + O 2= CO2
2)Углерод+ водород= метан
C + 2h3 =Ch5
Найдите сходства и различия в этих уравнениях.
Учитель:
Что произошло с углеродом?
Ответы учащихся:
1.Углерод из нейтрального атома превратился в условный ион в степени окисления +4, то есть отдал 4е:
С 0 – 4е С +4
Запишите в свой конспект:
Элементы или вещества, отдающие электроны называются восстановителями; в ходе реакции они окисляются.
2. Углерод из нейтрального атома превратился в условный ион в степени окисления -4, то есть принял 4е:
С 0+ 4е С -4
Элементы или вещества, принимающие электроны, называются окислителями; в ходе реакции они восстанавливаются.
Кто-то теряет, а кто-то находит…
Процесс отдачи электронов называется окислением, а принятия – восстановлением.
В процессе окисления степень окисления повышается, в процессе восстановления – понижается. Составляем алгоритм для составления окислительно-восстановительных реакций.
Эти процессы неразрывно связаны между собой.
III.Этап первичной проверки понимания изученного материала.
Вернемся к рассмотреным ранее химическим реакциям и разберем овр.
/разбор реакций /.
IV.Этап закрепления нового материала
Выполнение тестового задания
№ | I вариант | II вариант |
1 | К окислительно-восстановительным реакциям не относится реакция, представленная схемой: А) N2 + 3Н2 = 2NН3 Б) Mg + 2HCl = MgCl2 + H2↑ В)MgCO3 = MgO + CO2 ↑ Г) 2CuO = 2Cu + O2↑ | К окислительно-восстановительным реакциям относится реакция, представленная схемой: А) H2O + CaO = Ca(OH)2 Б) H2O + N2O5 = 2HNO3 В) Na2CO3 + 2HCl = 2NaCl + H2O + CO2 Г) CuO + H2 = Cu + H2O |
2 | В каком соединении степени окисления элементов равны -3 и +1 А) NF3 Б) Cl2O3 В) NH3 Г) AlCl3 | В каком соединении степени окисления элементов равны +3 и -2 А) NF3 Б) Cl2O3 В) NH3 Г) AlCl3 |
3 | Схема Na0 →Na+1 отражает процесс: А) Окисления Б) Восстановления Г) Диссоциации | Схема Сl0 → Сl-1 отражает процесс: А) Окисления Б) Восстановления Г) Диссоциации |
4 | Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются | Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются |
V.Рефлексия: Оценка результатов своей деятельности
учитель:
Подведем итоги урока. Окислительно-восстановительные реакции многообразны, они лежат в основе очень важнейших реакций: фотосинтез, дыхание, горение, брожение, коррозия металлов.
Продолжите фразу: Я-понял,Я-узнал,Я-научился
xn--j1ahfl.xn--p1ai
Методика преподавания химии в 9-м классе. Окислительно-восстановительные процессы
Необходимо точно понимать терминологическую разницу между понятием “валентность” и “степень окисления”.
Термин “валентность” относится к свободному атому и определяется, как способность атома образовывать химические связи. Их количество определяется числом неспаренных электронов на внешнем энергетическом уровне.
Термин “степень окисления” относится к атому (элементу), образовавшему химические связи и определяется числом смещенных общих электронных пар связей связи от менее (+) к более электроотрицательному элементу (-).
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ (СО) ЭЛЕМЕНТА.
Например:
К +1Мn хО-24 ; +1+х+4(-2)=0; х=+7.
Cr2xO72- ; х+7(-2)=-2; х= +6 (ПРИЛОЖЕНИЕ № 1)
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
При проведении реакций происходит разрыв химических связей в исходных веществах и образовании новых, которые, в некоторых случаях, происходит изменение валентности элементов и поляризации новых химических связей.
Окислительно-восстановительными называются (ОВ или ред-окс) реакции, протекающие с изменениями значений степеней окисления элементов, входящих в состав реагирующих соединений.
Основные положения теории ОВР:
- Окисление – это процесс отдачи электронов. Вещество (ион, атом, молекула), отдающее электроны, называется восстановителем. В процессе реакции восстановитель окисляется, а значение СО элемента повышается.
- Восстановление – это процесс принятия электронов. Вещество (ион, атом, молекула), принимающее электроны, называется окислителем. В процессе реакции окислитель восстанавливается, а значение СО элемента понижается.
- Так как в замкнутой системе (процесс оттока электронов за пределы реакционной системы отсутствует) электрический заряд сохраняется, то число электронов, отданных восстановителем равно числу электронов, принятых окислителем.
- Восстановление и окисление – два взаимонеразрывных процесса: нет окисления без восстановления и наоборот. (ПРИЛОЖЕНИЕ №2)
Алгоритм составления уравнения реакции методом электронного баланса.
- Записать схему реакции: HI +H2SO4 —> I2 + H2S + H2O
- Проставить СО элементов:
- Выписать элементы, изменившие СО, определить и прописать количество электронов, принятых или отданных в процессе реакции.
- Найти наименьшее общее кратное количества электронов: HOK = 8.
- Эти дополнительные множители проставляют перед соответствующими формулами веществ.
Найти дополнительные множители к числу отданных и принятых электронов.
- Число атомов в левой части уравнения уравнивается с числом атомов в правой части. (ПРИЛОЖЕНИЕ №3)
ТИПЫ ОВР
| МЕЖМОЛЕКУЛЯРНЫЕ (атомы восстановители и атомы окислители входят в состав разных исходных веществ) | |
| ВНУТРИМОЛЕКУЛЯРНЫЕ (атомы восстановителя и окислителя входят в состав молекул одного вещества и являются атомами одного или различных элементов) | |
| ДИСПРОПОРЦИОНИРОВАНИЯ (атомы восстановителя и окислителя входят в состав одного и того же вещества и имеют одинаковую степень окисления) | |
| КОНТРПРОПОРЦИОНИРОВАНИЯ (атомы восстановителя и окислителя являются атомами одного и того же элемента с различной СО, которые входят в состав различных веществ, а в результате реакции образуются молекулы одного и того же вещества продукта) |
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ВЕЩЕСТВ.
По окислительно-восстановительным свойствам все вещества можно разделить на 3 группы:
- Вещества, которые могут быть только окислителями – элементы, изменяющие степень окисления, находятся в высшей степени окисления (могут только присоединять электроны и понижать свою степень окисления)
- Вещества, которые могут быть только восстановителями — элементы, изменяющие степень окисления, находятся в низшей степени окисления (могут только отдавать электроны и повышать свою степень окисления)
- Вещества, которые могут быть и восстановителями и окислителями — элементы, изменяющие степень окисления, находятся в промежуточной степени окисления (могут и отдавать и принимать электроны) (ПРИЛОЖЕНИЕ № 4)
Д/З: параграф 5, упр. 6-8, с.22 [1] .
ИСТОЧНИКИ ИНФОРМАЦИИ.
- Рудзитис Г.Е.и др. Химия: неорганическая химия. Орган.химия: учебник для 9 кл. общеобразовательных учреждений. 12 изд., испр., М.: Просвещение, ОАО “Московские учебники, 2009. – 191 с.: ил.
- Богданова Н.Н., Мещерякова Л.М. Сборник тестовых заданий для тематического и итогового контроля. Химия 8-9 класс. /под.ред. Оржековского П.А.- М.: “Интеллект-центр”, 2009 – 128с.
- Врублевский А.И.. Решение заданий химических превращений с тестовым самоконтролем для школьников и абитуриентов – Мн.: ООО “Юнипресс”, 2003. — 176с.
urok.1sept.ru
| Приветствие. Создание условий для возникновения у обучающихся внутренней потребности включения в учебный процесс. | ПК , экран, мультимедий-ный проектор. | Включение в учебную деятельность |
| Урок начинается с повторения понятий «типы химических реакций», «степень окисления» в виде фронтальной беседы.
2. К какому из данных типов можно отнести указанные уравнения реакции? 3. В чем особенность, на ваш взгляд, уравнений реакций А),Б),Д)? 4. Что такое степень окисления элемента? Слайд 2 Известны следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена. Слайд 3 А) 4Al + 3O2 = 2Al2O3 Б) 2h3O= 2h3+ O2 В) ZnO + 2 HCl = ZnCl2 + h3O Г) СаСO3 = CaO + CO2 Д)) Zn + 2HCl = ZnCl2 + h3 Е) Na2O+ CO2=Nа2СO3 Подведем итоги, проверьте правильные ответы Слайд 4 А) 4Al + 3O2 = 2Al2O3 -р.соединения Б) 2h3O= 2h3+ O2 -р. разложения В) ZnO + 2 HCl = ZnCl2 + h3O -р.обмена Г) СаСO3 = CaO + CO2 р.соединения Д)) Zn + 2HCl = ZnCl2 + h3 р.замещения Е) Na2O+ CO2=Nа2СO3 р. соединения Слайд 5 ПК , экран, мультимедий-ный проектор. А) 4Al + 3O2 = 2Al2O3 -р.соединения Б) 2h3O= 2h3+ O2 -р. разложения В) ZnO + 2 HCl = ZnCl2 + h3O -р.обмена Г) СаСO3 = CaO + CO2 р.соединения Д)) Zn + 2HCl = ZnCl2 + h3 р.замещения Е) Na2O+ CO2=Nа2СO3 р. соединения (Особенности: в процессе данных реакций происходит изменение степеней окисления химических элементов). Слайд 6 Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер; либо – это заряд, который, возникает вследствие полного (действительного или условного) перехода электронов от одного атома к другому. | ПК , экран, мультимедий-ный проектор. | Личностные УД Умение управлять своей познавательной деятельностью. Познавательные УД 1. Умение анализировать, сравнивать, классифицировать и обобщать факты и явления. 2.Умение выявлять причины и следствия простых явлений. Регулятивные УД 1. Саморегуляция как способность к мобилизации сил и энергии, к волевому усилию (к выбору в ситуации мотивационного конфликта) и преодолению препятствий 2. Умение в диалоге с учителем совершенствовать самостоятельно выработанные критерии самооценки. Коммуникативные УД Умение слушать и вступать в диалог. |
| Попробуйте сформулировать тему урока. Какова цель урока? Какую проблему мы попытаемся решить? (реакции, идущие с изменением степени окисления, как они протекают, в чем их особенности) Одна из задач химии – предсказать, какие вещества получатся в той или иной реакции. Чтобы ответить на этот вопрос для ОВР, надо знать:
| ПК , экран, мультимедий-ный проектор. | Познавательные УД 1.Умение видеть проблему 2.Умение ставить вопросы. Регулятивные УД — умение ставить цели, планировать свою работу. Коммуникативные УД Умение сотрудничать, вступать в дискуссию, анализировать, доказывать, отстаивать свое мнение. | 4.Совместное открытие новых знаний. | Проблемные вопросы: Как протекают окислительно-восстановительные реакции? Почему изменяется степень окисления? Демонстрируются Слайды 7,8,9,10,11. Можно ли предугадывать окислительно-восстановительную способность веществ? Какие вещества проявляют только окислительные свойства, какие только восстановительные, или могут быть и теми и другими? Слайд 12. Окислители – элементы в высших степенях окисления:
Восстановители – элементы в низших степенях окисления:
Окислители и восстановители – элементы в промежуточных степенях окисления. Работа в парах. Слайд 13 Обсудите в паре, какие из приведённого ниже списка полуреакции относятся к окислению, какие к восстановлению и выпишите полуреакции: 1 вариант – окисления; 2 вариант – восстановления. Дополните схемы этих полуреакций, показав число электронов.
Осуществление взаимопроверки. Комментарии учителя. Слайды 14,15 Алгоритм составления окислительно-восстановительных реакций методом электронного баланса. Подробный комментарий учителя. | ПК , экран, мультимедий-ный проектор. | Коммуникативные УД 1. Умение самостоятельно организовывать учебное взаимодействие при работе в паре. 2. Умение участвовать в коллективном обсуждении проблем. Познавательные УД 1. Нахождение и использование нужной информации. 2. Умение анализировать, сравнивать, классифицировать и обобщать факты и явления; выявлять причины и следствия простых явлений. 3. Умение преобразовывать информацию из одного вида в другой (текст в таблицу и пр.). Регулятивные УД Умение, работая по плану, сверять свои действия с целью и при необходимости исправлять ошибки самостоятельно. Личностные УД 1. Умение уважительно и доброжелательно относиться к окружающим людям. 2. Умение управлять своей познавательной деятельностью; открыто выражать и отстаивать свою позицию и критично относиться к своим поступкам. | 5. Формирование решения проблемы, самостоятельное применение знаний. | Слайд 16 Закрепление знаний Используя метод электронного баланса, допишите схемы и составьте уравнения, расставив коэффициенты Mg + O2 = HCl + Zn = SO2 + O2 S + HNO3 = NO2 + h3SO4 + h3O Mg + h3SO4 = h3S + MgSO4 + h3O Выполненные задания сдаются на проверку. | ПК , экран, мультимедий-ный проектор. | Регулятивные УД 1.Умение проявлять настойчивость и усилия для достижения цели. Познавательные УД 1.Нахождение и использование нужной информации. Личностные УД 1.Умение оценивать меру ответственного отношения к учению. |
итоги урока | Слайды 17,18,19,20 Рефлексия:
1. На уроке я работал (активно/пассивно) 2.Своей работой на уроке я (доволен/не доволен) 3. Урок для меня показался (коротким/длинным) 4.За урок я ( не устал/устал) 5. Мое настроение (стало лучше/стало хуже) 6. Материал урока мне был (понятен/не понятен, полезен/бесполезен, интересен/скучен) 7.Домашнее задание мне кажется (легким/трудным, интересным/не интересным) Домашнее задание: параграф 5,упр.5-7 стр.20. | ПК , экран, мультимедий-ный проектор. | Личностные УД 1. Умение оценивать меру ответственного отношения к учению. 2. Умение управлять своей познавательной деятельностью; открыто выражать и отстаивать свою позицию и критично относиться к своим поступкам. |
nsportal.ru
План-конспект урока по химии (9 класс) по теме: План урока по теме «Окислительно-восстановительные реакции». 9 класс. УМК Рудзитиса
Урок 4
Окислительно-восстановительные реакции
Дидактическая цель урока: Обобщить и систематизировать материал по теме «Окислительно-восстановительные реакции», создать условия для самостоятельной работы учащихся по указанной теме.
Задачи урока:
1. Конкретизировать понятия «степень окисления», «окислитель», «восстановитель», «окислительно-восстановительная реакция». Определять степень окисления, расставлять коэффициенты в уравнениях ОВР методом электронного баланса (предметный результат).
2. Продолжить развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат).
Ход урока
- Подготовка к восприятию нового материала (10 мин)
Опрос учащихся по домашнему заданию. Индивидуальные карточки с заданиями.
- Изучение нового материала (20 мин)
Степень окисления – условный заряд элемента, рассчитанный, исходя из условия, что все связи в соединении ионные. Степень окисления бывает: положительная, отрицательная, нулевая. Знак ставится перед числом – это с.о., если после числа – то заряд.
Правила вычисления степени окисления элементов
1. Сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе – его заряду.
2. Степень окисления равна нулю как у свободных атомов, так и у атомов, входящих в состав неполярных молекул.
3. Если элемент находится в главной подгруппе, то высшая положительная степень окисления элемента равна номеру этой группы. Ех. с.о. магния равна +2., серы — +6.
4. Степень окисления фтора во всех соединениях равна -1. Степень окисления кислорода -2, водорода +1. Исключение: пероксиды О-1, гидриды Н-1.
Окислитель – атом или ион, который в ОВР принимает электроны. (Он восстанавливается).
Восстановитель – атом или ион, который отдает электроны. (Он окисляется).
ОВР – реакции, протекающие с изменением степеней окисления атомов.
Алгоритм составления окислительно-восстановительных реакций
а) составьте химическое уравнение:
Al + h3SO4 = Al2(SO4)3 + h3
б) определите степень окисления всех элементов в формулах веществ в левой и правой стороне уравнения:
Al0 + h3+1SO4 = Al2+3(SO4)3 + h30
в) подчеркните знаки элементов, у которых степень окисления изменяется в процессе реакции:
Al0 + h3+1SO4 = Al2+3(SO4)3 + h30
г) составьте схему электронного баланса:
Al0 -3е- = Al+3 2 окисление
2H+1 +2е- = h30 3 восстановление
д) расставьте коэффициенты:
2Al0 + 3H+2SO4 = Al+32(SO4)3 + 3Н20
е) проверьте, правильно ли расставлены коэффициенты, с учетом общей суммы атомов кислорода.
ОВР могут протекать в растворах. В этом случае, кроме электронного баланса, нужно написать полное ионное и сокращенное ионно-молекулярное уравнение.
- Обобщение и систематизация (15 мин)
Решение задач по: Рябов Сборник задач и упражнений по химии. 9 класс. С.20.
Домашнее задание: §5, с.22 №6, №8, а).
nsportal.ru
Окислительно-восстановительные реакции. Окисление. Восстановление. Метод электронного баланса.»
Тема: Окислительно-восстановительные реакции. Окисление. Восстановление. Метод электронного баланса.
Цель: Ознакомить учащихся с окислительно-восстановительными реакциями; сформировать понятие о процессах окисления и восстановления; сформировать умение уравнивать окислительно-восстановительные реакции методом электронного баланса.
Оборудование и материалы: Периодическая система химических элементов Д.И. Менделеева, окислительно-восстановительная шкала.
Базовые понятия и термины: Химическая связь, электроотрицательность, степень окисления, заряд атома, окисление, восстановление, прием и отдача электронов, окислитель, восстановитель, метод электронного баланса.
Тип урок: Урок изучения нового материала
Структура урока.
I. Организационный этап.
II. Актуализация опорных знаний.
III. Изучение нового материала.
1. Отличительные признаки окислительно-восстановительных реакций, значение окислительно-восстановительных реакций в природе и технике.
2. Процессы окисления и восстановления.
3. Составление электронного баланса.
IV. Обобщение и систематизация знаний.
V. Домашнее задание.
VI Подведение итогов урока.
Ход урока
I. Организационный этап.
II. Актуализация опорных знаний.
1. Что такое электроотрицательность.
2. Определить электроотрицательность в бинарных соединениях:
NaF CaO H2S AlCl3
3. Что такое степень окисления?
4. Определить степень окисления в соединениях формулы которых:
CO2 NH3 Cl2 H2SO4 Al2O3
III. Изучение нового материала.
1. Отличительные признаки окислительно-восстановительных реакций. Значение окислительно-восстановительных реакций в природе и технике.
Рассказ учителя.
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Например:
+1 -1 +1 -2 +1 +1 -1 +1 -2
HCl + NaOH → NaCl + H2O
Как видно, степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ.
Например:
+1 +5 -2 +1 -1 0
KClO3 → 2KCl + 3O2 (о.– в.)
Изменение степени окисления связано с оттягиванием или перемещением электронов.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (о.-в.).
Окислительно-восстановительные реакции – самые распространенные и играют большую роль в природе и технике. Они являются основой жизнедеятельности. С ними связано дыхание и обмен веществ в живых организмах, гниение, и брожение, фотосинтез в зеленых частях растений. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе.
Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря о.в. происходит превращение химической энергии в электрическую – в гальванических элементах и аккумуляторах.
Они же лежат в основе мероприятий по охране природы. Поэтому эти реакции преобладают и в школьном курсе неорганической химии.
2. Процессы окисления и восстановления.
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окисление (ок-е) – это процесс отдачи электронов атомом, молекулой, ионом.
2. Восстановление (в-е) – процесс приема электронов атомом, молекулой, ионом.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются.
Атомы, молекулы или оны, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
4. Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель – е ⇄ Окислитель
Окислитель + е ⇄ Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов окисления и восстановления.
5. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
3. Составление электронного баланса
Мы с вами рассмотрим порядок составления электронного баланса.
1. В записанном уравнении реакции определить степени окисления всех элементов.
2. Определить, какие элементы в процессе химической реакции изменяют степени окисления.
3. Записать отдельно процессы окисления и восстановления с указанием количества электронов, которые участвуют в каждом процессе.
4. Определить окислитель и восстановитель.
5. Определить коэффициенты, на которые необходимо умножить уравнения окисления и восстановления, чтобы количество электронов, отданных восстановителем и принятых окислителем, было одинаковым.
6. Просуммировать уравнения окисления и восстановления с учетом полученных коэффициентов или расставить соответствующие коэффициенты в исходном уравнении.
Оформление окислительно-восстановительной реакции с электронным балансом должно выглядеть следующим образом: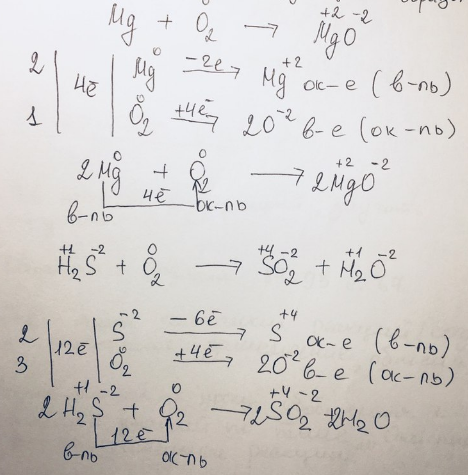
IV. Обобщение и систематизация знаний.
Задание.
Из списка уравнений реакций выбрать окислительно-восстановительные реакции и составить электронный баланс.
1) CaO + CO2 → CaCO3
2) Fe + Cl2 → FeCl3
3) Al + S → Al2S3
4) NaOH + HNO3 → NaNO3 + H2O
V. Домашнее задание
1.Повторить правила о-в реакций, заучить определения параграф 16.
2. Выполнить задания 89 – 93 с.67
3. Повторить типы химических реакций (соединение, разложение, замедление, обмена).
4. Подготовиться к уроку обобщения и закрепления знаний по теме « Окислительно – восстановительные реакции».
VI. Подведение итогов урока.
infourok.ru