неметалл→кислотный оксид→соль→кислота→кислотный оксид→неметалл генетический ряд (желательно — Школьные Знания.com
Массовая доля (%) раствора, который образуется при сливании 100 г 20%-ного и 50 г 10%-ного растворов. Подскажите пожалуйста.
Вариант-1 1.Какая масса калия вступит в реакцию с 17,75г хлора? 2.Найти массу образовавшейся соли при взаимодействии соляной кислоты и алюминия массой … 81 г. 3.Какая масса брома выделится при разложении бромида натрия массой 51,5 г? Вариант-2 1.Какая масса магния вступит в реакцию с 142 г хлора? 2.Найти массу образовавшейся соли при взаимодействии соляной кислоты и железа массой 224 г. 3.Какая масса йода выделится при разложении иодида натрия массой 300 г?
25 г мідного купоросу розчинили у 135 води. Визначте масову частку розчиненої речовини (M(CuSO4) = 160 г/моль, а M(CuSO4 — 5h3O) = 250г/моль Яку масу … мідного купоросу й води треба взяти для приготування 40 кг 20% -го розчину купрум сульфату? Помогите, пожалуйста
Практична робота №5.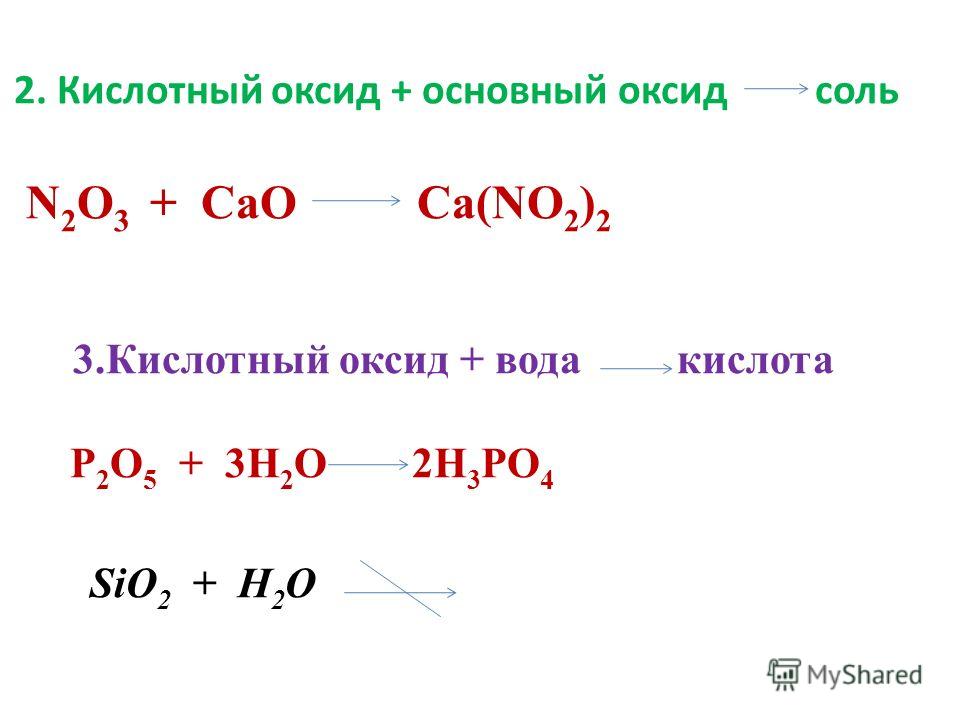 ТЕМА: ”Виготовлення водних розчинів із заданими масовими частками розчинених речовин .”МЕТА: (сформулюйте самостійно) ____________
… ________________________________ОБЛАДНАННЯ: (запишіть самостійно) __________________________________________________________________________________________________________________ЗАВДАННЯ: Влітку і восени засолюють огірки, помідори, деякі гриби. Для цього використовують водний розчин кухонної солі. Для огірків готують розчин із масовою часткою солі від 6 до 8%, для помідорів і грибів — від 5 до 6 %.За вікном весна. Зараз ви можете набути необхідного досвіду з виготовлення розчину з певною масовою часткою солі. Приготуйте розчин за бажанням: чи для засолки огірків, чи помідорів, чи грибів.Пригадайте правила безпеки, яких необхідно дотримуватись під час роботи.Підготуйте місце для роботи, а потім не забудьте прибрати за собою.Виконайте теоретичну частину.Виконайте практичну частину.Оформіть звіт, напишіть висновок.ХІД РОБОТИ:ТЕОРЕТИЧНА ЧАСТИНАПриготую _____ г розчину з масовою часткою _____% для засолки _______________ Дано:ѡ(NaCl) = ____ або __.
ТЕМА: ”Виготовлення водних розчинів із заданими масовими частками розчинених речовин .”МЕТА: (сформулюйте самостійно) ____________
… ________________________________ОБЛАДНАННЯ: (запишіть самостійно) __________________________________________________________________________________________________________________ЗАВДАННЯ: Влітку і восени засолюють огірки, помідори, деякі гриби. Для цього використовують водний розчин кухонної солі. Для огірків готують розчин із масовою часткою солі від 6 до 8%, для помідорів і грибів — від 5 до 6 %.За вікном весна. Зараз ви можете набути необхідного досвіду з виготовлення розчину з певною масовою часткою солі. Приготуйте розчин за бажанням: чи для засолки огірків, чи помідорів, чи грибів.Пригадайте правила безпеки, яких необхідно дотримуватись під час роботи.Підготуйте місце для роботи, а потім не забудьте прибрати за собою.Виконайте теоретичну частину.Виконайте практичну частину.Оформіть звіт, напишіть висновок.ХІД РОБОТИ:ТЕОРЕТИЧНА ЧАСТИНАПриготую _____ г розчину з масовою часткою _____% для засолки _______________ Дано:ѡ(NaCl) = ____ або __.
Задание по химии 10 классотвечайте, только если уверены на 100%, это годовая контрольная работа.В профиле еще другие вопросов по химии за много баллов … , кто шарит в химии посмотрите, пожалуйста)
Задание по химии 10 классотвечайте, только если уверены на 100%, это годовая контрольная работа.В профиле еще другие вопросов по химии за много баллов … , кто шарит в химии посмотрите, пожалуйста)
a) Ca→CaO→ Ca(OH), → → CaCO, b) AI→ AI,O, → AI, (SO), → Al(OH), → AICI, помогите пожалуйста это решить отмечу как лучший ответ
Пж помогите с химией
Пж помогите с химией
ПОЖАЛУЙСТА ОЧЕНЬ СРОЧНО!!
Подборка полезной теории по химии
Химия — предмет, который сдают будущие медики, биологи и технологи. Многие считают его непонятным, но если разобраться в основах, писать реакции и решать задачи будет несложно. Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Многие считают его непонятным, но если разобраться в основах, писать реакции и решать задачи будет несложно. Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Соли
Соли — первая часть теории по химии для подготовки к ЕГЭ. Способы получения солей:
- кислотный оксид + основный оксид: SO3 + Na2O → Na2SO4;
- основание + кислота: HCl + NaOH → NaCl + h3O;
- кислота + основный или амфотерный оксид: 2HCl + CuO → CuCl2 + h3O;
- основание + кислотный оксид: CO2 + Cu(OH)2 → CuCO2 + 2h3O;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: 2Na2SO3 + O2 → 2Na2SO4;
- металл + неметалл: Ca + S → CaS;
- металл + кислота: Fe + 2HCl → FeCl2 + h3.
Следующая часть теории по химии по солям — химические свойства:
- диссоциация: CaCl2 → Ca2+ + 2Cl–;
- с кислотными и амфотерными оксидами: K2CO3 + SiO2 → K2SiO3 + CO2↑;
- c кислотами: KCl + h3SO4 → K2SO4 + HCl;
- с щелочами: CuSO4 + 2KOH → Cu(OH)2 + K2SO4;
- с солями: CuSO4 + BaCl2 → BaSO4↓+ CuCl2;
- с металлами, более активными чем металл соли: CuSO4 + Fe → FeSO4 + Cu;
- разложение: 2AgNO3 → 2Ag +2NO2 + O2;
- окисление: 2KI— + 2Cu+2Cl2 → 2KCl + 2Cu+Cl + I20.

Кислоты
Первая часть теории по кислотам в химии — способы получения:
- кислотный оксид + вода: SO3 + h3O → h3SO4;
- неметалл + водород: h3 + Cl2 → 2HCl;
- электролиз солей: 2CuSO4 + 2h3O → 2Cu + 2h3SO4 + O2;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: P + 5HNO3 → h4PO4 + 5NO2 + h3O.
Вторая часть теории по кислотам — химические свойства:
- диссоциация: HCl → H+ + Cl–;
- с основаниями и амфотерными гидроксидами: Cu(OH)2 + 2HBr → CuBr2 + 2h3O;
- с основными и амфотерными оксидами: CuO + 2HBr → CuBr2 + h3O;
- окисление: 2HI— + 2Cu+2Cl2 → 2HCl + 2Cu+Cl + I20;
- с солями: CaCO3 + 2HCl → CaCl2 + h3O + CO2;
- с металлами, стоящими в ряду активности до водорода: Fe + 2HCl → FeCl2 + h3;
- разложение при нагревании: 2HNO2 → NO + h3O + NO2.
Основания
Теория по химии по основаниям включает в себя способы получения:
- основные оксиды + вода: Na2O + h3O → 2NaOH;
- металл + вода: 2K + 2h3O → 2KOH + h3;
- электролиз некоторых солей щелочных металлов: 2NaCl + 2h3O → 2NaOH + h3↑ + Cl2↑;
- щелочь + соль: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.

Далее разберем теорию по химическим свойствам оснований. Первая реакция относится ко всем типам, остальные — только к щелочам:
- с кислотами: NaOH + h4PO4 → Nah3PO4 + h3O;
- с амфотерными оксидами и гидроксидами в расплаве: NaOH + Al(OH)3 → NaAlO2 + 2h3O. И в растворе: NaOH + Al(OH)3 → Na[Al(OH)4];
- с кислотными оксидами: 2NaOH + CO2 → Na2CO3 + h3O;
- с солями: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
- с металлами: 2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3;
- с неметаллами: 2NaOH +Cl2 → NaCl + NaClO + h3O.
Оксиды
Теорию по химии по оксидам мы начнем изучать со способов получения:
- окисление металлов: 4Al + 3O2 → 2Al2O3;
- окисление неметаллов: S + O2 → SO2;
- окисление бинарных соединений: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
- разложение гидроксидов: h3SO3 → h3O + SO2;
- разложение солей при нагревании: Li2CO3 → CO2 + Li2O.
Теорию по химическим свойствам разных типов оксидов представим в таблице:
|
Основные |
Амфотерные |
Кислотные |
|
Al2O3 + 6HCl → 2AlCl3 + 3H2O |
Na2O + SO2 → Na2SO3 |
SO3 + H2O → H2SO4 |
|
CaO + H2O → Ca(OH)2 |
Al2O3 + 2NaOH → 2NaAlO2 + H2O ZnO + 2NaOH + H2O → Na2[Zn(OH)4] |
3SO3 + Al2O3 → Al2(SO4)3 |
|
K2O + Al2O3 → 2KAlO2 |
Al2O |
SO3 + CuO → CuSO4 |
|
CaO + 3C → CaC2 + CO |
Na2CO3 + Al2O3 → 2NaAlO2 + CO2 |
CaCO3 + SiO2 → CaSiO3 + CO2 |
|
3ZnO + 2Al → Al2O3 + 3Zn |
2SO2 + O2 → 2SO3 | |
|
4FeO + O2 → 2Fe2O3 |
Электролиз растворов солей
Следующий важный раздел — теория электролиза по химии. Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
- если металл активный (до Al включительно в ряду напряжения), то восстанавливается водород, образуется щелочная среда: 2h3O + 2ē → h3 + 2OH—;
- если металл средней активности (от Al до h3), то восстанавливаются и водород, и металл: Fe2+ + 2ē → Fe0 и 2H+2O +2ē → h30 + 2OH—;
- если металл неактивный (после водорода), то восстанавливается только он: Cu2+ + 2ē → Cu0.
Анодные процессы при электролизе:
- кислотный остаток, не содержащий кислорода: 2Cl— – 2ē → Cl20;
- в случае кислотного остатка, содержащего кислород, или иона F— окисляется вода: 2h3O-2 – 4ē → O20 + 4H+;
- окисление гидроксид-иона: 4O-2H– – 4ē → O20 + 2h3O;
- в случае с остатком карбоновой кислоты окислению подвергается углерод: 2Ch4C+3OO– –2ē → 2C+4O2+ Ch4-Ch4.

Пример написания суммарной реакции электролиза:
- 2Cu2+SO4 + 2h3O-2 → 2Cu0 + 2h3SO4 + O20
- Катод (–): 2H+2O +2ē → h30 + 2OH–
- Анод (+): 2Cl– – 2ē → Cl20
Гидролиз солей
Последняя тема по химии — гидролиз солей, то есть реакция с водой. Он идет в тех случаях, когда ионы соли способны образовать с ионами H+ и OH— (они получаются при диссоциации воды) малорастворимые электролиты. Из этого следует, что соли, образованные сильным основанием и сильной кислотой (например, NaCl), не гидролизуются. Существуют необратимые реакции, но они в школьном курсе не рассматриваются. Как правило, они связаны с взаимным гидролизом нескольких солей. Рассмотрим теорию по обратимому гидролизу для ЕГЭ по химии. В этом случае гидролиз идет по слабому месту. Если это кислота, то по аниону, а если основание — по катиону. В случае, когда обе части соли являются «слабыми», гидролиз идет и по катион
- соль образована сильным основанием и слабой кислотой.
 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH; - соль образована слабым основанием и сильной кислотой. Реакция идет по катиону: Nh5Cl + HOH ↔ Nh5OH + HCl;
- соль образована слабым основанием и слабой кислотой. Гидролиз идет и по аниону, и по катиону, среда ближе к нейтральной: Ch4COONh5 + HOH ↔ Ch4COOH + Nh5OH.
Мы разобрали основные классы неорганических соединений, а также гидролиз и электролиз в химии. Надеемся, что эта шпаргалка поможет вам подготовиться и сдать ЕГЭ. Но не забывайте о важности фундаментальных знаний, которые можно получить в школе или на курсах. Мы уверены, что у вас все получится, и вы обязательно поступите в вуз мечты.
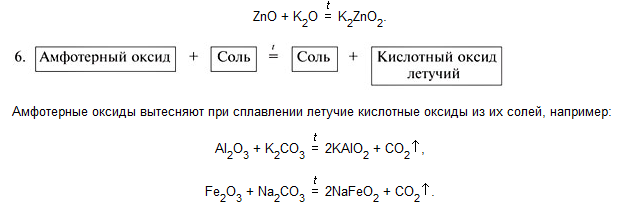
Химические свойства оксидов для ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания.
 Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов: - Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты. Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7. Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
- Кислотный оксид + основание → соль + вода (реакция обмена).

- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Кислотный оксид + основание → соль + вода (реакция обмена).
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т. к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
Решай с ответами:
Урок-путешествие «Генетическая связь между классами веществ»
Цели:
- Сформировать понятие о генетической связи и генетическом ряде.
- Рассмотреть генетические ряды металлов и неметаллов.
- Обобщить знания об основных классах неорганических веществ.
- Продолжить формирование навыков проведения эксперимента, развивать мышление, заставить детей задуматься о воздействии человека на состояние окружающей среды.
Оборудование и реактивы:
- карта путешествия,
- рисунок реки на доске,
- магнитная доска,
- карточки для схем и с формулами кислот,
- штативы с пробирками,
- 3 стакана,
- колба,
- ложечка для сжигания веществ,
- сера, СаО,
- вода, NaOH, HCl,
- универсальный индикатор,
- лимон,
- уксус,
- кефир,
- сода пищевая,
- пачка поваренной соли,
- мыло,
- спиртовка.

ХОД УРОКА
I. Организационный момент. Объявление темы и целей урока. Запись в тетради темы урока.
II. Обобщение знаний по изученным классам веществ.
У каждого из вас на столе лежит оценочный лист. Быстро подпишите их. В течение всего урока вы будете выполнять задания и отмечать результаты в своих оценочных листах.
1-я станция: Кислоты.
Выберите из предметов, которые находятся на столе, что относится к кислотам, и кратко расскажите о них.
Ученик: выбирает лимон, уксус, кефир. Рассказ ученика о кислотах.
Задание. Терминологический диктант. (Если ученик ответил про себя правильно, ставит себе в оценочном листе +, если неправильно, то -).
Учитель: Я показываю формулу кислоты, вы
сначала ее называете, затем отвечаете на вопрос:
какая она по основности? (азотная, серная,
угольная, кремниевая, азотистая, соляная). (Показывает карточки с формулами кислот).
(Показывает карточки с формулами кислот).
Задание. Перед нами на доске мы видим реку. Это Река Знаний. Задание вам — перейти через реку, где это возможно, т. е. дописать возможные уравнения реакций, и поставить в этом месте мостик. Где реакция не идет, объясните, почему, там мостик не ставим. Если ответ правильный, садитесь и ставите себе в оценочном листе +, если неправильный, то — . Вещества называем и объясняем, почему эта реакция идет. Все остальные ученики записывают реакции в тетрадь.
Типичные реакции кислот.
2-я станция : Основания.
Учитель: выбрать из предметов, что можно связать с классом оснований и кратко рассказать об этих веществах.
Ученик: выбирает мыло. Рассказ об основаниях.
Задание: Эксперимент. Мы сейчас с вами дали определения кислот и оснований. А как распознать среди трех выданных веществ, где находится кислота, где — основание, а где — вода?
Ученик: действует на растворы универсальным
индикатором. Делает вывод.
Делает вывод.
Садится, ставит себе +.
Задание: перейти реку. Типичные реакции оснований.
3-я станция: Оксиды.
Ребята, какие группы оксидов мы с вами изучили? Мы с вами составляли в тетради схему соответствия и взаимодействия кислот, оснований, кислотных оксидов и основных оксидов. Пока один из вас будет рассказывать об оксидах, кто-то пойдет к магнитной доске и составит эту схему.
1-й ученик: на магнитной доске составляет схему.
2-й ученик (в это время): выбирает песок, глину и воду. Рассказ об оксидах.
3-й ученик: рассказ об оксиде водорода (воде).
4-й ученик: рассказ об оксиде серы (IV) — сернистом газе.
Фронтальный опрос. (Результаты оформляются в оценочном листе).
- Ребята, к каким оксидам относится сернистый газ SO2?
- Какой кислоте он соответствует?
- С какими классами веществ взаимодействуют кислотные оксиды?
Проверяем схему на магнитной доске.
Задание. Перейти реку Знаний. Типичные реакции оксидов.
4-я станция: Соли.
Учитель: что на нашем столе относится к солям? Выберите и расскажите об одной из самых известных вам солей — хлориде натрия.
Задание: Установите соответствия: (сначала выполняют все на оценочных листах, затем один выходит и пишет ответ на доске)
Названия кислот Названия солей
| 1. Соляная | А. Сульфаты |
| 2. Серная | Б. Карбонаты |
| 3. Угольная | В. Хлориды |
| 4. Азотная | Г. Сульфиды |
| 5. Сероводородная | Д. Нитраты |
Ответ: 1В, 2А, 3Б, 4Д, 5Г.
2. Соответствие движению (игра)
Соответствие движению (игра)
Учитель называет, учащиеся выполняют соответствующее действие (действия записаны на доске).
| класс соединений | действие |
| кислота | правая рука |
| основание | левая рука |
| кислотный оксид | правое ухо |
| основный оксид | левое ухо |
| соль | хлопок в ладоши |
а) Гидроксид кальция, оксид азота (V), фосфорная кислота, нитрат магния, гидроксид меди (II), оксид натрия, серная кислота, хлорид серебра.
III. Изучение нового материала.
Учитель: Оценочные листы убрали в сторону.
Работаем в тетради.
Мы с вами записали тему урока: «Генетическая связь», а что это такое?
Между оксидами, кислотами, основаниями и солями имеется глубокая связь. Зная свойства веществ, можно легко перейти от одного класса соединений к другому.
| Генетической называют связь между веществами разных классов, основанную на их взаимопревращениях и отражающую единство их происхождения, т. е. генезис веществ. |
Вначале давайте наши сведения о классификации веществ представим в виде схемы. (Составляем вместе с классом схему «Классификация неорганических веществ» на магнитной доске)
5-я станция. Генетический рад неметаллов.
Генетический ряд неметаллов отражает
взаимосвязь веществ разных классов, в основу
которой положен один неметалл. |
Их можно выделить две разновидности.
1. Генетический ряд неметаллов, которым соответствует растворимая кислота, может быть отражен в виде такой цепочки превращений:
неметалл —> кислотный —> оксид —> кислота —> соль
Например, генетический ряд фосфора:
или генетический ряд серы:
S – SO3 – h4SO4 – BaSO4
Ученик: рассказ о сере.
Учитель: Демонстрационный опыт «Получение сернистого газа, сернистой кислоты, сульфита свинца».
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть представлен с помощью такой цепочки превращений:
Неметалл —> кислотный оксид —> соль —> кислота —> кислотный оксид —> неметалл.
Так как из изученных нами кислот нерастворима только кремниевая кислота, в качестве примера последнего генетического ряда рассмотрим генетический ряд кремния:
| Si | SiO2 | Na2SiO3 | h3SiO3 | SiO2 | Si |
6-я станция: Генетический ряд металлов.
| Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл. |
Различают две разновидности генетического ряда металлов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. В общем виде такой ряд может быть представлен следующей цепочкой превращений:
металл —> основный оксид —> основание (щелочь) —> соль
Например, генетический ряд кальция:
Ca — CaO — Ca(OH)2 — Ca3(PO4)2
Учащиеся выполняют лабораторный опыт: »Осуществление цепочки Ca — CaO — Ca(OH)2 — Ca3(PO4)2 » по карточке-инструкции, записывают уравнения реакций.
2. Генетический ряд металлов, которым соответствует нерастворимое основание. Можно представить следующей цепочкой превращений:
металл —> основный оксид —> соль —>
основание —> основный оксид —> металл.
Например, генетический ряд меди:
| Cu | CuO | CuCl2 | Cu(OH)2 | CuO | Cu |
Учитель выполняет демонстрационный опыт »Осуществление цепочки Cu CuO CuCl2 Cu(OH)2 CuO Cu «.
Задание: уравнения реакций записать в ионном виде в тетради и на доске.
7-я станция: Закрепительная. Компьютерная презентация.
1 слайд. Определение генетической связи.
2 слайд. Схема «Классификация неорганических веществ»
3 слайд. Генетический ряд металлов.
4 слайд. Генетический ряд неметаллов.
5 слайд. Что это за вещества?
6 слайд. Кислотные дожди.
7 слайд. Запишите уравнения реакций…
8 слайд. Домашнее задание.
П. 42, №№ 2,3 — письменно
Выставление оценок за урок.
Неорганические оксиды — Alfa Aesar
Оксид алюминия, 20% в H 2 O, коллоидная дисперсия
Оксид алюминия, 99%
Оксид алюминия 99% (металлы)
Оксид алюминия, кислотный, для ВЭЖХ Flash Grade
Оксид алюминия, кислотный, для ВЭЖХ Flash Grade
Оксид алюминия, активированный, кислотный, степень I по Брокманну, 58 ангстрем
Оксид алюминия, активированный, основной, степень I по Брокманну, 58 ангстрем
Оксид алюминия, активированный, нейтральный, степень I по Брокманну, 58 ангстрем
Оксид алюминия, активированный, нейтральный, Brockmann Grade II
Оксид алюминия, активированный, нейтральный, гамма-фаза, 99. 9% (металлы)
9% (металлы)
Оксид алюминия, аэрозольная огнеупорная красящаяся краска
ВНИМАНИЕ. Вред репродукции — https://www.p65warnings.ca.gov/
Оксид алюминия, аэрозольная огнеупорная краска
ВНИМАНИЕ.
 Вред репродукции — https: // www.p65warnings.ca.gov/
Вред репродукции — https: // www.p65warnings.ca.gov/ Оксид алюминия, альфа-фаза, не менее 99,95% (металлы)
Оксид алюминия, альфа-фаза, 99.997% (мет. Мет.)
Оксид алюминия, альфа-фаза, 99,997% (мет. Мет.)
Мет.)
Оксид алюминия, альфа-фаза, 99.99% (металлы)
Оксид алюминия, альфа-фаза, 99,9% (металлы)
Оксид алюминия, альфа-фаза, 99. 9% (металлы)
9% (металлы)
Оксид алюминия, альфа-фаза, носитель катализатора, с малой площадью поверхности, тримодальный
Оксид алюминия, альфа-фаза, гамма-фаза, 99.99% (металлы)
Оксид алюминия, основной, для TLC
Оксид алюминия, основной, для ВЭЖХ Flash Grade
Оксид алюминия, основной, для ВЭЖХ Flash Grade
Оксид алюминия кальцинированный изоляционный порошок
Оксид алюминия, носитель катализатора, большая площадь поверхности
Оксид алюминия, носитель катализатора, площадь промежуточной поверхности
Оксид алюминия, носитель катализатора, промежуточная площадь поверхности (с низким содержанием SiO 2 )
Оксид алюминия, носитель катализатора, с низким содержанием кремнезема
Оксид алюминия, носитель катализатора, низкая площадь поверхности
Оксид алюминия, цемент, Al 2 O 3 95% (SiO 2 ≈5%)
Оксид алюминия, для очистки биомассы
Оксид алюминия, для обесцвечивания
Оксид алюминия для анализа диоксинов
Оксид алюминия, для снятия печатных плат
Оксид алюминия, для очистки процесса (поглотитель)
Оксид алюминия, для очистки процесса (поглотитель)
Оксид алюминия, для удаления пирогенов
Оксид алюминия плавленый изолирующий порошок, 99. 7 +%
7 +%
Оксид алюминия плавленый изоляционный порошок 99,7 +%
Оксид алюминия, гамма-фаза, 96 +% вкл.3% С
Оксид алюминия, гамма-фаза, 99,97% (мет. Мет.)
Мет.)
Оксид алюминия, гамма-фаза, 99.997% (мет. Мет.)
Оксид алюминия, гамма-фаза, 99,997% (металлы)
Оксид алюминия, гамма-фаза, альфа-фаза, 99. 98% (металлы)
98% (металлы)
Оксид алюминия, гамма-фаза, носитель катализатора, большая площадь поверхности, бимодальный
Оксид алюминия, гамма-фаза, нанопорошок, 99 +%
Оксид алюминия, NanoArc ™, AL-0405, 99. 5%
5%
Оксид алюминия, NanoArc® AL-2220, 30% в уайт-спирите, коллоидная дисперсия с диспергатором
Оксид алюминия, NanoDur® AL-2420, 50% в уайт-спирите, коллоидная дисперсия с диспергатором
Оксид алюминия, нейтральный, для ВЭЖХ Flash Grade
Химическая реактивность | Группа Грандинетти
Водород
В отличие от остальных элементов Группы 1А, которые существуют в виде металлов, элементарный водород существует в виде газообразных молекул H 2 . Соединения, образующиеся между водородом и неметаллами, являются скорее молекулярными, чем ионными. (, то есть , водород образует ковалентные связи с неметаллами). Например, водород реагирует с галогенами (группа VIIA) согласно:
Соединения, образующиеся между водородом и неметаллами, являются скорее молекулярными, чем ионными. (, то есть , водород образует ковалентные связи с неметаллами). Например, водород реагирует с галогенами (группа VIIA) согласно:
2 H 2 (г) + О 2 (г) → 2 H 2 O (г)
8 H 2 (г) + С 8 (с) → 8 H 2 S (г)
3 H 2 (г) + N 2 (г) → 2 NH 3 (г)
Водород может также образовывать соединения с более активными металлами с образованием ионных гидридов .Например, гидрид лития образуется в соответствии с:
2 Li (т) + H 2 (г) → 2 LiH (т)
Металл (в данном случае Li) теряет электрон, чтобы стать катионом, а H приобретает электрон, чтобы стать H — (гидрид-анион), который имеет заряд -1. Вот еще один пример:
Вот еще один пример:
Mg (т) + H 2 (г) → MgH 2 (т)
Получая электрон, ион гидрида получает стабильную электронную конфигурацию замкнутой n = 1 оболочки, то есть конфигурацию благородного газа He.
Кислород
Кислород — это элемент группы 6А. Элементарный кислород присутствует в двух формах: газообразный кислород (O 2 ) и газообразный озон (O 3 ). Различные формы элемента в одном и том же состоянии называются Аллотропами .
Реакции кислорода с металлами
Когда кислород реагирует с большинством металлов, образуется оксид металла, где кислород имеет степень окисления -2. Например, оксид цинка образуется, когда металлический цинк реагирует с газообразным кислородом:
2 Zn (т) + О 2 (г) → 2 ZnO (т)
и оксид алюминия образуется, когда металлический алюминий реагирует с газообразным кислородом:
4 Al (s) + 3 O 2 (г) → 2 Al 2 O 3 (с)
Однако есть некоторые исключения, которые мы рассмотрим далее.
Металлы группы IA — щелочные металлы
Поскольку щелочные металлы настолько активны, продукт их реакции с газообразным кислородом — это не то, чего можно было ожидать. В то время как металлический литий реагирует с газообразным кислородом с образованием оксида лития, как и следовало ожидать:
4 Li (т) + О 2 (г) → 2 Li 2 O (т) ,
когда металлический натрий реагирует с газообразным кислородом в тех же условиях, он образует пероксид натрия:2 Na (т) + О 2 (г) → Na 2 O 2 (с)
а очень активные щелочные металлы, калий, рубидий и цезий, реагируют с газообразным кислородом с образованием супероксидов:Металлы группы IIA — щелочноземельные металлы
Кислород реагирует с большинством щелочноземельных металлов с образованием оксида металла:
2 млн (т) + О 2 (г) → 2 МО (т)
Например,
Однако кислород соединяется с металлическим барием, наиболее активным из этой группы, с образованием пероксида:
Ba (s) + О 2 (г) → BaO 2 (т)
Реакции между кислородом и неметаллами (кроме групп 7A и 8A)
Когда кислород соединяется с неметаллами в их элементарной форме, продукт представляет собой оксид неметалла. Например, кислород реагирует с твердым углеродом с образованием моноксида углерода или диоксида углерода соответственно, как показано ниже (реакция не сбалансирована):
Например, кислород реагирует с твердым углеродом с образованием моноксида углерода или диоксида углерода соответственно, как показано ниже (реакция не сбалансирована):
C (т) + О 2 (г) → CO (г) или же CO 2 (г)
Аналогичным образом кислород реагирует с твердым фосфором с образованием гептоксида тетрафорфора или декоксида тетрафорфора соответственно, как показано ниже (реакция не сбалансирована):
П 4 (т) + О 2 (г) → P 4 O 6 (г) или же P 4 O 10 (г)
При взаимодействии с твердой серой кислород образует газообразный диоксид серы:
S 8 (т) + 8 O 2 (г) → 8 SO 2 (г)
Оксидные реакции
Реакции с неметаллическими оксидами
Оксиды неметаллов кислые.Если оксид неметалла растворяется в воде, он образует кислоту.
Оксид неметалла + Воды → Кислота
Например,
SO 3 (г) +
H 2 O (л) →
H 2 SO 4 (водн. )
)
N 2 O 3 (г) + H 2 O (л) → HNO 2 (водн.)
Оксиды неметаллов можно нейтрализовать основанием с образованием соли и воды.
Оксид неметалла + База → Соль + Воды
Например,
SO 3 (г) + Ba (OH) 2 (водн.) → BaSO 4 (водн.) + H 2 O (л)
П 4 О 10 (с) + 12 NaOH (водн.) → 4 Na 3 PO 4 (водн.) + 6 H 2 O (л)
Реакции оксидов металлов
Оксиды металлов основные.Если оксид металла растворяется в воде, он образует гидроксид металла.
Оксид металла + Воды → Гидроксид металла
Например,
BaO (т) + H 2 O (л) → Ba (OH) 2 (водн.)
К 2 О (т) +
H 2 O (л) →
2 КОН (водн. )
)
Как и любое основание, эти основания можно нейтрализовать кислотой с образованием соли и воды.
Оксид металла + Кислота → Соль + Воды
Примеры:
CuO (т) + 2 HNO 3 (водн.) → Cu (NO 3 ) 2 (водн.) + H 2 O (л)
Al 2 O 3 (с) + 6 HCl (водн.) → 2 AlCl 3 (водн.) + 3 H 2 O (л)
Как правило, чем более металлический характер имеет элемент, тем более основным будет его оксид.Точно так же, чем более неметаллический характер имеет элемент, тем более кислым будет его оксид. Металлический характер элемента можно определить по его положению в таблице Менделеева:
Наконец, отметим, что соль также может быть образована в результате прямой реакции металла и неметалла.
Металл + Неметалл → Соль
Например,
2 Al (т) + 3 Br 2 (л) → 2 AlBr 3 (т)
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
7,53, 7,55, 7,57, 7,59, 7,61, 7,65, 7,67, 7,69, 7,71, 7,73, 7,77
Неорганическая химия — Почему Cr2O3 амфотерный, а CrO — нет?
Основной оксид — это оксид, который растворяется в воде с образованием растворимого гидроксида. По этой причине основные оксиды хорошо растворимы. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым.Это также относится к элементам, имеющим несколько оксидов. Поскольку окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит полезную информацию по этой теме:
Поскольку кислотность катиона быстро растет с ростом заряда, d-блок элементы с широким диапазоном степеней окисления могут иметь один или несколько оксидов, которые проявляют только основные свойства, и один или несколько оксиды, проявляющие только кислотные свойства.
Чем выше окисление число более кислый соответствующий оксид.{-}}) $.
Итак, эмпирическое правило: по мере увеличения степени окисления увеличивается заряд металла, увеличивается кислотный характер. Также основной оксид растворим в воде, кислотный оксид не растворяется в воде. Это может быть использовано для различения кислотного и основного оксида.
видов оксидов, основных оксидов, кислых оксидов. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — сложные химические вещества, представляющие собой простые химические соединения элементов с кислородом.Они солеобразуют и солей не образуют .
Существует 3 типа солеобразующих оксидов: Основные оксиды (от слова «Основа»), кислотные оксиды и Амфотерные оксиды .
Примером оксидов, не образующих соли, могут быть: NO (оксид азота) — бесцветный газ без запаха. Его образуют электрические бури в атмосфере. CO (окись углерода) газ без запаха, образуется при сгорании угля. Обычно его называют оксидом углерода.
Обычно его называют оксидом углерода.
Есть и другие оксиды, не образующие солей.
Теперь рассмотрим каждый тип солеобразующих оксидов.
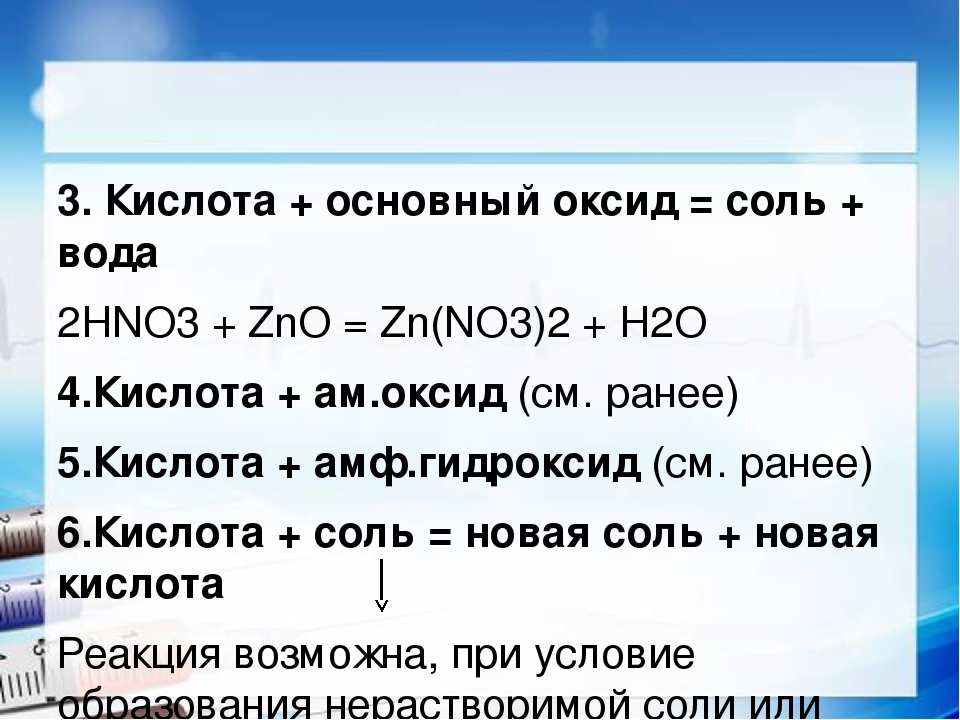
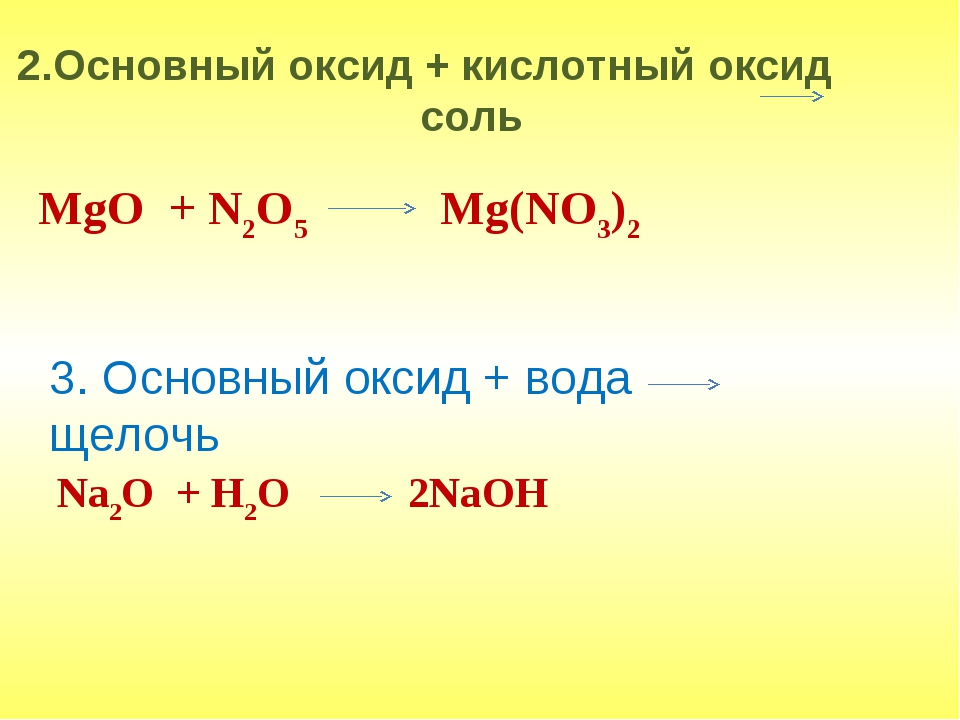
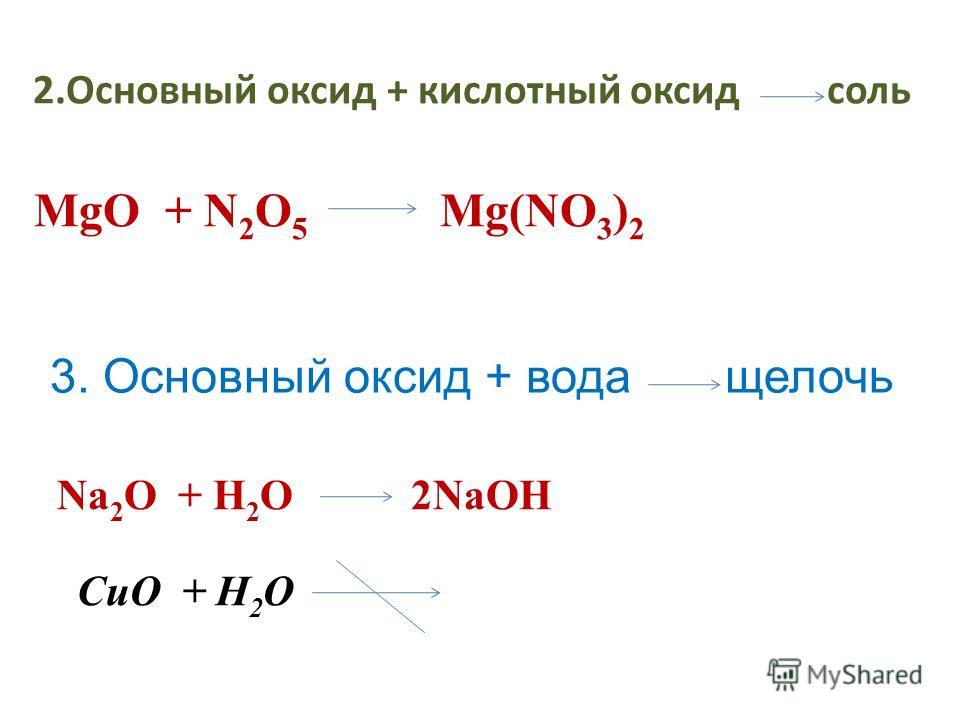
Основные оксиды
Основные оксиды — это сложные химические оксиды, которые образуют соли при химической реакции с кислотами или кислыми оксидами и не вступают в реакцию с основаниями или основными оксидами. Например, к основным оксидам относятся следующие:
K 2 O (оксид калия), CaO (оксид кальция), FeO (двухвалентный оксид железа).
Рассмотрим химических свойств оксидов примеров.
1.Реакция с водой:
— реагирует с водой и образует основание (или щелочь)
CaO + H 2 O → Ca (OH) 2 (реакция, известная как известкование, выделяет большое количество тепла!)
2. реагирует с кислотами:
реакция с кислотой и форма соли и воды (раствор соли в воде)
CaO + H 2 SO 4 → CaSO 4 + H 2 O (Кристаллы этого вещества CaSO 4 повсеместно известны как «гипс Парижа»).
3. реагирует с кислыми оксидами: образует соли
CaO + CO 2 → CaCO 3 (Это вещество, известное как мел!)
Кислые оксиды
Кислотные оксиды — это сложные химические оксиды, которые образуют соли при химических реакциях с основаниями или основными оксидами и не вступают в реакцию с кислотными оксидами.
Примеры кислых оксидов могут быть:
CO 2 (всем известный диоксид углерода), P 2 O 5 — оксид фосфора (образуется в воздухе, если горит белый фосфор), SO 3 — оксид серы (VI) — вещество, используемое для серной кислота
— химическая реакция с водой
CO 2 + H 2 O → H 2 CO 3 — это вещество — угольная кислота — одна из слабых кислот, ее добавляют в газированную воду для «пузырьков» газа.С повышением температуры растворимость газа в воде уменьшается, а избыток выходит в виде пузырьков.
— реакция со щелочами (основаниями):
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O-образующееся вещество (соль) широко используется в сельском хозяйстве. Это называется кальцинированной сода или стиральная сода, это отличное очищающее средство от пригоревших кастрюль, жира, ожогов. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO 2 + MgO → MgCO 3 получается соль — карбонат магния, также называемая «горькой солью».
Амфотерные оксиды
Амфотерные оксиды — это сложное химическое вещество, также оксиды, которые образуют соли при химических реакциях с кислотами (или кислотных оксидов ) и с основаниями (или основных оксидов ). Чаще всего используется слово «амфотерный» для оксидов металлов .
Пример амфотерных оксидов может быть:
ZnO — оксид цинка (белый порошок, часто используемый в медицине для изготовления масок и кремов), Al 2 O 3 — оксид алюминия (также называемый «оксидом алюминия»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химическую реакцию, подходящую как основания и кислоты. Например:
— реакция с кислым оксидом:
ZnO + H 2 CO 3 → ZnCO 3 + H 2 O — Образованное вещество, состав соли карбоната цинка в воде.
— основание реакции:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O — полученное вещество представляет собой двойную соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическими и химическими методами. Самый простой способ — химическая реакция простых элементов с кислородом. Например, в результате процесса горения одним из продуктов этой химической реакции являются оксидов .
Например, если раскаленные железные стержни (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, это на самом деле то, что у вас есть) поместить в колбу с кислородом, произойдет химическая реакция окисления, которая сопровождается яркой вспышкой и искрами. Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
2Fe + O 2 → 2FeO
Совершенно аналогичные химические реакции окисления для других металлов и неметаллов, такие как:
Цинк горит в кислороде с образованием оксида цинка
2Zn + O 2 → 2ZnO
При сжигании угля образуются два оксида: оксид углерода и диоксид углерода
2C + O 2 → 2CO — образование окиси углерода.
C + O 2 → CO 2 — образование диоксида углерода.Этот газ образуется, когда кислород доступен в более чем достаточных количествах, то есть в любом случае сначала происходит реакция с образованием монооксида углерода, а затем монооксид углерода окисляется до диоксида углерода.
Получение оксидов можно осуществить другим способом — реакцией химического разложения.
Например, для получения оксида железа или оксида алюминия необходимо поджечь соответствующую основу этих металлов в огне.
Fe (OH) 2 → FeO + H 2 O
Оксид алюминия — оксид корунда-железа (III).Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в почве оксида железа (III). Оксид алюминия — корунд Растворы оксидов 2Al (OH) 3 → Al 2 O 3 + 3H 2 O,
а также разложение отдельных кислот:
H 2 CO 3 → H 2 O + CO 2 — разложение угольной кислоты
H 2 SO 3 → H 2 O + SO 2 — разложение сернистой кислоты
Производство оксидов может осуществляться из солей металлов при сильном нагреве:
CaCO 3 → CaO + CO 2 — при воспламенении мела получают оксид кальция (или известь) и диоксид углерода.
2Cu (NO 3 ) 2 → 2CuO + 4NO 2 + O 2 — в этой реакции разложения получается два оксида: медь CuO (черный цвет) и азот NO 2 (его еще называют коричневый газ, потому что он действительно коричневый).
Другой способ получения оксидов с помощью окислительно-восстановительной реакции, например
Cu + 4HNO 3 (конц.) → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (конц.) → 3SO 2 + 2H 2 O
Оксиды хлора
Молекула ClO 2 Молекула Cl 2 O 7 Закись азота N 2 ON Диоксид азота N 2 O 3 Ангидрид азота N 2 O 5314 Коричневый газ 14 NO
2 Известны оксидов хлора : Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 . Все они, кроме Cl 2 O 7 , имеют желтый или оранжевый цвет и не являются устойчивыми, особенно ClO 2 Cl 2 O 6 .Все оксидов хлора взрывоопасны и являются очень сильными окислителями.Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорные кислоты:
Итак, Cl 2 O — оксид хлора хлорноватистой кислоты.
Cl 2 O + H 2 O → 2HClO — Хлорноватистая кислота
ClO 2 — кислоты оксид хлора хлорноватистой и чарнаватовой кислоты, поскольку химическая реакция с водой образует две кислоты:
ClO 2 + H 2 O → HClO 2 + HClO 3
Cl 2 O 6 также является кислым оксидом хлора чарнавати и хлорной кислотой:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
Наконец, Cl 2 O 7 представляет собой бесцветную жидкость кислый оксид хлора хлорноватой кислоты:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
а, Cl 2 O 7 — бесцветная жидкость — кислый оксид хлора хлорная кислота:
Cl 2 O 7 + H 2 O → 2HClO 4
Оксиды азота
Азот — это газ, который образует с кислородом 5 различных соединений — 5 оксидов . Например:
Например:
— N 2 O — азот смешанный . Имеет другое название, в медицине известен как веселящий газ или закись азота Газ бесцветен, сладок и приятен на вкус. NO окись азота — бесцветный, без запаха и вкуса газ.
— N 2 O 3 — азотистый ангидрид — бесцветное кристаллическое вещество
— NO 2 — диоксид азота .Другое его название — коричневый газ — газ действительно имеет ржаво-коричневый цвет
— N 2 O 5 — азотный ангидрид голубая жидкость, кипящая при температуре 3,5 0 C
Из всех перечисленных соединений азота наибольший интерес для промышленности представляют NO — монооксид азота, а NO 2 — диоксид азота. Окись азота (NO) Закись азота N 2 O не реагирует с водой или щелочью. Ангидрид азота (N 2 O 3 ) при реакции с водой образует слабую и нестабильную азотистую кислоту HNO 2 , которая на воздухе постепенно превращается в более стабильное химическое вещество азотную кислоту
Рассмотрим некоторые из химических свойств оксидов азота : Реакция с водой:
2NO 2 + H 2 O → HNO 3 + HNO 2 образуются 2 кислоты: азотная кислота HNO 3 и азотистая кислота.
Реакция с щелочью:
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O — образование двух солей: нитрата натрия NaNO 3 и нитрита натрия
Реакция с солями:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 — образуются две соли: нитрат натрия и нитрит натрия, а также диоксид углерода.
Получите диоксид азота (NO 2 ) из оксида азота (NO) химической реакцией соединения c кислород:
2НО + О 2 → 2НО 2
Оксиды железа
Железо образует два оксида : FeO — оксид железа (2-валентный) — черный порошок, который получают путем восстановления оксида железа (3-валентного) монооксида углерода в соответствии со следующей химической реакцией:
Fe 2 O 3 + CO → 2FeO + CO 2
Это основной оксид, легко вступающий в реакцию с кислотами. Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
4FeO + O 2 → 2Fe 2 O 3
Оксиды железа (3-валентные) — красно-коричневый порошок (гематит), обладающий амфотерными свойствами (вступает в реакцию с кислотами и щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что чаще всего его используют в качестве основного оксида .
Также присутствуют смешанных оксидов железа Fe 3 O 4 .Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным гематитом или магнетитом).
Если железо сжигается, в реакции образуются два оксида: оксид железа , (III) и (II) валентность.
Диоксид серы
Диоксид серы SO 2 Диоксид серы SO 2 — или сернистый газ — это кислые оксиды , но он не образует кислоту, хотя прекрасно растворяется в воде — 40 л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называется серной кислотой).
В норме это бесцветный газ с резким удушающим запахом горящей серы. При температуре -10 0 C он может быть переведен в жидкое состояние.
В присутствии катализатора оксида ванадия (V 2 O 5 ) диоксид серы присоединяет кислород и превращается в триоксид серы
2SO 2 + O 2 → 2SO 3
Растворенный в воде диоксид серы — SO 2 очень медленно окисляется, и в результате превращается в серную кислоту
Если диоксида серы пропустить через раствор щелочи, например гидроксид натрия, то через сульфит натрия (или гидросульфит, это зависит от того, сколько вы берете щелочи и диоксида серы)
NaOH + SO 2 → 2NaHSO 3 — диоксид серы взяты больше, чем необходимо
2NaOH + SO 2 → Na 2 SO 3 + H 2 O
Если диоксид серы не реагирует с водой, то почему его водный раствор дает кислую реакцию ?! Да не реагирует, но он сам окисляется в воде и добавляет кислород. И оказывается, в воде накапливаются атомы водорода, которые дают кислотную реакцию (это можно проверить по какому-нибудь индикатору!)
И оказывается, в воде накапливаются атомы водорода, которые дают кислотную реакцию (это можно проверить по какому-нибудь индикатору!)
Оксид — Энциклопедия
ОКСИД, в химии, бинарное соединение кислорода и других элементов. В общем, оксиды являются наиболее важными соединениями, с которыми приходится иметь дело химикам, изучение их состава и свойств позволяет провести ценное сравнительное исследование элементов.Возможно прямое соединение кислорода с большинством элементов (наличие следов водяного пара обычно необходимо согласно исследованиям HB Baker), а когда это не так, доступны косвенные методы, за исключением бром и фтор (а также так называемые инертные газы — аргон, гелий и т. д.), которые до сих пор не дали оксидов. Большинство элементов соединяется с кислородом в нескольких пропорциях, например, азот имеет пять оксидов: N 2 0, NO, N 2 0 3, NO 2, N205; для целей классификации, однако, выгодно назначать типичный оксид каждому элементу, который, как правило, является наивысшим, имеющим основной или кислотный характер. Таким образом, в группе I периодической системы типичным оксидом является M 2 O группы II. МО, III группы. M 2 O 3 группы IV. МО 2, группы V. M 2 O 5, группы VI. M03.
Таким образом, в группе I периодической системы типичным оксидом является M 2 O группы II. МО, III группы. M 2 O 3 группы IV. МО 2, группы V. M 2 O 5, группы VI. M03.
Можно выделить пять видов оксидов: (I) основные оксиды, (2) кислые оксиды, (3) нейтральные оксиды, (4) пероксиды, (5) смешанные ангидриды и соли. Основные оксиды соединяются с кислотами или кислыми оксидами с образованием солей; аналогично кислые оксиды соединяются с основными оксидами с образованием солей. Первые чаще образуются из металлов (однако некоторые металлы образуют оксиды, принадлежащие к другим группам), а вторые обычно связаны с неметаллами.Оксид может быть как кислотным, так и основным, , т.е. , может сочетаться как с основаниями, так и с кислотами; это относится к элементам, возникающим при переходе между основными и оксигенными элементами в периодической классификации, например. алюминий и цинк. Нейтральные оксиды не соединяются ни с кислотами, ни с основаниями с образованием солей, ни с водой с образованием основания или кислоты. Типичный член — оксид азота; окись углерода и закись азота также могут быть отнесены к этому классу, но следует помнить, что эти оксиды могут рассматриваться, по крайней мере, в некоторой степени, как ангидриды муравьиной и азотистой кислоты, хотя, в то же время, это невозможно. получить эти кислоты простой гидратацией этих оксидов.Пероксиды в большинстве случаев можно определить как оксиды, содержащие больше кислорода, чем типичный оксид. Несостоятельность этого определения наблюдается в случае диоксида свинца, который, безусловно, является пероксидом по свойствам, но также является типичным оксидом группы IV. к которому принадлежит свинец. Все перекиси обладают окислительными свойствами. Пероксиды могут быть основными или кислыми. Некоторые основные оксиды образуют перекись водорода с кислотами, другие — кислород (они также высвобождают хлор из соляной кислоты) и могут объединяться с более низкими кислотными оксидами с образованием солей нормального основного оксида с более высоким кислотным оксидом.
Типичный член — оксид азота; окись углерода и закись азота также могут быть отнесены к этому классу, но следует помнить, что эти оксиды могут рассматриваться, по крайней мере, в некоторой степени, как ангидриды муравьиной и азотистой кислоты, хотя, в то же время, это невозможно. получить эти кислоты простой гидратацией этих оксидов.Пероксиды в большинстве случаев можно определить как оксиды, содержащие больше кислорода, чем типичный оксид. Несостоятельность этого определения наблюдается в случае диоксида свинца, который, безусловно, является пероксидом по свойствам, но также является типичным оксидом группы IV. к которому принадлежит свинец. Все перекиси обладают окислительными свойствами. Пероксиды могут быть основными или кислыми. Некоторые основные оксиды образуют перекись водорода с кислотами, другие — кислород (они также высвобождают хлор из соляной кислоты) и могут объединяться с более низкими кислотными оксидами с образованием солей нормального основного оксида с более высоким кислотным оксидом.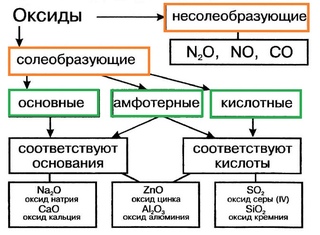 Примеры: Ba02-1-h3S04 = BaS04 + h302; 2Mn02-I-2h3S04 = 2MnS04-1-2h30 + 02; Mn02 — {- 4HC1 = MnC12 + 2H 2 0 + C1 2; Pb02 + S02 = PbS04 (т.е. Pb0 + 503) Можно выделить два вида основных пероксидов: (I) супероксиды или пероксидаты, содержащие атомы кислорода в цепи, например, Na 0 0 Na, Bab, которые с кислотами дают перекись водорода; и (2) полиоксиды, имеющие атомы кислорода, дважды связанные с атомом металла, например, 0: M n: 0,0: Pb: O и дает кислород с серной кислотой и хлор с соляной кислотой.Л. Марино ( Zeit. Anorg. Chem., 1907, 5 6, стр. 2 33) указал, что марганец и диоксид свинца по-разному ведут себя с диоксидом серы, первый дает дитионат, а второй сульфат, и предложил следующие формулы : O: Mn: 0, OPb: как объяснить эту разницу. Более простое объяснение состоит в том, что диоксид марганца сначала дает нормальный сульфит , который перегруппируется в дитионат, таким образом: Mn0 2 + 2S0 2 = Mn (S03) 2-MnS206, в то время как диоксид свинца дает основной сульфит , который перестраивается в сульфат.
Примеры: Ba02-1-h3S04 = BaS04 + h302; 2Mn02-I-2h3S04 = 2MnS04-1-2h30 + 02; Mn02 — {- 4HC1 = MnC12 + 2H 2 0 + C1 2; Pb02 + S02 = PbS04 (т.е. Pb0 + 503) Можно выделить два вида основных пероксидов: (I) супероксиды или пероксидаты, содержащие атомы кислорода в цепи, например, Na 0 0 Na, Bab, которые с кислотами дают перекись водорода; и (2) полиоксиды, имеющие атомы кислорода, дважды связанные с атомом металла, например, 0: M n: 0,0: Pb: O и дает кислород с серной кислотой и хлор с соляной кислотой.Л. Марино ( Zeit. Anorg. Chem., 1907, 5 6, стр. 2 33) указал, что марганец и диоксид свинца по-разному ведут себя с диоксидом серы, первый дает дитионат, а второй сульфат, и предложил следующие формулы : O: Mn: 0, OPb: как объяснить эту разницу. Более простое объяснение состоит в том, что диоксид марганца сначала дает нормальный сульфит , который перегруппируется в дитионат, таким образом: Mn0 2 + 2S0 2 = Mn (S03) 2-MnS206, в то время как диоксид свинца дает основной сульфит , который перестраивается в сульфат. , таким образом: PbO-l-S0 2 = PbOS03 -> PbS04.Кислые пероксиды соединяются с основными оксидами с образованием пероксидазных солей и за счет потери кислорода дают кислый оксид, типичный для этого элемента. Смешанные ангидриды представляют собой оксиды, образующие с водой две кислоты, или соли, состоящие из основного и кислого оксидов одного и того же металла. Примерами смешанных ангидридов являются C10 2 и NO2, которые дают хлорную и хлорноватую кислоты, а также азотистую и азотную кислоты: 2C102 + h30 = HC102 + HC103, 2N02 + h30 = HNO2 + HN03; и смешанных солей Pb203 и Pb304, которые можно рассматривать как мета- и ортоплюмбат свинца: Pb0Pb02, 2PbOPb02.
, таким образом: PbO-l-S0 2 = PbOS03 -> PbS04.Кислые пероксиды соединяются с основными оксидами с образованием пероксидазных солей и за счет потери кислорода дают кислый оксид, типичный для этого элемента. Смешанные ангидриды представляют собой оксиды, образующие с водой две кислоты, или соли, состоящие из основного и кислого оксидов одного и того же металла. Примерами смешанных ангидридов являются C10 2 и NO2, которые дают хлорную и хлорноватую кислоты, а также азотистую и азотную кислоты: 2C102 + h30 = HC102 + HC103, 2N02 + h30 = HNO2 + HN03; и смешанных солей Pb203 и Pb304, которые можно рассматривать как мета- и ортоплюмбат свинца: Pb0Pb02, 2PbOPb02.
Окисление и восстановление
В узком смысле «окисление» можно рассматривать как комбинацию вещества с кислородом, и, наоборот, «восстановление» как отрыв кислорода; в более широком смысле окисление включает не только добавление кислорода, но также других электроотрицательных элементов или групп, или удаление водорода или электроположительного элемента или группы.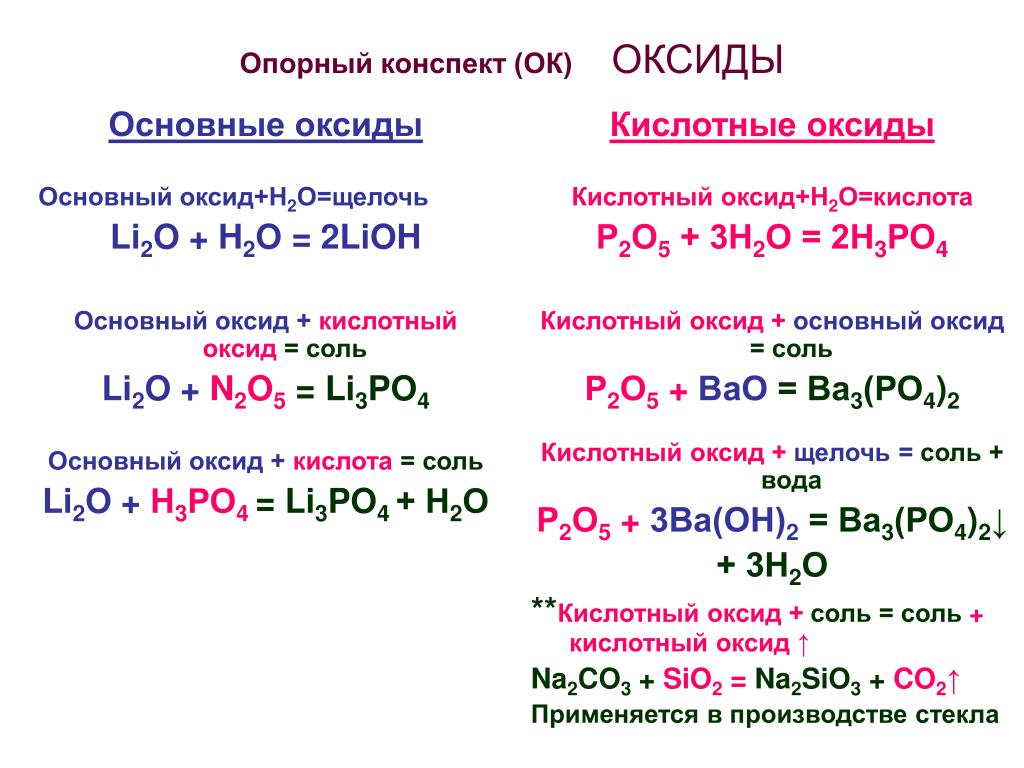 В неорганической химии окисление во многих случаях связано с увеличением активной валентности. Игнорируя процессы окисления или восстановления, просто вызываемые теплом или какой-либо другой формой энергии, мы можем рассматривать окислитель как вещество, имеющее сильное сродство к электроположительным атомам или группам, а восстановитель — как имеющее сильное сродство к электрохимическим атомам. -отрицательные атомы или группы; в реальных процессах окислитель подвергается восстановлению, а восстановитель окисляется.
В неорганической химии окисление во многих случаях связано с увеличением активной валентности. Игнорируя процессы окисления или восстановления, просто вызываемые теплом или какой-либо другой формой энергии, мы можем рассматривать окислитель как вещество, имеющее сильное сродство к электроположительным атомам или группам, а восстановитель — как имеющее сильное сродство к электрохимическим атомам. -отрицательные атомы или группы; в реальных процессах окислитель подвергается восстановлению, а восстановитель окисляется.
Многие вещества подвергаются одновременному окислению и восстановлению при определенной обработке; это известно как самоокисление. Например, при кипячении водного раствора гипохлорита, хлората и хлорида часть исходной соли окисляется, а часть восстанавливается: 3NaOC1 = NaC103-2NaC1. Подобным образом фосфорная и гипофосфористая кислоты дают фосфорную кислоту и фосфен, тогда как азотистая кислота дает азотную кислоту и оксид азота: 4h4P03 = 3h4P04 + Ph4; 2H 3 PO 2 = H 3 PO 4 + PH 3 i 3HN02 = HNO 3 + 2NO — h30. В органической химии известным примером является реакция Канниццаро, в которой ароматический альдегид дает кислоту и спирт: 2C E H 5 CHO + H 2 O = C6H5C02H + C6H5Ch30H.
В органической химии известным примером является реакция Канниццаро, в которой ароматический альдегид дает кислоту и спирт: 2C E H 5 CHO + H 2 O = C6H5C02H + C6H5Ch30H.
К важным окислителям относятся: кислород, озон, пероксиды, галогены, хлор и бром, оксикислоты, такие как азотная и хлорная, бром и йод, а также хромовая и перманганцевая кислоты. Важные восстановители включают водород, гидриды, такие как йод, сера, фосфор и т. Д., Углерод, многие металлы, калий, натрий, алюминий, магний и т. Д., соли низших оксикислот, низшие соли металлов и низшие оксиды.
Какие факторы делают амфотерные оксиды способными реагировать как с кислотами, так и с щелочами?
Основные оксиды
Металлический характер увеличивается справа налево и сверху вниз в Периодической таблице.
Самые металлические элементы образуют самые основные оксиды.
Даже если оксиды нерастворимы в воде, мы все равно называем их основными оксидами, потому что они вступают в реакцию с кислотами.
# «MgO (s) + 2HCl (водн.) → MgCl» _2 «(водн.)» + «H» _2 «O» (l) «#
Кислые оксиды
Неметаллический символ увеличивается слева направо и снизу вверх в Периодической таблице.
Самые неметаллические элементы образуют наиболее кислые оксиды.
Они реагируют с водой с образованием оксокислот. Например,
# «SO» _2 «(вод.)» + «H» _2 «O (l)» → «H» _2 «SO» _3 «(вод.)» #
Даже если оксид нерастворим в воде, мы все равно относим его к кислому, если он реагирует с основаниями с образованием солей.»-» «(водн.)» #
Более легкие элементы групп 2 и 13, некоторые из # «d» # — блочных элементов и более тяжелые элементы групп 14 и 15 содержат амфотерные оксиды.
Самые основные оксиды находятся в нижнем левом углу Периодической таблицы, а самые кислые оксиды — в верхнем правом углу, поэтому неудивительно, что граница между кислотными и основными оксидами проходит по диагонали.
Амфотеризм и степени окисления
Амфотеризм зависит от степени окисления оксида.
Нет простого способа предсказать, какие элементы будут амфотерными.
Амфотерный характер оксида, вероятно, отражает способность металла поляризовать окружающие ионы оксида, то есть вносить значительный ковалентный характер в связь # «M-O» #.
Эта способность увеличивается с увеличением степени окисления, поскольку положительный характер центрального атома увеличивается.
Однако в группе 15 амфотерными являются только оксиды с более низкой степенью окисления.
Оксиды с более высокой степенью окисления слишком кислые, чтобы быть амфотерными.
Многие переходные металлы образуют амфотерные оксиды, но трудно предсказать, какой из их оксидов будет амфотерным.
Мы можем сказать, что амфотерная природа оксида сильно зависит от степени окисления металла.
Кислотность катиона быстро повышается с увеличением заряда, поэтому переходные металлы с различными степенями окисления могут иметь кислые, основные или амфотерные оксиды.
«-» #
Приведите по два примера каждого из следующих оксидов: (a) Кислые оксиды (b) Основные оксиды (c) Амфотерные оксиды (d) Нейтральные оксиды. Укажите, какой из следующих оксидов, например, от (a) до (d)
Нажмите, чтобы оценить этот пост!
[Всего: 0 Среднее: 0](i) Взаимодействие с водой с образованием основания
Решение:
(ii) Взаимодействие с основанием с образованием соли и воды
(iii) Взаимодействие с кислотами и основаниями с образованием соли и воды.Кислый оксид:
Неметаллы реагируют с кислородом с образованием кислотных соединений оксидов, которые удерживаются вместе ковалентными связями.Эти соединения также можно назвать ангидридами кислот. Ангидриды кислот обычно имеют низкие температуры плавления и кипения, за исключением таких соединений, как B 2 O 3 и SiO 2 , которые имеют высокие температуры плавления и образуют гигантские молекулы.
Примеры: NO, CO 2
SO 3 + H 2 O -> H 2 SO 4
B 2 O 3 + H 2 O -> 2H 3 БО 3Основной оксид:
Металлы реагируют с кислородом с образованием основных соединений кислорода.Эти соединения обычно имеют ионную природу. Группы 1, 2 и лантаноиды образуют основные соединения кислорода, когда они реагируют с кислородом. Во время образования этих соединений выделяется большое количество энергии. Эти соединения легко вступают в реакцию с водой, за некоторыми исключениями.
Примеры: M 2 O 3 , MO 2 , ThO 2
Na 2 O + H 2 O -> 2NaOHАмфотерный оксид:
Амфотерный оксид — это соединения кислорода, которые обладают как кислотными, так и основными характеристиками.Эти оксиды при взаимодействии с кислотой претерпевают реакцию нейтрализации с образованием воды и соли.

 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH; Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов: 


 Чем выше окисление
число более кислый соответствующий оксид.{-}}) $.
Чем выше окисление
число более кислый соответствующий оксид.{-}}) $.

 «-» #
«-» #