Общая характеристика оксидов — урок. Химия, 8–9 класс.
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления \(–2\).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
h3O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
CO2 — оксид углерода(\(IV\)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза. Оксид углерода(\(IV\)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
CO — оксид углерода(\(II\)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
Fe2O3 — оксид железа(\(III\)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
SiO2 — оксид кремния(\(IV\)).
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
Классификация оксидов
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: \(+1\) или \(+2\).Примеры основных оксидов:
оксид натрия Na2O, оксид меди(\(II\)) CuO.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO3, оксид азота(\(IV\)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+8\). Например, оксид хрома(\(VI\)) CrO3 и оксид марганца(\(VII\)) Mn2O7.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может проявлять валентность равную двум, трём, шести.
Амфотерными свойствами обладает именно оксид хрома(\(III\)) Cr2O3.
- Несолеобразующие оксиды.
Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях.
К ним относятся: оксид углерода(\(II\)) CO, оксид кремния(\(II\)) SiO ,оксид азота(\(I\)) N2O, оксид азота(\(II\)) NO.
Они не имеют кислотных гидроксидов, не вступают в реакции с образованием солей.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu2O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe2O3 — оксид железа(\(III\)), Cl2O7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т. д.
Оксиды. Химия. 8 класс. Викторина
УМК «Химия. 8 класс» О. С. Габриеляна.
Цели:
Обучающие:
- Дать понятие об оксидах и летучих водородных соединениях;
- Продолжить формирование умения записывать формулы оксидов по с. о. и, наоборот, определять с. о. по формуле;
- Закрепить на оксидах знание химической номенклатуры для бинарных соединений;
- Раскрыть связь между химическими знаниями и повседневной жизнью человека.
Развивающие:
- Развивать познавательную активность, умение наблюдать окружающий мир, задумываться над причинами его изменения;
- Совершенствовать навыки само – и взаимопроверки.
Воспитательные:
- Воспитывать культуру речи, поведения.
- Прививать интерес к химии.

Планируемые результаты (учащиеся должны):
- знать определение оксидов, способы их получения, иметь представление о процессе окисления;
- уметь составлять формулы оксидов, летучих водородных соединений, называть их;
- уметь выделять признаки, на основании которых производится классификация оксидов и водородных соединений;
- повторить и обобщить материал о составе веществ, относящихся к оксидам;
- закрепить знания обучающихся составлять формулы и давать названия веществам;
- выяснить практическое значение оксидов в природе и жизни человека.
Тип урока: обобщающее повторение.
Оборудование: таблица химических элементов Д.И. Менделеева; компьютер, мультимедийный проектор, интерактивная доска.
Ход занятия
Здравствуйте! Сегодня мы с вами окунемся в мир неорганических веществ под названием «оксиды», проведем небольшое обобщающее повторение по данной теме. А для этого я приглашаю вас принять активное участие в викторине.
Слайд №1
Викторина « Оксиды»
Каждый может продемонстрировать свои знания, за каждый правильный ответ вы получаете жетон. По окончании викторины будут подведены итоги и количество набранных жетонов определят ваши оценки. Итак, мы начинаем!
Слайд №2
Вопрос: Что называют оксидами?
Ответ: Оксиды – бинарные соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна – II.
Слайд №3
Вопрос: Какова классификация оксидов?
Ответ: Оксиды делятся на три группы: основные, кислотные и амфотерные.
Слайд №4
Вопрос: Чтобы назвать оксид необходимо…
Ответ:
- произнести слово «оксид»,
- дать русское название элементу, который образовал оксид,
- если оксид образован неметаллом или элементом побочной подгруппы, то в скобках римской цифрой указать его валентность (она = степени окисления элемента.
 )
)
Пример: SiO2 – оксид кремния (IV)
Слайд №5
Вопрос: Как составить структурную формулу оксида?
Ответ:
- Составление формулы начинать с элемента, атомов которого больше в соединении;
- Атомы кислорода в оксидах между собой связей не образуют;
- Число химических связей, которые может образовать элемент равно его степени окисления по значению. Химическая связь обозначается «–»;
- Так как кислород в оксидах всегда имеет степень окисления «–2», то от его атома должно отходить две черточки «= »
Слайд №6
Вопрос: Составьте формулы названных в тексте оксидов.
В земной коре-литосфере находятся оксид алюминия (глина), оксид кремния (IV) (песок), оксид железа (III) (содержится в красном железняке)
Ответ:
Al2O3 – оксид алюминия (глина),
SiO2 – оксид кремния (IV) (песок),
Fe2O3 – оксид железа (III) (содержится в красном железняке).
Слайд №7
Вопрос: Составьте формулы названных в тексте оксидов.
Водная оболочка Земли – гидросфера – это оксид водорода (вода)
В воздухе есть оксид углерода (IV) (углекислый газ).
Ответ: Н2О – оксид водорода (вода), СО2 – оксид углерода (IV) (углекислый газ).
Слайд №8
Вопрос: Составьте формулы названных в тексте оксидов.
В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) (угарный газ), оксид серы (IV) (сернистый газ), оксид азота (I) и оксид азота (IV) .
Ответ:
CO – оксид углерода (II) (угарный газ)
SO2 – оксид серы (IV) (сернистый газ)
N2O – оксид азота (I)
NO2 – оксид азота (IV)
Слайд №9
Вопрос: Вычислите массу оксида кальция количеством 0,5 моль.
Слайд №10
Вопрос: Вычислить количество атомов натрия в 0,2 моль оксида натрия
Ответ: n(Na) = 2,408 атомов
Слайд №11
Вопрос: Из перечня веществ выберите оксиды
CuO, Cu(OH)2, HNO3, NO, OF2, H2O, NaOH
Ответ: CuO, NO, H2O
Слайд №12
Вопрос: Как называется оксид (газ), необходимый для фотосинтеза?
Ответ: СО2 – оксид углерода (II) (углекислый газ). Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
Слайд №13
Вопрос: Каждому кислотному оксиду соответствует определенная кислота?
СО2 →
SО2 →
SО3 →
N2О5 →
P2О5 →
Ответ:
СО2 → Н2СО3
SО2 → H2SО3
SО3 → Н2SО4
N2О5 → HNO3
P2О5 → H3PO4
Слайд №14
Вопрос: Каждому основному оксиду соответствует определённое основание?
Na2O →
CaO →
Al2O3 →
FeO →
Fe2O3 →
Ответ:
Na2O → NaOH
CaO → Ca(OH)2
Al2O3 → Al(OH)3
FeO → Fe(OH)2
Fe2O3 → Fe(OH)3
Слайд №15
Вопрос: Самый распространенный оксид на планете?
Ответ: Н2O – вода
Слайд №16
Вопрос: Каковы запасы воды в природе? Сколько из этого запаса приходится на долю пресной воды, в том числе доступной?
Ответ: Запасы воды на Земле составляют 1 млн 359 тыс. м3. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступны людям. Это – ледяной щит Северного Ледовитого океана, Гренландии, Антарктиды.
м3. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступны людям. Это – ледяной щит Северного Ледовитого океана, Гренландии, Антарктиды.
Слайд №17
Меня дает огонь в печи
И пламя маленькой свечи.
И стоит только сделать вдох,
Чтоб я на свет явиться мог.
Я в газированной воде,
Я в хлебе, дыме, я везде!
Вопрос: О каком оксиде идёт речь?
Ответ: CO2 – оксид углерода (IV), углекислый газ
Слайд №18
Вопрос: Какой оксид входит в состав горного хрусталя?
Ответ: SiO2 – оксид кремния (IV)
Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV).
Слайд №19
Вопрос: Это вещество белого цвета, идет для изготовления белой масляной краски (белил). О каком оксиде идет речь?
Ответ: ZnO – оксид цинка.
Слайд №20
Вопрос: Этот оксид используют как пигмент при изготовлении декоративного зеленого стекла и керамики. О каком оксиде идёт речь?
Ответ: Cr2O3 – оксид хрома (III).
Слайд №21
Молодцы!
Подведение итогов. Оценивание ответов обучающихся производится от количества набранных жетонов.
Домашнее задание
Подготовить презентацию по теме «Роль оксидов в жизни человека».
Источники информации:
Роль оксида азота в патологии
Огромный интерес исследователей к изучению патогенетической роли оксида азота первоначально был обусловлен новыми исключительно интересными публикациями, свидетельствующими о том, что расслабляющий сосуды фактор идентичен оксиду азота, а многочисленные лекарственные нитраты реализуют свой ангиотропный эффект благодаря освобождению из нитратов оксида азота [20, 45, 53, 57].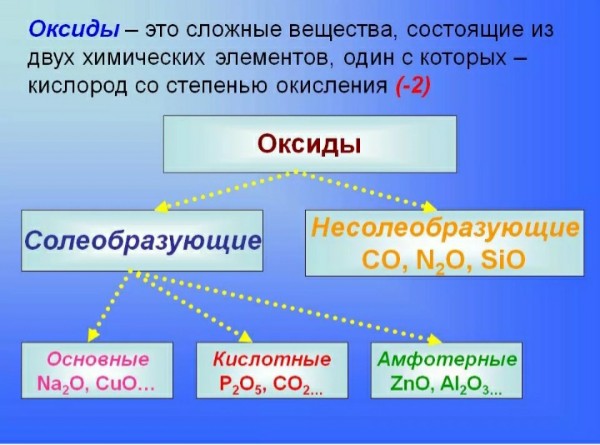 Большие трудности на пути открытия физиологической и патофизиологической роли оксида азота были связаны с тем, что молекула оксида азота имеет лишний электрон, что обусловливает высокую химическую реактивность и короткий полупериод жизни (от 6 до 30сек) [53, 57].
Большие трудности на пути открытия физиологической и патофизиологической роли оксида азота были связаны с тем, что молекула оксида азота имеет лишний электрон, что обусловливает высокую химическую реактивность и короткий полупериод жизни (от 6 до 30сек) [53, 57].
За короткий период, прошедший с момента открытия ангиотропной функции оксида азота, накоплен огромный экспериментальный и клинический материал, позволивший установить субстрат биосинтез оксида азота, ферменты и изоферменты, принимающие участие в биосинтезе оксида азота, тканевую специфичность изоферментов оксида азота, активаторы и ингибироты изоферментов оксида азота, молекулярный механизм физиологического и патофизиологического эффекта оксида азота, разработать и внедрить в практику препараты, активирующие и ингибирующие функцию различных изоферментов синтазы оксида азота, установить функциональную взаимосвязь ангиотензина II и оксида азота в регуляции сосудистого тонуса, а также сопряженность эффектов супероксидного радикала и оксида азота в реализации окислительного стресса [1].
Оксид азота является аутокринным и паракринным медиатором, так как, будучи синтезирован в каких-либо клетках, он способен влиять на метаболические процессы как в самих этих клетках, так и в расположенных по соседству [2]. Оксид азота, как мощный эндогенный вазодилататор, принимает участие в регуляции системного и легочного сосудистого сопротивления и процессах коагуляции крови [34]. Оксид азота функционирует в центральной и вегетативной нервной системе. По эфферентным нервам этот агент регулирует деятельность органов дыхательной систем, желудочно-кишечного тракта и мочеполовой системы [1]. Оксид азота подавляет пролиферацию гладкомышечных клеток сосудов [25, 39]. Совершенно закономерно, что снижение активности оксида азота вызывает вазоконстрикцию и тромбоз [17].
Оксид азота синтезируется из гуанидинового атома азота L-аргинина синтазой оксида азота, которая присоединяет молекулярный кислород к конечному атому азота в гуанидиновой группе L-аргинина [17]. Синтаза оксида азота также продуцирует неактивный конечный продукт L-цитруллин, который является маркером активности синтазы оксида азота [17, 57]. Синтаза оксида азота (СОА) включает в себя три изофермента — синтазы I, II, III типа [25, 39]. По физиологическим свойствам синтазы оксида азота подразделяются на конститутивные (кСОА), включающие нейрональную (I тип) и эндотелиальную (III тип), и индуцибельную (иСОА) [3, 8]. В сосудистом эндотелии, нервной ткани и тромбоцитах преобладает кСОА [8, 38].
Синтаза оксида азота также продуцирует неактивный конечный продукт L-цитруллин, который является маркером активности синтазы оксида азота [17, 57]. Синтаза оксида азота (СОА) включает в себя три изофермента — синтазы I, II, III типа [25, 39]. По физиологическим свойствам синтазы оксида азота подразделяются на конститутивные (кСОА), включающие нейрональную (I тип) и эндотелиальную (III тип), и индуцибельную (иСОА) [3, 8]. В сосудистом эндотелии, нервной ткани и тромбоцитах преобладает кСОА [8, 38].
Оксид азота необратимо инактивируется реакцией с гемоглобином (оксигенированной и деокигенированной формами) в просвете кровеносного сосуда, супероксидным радикалом в стенке кровеносного сосуда [27, 42] или кислородом в свободном растворе [63]. Реакция оксида азота с кислородом сопровождается образованием стабильных конечны продуктов — нитрита и нитрата, которые являются косвенными маркерами концентрации оксида азота в организме [56, 67].
Определение нитрита и нитрата, стабильных конечных продуктов оксида азота, в крови и других биологических жидкостях производят различными методами. При определении нитрита используется фотометрический метод [65] Тотальное определение содержания нитрита и нитрата в плазме крови также проводится фотометрическим методом, однако предварительно превращают нитраты в нитриты с помощью покрытой медью кадмиевой колонки [43] или редуктазы [14]. В последнее время для определения нитратов и нитритов в биологических жидкостях используются высокоэффективная хроматогафия [23] и капиллярный электрофорез [15].
Современное представление о механизме реализации биохимического действия оксида азота достаточно обосновано разработано для сосудистой системы. Так, в ответ на физическую и химическую стимуляцию в сосудистом эндотелии на короткий период повышается исходное образование оксида азота с помощью СОА I и III типов. Увеличение синтеза оксида азота синтазой оксида азота происходит под влиянием ацетилхолина, брадикинина, 5-гидрокситриптамина, адениловых нуклеотидов [28, 38, 59]. Участие синтазы оксида азота в сосудистой регуляции сопряжено с сосудорасширяющим эффектом этих нейротрансмиттеров, стимулирующих вход кальция в эндотелиальную клетку. Повышение уровня внутриклеточного кальция сопровождается активиацией, прежде всего, эндотелиальной формы синтазы оксида азота кальмодулин-зависимым механизмом, что ведет к кратковременному выделению небольших количеств оксида азота (пикомоли). Последний диффундирует в клетки прилежащих гладких мышц сосудов и связывается со специфическими рецепторными сайтами гема, который является составной частью молекулярной структуры растворимой цитоплазматической гуанилатциклазы [3]. Связывание оксида азота с группой гема растворимой гуанилатциклазы индуцирует конформационное изменение, которое смещает железо из плоскости порфиринового кольца, тем самым активирует растворимую гуанилатциклазу. При этом увеличивается концентрация циклического гуанозинмонофосфата (цГМФ) в клетке-мишени, что вызывает физиологическое действие [10]. Так, в гладкомышечных клетках цГМФ снижает уровень внутриклеточного кальция, что приводит к расслаблению клетки и вызывает вазодилятацию [24, 53].
Участие синтазы оксида азота в сосудистой регуляции сопряжено с сосудорасширяющим эффектом этих нейротрансмиттеров, стимулирующих вход кальция в эндотелиальную клетку. Повышение уровня внутриклеточного кальция сопровождается активиацией, прежде всего, эндотелиальной формы синтазы оксида азота кальмодулин-зависимым механизмом, что ведет к кратковременному выделению небольших количеств оксида азота (пикомоли). Последний диффундирует в клетки прилежащих гладких мышц сосудов и связывается со специфическими рецепторными сайтами гема, который является составной частью молекулярной структуры растворимой цитоплазматической гуанилатциклазы [3]. Связывание оксида азота с группой гема растворимой гуанилатциклазы индуцирует конформационное изменение, которое смещает железо из плоскости порфиринового кольца, тем самым активирует растворимую гуанилатциклазу. При этом увеличивается концентрация циклического гуанозинмонофосфата (цГМФ) в клетке-мишени, что вызывает физиологическое действие [10]. Так, в гладкомышечных клетках цГМФ снижает уровень внутриклеточного кальция, что приводит к расслаблению клетки и вызывает вазодилятацию [24, 53].
Растворимые гуанилатциклазы являются гетеродимерами двух различных субъединиц: А и В. К настоящему времени клонированы две А и две В субъединицы [52, 68, 69]. Другие гемсодержащие белки (аконитаза и цитохромы митохондриальной цепи электронного транспорта) также способны реагировать с оксидом азота, но физиологические последствия этого взаимодействия пока не установлены [57].
Сигнал оксида азота может имитироваться органическими нитратами (нитроглицерин), которые используются для лечения стенокардии, инфаркта миокарда и некоторых форм застойной сердечной недостаточности [9, 61]. Нитроглицерин входит в клетку, где он трансформируется тиолзависимой ферментной системой в оксид азота и близкородственные соединения [22]. Напротив, такие вазодилятаторы, как вновь разработанный STN-1, трансформируются в оксид азота неферментативными реакциями [9]. Это различие в механизме действия является принципиальным в развитии толерантности при лечении органическими нитратами. Продолжительное введение нитроглицерина индуцирует состояние толерантности. Механизм толерантности включает в себя инициирование антирегуляторных рефлексов и изменений метаболизма в ткани-мишени, так что нитроглицерин теряет свою терапевтическую эффективность [9]. Механизм толерантности не полностью понятен, но исследования in vitro показали, что нитроглицерин быстро истощает сульфгидрильные группы, необходимые для его биотрансформации в оксид азота [37, 62]. Введение N-ацетилцистеина обращает толерантность нитроглицерина [37].
Это различие в механизме действия является принципиальным в развитии толерантности при лечении органическими нитратами. Продолжительное введение нитроглицерина индуцирует состояние толерантности. Механизм толерантности включает в себя инициирование антирегуляторных рефлексов и изменений метаболизма в ткани-мишени, так что нитроглицерин теряет свою терапевтическую эффективность [9]. Механизм толерантности не полностью понятен, но исследования in vitro показали, что нитроглицерин быстро истощает сульфгидрильные группы, необходимые для его биотрансформации в оксид азота [37, 62]. Введение N-ацетилцистеина обращает толерантность нитроглицерина [37].
Кроме своей центральной роли вазодилататора, оксид азота выполняет функцию нейротрансмиттера и играет важную роль в долговременном потенцировании памяти нейронов, ингибирует адгезию форменных элементов крови к эндотелию [11,35]. Биосинтез оксида азота в центральной нервной системе и тромбоцитах реализуется конститутивной синтазой оксида азота (синтаза 1 типа). Агрегированные тромбоциты продуцируют оксид азота, который угнетает агрегацию тромбоцитов [41]. Эндотелиальный оксид азота подавляет действие вазоконстрикторов (тромбоксана А2 и серотонина), выделяемых из тромбоцитов [41] Это обусловлено действием оксида азота на сигналы адгезивных молекул так же, как его способностью ингибировать экспрессию адгезивных молекул и хемокинов эндотелия [55,64].
При эссенциальной и вторичной гипертонии, в первую очередь, страдает функция эндотелия резистивных артерий, снижается регулирующее влияние оксида азота на сосудистый тонус и адгезию тромбоцитов к сосудистому эндотелию. Внутривенная инфузия L-аргинина понижает кровяное давление у больных и с эссенциальной, и с вторичной гипертензией. При этом острая инфузия L-аргинина снижает общее сосудистое сопротивление и среднее артериальное давление, учащает сердечное сокращение, увеличивает сердечный выброс. Эти исследования также выявили увеличение цитруллина в плазме, нитрата и нитрита в моче, — маркеров увеличенной продукции оксида азота. Кровяное давление снижалось больше у гипертензивных, чем у нормотензивных пациентов после инфузии L-аргинина [30]. Интересные данные получены при изучении влияния предшественника оксида азота L-аргинина на системную и портальную гемодинамику у 20 больных с циррозом печении. Внутривенная инфузия L-аргинина вызывала системную вазодилатацию, более интенсивную у больных с циррозом печени, чем у здоровых лиц контрольной группы. Под влиянием L-аргинина повышался печеночный кровоток [62]
Кровяное давление снижалось больше у гипертензивных, чем у нормотензивных пациентов после инфузии L-аргинина [30]. Интересные данные получены при изучении влияния предшественника оксида азота L-аргинина на системную и портальную гемодинамику у 20 больных с циррозом печении. Внутривенная инфузия L-аргинина вызывала системную вазодилатацию, более интенсивную у больных с циррозом печени, чем у здоровых лиц контрольной группы. Под влиянием L-аргинина повышался печеночный кровоток [62]
Антигипертензивный эффект ингибиторов ангиотензинконвертирующего фермента тесно связан с функцией оксида азота [28]. Известно, что ангиотензинконвертирующий фермент является ключевым при образовании ангиотензина II [4]. Биосинтез ангиотензинконвертирующего фермента контролируется глюкокортикоидными рецепторами клеток сосудистого эндотелия [5]. Естественно, что уровень ангиотензина II также контролируется глюкокотикоид-рецепторным механизмом [7]. Обнаруженная тесная функциональная взаимосвязь ангиотензина II с расслабляющим сосуды фактором — оксидом азота может быть косвенным подтверждением возможной регуляции оксида азота глюкокортикоид-рецепторным механизмом. Об этом свидетельствуют данные о том, что глюкокортикоиды ингибируют транскрипцию индуцибельной синтазы оксида азота [5, 7]. Анализ индуцирующего механизма действия ангиотензина II на уровень оксида азота, проведенный с использованием блокатора рецепторов I типа ангиотензина II — лозартана, аналога L-аргинина — N(омега)-нитро-L-аргинин-метил-эфира, антагониста кaльмoдулинa-W-7, пoкaзaл, что ангиотензин II активирует эндотелиальную кальмодулин-зависимую синтазу оксида азота [49]. При гипертонии ингибиторы АСЕ препятствуют ухудшению связанной с оксидом азота вазодилятации. Ингибиторы ангиотен-зинконвертирующего фермента эналаприлат и рамиприлат дозозависимо повышают содержание оксида азота в венечных артериях и аорте [70].
В макрофагах, нейтрофилах, кардиомиоцитах, гепатоцитах обнаружена иСОА, которая является кальций независимой [20]. Ген иСОА человека локализован в 17 хромосоме [16[. При активации иСОА происходит продолжительное повышение уровня оксида азота [8, 20, 54]. При этом продукция оксида азота может в 1000 раз превышать количество оксида азота, продуцируемое кСОА [20, 39, 50]. Индуцирующими агентами для иСОА являются эндотоксин, у-интерферон, интерлейкин-1 и фактор некроза опухоли-а [19, 33, 40, 51]. Активированные гамма-интерфероном и липополисахаридом макрофаги продуцируют высокие концентрации оксида азота, которые не действуют через цАМФ, но проявляют прямое цитотоксическое и иммуногенное действие [58]. Под влиянием оксида азота происходит резкая вазодилатация, усиливается сосудистая проницаемость, формируется отек и последующее развитие воспалительной реакции [20, 29,44]. При этом оксид азота соединяется с супероксидом, образует пероксинитрит анион (ОNОО-), который индуцирует повреждение ДНК и мутацию [3, 18, 32]. Пероксинитрит анион участвует в реализации окислительного стресса [3, 18].
Ген иСОА человека локализован в 17 хромосоме [16[. При активации иСОА происходит продолжительное повышение уровня оксида азота [8, 20, 54]. При этом продукция оксида азота может в 1000 раз превышать количество оксида азота, продуцируемое кСОА [20, 39, 50]. Индуцирующими агентами для иСОА являются эндотоксин, у-интерферон, интерлейкин-1 и фактор некроза опухоли-а [19, 33, 40, 51]. Активированные гамма-интерфероном и липополисахаридом макрофаги продуцируют высокие концентрации оксида азота, которые не действуют через цАМФ, но проявляют прямое цитотоксическое и иммуногенное действие [58]. Под влиянием оксида азота происходит резкая вазодилатация, усиливается сосудистая проницаемость, формируется отек и последующее развитие воспалительной реакции [20, 29,44]. При этом оксид азота соединяется с супероксидом, образует пероксинитрит анион (ОNОО-), который индуцирует повреждение ДНК и мутацию [3, 18, 32]. Пероксинитрит анион участвует в реализации окислительного стресса [3, 18].
Патогенетический механизм окислительного стресса характеризуется снижением уровня АТФ, повышением содержания гипоксантина, превращеним ксантиндегидрогеназы в образующую прооксиданты ксантиоксидазу. В условиях гипоксии при восстановлении кровотока происходит приток молекулярного кислорода и кальция, что ускоряет взрыв кислородпроизводных свободных радикалов, возникающих в результате действия ксантиноксидазы и других оксидантных ферментов, в том числе и индуцибельной синтазы оксида азота. Эта оксидантаная среда генерирует перекиси липидов, которые увеличивают проницаемость для кальция и активируют фосфолипазу А2 [3]. В свою очередь, эти события запускают дальнейшую экспрессию индуцибельной синтазы оксида азота, адгезивных молекул и выделение фактора, активирующего тромбоциты, лейкотриенов, тромбоксана А2 и прочих индукторов воспаления. Нейтрофилы, курсирующие в этой неблагоприятной среде, активируются, прилипают к репефузированной ткани, генерируют супероксидные анионы и оксид азота, образуют пероксинитрит, сопряженно индуцируя некроз тканей [17, 32]. Следовательно, оксид азота является одним из ключевых звеньев в патофизиологии окислительного стресса [3].
Следовательно, оксид азота является одним из ключевых звеньев в патофизиологии окислительного стресса [3].
иСОА играет чрезвычайно важную роль в патогенезе многих экстремальных состояний, в том числе и септического шока [31, 47]. Интенсивная и продолжительная активация индуцибельной синтазы оксида азота при септическом шоке сопровождается мощным усилением биосинтеза оксида азота, который играет двойственную роль в патогенезе септического шока. Так, он оказывает защитный антибактериальный эффект, но в то же время проявляет неблагоприятное действие, включая устойчивую вазодилятацию, гипотензию и гипореактивность к сосудосуживающим агентам [21]. При септическом шоке установлено значительное повышение общей сывороточной концентрации нитрита и нитрата, которая положительно коррелировала с концентрацией эндотоксина в крови и отрицательно — с гемодинамическими нарушениями у этих больных [26]. У детей с септическим синдромом отмечено выраженное повышение общих сывороточных нитритов и нитратов (1 день — 118±93 мкмоль/л; 2 день — 112±94 мкмоль/л; 3 день — 112±91 мкмоль/л; контроль — 43±24 мкмоль/л). При выраженной гипотензии у детей с септическим синдромом выявлено более высокое содержание общего сывороточного нитрата и нитрита (145±97 мкмоль/л) по сравнению с данными, полученными у детей с септическим синдромом без гипотензии (82±76 мкмоль/л) [66]. При ожоговой болезни (общая площадь ожога 37±19%) уровень общего сывороточного нитрита и нитрата в течение 6 суток был выше, чем в контрольной. Однако максимальное повышение стабильных конечных продуктов оксида азота отмечено у обожженных с сепсисом (177±131 мкмоль/л) по сравнению с не инфицированными обожженными (83±48 мкмоль/л) [48]. Существенное повышение уровня конечного продукта оксида азота нитрита в крови отмечается у больных с тяжелой сочетанной травмой [6]. Воспалительная реакция тесно коррелирует с уровнем конечных продуктов оксида азота при кардиохирургических операциях [13], остром колите [36]. Повышение уровня оксида азота характерно при патологической беременности [65].
По-видимому, повышение уровня конечных продуктов оксида азота в крови больных с выраженной общей воспалительной реакцией играет важную роль в высвобождении интерлейкина-1 бета, интерлейкина-6, интерлейкина-8 и других индукторов воспалительной реакции [26]. Определение оксида азота хемилюминесцентным методом в крови больных ревматоидным артритом, характеризующимся выраженной воспалительной реакцией, свидетельствует о многократном повышении его уровня (293±108 нмоль/л) по сравнению с контролем (36±4 нмоль/л). Уровень оксида азота, интерлейкина-6, фактора некроза опухоли-а существенно был выше в активной фазе ревматоидного артрита, чем в фазе ремиссии [60]. Системная красная волчанка также характеризуется выраженными фазами воспаления. Изучение содержания нитрита в сыворотке крови 46 больных системной красной волчанкой свидетельствует о значительном повышении нитрита в сыворотке крови этих больных (37±6 мкмоль/л) по сравнению с нормой (15±7 мкмоль/л). В этих исследованиях абсолютные значения конечного продукта оксида азота у здоровых лиц значительно ниже, чем в исследованиях других авторов. Это связано с тем, что в данном исследовании авторы определяли в сыворотке крови только нитрит [12].
Больные с уремией нередко погибают от спонтанного желудочно-кишечного кровотечения во время операции или биопсии почки. Повышение уровня оксида азота может быть одной из причин спонтанного кровотечения при уремии, поскольку оксид азота ингибирует агрегацию и адгезию тромбоцитов, а ингибирование индуцибельной синтазы оксида азота при хронической почечной недостаточности полностью нормализует параметры свертывающей системы крови [57].
При лечении заболеваний, характеризующимися избытком оксида азота в крови, в комплексную терапию все чаще включаются препараты, ингибирующие активность индуцибельной синтазы оксида азота. Клиническое применение получили препараты аналоги L-аргинина, такие как N(омега)-нитро-L-аргинин-метил-эфир (L-NAME), N(дельта)-монометил-1-аргинин (L-NMMA) [34]. Глюкокортикоиды (преднизолон, дексаметазон) ингибируют транскрипцию индуцибельной синтазы оксида азота и снижают содержание конечных метаболитов оксида азота в крови, что, по-видимому, и определяет их высокую терапевтическую активность при состояниях, характеризующихся гиперпродукцией оксида азота [7, 46].
Глюкокортикоиды (преднизолон, дексаметазон) ингибируют транскрипцию индуцибельной синтазы оксида азота и снижают содержание конечных метаболитов оксида азота в крови, что, по-видимому, и определяет их высокую терапевтическую активность при состояниях, характеризующихся гиперпродукцией оксида азота [7, 46].
В настоящее время ведется активный поиск селективных ингибиторов индуцибельной синтазы оксида азота, регуляторов функции гуанилатциклазы и индукторов конститутивной синтазы оксида азота, соединений, способных пролонгировать эффект оксида азота и обеспечивающих транспорт оксида азота к различным органам и тканям [2, 3, 7].
Оксиды. Классификация оксидов. Названия оксидов
Оксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов. Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.

Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na2O, P2O3, BaO, V2O5, Fe2O3, GeO2, Rb2O. Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2O. Просто выучите эти четыре формулы!
Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
Оксид азота как диагностический маркер бронхиальной астмы
Оксид азота как диагностический маркер бронхиальной астмы
В патогенезе бронхиальной астмы (БА) важную роль играет оксидативный стресс (ОС). Показано, что гиперпродукция активных форм кислорода (АФК) вызывает бронхоконстрикцию, гиперсекрецию слизи, повреждение различных клеток и др. Однако, до настоящего времени не выявлены механизмы образования тех или иных АФК при БА, не ясно какие именно АФК реализуют обострение БА, не изучена взаимосвязь между образованием АФК и активными формами азота (АФА).
Среди диагностических тестов в настоящее время большое внимание уделяется необременительным для пациентов, неинвазивным методикам. Одним из таких тестов, является определение оксида азота (NO) в выдыхаемом воздухе на хемилюминесцентном газовом анализаторе в режиме on line. Доказано, что увеличение NO при БА является диагностическим маркером этого заболевания. Однако, в связи с высокой лабильностью измеряемого NO, обусловленной его реакционной способностью, данный метод не находит широкого практического применения. С другой стороны, известно, что в организме продуцируемый NO претерпевает целый каскад превращений, приводящий к образованию стабильных соединений, таких как нитраты, нитриты, S-нитрозотиолы, нитротирозины. Наибольшим процентом выхода из указанных продуктов обладают нитрат- и нитрит-анионы. Изменение концентрации этих стабильных метаболитов оксида азота в респираторном тракте может быть оценено в конденсате выдыхаемого воздуха (КВВ). КВВ представляет собой жидкость, образующуюся в результате охлаждения и последующей конденсации выдыхаемого воздуха. Т.е. КВВ представляет собой сумму аэрозольной фракции выдыхаемого воздуха, несущей в своем составе диспергационные частицы, сорванные с поверхности дыхательных путей, и конденсированного пара воды, и отражает процессы, протекающие в респираторном тракте, воспалительные изменения и эффект лечения. В составе КВВ на сегодняшний день выявлено более 100 соединений, которые в той или иной степени являются маркерами различных патологических процессов. Наиболее информативным для оценки воспалительных изменений в респираторном тракте признано определение маркеров оксидативного стресса в КВВ.
Доказано, что увеличение NO при БА является диагностическим маркером этого заболевания. Однако, в связи с высокой лабильностью измеряемого NO, обусловленной его реакционной способностью, данный метод не находит широкого практического применения. С другой стороны, известно, что в организме продуцируемый NO претерпевает целый каскад превращений, приводящий к образованию стабильных соединений, таких как нитраты, нитриты, S-нитрозотиолы, нитротирозины. Наибольшим процентом выхода из указанных продуктов обладают нитрат- и нитрит-анионы. Изменение концентрации этих стабильных метаболитов оксида азота в респираторном тракте может быть оценено в конденсате выдыхаемого воздуха (КВВ). КВВ представляет собой жидкость, образующуюся в результате охлаждения и последующей конденсации выдыхаемого воздуха. Т.е. КВВ представляет собой сумму аэрозольной фракции выдыхаемого воздуха, несущей в своем составе диспергационные частицы, сорванные с поверхности дыхательных путей, и конденсированного пара воды, и отражает процессы, протекающие в респираторном тракте, воспалительные изменения и эффект лечения. В составе КВВ на сегодняшний день выявлено более 100 соединений, которые в той или иной степени являются маркерами различных патологических процессов. Наиболее информативным для оценки воспалительных изменений в респираторном тракте признано определение маркеров оксидативного стресса в КВВ.
Таким образом, в проводимом совместно с ЛОЦ «Нормальное дыхание» и Университетской детской клинической больницей Первого МГМУ им.И.М.Сеченова клиническом исследовании необходимо определение стабильных метаболитов оксида азота, таких как нитрат — и нитрит-анионы, 3-нитротирозин КВВ. Нитрат- и нитрит-анионы являются наиболее стабильными из указанных метаболитов и представлены в КВВ в значимых концентрациях. Многочисленные исследования, проведенные нами, показали, уровень стабильных метаболитов NO (нитратов и нитритов) в КВВ является интегральным показателем синтеза оксида азота в респираторном тракте и соответственно степени воспаления. Обоснована информативность определения именно суммарной концентрации нитратов и нитритов в КВВ при ряде болезней органов дыхания.
Обоснована информативность определения именно суммарной концентрации нитратов и нитритов в КВВ при ряде болезней органов дыхания.
Функционирование различных систем организма обеспечивается внутренним гомеостазом, оказывающим влияние на скорости течения свободно-радикальных процессов (рН среды, электролитный баланс, баланс микроэлементов переменной валентности, глюкозы и т.д.). Таким образом, комплексная оценка этих показателей в КВВ позволит более адекватно оценивать изучаемые данные и избегать артефактов.
В связи с ключевым значением оксидантов в патогенезе бронхиальной астмы, исследование механизмов антиоксидантной защиты (АОЗ) легких являются первостепенными по важности. В настоящем исследовании проводится определение активности трех основных ферментов АОЗ – каталазы, СОД, глутатионпероксидазы в сыворотке крови.
Оборудование для измерения уровня окиси азота в выдыхаемом воздухе (NO)
Определение остаточного уровня оксида этилена
СтериПак Сервис предлагает для производителей медицинских изделий услуги лабораторного определения остаточного оксида этилена после стерилизации. Любое медицинское изделие, прошедшее стерилизацию оксидом этилена (ЭО) и контактирующее с пациентом, должно пройти тестирование для анализа остаточных уровней ЭО.
Остатки этиленоксида могут представлять опасность как для врача, так и для пациента. Для безопасности пациента важно, чтобы все изделия соответствовали ограничениям, установленным в стандарте ISO 10993-7.
Ограничения будут варьироваться в зависимости от предполагаемого использования изделия, так как существует три основных категории, к которым может относиться изделие: ограниченное использование, длительное использование и постоянное использование. Кроме того, существует несколько специальных категорий изделий, которые имеют собственный уникальный набор ограничений. Изделия, которые не имеют контакта с пациентом, не обязаны соответствовать этому стандарту.
Изделия, рассматриваемые как контактирующие с наружными покровами или имплантируемые, должны соответствовать дополнительному набору критериев, называемых допустимым пределом контакта. Целью этого ограничения является предотвращение локального раздражения из-за выделения этиленоксида или этиленхлоргидрина из изделия. Допустимый предел контакта — это расчетное значение, которое учитывает площадь поверхности изделия и остаточные уровни ОЭ, позволяющее определить, будет ли раздражение проблемой для пациента.
Тестирование для определениия остатков ОЭ проводится во время валидационных исследований стерилизации для определения:
- Требуемых характеристик естественной (атмосферной) или искусственной (тепловой) аэрации
- Переработки ОЭ (2X) и применения процесса аэрации для снижения риска
Какие основные причины высокого уровня остаточного оксида этилена?
Существует несколько причин, по которым изделие может содержать большое количество остатков ОЭ после процесса газовой стерилизации:
- Материал: некоторые материалы будут поглощать и удерживать молекулы газа лучше, чем другие. Природные материалы, такие как целлюлоза и хлопок, как известно, очень хорошо поглощают ОЭ. Известно также, что некоторые виды пластмасс демонстрируют высокие скорости абсорбции ОЭ при газовой стерилизации.
- Упаковка: для стерилизации этиленоксидом требуется воздухопроницаемая упаковка, такая как Tyvek или медицинская бумага, чтобы пропустить молекулу газа. Упаковка с минимальной или затрудненной воздухопроницаемой поверхностью (то есть с большой клейкой этикеткой) не позволит газу свободно перемещаться через воздухопроницаемый барьер.
- Конфигурация загрузки: объем, плотность и общая конфигурация груза в корзинах или на поддоне могут влиять на способность удаления газа после стерилизации.
Определение остаточного уровня этиленоксида используется для:
- Фармацевтические препараты
- Медицинские изделия
Принцип действия: | Перекрестная модуляция, хемилюминесценция. |
Применение: | Измерение концентрации NО, NO2, NOx в атмосферном воздухе |
Стандартные диапазоны: | 0…0,1/0,2/0,5/1 млн-1; 4 дополнительных диапазона, переключаемых в пределах 0-10 млн-1 при условии десятикратного отношения границ. Предусмотрено автоматическое и ручное определение диапазонов, а также дистанционное управле-ние. |
Предел обнаружения: | 0,5 ppb (3 σ) |
Воспроизводимость: | ±1% от полной шкалы прибора. |
Линейность: | ±1% от полной шкалы прибора. |
Дрейф нуля: | < порога чувствительности в день на нижнем диапазоне. |
Дрейф шкалы: | < порога чувствительности в день на нижнем диапазоне. |
Время отклика (Т90): | В пределах 90 с на нижнем диапазоне. |
Скорость потока образца газа: | 0,8 л/мин |
Показания: | Измеренное значение, диапазон, сигнализация. |
Cигнализация: | автокалибровки, ошибка калибровки и т.п. |
Входные/выходные сигналы: | 0-1 В/0-10 В/4-20 мА. Возможен вывод зна чений моментальных и интегральных, либо скользящего среднего. |
Интерфейс ввода/вывода: | RS-232C |
Температура эксплуатации: | 5…40°С |
Напряжение питания: | 220В, 50/60 Гц |
Габариты: | 430 (Ш) х 550 (Г) х 221 (В) мм |
Масса: | 21 кг |
Определение оксида по Merriam-Webster
вол · яд | \ Äk-ˌsīd \ : бинарное соединение кислорода с более электроположительным элементом или группой.
Оксид | химическое соединение | Британника
Оксид , любой из большого и важного класса химических соединений, в котором кислород сочетается с другим элементом. За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
Как металлы, так и неметаллы могут достигать своих высших степеней окисления (т. Е. Отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные металлы и щелочноземельные металлы, а также переходные металлы и постпереходные металлы (в их более низких степенях окисления) образуют ионные оксиды — т.е.е., соединения, содержащие анион O 2-. Металлы с высокой степенью окисления образуют оксиды, связи которых имеют более ковалентную природу. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионного к ковалентному наблюдается по мере перехода таблицы Менделеева от металлов слева к неметаллам справа. Такое же изменение наблюдается в реакции оксидов с водой и, как следствие, кислотно-щелочном характере продуктов.Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион OH —) и образующихся основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
| Источник: Источник: W.Робинсон, Дж. Одом и Х. Хольцкло-младший, Химия: концепции и модели, D.C. Heath and Co., 1992. | |||||||
| Реакция оксидов с водой и кислотно-основной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg (OH) 2 (слабое основание) | Al 2 O 3 нереагирующий | SiO 2 нереагирующий | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Cl 2 O 7 дает HClO 4 (сильная кислота) |
| соединение в оксидах | Na 2 O ионный | MgO ионный | Al 2 O 3 ионный | SiO 2 ковалентный | P 4 O 10 ковалентный | SO 3 ковалентный | Cl 2 O 7 ковалентный |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами. Таким образом, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические простые эфиры.
Таким образом, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические простые эфиры.
Оксиды металлов
Оксиды металлов — это твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных кислородных соединений: (1) оксиды, содержащие ионы оксидов, O 2-, (2) пероксиды, содержащие ионы пероксидов, O 2 2-, которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 —, которые также имеют ковалентные связи кислород-кислород, но с одним отрицательным зарядом меньше, чем ионы пероксида. Щелочные металлы (которые имеют степень окисления +1) образуют оксиды, M 2 O, пероксиды, M 2 O 2 , и супероксиды, MO 2 .(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2MNO 3 + 10M + тепло → 6M 2 O + N 2 Обычное получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 И оксиды щелочных металлов, и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M (OH) 2 (где M = металл группы 2)
Таким образом, эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; Например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важные основные оксиды являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорного кирпича и теплоизоляции, а также оксид кальция (СаО), также называемый негашеной или известь, широко используется в металлургической промышленности и в воде очищение.
В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; Например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важные основные оксиды являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорного кирпича и теплоизоляции, а также оксид кальция (СаО), также называемый негашеной или известь, широко используется в металлургической промышленности и в воде очищение.
Периодические тренды оксидов тщательно изучены. В любой данный период связь в оксидах прогрессирует от ионной до ковалентной, и их кислотно-основной характер меняется от сильно основного до слабоосновного, амфотерного, слабокислого и, наконец, сильнокислого. В общем, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO
неорганическая химия — Что означает «высший» или «низший» оксид?
неорганическая химия — Что означает «высший» или «низший» оксид? — Обмен химического стекаСеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange- 0
- +0
- Авторизоваться Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов, изучающих химию.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществуКто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено 111 раз
$ \ begingroup $Хотите улучшить этот вопрос? Добавьте подробности и проясните проблему, отредактировав этот пост.
Закрыт 1 год назад.
Проще говоря, во многих книгах используется термин «высший оксид» или «низший оксид».
Что это значит?
Создан 06 дек.
$ \ endgroup $ $ \ begingroup $Я думаю, это обычно означает, что средняя степень окисления металлического элемента в оксиде выше или ниже.Также можно сказать, что массовый процент кислорода в оксиде больше или меньше.
Создан 06 дек.
Макрофаг40822 серебряных знака99 бронзовых знаков
$ \ endgroup $ Chemistry Stack Exchange лучше всего работает с включенным JavaScriptВаша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie Настроить параметры
Глоссарий: оксиды азота (NO
оксиды азота (NO
x )Аналогичные термины : оксид азота (NO), диоксид азота (NO 2 ).
Определение:
NO x — общий термин для группы высокореактивных газов, все из которых содержат азот и кислород в различных количествах [например, азотная оксид ( NO ) и диоксид азота ( NO 2 )].
Многие оксиды азота не имеют цвета и запаха. Однако один общий загрязнитель, диоксид азота (NO2) вместе с частицами в воздухе часто может быть виден как красновато-коричневый слой над многими городскими районами.
Оксиды азота образуются при сжигании топлива […]. Основными источниками NOx являются: автотранспортные средства, электроэнергетика и другие промышленные, коммерческие и бытовые источники, сжигающие топливо.
В атмосфере оксиды азота могут способствовать образованию фотохимический озон (смог) и имеет последствия для здоровья. Они также приводят к кислоте дождь и способствуют глобальному потеплению.
Источник: Агентство по охране окружающей среды США NOx: Что это такое? Откуда это взялось?
Больше:
Оксид азота ( NO ) является наиболее распространенной формой азот напрямую выбрасывается в атмосферу.
В окружающем наружном воздухе оксид азота (NO), выделяемый автотранспортными средствами, соединяется с кислородом в атмосфере под действием солнечного света, производя диоксид азота ( NO 2 ) — основной воздух загрязняющие вещества и другие NO x .
Источник: GreenFacts
Связанные слова:
Кислотный дождь — Озон — Прекурсор (и)
Перевод (и):
Deutsch: Stickoxide (NOx)
Español: osxidos de nitrógeno (NOx)
Français: Oxy (NO x )
Связанные публикации:
Оксиды | Введение в химию
Цель обучения
- Обсудите химические свойства оксидов.
Ключевые моменты
- Оксиды металлов обычно содержат анион кислорода в степени окисления -2.
- Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
- Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха.
- Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Условия
- пассивация Самопроизвольное образование твердой нереактивной поверхностной пленки (обычно оксида или нитрида), которая препятствует дальнейшей коррозии.
- оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- кокс Твердый остаток от обжига угля в коксовой печи; используется в основном в качестве топлива и при производстве стали, а ранее в качестве бытового топлива.
Химические свойства оксидов
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле.Оксиды металлов обычно содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. При сжигании углеводородов образуются два основных оксида углерода: монооксид углерода (CO) и диоксид углерода (CO 2 ). Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Кислород демонстрирует высокую реакционную способность
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов. Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем. Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Комбинация воды и кислорода еще более агрессивна.Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы, например натрий, быстро и даже опасно реагируют с образованием гидроксидных продуктов. Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Пассивация
Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Как упоминалось выше, хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию. Слой оксида алюминия может быть увеличен до большей толщины с помощью процесса электролитического анодирования. Хотя твердые магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры.
Полимерные и мономерные молекулярные структуры
Оксиды большинства металлов имеют полимерную структуру с поперечными связями M-O-M. Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований. Формулы часто обманчиво просты. Многие из них нестехиометрические. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Диоксид кремния Диоксид кремния (SiO 2 ) — один из наиболее распространенных оксидов на поверхности Земли.Как и большинство оксидов, он имеет полимерную структуру.Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами. Самые известные молекулярные оксиды — это углекислый газ и окись углерода. Пятиокись фосфора — более сложный молекулярный оксид с обманчивым названием, формула которого P 4 O 10 . Некоторые полимерные оксиды (диоксид селена и триоксид серы) деполимеризуются с образованием молекул при нагревании. Тетроксиды редки, и известно только пять примеров: четырехокись рутения, четырехокись осмия, четырехокись гассия, четырехокись иридия и четырехокись ксенона.Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, например, нитрозоний (NO + ). Конечно, известно много соединений как с оксидами, так и с другими группами. Для переходных металлов известно много оксокомплексов, а также оксигалогенидов.
Кислотно-основные реакции
Оксиды подвержены действию кислот и оснований. Те, на кого воздействуют только кислоты, являются основными оксидами; те, на которые воздействуют только основания, являются кислыми оксидами. Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными.Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Другие окислительно-восстановительные реакции
Металлы «извлекаются» из оксидов путем химического восстановления. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды.
Оксиды, такие как оксид железа (III) (или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 · nH 2 O и оксид-гидроксид железа (III) FeO (OH), Fe (OH) 3 ), образуются при соединении кислорода с железом.
Оксиды металлов можно восстанавливать органическими соединениями. Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств ферментами P450 и производство этиленоксида, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Определение оксида в химии.
Примеры оксидов в следующих темах:
Число окисления металлов в координационных соединениях
- Переходные металлы обычно образуют несколько степеней окисления и, следовательно, имеют несколько порядков окисления .
- Это число окисления является индикатором степени окисления (потеря электронов) атома в химическом соединении.
- O2- и S2- имеют степень окисления , , -2.
- В молекуле или соединении число окисления является суммой чисел окисления составляющих его атомов.
- Число окисления H равно +1 (H + имеет число окисления +1).
Оксиды
- Оксиды металла обычно содержат анион кислорода в степени окисления -2.
- Большая часть земной коры состоит из твердых оксидов, , в результате окисления элементов кислородом воздуха или воды.
- Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами.
- Только кислотами подвержены основные оксиды ; атакованные только основаниями кислотные оксиды .
- Металлы имеют тенденцию образовывать основные оксиды , неметаллы имеют тенденцию образовывать кислые оксиды , а амфотерные оксиды образуются элементами вблизи границы между металлами и неметаллами (металлоидами).
Окисление и восстановление
- Параллельный и независимый метод характеристики органических реакций — это окисление, — терминология восстановления.
- Атомы углерода могут иметь любую степень окисления от –4 (например,
- К счастью, нам не нужно определять абсолютное состояние окисления каждого атома углерода в молекуле, а только изменение состояния окисления тех атомов углерода, которые участвуют в химическом превращении.
- Атомы углерода, окрашенные в синий цвет, восстановлены, а окрашенные в красный цвет — это окисленные .
- Эпоксидирование надкислотой и добавление брома окисляют обоих атомов углерода, поэтому они называются реакциями окисления .
Окисление
- Атом углерода карбонильной группы имеет относительно высокую степень окисления .
- Полезные тесты на альдегиды, тест Толленса, тест Бенедикта и тест Фелинга используют преимущества этой легкости окисления за счет использования Ag (+) и Cu (2+) в качестве окислителей ( окислителей ).
- В тестах Фелинга и Бенедикта в качестве окислителя используется катион меди. .
- Этот темно-синий реагент восстанавливается до оксида меди , который выпадает в осадок в виде твердого вещества от красного до желтого цвета.
- Все эти окисления катионов должны проводиться в щелочных условиях.
Окислительные состояния
- Повышение атома в состоянии окисления в результате химической реакции называется окислением , и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением, и оно включает в себя усиление электронов.
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Например, Cl- имеет степень окисления , -1.
- Когда он присутствует в большинстве соединений, водород имеет степень окисления , +1, а кислород степень окисления -2.
- Это помогает определить степень окисления любого одного элемента в данной молекуле или ионе, предполагая, что мы знаем общие состояния окисления для всех других элементов.
Марганец
- Наиболее распространенные степени окисления металлического марганца: +2, +3, +4, +6 и +7; степень окисления +2 является наиболее стабильной.
- Соединения марганца, в которых марганец находится в степени окисления 7+, являются мощными окислителями .
- Соединения с степенью окисления состояниями 5+ (синий) и 6+ (зеленый) являются сильными окислителями .
- Степень окисления 3+ наблюдается в таких соединениях, как ацетат марганца (III); это очень мощные окислители .
- Предскажите окислительно- или восстановительную способность разновидностей марганца с учетом его формулы или степени окисления .
Окисление фенолов
- Фенолы довольно легко окисляются , несмотря на отсутствие атома водорода на атоме углерода, несущем гидроксил.
- Окислительно-восстановительное равновесие между дигидроксибензолами гидрохиноном и катехолом и их состояниями окисления хинона настолько легкое, что обычно предпочтительны более мягкие окислители , чем хромат (реагент Джонса).
- Одним из таких окислителей является соль Фреми, показанная ниже.
- Хотя хромовая кислота окисление фенолов, имеющих незамещенное пара-положение, дает некоторое количество п-хинонового продукта, реакция является сложной и не является синтетической.
- Растворителем для этих окислений обычно является метанол или диметилформамид (ДМФ).
Нитрификация
- Nitrobacter играет важную роль в круговороте азота, окисляя нитрит в нитрат в почве.
- Нитрификация является чистым результатом двух различных процессов: окисление аммония до нитрита (NO2-) нитрозификацией или аммиаком- окисление бактерий и окисление нитрита (NO2-) до нитрата (NO3-) нитритом — окисляющих бактерий.
- Нитрификация — это процесс окисления соединения азота (фактически потеря электронов от атома азота к атомам кислорода):
- Биохимически окисление аммония происходит путем ступенчатого окисления аммония до гидроксиламина (Nh3OH) ферментом аммониймонооксигеназой в цитоплазме с последующим окислением гидроксиламина до нитрита ферментом гидроксиламиноксидоредуктазой в периплазме.
- Кислород необходим для окисления аммония и нитрита , что означает, что как нитрозирующие, так и нитрит- окисляющие бактерии являются аэробами.
Хром
- Хром демонстрирует широкий диапазон возможных состояний окисления , , где состояние +3 является наиболее стабильным с энергетической точки зрения.
- Он обезвоживается путем нагревания с образованием зеленого оксида хрома (III) (Cr2O3), который представляет собой стабильный оксид с кристаллической структурой, идентичной структуре корунда.
- Соединения хрома (VI) являются сильными окислителями при низком или нейтральном pH.
- И хроматные, и дихроматные анионы являются сильными окисляющими реагентами при низком pH.
- Степень окисления +5 реализуется только в нескольких соединениях, но является промежуточным звеном во многих реакциях, включающих окисление хроматом.
Окисление восстановленных соединений серы
- Окисление серы включает окисление восстановленных соединений серы, неорганической серы и тиосульфата с образованием серной кислоты.
- Окисление серы включает окисление восстановленных соединений серы, таких как сульфид (h3S), неорганическая сера (S0) и тиосульфат (S2O2−3), с образованием серной кислоты (h3SO4).
- Примером бактерии , окисляющей серу-, является Paracoccus.
- Помимо аэробного окисления серы , некоторые организмы (например,
- Морские автотрофные виды Beggiatoa способны окислять внутриклеточную серу до сульфата.
Стерилизация оксидом этилена — определение (v1)
{{PublicationType | capitalize}} рейтинг
ОпределениеQeios ID: {{публикации.qeios_id}}
Открытый доступ CC BYАвторские права: © {{PublicationYear}} {{publishing.presentation_authors [0] .full_name + (publishing.presentation_authors.length> 1? ‘Et al’: »)}}. Это публикация в открытом доступе, распространяемая на условиях CC BY 4.0 Лицензия, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Lic. ИнформацияПроверьте {{PublicationType | capitalize}} Источник информации об авторских правах и лицензии.
ДекларацииСвязанные определения ({{публикации.ranked_siblings.length}})
Спасибо за ваш вклад в сообщество.
Закрывать .
 )
)