Валентность и степень окисления, формулы и примеры
Валентность
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Рассмотрим на примере элементов Iи II групп. Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be 1s22s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.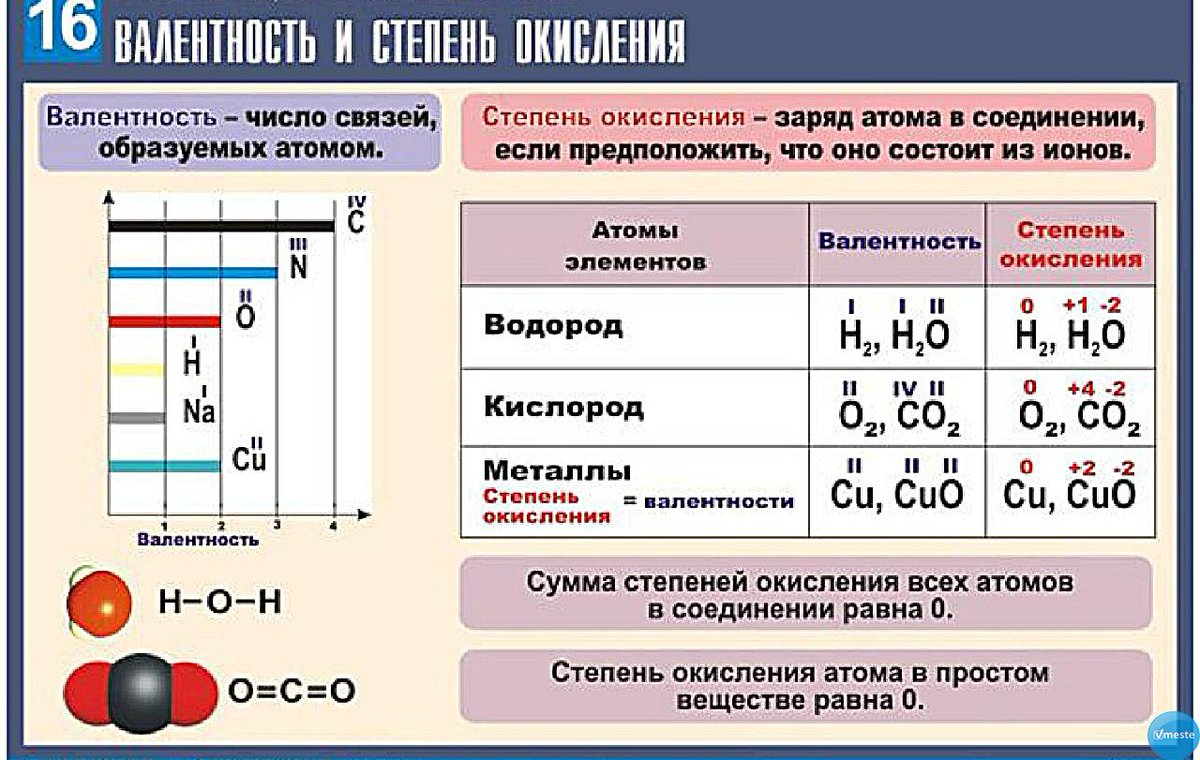
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей.
Понятие степени окисления для большинства соединений имеет условных характер, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральныхмолекуах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода – (-2). Соответственно степень окисления азота равна:
KNO2 1+ x + 2 × (-2) = 0, x=+3.
HNO3 1+x+ x + 3 × (-2) = 0, x=+5.
Примеры решения задач
Валентность. Степень окисления. Составление формул по валентностям и степеням окисления. Химия, 8–9 класс: уроки, тесты, задания.
| 1. |
Постоянная валентность
Сложность: лёгкое |
1 |
| 2. | Сложность: лёгкое |
1 |
3.
|
Степени окисления элементов
Сложность: лёгкое |
1 |
| 4. |
Валентность элемента в водородном соединении
Сложность: среднее |
2 |
5.
|
Валентность элемента в соединении с кислородом
Сложность: среднее |
2 |
| 6. | Формула кислородного соединения Сложность: среднее | 2 |
7.
|
Составь формулу по степеням окисления элементов
Сложность: среднее |
2 |
| 8. |
Составь формулу и вычисли относительную молекулярную массу
Сложность: сложное |
3 |
9.
|
Исправь формулу
Сложность: сложное |
3 |
| 10. |
Расположи формулы по возрастанию валентности
Сложность: сложное |
4 |
Еще немного о валентности.
 Информация для вдумчивых
Информация для вдумчивых ← Начало статьи
В первой статье о валентности мы рассмотрели классическое определение этого понятия, привели несколько простых примеров. К сожалению, «формальное правило» определения валентности не всегда «работает».
Пример 6. Установите валентности элементов в молекуле Н2О2 (это вещество — известная всем перекись водорода).
Решение. «Ну, что же, ничего сложного! — скажете вы. — Валентность водорода известна (I), составим уравнение: 2 • 1 = 2 • Х. Вывод: валентность кислорода также = I. Правильно?»
Нет, друзья, неверно! Взгляните на перечень элементов с постоянной валентностью. Разве для кислорода она равна I?
«Хорошо, попробуем иначе, — скажете вы. — Валентность кислорода = II, валентность водорода = Х,
2 • 2 = 2 • х, следовательно, валентность водорода также равна II. На этот раз верно?»
Нет, снова промах! В той же таблице видим, что валентность Н всегда равна I. Кроме того, водород находится в I группе, значит, его валентность не может быть больше одного.
Кроме того, водород находится в I группе, значит, его валентность не может быть больше одного.
«Как же это возможно? — возмутитесь вы. — У кислорода всегда II, у водорода — I. Но ведь 2 • 2 не равно 2 • 1! Похоже, что наше правило не работает!»
Да, верно, формальное правило в данном случае оказывается бессильным. Но нет никаких причин для беспокойства! Молекула пероксида водорода имеет следующую структуру: H-O-O-Н. Мы видим, что валентность кислорода действительно равна двум (т. к. атом О образует две связи), а водорода — единице (по одной связи на каждый атом Н).
Для большинства органических соединений применение «формального правила» вообще приводит к абсурдным цифрам.
Пример 7. Установите валентности элементов в молекуле С3Н7 (пропан).
Решение. Валентность водорода нам известна, следовательно, для углерода получаем значение … 7/3. Абсурд!
В действительности, все не так уж плохо. Структурная формула пропана имеет вид СH3-CH2-CH3. Каждый атом углерода соединен с четырьмя соседями. Валентность углерода в пропане равна IV. Кстати, в подавляющем большинстве органических соединений углерод имеет такую же валентность.
Каждый атом углерода соединен с четырьмя соседями. Валентность углерода в пропане равна IV. Кстати, в подавляющем большинстве органических соединений углерод имеет такую же валентность.
«Формальное правило» неэффективно в данном случае, поскольку часть валентных возможностей углерода тратится не на водород, а на связь с соседними атомами С.
Приведенные примеры показывает, что даже в бинарном соединении определить валентность не всегда легко. Но если бы дело было только в этом! Существует масса примеров, когда понятие валентности вообще теряет смысл.
Пример 8. Чему равна валентность кальция в простом веществе?
Аналогичный вопрос можно было бы задать по поводу магния, железа, урана или любого другого металла. Люди, знакомые со строением металлов и с понятием «металлическая связь», понимают, что вопрос о валентности задавать в данном случае вообще бессмысленно! Можно говорить о координационном числе, но это уже совершенно другое понятие.
Пример 9.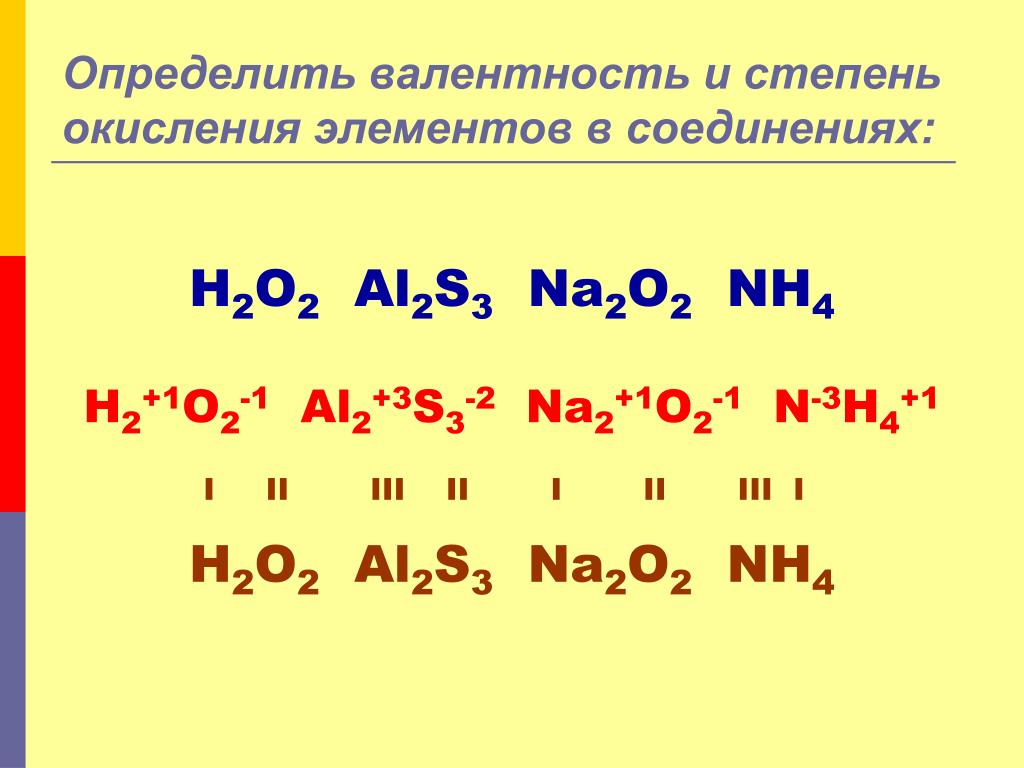 Определите валентность железа в комплексном соединении K3[Fe(CN)6].
Определите валентность железа в комплексном соединении K3[Fe(CN)6].
Степень окисления железа в данном веществе равна +3, а вот валентность …
С этим вновь проблемы. Опять корректнее говорить не о валентности, а о координационном числе атома Fe. Координационное число = 6.
Пример 10. Чему равна валентность железа в FeO?
Ну, с формальной точки зрения все очень просто: валентность железа, разумеется, равна II. Мы так и называем это вещество: оксид железа (II).
Не будем, однако, спешить с выводами. Во-первых, оксид железа — вещество немолекулярного строения. Если мы рассматриваем, например, оксид SO2, можно выделить отдельные молекулы, в каждой из которых атомы кислорода соединены двумя ковалентными связями с атомом серы. В случае с FeO подобные рассуждения ошибочны. В кристаллической решетке нет «молекул» FeO.
Но и это еще не все. Состав оксида железа (II) вообще неправильно описывать формулой FeO. Правильнее записывать: FeхO, где х находится в диапазоне 0,9-0,95. Да-да, это соединение т. н. переменного состава. Вопреки канонам «классической» химии, его состав зависит от метода и условий получения. Вот и думайте тут о валентности! Считать ее переменной или считать, что различные атомы железа в кристалле имеют разную валентность?
Правильнее записывать: FeхO, где х находится в диапазоне 0,9-0,95. Да-да, это соединение т. н. переменного состава. Вопреки канонам «классической» химии, его состав зависит от метода и условий получения. Вот и думайте тут о валентности! Считать ее переменной или считать, что различные атомы железа в кристалле имеют разную валентность?
В любом случае, о двухвалентном железе в данной ситуации можно забыть!
Прежде чем переходить к следующей части статьи, рекомендую вам задуматься над следующими вопросами:
- Чему равна валентность азота в ионе аммония (NH4+)? Если вы считаете, что валентность выше трех, как это согласуется с тем фактом, что в атоме азота имеется три неспаренных электрона?
- Некоторые утверждают, что валентность азота в HNO3 равна V. Возможно ли такое?
- В молекуле СО углерод и кислород связаны тремя ковалентными связями, однако в основном состоянии в атоме углерода два неспаренных электрона, а в первом возбужденном состоянии — четыре.
 Как можно объяснить данное противоречие?
Как можно объяснить данное противоречие?
- А как вообще можно утверждать, что валентность углерода в СО равна III? Как это доказать экспериментальным путем?
В следующей части мы ответим на эти вопросы и рассмотрим еще несколько интересных соединений.
Продолжение статьи →Соединения химических элементов. Валентность и степень окисления элементов
1. Соединения химических элементов
Валентность и степеньокисления элементов
2. Валентность элементов
Валентность – это способность атомаобразовывать химические связи.
Валентность для элементов бывает
постоянная и переменная.
Элементы с постоянной валентностью:
I – H, Li, Na, K, Rb, Cs, Ag
II – O, Be, Mg, Ca, Sr, Ba, Zn
III – B, Al
3. Определите валентности элементов в следующих соединениях:
P2O5FeO
AlCl3
CaO
h3S
SO3
FeS
N2O3
Nh4
NaH
P2S3
CuO
K 2O
SeO3
FeF3
AlP
SnO2
HCl
Sih5
Mg3N2
4.
 Степень окисления элементов Степень окисления – условный заряд атома
Степень окисления элементов Степень окисления – условный заряд атомаэлемента, вычисленный из предположения, что
вещество состоит из ионов.
Для вычисления степени окисления элемента
следует учитывать следующие положения:
1. Степени
окисления атомов в простых
веществах равны нулю. Простыми называются
вещества, состоящие из одного элемента.
2. Алгебраическая сумма степеней окисления
всех атомов, входящих в состав молекулы
сложного вещества, всегда равна нулю.
Сложными называются вещества, состоящие
из нескольких элементов.
5. Степень окисления элементов
Постоянную степень окисления имеют атомы:водорода
(+1)
(исключение
гидриды
щелочных и щелочноземельных металлов –
NaH-1), кислорода (-2) (исключения: Н2О2-1
(пероксид водорода и его соли), О+2F2
(фторид кислорода).
4. Степень
окисления
металлов
всегда
положительна и численно равна валентности.
Металлы с постоянной валентностью и СО:
+1 – Li, Na, K, Rb, Cs, Ag
+2 – Be, Mg, Ca, Sr, Ba, Zn
+3 – Al
3.
6. Степень окисления элементов
Дляэлементов
главных
подгрупп
положительная степень окисления не может
превышать величину, равную номеру группы
периодической системы, а отрицательная
степень окисления вычисляется по формуле:
номер группы – 8.
6. Степень окисления элемента в кислотном
оксиде,
соответствующей
кислоте
и
образующейся соли одинакова.
5.
7. Степень окисления элементов
Определите СО каждого элемента в следующих соединениях:1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
P2O5
Cu
Fe
Cu(OH)2
Al(ClO4)3
K2CO3
Ca(OH)2
SO3
H 2S
h4PO3
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
h3Cr2O7
O2
Na2SO3
Sn(OH)2
N2
HClO4
Nh5OH
Sih5
HNO3
Zn(NO3)2
Дополнительное задание:
Определите СО каждого элемента в следующих соединениях:
1.

2.
3.
4.
5.
6.
7.
8.
9.
10.
Al(NO3)3
h3
Mg3N2
Nh4
Cu
K2Cr2O7
Cr(OH)3
Nh5OH
HClO4
Fe2O3
O3
12. NO2
13. h4AsO4
14. Ca(OH)2
15. CaSO4
16. N2
17. RbNO2
18. KMnO4
19. SO3
20. h3S
11.
9. Определите валентности элементов в следующих соединениях:
Определитесоединениях:
валентности
элементов
в
следующих
Вариант 1
P2O5
FeCl3
Li3N
CaS
Sih5
Nh4
SiO2
MgS
K3P
CdCl2
Вариант 2
Ch5
NaCl
Al4C3
AlCl3
CoS
BaBr2
Cr2S3 Cl2O7
Ph4
SO3
10. Определите степени окисления элементов в следующих соединениях:
ВАРИАНТ 1ВАРИАНТ 2
Na3PO4
Cr(OH)3
h4PO4
HClO4
Ph4
Fe
SiO2
P
Zn(OH)2
Al2(SO4)3
h3Cr2O7
HNO2
N2
Fe2O3
O3
Ch5
Fe(OH)2
Mg(OH)2
Ca(NO3)2 Zn3(PO4)2
Онлайн урок: Валентность.
 Степень окисления. Количество вещества по предмету Химия 8 класс
Степень окисления. Количество вещества по предмету Химия 8 классВалентность показывает, сколько электронов «отдал» или «приобрел» атом, но не показывает, отдал атом эти электроны или приобрёл.
Разные элементы обладают разной степенью активности, и в зависимости от этого при реакциях электроны, хотя и являются общими для двух атомов, являются как бы «сдвинутыми» в сторону какого-то одного из них.
Ядро атома заряжено положительно, электроны — отрицательно. В целом атом нейтрален, поэтому такое смещение нарушает эту нейтральность.
Степень окисления – это условный заряд атома в составе молекулы, если предположить, что принятый электрон полностью принадлежит атому, а отданный полностью не принадлежит.
Рассмотрим степени окисления атомов азотной кислоты HNO3
Известно, что в химических формулах количество атомов в 1 единицу не пишут, но для наглядности мы это сделаем. Получилось H1N1O3
Получилось H1N1O3
Азотная кислота в природе существует в виде устойчивого соединения, это значит, что сумма всех степеней окисления составляющих ее атомов равна нулю.
Азотная кислота состоит из 1 атома водорода, 1 атома азота и 3-х атомов кислорода.
Водород имеет степень окисления +1
Кислород имеет степень окисления -2
Посмотрим на алгоритм определения степени окисления:
Вам придется часто определять степени окисления веществ в составе молекул.
Это просто. Главное надо знать степени окисления атомов, там, где вариантов немного или всего один.
Зная, что сумма всех произведений степеней окисления в одной молекуле равна нулю, мы сможем очень легко определить неизвестную степень окисления.
Рассмотрим алгоритм определения степени окисления азота в молекуле азотистой кислоты.
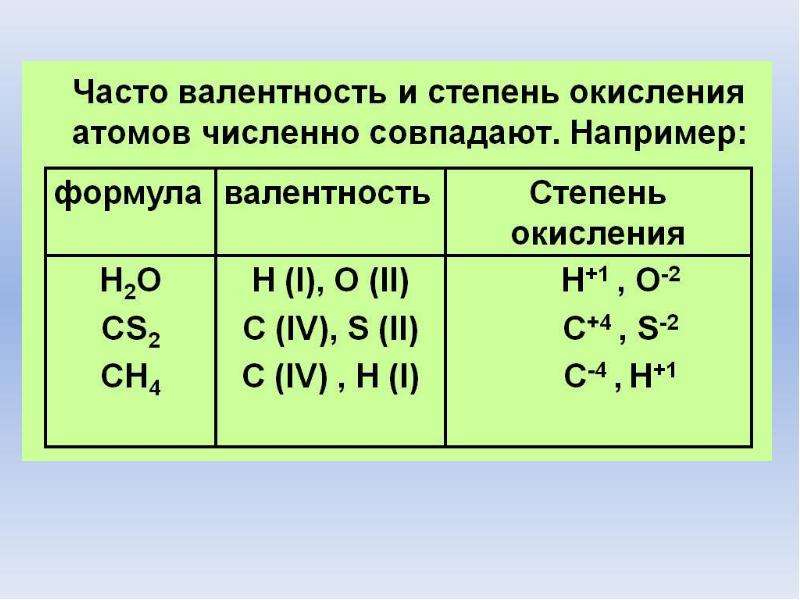
Часто степень окисления и валентность совпадают. Но это происходит не всегда. Наиболее ярко это различие проявляется в простых веществах, образованных некоторыми газами, но также проявляется и в других соединениях.
Химический элемент | Вещество | Валентность | Степень окисления |
Водород | H2 (водород) | 1 | 0 |
Кислород | O2 (кислород) | 1 | 0 |
Кислород | H2O2 (перекись водорода) | 2 | –1 |
Азот | N2 (азот) | 3 | 0 |
Азот | HNO3 (азотная кислота) | 4 | +5 |
Главное отличие степени окисления от валентности: валентность не имеет знака, а степень окисления имеет знак.
Положительное число говорит об отдаче электрона (т.к. заряд электрона отрицательный), отрицательное – наоборот.
Высшая положительная степень окисления элемента равна номеру группы периодической системы.
Химический элемент | Номер группы в периодической системе | Высшая положительная степень окисления |
Натрий | I | +1 |
Магний | II | +2 |
Алюминий | III | +3 |
Кремний | IV | +4 |
Фосфор | V | +5 |
Сера | VI | +6 |
Хлор | VII | +7 |
Большинство элементов имеют переменную степень окисления.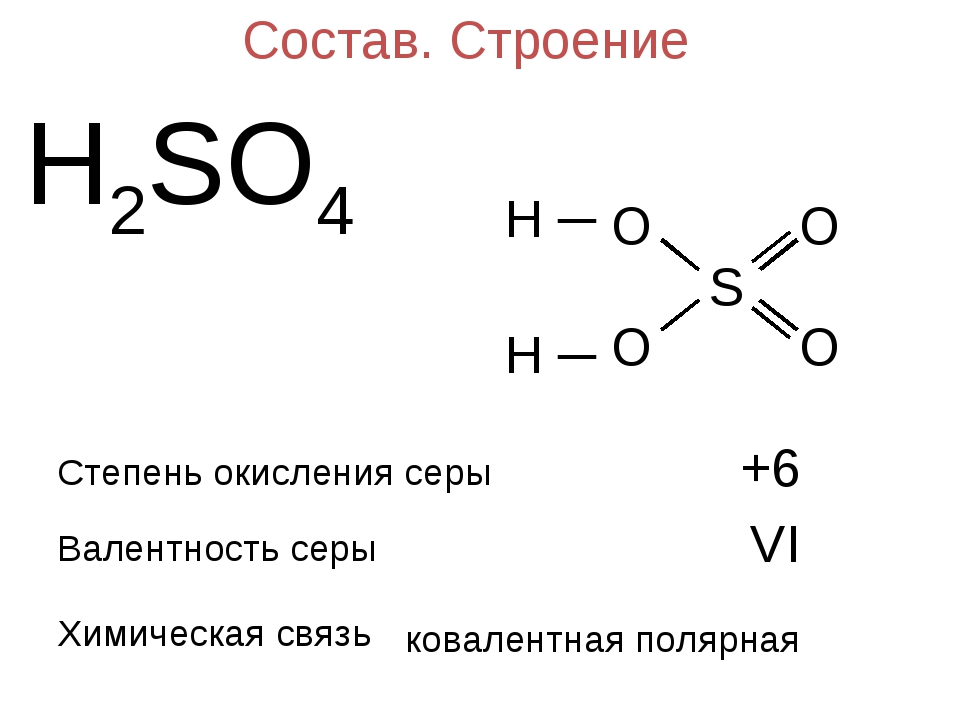
Например, марганец имеет степень окисления в разных его соединениях +2, +3, +4, +6, +7
В природе элементы встречаются в таких соединениях, где проявляют самую устойчивую степень окисления.
Химический элемент | Наиболее распространенное в природе вещество и степень окисления элемента в нём | Другие вещества и степени окисления элемента в них |
Кислород | Кварц (оксид кремния) SiO2 –2 | Фторид кислорода OF2 +2 |
Сера | Пирит (сульфид железа) FeS2 –2 | Сернистый газ SO2 +4
Серная кислота H2SO4 +6 |
Хлор | Cоль (хлорид натрия) NaCl –1 | Хлорная кислота HClO4 +7 |
Золото | Золото самородное Au 0 | Золотохлористоводородная кислота HAuCl4 +3 |
Разница между валентностью и степенью окисления
Основное отличие — валентность и степень окисления
Все соединения состоят из атомов разных элементов. Эти атомы комбинируются в различных соотношениях в зависимости от количества свободных орбиталей, которые они имеют, или количества электронов, которые может высвобождать конкретный атом. Валентность и степень окисления — два термина, используемые для объяснения причин этих различных комбинаций атомов. Основное различие между валентностью и степенью окисления заключается в том, что валентность — это количество электронов, присутствующих в самой внешней оболочке атома определенного элемента, тогда как степень окисления — это количество электронов, которые элемент в конкретном соединении потерял или приобрел.
Эти атомы комбинируются в различных соотношениях в зависимости от количества свободных орбиталей, которые они имеют, или количества электронов, которые может высвобождать конкретный атом. Валентность и степень окисления — два термина, используемые для объяснения причин этих различных комбинаций атомов. Основное различие между валентностью и степенью окисления заключается в том, что валентность — это количество электронов, присутствующих в самой внешней оболочке атома определенного элемента, тогда как степень окисления — это количество электронов, которые элемент в конкретном соединении потерял или приобрел.
Ключевые области охвата
1. Что такое Valuction
— определение, указание, примеры
2. Что такое состояние окисления
— определение, указание, правила определения состояния окисления, примеры
3. В чем разница Между валентностью и степенью окисления
– Сравнение ключевых различий
Ключевые термины: атом, соединение, элемент, оболочка, степень окисления, валентность
Что такое валентность
Валентность можно определить как количество электронов, присутствующих на самой внешней оболочке определенного элемента.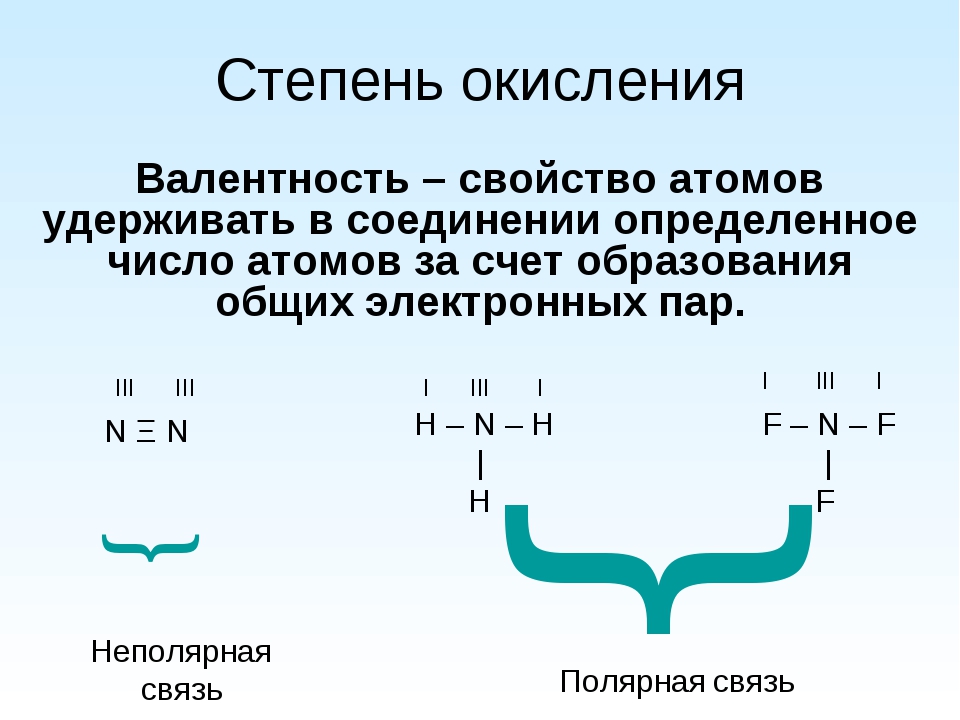 Валентность определяет максимальное количество связей, которое может иметь конкретный атом. Элементы в периодической таблице сгруппированы в соответствии с количеством валентных электронов (электронов на самых внешних орбиталях), которые может иметь атом, когда он находится в нейтральном и газообразном состоянии. Следующая таблица объяснит это.
Валентность определяет максимальное количество связей, которое может иметь конкретный атом. Элементы в периодической таблице сгруппированы в соответствии с количеством валентных электронов (электронов на самых внешних орбиталях), которые может иметь атом, когда он находится в нейтральном и газообразном состоянии. Следующая таблица объяснит это.
Элемент | Атомный номер | Электронная конфигурация | Валентность |
Натрий (Na) | 11 | 1s 2 2s 2 2p 6 3s 1 | 1 |
Магний (мг) | 12 | 1s 2 2s 2 2p 6 3s 2 | 2 |
Бор (Б) | 5 | 1с 2 2с 2 2п 1 | 3 |
Углерод (С) | 6 | 1с 2 2с 2 2п 2 | 4 |
Сера (S) | 16 | 1s 2 2s 2 2p 6 3s 2 3p 4 | 6 |
Элементы одной и той же группы в периодической таблице имеют одинаковую валентность, поскольку элементы сгруппированы в соответствии с атомным номером, а количество электронов, присутствующих на самой внешней оболочке, одинаково при рассмотрении их электронных конфигураций.
Рисунок 1: Валентность калия равна 1
Что такое степень окисления
Степень окисления можно определить как количество электронов, которое конкретный атом может потерять, получить или разделить с другим атомом. Потеря или приобретение электронов вызывает изменение заряда атома, поскольку электроны заряжены отрицательно, и каждый отрицательный заряд нейтрализуется положительным зарядом протонов в ядре. Когда атом теряет или приобретает электроны, возникает дисбаланс электрических зарядов.Следовательно, степень окисления этого атома является зарядом этого атома. Степень окисления можно использовать для описания заряда атома в соединении.
Степень окисления указывается с помощью положительного (+) или отрицательного (-) символа вместе с числом. Символ описывает заряд этого атома, а число описывает количество электронов, которые были обменены.
Рисунок 2: 0 и +2 — единственные степени окисления цинка
Как определить степень окисления
Степень окисления атома рассчитывается по семи правилам. Эти правила и некоторые примеры степеней окисления приведены ниже.
Эти правила и некоторые примеры степеней окисления приведены ниже.
Правило 1
Степень окисления элемента всегда равна нулю. Элементы в своей элементарной форме также находятся в нулевой степени окисления.
Пример: степень окисления натрия (Na) равна 0, а водорода (H 2 ) равна 0
Правило 2
Общий заряд молекулы или иона должен быть суммой зарядов каждого атома в соединении.
Пример: общая заправка KCl равна 0
Заряд (степень окисления) K равен +1
Заряд (степень окисления) Cl равен -1
Правило 3
Степень окисления элементов группы 1 всегда +1.
Правило 4
Степень окисления элементов группы 2 всегда +2.
Правило 5
Отрицательный заряд дается наиболее электроотрицательному атому по сравнению с другими атомами, связанными с ним.
Пример: Фтор является наиболее электроотрицательным элементом. Следовательно, всякий раз, когда он находится в связи с другим элементом, фтор получает степень окисления -1.
Правило 6
Степень окисления водорода (H) равна +1.
Но когда это с металлами группы 1, степень окисления водорода равна -1.
Правило 7
Степень окисления кислорода (O) равна -2.
Но в пероксидах степень окисления O равна -1.
Соединение | Элемент Х | Степень окисления X |
НХ 3 | Х = N | -3 |
КМНО 4 | Х = Mn | +7 |
Cr 2 O 7 2- | Х = Кр | +6 |
Разница между валентностью и степенью окисления
Определение
Валентность: Валентность можно определить как количество электронов, присутствующих на самой внешней оболочке определенного элемента.
Окисление: Степень окисления можно определить как количество электронов, которое конкретный атом может потерять, получить или разделить с другим атомом.
Электрический заряд
Валентность: Валентность не указывает на электрический заряд атома в соединении.
Окисление: Степень окисления указывает на электрический заряд атома в соединении.
Склеивание
Валентность: Валентность определяет максимальное количество связей, которые может иметь атом.
Степень окисления: Степень окисления не указывает на количество связей, которое может иметь конкретный атом.
Чистые элементы
Валентность: Валентность чистого элемента зависит от количества электронов, которые он имеет в своей внешней оболочке атома (атом в газовой фазе).
Окисление: Степень окисления чистого элемента всегда равна нулю.
Заключение
Валентность и степень окисления могут иметь одинаковые или разные значения.Валентность — это количество электронов, присутствующих на самой внешней оболочке определенного элемента, тогда как степень окисления — это количество электронов, которые элемент в конкретном соединении потерял или приобрел. Это основное различие между валентностью и степенью окисления.
Каталожные номера:
1. «Степени окисления (степени окисления)». Степени окисления (числа окисления) N.p., n.d. Веб. Доступно здесь. 06 июля 2017 г.
2. «Правила присвоения степеней окисления элементам». Манекены.н.п., н.д. Веб. Доступно здесь. 06 июля 2017 г.
Изображение предоставлено:
1. «Электронная оболочка 019 калий» Пумба (оригинальная работа Грега Робсона) — Файл: Электронная оболочка 019 калий.png (CC BY-SA 2.0 uk) через Commons Wikimedia
2. «Электронная оболочка 030 цинк» (CC BY -SA 2.0 uk) через Commons Wikimedia
Разница между валентностью и числом окисления
Автор: Madhu
Ключевое различие между валентностью и степенью окисления заключается в том, что валентность — это максимальное количество электронов, которое атом может потерять, получить или разделить, чтобы стать стабильным, тогда как степень окисления — это число электронов атом может потерять или получить, чтобы образовать связь с другим атомом .
Термины «степень окисления» и «валентность» относятся к валентным электронам атома. Валентные электроны — это электроны, занимающие крайние орбитали атома. Эти электроны имеют слабое притяжение к атомному ядру; таким образом, атомы могут легко удалить или разделить эти электроны с другими атомами. Эта потеря, приобретение или совместное использование электронов приводит к тому, что конкретный атом имеет степень окисления и валентность, и в конечном итоге он образует химическую связь между двумя атомами.
СОДЕРЖАНИЕ
1.Обзор и ключевые отличия
2. Что такое валентность
3. Что такое число окисления
Что такое число окисления
4. Прямые сравнения – валентность и число окисления в табличной форме
5. Резюме
Что такое валентность?
Валентность — это максимальное количество электронов, которое атом теряет, приобретает или разделяет, чтобы стать стабильным. Для металлов и неметаллов правило октетов описывает наиболее стабильную форму атома. Здесь, если номер самой внешней оболочки атома заполнен полностью (для этого необходимо восемь электронов), эта электронная конфигурация стабильна.Другими словами, если суборбитали s и p полностью заполнены, имея конфигурацию ns 2 np 6 , атом стабилен.
Естественно, такую электронную конфигурацию имеют атомы инертных газов. Следовательно, другие элементы должны либо терять, либо приобретать, либо делиться электронами, чтобы подчиняться правилу октета. Максимальное количество электронов, которое атом должен потерять или получить или разделить в этой стабилизации, является валентностью этого атома.
Например, рассмотрим кремний. Электронная конфигурация кремния: 1s 2 2s 2 2p 6 3s 2 3p 2 .Самая внешняя оболочка n = 3, и она имеет 4 электрона. Следовательно, он должен получить еще четыре электрона, чтобы завершить октет. Как правило, кремний может разделить 4 электрона с другими элементами, чтобы завершить октет. Таким образом, валентность кремния равна 4,
.У разных химических элементов валентность разная. Это связано с тем, что электроны заполняются орбиталями в соответствии с энергетическими уровнями этих орбиталей. Однако большинство переходных металлов имеют одинаковую валентность; часто это 2. Но некоторые элементы могут иметь разные валентности, потому что атом может стабилизироваться в разных электронных конфигурациях, удаляя электроны.
Например, в железе (Fe) электронная конфигурация [Ar]3d 6 4s 2 . Следовательно, валентность железа равна 2 (2 электрона в 4s 2 ). Но иногда валентность железа становится равной 3. Это связано с тем, что конфигурация электронов 3d 5 более стабильна, чем 3d 6 . Таким образом, удаление еще одного электрона вместе с 4s-электронами еще больше стабилизирует железо.
Но иногда валентность железа становится равной 3. Это связано с тем, что конфигурация электронов 3d 5 более стабильна, чем 3d 6 . Таким образом, удаление еще одного электрона вместе с 4s-электронами еще больше стабилизирует железо.
Что такое число окисления?
Степень окисления — это количество электронов, которые атом может потерять или приобрести, чтобы образовать связь с другим атомом.Иногда мы используем термины степень окисления и степень окисления взаимозаменяемо, но они имеют небольшие различия.
Рисунок 01. Некоторые химические элементы могут иметь разные степени окисления
В большинстве случаев термин степень окисления применяется для координационных комплексов. В координационных комплексах степень окисления представляет собой заряд центрального атома координационного соединения, если все связи вокруг этого атома были ионными связями. Координационные комплексы почти всегда состоят из атомов переходных металлов в центре комплекса. Этот атом металла имеет в своем окружении химические группы, которые мы называем лигандами. Эти лиганды имеют неподеленные электронные пары, которые могут быть общими с атомами металла для образования координационных связей.
Этот атом металла имеет в своем окружении химические группы, которые мы называем лигандами. Эти лиганды имеют неподеленные электронные пары, которые могут быть общими с атомами металла для образования координационных связей.
После образования координационной связи она аналогична ковалентной связи. Это потому, что два атома в координационных связях имеют общую пару электронов, как и ковалентная связь. Однако мы должны рассчитать степень окисления центрального атома металла, рассматривая координационные связи как ионные связи.
В чем разница между валентностью и степенью окисления?
Термины «степень окисления» и «валентность» относятся к валентным электронам атома. Ключевое различие между валентностью и степенью окисления заключается в том, что валентность — это максимальное количество электронов, которые атом может потерять, получить или разделить, чтобы стать стабильным, тогда как степень окисления — это количество электронов, которые атом может потерять или получить, чтобы образовать связь с другим атомом. Более того, термин валентность применяется к любому химическому элементу, а термин степень окисления применяется в основном к координационным комплексам.
Более того, термин валентность применяется к любому химическому элементу, а термин степень окисления применяется в основном к координационным комплексам.
Ниже инфографика суммирует разницу между валентностью и степенью окисления.
Резюме– Валентность и степень окисления
И степень окисления, и валентность — это термины, относящиеся к валентным электронам атома. Ключевое различие между валентностью и степенью окисления заключается в том, что валентность — это максимальное количество электронов, которые атом может потерять, получить или разделить, чтобы стать стабильным, тогда как степень окисления — это количество электронов, которые атом может потерять или получить, чтобы образовать связь с другим атомом.
Артикул:
1. «Число окисления». Encyclopædia Britannica, Encyclopædia Britannica, Inc., доступна здесь.
Изображение предоставлено:
1. «Степени окисления периода 2». Альбрис — собственная работа (CC BY-SA 4. 0) через Commons Wikimedia
0) через Commons Wikimedia
Периодичность валентности или степеней окисления элементов
Валентность элемента описывается как мера его комбинированной способности и может быть определена как «количество электронов, которые должны быть приобретены или потеряны атомом для получения стабильного электронная конфигурация.
Что означает степень окисления?
Степень окисления атома определяется как количество электронов, полученных или потерянных им.
Валентность и степень окисления являются наиболее фундаментальными свойствами элементов и изучаются с помощью электронной справка по конфигурациям
Валентность и степень окисления
Обычно валентными электронами называют электроны, находящиеся во внешней оболочке.В то же время число валентных электронов определяет валентность или валентность атома.
Обычно валентности элементов, принадлежащих как к s-блоку, так и к p-блоку периодической таблицы, рассчитываются как восемь минус количество валентных электронов или количество валентных электронов.

Для d- и f-элементов валентность можно определить не только по валентным электронам, но и по d- и f-орбитальным электронам. Однако общие валентности этих элементов блока d и f указаны как 2 и 3.
Общая степень окисления элементов, присутствующих в периодической таблице, может быть проиллюстрирована в таблице, представленной ниже.
(изображение, которое будет добавлено в ближайшее время)
Валентность первых 20 элементов
Периодическая таблица валинции первых 30 элементов может быть табалее следующим образом:
9004 9007 9001 9007 9004 9004 90071 29 9004| 1 Element | Валентность | атомный номер | |
| 1 500501 1 | 9004 | 9004 | |
| 9004 | |||
| 1 9004 | |||
| 0 | 2 | ||
| 1 Литий | 1 | 3 | |
Бериллий валентность | 2 | 4 | |
бора валентность | 3 | 5 | |
Валентность углерода | 4 9000 7 | 6 | |
| 1 | 1 2 | 8 | |
| 9001 | |||
1 | 1 9 | ||
| 1 | |||
| 1 0 | |||
| 1 Натрий (Na) Valency | 1 1 | 11 | |
Магний (мг) Valency | 2 | 12 | |
| 1 3 | |||
| 1 Silicon Valency | 4 | 14 | |
| 9050 1 фосфор Valency | 3 | 15 | |
| 1 2 | 16 | ||
| 1 Chronine | 1 1 | 17 | |
| 1 | |||
1 | 1 19 | ||
| 1 Calcium Valency | 2 | 20 | |
| 1 | |||
| 1 | 1 4 | 1 22 | |
Ванадиевая ванадия | 5, 4 9004 5 | 23 | |
| 1 | |||
| 1 7, 4, 3 | |||
| Железо (FE) Valency | 1 2, 3 | ||
| 1 3, 2 | 1 27 | ||
| 1 Nickel Valency | 2 | 28 | |
| 1 | |||
2, 1 | |||
| 1 1 | 1 30 |
Периодические тренды степеней окисления элементов
При движении слева направо по iod число валентных электронов элементов увеличивается и изменяется от 1 до 8. Тогда как валентность элементов при соединении сначала с H или O увеличивается от 1 до 4, а после этого снижается до нуля. Рассмотрим два соединения с кислородом Na2O и F2O. В соединении F2O электроотрицательность F больше, чем у кислорода.
Тогда как валентность элементов при соединении сначала с H или O увеличивается от 1 до 4, а после этого снижается до нуля. Рассмотрим два соединения с кислородом Na2O и F2O. В соединении F2O электроотрицательность F больше, чем у кислорода.
Таким образом, каждый из атомов F будет притягивать один электрон от соединения кислорода. Это означает, что F будет иметь степень окисления -1, а O будет иметь степень окисления +2. С другой стороны, в случае Na2O кислород сильно электроотрицателен по сравнению с атомом натрия.Следовательно, кислород будет притягивать по 2 электрона от каждого из атомов натрия со степенью окисления -2, а соединение Na будет иметь степень окисления +1.
Степень окисления элемента представляет собой заряд, которым обладает атом из-за приобретения или потери электронов (из-за разницы в электроотрицательности, которая существует между объединяющимися атомами) в молекуле.
Пока мы движемся вниз в группе, не происходит изменения числа валентных электронов. Таким образом, все элементы одной группы имеют одинаковую валентность.
Таким образом, все элементы одной группы имеют одинаковую валентность.
Рекомендации по присвоению степеней окисления
Степени окисления таких элементов, как S8, O2, h3, Fe, P4 и других, равны нулю.
Кислород имеет степень окисления -2. В то время как его пероксиды, такие как h3O2 и Na2O2, имеют степень окисления -1.
Точно так же водород содержит +1. Но что касается гидридов металлов, таких как LiH, NaH и других, он имеет -1
. время, когда они производят соединение с кислородом или друг с другом.
Щелочные металлы, такие как K, Na, Rb, Cs, -Li; есть +1
Щелочноземельные металлы содержат +2, такие как Ca, Mg, Ba, Sr, -Be и другие родственные.

Определение валентности элементов
Как мы, наверное, уже знаем, валентность элемента измеряет его способность сочетаться с другими элементами. Количество электронов во внешней оболочке элемента определяет его валентность. Существует несколько методов расчета валентности элемента (или молекулы, если уж на то пошло).
Рассмотрим один из способов определения валентности элементов.
Первый и самый простой способ — просто обратиться к периодической таблице: элементы рассортированы по группам, и элементы, присутствующие в группах (1–8 соответственно), имеют такую же валентность, как и другие в своей группе. Допустим, все элементы 8-й группы содержат 8 электронов (с высокой стабильностью).
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление включает повышение степени окисления
Восстановление включает уменьшение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный процесс, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Mg + 2HCl MgCl 2 + H 2
Изменились ли степени окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и в виде несвязанных элементов с другой.Проверьте все степени окисления, чтобы быть уверенным:.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — он восстановился. Хлор находится в одинаковой степени окисления в обеих частях уравнения — он не окисляется и не восстанавливается.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
NaOH + HCl NaCl + H 2 O
Проверка всех степеней окисления:
Ничего не изменилось.Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и холодным разбавленным раствором гидроксида натрия:
2NaOH + Cl 2 NaCl + NaClO + H 2 O
Очевидно, хлор изменил степень окисления, потому что он оказался в соединениях, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Хлор — это единственная вещь, которая изменила степень окисления.Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования – это реакция, при которой одно вещество одновременно окисляется и восстанавливается.
Реакция диспропорционирования – это реакция, при которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для идентификации окислителя и восстановителя
Это небольшое дополнение к последнему разделу.Если вы знаете, что окислялось, а что восстанавливалось, то вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
2Cr 3+ + Zn 2Cr 2+ + Zn 2+
Хром перешел из степени окисления +3 в +2 и, таким образом, был восстановлен. Цинк перешел от нулевой степени окисления в элементе к +2.Он был окислен.
Так что же делает сокращение? Это цинк — цинк отдает электроны ионам хрома (III). Таким образом, цинк является восстановителем.
Точно так же вы можете решить, что окислителем должны быть ионы хрома (III), потому что они забирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата(VII) и ионами железа(II) в кислой среде. Это проработано ниже на странице.
MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O + 5FE 3+
При быстром рассмотрении видно, что ионы железа(II) окислились до ионов железа(III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если посчитать степень окисления марганца, то она упала с +7 до +2 — восстановление.
Итак, ионы железа(II) окислились, а ионы манганата(VII) восстановились.
Что восстановило ионы манганата(VII) — однозначно это ионы железа(II). Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.
Аналогично, ионы манганата(VII) должны быть окислителями.
Использование степеней окисления для расчета пропорций реакции
Это иногда бывает полезно, когда вам нужно определить реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, передается один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться таким же повышением степени окисления чем-то другим.
Этот пример основан на информации из старого вопроса уровня AQA A’.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна упасть на 4, чтобы компенсировать это.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3 — падение на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реагирующие пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или взять более распространенный пример с участием ионов железа (II) и ионов манганата (VII). . .
Раствор манганата калия(VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа(II) до ионов железа(III).При этом ионы манганата(VII) восстанавливаются до ионов марганца(II). Используя степени окисления, составьте уравнение реакции.
Степень окисления марганца в манганат-ионе (VII) равна +7. Название говорит вам об этом, но попробуйте еще раз, просто для практики!
При переходе к ионам марганца (II) степень окисления марганца упала на 5. Каждый реагирующий ион железа (II) увеличивает свою степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата(VII).
Каждый реагирующий ион железа (II) увеличивает свою степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата(VII).
Таким образом, левая часть уравнения будет:
MnO 4 — + 5Fe 2+ + ?
Правая часть будет:
Mn 2+ + 5Fe 3+ + ?
После этого вам придется гадать, как сбалансировать оставшиеся атомы и заряды. В этом случае, например, вполне вероятно, что кислород окажется в воде. Это означает, что вам нужно откуда-то взять водород.
Это не проблема, потому что у вас есть реакция в растворе кислоты, так что водород вполне может происходить из ионов водорода.
В конце концов, вы получите это:
MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O + 5FE 3+
Лично я предпочел бы вычислять эти уравнения из электронных полууравнений!
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Степень окисления — Элементы периодической таблицы
Степень окисления элементов периодической таблицы
Число окисления или состояние элементов таблицы Менделеева в химическом соединении или молекуле – это формальные заряды (положительные или отрицательные), которые присваиваются элементу, если все связи в соединениях ионные.В химии степень окисления или состояние определяется как общее количество электронов, потерянных или полученных атомами или ионами для образования химической связи. Менее или более электроотрицательному партнеру бинарного соединения произвольно присваиваются положительные или отрицательные степени окисления или состояния элементов периодической таблицы. Например, галогены, такие как фтор (F), хлор (Cl), бром (Br), являются сильно электроотрицательными, но щелочные или щелочные металлы, такие как натрий (Na), алюминий (Al), калий (K), кальций (Ca), имеют сильно электроположительные .Следовательно, атомы галогена обычно показывают отрицательную степень окисления, а щелочные или щелочные металлы обычно показывают положительную степень окисления или число.
Например, галогены, такие как фтор (F), хлор (Cl), бром (Br), являются сильно электроотрицательными, но щелочные или щелочные металлы, такие как натрий (Na), алюминий (Al), калий (K), кальций (Ca), имеют сильно электроположительные .Следовательно, атомы галогена обычно показывают отрицательную степень окисления, а щелочные или щелочные металлы обычно показывают положительную степень окисления или число.
Периодическая таблица со степенью окисления
Некоторые общие правила используются для расчета степеней окисления s-, p-, d- и f-элементов периодической таблицы. Элементы s-блока обычно показывают степени окисления +1 и +2, но элементы p-блока обычно показывают степени окисления +3, +4, -3, -2 и -1. Одним из наиболее важных свойств, которое отличает переходные металлы или элементы d-блока от непереходных элементов, является переменная степень окисления или степень окисления.
Как найти степень окисления элементов?
Чтобы определить или сбалансировать распространенные окислительно-восстановительные реакции, мы использовали правило степени окисления, поскольку некоторые реакции нельзя объяснить с помощью электронных или классических концепций.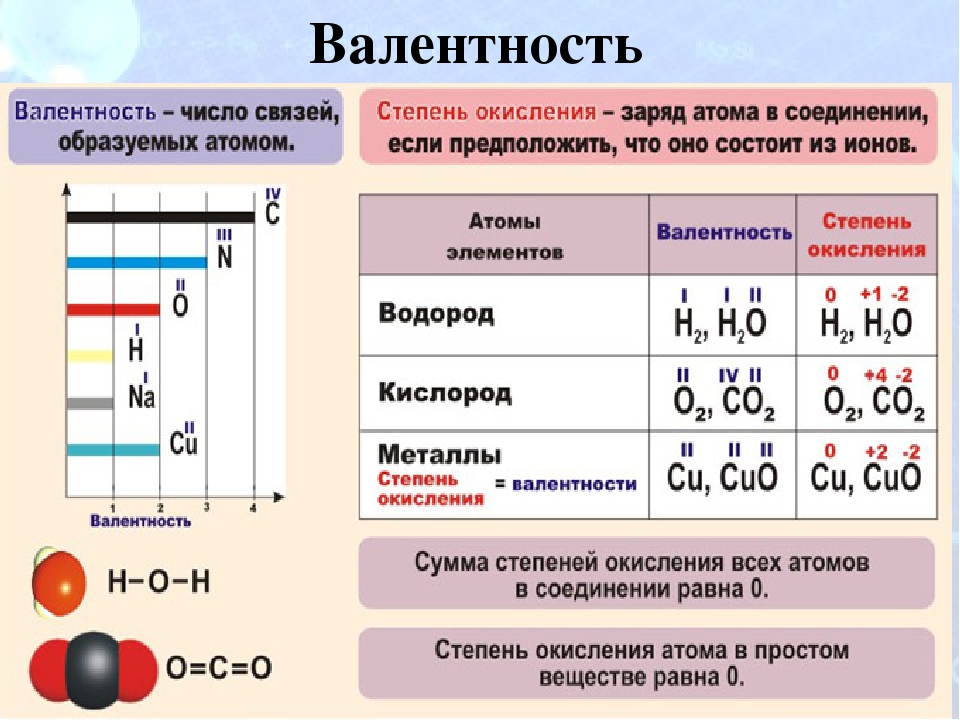 Например, молекула воды образуется при связывании водорода с кислородом, а соляная кислота образуется при связывании водорода с хлором. Образование молекул воды (H 2 O) и соляной кислоты (HCl) не может быть объяснено классическим определением, но легко объясняется правилами степени окисления.Общие правила, которые используются в этой теме изучения химии для определения степени окисления элементов периодической таблицы, приведены ниже:
Например, молекула воды образуется при связывании водорода с кислородом, а соляная кислота образуется при связывании водорода с хлором. Образование молекул воды (H 2 O) и соляной кислоты (HCl) не может быть объяснено классическим определением, но легко объясняется правилами степени окисления.Общие правила, которые используются в этой теме изучения химии для определения степени окисления элементов периодической таблицы, приведены ниже:
- Правило 1: Атомы двухатомных молекул, таких как хлор (Cl 2 ), кислород (O 2 ), водород (H 2 ), азот (N 2 ) и т. д., или металлическим элементам, таким как алюминий (Al), железо (Fe), цинк (Zn), медь (Cu), натрий (Na), кальций (Ca) и т. д., присваивается нулевая степень окисления. Так как в связывании двухатомных молекул участвуют одни и те же элементы с одинаковой электроотрицательностью.
- Правило 2: Обычная степень окисления водорода = +1.
 В гидридах щелочных металлов, таких как гидрид лития, гидрид натрия, гидрид цезия, степень окисления атома водорода = -1. Весь металл в соединении обычно имеет положительную степень окисления.
В гидридах щелочных металлов, таких как гидрид лития, гидрид натрия, гидрид цезия, степень окисления атома водорода = -1. Весь металл в соединении обычно имеет положительную степень окисления. - Правило 3: Нормальная степень окисления кислорода в соединении = -2, но в пероксидах, таких как перекись водорода (H 2 O 2 ) и супероксид, кислороду присваивают состояние -1 и -1/2.
- Правило 4: Степени окисления ионов в полярных молекулах рассчитываются по их заряду.Алгебраическая сумма степеней окисления всех атомов в соединении должна быть равна нулю, но во многих атомарных ионах равна его заряду.
Номера окисления с примерами
| Примеры степеней окисления в соединениях | |||
| Соединение | Число элементов окисления | ||
| Н 2 О 2 | Г = +1 | О = -1 | |
| КГ 2 | Са = +2 | Н = -1 | |
| CHCl 3 | С = +2 | Г = +1 | Кл = -1 |
| Ba(MnO 4 ) 2 | Ба = +2 | Мн = +7 | О = -2 |
| К 2 MnO 4 | К = +1 | Мн = +6 | О = -2 |
| Н 4 Р 2 О 7 | Г = +1 | Р = +5 | О = -2 |
| CH 2 Класс 2 | С = 0 | Г = +1 | Кл = -1 |
Степень окисления водорода
Электронная конфигурация водорода, 1s 1 .-(Teorija-stroenija-organicheskih-soedinenij)-otvet-na-vopros-1.jpg) Таким образом, водород имеет одну электронную частицу во внешнем квантовом пространстве, подобно щелочноземельным металлам, и всего на один электрон меньше следующего благородного газа гелия. Следовательно, водород может легко потерять один электрон, чтобы показать степень окисления +1. Он также может получить один электрон от щелочных или щелочноземельных металлов, чтобы показать состояние -1.
Таким образом, водород имеет одну электронную частицу во внешнем квантовом пространстве, подобно щелочноземельным металлам, и всего на один электрон меньше следующего благородного газа гелия. Следовательно, водород может легко потерять один электрон, чтобы показать степень окисления +1. Он также может получить один электрон от щелочных или щелочноземельных металлов, чтобы показать состояние -1.
Щелочи и щелочные металлы
Щелочные и щелочноземельные металлы обладают высокой электроположительностью с очень низкой энергией ионизации. Следовательно, щелочные и щелочноземельные металлы всегда представляли положительные степени окисления.Например, в галогенидах щелочных металлов галоген определяет отрицательные степени окисления, а щелочные и щелочноземельные металлы показывают положительные состояния.
При электролизе гидридов щелочных металлов, таких как гидрид лития (LiH), гидрид цезия (CsH) и гидрид кальция (CaH 2 ), на аноде может выделяться газообразный водород. В гидриде натрия (NaH), гидриде лития (LiH), гидриде цезия (CsH) и гидриде кальция (CaH 2 ) водороду присваивается исключительная степень окисления = -1, поскольку обычное состояние водорода = +1.
В гидриде натрия (NaH), гидриде лития (LiH), гидриде цезия (CsH) и гидриде кальция (CaH 2 ) водороду присваивается исключительная степень окисления = -1, поскольку обычное состояние водорода = +1.
Супероксид и пероксид
Щелочные и щелочноземельные металлы реагируют с кислородом с образованием ряда бинарных соединений, таких как монооксиды (M 2 O), пероксиды (M 2 O 2 ) и супероксид (MO 2 ). Эти элементы являются единственным известным примером образования супероксида.
Степень окисления кислорода в пероксидах и супероксидах щелочных (литий, натрий) и щелочноземельных металлов (магний, кальций) составляет -1 и -1/2 соответственно.Фтор более электроотрицателен, чем кислород. Следовательно, фтор в таблице Менделеева образует монооксидные и пероксидные соединения со щелочными и щелочноземельными металлами, определяющими степень окисления = -1.
Расчет степени окисления
Степень окисления Mn в KMnO
4 Пусть степень окисления марганца (Mn) в перманганате калия (KMnO 4 ) = x. Следовательно, согласно приведенному выше правилу, (+1) + x + 4(-2) = 0; или х = +7.
Следовательно, согласно приведенному выше правилу, (+1) + x + 4(-2) = 0; или х = +7.
Хром в дихромат-ионе
Пусть степень окисления хрома в бихромат-ионе (Cr 2 O 7 -2 ) = x. Следовательно, 2x + 7(-2) = -2; или х = +6.
Оба азота в нитрате аммония
аммоний нитрата (NH 4 № 3 ) Присутствует как катион NH 4 + и № + и NO 3 — ион, пусть окисление Количество азота в NH 4 + = X и NO 3 – = у.Следовательно, х + 3(+1) = +1; или х = 0 и у + 3 (-2) = -1;
или, у = +5.
Оба атома хлора в хлорной извести
В хлорной извести, химическая формула Ca(OCl)Cl, один атом хлора соединяется с кислородом с образованием иона OCl – , а другой атом хлора образует ион Cl – со степенью окисления хлора = +1 и -1 соответственно.
Фосфор в пирофосфорной кислоте
Пусть степень окисления фосфора в пирофосфорной кислоте ( H 4 P 2 O 7 ) = x. Следовательно, 4(+1) + 2x + 7(-2) = 0 или x = +5
Следовательно, 4(+1) + 2x + 7(-2) = 0 или x = +5
Сера в серной кислоте
Пусть степень окисления или число серы в серной кислоте (H 2 SO 4 ) = x. Следовательно, 2(+1) + х + 4(-2) = 0; или х = +6.
Металлы в координационных соединениях
Ионы металлов Ион в координационном соединении обладает двумя типами валентности, такими как первичная и вторичная валентность. Согласно теории Вернера, первичная валентность приравнивается к степени окисления и координационным числам вторичной валентности координационного комплекса.
Например, в комплексе [Cr(NH 3 ) 6 ]Cl 3 координационное число хрома = 6 и степень окисления или степень окисления хрома = +3, молекула аммиака (NH 3 ) = 0, а ион хлора (Cl – ) = -1. В пентакарбониле железа или комплексе Fe(CO) 5 степень окисления карбонила (CO) и железа равна нулю.
Степень окисления углерода в органических соединениях
Номера окисления по списку углеводородных или углеродных соединений, таких как метан (CH 4 ), метилхлорид (CH 3 Cl), дихлорметан (CH 2 Cl 2 ), хлороформ (CHCl 3 ), и четыреххлористый углерод (CCl 4 ) равны -4, -2, 0, +2, +4 соответственно. Но сахар, глюкоза, формальдегид и т. д. являются примерами в органической химии, где степень окисления или состояние углерода химического элемента в этих соединениях всегда равна нулю.
Но сахар, глюкоза, формальдегид и т. д. являются примерами в органической химии, где степень окисления или состояние углерода химического элемента в этих соединениях всегда равна нулю.
Углерод в соединениях с ацетоном
Пусть степени окисления углерода в ацетоновых соединениях = х, а водорода и кислорода +1 и -2 соответственно. Согласно приведенному выше правилу, 3x + 6(+1) + (-2) = 0, или x = -(4/3).
Проблемы со степенью окисления
Задача: Как определить степень окисления фосфора в Ba(H 2 PO 2 ) 2 ?
Решение: Согласно правилам, степени окисления водорода и кислорода в Ba(H 2 PO 2 ) 2 равны +1 и -2 соответственно, а фосфор = x.Следовательно, (+2) + 2{2(+1) + х + 2(-2)} = 0; или х = +1.
Задача: Рассчитать степень окисления железа в [Fe(H 2 O) 5 (NO) + ]SO 4 .
Решение: Пусть степень окисления железа в [Fe(H 2 O) 5 NO + ]SO 4 = x и вода, NO + и сульфат-ион = 0, +1 и -2 соответственно. Следовательно, х + 5(0) + (+1) – 2 = 0; или х = +1.
Задача: Как найти степень окисления хрома в CrO 5 в химии?
Решение: Из-за степени окисления перекисной связи или состояния хрома в CrO 5 = +6.
Степени окисления
Степени окисленияСтепени окисления от Lewis StructuresСтепень окисления атома дает нам представление об электронной плотности вокруг атома и помогает отслеживать изменение электронов в реакциях окисления-восстановления. В формализме степени окисления мы считаем, что каждый атом в молекуле или ионе связан с другими посредством ионных связей.Для каждого атома в структуре:
Окислительно-восстановительные полуреакцииДавайте посмотрим на превращение НАДФ в НАДФН и сосредоточимся на 3 атомах углерода и атоме азота, которые, кажется, меняют свои связи (красный). Степень окисления атома азота не меняется, но степень окисления 2 атомов углерода уменьшается. Углерод, который связывается с дополнительным протоном, переходит из -I в -II в степени окисления. Один из углеродов, связанных с азотом, переходит из степени окисления I в 0. В целом, добавление 2 электронов приводит к уменьшению суммы степеней окисления на 2 единицы. |
 Как можно объяснить данное противоречие?
Как можно объяснить данное противоречие?



 В гидридах щелочных металлов, таких как гидрид лития, гидрид натрия, гидрид цезия, степень окисления атома водорода = -1. Весь металл в соединении обычно имеет положительную степень окисления.
В гидридах щелочных металлов, таких как гидрид лития, гидрид натрия, гидрид цезия, степень окисления атома водорода = -1. Весь металл в соединении обычно имеет положительную степень окисления.
