«Основания. Физические и химические свойства щелочей , их получение».
Урок «Основания. Физические и химические свойства щелочей ,
их получение.»
Задачи урока: -систематизировать смысл названий и состав сложных веществ;
-сформировать знания учащихся о составе оснований, валентности гидроксогруппы, физических и химических свойств щелочей, их получении;
-развивать умения учащихся сравнивать вещества выделять общие черты в составе и свойствах оснований.
Цели урока: -развитие умений характеризовать состав оснований по формулам и отличать их от других сложных веществ;
-отработка правильности составления и записи уравнений химических реакций, в том числе реакции нейтрализации;
-формирование навыков аккуратной работы с химическими веществами согласно правилам ТБ.
Оборудование и реактивы: на каждой парте NaOH сухой в пробирке, стакан с дистиллированной водой, лакмус, фенолфталеин, метилоранж, стеклянные палочки.
Ход урока:
Эпиграфом к уроку я хотела бы привести слова: «Все предметы бессмертной природы лишены смысла, пока их не познали смертные и не возлюбили земной любовью.» С. Цвейг (2 слайд)
Актуализация ранее полученных знаний – беседа по вопросам с презентации:
— Что такое гидроксиды и как их классифицируют?
— С помощью чего можно распознать кислоту и основание?
(наглядная демонстрация – слайды 5 и 6)
-Как определить кислоту по составу?
-Чему равна валентность кислотного остатка?
(наглядная демонстрация – слайд 9)
— С чем взаимодействует кислота и какого типа эти реакции?
2. Самостоятельная работа с самопроверкой: (слайд 11 и 12) ((
Выберите из списка вещества, взаимодействующие с кислотами и напишите уравнения реакций с НСl, укажите тип реакции.
Al, SO3, ZnO, C, HBr, h3O
Выберите из списка вещества, взаимодействующие с кислотами и напишите уравнения реакций с Н2SO4, укажите тип реакции.
MgO, h3O, P, Zn, SO2, HCl
Объяснение новой темы:
— Приведите примеры оснований?
— Что общего в этих формулах?
(наглядная демонстрация – слайд 14,16,17)
Учащиеся делают выводы, что общее – это атомы металлов и группа -ОН. Учитель вводит понятие гидроксильной группы и её валентности, дают вместе определениие основаниям.
ОСНОВАНИЯ — это сложные вещества, в состав которых входят атомы металлов, связанные с одной или несколькими гидроксильными группами ОН- . (слайд 17)
Общая формула оснований — Me (OH)n (слайд 18)
— Как можно классифицировать основания?
(находят в таблице растворимости и делят по растворимости, классифицируют с примерами) (слайд 20)
Основания нерастворимые
растворимые
Рассматривают и записывают физические свойства оснований ( слайды 21-23)
Химические свойства изучают, выполняя лабораторные опыты. В выданную пробирку с сухой щелочью учащиеся наливают воду, размешивают стеклянной палочкой, убеждаются, что щелочи хорошо растворимы в воде, затем разливают ещё в две пробирки и в каждую из трёх пробирок добавляют по очереди индикаторы, записывают наблюдаемые изменения, затем добавляют кислоту. Видят реакцию с изменением цвета индикатора. Вводится понятие реакции нейтрализации, записывают уравнение реакции с кислотой, с кислотными оксидами.
В выданную пробирку с сухой щелочью учащиеся наливают воду, размешивают стеклянной палочкой, убеждаются, что щелочи хорошо растворимы в воде, затем разливают ещё в две пробирки и в каждую из трёх пробирок добавляют по очереди индикаторы, записывают наблюдаемые изменения, затем добавляют кислоту. Видят реакцию с изменением цвета индикатора. Вводится понятие реакции нейтрализации, записывают уравнение реакции с кислотой, с кислотными оксидами.
Реакция нейтрализации – это взаимодействие между кислотами с образованием соли и воды и основаниями. (слайды 25)
Изучаются способы получения оснований с записью уравнений реакций :
1. активный металл с водой
2Na + 2H 2O = 2NaOH + h3
2. основный оксид с водой
CaO + h3O = Ca(OH)2
3. соль с щелочью
CuCl2 + 2KOH = Cu(OH)2 + 2KCl (слайд 26)
Рефлексия изученного на уроке материала — дополнение подходящими по смыслу словами в стихах: (слайды 27)
Очень страшные подчас
Разъедают кожу рук
И их ………. зовут.
зовут.
Осторожность соблюдаем
И состав знаком нам ваш
Из ……….. и ……….
Значит …………. звать тебя
А найти нам вас нам помогут
……………….. цвета.
…………………. кличут их тут.
Получить такой мы можем
Если щелочь с …………. сложим.
С ……….. средой они дружат
играя.
И основание плюс кислота
………….. окажется,значит,
среда.
Полный вариант:
Очень страшные подчас
Разъедают кожу рук
И их едкими зовут
Осторожность соблюдаем
И состав знаком нам ваш
Из металлов и ОН
Значит щелочь звать тебя
А найти нам вас нам помогут
Индикаторов цвета.
Нерастворимыми кличут их
тут.
Получить такой мы можем
Если щелочь с солью сложим.
щелочная
С кислотной средой они
дружат играя.
И основание плюс кислота
Нейтральной окажется,
значит, среда.
Домашнее задание: § 18 (стр.
 91-94) воп. 3, 5(а,б)
91-94) воп. 3, 5(а,б)
Основания. Свойства оснований в свете ТЭД. Презентация
Материал опубликовалДевиз урока «Сами трудясь, вы сделаете все и для близких, и для себя, а если при труде успеха не будет, будет неудача – не беда, пробуйте еще» (Д.И.Менделеев)
Взаимопроверка домашнего задания Упр.6 стр. 214 HNO2 N2O3 HNO3 N2O5 h4PO4 P2O5 h3SO4 SO3 h3SiO3 SiO2
Чем отличаются простые вещества от сложных ? Какие классы неорганических веществ вам могут подвергаться диссоциации? Какие молекулы диссоциируют, а какие – нет? Что называется электролитами? Признаки электролитов. Какие вещества называются кислотами с точки зрения ТЭД? Классификация кислот. Назовите известные вам индикаторы и укажите их цвет в различных средах
Состав моющих средств МОЮЩИЕ СРЕДСТВА ОКРАСКА ЛАКМУСА ОКРАСКА ФЕНОЛФТАЛЕИНА РЕАКЦИЯ СРЕДЫ РАСТВОР МЫЛА РАСТВОР СМС
— это электролиты, при диссоциации которых в водных растворах образуются катионы металла (или аммония Nh5 +) и анионы гидроксогрупп OН- Основания KOH → K + + Ca(OH)2 Ca2+ + 2 Мe(OH)n Men+ + n OН- OН- OН- Диссоциация оснований:
ПРАВИЛА БЕЗОПАСНОСТИ
Щелочь – едкое вещество! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 1% раствором уксусной кислоты.
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 1% раствором уксусной кислоты.
Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2
Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
Таблица растворимости кислот, оснований, солей
По какому признаку основания разделены на группы? NaOH KOH LiOH СsOH Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 Al(OH)3 Fe(OH)3 ? ? ?
Классификация оснований по числу гидроксогрупп (по кислотности) Однокислотные NaOH, KOH Fe(OH)2 Двухкислотные , Pb(OH)2 Al(OH)3 Трехкислотные
+ + + + + + + + + Сильные и слабые Классификация оснований по степени электролитической диссоциации
Сильные основания
Слабые
основания
NaOH гидроксид натрия (едкий натр)
KOH гидроксид калия (едкое кали)
LiOH гидроксид лития
Ba(OH)2 гидроксид бария
Ca(OH)2 гидроксид кальция
(гашеная известь)
Mg(OH)2 гидроксид магния
Fe(OH)2 гидроксид железа (II)
Zn(OH)2 гидроксид цинка
Nh5OH гидроксид аммония
и т.
БОЙЛЬ РОБЕРТ (1627–1691) английский химик и физик, положил начало применению индикаторов
Химические свойства щелочей Действие щелочей на индикаторы Индикаторы – от лат. «indication» — указатели лакмус метиловый оранжевый фенолфталеин синий желтый малиновый
Химические свойства оснований
Взаимодействие с кислотами (реакция нейтрализации): NaOH + HCl = NaCl + h3O 2. Взаимодействие щелочей с кислотными оксидами (для написания реакций необходимо знать какая кислота соответствует кислотному оксиду): 2NaOH + SO3 = Na2SO4 + h3O (h3SO4)
3. Взаимодействие с солями (условия протекания – исходные вещества должны быть растворимы и образовываться осадок или газ)
2 NaOH + СuCl2 = 2 NaCl + Cu(OH)2
Nh5Cl + KOH = KCl + Nh4 + h3O
4. Разложение нерастворимых оснований при нагревании:
Cu(OH)2 = CuO + h3O
Разложение нерастворимых оснований при нагревании:
Cu(OH)2 = CuO + h3O
Тест «Пятерочка» 1. Выберите формулы оснований: а) SO3 б) Mg(OH)2 в) h3SO4 г) СаО 2. К каждому из ниже указанных веществ прибавили воду и фенолфталеин. В каких случаях появится малиновое окрашивание? а) BaO б) HNO3 в) CuO г) КОН 3. Какие из указанных гидроксидов не могут быть получены взаимодействием соответствующих оксидов с водой? а) Аl(OH)3 б) Fe(OH)3 в) Са(ОН)2 г) LiOH
4.Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом: а) лакмус краснеет б) лакмус синеет в) метилоранж краснеет г) метилоранж желтеет д) фенолфталеин становится малиновым е) фенолфталеин остается бесцветным 5. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых а) СО2 б) h3S в) Са(ОН)2 г) Cu д) NaNO3 e) Mg
Проверь себя
1. б
2. а г
3. а б
4. б г д
5. а б
б
2. а г
3. а б
4. б г д
5. а б
Основания в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Основания, как и оксиды, кислоты и соли, относятся к сложным неорганическим веществам. Выясним, из каких частей состоит формула любого основания, воспользовавшись таким рядом формул:
Разделим формулы черточкой на две части, отделив символ металлического элемента от остальных символов, и напишем над металлом его валентность:
Общим для всех формул является наличие группы атомов которая имеет название гидроксильная группа. В первой формуле она записана без скобок, а в остальных формулах заключена в скобки, после которых стоит соответствующий индекс.
Как вы уже знаете, понятие валентности распространяется на группы атомов, в частности на кислотные остатки. Имеет свою валентность и гидроксильная группа Она одновалентна. Обратите внимание на валентность металла в приведенных формулах, и станет понятно, что наличие индексов связано с валентностью металла. Действительно, одновалентный калий соединен с одной гидроксильной группой, двухвалентные кальций и барий — с двумя, а трехвалентный алюминий — с тремя. Поэтому, чтобы соблюдать правило относительно одинаковой суммы единиц валентностей обеих частей формулы сложного вещества, и ставят соответствующие индексы.
Действительно, одновалентный калий соединен с одной гидроксильной группой, двухвалентные кальций и барий — с двумя, а трехвалентный алюминий — с тремя. Поэтому, чтобы соблюдать правило относительно одинаковой суммы единиц валентностей обеих частей формулы сложного вещества, и ставят соответствующие индексы.
Теперь можем сформулировать определение оснований:
Основания — это сложные вещества, образованные металлическим элементом и гидроксильными группами.
Запишем формулу оснований в общем виде:
Следует отметить, что основания, как и соли,— вещества не молекулярного, а ионного строения, поэтому их формулы отображают соотношения ионов металла и ионов гидроксильной группы в веществе.
Номенклатура основанийПо современной номенклатуре название оснований состоит из двух слов: слова гидроксид и названия металлического элемента, например: — гидроксид калия. Если металл проявляет переменную валентность, ее указывают в круглых скобках после названия металла без интервала: — гидроксид хрома
У некоторых оснований сохранились также исторические названия: — едкое кали, — едкий натр.
Составление формул оснований и определение валентности металла в формуле основания. Рассмотрим на примерах, как составлять формулы оснований и определять валентность металла по формуле основания.
Пример:
Составить формулу гидроксида магния.
Решение
Исходя из определения оснований, первым записываем символ металла, а после него — гидроксильную группу Магний проявляет постоянную валентность 2. Поэтому и гидроксильных групп в формуле этого основания будет две.
Ответ: формула основания —
Пример 2. Определить валентность меди в формулах оснований
Решение
Известно, что в формуле основания валентность металла совпадает с количеством гидроксильных групп. Первая формула содержит одну гидроксильную группу, вторая — две. Поэтому в первой формуле медь одновалентна, а во второй — двухвалентна.
Ответ:
Физические свойства и классификация основанийОснования — твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов. Например, гидроксид меди — голубой, гидроксид железа — коричневый.
Например, гидроксид меди — голубой, гидроксид железа — коричневый.
По способности растворяться в воде основания, как и соли, бывают растворимые, малорастворимые и нерастворимые. Преобладают нерастворимые. Среди хорошо растворимых — гидроксид натрия, гидроксид калия. Их растворы мылкие на ощупь.
Растворимые в воде основания получили название щелочи. По таблице растворимости солей, оснований и кислот можно узнать, к какой группе по способности растворяться в воде принадлежит то или иное основание.
Итак, по физической характеристике — способности растворяться в воде — основания разделяют на растворимые, или щелочи, и нерастворимые.
Существует еще одна классификация оснований — по химическим свойствам. Согласно ей их разделяют на типичные основания и амфотерные гидроксиды. Но об этом речь пойдет позже.
Основания, хорошо растворимые в воде,— тугоплавкие вещества. Основания, нерастворимые в воде, при нагревании разлагаются с выделением воды и образованием оксида.
Итоги:
- Основания — сложные вещества немолекулярного строения, химическая формула которых состоит из одного атома металла и одной или нескольких гидроксильных групп.
- Число одновалентных гидроксильных групп в формуле основания равно валентности металла, поэтому в общем виде формула оснований имеет вид
- Современное название основания состоит из слова гидроксид с добавлением к нему названия металла. Если металл проявляет переменную валентность, то ее указывают после названия металла в скобках.
- При обычных условиях основания находятся в твердом состоянии, часть из них хорошо растворяется в воде. Растворенные в воде основания называются щелочами.
Известь — соединение, известное человеку давно. Смесь извести с водой нередко используют и в настоящее время в строительстве. Такой смесью белят стволы и ветки деревьев, защищая их от вредителей, а зимой — от солнечных ожогов. Известь (точнее — гашеная известь) принадлежит к классу оснований.
Известь (точнее — гашеная известь) принадлежит к классу оснований.
Каждое основание образовано тремя элементами. Из них два элемента «обязательные» — Оксиген и Гидроген, а третьим является металлический элемент.
Основание — соединение, которое состоит из катионов металлического элемента и гидроксид-анионов
Название иона происходит от названий элементов Гидрогена и Оксигена. Объяснить, почему его заряд равен — 1, можно так. Представим себе, что ион образуется в результате соединения ионов и сложим заряды этих частиц:
Формулы основанийВыведем общую химическую формулу соединений этого класса. Вы знаете, что любое вещество электронейтрально. Поэтому в основании на каждый ион металлического элемента с зарядом +n должно приходиться n ионов . Следовательно, общая формула оснований —
Примеры химических формул оснований:
Основания — ионные соединения. Поэтому для них не составляют графические формулы.
Химические названия оснований состоят из двух слов. Первым словом является название элемента, а вторым — «гидроксид». Например, соединение с формулой называют «натрий гидроксид», а основание — «магний гидроксид» . Склоняется лишь второе слово названия: натрий гидроксида, магний гидроксидом.
Если элемент имеет переменную валентность, то в названии основания указывают ее значение после названия элемента (римской цифрой в скобках): — феррум(II) гидроксид.
Это интересно. Оснований и не существует.
Среди соединений с общей формулой есть и такие, которые не принадлежат к основаниям, так как отличаются от них по химическим свойствам. Их называют амфотерными гидроксидами (§ 13).
Основание основный оксид. Каждому основанию соответствует определенный оксид:
Заряд иона металлического элемента в основании и оксиде один и тот же.
Оксиды, которые отвечают основаниям, называют основными.
В отличие от оксидов, оснований в природе нет.
Выводы:
Основания — соединения, которые содержат катионы металлических элементов и гидроксид-анионы Общая формула оснований —
Химическое название основания состоит из названия металлического элемента и слова «гидроксид».
Каждому основанию соответствует оксид; его называют основным оксидом. Заряд иона металлического элемента в этих соединениях один и тот же.
Свойства и применение основанийФизические свойства оснований:
Вам известно, что каждое основание состоит из положительно заряженных ионов металлического элемента и отрицательно заряженных гидроксид-ионов . Основания, как и ионные оксиды, в обычных условиях являются твердыми веществами. Они должны иметь высокие температуры плавления. Но при умеренном нагревании почти все основания разлагаются (на соответствующий оксид и воду). Расплавить удается только гидроксиды Натрия и Калия (температуры плавления соединений составляют соответственно 322 и 405 °С).
Большинство оснований не растворяются в воде (рис. 20). Малорастворимыми являются гидроксиды а хорошо растворимыми — основания, образованные щелочными элементами и соединение
> > >
Водорастворимые основания называют щелочами*.
* — К щелочам часто относят соединения
Сведения о растворимости оснований в воде можно найти в таблице, размещенной на форзаце 2 учебника. Ее называют таблицей растворимости. Приводим соответствующий фрагмент этой таблицы:
Растворимость некоторых оснований в воде при температуре 20—25 °С
Буквой «р» обозначены растворимые основания (щелочи), «м» —малорастворимые, «н>> — нерастворимые. Прочерк «— » означает, что такого основания не существует.
Щелочи и их растворы мылки на ощупь, разъедают многие материалы, вызывают серьезные ожоги кожи, слизистых оболочек, сильно поражают глаза (рис. 21). Поэтому натрий гидроксид в прошлом получил название «едкий натр», а калий гидроксид — «едкое кали ».
Работая со щелочами и их растворами, будьте особенно осторожны. Если раствор щелочи попал на руку, немедленно смойте его большим количеством проточной воды и обратитесь за помощью к учителю или лаборанту. Вы получите у них разбавленный раствор определенного вещества (например, уксусной кислоты), которым нужно обработать кожу для удаления остатков щелочи. После этого руку тщательно промойте водой.
Химические свойства оснований:
Возможность протекания многих реакций с участием оснований зависит от растворимости этих соединений в воде. Щелочи в химических превращениях значительно более активны, чем нерастворимые основания, которые, например, с солями и некоторыми кислотами не реагируют.
Действие на индикаторы:
Растворы щелочей способны изменять окраску особых веществ — индикаторов*. Эти вещества были обнаружены в некоторых плодах и цветах. В настоящее время используют индикаторы, которые производят на химических заводах. Они более эффективны, чем природные, и лучше сохраняются.
Они более эффективны, чем природные, и лучше сохраняются.
К важнейшим индикаторам относятся лакмус, фенолфталеин, метиловый оранжевый (сокращенное название — метилоранж), а также универсальный индикатор. Последний является смесью нескольких веществ. Эта смесь, в отличие от отдельных веществ-индикаторов, изменяет цвет не только в присутствии щелочи, но и в зависимости от ее количества в растворе.
В химических лабораториях применяют водные растворы метилоранжа и лакмуса, водно-спиртовый раствор фенолфталеина. Очень удобна в использовании так называемая индикаторная бумага. Это — специальная бумага, пропитанная раствором индикатора, а затем высушенная и нарезанная маленькими полосками (рис. 22). Существует также индикаторная бумага, пропитанная раствором лакмуса или фенолфталеина.
Изменение окраски индикатора (рис. 23) является следствием его реакции со щелочью.
* — Термин происходит от латинского слова indico — указываю, определяю.
Уравнения таких реакций не приводим, поскольку формулы индикаторов и продуктов их химических превращений довольно сложные.
Нерастворимые основания на индикаторы не действуют.
Реакции с кислотными оксидамиРастворимые и нерастворимые основания взаимодействуют с соединениями противоположного характера, т. е. имеющими кислотные свойства. Среди этих соединений — кислотные оксиды. Соответствующие реакции были рассмотрены в предыдущем параграфе. Приводим дополнительные примеры:
Реакции с кислотамиПри взаимодействии основания с кислотой вещества обмениваются своими составными частями:
Это — реакция обмена.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Мп(ОН)2 + 2HN03 = Mn(N03)2 + 2Н20.
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Реакции щелочей с солямиЭто — реакции обмена. Они происходят в растворе, причем исходная соль должна быть растворимой, а новое основание или новая соль — нерастворимыми.
Выясним возможность реакции между натрий гидроксидом и манган(II) нитратом:
Воспользуемся таблицей растворимости (приводим ее фрагмент):
Как видим, соль растворяется в воде. Чтобы реакция произошла, исходные вещества — щелочь и соль — должны обменяться своими ионами с образованием нерастворимого соединения. По таблице определяем, что этим соединением является новое основание а новая соль растворяется в воде. Значит, реакция между натрий гидроксидом и манган(II) нитратом возможна:
Термическое разложениеПочти все основания (кроме гидроксидов Натрия и Калия) при нагревании разлагаются на соответствующий оксид и воду (водяной пар):
Взрослым известна жидкость под названием «нашатырный спирт». Это — водный раствор газа аммиака его используют как лечебное средство. В нашатырном спирте содержится необычное по своему составу основание. Его формула — а химическое название — аммоний гидроксид. Соединение образуется в результате реакции
Это — водный раствор газа аммиака его используют как лечебное средство. В нашатырном спирте содержится необычное по своему составу основание. Его формула — а химическое название — аммоний гидроксид. Соединение образуется в результате реакции
в которую вступает небольшая часть растворенного аммиака, и одновременно разлагается на исходные вещества. На это указывает знак в химическом уравнении.
Аммоний гидроксид подобно щелочам (NaOH, КОН и др.) изменяет окраску индикаторов, взаимодействует с кислотными оксидами, кислотами, солями:
Изложенный материал обобщен в схеме 2.
Широкое применение среди оснований получили щелочи, прежде всего гидроксиды Кальция и Натрия.
Вам известно, что вещество, называемое гашеной известью, является кальций гидроксидом Гашеную известь используют как связующий материал в строительстве. Ее смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят ею стены. В результате реакций основания с углекислым газом и силиций(IV) оксидом смесь затвердевает. Кальций гидроксид также применяют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих важных веществ.
В результате реакций основания с углекислым газом и силиций(IV) оксидом смесь затвердевает. Кальций гидроксид также применяют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих важных веществ.
Натрий гидроксид используют при производстве мыла (осуществляют реакции щелочи с жирами), лекарств, в кожевенной промышленности, для очистки нефти и т. д.
Выводы:
Основания — твердые вещества ионного строения. Большинство оснований не растворяется в воде. Водорастворимые основания называют щелочами. Щелочи изменяют окраску особых веществ — индикаторов.
Основания взаимодействуют с кислотными оксидами и кислотами с образованием солей и воды. Щелочи реагируют и с солями; продукты каждой реакции — другие основание и соль. Нерастворимые основания разлагаются при нагревании на соответствующие оксиды и воду.
Реакцию между основанием и кислотой называют реакцией нейтрализации. На практике используют преимущественно гидроксиды Кальция и Натрия.
Получение щелочей: один из способов получения щелочей основан на реакции металла с водой (рис. 40). Кроме щелочи, образуется водород:
Второй способ получения щелочей — взаимодействие основного оксида с водой:
Таким способом получают гашеную известь на заводах и непосредственно перед использованием этого вещества для строительных работ, побелки стволов деревьев:
Щелочь можно получить и с помощью реакции обмена между растворимой солью и другой щелочью (в растворе). Исходные соединения подбирают так, чтобы образовалась нерастворимая соль:
Гидроксиды Натрия и Калия производят в промышленности действием постоянного электрического тока на водные растворы хлоридов:
Этот процесс называют электролизом.
Получение нерастворимых основанийНерастворимое основание можно получить только с помощью реакции обмена между солью и щелочью в растворе. Поскольку основание будет выпадать в осадок, то образующаяся соль должна быть растворимой в воде (два нерастворимых соединения разделить невозможно):
Поскольку основание будет выпадать в осадок, то образующаяся соль должна быть растворимой в воде (два нерастворимых соединения разделить невозможно):
Малорастворимый магний гидроксид может быть не только продуктом реакции обмена. Это соединение, как и щелочи, образуется при взаимодействии металла или оксида с водой. Правда, эти реакции происходят медленно, а первая — только при нагревании:
Изложенное обобщает схема 7.
Схема 7. Получение оснований
Получение амфотерных гидроксидовВвиду того что амфотерный гидроксид проявляет свойства основания и кислоты, его можно получить с помощью реакций обмена и как основание
и как кислоту
Эти превращения происходят потому, что все амфотерные гидроксиды нерастворимы в воде.
Щелочь или кислоту нельзя брать в избытке, поскольку амфотерный гидроксид реагирует с обоими соединениями. Например, при взаимодействии натрий цинка с избытком сульфатной кислоты вместо цинк гидроксида образуется цинк сульфат:
Некоторые амфотерные гидроксиды можно получить реакцией обмена между двумя солями в растворе, если одна из солей — продуктов реакции — разлагается водой (такие сведения имеются в таблице растворимости):
Выводы:
Щелочи получают взаимодействием соответствующих металлов или оксидов с водой.
Общий метод получения растворимых и нерастворимых оснований, а также амфотерных гидроксидов основан на реакции обмена между щелочью и солью в растворе. Амфотерные гидроксиды, кроме того, получают взаимодействием соответствующих солей с кислотами.
Химические свойства оснований
О действии растворов оснований на индикаторы, взаимодействие оснований с кислотными оксидами и кислотами вы узнали ранее. Вспомним соответствующие реакции.
Действие оснований на индикаторы(Это свойство имеют лишь основания, растворимые в воде, то есть щелочи.) В растворе щелочей лакмус приобретает синий цвет, метиловый оранжевый — желтый, а фенолфталеин — малиновый. Универсальный индикатор в разбавленном растворе щелочи имеет зеленую окраску, в концентрированном — синюю и сине-фиолетовую.
Взаимодействие с кислотными оксидамиЩелочи взаимодействуют с кислотными оксидами, образовывая соль кислоты, которой отвечает взятый для реакции оксид, и воду:
Взаимодействие с кислотами (реакция нейтрализации)Щелочи (уравнение а) и нерастворимые основания (уравнение б) взаимодействуют с кислотами, образуя соль и воду:
Следующие два свойства оснований вам еще неизвестны, поэтому для их изучения проведем химический эксперимент.
(Реакция происходит в том случае, если по крайней мере один из продуктов реакции выпадает в осадок или выделяется в виде газа.)
Опыт 1. Нальем в сосуд раствор сульфата железа и прибавим к нему раствор гидроксида натрия. Сразу же происходит взаимодействие веществ, о чем свидетельствует образование коричнево-красного осадка:
Отношение оснований к нагреваниюЩелочи устойчивы к нагреванию. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Опыт 2. Сухую пробирку на 1/4 наполним гидроксидом меди закрепим ее в держателе и нагреем. Наблюдаем, как голубой цвет (цвет гидроксида меди изменится на черный (цвет оксида меди а вблизи отверстия пробирки появятся капельки воды:
В том, что одним из продуктов этой реакции будет вода, можно удостовериться, подержав холодный предмет (например, стеклянную пластину) около отверстия пробирки.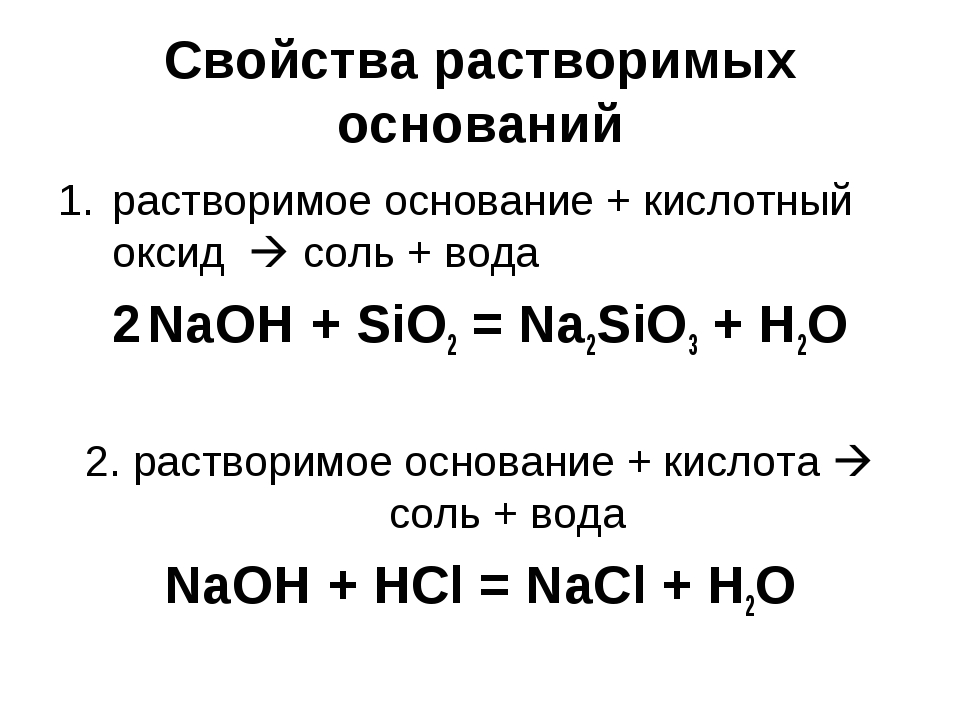
Чтобы закрепить знания о химических свойствах оснований, выполните лабораторные опыты 3, 4, 5, 6. Прежде чем приступить к их выполнению, ознакомьтесь с мерами предосторожности во время работы со щелочами и неуклонно выполняйте их.
Меры предосторожности во время работы со щелочами:
Твердые щелочи и их растворы разъедают ткань, бумагу, вызывают ожоги кожи, глаз, что очень опасно. Поэтому обращаться с ними нужно осторожно: гранулу щелочи (вспомните, что это твердые вещества) ни в коем случае не брать руками; не разливать растворы; следить, чтобы раствор не попадал на открытые участки кожи, в глаза, на одежду, парту, книги, тетради. Вам понадобятся защитная одежда (халат, передник) и защитные очки. Посуду с раствором щелочи следует держать закрытой, чтобы она не реагировала с углекислым газом воздуха.
Если вы разлили щелочь, сразу нейтрализуйте ее уксусом. Участок кожи, на который попала щелочь, быстро промойте большим количеством воды. Если щелочь попала в глаза, немедленно промойте их медицинским раствором борной кислоты.
Если щелочь попала в глаза, немедленно промойте их медицинским раствором борной кислоты.
Итоги:
- Щелочи в химическом отношении более активны, чем нерастворимые основания, и имеют такие типичные свойства:
- Типичными химическими свойствами нерастворимых оснований является взаимодействие с кислотами и разложение при нагревании:
- Реакция нейтрализации свойственна и щелочам, и нерастворимым основаниям.
- Взаимодействие щелочи с раствором соли происходит, если среди продуктов реакции есть нерастворимые вещества.
«Для того, чтобы спаять две железные части какого-либо предмета, необходимо поверхность металла тщательным образом очистить от ржавчины, в состав которой входит гидроксид железа (этот процесс имеет еще название «травление»). Чаще всего для этого используют соляную кислоту:
Чтобы во время травления с кислотой взаимодействовала только ржавчина, а не железо, из которого изготовлен предмет, в травильный раствор добавляют ингибиторы — вещества, которые действуют противоположно катализаторам. Они замедляют реакции, а то и совсем их прекращают. Ингибитором реакции между железом и соляной кислотой является органическое вещество уротропин.
Они замедляют реакции, а то и совсем их прекращают. Ингибитором реакции между железом и соляной кислотой является органическое вещество уротропин.
Если вы хотя бы раз пользовались горючим под названием «сухой спирт», то имели дело со смесью уротропина с небольшим количеством парафина. Это горючее удобно тем, что быстро зажигается, легко гаснет и почти не оставляет пепла.
Понятие об амфотерных гидроксидах
Щелочи и большинство нерастворимых оснований взаимодействуют с кислотами и не взаимодействуют с представителями своего класса. Кислоты взаимодействуют с основаниями и не взаимодействуют с другими кислотами. Проверив экспериментально, с какими веществами данное вещество взаимодействует, а с какими — нет, можно сказать: к классу оснований или к классу кислот оно относится. Это общее правило. Однако оно имеет исключение, понять которое нам помогут опыты с гидроксидом цинка.
По способности растворяться в воде это вещество принадлежит к нерастворимым основаниям. Единственным способом получения нерастворимых оснований является взаимодействие растворимой соли соответствующего металла с раствором щелочи. Одним из продуктов этого взаимодействия будет нерастворимое основание.
Единственным способом получения нерастворимых оснований является взаимодействие растворимой соли соответствующего металла с раствором щелочи. Одним из продуктов этого взаимодействия будет нерастворимое основание.
Опыт 1. Нальем в колбу раствор сульфата цинка и добавим к нему небольшими порциями раствор гидроксида натрия, пока в колбе не образуется белый осадок (рис. 13):
Образовавшийся осадок разделим, поместим в 2 колбы и проведем следующие опыты.
Опыт 2. В первую колбу с гидроксидом цинка добавим соляной кислоты. Осадок сразу исчезает, что является признаком химического явления:
Обратимся к таблице растворимости и увидим, что образовавшаяся соль хлорид цинка — растворимое в воде соединение.
Произошла реакция нейтрализации, в которой гидроксид цинка проявил свойства основания.
Опыт 3. Во вторую колбу с гидроксидом цинка добавим раствор гидроксида натрия. Наблюдение показывает, что, как и в опыте с соляной кислотой, осадок исчез. Следовательно, осадок прореагировал с избытком щелочи (в опыте 1 мы прекратили доливать раствор щелочи, как только образовался осадок. При избыточном добавлении щелочи мы успели бы лишь визуально зафиксировать появление и исчезновение осадка).
Следовательно, осадок прореагировал с избытком щелочи (в опыте 1 мы прекратили доливать раствор щелочи, как только образовался осадок. При избыточном добавлении щелочи мы успели бы лишь визуально зафиксировать появление и исчезновение осадка).
Запишем уравнение проведенной реакции:
Образовалась соль натрия, в которой вместо привычного кислотного остатка есть остаток, содержащий один атом цинка и четыре (тетра — четыре) гидроксильные группы. Остаток такого вида записывают в квадратных скобках.
В этой реакции гидроксид цинка сыграл роль кислоты, потому что металлический элемент цинк после реакции вошел в состав кислотного остатка.
Гидроксиды, которые образуют соль при взаимодействии как с кислотой, так и со щелочью, называют амфотерными гидроксидами.
Повторите материал об амфотерных оксидах (§ 13) и составьте формулы амфотерных гидроксидов, которые им отвечают.
Амфотерные гидроксиды реагируют со щелочами не только в растворе, но и в расплаве:
Образовавшаяся соль имеет двухвалентный кислотный остаток Наличие в нем цинка доказывает, что при сплавлении со щелочью гидроксид цинка проявил свойства кислоты.
Проведенные опыты свидетельствуют, что разделение сложных неорганических веществ на оксиды, кислоты, основания и
соли не лишено исключений. Бывают вещества со смешанными свойствами, например амфотерные гидроксиды.
Применение оснований:
Представители этого класса неорганических веществ в природе отсутствуют. Но потребность в них существует, поэтому их получают специально. Наибольшее практическое значение имеют щелочи гидроксид натрия и гидроксид калия. Применение этих и некоторых других оснований показано на рисунке 14.
Итоги:
- По характерным химическим свойствам исниваним разделяют на типичные и амфотерные гидроксиды.
- Амфотерные гидроксиды, в отличие от типичных, взаимодействуют не только с кислотами, но и со щелочами, образуя соли.
- В формулах солей, образовавшихся в результате взаимодействия амфотерного гидроксида с кислотой, металлическим элементом образовавшейся соли является металл, который входил в состав основания и т.
 п.).
п.). - В формулах солей, образовавшихся при взаимодействии амфотерного гидроксида со щелочью, металлический элемент амфотерного гидроксида входит в состав кислотного остатка и некоторых других).
Растворимые основания (щелочи) получают взаимодействием металла или его оксида с водой.
1. Взаимодействие активных металлов с водой приводит к образованию щелочей и выделению водорода:
(К какому типу относятся эти реакции?)
2. Взаимодействие оксидов активных металлов с водой завершается образованием растворимого в воде гидроксида — щелочи:
(Какой это тип реакции?)
3. В промышленности щелочи получают электролизом водных растворов бескислородных кислот. Этот способ вы будете изучать в следующем классе.
4. Нерастворимые основания получают действием раствора щелочи на растворимую соль соответствующего металла:
Классификация, номенклатура и получение основанийПоместите в керамический тигель немного карбоната кальция (известняка) и в течение 10 минут раскалите на огне спиртовки.
После того как тигель остынет, влейте поверх него немного дистиллированной воды, Затем помешивайте стеклянной палочкой и проверьте красной лакмусовой бумагой. Что вы наблюдаете? Обсудите свои соображения с товарищами. Запишите уравнения реакций.
Сложные вещества, в составе которых содержатся одна или несколько гидроксильных групп (ОН), соединенных с атомами металлов, называются основаниями. Основания обозначаются общей формулой Me(OH)n
Гидроксильная группа ОН всегда одновалентна. Число гидроксильных групп соответствует валентности металла.
Классификация:
Основания классифицируются по своей растворимости в воде и кислотности.
Растворимые в воде основания называют щелочами. Кроме Li, Na, К, Rb, Cs, Ca, Sr, Ba, гидроксиды других металлов не растворяются или очень мало растворяются в воде. Часть нерастворимых в воде оснований обладает амфотерными (двойственными) свойствами.
Основания, вступающие в реакцию как с кислотами, так и с щелочами, образуя соль и воду, называются амфотерными основаниями: Zn (ОН)2, Be (OH)2, Al (OH)3, Fe (OH)3.
Число гидроксильных групп в составе оснований определяет их кислотность.
Номенклатура:
При наименовании оснований по международной номенклатуре, если металл, образующий основание, имеет постоянную валентность, то вначале указывается слово «гидроксид», а затем название металла. Если же металл обладает переменной валентностью, то после слова «гидроксид» и названия металла валентность отмечают римскими цифрами в скобках.
| Основания металлов с постоянной валентностью | Основания металлов с постоянной валентностью | ||
| Гидроксид металла | Международное название | Гидроксид металла | Международное название |
| Mg(OH)2 | Гидроксид магния | Pb(OH)2 | Гидроксид свинца (II) |
| NaOH | Гидроксид натрия | Cr(OH)3 | Гидроксид хрома (III) |
| Al(OH)3 | Гидроксид алюминия | CuOH | Гидроксид меди (I) |
Графические формулы оснований:
Получение в лабораторных условиях.
При взаимодействии активных металлов (щелочных металлов Li, Na, К, Rh, Cs и щелочноземельных металлов Ca, Sr, Ba) с водой. Эти реакции протекают в обычных условиях.
металл + вода → щелочь + h3 ↑
2Li + 2HОH → 2LiOH + h3 ↑
При взаимодействии в обычных условиях гидридов щелочных (NaH3 КН) и щелочноземельных металлов(CaH2, BaH2) с водой.
гидрид металла + вода → щелочь + h3↑
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH) 2 + 2H2
При взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
оксид металла + вода → щелочь
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Получение нерастворимых в воде основанийПри добавлении в раствор растворимой соли среднеактивных и пассивных металлов щелочи. Получение растворимых в воде оснований этим методом возможно в том случае, если в результате реакции получится нерастворимая соль.
Получение растворимых в воде оснований этим методом возможно в том случае, если в результате реакции получится нерастворимая соль.
FeCh + ЗКОН → Fe(OH)3↓ + 3 KCl
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Путем воздействия постоянного электрического тока на водные растворы хлоридов щелочных и щелочноземельных металлов.
2NaCl + 2H2OH2↑ +Cl2 ↑ +2NaOH
Определите основания по цвету раствора и осадка в пробирке. Какие физические и химические свойства имеют основания?
Физические свойства: В обычных условиях щелочи это растворимые в воде твердые вещества белого цвета. Некоторые нерастворимые в воде основания имеют другие цвета. Cu(OH)2 голубого, CuOH желтого, Fe(OH)3 бурого, Fe(ОН)2 зеленовато-бурого, Сг(ОН)3 серовато-зеленого цвета.
гидроксид железа (III) | гидроксидмеди (II) | гидроксид натрия | гидроксид кальция |
Все щелочи бывают скользкие как мыло. При растворении в воде они образуют бесцветный раствор.
На рисунке показывается, как меняется цвет индикаторов под действием щелочей. Нерастворимые в воде основания не меняют окраску индикаторов.
| Слово «индико» в переводе с латинского означает «показываю», «определяю». Индикаторы это сложные органические соединения. Для определения щелочей (а также кислот) используют такие индикаторы, как лакмус, фенолфталеин и метилоранж. |
Химические свойства: Взаимодействие оснований с кислотами (реакция нейтрализации). Для всех оснований характерным химическим свойством является их взаимодействие с кислотами. При взаимодействии кислот с основаниями образуются соль и вода.
При взаимодействии кислот с основаниями образуются соль и вода.
Cu(OH)2 + 2HNO3 → Cu(NO3)2 +2H2O
| Нальем в химический стакан (или колбу) на 1/4 раствора гидроксида натрия и добавим к нему 1 2 капли лакмуса. Затем к полученному раствору будем прикатывать раствор соляной кислоты. Понаблюдайте, как меняется цвет. Запишите уравнение реакции. |
Взаимодействие щелочей с амфотерными металлами. Из металлов щелочи взаимодействуют только с амфотерными металлами (Be, Zn, Al), при этом образуется соль и выделяется водород.
Zn+ 2NaOH Na2ZnO2 + H2 ↑
2Al + 2NaOH + 2H2O2NaAlO2+3H2 ↑
Взаимодействие щелочей с неметаллами. Щелочи взаимодействуют с целым рядом неметаллов (CL, Br2), образуя соль и воду. Лишь при взаимодействии с кремнием выделяется водород.
Щелочи взаимодействуют с целым рядом неметаллов (CL, Br2), образуя соль и воду. Лишь при взаимодействии с кремнием выделяется водород.
Si+ 2NaOH +H2ONa2SiO3+ 2H2 ↑
Щелочам и нерастворимым в воде основаниям присущи и отличающие их друг от друга химические свойства.
Взаимодействие щелочей с кислотными оксидами. Щелочи вступают в реакцию с кислотными оксидами, а нерастворимые в воде основания не вступают в такую реакцию. 1 моль таких кислотных оксидов, как CO2, S02, SO2, вступает в реакцию соединения с 1 молем однокислотной щелочи.
CO2+NaOH → NaHCO3
| Хранить щелочи в открытой посуде нельзя. Потому что при вступлении в реакцию с углекислым газам воздуха образуются соответствующие карбонаты. |
В этих реакциях даже в том случае, если кислотного оксида берется в избытке, реакция соединения всё равно происходит. При избытке щелочи, например, в соотношении молей 1:2, получится нормальная соль и вода.
При избытке щелочи, например, в соотношении молей 1:2, получится нормальная соль и вода.
CO2 + 2NaOH → Na2CO3 +H2O
Такие кислотные оксиды, как CO2, SO2, SO2, в зависимости от мольного соотношения, вступают в различные реакции с двухкислотными щелочами, при этом получаются различные продукты.
CO2 + Ca(OH)2 → СаСО3↓ + H2O 2CO2 + Ca(OH)2 → Ca(HCO3)2
Из кислотных оксидов NO2 при взаимодействии с щелочами образует две различные соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 +H2O
Взаимодействие щелочей с амфотерными оксидами и гидроксидами. Щелочи также взаимодействуют с амфотерными оксидами и гидроксидами, образуя соль и воду.
Разложение оснований. В то время как щелочи не разлагаются, нерастворимые в воде основания при нагревании разлагаются. Самыми неустойчивыми основаниями являются гидроксиды серебра и ртути. Они подвергаются разложению при комнатной температуре.
Самыми неустойчивыми основаниями являются гидроксиды серебра и ртути. Они подвергаются разложению при комнатной температуре.
Hg(OH)2 → HgO+ H2O
Задача:
При размешивании растворов, как показано на рисунке, то в I сосуде красный цвет лакмуса превратится в голубой, а во II сосуде голубой цвет превратится в красный. На основе этих данных определите, какое из веществ X, Y, Z является кислотой, а какие основанием?
| Кислота | Основание |
| A) X, Y | Z |
| В) Y, Z | X |
| С) Y | X, Z |
| D) Z | X, Y |
| Е) X | Y, Z |
Решение: Если в I сосуде красный цвет лакмуса превращается в голубой, то Х→кислота, a Y→ щелочь.
А во II сосуде голубой цвет лакмуса превращается в красный, значит, Z→ щелочь, a X→ кислота.
Ответ: E
Задача:
Какие выражения верные, если в результате реакции получается нерастворимая в воде соль?
1) Формула полученной соли: YxAb
2) Получится х+b моль Н2О
3) xb
4) Продукты реакции проводят электрический ток
5) Полученный в реакции v (H2O)=x=b
| Вступившие в реакцию вещества | v (моль) |
| HxA кислота | a |
| Y(OH)b основание | a |
Решение: HxA + Y(OH)b→ YxAb+ xH2O (или b H2O).
Ответ: 1:5. Согласно условиям, поскольку соль YxAb нерастворимая в воде соль, то она не проводит электрический ток.
Задача:
Что можно определить на основе таблицы?
1) Массу оксида
2) Ar (X)
3) Степень окисления X в оксиде.
| Вещества, полностью вступившие в реакцию | Продукт реакции | |
| X | O2 | XO |
| 4 г | 1,6 г | |
Решение:
m(ХО) = 4+1,6 = 5,6г;
Ответ: 1,2,3
Задача:
| Вещества, вступившие в реакцию, и их мольное количество | Масса полученной соли (в г) | N (атом) в молекуле полученной соли (в целом) | |
| Fe(OH)3 | HNO3 | ||
| 1 | xl | yl | z1 |
| x2 | y2 | z2 | |
| x3 | y3 | z3 | |
Если y3y2y1, то определите отношения между x1x2χ3 и z1z2z3.
Решение:
Ответ: E x3x2x1 z3z2z1
Персональный сайт учителя химии Куликовой Надежды Владимировны
Щёлочи – это основания растворимые в воде.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Остальные — нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
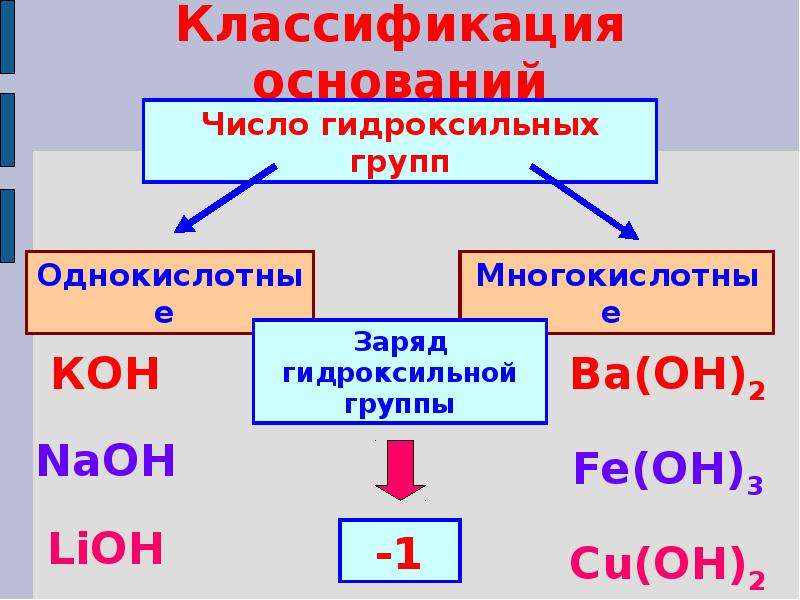
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
III. Способы получения оснований
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2h3O = 2NaOH + h3
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra)
2. Оксид металла+ H2O = Щелочь
Оксид металла+ H2O = Щелочь
Na2O + h3O = 2 NaOH
Здесь, оксид металла (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Видео «Получение нерастворимых оснований»
IV. Выполните задания
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al2O3, Zn(OH)2, CaO , SiO2, CrO , NaOH , Mn2O7, Fe(OH)2, Cr2O3
| Основный оксид | Кислотный оксид | Амфотерный оксид | Безразличный оксид | Щёлочь | Нерастворимое основание |
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
№3. Приведите по два уравнения реакций получения следующих оснований:
1) Гидроксид калия
2) Гидроксид кальция
в) Гидроксид железа (III)
V. Тренажеры
Тренажер №1. Классификация оснований
Тренажёр №2. Классификация оснований по растворимости в воде
Тренажёр №3. Оказание первой помощи при попадании щелочей на кожу
Тренажёр №4. Правила техники безопасности при работе со щелочами
Тренажёр №5. Составление названия основания по формуле
Тренажёр №6. Составление формул оснований
Тренажёр №7. Установление соответствия: основание — оксид металла
ЦОРы
Видео: “Получение нерастворимых оснований”
Видео-презентация: “Классификация оснований”
Краткий конспект подготовки к ЗНО по химии №9 Основания
Подготовка к ВНО.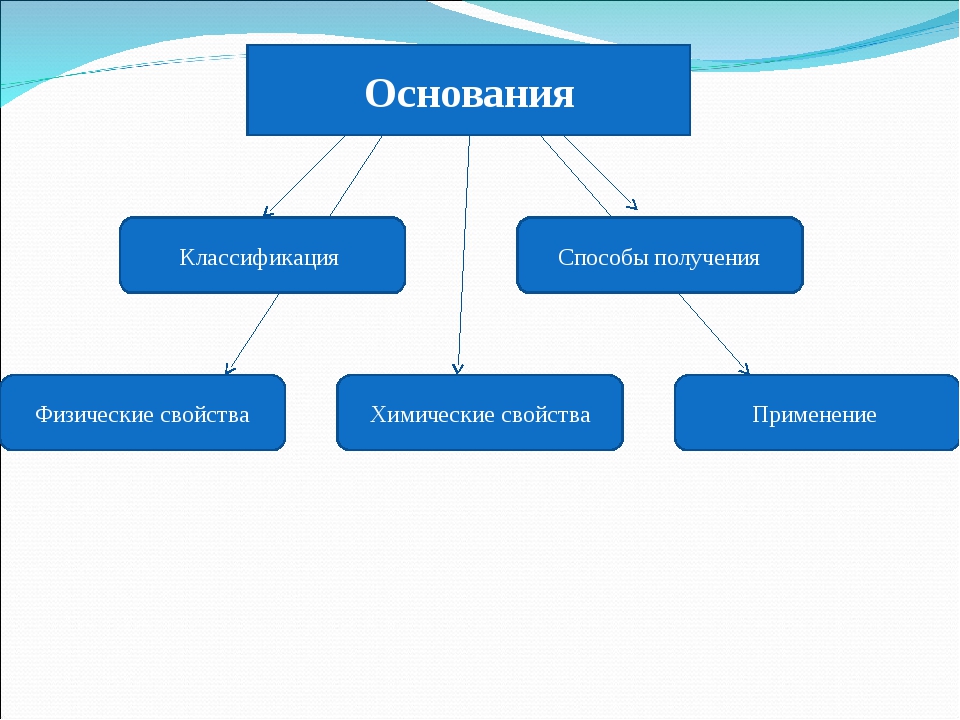 Химия.
Химия.
Конспект 9. Основания
Классификация оснований
Гидроксиды – это электролиты, в результате диссоциации их водных растворов образуется толь один вид анионов: гидроксид анион .
1. По растворимости в воде гидроксиды делятся на:
К растворимым гидроксидам относятся гидроксиды щелочных и щелочноземельных металлов.
Остальные гидроксиды относятся к нерастворимым.
2. По количеству гидроксогрупп гидроксиды делятся на:
Физические свойства
Гидроксиды щелочных металлов при обычных условиях — это твердые белые вещества, гигроскопичны и очень хорошо растворимы в воде. При растворении в воде гидроксидов щелочных металлов происходит интенсивное выделение тепла. Поэтому при приготовлении их растворов нужно быть очень осторожным.
Гидроксиды щелочноземельных металлов – это также белые кристаллические вещества, но менее растворимые в воде, чем гидроксиды щелочных металлов.
Амфотерные гидроксиды в основном образуются в виде студенистых гелеобразных осадков при прибавлении растворов щелочей к растворимым солям соответствующих металлов.
Химические свойства
1. Реакция с кислотами.
Все гидроксиды реагируют с кислотами с образованием соли и воды.
Реакция сильных гидроксидов с сильными кислотами называется реакцией нейтрализации.
2. Реакция с кислотными оксидами.
3. Реакция с солями. Щелочи реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок, поскольку образование нерастворимых соединений смещает равновесие вправо и делает её практически необратимой.
↓
↓
4. Разложение при нагревании. Нерастворимые гидроксиды при нагревании разлагаются на соответствующий оксид и воду.
Этот процесс происходит медленно и без нагревания при хранении оксидов в безводной среде.
5. Обнаружение щелочей при помощи кислотно-основных индикаторов.
В щелочной среде лакмус приобретает синюю окраску. Метиловый оранжевый – желтую, а фенолфталеиновый – малиновый.
Основные способы получения гидроксидов
1. Щелочи можно получить при взаимодействии соответствующих металлов с водой.
Взаимодействие калия и цезия с водой.
Активность щелочных металлов возрастает с увеличением их молярной массы. Взаимодействие цезия с водой происходит уже со взрывом.
2. Щелочи можно получить при взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
3. Электролиз растворов солей металлов I-A и II-A группы.
↑+ ↑
4. Нерастворимые и амфотерные гидроксиды получают в основном обменными реакциями солей соответствующего металла со щелочью.
↓
Некоторые сложности наблюдаются при получении амфотерных гидроксидов,
↓
Так как полученный осадок при добавлении щелочи образует растворимые гидроксокомплексы.
Нужно контролировать количество добавляемой щелочи или использовать другие реагенты. Например, при взаимодействии с гидроксидом аммония получается осадок ↓, который даже не растворяется в избытке гидроксида аммония.
↓
5. Нерастворимы гидроксиды можно получить при необратимом гидролизе некоторых солей.
↓ + ↑
Применение щелочей
Встретиться со щелочами можно и в быту. Гидроксид натрия используется в качестве агента при растворении засора в трубах. Применяется он в виде сухих гранул, или в виде раствора. Средство для прочистки труб «Крот» — это подкрашенный раствор гидроксида натрия. Щелочь вызывает растворимость органических соединений, содержащихся в засоре. Способствует его разрушению. Гидроксид натрия иногда применяется даже в пищевой промышленности. В России он зарегистрирован в качестве пищевой добавки Е-524.некоторые традиционные блюда готовятся с применением этого вещества. Например, это скандинавское блюдо из рыбы под названием Лютефиск.
Для его приготовления сушеная треска вымачивается 5-6 дней в щелочи и приобретает из-за этого мягкую желеобразную консистенцию.
Малорастворимые гидроксиды алюминия и магния применяются для лечения изжоги. Они нейтрализуют избыток соляной кислоты при повышенной кислотности желудочного сока. Таким образом, уменьшая его вредное действие на слизистую желудка. Важно, что избыток гидроксидов не вредит организму, так как они нерастворимы, то они просто выводятся из организма. Известный препарат «Альмагель» – это почти целиком гель гидроксида алюминия с небольшой добавкой гидроксида магния, а «Маалокс» – это смесь гидроксидов алюминия и магния в одинаковом соотношении по массе.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №11 «Классы неорганических соединений. Основания»
2.2.2.12. Химия / КонсультантПлюс
В системе естественнонаучного образования химия как учебный предмет занимает важное место в познании законов природы, формировании научной картины мира, создании основы химических знаний, необходимых для повседневной жизни, навыков здорового и безопасного для человека и окружающей его среды образа жизни, а также в воспитании экологической культуры.
Успешность изучения химии связана с овладением химическим языком, соблюдением правил безопасной работы при выполнении химического эксперимента, осознанием многочисленных связей химии с другими предметами школьного курса.
Программа включает в себя основы неорганической и органической химии. Главной идеей программы является создание базового комплекса опорных знаний по химии, выраженных в форме, соответствующей возрасту обучающихся.
В содержании данного курса представлены основополагающие химические теоретические знания, включающие изучение состава и строения веществ, зависимости их свойств от строения, прогнозирование свойств веществ, исследование закономерностей химических превращений и путей управления ими в целях получения веществ и материалов.
Теоретическую основу изучения неорганической химии составляет атомно-молекулярное учение, Периодический закон Д.И. Менделеева с краткими сведениями о строении атома, видах химической связи, закономерностях протекания химических реакций.
В изучении курса значительная роль отводится химическому эксперименту: проведению практических и лабораторных работ, описанию результатов ученического эксперимента, соблюдению норм и правил безопасной работы в химической лаборатории.
Реализация данной программы в процессе обучения позволит обучающимся усвоить ключевые химические компетенции и понять роль и значение химии среди других наук о природе.
Изучение предмета «Химия» в части формирования у обучающихся научного мировоззрения, освоения общенаучных методов (наблюдение, измерение, эксперимент, моделирование), освоения практического применения научных знаний основано на межпредметных связях с предметами: «Биология», «География», «История», «Литература», «Математика», «Основы безопасности жизнедеятельности», «Русский язык», «Физика», «Экология».
Первоначальные химические понятия
Предмет химии. Тела и вещества. Основные методы познания: наблюдение, измерение, эксперимент. Физические и химические явления. Чистые вещества и смеси. Способы разделения смесей. Атом. Молекула. Химический элемент. Знаки химических элементов. Простые и сложные вещества. Валентность. Закон постоянства состава вещества. Химические формулы. Индексы. Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. Условия и признаки протекания химических реакций. Моль — единица количества вещества. Молярная масса.
Чистые вещества и смеси. Способы разделения смесей. Атом. Молекула. Химический элемент. Знаки химических элементов. Простые и сложные вещества. Валентность. Закон постоянства состава вещества. Химические формулы. Индексы. Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. Условия и признаки протекания химических реакций. Моль — единица количества вещества. Молярная масса.
Кислород. Водород
Кислород — химический элемент и простое вещество. Озон. Состав воздуха. Физические и химические свойства кислорода. Получение и применение кислорода. Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях. Водород — химический элемент и простое вещество. Физические и химические свойства водорода. Получение водорода в лаборатории. Получение водорода в промышленности. Применение водорода. Закон Авогадро. Молярный объем газов. Качественные реакции на газообразные вещества (кислород, водород). Объемные отношения газов при химических реакциях.
Качественные реакции на газообразные вещества (кислород, водород). Объемные отношения газов при химических реакциях.
Вода. Растворы
Вода в природе. Круговорот воды в природе. Физические и химические свойства воды. Растворы. Растворимость веществ в воде. Концентрация растворов. Массовая доля растворенного вещества в растворе.
Основные классы неорганических соединений
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов. Основания. Классификация. Номенклатура. Физические свойства оснований. Получение оснований. Химические свойства оснований. Реакция нейтрализации. Кислоты. Классификация. Номенклатура. Физические свойства кислот. Получение и применение кислот. Химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах. Соли. Классификация. Номенклатура. Физические свойства солей. Получение и применение солей. Химические свойства солей. Генетическая связь между классами неорганических соединений. Проблема безопасного использования веществ и химических реакций в повседневной жизни. Токсичные, горючие и взрывоопасные вещества. Бытовая химическая грамотность.
Химические свойства солей. Генетическая связь между классами неорганических соединений. Проблема безопасного использования веществ и химических реакций в повседневной жизни. Токсичные, горючие и взрывоопасные вещества. Бытовая химическая грамотность.
Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева
Строение атома: ядро, энергетический уровень. Состав ядра атома: протоны, нейтроны. Изотопы. Периодический закон Д.И. Менделеева. Периодическая система химических элементов Д.И. Менделеева. Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д.И. Менделеева и строения атома. Значение Периодического закона Д.И. Менделеева.
Строение веществ. Химическая связь
Электроотрицательность атомов химических элементов. Ковалентная химическая связь: неполярная и полярная. Понятие о водородной связи и ее влиянии на физические свойства веществ на примере воды. Ионная связь. Металлическая связь. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки.
Химические реакции
Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Понятие о катализаторе. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления атомов химических элементов; поглощению или выделению энергии. Электролитическая диссоциация. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Реакции ионного обмена. Условия протекания реакций ионного обмена. Электролитическая диссоциация кислот, щелочей и солей. Степень окисления. Определение степени окисления атомов химических элементов в соединениях. Окислитель. Восстановитель. Сущность окислительно-восстановительных реакций.
Степень окисления. Определение степени окисления атомов химических элементов в соединениях. Окислитель. Восстановитель. Сущность окислительно-восстановительных реакций.
Неметаллы IV — VII групп и их соединения
Положение неметаллов в периодической системе химических элементов Д.И. Менделеева. Общие свойства неметаллов. Галогены: физические и химические свойства. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. Серная, сернистая и сероводородная кислоты и их соли. Азот: физические и химические свойства. Аммиак. Соли аммония. Оксиды азота. Азотная кислота и ее соли. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. Кремний и его соединения.
Кремний и его соединения.
Металлы и их соединения
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлы в природе и общие способы их получения. Общие физические свойства металлов. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. Алюминий. Амфотерность оксида и гидроксида алюминия. Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III).
Первоначальные сведения об органических веществах
Первоначальные сведения о строении органических веществ. Углеводороды: метан, этан, этилен. Источники углеводородов: природный газ, нефть, уголь. Кислородсодержащие соединения: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная кислота, аминоуксусная кислота, стеариновая и олеиновая кислоты). Биологически важные вещества: жиры, глюкоза, белки. Химическое загрязнение окружающей среды и его последствия.
Химическое загрязнение окружающей среды и его последствия.
Типы расчетных задач:
1. Вычисление массовой доли химического элемента по формуле соединения.
Установление простейшей формулы вещества по массовым долям химических элементов.
2. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции.
3. Расчет массовой доли растворенного вещества в растворе.
Примерные темы практических работ:
1. Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории.
2. Очистка загрязненной поваренной соли.
3. Признаки протекания химических реакций.
4. Получение кислорода и изучение его свойств.
5. Получение водорода и изучение его свойств.
6. Приготовление растворов с определенной массовой долей растворенного вещества.
7. Решение экспериментальных задач по теме «Основные классы неорганических соединений».
8. Реакции ионного обмена.
9. Качественные реакции на ионы в растворе.
10. Получение аммиака и изучение его свойств.
11. Получение углекислого газа и изучение его свойств.
12. Решение экспериментальных задач по теме «Неметаллы IV — VII групп и их соединений».
13. Решение экспериментальных задач по теме «Металлы и их соединения».
Кислотно-щелочные свойства — Справка
Свойства кислот и оснований Кислоты можно отличить от оснований на основе наблюдаемых свойств. Вам придется провести в этом вопросе такие различия, чтобы определить, какие два представления характерны для кислот, а какие для оснований. Эта группа вопросов сосредоточит внимание на многих из следующих контрастирующих свойств: Шкала pH и pOH
Для растворов кислот и оснований можно проверить значение pH.Это относится к числу, которое показывает, как они смещают компоненты H-OH в воде. Проще говоря, кислоты имеют низкий pH… менее 7 (в водных растворах при 25°C), а основания имеют высокий pH… больше 7 (в водных растворах при 25°C).
Проще говоря, кислоты имеют низкий pH… менее 7 (в водных растворах при 25°C), а основания имеют высокий pH… больше 7 (в водных растворах при 25°C).
Шкала pH — не единственная шкала, используемая в качестве индикатора кислот и оснований. Существует также так называемая шкала pOH. В то время как шкала pH служит индикатором количества ионов H + в растворе, шкала pOH обеспечивает меру количества ионов OH — в растворе.Поскольку эти две концентрации ионов обратно пропорциональны друг другу, значения pH и pOH также обратно пропорциональны друг другу. Таким образом, раствор с низким значением pH (кислота) будет иметь высокое значение pH. А раствор с высоким значением pH (основание) будет иметь низкое значение pOH.
Тест на лакмусовую бумагу
Одним из самых быстрых тестов, позволяющих определить, является ли раствор кислотой или основанием, является тест на лакмусовую бумагу. Это включает в себя погружение специальной полоски бумаги (известной как лакмусовая бумага) в раствор и наблюдение за цветом бумаги. Лакмусовая бумажка становится красной в растворах кислот и синеет в растворах щелочей.
Лакмусовая бумажка становится красной в растворах кислот и синеет в растворах щелочей.
pH-бумага
В то время как тест с лакмусовой бумагой покажет только, является ли раствор кислотным или щелочным, бумажный тест на рН предоставит дополнительную информацию — оценку рН раствора. В тесте используется специальная полоска бумаги, называемая бумагой pH или бумагой Hydrion. Бумажная полоска погружается в водный раствор и окрашивается. Полученный цвет зависит от рН. Таким образом, бумажный тест pH показывает, является ли раствор кислым или щелочным.Набор цветов для pH-бумаги и соответствующее им значение pH показаны на графике ниже. Как видите, красно-оранжево-желтые цвета являются индикаторами кислот, а зелено-сине-фиолетовые — индикаторами оснований.
Индикаторный тест на фенолфталеин
Кислотно-щелочной индикатор представляет собой химическое соединение, которое добавляют к водному раствору, чтобы определить, является ли он кислым (pH7).
 Одним из самых популярных кислотно-щелочных индикаторов является фенолфталеин.Индикатор фенолфталеин становится розовым в щелочном растворе и бесцветным в кислом растворе. Таким образом, добавление одной или двух капель фенолфталеина в водный раствор является быстрым способом определения того, является ли раствор кислым или щелочным.
Одним из самых популярных кислотно-щелочных индикаторов является фенолфталеин.Индикатор фенолфталеин становится розовым в щелочном растворе и бесцветным в кислом растворе. Таким образом, добавление одной или двух капель фенолфталеина в водный раствор является быстрым способом определения того, является ли раствор кислым или щелочным. Ощущение базы
В лабораторных условиях никогда не стоит обращаться с кислотами и щелочами голыми руками. Тем не менее, многие потребительские товары являются щелочными или щелочными и имеют характерное ощущение скользкости. Мыло — хороший пример щелочного или основного коммерческого продукта, который скользит на ощупь.Основания кажутся скользкими.
Химические свойства
Возможно, наиболее распространенным химическим свойством кислот является их склонность реагировать с металлами с образованием газообразного водорода. Хотя реакция кислоты с металлом может быть более интенсивной с некоторыми металлами, чем с другими, тест на реакционную способность металла всегда является отличным тестом для определения того, содержит ли водный раствор кислоту.
Концентрации ионов гидроксония и гидроксида
Нейтральная вода содержит в равных количествах ионы водорода (Н + ) и гидроксид-ионы (ОН — ).Добавление кислоты к нейтральной воде сместит этот баланс ионов водорода и гидроксида. Добавление кислоты в воду увеличивает количество ионов водорода и уменьшает количество ионов гидроксида. А добавление основания в воду уменьшает количество ионов водорода и увеличивает количество ионов гидроксида.
Но при чем здесь ион гидроксония? Получается, что ионы водорода на самом деле не существуют в виде ионов водорода в водном растворе. Ион водорода прикрепится к молекуле воды и образует ионы гидроксония — H 3 O + .Для практических целей вы можете просто думать об ионах водорода как о том же самом, что и ионы гидроксония (поскольку именно так они существуют в растворах на водной основе). Таким образом, последнее предложение в предыдущем абзаце можно переформулировать следующим образом: Добавление кислоты в воду увеличивает количество ионов гидроксония и уменьшает количество ионов гидроксида. А добавление основания в воду уменьшает количество ионов гидроксония и увеличивает количество ионов гидроксида.
А добавление основания в воду уменьшает количество ионов гидроксония и увеличивает количество ионов гидроксида.
Как уже упоминалось, нейтральный водный раствор будет содержать равные количества ионов гидроксония (H 3 O + ) и ионов гидроксида (OH — ).При температуре 25°С это количество составляет 1,0 х 10 -7 молей Н 3 О + на литр раствора (сокращенно 1,0 х 10 -7 М). Кислый раствор будет иметь концентрацию иона гидроксония (H 3 O + ), превышающую 1,0 x 10 -7 M. А основной раствор будет иметь ион гидроксония (H 3 O + ). ) концентрация меньше 1,0 x 10 -7 М. Вы должны знать, что число вроде 1,0 x 10 -3 М больше 1.0 х 10 -7 М; а число, подобное 1,0 x 10 -10 M, меньше, чем 1,0 x 10 -7 M.
связанный с раствором, являющимся кислотой или основанием. Аналогичные утверждения можно сделать и в отношении гидроксид-иона (ОН —). При температуре 25 °C кислый раствор будет иметь концентрацию гидроксид-иона (OH –) менее 1.0 x 10 -7 M. И основной раствор будет иметь концентрацию гидроксид-иона (OH — ), превышающую 1,0 x 10 -7 M.
При температуре 25 °C кислый раствор будет иметь концентрацию гидроксид-иона (OH –) менее 1.0 x 10 -7 M. И основной раствор будет иметь концентрацию гидроксид-иона (OH — ), превышающую 1,0 x 10 -7 M.
Проверьте бутылку
В лабораторных условиях кислоты и основания распределяются в каком-то контейнере. Контейнер должен быть промаркирован, и часто на нем указана формула его содержимого. Формула может быть подсказкой относительно того, является ли содержимое бутылки кислотным или щелочным. Кислотные формулы обычно записываются как HA , где A представляет собой некоторый анион, сопровождающий катион водорода.И хотя не каждая основа имеет формат формулы MOH (где M — это символ некоторого иона металла), эта формула является почти определенным индикатором того, что бутылка содержит основу.
Физические и химические свойства оснований Примечания
ФИЗИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
(i) Вкус Они резко горькие на вкус.
(ii) Воздействие на кожу Они дают ощущение мыльного прикосновения, и все щелочи оказывают мягкое разъедающее действие на кожу.
(III) Эффект на индикатор Они влияют на индикаторы, как указано ниже
Рис.: Основы показывают различные физические свойства
| индикатор | изменение в кислой среде |
| красный до синий | |
| Orange Orange | Оранжевый до желтого | Бесцветный до розового |
| Turmeric Paper | желтый до красного коричневого |
химические свойства баз
2.Реакция с металлами
(i)
(ii)
.
(i)
(ii)
Некоторые щелочи, такие как гидроксид натрия (NaOH), называются растворимыми, потому что они поглощают углекислый газ из воздуха, и его прочность со временем уменьшается.
3. Реакция оснований с кислотами
Они нейтрализуют кислоты с образованием соли и воды.
Кислота + основание → соль + вода
4. Реакция оснований с солью аммония
Основания реагируют с солью аммония с выделением газообразного аммиака.
(i)
(ii)
5. Взаимодействие оснований с солью
Основания реагируют с раствором другой соли.
(i)
(ii)
ИСПОЛЬЗОВАНИЕ ОСНОВ
Используется при изготовлении мытья мыла, бумаги, бензинового переработки и в качестве реагента в лаборатории.
СРАВНЕНИЕ СВОЙСТВ КИСЛОТ И ОСНОВАНИЯ
S.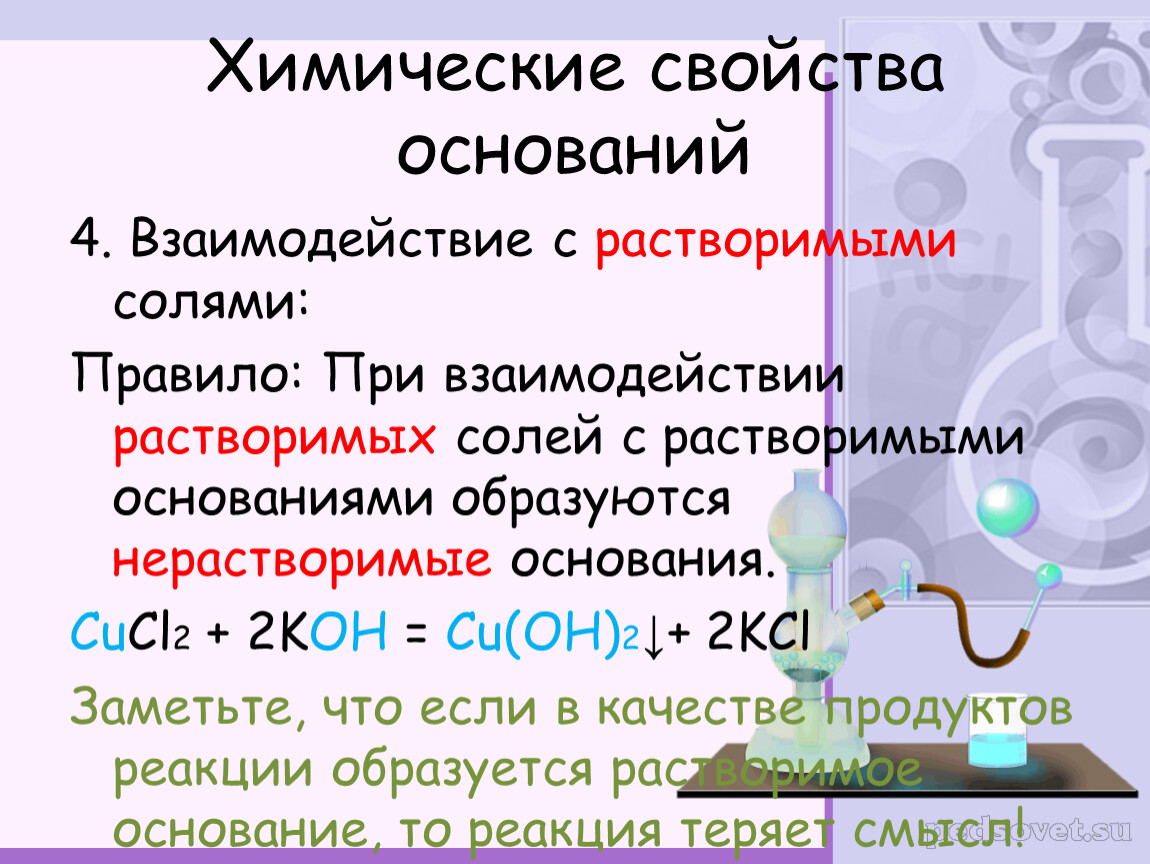 нет. нет. | кислоты | Базы | | | |
| (I) | Кислый на вкус | горький вкусовый на вкус | ||
| (II) | Свойства обусловлены присутствием иона водорода (H + ) в водном растворе кислоты | Свойства обусловлены присутствием гидроксид-иона (ОН — ) в водном растворе основания. | ||
| (III) | (III) | (III) | Оворачивает синий Литм к красному | Оказывается красный Литм к синий |
| (IV) | Водный раствор проводит электричество | водный раствор проводит электричество | ||
| (V) | Реагирует с активными металлами, такими как Na, K, Ca и Zn, с образованием газообразного водорода. | Не реагирует с металлами, кроме Zn, Al и Sn. | ||
| (VI) | (VI) | Кислотные свойства исчезают при реакции с базами (нейтрализация) | Основные свойства исчезают при реакции с кислотами (нейтрализация) | |
| (VII) | реагирует с карбонаты для получения углерода | углекислого газа с образованием карбоната. | ||
| (viii) | Часто разъедает кожу | Часто разъедает кожу и скользкий по своей природе. | ||
| (ix) | Значение pH меньше 7 при 25°C | Значение pH больше 7 при 25°C |
Q.1. Что общего у всех кислот и оснований?
Ответ. Общим для всех кислот является то, что они образуют ионы водорода [H + (водн.)] при растворении в воде. Например, Кислоты, такие как HCl, H 2 SO 4 , HNO 3 , CH 3 COOH и т. д. проявляют кислотный характер, поскольку они диссоциируют в водном растворе с образованием ионов водорода.Но все соединения, содержащие водород, не являются кислотами, например глюкоза (C 6 H 12 O 6 ) и спирт (C 2 H 5 OH) тоже содержат водород, но не проявляют кислотного характера.
Упражнение: Найти общие характеристики кислот и оснований.
Требуемые материалы: Разбавленная соляная кислота, Разбавленная серная кислота, Разбавленный раствор гидроксида натрия, Этанол, Раствор глюкозы и химический стакан, Угольные электроды, Сухие элементы, колба 1.5 В, Ключ.
Процедура: Возьмите химический стакан и поместите в него два угольных электрода.
Подсоедините электроды к аккумуляторной лампочке через ключ и сухой элемент. Налейте в стакан разбавленную соляную кислоту и нажмите кнопку. Лампа загорелась? Проведите аналогичный эксперимент со всеми данными растворами и запишите свои наблюдения.
Наблюдение
Заключение: Растворы кислот и оснований являются хорошими проводниками электричества.Раствор глюкозы и этанола не является проводником электричества.
Основания: Общим для всех оснований (или ) является то, что все они образуют гидроксид-ионы (ОН — ) при растворении в воде. Например: NaOH, Mg(OH) 2 , Ca(OH) 2 и NH 4 OH являются основаниями, поскольку они растворяются в воде с образованием гидроксид-иона (OH — )
Например: NaOH, Mg(OH) 2 , Ca(OH) 2 и NH 4 OH являются основаниями, поскольку они растворяются в воде с образованием гидроксид-иона (OH — )
0 A Кислоты или основания (щелочи) в водном растворе-
Кислотное поведение кислот из-за присутствия ионов водорода.H + (водн.) ионы, в них. Кислоты производят ионы водорода только в присутствии воды. Таким образом, в отсутствие воды вещество не будет образовывать ионы водорода и, следовательно, не будет проявлять своего кислотного поведения.
Активность: Показать, что кислоты выделяют ионы H + (водн.) только в присутствии воды.
Требуемые материалы: Поваренная соль, конц. серная кислота, безводный хлорид кальция, синяя лакмусовая бумажка, кипящая трубка, нагнетательная трубка, заполненная безводным хлоридом кальция.
Процедура: Возьмите 0,5 г сухой поваренной соли в пробирку для сухого кипячения. Добавьте в кипящую трубку несколько капель концентрированной серной кислоты на поваренную соль. Что ты видишь? Выделяется бесцветный раздражающий газ. Вставьте пробку, содержащую трубку подачи, заполненную хлористым кальцием, в горловину трубки для кипячения.
Добавьте в кипящую трубку несколько капель концентрированной серной кислоты на поваренную соль. Что ты видишь? Выделяется бесцветный раздражающий газ. Вставьте пробку, содержащую трубку подачи, заполненную хлористым кальцием, в горловину трубки для кипячения.
Поднесите сухую синюю лакмусовую бумажку к отверстию пробирки с хлоридом кальция
. Обратите внимание, если есть какие-либо изменения в цвете. Цвет лакмусовой бумажки не меняется.Теперь поднесите влажную синюю лакмусовую бумажку к отверстию пробирки с хлористым кальцием. Наблюдаете ли вы изменение цвета лакмусовой бумажки? Да, синий лакмус изменился на красный.
На основании вышеизложенного можно сделать следующий вывод:
Заключение: Сухой газ HCl при контакте с сухой синей лакмусовой бумагой не образует ионов H + , и, следовательно, цвет лакмусовой бумаги не меняется. изменять. Таким образом, можно сказать, что выделение ионов Н + из кислоты происходит только в присутствии воды.
Q.2. Почему нельзя добавлять воду в раствор кислоты?
Ответ. Смешивание воды с кислотой является экзотермическим процессом, и большее количество тепла приводит к разбрызгиванию воды. Во избежание этого. Мы должны добавлять кислоту в воду, а не воду в кислоту.
Кроме того, кислоту также необходимо добавлять в воду небольшими порциями, а не за один прием.
Q.3. Насколько сильны кислота или щелочной раствор?
Ответ. Кислоты и щелочи при разбавлении водой снижает концентрацию ионов H + (водн.) или OH — (водн.) в кислом и щелочном растворах соответственно.
Если мы найдем количественно количество ионов Н + (водн.) / ОН — (водн.) ионов, присутствующих в растворе, мы сможем судить, насколько сильна кислота или основание?
Сделать это можно с помощью универсального индикатора, представляющего собой смесь нескольких индикаторов. Универсальный индикатор показывает разные цвета при разной концентрации ионов водорода или значениях pH в растворе.
Универсальный индикатор показывает разные цвета при разной концентрации ионов водорода или значениях pH в растворе.
LHS | Химическая Тайна | Свойства кислот, оснований и нейтралов
Вкус: Вы когда-нибудь пробовали из кислого лимона? Когда вы пробуете что-то кислое, ваше лицо выглядит как это — *.Лимонный сок — это кислота, а кислоты могут иметь кислый вкус. Пищевая сода имеет горький вкус, который не нравится большинству людей — *. Это пример базы и основы могут иметь горький вкус. Вода не является кислотой или основанием, она нейтральна и имеет нет особого вкуса. Пожалуйста, никогда не пробуйте сильные кислоты или сильные основания или любые другие химические вещества, не являющиеся пищевыми!
Почувствуйте: Что произойдет, если вы нарежете лимоны и немного сока
попасть в порез на пальце? йоу! Это жалит.Кислоты жалят порезы.
Если вы когда-либо проливали на пол отбеливатель или мыло,
заметил, что он скользкий. Такие основы, как отбеливатель и мыло, скользкие.
Наше нейтральное вещество, вода, было бы хорошим выбором для очистки.
кислот и оснований, потому что он не жалит и не скользкий.
Пожалуйста, никогда не прикасайтесь к сильным кислотам или сильным основаниям, потому что они
может быть вредным для вашей кожи и может повредить чувствительные ткани, такие как
как твои глаза.
Такие основы, как отбеливатель и мыло, скользкие.
Наше нейтральное вещество, вода, было бы хорошим выбором для очистки.
кислот и оснований, потому что он не жалит и не скользкий.
Пожалуйста, никогда не прикасайтесь к сильным кислотам или сильным основаниям, потому что они
может быть вредным для вашей кожи и может повредить чувствительные ткани, такие как
как твои глаза.
Примеры кислот, оснований и нейтралов
Каковы некоторые общие кислоты, основания и нейтралы? Это некоторые кислоты, которые вы можете
быть знакомым с: лимонным соком, уксусом, апельсиновым соком, газированными напитками, желудком
кислота и аккумуляторная кислота. Продукты из списка на вкус и на ощупь напоминают кислоты?
Вот некоторые основы, которые вы, возможно, видели: пищевая сода, отбеливатель, нашатырный спирт, средство для чистки канализации.
и мыло. Некоторые нейтральные вещества: вода, молоко и лосьон для рук.
Химические эффекты:
Вам может быть интересно, что кислоты и основания делают с другими химическими веществами. Кислоты растворяются
металлы — томатный соус в алюминиевой кастрюле, разбить белки — маринование мяса,
проводят электричество — аккумуляторная кислота и растворяют карбонатные соединения — бактериальные
кислота, вызывающая кариес на зубах. Основания и кислоты нейтрализуют друг друга. Смешивание
равные количества кислот и оснований одинаковой силы дают нейтральное вещество
Кислоты растворяются
металлы — томатный соус в алюминиевой кастрюле, разбить белки — маринование мяса,
проводят электричество — аккумуляторная кислота и растворяют карбонатные соединения — бактериальные
кислота, вызывающая кариес на зубах. Основания и кислоты нейтрализуют друг друга. Смешивание
равные количества кислот и оснований одинаковой силы дают нейтральное вещество
Измерение кислот и оснований
Вам, вероятно, говорили не пробовать на вкус и не прикасаться к сильным кислотам и основаниям. Так
откуда мы знаем, насколько сильны эти химические вещества? Шкала pH – это инструмент для измерения
кислоты и основания.Это расширяющаяся шкала от 0 до 14. Чем ниже
номер более кислое вещество, рН 7 прямо посередине является нейтральным
и чем выше число, тем более основным является вещество. Цвет рН-бумаги
соответствует числам на шкале рН, чтобы сказать вам, какое вещество
вы тестируете.
Сила водорода
Аббревиатура pH означает мощность водорода, потому что
на самом деле это мера количества ионов водорода или протонов
в растворе (pH = -log[H+]
или рН 7 в воде означает наличие 10-7 молей ионов Н+ на литр). кислоты
выделяют ионы водорода (положительно заряженные частицы) из раствора
и базы удалить
ионы водорода из раствора. Поскольку шкала pH логарифмическая, это означает
вещество с pH 5 в 10 раз более кислое, чем вещество с pH 6.
кислоты
выделяют ионы водорода (положительно заряженные частицы) из раствора
и базы удалить
ионы водорода из раствора. Поскольку шкала pH логарифмическая, это означает
вещество с pH 5 в 10 раз более кислое, чем вещество с pH 6.
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7А
Класс 7Б
Класс 7 (объединенные А и В)
Африкаанс
Граад 7А
Граад 7Б
Graad 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 8А
Класс 8Б
Класс 8 (объединенные А и В)
Африкаанс
Граад 8А
Граад 8Б
Graad 8 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 9А
Класс 9Б
Класс 9 (объединенные А и В)
Африкаанс
Граад 9А
Граад 9Б
Graad 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4А
Класс 4Б
Класс 4 (объединенные A и B)
Африкаанс
Граад 4А
Граад 4Б
Graad 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 5А
Класс 5Б
Класс 5 (объединенные A и B)
Африкаанс
Граад 5А
Граад 5Б
Graad 5 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 6А
Класс 6Б
Класс 6 (объединенные А и В)
Африкаанс
Граад 6А
Граад 6Б
Graad 6 (A en B saam)
Пособия для учителей
Лицензирование нашей книги
Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (безбрендовые версии)
Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться, адаптировать, преобразовывать, изменять или развивать их любым способом, с единственным требованием — отдать должное Сиявуле. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Сегмент G: Кислоты и основания Часть I
кислота — вещества, ионизирующиеся в растворах с образованием ионов H^+. — ионы.
— ионы.
бинарные кислоты — кислоты, не содержащие кислорода в своей химической формуле.
повышение температуры кипения — происходит, когда температура кипения раствора выше, чем точка кипения одного только чистого растворителя.
Bronsted-Lowry Model — эта модель утверждает, что любое соединение, которое может передавать протон любому другому соединению, является кислотой, а соединение, которое принимает протон, является основанием.
коллигативные свойства — свойства раствора, отличные от свойств самого чистого растворителя.
разбавление — процесс добавления большего количества растворителя в раствор.
электролиз — разложение воды.
понижение точки замерзания — коллигативное свойство, описывающее, насколько снижается точка замерзания раствора по сравнению с точкой замерзания чистого растворителя.
гетерогенная смесь — комбинация двух или более веществ, в которой исходные вещества разделены на физически различные области с различными свойствами.
гомогенная смесь — комбинация двух или более веществ, имеющих одинаковый состав и химические свойства на всем протяжении; также известный как решение.
нерастворимый — твердое, жидкое или газообразное вещество, которое не растворяется в конкретном растворителе.
Модель Льюиса — основания отдают пары электронов, а кислоты принимают пары электронов.
массовые проценты — способ выражения концентрации раствора; равна массе растворенного вещества в растворе, деленной на общую массу раствора и умноженной на 100.
смесь — сочетание двух или более чистых веществ, в котором каждое чистое вещество сохраняет свои индивидуальные химические свойства.
моляльность — отношение молей растворенного вещества к массе растворителя в килограммах.
молярность — отношение молей растворенного вещества к объему раствора в литрах.
оксикислоты — кислоты, химические формулы которых содержат кислород.
чистое вещество — материал, имеющий постоянный состав и обладающий стабильными свойствами по всей пробе.
насыщенный раствор — раствор, в котором максимальное количество растворенного вещества растворено в данном количестве растворителя при определенной температуре.
точка насыщения t — точка, при которой растворенное вещество не может больше растворяться в растворе при данной температуре.
растворимость — максимальное количество вещества, которое можно растворить в данном количестве растворителя при данной температуре с образованием насыщенного раствора.
растворенное вещество — вещество, которое растворяется в растворе.
раствор — жидкая смесь, в которой растворенное вещество равномерно распределено внутри растворителя.
 91-94) воп. 3, 5(а,б)
91-94) воп. 3, 5(а,б) п.).
п.).  Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это.